Синдром Морганьи-Адамса-Стокса, неотложная помощь при приступе

Виды синдрома
Приступы Морганьи-Адамса-Стокса могут возникать у пациентов без атриовентрикулярной блокады. Поэтому принято выделять 3 формы синдрома:
- гипердинамическую (тахикардитическую) — вызвана трепетанием или фибрилляцией желудочков, слабостью синусового узла, синоаурикулярной блокадой, развивается на фоне частоты сокращения 250 и более в минуту, составляет половину всех случаев;
- брадикардитическую — развивается при полной атриовентрикулярной и синоатриальной блокадах, остановке синусового узла, при этом частота желудочковых сокращений доходит до 25 в минуту;
- смешанную — выражается в чередовании первых двух форм.
Лечение синдрома МАС

Часто пациентам, перенесшим приступ МАС. требуется имплантация искусственного кардиостимулятора
Терапия зависит от многих факторов: причина, продолжительность болезни, компенсация гемодинамики, возраст и наличие других сопутствующих заболеваний. В любом случае с пациентом «работает» кардиолог, аритмолог и терапевт.
При медикаментозно обусловленных нарушениях ритма, приводящих к появлению приступов Морганьи-Эдамса-Стокса (брадикардии), первым делом необходимо отменить препараты, влияющие на сердечный ритм (замедляющие его).
Но если на этом фоне жалобы прошли, все равно стоит провести мониторирование ЭКГ. Возможно, что причина вовсе не в медикаментозном влиянии.
Если на ЭКГ или при мониторировании обнаружены паузы более 2.0 секунд, ставится вопрос об имплантации искусственного кардиостимулятора. Он устанавливается в срочном или плановом порядке в зависимости от клинической ситуации.
Синдром Морганьи-Адамса-Стокса (Морганьи-Эдемса-Стокса, МАС, МЭС) представляет собой внезапное нарушение ритма сердца, которое приводит к его остановке, нарушению транспортировки крови к органам и, прежде всего, мозгу.
Патология характеризуется внезапными обмороками, влекущими нарушение работы центральной нервной системы, что проявляется уже через считанные секунды после остановки сердца. Результатом приступа синдрома МАС может стать клиническая смерть.
По данным статистики, до 70 % больных с постоянной полной атрио-вентрикулярной блокадой имеют проявления синдрома МАС. В педиатрической практике этот синдром обычно наблюдается у детей с предсердно-желудочковыми блокадами 2-3 степени и синдроме слабости синусового узла.
Выраженность проявлений синдрома МАС и частота приступа зависят от его причины, исходного состояния сердца и сосудов, метаболических сдвигов в миокарде. В некоторых случаях приступы могут быть кратковременными и проходить сами по себе, но тяжелые аритмии и остановка сердца требуют экстренных реанимационных мероприятий, поэтому такие пациенты нуждаются в повышенном внимании со стороны кардиологов.

Так как синдром МАС проявляется внезапными приступами потери сознания и мозговой дисфункции, то больному может потребоваться неотложная помощь. Часто случается, что человек падает и теряет сознание в общественном месте или дома в присутствии родных, тогда последние должны незамедлительно вызвать бригаду скорой помощи и попытаться оказать первую медицинскую помощь.
Конечно, окружающие могут растеряться, не знать, с чего начинать реанимацию, как правильно ее проводить, но в случае внезапной остановки сердца счет идет на минуты, и больной может умереть прямо на глазах очевидцев, поэтому в таких случаях лучше делать хоть что-то для спасения жизни человека, ведь промедление и бездействие стоят жизни.
- Прекардиальный удар.
- Непрямой массаж сердца.
- Искусственное дыхание.
Большинство из нас так или иначе слышали о приемах сердечно-легочной реанимации, но далеко не все владеют этими навыками. Когда нет уверенности в своих умениях, можно до приезда «скорой» ограничиться надавливаниями на грудь (примерно 2 раза в секунду). Если реанимирующий уже сталкивался с подобными манипуляциями и знает, как правильно их делать, то на каждые 30 нажатий он выполняет 2 выдоха по принципу «рот в рот».
Прекардиальный удар – это интенсивный толчок кулаком в область нижней трети грудины, который часто помогает восстановить электрическую активность сердца. Человеку, ни разу не делавшему это, следует быть осторожным, ведь сильный удар кулака, особенно, мужского, может вызвать перелом ребер и ушибы мягких тканей. Кроме того, этот прием не рекомендован для детей младшего возраста.
Непрямой массаж сердца и искусственное дыхание можно делать в одиночку или с напарником, второе – проще и эффективнее. В первом случае на 30 нажатий приходится 2 выдоха, во втором – один выдох нанажатий на грудную клетку.
Бригада «скорой» при остановке сердца продолжит неотложную помощь, дополнив ее медикаментозной поддержкой. Для восстановления сердечного ритма проводится электрокардиостимуляция, а при невозможности ее осуществления вводят адреналин внутрисердечно или в трахею.
В целях восстановления проведения импульсов от предсердий к желудочкам показан атропин внутривенно или подкожно, введение которого повторяют каждые 1-2 часа в связи с кратковременностью действия препарата. По мере улучшения состояния больного, ему дают под язык изадрин и транспортируют в кардиологический стационар.
При брадиаритмической форме МАС лечение включает временную кардиостимуляцию и введение атропина, при отсутствии эффекта которого показан аминофиллин. Если после этих препаратов результат отрицателен, вводят допамин, адреналин. После стабилизации состояния пациента рассматривается вопрос о постоянной кардиостимуляции.
Тахиаритмическая форма требует устранения фибрилляции желудочков посредством электроимпульсной терапии. Если тахикардия связана с наличием дополнительных путей проведения в миокарде, то пациенту потребуется в дальнейшем операция по их пересечению. При желудочковых вариантах тахикардии проводят установку кардиостимулятора-кардиовертера.
Для того чтобы избежать приступов остановки сердца, пациентам с синдромом МАС назначается профилактическая антиаритмическая терапия, включающая такие препараты как флекаинид, пропранолол, верапамил, амиодарон и др. (назначает кардиолог!).
Если консервативное лечение с помощью антиаритмиков не дает результата, сохраняется высокий риск полной атрио-вентрикулярной блокады и остановки сердца, то показана электрокардиостимуляция с установкой специального прибора, который поддерживает работу сердца и в нужный момент дает ему необходимый импульс к сокращениям.
Кардиостимулятор может работать в постоянном режиме либо «по требованию», а тип его выбирается индивидуально исходя из особенностей течения заболевания. При полной блокаде проведения импульсов от предсердий к желудочкам целесообразно использовать кардиостимулятор, работающий непрерывно, а при относительной сохранности автоматизма сердца можно рекомендовать аппарат, работающий в режиме «по требованию».
Синдром Морганьи-Адамса-Стокса – опасная патология. Внезапные приступы потери сознания и вероятность клинической смерти требуют своевременной постановки диагноза, назначения лечения и наблюдения. Больные с синдромом МАС должны регулярно приходить на осмотр к кардиологу и выполнять все его рекомендации.

Лечение синдрома Морганьи-Адамса-Стокса заключается в немедленном восстановлении деятельности сердечной мышцы и профилактике повторных припадков. Целесообразна госпитализация и проведение кардиологической терапии с дополнительным обследованием.
Синдром Морганьи-Адамса-Стокса требует проведения неотложных мер по аналогии с остановкой сердца. Первым шагом являет прекардиальное воздействие на нижнюю треть грудины. Это может быть удар кулаком. Следует соблюдать предельную осторожность, чтобы не попасть в область сердца. Данная процедура в некоторых случаях помогает вызвать рабочий рефлекс сердца. Вслед за этим показан непрямой массаж сердца и вентиляция легких.
Бригадой скорой помощи для купирования припадка применяется дефибрилляция. Электрический разряд нередко возвращает сердце к правильному рабочему ритму. Справиться с остановкой органа также помогает введение в его полость раствора адреналина и атропина. Несмотря на то, что припадок синдрома Морганьи-Адамса-Стокса может пройти самостоятельно, нельзя оставлять больного без помощи. Ведь он также может завершиться летальным исходом. Во время приступа реанимационные процедуры продолжаются до приведения больного в сознание.
Предупредительное лечение синдрома Морганьи-Адамса-Стокса заключается в приеме препаратов, которые снижают риск развития аритмии.
Хирургическое лечение заболевания заключается в имплантации больному электростимуляторов кардиологического назначения. Суть их работы состоит в стимуляции работы сердца во время развития приступов. После установки устройств ежеквартально ведется мониторинг их работоспособности.
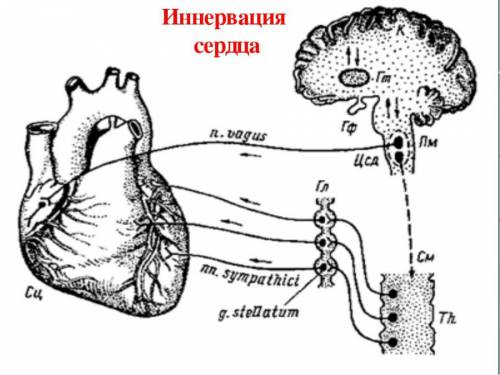
Важным этапом лечения является правильность оказания неотложной помощи при внезапном приступе, так как от этого зависит жизнь пациента. После восстановления сознания показано медикаментозное и оперативное лечение с установкой кадиостимулятора.
Реанимационные мероприятия могут быть проведены и не специалистами. Нужно учитывать такие правила:
- Проверить пульс на сонной артерии.
- При его отсутствии ударить кулаком в нижнюю треть грудины (удар должен быть ощутимым, но не чрезмерным, обычно расстояние до грудины не более 20 см).
- Ритмично надавливать на грудину, после 30 нажатий провести 2 вдоха в рот больного.
При развитии синдрома МАС вследствие тахиаритмии или паркосизмов тахикардии больному может рекомендоваться лекарственная профилактика для предупреждения припадков. Таким пациентам назначается постоянный прием противоаритмических средств.
При высоком риске развития атриовентрикулярной или синоатриальной блокад и несостоятельности замещающего ритма больным показана имплантация кардиостимулятора. Тип электрокардиостимулятора подбирается в зависимости от формы блокады:
- при полной АВ-блокаде показана имплантация асинхронных, постоянно функционирующих кардиостимуляторов;
- при урежении ЧСС на фоне неполной АВ-блокады показана имплантация кардиостимуляторов, функционирующих в режиме «по требованию».
Обычно электрод кардиостимулятора вводится по вене в правый желудочек и закрепляется в межтрабекулярном пространстве. В более редких случаях, при периодической остановке синусового узла или выраженной синоауртикулярной блокаде, электрод закрепляют на стенке правого предсердия. У женщин корпус прибора фиксируют между фасциальным футляром молочной железы и фасцией большой грудной мышцы, а у мужчин – во влагалище прямой мышцы живота. Работоспособность прибора должна контролироваться при помощи специальных устройств каждые 3-4 месяца.
 Атриовентрикулярная блокада с синдромом МАС — прямое показание к имплантации электрокардиостимулятора.
Атриовентрикулярная блокада с синдромом МАС — прямое показание к имплантации электрокардиостимулятора.Приступ Морганьи Адамса Стокса, отчего возникает, как проявляется и чем лечится
Обморочные состояния составляют большую диагностическую проблему для врачей практически всех специальностей. Не всегда возможно четко определиться с причиной этого состояния, чтобы начать оказывать адекватную медицинскую помощь.
Приступ Морганьи Адамса Стокса или МАС (иначе – МЭС) встречается при некоторых видах аритмий. Его выраженность колеблется от легкого потемнения в глазах до потери сознания, которая сменяется клинической смертью.
Причины развития синдрома Морганьи-Адамса-Стокса

Синдром МАС возникает при отсутствии сигнала от синусового узла, нарушении проведения его от предсердия к желудочкам или при асинхронном сокращении мышечных волокон сердца. К этому могут привести такие патологические состояния:
- Блокада атриовентрикулярного пути или переход неполной блокировки в полную.
- Приступ тахикардии (более 200 сокращений в минуту), трепетания или фибрилляции желудочков.
- Асистолия или брадикардия ниже 30 ударов за 60 секунд.
- Синдром недостаточности синусового узла.
Механизм развития синдрома Морганьи-Адамса-Стокса
Такие нарушения возникают на фоне ишемической болезни, накоплении в миокарде белка амилоида, кардиосклерозе после воспалительных или дистрофических процессов в миокарде, отравлении сердечными гликозидами, Кордароном, Лидокаином, бета-блокаторами или антагонистами кальция. Приступ МАС может возникнуть и при аутоиммунных заболеваниях, поражении нервной системы.
А здесь подробнее о лечении атриовентрикулярной блокады.
Синдром слабого синусового узла — причины, симптомы, диагностика и лечение

Синдром слабости синусового узла (СССУ, синдром дисфункции синусового узла) – нарушение ритма, вызванное ослаблением или прекращением функции автоматизма синусно-предсердного узла. При СССУ нарушается образование и проведение импульса из синусового узла в предсердия, что проявляется урежением сердечного ритма (брадикардией) и сопутствующими эктопическими аритмиями. У пациентов с синдромом слабости синусового узла возможно наступление внезапной остановки сердечной деятельности.
Общие сведения
Синдром слабости синусового узла (СССУ, синдром дисфункции синусового узла) – нарушение ритма, вызванное ослаблением или прекращением функции автоматизма синусно-предсердного узла. При СССУ нарушается образование и проведение импульса из синусового узла в предсердия, что проявляется урежением сердечного ритма (брадикардией) и сопутствующими эктопическими аритмиями. У пациентов с синдромом слабости синусового узла возможно наступление внезапной остановки сердечной деятельности.
Синдромом слабости синусового узла в основном страдают пожилые пациенты (старше 60-70 лет) обоего пола, хотя СССУ также встречается у детей и подростков. Распространенность данного вида аритмии в общей популяции составляет от 0,03 до 0,05%. Помимо истинной дисфункции синусового узла, связанной с его органическим поражением, встречаются вегетативные и медикаментозные нарушения функции автоматизма, устраняющиеся лекарственной денервацией сердца либо отменой препаратов, ведущих к подавлению образования и проведения импульса.
Синусовый (синусно-предсердный) узел является генератором импульсов и водителем сердечного ритма первого порядка. Он расположен в зоне устья верхней полой вены в правом предсердии. В норме в синусовом узле зарождаются электрические импульсы с частотой 60—80 в 1минуту. Синусовый узел состоит из ритмогенных пейсмекерных клеток, обеспечивающих функцию автоматизма. Деятельность синусно-предсердного узла регулирует вегетативная нервная система, что проявляется изменениями сердечного ритма сообразно гемодинамическим потребностям организма: учащением сердечных сокращений при физической нагрузке и замедлением в покое и период сна.
При развитии синдрома слабости синусового узла возникает периодическая или постоянная утрата синусно-предсердным узлом ведущей позиции в формировании сердечного ритма.

Синдром слабого синусового узла
Классификация СССУ
По особенностям клинического проявления выделяют следующие формы синдрома слабости синусового узла и варианты их течения:
1. Латентная форма – отсутствие клинических и ЭКГ-проявлений; дисфункция синусового узла определяется при электрофизиологическом исследования. Ограничений трудоспособности нет; имплантация электрокардиостимулятора не показана.
2. Компенсированная форма:
- брадисистолический вариант – слабо выраженные клинические проявления, жалобы на головокружение и слабость. Может быть профессиональное ограничение трудоспособности; имплантация электрокардиостимулятора не показана.
- брадитахисистолический вариант – к симптомам брадисистолического варианта добавляются пароксизмальные тахиаритмии. Имплантация электрокардиостимулятора показана в случаях декомпенсации синдрома слабости синусового узла под влиянием противоаритмической терапии.
3. Декомпенсированная форма:
- брадисистолический вариант – определяется стойко выраженная синусовая брадикардия; проявляется нарушением церебрального кровотока (головокружением, обморочными состояниями, преходящими парезами), сердечной недостаточностью, вызванной брадиаритмией. Значительное ограничение трудоспособности; показаниями к имплантации служат асистолия и время восстановления функции синусового узла (ВВФСУ) более 3 секунд.
- брадитахисистолический вариант (синдром Шорта) – к симптомам брадисистолического варианта декомпенсированной формы добавляются пароксизмальные тахиаритмии (суправентрикулярная тахикардия, мерцание и трепетание предсердий). Пациенты полностью нетрудоспособны; показания к имплантации электрокардиостимулятора те же, что и при брадисистолическом варианте.
4. Постоянная брадисистолическая форма мерцательной аритмии (на фоне ранее диагностированного синдрома слабости синусового узла):
- тахисистолический вариант – ограничение трудоспособности; показаний к имплантации электрокардиостимулятора нет.
- брадиситолический вариант — ограничение трудоспособности; показаниями к имплантации электрокардиостимулятора служат церебральная симптоматика и сердечная недостаточность.
Развитию брадисистолической формы мерцательной аритмии может предшествовать любая из форм дисфункции синусового узла. В зависимости от регистрации признаков слабости синусового узла при холтеровском ЭКГ-мониторировании выделяют латентное (признаки СССУ не выявляются), интермиттирующее (признаки СССУ выявляются при снижении симпатического и возрастании парасимпатического тонуса, например, в ночные часы) и манифестирующее течение (признаки СССУ выявляются при каждом суточном ЭКГ-мониторировании).
Синдром слабости синусового узла может протекать остро и хронически, с рецидивами. Острое течение синдрома слабости синусового узла часто наблюдается при инфаркте миокарда. Рецидивирующее течение СССУ может быть стабильным или медленно прогрессирующим. По этиологическим факторам различаются первичная и вторичная формы синдрома слабости синусового узла: первичная вызывается органическими поражениями синусно-предсердной зоны, вторичная — нарушением ее вегетативной регуляции.
Причины СССУ
К случаям первичного синдрома слабости синусового узла относится дисфункция, вызванная органическими поражениями синоатриальной зоны при:
- кардиальной патологии — ИБС, гипертонической болезни, кардиомиопатии, пороках сердца, миокардитах, хирургических травмах и трансплантации сердца;
- идиопатических дегенеративных и инфильтративных заболеваниях;
- гипотиреозе, дистрофии костно-мышечного аппарата, старческом амилоидозе, саркаидозе, склеродермическом сердце, злокачественных опухолях сердца, в стадии третичного сифилиса и др.
Ишемия, вызванная стенозом артерии, питающей синусовый узел и синоатриальную зону, воспаление и инфильтрация, кровоизлияние, дистрофия, локальный некроз, интерстициальный фиброз и склероз вызывают развитие на месте функциональных клеток синусно-предсердного узла соединительной ткани. Вторичный синдром слабости синусового узла обусловлен внешними (экзогенными) факторами, воздействующими на синусный узел. К экзогенным факторам относят гиперкалиемию, гиперкальциемию, лечение лекарственными препаратами, снижающими автоматизм синусового узла ( b-адреноблокаторами, клофелином, допегитом, резерпином, кордароном, верапамилом, сердечными гликозидами и др.).
Особо среди внешних факторов выделяют вегетативную дисфункцию синусового узла (ВДСУ). ВДСУ часто наблюдается в связи с гиперактивацией блуждающего нерва (рефлекторной или длительной), вызывающей урежение синусового ритма и удлинение рефрактерности синусового узла. Тонус блуждающего нерва может повышаться при физиологических процессах: во сне, во время мочеиспускания, дефекации, кашля, глотания, тошноты и рвоты, пробы Вальсавы. Патологическая активация блуждающего нерва может быть связана с заболеваниями глотки, мочеполового и пищеварительного трактов, имеющих обильную иннервацию, а также при гипотермии, гиперкалиемии, сепсисе, повышении внутричерепного давления.
ВДСУ чаще наблюдается у подростков и молодых людей в связи со значительной невротизацией. Стойкий синусовый брадикардический ритм также может отмечаться у тренированных спортсменов в связи с выраженным преобладанием вагусного тонуса, однако, такая брадикардия не является признаком синдрома слабости синусового узла, т. к. нарастание частоты сердечных сокращений происходит адекватно нагрузке. Вместе с тем, у спортсменов может развиваться истинная СССУ в сочетании с другими нарушениями ритма, обусловленные дистрофией миокарда.
Симптомы СССУ
Варианты клинического течения синдрома слабости синусового узла разнообразны. У части пациентов клиника СССУ длительный период времени может отсутствовать, у других отмечаются выраженные нарушения ритма, сопровождающиеся в тяжелых случаях головными болями, головокружением, приступами Морганьи-Адамса-Стокса. Возможно расстройство гемодинамики в результате уменьшения ударного и минутного объема выброса, сопровождающихся, в том числе, развитием кардиальной астмы, отека легких, коронарной недостаточностью (стенокардией, реже – инфарктом миокарда).
В клинике синдрома слабости синусового узла выделяют две основные группы симптомов: церебральные и кардиальные. Церебральная симптоматика при маловыраженных нарушениях ритма проявляется усталостью, раздражительностью, забывчивостью, эмоциональной лабильностью. У пожилых пациентов наблюдается снижение интеллекта и памяти. При прогрессировании СССУ и недостаточности мозгового кровообращения церебральная симптоматика нарастает. Развиваются предобморочные состояния и обмороки, которым предшествует появление шума в ушах, резкой слабости, ощущение замирания или остановки сердца. Обмороки кардиального генеза при синдроме Морганьи-Эдемс-Стокса протекают без предвестников и судорог (исключение – случаи длительной асистолии).
Кожные покровы бледнеют, холодеют, покрываются холодным потом, АД резко снижается. Провоцировать обмороки может кашель, резкий поворот головы, ношение тесного воротника. Обычно обмороки проходят самостоятельно, однако при затяжных обморочных состояниях может потребоваться оказание неотложной помощи. Выраженная брадикардия может вызывать дисциркуляторную энцефалопатию, характеризующуюся усилением головокружения, появлением мгновенных провалов в памяти, парезов, «проглатыванием» слов, раздражительностью, инсомнией, снижением памяти.
Кардиальные проявления синдрома слабости синусового узла начинаются с ощущений пациентом замедленного или нерегулярного пульса, болей за грудиной (в связи с недостатком коронарного кровотока). Присоединяющиеся аритмии сопровождаются сердцебиением, перебоями в работе сердца, одышкой, слабостью, развитием хронической сердечной недостаточности.
При прогрессировании СССУ нередко присоединяется вентрикулярная тахикардия или фибрилляция, повышающие вероятность развития внезапной сердечной смерти. Среди других органических проявлений синдрома слабости синусового узла могут отмечаться олигурия, обусловленная почечной гипоперфузией; нарушения со стороны желудочно-кишечного тракта, перемежающаяся хромота, мышечная слабость в связи с недостаточностью оксигенации внутренних органов и мышц.
Объективно выявляются синусовая брадикардия (особенно ночная), сохраняющаяся при физической нагрузке, синоаурикулярная блокада и эктопические ритмы (мерцание и трепетание предсердий, пароксизмальная тахикардия, суправентрикулярная, реже желудочкая экстрасистолия). После периода эктопических ритмов восстановление нормального синусового ритма замедлено и наступает после предшествующей длительной паузы.
Диагностика СССУ
Наиболее характерным признаком синдрома слабости синусового узла служит брадикардия, встречающаяся в 75% случаев, поэтому предположить наличие СССУ следует у любого пациента с выраженным урежением сердечного ритма. Установление наличия брадикардии производится при помощи ЭКГ-регистрации ритма во время появления характерной симптоматики. В пользу синдрома слабости синусового узла могут свидетельствовать следующие электрокардиографические изменения: синусовая брадикардия, синоатриальная блокада, остановка деятельности синусового узла, депрессия синусового узла в постэкстрасистолический период, синдром тахи-брадикардии, внутрипредсердная миграция водителя ритма.
В диагностике преходящей брадикардии используется холтеровское суточное мониторирование ЭКГ на протяжении 24-72 часов. Мониторирование с большей вероятностью и частотой позволяет зафиксировать вышеозначенные феномены, проследить их связь с нагрузкой и реакцию на лекарственные препараты, выявить бессимптомное течение синдрома слабости синусового узла. Для диагностики СССУ применяется атропиновая проба: при синдроме слабости синусового узла после введения 1 мл 0,1% атропина частота синусового сердечного ритма не превышает 90 ударов в минуту.
Следующим этапом диагностики СССУ служит ЭФИ — электрофизиологическое исследование. Путем введения чрезпищеводного электрода (ЧПЭКГ) пациенту проводится стимуляция ритма до 110-120 в мин., и после прекращения стимуляции по ЭКГ оценивается скорость восстановления синусовым узлом ритма сокращений. При паузе, превышающей 1,5 см, можно предположить наличие синдрома слабости синусового узла.
При выявлении измененной функции синусового узла проводится дифференциальная диагностика между истинным СССУ, обусловленным органическим поражением водителя ритма, и вегетативной или медикаментозной дисфункцией синусового узла. Для выявления кардиопатологии проводится УЗИ сердца, МСКТ и МРТ сердца.
Лечение СССУ
Объем лечебных мероприятий при синдроме слабости синусового узла зависит от степени нарушения проводимости, остроты нарушения ритма, этиологии, выраженности клинической симптоматики. При отсутствии или минимальных проявлениях СССУ проводится терапия основного заболевания и динамическое наблюдение кардиолога. Медикаментозное лечение СССУ проводится при умеренных проявлениях бради- и тахиаритмий, однако, оно малоэффективно.
Основным методом лечения синдрома слабости синусового узла является постоянная электрокардиостимуляция. При выраженной клинике СССУ, вызванной брадикардией, удлинении ВВФСУ до 3-5 сек., наличии признаков хронической сердечной недостаточности показана имплантация электрокардиостимулятора, работающего в demand-режиме, т. е. вырабатывающего импульсы при падении частоты сердечных сокращений до критических показателей.
Абсолютными показаниями к электрокардиостимуляции служат:
- хотя бы однократное возникновение приступа Морганьи-Эдемс-Стокса;
- брадикардия
- головокружения, пресинкопальные состояния, коронарная недостаточность, высокая артериальная гипертензия;
- сочетание брадикардии с другими видами аритмий, требующих назначения противоаритмических препаратов, что невозможно при нарушении проводимости.
Прогноз при СССУ
Течение синдрома слабости синусового узла обычно имеет тенденцию к прогрессированию, поэтому в отсутствии лечения клиническая симптоматика усугубляется. Неблагоприятно на прогноз СССУ влияют имеющиеся органические заболевания сердца.
В значительной мере прогноз СССУ определяется проявлением дисфункции синусового узла. Наиболее неблагоприятным сочетанием является синусовая брадикардия и предсердные тахиаритмии; менее неблагоприятный прогноз – при сочетании с синусовыми паузами; удовлетворительный – наличие изолированной синусовой брадикардии. Такой прогноз обусловлен вероятностью развития тромбоэмболических осложнений при каждом из вариантов течения, являющихся причиной летальности у 30-50% пациентов с синдромом слабости синусового узла.
В целом СССУ увеличивает процент летальности в среднем на 4-5% ежегодно, причем развитие внезапной сердечной смерти может наступить в любой из периодов заболевания. Продолжительность жизни пациентов с СССУ при отсутствии лечения вариабельна и может составлять от нескольких недель до 10 и более лет.
Профилактика СССУ
Предупреждение развития синдрома слабости синусового узла включает своевременное выявление и терапию опасных этиологических состояний, осторожное назначение противоаритмических препаратов, влияющих на автоматизм и проводимость синусового узла. Для профилактики фибрилляции предсердий у пациентов с СССУ необходимо проведение электрокардиостимуляции.
Синусовый узел: понятие, синдром слабости, дисфункция
Автор: Сазыкина Оксана Юрьевна, кардиолог
Самозарождение электричества в сердце кажется нереальным и невозможным, но так и есть – сердце способно самостоятельно генерировать электрические импульсы, и главенствующую роль в этом по праву играет синусовый узел.
Основа сокращения сердечной мышцы – перевод электрической энергии в кинетическую, то есть электрическое возбуждение мельчайших клеток миокарда приводит к их синхронному сокращению, способному с определенной силой и частотой выталкивать кровь в сосуды организма. Такая энергия возникает в клетках синусового узла, которые предназначены не для того, чтобы сокращаться, а для того, чтобы благодаря работе ионных каналов, пропускающих в клетку и из нее ионы калия, натрия и кальция, генерировать электрический импульс.
Синусовый узел – что это такое?
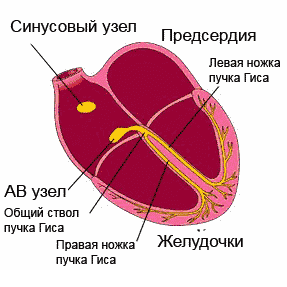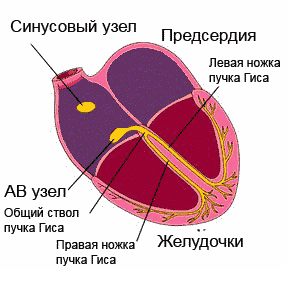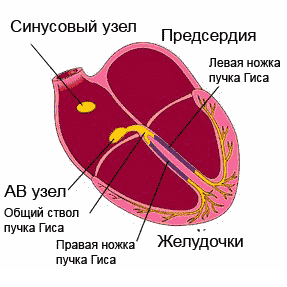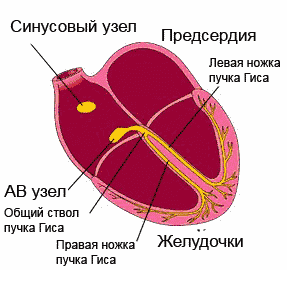
Синусовый узел также называется водителем ритма и представляет собой образование размером около 15 х 3 мм, располагающееся в стенке правого предсердия. Импульсы, возникающие в этом месте, передаются на близлежащие сократительные клетки миокарда и распространяются до следующего участка проводящей системы сердца – до атриовентрикулярного узла. Синусовый узел способствует сокращению предсердий в определенном ритме – с частотой 60-90 сокращений в минуту. Сокращение желудочков в таком же ритме осуществляется путем проведения импульсов по атриовентрикулярному узлу и пучку Гиса.
Регуляция деятельности синусового узла тесно связана с вегетативной нервной системой, представленной симпатическими и парасимпатическими нервными волокнами, осуществляющими регуляцию всех внутренних органов. Последние волокна представлены блуждающим нервом, замедляющим частоту и силу сердечных сокращений. Симпатические волокна же, наоборот, ускоряют ритм и увеличивают силу сокращений миокарда. Вот почему замедление (брадикардия) и учащение (тахикардия) ритма сердца возможно у практически здоровых лиц с вегето-сосудистой дистонией, или вегетативной дисфункцией – нарушением нормальной координации вегетативной нервной системы.
Если же речь идет о поражении именно сердечной мышцы, то возможно развитие патологического состояния, называемого дисфункцией (ДСУ), или синдромом слабости синусового узла (СССУ). Данные понятия не являются практически равнозначными, но в целом речь идет об одном и том же – о брадикардии с различной степенью выраженности, способной вызвать катастрофическое снижение кровотока в сосудах внутренних органов, и, в первую очередь, головного мозга.
Причины слабости синусового узла
Ранее понятия дисфункции и слабости синусового узла объединялись, но в настоящее время принято считать, что дисфункция является состоянием потенциально обратимым и вызвана функциональными расстройствами, в то время как синдром слабости узла обусловлен органическим поражением миокарда в области водителя ритма.
Причины дисфункции синусового узла (чаще встречается в детском возрасте и у подростков):
- Возрастная инволюция синусового узла – уменьшение активности пейсмекерных клеток вследствие возрастных особенностей,
- Возрастная или врожденная дисфункция отделов вегетативной нервной системы, проявляющаяся не только нарушением регуляции синусовой активности, но и изменением тонуса сосудов, вследствие чего имеет место понижение или повышение артериального давления.
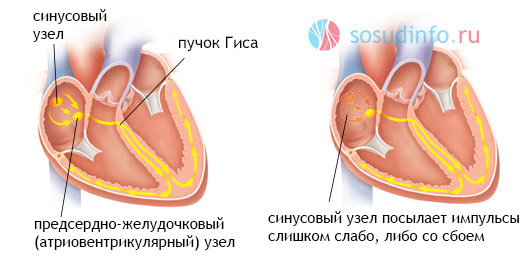
Причины синдрома слабости синусового узла (СССУ) у детей:
- Амилоидоз с поражением сердечной мышцы – откладывание в миокарде патологического белка – амилоида,
- Аутоиммунное поражение сердечной мышцы вследствие системных процессов – системная красная волчанка, ревматизм, системная склеродермия,
- Поствирусные миокардиты – воспалительные изменения в толще сердечной мышцы, захватывающие правое предсердие,
- Токсическое влияние некоторых веществ – антиаритмические препараты, фосфороганические соединения (ФОС), блокаторы кальциевых каналов (верапамил, дилтиазем и др) – как правило, клинические проявления исчезают после прекращения действия вещества и проведения дезинтоксикационной терапии.
Причины слабого синусового узла во взрослом возрасте (как правило, у лиц старше 50 лет) – кроме возможных перечисленных выше состояний, наиболее часто развитие заболевания провоцируют:
Симптомы заболевания

Клинические признаки слабости синусового узла зависят от типа и степени возникающих нарушений в его работе. Так, по типу клинико-электрокардиографических изменений выделяют:
- Упорную выраженную брадикардию,
- Синдром «тахи-бради» – чередующиеся приступы редкого и быстрого сердцебиения,
- Брадисистолическую форму мерцательной аритмии – это состояние, которое характеризуется тем, что функции водителя ритма на себя берут мельчайшие участки электрически активной ткани в предсердиях, но вследствие этого мышечные волокна предсердий сокращаются не синхронно, а хаотично, так еще и реже, чем должно быть в норме,
- Синоаурикулярную (синоатриальную) блокаду – состояние, при котором возникает блок для проведения импульсов либо в самом узле, либо на выходе из него.
Клинически брадикардия начинает проявляться, когда частота сердечных сокращений составляет менее 45 – 50 ударов в минуту. К симптомам относятся повышенная утомляемость, головокружение, резкая слабость, мелькание мушек перед глазами, предобморочное состояние, особенно при физической нагрузке. При ритме менее 40 развиваются приступы МЭС (МАС, Морганьи – Адемса – Стокса) – потери сознания, обусловленные резким снижением поступления крови в головной мозг. Опасность таких приступов в том, что в это время период отсутствия электрической активности сердца составляет более 3-4 секунд, что чревато развитием полной асистолии (остановки сердца) и клинической смерти.
Синоаурикулярная блокада I степени клинически никак себя не проявляет, а вот II и III степени характеризуется приступами головокружения и обмороками.
Синдром тахи-бради проявляется резкими ощущениями перебоев в работе сердца, чувством учащенного сердцебиения (тахикардии), а затем резким замедлением пульса, вызывающего головокружение или обморок. Подобными нарушениями проявляется и мерцательная аритмия – резкие перебои в сердце с последующей потерей сознания или без нее.
Диагностика
В план обследования при подозрении на синдром синусового узла (СССУ) включены следующие методы диагностики:
- Стандартная ЭКГ – может быть информативной при выраженных нарушениях проводимости по синоатриальному соединению, так как, например, при блокаде I степени не всегда удается зафиксировать электрокардиографические признаки.
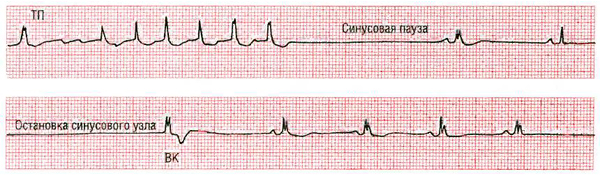
Лента ЭКГ: синдром тахи-бради – с остановкой синусового узла после приступа тахикардии, затем следует синусовая брадикардия
- Суточное мониторирование ЭКГ и АД более информативно, однако тоже не всегда может зарегистрировать нарушения ритма, особенно если речь идет о коротких пароксизмах тахикардии с последующими значимыми паузами в сокращении сердца.
- Запись ЭКГ после дозированной физической нагрузки, например, после проведения тредмил теста (ходьбы по беговой дорожке) или велоэргометрии (прокрутки педалей на устойчивом велосипеде). Оценивается прирост тахикардии, которая в норме должна наблюдаться после нагрузки, а при наличии СССУ отсутствует или выражена незначительно.
- Эндокардиальное ЭФИ (эндоЭФИ) – инвазивный метод исследования, суть которого состоит во введении микроэлектрода через сосуды в полость сердца и в последующей стимуляции сокращений сердца. После искусственно вызванной тахикардии оценивается наличие и степень задержек проводимости по синусовому узлу, которые проявляются на ЭКГ паузами длительностью более 3 секунд в случае наличия синдрома слабости синусового узла.
- Чрезпищеводное электрофизиологическое исследование (ЧПЭФИ) – сущность метода состоит примерно в том же, только электрод вводится через пищевод в месте его анатомической близости к правому предсердию.
Лечение синдрома слабости синусового узла
Если у пациента диагностирована дисфункция синусового узла, обусловленная вегето-сосудистой дистонией, следует получить консультацию невролога и кардиолога. Обычно в таких случаях рекомендуется соблюдение здорового образа жизни и прием витаминов, седативных и общеукрепляющих препаратов. Обычно назначаются настойки валерианы, пустырника, женьшеня, элеутерококка, эхинацеи пурпурной и т. д. Также показаны глицин и магне В6.
В случае наличия органической патологии, вызвавшей развитие синдрома слабости синусового узла, особенно с опасными для жизни длительными паузами в сердечном ритме, рекомендовано медикаментозное лечение основной патологии (пороки сердца, ишемия миокарда и тд).
В связи с тем, что в большинстве случаев СССУ прогрессирует до клинически значимых блокад и длительных периодов асистолии, сопровождающихся приступами МЭС, большей части таких пациентов в качестве единственно эффективного метода лечения показана имплантация кардиостимулятора – искусственного водителя ритма.
Операция в настоящее время может быть проведена бесплатно в системе ОМС, если пациенту одобрена заявка на получение квоты.
Приступ МЭС (Морганьи Адамса Стокса) – неотложная помощь
При потере сознания (при непосредственно приступе) или резком внезапном головокружении (при эквиваленте приступа МЭС) пациенту необходимо посчитать пульс, или, если он с трудом прощупывается на сонной артерии, посчитать частоту сердечных сокращений с помощью прощупывания или прослушивания грудной клетки слева под соском. Если пульс менее 45-50 в минуту, следует немедленно вызвать скорую медицинскую помощь.
По приезду бригады СМП или в случае наличия у пациента необходимых медикаментов необходимо подкожно ввести 2 мл 0,1%-ного раствора атропина сульфата (часто такие пациенты имеют с собой все необходимое, зная, что приступ у них может случиться в любой момент). Это препарат нивелирует замедляющее частоту сердечных сокращений действие блуждающего нерва, благодаря чему синусовый узел начинает работать с нормальной частотой.
Если инъекция оказалась неэффективной, и пациент продолжает находиться без сознания более 3-4 минут, следует незамедлительно начинать непрямой массаж сердца, так как длительная пауза в работе синусового узла может перейти в полную асистолию.
В большинстве случаев ритм восстанавливается без каких-то вмешательств благодаря импульсам либо из самого синусового узла, либо из дополнительных источников возбуждения в стенке правого предсердия. Тем не менее, если у пациента развился хотя бы один приступ МЭС, следует обследоваться в стационаре и решить вопрос об установке кардиостимулятора.
Образ жизни
При наличии у пациента синдрома слабости синусового узла он должен позаботиться о соблюдении здорового образа жизни. Необходимо правильно питаться, соблюдать режим труда и отдыха, а также исключить занятия спортом и экстремальные физические нагрузки. Незначительные нагрузки, такие как ходьба пешком, не противопоказаны при удовлетворительном самочувствии пациента.
Пребывание в армии для юношей и молодых мужчин противопоказано, так как заболевание несет потенциальную опасность для жизни.
Прогноз
При дисфункции синусового узла прогноз благоприятнее, чем при синдроме его слабости, обусловленном органическим поражением сердца. В последнем случае возможно быстрое прогрессирование частоты приступов МЭС, что может закончиться неблагоприятным исходом. После установки кардиостимулятора прогноз благоприятный, возрастает потенциальная продолжительность жизни.
Видео: лекция по синдрому слабости/дисфункции синусового узла
Вывести все публикации с меткой:Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос ответит один из ведущих авторов сайта.
На вопросы данного раздела в текущий момент отвечает: Сазыкина Оксана Юрьевна, кардиолог, терапевт
Поблагодарить специалиста за помощь или поддержать проект СосудИнфо можно произвольным платежом по ссылке.
МЭС — это… Что такое МЭС?
МЭСмеры электрического сопротивления
техн.
МЭС«Машиностроение. Энциклопедический справочник»
юр.
МЭСмедико-социальное экспертное собрание
МЭС магистральные электрические сети;
магистральные электросети
техн., энерг.
МЭСМеждународный эмиссионный синдикат
Узбекистан
МЭС«Международный электротехнический словарь»
техн.
МЭСмежрайонные электрические сети
техн.
МЭСмаксимальные элементы столбцов (строк)
МЭСминиэлектростанция
техн., энерг.
МЭСМолодёжный экспертный совет
Санкт-Петербург
Источник: Росбалт, 18.07.2003
МЭСмежсистемные электрические сети
техн.
Пример использования
МЭС Северо-Запада
МЭСмногостороннее экологическое соглашение
МЭСмагнитоуправляемая электрошлаковая сварка
техн.
МЭСМежрегиональный энергетический союз
ЗАО
Бурятия, организация, энерг.
Источник: http://www.regnum.ru/expnews/275696.html
МЭСмотовоз-электростанция
техн., энерг.
МЭСмежэлементные соединении
МЭСморская экспериментальная станция
морск.
МЭСМеждународное экономическое сотрудничество
фонд
фин.
МЭСмастерская электроспецоборудования
техн.
МЭС«Морской энциклопедический словарь»
издание, морск.
Словарь: С. Фадеев. Словарь сокращений современного русского языка. — С.-Пб.: Политехника, 1997. — 527 с.
МЭСмедико-экономические стандарты
фин.
МЭСмусоросжигающая электростанция
техн., энерг.
Словарь: С. Фадеев. Словарь сокращений современного русского языка. — С.-Пб.: Политехника, 1997. — 527 с.
МЭСмногоканальная электросвязь
связь, техн.
Пример использования
факультет МЭС
МЭСмашинно-экскаваторная станция
МЭСмобильные энергетические средства
энерг.
МЭС«Малый энциклопедический словарь»
МЭСмодульное энергетическое средство
энерг.
МЭСмежсистемные электрическме сети
техн.
МЭСМеждународный экспертный совет
Словарь: С. Фадеев. Словарь сокращений современного русского языка. — С.-Пб.: Политехника, 1997. — 527 с.
- МИРЭС
- МЭС
Мировой Энергетический Совет
энерг.
- МИРЭС
Словарь: С. Фадеев. Словарь сокращений современного русского языка. — С.-Пб.: Политехника, 1997. — 527 с.
МЭСморская экспедиционная станция
морск.
- МЭС
- МЭС СССР
Министерство электростанций СССР
гос., СССР, техн., энерг.
МЭСмедицинская экспертная система
мед.
МЭСМежгосударственный экологический совет
СНГ
СНГ
МЭСмировая экономическая система
фин.
МЭСмежотраслевой экспертный совет
МЭСмикроэмболические сигналы
МЭСмонтажно-эксплуатационная служба
МЭСмалая экспертная система
МЭСМагистральные электрические сети
филиалы ОАО «ФСК ЕЭС»: МЭС Волги, МЭС Востока, МЭС Западной Сибири, МЭС Северо-Запада, МЭС Сибири, МЭС Урала, МЭС Центра, МЭС Юга
РФ, энерг.
Источник: http://www.fsk-ees.ru/branches.html?PHPSESSID=653ea96c7ff14bfaf643322e891f8ac5
МЭСмедико-экономический стандарт
мед.
Источник: http://elibrary.ru/item.asp?id=11031226
МЭСМежрегиональная экспертная сеть
МЭСМосэнергосбыт
с апреля 2005
ранее:
Энергосбыт – филиал ОАО «Мосэнерго»
ОАО
http://www.mosenergosbyt.ru/
организация, энерг.
МЭСмежведомственный экспертный совет
Источник: http://www.garant.ru/nav.php?pid=16&ssid=35&mon=59635
Пример использования
МЭС по установлению причинной связи заболеваний, инвалидности и смерти граждан, подвергшихся воздействию радиационных факторов
Словарь сокращений и аббревиатур. Академик. 2015.
Терминальные состояния — причины, симптомы, диагностика и лечение

Терминальные состояния – это патологии, которые характеризуются критическим уровнем нарушения жизнедеятельности, грубыми изменениями газообмена, гемодинамики и метаболизма. Процесс необратим без реанимационных мероприятий. Основные клинические проявления — централизация кровотока, патологический тип дыхания, снижение артериального давления вплоть до неопределяемого, угнетение или полная утрата сознания, бледность и мраморность кожи, холодный пот, нарушение сердечного ритма. Диагностируются по имеющейся клинической картине при физикальном обследовании. Специфическое лечение — реанимационные мероприятия, которые заключаются в проведении ИВЛ, вливании кардиотонических средств, глюкокортикостероидов, коллоидных и кристаллоидных инфузионных растворов.
Общие сведения
Терминальные состояния (ТС) — начальный этап умирания. Возникают как финал жизни в глубокой старости, исход неизлечимого заболевания, результат несчастного случая. Чаще выявляется у пациентов отделений реанимации и интенсивной терапии. Скорость развития увеличивается прямо пропорционально стадии. Наиболее быстро смерть наступает у ослабленных пациентов, при лихорадке и ускоренном обмене веществ. Основным патогенетическим фактором является прогрессирующая гипоксия, которая сопровождается переходом метаболических процессов на анаэробный гликолиз. Происходит активация компенсаторных систем, что становится причиной истощения внутренних резервов. Продолжительность состояний колеблется от нескольких минут до 1-2 суток.
Терминальные состояния
Причины
Существует множество факторов развития ТС. К их числу относятся все виды болезней, приводящих к смерти пациента, а также естественные возрастные изменения. Глубоким патогенетическим фактором считается критическое уменьшение перфузии крови, кислородное голодание, нарушение метаболических процессов, накопление в организме патологических продуктов обмена веществ. Терминальные состояния возникают в следующих случаях:
- Старость. С годами тело человека подвергается изменениям деструктивного характера. Естественная смерть, которой предшествует короткий период умирания, наступает в возрасте 80-100 лет на фоне сенильной деградации миокарда, ослабления функциональной способности сердца, кахексии и обезвоживания. Подобные процессы считаются нормальными, реанимация проводится крайне редко.
- Тяжелые соматические заболевания. Около 80% случаев остановки сердца обусловлено диффузным поражением коронарных артерий, злокачественными желудочковыми тахиаритмиями, фибрилляцией желудочков и другой патологией кардиологического профиля. Сердечные заболевания могут развиваться самостоятельно или иметь вторичную природу. Кроме того, терминальные состояния являются результатом онкологических процессов, полиорганной недостаточности, генерализованных инфекций и ОНМК.
- Травматические повреждения. Критические нарушения жизнедеятельности возникают при поражении центральной нервной системы (головного и спинного мозга), легких и органов брюшной полости. При сочетанных травмах они могут развиваться в первые минуты. Ограниченное повреждение приводит к ТС через определенный промежуток времени, чаще 3-4 дня. Это обусловлено развитием раневой инфекции, истощением компенсаторных механизмов, обезвоживанием (ожоги), некрозом. Отдельно рассматривают геморрагический шок, который формируется при большом объеме кровопотери и резком снижении ОЦК.
- Механическая асфиксия. Имеет место при утоплении, удушении, удавлении, обструкции дыхательных путей инородными телами. Чаще асфиксия встречается среди детей дошкольного и младшего школьного возраста. Сравнительно легко купируется при устранении патогенетического фактора. В некоторых случаях не требует реанимационных мероприятий. Состояние стабилизируется после восстановления нормального газообмена в легких.
- Врождённая нежизнеспособность. Встречается среди недоношенных младенцев, рожденных на сроке беременности 5-7 месяцев. Обусловлена незрелостью внутренних систем организма, неспособностью ребенка существовать вне матки. Выживаемость среди таких детей низкая. Необходимо помещение в кувез, обеспечение сложных и длительных реанимационных мероприятий.
Патогенез
Терминальные состояния формируются в момент трансформации патогенеза в танатогенез. Это происходит на фоне истощения защитных ресурсов, после чего реакции, направленные на поддержание жизнедеятельности, приобретают убивающий характер. Гипервентиляция, свойственная многим патологическим процессам, приводит к возникновению респираторного алкалоза и ухудшению мозгового кровотока. Централизация кровообращения становится причиной изменения реологических свойств крови, сокращения ее общего объема.
Реакции гемостатического типа преобразуются в диссеминированное внутрисосудистое свертывание, при котором отмечается усиленное тромбообразование, сменяющееся кровоточивостью. Сокращается функциональная способность органов, выявляется декомпенсация кислотно-щелочного и электролитного баланса, наблюдается инактивация ферментных систем. Уменьшается выработка энергии, происходит нарушение передачи нервного импульса в синапсах, расстройство иннервации всех систем организма, которое заканчивается остановкой сердца.
Классификация
Критические ситуации классифицируются в зависимости от типа имеющихся изменений, глубины поражения жизненно важных систем организма, предполагаемых шансов на спасение пациента. Деление условно, так как происходящие трансформации аналогичны при большинстве танатогенных процессов. Различают семь основных разновидностей ТС:
- Шок IV степени. Возникает на фоне циркуляторной дисфункции, проявляется резким ухудшением перфузии тканей, протекает с вовлечением нескольких органов и систем. Один из основных признаков – централизация сосудистой деятельности. Развивается при острой кровопотере, сердечных катастрофах, тиреотоксическом кризе, адреногенитальном синдроме, обезвоживании, интоксикациях различного происхождения, генерализованных инфекционных процессах и аллергических реакциях.
- Терминальная кома. Присутствуют множественные нарушения в работе организма, происходит глубочайшее угнетение ЦНС, стволовых структур головного мозга. Обычно выявляется полиорганная недостаточность. Без искусственного поддержания жизнедеятельности очень быстро наступает клиническая, а после и биологическая смерть.
- Коллапс. Одна из разновидностей коронарной недостаточности. Проявляется резким снижением сосудистого тонуса, спаданием периферической кровеносной сети, уменьшением объема циркулирующей крови и сердечного выброса. При отсутствии помощи быстро приводит к гипоксии мозга, угнетению большинства функций человеческого тела, брадикардии. Может возникать при острых инфекциях, интоксикациях, передозировке инсулином, гипотензивными средствами и ганглиоблокаторами, абдоминальных и сердечных заболеваниях. Некупирующийся коллапс — причина остановки кровообращения.
- Преагональное состояние. Характеризуется быстрым и неуклонным нарастанием патологических изменений: снижением перфузии, ослаблением дыхания, угнетением сознания. Длительность периода зависит от вызвавшей его причины. При кровопотере счёт идёт на часы, при неизлечимых хронических заболеваниях — на сутки. В случае гибели от удара током или травм, несовместимых с жизнью (размозжение головы, объемные повреждения сердца), не наблюдается.
- Терминальная пауза. Представляет собой задержку дыхания, которая может продолжаться от 2 до 4 минут. Во время нее у больного отмечается резкая брадикардия или обратимая асистолия, неопределяемое артериальное давление, арефлексия и адинамия. Может быть ошибочно принята за наступление клинической смерти.
- Агония. Последняя вспышка жизнедеятельности организма. Происходит недолгосрочное восстановление коронарной активности и дыхания, незначительное повышение АД, просветление сознания на несколько минут. Не считается признаком улучшения, без реанимационной помощи всегда заканчивается смертью больного. Купировать подобные явления удается только в том случае, если они были спровоцированы устранимым фактором. Агональные эпизоды у хронических больных практически не поддаются коррекции.
- Клиническая смерть. Считается переходным периодом между жизнью и смертью. Обратима при своевременном начале восстановительных мероприятий. Сопровождается остановкой дыхания и кровообращения, отсутствием сознания, пульса на периферических и центральных артериях. Протекает на протяжении 3-5 минут, после чего изменения в ЦНС становятся необратимыми. При глубокой гипотермии восстановить жизнедеятельность можно через 30-40 минут.
Симптомы терминальных состояний
Все состояния данной группы проявляются похожей клинической картиной. У пациента отмечается гипотензия, тахикардия, по мере углубления патологии переходящая в брадикардию, признаки централизации кровообращения: бледность, серость или синюшность кожи, появление застойных пятен. На начальном этапе рефлексы могут сохраняться. Выявляется повышенная судорожная готовность. Дыхание учащенное и углублённое, с включением в процесс шеи, плечевого пояса, дна полости рта, передней брюшной стенки и межреберных мышц. Выдох активный.
По мере прогрессирования процесса развивается угнетение дыхательного центра. Респираторные движения замедляются, урежаются. Вдохи поверхностные, редкие, недостаточные для полноценного обмена газов в легких. При шоках и терминальной коме гемодинамика поддерживается с помощью кардиотоников. Самостоятельная жизнедеятельность невозможна. Сознание, как правило, отсутствует. Нормальные рефлексы постепенно угасают, сменяясь патологическими. В период агонии пульс и артериальное давление на периферии не определяются. Обнаруживаются пальпаторно выявляемые нарушения сердечного ритма. При возникновении клинической смерти дыхание, сознание и кровообращение отсутствует. Тканевый и клеточный метаболизм частично сохранены. Рефлексов любого типа, реакции на боль нет.
Диагностика
Вывод о необходимости спасательных мероприятий делают на основании клинической картины. Лечащий врач — реаниматолог-анестезиолог. Показана консультация кардиолога и специалистов, занимающихся терапией основной болезни, спровоцировавшей ухудшение. Данных, полученных в ходе физикального осмотра, достаточно для установления типа и тяжести патологии. Чтобы уточнить глубину изменений и определиться с тактикой дальнейшего ведения больного, могут использоваться аппаратные и лабораторные способы обследования:
- Физикальные методы. В ходе осмотра у пациента выявляется частота дыхания >36 или <8 в минуту, ЧСС >130-140 или <40 ударов. Уровень систолического артериального давления меньше 80 мм рт. ст., SpO2<90%. Тоны сердца приглушены, ритм неровный. Тоны Короткова при измерении АД механическим устройством могут не выслушиваться.
- Лабораторные методы. Наибольшее диагностическое значение имеет исследование крови на КЩС, содержание газов и электролитов. Выявляют снижение pH ниже 7,35, а чаще 7,29, уровень периферического pO2 <10 мм, центрального (в крови, оттекающей от мозга) — <10-12 мм. рт. столба. Показатель pCO2 превышает 50 mmHg.
- Аппаратные методы. Основной способ аппаратного обследования – использование анестезиологического монитора. Устройство позволяет в онлайн-режиме контролировать показатели жизнедеятельности: артериальное давление, сатурацию, сердечный ритм, дыхание. При необходимости практикуется прямое измерение АД с помощью внутриартериального катетера (инвазивная тонометрия). Для установления причин, спровоцировавших терминальные состояния, применяют компьютерную томографию, лапароскопию, рентгенографию, сцинтиграфию и пр. Выбор способа зависит от основного диагноза.
Интенсивная терапия
Лечение проводится с использованием ряда медикаментозных и аппаратных методик. Для восполнения ОЦК показано вливание 400-800 мл коллоидных растворов, в том числе реополиглюкина и волюлайта. Стабилизация гемодинамики достигается путем длительного постоянного введения вазопрессоров: допамина, норадреналина. Чтобы остановить патологическое свертывание, рекомендован гепарин. Подавление неадекватных иммунных реакций осуществляется за счет гормональных средств.
Для усиления действия медикаментов применяется кальция хлорид или глюконат. Восстановление нервно-мышечной проводимости выполняется с помощью прозерина. Коррекция кислотно-щелочного равновесия требует инфузии натрия гидрокарбоната в дозе 200-400 мг. Восстановление баланса солей производят с помощью растворов трисоля, ацесоля, дисоля. Для выведения токсичных метаболитов показано внутривенное введение мочегонных средств. При судорогах – мышечные релаксанты курареподобного действия, бензодиазепины.
Аппаратная поддержка заключается в проведении искусственной вентиляции лёгких. Современная техника дает возможность отрегулировать соотношение газов таким образом, чтобы избежать развития респираторного ацидоза, обеспечивая адекватную оксигенацию. Для доставки прессорных аминов используют инъектоматы — устройства, позволяющие на протяжении нескольких часов или дней вводить строго дозированное количество препарата. Блокады внутрисердечной проводимости могут потребовать установки кардиостимулятора. С целью купирования последствий гипоксии на этапе выздоровления назначается гипербарическая оксигенация.
Прогноз и профилактика
Терминальные состояния имеют неблагоприятный прогноз. Погибает до 75-80% больных. При отсутствии специализированной помощи смертность достигает 100%. Чтобы предотвратить подобные ситуации, необходим тщательный контроль над состоянием пациентов реанимационных отделений, ежедневное лабораторное исследование крови, мониторинг функции внешнего дыхания и сердечной деятельности. Все имеющиеся отклонения должны корректироваться на ранних этапах. Заболевания, потенциально способные приводить к ТС, подлежат контролю. Больной должен проходить регулярное обследование, следить за своим здоровьем, соблюдать рекомендации врача.
Синдром Мейгса — причины, симптомы, диагностика и лечение
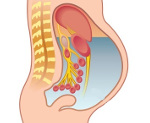
Синдром Мейгса — это особый вариант полисерозита, который возникает у пациенток с опухолями овариальной ткани, матки и полностью проходит после удаления неоплазии. Проявляется увеличением объема живота, нарастанием одышки, тахикардией, слабостью, утомляемостью, бледностью, прибавкой веса при внешних признаках кахексии. Диагностируется при помощи гинекологического осмотра, УЗИ брюшной и плевральной полостей, перикарда, тазовых органов, цитологического исследования плеврального выпота и асцитической жидкости, лапароскопии. Лечение предполагает эвакуацию экссудата, коррекцию органных расстройств, хирургическую экстирпацию опухоли.
Общие сведения
Синдром Мейгса (Демона-Мейгса, Мейгса-Салмона, Мейгса-Касса) — редкое паранеопластическое расстройство, наблюдаемое у 3% пациенток, страдающих объемными образованиями репродуктивных органов. Симптомокомплекс, проявляющийся асцитом и выпотом в полость плевры у женщин с солидными новообразованиями яичников, был детально описан Дж. Мейгсом в 1934-1935 годах. Несколько позже Р.У. Лайт расширил трактовку синдрома на все новообразования тазовых органов, в том числе злокачественные неоплазии без метастазов. Классическая комбинация овариальной опухоли, асцита и гидроторакса наблюдается в единичных случаях, чаще у пациенток определяется абдоминальный выпот. При наличии плевральной экссудации в 70% случаев процесс локализован справа, в 10% — слева, в 20% — является двусторонним. Расстройство чаще возникает у женщин после 45 лет.
Синдром Мейгса
Причины
Патологический симптомокомплекс развивается на фоне неопластического поражения яичниковой ткани и миометрия. Чаще всего полисерозит сочетается с фибромой яичников, овариальными кистами, лейомиомой матки. Плевральный, перитонеальный и перикардиальный выпот также может образовываться при карциноме яичников без признаков метастазирования, хотя в таком случае специалисты в сфере акушерства и гинекологии говорят о псевдосиндроме Мейгса. Описаны спорадические случаи возникновения полисерозита с соответствующей клинической картиной на фоне дегенеративного изменения овариальной ткани без опухолевой трансформации, обширного отека яичников, синдрома их гиперстимуляции гонадотропинами, гонадолиберинами при экстракорпоральном оплодотворении.
Патогенез
Патогенез синдрома Мейгса пока не изучен. Какие-либо специфические каналы, связывающие матку и яичники с полостями плевры и перикарда, не выявлены. Предложено несколько гипотез формирования экссудата при новообразованиях женских репродуктивных органов. Согласно одной из теорий, экссудативный выпот при синдроме Демона-Мейгса-Касса изначально скапливается в брюшной полости в результате возникновения «реакции тревоги» сосудов брюшины на растущую опухоль. Асцит способствует растяжению диафрагмы с формированием конгенитальных дефектов (плевроперитонеальных каналов), по которым экссудат просачивается в плевральную полость.
Ряд авторов не исключает патогенетическую роль лимфатических сосудов, перфорирующих диафрагмальную перегородку. Идея о нарушении венозного и лимфатического оттока в результате механического сдавливания тканей неоплазией не нашла подтверждения, поскольку у части пациенток характерный для синдрома массивный полисерозит развивается при опухолях, диаметр которых не превышает 5 см. Механизмы экссудации также могут запускаться пока неустановленными веществами, секретируемыми новообразованием.
Симптомы
Клиническая симптоматика расстройства нарастает постепенно, является неспецифической и, как правило, становится следствием давления скопившегося выпота на окружающие органы. Пациентка жалуется на периодически возникающую или постоянную незначительную, чаще одностороннюю боль внизу живота, обычно описываемую как дискомфорт. Часть женщин воспринимает болезненные ощущения как тупые, ноющие, распирающие. В последующем живот увеличивается в размерах, нарастает чувство нехватки воздуха, общее недомогание, слабость, быстрая утомляемость, потливость, ухудшение аппетита, появляется бледность кожных покровов, отечность. Отмечается значительная прибавка в весе на фоне признаков кахектического синдрома (дряблости кожи, мышечной гипотрофии). Уменьшается количество мочи, возможны запоры. У пациенток репродуктивного возраста могут возникать дисфункциональные маточные кровотечения.
Осложнения
При прогрессировании процесса и накоплении значительных объемов экссудативного выпота синдром Мейгса осложняется сердечной и легочной недостаточностью, метаболической кардиомиопатией, анемией, нарастающей ишемией различных органов и тканей. В тяжелых случаях кислородное голодание мозга, вызванное недостаточной оксигенацией крови в легких, способствует возникновению когнитивных расстройств (ухудшения памяти, невнимательности), эмоциональной лабильности, раздражительности, снижению критичности к своему состоянию. На фоне необратимых кахектических изменений возникает полиорганная недостаточность, приводящая к летальному исходу.
Диагностика
Первоначально выпот в брюшной, плевральной, перикардиальной полостях выявляется в ходе физикального обследования (перкуссии и аускультации). О наличии жидкости свидетельствует притупление перкуторного звука над пораженной половиной грудной клетки, в правом и левом фланках живота, расширение границ сердца в обе стороны. Аускультативно везикулярное дыхание в зоне тупости отсутствует или резко ослаблено, сердечные тоны приглушены, учащены. Наличие экссудата подтверждается с помощью рентгенографии грудной клетки, УЗИ плевральной полости, перикарда, органов брюшной полости, эхокардиографии. Выявление перитонеального, плеврального, перикардиального выпота служит основанием для углубленного онкообследования с целью исключения опухолей матки или яичников. Наиболее информативными методами при подозрении на синдром Мейгса являются:
- Осмотр на кресле. При бимануальном гинекологическом исследовании определяется увеличение матки (при наличии миомы), овоидное или округлое объемное образование справа или слева в области придатков (при овариальной опухоли). Доброкачественные неоплазии обычно имеют гладкую поверхность, не спаяны с окружающими тканями. Фибромы отличаются высокой плотностью, кисты зачастую эластичны.
- Сонография тазовых органов. Ультразвуковое исследование ОМТ позволяет определить точную локализацию, размеры, структуру опухолевого образования. Для уточнения особенностей его кровоснабжения используют допплерографию с цветным картированием. При необходимости УЗИ дополняют МРТ или КТ женских половых органов, в ходе которых создается их послойное изображение.
- Анализ плеврального выпота. Данные цитологического исследования жидкости, полученной с помощью торакоцентеза, подтверждают экссудативный характер процесса. Определяется повышенное количество белка, положительная проба Ривальта, единичные лимфоциты. Атипичные клетки отсутствуют. Аналогичные изменения отмечаются при цитологии асцитической жидкости.
Для выявления опухолевого процесса может быть рекомендована диагностическая лапароскопия, определение онкомаркера СА-125. В общем анализе крови пациенток с синдромом Мейгса обычно несколько снижены количество эритроцитов и уровень гемоглобина, СОЭ увеличено до 25-30 мм/ч, отмечается незначительный лейкоцитоз с палочкоядерным сдвигом влево. На ЭКГ определяются признаки дистрофических изменений миокарда.
Дифференциальная диагностика проводится с экссудативным плевритом, циррозом печени, декомпенсированной сердечной недостаточностью, синдромом полисерозита при туберкулезе, ревматизме, системной красной волчанке, уремии, сепсисе, парапротеинемическом гемобластозе, семейной средиземноморской лихорадке (периодической болезни). По показаниям пациентку консультируют пульмонолог, кардиолог, фтизиатр, ревматолог, нефролог, гематолог, онколог.
Лечение синдрома Мейгса
Терапевтическая тактика направлена на быстрое устранение симптомов компрессии органов, коррекцию сопутствующих расстройств и последующее хирургическое удаление неоплазии. При декомпенсированной полиорганной недостаточности пациентку госпитализируют в отделение интенсивной терапии, в остальных случаях рекомендована плановая предоперационная подготовка в гинекологическом стационаре. Основными этапами лечения синдрома Мейгса являются:
- Удаление экссудата. Для быстрой разгрузки организма от скопившейся жидкости выполняют торакоцентез, лапароцентез. Эвакуация жидкости проводится через дренажную систему с помощью аппарата активной аспирации. Патогномоничным признаком синдрома Демона-Мейгса является «неисчерпаемость экссудата» — его быстрое накопление после эвакуации.
- Коррекция полиорганных расстройств. Для улучшения сердечной деятельности применяют мочегонные средства, сердечные гликозиды. При тахикардии показаны ингибиторы If-каналов синусового узла, при аритмии — противоаритмические препараты. Пациенткам с нарушениями электролитного баланса рекомендовано введение солевых и онкотических растворов.
- Оперативное лечение. Объем вмешательства зависит от выявленной гинекологической патологии, возраста пациентки, ее репродуктивных планов. Возможно проведение широкого спектра операций — от вылущивания овариальной опухоли, резекции части яичника, гистерорезектоскопии миомы до циторедукции при раке яичников и экстирпации матки с придатками.
Прогноз и профилактика
Полная резорбция экссудата с восстановлением общего самочувствия обычно происходит в течение 2-х недель после оперативной экстирпации опухоли. У некоторых пациенток остается небольшое количество спаек, плевральных и перикардиальных сращений. При псевдосиндроме Мейгса, осложняющем течение злокачественных новообразований, прогноз зависит от стадии и типа онкологического процесса. Профилактика предполагает плановые осмотры акушера-гинеколога и регулярный УЗИ-скрининг для своевременного выявления и адекватного лечения опухолевого поражения матки, овариальной ткани.
Посткоммоционный синдром — причины, симптомы, диагностика и лечение

Посткоммоционный синдром — это распространённое осложнение черепно-мозговой травмы, наблюдающееся преимущественно при сотрясении головного мозга. Проявляется утомляемостью, раздражительностью, цефалгией, головокружением, лёгким интеллектуальным снижением, апатией, изменением характера. Посткоммоционный синдром диагностируется согласно клиническим критериям после исключения иных причин подобной симптоматики. Дополнительные обследования (ЭЭГ, электронистагмография, МРТ) проводятся с целью дифдиагностики. Лечение включает фармакотерапию и психотерапевтические методики.
Общие сведения
Посткоммоционный синдром (ПКС) возникает вследствие коммоции (сотрясения) головного мозга. В отдельных литературных источниках по неврологии встречается синонимичное название — постконтузионный синдром. ПКС является распространённым последствием черепно-мозговой травмы, распространенность, по различным данным, составляет до 50% от общего числа ЧМТ. Посткоммоционный синдром значительно чаще наблюдается у пациентов с лёгкой ЧМТ (сотрясением головного мозга), чем со среднетяжёлой и тяжёлой (ушиб головного мозга). У большинства пострадавших симптоматика регрессирует в период от 3 до 6 месяцев, у 15-30% проявления ПКС отмечаются более полугода, у 8-15% – до года. В случаях сохранения симптомов более года посткоммоционный синдром считается хроническим (персистирующим).

Посткоммоционный синдром
Причины посткоммоционного синдрома
Этиофактором, непосредственно вызывающим ПКС, является ЧМТ. Наблюдается обратная зависимость между тяжестью травмы и частотой возникновения синдрома. Выделяют целый ряд факторов, повышающих вероятность развития посттравматических осложнений, в том числе и ПКС. К ним относят факт потери сознания, длительную посттравматическую амнезию, пожилой возраст, субарахноидальное кровоизлияние, повреждения черепа (трещины, переломы черепных костей), алкоголизм. Однако ни один из указанных критериев не является достоверным прогностическим признаком возникновения ПКС.
Преобладающее влияние на процесс хронизации ПКС оказывают психогенные факторы, а не тяжесть травмы. Многие исследователи предполагают мультифакторный характер происходящих нарушений. Среди возможных причин персистенции выделяют:
- Преморбидные особенности характера. Эмоциональная лабильность, повышенная тревожность, раздражительность, эгоистичная настроенность приводят к длительному переживанию связанного с ЧМТ стресса. Склонность к ипохондрии закрепляет искажённое восприятие происходящих событий, что способствует хронизации ПКС.
- Соматические заболевания. Имевшиеся до травмы нарушения со стороны желудочно-кишечного тракта, гемодинамические сдвиги, вегето-сосудистая дистония негативно отражаются на течении ПКС. В основе перехода острого процесса в хронический может лежать плохое самочувствие пациента в связи с фоновой патологией.
- Психосоциальные проблемы. Низкий социально-экономический статус, плохие семейные отношения накладывают негативный отпечаток на психику пациента. Финансовые затруднения зачастую является основой мотивационного фактора — стремлением пострадавшего получить страховку, компенсацию по травме.
- Ятрогенные факторы. Переоценка тяжести ЧМТ специалистами амбулаторной практики, дополнительные обследования и госпитализация без наличия существенных показаний поддерживают стрессовое состояние пациента. Необоснованное назначение медикаментозного лечения негативно отражается на здоровье и самочувствии.
Патогенез
Причинно-следственная связь с травмой и механизм развития патологии окончательно не выяснены. Одни клиницисты полагают, что посткоммоционный синдром имеет органическую природу, другие выдвигают психогенную теорию его патогенеза. Макроскопические морфологические изменения, выявляемые при проведении церебральной МРТ, у 8-10% больных свидетельствуют в пользу органического происхождения ПКС. Подтверждением гипотезы считается обнаружение диффузных аксональных повреждений при микроскопии мозга в ходе аутопсии пациентов, у которых лёгкая ЧМТ сочеталась с тяжёлой политравмой. Составляющими органической природы ПКС могут являться возникающие после травмы метаболические расстройства, нарушения церебральной микроциркуляции. Исследование при помощи ПЭТ-КТ показало пониженный уровень метаболизма глюкозы в височных областях мозга больных, имеющих посткоммоционный симптомокомплекс.
В пользу психогенной теории свидетельствует большая встречаемость и тяжесть протекания ПКС у больных с психическими расстройствами в анамнезе, усугубление течения под воздействием стресса, сходство тревожно-депрессивной симптоматики ПКС с невротическими расстройствами. Некоторые исследователи утверждают, что ПКС чаще встречается у женщин, отличающихся более выраженной склонностью к психоэмоциональным реакциям, чем мужчины. Возможен сочетанный механизм развития, включающий реализацию психогенных механизмов на фоне органических церебральных изменений.
Симптомы посткоммоционного синдрома
Симптоматика ПКС отличается отсутствием специфичности и большим полиморфизмом. Наиболее характерными жалобами являются упорные головные боли, головокружения, тошнота, нарушения сна, гиперакузия, быстрая утомляемость, чувство беспокойства, пониженный фон настроения. Расстройства сна протекают в рамках инсомнии со сложностями засыпания, ночными пробуждениями. Посткоммоционный симптомокомплекс включает лёгкие нарушения когнитивных функций – снижение памяти, способности концентрировать внимание.
В психоэмоциональной сфере наблюдается аффективная лабильность, заниженная самооценка, раздражительность, апатия, снижение мотивации, склонность к депрессии. Близкие пациента отмечают изменения его личности. Возможны сексуальные расстройства: снижение либидо, фригидность, диспареуния. Определяется снижение толерантности к алкоголю, существенное падение уровня стрессоустойчивости. В ряде случаев присутствуют проявления вегетативной дисфункции: приливы жара в теле, ознобы, сердцебиения, эпизодическая потливость.
Осложнения
Основным осложнением ПКС является хронизация процесса. Симптоматика при этом носит пожизненный характер. Возникает стойкое когнитивное снижение, патологическое изменение личности. Возможны психические расстройства в виде тяжёлой депрессии, аффективных реакций. Указанные нарушения фактически инвалидизируют пациента, лишают возможности продолжать профессиональную деятельность. Потеря работы может усугубить посткоммоционный синдром, спровоцировать серьёзные психические расстройства.
Диагностика
В основу диагностики положены анамнестические и клинические данные. В 1992 году в МКБ-10 впервые были сформулированы клинические критерии ПКС, что намного облегчило обнаружение данного состояния. Основными критериями являются наличие ЧМТ в анамнезе, когнитивный дефицит, присутствие 3-х из следующих симптомов: расстройство сна, головная боль, утомляемость, головокружение, изменения личности, раздражительность, эмоциональная лабильность, апатия. Инструментальные исследования необходимы для дифференциальной диагностики. Стандартный перечень обследований включает:
- Осмотр невролога. В неврологическом статусе отсутствуют признаки очагового неврологического дефицита. Объективный осмотр выявляет симптомы вегетативной дисфункции.
- Нейропсихологическое тестирование. Осуществляется нейропсихологом, психиатром, клиническим психологом. Необходимо для оценки состояния когнитивных функций и эмоционально-волевой сферы.
- Электроэнцефалографию. Проводится с целью дифференциальной диагностики. Подтверждает неспецифические диффузные изменения в виде снижения амплитуды основного ритма.
- Электронистагмографию. Исследование производится офтальмологом, направлено на определение скрытого нистагма, который выступает одним из признаков органического поражения мозга. Наличие нистагма нехарактерно для ПКС.
- МРТ головного мозга. Спустя 3 недели с момента травмы выявляет фокусы повреждения мозговой ткани у 10% пострадавших. Указанные изменения имеют тенденцию к регрессу и полностью исчезают в течение 3 месяцев.
Диагноз «Посткоммоционный синдром» правомочен при наличии типичной симптоматики через 3 месяца после травмы. Необходимым условием является исключение прочих посттравматических осложнений (внутримозговой гематомы) и фоновых церебральных заболеваний (рассеянного склероза, энцефалопатии, мультисистемной атрофии). При повторном характере ЧМТ указанные симптомы вероятнее всего укладываются в рамки травматической энцефалопатии.
Лечение посткоммоционного синдрома
Оптимальное ведение больных с ПКС неоднозначно и широко дискутируется специалистами. Осуществляется комплексная коррекция основных клинических проявлений, психологическая и психотерапевтическая поддержка. Наряду с этим необходимо избегать применения фармпрепаратов с выраженным седативным эффектом, замедляющим восстановительные процессы. Лечение включает две основные составляющие:
- Фармакотерапию. Большинство клиницистов предпочитают назначать препараты комбинированного действия, содержащие алкалоиды красавки, фенобарбитал, эрготамин. Положительный эффект связан с вегетостабилизирующим, лёгким седативным, спазмолитическим действием. С целью восстановления когнитивных функций показаны ноотропы (пирацетам, аминалон), нейрометаболиты (глютаминовая кислота).
- Психокоррекцию. С учетом выраженности нарушений применяется психологическое консультирование, психотерапия, когнитивно-поведенческая терапия. Для улучшения интеллектуальных способностей рекомендованы когнитивные тренинги.
Прогноз и профилактика
В большинстве случаев прогноз благоприятный, посткоммоционный синдром регрессирует в течение полугода. В 8-15% случаев симптоматика наблюдается на протяжении года и дольше. В случаях, когда посткоммоционный синдром переходит в хроническую форму, прогноз для выздоровления сомнительный. Поскольку основным этиопатогенетическим звеном развития заболевания выступает психогенный механизм, профилактика заключается в создании благоприятного психологического климата перенёсшему травму пациенту, исключении факторов, способствующих хронизации процесса. В восстановительном периоде больному рекомендованы занятия с психологом, психотерапевтом.
