Щавелевая кислота — это… Что такое Щавелевая кислота?
- Щавелевая кислота
- простейшая двухосновная Карболовая кислота, HOOC—COOH; бесцветные кристаллы, tпл 189,5 °С; растворяется в воде: в 100 г — 10 г (20 °С) и 120 г (100 °С), ограниченно — в спирте, эфире; нерастворима в бензоле, хлороформе. Щ. к. — относительно сильная кислота (K125 = 3,6.10―2). Образует гидрат состава C2H2O4.2H2O (tпл 101,5 °С), кислые и средние соли (оксалаты), эфиры, амиды и другие производные. Соли Щ. к. распространены в растениях, например кислая калиевая соль обнаружена в щавеле (отсюда и название кислоты). В тканях организма Щ. к. образуется как продукт обмена веществ и вместе с Щ. к. пищи выделяется с мочой в виде оксалата кальция. При нарушениях минерального обмена оксалаты участвуют в образовании камней в почках и мочевом пузыре. Щ. к. образуется при щавелевокислом брожении. Впервые Щ. к. синтезирована в 1842 Ф. Вёлером из дициана. В промышленности её получают пиролизом муравьинокислого натрия (HCOONa). Применяется как протрава при ситцепечатании, в производстве красителей, чернил, в качестве отбеливающего средства и осадителя редкоземельных элементов.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
Смотреть что такое «Щавелевая кислота» в других словарях:
Щавелевая кислота — Номенклату … Википедия
ЩАВЕЛЕВАЯ КИСЛОТА — ЩАВЕЛЕВАЯ КИСЛОТА, (COOH)2, бесцветные кристаллы, tпл 189,5шC. Содержится в виде калиевой соли в щавеле, кислице. В промышленности щавелевая кислота и её соли (оксалаты) получают химическим синтезом, применяют в текстильной промышленности… … Современная энциклопедия
ЩАВЕЛЕВАЯ КИСЛОТА — НООССООН; бесцветные кристаллы, tпл 189,5 .С. Содержится в виде калиевой соли в щавеле, кислице. В промышленности получают синтетически. Щавелевая кислота и ее соли (оксалаты) применяются в текстильной промышленности (протрава), в аналитической… … Большой Энциклопедический словарь
ЩАВЕЛЕВАЯ КИСЛОТА — ЩАВЕЛЕВАЯ КИСЛОТА, этан дикислота, (С00Н)2 2Н2О. Щ. к. весьма распространена в природе. Она встречается как в свободном виде (в нек рых грибах), так гл. обр. в виде солей. Калиевая соль Щ. к., кислая и средняя, находится в щавеле, ревене,… … Большая медицинская энциклопедия
Щавелевая кислота — ЩАВЕЛЕВАЯ КИСЛОТА, (COOH)2, бесцветные кристаллы, tпл 189,5°C. Содержится в виде калиевой соли в щавеле, кислице. В промышленности щавелевая кислота и её соли (оксалаты) получают химическим синтезом, применяют в текстильной промышленности… … Иллюстрированный энциклопедический словарь
ЩАВЕЛЕВАЯ КИСЛОТА — (дикарбоновая кислота), ядовитая бесцветная кристаллическая органическая кислота (С2Н2О4), чьи соли содержатся в некоторых растениях, например, в щавеле и в ревене. Используется для чистки текстильных и металлических изделий, а также в дублении … Научно-технический энциклопедический словарь
ЩАВЕЛЕВАЯ КИСЛОТА — (HOOCCOOH) простейшая двухосновная кислота насыщенного ряда, принадлежит к сильным органическим кислотам; бесцветные игольчатые кристаллы. Щ. к. ядовита. Содержится в виде калиевой соли в щавеле, кислице. В промышленности получают синтетически. Щ … Российская энциклопедия по охране труда
щавелевая кислота — Кислота, синтезируемая некоторыми организмами [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN oxalic acid … Справочник технического переводчика
ЩАВЕЛЕВАЯ КИСЛОТА — (Н2С204) простейшая двухосновная кислота насыщенного ряда, принадлежит к сильным органическим кислотам, образует кристаллогидрат с двумя молекулами воды. Широко распространена в природе как в свободном состоянии, так и виде солей оксалатов.… … Большая политехническая энциклопедия
Щавелевая кислота — ЩАВЕЛЬ, я, м. Травянистое растение сем. гречишных с продолговатыми съедобными кислыми листьями. Щи из щавеля. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ЩАВЕЛЕВАЯ КИСЛОТА — НООССООН, дикарбоновая к та. В свободном состоянии и в виде солей оксалатов широко распространена во мн. растениях (кислица, щавель, шпинат, молодило), часто образуя в клетках характерные кристаллы друзы; оксалаты обнаружены также в тканях… … Биологический энциклопедический словарь
Разница между Оксалатом и Щавелевой кислотой
Основное различие между Оксалатом и Щавелевой кислотой заключается в том, что
Оксалат является сопряженным основанием Щавелевой кислоты. Тогда как образование щавелевой кислоты является поэтапной реакцией, которая дает набор из нескольких соединений, известных как Щавелевая кислота.
Содержание
- Обзор и основные отличия
- Что такое Оксалат
- Что такое Щавелевая кислота
- В чем разница между Оксалатом и Щавелевой кислотой
- Заключение
Что такое Оксалат?
Оксалат представляет собой анион, имеющий химическую формулу C2O42-. Он является дианионом, так как это комбинация двух заряженных разновидностей, которую можно записать как (COO)22-. Кроме того, он может встречаться в виде аниона в ионных соединениях или в качестве лиганда в координационных соединениях. Однако превращение оксалата в щавелевую кислоту является сложной и поэтапной реакцией.
 Химическая структура Оксалата
Химическая структура ОксалатаМолярная масса этого иона составляет 88 г/моль. При рассмотрении структуры этого аниона, геометрия может быть либо плоской, либо ступенчатой структурой в соответствии с рентгеноструктурным анализом.
 Оксалат кальция — камни в почках
Оксалат кальция — камни в почкахОксалат в организме при соединении с катионами кальция магния и железа оксалат образует нерастворимый осадок, который может накапливаться в виде камней почках.
Что такое Щавелевая кислота?
Щавелевая кислота — это органическое соединение, имеющее химическую формулу C2H2O4. Это бесцветное твердое вещество, которое легко растворяется в воде.

Она является дикарбоновой кислотой, так как имеет комбинацию двух групп карбоновых кислот, и является самой простой дикарбоновой кислотой. Кроме того, она обладает высокой кислотной силой и является сильным восстановителем. Основанием конъюгата этой кислоты является оксалат-ион.
 Химическая структура Щавелевой кислоты
Химическая структура Щавелевой кислотыКак правило, эта кислота встречается в дигидратной форме. Она естественным образом встречается в некоторых продуктах питания. Молярная масса безводной формы составляет 90 г/моль.
В чем разница между Оксалатом и Щавелевой кислотой?
Основное различие между Оксалатом и Щавелевой кислотой заключается в том, что Оксалат представляет собой анион, тогда как Щавелевая кислота представляет собой органическое соединение. Кроме того, молярная масса Оксалата составляет 88 г/моль, тогда как молярная масса щавелевой кислоты составляет 90 г/моль. Конъюгат оксалат-иона представляет собой щавелевую кислоту, а конъюгат щавелевой кислоты — оксалат.
Заключение — Оксалат против Щавелевой кислоты
Оксалат это анион, который происходит от щавелевой кислоты. Щавелевая кислота является органическим соединением. Основное различие между Оксалатом и Щавелевой кислотой заключается в том, что Оксалат представляет собой анион, тогда как Щавелевая кислота представляет собой органическое соединение.
XuMuK.ru — Щавелевая кислота
Эта кислота известна еще с XVII столетия. Она чрезвычайно распространена в природе. В виде щавелевокислого кальция (оксалата кальция) она содержится во всех растениях. Много кислой калиевой соли щавелевой кислоты находится в щавеле и кислице. В ничтожных количествах щавелевая кислота встречается и в животных организмах. Оксалат кальция содержится в виде осадка в моче человека при некоторых нарушениях обмена веществ.Щавелевая кислота образуется часто при окислении, различных органических веществ. Раньше ее получали окислением древесных опилок кислородом воздуха при нагревании их с расплавленными едкими щелочами. При этом для прохождения реакции обязательно требуется присутствие хотя бы небольшого количества едкого кали; с чистым едким натром получение щавелевой кислоты невозможно. Окисление сахара азотной кислотой в присутствии пятиокиси ванадия как катализатора применяется и теперь для технического получения щавелевой кислоты
(отсюда и произошло в свое время название этой кислоты — «сахарная соль»). Другой промышленный способ получения щавелевой кислоты основан на том, что при быстром нагревании до 360° С формиат натрия (а также калия) отщепляет водород, превращаясь в оксалат натрия. Так как формиат натрия получается из окиси углерода и едких щелочей, то практически щавелевую кислоту можно получить непосредственно из этих веществ.
Существует много способов получения щавелевой кислоты, представляющих теоретический интерес. Например, при взаимодействии щелочных металлов с углекислым газом при 360° С получается соль щавелевой кислоты:
Щавелевая кислота получается при омылении дициана NC—CN и др.
При кристаллизации из воды щавелевая кислота обыкновенно получается в виде гидрата С2Н2О4 ∙ 2Н2О. Этот гидрат начинает диссоциировать уже выше 30° С. При очень быстром нагревании он плавится при 101,5° С. Безводная кислота в виде ромбических октаэдров может быть получена кристаллизацией из 70%-ной серной кислоты, а также высушиванием при осторожном нагревании (лучше — в вакууме). При возгонке щавелевая кислота получается в двух кристаллических формах: при низких температурах в вакууме — иглы, при более высоких — октаэдры. Безводная кислота плавится при 180° С с разложением.
Щавелевая кислота может быть окислена до углекислоты и воды:
На этом основано применение щавелевой кислоты и
При нагревании щавелевая кислота разлагается (особенно легко в присутствии концентрированной серной кислоты) на окись углерода, углекислоту и воду:
Таким образом, теоретически возможный ангидрид щавелевой кислоты оказывается неспособным к существованию.
Щавелевая кислота как двухосновная дает кислые и средние соли (оксалаты). Известны также и молекулярные соединения кислых оксалатов со щавелевой кислотой («тетраоксалаты»), как, например, кисличная соль КНС2О4 ∙ Н2С2О4 ∙ 2Н2О, употребляемая для выведения чернильных пятен.
Из солей щавелевой кислоты растворимы в воде лишь соли щелочных металлов. Щавелевокислый кальций нерастворим в воде и уксусной кислоте, но растворим в соляной кислоте; эти его свойства используются в качественном и количественном анализе для определения кальция. При обыкновенной температуре он кристаллизуется с одной молекулой воды, при более низких температурах — с тремя молекулами воды.
Щавелевая кислота легко дает комплексные соли, например K2[Fe(C2O4)2] и K3[Fe(C2O4)3]. В растворах этих солей содержатся комплексные ионы — двухзарядный ион Fe(C2O4)22– и трехзарядный ион Fe(C2O4)33–. Растворы первой из указанных солей имеют желтый цвет; эта соль применяется в качестве проявителя в фотографии.
Растворы второй соли окрашены в зеленый цвет.
Оксалоацетат — Википедия
Материал из Википедии — свободной энциклопедии
Оксалоацетат | |
|---|---|
 | |
Общие | |
| Систематическое наименование | оксобутандиовая кислота |
| Традиционные названия | щавелевоуксусная кислота |
| Хим. формула | C₄H₄O₅ |
| Рац. формула | HO2C-C(OH)=CH-CO2H |
Термические свойства | |
| Т. плав. | 161 ℃ |
Классификация | |
| Номер CAS | 328-42-7 |
| PubChem | 970 |
| ChemSpider | 945 |
| Номер EINECS | 206-329-8 |
| ChEBI | 30744 |
C(C(=O)C(=O)O)C(=O)O | |
1S/C4h5O5/c5-2(4(8)9)1-3(6)7/h2h3,(H,6,7)(H,8,9) | |
Безопасность | |
| R-фразы | R34 |
| S-фразы | S20, S26, S36/37/39, S45 |
| Пиктограммы СГС |  |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
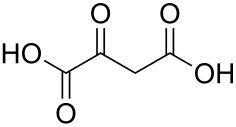
Оксалоацетат, щавелевоуксусная кислота (HO2C-C(O)-CH2-CO2H) — органическое соединение, четырёхуглеродная двухосновная кетокислота. Существует в виде таутомера HO2C-C(OH)=CH-CO2H.[1]
- Окисление L-яблочной кислоты
Диэтилоксалоацетат (диэтиловый эфир щавелевоуксусной кислоты, щавелевоуксусный эфир) — может быть получен конденсацией этилацетата с диэтилоксалатом в присутствии металлического натрия или этилата натрия.[2][3] Применяется в органическом синтезе.
Оксалоацетат является промежуточным соединением в цикле Кребса и глюконеогенезе. Оксалоацетат образуется при окислении малата, катализируемого малатдегидрогеназой. Оксалоацетат взаимодействует с ацетил-КоА, образуя цитрат, при участии фермента цитратсинтазы.[1]
Также оксалоацетат образуется в мезофилле растений, путём конденсации углекислого газа с фосфоенолпируватом, катализируемой фосфоенолпируваткарбоксилазой. Оксалоацетат образуется из пирувата в анаплеротической реакции.[4]
Из щавелевоуксусной кислоты и ацетил кофермента А по типу альдольной конденсации происходит биосинтез лимонной кислоты.
Оксалат кальция — Википедия
Материал из Википедии — свободной энциклопедии
Оксалат кальция — соль щелочноземельного металла кальция и органической двухосновной щавелевой кислоты с формулой CaC2O4, бесцветные кристаллы, образует кристаллогидрат.
- Обменными реакциями:
- CaCl2+(Nh5)2C2O4 → CaC2O4↓+2 Nh5Cl{\displaystyle {\mathsf {CaCl_{2}+(NH_{4})_{2}C_{2}O_{4}\ {\xrightarrow {\ }}\ CaC_{2}O_{4}\downarrow +2\ NH_{4}Cl}}}
Оксалат кальция образует бесцветные кубические кристаллы. Из водных растворов образует кристаллогидрат CaC2O4•H2O — бесцветные моноклинные кристаллы. В литературе есть упоминание о кристаллогидрате CaC2O4•3H2O.
Реагирует с сильными кислотами:
- CaC2O4+2HCl →CaCl2+h3C2O4{\displaystyle {\mathsf {CaC_{2}O_{4}+2HCl\ \rightarrow CaCl_{2}+H_{2}C_{2}O_{4}}}}
Чистую щавелевую кислоту можно получить, действуя серной кислотой на оксалат кальция.
- CaC2O4+h3SO4→CaSO4↓+h3C2O4{\displaystyle {\mathsf {CaC_{2}O_{4}+H_{2}SO_{4}\rightarrow CaSO_{4}\downarrow +H_{2}C_{2}O_{4}}}}
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Щавлева кислота — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
| Щавлева кислота | |
|---|---|
Structural formula of oxalic acid | |
 Ball-and-stick model of oxalic acid |  Space-filling model of oxalic acid |
| Назва за IUPAC | ethanedioic acid |
| Інші назви | oxalic acid |
| Ідентифікатори | |
| Номер CAS | 144-62-7 |
| PubChem | 971 |
| Номер EINECS | 205-634-3 |
| DrugBank | DB03902 |
| KEGG | C00209 |
| Назва MeSH | Oxalic+acid |
| ChEBI | 16995 |
| RTECS | RO2450000 |
| SMILES | C(=O)(C(=O)O)O |
| InChI | 1S/C2h3O4/c3-1(4)2(5)6/h(H,3,4)(H,5,6) |
| Номер Бельштейна | 385686 |
| Номер Гмеліна | 2208 |
| 3DMet | B00059 |
| Властивості | |
| Молекулярна формула | C2H2O4 |
| Молярна маса | 90,03 г/моль |
| Молекулярна маса | 89,995308552 г моль−1 |
| Зовнішній вигляд | Білі кристали |
| Густина | 1,90 г см−3 |
| Тпл | 191 |
| Розчинність (вода) | 90 г дм−3 (при 20 °C) |
| Кислотність (pKa) | 1,25, 4,14[1] |
| Небезпеки | |
| MSDS | External MSDS |
| NFPA 704 |  1 3 0 |
| Температура спалаху | 166 °C |
| Пов’язані речовини | |
| Пов’язані речовини | Оксаліл хлорид Оксалат натрію Оксалат кальцію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Щавле́ва кислота́ (оксала́тна кислота́) — тверда кристалічна речовина, легко розчинна у воді (80г/л). В природі найчастіше міститься у вигляді кальцієвих солей (оксалати). Міститься у щавлі, шпинаті, бегонії — 10-16 %. Оксалат кальцію може відкладатися у суглобах чи формувати камені у сечовивідних шляхах.
Двоосновна кислота (HOOC-COOH).
- C2O4H2 → C2O4H− + H+; pKa = 1,27
- C2O4H− → C2O2−4 + H+; pKa = 4,28
- ↑ Bjerrum, J., et al. Stability Constants, Chemical Society, London, 1958.
