Аферез — Центр крови
Что такое аферез?Аферез – это возможность в ходе одной сдачи крови дать больше! Во время процедуры из крови донора выделяют нужный компонент, а остальные компоненты крови переливают обратно донору.
При плазмаферезе собирают три лечебных дозы плазмы, для чего в ином случае потребовалась бы помощь нескольких доноров цельной крови. Поскольку пациент обычно нуждается не в одной, а в нескольких лечебных дозах, то в всегда лучше, когда ему переливается плазма одного донора – это снижает риск нежелательных реакций, связанных с переливанием крови.
Плазмаферез подходит большинству доноров, которые хорошо переносят сдачу крови и необходимо иметь подходящие, хорошо видимые вены.
Смотрите видео, знакомящее с аферезом!
Кроме плазмафереза, в Центре крови проводится процедура мультикомпонентного афереза, в ходе которой можно одновременно собирать тромбоциты («кровяные пластинки»), плазму и при необходимости также эритроциты (красные кровяные тельца).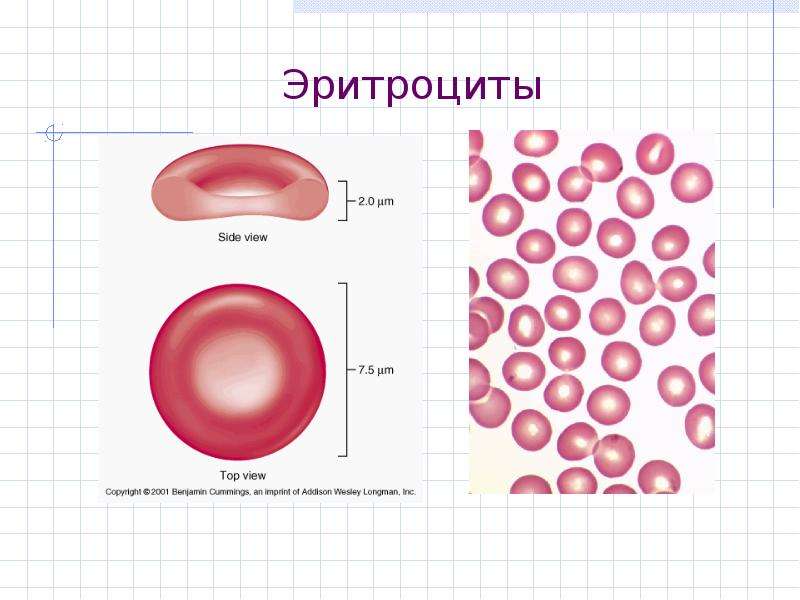
БОНУСЫ плазмафереза
+ процедура афереза удобна и безопасна для здоровья
+ возможность сдать качественную плазму, из которой можно изготовить несколько лечебных доз
+ большинство аферезных доноров утверждают, что после процедуры у них никогда не было ни одной физической проблемы, и самочувствие было очень хорошим
+ во время афереза имеется возможность пользоваться предоставляемым Центром крови ноутбуком с интернет-подсоединением, смотреть телевизор и читать свежую прессу
+ когда у донора забирают только плазму, остальные компоненты крови остаются у него и кровь восстанавливается уже через две недели
+ аферезные доноры – здоровые люди, которые заботятся и о здоровье других
+ если сделано определенное число пожертвований, у плазмаферезного донора есть возможность насладиться вместе со спутником культурным событием.
ТРЕБОВАНИЯ к аферезному донору
+ в возрасте от 18 до 55 лет
+ за последнее время не менее двух раз сдавал кровь без появления побочных действий
+ подходящие для процедуры вены
+ вес тела не менее 60 кг
+ хорошее здоровье и нормальные результаты анализов
+ смелость пробовать что-то новое
+ желание помогать другим людям
Донор на процедуре плазмафереза
Как проходит процедура?Плазму от крови аферезного донора отделяют методом центрифугирования в специальном аппарате – сепараторе (см. верхнюю картинку). В этом аппарате находится одноразовая пластиковая система, которая с помощью иглы подсоединяется к донору. Для того, чтобы кровь не свертывалась, в кровь донора добавляют вещество, препятствующее свертыванию (антикоагулянт). Отделенная центрифугированием плазма собирается в стерильный мешок, а остальные компоненты крови переливаются обратно донору.
верхнюю картинку). В этом аппарате находится одноразовая пластиковая система, которая с помощью иглы подсоединяется к донору. Для того, чтобы кровь не свертывалась, в кровь донора добавляют вещество, препятствующее свертыванию (антикоагулянт). Отделенная центрифугированием плазма собирается в стерильный мешок, а остальные компоненты крови переливаются обратно донору.
В ходе плазмафереза собирают 720 мл плазмы, и для этого проводят несколько циклов забора и возврата крови. Процедура длится 40-50 минут и безопасна для донора. Посмотрите также и короткое видео, знакомящее с процедурой афереза.
Возможные побочные действия:- Озноб при обратном переливании эритроцитов
- При повышенной чувствительности к антикоагулянтам легкое ощущение зуда на губах
- Кровоподтек в месте пункции
- Головокружение, тошнота
NB! Все реакции быстро проходят и не вызывают каких-либо проблем со здоровьем.
Как часто можно делать процедуру афереза?
Интервал между плазмаферезами должен быть не менее 2 недель, интервал между плазмаферезом и донорством цельной крови – 30 дней. Интервал между процедурами афереза тромбоцитов и мультикомпонентного афереза – как минимум 1 месяц. На процедуру афереза нужно предварительно зарегистрироваться (тел. 617 3009, 617 3033). Обычно Центр крови приглашает аферезных доноров на процедуру лично по телефону, однако рекомендуем донорам самим регистрироваться на следующую процедуру во время медицинского осмотра.
Интервал между процедурами афереза тромбоцитов и мультикомпонентного афереза – как минимум 1 месяц. На процедуру афереза нужно предварительно зарегистрироваться (тел. 617 3009, 617 3033). Обычно Центр крови приглашает аферезных доноров на процедуру лично по телефону, однако рекомендуем донорам самим регистрироваться на следующую процедуру во время медицинского осмотра.
Плазма содержит белки и свертывающие факторы. Замороженные дозы плазмы можно хранить при температуре -25° С и ниже и использовать их в течение 3-х лет. Переливание плазмы пациентам показано при нарушениях свертываемости и для восполнения потерь крови при массивных кровотечениях.
Хочу стать аферезным донором! Как это сделать?Если Вы хотите стать плазмаферезным донором, свяжитесь, пожалуйста, с Центром крови по телефону или по э-почте, или же просто придите к нам на место. Решение о пригодности для афереза принимается в ходе медицинского осмотра. Процедуры проводятся в здании Центра крови по адресу ул. Эдала 2, Таллинн. О своем желании можно сообщить:
Процедуры проводятся в здании Центра крови по адресу ул. Эдала 2, Таллинн. О своем желании можно сообщить:
По телефону: 617 3009, 617 3033
По э-почте: [email protected]
Центр крови Северо-Эстонской региональной больницы, Эдала, 2, ТАЛЛИНН
Пн, Пт 08.00 – 16.00
Вт – Чт 11.00 – 19.00
Аферезные доноры говорят:
«Мне кажется, что так я смогу сделать более серьезное доброе дело – это возможность дать больше».
«Во время процедуры я могу целый час провести в полном покое, без всяких помех».
«Если Вас приглашают, то обязательно воспользуйтесь этим приглашением. Потому что аферезные доноры – это донорская элита – приглашают не каждого!»
Правила подготовки пациента к лабораторному обследованию (сдаче анализов)
Памятка пациенту
Общий анализ крови включает следующие исследования: определение содержания гемоглобина, количества эритроцитов, лейкоцитов, тромбоцитов, лейкоцитарной формулы и скорости оседания эритроцитов (СОЭ).
Кровь на биохимический анализ берётся из вены стерильным шрицем или стерильной вакуумной системой для взятия крови (вакутайнером).
Для получения достоверных результатов лабораторных исследований строго придерживайтесь указанных ниже рекомендаций:
Кровь для исследования берут строго натощак, т.е. когда между последним приемом пищи и взятием крови проходит 12 часов и более. Сок, чай, кофе, тем более с сахаром — тоже еда, это необходимо помнить.

За 1-2 дня до обследования необходимо исключить из рациона жирную пищу, жареные блюда и алкоголь. Обильная жирная пища вызывает изменения во многих показателях крови. Алкоголь влияет на многие биохимические процессы в организме и оказывает токсический эффект на органы кроветворения и печёночные клетки, тем самым приводит к искажению многих лабораторных показателей.
Курильщикам за 1час до взятия крови нужно воздержаться от курения. Курение вызывает множество острых и хронических (сохраняющихся длительное время) изменений в лабораторных показателях. Это связано и с токсическим влиянием никотина на организм человека и с химическими реакциями, происходящими между веществами табачного дыма и клетками организма.
Перед сдачей крови исключаются физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение. Физические нагрузки и стрессовые состояния вызывают гормональные и биохимические изменения в организме. Поэтому людям, занимающимся тяжелым физическим трудом, рекомендуется сдавать анализ крови после выходных.
 Не рекомендуется сдавать анализы на следующий день после интенсивных тренировок, спортивных соревнований, посещения бани или сауны. Так как значительные физические нагрузки могут привести к снижению одних и повышению других показателей крови. В случае стресса сдачу анализа лучше отложить до более благоприятного времени. Перед процедурой следует отдохнуть в течение 10-15 минут, успокоиться.
Не рекомендуется сдавать анализы на следующий день после интенсивных тренировок, спортивных соревнований, посещения бани или сауны. Так как значительные физические нагрузки могут привести к снижению одних и повышению других показателей крови. В случае стресса сдачу анализа лучше отложить до более благоприятного времени. Перед процедурой следует отдохнуть в течение 10-15 минут, успокоиться. Кровь следует сдавать до рентгенологического, ультразвукового исследований, массажа, рефлексотерапии или физиотерапевтических процедур. Если же какое-либо исследование было сделано, анализ рекомендуется отложить на несколько дней. Так как диагностические процедуры способны повлиять на результаты лабораторных исследований.
Общий анализ мочи
При назначении исследования мочи следует придерживаться следующих рекомендаций:
Необходимо накануне процедуры исключить из рациона фрукты и овощи (свекла, морковь), которые могут изменить цвет мочи, а также лекарственных веществ, так же влияющих на цвет мочи (фуразолидон, ибупрофен, метронидазол и т.
 д.), либо сообщить об их приёме врачу.
д.), либо сообщить об их приёме врачу. Утренняя порция мочи полностью собирается в чистую посуду и в течение 0,5 — 1 часа доставляется в лабораторию. Длительное хранение мочи ведёт к изменению её физических свойств, размножению бактерий и к разрушению элементов осадка.
Перед сбором мочи нужно провести тщательную гигиеническую обработку наружных половых органов. Женщинам не рекомендуется сдавать мочу на анализ во время менструации.
Нельзя сдавать в один день два анализа мочи, например, общий анализ мочи и анализ мочи по Нечипоренко.
Подготовила И.Н. Элькинд, зав. клинико-диагностической лабораторией.
Вопросы | ОГБУЗ Смоленский центр крови
Интервалы между различными видами донорства(в днях)
| Исходные процедуры | Последующие процедуры | |||
| Кроводача | Плазмаферез | Тромбоцитаферез | Лейкоцитаферез | |
| Кроводача | 60 | 30 | 30 | 30 |
| Плазмаферез | 14 | 14 | 14 | 14 |
| Тромбоцитаферез | 14 | 14 | 14 | |
| Лейкоцитаферез | 30 | 14 | 14 | 30 |
Быть или не быть…донором?
В современном мире нельзя быть до конца уверенным в завтрашнем дне, и нельзя с полным убеждением заявлять, что завтра чьи-то помощь и милосердие не понадобятся именно Вам. Так почему бы всем здоровым людям не объединиться этой благородной целью?! Ведь так замечательно нести в себе это ни с чем не сравнимое чувство выполненного гражданского долга и осознания того, что, возможно, минуту назад спас кому-то жизнь!
Так почему бы всем здоровым людям не объединиться этой благородной целью?! Ведь так замечательно нести в себе это ни с чем не сравнимое чувство выполненного гражданского долга и осознания того, что, возможно, минуту назад спас кому-то жизнь!
Стоит ли сомневаться в искреннем отношении к этой проблеме со стороны самого Центра, если учесть, что почти треть его сотрудников являются Почетными донорами. Будь такой статус, многие из них были бы Почетными донорами дважды!
Как это происходит?
Говоря о процедуре донорства, стоит отметить, что она до предела автоматизирована! С помощью современного медицинского оборудования и информационной системы “АИСТ” сотрудники центра крови позаботится об экономии Вашего времени. От начала и до завершения процедуры Вы будете находиться под присмотром высококвалифицированных специалистов.
Чего следует избегать перед сдачей крови?
За 1 день – употребления жирной пищи;
За 3 дня – употребления алкоголя;
За 10 дней – визитов к стоматологу;
За 12 месяцев – тату, пирсинг;
Исключить возможные контакты с больными сифилисом, ВИЧ, гепатитами!
Какова сумма денежного вознаграждения донору?
С 09 ноября 2020 г. утверждены новые расценки на сдачу крови и ее компонентов:
утверждены новые расценки на сдачу крови и ее компонентов:
* за одну донацию крови (450 мл +/-10%) – 958,72
* за одну донацию плазмы (600 мл +/-10%) – 1797-60
* за одну донацию эритроцитов (400 мл +/-10%) – 2996-00
* за одну донацию тромбоцитов -4194-40
* замена бесплатного питания денежной компенсацией (безвозмездный донор) – 599-20
Как восстановить организм после проведения процедуры донации?
В выбранный день лучше избежать физических нагрузок, постараться не заниматься спортом и не поднимать тяжести.
Водить автомобиль можно в обычном режиме.
Первые два дня после сдачи крови необходимо усиленное полноценное питание, обильное питье не менее 1-2 литров в день, алкоголь следует исключить.
Дальше человек может вести свой обычный образ жизни.
Прививки рекомендуется делать только спустя 10 дней после сдачи крови.
Организм после процедуры полностью восстанавливается через неделю. Но этот показатель очень индивидуален. Скорость восстановление зависит от возраста донора, его привычного образа жизни. Также с разной скоростью в крови восстанавливаются нужные компоненты. Для быстрого восстановления обычного состава крови требуется больше жидкости в ежедневном питачии чем обычно, они должны быть дополнены соками и восстановительным чаем. В правильном питании необходим белок, который отвечает за восстановление гемоглобина в крови. белок содержится ак в животных продуктах – мясе и рыбе, так и в растительных – в бобовых, свекле, гречке, фасоли, чечевице.
Скорость восстановление зависит от возраста донора, его привычного образа жизни. Также с разной скоростью в крови восстанавливаются нужные компоненты. Для быстрого восстановления обычного состава крови требуется больше жидкости в ежедневном питачии чем обычно, они должны быть дополнены соками и восстановительным чаем. В правильном питании необходим белок, который отвечает за восстановление гемоглобина в крови. белок содержится ак в животных продуктах – мясе и рыбе, так и в растительных – в бобовых, свекле, гречке, фасоли, чечевице.
Может ли быть донором кормящая мать?
Сегодня период беременности и лактации является временным противопоказанием для проведения процедуры донации. После родов женщина может стать донором только спустя год и после трех месяцев по окончании лактации.
Решение допускать женщину к сдаче крови или нет решает врач-трансфузиолог донорского пункта.
Как подтвердить свое звание “Почетный донор” и как правильно собирать справки?
Система, созданная в нашей стране, подключена к единой базе учета доноров, где зафиксированы все процедуры донации. Вся информация хранится в учреждениях Службы крови в течении долгих лет.
Вся информация хранится в учреждениях Службы крови в течении долгих лет.
Получение нагрудного знака “Почетный донор России” происходит только после учета безвозмездных донаций.
Нужно ли предоставлять дополнительные документы для сдачи компонентов крови?
Нет, никаких дополнительных документов не требуется. Оформление ничем не отличается от обычной процедуры сдачи крови.
Желание сдать компонент крови должно совпасть с потребностями данного донорского пункта.
Являются ли безвозмездными донации, за которые были выплачены только компенсации на питание? Учитываются ли такие донации при получении звания “Почетный донор”?
Если после донации Вы получили только питание или денежную компенсацию за него, то такие процедуры сдачи крови являются безвозмездными, и их учитывают при получении нагрудного знака “Почетный донор России”.
Можно стать донором в случае, если у близкого родственника обнаружен гепатит Б, но он у него в хронической и неактивной фазе?
Такая ситуация считается неблагоприятной для донорства, так как вы являетесь контактным лицом с больним гепатитом. От донорства будет получен отвод.
От донорства будет получен отвод.
Задать вопрос нашим специалистам
Наиболее часто задаваемые вопросы по донорству
Наиболее часто задаваемые вопросы по донорству
НЕ ВРЕДНО ЛИ СДАВАТЬ КРОВЬ?
Люди эволюционно приспособлены к кровопусканиям: это универсальный механизм реакции при травмах, а у женщин — вообще часть функционирования организма. Кровопускание в научно-обоснованных дозах обладает стимулирующим эффектом, поэтому доноры — в большинстве своём активные и жизнерадостные люди. Последние исследования показали, что периодическая сдача крови в пять раз снижает риск инфаркта и инсульта, доноры реже болеют ишемической болезнью сердца.
Сдавать кровь особенно полезно людям экстремальных специальностей: военнослужащим, сотрудникам службы спасения, охранникам, а также людям подверженным профессиональному риску. Доноры более устойчивы к кровопотере, и если одинаковое ранение получит донор и человек, который не сдавал кровь, у первого шансы уцелеть значительно выше.
Донорство, осуществляется под контролем специалистов учреждения Службы крови. Каждый донор перед кроводачей обязательно проходит медицинский осмотр.
При заборе крови используются только одноразовые пластикатные контейнеры, представляющие собой закрытые системы, позволяющие исключить инфицирование донора.
Кровь донора тщательно исследуют: проверяется содержание гемоглобина, определяется групповая и резусная принадлежность крови, проводятся тестирование крови на ВИЧ-инфекцию, гепатит В и С, сифилис. Сколько бы могло стоить такое обследование в платной клинике? А для доноров такая проверка здоровья будет проведена бесплатно и в минимальные сроки. А результаты своих анализов вы можете получить на руки в течение трёх дней! Через 6 месяцев вам перезвонят или пригласят письменно для обследования и повторной сдачи крови.
КАК ЧАСТО МОЖНО СДАВАТЬ КРОВЬ?
Интервалы между донациями (в днях)
| Исходные процедуры | Последующие процедуры | |||
| Кроводача | Эритроцитаферез | Плазмаферез | Тромбоцитаферез | |
| Кроводача | 60 | 90 | 30 | 30 |
| Плазмаферез | 14 | 14 | 14 | 14 |
| Эритроцитаферез
| 180 | 180 | 90 | 60 |
| Тромбоцитаферез
| 30 | 30 | 30 | 30 |
КАКИЕ РЕАКЦИИ МОГУТ БЫТЬ ПОСЛЕ СДАЧИ КРОВИ?
- процедура венепункции может сопровождаться формированием гематомы.
 Риск формирования гематом в области венепункции значительно увеличивается при раннем (менее 4 часов с момента завершения донации) снятии давящей повязки, накладываемой на область локтевого сгиба, и при физических нагрузках
Риск формирования гематом в области венепункции значительно увеличивается при раннем (менее 4 часов с момента завершения донации) снятии давящей повязки, накладываемой на область локтевого сгиба, и при физических нагрузках - во время выполнения донации возможны незначительные реакции организма в виде кратковременного снижения артериального давления
КАКИЕ ВИДЫ ДОНАЦИЙ ОСУЩЕСТВЛЯЮТСЯ В ВАШЕЙ БОЛЬНИЦЕ?
В отделении переливания крови нашей больницы осуществляются все виды донаций, разрешенные на территории РФ.
- Донация цельной крови
Цельная кровь состоит из плазмы и клеток крови (форменных элементов) – эритроцитов, лейкоцитов и тромбоцитов, и при переливании пациент получает именно тот компонент крови, который ему необходим. Таким образом, кровь одного донора может помочь нескольким пациентам.
Научными исследованиями и практическими наблюдениями доказано, что дача крови в дозе до 500 мл. совершенно безвредна и безопасна для здоровья человека.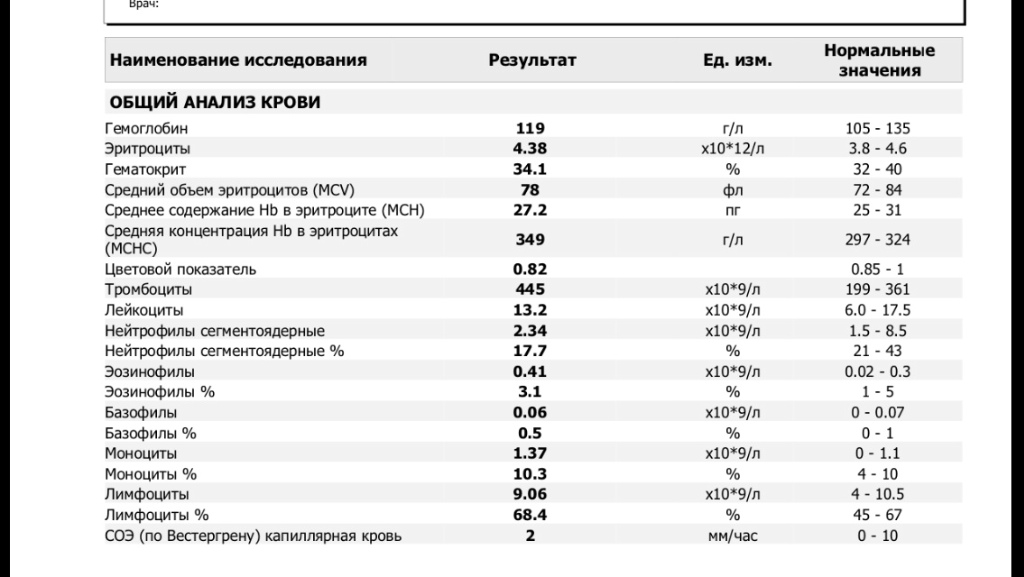 Поэтому доза 450 мл. называется физиологической ( что составляет примерно 10% от общего объема крови). Максимально допустимое число кроводач в год у мужчин 5, у женщин — 4.
Поэтому доза 450 мл. называется физиологической ( что составляет примерно 10% от общего объема крови). Максимально допустимое число кроводач в год у мужчин 5, у женщин — 4.
- Плазмаферез
Это метод получения от донора плазмы с возвратом собственных форменных элементов крови (эритроцитов, тромбоцитов, лейкоцитов). Длительность процедуры в среднем составляет 40минут. Максимальный объём одной плазмодачи не превышает 600 мл.
Полное восстановление состава крови у донора происходит на 2 сутки. Максимальный объём сданной плазмы в год не должен превышать 12 л.
- Тромбоцитаферез
Это аппаратная процедура, во время которой кровь донора обрабатывается путем автоматического разделения в закрытой системе, в замкнутом контуре . После отделения тромбоцитов все остальные элементы крови возвращаются донору через ту же иглу путем чередования циклов забора и возврата.
Процедура тромбоцитафереза занимает примерно 1,5 часа. Срок восстановления уровня тромбоцитов около 2 недель.
Срок восстановления уровня тромбоцитов около 2 недель.
- Эритроцитаферез
Процедура происходит аналогично тромбоцитаферезу, но вместо тромбоцитов отбираются эритроциты.
Длительность процедуры — 40 минут. Срок восстановления уровня эритроцитов около 1 месяца.
Часто задаваемые вопросы / Центр крови ФМБА России
1. Как начать пользоваться приложением?
Для авторизации Вы можете выбрать один из удобных для Вас способов (по электронной почте, номеру телефона, через социальную сеть).
2. При регистрации профиля по электронной почте, на указанный адрес не приходит письмо со ссылкой для активации
В данном случае просим проверить папку «Спам». В случае отсутствия письма в данной папке, просим направить письмо с описанием проблемы в адрес техподдержки: [email protected]
3. При нажатии на ссылку о подтверждении регистрации профиля, направленную по электронной почте, интернет-портал выдает ошибку. Что делать в данном случае?
Что делать в данном случае?
Просим направить письмо с описанием проблемы в адрес техподдержки [email protected]
4. Зарегистрировался в приложении. Почему не отображается история моих донаций?
Для актуализации истории совершаемых донациях необходимо получение 20значного кода донации по последней процедуре и его введение в приложение. Код донации Вы можете получить, обратившись в регистратуру учреждения службы крови, где была проведена процедура. Просим обратить внимание, что в настоящее время не все учреждения имеют такую техническую возможность ввиду отсутствия подключения к автоматизированной информационной системе трансфузиологии. Ознакомиться с перечнем учреждений, имеющих техническую возможность выдачи кода донации, Вы можете в разделе Где сдать кровь?, выставив фильтр «Выдает код донации».
5.Как внести информацию о совершенных донациях?
В настоящее время в мобильном приложении реализована возможность ввода данных о донациях двумя способами:
1. Путем ввода кода: достаточно один раз внести 20значный код, далее информация о донациях будет обновляться в автоматическом режиме в течение нескольких дней.
Путем ввода кода: достаточно один раз внести 20значный код, далее информация о донациях будет обновляться в автоматическом режиме в течение нескольких дней.
2. Ручной ввод донаций: в разделе «Планирование» необходимо запланировать донацию, после прохождения даты донации, необходимо открыть эту запись и нажать кнопку «Подтвердить». В этом случае запись появится в разделе «Мои донации», а также будет учтена в счетчиках. Записи о донации введенные вручную (через раздел планирования) можно редактировать и удалять, записи о донации, полученные по коду — нет.
6. Как ввести код донации?
Для ввода кода донации кликните на иконку с каплей и + внизу по центру в нижнем блоке меню. Обратите внимание, что с момента получения кода до его активации в системе может пройти до 24 часов. В случае, если с момента получения кода прошло более 24 часов, но он все также неактивен, рекомендуем обратиться в службу технической поддержки по e-mail: [email protected]
7. Почему при добавлении кода по новой донации высвечивается сообщение «Код был добавлен ранее»?
Почему при добавлении кода по новой донации высвечивается сообщение «Код был добавлен ранее»?
В случае, если ранее Вы уже вводили код донации в приложение, в последующем все данные обновляются в автоматическом режиме в течение нескольких дней. Коды по вновь совершенным донациям вводить не нужно.
8. Совершил донацию. Данные о ней отображены, но анализы отсутствуют. Что делать?
Обратите внимание, что информация с полными результатами анализов будет доступна через трое суток после донации.
9. Перехожу в свой профиль, вся информация о донациях пропала. Что делать?
Необходимо проверить, правильно ли Вы прошли авторизацию. Возможно Ваша история донаций привязана к профилю, зарегистрированному другим образом. В случае, если проблема сохраняется, просим направить письмо с ее описанием в адрес техподдержки: [email protected] , а также сообщить код по любой из совершенных Вами донаций.
Безопасность донора
Регулярные доноры ежегодно проходят медицинское обследование, включающее сдачу анализов, проведение флюорографического обследования органов грудной клетки, электрокардиографии и др.
Для забора крови используются только стерильные одноразовые инструменты. Повторное использование инструментов исключено. Для плазмафереза и тромбоцитафереза все чаще используются т. н. закрытые системы, в которых забор крови производится автоматически на специальном оборудовании, при минимальном вмешательстве медицинского персонала.
Соблюдение донорами рекомендаций сотрудников Центра крови позволяет улучшить переносимость донации.
Влияние донации на организм
В целом сдача крови безвредна для донора. Во-первых, количество крови, взятой при донации, не критично для работы организма, и она довольно быстро восстанавливается. Во-вторых, доноры перед сдачей проходят медицинский осмотр. Если врачи считают, что сдача крови может быть вредна для донора, то он получит отвод (т.е. кровь у него не возьмут). Требования к здоровью донора в России чрезвычайно строги.
Донорство даже считается полезным. Так, доноры легче переносят кровопотери, например, после травм или операций: их организм «натренирован» компенсировать потерю части крови. У доноров более здоровая сердечно-сосудистая система и в среднем меньший риск инфаркта миокарда. Доноры регулярно проходят медицинское обследование – а значит, могут своевременно узнать о каких-то отклонениях от нормы и принять меры.
У доноров более здоровая сердечно-сосудистая система и в среднем меньший риск инфаркта миокарда. Доноры регулярно проходят медицинское обследование – а значит, могут своевременно узнать о каких-то отклонениях от нормы и принять меры.
Неблагоприятные последствия от сдачи крови и ее компонентов
Однако восстановление организма после кроводачи происходит не мгновенно.
Основное неблагоприятное последствие сдачи цельной крови – это потеря эритроцитов, а следовательно, снижение уровня гемоглобина. Если вы склонны к анемии, то кровь сдавать не рекомендуется. Но, в принципе, это выясняется еще перед кроводачей, когда донору делают экспресс-анализ на гемоглобин: нормы по гемоглобину очень строгие, и если его уровень хотя бы на единицу ниже положенного, то кровь не возьмут.
Уровень тромбоцитов после тромбоцитафереза, как правило, восстанавливается довольно быстро. Но некоторые проблемы могут быть связаны с использованием цитрата натрия. Это вещество не позволяет донорской крови сворачиваться во время сдачи тромбоцитов; оно ускоряет и облегчает процесс афереза. Но недостаток применения цитрата в том, что он связывает кальций, и возникает риск «вымывания» кальция из костей. Поэтому во время сдачи тромбоцитов донору несколько раз делают укол глюконата кальция, а после нее рекомендуется некоторое время пить кальцийсодержащие витамины («Кальций Д3 Никомед», «Кальций Витрум»). Можно принимать и просто таблетки глюконата кальция, запивая их соком лимона. Кроме того, постоянным донорам советуют сдавать тромбоциты не слишком часто – скажем, раз в два-три месяца. Это связано и с риском возникновения так нвазываемой цитратной реакции: после многочисленных частых тромбоцитаферезов организм начинает плохо переносить попадание новых доз цитрата в кровь, что проявляется ухудшением самочувствия во время и после сдачи тромбоцитов.
Но недостаток применения цитрата в том, что он связывает кальций, и возникает риск «вымывания» кальция из костей. Поэтому во время сдачи тромбоцитов донору несколько раз делают укол глюконата кальция, а после нее рекомендуется некоторое время пить кальцийсодержащие витамины («Кальций Д3 Никомед», «Кальций Витрум»). Можно принимать и просто таблетки глюконата кальция, запивая их соком лимона. Кроме того, постоянным донорам советуют сдавать тромбоциты не слишком часто – скажем, раз в два-три месяца. Это связано и с риском возникновения так нвазываемой цитратной реакции: после многочисленных частых тромбоцитаферезов организм начинает плохо переносить попадание новых доз цитрата в кровь, что проявляется ухудшением самочувствия во время и после сдачи тромбоцитов.
Донорство гранулоцитов
Донорство гранулоцитов – более новая и редкая процедура в трансфузиологии, и пока влияние гранулоцитафереза на здоровье донора изучено не так подробно. У некоторых доноров вызывает беспокойство использование нейпогена для стимуляции костного мозга. Но врачи считают, что однократное применение этого стимулятора не приводит к отрицательным отдаленным последствиям для организма, хотя исследования на эту тему постоянно ведутся. Так, в журнале Transfusion (мартовский номер 2010 г.) проанализированы данные о состоянии здоровья доноров, более или менее систематически сдававших гранулоциты около десяти лет назад; по сравнению с контрольной выборкой у них не обнаружено значимой тенденции к возникновению каких-либо заболеваний, включая онкологические.
Но врачи считают, что однократное применение этого стимулятора не приводит к отрицательным отдаленным последствиям для организма, хотя исследования на эту тему постоянно ведутся. Так, в журнале Transfusion (мартовский номер 2010 г.) проанализированы данные о состоянии здоровья доноров, более или менее систематически сдававших гранулоциты около десяти лет назад; по сравнению с контрольной выборкой у них не обнаружено значимой тенденции к возникновению каких-либо заболеваний, включая онкологические.
Некоторое время после гранулоцитафереза могут ощущаться небольшие боли в костях или недомогание, напоминающее простуду, но эти неприятные явления являются нормальной реакцией организма на стимуляцию костного мозга и быстро проходят. Более серьезные осложнения исключительно редки. Цитрат при гранулоцитаферезе не применяется (его заменяют гепарином), поэтому проблемы вымывания кальция нет.
Отделение переливания крови
Донорство костного мозга – сложная проблема, гораздо сложнее, чем донорство крови.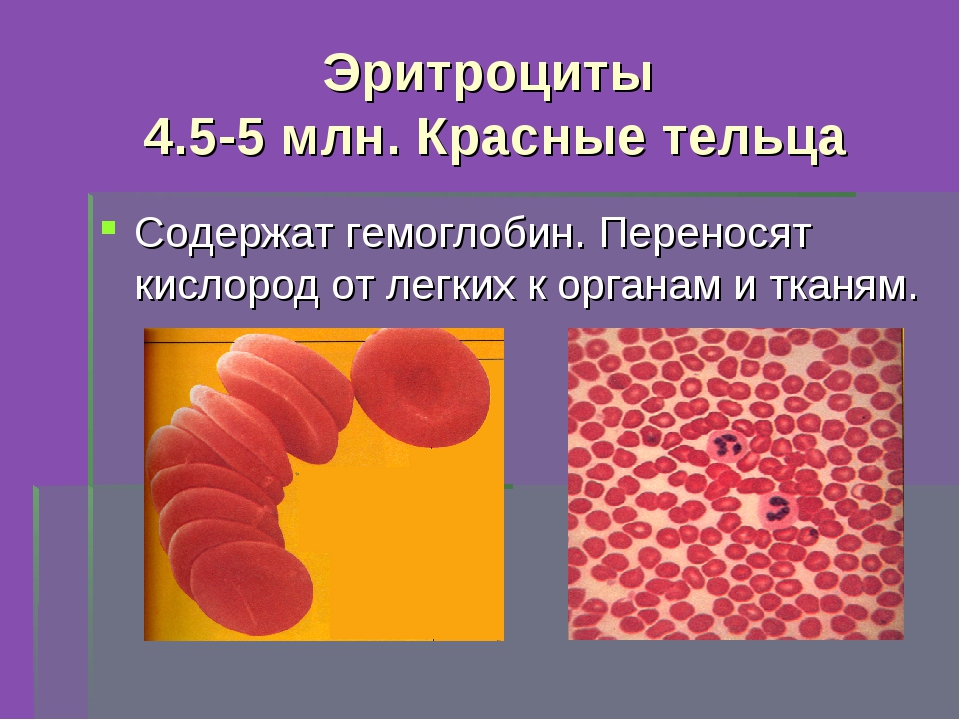 Вероятность тканевой совместимости между конкретным больным и случайно взятым посторонним человеком очень мала. Чтобы с достаточно высокой вероятностью найти подходящего донора, нужно вести поиск среди десятков и сотен тысяч людей. Именно для этого в различных странах функционируют регистры доноров костного мозга. Это означает, что многим тысячам добровольцев делается так называемое типирование (определение нужных HLA-белков), результаты заносятся в базу данных, и когда нужно найти донора для кокретного пациента, то его можно предварительно подобрать именно по этой базе данных, а затем уточнить совместимость, проведя дополнительные анализы.
Вероятность тканевой совместимости между конкретным больным и случайно взятым посторонним человеком очень мала. Чтобы с достаточно высокой вероятностью найти подходящего донора, нужно вести поиск среди десятков и сотен тысяч людей. Именно для этого в различных странах функционируют регистры доноров костного мозга. Это означает, что многим тысячам добровольцев делается так называемое типирование (определение нужных HLA-белков), результаты заносятся в базу данных, и когда нужно найти донора для кокретного пациента, то его можно предварительно подобрать именно по этой базе данных, а затем уточнить совместимость, проведя дополнительные анализы.
Самые крупные регистры насчитывают миллионы потенциальных доноров костного мозга, в российском пока лишь 63 тысячи. Поиски доноров в регистрах других стран стоят достаточно дорого, к тому же найти донора для некоторых национальностей, которые проживают только на территории России, просто невозможно. Именно поэтому так важно, чтобы как можно большее количество людей вошли в единую базу.
Когда нужна трансплантация костного мозга
Трансплантация костного мозга (ТКМ) используется, прежде всего, при лечении онкологических заболеваний, таких как лейкозы, поражения лимфатической системы, нейробластома, а также при апластической анемии и ряде наследственных дефектов крови. Трансплантация клеток костного мозга от донора является порой единственным шансом на излечение.
Что такое пересадка костного мозга?
Под пересадкой костного мозга понимается на самом деле трансплантация гемопоэтических стволовых клеток. Гемопоэтические (кроветворные)стволовые клетки образуются в костном мозге человека и являются родоначальниками всех клеток крови: лейкоцитов, эритроцитов и тромбоцитов.
Кто может стать донором?
Любой здоровый гражданин РФ в возрасте до 45 лет.
Как происходит типирование костного мозга?
Для определения HLA-генотипа (типирования) у вас возьмут пробирку крови. Образец крови (до 10 мл) человека, желающего стать донором кроветворных клеток, исследуют в специализированной лаборатории. Информация о типировании вносится в Российский регистр доноров гемопоэтических клеток.
Информация о типировании вносится в Российский регистр доноров гемопоэтических клеток.
Что происходит после внесения данных в регистр?
При появлении пациента, которому необходимо выполнить трансплантацию костного мозга, его данные HLA-генотипа сравнивают с данными потенциальных доноров, имеющихся в регистре. В результате может быть подобран один или несколько «совместимых» доноров. Потенциальному донору сообщают об этом, и он принимает решение, становиться или нет реальным донором. Для потенциального донора вероятность стать донором реальным составляет не более 1%.
Каковы шансы, что потенциальный неродственный донор будет найден?
Около 80% всех пациентов имеют хотя бы одного потенциального донора на стадии предварительного поиска. Этот процент постоянно растет (в 1991 году был 41%), поскольку во многих странах мира прикладываются большие усилия как на государственном уровне, так и на уровне общественных организаций с тем, чтобы увеличить число потенциальных неродственных доноров и учесть при этом все расовые и национальные группы.
К сожалению, России в этом отношении похвастать нечем — государственной поддержкой программа неродственного донорства не пользуется до сих пор. Важно добавить, что из этих 80% далеко не все могут служить реальными донорами, а для остающихся 20% трансплантация зачастую может быть успешно проведена от донора, который подходит не совершенно, но лишь частично.
Может ли потенциальный донор отказаться от донорства?
Иногда потенциальный донор, подходящий по всем показателям, может решить не становиться донором реальным. Есть ряд причин отказаться от донорства, включая нездоровье, затраты времени и сил, страх перед риском осложнений или болезненностью процедур. Как доброволец, потенциальный донор не связан никакими обязательствами. Тем не менее, поскольку от решения потенциального донора зависит человеческая жизнь, значение такого решения объясняется потенциальному донору многократно и с самого начала. Изменение решения в последнюю минуту может привести к фатальным последствиям для больного, ждущего донорский костный мозг. Донорство накладывает на человека серьезные обязательства. Большинство потенциальных доноров идут до конца, взвесив все «за» и «против» и поняв важность своего решения не только для пациента, но и для самих себя.
Донорство накладывает на человека серьезные обязательства. Большинство потенциальных доноров идут до конца, взвесив все «за» и «против» и поняв важность своего решения не только для пациента, но и для самих себя.
Как происходит процедура донации стволовых клеток?
Есть два варианта. Вы жертвуете либо некоторое количество своего костного мозга, либо стволовые клетки из крови. Выбор, как правило, диктуется медицинской необходимостью.
Если донор сдает костный мозг, то под наркозом производится прокол тазовой кости, при этом обычно наносится от 4 до 9 крошечных надрезов в тазовой области, настолько малых, что последующее наложение швов не требуется, и затем хирургической иглой забирается необходимое количество костного мозга. Процедура занимает около 30 минут. Костный мозг донора полностью восстанавливается через несколько недель. После такой процедуры донор несколько дней в специализированном стационаре находится под наблюдением врача.
Если же донор сдает периферические клетки крови, то за несколько дней до сдачи крови нужно начать принимать специальный препарат, способствующий выходу стволовых клеток из костного мозга в кровь. Дело в том, что стволовые клетки берутся из кровяного русла в ходе процесса, называемого аферез (похожий на донорство плазмы или тромбоцитов), когда кровь из вены на одной руке проходит через специальный прибор для сепарации гемопоэтических стволовых клеток и возвращается в кровяное русло через вену на другой руке. Разумеется, эта процедура производится в стерильных условиях. Нужно провести 5-6 часов в относительно неподвижном состоянии, но нет необходимости ни в госпитализации, ни в анестезии. Восстановление взятых клеток проходит за 7-10 дней.
Дело в том, что стволовые клетки берутся из кровяного русла в ходе процесса, называемого аферез (похожий на донорство плазмы или тромбоцитов), когда кровь из вены на одной руке проходит через специальный прибор для сепарации гемопоэтических стволовых клеток и возвращается в кровяное русло через вену на другой руке. Разумеется, эта процедура производится в стерильных условиях. Нужно провести 5-6 часов в относительно неподвижном состоянии, но нет необходимости ни в госпитализации, ни в анестезии. Восстановление взятых клеток проходит за 7-10 дней.
Есть ли риск для здоровья донора?
Сдача костного мозга — хирургическая процедура, сопряженная с минимальным риском. Серьезные осложнения редки. Они могут вызываться индивидуальными реакциями на анестезию, зафиксированы случаи возникновения инфекции, реакции на введение хирургической иглы. После забора костного мозга донор может испытывать болезненные ощущения в оперированной области в течение некоторого времени. Донор гемопоэтических стволовых клеток может испытывать боль в костях, мышцах, тошноту, бессонницу и повышенную утомляемость от препарата, принимаемого до операции. Самые частые побочные эффекты — головная боль и боль в костях. Эти болезненные ощущения проходят сразу после того, как совершается забор стволовых клеток. Во время проведения афереза некоторые доноры жалуются на шум в ушах, возникающий из-за использования антикоагулянта, необходимого для предотвращения свертываемости крови. По окончании процедуры эти эффекты постепенно проходят. Наблюдения за 20 000 доноров гемопоэтических стволовых клеток, проводимые в течение длительного срока от одного года до пяти лет после трансплантации, показали, что риск побочных эффектов после процедуры афереза крайне низок. В качестве иллюстрации заметим, что самому молодому родственному донору гемопоэтических стволовых клеток в российской практике было 1,5 года, в мире известно о доноре 11-месячного возраста.
Самые частые побочные эффекты — головная боль и боль в костях. Эти болезненные ощущения проходят сразу после того, как совершается забор стволовых клеток. Во время проведения афереза некоторые доноры жалуются на шум в ушах, возникающий из-за использования антикоагулянта, необходимого для предотвращения свертываемости крови. По окончании процедуры эти эффекты постепенно проходят. Наблюдения за 20 000 доноров гемопоэтических стволовых клеток, проводимые в течение длительного срока от одного года до пяти лет после трансплантации, показали, что риск побочных эффектов после процедуры афереза крайне низок. В качестве иллюстрации заметим, что самому молодому родственному донору гемопоэтических стволовых клеток в российской практике было 1,5 года, в мире известно о доноре 11-месячного возраста.
Почему желающих стать донором костного мозга так мало и что делать?
Главное – элементарный ликбез. Многие просто не понимают, что значит быть донором костного мозга. Они считают, что это процедура, связанная с распиливанием костей и извлечением жизненно важного органа.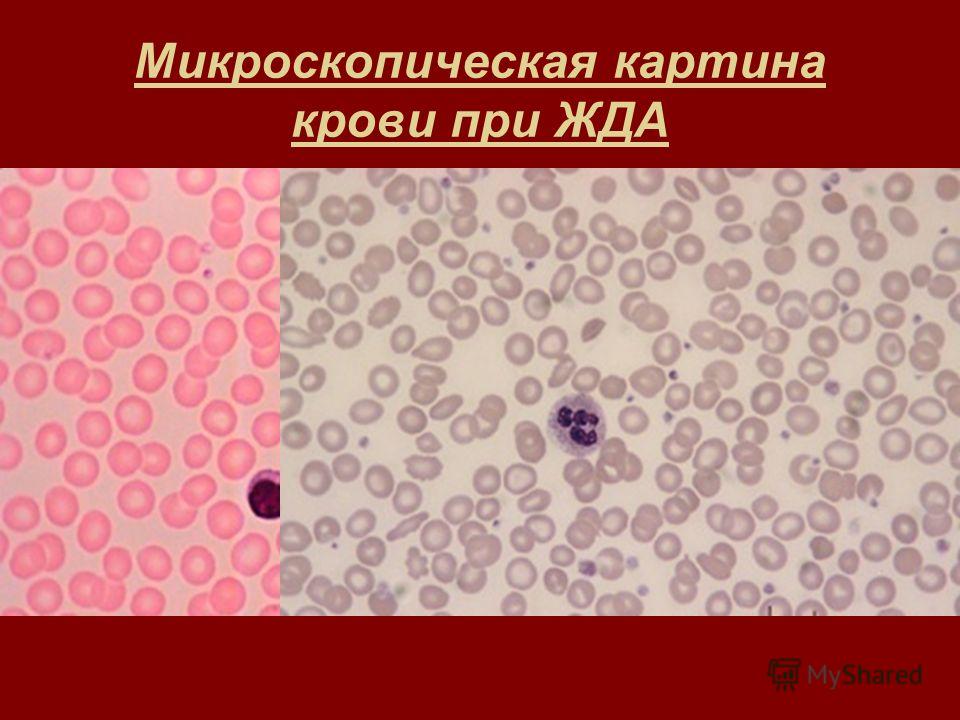 Важно объяснять, что для донора забор клеток костного мозга не представляет опасности и он восстановится в нужном количестве уже через несколько дней.
Важно объяснять, что для донора забор клеток костного мозга не представляет опасности и он восстановится в нужном количестве уже через несколько дней.
Вступление в регистр потенциальных доноров костного мозга в ГКБ №52
Отделение переливания крови ГКБ№52 подключилось к созданию национального регистра потенциальных доноров костного мозга. Теперь все доноры, пришедшие на донацию, могут пройти типирование и попасть в регистр.
Для вступления в регистр требуется:
- подписать соглашение о добровольном вступлении в регистр доноров костного мозга;
- сдать 10 мл крови из вены.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.
 ,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
повторно запечатанных эритроцитов — GRIN
Содержание
Введение
Источник эритроцитов
Выделение эритроцитов
загрузка препарата в эритроцитах
Факторы, влияющие на повторно закрытые эритроциты
Преимущества эритроцитов
Способ загрузки препарата
Характеристика эритроцитов in vitro
заявки
Введение
— Настоящий фармацевтический сценарий направлен на разработку систем доставки лекарств, которые максимизируют нацеливание лекарств наряду с высокими терапевтическими преимуществами для безопасного и эффективного лечения заболеваний.
— Система целевой доставки лекарств действительно очень привлекательная цель, потому что в этой системе нацеливание на активную био молекулу из эффективной доставки лекарственного средства, где фармакологические агенты направлены конкретно на ее цель.
— Для нацеливания лекарств использовались различные клеточные носители, среди которых клеточные носители (лейкоциты, тромбоциты и эритроциты) предлагают отличные
Эритроциты
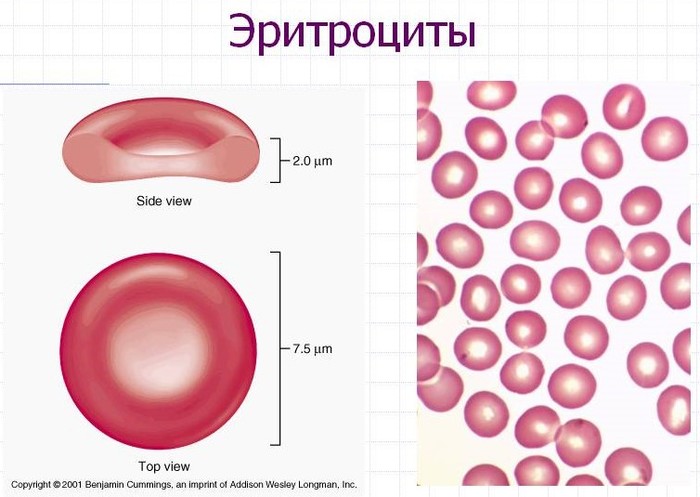
• Эритроциты, также известные как красные кровяные тельца, были тщательно изучены на предмет их потенциального переносчика для доставки лекарств.
иллюстрация не видна в этом отрывке
Электролитный состав эритроцитов:
— Хотя качественно он похож на плазму. Однако количественно он отличается от плазмы.
— Концентрация К + больше в эритроцитах и Na + в плазме.
— Осмотическое давление внутри эритроцитов равно осмотическому давлению плазмы и называется изотоническим (0,9% NaCl или нормальный физиологический раствор).
— Изменения осмотического давления среды, окружающей эритроциты, изменяют морфологию клеток.
— Если среда является гипотонической, вода диффундирует в клетки, они набухают и в конечном итоге теряют весь свой гемоглобин и могут лопнуть.
— если среда является гипертонической (т.е. более высокое осмотическое давление
, чем 0,9% NaCl), они сжимаются и приобретают неправильную форму. 1
иллюстрация не видна в этом отрывке
Значение гематокрита
— Если кровь поместить в пробирку и центрифугировать, клетки и плазма разделятся.
— Тяжелые эритроциты оседают на дно пробирки, в то время как плазма поднимается вверх, а лейкоциты и тромбоциты образуют тонкий слой (лейкоцитарную пленку) между эритроцитами и плазмой.
— Гематокрит определяется как процент цельной крови, состоящей из эритроцитов.
иллюстрация не видна в этом отрывке
иллюстрация не видна в этом отрывке
Источник эритроцитов
— Различные эритроциты млекопитающих использовались для загрузки лекарств, повторного закрытия и последующего использования для доставки лекарств и ферментов.
Например, мыши, крупный рогатый скот, свиньи, собаки, овцы, козы, обезьяны, курицы, крысы, кролики и т. д.
— В качестве антикоагулянтов можно использовать ЭДТА или гепарин
Выделение эритроцитов
— Кровь собирается в гепаринизированные пробирки венепункцией
— Кровь берут из сердечной / селезеночной пункции (у мелких животных) и через вены (у крупных животных) в шприце, содержащем каплю антикоагулянта.
— Цельную кровь центрифугируют при 2500 об / мин в течение 5 минут при 4 ± 1.0 ° C в охлаждаемой центрифуге.
— Покрытия сыворотки осторожно удалены и упакованы клетки
трижды промывали фосфатным буферным солевым раствором (pH = 7,4).
— Промытые эритроциты разбавляют PBS и хранят при 40 ° C до использования.
иллюстрация не видна в этом отрывке
иллюстрация не видна в этом отрывке
Лекарственная нагрузка в эритроцитах
— Когда эритроциты суспендированы в гипотонической среде, они набухают примерно в полтора раза по сравнению с их нормальным размером, и происходит разрыв мембраны с образованием пор диаметром от 200 до 500 Ao
— Поры позволяют уравновешивать внутриклеточный и внеклеточный раствор.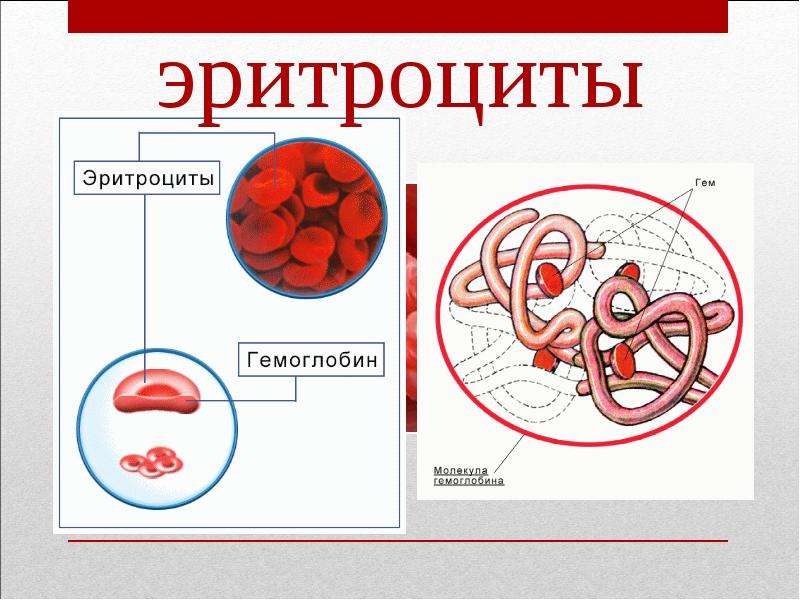 Если ионную силу среды довести до изотонической и клетки инкубировать при 37 ° C, поры закроются и эритроциты «снова запечатываются».
Если ионную силу среды довести до изотонической и клетки инкубировать при 37 ° C, поры закроются и эритроциты «снова запечатываются».
[…]
1 Сбалансированные ионные растворы, такие как раствор Рингера и Тирода. которые не только изотоничны, но также содержат ионы в нужном количестве, используются в экспериментах, связанных с эритроцитами.
Доставка лекарств на основе наночастиц автостопом через эритроциты для подавления роста метастазов в легких
Доставка тераностических агентов на основе частиц через их транспортировка на поверхности красных кровяных телец, обычно называемая эритроцитами-автостопом, исторически разрабатывалась как многообещающая стратегия для увеличения срока службы крайне плохой циркуляции крови, в первую очередь, крупногабаритные субмикронные агенты.Здесь мы впервые показываем, что автостоп с эритроцитами может быть чрезвычайно эффективным для доставки наночастиц и лечения опухолей даже в тех случаях, когда не наблюдается удлинения кровообращения. В частности, мы демонстрируем, что перемещение эритроцитов определенных мелких частиц размером 100 нм, в отличие от обычных субмикронных, может повысить доставку нецелевых частиц в легкие до рекордно высокого значения в 120 раз (и до 40% введенной дозы). Для достижения этого замечательного результата мы провели скрининг наночастиц размером менее 200 нм различного размера, полимерных покрытий и ζ-потенциалов и идентифицировали частицы с оптимальными характеристиками адсорбции / десорбции эритроцитов.Кроме того, мы продемонстрировали, что такое RBC-опосредованное перенаправление частиц в легкие можно использовать для борьбы с легочными метастазами агрессивной меланомы B16-F1. Наши результаты могут изменить общую парадигму доставки лекарств для лечения рака автостопом с эритроцитами. Ключевым фактором эффективности наночастиц является не время циркуляции крови, а комплексообразование наночастиц с эритроцитами. Продемонстрированная технология может стать ценным инструментом для разработки новых стратегий, основанных на малых наночастицах, для лечения агрессивных и мелкоклеточных типов рака, а также других заболеваний легких.
В частности, мы демонстрируем, что перемещение эритроцитов определенных мелких частиц размером 100 нм, в отличие от обычных субмикронных, может повысить доставку нецелевых частиц в легкие до рекордно высокого значения в 120 раз (и до 40% введенной дозы). Для достижения этого замечательного результата мы провели скрининг наночастиц размером менее 200 нм различного размера, полимерных покрытий и ζ-потенциалов и идентифицировали частицы с оптимальными характеристиками адсорбции / десорбции эритроцитов.Кроме того, мы продемонстрировали, что такое RBC-опосредованное перенаправление частиц в легкие можно использовать для борьбы с легочными метастазами агрессивной меланомы B16-F1. Наши результаты могут изменить общую парадигму доставки лекарств для лечения рака автостопом с эритроцитами. Ключевым фактором эффективности наночастиц является не время циркуляции крови, а комплексообразование наночастиц с эритроцитами. Продемонстрированная технология может стать ценным инструментом для разработки новых стратегий, основанных на малых наночастицах, для лечения агрессивных и мелкоклеточных типов рака, а также других заболеваний легких.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Характеристика эритроцитов-носителей для применения в биосенсорных исследованиях
1.
Введение
Диабет и другие изнурительные состояния диагностируются, лечатся и контролируются путем отбора проб крови. Для диабетиков диета, регулирование уровня инсулина и мониторинг уровня глюкозы помогают облегчить серьезные осложнения. Первичные устройства для мониторинга глюкозы, глюкометры на основе пальцев, страдают от таких проблем, как человеческий фактор и качество глюкометра / полоски, а также подвержены влиянию мешающих факторов. 1 — 3 Плохой контроль уровня глюкозы в крови может привести к осложнениям, затрагивающим глаза, сердце, почки, нервы и ступни. 4 Кроме того, развитие гипогликемии или гипергликемии может привести к летальному исходу.Укол пальцем несколько раз в течение дня мешает точному выявлению тенденций, снижает соблюдение режима и увеличивает риск осложнений. 3 , 4 Таким образом, существует острая необходимость в исследовании непрерывного определения аналитов крови.
Для диабетиков диета, регулирование уровня инсулина и мониторинг уровня глюкозы помогают облегчить серьезные осложнения. Первичные устройства для мониторинга глюкозы, глюкометры на основе пальцев, страдают от таких проблем, как человеческий фактор и качество глюкометра / полоски, а также подвержены влиянию мешающих факторов. 1 — 3 Плохой контроль уровня глюкозы в крови может привести к осложнениям, затрагивающим глаза, сердце, почки, нервы и ступни. 4 Кроме того, развитие гипогликемии или гипергликемии может привести к летальному исходу.Укол пальцем несколько раз в течение дня мешает точному выявлению тенденций, снижает соблюдение режима и увеличивает риск осложнений. 3 , 4 Таким образом, существует острая необходимость в исследовании непрерывного определения аналитов крови.
Системы непрерывного мониторинга глюкозы (CGMS) имеют ограниченный срок действия считывания и должны учитывать проблемы иммуногенности, селективности и биодеградации. Текущие CGMS имеют срок службы порядка 10 дней и требуют частой повторной калибровки, часто с использованием стандартного укола пальца. 5 — 7 Кроме того, имплантируемый CGMS может вызвать нежелательный иммунный ответ, в результате которого фиброзная ткань отделяет устройство от кровеносных сосудов и окружающей ткани. Такое разделение может привести к неточности, более короткому сроку службы и нишам, восприимчивым к инфекции. 8 , 9 Следовательно, необходимо изучить новые методы мониторинга.
Текущие CGMS имеют срок службы порядка 10 дней и требуют частой повторной калибровки, часто с использованием стандартного укола пальца. 5 — 7 Кроме того, имплантируемый CGMS может вызвать нежелательный иммунный ответ, в результате которого фиброзная ткань отделяет устройство от кровеносных сосудов и окружающей ткани. Такое разделение может привести к неточности, более короткому сроку службы и нишам, восприимчивым к инфекции. 8 , 9 Следовательно, необходимо изучить новые методы мониторинга.
Эритроциты, оснащенные оптическими сенсорами или эритросенсорами, могут удовлетворить потребность в биосовместимой платформе для долгосрочного мониторинга.Этот подход к мониторингу аналитов крови основан на выделении эритроцитов, загрузке их флуоресцентными датчиками и введении эритросенсоров в кровоток для мониторинга аналитов. 10 , 11 Флуоресцентный сигнал эритросенсоров можно возбуждать и обнаруживать неинвазивно через кожу. С целью разработки эритросенсоров функционализация или нагрузка эритроцитов должны сохранять такие характеристики, как форма, морфология поверхности, размер и содержание гемоглобина.
С целью разработки эритросенсоров функционализация или нагрузка эритроцитов должны сохранять такие характеристики, как форма, морфология поверхности, размер и содержание гемоглобина.
Нативные эритроциты (NE) сохраняют ключевые свойства, такие как объем и содержание гемоглобина, поскольку они меняют форму для прохождения через систему кровообращения. Эритроциты крупного рогатого скота имеют диаметр около 5 мкм и имеют продолжительность жизни 160 дней, тогда как эритроциты человека имеют диаметр около 8 мкм и продолжительность жизни 120 дней. 12 , 13 Характерная двояковогнутая форма максимизирует площадь поверхности для кислородного обмена и обеспечивает деформацию для навигации через мельчайшие капилляры с деформацией, зависящей от диаметра капилляра и скорости потока.Стареющие эритроциты имеют аномалии размера и морфологии из-за изменений цитоскелета, мембраны и / или осаждения гемоглобина. В конечном итоге эндотелиальная система ретикулума (ЭС) выводит из обращения стареющие эритроциты. 14 , 15 Таким образом, «простая» архитектура эритроцитов, по сути, представляет собой сложную сеть механических, химических и биологических взаимодействий, определяющих выживаемость клеток.
14 , 15 Таким образом, «простая» архитектура эритроцитов, по сути, представляет собой сложную сеть механических, химических и биологических взаимодействий, определяющих выживаемость клеток.
Было исследовано несколько механических, химических и электрических методов загрузки эритроцитов-носителей для доставки лекарств и в качестве контрастных агентов для визуализации. 16 Изменение осмотических условий эритроцитов или индукция электрического пробоя вызывает обратимое порообразование, но в экстремальных условиях это приводит к лизису мембраны. 17 При стабильном порообразовании диффузия позволяет входить и выходить через поры мембраны, поскольку происходит уравновешивание с внешней средой. 18 — 20
Процедуры, основанные на гипотонических условиях, были исследованы для производства эритросенсоров. 19 , 21 , 22 На сегодняшний день исследователи изучили гипотонический диализ и гипотоническое разведение для получения эритросенсоров.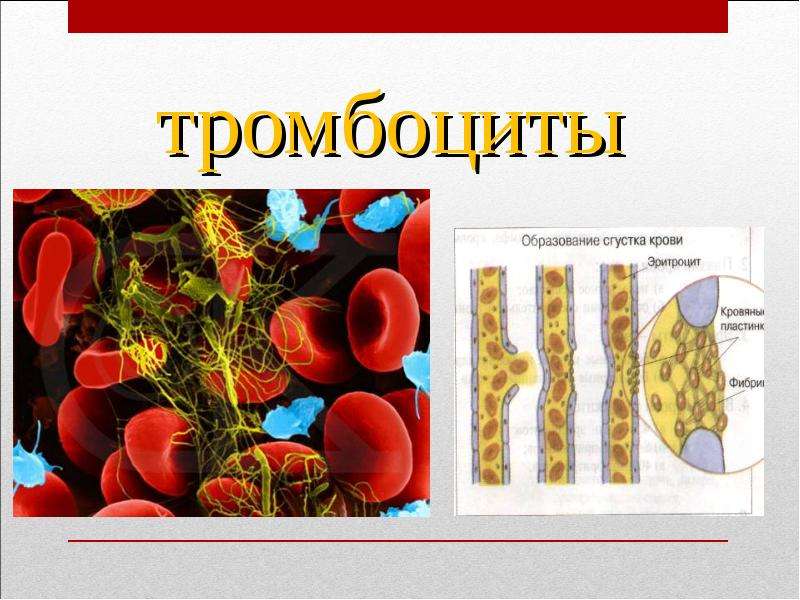 10 , 11 Варианты техники гипотонического диализа, использующие диализную трубку, заполненную эритроцитами, погруженными в гипотонический буфер, обеспечивают диффузию груза через диализную мембрану и мембрану эритроцитов для захвата, в то время как диализная мембрана поддерживает эритроциты и концентрация гемоглобина. Гипотоническое разведение состоит из разбавления эритроцитов в гипотоническом растворе для создания пор и быстрого закрытия мембраны с использованием гипертонического буфера при 37 ° C без использования диализной мембраны.Изменение осмолярности создает поры через мембрану эритроцитов и позволяет загружать груз, поскольку эритроциты уравновешиваются с внеклеточной средой. 23 Эти поры мембраны позволяют относительно крупным молекулам диффундировать в клетки и, как правило, приводят к эффективности загрузки ~ 50%. Предыдущая работа показала, что спектр излучения эритросенсоров, нагруженных флуоресцеинизотиоцианатом, конъюгированным с глицилглицином (FITC-glygly), был эквивалентен излучению свободного FITC-glygly и позволял отслеживать внеклеточный pH.
10 , 11 Варианты техники гипотонического диализа, использующие диализную трубку, заполненную эритроцитами, погруженными в гипотонический буфер, обеспечивают диффузию груза через диализную мембрану и мембрану эритроцитов для захвата, в то время как диализная мембрана поддерживает эритроциты и концентрация гемоглобина. Гипотоническое разведение состоит из разбавления эритроцитов в гипотоническом растворе для создания пор и быстрого закрытия мембраны с использованием гипертонического буфера при 37 ° C без использования диализной мембраны.Изменение осмолярности создает поры через мембрану эритроцитов и позволяет загружать груз, поскольку эритроциты уравновешиваются с внеклеточной средой. 23 Эти поры мембраны позволяют относительно крупным молекулам диффундировать в клетки и, как правило, приводят к эффективности загрузки ~ 50%. Предыдущая работа показала, что спектр излучения эритросенсоров, нагруженных флуоресцеинизотиоцианатом, конъюгированным с глицилглицином (FITC-glygly), был эквивалентен излучению свободного FITC-glygly и позволял отслеживать внеклеточный pH. 11 Гипотоническое разведение остается самым простым и быстрым методом загрузки. Однако конечные физические характеристики эритросенсора и местонахождение груза внутри эритроцита остаются неизвестными. 24 , 25
11 Гипотоническое разведение остается самым простым и быстрым методом загрузки. Однако конечные физические характеристики эритросенсора и местонахождение груза внутри эритроцита остаются неизвестными. 24 , 25
Электропорация — это альтернативный метод загрузки, который основан на использовании коротких интенсивных электрических зарядов для создания трансмембранных пор и обеспечения возможности входа груза. Из-за разности потенциалов мембраны и обратимого электрического пробоя фосфолипид мембраны повторно собирается, образуя гидрофильные поры. 26 Этот метод используется для приложений доставки лекарств и трансформации / трансфекции, поскольку размер пор регулируется в условиях электропорации. 27 — 29 Zimmermann et al. 30 показали данные, указывающие на то, что, хотя бычьи эритроциты имеют меньший диаметр, для их разрушения требуется более высокая напряженность поля, чем для эритроцитов человека. При 0 ° C поры стабильны, а повышение температуры быстро закрывает мембрану. 31 Ограничения, связанные с текущими методами, включают низкую эффективность инкапсуляции, неравномерную загрузку красителя и потерю гемоглобина, которые влияют на внутренние функции клеток. 28 В оптимальных условиях эритроциты, нагруженные с помощью этого метода, имеют высокое восстановление клеток, сохраняют свой размер и форму и показывают нормальное время циркуляции in vivo . 32 Эти признаки послужили основанием для оценки электропорированных эритроцитов для использования в качестве эритросенсоров.
При 0 ° C поры стабильны, а повышение температуры быстро закрывает мембрану. 31 Ограничения, связанные с текущими методами, включают низкую эффективность инкапсуляции, неравномерную загрузку красителя и потерю гемоглобина, которые влияют на внутренние функции клеток. 28 В оптимальных условиях эритроциты, нагруженные с помощью этого метода, имеют высокое восстановление клеток, сохраняют свой размер и форму и показывают нормальное время циркуляции in vivo . 32 Эти признаки послужили основанием для оценки электропорированных эритроцитов для использования в качестве эритросенсоров.
Оптимальная долговременная эффективность эритросенсора зависит от сохранения свойств эритроцитов при одновременном включении сенсорных возможностей. Потеря гемоглобина в процессе загрузки приводит к необратимым морфологическим изменениям. 32 — 34 Эти морфологические изменения в эритроцитах могут впоследствии привести к увеличению жесткости, прекращению их способности продавливаться через капилляры и вызвать закупорку, а также удаление клеток. 14 Кроме того, сообщения о клеточных модификациях эритроцитов-носителей, приводящих к быстрому удалению через RES, мишень для доставки лекарств, и фагоцитозу, ограничивают их применение в других приложениях. 14 , 15 , 35 Патологические и НЭ были широко изучены с помощью атомно-силовой микроскопии (АСМ). 36 — 38 Несмотря на преимущества использования эритроцитов в качестве систем-носителей для оптических датчиков и доставки лекарств, мало что известно о клеточных характеристиках загруженных клеток.
14 Кроме того, сообщения о клеточных модификациях эритроцитов-носителей, приводящих к быстрому удалению через RES, мишень для доставки лекарств, и фагоцитозу, ограничивают их применение в других приложениях. 14 , 15 , 35 Патологические и НЭ были широко изучены с помощью атомно-силовой микроскопии (АСМ). 36 — 38 Несмотря на преимущества использования эритроцитов в качестве систем-носителей для оптических датчиков и доставки лекарств, мало что известно о клеточных характеристиках загруженных клеток.
Brähler et al. 39 обнаружил, что эритроциты-носители с грузом магнетита, загруженные с помощью гипоосмотической техники, имели неровный профиль поперечного сечения, как было оценено с помощью АСМ. Эти данные послужили мотивацией и руководством для продолжения сравнительных исследований свойств НЭ и эритросенсоров с использованием АСМ.Описанная здесь работа предлагает понимание максимальной загрузки оптически активного груза, FITC-glygly, в эритроциты путем оптимизации и реализации протоколов загрузки. Мы сосредоточены на изучении воздействия нагрузки на эритросенсоры, созданные с помощью гипотонического разведения. Чтобы понять морфологию эритросенсора, равномерность нагрузки и объемную нагрузочную способность, используются как конфокальная микроскопия, так и АСМ. Были оценены клеточные свойства и флуоресцентный сигнал двух различных процедур загрузки, гипотонического разведения и электропорации (рис.1). Работа в области доставки лекарств с использованием эритроцитов продемонстрировала, что общие принципы загрузки применимы ко всем видам. Например, исследования по инкапсулированию L-аспарагиназы в качестве терапевтической молекулы в эритроцитах проводились на мышах, обезьянах и людях. 40 — 42 Хотя особенности загрузки немного меняются в зависимости от вида, эритроциты разных видов одинаково реагируют на изменения осмолярности и электрические заряды. В этом исследовании изучаются эритросенсоры крупного рогатого скота как модельная система для определения несущих способностей и определяются вредные клеточные модификации для долгосрочного мониторинга.
Мы сосредоточены на изучении воздействия нагрузки на эритросенсоры, созданные с помощью гипотонического разведения. Чтобы понять морфологию эритросенсора, равномерность нагрузки и объемную нагрузочную способность, используются как конфокальная микроскопия, так и АСМ. Были оценены клеточные свойства и флуоресцентный сигнал двух различных процедур загрузки, гипотонического разведения и электропорации (рис.1). Работа в области доставки лекарств с использованием эритроцитов продемонстрировала, что общие принципы загрузки применимы ко всем видам. Например, исследования по инкапсулированию L-аспарагиназы в качестве терапевтической молекулы в эритроцитах проводились на мышах, обезьянах и людях. 40 — 42 Хотя особенности загрузки немного меняются в зависимости от вида, эритроциты разных видов одинаково реагируют на изменения осмолярности и электрические заряды. В этом исследовании изучаются эритросенсоры крупного рогатого скота как модельная система для определения несущих способностей и определяются вредные клеточные модификации для долгосрочного мониторинга.
Рис. 1
Загрузка эритроцитов посредством электропорации и разбавления. Изолированные эритроциты подвергали либо электропорации, либо гипотоническому разведению. Электропорация основана на приложении электрических зарядов для разрушения мембранного потенциала, позволяя грузу попасть и требуя повторной герметизации для полной загрузки. Клетки, подвергшиеся разбавлению, лизируют и затем снова герметизируют, чтобы инкапсулировать груз.
2.
Материалы и методы
2.1.
Флуоресцеина изотиоцианат-глицилглицин
FITC конъюгировали с глиглием и использовали в качестве груза. FITC, pH-чувствительный краситель, используемый в качестве химического сенсора в биологических материалах, имеет пики возбуждения и излучения при 492 и 518 нм соответственно. Этот диапазон длин волн облегчает сбор данных флуоресценции и изучение распределения внутри эритросенсоров. В качестве модельного груза добавка глигли делает FITC-глигли непроницаемым после инкапсуляции, предотвращая самопроизвольную утечку. Более того, было показано, что конъюгат FITC-глигли сохраняет свою кривую эмиссии при инкапсулировании в эритроциты. 11 FITC и глиглик разводили в воде в молярном соотношении 1: 4 до конечной концентрации 5 мМ FITC и 20 мМ глиглила при pH 9,0. Конъюгирование достигалось перемешиванием при комнатной температуре в течение 30 мин. Этот препарат готовили непосредственно перед использованием и хранили в темноте при 4 ° C. FITC и глигли были получены от Sigma-Aldrich.
Более того, было показано, что конъюгат FITC-глигли сохраняет свою кривую эмиссии при инкапсулировании в эритроциты. 11 FITC и глиглик разводили в воде в молярном соотношении 1: 4 до конечной концентрации 5 мМ FITC и 20 мМ глиглила при pH 9,0. Конъюгирование достигалось перемешиванием при комнатной температуре в течение 30 мин. Этот препарат готовили непосредственно перед использованием и хранили в темноте при 4 ° C. FITC и глигли были получены от Sigma-Aldrich.
2.2.
Гипотоническое разведение
Температура гипотонического лизисного буфера (10-кратный раствор, состоящий из 10 мМ MgCl2, 20 мМ ЭДТА, 50 мМ фосфатного буфера и 1 мМ мочевины) была понижена до 0–2 ° С, а 1- мл FITC-глиглик при pH 9.0 смешивали с 25 мл 1 × буфера для гипотонического лизиса (2,5 мл 10 × буфера для лизиса + 22,5 мл деионизированной воды). Упакованные бычьи эритроциты (2 мл) разводили в 25 мл водного раствора для лизиса с FITC-глиглием и инкубировали в течение 10 мин. Затем добавляли 2,5 мл концентрированного гипертонического буфера для лизиса (10 ×) с последующей инкубацией в течение 10 минут при 0 ° C, затем повышали температуру до 37 ° C и инкубировали в течение 30 минут. Для повышения эффективности загрузки и создания более равномерно загруженных эритроцитов раствор перемешивали на протяжении всей процедуры, а в конце процедуры вводили дополнительный этап центрифугирования для разделения загруженных эритросенсоров.Клетки осторожно встряхивали на протяжении всего процесса. Полученный осадок образца промывали изотоническим буферным раствором. Для удаления агрегатов FITC-глигли и дебриса образец пропускали через 40-мкм мембрану и суспендировали при 50% гематокрите (hct) для немедленного анализа. Для выявления аутофлуоресценции эритроциты подвергали процедуре гипотонического разведения без FITC-глигли (EH).
Для повышения эффективности загрузки и создания более равномерно загруженных эритроцитов раствор перемешивали на протяжении всей процедуры, а в конце процедуры вводили дополнительный этап центрифугирования для разделения загруженных эритросенсоров.Клетки осторожно встряхивали на протяжении всего процесса. Полученный осадок образца промывали изотоническим буферным раствором. Для удаления агрегатов FITC-глигли и дебриса образец пропускали через 40-мкм мембрану и суспендировали при 50% гематокрите (hct) для немедленного анализа. Для выявления аутофлуоресценции эритроциты подвергали процедуре гипотонического разведения без FITC-глигли (EH).
2.3.
Электропорация
Упакованные эритроциты (2 мл) ресуспендировали в 25 мл буфера для электропорации.Температуру упакованных эритроцитов снижали и поддерживали в пределах от 0 ° C до 4 ° C, чтобы продлить время жизни образующихся переходных пор. FITC-глиглигли получали, как и раньше (5 мМ FITC и 20 мМ глиглигли), и непосредственно перед электропорацией к эритроцитам, суспендированным в буфере для электропорации, добавляли 1 мл FITC-глиглили. Затем смешанные эритроциты помещали в кюветы для электропорации размером 0,2 см для 400 мкл образца. Электропорацию выполняли с использованием системы Bio-Rad Gene Pulser Xcell ™ при различных электрических полях (250, 300 и 750 В с прямоугольным импульсом в диапазоне от 0 до 0,15 В).5–5 мс и интервалы от 5 до 15 мин, всего четыре цикла). Клетки инкубировали в течение 10 мин при 4 ° C после электропорации. Затем образцы разбавляли 1: 2 в растворе для повторного запечатывания, состоящем из 8 мМ KCL (P9541-Sigma), 150 мМ NaCl (s9888-Sigma), 6 мМ Nah3PO4 (s5011-Sigma), 10 мМ D-глюкозы (g8270-Sigma). , 2 мМ MgCl2 (M8266-Sigma) и 1% бычий сывороточный альбумин (BSA), pH 7,4. Повторное засевание стимулировали инкубацией при 37 ° C в течение 30 минут с последующей инкубацией при 4 ° C в течение 24 часов. Загруженные эритроциты промывали фосфатным буферным солевым раствором (PBS) центрифугированием и ресуспендировали при 4 ° C при начальных 50% hct.Образец был дополнительно разбавлен в зависимости от эксперимента и немедленно проанализирован.
Затем смешанные эритроциты помещали в кюветы для электропорации размером 0,2 см для 400 мкл образца. Электропорацию выполняли с использованием системы Bio-Rad Gene Pulser Xcell ™ при различных электрических полях (250, 300 и 750 В с прямоугольным импульсом в диапазоне от 0 до 0,15 В).5–5 мс и интервалы от 5 до 15 мин, всего четыре цикла). Клетки инкубировали в течение 10 мин при 4 ° C после электропорации. Затем образцы разбавляли 1: 2 в растворе для повторного запечатывания, состоящем из 8 мМ KCL (P9541-Sigma), 150 мМ NaCl (s9888-Sigma), 6 мМ Nah3PO4 (s5011-Sigma), 10 мМ D-глюкозы (g8270-Sigma). , 2 мМ MgCl2 (M8266-Sigma) и 1% бычий сывороточный альбумин (BSA), pH 7,4. Повторное засевание стимулировали инкубацией при 37 ° C в течение 30 минут с последующей инкубацией при 4 ° C в течение 24 часов. Загруженные эритроциты промывали фосфатным буферным солевым раствором (PBS) центрифугированием и ресуспендировали при 4 ° C при начальных 50% hct.Образец был дополнительно разбавлен в зависимости от эксперимента и немедленно проанализирован.
Для контроля аутофлуоресценции эритроциты электропорировали (EE) при амплитуде 300 В и ширине импульса 1 мс без FITC-глиглик (флуоресцентный груз), если флуоресцентный сигнал в этом контроле указывает на эндогенную флуоресценцию. Для определения спонтанного поглощения FITC-глигли, если таковой имеется, готовили второй контрольный образец, взяв аликвоту смешанных эритроцитов, суспендированных в буфере для электропорации с FITC-глиглием в кювете для электропорации (тот же объем, что и выше), которые инкубировали между 0 ° C и 4 ° C в течение всего времени электропорации (от 35 до 95 мин), но образцы не подвергали электропорации.Затем образцы обрабатывались и оценивались так же, как и экспериментальные образцы.
2.4.
Флуоресцентная микроскопия
После инкапсуляции образцы суспендировали в 1% BSA, разведенном в PBS, для немедленной визуализации с использованием эпифлуоресцентного микроскопа Nikon TE2000. Блок возбуждения Nikon Blue B-2E / C использовался для возбуждения FITC, который поглощает на длине волны 492 нм. Образец объемом 5 мкл был взят из образца 25% hct и помещен на предметное стекло микроскопа и покрыт покровным стеклом 0,15 мм для визуализации.Скорректированную общую флуоресценцию клеток (CTCF) для образцов рассчитывали с использованием случайно выбранных клеток из каждой группы (электропорация 300 В, гипотоническое разведение и контроли). Используя ImageJ 1.48v5, среднюю флуоресценцию клеток и фон использовали в следующем уравнении:
Образец объемом 5 мкл был взят из образца 25% hct и помещен на предметное стекло микроскопа и покрыт покровным стеклом 0,15 мм для визуализации.Скорректированную общую флуоресценцию клеток (CTCF) для образцов рассчитывали с использованием случайно выбранных клеток из каждой группы (электропорация 300 В, гипотоническое разведение и контроли). Используя ImageJ 1.48v5, среднюю флуоресценцию клеток и фон использовали в следующем уравнении:
Округлость оценивалась с помощью ImageJ, в котором атрибуты варьируются от 0 (для бесконечно вытянутого многоугольника) до 1 (соответствует идеальному кругу).В соответствии с условием оценивали четыре изображения и в общей сложности от 100 до 150 клеток. Анализ с использованием ImageJ был выполнен на однородных образцах случайно выбранных клеток для каждой микрофотографии.
2,5.
Конфокальная микроскопия
Эритросенсоры, загруженные посредством гипотонического разведения, и контроли фиксировали в 0,025% глутаровом альдегиде для повышения механической прочности и стабильности. Затем 5 мкл из 200 мкл общего полученного образца иммобилизовали на предметном стекле, покрытом поли-L-лизином (PLL), для визуализации. Конфокальную флуоресцентную микроскопию выполняли с использованием конфокального микроскопа Olympus FV1000.Объектив 100 × с числовой апертурой 1,4 использовали для изображения излучения флуоресценции при возбуждении 488 нм (аргоновым) лазером с фильтром излучения на длине волны от 505 до 575 нм. Планарные изображения были получены с интервалом 0,39 мкм через образец последовательно. Реконструкция и анализ трехмерных изображений были выполнены с использованием стандартных программ Olympus FV10-ASW и Image J 1.48v5, впоследствии.
Затем 5 мкл из 200 мкл общего полученного образца иммобилизовали на предметном стекле, покрытом поли-L-лизином (PLL), для визуализации. Конфокальную флуоресцентную микроскопию выполняли с использованием конфокального микроскопа Olympus FV1000.Объектив 100 × с числовой апертурой 1,4 использовали для изображения излучения флуоресценции при возбуждении 488 нм (аргоновым) лазером с фильтром излучения на длине волны от 505 до 575 нм. Планарные изображения были получены с интервалом 0,39 мкм через образец последовательно. Реконструкция и анализ трехмерных изображений были выполнены с использованием стандартных программ Olympus FV10-ASW и Image J 1.48v5, впоследствии.
2.6.
Спектрофотометрия
Концентрации гемоглобина и FITC-глиглик определили с использованием спектрофотометра Hitachi U-4100 UV-vis-NIR.Оптическую плотность остаточного оксигенированного гемоглобина измеряли в лизированных НЭ в качестве контроля и в образцах эритросенсоров (полученных с помощью гипотонического разбавления и электропорации) при 540 нм. Измерения абсорбции были записаны в тот же день. Образцы (10% hct) разбавляли до 1% hct в деионизированной воде и подвергали 100% лизису. Ссылаясь на концентрацию гемоглобина в крови крупного рогатого скота, находящуюся в диапазоне от 8 до 15 г / дл, рассчитывали данные по абсорбции для пула NE и строили стандартную кривую.
2.7.
Атомно-силовая микроскопия
Для получения АСМ топографических изображений эритросенсоров и NE клетки фиксировали с использованием 0,025% глутарового альдегида и иммобилизовали на предметном стекле, покрытом PLL. АСМ Bruker Dimension Icon использовали для сканирования и получения топографических изображений с эритросенсоров и НЭ. Для изображения образцов использовались алмазный наконечник (наконечник Bruker MPP21000 RSFP 3 Н / м) и ScanAsyst, режим сканирования с оптимизацией изображения в режиме постукивания. Используя ScanAsyst, система постоянно контролирует качество изображения и выполняет настройку параметров для оптимизации получения изображения.Это позволяет режиму работать с меньшим усилием, чем стандартный режим постукивания, и использовать кривые усилия в качестве сигнала обратной связи изображения. Эритроциты — хрупкие образцы; поэтому для экспериментов АСМ использовалась комбинация ScanAsyst (жидкость) и режима постукивания (воздух), чтобы минимизировать силу, приложенную к образцу. Размер сканирования 40 мкм × 40 мкм, частота 0,500 Гц, 512 отсчетов на строку. Для количественной оценки шероховатости поверхности было рассчитано среднее абсолютное вертикальное отклонение от средней линии топографического профиля, среднее значение шероховатости (Ra).Вкратце, сечение 1 мкм × 1 мкм было выбрано из шести различных топографических изображений (три NE в качестве контроля и три в качестве изображений эритросенсоров). Для каждой ячейки были рассчитаны три значения Ra и усреднены с использованием программного обеспечения Nanoscope версии 6.14.
3.
Результаты
Электропорационную загрузку FITC-глиглила в изолированные эритроциты крупного рогатого скота оценивали в различных условиях. Было обнаружено, что эритроциты, подвергнутые электропорации при 200, 300 и 750 В, имели средний диаметр 4.37 ± 0,54 мкм (среднее ± стандартное отклонение), 5,32 ± 0,80 мкм и 5,73 ± 0,88 мкм стандартное отклонение соответственно (данные не показаны). При электропорации при 300 В эритроциты сохраняли средний диаметр 4,89 ± 0,49 мкм, что находится в нижнем крае диапазона клеток NE. Хотя эритроциты, нагруженные с использованием амплитуды 750 В, имели больший размер диаметра, они также демонстрировали вариацию в размере, которая могла объяснять набухшие эритроциты, лизированные эритроциты и фрагменты мусора. Увеличение амплитуды (200, 300, 400, 750 и 1000 В) и, следовательно, поля напряженности уменьшало hct восстановленных эритросенсоров.Эритросенсоры, загруженные посредством электропорации, имели самую высокую флуоресценцию на клетку, когда четыре импульса длительностью 0,5 мс и амплитудой 300 В применялись с использованием кюветы 0,2 см, что эквивалентно напряженности электрического поля 1,5 кВ / см. Эти условия использовались для остальных экспериментов.
Флуоресцентные микрофотографии использовали для оценки относительной флуоресценции клеток от эритросенсоров, загруженных посредством гипотонического разведения и электропорации (рис. 2). Эритроциты, загруженные с помощью гипотонического разведения, имели в среднем в четыре раза большую интенсивность флуоресценции, чем клетки, загруженные с помощью электропорации (P <0.05). Эритроциты, которые проходят процедуры загрузки (электропорация или гипотоническое разведение), в которых отсутствует флуоресцентный груз FITC-глигли, не проявляют аутофлуоресценции. Ни EE, ни EH не проявляли аутофлуоресценции, связанной с открытием пор посредством гипотонического разбавления или электропорации. Круглый контур виден на флуоресцентных микрофотографиях и микрофотографиях в светлом поле для эритросенсоров, полученных с помощью обоих методов, гипотонического разведения и электропорации. Однако характерная двояковогнутая форма эритроцитов не сразу видна на 20-кратной микрофотографии (рис.2). Кроме того, после гипотонического разведения было извлечено меньше эритроцитов, чем после электропорации, при этом только от 10% до 20% исходного образца было извлечено с использованием гипотонического разведения, тогда как от 40% до 50% образца было извлечено с помощью электропорации.
Рис. 2
Эритроциты крупного рогатого скота, нагруженные посредством электропорации или разбавления, и флуоресценция на клетку, выявленная как мера эффективности загрузки. Изображение в светлом поле показано вверху, а соответствующие изображения флуоресценции показаны ниже.Интегрированную плотность клеток, площадь и среднюю флуоресценцию фона использовали для оценки относительного среднего сигнала флуоресценции на клетку. Столбцы указывают на стандартное отклонение (* P≤0,05).
Из микрофотографий диаметр и округлость оценивали в эритросенсорах и сравнивали со значениями NE (рис. 3). Кроме того, удерживаемый гемоглобин оценивали с помощью эритросенсоров и сравнивали со значениями NE с помощью спектрофотометрии (рис. 3). Диаметры значительно различались среди эритросенсоров, созданных электропорацией, гипотоническим разведением и НЭ в качестве контроля.Средний диаметр клеток NE составил 6,2 ± 1,13 мкм (среднее ± стандартное отклонение), что значительно больше, чем опубликованный диаметр бычьих эритроцитов, составляющий 5,84 мкм. 12 , 43 , 44 Размер эритроцитов, подвергшихся разбавлению и электропорации, составлял 5,0 ± 0,51 мкм и 5,32 ± 0,80 мкм соответственно. Что касается округлости, не было существенной разницы между NE в качестве контроля и эритросенсорами, созданными с использованием электропорации или гипотонического разведения.Значения округлости для электропорированных, разбавленных и контрольных образцов составляли 0,887 ± 0,108, 0,908 ± 0,052 и 0,909 ± 0,099 соответственно. Эритроциты крупного рогатого скота содержат от 8 до 15 г / дл гемоглобина. 12 Гемоглобин в НЭ в качестве контрольных образцов оценивался между 7 и 9 г / дл, что хорошо коррелирует со значениями, найденными в литературе. 12 Средняя концентрация гемоглобина внутри эритросенсоров, нагруженных посредством электропорации, составляла 5,63 ± 0,60 г / дл. Таким образом, электропорированные эритроциты теряли в среднем около 46% общего гемоглобина.Концентрация гемоглобина внутри эритросенсоров, загруженных посредством гипотонического разведения, составляла 1,00 ± 0,56 г / дл. Таким образом, эритросенсоры, полученные с помощью гипотонического разведения, теряли в среднем около 89% общего содержания гемоглобина. Хотя эритросенсоры, созданные с использованием электропорации, сохраняли более высокие концентрации гемоглобина, эритросенсоры с гипотоническим разведением и электропорацией теряли значительную часть своего гемоглобина. Эта потеря может стать проблемой для выживания in vivo эритросенсоров.
Рис. 3
Характеристика размера, формы и удержания гемоглобина эритросенсора по сравнению с контрольными НЭ. Концентрация гемоглобина внутри эритросенсоров. Поглощение при 540 нм гемоглобина в образце контрольных НЭ для лизиса эритросенсоров, приготовленных с использованием методов гипотонического разведения и электропорации. Столбцы указывают на стандартное отклонение (* P≤0,05, **** P≤0,0001).
Низкая эффективность загрузки метода электропорации затрудняет разработку эффективной системы измерения на основе эритросенсора in vivo .Таким образом, конфокальная микроскопия использовалась для оценки ключевых характеристик популяции в эритросенсорах, созданных с использованием гипотонического разведения. Конфокальные флуоресцентные микрофотографии показывают неравномерную загрузку образца (рис. 4). Репрезентативный конфокальный Z-стек, созданный с использованием размера шага 0,39 мкм для оценки равномерности загрузки популяции и захвата FITC-глигли. Последовательные изображения были обработаны для создания объемного изображения, а затем повернуты на 90 градусов по оси x, чтобы выявить распределение FITC-глигли.Трехмерные изображения предоставили представление о форме эритросенсоров и продемонстрировали объемную нагрузку. Помимо характерной круглой формы эритросенсоров, микрофотографии выявили популяцию эритроцитов с эффективностью загрузки около 30% и неоднородным сигналом флуоресценции.
Рис. 4
Эритросенсоры для конфокальной микроскопии, нагруженные методом гипотонического разведения, улавливающие FITC-глиглик. (а) Последовательность визуализации объема эритросенсоров, нагруженных FITC-глиглием, демонстрирующая их сферическую форму.(б) Типичные микрофотографии эритросенсоров, демонстрирующих неоднородность загрузки полученной популяции. Светлопольное изображение и флуоресценция показаны вверху и внизу соответственно.
Чтобы лучше понять изменения морфологии, AFM использовался для изучения топографии и профиля поперечного сечения NE (контроль) и эритросенсоров с гипотоническим разведением. Результаты АСМ показывают площадь 10 мкм × 10 мкм и соответствующее топографическое изображение [Рис. 5 (а)]. Контрольные эритроциты имеют характерную форму и размеры тороидальной формы с 5.Диаметр 85 ± 0,18 мкм. Эритросенсоры с гипотоническим разведением имели гофрированную, круглую и плоскую форму с диаметром 5,30 ± 1,63 мкм. Сравнение профиля поверхности эритроцитов и эритросенсоров выявило серьезные морфологические изменения. Максимальные пики, обнаруженные на топографии эритросенсоров, в среднем составляют 0,77 ± 0,17 мкм по сравнению с 1,42 ± 0,31 мкм в контроле. Эритросенсоры, хотя и схожи по диаметру, имели большую вариабельность в диаметре и имели высоту вдвое меньше, чем нормальные эритроциты крупного рогатого скота.
Рис. 5
На топографии эритросенсоров видны холмы и долины на их поверхности. (а) Высота эритросенсоров, показанных на этих изображениях, составляет от 481 до 883 нм. (b) Значение Ra, измеряющее среднее абсолютное отклонение по вертикали от средней линии топографического профиля. Столбцы указывают на стандартное отклонение (* P≤0,05).
Шероховатость топографии контрольных эритроцитов и эритросенсоров показывает различия на топографических изображениях. Было обнаружено, что значение Ra выше у эритросенсоров [рис.5 (б)]. Шероховатость поверхности эритросенсоров, измеренная по значению Ra (0,2 нм), на ~ 33% шире, чем поверхность НЭ (0,14 нм). Данные свидетельствуют о том, что эритросенсоры, нагруженные посредством гипотонического разведения, демонстрируют морфологические изменения, которые могут поставить под угрозу продолжительность жизни эритросенсора in vivo .
4.
Обсуждение
Прежде чем использовать эритроциты в качестве сенсорной платформы, мы исследовали флуоресцентный сигнал эритросенсора, размеры, морфологию и удержание гемоглобина.Это важные функции, позволяющие поддерживать циркуляцию эритросенсоров в течение длительного периода времени. Процедуры загрузки были оптимизированы для инкапсуляции pH-чувствительного FITC-глиглила в эритроциты как для гипотонического разведения, так и для электропорации. При сравнении этих методов загрузки эритросенсоры, полученные с помощью гипотонического разведения, показали более высокую эффективность загрузки. Более высокая нагрузка на оптический датчик имеет решающее значение для обеспечения достаточного оптического сигнала для долгосрочных неинвазивных измерений, основанных на реинфекции эритросенсоров в кровоток.Диаметр электропорированных эритроцитов (с FITC-глиглием и без него) меньше по сравнению с NE, вероятно, из-за потери клеточного содержимого. Это подтверждается тем фактом, что эритроциты, электропорированные с грузовым FITC-глиглигом (эритросенсоры), имеют больший диаметр, чем эритроциты, электропорированные без FITC-глиглигли (EE). При загрузке эритроцитов посредством электропорации клетки сохраняли более высокую концентрацию гемоглобина, чем метод разведения, но все же теряли примерно половину своего общего гемоглобина.Потеря гемоглобина в обоих случаях могла быть препятствием для выживания эритросенсора в кровообращении. Это исследование предполагает, что уровни гемоглобина и концентрации груза при загрузке обратно пропорциональны. Эти результаты особенно полезны в качестве основы для стандартизации характеристик эритросенсоров для использования в системе мониторинга аналитов крови на основе эритросенсоров.
Эритроциты, нагруженные посредством гипотонического разведения и электропорации, сохраняли округлую форму. Аномальные формы указывают на нарушение цитоскелета или мембраны или вторичные проблемы, включая осаждение гемоглобина.Таким образом, форма эритроцитов и эритросенсоров может использоваться как маркер функциональности и целостности клеточной мембраны и цитоскелета. Наши результаты (т.е. неправильная форма эритросенсоров и потеря гемоглобина) предполагают, что для долгосрочного мониторинга необходимо найти альтернативную нагрузку для производства эритросенсоров, которые лучше имитируют НЭ.
Одним из атрибутов эритросенсоров, загружаемых посредством гипотонического разведения, является испускание более сильного флуоресцентного сигнала по сравнению с электропорированными эритросенсорами, что послужило поводом для углубленного изучения техники загрузки гипотоническим разбавлением.Дальнейшая характеристика сигнала флуоресценции, испускаемого FITC-глиглием от эритросенсоров в результате гипотонического разведения, выявила неравномерно загруженную популяцию. Использование дополнительной стадии центрифугирования для дальнейшего концентрирования загруженных эритросенсоров было принято в качестве стандарта для исследования эритросенсоров с помощью конфокальной микроскопии и АСМ. Изоляция эритросенсоров с аналогичной флуоресценцией увеличивает шансы того, что, например, во время топографических изображений АСМ исследуемые эритросенсоры будут загружены FITC-глиглием.Наиболее важно то, что было продемонстрировано, что эритросенсоры были загружены FITC-глигли по объему. До этого исследования расположение груза в эритроцитах-носителях не было хорошо охарактеризовано. Хотя предыдущие исследования предполагали захват груза, не было убедительных доказательств объемной загрузки. 10 , 11 , 35
Эритросенсоры, нагруженные гипотоническим разбавлением, деформировались, и топография их поверхности стала неровной. После проверки целостности эритросенсоров с помощью АСМ было подтверждено, что эритросенсоры, загруженные с помощью гипотонического разведения, утратили архитектуру NE в соответствии с Brähler et al.’ 39 результатов, в которых клеточные изменения эритроцитов-носителей впервые были изучены с помощью АСМ. Использование АСМ для характеристики эритросенсоров дало возможность изучить эти изменения в сочетании с флуоресцентными исследованиями.
Здесь характеристика эритросенсоров, загруженных с использованием гипотонического разведения, включала оценку размера, морфологии, удержания гемоглобина и однородности нагрузки. Уменьшенный размер, повышенная деформация и неровная топография — вот некоторые из обнаруженных здесь признаков эритросенсора.Клеточные артефакты эритроцитов-носителей и эритросенсоров не были хорошо изучены, и потребуются дальнейшие исследования / оптимизация методов загрузки, чтобы минимизировать клеточные изменения и потенциально увеличить кровообращение в течение жизни в качестве платформы для долгосрочного мониторинга кровотока.
5.
Выводы
Благодаря своей простоте, биосовместимости и биоразлагаемости эритроциты являются привлекательной платформой для доставки и мониторинга крови.Эритроциты зависят от множества свойств, включая размер, форму клеток и содержание гемоглобина, для выполнения своих физиологических функций. Хотя функционализированные сенсором эритроциты, также известные как эритросенсоры, предлагают интригующее решение для долгосрочного мониторинга анализируемых веществ в крови, несколько факторов могут влиять на выход, целостность и производительность эритросенсоров. Например, процесс функционализации может оказывать вредное воздействие на структуру и / или функцию клетки. Таким образом, клеточные свойства эритросенсоров будут влиять на их функциональность в качестве платформы для долгосрочного мониторинга.
Это исследование направлено на более глубокое понимание клеточных изменений, испытываемых эритросенсорами, загруженными с помощью обычных методов, гипотонического разведения и электропорации. Морфологические изменения эритросенсоров и эритроцитов-носителей после гипотонического разведения и нагрузки электропорации ранее не были хорошо изучены. Это исследование было направлено на разработку протоколов для характеристики физических свойств эритросенсоров и определения того, чем эритросенсоры отличаются от НЭ. Хотя гипотоническое разведение, по-видимому, нагружает эритросенсоры достаточным грузом, выявленные клеточные изменения могут поставить под угрозу способность эритросенсоров имитировать NE и функционировать в качестве долгосрочной сенсорной платформы в кровотоке.По данным этого исследования, ни гипотоническое разведение, ни электропорация не позволяют получить эритросенсоры, точно имитирующие эритроциты. Таким образом, данное исследование представляет собой шаг к пониманию клеточных свойств эритросенсоров и стандартизации методологий оценки эритроцитов-носителей и эритросенсоров.
Улучшенная система доставки химиотерапии для лечения злокачественной ткани легкого — Harvard Gazette
Химиотерапия была основой лечения рака на протяжении десятилетий, но она печально известна своей токсичностью для здоровых клеток, серьезными побочными эффектами и плохим воздействием на предполагаемые опухоли.
Усилия по повышению эффективности и переносимости химиотерапии включают упаковку лекарств в наночастицы, которые могут защитить их от разложения в организме, контролировать характер их высвобождения и защитить пациента от некоторых побочных эффектов лекарств.
Однако наночастицы до сих пор не демонстрировали значительного накопления в сайтах-мишенях, даже если они сконструированы с использованием поверхностных белков, предназначенных для связывания с конкретными тканями, в основном потому, что они быстро выводятся из крови печенью и селезенкой.
Теперь новая методика под названием ELeCt (химиотерапия с использованием эритроцитов), разработанная Гарвардским институтом биологической инженерии Висса и Школой инженерии и прикладных наук Джона А. Полсона (SEAS), направлена на решение этих проблем с помощью троянского коня, контрабандного наркотика. загружают наночастицы в злокачественную ткань легких, закрепляя их на собственных эритроцитах организма, обычно называемых эритроцитами. Когда эритроциты плотно протискиваются через крошечные капилляры легких, наночастицы отрываются и захватываются клетками легких с 10-кратным успехом, чем свободно плавающие наночастицы, и значительно улучшают выживаемость мышей с метастазами рака легких.Об исследовании сообщается в Science Advances.
«От 30 до 55 процентов пациентов с запущенным раком имеют метастазы в легкие из-за большого количества капилляров, и в настоящее время не существует лечения самих метастазов в легкие», — сказал соавтор исследования Цзунминь Чжао, научный сотрудник лаборатории. Самира Митраготри из Института Висс и SEAS. «ELeCt использует те же самые кровеносные сосуды для эффективной доставки лекарств, которые борются с метастазами в легких, и имеет большой потенциал для превращения в клиническое лечение.”
Для создания системы ELeCt Чжао и его сотрудники загрузили доксорубицин, распространенный препарат для химиотерапии рака, в крошечные наночастицы, состоящие из биоразлагаемого полимера под названием PLGA. Затем они инкубировали наночастицы как с эритроцитами мыши, так и с человеческими эритроцитами и обнаружили, что они связываются с поверхностью клеток с высокой эффективностью и не повреждают их, что позволяет регулировать дозу лекарства, переносимого эритроцитами, в соответствии с различными требуемыми дозировками.
Затем группа исследователей подвергла связанные с эритроцитами наночастицы соответствующему напряжению сдвига в легких in vitro , чтобы смоделировать условия, с которыми сталкиваются эритроциты при протискивании через капилляры легких, и обнаружила, что более 75 процентов наночастиц были оторваны как от мыши, так и от человека.

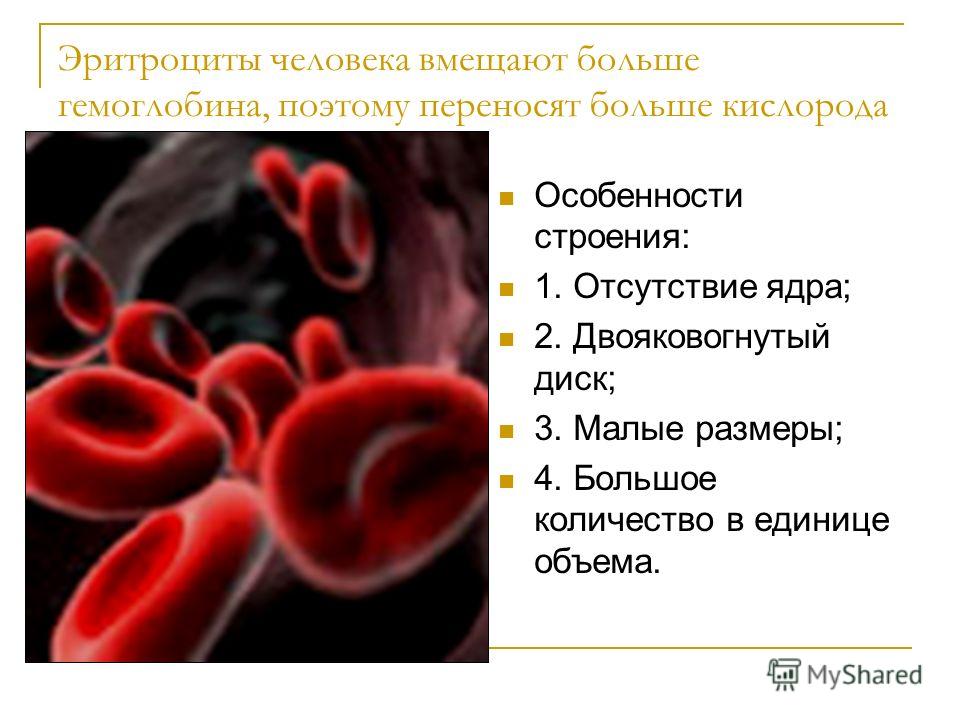 Риск формирования гематом в области венепункции значительно увеличивается при раннем (менее 4 часов с момента завершения донации) снятии давящей повязки, накладываемой на область локтевого сгиба, и при физических нагрузках
Риск формирования гематом в области венепункции значительно увеличивается при раннем (менее 4 часов с момента завершения донации) снятии давящей повязки, накладываемой на область локтевого сгиба, и при физических нагрузках
 ,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.