РНК Википедия
Рибонуклеи́новая кислота́ (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов и играют важную роль в ировании, прочтении, регуляции и выражении генов.
Так же, как ДНК (дезоксирибонуклеиновая кислота), РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК ировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами. Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией. Трансляция — это синтез белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.
Для одноцепочечных РНК характерны разнообразные пространственные структуры, в которых часть нуклеотидов одной и той же цепи спарены между собой. Некоторые высокоструктурированные РНК принимают участие в синтезе белка клетки, например, транспортные РНК служат для узнавания онов и доставки соответствующих аминокислот к месту синтеза белка, а рибосомные РНК служат структурной и каталитической основой рибосом.
Однако функции РНК в современных клетках не ограничиваются их ролью в трансляции. Так, малые ядерные РНК принимают участие в сплайсинге эукариотических матричных РНК и других процессах.
Помимо того, что молекулы РНК входят в состав некоторых ферментов (например, теломеразы), у отдельных РНК обнаружена собственная ферментативная активность: способность вносить разрывы в другие молекулы РНК или, наоборот, «склеивать» два РНК-фрагмента. Такие РНК называются рибозимами.
Геномы ряда вирусов состоят из РНК, то есть у них она играет роль, которую у высших организмов выполняет ДНК. На основании разнообразия функций РНК в клетке была выдвинута гипотеза, согласно которой РНК — первая молекула, которая была способна к самовоспроизведению в добиологических системах.
История изучения[ | ]
Нуклеиновые кислоты были открыты в 1868 году швейцарским учё
РНК (рибонуклеиновая кислота)
☰
РНК (рибонуклеиновая кислота), так же как и ДНК, относится к нуклеиновым кислотам. Молекулы-полимеры РНК намного меньше, чем у ДНК. Однако в зависимости от типа РНК количество входящих в них нуклеотидов-мономеров различается.
В состав нуклеотида РНК в качестве сахара входит рибоза, в качестве азотистого основания — аденит, гуанин, урацил, цитозин. Урацил по строению и химическим свойствам близок к тимину, который обычен для ДНК. В зрелых молекулах РНК многие азотистые основания модифицированы, поэтому в реальности разновидностей азотистых оснований в составе РНК намного больше.
Рибоза в отличие от дезоксирибозы имеет дополнительную -ОН-группу (гидроксильную). Это обстоятельство позволяет РНК легче вступать в химические реакции.
Главной функцией РНК в клетках живых организмов можно назвать реализацию генетической информации. Именно благодаря разным типам рибонуклеиновой кислоты генетический код считывается (транскрибируется) с ДНК, после чего на его основе синтезируются полипептиды (происходит трансляция). Итак, если ДНК в основном отвечает за хранение и передачу из поколения в поколение генетической информации (основной процесс – репликация), то РНК реализует эту информацию (процессы транскрипции и трансляции). При этом транскрипция происходит на ДНК, так что этот процесс относится к обоим типам нуклеиновых кислот и тогда с этой точки зрения можно сказать, что и ДНК отвечает за реализацию генетической информации.
При более подробном рассмотрении функции РНК намного разнообразнее. Ряд молекул РНК выполняют структурную, каталитическую и другие функции.
Существует так называемая гипотеза РНК-мира, согласно которой вначале в живой природе в качестве носителя генетической информации выступали только молекулы РНК, при этом другие молекулы РНК катализировали различные реакции. Данная гипотеза подтверждена рядом опытов, показывающих возможную эволюцию РНК. На это указывает и то, что ряд вирусов в качестве нуклеиновой кислоты, хранящей генетическую информацию, имеют молекулу РНК.
Согласно гипотезе РНК-мира ДНК появилась позже в процессе естественного отбора как более устойчивая молекула, что важно для хранения генетической информации.
Выделяют три основных типа РНК (кроме них есть и другие): матричная (она же информационная), рибосомальная и транспортная. Обозначаются они соответственно иРНК (или мРНК), рРНК, тРНК.
Информационная РНК (иРНК)
Перед транскрипцией нити ДНК расплетаются, и на одной из них с помощью комплекса белков-ферментов синтезируется РНК по принципу комплементарности, так же как это происходит при репликации ДНК. Только напротив аденина ДНК к молекуле РНК присоединяется нуклеотид, содержащий урацил, а не тимин.
На самом деле на ДНК синтезируется не готовая информационная РНК, а ее предшественник — пре-иРНК. Предшественник содержит участки последовательности нуклеотидов, которые не кодируют белок и которые после синтеза пре-иРНК вырезаются при участии малых ядерных и ядрышковых РНК («дополнительные» типы РНК). Эти удаляющиеся участки называются интронами
. Остающиеся части иРНК называются экзонами. После удаления интронов экзоны сшиваются между собой. Процесс удаления интронов и сшивания экзонов называется сплайсингом. Усложняющей жизнь особенностью является то, что можно вырезать интроны по-разному, в результате получатся разные готовые иРНК, которые будут служить матрицами для разных белков. Таким образом, вроде бы один ген ДНК может играть роль нескольких генов.Следует отметить, что у прокариотических организмов сплайсинга не происходит. Обычно их иРНК сразу после синтеза на ДНК готова к трансляции. Бывает, что пока конец молекулы иРНК еще транскрибируется, на ее начале уже сидят рибосомы, синтезирующие белок.
После того как пре-иРНК созревает в информационную РНК и оказывается вне ядра, она становится матрицей для синтеза полипептида. При этом на нее «насаживаются» рибосомы (не сразу, какая-то оказывается первой, другая — второй и т. д.). Каждая синтезирует свою копию белка, т. е. на одной молекуле РНК могут синтезироваться сразу несколько одинаковых белковых молекул (понятно, что каждая будет находиться на своей стадии синтеза).
Рибосома, передвигаясь от начала иРНК к ее концу, считывает по три нуклеотида (хотя вмещает шесть, т. е. два кодона) и присоединяет соответствующую транспортную РНК (имеющую соответствующий кодону антикодон), к которой присоединена соответствующая аминокислота. После этого с помощью активного центра рибосомы ранее синтезированная часть полипептида, соединенная с предшествующей тРНК, как-бы «пересаживается» (образуется пептидная связь) на аминокислоту, прикрепленную к только что пришедшей тРНК. Таким образом, молекула белка постепенно увеличивается.
Когда молекула информационной РНК становится не нужна, клетка ее разрушает.
Транспортная РНК (тРНК)
Транспортная РНК — это достаточно маленькая (по меркам полимеров) молекула (количество нуклеотидов бывает разным, в среднем около 80-ти), во вторичной структуре имеет форму клеверного листа, в третичной сворачивается в нечто подобное букве Г.
Функция тРНК — присоединение к себе соответствующей своему антикодону аминокислоты. В дальнейшем соединение с рибосомой, находящейся на соответствующем антикодону кодоне иРНК, и «передача» этой аминокислоты. Обобщая, можно сказать, что транспортная РНК переносит (на то она и транспортная) аминокислоты к месту синтеза белка.
Живая природа на Земле использует всего около 20-ти аминокислот для синтеза различных белковых молекул (на самом деле аминокислот куда больше). Но поскольку, согласно генетическому коду, кодонов больше 60-ти, то каждой аминокислоте может соответствовать несколько кодонов (на самом деле какой-то больше, какой-то меньше). Таким образом, разновидностей тРНК больше 20, при этом разные транспортные РНК переносят одинаковые аминокислоты. (Но и тут не так все просто.)
Рибосомная РНК (рРНК)
Рибосомную РНК часто также называют рибосомальной РНК. Это одно и то же.
В рибосомах рРНК образует комплексы с белками, выполняет структурную и каталитическую функции.
В состав рибосомы входят несколько разных молекул рРНК, отличающиеся между собой как по длине цепи, вторичной и третичной структуре, выполняемым функциям. Однако их суммарная функция — это реализация процесса трансляции. При этом молекулы рРНК считывают информацию с иРНК и катализируют образование пептидной связи между аминокислотами.
Y-РНК — Википедия
Y-РНК — малые некодирующие РНК, входят в состав рибонуклеопротеинов, содержащих белки Ro60[en][1] и La[en], которые являются мишенью аутоантител у пациентов, страдающих системной красной волчанкой[2] и синдромом Шегрена[3]. Они также необходимы для репликации ДНК, так как взаимодействуют с хроматином и инициаторными белками [4][5].
Y-РНК впервые были описаны в 1981 году. Они были выявлены в цитоплазме клеток млекопитающих (человека, мыши и мартышки), в связи с чем получили название Y-РНК от cytoplasmic в противовес ядерным РНК (U-РНК от nuclear)[3].
Y-РНК удалось обнаружить у всех исследованных позвоночных, причём у каждого вида есть от одного до четырёх генов Y-РНК, что свидетельствует о дупликациях и делециях этих генов в ходе эволюции позвоночных. У человека насчитываются четыре вида Y-РНК: hY1, hY3, hY4 и hY5. Ранее в их число также включали hY2, однако впоследствии оказалось, что это не отдельный вид Y-РНК, а продукт разрушения РНК hY1. Все 4 гена Y-РНК у человека образуют единый кластер на 7-й хромосоме в локусе 7q36, у других позвоночных они тоже сгруппированы в кластер. Самой древней среди Y-РНК позвоночных, по-видимому, является Y3[6]. Каждый ген Y-РНК транскрибируется РНК-полимеразой III[en] с собственного промотора. Было показано, что малые некодирующие РНК нематод, известные как sbРНК
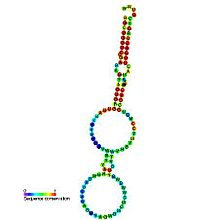 Предполагаемая вторичная структура Y-РНК
Предполагаемая вторичная структура Y-РНКМолекулы Y-РНК состоят из 80—120 нуклеотидов и имеют характерную шпилечную вторичную структуру. 5′- и 3′-конец каждой молекулы Y-РНК гибридизуются с образованием двух двуцепочечных стеблевых участков, разделённых небольшой внутренней петлёй. Самая длинная петля — у hY1, самая короткая — у hY5. Нуклеотидные последовательности нижнего и верхнего стеблей высококонсервативны, в то время как последовательности внутренней петли сильно различаются у разных Y-РНК. Нижний стебель несёт консервативно выпяченный остаток цитозина, который является ключевым остатком, участвующим в связывании с белком Ro60[6]. Именно петля взаимодействует с разнообразными белками, в числе которых нуклеолин, PTB и ZBP1[en]. Показано, что стабильность и процессинг 3′-концов Y-РНК зависят от экзорибонуклеазы PARN[en][9]. Все четыре человеческие Y-РНК взаимодействуют с антивирусной цитидиндеаминазой[en] APOBEC3G[en], которая также входит в состав рибонуклеопротеинов, содержащих Ro60 и La. Возможно, APOBEC3G осуществляет редактирование Y-РНК. Петлевой домен также задействован во взаимодействии Y-РНК с ядерными хроматиновыми доменами. hY5 взаимодействует с особым набором белков, что указывает на её функции, отличные от прочих Y-РНК — она, например, взаимодействует с рибосомным белком L5[en] и IFIT5. Кроме того, hY5 взаимодействует с 5S рРНК[en], преимущественно в неуложенном виде[3].
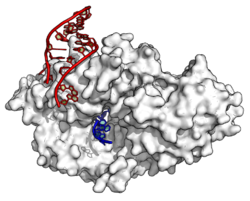 Белок Ro (белый) связывает конец двуцепочечной Y-РНК (красный) и одноцепочечной РНК (синий) (PDB: 1YVP [1])[10]
Белок Ro (белый) связывает конец двуцепочечной Y-РНК (красный) и одноцепочечной РНК (синий) (PDB: 1YVP [1])[10]Первоначально Y-РНК были описаны как некодирующие РНК, связывающиеся с белком Ro60, который является антигеном, распознаваемым антителами из крови пациентов с системной красной волчанкой и синдромом Шегрена. Ro60 у позвоночных консервативен, его гомологи были выявлены у большинства Metazoa, а также в 5 % бактериальных геномов (среди которых геномы D. radiodurans и Salmonella). У всех этих организмов гомологи Ro60 связываются с Y-РНК или подобными им РНК с образованием рибонуклеопротеинов. У позвоночных Ro60 взаимодействует с нижним стеблевым доменом Y-РНК. С частью рибонуклеопротеинов, состоящих из Ro60 и Y-РНК (RoRNP), связывается белок La. Он необходим для правильной терминации транскрипции, опосредованной РНК-полимеразой III, и связывается с 3′-концевым полиуридиновым[en] хвостом новосинтезированных РНК в ядре. Большинство РНК впоследствии утрачивают полиуридиновый хвост, но Y-РНК его сохраняют и продолжают взаимодействовать с La. Он участвует в накоплении Y-РНК в ядре и защищает их от разрушения экзонуклеазами[3].
RoRNP участвуют в контроле качества некодирующих РНК, регулируют стабильность РНК и у некоторых видов участвуют в клеточном ответе на стресс. У многих видов, в числе которых лягушка Xenopus laevis, нематода C. elegans и домовая мышь, Ro60 связывается с такими дефектными некодирующими РНК, как неправильно уложенные 5S рРНК и малая ядерная РНК U2[en]. Нематоды, лишённые гомолога Ro60, жизнеспособны, однако у них нарушается процесс формирования особой личинки, предназначенной для перенесения неблагоприятных условий. Под действием УФ-излучения в клетках мыши и D. radiodurans происходит накопление RoRNP, и в отсутствие Ro60 их устойчивость к УФ-излучению понижается. У D. radiodurans ортолог Ro60 участвует в созревании рРНК, экспрессия которых была индуцирована тепловым стрессом, и разрушении рРНК, вызванном голоданием. Связывание Ro60 с неправильно уложенными некодирующими РНК неспецифично в отношении последовательности, и, по-видимому, этот белок может связываться с самыми разными РНК. По этой причине RoRNP можно рассматривать как внутриклеточные сенсоры стресса. В отсутствие Ro60 уровень Y-РНК в клетках как эукариот, так и прокариот снижался, из чего, вероятно, следует, что Ro60 стабилизирует Y-РНК, с которыми он взаимодействует[3].
Y-РНК участвует в инициации репликации хромосомной ДНК, а именно в формировании новых репликативных вилок. Однако они не нужны для элонгации и репликации и самого процесса удвоения ДНК как такового. Y-РНК вовлечены в инициацию репликации ДНК не сами по себе, а посредством белков. Для участия в инициации репликации ДНК необходим верхний стебель Y-РНК, но не участки связывания с белками Ro60 и La и не сами эти белки. Фактически около половины Y-РНК в человеческих клетках существует вне комплексов с белками Ro60 и La. Нарушение работы Y-РНК с помощью РНК-интерференции блокирует репликацию ДНК и пролиферацию клеток млекопитающих. При этом нормальный фенотип возвращается при введении в такие клетки короткой двуцепочечной РНК, соответствующей верхнему стеблю РНК hY1. Инактивация Y-РНК с помощью морфолиновых олигонуклеотидов в эмбрионах X. laevis и рыбы Danio rerio приводит к остановке развития и гибели на ранних этапах эмбриогенеза. В человеческих опухолях, напротив, наблюдается сверхэкспрессия Y-РНК по сравнению с нормальными тканями. Последовательности верхних стеблей Y-РНК таких организмов, как C. elegans, B. floridae и D. radiodurans, сильно отличаются от последовательностей позвоночных, и эти Y-РНК не могут функционально заменить Y-РНК в клетках человека[3].
Конкретный механизм участия Y-РНК в инициации репликации ДНК неизвестен. Известно, однако, что Y-РНК взаимодействует с несколькими белками, вовлечёнными в инициацию репликации ДНК, в числе которых комплекс распознавания ориджина[en] репликации ORC, а также en[en], Cdt1[en] и DUE-B, но не взаимодействует с белками репликативной вилки. С помощью флуоресцентно-меченных[en] Y-РНК удалось показать, что у человека Y-РНК динамически взаимодействуют с нереплицированным хроматином в G1-фазе клеточного цикла, колокализуясь с несколькими белками инициации репликации ДНК. После того как репликация началась, Y-РНК вытесняются из места начала репликации и не выявляются в местах активного синтеза ДНК[3].
У эукариот биогенез Y-РНК начинается в ядре, но в дальнейшем Y-РНК могут выйти в цитоплазму, как другие транскрипты РНК-полимеразы III (тРНК и пре-микроРНК), или же остаться в ядре, как малые ядерные РНК. Экспериментальные данные об относительном распределении Y-РНК между ядром и цитоплазмой противоречивы, возможно, из-за используемых методик. Первоначальные эксперименты с фракционированием клеток[en] показали, что в клетках млекопитающих в культуре и ооцитах X. laevis Y-РНК локализованы преимущественно или даже исключительно в цитоплазме. Далее было показано, что hY1, hY3 и hY4 (и соответствующие мышиные гомологи) находятся в цитоплазме, а hY5 накапливается в ядре. Гибридизация in situ[en] и электронная микроскопия показали, однако, что Y-РНК образуют дискретные кластеры как в ядре, так и в цитоплазме в клетках человека в культуре. В пролиферирующих человеческих клетках hY1, hY3 и hY5 также выявляются на краю ядрышка (в околоядрышковом компартменте). Использование флуоресцентно-меченных Y-РНК показало, что все четыре человеческие Y-РНК динамически связываются с хроматином в переходе из G1-фазы в S-фазу. При этом hY1, hY3 и hY4 локализуются вместе и связаны преимущественно с эухроматином на ранних этапах репликации, а hY5 накапливается в ядрышке. В связи с тем, что hY5 взаимодействует с 5S рРНК и локализуется в ядрышке, можно предположить, что она участвует в биогенезе рибосом. Таким образом, вероятнее всего, Y-РНК присутствуют как в ядре, так и в цитоплазме эукариотических клеток, а их относительное преобладание в одном из компартментов связано с методологией эксперимента[3].
Экспорт Y-РНК из ядра происходит при участии ГТФазы Ran[en], поэтому в роли транспортных рецепторов для Y-РНК, вероятнее всего, выступают экспортины[en]. Нижний стебель Y-РНК очень похож на структуру других РНК-субстратов экспортина-5, и было показано, что экспортин-5[en] связывается с комплексом hY1 и Ran/ГТФ. Делеция нижнего стебля hY1 вызывает нарушения в её экспорте из ядра. Механизм обратного поступления Y-РНК в ядро неизвестен[3].
Было высказано предположение, что в клетках млекопитающих Y-РНК регулирует внутриклеточную локализацию Ro60. Этот белок выявляется и в ядре, и в цитоплазме, и было показано, что Y-РНК может влиять на его локализацию. В клетках мыши связывание Y-РНК с Ro60 приводит к тому, что его сигнал ядерной локализации оказывается скрыт в глубине комплекса, из-за чего RoRNP остаётся в цитоплазме[3].
Внутриклеточная локализация Y-РНК меняется в условиях стресса. У некоторых видов после окислительного стресса или воздействия УФ-излучения и Ro60, и Y-РНК накапливаются в ядре, что согласуется с предполагаемой ролью RoRNP в клеточном ответе на стресс. Возможно также, что в условиях стресса нарушается работа ГТФазы Ran, что приводит к накоплению комплексов в ядре[3].
У млекопитающих Y-РНК могут быть селективно упакованы в вирусные частицы. Подобный эффект был показан для ВИЧ-1 и вируса мышиной лейкемии Moloney. Для упаковки в вирионы не нужен Ro60, и, вероятно, это происходит на ранних этапах биогенеза Y-РНК, когда она ещё не успевает покинуть ядро. Роль Y-РНК в вирусной инфекции неизвестна[3].
С помощью нозерн-блоттинга была проанализирована экспрессия Y-РНК в различных тканях взрослых мышей. Базальный уровень экспрессии mY1 и mY3 наблюдался во всех тканях. Наибольшие уровни Y-РНК наблюдались в мозге, лёгких, сердце, желудке, почках, яичниках, жировой и мышечной тканях, а наименьшие — в печени, кишечнике, селезёнке, коже и крови. При этом паттерн экспрессии Y-РНК был похож на таковой у Ro60[6].
Секвенирование тотальной РНК, выделенной из эукариотических клеток, показало, что в клетках в состоянии апоптоза накапливается много малых РНК, представляющих собой «обломки» Y-РНК. Тем не менее, эти малые РНК связываются с Ro60 и La, поэтому, видимо, участки связывания с этими белками в нижнем стебле защищены от разрушения. Вероятно, основной мишенью разрушения при апоптозе является верхний стебель, который участвует в инициации репликации ДНК. Производные Y-РНК также выявляются в пролиферирующих клетках, как раковых, так и нераковых, в мозге, сетчатке и других здоровых тканях млекопитающих, а также в разнообразных опухолях. Некоторые из них были первоначально ошибочно идентифицированы как новый тип микроРНК, образующийся при процессинге полноразмерных Y-РНК. Однако впоследствии было показано, что малые РНК образуются из Y-РНК не так, как микроРНК. Более того, производные Y-РНК, в отличие от микроРНК, не участвуют в сайленсинге генов. Было показано, что в крови человека и других животных циркулирует большое количество производных Y-РНК, как в составе везикул, так и в виде свободных рибонуклеопротеинов. Уровень РНК, образованных из 3′- и 5′-концов Y-РНК, а также из 5′-конца тРНК, значительно выше в крови пациентов, страдающих от рака груди, по сравнению со здоровыми людьми, поэтому эти РНК могут иметь диагностическое значение как биомаркеры рака. Полноразмерные Y-РНК и производные Y-РНК были выявлены в везикулах, образованных мышиными иммунными клетками, кроме того, производные Y-РНК составляют весомую долю РНК-компонента экзосом в человеческой сперме. Фрагмент Y-РНК, известный как EV-YF1, в составе экзосом, вероятно, можно использовать для минимизации отрицательных эффектов на сердце и почки, вызванных инфузиями ангиотензина II[11]. Фрагмент Y-РНК, известный как 5′-YsRNA, возможно, может служить биомаркером синдрома Шегрена[12]. Функции производных Y-РНК неизвестны, но, возможно, они участвуют в передаче сигнала между клетками[3].
Лучше всего Y-РНК изучены у бактерии Deinococcus radiodurans. У этой бактерии почти все функции Y-РНК так или иначе связаны с гомологом Ro60, известным как Rsr. Например, Y-РНК обеспечивает взаимодействие Rsr с экзорибонуклеазой полинуклеотидфосфорилазой[en]. Y-РНК и Rsr опосредуют клеточный ответ на воздействие УФ-излучения. У Salmonella enterica serovar Typhimurium Y-РНК также тесно взаимодействуют с Rsr. Поиск гомологов Y-РНК Salmonella показал, что Y-РНК очень широко распространены среди бактерий, а также кодируются геномами некоторых бактериофагов. Некоторые бактериальные Y-РНК даже демонстрируют структурное сходство с тРНК. Широкое распространение Y-РНК среди неродственных бактерий говорит о том, что у большинства видов гены Y-РНК были приобретены при помощи горизонтального переноса генов[13].
Чрезмерная экспрессия Y-РНК характерна для некоторых человеческих опухолей и необходима для клеточной пролиферации[14]. Кроме того, небольшие фрагменты размером с микроРНК, образующиеся при распаде Y-РНК, могут играть некоторую роль в развитии аутоиммунных заболеваний и некоторых других патологических состояний[15].
- ↑ Hall A. E., Turnbull C., Dalmay T. Y RNAs: recent developments. (англ.) // Biomolecular concepts. — 2013. — Vol. 4, no. 2. — P. 103—110. — DOI:10.1515/bmc-2012-0050. — PMID 25436569. [исправить]
- ↑ Lerner M. R., Boyle J. A., Hardin J. A., Steitz J. A. Two novel classes of small ribonucleoproteins detected by antibodies associated with lupus erythematosus. (англ.) // Science (New York, N.Y.). — 1981. — Vol. 211, no. 4480. — P. 400—402. — PMID 6164096. [исправить]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Kowalski M. P., Krude T. Functional roles of non-coding Y RNAs. (англ.) // The International Journal Of Biochemistry & Cell Biology. — 2015. — September (vol. 66). — P. 20—29. — DOI:10.1016/j.biocel.2015.07.003. — PMID 26159929. [исправить]
- ↑ Christov C. P., Gardiner T. J., Szüts D., Krude T. Functional requirement of noncoding Y RNAs for human chromosomal DNA replication. (англ.) // Molecular and cellular biology. — 2006. — Vol. 26, no. 18. — P. 6993—7004. — DOI:10.1128/MCB.01060-06. — PMID 16943439. [исправить]
- ↑ Zhang A. T., Langley A. R., Christov C. P., Kheir E., Shafee T., Gardiner T. J., Krude T. Dynamic interaction of Y RNAs with chromatin and initiation proteins during human DNA replication. (англ.) // Journal of cell science. — 2011. — Vol. 124, no. Pt 12. — P. 2058—2069. — DOI:10.1242/jcs.086561. — PMID 21610089. [исправить]
- ↑ 1 2 3 4 Köhn M., Pazaitis N., Hüttelmaier S. Why YRNAs? About Versatile RNAs and Their Functions. (англ.) // Biomolecules. — 2013. — Vol. 3, no. 1. — P. 143—156. — DOI:10.3390/biom3010143. — PMID 24970161. [исправить]
- ↑ Van Horn D. J., Eisenberg D., O’Brien C. A., Wolin S. L. Caenorhabditis elegans embryos contain only one major species of Ro RNP. (англ.) // RNA (New York, N.Y.). — 1995. — Vol. 1, no. 3. — P. 293—303. — PMID 7489501. [исправить]
- ↑ Boria I., Gruber A. R., Tanzer A., Bernhart S. H., Lorenz R., Mueller M. M., Hofacker I. L., Stadler P. F. Nematode sbRNAs: homologs of vertebrate Y RNAs. (англ.) // Journal of molecular evolution. — 2010. — Vol. 70, no. 4. — P. 346—358. — DOI:10.1007/s00239-010-9332-4. — PMID 20349053. [исправить]
- ↑ Shukla S., Parker R. PARN Modulates Y RNA Stability and Its 3′-End Formation. (англ.) // Molecular And Cellular Biology. — 2017. — 15 October (vol. 37, no. 20). — DOI:10.1128/MCB.00264-17. — PMID 28760775. [исправить]
- ↑ Stein A. J., Fuchs G., Fu C., Wolin S. L., Reinisch K. M. Structural insights into RNA quality control: the Ro autoantigen binds misfolded RNAs via its central cavity. (англ.) // Cell. — 2005. — Vol. 121, no. 4. — P. 529—539. — DOI:10.1016/j.cell.2005.03.009. — PMID 15907467. [исправить]
- ↑ Cambier L., Giani J. F., Liu W., Ijichi T., Echavez A. K., Valle J., Marbán E. Angiotensin II-Induced End-Organ Damage in Mice Is Attenuated by Human Exosomes and by an Exosomal Y RNA Fragment. (англ.) // Hypertension (Dallas, Tex. : 1979). — 2018. — August (vol. 72, no. 2). — P. 370—380. — DOI:10.1161/HYPERTENSIONAHA.118.11239. — PMID 29866742. [исправить]
- ↑ Kabeerdoss J., Sandhya P., Danda D. Y RNA derived small RNAs in Sjögren’s syndrome: Candidate biomarkers? (англ.) // International Journal Of Rheumatic Diseases. — 2017. — November (vol. 20, no. 11). — P. 1763—1766. — DOI:10.1111/1756-185X.13229. — PMID 29152879. [исправить]
- ↑ Sim S., Wolin S. L. Bacterial Y RNAs: Gates, Tethers, and tRNA Mimics. (англ.) // Microbiology Spectrum. — 2018. — July (vol. 6, no. 4). — DOI:10.1128/microbiolspec.RWR-0023-2018. — PMID 30006996. [исправить]
- ↑ Christov C. P., Trivier E., Krude T. Noncoding human Y RNAs are overexpressed in tumours and required for cell proliferation. (англ.) // British journal of cancer. — 2008. — Vol. 98, no. 5. — P. 981—988. — DOI:10.1038/sj.bjc.6604254. — PMID 18283318. [исправить]
- ↑ Verhagen A. P., Pruijn G. J. Are the Ro RNP-associated Y RNAs concealing microRNAs? Y RNA-derived miRNAs may be involved in autoimmunity. (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2011. — Vol. 33, no. 9. — P. 674—682. — DOI:10.1002/bies.201100048. — PMID 21735459. [исправить]
РНК-полимераза — Википедия
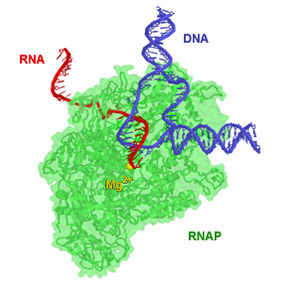 РНК-полимераза из клетки T. aquaticus в процессе репликации. Некоторые элементы фермента сделаны прозрачными, и цепи РНК и ДНК видны более отчётливо. Ион магния (жёлтый) располагается на активном участке фермента.
РНК-полимераза из клетки T. aquaticus в процессе репликации. Некоторые элементы фермента сделаны прозрачными, и цепи РНК и ДНК видны более отчётливо. Ион магния (жёлтый) располагается на активном участке фермента. 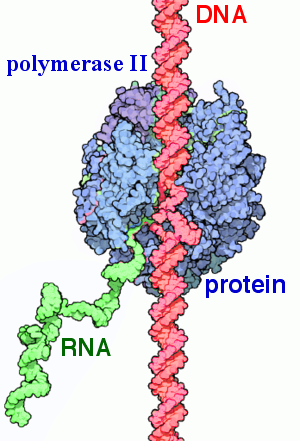
РНК-полимераза — фермент, осуществляющий синтез молекул РНК. В узком смысле, РНК-полимеразой обычно называют ДНК-зависимые РНК-полимеразы, осуществляющие синтез молекул РНК на матрице ДНК, то есть осуществляющие транскрипцию. Ферменты класса РНК-полимераз очень важны для функционирования клетки, поэтому они имеются во всех организмах и во многих вирусах. Химически РНК-полимеразы являются нуклеотидил-трансферазами, полимеризующими рибонуклеотиды на 3′-конце цепи РНК.
РНК-полимераза была открыта независимо Сэмом Вайссом и Джерардом Хурвицем (1928-2019) в 1960.[1] К этому моменту Нобелевская премия по медицине в 1959 году уже была присуждена Северо Охоа и Артуру Корнбергу за открытие вещества, которое считали РНК-полимеразой[2], впоследствии оказавшегося рибонуклеазой.
Нобелевская премия по химии в 2006 году была присуждена Роджеру Корнбергу за получение точных изображений молекул РНК-полимеразы в различные моменты процесса транскрипции.[3]
 Электронная микрофотография нитей ДНК, обвешанных сотнями молекул РНК-полимеразы, слишком маленьких для такого разрешения. Каждая РНК-полимераза транскрибирует нить РНК, которая видна на фотографии как ответвление от ДНК. Отметкой «Begin» указан 5′-конец ДНК, с которого РНК-полимераза начинает транскрипцию; «End» — 3′-конец, у которого транскрипция более длинных молекул РНК завершается.
Электронная микрофотография нитей ДНК, обвешанных сотнями молекул РНК-полимеразы, слишком маленьких для такого разрешения. Каждая РНК-полимераза транскрибирует нить РНК, которая видна на фотографии как ответвление от ДНК. Отметкой «Begin» указан 5′-конец ДНК, с которого РНК-полимераза начинает транскрипцию; «End» — 3′-конец, у которого транскрипция более длинных молекул РНК завершается.Управление процессом транскрипции генов позволяет контролировать экспрессию генов и таким образом позволяет клетке адаптироваться к изменяющимся условиям внешней среды, поддерживать метаболические процессы на должном уровне, а также выполнять специфические функции, необходимые для существования организма. Неудивительно, что действие РНК-полимеразы очень сложно и зависит от множества факторов (так, у Escherichia coli идентифицировано более 100 факторов, тем или иным способом влияющих на РНК-полимеразу[4]).
РНК-полимераза начинает транскрипцию с особых участков ДНК, называемых промоторами и производит цепочку РНК, комплементарную соответствующей части нити ДНК.
Процесс наращивания молекулы РНК нуклеотидами называется элонгацией. В эукариотических клетках РНК-полимераза может собирать цепочки из более 2,4 млн элементов (например, такую длину имеет полный ген белка дистрофина).
РНК-полимераза завершает формирование цепочки РНК, когда встречает в ДНК специфическую последовательность, называемую терминатором.
РНК-полимераза производит следующие разновидности РНК:
- Матричная РНК (мРНК) — шаблон для синтеза белков в рибосомах.
- Некодирующая РНК или «РНК-ген» — большой класс генов, кодирующих РНК, на которых не может быть построено белка. Самые известные представители этого класса — транспортная РНК (тРНК) и рибосомная РНК (рРНК), сами участвующие в процессе синтеза белка. Однако начиная с поздних 90-х годов XX столетия было обнаружено много других РНК-генов. Это дало возможность предположить, что РНК-гены играют более значительную роль в клетке, чем было принято считать раньше.
РНК-полимераза осуществляет синтез с нуля. Это возможно вследствие того, что взаимодействие начального нуклеотида гена и РНК-полимеразы позволяет ей закрепиться на цепочке и обрабатывать следующие нуклеотиды. Это отчасти объясняет, почему РНК-полимераза обычно начинает транксрипцию с АТФ, за которым следует ГТФ, УТФ и затем ЦТФ. В отличие от ДНК-полимеразы РНК-полимераза обладает также геликазным действием.
Связывание и инициирование транскрипции[править | править код]
Схема инициализации транскрипцииВ связывании РНК-полимеразы участвует α-субъединица, распознающая элемент ДНК, предшествующий гену (-40…-70 шагов), и σ-фактор, распознающий участок −10…-35. Существует большое количество σ-факторов, контролирующих экспрессию генов. Например: σ70, который синтезируется в нормальных условиях и позволяет РНК-полимеразе связываться с генами, отвечающими за метаболические процессы клетки; или σ32, блокирующий связывание РНК-полимеразы с генами белков теплового шока.
После связывания с ДНК структура РНК-полимеразы превращается из закрытой в открытую. Это превращение включает в себя разделение моноспиралей ДНК с образованием раскрученного участка длиной около 13 шагов. Рибонуклеотиды затем собираются в цепочку в соответствии с базовой нитью ДНК, используемой в качестве шаблона. Суперскрученность молекул ДНК играет существенную роль в деятельности РНК-полимеразы: поскольку участок ДНК перед РНК-полимеразой раскручен, в нем существуют положительные компенсационные супервитки. Участки ДНК позади РНК-полимеразы снова закручиваются и в них присутствуют отрицательные супервитки.
Элонгация[править | править код]
Во время элонгационной фазы транскрипции происходит добавление рибонуклеотидов к цепи и переход от структуры РНК-полимеразного комплекса от открытой к транскрипционной. По мере сборки молекулы РНК участок ДНК перед РНК-полимеразой раскручивается далее, и 13-парный открытый комплекс превращается в 17-парный транскрипционный комплекс. В этот момент промотор (участок ДНК −10…-35 шагов) завершается, и σ-фактор отделяется от РНК-полимеразы. Это позволяет остальному РНК-полимеразному комплексу начать движение вперед, так как σ-фактор удерживал его на месте.
17-парный транскрипционный комплекс содержит гибрид ДНК и РНК, содержащий 8 пар оснований — 8-шаговый участок РНК, соединенный с шаблонной цепью ДНК. По мере выполнения транскрипции рибонуклеотиды добавляются к 3′-концу собираемой РНК, и РНК-полимеразный комплекс движется по цепи ДНК. Хотя в РНК-полимеразе не обнаружено свойств, характерных для 3′-экзонуклеазы, аналогичных проверочной деятельности ДНК-полимеразы, есть свидетельства того, что РНК-полимераза останавливается и корректирует ошибки в случаях ошибочного формирования пар оснований ДНК-РНК.
Добавление рибонуклеотидов к РНК обладает механизмом, очень близким к полимеризации ДНК. Считается, что ДНК- и РНК-полимеразы могут быть эволюционно связаны. Аспарагиновые остатки в РНК-полимеразе связываются с ионами Mg2+, которые, в свою очередь, осуществляют выравнивание фосфатных групп рибонуклеотидов: первый Mg2+ удерживает α-фосфат нуклеотидтрифосфата, подлежащего добавлению в цепочку. Это позволяет осуществить связывание нуклеотида с 3′ OH-группой конца собираемой цепочки и таким образом добавить НТФ в цепочку. Второй Mg2+ удерживает пирофосфат НТФ. Общее уравнение реакции таким образом имеет вид:
(НМФ)n + НТФ —> (НМФ)n+1 + ПФi
Терминация[править | править код]
Терминация транскрипции РНК может быть ρ-независимой либо ρ-зависимой.
ρ-независимая терминация осуществляется без помощи ρ-фактора. Транскрипция палиндромного участка ДНК приводит к формированию шпильки из РНК, зацикленной и связанной с самой собой. Эта шпилька богата гуанином и цитозином, что делает её более стабильной, нежели гибрид ДНК-РНК. В результате 8-парный гибрид ДНК-РНК в транскрипционном комплексе сокращается до 4-парного. В случае если эти 4 последние пары оснований составлены слабыми аденином и уридином, молекула РНК отделяется.[5]
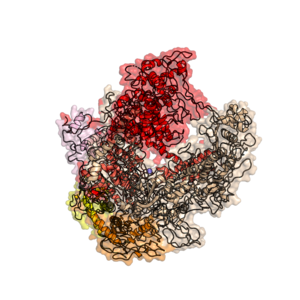 Структура бактериальной РНК-полимеразы из Thermus aquaticus, PDB ID 1HQM [6]. Покрашены субъединицы: α1 – оранжевый, α2 – желтый, β – бежевый , β’ – красный, ω – розовый.
Структура бактериальной РНК-полимеразы из Thermus aquaticus, PDB ID 1HQM [6]. Покрашены субъединицы: α1 – оранжевый, α2 – желтый, β – бежевый , β’ – красный, ω – розовый.У бактерий один и тот же фермент катализирует синтез трёх типов РНК: мРНК, рРНК и тРНК.
РНК-полимераза — достаточно большая молекула. Основной фермент содержит 5 субъединиц (~400 кДа):
- α2: две α-субъединицы связывают остальные элементы фермента и распознают регулирующие факторы. Каждая субъединица состоит из двух доменов: αСКД (С-концевой домен) связывает первый элемент промотора, и αNКД (N-концевой домен) связывается с остальными компонентами полимеразы.
- β: эта субъединица обладает собственно полимеразным действием, катализируя синтез РНК. Она осуществляет инициацию процесса и управляет элонгацией.
- β’: неспецифически связывается с ДНК.
- ω: восстанавливает денатурированную РНК-полимеразу обратно в дееспособную форму in vitro. Также обнаружено её защитное/шаперонное действие на β’-субъединицу у Mycobacterium smegmatis.
Для связывания с промоторными областями ДНК, основной фермент нуждается в еще одной субъединице — сигма (σ). Сигма-фактор значительно снижает сродство РНК-полимеразы к неспецифичным областям ДНК, и в то же время повышает её чувствительность к определенным промоторам, в зависимости от своей структуры. С его помощью транскрипция начинается с нужного участка ДНК.
Полный голоэнзим таким образом состоит из 6 субъединиц: α2ββ’σω (~480 кДа). В структуре РНК-полимеразы присутствует канавка длиной 55 Å (5,5 нм) и шириной 25 Å (2,5 нм). Именно в эту канавку помещается двойная спираль ДНК, имеющая ширину 20 Å (2 нм). На длине канавки укладывается 16 нуклеотидов.
Молекулы РНК-полимеразы не растворены в цитоплазме. Когда РНК-полимераза не используется, она связывается с неспецифичными областями ДНК в ожидании открытия активного промотора.
Транскрипционные кофакторы[править | править код]
Существуют белки, связывающиеся с РНК-полимеразой и влияющие на её поведение. Например greA и greB из E. coli усиливают способность РНК-полимеразы расщеплять шаблон РНК у растущего конца цепи. Такое расщепление может «спасти» застрявшую молекулу РНК-полимеразы, а также, вероятно, участвует в устранении ошибок сборки цепи РНК.
Отдельный кофактор Mfd задействован в транскрипционном восстановлении ДНК. Во время этого процесса РНК-полимераза обнаруживает поврежденные участки ДНК и привлекает другие ферменты для её восстановления.
Многие другие кофакторы обладают регулирующим влиянием, заставляя РНК-полимеразу экспрессировать или не экспрессировать определенные гены.
РНК-полимераза в эукариотических клетках[править | править код]
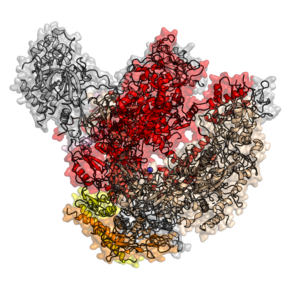 Структура эукариотической РНК-полимеразы II из Saccharomyces cerevisiae, PDB ID 1WCM [7]. Покрашены субъединицы, гомологичные субъединицам бактериальной полимеразы: RPB3 – оранжевый , RPB11 – желтый , RPB2 – бежевый, RPB1 – красный, RPB6 – розовый, остальные 7 субъединиц покрашены серым.
Структура эукариотической РНК-полимеразы II из Saccharomyces cerevisiae, PDB ID 1WCM [7]. Покрашены субъединицы, гомологичные субъединицам бактериальной полимеразы: RPB3 – оранжевый , RPB11 – желтый , RPB2 – бежевый, RPB1 – красный, RPB6 – розовый, остальные 7 субъединиц покрашены серым.Эукариоты обладают различными типами РНК-полимераз, классифицируемыми по типам РНК, которые они производят:
- РНК-полимераза I, синтезирующая 45S-предшественника рРНК, превращающуюся затем в рРНК 28S, 18S и 5,8S, которые уже образуют главные РНК-секции рибосомы.[8]
- РНК-полимераза II, производящая предшественников для мРНК, а также для большинства мяРНК и миРНК.[9] Это наиболее хорошо изученный тип РНК-полимеразы. Ввиду того, что транскрипция должна происходить под строгим контролем, РНК-полимеразе II для связывания с промоторами требуется целый набор факторов транскрипции.
- РНК-полимераза III, синтезирующая тРНК, 5S рРНК и другие малые РНК, присутствующее в ядре и цитозоле.[10]
Существуют также и другие типы РНК-полимеразы, используемые в митохондриях и хлоропластах. Молекулярная масса этих ферментов составляет величину порядка 500 000. Они различаются по чувствительности к альфа-аманитину. РНК-полимераза I нечувствительна к нему, РНК-полимераза III умеренно чувствительна, а РНК-полимераза II сильно ингибируется им.[11]
Археи используют один вид РНК-полимеразы, который тем не менее очень похож на три основных типа РНК-полимераз у эукариот. Некоторые ученые предполагают, что архейная РНК-полимераза в определенном приближении может являться эволюционным предком специализированных эукариотических полимераз.[12]
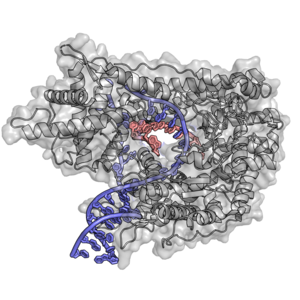 Структура РНК-полимеразы бактериофага T7 с фрагментами ДНК и РНК , PDB ID 1MSW [13]. Белок покрашен серым, ДНК синим, РНК персиковым.
Структура РНК-полимеразы бактериофага T7 с фрагментами ДНК и РНК , PDB ID 1MSW [13]. Белок покрашен серым, ДНК синим, РНК персиковым.Многие вирусы содержат РНК-полимеразу. Пожалуй, наиболее хорошо изученная вирусная РНК-полимераза имеется у бактериофага Т7. Эта РНК-полимераза, состоящая из одной субъединицы, похожа на митохондриальную и хлоропластную, а также на ДНК-полимеразу.[14] Считается, что большинство вирусных полимераз произошли от ДНК-полимеразы, а не от сложных многокомпонентных РНК-полимераз.
Вирусные полимеразы очень многочисленны. Многие из них могут использовать в качестве шаблона РНК, а не ДНК, как, например, у вирусов с двуцепочечной РНК или с одноцепочечной РНК негативной полярности. Некоторые вирусы с одноцепочечной РНК позитивной полярности также содержат РНК-зависимые РНК-полимеразы.[15]
C-концевой домен РНК-полимеразы[править | править код]
Инициирование транскрипции[править | править код]
Домен, расположенный на углекислом конце РНК-полимеразы II осуществляет инициирование транскрипции ДНК. C-концевой домен обычно состоит из порядка 52 повторений последовательности Tyr-Ser-Pro-Thr-Ser-Pro-Ser [16]. Фактор транскрипции TFIIH, являющийся киназой, гиперфосфорилирует C-концевой домен РНК-полимеразы, тем самым заставляя полимеразный комплекс начать движение от места инициирования транскрипции.
5′-кэпирование[править | править код]
С-концевой домен также является местом связывания комплекса кэпирования. У эукариот после синтеза 5′-конца мРНК фосфатаза концевой фосфат с 5′-конца полирибонуклеотида фермент гуанозинтрансфераза присоединяет к нему гуанозинмонофосфат. При этом образуется 5′,5′-трифосфатная связь. Кэпирующий комплекс затем диссоциирует от мРНК, 5′-кэп из ГТФ связывается с кэп-связывающим комплексом, C-концевого домена РНК-полимеразы. 5′-кэп в структуре мРНК эукариот имеет большое значение для связывания молекул мРНК с рибосомами, а также предотвращает деградацию РНК.
Сплайсосома[править | править код]
С-концевой домен РНК-полимеразы также является областью связывания со сплайсосомными факторами, участвующими в процессе сплайсинга РНК. Эти факторы способствуют осуществлению сплайсинга и удалению интронов в процессе транскрипции РНК.
Мутация в C-концевом домене[править | править код]
Был проведен ряд исследований поведения РНК-полимеразы при удалении определенных аминокислот из её C-концевого домена. Показано, что мутации усечения C-концевого домена РНК-полимеразы II влияют на её способность начинать транскрипцию набора генов in vivo, снижая чувствительность к активационным последовательностям этих генов.
РНК-полимераза может быть выделена следующими способами:
А также комбинациями вышеуказанных методов.
- ↑ Jerard Hurwitz. The Discovery of RNA Polymerase (англ.) // Journal of Biological Chemistry : journal. — 2005. — December (vol. 280, no. 52). — P. 42477—42485. — DOI:10.1074/jbc.X500006200. — PMID 16230341.
- ↑ Nobel Prize 1959
- ↑ Nobel Prize in Chemistry 2006
- ↑ Akira Ishihama. Functional modulation of Escherichia coli RNA polymerase (англ.) : journal. — 2000. — Vol. 54. — P. 499—518. — PMID 11018136.
- ↑ Farnham PJ; Platt T. Rho-independent termination: dyad symmetry in DNA causes RNA polymerase to pause during transcription in vitro (англ.) // Nucleic Acids Res. (англ.)русск. : journal. — 1981. — February (vol. 9, no. 3). — P. 563—577. — PMID 7012794.
- ↑ Minakhin L., Bhagat S., Brunning A., Campbell E. A., Darst S. A., Ebright R. H., Severinov K. Bacterial RNA polymerase subunit omega and eukaryotic RNA polymerase subunit RPB6 are sequence, structural, and functional homologs and promote RNA polymerase assembly (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2001. — 30 January (vol. 98, no. 3). — P. 892—897. — DOI:10.1073/pnas.98.3.892. — PMID 11158566.
- ↑ Armache K. J., Mitterweger S., Meinhart A., Cramer P. Structures of complete RNA polymerase II and its subcomplex, Rpb4/7 (англ.) // J Biol Chem : journal. — 2005. — 25 February (vol. 280, no. 8). — P. 7131—7134. — DOI:10.1074/jbc.M413038200. — PMID 15591044.
- ↑ Grummt I. Regulation of mammalian ribosomal gene transcription by RNA polymerase I. (англ.) // Prog Nucleic Acid Res Mol Biol. : journal. — 1999. — Vol. 62. — P. 109—154. — PMID 9932453.
- ↑ Lee Y; Kim M; Han J; Yeom KH; Lee S; Baek SH; Kim VN. Гены микроРНК, транскрибируемые РНК-полимеразой II (англ.) // EMBO J. (англ.)русск. : journal. — 2004. — October (vol. 23, no. 20). — P. 4051—4060. — PMID 15372072.
- ↑ Willis IM. RNA polymerase III. Genes, factors and transcriptional specificity (англ.) // Eur J Biochem. : journal. — 1993. — February (vol. 212, no. 1). — P. 1—11. — PMID 8444147.
- ↑ РНК-полимеразы: общие сведения (неопр.). Дата обращения 20 февраля 2011. Архивировано 16 февраля 2012 года.
- ↑ Langer D., Hain J., Thuriaux P., Zillig W. Transcription in archaea: similarity to that in eucarya. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1995. — Vol. 92, no. 13. — P. 5768–5772. — PMID 7597027. [исправить]
- ↑ Yin Y. W., Steitz T. A. Structural basis for the transition from initiation to elongation transcription in T7 RNA polymerase (англ.) // Science : journal. — 2002. — 15 October (vol. 298, no. 5597). — P. 1387—1395. — DOI:10.1126/science.1077464. — PMID 12242451.
- ↑ Hedtke B., Börner T., Weihe A. Mitochondrial and chloroplast phage-type RNA polymerases in Arabidopsis. (англ.) // Science (New York, N.Y.). — 1997. — Vol. 277, no. 5327. — P. 809—811. — PMID 9242608. [исправить]
- ↑ Ahlquist P. RNA-dependent RNA polymerases, viruses, and RNA silencing. (англ.) // Science (New York, N.Y.). — 2002. — Vol. 296, no. 5571. — P. 1270—1273. — DOI:10.1126/science.1069132. — PMID 12016304. [исправить]
- ↑ Anton Meinhart1; Patrick Cramer. Recognition of RNA polymerase II carboxy-terminal domain by 3′-RNA-processing factors (англ.) // Nature : journal. — 2004. — July (vol. 430, no. 6996). — P. 223—226. — DOI:10.1038/nature02679. — PMID 15241417.
- ↑ Kelly JL; Lehman IR. Yeast mitochondrial RNA polymerase. Purification and properties of the catalytic subunit. (англ.) // J Biol Chem. : journal. — 1986. — August (vol. 261, no. 22). — P. 10340—10347. — PMID 3525543.
- ↑ Honda A et al. Purification and molecular structure of RNA polymerase from influenza virus A/PR8. (англ.) // J Biochem (Tokyo) (англ.)русск. : journal. — 1990. — April (vol. 107, no. 4). — P. 624—628. — PMID 2358436.
- ↑ Hager D. A., Jin D. J., Burgess R. R. Use of Mono Q high-resolution ion-exchange chromatography to obtain highly pure and active Escherichia coli RNA polymerase. (англ.) // Biochemistry. — 1990. — Vol. 29, no. 34. — P. 7890—7894. — PMID 2261443. [исправить]
- Lehninger Principles of Biochemistry, 4th edition, David L. Nelson & Michael M. Cox
Гипотеза мира РНК — Википедия
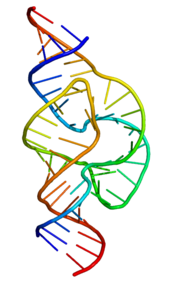
Мир РНК — гипотетический этап возникновения жизни на Земле, когда как функцию хранения генетической информации, так и катализ химических реакций выполняли ансамбли молекул рибонуклеиновых кислот. Впоследствии из их ассоциаций возникла современная ДНК-РНК-белковая жизнь, обособленная мембраной от внешней среды. Идея мира РНК была впервые высказана Карлом Вёзе в 1968 году, позже развита Лесли Орджелом и окончательно сформулирована Уолтером Гильбертом в 1986 году.
В XXI веке гипотеза находит всё больше подтверждений.
В живых организмах практически все процессы происходят в основном благодаря ферментам белковой природы. Белки, однако, не могут самореплицироваться и синтезируются в клетке de novo на основании информации, заложенной в ДНК. Но и удвоение ДНК происходит только благодаря участию белков и РНК. Образуется замкнутый круг, из-за которого в рамках теории самозарождения жизни приходилось признать необходимость не только абиогенного синтеза обоих классов молекул, но и спонтанного возникновения сложной системы их взаимосвязи.[источник не указан 31 день]
В начале 1980-х годов в лаборатории Т. Чека и С. Олтмана в США была открыта каталитическая способность РНК. По аналогии с ферментами (англ. enzyme) РНК-катализаторы были названы рибозимами, за их открытие Томасу Чеку в 1989 году была присуждена Нобелевская премия по химии. Более того, оказалось, что активный центр рибосом содержит большое количество рРНК. Также РНК способны создавать двойную цепочку и самореплицироваться[1].
Таким образом, РНК могли существовать полностью автономно, катализируя «метаболические» реакции, например, синтеза новых рибонуклеотидов и самовоспроизводясь, сохраняя из «поколения» в «поколение» каталитические свойства. Накопление случайных мутаций привело к появлению РНК, катализирующих синтез определённых белков, являющихся более эффективным катализатором, в связи с чем эти мутации закреплялись в ходе естественного отбора. С другой стороны возникли специализированные хранилища генетической информации — ДНК. РНК сохранилась между ними как посредник.[источник не указан 31 день]
Следы мира РНК остались в современных живых клетках, причём РНК участвует в критически важных процессах жизнедеятельности клетки:
- Основной носитель энергии в клетках — АТФ — это рибонуклеотид, а не дезоксирибонуклеотид.
- Биосинтез белка почти целиком осуществляется с помощью различных видов РНК:
- Для репликации ДНК также критически важна РНК:
- В процессе обратной транскрипции информация из РНК переписывается в ДНК.
- В процессе созревания РНК используются различные РНК, не кодирующие белки, включая малые ядерные РНК, малые ядрышковые РНК.
Кроме того, многие вирусы хранят свой генетический материал в виде РНК и поставляют в заражённую клетку РНК-зависимую РНК-полимеразу для его репликации.
Абиогенный синтез РНК из более простых соединений пока не продемонстрирован экспериментально в полной мере. В 1975 году Манфред Сампер (англ. Manfred Sumper) и Рудигер Льюс (англ. Rudiger Luce) в лаборатории Эйгена продемонстрировали, что в смеси, вообще не содержащей РНК, а содержащей только нуклеотиды и Qβ-репликазу, может при определённых условиях спонтанно возникнуть самореплицирующаяся РНК[2].
В 2009 году группе учёных из университета Манчестера под руководством Джона Сазерленда (англ. John Sutherland) удалось продемонстрировать возможность синтеза уридина и цитидина с высокой эффективностью и степенью закрепления результата реакции (а также с возможностью накопления конечных продуктов) в условиях ранней Земли[3][4]. В то же время, хотя абиогенный синтез пуриновых оснований продемонстрирован достаточно давно[5], синтез аденозина и гуанозина в условиях ранней Земли был продемонстрирован лишь в малоэффективном варианте[4].
В 2016 году опубликовано исследование, показавшее возможность синтеза всех 4 рибонуклеотидов из формамида[6].
В 2017 году была показана возможность самосборки уридина из рибозы, урацила и фосфорной кислоты[7].
В 2019 году рибоза была обнаружена в метеоритах среди сахаров внеземного происхождения, что обосновывает предположение о её доступности на древней Земле. Наиболее вероятный путь синтеза таких сахаров — реакция Бутлерова. При этом в тех же метеоритах отсутствует дезоксирибоза, что свидетельствует о более вероятном синтезе РНК, чем ДНК[8].
Способность молекул РНК к эволюции была наглядно продемонстрирована в ряде экспериментов. Ещё до открытия каталитической активности РНК такие эксперименты проводили Лесли Орджел с коллегами в Калифорнии. Они добавляли к пробирке с РНК яд — бромид этидия, ингибирующий синтез РНК. Сначала темп синтеза был замедлен ядом, но примерно после девяти «пробирочных поколений» эволюции в процессе естественного отбора вывелась новая порода РНК, стойкая к яду. Путём последовательного удвоения доз яда была выведена порода РНК, стойкая к очень высоким его концентрациям. Всего в эксперименте сменилось 100 пробирочных поколений (и намного больше поколений РНК, так как поколения сменялись и внутри каждой пробирки). Хотя в этом эксперименте РНК-репликаза добавлялась в раствор самими экспериментаторами, Орджел обнаружил, что РНК способны и к спонтанному самокопированию, без добавления фермента, правда, намного медленнее.
Дополнительный эксперимент был позже проведён в лаборатории немецкой школы Манфреда Ейгена. Он обнаружил спонтанное самозарождение молекулы РНК в пробирке с субстратом и РНК-репликазой. Она была создана постепенно нарастающей эволюцией.[9]
После открытия каталитической активности РНК (рибозимов) их эволюция в автоматизированном устройстве под управлением компьютера наблюдалась в экспериментах Брайана Пегеля и Джеральда Джойса из Исследовательского института имени Скриппса в Калифорнии в 2008 году. Фактором, играющим роль давления отбора, являлась ограниченность субстрата, куда входили олигонуклеотиды, которые рибозим распознавал и присоединял к себе, и нуклеотиды для синтеза РНК и ДНК. При построении копий иногда случались дефекты — мутации — влияющие на их каталитическую активность (для ускорения процесса несколько раз смесь подвергалась мутированию с помощью полимеразной цепной реакции с использованием «неточных» полимераз). По этому признаку и происходил отбор молекул: наиболее быстро копирующиеся молекулы быстро начинали доминировать в среде. Затем 90 % смеси удалялось, а вместо этого добавлялась свежая смесь с субстратом и ферментами, и цикл повторялся снова. За 3 суток каталитическая активность молекул за счёт всего 11 мутаций увеличилась в 90 раз.[10][11]
Эти эксперименты доказывают, что первым молекулам РНК не нужно было обладать достаточно хорошими каталитическими свойствами. Они развились потом в ходе эволюции под действием естественного отбора.
В 2009 году канадские биохимики из Монреальского университета К. Боков и С. Штейнберг, изучив основную составляющую рибосомы бактерии Escherichia coli, молекулу 23S-рРНК, показали, каким образом из относительно небольших и простых рибозимов мог развиться механизм белкового синтеза. Молекула была подразделена на 60 относительно самостоятельных структурных блоков, основным из которых является каталитический центр (пептидил-трансферазный центр, PTC, peptidyl-transferase centre), ответственный за транспептидацию (образование пептидной связи). Было показано, что все эти блоки можно последовательно отсоединять от молекулы без разрушения её оставшейся части до тех пор, пока не останется один лишь транспептидационный центр. При этом он сохраняет способность катализировать транспептидацию. Если каждую связь между блоками молекулы представить в виде стрелки, направленной от того блока, который при отрыве не разрушается, к тому блоку, который разрушается, то такие стрелки не образуют ни одного замкнутого кольца. Если бы направление связей было случайным, вероятность этого составляла бы менее одной миллиардной. Следовательно, такой характер связей отражает последовательность постепенного добавления блоков в процессе эволюции молекулы, который исследователям удалось детально реконструировать. Таким образом, у истоков жизни мог стоять сравнительно простой рибозим — PTC-центр молекулы 23S-рРНК, к которому затем добавлялись новые блоки, совершенствуя процесс синтеза белка. Сам PTC состоит из двух симметричных лопастей, каждая из которых удерживает CCA’-хвостик одной молекулы тРНК. Предполагается, что такая структура возникла в результате дупликации (удвоения) одной исходной лопасти. Методом искусственной эволюции были получены функциональные РНК (рибозимы), способные катализировать транспептидацию. Структура этих искусственно выведенных рибозимов очень близка к структуре той проторибосомы, которую «вычислили» авторы.[12][13]
О том, как выглядели самовоспроизводящиеся РНК системы, есть разные предположения. Чаще всего постулируется необходимость агрегирующих РНК мембран или размещения РНК на поверхности минералов и в поровом пространстве рыхлых пород. В 1990-е годы А. Б. Четвериным с сотрудниками была показана способность РНК формировать молекулярные колонии на гелях и твёрдых субстратах при создании им условий для репликации. Происходил свободный обмен молекулами, которые при столкновении могли обмениваться участками, что показано экспериментально. Вся совокупность колоний в связи с этим быстро эволюционировала[14].
После возникновения белкового синтеза колонии, умеющие создавать ферменты, развивались успешнее. Ещё более успешными стали колонии, сформировавшие более надёжный механизм хранения информации в ДНК и, наконец, отделившиеся от внешнего мира липидной мембраной, препятствующей рассеиванию своих молекул.
Пре-биотические модели, при которых создаются нуклеотиды, несовместимы с условиями, необходимыми для создания сахаров (из за большой концентрации формальдегида). Так что они должны быть синтезированы в разных местах, а затем перенесены в какое-то одно место. Однако, они не реагируют в воде. Безводные реакции легко связывают пурины с сахарами, но только 8 % из них соединяют правильный углеродный атом на сахаре с правильным атомом азота на основе. Пиримидины, однако, не будут реагировать с рибозой, даже в безводных условиях.
Кроме того, необходимые для синтеза фосфаты в природе встречаются крайне редко, так как они легко выпадают в осадок. При введении фосфата, последний должен быстро соединяться с правильной гидроксильной группой нуклеотида.
Чтобы нуклеотиды могли сформировать РНК, они сами должны быть активизированы. Активизированыe пуриновые нуклеотиды формируют маленькие цепочки на существующем шаблоне пиримидиновых РНК, но этот процесс не идет наоборот потому что пиримидиновые нуклеотиды не полимеризуются так легко.
Дополнительно, вся рибоза должна быть одного стерео-изомерного типа, потому что любой нуклеотид неправильной хиральности действует как терминатор цепочки.
Согласно критиками гипотезы мира РНК (например А.Каинс-Смит AG Cairns-Smith), процесс строительства нуклеиновых кислот требовал бы синхронизации возникновения благоприятных условий и событий. Более того эта синхронизация должна быть достаточно протяженной во времени (в течение миллионов лет) для создания достаточного количества необходимых веществ.
Несмотря на это, в 2009 году был синтезирован 2 пиримидиновые рибонуклеотиды без формирования промежуточных звеньев отдельно рибозы и основы, формируя взамен другие промежуточные продукты (арабинозы амино-оксалозны и ангидриднуклеозиды) . В 2016 году было показано, что можно синтезировать остальные нуклеотидов-пуринов: аденин и гуанин и соединить их с рибозой. Однако пока не установлено, каким образом может пойти присоединения фосфатного остатка.
Биохимик Р. Шапиро критикует гипотезу РНК-мира, считая, что вероятность спонтанного возникновения РНК, обладающей каталитическими свойствами, очень низка. Взамен гипотезы «вначале была РНК», он предлагает гипотезу «вначале был метаболизм», то есть возникновение комплексов химических реакций — аналогов метаболических циклов — с участием низкомолекулярных соединений, протекающих внутри компартментов — пространственно ограниченных самопроизвольно образовавшимися мембранами или иными границами раздела фаз — областей. Эта концепция близка к коацерватной гипотезе абиогенеза, предложенной А. И. Опариным в 1924 году[15].
Другой гипотезой абиогенного синтеза РНК, призванной решить проблему низкой оценочной вероятности синтеза РНК, является гипотеза мира полиароматических углеводородов, предложенная в 2004 году и предполагающая синтез молекул РНК на основе стека из полиароматических колец.
Фактически, обе гипотезы «пре-РНК миров» не отвергают гипотезу мира РНК, а модифицируют её, постулируя первоначальный синтез реплицирующихся макромолекул РНК в первичных метаболических компартментах, либо на поверхности ассоциатов, отодвигая «мир РНК» на вторую стадию абиогенеза.
Академик РАН А. С. Спирин считает, что РНК-мир не мог появиться и существовать на Земле, и рассматривает вариант внеземного (в первую очередь на кометах) происхождения и эволюции РНК-мира[16].
- ↑ Johnston, W. RNA-catalyzed RNA polymerization : accurate and general RNA-templated primer extension : [англ.] / W. Johnston, P. Unrau, M. Lawrence … [] // Science : j. — 2001. — Vol. 292, no. 5520. — P. 1319—1325. — DOI:10.1126/science.1060786. — PMID 11358999.
- ↑ Sumper, M. Evidence for De Novo Production of Self-Replicating and Environmentally Adapted RNA Structures by Bacteriophage Qβ Replicase : [англ.] / M. Sumper, R. Luce // Proceedings of the National Academy of Science USA. — 1975. — Vol. 72, no. 1 (January). — P. 162–166. — DOI:10.1073/pnas.72.1.162. — PMID 1054493. — PMC 432262.
- ↑ Powner, M. W. Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions : [англ.] / M. W. Powner, B. Gerland, J. D. Sutherland // Nature. — 2009. — Vol. 459, no. 7244 (14 May). — P. 239–42. — DOI:10.1038/nature08013. — PMID 19444213.
- ↑ 1 2 Марков, Александр. Химики преодолели главное препятствие на пути к абиогенному синтезу РНК // Элементы : [сайт]. — 2009. — 18 мая.
- ↑ Yuasa, S. Abiotic synthesis of purines and other heterocyclic compounds by the action of electrical discharges : [англ.] / S. Yuasa, D. Flory, B. Basile … [] // Journal of Molecular Evolution (англ.)русск.. — 1984. — Vol. 21, no. 1. — P. 76—80. — ISSN 0022-2844. — DOI:10.1007/bf02100630. — PMID 6442361.
- ↑ Šponer, Judit E. Emergence of the First Catalytic Oligonucleotides in a Formamide‐Based Origin Scenario : [англ.] / Judit E. Šponer, Jiří Šponer, Olga Nováková … [] // Chemistry : J. — 2016. — Vol. 22, no. 11. — P. 3572–3586. — DOI:10.1002/chem.201503906. — PMID 26807661.
- ↑ Nam, I. Abiotic production of sugar phosphates and uridine ribonucleoside in aqueous microdroplets : [англ.] / I. Nam, J. Lee, H. G. Nam … [] // Proceedings of the National Academy of Science USA. — 2017. — Vol. 114, no. 47 (21 November). — P. 12396–12400. — DOI:10.1073/pnas.1714896114. — PMID 29078402. — PMC 5703324.
- ↑ Власов, Кирилл. Сахар из Мурчисонского метеорита имеет внеземное происхождение // Элементы. — 2019. — 20 декабря. — Дата обращения: 21.12.2019.
- ↑ Ричард Докинз. Слепой часовщик. Глава 5 «Власть над прошлым и будущим».
- ↑ Элементы — новости науки: Эволюция под управлением компьютера
- ↑ Заметка «Эволюция по заказу» об экспериментальном изучении эволюции РНК
- ↑ Элементы — новости науки: Тайна происхождения рибосом разгадана?
- ↑ Марков, А. В. Гл. 1. Происхождение жизни // Рождение сложности : Эволюционная биология сегодня: неожиданные открытия и новые вопросы. — М. : Астрель : CORPUS, 2010. — С. 60. — 248 с. — (Элементы). — ISBN 978-5-17-084031-1.
- ↑ Chetverina H. V., Chetverin A. B. Cloning of RNA molecules in vitro (англ.) // Nucleic Acids Res. (англ.)русск. : journal. — 1993. — May (vol. 21, no. 10). — P. 2349—2353. — PMID 7685078.
- ↑ Шапиро Р. У истоков жизни // В мире науки (русское издание Scientific American), № 10, 2007. С.21—29
- ↑ А. С. Спирин Когда, где и в каких условиях мог возникнуть и эволюционировать мир РНК? Архивная копия от 5 сентября 2014 на Wayback Machine//Палеонтологический журнал. — № 5. — с.11-19
- Григорович С. Вначале была РНК? В поисках молекулы первожизни // Наука и жизнь, № 2 (2004)
- Крицкий М. С., Телегина Т. А. Коферменты и эволюция мира РНК // Успехи биологической химии. — 2004. — Т. 44. — С. 341—364. Архивировано 19 октября 2016 года.
- Спирин А. С. Рибонуклеиновые кислоты как центральное звено живой материи // Вестник РАН, том 73, № 2, с. 117—127 (2003)
- Спирин А. С. Биосинтез белков, мир РНК и происхождение жизни
- Чек Томас Р. РНК — фермент // В мире науки (русское издание Scientific American), 1987, № 1
- Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Эволюция клетки / Молекулярная биология клетки, в 3-х томах, 2-е издание, — М.: Мир, 1994.
Малые ядерные РНК — Википедия
Материал из Википедии — свободной энциклопедии
Малые ядерные РНК (мяРНК, snRNA) — класс РНК, которые встречаются в ядре эукариотических клеток. Они транскрибируются РНК-полимеразой II или РНК-полимеразой III и участвуют в важных процессах, таких как сплайсинг (удаление интронов из незрелой мРНК), регуляции факторов транскрипции (7SK РНК) или РНК-полимеразы (B2 РНК) и поддержании целостности теломер.
Малые ядерные РНК всегда ассоциированы со специфическими белками, комплексы мяРНК с белками называются малые ядерные рибонуклеопротеины (мяРНП). Малые ядерные РНК содержат большое число уридиновых нуклеотидов.
Важной группой мяРНК являются малые ядрышковые РНК (snoRNA), участвующие в процессинге рРНК, тРНК и собственно мяРНК.
Малые ядерные РНК, синтезированные РНК-полимеразой II, экспортируются в цитоплазму на некоторое время для дальнейшего созревания, после чего возвращаются обратно в ядро для выполнения своих функций, при этом кэп регулирует их транспорт в обоих направлениях. мяРНК экспортируются при участии транспортного белка Crm1, который, как и в случае с мРНК, связывает специфический субстрат через адаптерный белок PHAX (англ. phosphorylated adaptor for RNA export)[1]. PHAX присоединяется к мяРНК благодаря сродству к кэп-связывающему комплексу. В ходе формирования мяРНП в цитоплазме кэп-структура мяРНК подвергается двойному метилированию с образованием 2,2,7-триметилгуанозинового кэпа[2]. Другой транспортный фактор, снурпортин 1, узнаёт такой модифицированный кэп и обеспечивает транспорт мяРНП обратно в ядро[3]. Вероятно, что дополнительное метилирование кэпа также предотвращает повторный или случайный экспорт РНК из ядра и/или их возвращение в ядро после митоза.
- ↑ Ohno M., Segref A., Bachi A., Wilm M., Mattaj I. W. PHAX, a mediator of U snRNA nuclear export whose activity is regulated by phosphorylation (англ.) // Cell : journal. — Cell Press (англ.)русск., 2000. — Vol. 101, no. 2. — P. 187—198. — DOI:10.1016/S0092-8674(00)80829-6. — PMID 10786834.
- ↑ Cougot N., van Dijk E., Babajko S., Séraphin B. ‘Cap-tabolism’ (англ.) // Trends Biochem. Sci. (англ.)русск. : journal. — 2004. — Vol. 29, no. 8. — P. 436—444. — DOI:10.1016/j.tibs.2004.06.008. — PMID 15362228.
- ↑ Huber J., Cronshagen U., Kadokura M., Marshallsay C., Wada T., Sekine M., Lührmann R. Snurportin1, an m3G-cap-specific nuclear import receptor with a novel domain structure (англ.) // EMBO J. (англ.)русск. : journal. — 1998. — Vol. 17, no. 14. — P. 4114—4126. — DOI:10.1093/emboj/17.14.4114. — PMID 9670026.
Кольцевые РНК — Википедия
Кольцевы́е РНК (англ. Circular RNA, circRNA) — тип молекул РНК, концы которых замкнуты друг на друга с помощью ковалентной связи между концевыми нуклеотидами. Кольцевые РНК могут образовываться из интронов или в результате выпетливания различных участков созревающего транскрипта. Хотя кольцевые РНК обычно относят к числу некодирующих РНК, в настоящее время накапливаются свидетельства того, что они могут кодировать пептиды[1]. Конкретные функции кольцевых РНК до конца не изучены, но, вероятно, они задействованы в регуляции экспрессии генов. Кольцевых РНК особенно много в головном мозге, они свободно циркулируют в плазме крови. Возможно, в будущем кольцевые РНК будут использовать в качестве биомаркеров различных видов рака.
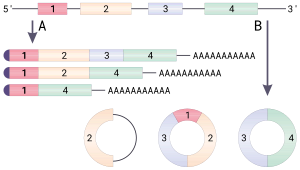 Схема биогенеза некоторых кольцевых РНК. А. Сплайсинг мРНК с образованием альтернативных сплайсинговых вариантов. Все мРНК имеют кэп и поли(А)-хвост. B. Образование кольцевой РНК по механизму бэксплайсинга
Схема биогенеза некоторых кольцевых РНК. А. Сплайсинг мРНК с образованием альтернативных сплайсинговых вариантов. Все мРНК имеют кэп и поли(А)-хвост. B. Образование кольцевой РНК по механизму бэксплайсингаТеоретически кольцевую РНК можно получить тремя разными способами. Во-первых, в ходе сплайсинга интроны удаляются из созревающего транскрипта не в виде линейного фрагмента, а в виде лассо. Если от этого лассо отрезать «хвост», то получится кольцевая РНК. Такие интронные кольцевые молекулы накапливаются преимущественно в ядре и обозначаются ciRNA (от англ. circular intronic long non-coding RNAs). Во-вторых, в созревающем транскрипте отдельные экзоны могут выпетливаться, и такие петли могут вырезаться сплайсосомой и ковалентно замыкаться в кольцо. Так образуются кольцевые РНК, состоящие только из одного экзона. Кольцевые РНК, которые состоят исключительно из экзонов — одного или нескольких, объединяют в группу ecircRNA (от англ. exonic circRNAs) и обычно находят в цитоплазме. В-третьих, выпетливаться может участок, содержащий несколько интронов и экзонов. При вырезании и замыкании сплайсосомой такой петли формируются кольцевые РНК, содержащие и экзоны, и интроны. Они локализуются преимущественно в ядре и обозначаются EIciRNA (от англ. exon-intron circRNAs). Эти молекулы могут продолжить сплайсироваться, и после удаления интронов из них получатся кольцевые РНК, состоящие из нескольких экзонов[2].
Процесс вырезания сплайсосомой выпетливающихся участков транскрипта называется бэксплайсингом (англ. backsplicing). Зачастую интроны, окружающие один экзон, содержат комплементарные друг другу инвертированные повторы[en], которые, образуя водородные связи, формируют «стебелёк» петли. Выпетливание может происходить при участии специальных белков: два мономера такого белка связываются с двумя концами будущей петли, димеризуются и сближают концы так, что сплайсосома может ковалентно сшить их. Пока известны три белка, регулирующих образование некоторых кольцевых РНК: Quaking (QKI), Muscleblind (Mbl/MBNL1—3) и Fusedinsarcoma (FUS[en]). Так, Muscleblind регулирует образование circRNA своего же гена, связываясь с особыми участками в интронах незрелого транскрипта. Кроме того, образование кольцевых РНК зависит от белков, которые связываются с незрелой мРНК в сайтах вырезания кольцевых РНК, делая их недоступными для сплайсосомы. Обобщая, можно сказать, что биогенез кольцевых РНК — это сложный процесс, регулируемый комбинацией многих факторов, в том числе расположением инвертированных повторов и взаимодействием с белками, которые опосредуют выпетливание или, напротив, делают бэксплайсинг невозможным[2].
Интересно, что у некоторых архей образование рРНК протекает через стадию кольцевой молекулы-предшественницы, которая далее нарезается на отдельные рРНК[3].
Уровень синтеза кольцевых РНК варьирует в зависимости от типа клеток. В среднем соответствующие кольцевые РНК выявляются для 5—20 % активных генов, и в отдельной клетке одновременно содержится 5000—25 000 circRNA. Однако на их долю приходится совсем небольшая часть транскриптома: за редким исключением circRNA составляют 5—10 % от количества линейных матричных РНК, синтезируемых с того же гена. С одного гена, как правило, транскрибируется несколько изоформ кольцевых РНК, причём чаще всего в состав circRNA входит второй экзон гена, а первый и последний экзоны в кольцевой форме почти никогда не остаются. Образование той или иной изоформы может регулироваться. Уровень синтеза кольцевых РНК в целом сильно меняется в ходе дифференцировки клеток, однако для его существенного изменения обычно требуется несколько дней или даже недель[2].
Лишённые свободных концов, кольцевые РНК не могут быть разрушены ферментами экзонуклеазами, которые разрушают многие транскрипты упорным отщеплением концевых нуклеотидов. В связи с этим средняя кольцевая РНК более стабильна, чем линейная мРНК: circRNA живёт 19—24 часа (иногда до 48 часов), что в 2—5 (до 10) раз превышает срок жизни линейных молекул. Существует несколько гипотез насчёт того, как разрушаются кольцевые РНК. Кольцевые РНК могут расщеплять эндонуклеазы, которые разрушают нуклеиновые кислоты не с концов, а вносят разрывы во внутренние части молекулы. Вероятно, в этом случае за разрушение отвечает комплекс, содержащий микроРНК, «наводящие» эндонуклеазы группы Argonaute на молекулы-мишени. В circRNA, подлежащих разрушению, некоторые остатки аденозина могут специфически метилироваться. Такие метилированные РНК распознаются особыми белками, переносящими их в места деградации рибонуклеиновых кислот — так называемые P-тельца[en]. В разрушении circRNA могут быть задействованы особые органеллы — аутофагосомы[en]*, среди прочего содержащие эндонуклеазы. Клетки могут выбрасывать излишние circRNA в кровь в составе внеклеточных везикул. Если для первого гипотетического пути разрушения кольцевых РНК есть некоторые экспериментальные подтверждения, то остальные модели ещё ожидают своей проверки опытом[2].
Описаны биологические эффекты как самих кольцевых РНК, так и процесса их образования. Кроме того, кольцевые РНК могут кодировать пептиды, которые тоже выполняют определённые клеточные функции. Хотя бэксплайсинг, приводящий к образованию circRNA, — событие в 100 раз более редкое, чем обычный линейный сплайсинг, вполне вероятно, что эти два процесса конкурируют друг с другом и взаимоподавляются. Возможно, именно подавление линейного сплайсинга в ходе формирования кольцевых РНК — основная клеточная функция этих молекул. Выпетливание участка незрелого транскрипта за счет комплементарного связывания инвертированных повторов в интронах само по себе может эффективно подавлять линейный сплайсинг. Кроме того, для протекания как бэксплайсинга, так и линейного сплайсинга необходимы одни и те же участки транскрипта; обычно они задействованы именно в линейном процессе, что в большинстве случаев подавляет бэксплайсинг. Действительно, показано, что с одного и того же гена кольцевые РНК и обычные линейные мРНК не синтезируются одновременно. Однако экспериментальные данные свидетельствуют о более сложной, чем обычное конкурентное подавление, связи между линейным и бэксплайсингом. Возможно, важную роль в том, какая РНК будет считываться с гена — мРНК или кольцевая, может играть скорость транскрипции. Так, альтернативный сплайсинг часто приводит к образованию лассо, содержащих интроны (то есть возможных предшественников кольцевых РНК), а это нередко происходит при ускорении транскрипции. Выбор между бэксплайсингом и линейным сплайсингом может быть основан и на более сложных механизмах. Предполагают, например, что кольцевая РНК, которая считывается с гена mbl, забирает на себя весь белковый продукт этого гена — Muscleblind. Известно, что этот белок необходим для образования линейных mbl-мРНК, поэтому, связываясь с ним и не давая ему функционировать, кольцевые mbl-РНК (circMbl) подавляют синтез своих линейных «собратьев». Не исключена и возможность комплементарного связывания кольцевых РНК с участками породивших их генов, то есть с ДНК[2].
Ряд экспериментов свидетельствует в пользу того, что EIciRNA (экзон-интронные) и ciRNA (интронные) влияют на транскрипцию собственных генов, стимулируя РНК-полимеразу II. Исследователям удалось осадить с помощью антител комплекс EIciRNA с РНК-полимеразой II, причём выяснилось, что для стимуляции полимеразы необходим ещё один компонент — малая ядерная РНК U1[en]. Возможно, при взаимодействии с EIciRNA U1 располагается таким образом, что стимулирует работу полимеразы. В то же время ciRNA, похоже, могут связываться непосредственно с хроматином в области «родительских» генов и повышать скорость их транскрипции. Удалось осадить, например, ciRNA под названием ci-ankrd52 в комплексе с активно работающей РНК-полимеразой II (активная форма фермента отличается особым фосфорилированием С-концевого домена). Поскольку ciRNA способны связываться и с «чужими» последовательностями ДНК, их роль в контроле экспрессии генов может быть значительной[2].
Для двух ecircRNA (экзонных, локализованных в цитоплазме) экспериментально показана способность влиять на синтез белка. Кольцевая РНК circANRIL нарушает работу комплекса белков, процессирующих рРНК, уменьшая тем самым количество функциональных рибосом и выход белка. В то же время circPABPN1 подавляет работу белка HuR[en], необходимого для трансляции ряда мРНК[2].
Кольцевые РНК могут служить структурной основой для сборки белковых комплексов и тем самым обеспечивать межбелковые взаимодействия. Например, благодаря circ-Foxo3 циклинзависимая киназа 2 (Cdk2) взаимодействует со своим ингибитором, p21, что приводит к остановке клеточного цикла. Кроме того, кольцевые РНК могут секвестрировать белки — ограничивать их перемещение к рабочим местам. Так, вышеупомянутая circ-Foxo3 может «запирать» в цитоплазме транскрипционный фактор E2F1 и некоторые другие белки[3].
Некоторые экзонные кольцевые РНК содержат сайты связывания негативных регуляторов экспрессии генов — микроРНК. В англоязычной литературе такие circRNA часто называют microRNA sponges — «губки, впитывающие микроРНК». Связываясь с ними, микроРНК уже не могут взаимодействовать с комплементарными мРНК-мишенями и мешать их трансляции. Например, кольцевая РНК CDR1as содержит 74 сайта связывания с микроРНК miR-7, а мышиная кольцевая РНК, считанная с гена Sry (важен для определения пола), — 16 сайтов связывания с miR-138. Стоит, однако, отметить, что лишь для немногих кольцевых РНК показана способность связываться с микроРНК, то есть это скорее исключение, чем правило. Интересно, что circRNA найдены у некоторых одноклеточных эукариот, у которых вообще нет микроРНК, а именно — у дрожжей Saccharomyces cerevisiae и малярийного плазмодия Plasmodium falciparum. Таким образом, связывание с микроРНК не может быть основной функцией кольцевых РНК[2].
Ряд кольцевых РНК играет важную роль в противовирусном иммунитете. Например, у кур, устойчивых к вирусу птичьего лейкоза[en], 12 circRNA образуются в бόльших количествах, чем у обычных кур. Многие из этих молекул связываются с микроРНК, регулирующими экспрессию генов, которые связаны с такими иммунными процессами, как активация В-лимфоцитов и презентация антигена. Любопытно, что иммунная система тоже влияет на синтез кольцевых РНК. Например, иммунные факторы NF90 и NF110 (сплайс-варианты гена ILF3[en]) стимулируют образование circRNA из созревающего транскрипта в ядре. В условиях же вирусной инфекции эти белки уходят в цитоплазму, где связываются с вирусными мРНК и тормозят жизненный цикл вируса; количество ядерной circRNA при этом снижается, что может модулировать экспрессию генов. Кольцевые РНК могут участвовать в подавлении инфекции и путём связывания вирусных или клеточных микроРНК, мешающих иммунному ответу[3].
Известно, что большинство событий бэксплайсинга затрагивает экзоны и происходит в РНК генов, кодирующих белки. Трансляция большинства мРНК начинается с распознавания рибосомой видоизменённого нуклеотида на 5′-конце мРНК, так называемого кэпа. У кольцевых РНК нет свободного 5′-конца, поэтому у них не может быть и кэпа. Однако некоторые клеточные и вирусные РНК могут транслироваться в отсутствие кэпа при участии особой последовательности — IRES. С кольцевыми РНК могло бы происходить то же самое[2][3].
И действительно, искусственные circRNA, содержащие IRES и кодирующие какой-нибудь пептид, удавалось транслировать. Однако показано, что большинство кольцевых РНК в живых клетках не связаны с рибосомами, поэтому вряд ли их трансляция носит массовый характер. Пока известны две кольцевые РНК, по которым, вероятно, синтезируются белки in vivo, — это circMbl и circZNF609. Стоит отметить, что эти молекулы образуются несколько нестандартно: в первом случае бэксплайсинг затрагивает первый экзон, который, как мы помним, обычно в состав кольцевых РНК не включается, а во втором в circRNA попадает фрагмент 5′-нетранслируемой области исходного транскрипта, который обладает свойствами IRES. Возможно, синтез белков по circRNA возможен только в особых условиях, например, при стрессе — тепловом шоке[en] или голодании[2].
Если предположить, что какая-то кольцевая РНК содержит открытую рамку считывания с числом нуклеотидов, кратным трём, то теоретически трансляция такой РНК может протекать по механизму катящегося кольца. Результатом такой трансляции была бы теоретически бесконечная цепочка повторяющихся блоков аминокислот, и рост её ограничивался бы процессивностью рибосом. Подобные случаи пока не известны для клеточных кольцевых РНК, однако нечто похожее происходит с вироидной кольцевой РНК, ассоциированной с вирусом жёлтой пятнистости риса[2].
Последние успехи в обнаружении кольцевых РНК связаны с усовершенствованиями технологии секвенирования РНК, такими как увеличение длины одиночных прочтений[en], улучшение алгоритмов сопоставления РНК с известными генами и расширение библиотек[en] РНК. Кольцевые РНК можно отличить от линейных с помощью биоинформатического подхода (по результатам секвенирования) или «мокрым» способом — с помощью экзонуклеаз. Как упоминалось выше, эти ферменты быстро расщепляют линейные РНК, но не трогают кольцевые. С помощью экзонуклеаз идентифицировали тысячи кольцевых РНК, но всё же большинство circRNA описали благодаря высокопроизводительному секвенированию с использованием специальных алгоритмов[4].
В настоящее время функционирует несколько баз данных, посвящённых кольцевым РНК, и онлайн-инструментов для работы с ними. В их числе[5]:
- Circ2Traits— содержит информацию о кольцевых РНК, связанных с заболеваниями человека;
- CircInteractome — онлайн-инструмент для определения сайтов связывания с микроРНК и белками в кольцевых РНК;
- CircRNADb— содержит детальную информацию о хорошо изученных кольцевых РНК;
- HumanViCe — хранилище последовательностей кольцевых РНК, которые могут связываться с клеточными или вирусными микроРНК в заражённых клетках.
Кольцевые РНК в разном количестве выявляются в плазме крови, причём в периферической крови их даже больше, чем в клетках органов. Причины этого неясны, особенно если учесть тот факт, что в 25-процентной сыворотке circRNA распадаются всего через 30 секунд (в клетке средняя кольцевая РНК существует 1—2 дня). Как бы то ни было, наличие и количество некоторых кольцевых РНК в плазме крови могут служить важным показателем здоровья организма. Иными словами, кольцевые РНК можно использовать в качестве биомаркеров для диагностики и определения стадии таких патологий, как коронарные заболевания сердца, различные виды рака (в том числе лейкемия), диабет и рассеянный склероз[2].
Некоторые кольцевые РНК связаны с клеточным старением. Так, circPVT1 действует как ингибитор старения пролиферирующих фибробластов[4]. Ряд кольцевых РНК ассоциирован с возрастными изменениями организма: например, идентифицированы молекулы, связанные со старением мышц у мартышек[6].
К настоящему моменту известны 10 кольцевых РНК, вовлечённых в развитие сердечно-сосудистых и метаболических заболеваний (например, сахарного диабета). Уже упоминавшаяся circANRIL может защищать от атеросклероза, подавляя созревание рРНК и сдерживая этим деление клеток, избыточная пролиферация которых ведёт к формированию атеросклеротических бляшек[en]. Кольцевая РНК под названием MICRA может сигнализировать о нарушениях работы левого желудочка, возникших вследствие инфаркта миокарда. При гипертрофии сердца и сердечной недостаточности наблюдается снижение синтеза ряда кольцевых РНК[2].
Для некоторых клеточных РНК показана связь с сахарным диабетом. Известно, что гиперпродукция микроРНК miR-7 в β-клетках поджелудочной железы способствует развитию диабета, а гиперпродукция ciRS-7 — кольцевой РНК, связывающей miR-7, — в этих клетках, напротив, улучшает секрецию инсулина[4].
В нервных тканях различных организмов (от плодовой мушки до человека) находят особенно много кольцевых РНК. Возможно, это связано с большей распространённостью альтернативного сплайсинга в нейронах. Кроме того, кольцевые РНК в них могут выполнять особые функции, связанные с проведением нервных импульсов. Белок Qki[en], задействованный в образовании circRNA, участвует в развитии олигодендроцитов и регулирует миелинизацию, а также подавляет образование дендритов в центральной нервной системе. Мутации гена этого белка связывают с атаксией и шизофренией[2]. Есть свидетельства и о связи кольцевых РНК с болезнью Альцгеймера[4][6].
Более 20 кольцевых РНК связаны с развитием разных видов рака, таких как колоректальный рак, рак яичника, мочевого пузыря, молочной железы, печени, желудка, почек и предстательной железы. Онкологические процессы часто сопровождаются транслокациями, которые приводят к появлению специфичных для определённых опухолей видов circRNA. Чаще всего кольцевые РНК, ассоциированные с развитием рака, функционируют как «губки» для микроРНК[2].
- ↑ Pamudurti Nagarjuna Reddy, Bartok Osnat, Jens Marvin, Ashwal-Fluss Reut, Stottmeister Christin, Ruhe Larissa, Hanan Mor, Wyler Emanuel, Perez-Hernandez Daniel, Ramberger Evelyn, Shenzis Shlomo, Samson Moshe, Dittmar Gunnar, Landthaler Markus, Chekulaeva Marina, Rajewsky Nikolaus, Kadener Sebastian. Translation of CircRNAs (англ.) // Molecular Cell. — 2017. — April (vol. 66, no. 1). — P. 9—21.e7. — ISSN 1097-2765. — DOI:10.1016/j.molcel.2017.02.021. [исправить]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Holdt Lesca M., Kohlmaier Alexander, Teupser Daniel. Molecular roles and function of circular RNAs in eukaryotic cells (англ.) // Cellular and Molecular Life Sciences. — 2017. — 7 November (vol. 75, no. 6). — P. 1071—1098. — ISSN 1420-682X. — DOI:10.1007/s00018-017-2688-5. [исправить]
- ↑ 1 2 3 4 Wang Man, Yu Fei, Wu Wei, Zhang Yuan, Chang Wenguang, Ponnusamy Murugavel, Wang Kun, Li Peifeng. Circular RNAs: A novel type of non-coding RNA and their potential implications in antiviral immunity (англ.) // International Journal of Biological Sciences. — 2017. — Vol. 13, no. 12. — P. 1497—1506. — ISSN 1449-2288. — DOI:10.7150/ijbs.22531. [исправить]
- ↑ 1 2 3 4 Greene John, Baird Anne-Marie, Brady Lauren, Lim Marvin, Gray Steven G., McDermott Raymond, Finn Stephen P. Circular RNAs: Biogenesis, Function and Role in Human Diseases (англ.) // Frontiers in Molecular Biosciences. — 2017. — 6 June (vol. 4). — ISSN 2296-889X. — DOI:10.3389/fmolb.2017.00038. [исправить]
- ↑ Szabo Linda, Salzman Julia. Detecting circular RNAs: bioinformatic and experimental challenges (англ.) // Nature Reviews Genetics. — 2016. — November (vol. 17, no. 11). — P. 679—692. — ISSN 1471-0056. — DOI:10.1038/nrg.2016.114. [исправить]
- ↑ 1 2 Panda Amaresh C., Grammatikakis Ioannis, Munk Rachel, Gorospe Myriam, Abdelmohsen Kotb. Emerging roles and context of circular RNAs (англ.) // Wiley Interdisciplinary Reviews: RNA. — 2016. — 9 September (vol. 8, no. 2). — P. e1386. — ISSN 1757-7004. — DOI:10.1002/wrna.1386. [исправить]
- Минина Е. Власть колец: всемогущие кольцевые РНК (неопр.). Биомолекула (13 февраля 2018). Дата обращения 13 декабря 2018. Архивировано 2 ноября 2018 года.
- Kristensen, L. S., Andersen, M. S., Stagsted, L. V., Ebbesen, K. K., Hansen, T. B., & Kjems, J. (2019). The biogenesis, biology and characterization of circular RNAs. Nature Reviews Genetics, 1-17.
