Лактатдегидрогеназа: механизм каталитической реакции. НАГЛЯДНАЯ БИОХИМИЯ. Ян Кольман, Клаус-Генрих Рем, Юрген Вирт
Лактатдегидрогеназа: механизм каталитической реакции
Механизм действия лактатадегидрогеназы (ЛДГ) можно представить
на основе общих закономерностей ферментативного катализа, которые изложены на
с. 96.
А. Лактатдегидрогеназа: каталитический
цикл
ЛДГ катализирует передачу восстановительного
эквивалента от лактата на НАД+ (NАD+) или от НАДН (NADH)
на пируват.
L-лактат + НАД+ ↔ пируват + НАДН
+ H+
Равновесие реакции сдвинуто в сторону образования лактата (см.
с. 24). Однако при высоких концентрациях лактата и НАД+
возможно окисление лактата в пируват. ЛДГ катализирует реакцию в обоих направлениях,
но подобно всем ферментам не влияет на положение химического равновесия.
Из-за обратимости реакции каталитический
процесс можно представить в виде движения по кругу. Каталитический цикл
ЛДГ представлен на схеме в виде шести моментальных «снимков». Приведенные на
схеме промежуточные стадии катализа очень кратковременны и поэтому строго не
доказаны. Однако их существование подтверждается множеством экспериментальных
данных
В активном центре ЛДГ принимают участие многие аминокислотные
остатки. Они способствуют присоединению субстратов и кофермента или непосредственно
участвуют в одной из стадий катализа. Здесь показаны лишь три особенно важные
боковые цепи аминокислот: положительно заряженная гуанидиновая группа аргинина-171
связывает карбоксильную группу субстрата с помощью электростатического взаимодействия,
имидазольная группа гистидина-195 принимает участие в кислотно-основном
катализе, боковая цепь аргинина-109 важна для стабилизации переходного
состояния. В противоположность His-195, меняющему свой заряд во время катализа,
оба упомянутых остатка аргинина протонированы постоянно. Кроме этих трех остатков
важную роль играет пептидная петля 98-111, показанная схематически (окрашена
в малиновый цвет) на рис. 103. Ее функция состоит в том,
чтобы после связывания субстрата и кофермента закрыть активный центр и исключить
доступ молекул воды во время переноса электронов.
Рассмотрим теперь отдельные стадии катализируемого ЛДГ восстановления пирувата: в свободном ферменте (1) His-195 протонирован, в связи с чем эта форма обозначена как E ∙ H+ . Кофермент НАДН связывается первым (2), а за ним — пируват (3) Важно, что в молекуле фермента карбонильная группа пирувата и никотинамидное кольцо кофермента в активированном состоянии расположены друг относительно друга оптимально и такая ориентация фиксирована (сближение и ориентирование субстратов). Затем закрывается петля 98-111 над активным центром. Сильно пониженная полярность в области активного центра облегчает образование
Входящий в уравнение реакции протон
присоединяется не одновременно с NADH а после освобождения лактата, т. е. между
стадиями (5) и (6) предшествующего цикла.
— лактатдегидрогеназа — Биохимия
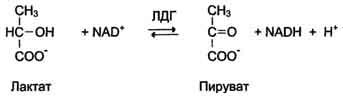
Лактатдегидрогеназа (L‑лактат:НАД‑оксидоредуктаза, ЛДГ, КФ 1.1.1.27) является гликолитическим ферментом и катализирует следующую реакцию:
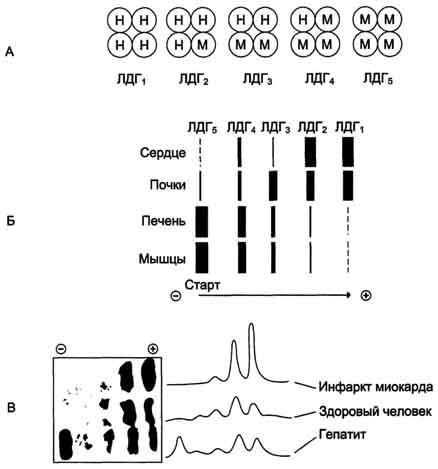
Лактат + НАД Пируват + НАДНМолекула ЛДГ представляет собой тетрамер, состоящий из одного или двух типов субъединиц, обозначаемых как M (англ: muscle) и H (англ: heart). В сыворотке крови фермент существует в пяти молекулярных формах, различающихся по первичной структуре, кинетическим свойствам, электрофоретической подвижности (ЛДГ‑1 быстрее движется к аноду по сравнению с ЛДГ‑5, то есть более электрофоретичеки подвижна). Каждая форма имеет характерный полипептидный состав: ЛДГ‑1 состоит из 4 H‑субъединиц, ЛДГ‑2 — из 3 H‑субъединиц и 1 M‑субъединицы, ЛДГ‑3 представляет собой тетрамер из 2 H‑субъединиц и 2 M‑субъединиц, ЛДГ‑4 содержит 1 H‑субъединицу и 3 M‑субъединицы, ЛДГ‑5 состоит только из M‑субъединиц.
По степени убывания общей каталитической активности энзима все органы и ткани располагаются в следующем порядке: почки, сердце, скелетные мышцы, поджелудочная железа, селезенка, печень, легкие, сыворотка крови.
От того, какой изофермент наиболее представлен, зависит преимущественный способ окисления глюкозы в ткани: аэробный (до CO2 и H2O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью сродства изоферментов к пировиноградной кислоте. Изоферменты, содержащие в основном H‑субъединицы (ЛДГ‑1 и ЛДГ‑2), обладают низким сродством к пирувату и поэтому неспособны эффективно конкурировать за субстрат с пируватдегидрогеназным комплексом. В результате пируват подвергается окислительному декарбоксилированию и в виде ацетил‑КоA вступает в цикл Кребса. Напротив, изоферменты, обладающие главным образом M‑субъединицами (ЛДГ‑4 и ЛДГ‑5), имеют более высокое сродство к пирувату и, как следствие, превращают его в молочную кислоту. Для каждой ткани установлены наиболее типичные изоферменты. Для миокарда и мозговой ткани основным изоэнзимом является ЛДГ‑1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ‑1 и ЛДГ‑2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ‑3. ЛДГ‑4 находится во всех тканях с ЛДГ‑3, а также в гранулоцитах и мужских половых клетках, в последних дополнительно обнаруживается ЛДГ‑5. В скелетных мышцах изоферментная активность располагается в порядке убывания в ряду: ЛДГ‑5, ЛДГ‑4, ЛДГ‑3. Для печени наиболее характерен изофермент ЛДГ‑5, выявляется также ЛДГ‑4.
В норме основным источником активности ЛДГ в плазме крови являются разрушающиеся клетки крови. В сыворотке активность изоферментов распределяется следующим образом: ЛДГ‑2 > ЛДГ‑1 > ЛДГ‑3 > ЛДГ‑4 > ЛДГ‑5. При электрофорезе между фракциями ЛДГ‑3 и ЛДГ‑4 иногда обнаруживается дополнительная полоса изофермента ЛДГ‑X, данный изофермент локализован в тех же органах, что и ЛДГ‑5.
Для определения общей активности ЛДГ в сыворотке крови используют две группы методов:
1. Спектрофотометрические, основанные на прямом оптическом тесте Варбурга: различие в разности поглощения окисленной и восстановленной форм НАД.
2. Колориметрические:
- динитрофенилгидразиновые, базирующиеся на исследовании содержания пирувата с помощью 2,4‑динитрофенилгидразина:
| ◊ из методов этой группы наиболее точным и чувствительным является метод Нательсона, состоящий в определении концентрации непрореагировавшего в реакции пирувата. Однако вследствие нестабильности раствора пировиноградной кислоты метод не получил широкого распостранения. |
| ◊ метод Севела и Товарека, заключающийся в определении количества образовавшегося пирувата. |
- редоксиндикаторные методы — точны и просты технически, в них используется способность некоторых веществ (индикаторов) менять цвет в реакциях окисления‑восстановления.
Для определения активности изоферментов ЛДГ наиболее распостраненным является электрофоретическое разделение на ацетате целлюлозы и агарозе. Наиболее простыми и быстро выполнимыми являются методы, основанные на различном отношении ЛДГ‑1 и ЛДГ‑5 к температуре, но для получения воспроизводимых результатов требуется точное соблюдение температурных условий, так как у всех изоферментов имеется некоторая тепловая нестабильность. Методы, основанные на химическом ингибировании изоферментов мочевиной или лактатом дают недостаточно достоверные результаты. Хроматографические методы основаны на разной степени адсорбции изоферментов ЛДГ на сефадексе. Возможно определение изоферментов по выбору оптимальной концентрации субстрата для каждого изофермента.
В качестве унифицированных методов определения общей активности ЛДГ выбраны метод по оптимизированному оптическому тесту и метод Севела‑Товарека; для изучения изоферментной активности — электрофорез на ацетате целлюлозы.
Определение общей активности лактатдегидрогеназы
в сыворотке крови методом Севела‑Товарека
Принцип
Пировиноградная кислота, образованная в результате ферментативной реакции, в щелочной среде взаимодействует с 2,4‑динитрофенилгидразином и образует окрашенный комплекс.
Нормальные величины
| Сыворотка | (указанный метод) | 220‑1100 нмоль/с×л или 13‑67 МЕ |
| (оптический тест) | 140‑320 МЕ |
Определение активности фракций ЛДГ
с помощью термоингибирования
Принцип
Ферменты, с преимущественным содержанием М‑субъединиц (ЛДГ‑4 и ЛДГ‑5) более термолабильны по сравнению с изоферментами, содержащими H‑субъединицы (ЛДГ‑1 и ЛДГ‑2).Нормальные величины
| Сыворотка | при 56°С | инактивация на 30% |
| при 65°С | инактивация на 80% |
Определение активности фракций ЛДГ
по инактивации мочевиной
Принцип
Заключается в ингибировании мочевиной активности изофермента ЛДГ‑5 почти на 100%.
Нормальные величины
| Сыворотка | (ингибирование мочевиной) | 25‑36% общей активности | |
| (электрофорез на ацетате целлюлозы) | ЛДГ‑1 | 19‑29% общей активности | |
| ЛДГ‑2 | 23‑37% общей активности | ||
| ЛДГ‑3 | 17‑25% общей активности | ||
| ЛДГ‑4 | 8‑17% общей активности | ||
| ЛДГ‑5 | 8‑18% общей активности |
Влияющие факторы
Наркотические анальгетики и другие обезболивающие препараты, этанол, дикумарин завышают результаты исследования. Необходимо избегать гемолиза, так как в эритроцитах активность фермента выше, чем в сыворотке. Оксалаты и мочевина ингибируют фермент.
Клинико‑диагностическое значение
Все заболевания, протекающие с разрушением клеток, сопровождаются резким повышением активности ЛДГ в сыворотке крови. Нарастание общей активности фермента обнаруживается при таких заболеваниях как инфаркт миокарда, некротическое поражение почек, гепатит, панкреатит, воспаление и инфаркт легкого, опухоли различной локализации, повреждения, дистрофия и атрофия мышц, гемолитические анемии и физиологическая желтуха новорожденных, лимфогранулематоз, лейкозы. При инфаркте миокарда начало роста активности фермента в сыворотке крови отмечается на 8‑10 час от момента приступа, максимальное увеличение наступает к 24‑48 часу, нередко в 15‑20 раз превышая норму. Повышенная активность ЛДГ сохраняется до 10‑12 суток от начала заболевания. Степень нарастания активности фермента не всегда коррелирует с размерами поражения сердечной мышцы и для прогноза исхода заболевания может являться лишь ориентировочным фактором. У больных стенокардией активность фермента не изменяется, что позволяет применять тест для дифференциальной диагностики в пределах 2‑3 суток после сердечного приступа.
Наличие органной специфичности ферментов позволяет применять исследование их активности с целью топической диагностики .
| Заболевание | Общая активность ЛДГ |
Изоферменты | ||||
| ЛДГ‑1 | ЛДГ‑2 | ЛДГ‑3 | ЛДГ‑4 | ЛДГ‑5 | ||
| Инфаркт миокарда | ++ | + | + | |||
| Заболевания легких | + | + | + | |||
| Вирусный гепатит | + | + | + | |||
| Токсический гепатит | + | + | + | |||
| Цирроз печени | + | + | + | |||
| Миелолейкоз | ++ | + | + | |||
| Гранулоцитоз | ++ | + | + | |||
| Разрушение тромбоцитов (эмболии, гемотрансфузии) |
+ | + | + | + | ||
| Панкреатит | + | + | + | |||
| Мегалобластическая анемия | +++ | + | + | |||
| Гемолитическая анемия | +++ | + | + | |||
| Почечные заболевания | ++ | + | + | |||
| Миопатия | ++ | + | + | |||
При заболеваниях печени сыворотка после инкубации при 56°С теряет около 50% своей активности, при 65°С — до 90%. При сердечных поражениях инактивация при 56°С достигает 10%, при 65°С — около 60%. Активность мочевиностабильной фракции при заболеваниях печени снижается до 20% от общей, инфаркт миокарда сопровождается возрастанием свыше 40% активности данной фракции.
Лактатдегидрогеназа
Лактатдегидрогеназа (ЛДГ, L-лактат: NAD-оксидоредуктаза; К.Ф. 1.1.1.27) – цитоплазматический , Zn-содержащий гликолитический фермент, обратимо катализирующий восстановление пировиноградной кислоты в молочную кислоту:
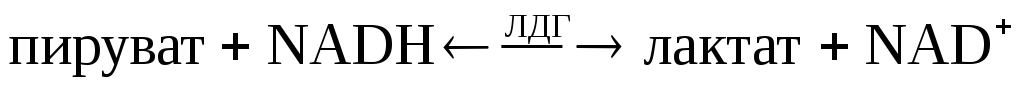
Фермент широко распространён в организме человека. По степени убыли активности ЛДГ органы и ткани можно расположить в следующей последовательности: почки, сердце, скелетные мышцы, поджелудочная железа, селезёнка, печень, лёгкие, сыворотка крови. ЛДГ содержится в значительном количестве в эритроцитах, поэтому исследуемая сыворотка не должна содержать следов гемолиза. ЛДГ имеет пять изоферментов, представляющих различные комбинации из четырёх субъединиц двух основных типов – Н (от англ. heart – сердце) и М (от англ. muscle – мышца):
ЛДГ1 – 4Н;
ЛДГ2 – 3Н1М;
ЛДГ3 – 2Н2М;
ЛДГ4 – 1Н3М;
ЛДГ5 – 4М.
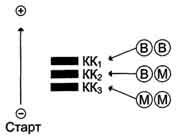
Изоферменты ЛДГ нумеруются в соответствии с электрофоретической подвижностью по направлению к аноду (рис. 5.2.2). На рисунке показано распределение и относительное количество изоферментов ЛДГ в различных органах. Экстракты нанесены на линию, отмеченную надписью «Старт». При заданных условиях опыта (рН) 4 изофермента ЛДГ движутся к аноду, а один (ЛДГ5) к катоду.
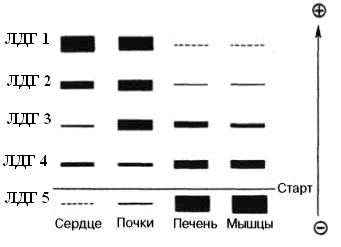
Рис. 5.2.2 Распределение и относительное количество изоферментов ЛДГ в различных органах
Протекание прямой реакции превращения пирувата в лактат обеспечивает М субъединица ЛДГ, протекание обратной реакции – Н субъединица (рис. 5.2.3).
Рис. 5.2.3. Обратимая реакция превращения пирувата в лактат, катализируемая ЛДГ
Изоферментный спектр и тип обмена веществ в ткани коррелируют между собой. Так, в тканях с преимущественно аэробным обменом веществ (мозг, сердце, почки и др.) наибольшей активностью обладают ЛДГ1 и ЛДГ2, в тканях с выраженным анаэробным обменом веществ (печень, скелетная мускулатура и др.) преобладают ЛДГ4 и ЛДГ5. Наиболее высокое содержание ЛДГ3 отмечают в лимфоидной ткани, тромбоцитах и опухолях. Это распределение имеет большой биологический смысл. Изофермент ЛДГ1 in vitro активен при низкой концентрации пирувата и ингибируется его избытком, в то время как ЛДГ5 сохраняет активность при сравнительно высоких концентрациях пирувата. Поскольку восстановление пирувата в лактат, катализируемое ЛДГ1, сильно ингибируется уже небольшими концентрациями пирувата, то в ткани, богатой этим изоферментом, например в сердце, пируват подвергается преимущественно аэробному окислению. Кроме активной переработки собственного (эндогенного) лактата, сердечная мышца способна поглащать лактат из крови, затем превращать его в пировиноградную кислоту и подвергать дальнейшему окислению для пополнения запасов АТР. С другой стороны, в тканях, где преобладают изоферменты ЛДГ4 и ЛДГ5 (печень, скелетная мускулатура), АТР в значительной степени образуется за счёт гликолиза. Высокая активность ЛДГ5 в них обеспечивает быстрое превращение пирувата в лактат, который затем выбрасывается в кровь, поскольку в скелетной мускулатуре дальнейшее превращение лактата почти не осуществляется. Однако в некоторых тканях нет зависимости между типом обмена и изоферментным спектром. Так в эритроцитах, тромбоцитах, хрусталике глаза, где преобладает анаэробный обмен, фермент представлен в основном изоферментами ЛДГ1 ЛДГ2.
Молекулярная масса каждой изоформы ЛДГ составляет 135 кДа (по другим данным 140 кДа), а каждой субъединицы – 34 кДа (по другим данным – 33,5 кДа). Вместо лактата ЛДГ может окислять α-гидроксибутират до α-оксибутирата. Особенно высокую активность в отношении α-гидроксибутирата по сравнению с лактатом проявляет ЛДГ1. Вследствие этого ЛДГ1 обычно измеряют с использованием именно этого субстрата, а данный изофермент (ЛДГ1) имеет второе название – α-гидроксибутиратдегидрогеназа (α-ГБДГ).
Соотношение между изозимами ЛДГ, по данным разных авторов при электрофорезе на ацетатцеллюлозных плёнках составляет у взрослых:
ЛДГ1 | 19-29% |
ЛДГ2 | 23-27% |
ЛДГ3 | 17-25% |
ЛДГ4 | 8-17% |
ЛДГ5 | 8-18% |
Это соотношение может изменяться как при адаптации к меняющимся условиям среды, так и в ходе онтогенеза. Эмбрионы всех млекопитающих проходят стадию развития, когда митохондрии ещё не готовы к окислению субстратов. В этих условиях особенно велика роль анаэробного гликолиза. Как показано для развивающихся мышей, на стадии эмбриона основной формой фермента является тетрамер типа М4. После рождения постепенно нарабатываются другие формы ЛДГ, и к периоду, соответствующему взрослому организму, устанавливается соотношение разных изоформ, типичное для каждой ткани.
Клиническое значение определения ЛДГ
Рост общей активности ЛДГ сыворотки крови не несёт достаточно специфической информации. Можно отметить, что общая активность ЛДГ резко повышена при миелобластных и пернициозных анемиях, обширных опухолевых процессах, вирусных гепатитах, шоке и гипоксии. Выраженное повышение наблюдается при циррозах печени, обтупационных желтухах, заболеваниях почек, опорно-мышечного аппарата, опухолях, при сердечной недостаточности. Активность фермента повышается при любых патологических процессах, связанных с цитолизом клеток органов и тканей (например, при инфарктах миокарда, лейкозах, гемолитических анемиях, гепатитах и др.). Определение отдельных изоферментов ЛДГ в сыворотке крови имеет большую диагностическую значимость, чем определение суммарной активности.
Активность ЛДГ1 и ЛДГ2 увеличивается при инфаркте миокарда, различных видах анемий, острых поражениях (некрозах) почечной ткани. Уровень ЛДГ1 повышается при опухолевых заболеваниях яичников. Повышение активности ЛДГ5 выявляется при повреждении скелетных мышц, любых воспалительных или дегенеративных заболеваниях скелетных мышц, многих заболеваниях печени (циррозе, всех типах гепатитов) и при раковых опухолях. Повышение активности изоферментов средней зоны, то есть ЛДГ2 и ЛДГ3 ЛДГ4 встречается при массивном разрушении тромбоцитов (эмболия лёгочной артерии, массивная гемотрансфузия) и вовлечении в патологический процесс лимфатической системы, например, при таких заболеваниях, как инфекционный мононуклеоз, лимфомы, лимфоцитарный лейкоз.
У здоровых новорожденных, в первые дни жизни содержание ЛДГ2 ниже, а содержание ЛДГ5 выше чем у взрослого человека. Максимальная активность фермента наблюдается на 2-4 день жизни. К 6-7 годам соотношение фракций ЛДГ примерно соответствуют таковому у взрослого человека.
Рекомендации по определению ЛДГ:
1. Сыворотка не должна быть гемолизирована, так как ЛДГ содержится в эритроцитах и результаты могут быть завышены;
2. Не рекомендуется использовать в качестве антикоагулянта оксалаты, так как соли щавелевой кислоты являются ингибиторами лактатдегидрогеназной реакции;
3. Рекомендуется использовать свежую сыворотку или плазму крови, лучше плазму, так как ЛДГ много в тромбоцитах и при их разрушении активность ЛДГ повышается.
УРОКИ БИОХИМИИ. Урок №12: «Раскинулось море широко…». ЛДГ
ЛДГ – показатель окислительно-восстановительного потенциала крови, стабилизатор рН, маркер состояния эритроцитарного пула, компонент буферной системы, регулятор метаболических потоков, маркер анаэробного токсикоза и т. д. и т. п.
Сначала цифры: площадь капилляров печени равна 400 м2, в букве О может поместиться 100 эритроцитов, в эритроците 340000000 молекул гемоглобина, в клетке печени 1560 митохондрий (в 1 митохондрии 20 тыс. дыхательных ансамблей), 2.1013 молекул и 40 млрд. белков, в крови 750 г гемоглобина, скорость мозгового кровотока 750 мл/мин. А ведь 90 г глюкозы в сутки расходует мозг, 400г глюкозы синтезируется в печени и это количество за сутки дает 53 кг АТФ. Это погружение в микромир показывает, что требуется наличие фермента с макровозможностями, которыми и обладает ЛДГ. Через сердце в покое проходит 4л крови в 1 минуту, совершая полный оборот. Для функционирования организма необходимо «море крови» с характером горной реки, что и имеет организм в виде этой уникальной ткани. 1г массы человека за 1 час даёт в 10000 раз больше энергии, чем 1г Солнца и при этом 1л пота может снизить температуру на 10оС. А на коже 30 тыс. тепловых и 250 тыс. холодовых рецепторов для получения ранних сигналов о сохранении тепла. Всё это обеспечивает и стабильный, полифункциональный, до конца не понятный фермент ЛДГ, активность которого не опускается ниже 150 и не повышается выше 650 МЕ/л с манерой поведения физиологического типа, как рН или давление.
Общая активность лактатдегидрогеназы (ЛДГ) в покое составляет 250 МЕ/л и складывается из разных изоформ. ЛДГ обнаруживается во всех тканях животных и человека, особенно в сердечной и скелетных мышцах, эритроцитах, печени и почках. Молекула ЛДГ с мол. массой 140 000 представляет собой тетрамер, состоящий из одного или двух типов субъединиц Н и М, комбинации которых образуют 5 изоформ фермента: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5 (рис.12). Изоферменты катализируют одну реакцию, но имеют различное строение (своеобразные биохимические синонимы). Остальные же изоформы менее органоспецифичны, но в определенной мере увязаны с почками, печенью и головным мозгом.
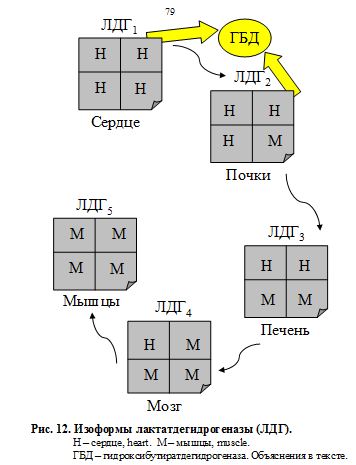
ЛДГ способна катализировать образование как тупикового токсичного лактата, так и вариативного пирувата и фактически выполнять буферную роль по отношению к пулу кетокислот — полифункциональных метаболитов. ЛДГ создает фонд кетокислот для последующего трансаминирования, т.е. фермент с большей активностью (активность ЛДГ равна 250 МЕ/л) создаёт широкие метаболические возможности для ферментов с меньшей активностью и более узкой специфичностью (АСТ – 30 и АЛТ – 20 МЕ/л). Жесткий интервальный уровень активности фермента в крови необходим для создания оптимальной интенсивности и направленности потока важнейших метаболитов в зависимости от складывающихся физиологических условий. Реакция превращения пировиноградной кислоты (ПВК) в молочную с участием ЛДГ5 (рис. 13) называется пируватгидрогенезированием, а сам фермент (ЛДГ5) в этом случае именуется «пируват-гидрогеназа». Обратный процесс катализируется тем же ферментом, но теперь его «официальное» название – лактатдегидрогеназа. С точки зрения ортодоксального химика данный термин неверен, но принят. Оба взаимообратных процесса равновесны и представляют собой единую саморегулирующуюся систему, поддерживающую конкретные процентные соотношения каждого компонента. Но меняется субстрат, и равновесие поддерживается «в другую сторону», «в пользу» продукта реакции (рис.). Фактически это система саморегуляции в крови важнейших потоков. В сердце же организму нельзя допустить образования молочной кислоты, иначе произойдет contractura – остановка сердца. Зато в скелетных мышцах это вполне допустимо. Ведь там МК, образуясь в анаэробных условиях при физической нагрузке, затем постепенно поступает в печень в цикл Кори, т.е. реверсивно превращается в глюкозу. От МК отщепляется два атома водорода, идет превращение МК в ПВК с участием ЛДГ1, схематично изображенное на рис. Часть пирувата, в свою очередь, идет по 1-му, 2-му и общему пути катаболизма глюкозы в цикле Кребса, а часть расходуется на образование глюкозы через глюконеогенез. Возможно также превращение ПВК в аланин (а затем – в белки) в ГАШ. На приведенном примере видно, насколько крепки организменные функциональные взаимосвязи между веществами, соединениями, их превращениями и физиологическими процессами. Все это объединяет организм в живую саморазвивающуюся систему, создает его целостность, формирует единство и содружественный ответ всех компонентов на постоянно меняющиеся условия окружающей среды. Это и есть – МЕТАБОЛИЗМ.
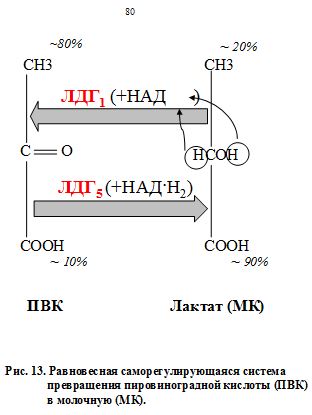
В физиологических условиях равновесие реакции, катализируемой ЛДГ, смещено в сторону образования лактата. В крови в норме содержание лактата 10-20 мг%, что на порядок выше, чем содержание пирувата 0.8-1.2 мг%. Восстановлением пирувата под действием ЛДГ завершается внутренний окислительно-восстановительный цикл гликолиза. Утомление мышц частично обусловлено развитием ацидоза в мышцах и при гликолизе из каждой нейтральной молекулы глюкозы образуются две молекулы молочной кислоты. В моче концентрация водородных ионов повышается в 800 раз. Использование искусственной гипергликемии у больных раком легкого с повышением глюкозы до 22-30 ммоль/л сопровождалось изменением соотношения анаэробных и аэробных фракций в пользу аэробных, что можно рассматривать как кратковременную адаптивную реакцию для более интенсивного сгорания избытка глюкозы. Периоды «полужизни» ЛДГ1 – 113±60 ч. и ЛДГ5 –10±2ч. Реакция катализируемая ЛДГ1 важнее для долгосрочного обеспечения энергетическими субстратами, а ЛДГ5 катализирует реакцию потенциально опасную с резким снижением уровня глюкозы, но более необходимую в экстренных ситуациях.
Онтогенетические сдвиги активности ЛДГ в тканях разнонаправлены: в печени с увеличением возраста происходит рост активности фермента, а в мозге и скелетных мышцах снижается. В почках и сердце активность не изменяется. У новорожденных активность составляет в среднем 175 МЕ/л и в течение первых 9 лет жизни снижается на 2.9 МЕ/л в год, затем падение активности на 8 МЕ/л в год в возрасте от 14 до 21 года. Контроль за активностью ЛДГ осуществляется не только на уровне транскрипции и трансляции, но и на уровне разрушения фермента. В миокарде ЛДГ1 разрушается в 22 раза быстрее чем в скелетной мышце, что может ограничивать сгорание глюкозы в сердце и экономить ее для других тканей.
ЛДГ играет ключевую роль в глюкозо-аланиновом цикле, где осуществляется интеграция углеводного и белкового обменов. ЛДГ оказывает регуляторное воздействие на цикл Кори, протекающий в мышцах и печени, катализируя конечную стадию гликолиза и начальную глюконеогенеза. Как и в мультиферментных комплексах на мембранах и эритроцитах в крови большое количество ферментов и малое субстратов при интенсивном использовании последних (лактат венозной крови 0,9-1,7 ммоль/л, пируват – 34-103 ммоль/л). Это наводит на мысль о возможности протекания реакций в крови для особой роли ферментов. Изменяя рН среды и, следовательно, направление всего одной ферментативной реакции можно получить разнообразные догормональные метаболические эффекты, которые приведут к изменению активности других ферментов и других видов обмена в среде их функционирования.
ЛДГ имеет постоянно высокий уровень активности в сыворотке, не опускаясь ниже 99 МЕ/л. Максимальная активность приходится на ЛДГ1,2, которая определяет высокую постоянную активность ЛДГ и зависит от полужизни фермента. Анаэробные фракции менее представлены в тканях, в большей степени деградируют и имеют более короткий период полужизни. Глюкоза является наиболее доступным для организма субстратом при разных условиях существования, а ключевой и регуляторный фермент метаболизма глюкозы должен иметь высокую активность и обладать определенным «резервом» для экстремальных ситуаций и поэтому его можно рассматривать как буферную систему.
ЛДГ имеет неабсолютную специфичность, иначе способен превращать и гидроксибутират из липидного обмена, т.е. влиять на соотношение углеводного и липидного обмена. Но это особая тема.
5. Изоферменты. Строение, биологическую роль, диагностическое значение определения. Изоферменты лактатдегидрогеназы (лдг), креатинкиназы (кк)
Изоферменты– это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам (сродству к субстрату, максимальной скорости катализируемой реакции, электрофоретической подвижности, разной чувствительности к ингибиторам и активаторам, оптимуму рН и термостабильности). Изоферменты имеют четвертичную структуру, которая образована четным количеством субъединиц (2, 4, 6 и т.д.). Изоформы фермента образуются в результате различных комбинаций субъединиц.
В качестве примера можно рассмотреть лактатдегидрогеназу (ЛДГ), фермент, который катализирует обратимую реакцию:
НАДН2 НАД+
пируват ←ЛДГ→ лактат
ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров (субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне четвертичной структуры: ЛДГ1(НННН), ЛДГ2(НННМ), ЛДГ3(ННММ), ЛДГ4(НМММ), ЛДГ5(ММММ).
Полипептидные цепи Н и М типа имеют одинаковую молекулярную массу, но в составе первых преобладают карбоновые аминокислоты, последних – диаминокислоты, поэтому они несут разный заряд и могут быть разделены методом электрофореза.
Кислородный обмен в тканях влияет на изоферментный состав ЛДГ. Где доминирует аэробный обмен, там преобладают ЛДГ1, ЛДГ2(миокард, надпочечники), где анаэробный обмен — ЛДГ4, ЛДГ5(скелетная мускулатура, печень). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ4, ЛДГ5. После рождения в некоторых тканях происходит увеличение содержания ЛДГ1, ЛДГ2.
Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям. По изменению изоферментного состава оценивают метаболическое состояние органов и тканей.
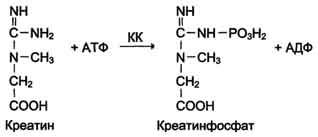
Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
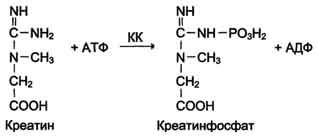
Молекула КК — димер, состоящий из субъединиц двух типов: М (от англ, muscle — мышца) и В (от англ, brain — мозг). Из этих субъединиц образуются 3 изофермента — ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ — в скелетных мышцах и MB — в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
6. Локализация и компартментализация ферментов в клетке и тканях: ферменты общего назначения, органоспецифические и органеллоспецифические (маркерные) ферменты.
Ферменты по локализации делят на 3 группы:
I– общие ферменты (универсальные)
II- органоспецифические
III- органеллоспецифические
Общие ферментыобнаруживаются практически во всех клетках, обеспечивают жизнедеятельность клетки, катализируя реакции биосинтеза белка и нуклеиновых кислот, образование биомембран и основных клеточных органелл, энергообмен. Общие ферменты разных тканей и органов, тем не менее, отличаются по активности.
Органоспецифичные ферментысвойственны только определенному органу или ткани. Например: Для печени – аргиназа. Для почек и костной ткани – щелочная фосфатаза. Для предстательной железы – КФ (кислая фосфатаза). Для поджелудочной железы – α-амилаза, липаза. Для миокарда – КФК (креатинфосфокиназа), ЛДГ, АсТ и т.д.
Внутри клеток ферменты также распределены неравномерно. Одни ферменты находятся в коллоидно-растворенном состоянии в цитозоле, другие вмонтированы в клеточных органеллах (структурированное состояние).
Органеллоспецифические ферменты. Разным органеллам присущ специфический набор ферментов, который определяет их функции.
Органеллоспецифические ферменты это маркеры внутриклеточных образований, органелл:
Клеточная мембрана: ЩФ (щелочная фосфатаза), АЦ (аденилатциклаза), К-Nа-АТФаза
Цитоплазма: ферменты гликолиза, пентозного цикла.
ЭПР: ферменты обеспечивающие гидроксилирование (микросомальное окисление).
Рибосомы: ферменты обеспечивающие синтез белка.
Лизосомы: содержат гидролитические ферменты, КФ (кислая фосфатаза).
Митохондрии: ферменты окислительного фосфорилирования, ЦТК (цитохромоксидаза, сукцинатдегидрогеназа), β-окисления жирных кислот.
Ядро клетки: ферменты обеспечивающие синтез РНК, ДНК ( РНК-полимераза, НАД-синтетаза).
Ядрышко: ДНК-зависимая-РНК-полимераза
В результате в клетке образуются отсеки (компартменты), которые отличаются набором ферментов и метаболизмом (компартментализация метаболизма).
Среди ферментов выделяется немногочисленная группа регуляторных ферментов,которые способны отвечать на специфические регуляторные воздействия изменением активности. Эти ферменты имеются во всех органах и тканях и локализуются в начале или в местах разветвления метаболических путей.
Строгая локализация всех ферментов закодирована в генах.
Определение в плазме или сыворотке крови активности органо- органеллоспецифических ферментов широко используется в клинической диагностике.
2. Изоферменты
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой — изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформы лактатдегидрогеназы. Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7).
Лактатдегидрогеназа — олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle — мышца) и Н (от англ, heart — сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 — в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б).
120
Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
121
Молекула КК — димер, состоящий из субъединиц двух типов: М (от англ, muscle — мышца) и В (от англ, brain — мозг). Из этих субъединиц образуются 3 изофермента — ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ — в скелетных мышцах и MB — в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
Органные — ферменты гликолиза в печени и мышцах.
Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются разными аллелями одного и того же гена.
10. I. Применение ферментов с лечебной целью в свою очередь подразделяется на два вида: 1) применение в целях заместительной терапии и 2) с целью воздействия фермента на очаг заболевания.
С целью заместительной терапии наиболее широко используют пищеварительные ферменты, когда у пациента обнаруживается их недостаточность. В качестве примера можно привести препараты желудочного сока или чистыйпепсин или ацидин-пепсин, который незаменим при гастритах с секреторной недостаточностью, при диспепсиях у детей. Панкреатин — препарат, представляющий смесь ферментов поджелудочной железы, применяют при панкреатитах, в основном хронического характера. Такое же значение имеют известные препараты холензим, панзинорм и др.
Другая область применения заместительной терапии — это лечение заболеваний, связанных с так называемымиэнзимопатиями. Это заболевания врожденные или наследственные, при которых нарушен синтез каких-либо ферментов. Эти заболевания обычно чрезвычайно тяжелые, дети с наследственным отсутствием какого-либо фермента живут недолго, страдают тяжелыми умственными и расстройствами, отсталостью физического и умственного развития. Заместительная терапия иногда может помочь преодолеть эти нарушения.
Целый ряд ферментных препаратов используют в хирургической практике для очистки раневой поверхности от гноя, микробов, излишков грануляционной ткани; в клинике внутренних болезней их применяют:с целью разжижения вязких секретов, экссудатов, сгустков крови, например, при тяжелых воспалительных заболеваниях легких и бронхов. это в основном ферменты — гидролазы, способные расщеплять природные биополимеры — белки, НК, полисахариды. В связи с их противовоспалительным действием их применяют также при тромбофлебитах, воспалительно-дистрофических формах пародонтоза, остеомиелите, гайморите, отитах и др. воспалительных заболеваниях.
Среди них такие ферменты, как трипсин, химотрипсин, РНК-за, ДНК -аза, фибринолизин. Фибиринолизин также используют для удаления внутрисосудистых тромбов. РНК-азу и ДНК-азу с успехом применяют для лечения некоторых вирусных инфекций, например для уничтожения вируса герпеса.
Такие ферменты, как гиалуронидаза, коллагеназа, лидаза, используются для борьбы с излишними рубцовыми образованиями.
Аспарагиназа — фермент, образуемый некоторыми штаммами кишечной палочки. Оказывает лечебный эффект при некоторых формах опухолей. Лечебный эффект связан со свойством фермента нарушать обмен аминокислоты аспарагина, необходимой опухолевым клеткам для роста.
Применение ферментных препаратов с лечебной целью представляет пока еще очень молодое направление медицинской науки. Ограничением здесь является трудоемкость технологий и дороговизна получения чистых ферментных препаратов в кристаллическом виде, пригодном для хранения и применения у человека. Кроме того, при использовании ферментных препаратов приходится учитывать также и другие обстоятельства:
1) Ферменты — это белки, а следовательно в некоторых случаях могут вызвать нежелательную аллергическую реакцию.
2) Быстрым разложением введенных ферментов (белковый препарат, поэтому немедленно захватывается клетками «мусорщиками» — макрофагами, фибробластами и др. Отсюда, требуются большие концентрации препаратов, чтобы достичь нужного эффекта.
3) Однако при повышении концентрации ферментные препараты могут оказаться токсичными.
И все-таки, в тех случаях, когда удается преодолеть эти препятствия, ферментные препараты оказывают прекрасный лечебный эффект.
Например, эти недостатки частично устраняются при переводе ферментов в так называемую «иммобилизованную» форму.
Более подробно о методах иммобилизации ферментов и способах их применения вы прочтете в ваших учебно-методических пособиях.
— строение ферментов — Биохимия
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому, подобно белкам, ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин , трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), различные пероксидазы (содержат гем), лактатдегидрогеназа (содержит Zn2+), амилаза (содержит Ca2+).
Кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+).
Деление на коферменты и простетические группы не всегда однозначно:
• если связь кофактора с белком прочная, то в этом случае говорят о наличии простетической группы,
• но если в качестве кофактора выступает производное витамина – то его называют коферментом, независимо от прочности связи.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Как многие белки, ферменты могут быть мономерами, т.е. состоять из одной субъединицы, и полимерами, состоящими из нескольких субъединиц.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
Схема формирования сложного фермента
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы, называемой активатором или ингибитором (или эффектором, модулятором, регулятором), вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см «Регуляция активности ферментов»).
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы. Определение активности разных изоферментов КК в сыворотке крови имеет клинико-диагностическое значение.
Изоферменты креатинкиназы |
Изоферменты лактатдегидрогеназы |
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. Изоферменты ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Определение активности разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение.
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами «туннель». В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции.
Строение мульферментного комплекса
Например,
Абзимы
Абзимами называются антитела, имеющие каталитическую функцию (англ. abzymes, antibodies as enzymes) и катализирующие конкретные реакции. Такая способность возникает в результате формирования промежуточного продукта при связывании антитела с антигеном (имитация переходного комплекса E-X ферментативной реакции).
