С больной головы на здоровую
Боль, от которой голова просто раскалывается пополам… Вам знакома такая картина, когда кажется, что готов выпить целую гору обезболивающих, лишь бы отпустило? Благо, аптеки предлагают целый арсенал лекарств. Но, не спешите хвататься за таблетки. Попробуйте сначала понять, отчего у вас болит голова? Разобраться в этом поможет руководитель Областного центра диагностики и лечения головной боли ОКДЦ, кандидат медицинских наук Елена Шестель.
Все «счастливые» головы болят одинаково…
У здоровых людей причиной головной боли может стать стресс или банальное переутомление. Дело в том, что такие негативные состояния, как гнев, беспокойство, страх, приводят к продолжительному напряжению мышц лица, плеч и шеи. В напряженных мышцах «зажимаются» нервные окончания, а поступающие от них нервные импульсы передаются к рецепторам, имеющимся в мягких тканях головы, – человек ощущает боль.
Длительное нахождение в сидячем полусогнутом положении также способно спровоцировать боль, поскольку спина и шея в таком положении «затекают», а это приводит к сужению сосудов и сокращению кровотока, что, в свою очередь, вызывает недостаток кислорода в тканях и скопление в них продуктов обмена веществ. В то же время расширение кровеносных сосудов (например, вследствие чрезмерного напряжения глаз) приводит к раздражению нервных окончаний, что также вызывает головную боль.
Согласно данным ВОЗ, 99% людей земли хотя бы однократно в своей жизни испытывают приступ головной боли. Чаще всего она проходит сама по себе: достаточно выпить горячего чая, отдохнуть, принять ванну добавив в воду несколько капель эфирных масел: лаванды, лимона, мяты перечной… Ароматная пена и морская соль только приветствуются! Или же постойте под горячим душем – это поможет ослабить спастические головные боли, вызванные спазмом мышцы на задней поверхности шеи и головы. Можно сделать горчичные ванны ног – они снижают давление крови в мозгу.
Но, если боль не проходит длительное время, если она часто повторяется, то разбираться с ней нужно уже в кабинете врача.
Дело в том, что головная боль может быть проявлением таких угрожающих заболеваний, как опухоль головного мозга, инфаркт или инсульт, мозговое кровоизлияние, менингит, энцефалит, травма… В этом случае речь идет о вторичных головных болях — в медицинской классификации их количество приближается к трёмстам. Но, к счастью, данная ситуация встречается только в 2% случаев. Чаще всего боли не связаны со структурными нарушениями головного мозга, носят доброкачественный характер с благоприятным прогнозом. Их называют первичными. Самые распространенные среди них — мигрень, головная боль напряжения, кластерная головная боль.
Но, к счастью, данная ситуация встречается только в 2% случаев. Чаще всего боли не связаны со структурными нарушениями головного мозга, носят доброкачественный характер с благоприятным прогнозом. Их называют первичными. Самые распространенные среди них — мигрень, головная боль напряжения, кластерная головная боль.
Болезнь ответственных людей
От мигрени страдает едва ли не пятая часть населения Земли. Замечено, что болезнь, как правило, возникает у людей честолюбивых, ответственных и добросовестных, склонных перегружать себя работой. Мигрень часто носит наследственный характер. Примечательно, что тяжёлому, но не смертельному недугу наиболее подвержен слабый пол. Признак заболевания хорошо известен: при мигрени болит только половина головы. Сильная пульсирующая боль во время приступа может охватывать глазничную, теменную, височную или затылочную область головы. Иногда перед приступом у человека появляется особая зрительная аура: мерцающие пятна, нечеткие очертания предметов, потемнение в глазах.
Мужественные внешне, нежные внутри
Однако не стоит думать, что головная боль — чисто женская привилегия. К примеру, кластерная головная боль, самая мучительная из всех, присуща исключительно мужчинам. Проявляется она характерными болевыми периодами с длительностью 15 — 180 минут, повторяющимися несколько раз в день на протяжении до 3-х месяцев. Это чрезвычайно интенсивная приступообразная боль с локализацией в области одного глаза, сопровождающаяся слезотечением, заложенностью носа и выраженным чувством тревоги и беспокойства. Боль исчезает внезапно и бывает, что несколько лет совсем не тревожит человека. Среди медиков распространено мнение, что кластерными болями страдают представители «сильного» пола с исключительно мужественной, но обманчивой внешностью. На самом деле — они мягкие, боязливые, нерешительные.
Среди медиков распространено мнение, что кластерными болями страдают представители «сильного» пола с исключительно мужественной, но обманчивой внешностью. На самом деле — они мягкие, боязливые, нерешительные.
Устал — отдохни
Всем известна головная боль, связанная с переутомлением. Её причина не только стресс, но и напряженный график работы, личные проблемы, изменение погоды. Это самый распространенный вид головной боли, так называемая головная боль напряжения. Она проявляется в виде эпизодов продолжительностью от нескольких минут до нескольких суток, обычно двухсторонняя, сжимающая или давящая, умеренной интенсивности. Но часто при отсутствии правильного лечения такая головная боль переходит в хроническую форму, носит постоянный характер и слабо снимается приёмом классических анальгетиков.
Не спешите пить таблетки
Что же делать, если болит голова? Первое и самое главное – не торопитесь принимать лекарства. Какой бы хороший, современный и дорогостоящий ни был препарат, любой из них обладает побочными эффектами. Особенно это касается гомеопатических средств и биологически активных добавок. Кроме того, самостоятельный прием лекарств дает лишь кратковременный результат, но не действует на механизмы возникновения болевого синдрома. В результате головная боль возвращается вновь и вновь, количество болеутоляющих возрастает, что приводит не только к развитию побочных воздействий самого лекарства, но и к развитию зависимости от анальгетиков, которая сама по себе тоже может провоцировать головную боль. Грамотную терапию специфическими препаратами может подобрать только врач, и принимать лекарства в таких случаях надо под строгим врачебным наблюдением.
Какой бы хороший, современный и дорогостоящий ни был препарат, любой из них обладает побочными эффектами. Особенно это касается гомеопатических средств и биологически активных добавок. Кроме того, самостоятельный прием лекарств дает лишь кратковременный результат, но не действует на механизмы возникновения болевого синдрома. В результате головная боль возвращается вновь и вновь, количество болеутоляющих возрастает, что приводит не только к развитию побочных воздействий самого лекарства, но и к развитию зависимости от анальгетиков, которая сама по себе тоже может провоцировать головную боль. Грамотную терапию специфическими препаратами может подобрать только врач, и принимать лекарства в таких случаях надо под строгим врачебным наблюдением.
Важно
Очень часто головную боль вызывают определенные провоцирующие факторы – триггеры. У всех они разные и могут меняться у одного человека от приступа к приступу. Вот наиболее распространенные из них:
- Питание.
 В основном, это нерегулярный режим питания. Кроме того, некоторые люди чувствительны к определенным видам продуктов (сыр, шоколад, кофе, цитрусовые). Алкоголь, особенно красное вино, пиво, шампанское, коктейли – частые триггеры головной боли.
В основном, это нерегулярный режим питания. Кроме того, некоторые люди чувствительны к определенным видам продуктов (сыр, шоколад, кофе, цитрусовые). Алкоголь, особенно красное вино, пиво, шампанское, коктейли – частые триггеры головной боли. - Сон. Недосыпание или продолжительный сон — частые причины головной боли. Старайтесь в выходные дни вставать не позже, чем через 2 часа от вашего привычного пробуждения в будни.
- Физические нагрузки. Тяжёлая физическая работа или интенсивные занятия в спортивном зале могут спровоцировать головную боль, но в то же время регулярные упражнения и поддержание физической формы являются хорошей защитой от этой напасти. Желательны дозированные аэробные нагрузки и плавание.
- Окружающая обстановка: яркий или мерцающий свет, сильные (иногда даже и приятные) запахи, душные помещения, резкие перемены погоды, дальние поездки (особенно со сменой часовых поясов).
- Психологические факторы: отрицательные эмоции или, как это ни удивительно, расслабление после стрессовой ситуации.

- Гормональные факторы у женщин: определенная фаза менструального цикла, беременность, климакс, прием или прерывание гормональной контрацепции.
Если вы изменили образ жизни, а у вас сохраняются головные боли и вы вынуждены принимать анальгетики больше 2 таблеток в месяц, вам необходимо обратиться к врачу.
Чего нельзя категорически:
— Употреблять алкоголь. Он расширяет сосуды и поначалу, действительно, становится легче, но затем состояние ухудшается.
— Пить кофе. Если у вас повышенное давление или есть склонность к атеросклерозу, даже одна чашка кофе может навредить. Однако для гипертоников, наоборот, пара глотков кофе будет спасением. Тем же, кто постоянно принимает лошадиные дозы этого напитка, лишняя доза не поможет, а сделает только хуже.
— Курить. Никотин вызывает резкий спазм сосудов, от этого боль станет еще интенсивнее.
Главное:
Если вы изменили ваш образ жизни, а у вас сохраняются головные боли и вы вынуждены принимать аналгетики больше 2 таблеток в месяц, вам необходимо срочно обратиться к неврологу. Жители Ростовской области имеют уникальную возможность попасть в единственный на юге России Областной центр диагностики и лечения головной боли на базе ОКДЦ. Для того, чтобы пройти углубленное обследование, соответствующее европейским стандартам и получить консультацию специалистов, достаточно иметь полис ОМС и направление из районной больницы или поликлиники.
Жители Ростовской области имеют уникальную возможность попасть в единственный на юге России Областной центр диагностики и лечения головной боли на базе ОКДЦ. Для того, чтобы пройти углубленное обследование, соответствующее европейским стандартам и получить консультацию специалистов, достаточно иметь полис ОМС и направление из районной больницы или поликлиники.
Сотрудники нашего центра головной боли являются членами Российского общества по изучению головной боли (РОИГБ).
Какие продукты расширяют сосуды головного мозга? | sortmozg
Патологический спазм сосудов приводит к расстройству кровообращения головного мозга. Снижение ежеминутного объема циркулирующей крови приводит к острым состояниям (ишемический инсульт, транзиторная ишемическая атака, субарахноидальное кровоизлияние) и хроническим заболеваниям (сосудистая энцефалопатия и сосудистая деменция).
Спазм можно предупреждать и снимать в домашних условиях при помощи правильного питания и лекарственных препаратов.
Какая клиническая картина
Специфических симптомов суженых сосудов мозга нет, за исключением остро развивающихся патологий, например, инсульта. Хронический спазм и симптоматика сужения развиваются постепенно. Некоторые хронические болезни (энцефалопатия) развиваются от 2 до 10 лет. Однако всякое патологическое сужение можно распознать на ранних этапах развития при помощи таких симптомов:
- Общемозговые признаки: головная боль, головокружение, быстрая утомляемость от простой работы, раздражительность, нарушение сна, повышенная чувствительность к свету, звуку или запаху, сонливость, отсутствие желания заниматься трудовой деятельностью.
- Вегетативные нарушения: потливость, запор, диарея, парестезии, одышка, чувство сердцебиения, снижение аппетита, боли в правом подреберье, нарушение мочеиспускания, нарушение эрекции.
Эти симптомы характерны для многих заболеваний головного мозга, поэтому называются неспецифическими. Если вы обнаружили у себя или у близких такие признаки – обратитесь к неврологу и пройдите исследования головного мозга.
Ответы на популярные вопросы
Список частых бытовых вопросов:
Кофе сужает или расширяет сосуды головного мозга?
Кофе – это типовой тонизирующий напиток за счет того, что он содержит кофеин – психостимулятор, повышающий тонус центральной нервной системы. Кофеин сужает сосуды головного мозга. Напиток показан людям, страдающим гипотонией. Однако реакция на кофе индивидуальна и может быть парадоксальной: у некоторых людей при малых объемах напитка сосуды могут расширяться и даже вызывать сонливость.
Алкоголь расширяет или сужает сосуды головного мозга?
Алкоголь и содержащие его элементы оказывают седативное воздействие на центральную нервную систему, расширяя сосуды головного мозга.
Коньяк сужает или расширяет сосуды головного мозга?
Коньяк, как представитель крепких алкогольных напитков, оказывает тормозящее и седативное воздействие на нервную систему, из-за чего сосуды головного мозга расширяются. Он понижает артериальное давление и расслабляет артерии.
Глицин расширяет сосуды?
Глицин – это ноотропное средство. Эта фармакологическая группа влияет на клетки головного мозга, защищая их от повреждения и кислородного голодания. Ноотропы улучшают обмен веществ в тканях мозга. Однако глицин никак не воздействует на тонус сосудов и не понижает артериальное давление.
Что расширяет сосуды и какие народные средства можно применять:
- Зеленый чай, содержаний катехины. Этот флавоноид оказывает мягкое расширение сосудов головного мозга. Также зеленый чай снижает артериальное давление. При повышенном давлении в день можно пить 2-3 чашки напитка.
- Отвар трав валерианы. Как приготовить: в 200 мл кипятка добавить 10 г корней растения и настоять 2-3 часа. В день следует принимать по одной столовой ложке 4 раза.
- Масло из чеснока. Как приготовить: очистите одну головку чеснока и растолките его. Залейте мелкий чеснок 100 мл подсолнечного масла. Поставьте смесь в холодильник на день, ему нужно настояться.
 На следующий день к смеси добавьте чайную ложку свежего лимонного сока и смешайте. Полученную жидкость принимайте 3 раза в день за 30 минут перед едой.
На следующий день к смеси добавьте чайную ложку свежего лимонного сока и смешайте. Полученную жидкость принимайте 3 раза в день за 30 минут перед едой.
Травы для расширения сосудов головного мозга:
- Сбор из растений: ромашка, березовые почки, зверобой, бессмертник и тысячелетник. Все части должны быть пропорциональны (1к1). Смешайте сухие части растений и залейте их 300 мл кипятка. Настаивать в течение часа. Рекомендуется принимать утром и вечером за 30 минут до приема пищи.
- Боярышник. Растение снижает артериальное давление и снимает сосудистый спазм. Как приготовить: 20-30 г сухого плода залейте 100 мл кипятка и варите в течение 5 минут. После варки процедите жидкость и дайте ему остыть и поставьте в холодильник. На следующий день принимайте по 1 столовой ложке перед едой. Рекомендуется пить в течение 3 месяцев.
Упражнения для расширения сосудов головного мозга можно выполнять в домашних условиях. Рекомендуется такая гимнастика для расширения сосудов:
- Исходное положение – стоя.
 Ноги расставлены по ширине плеч. 2-3 минуты делайте круговые движения головой по часовой и против часовой стрелки.
Ноги расставлены по ширине плеч. 2-3 минуты делайте круговые движения головой по часовой и против часовой стрелки. - Положение такое же. Полностью поднимите руки и сцепитесь пальцами, делая из него замок. Теперь сделайте 4 наклона вперед и 4 наклона назад.
- Исходное положение – лежа на спине. Вытяните руки по бокам. Теперь нужно поднимать ноги не сгибая коленями. При поднятии ног в тазобедренном суставе необходимо сделать так, чтобы нижние конечности и туловище образовывали прямой угол.
- Исходное положение – сидя. Приложитесь ладошкой ко лбу и давите на него, одно временно оказывая сопротивление мышцами шеи. В таком положении необходимо пробыть 10-15 секунд. Это упражнение разогревает мышцы шеи, расширяет магистральные артерии и улучшает кровоток головного мозга.
Питание
Продукты, расширяющие сосуды:
- Чеснок. В его состав входят эфирные масла и аллицин. Эти биологически активные вещества снимают спазм артерий и укрепляют стенки сосудов.
 Кроме того, аллицин препятствует образованию холестериновых бляшек.
Кроме того, аллицин препятствует образованию холестериновых бляшек. - Имбирь. Он так же содержи аллицин, только в меньших количествах. Кроме расширения сосудов, имбирь усиливает иммунную защиту и оказывает детоксикационную функцию.
- Лимон. Цитрусовое растение оказывает слабое воздействие на тонус сосудов, однако в комбинации с содержащимися витаминами лимон укрепляет стенку и снижает риск развития атероматозных бляшек.
- Мед. Продукт не оказывает прямого воздействия на тонус, но благодаря микроэлементам и соединениям, мед нормализирует реологические свойства крови.
- Калина. Плоды растения, для расширения следует употреблять в свежем виде. Калина снижает кровяное давление. Следует помнить об ограничении: 50 г продукта. Так, если употребить больше, калина наоборот, повышает артериальное давление и скорость сердечных сокращений за минуту.
- Зеленый чай. Расширяет просвет артерий. Для лучшего эффекта следует пить с лимоном. Лучше пить утром.
Медикаментозно
Медикаментозные средства для расширения сосудов головного мозга разделяются на такие фармакологические группы:
- Препараты, действующие непосредственно на гладкую мускулатуру сосудов.
 Они расслабляют стенки сосудов, снижают периферическое сопротивление артерий и вен, регулируют тонус и снижают кровяное давление. Препараты: Дибазол, Апрессин, Нитропруссид натрия.
Они расслабляют стенки сосудов, снижают периферическое сопротивление артерий и вен, регулируют тонус и снижают кровяное давление. Препараты: Дибазол, Апрессин, Нитропруссид натрия. - Препараты, блокирующие кальциевые каналы. Эти средства блокируют каналы, которые пропускают кальций и запускают возбуждение. Эти таблетки не дают кальцию войти в мембрану и развить потенциал действия. Препараты: Верапамил, Нифедипин.
- Ингибиторы ангиотензин превращающего фермента. Эти препараты не дают превратиться пассивной форме ангиотензина I в активную форму – ангиотензин II. Препараты: Каптоприл, Эналаприл.
- Антагонисты рецепторов ангиотензина II. Они блокируют рецепторы, которые воспринимают ангиотензин II. Представители: Лозартан.
- Препараты, активирующие калиевые каналы. Препараты расширяют каналы, чтобы как можно больше калия вошло в клетку, вследствие чего снижается возбудимость клеточной мембраны и блокируется потенциал действия клетки. Представители: Лонител, Гиперстат.

Профилактика
Чтобы сосуды находились в нормальном состоянии следует придерживаться свода правил неспецифической профилактики:
- Избегание стрессов. Баланс между трудом и отдыхом.
- Нормальный сон. Рекомендуется спать от 7 до 8 часов в сутки, но не меньше 6. Однако количество часов зависит индивидуально.
- Сбалансированное питание. В рацион должны входить овощи, фрукты, каши, зелень, соки – все эти продукты содержат витамины и биологически активные вещества, влияющие на тонус сосудов, целостность стенки и реологические свойства крови.
- от 2 до 4 раз рекомендуется посещать тренажерный зал. Нагрузки должны быть дозированными. Для профилактики можно просто заниматься утренней пробежкой и делать гимнастику.
Оригинал статьи размещён здесь:
https://sortmozg. com/lechenie/v-domashnih-usloviyah/kak-rasshirit-sosudy-golovnogo-mozga
com/lechenie/v-domashnih-usloviyah/kak-rasshirit-sosudy-golovnogo-mozga
Сосудорасширяющие средства【Интернет-Аптека】 | E-apteka
Таблетки для расширения сосудов – как выбрать эффективные
Проблема сужения кровеносных сосудов зачастую встречается при атеросклерозе, артериальной гипертензии. И если ранее с такими симптомами сталкивались пожилые, то сегодня наблюдаются проблемы и у молодого поколения. Всему виной – длительное действие раздражающих факторов на человеческий организм, что приводит его к износу (неправильный образ жизни, определенные пищевые пристрастия, курение, злоупотребление алкоголем и т.д.).
Каковы симптомы расширения сосудов?Самочувствие человека значительно ухудшается, когда происходит сужение кровеносных сосудов. Наблюдается:
• головокружение;
• снижение работоспособности;
• шум в ушах;
• ускоренная утомляемость;
• ухудшение памяти;
• частые головные боли.
Прежде чем назначать лечение препаратами для расширения сосудов головного мозга, врач ставит точный диагноз и выясняет причины возникновения патологии. Она может быть следствием чрезмерной эмоциональной нагрузки, гиподинамии, постоянных стрессовых ситуаций, физического перенапряжения, неправильного питания (это вызывает рост уровня холестерина, спазмы) и т.д.
Она может быть следствием чрезмерной эмоциональной нагрузки, гиподинамии, постоянных стрессовых ситуаций, физического перенапряжения, неправильного питания (это вызывает рост уровня холестерина, спазмы) и т.д.
Препараты направлены на снижения тонуса кровеносных сосудов – это вызивает увеличение их просвета. Артерии расслабляются, улучшается кровоток.
Существуют медикаментозные средства:
• Нейротропные. К препаратам рефлекторного действия относят валидол, центрального – резерпин, нитриты и нитраты, периферического – ганглиоблокирующие, адренолитические, симпатолитические лекарственные средства.
• Миотропные (папаверин, хлорацизин, дибазол, теобромин, эуфиллин).
Стоит учитывать, что в основном препараты, работающие на расширение сосудов, понижают давление. Есть исключения – лекарственные средства для расширения сосудов в определенных органах.
Непосредственно к медикаментам, действие которых направлено на расширение сосудов, относятся препараты:
• Блокаторы кальциевых каналов.
• На основе алкалоидов (с применением барвинка, Гинго Билоба).
В «Аптеке гормональных препаратов» представлен широкий ассортимент медикаментов. Вы обязательно найдете здесь то, что приписал лечащий врач. Есть препараты первого и второго поколений, разной фармакологической группы. Благодаря понятному интерфейсу сайта и разделению на категории можно быстро отсортировать продукцию по нужным параметрам или ввести название препарата в строку поиска.
Аура мигрени. От чего возникает
Врач-невролог, цефалголог, соучредитель «Университетской клиники головной боли» Юлия Эдвардовна Азимова подготовила серию статей о головной боли с аурой.
Вот самые частые вопросы, которые я слышу от пациентов, испытавших ауру.
Правда ли, что при ауре сначала сосуды сужаются, мозг недополучает кровь и поэтому появляются симптомы? А потом при головной боли сосуды расширяются – и от этого возникает боль?
💡 Аура связана с эпилепсией? Я вижу вспышки света, это похоже!
💊 Можно ли лечить ауру? Она мешает, когда я работаю в офисе или еду за рулем. Вдруг у меня в голове что-нибудь оторвется? 💣 Аура так похожа на инсульт.
Вдруг у меня в голове что-нибудь оторвется? 💣 Аура так похожа на инсульт.
Давайте разбираться по порядку.
Что такое аура? Это кратковременные неврологические нарушения, которые бывают у некоторых людей с мигренью перед тем, как заболит голова. Нарушения могут быть зрительными (зигзаги, радужные вспышки, пятно перед глазами), осязательными (покалывание или онемение кисти, плеча, лица), и даже обонятельными (запах). Симптомы постепенно нарастают, а затем так же уходят. Длится не более 60 минут.
Обычно на смену ауре приходит головная боль, но в некоторых случаях аура может развиваться без связи с головной болью
Вопрос 1: про сужение и расширение сосудов
Согласно устаревшей сосудистой теории мигрени предполагалось, что зрительные нарушения с последующей головной болью – следствие спазма сосудов, которые затем расширяются. На самом деле все не так 🤷♀️. Причина ауры – волна высокой электрической активности нервных клеток, которая медленно распространяется по мозгу.
А сосуды? А сосуды действительно могут сужаться и расширяться, но
- в ответ на прохождение электрической волны
- они делают это так незначительно, что изменения не влияют на питание мозга
Волна возникает в затылочной области мозга, где расположены центры зрения. Поэтому в 99% случаев аура – это зрительные симптомы.
Здесь обычно мои пациенты говорят так: «Да-да, я ощущаю, у меня приступ начинается с затылочной области». ☝️И это очень интересное наблюдение!
Ещё учёные предполагают, что во время прохождения этой «волны» меняется химический состав в области оболочки мозга, где находятся окончания тройничного нерва, которые восприимчивы к изменению химического состава. А тройничный нерв играет важную роль в возникновении приступа мигрени.
Подписывайтесь на наш Инстаграм, чтобы читать свежие материалы о диагностике и лечении головной боли!
Хирургическое лечение пациентов со стенозами сонных и позвоночных артерий и внутричерепными аневризмами головного мозга
Научный центр неврологии приглашает пройти хирургическое лечение пациентов со стенозами сонных и позвоночных артерий и внутричерепными аневризмами головного мозгаПо вопросам консультации и госпитализации обращаться
по тел.+7(985) 931-60-24
Сонные и позвоночные артерии – 4 главных сосуда в области шеи, которые кровоснабжают головной мозг. Возраст, нездоровый образ жизни, повышенное артериальное давление и высокий уровень холестерина приводит к сужению (СТЕНОЗУ) сонных и позвоночных артерий, что, в свою очередь приводит к инсульту.
Очень часто у пациента нет симптомов стенозов этих артерий и инсульт развивается неожиданно.
С целью профилактики инсульта необходимо избавить пациента от стенозов. Для этого производится два вида хирургических операций: каротидная эндартерэктомия – удаление атеросклеротической бляшки из сонной артерии в открытом поле зрения и стентирование сонной или позвоночной артерии – расширение просвета артерии с помощью стента под рентгеном.
Стент — это металлический сетчатый каркас, который устанавливается в суженный участок сосуда для его расширения.
Та или иная операция выполняется в зависимости от степени стеноза, строения атеросклеротической бляшки, сопутствующей патологии и особенностей пациента. Для выявления стенозов сонных и позвоночных артерий всему населению после 40 лет вне зависимости от наличия или отсутствия каких-либо изменений самочувствия (симптомов) необходимо проводить дуплексное сканирование артерий сонных и позвоночных артерий. Это неинвазивное безболезненное ультразвуковое исследование, позволяющее точно определить, есть ли необходимость в лечении, и его метод в том случае, когда без него не обойтись. Своевременная диагностика позволяет сохранить здоровье и качество жизни пациента.
ВНУТРИЧЕРЕПНЫЕ АНЕВРИЗМЫ
Аневризма – это различное по форме и протяженности локальное расширение сосуда головного мозга. Основными причинами их возникновения принято считать:
- Высокое АД
- Атеросклероз
- Генетический фактор
- Инфекционные заболевания
Аневризмы опасны тем, что их выпуклые участки могут оказывать давление на нерв и окружающие ткани мозга. Но самую большую опасность представляет разрыв аневризмы, который может произойти внезапно и в любой момент (травма головы, стресс, повышенные физические нагрузки и пр.). При разрыве аневризмы происходит кровоизлияние в мозг (геморрагический инсульт).
Чтобы выявить аневризму и выбрать правильную тактику лечения необходимо провести полную диагностику пациента, включая спиральную компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и рентгеноконтрастную ангиографию сосудов головного мозга. Точные результаты исследований позволяют неврологу и нейроангиохирургу подобрать наиболее подходящий метод лечения.
Хирургическая операция является единственным эффективным методом лечения аневризмы сосудов головного мозга. Получив результаты обследования пациента, хирург принимает решение о целесообразности проведения хирургической операции. Так как последствия разрыва аневризмы сосудов головного мозга носят летальный характер, проведение оперативного вмешательства может сохранить жизнь пациенту.
Предварительно хирург совместно с пациентом обсуждает возможные риски и исходы заболевания, и определяют подходящий метод лечения.
По показаниям назначается следующие виды операции:
- Клипирование аневризмы — процедура проводится следующим образом: в черепе вырезается отверстие, через которое вводят специальную металлическую клипсу и пережимают стенку поврежденного сосуда. Жизнь после клипирования имеет множество ограничений, пациенту назначается группа по инвалидности. Кроме того, этот вид оперативного вмешательства не предотвращает образования повторной аневризмы.
- Эмболизация аневризмы является одним из самых распространенных методов борьбы с заболеванием. Эмболизация аневризмы приводит к прекращению кровотока в аневризме (выпячивании), сохраняя нормальный кровоток по мозговой артерии. В процессе эмболизации через удобный сосудистый доступ (чаще паховый) под радиологическим контролем вводится катетер и проводится до аневризмы. Затем в катетер вводится более тонкий микро-катетер с уложенной внутри него проволочной микроспиралью, и заводится в полость аневризмы.
Как только кончик микрокатетера окажется в полости аневризмы, из микрокатетера высвобождается микроспираль, которая изменяет свою форму, и в виде беспорядочного мотка проволоки занимает собой полость аневризмы. При больших размерах аневризмы может понадобиться несколько спиралей. Заполненная проволочной спиралью аневризма выключается из кровотока и постепенно зарастает соединительной тканью, то есть, исключается возможность ее разрыва.
В большинстве случаев, эндоваскулярная эмболизация – наименее инвазивный на сегодня метод лечения аневризм сосудов головного мозга. При невозможности провести внутрисосудистую эмболизацию или стентирование, может быть проведена обычная нейрохирургическая операция стентирования сосуда или клеммирования аневризмы.
Атеросклероз сосудов головного мозга
Атеросклероз – самое распространенное хроническое заболевание, поражающее кровеносные сосуды, в частности, эластичные и эластично-мышечные артерии сердца, головного мозга и других органов с формированием на их внутренней поверхности жировых, чаще холестериновых отложений в виде атероматозных ( от лат. “atero” – каша) бляшек с последующим разрастанием в них плотной соединительной ткани (склерозированием) и пропитыванием солями кальция (известкованием).
Вследствие этого просвет артерий постепенно уменьшается или облитерируется, т.е. вовсе исчезает, что приводит к нарастающей недостаточности кровоснабжения тканей органа, питающихся от этой артерии. Кроме этого возможны полные закупорки (окклюзии) просвета сосудов содержимым бляшек в сочетании с тромбами, что приводит к некрозу (инфаркту) тканей или гангрене органа или части тела.
В проведенных исследованиях отмечается возможность полного обратного рассасывания холестериновой инфильтрации сосудов, что свидетельствует о возможности излечения атеросклероза на ранних стадиях его развития. Появление атеросклеротических бляшек иногда обнаруживаются уже у молодых людей в возрасте 20 лет, но наибольшая распространенность заболевания отмечается у лиц в зрелом возрасте – 50-60 лет, причем чаще у мужчин; у женщин заболевание чаще отмечается после 60 лет. Высокая распространенность этого заболевания среди населения ассоциирует его даже с одним из проявлений старения организма
Причины атеросклероза сосудов головного мозга
Среди причин возникновения заболевания следует, наряду с наследственной предрасположенностью, следует отметить часто повторяющиеся психоэмоциональные напряжения, влияющие на тонус артерий, гипертоническую болезнь, сахарный диабет, ожирение, гиподинамию и курение.
Клиническое проявление атеросклероза сосудов головного мозга определяется степенью вызванной им недостаточности (ишемии) кровообращения и питания ткани мозга. К первым признакам ишемии относятся периодически возникающая головная боль, шум в ушах преходящего характера, особенно в периоды напряженной умственной деятельности. Отмечается ухудшение памяти на текущие события, забывание слов во время разговора, но при этом память на давно прошедшие события сохраняется полностью. Нарушается сон, частыми становятся тревожные пробуждения и бессонница. У больных отмечаются изменения в психоэмоциональной сфере – они становятся мнительны, склонны к слезливости, беспричинной депрессии и “умственной жвачке” — длительному переживанию незначительных неудач или обид.
В дальнейшем у больных обнаруживаются более объективные проявления атеросклероза сосудов головного мозга – нарушение координации движений, периодическое, особенно при волнении, дрожание конечностей и головы. При обследовании крупных артерий головного мозга могут определяться признаки их обызвествления, так же становится видимой пульсация плечевых артерий. В этот период у больных вследствие временной ишемии мозга могут развиваться транзиторные (преходящие) инсульты с временными нарушениями кожной чувствительности – парестезиями, тонуса скелетной и мимической мускулатуры с ослаблением активных движений в отдельных конечностях, односторонним искажением лица за счет утраты мышечного тонуса. Наиболее грозным осложнением заболевания является ишемический инсульт части мозга вследствие полной окклюзии одной из крупных мозговых артерий, приводящий, как правило, к стойкой инвалидизации больного.
Лечение атеросклероза сосудов головного мозга
В лечении больного главной задачей врача является предупреждение дальнейшего прогрессирования процесса формирования атеросклеротических бляшек и стимуляция развития окольных путей кровообращения страдающих органов. Последнее достигается назначением индивидуальной лечебной физкультуры в виде дозированных и регулярных, соответствующих возрасту и возможностям больного, физических нагрузок. Такая мера способствует открытию коллатеральной, не задействованной в покое и в условиях привычной гиподинамии, сети сосудов, приносящих кровь к страдающему от ишемии органу. В комплексе с физическими упражнениями полезны будут прогулки на свежем воздухе, легкий массаж тела, водные процедуры, включая бальнеотерапию лечебными йодобромными, родоновыми ваннами или с применением хвойного экстракта, морской соли, отвара овса. Эти процедуры также способствуют снижению возбудимости нервной системы и нормализации артериального давления.
К мерам, направленным на предупреждение прогрессирования атеросклероза, в первую очередь относится рациональное питание с ограничением и равным содержанием растительных и животных жиров, достаточным содержанием витаминов, (в первую очередь витамина С, антиоксидантов – витаминов Е, А, а также витаминов группы В) и исключающее нарастание массы тела. В ежедневном рационе должна преобладать растительная пища – зелень, фрукты, овощи, рыба и морепродукты, должны быть ограничены белые сорта хлеба, макаронные изделия, продукты с высоким содержанием холестерина — жирное мясо, копчености, яйца и сливочное масло. В случае избыточного веса организация питания должна быть направлена на его снижение за счет ограничения калорийности пищи. Выведению избыточного холестерина из организма способствуют мероприятия по его очищению, в частности очищению кишечника от холестерина, связанного с желчью, путем периодического приема солевых слабительных средств, включения в пищу круп, богатых растительной клетчаткой, многократное орошение кишечника.
При лечении сопутствующих заболеваний, способствующих развитию и прогрессированию процесса (это в первую очередь гипертоническая болезнь и сахарный диабет), не следует стремиться к срочному снижению уровня сахара в крови и артериального давления – это может усугубить уже имеющуюся ишемию органов. Но в то же время систематическое лечение этих заболеваний также является одной из главных мер вторичной профилактики.
Медикаментозное лечение под врачебным контролем средствами, снижающими уровень холестерина в крови, в данном случае может выполнять лишь второстепенную роль.
Напоминаем наш адрес:
191014, Санкт-Петербург (СПБ), Литейный пр., д.55А
тел./факс: + 7 (812) 600-7777
Клиника «Скандинавия»
Более подробную информацию смотрите на странице «контакты».
Сосудистые Заболевания: Симптомы, Лечение, Специалисты
Что такое сосудистое заболевание?
Сосудистые нарушения, также называемые ангиопатиями на медицинском языке, в основном понимаются как заболевания артериальных, венозных и лимфатических сосудов.
В промышленно развитых странах заболевания, связанные с артериями, а также кровотоком, идущим от сердца, являются одной из главных причин смерти населения. В случае артериальных сосудистых заболеваний проводится различие между сужением (стенозом) или окклюзией (обтурацией) и расширением (делитацией) сосуда или расслоением (рассечением) его стенки. Увеличение толщины стенки сосуда является наиболее распространенным явлением при сосудистых заболеваниях артерий. Это обычно вызвано атерослерозом и может привести к полному или частичному закрытию сосуда.
Вены - кровеносные сосуды, несущие кровь к сердцу. Заболевания вен очень распространены и относятся к болезням века. Они в основном поражают ноги. Основными заболеваниями вен являются варикозное расширени вен и тромбоз .
Болезни лимфатических сосудов также относятся к сосудистым заболеваниям. Здесь наиболее серьёзной проблемой считается лимфедема , которая возникает из-за застоя лимфатической жидкости.
Какие сосудистые заболевания существуют?
Артериальные сосудистые заболевания
Сосудистый стеноз и обтурация: сужение и, в конечном итоге, полная окклюзия артериального кровеносного сосуда могут иметь разные причины. Атеросклероз является наиболее распространенной формой повреждения кровотока. На разговорном языке его также называют отвердением артерий. Он вызван воспалительной реакцией стенки сосуда. В развитии атеросклероза играют роль многие факторы. Они включают высокое кровяное давление, потребление никотина, диабет, отсутствие физических упражнений или расстройство метаболизма липидов.
В среднем у мужчин атеросклероз развивается раньше, чем у женщин, и с возрастом усиливается. Кровь переносит кислород и питательные вещества в клетки нашего организма. Из-за сужения или закупорки сосуда кровоснабжение тканей сокращается или прекращается, приводя к нехватке питания. Атеросклероз возникает в разных областях сосудистой системы и может вызывать различные симптомы в зависимости от местоположения. Это приводит ко многим различным последствиям.
Стеноз артерий может иметь и другие причины помимо артериосклероза. Например, он может быть вызван воспалением сосудов, повреждением стенки сосуда внешними факторами (лекарствами, лучевой терапией, поражением тока) или врожденным нарушением строения стенки сосуда.
Сосудистая дилатация и расслоение: патологическое расширение сосудов возникает, когда дестабилизация сосудистой стенки приводит к увеличению диаметра сосудов. Расслоение сосудов связано с расщеплением слоев их стенки. Опять же, основной причиной является атеросклероз, описанный выше.
Неатеросклеротические причины включают врожденные заболевания, такие как синдром Марфана или синдром Элерса-Данлоса. Они вызывают изменение соединительной ткани и, таким образом, также влияют на состояние стенок кровеносных сосудов. Кроме того, в развитии растяжения и расслоения артерий важную роль играет гипертония .
Венозные заболевания
Повышенное давление в венах может привести к их варикозному расширению. Сгустки крови, которые прилипают в венах и забивают их, способны вызвать тромбоз.
Какие последствия могут возникнуть и какие симптомы они вызывают?
Стенокардия
Стенокардия - этот термин относится к повторяющимся симптомам, которые являются результатом недостаточного кровоснабжения сердечной мышцы. Причиной часто является сужение коронарных артерий при атеросклерозе. Коронарные артерии снабжают сердечную мышцу кровью. Боль в груди описывается пациентами как чувство тяжести, давления, сжатия или удушения.
Хотя отдельные эпизоды стенокардии обычно вызваны физическими упражнениями или сильными эмоциями, а также расслабления, они также могут возникать в периоды отдыха или во время сна. Запущенная стенокардия опасна, поскольку она может привести к полному закрытию коронарных артерий и, следовательно, сердечному приступу.
Инфаркт миокарда
Инфаркт миокарда - опасное для жизни состояние. Оно вызвано полной окклюзией коронарного сосуда, которая может произойти, например, из-за серьезного сужения или сгустков крови. Из-за окклюзии пораженной коронарной артерии сердечная мышцы больше не может снабжаться кислородом. Если просвет поврежденного кровеносного сосуда не восстанавливается в течение нескольких часов, истощенная мышечная ткань умирает. Такая мертвая ткань называется площадью инфаркта. Чем больше закупоренный коронарный сосуд, тем больше площадь инфаркта.
Симптомы сердечного приступа могут сильно различаться от человека к человеку. Типичными являются стойкая боль в грудной клетке, которая может иррадиировать в шею, нижнюю челюсть, плечевую область и левую руку. При этом также часто наблюдается чувство слабости, беспокойства, потливости, тошноты и рвоты.
Инсульт
Инсульт вызывают нарушения кровообращения головного мозга в результате закрытия или разрыва сосуда, что приводит в внезапной потери функций некоторых областей мозга. Причиной нарушения кровообращения обычно является патологическое изменение кровотока в головном мозге (например, при атеросклерозе).
Характерными симптомами являются расстройства языка, движения, сенсорного восприятия, сознания и психики. В этом случае соответствующее лицо должно как можно скорее обратиться за медицинской помощью.
Заболевание периферических артерий
Облитерирующий атеросклероз периферических артерий (ОАПА) - это состояние, вызванное сужением аорты или артерий. Болезнь также называется перемежающейся хромотой или «витринной болезнью», потому что пациент часто останавливается из-за повторяющейся боли, а выглядит это так, как будто он рассматривает витрины магазинов.
При сужении артерий ноги не снабжаются достаточным объемом крови, и при физической нагрузке возникает боль. Если болезнь прогрессирует, боль может также появляться в состоянии покоя. У большинства людей с ОАПА также сужены сосуды сердца и мозга.
Аневризма
Аневризма - это патологическое мешковидное или веретенообразное расширение кровеносного сосуда. Она может развиваться в течение жизни в слабых точках стенки сосуда и является необратимой. Аневризмы вызваны врожденным или приобретенным изменением сосудов. Риск развития аневризмы заключается в том, что они могут разрываться. Если это произойдет, возникнет угрожающее жизни внутреннее кровотечение.
Варикозное расширение вен
Варикоз вен, также известный как варикозное расширение вен, представляет собой появление расширенных, извилистых поверхностных вен. Их хорошо видно, поскольку они обычно расположены непосредственно под кожей. Если пациент страдает от варикоза, то говорят, что он имеет варикозные вены. Такое состояние является наиболее распространенным из всех венозных заболеваний, затрагивающих примерно 20 % всех взрослых.
Задача вен заключается в переносе крови из сосудистой системы обратно в сердце. В ногах кровь должна накачиваться против силы тяжести. Это происходит в конечностях благодаря напряжению мышц. Когда мышцы снова расслабляются, кровь в ногах опускается. По этой причине внутри вен есть называемые венозные клапаны, которые можно сравнить с вентилями. Они не дают крови течь обратно. Когда венозные клапаны не закрываются должным образом, кровь течет медленнее, накапливается в сосудах, и они становятся видимыми под кожей.
Варикозные вены - это не просто косметическая проблема. Симптомы часто включают тупую боль или ощущение тяжести в ногах после долгой нагрузки.
Развивается усталость, тяжесть и напряжение в ногах, которые проходят после того, как пациент полежит или подвигается. Ночью в ногах могут появляться судороги. Иногда возникает так называемый отек, то есть опухание голени и лодыжек. При сильном расширении вен могут появляться язвы кожи над лодыжками, кровотечение и тромбоз.
Тромбоз
Тромбоз -это закупорка вены кровяным сгустком. Сгустки крови медицинским языком называются тромбами. Они вызваны защитной функцией нашего организма в результате свертывания крови. При повреждении данный механизм защищает организм от кровотечения, заставляя кровь сгущаться, закрывая рану. Когда такие сгустки попадают в кровоток, они могут закрыть просвет сосуда и вызвать осложнения. В основном это тромбоз вен, особенно глубоких вен нижних конечностей.
Если способность крови к свёртываемости в организме возрастает, риск тромбоза также увеличивается. Факторами риска здесь является прием противозачаточных таблеток, курение, беременность, обезвоживание, избыточный вес и т.д.
Симптомы тромбоза вен нижних конечностей включают боль, отек, тяжесть и напряжение, перегрев и покраснение или синеватость ног.
Наиболее опасным осложнением тромбоза является то, что тромб может оторваться и мигрировать в легкие. Это заболевание называется легочной эмболией, которая способна привести к смерти.
Какие врачи являются специалистами в сосудистых заболеваниях?
Специалистами по диагностике и лечению заболеваний кровеносных сосудов являются ангиологи и ссосудистые хирурги. Ангиология является разделом внутренней медицины и изучает функции и заболевания артериальных, венозных и лимфатических сосудов. Сосудистые хирурги являются специалистами в области сосудистой хирургии.
Опрос пациентов, тщательный осмотр и дополнительные методы обследования с помощью медицинских приборов позволяют установить диагноз. К обследованиям с помощью специальной медтехники относятся ультразвуковые и другие методы визуализации, такие как ангиография, магнитно-резонансная и компьютерная томография.
Ангиологи и сосудистые хирурги очень часто сотрудничают с кардиологами, неврологами, дерматологами и специалистами по лимфатической системе.
Контроль церебрального кровотока — Церебральное кровообращение
Мозг использует ~ 20% доступного кислорода для нормального функционирования, что делает жесткую регуляцию кровотока и доставку кислорода критическими для выживания [133]. В нормальном физиологическом состоянии общий кровоток к головному мозгу удивительно постоянен, отчасти из-за значительного вклада крупных артерий в сосудистое сопротивление [58] (см. Сегментарное сосудистое сопротивление ). Кроме того, паренхиматозные артериолы имеют значительный базальный тонус и также вносят значительный вклад в сопротивление сосудов головного мозга [58,105].Высокая метаболическая потребность нейрональной ткани требует тесной координации между нейрональной активностью и кровотоком в паренхиме мозга, известной как функциональная гиперемия [21,22,134] (см. Регламент нервных клеток и астроцитов ). Однако для увеличения потока в области мозга, которые этого требуют, сосуды, расположенные выше по потоку, должны расширяться, чтобы избежать снижения микроваскулярного давления ниже по потоку [58,135]. Следовательно, в головном мозге возникают скоординированные реакции кровотока, вероятно, из-за проводимой или опосредованной потоком вазодилатации от дистальных к проксимальным сегментам артерий и миогенных механизмов, которые увеличивают кровоток в ответ на снижение давления [94] (см. Myogenic Response ).
Церебральная гемодинамика
Кровоток в головном мозге можно смоделировать с физической точки зрения как поток в трубке с допущением, что поток является устойчивым, ламинарным и однородным через тонкостенные (толщина стенки <10% просвета) не- растяжимые трубки [87]. Эти предположения не применимы к крупным артериям с толстыми стенками или к микроциркуляции, кровоток в которых неньютоновский [161]. Закон Ома гласит, что расход пропорционален разнице давлений на входе и выходе (Δ P ), деленной на сопротивление потоку ( R ): расход = Δ P / R .В головном мозге Δ P — это церебральное перфузионное давление (ЦПД), разница между внутриартериальным давлением и давлением в венах. Венозное давление обычно низкое (2–5 мм рт. Ст.) И напрямую зависит от внутричерепного давления (ВЧД). Следовательно, Δ P рассчитывается как разница в CPP и венозном давлении или ICP, в зависимости от того, что больше. Кровоток также оценивается по закону Пуазейеля, который гласит, что поток напрямую связан с Δ P , вязкостью крови и длиной сосуда (предполагается, что она постоянна) и обратно пропорционально радиусу в четвертой степени: поток = (8 × η × L) / r 4 [136].Таким образом, радиус является самым мощным детерминантом кровотока, и даже небольшие изменения диаметра просвета оказывают значительное влияние на мозговой кровоток, и именно благодаря этому механизму сосудистое сопротивление может быстро измениться, чтобы изменить региональный и глобальный мозговой кровоток [137].
Ауторегуляция церебрального кровотока
Ауторегуляция церебрального кровотока — это способность мозга поддерживать относительно постоянный кровоток, несмотря на изменения перфузионного давления [137]. Ауторегуляция присутствует во многих сосудистых руслах, но особенно хорошо развита в мозге, вероятно, из-за необходимости постоянного кровоснабжения и гомеостаза воды.У взрослых с нормальным АД церебральный кровоток поддерживается на уровне ~ 50 мл на 100 г ткани мозга в минуту при условии, что CPP находится в диапазоне от ~ 60 до 160 мм рт. Ст. [138]. Выше и ниже этого предела ауторегуляция теряется, и церебральный кровоток становится линейно зависимым от среднего артериального давления [71, 72, 139]. Когда CPP падает ниже нижнего предела ауторегуляции, возникает церебральная ишемия [27, 140]. Снижение мозгового кровотока компенсируется увеличением извлечения кислорода из крови [141].Клинические признаки или симптомы ишемии не наблюдаются до тех пор, пока снижение перфузии не превысит способность увеличения экстракции кислорода для удовлетворения метаболических потребностей. На этом этапе возникают клинические признаки гипоперфузии, включая головокружение, изменение психического статуса и, в конечном итоге, необратимое повреждение тканей (инфаркт) [140, 141].
Механизмы ауторегуляции в головном мозге до конца не изучены и, вероятно, различаются при повышении или понижении давления. Хотя участие нейронов в ауторегуляции является привлекательной, исследования показали, что ауторегуляция церебрального кровотока сохраняется у симпатически и парасимпатически денервированных животных, что указывает на то, что основной вклад внешних нейрогенных факторов в ауторегуляцию мозгового кровотока маловероятен [70] (см. Периваскулярная иннервация ).Недавно была показана роль оксида азота в нейронах в модуляции ауторегуляции мозгового кровотока, предполагая, что, хотя внешняя иннервация может не участвовать, внутренняя иннервация может играть роль [62]. Предполагается, что биопродукты метаболизма также играют роль в ауторегуляции [142]. Снижение мозгового кровотока стимулирует высвобождение вазоактивных веществ из мозга, вызывающих расширение артерий. Кандидатами на эти вазоактивные вещества являются H + , K + , O 2 , аденозин и другие.Ауторегуляция церебрального кровотока, когда давление колеблется на верхнем конце ауторегуляторной кривой, наиболее вероятно из-за миогенного поведения гладких мышц головного мозга, которые сокращаются в ответ на повышенное давление и расширяются в ответ на пониженное давление [68,69–71] . Важный вклад миогенной активности в ауторегуляцию продемонстрирован in vitro в изолированных и находящихся под давлением церебральных артериях, которые сужаются в ответ на повышенное давление и расширяются в ответ на пониженное давление [71,105] (см. Myogenic Response ).Ауторегуляция при давлениях ниже миогенного диапазона, вероятно, включает гипоксию и высвобождение метаболических факторов [68].
Важность ауторегуляции нормальной функции мозга подчеркивается тем фактом, что серьезное повреждение головного мозга происходит при потере механизмов ауторегуляции. Например, во время острой гипертензии при давлении выше ауторегуляторного предела миогенное сокращение гладкой мускулатуры сосудов преодолевается избыточным внутрисосудистым давлением и происходит принудительное расширение сосудов головного мозга [143–146].Потеря миогенного тонуса во время принудительной дилатации снижает цереброваскулярное сопротивление, что может привести к значительному увеличению церебрального кровотока (300–400%), известному как ауторегуляторный прорыв [143–146] (). Кроме того, снижение цереброваскулярного сопротивления увеличивает гидростатическое давление на церебральный эндотелий, вызывая образование отека [143–145], лежащего в основе таких состояний, как гипертоническая энцефалопатия, синдром задней обратимой энцефалопатии (PRES) и эклампсия [143 147] (см. Vasogenic Образование отека ).
РИСУНОК 16
Отслеживание CBF (в единицах лазерного допплера) и ABP (в мм рт. Ст.) В ответ на возрастающие дозы PE. В этом эксперименте CBF увеличивался в четыре раза по сравнению с исходным уровнем, когда АД увеличивалось со 140 до 210 мм рт.ст., демонстрируя прорыв ауторегуляции. Используется (подробнее …)
Несмотря на то, что гипертоническая энцефалопатия является редкостью с момента появления эффективной антигипертензивной терапии, она возникает в результате внезапного устойчивого повышения артериального давления, достаточного для превышения верхнего предела ауторегуляции мозгового кровотока (> 160 мм рт. [148–150].Ранние исследования реакции сосудов головного мозга на высокое кровяное давление привели к появлению концепции гипертонического вазоспазма. Считалось, что острая гипертоническая энцефалопатия является результатом спазма — определяемого как неконтролируемое сужение сосудов — церебральных артерий, вызывающего ишемию ткани головного мозга [151, 152]. Эта концепция возникла из наблюдений Байрома [151], который произвел экспериментальную почечную гипертензию и обнаружил, что ~ 90% крыс с гипертензией с неврологическими проявлениями имели множественные корковые пятна экстравазации трипанового синего, тогда как крысы без церебральных симптомов имели нормальную цереброваскулярную проницаемость.Он также отметил то, что он назвал чередующейся вазоконстрикцией / расширением сосудов пиальных сосудов, явление, известное как появление «колбасной нити». Это наблюдение привело его к выводу, что церебральный вазоспазм вызывает ишемию и образование отека в ответ на острую гипертензию. Позже Байром изменил свою точку зрения и сослался на открытие брыжеечного кровообращения, согласно которому в сосудах с таким видом «колбасной нити» протеин просачивается только в расширенные части сосудов [153,154]. С тех пор было установлено, что высокое кровяное давление приводит к усилению мозгового кровотока и «прорыву ауторегуляции» [155].Дальнейшие эксперименты подтвердили, что потеря миогенной вазоконстрикции во время принудительной дилатации, а не спазм, является критическим событием при гипертонической энцефалопатии [156].
Сегментарное сосудистое сопротивление
В периферическом кровообращении небольшие артериолы (<100 мкм в диаметре) обычно являются основным местом сосудистого сопротивления (157). Однако в головном мозге как крупные артерии, так и мелкие артериолы вносят значительный вклад в сопротивление сосудов. Прямое измерение градиента давления в различных сегментах мозгового кровообращения показало, что крупные экстракраниальные сосуды (внутренние сонные и позвоночные) и внутричерепные пиальные сосуды вносят ~ 50% сопротивления сосудов головного мозга [58, 158].Сопротивление крупных артерий в головном мозге, вероятно, важно для обеспечения постоянного кровотока в условиях, которые изменяют кровоток локально, например, метаболизм. Большое сопротивление артерии также ослабляет изменения в нижерасположенном микрососудистом давлении во время повышения системного артериального давления. Таким образом, сегментарное сосудистое сопротивление в головном мозге является защитным механизмом, который помогает обеспечить постоянный кровоток в органе с высокой метаболической потребностью без патологически повышенного гидростатического давления, которое может вызвать вазогенный отек.
Регуляция нервных клеток и астроцитов
В отличие от пиальных артерий и артериол, паренхимные артериолы тесно связаны с астроцитами и, в меньшей степени, с нейронами. Оба эти типа клеток могут играть роль в контроле местного кровотока [2,12,22,32]. Подкорковые микрососуды иннервируются изнутри паренхимы головного мозга и уникальны тем, что большинство веркозов граничат с концами астроцитов, окружающими артериолы, и, таким образом, не имеют обычных сосудисто-нервных соединений [135].Нейроны, чьи клеточные тела находятся в подкорковых областях мозга (например, базальное ядро, голубое пятно, ядро шва), проецируются в корковые микрососуды, чтобы контролировать локальный кровоток путем высвобождения нейромедиатора (например, ACH, норэпинефрина, 5HT) [22] () . Высвобождение нейротрансмиттера стимулирует рецепторы гладких мышц, эндотелия или астроцитов, вызывая сокращение или расширение, тем самым регулируя местный кровоток в соответствии с потребностями нейронов [22,98,134]. Некоторое время известно, что астроциты могут выделять вазоактивные факторы [159].Недавно появились доказательства участия астроцитов в местном контроле кровотока in vivo. Их близкое прилегание к микрососудам, охватывая почти все паренхимные артериолы и капилляры с небольшим контактом с нейронами, делает вероятным вовлечение астроцитов на этом уровне [21,22,98,134]. Исследования срезов головного мозга, в которых вся нервно-сосудистая единица не повреждена, показали, что прямая электрическая стимуляция нейрональных процессов повышает содержание кальция в концевых частях астроцитов и вызывает расширение близлежащих артериол [160].Стимуляция астроцитов также повышает содержание кальция в конечностях и оказывает аналогичное вазоактивное действие на паренхиматозные артериолы; однако, происходит ли расширение или сужение, по-видимому, зависит от уровня кальция и, что неудивительно, от тонуса покоя [161]. Было высказано предположение, что повышение уровня кальция в астроцитах высвобождает вазоактивные факторы, включая K + , 20-HETE и PGE 2 [160–162]. Однако слабым местом подготовки срезов мозга является то, что он не позволяет артериолам находиться под давлением или течь.Таким образом, роль миогенного ответа, который может значительно изменять любые сигналы, происходящие от астроцитов, in vivo неизвестна.
РИСУНОК 17
Краткое описание регуляции корковых микрососудов клетками, расположенными в подкорковых областях и в коре головного мозга. Возможность того, что интернейроны также вызывают высвобождение вазоактивных молекул из астроцитов, не включена для ясности. (подробнее …)
Влияние кислорода
Мозг имеет очень высокую метаболическую потребность в кислороде по сравнению с другими органами, и поэтому неудивительно, что острая гипоксия является мощным расширителем мозгового кровообращения, вызывающим заметное увеличение в мозговом кровотоке [163].В общем, кровоток в головном мозге не изменяется до тех пор, пока ткань P O 2 не упадет ниже ~ 50 мм рт. Ст., Ниже которого церебральный кровоток существенно возрастет [163]. По мере дальнейшего уменьшения гипоксии на P O 2 церебральный кровоток может повышаться до 400% от уровня покоя [164]. Увеличение мозгового кровотока не изменяет метаболизм, но сатурация гемоглобина падает с ~ 100% при P O 2 > 70 мм рт. Ст. До ~ 50% при P O 2 <50 мм рт.Острая гипоксия вызывает усиление мозгового кровотока за счет прямого воздействия на сосудистые клетки церебральных артерий и артериол. Вызванное гипоксией падение уровня АТФ открывает каналы K ATP на гладких мышцах, вызывая гиперполяризацию и вазодилатацию [165]. Кроме того, гипоксия быстро увеличивает локальную продукцию оксида азота и аденозина, что также способствует расширению сосудов [166]. Хроническая гипоксия увеличивает церебральный кровоток за счет влияния на плотность капилляров [16-19] (см. Microcirculation and Neurovascular Unit ).
Влияние двуокиси углерода
Двуокись углерода (CO 2 ) оказывает глубокое и обратимое влияние на церебральный кровоток, так что гиперкапния вызывает заметное расширение церебральных артерий и артериол и усиление кровотока, тогда как гипокапния вызывает сужение и снижение кровоснабжения поток [167,168]. Мощный сосудорасширяющий эффект CO 2 демонстрируется обнаружением того факта, что у людей вдыхание 5% CO 2 вызывает увеличение мозгового кровотока на 50%, а вдыхание 7% CO 2 вызывает увеличение церебральной крови на 100%. поток [168].Хотя было предложено несколько механизмов, участвующих в гиперкапнической вазодилатации, основной механизм, по-видимому, связан с прямым действием внеклеточного H + на гладкие мышцы сосудов [169]. Это подтверждается данными о том, что ни бикарбонат-ион, ни изменения в P CO 2 сами по себе не влияют на диаметр церебральной артерии [170]. Другие предложенные механизмы, участвующие в реакции на изменения в P CO 2 , включают простаноиды, расширяющие сосуды, и оксид азота; однако участие этих медиаторов, по-видимому, зависит от вида [171, 172].
Повышение церебрального кровотока и локальное сужение капилляров, вызванное стимуляцией, зависит от проводимых сосудистых реакций.
Значимость
Перициты расположены на внешней стенке капилляров. Однако вопрос о том, участвуют ли перициты в регуляции кровотока в капиллярах головного мозга и каким образом, остается открытым. Мы сообщаем, что капиллярно-сосудистые реакции в основном инициируются и достигают максимума в капиллярах, прилегающих к артериолам. Эти сосудистые реакции проходят вдоль капилляров со скоростью 5–20 мкм / с.Проведенные сосудистые реакции в капиллярах головного мозга, по-видимому, связаны с перицитами, настенными клетками микрососудов и могут быть новым модулятором сосудистой функции в головном мозге.
Abstract
Функциональная нейровизуализация, такая как фМРТ, основана на сочетании нейрональной активности и сопутствующих изменений мозгового кровотока (CBF) и метаболизма. Однако связь между CBF и событиями на уровне проникающих артериол и капилляров не установлена. Недавние открытия предполагают активную роль капилляров в контроле CBF, а перициты на капиллярах могут быть основными регуляторами CBF и инициаторами сигналов функциональной визуализации.Здесь, используя двухфотонную микроскопию мозга живых мышей, мы демонстрируем, что вызванное стимуляцией увеличение синаптической активности в соматосенсорной коре головного мозга мыши вызывает расширение капилляров, начинающееся в основном в капилляре первого или второго порядка, распространяясь вверх и вниз по течению на 5– 20 мкм / с. Таким образом, наши данные подтверждают активную роль перицитов в контроле сосудов головного мозга. Глиотрансмиттер АТФ, нанесенный на капилляры первого и второго порядка путем выдувания микропипетки, вызвал дилатацию с последующим сжатием, которое также распространялось со скоростью 5–20 мкм / с.Сужение капилляров, вызванное АТФ, блокировалось пуринергическими рецепторами P2. Таким образом, проводимые сосудистые ответы в капиллярах могут быть ранее не идентифицированным модулятором цереброваскулярной функции и функциональных нейровизуализационных сигналов.
Функция мозга возникает в результате передачи сигналов в нейронах и астроцитах и между ними, вызывая колебания скорости мозгового метаболизма кислорода и церебрального кровотока (CBF). Нормальная функция мозга зависит от сохраненного поступления глюкозы и кислорода, которое опосредуется нервно-сосудистой связью, устойчивой связью между активностью мозга и CBF.Нейроваскулярная связь зависит от функциональных свойств ассоциации микрососудов головного мозга, астроцитов, перицитов и нейронов, которые вместе составляют нервно-сосудистую единицу (1).
Традиционно считается, что артериолы головного мозга контролируют CBF, а капилляры головного мозга служат в обмене веществами между кровью и мозгом. Этот взгляд на динамику CBF был недавно коренным образом изменен открытием, что и артериолы, и капилляры участвуют в обмене веществ (2) и цереброваскулярном сопротивлении (3, 4).В частности, модифицированные гладкомышечные клетки, называемые перицитами, прикрепляются к капиллярам и могут регулировать CBF на капиллярном уровне (3, 5, 6). Однако это положение до конца не изучено. Перициты сетчатки сужаются под действием АТФ и расширяются нейротрансмиттерами in vitro (5), а также сужаются in vivo после инсульта (7). В ответ на световую стимуляцию капилляры сетчатки активно расширяются и регулируют кровоток независимо от артериол (8). Более того, передача сигналов глиального Ca 2+ регулирует капиллярный, но не артериолный кровоток как в сетчатке, так и в коре головного мозга (8, 9).Тем не менее, перициты капилляров не могут быть сократительными, и что регуляция CBF в ЦНС опосредуется только гладкомышечными клетками в проникающих артериолах (p.a.s) и капиллярах, но не перицитами на капиллярах (10–12). Это противоречие может быть более очевидным, чем реальным, потому что оно зависит от того, как определяются перицит и капилляр, а не от роли капилляров головного мозга в цереброваскулярном контроле. Мы решили проанализировать изменения в капиллярах мозга на основе порядка ветвления из p.а. (13). Используя эту беспристрастную методологию, наше исследование может способствовать пониманию вклада капилляров и перицитов в цереброваскулярный контроль и взаимодействие между капиллярами и артериолами.
Все капилляры покрыты перицитами (14), а перициты почти полностью покрыты концевыми ножками астроцитов (15), что повышает вероятность того, что растворимые сигнальные молекулы, высвобождаемые астроцитами в микроокружение, воспринимаются специализированными поверхностными рецепторами на перицитах.АТФ является основным передатчиком, с помощью которого астроциты связываются с соседними астроцитами (16), а также важным паракринным передатчиком в передаче сигналов нейронам (17) и, возможно, перицитам (18). Поэтому важной частью этого исследования было изучение влияния АТФ на перициты капилляров головного мозга in vivo.
В текущем исследовании использовалась двухфотонная микроскопия in vivo модели трансгенных мышей с флуоресцентными перицитами. Зависимое от активности увеличение синаптической активности было исследовано, чтобы определить, являются ли капилляры всех порядков ветвления расширенными или суженными, или только капилляры, близкие к p.a., и проявляют ли капилляры проводимые сосудистые ответы (CVR), подобные пиальным артериолам.
Наше исследование подтверждает мнение о том, что перициты играют активную роль в нервно-сосудистом соединении. Кроме того, результаты показывают, что и артериолы, и капилляры способствуют контролю сосудов головного мозга во время физиологической стимуляции, и что пространственно ограниченные CVR могут способствовать регулированию потока в капиллярах мозга и пространственно-временным характеристикам функциональных нейровизуализационных сигналов.
Результаты
CVR инициируются на капиллярах или в год.
Мы использовали двухфотонную микроскопию in vivo для изображения сосудистой сети в коре головного мозга усов анестезированных мышей, экспрессирующих DsRed в перицитах под контролем промотора NG2. Для мечения плазмы крови использовали FITC-декстран (показан зеленым на фиг. 1 A ). Пациенты были однозначно идентифицированы in vivo путем прослеживания их связей с пиальными артериолами и по четким непрерывным кольцам гладких мышц вокруг них.Для анализа данных использовались только паспортные данные с продольной осью, перпендикулярной плоскости x – y. Капилляры были идентифицированы как микрососуды, отходящие от половой оболочки глаза. с продольной осью, параллельной плоскости x – y. Такое геометрическое расположение было необходимо для надежного измерения изменений диаметра артериол и капилляров. Перициты были идентифицированы как NG2-положительные настенные клетки на капиллярах, ответвляющихся от артериолы. Тела перицитов пространственно отделены от п.а.и друг друга, а отдельные перициты были идентифицированы по отросткам, идущим продольно вдоль капилляров (Fig. 1 A ).
Рис. 1.Функциональное расширение сосудов в коре ствола мышей. ( A ) Двухфотонное изображение стволовой коры мышей NG2-DsRed на глубине ~ 150 мкм. ПА разветвляются по горизонтали от капилляра (первый порядок). Дальнейшие ответвления определяются как капилляры второго и третьего порядка. Перициты помечаются красным флуорофором (NG2-DsRed), а просвет сосуда — FITC-декстраном (зеленый).Области интереса размещаются поперек сосуда, чтобы можно было измерить диаметр сосуда (цветные полосы). (Шкала: 10 мкм.) ( B ) Диаметры сосудов при различных порядках капилляров. p.a., 15,09 ± 4,15 мкм; 1-я крышка (капилляры первого порядка), 7,18 ± 1,93 мкм; 2-я крышка (капилляры второго порядка), 6,25 ± 2,43 мкм; 3-я крышка (капилляры 3-го порядка), 7,63 ± 2,47 мкм. Годовой отчет диаметр значительно больше, чем у всех порядков капилляров. *** P <0,001, однофакторный дисперсионный анализ с апостериорным тестом.( C ) Пример кривой интенсивности флуоресценции во времени в синей области интереса в A показан серым изображением, а две красные кривые указывают на стенку сосуда ( верхний ). Расстояние между двумя красными кривыми рассчитывается как изменение диаметра сосуда от времени ( Нижний ). ( D ) Нормализованное изменение диаметра капилляров с течением времени в разных порядках капилляров в ответ на стимуляцию подушечками усов. Короткая вертикальная полоса — это место, где кривая достигает пика 50%, что определяется как начало реакции.( E ) Распределение участков, в которых началась функциональная дилатация ( n = 29 мест). ( F ) Несколько рентабельности инвестиций в год. капилляры первого, второго и третьего порядка отмечены красным, синим, зеленым и желтым цветом соответственно. (Масштаб: 10 мкм.) ( G ) В этом эксперименте на мышах полумаксимальная латентность дилатации каждой области интереса нанесена соответствующими цветами слева на географическом расстоянии от точки зрения. Пунктирными линиями показана линейная аппроксимация проведенной дилатации.( H ) Максимальная амплитуда дилатации нанесена соответствующими цветами слева вдоль географического расстояния от точки зрения. ( I ) Восемнадцать из 29 визуализированных сосудов продемонстрировали кондуктивную функциональную дилатацию с проводящей скоростью выше по потоку 12,65 ± 0,96 мкм / с и со скоростью ниже по потоку 12,83 ± 0,64 мкм / с. Не было обнаружено существенной разницы между скоростями проводимости на входе и выходе. n.s., не имеет значения; P > 0,05, непарный t проба.( J ) Время до 50% максимальной дилатации было значительно больше в капиллярах третьего порядка, чем в год. и капилляры первого порядка. Капилляры второго порядка расширяются значительно медленнее, чем капилляры первого порядка. * P <0,05, однофакторный дисперсионный анализ с апостериорным тестом. ( K ) Максимальная амплитуда расширения в капиллярах разного порядка. Капилляры первого и второго порядка показали значительно больший отклик, чем другие места. * P <0.05, односторонний дисперсионный анализ с апостериорным тестом. Все планки погрешностей представляют SEM.
Основываясь на z-стеках коры, мы сегментировали кровеносные сосуды по порядку ветвления, где 0 — п.о., 1 — капилляр первого порядка, отходящий от артериолы, и так далее (рис. 1 A ). В состоянии покоя диаметры п.а. капилляры первого, второго и третьего порядка были 15,09 ± 0,10 мкм, 7,18 ± 0,04 мкм, 6,25 ± 0,10 мкм и 6,75 ± 0,28 мкм соответственно. Годовой отчет был значительно шире капилляров, но диаметр капилляров был одинаковым для первых трех порядков капилляров (рис.1 В ).
Сообщается, что капилляры первого порядка расширяются первыми в ответ на соматосенсорную стимуляцию, и время до расширения сосудов в капиллярах первого порядка обычно предшествует расширению в ПА. (3). В настоящем исследовании временное разрешение не позволило нам оценить различия во времени начала вызванной стимуляцией вазодилатации, но в качестве заместителя мы использовали латентность от начала стимула до 50% максимальной дилатации (рис.1 D ). и фильм S1). Из 29 препаратов дилатация, вызванная стимуляцией, была достигнута первой в капиллярах первого порядка в 55% экспериментов, тогда как дилатация была достигнута первой в p.а. в 21% и в капиллярах второго или третьего порядка в 24% экспериментов (рис. 1 E ). Затем мы оценили, существует ли закономерность в развитии расширения капилляров, то есть происходит ли расширение сначала в определенной точке и распространяется ли реакция в соответствии с порядком ветвления капилляров. Для этой цели были нарисованы несколько прямоугольных областей интереса (ROI) с длинной стороной, перпендикулярной стенке сосуда, как показано цветовой кодировкой на рис. 1 F .Половинную максимальную латентность и максимальное расширение сосудов для каждой области интереса строили как функцию географического расстояния вдоль сосудистой сети от р.а. используя ту же цветовую кодировку, что и квадраты, представляющие области интереса (рис. 1 G и H ). Рис. 1 G показывает плоскость x – y одной мыши. Дилатация началась в капилляре первого порядка, и дилатация распространилась на р.а. и второй и третий капилляры линейно. Капилляры первого и второго порядков продемонстрировали наиболее сильную дилатацию (рис.1 H ). Временная последовательность сосудистых реакций может быть представлена для 18 из 29 экспериментов; в 11 экспериментах стабильность базовой линии была неоптимальной. В экспериментах с достаточно стабильной базовой линией средняя проводящая скорость на входе составляла 12,65 ± 0,96 мкм / с, а средняя проводящая скорость на выходе составляла 12,83 ± 0,64 мкм / с (рис. 1 I ). Расширение сосудов распространяется с одинаковой скоростью вверх и вниз по течению ( P = 0,67). Расширение капилляров второго и более высокого порядка происходило значительно медленнее, чем в капиллярах первого порядка и p.а. (Рис. 1 J ), тогда как изменения диаметра были значительно больше в капиллярах первого и второго порядка, чем в капиллярах р.а. и капилляры высших порядков (рис. 1 K ).
Чтобы исключить возможность того, что на проводимые ответы влияет дрейф фокуса, мы выполнили визуализацию гиперстека (непрерывные и повторяющиеся записи изображений z-стека) во время стимуляции подушечками усов. Изображения были сглажены, чтобы создать фильм временного ряда с помощью проекций максимальной интенсивности для каждого стека изображений.Эта процедура подтвердила CVR в АП и капиллярах при стимуляции усов, как в верхнем, так и в нижнем потоке, в пяти из пяти экспериментов ( Supporting Information , Fig. S1, and Movie S2).
CVR, индуцированных местной инъекцией АТФ.
Пуринергическая передача сигналов может влиять на нервно-сосудистую единицу при патологических состояниях, например, во время церебральной ишемии, когда АТФ высвобождается в высоких концентрациях (19⇓⇓ – 22). АТФ сужает перициты и капилляры сетчатки in vitro, что представляет интерес, поскольку короткие периоды ишемии приводят к феномену отсутствия оплавления и уменьшению калибра мелких сосудов (7, 23).Мы исследовали влияние активации пуринергических рецепторов на перициты и капилляры in vivo путем локальной инъекции АТФ в ствол коры головного мозга мышей NG2-DsRed. Под двухфотонным микроскопом стеклянную микропипетку вводили в кору и продвигали в непосредственной близости от р.а. и первые несколько порядков капилляров. Смесь 10 мкМ Alexa 594 (красный цвет в стеклянной микропипетке) и 1 мМ АТФ выдавливали из микропипетки под давлением воздуха (фиг. 2 A и B ).Вдыхание АТФ вызывало расширение капилляров с последующим сужением (рис. 2 B и Movie S3). Пятнадцать прямоугольных областей интереса были изучены на капиллярах разного порядка (рис. 2 C ), и нормированное изменение диаметра было нанесено на график во времени для каждой области интереса (рис. 2 D ). Амплитуды расширения или сужения определялись как положительные или отрицательные амплитуды при максимальном сосудистом ответе. О латентном периоде расширения и сжатия сообщалось как время до полу положительного или отрицательного максимума после начала затяжки (рис.2 E ). Четыре переменных были нанесены на график в зависимости от географического расстояния вдоль сосудистой сети от р.а. (Рис.2 F — I ). Такая же цветовая кодировка использовалась для квадратов, представляющих ROI. Точка ветвления капилляра первого-второго порядка показала наиболее сильную и раннюю дилатацию и сужение, тогда как капилляр третьего порядка имел очень небольшое изменение диаметра (рис. 2 F и G ). Значительно более высокая амплитуда как вазодилатации, так и вазоконстрикции была обнаружена в капиллярах первого и второго порядка, тогда как диаметр капилляров более высокого порядка практически не изменился ( n = 7; рис.3 A и B ). Латентные периоды вазодилатации и вазоконстрикции в капиллярах третьего и более высокого порядка были значительно дольше, чем в капиллярах более низкого порядка (рис. 3 C и D ). Не было обнаружено существенной разницы для среднего расстояния от наконечника пипетки до капилляров разного порядка, что исключает влияние расстояния до наконечников пипетки на полученные ответы (рис. 3 E ). Кроме того, следы от отдельных мышей показали отсутствие корреляции между расстоянием между дозатором и характеристиками ответа (т.е.е., задержка и амплитуда) (рис. S2).
Рис. 2.Выдувание АТФ микропипеткой вызывает расширение сосудов с последующим сужением. ( A ) Схема экспериментальной установки in vivo. Микропипетку для выдувания помещают рядом с участком около артериолы. Микропипетка содержит смесь 10 мкМ Alexa 594 (красный цвет в стеклянной микропипетке) и 1 мМ АТФ. ( B ) Видеозаписи динамики затяжки с 1 мМ АТФ из микропипетки. Расширение сосуда предшествует сужению.Пунктирными линиями обозначены контуры сосуда в состоянии покоя. (Шкала: 10 мкм.) ( C ) Вдоль сосудистой сети размещают несколько областей интереса с уникальным цветом для измерения диаметра сосуда. (Шкала: 10 мкм.) ( D ) Нормализованное изменение диаметра нанесено на график во времени для каждой области интереса. Области интереса и цвет трассы имеют одинаковую кодировку. ( E ) Амплитуды расширения или сжатия определяются как положительные или отрицательные амплитуды при максимальном сосудистом ответе. О латентности расширения и сжатия сообщают как время до полу положительного или отрицательного максимума после начала затяжки.( F — I ) В этом эксперименте на мышах распределение всех областей интереса в C и D с амплитудой расширения ( F ), амплитудой сжатия ( G ), латентностью дилатации ( H ), и задержка сужения ( I ) на географическом расстоянии от компьютера. вдоль сосудистой сети. Пунктирные линии представляют собой линейную аппроксимацию проводящих откликов на входе и выходе.
Рис. 3.Расширение и сужение, вызванные АТФ-затяжкой, различаются по амплитуде и латентности в капиллярах разного порядка.( A ) Амплитуды расширения и ( B ) сужения значительно выше в капиллярах первого и второго порядка по сравнению с капиллярами других порядков. ( C ) Латентные периоды расширения и ( D ) сужения значительно больше для капилляров третьего и более высокого порядка, чем для капилляров других порядков. * P <0,05, однофакторный дисперсионный анализ с апостериорным тестом. ( E ) Среднее расстояние от наконечника дозатора до сосудов разных порядков отделения.n.s., не имеет значения; P > 0,05, однофакторный дисперсионный анализ с апостериорным тестом. ( F ) Сравнение проводящих скоростей выше и ниже по потоку при расширении и сжатии, вызванных АТФ-затяжкой. * P <0,05, однофакторный дисперсионный анализ с апостериорным тестом. Все планки погрешностей представляют SEM.
Расширение и сужение, вызванные выдуванием АТФ, продемонстрировали линейную или почти линейную проводимость в направлении вверх и вниз по течению (рис. 2 H и I ). Кондуктивная скорость расширения для сосудов вверх и вниз по течению составляла 11.47 ± 3,37 мкм / с и 14,78 ± 3,85 мкм / с, соответственно, тогда как проводящая скорость сужения для сосудов выше и ниже по потоку составляла 6,54 ± 1,05 мкм / с и 6,55 ± 1,22 мкм / с, соответственно, то есть медленнее, чем для дилатация (рис.3 F ). Визуализация Hyperstack во время вдувания АТФ подтвердила проводящие ответы как на АТФ-индуцированную дилатацию, так и на сжатие в пяти из пяти экспериментов ( Supporting Information , Fig. S3, and Movie S4). Более высокая проводящая скорость для расширения ниже по потоку предполагает, что вызванное АТФ расширение и сужение сосудов модулируется разными механизмами.
Сужение, но не расширение, вызванное АТФ, зависит от пуринергических рецепторов 2 типа.
Для исследования механизма сужения, вызванного выдуванием АТФ, 0,5 мМ антагониста рецептора P2 пиридоксальфосфат-6-азофенил-2 ‘, 4’-дисульфоновой кислоты (PPADS) наносили местно на облученную кору головного мозга не менее чем за 2 часа до Пыхтение АТФ. Предварительная подготовка с использованием PPADS сохранила расширение сосудов, но значительно уменьшила сужение сосудов (рис. 4 A и B ). Чувствительность к PPADS особенно выражена в капиллярах первого и второго порядка (рис.4 C и D ). Это указывает на то, что вызванное АТФ сужение наблюдается в отсутствие ингибитора в капиллярах первого и второго порядка и в меньшей степени в капиллярах р.а. капилляры третьего и более высокого порядка (рис. 3) были обусловлены активацией пуринергического рецептора P2.
Рис. 4.Сужение, вызванное выдуванием АТФ, опосредуется пуринергическими рецепторами 2 типа. ( A ) После местного нанесения 0,5 мМ PPADS пипетку для выдувания помещают рядом с участком, прилегающим к артериоле.Красные, синие, зеленые и желтые области интереса помещаются в год. капилляры первого, второго и третьего порядка для измерения диаметра соответственно. (Шкала: 10 мкм.) ( B ) Динамика изменения диаметра в каждой области интереса, указанная в A . Предварительная обработка 0,5 мМ PPADS и выдувание 1 мМ АТФ вызывают дилатацию, но значительно ослабляют сужение. ( C ) Амплитуда расширения существенно не различается с применением и без применения PPADS среди всех порядков капилляров.n.s., не имеет значения; P > 0,05, непарный t проба. ( D ) Амплитуда сужения значительно различается при использовании и без предварительной обработки PPADS на капиллярах первого и второго порядка. * P <0,05, непарный тест t . Все планки погрешностей представляют SEM.
Активация рецепторов P2X и P2Y приводит к аналогичным ответам сосудов.
Исследования артерий и артериол in vitro показали, что активация рецепторов P2Y на гладкомышечных клетках приводит к сужению сосудов, тогда как активация рецепторов P2X на артериолярных эндотелиальных клетках (ЭК) приводит к расширению сосудов (24–27) .Чтобы проверить, вносят ли одни и те же механизмы вклад в контроль капилляров мозга in vivo, мы исследовали реакции сосудов, вызываемые агонистами рецепторов P2X и P2Y. Агонист рецептора P2X αβATP (αβ-метилен-АТФ) и агонист рецептора P2Y UTP вводили (по 1 мМ каждый) путем вдыхания в непосредственной близости от р.а. и капилляры первого порядка. Поскольку аденозин, гидролизованный из АТФ, является сильнодействующим вазодилататором (28), более стабильный аналог АТФ, ATPγS, был использован в концентрации 1 мМ для экспериментов по надуванию микропипеток.Наконец, контрольные эксперименты были выполнены путем вдувания 10 мкМ Alexa 594 только для того, чтобы исключить эффект самого выдувания.
Мы сравнили влияние соединений на капиллярные ответы первого порядка, потому что эти капилляры давали наиболее устойчивые и глубокие ответы при вдыхании АТФ (рис. 3; см. Также рис. S4). Агонисты рецепторов P2X и P2Y вызывали расширение капилляров первого порядка с последующим сужением. Хотя амплитуды дилатации были одинаковыми для всех соединений (рис.5 A ), контрольные эксперименты с использованием только Alexa 594 показали только слабое расширение в одном из пяти экспериментов. Амплитуда вазоконстрикции была значительно больше при использовании ATPγS, чем ATP (рис. 5 B ), что можно объяснить тем, что ATPγS индуцирует сужение сосудов через активацию рецепторов P2X и P2Y. Эффект расширения менее выражен, поскольку ATPγS более стабилен, чем ATP, с образованием меньшего количества аденозина. В контрольных опытах сужение сосудов наблюдалось редко.Как вазодилатация, так и вазоконстрикция развивались дольше, когда вызывались АТФ, чем для более стабильных соединений (фиг. 5 C и D ). Это может быть объяснено сосудорасширяющим аденозином, гидролизованным из АТФ, что увеличивает латентный период до максимального сужения сосудов. Сравнение проводящих скоростей восходящей и нисходящей проводимости как вазодилатации, так и сужения с четырьмя соединениями не обнаружило существенной разницы (рис. 5 E ), что позволяет предположить, что четыре соединения вызывают проводимые сосудистые реакции посредством аналогичного механизма.
Рис. 5.Реакция сосудов капилляров первого порядка на вдыхание АТФ, P2X, агонистов рецепторов P2Y, ATPγS и красного красителя. ( A ) Сравнение различных компаундов для вдыхания с амплитудой расширения, ( B ) амплитудой сжатия, ( C ) задержкой расширения, ( D ) задержкой сжатия и ( E ) скоростью проводимости . Соединения представляют собой 1 мМ АТФ, 1 мМ агонист рецептора P2X (αβATP), 1 мМ агонист рецептора P2Y (UTP), 1 мМ ATPγS и 10 мкМ Alexa 594 в качестве контроля.н / д, нет в наличии; * P <0,05, *** P <0,001, однофакторный дисперсионный анализ с апостериорным тестом. Обратите внимание, что латентность контрольного эксперимента отмечена как недоступная как для дилатации ( C, ), так и для сужения ( D ). Это связано с небольшими откликами при контрольной затяжке и неоптимальными измерениями задержки. Все планки погрешностей представляют SEM. n.s., не имеет значения.
Мгновенное и тяжелое сужение перицитов после ишемии.
Для изучения мгновенного ответа перицитов при ишемическом инсульте in vivo остановку сердца вызывали i.v. введение 0,05 мл пентобарбитала. Пакет изображений, покрывающий всю приартериольную область, был записан до остановки сердца, а другой пакет изображений в той же области был записан через 5 минут после остановки сердца. Затем каждый стек изображений проецировался на одно изображение с помощью проецирования средней интенсивности. Годовой отчет а капилляры первого и второго порядка демонстрируют сильное сужение, в некоторых случаях с забитыми внутри эритроцитами, но только рядом с телами перицитов. Капилляры третьего и более высокого порядка сужены меньше, хотя также имеют настенные перициты (рис.6 A и C ). Капилляры с видимыми телами перицитов демонстрируют большее сужение, чем капилляры, лишенные тел перицитов (фиг. 6 C ).
Рис. 6.Ишемия приводит к сильному сужению капилляров в районе артериолы, а предварительное кондиционирование блокаторов рецепторов P2 снижает сужение капилляров. ( A ) Пакеты изображений (размер шага 1 мкм, проекция средней интенсивности) сосудистой сети, в том числе р.а. и первые несколько порядков капилляров.Через пять минут после ишемии вследствие остановки сердца (СА) наблюдалось сильное сужение р.а. капилляры первого и второго порядка, но капилляры третьего и более высокого порядка были умеренно сужены. Пунктирными линиями показаны контуры сосудов капилляров первого порядка до остановки сердца. (Шкала: 20 мкм.) ( B ) Предварительная подготовка с использованием 0,5 мМ PPADS в течение 2 часов спасла серьезное сужение р.а. и капилляр первого порядка через 5 мин после CA. Пунктирными линиями показаны контуры сосудов капилляров первого порядка перед СА.(Шкала: 20 мкм.) ( C ) Наиболее серьезные сужения капилляров первого и второго порядка, локализованных вместе с перицитами. Капилляры третьего и более высокого порядка сужены умеренно. Предварительное кондиционирование с помощью PPADS смягчило вазоконстрикцию в п.п. капилляры первого и второго порядка. Для годовых использовался непарный тест t . н / д, нет в наличии; *** P <0,001. Для капилляров другого порядка использовался односторонний дисперсионный анализ ANOVA с апостериорным тестом (* P <0.05). Все планки погрешностей представляют SEM.
Затем мы оценили, вовлечены ли пуринергические рецепторы в вызванное ишемией сужение капилляров перицитами. С этой целью мы суперслили облученную кору мышей с 0,5 мМ PPADS в течение как минимум 2 ч до остановки сердца. Это смягчило сжатие межпозвоночного диска. капилляры первого и второго порядка (рис. 6 B и C ). Эти результаты согласуются с предыдущими исследованиями срезов мозга и патологоанатомическими исследованиями, предполагающими, что перициты сжимаются при ишемии (3, 7) и что предварительное кондиционирование животных с помощью PPADS помогает в восстановлении после экспериментального инсульта (29, 30).Мы пришли к выводу, что перициты в первых нескольких порядках капилляров сильно сужаются после ишемии in vivo и что блокирование пуринергических рецепторов смягчает сужение как артериол, так и капилляров.
Обсуждение
Понимание нейроваскулярной передачи сигналов в ответ на нейрональную или астроцитарную активность имеет решающее значение для понимания того, как процессы мозга снабжаются энергией и генерируются функциональные сигналы нейровизуализации. Наши результаты показывают, что капилляры первого и второго порядка инициируют функциональную дилатацию чаще, чем капилляры p.а. и капилляры более высокого порядка. Кроме того, местное и прямое введение АТФ вызывает расширение сосудов с последующим сужением первых нескольких порядков капилляров. Функциональная дилатация, а также дилатация и сужение, вызванные выдуванием АТФ, инициируются в основном в капиллярах первого или второго порядка, а CVR развиваются как выше, так и ниже по течению. Однако скорость проводимой вазодилатации выше, чем проводимой вазоконстрикции. Более того, через несколько минут после церебральной ишемии перициты на участках, близких к артериолам, сужаются посредством механизма, зависимого от рецептора P2.
Вклад перицитов в регулирование CBF является спорным (13). Некоторые исследования in vivo предполагают роль перицитов в регуляции капиллярного кровотока (3, 6), в то время как другие показали, что контроль кровотока обнаруживается только в артериолах, но не в капиллярах, и что гладкомышечные клетки сосудов, но не перициты , способствуют регуляции ответов CBF (10–12). Однако в большинстве этих исследований было высказано предположение, что перициты, близкие к п.о. сокращаются во время нормальной мозговой деятельности, а перициты на капиллярах первого и второго порядка обладают гибридными свойствами как гладкомышечных клеток, так и капиллярных перицитов (31).В наших исследованиях перициты были идентифицированы с помощью двухфотонной микроскопии как красные флуоресцентные клетки на стенке капилляров у мышей NG2-DsRed. Тем не менее, мы описываем изменения капиллярной функции в соответствии с порядком ветвления от р.а. и участие перицитов в этом контексте. Наши результаты подтверждают важность использования определенной геометрии сосудов по отношению к кортикальной поверхности для надежной оценки небольших изменений диаметра капилляров.
Как и в других исследованиях (3, 10), наши данные свидетельствуют о ключевой роли капилляров, близких к p.а. в местном контроле кровотока. В качестве мощного инструмента для изучения CBF (32) использовался двухфотонный микроскоп для визуализации для фокусировки в одной горизонтальной плоскости на глубине 100–200 мкм для получения изображения хорошего качества. Эта горизонтальная плоскость обычно составляла один раз в год. и связанные с ними капилляры первого, второго или третьего порядка. Наши результаты показали, что дилатация капилляров как ответ на повышенную синаптическую активность (то есть ответ нервно-сосудистого сопряжения) в большинстве случаев инициируется в капиллярах первого порядка.Это согласуется с более ранними результатами, указывающими на активное расслабление перицитов перед расслаблением гладкомышечных клеток артериол (3), и с недавними исследованиями, показывающими, что актин гладких мышц присутствует в перицитах около артериол капилляров (10, 33). Кроме того, перициты околоартериоловых капилляров могут иметь более плотный гладкомышечный актин (12, 34), поскольку капилляры первого и второго порядка реагируют с самой ранней и наиболее глубокой дилатацией.
Выдувание АТФ вызывало дилатацию и сужение первых нескольких порядков капилляров.Напуск АТФ на капилляры выше второго порядка почти не вызывал изменений в диаметре. Наблюдения показывают, что перициты обладают различной чувствительностью к пуринергической стимуляции в соответствии с предыдущими исследованиями (5). Было высказано предположение, что дилатация, вызванная вдыханием АТФ, опосредуется активацией рецепторов P2X на артериолярных ЭК (24). Однако недавнее исследование показало, что АТФ может также действовать на рецепторы P2X1 астроцитов, вызывая высвобождение PGE 2 , который расслабляет перициты (9).Другие исследования показали, что аналог АТФ ATPγS имеет свой собственный фармакологический профиль; например, он действительно может быть гидролизован до аденозина (35), что может быть другим объяснением вазодилатации, вызванной АТФ-затяжкой.
Сужение сосудов, вызванное выдуванием АТФ, было значительно ослаблено антагонистом пуринергических рецепторов 2 типа PPADS, что указывает на участие пуринергических рецепторов 2 типа. Подобно нашему исследованию, вдувание АТФ в срезах мозга ранее было показано, что увеличивает цитозольный Ca 2+ в глиальных клетках с последующим сужением соседних сосудов, которое устраняется преинкубацией с блокатором рецепторов P2Y1 (36).Наши исследования in vitro с перицитами в монокультуре ( Supporting Information , Fig. S5 и Movie S5) подтвердили, что АТФ сужает перициты капилляров способом, зависящим от активации рецептора P2 и увеличивает цитозольный Ca 2+ . Это исследование демонстрирует, что внутриклеточное увеличение перицитов Ca 2+ может быть механизмом, лежащим в основе сокращения перицитов в ответ на АТФ. АТФ, примененный к церебральным артериолам in vitro, вызывал двухфазную реакцию сосудов, сужение с последующим расширением (24), что противоположно тому, что мы наблюдали в капиллярах.Данные свидетельствуют о том, что эффект пуринергического сигнального каскада в капиллярах отличается от эффекта в артериолах (9).
В артериях и артериолах CVR в первую очередь характеризуются быстрой (1-3 мм / с) и далеко идущей электрической проводимостью вдоль хорошо спаренного эндотелия в гладкие мышцы (37, 38). При стимуляции G-сопряженного рецептора вторичная медленная и пространственно ограниченная волна Ca 2+ распространяется вдоль эндотелия (~ 100 мкм / с), вызывая выработку оксида азота и простагландинов (рис.7 A и B ). Ингибирование электрического компонента продемонстрировало, что скорость медленного, основанного на диффузии CVR составляет ~ 20 мкм / с, что аналогично медленной скорости распространения вазодилатации, наблюдаемой в настоящем исследовании (39). Кроме того, гиперполяризующие импульсы распространяются вдоль ЭК в капиллярах со скоростью проводимости в 100 раз быстрее, чем вызванный диффузией CVR (37). Напротив, времена сосудистой релаксации одинаковы для двух типов проводимых ответов. Возможно, что окончательный общий путь обоих типов сосудистых ответов может включать сброс бутонов аксонов калия одновременно с быстрым выбросом калия (40), но это необходимо будет рассмотреть более подробно в будущих исследованиях.
Рис. 7.Возможные механизмы дилатации и сжатия, вызванной АТФ-затяжкой. ( A ) Пиальная артерия и артерии состоят из эндотелия, окруженного гладкомышечными клетками (светло-красные). По мере того, как капилляры отходят от АП, гладкие мышцы замещаются перицитами (светло-голубыми) с неоднородной морфологией по капиллярам первого, второго и более высокого порядка (т. Е. Идущим от АП к венозной стороне). ( B ) Быстрая и дальняя проводимость по артериолам и артериям посредством электрической проводимости и локальной волны Ca 2+ .( C ) Наблюдаемое медленное и низкоуровневое проведение вазомоторных ответов, исходящих в основном из капилляров первого и второго порядка, по-видимому, связано с передачей сигналов путем диффузии. Можно предвидеть как паракринную передачу сигналов вдоль концевых точек астроцитов, так и внутриклеточную диффузию по предполагаемым щелевым соединениям.
Хотя основной механизм остается неясным, можно предположить основанное на диффузии проведение вазомоторных реакций, исходящих из капилляров первого и второго порядка, например паракринную передачу сигналов вдоль концевых ножек астроцитов или внутриклеточную диффузию через щелевые соединения, соединяющие ЭК и / или перициты (рис.7 С ). Однако документация о соединении щелевых соединений между ЭК капилляров первого и второго порядка в коре головного мозга мышей отсутствует. Кроме того, в отличие от артериального эндотелия, капиллярные ЭК не содержат каналов SK Ca / IK Ca (37), которые, как полагают, лежат в основе инициирования быстрых электрических CVR (41). Это также может объяснить, почему микроприменение АТФ к пиальным артериям и АП in vitro приводит к сужению, за которым следует эндотелий-зависимое расширение сосудов (25, 26).
Во время ишемии церебральные перициты сужаются и останавливают кровоток в капиллярах в течение нескольких минут. Сужение выражено в области п.а. капилляры первого и второго порядка, тогда как диаметр высших капилляров оставался постоянным. Это поддерживает и изменяет представление о том, что перициты способствуют длительному снижению капиллярного кровотока после церебральной ишемии (3, 7, 42). Наиболее чувствительной к ишемии областью сосудистой сети являются капилляры первого порядка в районе артериолы.Предварительное кондиционирование антагонистом рецептора P2 PPADS облегчало сужение перицитов после ишемии, что может быть связано с блокадой пуринергических рецепторов 2 типа, но его эффект в предотвращении сужения перицитов при ишемии с равной вероятностью отражает то, что он блокирует обратный режим Na +. Обмен / Ca 2+ , хорошо известный путь перегрузки Ca 2+ при ишемии (43). Более того, PPADS блокирует экто-АТФазы (44), тем самым способствуя сужению перицитов после ишемии.В других исследованиях сообщалось, что модуляция пуринергических рецепторов способствует выздоровлению животных после инсульта in vivo (29, 30), но наши исследования показывают, что перициты на капиллярах первого порядка могут быть спасены путем блокирования пуринергических рецепторов до церебральной ишемии.
Материалы и методы
Обращение с животными.
Все процедуры с участием животных были одобрены Датским национальным этическим комитетом в соответствии с руководящими принципами, изложенными в Конвенции Совета Европы о защите позвоночных животных, используемых для экспериментальных и других научных целей, и соответствовали руководящим принципам ARRIVE.Сорок мышей NG2-DsRed [Tg (Cspg4-DsRed.T1) 1Akik / J; Джексона] для обоих полов использовались в возрасте 4–7 месяцев. Трахею канюлировали для механической вентиляции (Minivent type 845; Harvard Apparatus), и катетеры были помещены в левую бедренную артерию и вену для инфузии веществ и для контроля артериального давления и газов крови. Чтобы гарантировать, что животные содержатся в физиологических условиях, мы непрерывно отслеживали CO 2 в конце выдоха (Capnograph type 340; Harvard Apparatus) и артериальное давление (манометр BP-1; World Precision Instruments) и оценивали газы в артериальной крови. образцы дважды в течение каждого эксперимента (pO 2 , 95–110 мм рт. ст .; pCO 2 , 35–40 мм рт. ст .; pH, 7.35–7.45) с помощью радиометра ABL 700Series. Температуру тела поддерживали на уровне 37 ° C с помощью ректального датчика температуры и обогревающего одеяла (контроллер температуры TC-1000; CWE).
Экспериментальная установка включала приклеивание черепа к металлической пластине цианоакрилатным гелем (Loctite Adhesives). Была просверлена трепанация черепа диаметром 4 мм, центрированная на 0,5 мм позади и на 3 мм справа от брегмы над сенсорной областью коры головного мозга. После удаления твердой мозговой оболочки препарат был покрыт 0,75% гелем агарозы (тип III-A, низкий EEO; Sigma-Aldrich), смоченным искусственной спинномозговой жидкостью (aCSF; NaCl 120 мМ, KCl 2.8 мМ, NaHCO 3 22 мМ, CaCl 2 1,45 мМ, Na 2 HPO 4 1 мМ, MgCl 2 0,876 мМ и 2,55 мМ глюкозы; pH 7,4) и выдерживали при 37 ° C. Для экспериментов по визуализации часть краниотомии была покрыта покровным стеклом, что позволяло вводить электроды и проводить фармакологические вмешательства.
Мышей анестезировали внутрибрюшинно. инъекция смеси кетамина (60 мг / кг) и ксилазина (10 мг / кг) и введение дополнительных доз (30 мг / кг) кетамина каждые 20 мин.По завершении всех хирургических вмешательств анестезия была переведена на непрерывную внутривенную анестезию. инфузия с α-хлоралозой (33% мас. / об .; 0,01 мл / 10 г / ч). В конце экспериментального протокола мышей умерщвляли внутривенным введением. инъекция 0,05 мл пентобарбитала с последующим смещением шейки матки.
Стимуляция Whisker-Pad.
Сенсорная кора головного мозга мыши была активирована стимуляцией контралатеральной подглазничной ветви тройничного нерва с использованием набора изготовленных на заказ биполярных электродов, вводимых чрескожно.Катод располагали относительно hiatus infraorbitalis (IO), а анод вводили в жевательные мышцы (45). Таламокортикальная стимуляция ИО выполнялась при интенсивности 1,5 мА (ISO-flex; A.M.P.I.) в течение 1 мс в сериях по 20 с при 2 Гц.
Выдувание микропипеток.
Стеклянные микропипетки для выдувания были изготовлены съемником пипеток (P-97; Sutter Instrument) с сопротивлением 3–3,5 МОм. В пипетку загружали смесь 10 мкМ Alexa 594 и активных веществ для визуализации пипетки под двухфотонным микроскопом.Под двухфотонной микроскопией пипетка была вставлена в кору, и сосудистая сеть приблизилась на 100–200 мкм ниже поверхности. Расстояние между наконечником пипетки и сосудистой сетью составляло 30–50 мкм (рис. 2 A ). Вещества вдыхали в течение ~ 200 мс, используя в пипетке давление воздуха ~ 15 фунтов на квадратный дюйм. Наконечник пипетки случайным образом располагался рядом с кончиком пипетки. или капилляры первого или второго порядка, и краситель распространяется очень быстро (~ 160 мкм / с). В течение одного-двух периодов сбора данных «красное облако» покрыло и артериолу, и капилляры, и фон вернулся к нормальному состоянию через ~ 20 с после затяжки.На сосудистые реакции не влияла концентрация АТФ на разных расстояниях (рис. S2).
Двухфотонная визуализация.
FITC-декстран (2% масс. / Об., Молекулярная масса 70 000, 50 мкл; Sigma-Aldrich) вводили в бедренную вену для мечения плазмы крови. Эксперименты проводились с использованием коммерческого двухфотонного микроскопа (Femto3D-RC; Femtonics Ltd.) и водно-иммерсионного объектива 25 × 1.0 N.A. Длину волны возбуждения устанавливали 900 нм. Излучаемый свет фильтровали для сбора красного и зеленого света от DsRed (перициты) и FITC-декстрана (просвет сосуда).Размер кадра обычно составлял 400 × 400 пикселей (370 мс на кадр). Временные ряды x – y были взяты для изображения перицитов и кровеносных сосудов во время стимуляции или выдувания микропипетки. В наших более ранних исследованиях (3) использовалась частота кадров 5,9 Гц, но из-за свойств прибора в настоящем исследовании мы использовали частоту кадров 2–3 Гц. Более низкая частота кадров одновременно обеспечивала превосходное пространственное разрешение CVR в ансамбле мелких кровеносных сосудов. Однако это временное разрешение не позволило нам получить достоверную информацию о времени задержки до 10% ответа.Поэтому в этом исследовании мы использовали время задержки до 50% ответа.
Анализ изображений.
Аналитическое программное обеспечение было разработано с использованием MATLAB. Было построено усредненное по времени изображение из зеленого канала. Прямоугольная область интереса шириной 4 мкм была нарисована перпендикулярно долготе сосуда (рис. 1 A ). Чтобы свести к минимуму влияние черных теней эритроцитов и незначительной вибрации коры, прямоугольная область интереса была усреднена путем проецирования в одну линию для каждого кадра, представляющего профиль сегмента сосуда на этом кадре.Линия профиля была построена в виде двухмерного изображения с осью x как количество кадров (рис. 1 C , верхний ). Алгоритм активного контура (сегментация Чана – Весе) использовался для поиска краев сосуда, которые обозначены красными кривыми (46, 47), а временной ход измеренного диаметра рассчитывался по расстоянию между верхними слоями сосуда. и нижние красные кривые (рис. 1 C , Lower ). Отвечающие капилляры были определены как капилляры с изменением более чем 2% от начального диаметра сосуда.Амплитуду ответа сосуда определяли как максимальную амплитуду пика после стимуляции / затяжки. Задержка ответа была определена как задержка половины максимальной амплитуды.
Заявка на лекарство.
По завершении всех хирургических вмешательств внутривенно вводили FITC-декстран (FD2000S; Sigma-Aldrich). через катетер в бедренную вену для маркировки сыворотки крови и визуализации сосудистой сети под двухфотонным микроскопом (зеленый цвет). В исследовании выдувания АТФ с помощью микропипетки выдувное вещество представляло собой смесь 10 мкМ Alexa Fluor 594 (A-10438; Life Technologies; красный цвет) и 1 мМ АТФ (A9187; Sigma-Aldrich), растворенных в aCSF.Тот же метод был использован для исследований ATPγS (A1388; Sigma-Aldrich), UTP (U6875; Sigma-Aldrich) и αβ-метилен-ATP (M6517; Sigma-Aldrich). В исследовании предварительно кондиционированного выдувания АТФ с использованием антагониста рецептора P2 PPADS (P178; Sigma-Aldrich), aCSF, содержащий 0,5 мМ PPADS, использовался для суперплавления обнаженной коры сразу после удаления твердой мозговой оболочки и для приготовления агарозы и жидкости для купания для краниального окна. во время визуализации. Эксперименты по вдыханию АТФ проводились по крайней мере после 2 часов воздействия PPADS.Та же процедура для нанесения и воздействия PPADS использовалась в подгруппе экспериментов, в которых остановка сердца и церебральная ишемия вызывались внутривенным введением. применение 0,05 мл (200 мг / мл) пентобарбитала.
Статистический анализ.
Ответы представлены как среднее ± стандартная ошибка среднего. Значения P получены из однофакторного дисперсионного анализа с апостериорным тестом Тьюки – Крамера или непарных тестов Стьюдента t , в зависимости от ситуации. P ≤ 0,05 считалось значимым. Все статистические анализы были выполнены с использованием MATLAB.
Благодарности
Мы благодарим Кшиштофа Кухара за его вдохновляющие советы и профессиональную помощь с полировкой фигур и видео и Алексея Браже за его любезную помощь в улучшении алгоритма видеоанализа. Это исследование было поддержано Исследовательской инициативой Фонда Лундбека по мозговым барьерам и доставке лекарств, Фондом NOVO-Nordisk, Датским советом по медицинским исследованиям и грантом фонда Nordea Центру здорового старения.
Сноски
Автор: C.К., Б. Б. и М.Дж.Л. спланированное исследование; C.C., J.C.F., S.H.J., M.L. и S.A.Z. проведенное исследование; C.C. и Б. внесены новые реагенты / аналитические инструменты; C.C. и B.O.H. проанализированные данные; и C.C., B.O.H. и M.J.L. написал газету.
Авторы заявляют об отсутствии конфликта интересов.
Эта статья представляет собой прямое представление PNAS.
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1707702115/-/DCSupplemental.
Локальная передача сигналов калия связывает активность нейронов с расширением сосудов в головном мозге
Рой, К.С. и Шеррингтон, К. О регуляции кровоснабжения мозга. J. Physiol. (Лондон) 11 , 85–108 (1890).
CAS Статья Google Scholar
Filosa, J.A., Bonev, A.D. & Nelson, M.T. Динамика кальция в корковых астроцитах и артериолах при нервно-сосудистом соединении. Circ. Res. 95 , e73 – e81 (2004).
CAS Статья Google Scholar
Chaigneau, E., Oheim, M., Audinat, E. & Charpak, S. Двухфотонная визуализация капиллярного кровотока в клубочках обонятельной луковицы. Proc. Natl. Акад. Sci. США 100 , 13081–13086 (2003).
CAS Статья Google Scholar
Метеа, М.Р. и Ньюман, Э.А. Глиальные клетки расширяют и сужают кровеносные сосуды: механизм нервно-сосудистого взаимодействия. J. Neurosci. 26 , 2862–2870 (2006).
CAS Статья Google Scholar
Mulligan, S.J. И MacVicar, B.A. Транзитенты кальция в конечностях астроцитов вызывают сужение сосудов головного мозга. Nature 431 , 195–199 (2004).
CAS Статья Google Scholar
Такано Т.и другие. Астроцит-опосредованный контроль мозгового кровотока. Нац. Neurosci. 9 , 260–267 (2006).
CAS Статья Google Scholar
Zonta, M. et al. Передача сигналов от нейронов к астроцитам занимает центральное место в динамическом контроле микроциркуляции головного мозга. Нац. Neurosci. 6 , 43–50 (2003).
CAS Статья Google Scholar
Росси, Д.J. Еще одна СМЕШАННАЯ роль астроцитов: связь кровотока с нервной активностью. Нац. Neurosci. 9 , 159–161 (2006).
CAS Статья Google Scholar
Price, D.L., Ludwig, J.W., Mi, H., Schwarz, T.L. И Эллисман, М. Распределение каналов K + , активированных rSlo Ca 2+ , в периваскулярных конечностях астроцитов крыс. Brain Res. 956 , 183–193 (2002).
CAS Статья Google Scholar
Узел, H.Дж., Циммерманн П.А. И Нельсон, М. Внеклеточные K (+) — индуцированные гиперполяризации и дилатации коронарных и церебральных артерий крыс вовлекают внутренние выпрямительные K (+) каналы. J. Physiol. (Лондон) 492 , 419–430 (1996).
CAS Статья Google Scholar
Horiuchi, T., Dietrich, H.H., Hongo, K. & Dacey, R.G., Jr. Механизм внеклеточных K + -индуцированных локальных и проводимых ответов в проникающих в мозг артериолах. Инсульт 33 , 2692–2699 (2002).
CAS Статья Google Scholar
McCarron, J.G. & Halpern, W. Калий расширяет мозговые артерии крыс с помощью двух независимых механизмов. Am. J. Physiol. 259 , H902 – H908 (1990).
CAS PubMed Google Scholar
Кущинский, В., Валь, М., Боссе, О. и Турау, К.Периваскулярный калий и pH как детерминанты местного диаметра пиальной артерии у кошек. Исследование микроприложения. Circ. Res. 31 , 240–247 (1972).
CAS Статья Google Scholar
Зарицкий, Дж. Дж., Экман, Д. М., Веллман, Г. К., Нельсон, М. Т. И Шварц, Т. Направленное нарушение генов Kir2.1 и Kir2.2 обнаруживает существенную роль внутреннего выпрямляющего тока K (+) в K (+) — опосредованной вазодилатации. Circ. Res. 87 , 160–166 (2000).
CAS Статья Google Scholar
Брэдли, К.К. и другие. Kir2.1 кодирует внутренний выпрямительный калиевый канал в артериальных гладкомышечных клетках крыс. J. Physiol. (Лондон) 515 , 639–651 (1999).
CAS Статья Google Scholar
Узел, Х.Дж. и Нельсон, М.T. Регулирование диаметра и стенки артерии [Ca 2+ ] в церебральных артериях крыс с помощью мембранного потенциала и внутрисосудистого давления. J. Physiol. (Лондон) 508 , 199–209 (1998).
CAS Статья Google Scholar
Quayle, J.M., McCarron, J.G., Brayden, J.E. & Nelson, M.T. Внутренний выпрямитель K + направляет токи в гладкомышечные клетки из церебральных артерий размером с сопротивление крысы. Am. J. Physiol. 265 , C1363 – C1370 (1993).
CAS Статья Google Scholar
Quayle, J.M., Nelson, M.T. И Станден, Н. АТФ-чувствительные и внутренне выпрямляющие калиевые каналы в гладких мышцах. Physiol. Ред. 77 , 1165–1232 (1997).
CAS Статья Google Scholar
Нельсон М.Т., Патлак, Дж. Б., Уорли, Дж. Ф. и Станден, Н. Б. Кальциевые каналы, калиевые каналы и зависимость тонуса гладких мышц артерий от напряжения. Am. J. Physiol. 259 , C3–18 (1990).
CAS Статья Google Scholar
Nelson, M.T. & Quayle, J.M. Физиологические роли и свойства калиевых каналов в гладких мышцах артерий. Am. J. Physiol. 268 , C799 – C822 (1995).
CAS Статья Google Scholar
Mayhew, J.E. et al. Церебральная вазомоция: колебание 0,1 Гц при отображении нервной активности в отраженном свете. Neuroimage 4 , 183–193 (1996).
CAS Статья Google Scholar
Nilsson, H. & Aalkjaer, C. Vasomotion: механизмы и физиологическое значение. Мол. Интерв. 3 , 79–89 (2003).
CAS Статья Google Scholar
Браун, Л.А., Ки, Б.Дж. и Ловик, Т.А. Подавление вазомоции в артериолах головного мозга гиппокампа во время повышения нейрональной активности. Auton. Neurosci. 95 , 137–140 (2002).
CAS Статья Google Scholar
Лэнгтон, П.Д., Нельсон, М.Т., Хуанг Ю. и Станден Н. Блокировка кальций-активируемых калиевых каналов в артериальных миоцитах млекопитающих ионами тетраэтиламмония. Am. J. Physiol. 260 , H927 – H934 (1991).
CAS PubMed Google Scholar
Силва А.С., Ли С.П., Ядекола С. и Ким С.Г. Ранние временные характеристики мозгового кровотока и изменения дезоксигемоглобина во время соматосенсорной стимуляции. Дж.Цереб. Blood Flow Metab. 20 , 201–206 (2000).
CAS Статья Google Scholar
Silva, A.C., Lee, S.P., Yang, G., Iadecola, C. & Kim, S.G. Одновременная магнитно-резонансная томография, зависящая от уровня оксигенации крови, и функциональная магнитно-резонансная томография мозгового кровотока во время стимуляции передней лапы крысы. J. Cereb. Blood Flow Metab. 19 , 871–879 (1999).
CAS Статья Google Scholar
Nagelhus, E.A. et al. Данные Immunogold подтверждают, что соединение сифонирования K + и транспорта воды в клетках Мюллера сетчатки крыс опосредуется совместным обогащением Kir4.1 и AQP4 в специфических мембранных доменах. Glia 26 , 47–54 (1999).
CAS Статья Google Scholar
Симард М. и Недергаард М. Нейробиология глии в контексте гомеостаза воды и ионов. Неврология 129 , 877–896 (2004).
CAS Статья Google Scholar
Wang, X. et al. Астроцитарная передача сигналов Ca 2+ , вызванная сенсорной стимуляцией in vivo . Нац. Neurosci. 9 , 816–823 (2006).
CAS Статья Google Scholar
Симард, М., Аркуино, Г., Такано, Т., Лю, К.С. & Nedergaard, M. Передача сигналов на глиоваскулярном интерфейсе. J. Neurosci. 23 , 9254–9262 (2003).
CAS Статья Google Scholar
Kuffler, S.W., Nicholls, J.G. И Orkand, R.K. Физиологические свойства глиальных клеток центральной нервной системы амфибий. J. Neurophysiol. 29 , 768–787 (1966).
CAS Статья Google Scholar
Гебремедин, Д.и другие. Активация метаботропного рецептора глутамата усиливает активность двух типов каналов K + , активируемых Ca 2+ , в астроцитах гиппокампа крысы. J. Neurosci. 23 , 1678–1687 (2003).
CAS Статья Google Scholar
Мередит, А.Л., Торнело, К.С., Вернер, М.Э., Нельсон, М.Т. & Aldrich, R.W. Гиперактивный мочевой пузырь и недержание мочи в отсутствие канала K + , активированного большой проводимостью BK, Ca 2+ . J. Biol. Chem. 279 , 36746–36752 (2004).
CAS Статья Google Scholar
Newman, E.A. Региональная специализация мембраны глиальных клеток сетчатки. Nature 309 , 155–157 (1984).
CAS Статья Google Scholar
Ньюман, Э.А. Высокая калиевая проводимость на концах астроцитов. Наука 233 , 453–454 (1986).
CAS Статья Google Scholar
Horiuchi, T., Dietrich, H.H., Tsugane, S. & Dacey, R.G., Jr. Роль калиевых каналов в регуляции тонуса артериол головного мозга: сравнение головного мозга и ствола головного мозга. Инсульт 32 , 218–224 (2001).
CAS Статья Google Scholar
Nelson, M.T. и другие. Расслабление гладкой мускулатуры артерий кальциевыми искрами. Наука 270 , 633–637 (1995).
CAS Статья Google Scholar
Iadecola, C. Нейроваскулярная регуляция в нормальном мозге и при болезни Альцгеймера. Нац. Rev. Neurosci. 5 , 347–360 (2004).
CAS Статья Google Scholar
Park, L. et al. Abeta-индуцированный оксидативный стресс сосудов и ослабление функциональной гиперемии в соматосенсорной коре мышей. J. Cereb. Blood Flow Metab. 24 , 334–342 (2004).
CAS Статья Google Scholar
Cheney, J.A. и другие. Открыватель maxi-K каналов BMS-204352 ослабляет региональный отек мозга и неврологические двигательные нарушения после экспериментальной травмы головного мозга. J. Cereb. Blood Flow Metab. 21 , 396–403 (2001).
CAS Статья Google Scholar
Heurteaux, C., Bertaina, V., Widmann, C. & Lazdunski, M. Открыватели каналов K + предотвращают глобальную ишемию-индуцированную экспрессию c-fos, c-jun, белка теплового шока и генов-предшественников амилоидного бета-белка, а также гибель нейронов. в гиппокампе крысы. Proc. Natl. Акад. Sci. США 90 , 9431–9435 (1993).
CAS Статья Google Scholar
Jensen, B.S. BMS-204352: открыватель калиевых каналов, разработанный для лечения инсульта. CNS Drug Rev. 8 , 353–360 (2002).
CAS Статья Google Scholar
Грибков В.К. и другие. Ориентация на острый ишемический инсульт с помощью кальций-чувствительного средства, открывающего калиевые каналы maxi-K. Нац. Med. 7 , 471–477 (2001).
CAS Статья Google Scholar
Cauli, B. et al. Кортикальные интернейроны ГАМК в сосудисто-нервном соединении: реле для подкорковых вазоактивных путей. J. Neurosci. 24 , 8940–8949 (2004).
CAS Статья Google Scholar
Повышенное ВЧД: гипервентиляция
Внутричерепное давление (ВЧД) определяется объемом паренхимы головного мозга (80%), крови (12%) и спинномозговой жидкости (8%) в жестком своде черепа. Нормальное ВЧД колеблется в пределах 5-15 мм рт. Поскольку черепное отделение окружено жестким черепом, его способность вмещать дополнительный объем ограничена.Когда внутричерепное содержимое увеличивается в объеме (например, вследствие опухоли, крови, отека, гидроцефалии), первоначально циркулирующая кровь и спинномозговая жидкость вытесняются, чтобы компенсировать дополнительный объем, а ВЧД остается неизменным. Однако после определенного порога, если внутричерепное содержимое продолжает увеличиваться в объеме, то ВЧД будет быстро увеличиваться, поскольку в фиксированном внутричерепном своде податливость снижается. Эта динамика имеет решающее значение для хирургических пациентов с уже сниженной внутричерепной податливостью из-за объемных поражений, которые могут быть чрезвычайно чувствительны к изменениям ВЧД, связанным с анестезиологическими эффектами (например,д., расширение сосудов головного мозга от ингаляционных анестетиков или расширение сосудов от периодов гиповентиляции / гиперкапнии).
Гипервентиляция — один из известных методов быстрого снижения ВЧД. Церебральный кровоток во многом зависит от PaCO2. Гипервентиляция вызывает снижение PaCO2, что впоследствии приводит к сужению артериальных сосудов, что снижает церебральный кровоток (CBF), объем церебральной крови и ВЧД. Этот эффект опосредован моими изменениями pH во внеклеточной жидкости, которые вызывают церебральную вазоконстрикцию или вазодилатацию в зависимости от pH.Приблизительно на 2% уменьшается CBF на каждый 1 мм рт.ст. снижения уровня PaCO2. Хотя эффекты гипервентиляции проявляются почти сразу, это влияние на CBF уменьшается в течение 6-24 часов, поскольку мозг адаптируется путем изменения уровня бикарбоната во внеклеточной жидкости для нормализации pH. Кроме того, если длительная гипервентиляция внезапно прерывается и нормокапния восстанавливается слишком быстро, возникает результирующее увеличение CBF и, следовательно, ICP, что может быть вредным.
Гипервентиляция обычно используется для облегчения внутричерепной хирургии, поскольку считается, что она быстро обеспечивает «расслабление» мозга в операционном поле.Одно многоцентровое рандомизированное исследование показало, что гипервентиляция до умеренной гипокапнии (PaCO2 = 25 ± 2 мм рт. Ст.) Эффективна для снижения ВЧД и уменьшения объема мозга в операционном поле во время краниотомии (Gelb et al., 2008). С другой стороны, гипервентиляция также может иметь побочные эффекты. Было показано, что гипервентиляция до уровней PaCO2 ниже 20 мм рт. Ст. Вызывает ишемию головного мозга. Церебральная ишемия с чрезмерной гипервентиляцией, вероятно, опосредована тяжелым сужением сосудов головного мозга и алкалозом, вызванным сдвигом кривой оксигемоглобина влево, что снижает доставку кислорода к ткани мозга.По этой причине гипервентиляция до умеренного уровня (PaCO2 = 25-35) обычно считается краткосрочной временной мерой для снижения ВЧД или уменьшения объема мозга во время нейрохирургии, и следует избегать чрезмерно агрессивной гипервентиляции (PaCO2 <25 мм рт.
Синдром обратимого церебрального сужения сосудов (RCVS)
Не то, что вы ищете?Обзор
Синдром обратимой церебральной вазоконстрикции (RCVS) — это группа заболеваний, характеризующихся сильными головными болями и сужением кровеносных сосудов в головном мозге.RCVS обратима, и пациенты часто выздоравливают в течение трех месяцев; это состояние часто упускается из виду, и оно встречается чаще, чем думает большинство врачей. Серьезные осложнения, такие как инсульт, могут быть связаны с RCVS, если не своевременно диагностировать и не лечить.
RCVS возникает, когда постоянное сокращение кровеносных сосудов (сужение сосудов) вызывает сужение артерий. Это снижает приток крови и доставку кислорода к пораженному участку тела. Когда сужение сосудов затрагивает кровеносные сосуды головного мозга, это называется сужением сосудов головного мозга.
Симптомы
Наиболее частый симптом RCVS — внезапная сильная головная боль, часто называемая головной болью «грома». Другие симптомы могут включать:
- Изъятия
- Изменения зрения
- Проблемы с пониманием других, когда они говорят
- Затруднения при разговоре
- Слабость на одной стороне тела
Пациенты RCVS подвержены риску инсульта или транзиторной ишемической атаки (ТИА).Признаки инсульта включают:
- Внезапное онемение или слабость лица, руки или ноги, особенно одной стороны тела
- Внезапное замешательство
- Внезапное затруднение речи
- Внезапное нарушение зрения одним или обоими глазами
- Внезапное нарушение ходьбы
- Внезапное головокружение, потеря равновесия или координации
- Внезапная сильная головная боль без известной причины
Последствия острого ишемического инсульта могут вызвать у женщин дополнительные симптомы, в том числе:
- Боль в лице, руке или ноге
- Икота или тошнота
- Боль или сердцебиение в груди
- Одышка
Если вы заметили один или несколько из этих признаков инсульта у другого человека или у себя, не ждите, чтобы обратиться за помощью. Немедленно позвоните в службу 9-1-1.
Причины и факторы риска
Причина RCVS неизвестна. Заболевание чаще диагностируется у женщин в возрасте от 20 до 50 лет и может быть связано с изменениями, происходящими в организме сразу после родов (послеродовой период) или смены противозачаточных таблеток. История мигрени почти всегда обнаруживается у пациентов с RCVS.
Другие факторы риска, связанные с RCVS, включают:
- Употребление наркотиков
- Употребление алкоголя, особенно запой
- Использование определенных лекарств, отпускаемых по рецепту, например антидепрессантов
- Использование противоотечных средств для носа
- Использование никотиновых пластырей
- Некоторые опухоли
- Повышенный уровень кальция в крови (гиперкальциемия)
- Травма головы
Диагностика
Диагностика RCVS обычно начинается с физического осмотра и изучения истории болезни пациента и симптомов, а также результатов диагностических тестов.Однако, учитывая связь с мигренью, не всем пациентам с подозрением на RCVS потребуются расширенные визуализационные тесты.
Визуализирующие обследования, такие как магнитно-резонансная томография (МРТ) и компьютерная томография (КТ), используются, чтобы увидеть область, пораженную суженными кровеносными сосудами. Эти визуализирующие тесты исследуют мягкие ткани и кровеносные сосуды в организме и могут определить, связано ли состояние с инсультом или другими основными проблемами.
Другие тесты исследуют исключительно кровеносные сосуды внутри тела.Ангиограмма также может использоваться для просмотра артерий. Транскраниальный допплеровский ультразвук используется для измерения крови, которая течет по артериям у основания головного мозга.
Анализы крови и мочи также можно использовать для проверки того, насколько хорошо функционируют печень и почки.
Лечение
Лечение RCVS зависит от тяжести состояния. В некоторых случаях состояние проходит без лечения. Однако из-за риска инсульта важно, чтобы пациенты немедленно обращались за медицинской помощью.Жидкости будут вводиться внутривенно, и могут быть назначены лекарства от мигрени, такие как аспирин или Депакот.
В некоторых случаях блокатор кальциевых каналов может использоваться для расслабления кровеносных сосудов и обеспечения прохождения большего количества крови. Было показано, что это лекарство помогает облегчить головные боли типа «грома», но не снижает риск инсульта.
Для пациентов, перенесших инсульт, программа лечения инсульта в Cedars-Sinai предлагает многопрофильный подход к лечению с помощью планов лечения, адаптированных для каждого пациента.Уход за пациентами обычно делится на три категории: профилактика инсульта, лечение сразу после инсульта и реабилитация после инсульта.
© 2000-2021 Компания StayWell, LLC. Все права защищены. Эта информация не предназначена для замены профессиональной медицинской помощи. Всегда следуйте инструкциям лечащего врача.
Не то, что вы ищете?Что это такое, причины и многое другое
Термин «расширение сосудов» относится к расширению кровеносных сосудов в организме.Это происходит, когда расслабляются гладкие мышцы артерий и крупных вен.
Расширение сосудов происходит естественным путем в ответ на низкий уровень кислорода или повышение температуры тела. Его цель — увеличить кровоток и доставку кислорода к тем частям тела, которые в этом больше всего нуждаются.
При определенных обстоятельствах вазодилатация может благотворно сказаться на здоровье человека. Например, врачи иногда используют расширение сосудов для лечения высокого кровяного давления и связанных с ним сердечно-сосудистых заболеваний.Однако расширение сосудов также может способствовать определенным состояниям здоровья, таким как низкое кровяное давление и ряд хронических воспалительных состояний.
Продолжайте читать, чтобы получить дополнительную информацию о влиянии расширения сосудов на организм. В этой статье также описаны условия, которые могут вызвать расширение сосудов, и условия, при которых расширение сосудов может использоваться в качестве лечения.
Расширение сосудов означает расширение артерий и крупных кровеносных сосудов. Это естественный процесс, который происходит в ответ на низкий уровень кислорода или повышение температуры тела.Он увеличивает приток крови и доставку кислорода к тем участкам тела, которые в этом больше всего нуждаются.
Врач может иногда вызвать вазодилатацию для лечения высокого кровяного давления, также известного как гипертония, и связанных с ней состояний. Примеры таких состояний включают:
- легочная гипертензия, то есть высокое кровяное давление, которое специфически влияет на легкие
- преэклампсия и эклампсия, оба из которых являются потенциальными осложнениями беременности
- сердечная недостаточность
Врач может также вызвать вазодилатацию до улучшить эффекты лекарственного средства или лучевой терапии.Вазодилатация, по-видимому, полезна для этой цели, потому что она увеличивает доставку лекарств или кислорода к тканям, для которых эти методы лечения предназначены.
Есть несколько потенциальных причин расширения сосудов. Вот некоторые из наиболее распространенных:
- Упражнение: Расширение сосудов обеспечивает доставку дополнительного кислорода и питательных веществ к мышцам во время упражнений.
- Спирт: Спирт является естественным сосудорасширяющим средством. Некоторые люди могут испытывать вызванное алкоголем вазодилатацию в виде тепла или покраснения кожи лица.
- Воспаление: Воспаление — это способ организма восстанавливать повреждения. Расширение сосудов способствует воспалению, обеспечивая доставку кислорода и питательных веществ к поврежденным тканям. Расширение сосудов — это то, что заставляет воспаленные участки тела казаться красными или теплыми.
- Природные химические вещества: Выделение определенных химических веществ в организме может вызвать расширение сосудов. Примеры включают оксид азота и диоксид углерода, а также гормоны, такие как гистамин, ацетилхолин и простагландины.
- Сосудорасширяющие средства: Это лекарства, расширяющие кровеносные сосуды. Врачи иногда используют эти препараты для лечения гипертонии и связанных с ней состояний.
Сужение сосудов противоположно расширению сосудов. Сужение сосудов относится к сужению артерий и кровеносных сосудов.
Во время сужения сосудов сердцу необходимо сильнее перекачивать кровь, чтобы кровь проходила по суженным венам и артериям. Это может привести к повышению артериального давления.
Расширение сосудов может вызвать перечисленные ниже состояния.
Низкое кровяное давление
Расширение кровеносных сосудов во время расширения сосудов способствует кровотоку. Это снижает кровяное давление в стенках кровеносных сосудов.
Расширение сосудов вызывает естественное падение артериального давления.
Некоторые люди испытывают аномально низкое кровяное давление или гипотонию. В некоторых случаях это может привести к появлению следующих симптомов:
Хронические воспалительные состояния
Расширение сосудов также играет важную роль в воспалении.Воспаление — это процесс, который помогает защитить организм от вредных патогенов и устранить повреждения, вызванные травмой или болезнью.
Расширение сосудов способствует воспалению, увеличивая приток крови к поврежденным клеткам и тканям организма. Это позволяет более эффективно доставлять иммунные клетки, необходимые для защиты и восстановления.
Однако хроническое воспаление может вызывать повреждение здоровых клеток и тканей. Это может привести к повреждению ДНК, отмиранию тканей и рубцеванию.
Некоторые состояния, которые могут вызвать воспаление и сопутствующее расширение сосудов, включают:
- инфекции
- тяжелые аллергические реакции
- хронические воспалительные состояния, такие как ревматоидный артрит, воспалительное заболевание кишечника, волчанка и синдром Шегрена
Есть несколько факторов, которые могут влияют на расширение сосудов.Некоторые из наиболее распространенных примеров приведены ниже.
Температура
В теле человека есть нервные клетки, называемые терморецепторами, которые обнаруживают изменения температуры в окружающей среде.
Когда окружающая среда становится слишком теплой, терморецепторы вызывают расширение сосудов. Это направляет кровоток к коже, откуда может уйти избыточное тепло тела.
Вес
Люди с ожирением чаще испытывают изменения в реактивности сосудов. Это может произойти, если кровеносные сосуды не сужаются и не расширяются должным образом.
В частности, у людей с ожирением кровеносные сосуды более устойчивы к расширению сосудов. Это увеличивает риск гипертонии и связанных с ней сердечно-сосудистых заболеваний, таких как сердечный приступ и инсульт.
Возраст
Кровеносные сосуды содержат рецепторы, называемые барорецепторами. Они постоянно контролируют артериальное давление и при необходимости вызывают сужение или расширение сосудов.
С возрастом его барорецепторы становятся менее чувствительными. Это может снизить их способность поддерживать постоянный уровень артериального давления.
Кровеносные сосуды с возрастом становятся более жесткими и менее эластичными. Это делает их менее способными сжиматься и расширяться по мере необходимости.
Высота
Воздух на больших высотах содержит меньше доступного кислорода. Таким образом, человек, находящийся на большой высоте, будет испытывать вазодилатацию, поскольку его тело пытается поддерживать снабжение кислородом своих клеток и тканей.
Хотя расширение сосудов снижает кровяное давление в крупных кровеносных сосудах, оно может повышать кровяное давление в более мелких кровеносных сосудах, называемых капиллярами.Это связано с тем, что капилляры не расширяются в ответ на усиление кровотока.
Повышенное кровяное давление в капиллярах головного мозга может вызвать утечку жидкости в окружающие ткани головного мозга. Это приводит к локализованному отеку или припухлости. Медицинские работники называют это состояние высотным отеком мозга (HACE).
Люди на большой высоте также могут испытывать сужение сосудов в легких. Это может вызвать скопление жидкости в легких, которое медицинские работники называют высотным отеком легких (HAPE).
И HACE, и HAPE могут быть опасными для жизни, если человек не получает лечения.
В некоторых случаях врач может вызвать расширение сосудов для лечения определенных состояний. В других случаях может потребоваться вазодилатация.
Лекарства, вызывающие вазодилатацию
Вазодилататоры — это лекарства, вызывающие расширение кровеносных сосудов. Врачи могут использовать эти препараты для снижения артериального давления и уменьшения нагрузки на сердечную мышцу.
Существует два типа вазодилататоров: лекарства, которые действуют непосредственно на гладкие мышцы, например, на кровеносные сосуды и сердце, и лекарства, которые стимулируют нервную систему, вызывая вазодилатацию.
Тип вазодилататора, который получает человек, будет зависеть от состояния, которое требует лечения.
Люди должны знать, что вазодилататоры могут вызывать побочные эффекты. Сюда могут входить:
Лекарства для лечения вазодилатации
Вазодилатация — важный механизм. Однако иногда это может быть проблематично для людей, страдающих гипотонией или хроническим воспалением.
Людям с любым из этих состояний могут потребоваться лекарства, называемые вазоконстрикторами.Эти препараты вызывают сужение кровеносных сосудов.
У людей с гипотонией сосудосуживающие средства помогают повысить кровяное давление. У людей с хроническими воспалительными состояниями сосудосуживающие средства уменьшают воспаление, ограничивая приток крови к определенным клеткам и тканям организма.
Расширение сосудов означает расширение или расширение кровеносных сосудов. Это естественный процесс, который увеличивает кровоток и обеспечивает дополнительный кислород тканям, которые в нем больше всего нуждаются.
В некоторых случаях врачи могут намеренно вызвать расширение сосудов для лечения определенных заболеваний.Например, они могут прописать вазодилататоры для снижения кровяного давления и защиты от сердечно-сосудистых заболеваний.
В других случаях врачи могут уменьшить расширение сосудов, так как это может ухудшить такие состояния, как гипотония и хронические воспалительные заболевания. Врачи иногда используют препараты, называемые вазоконстрикторами, для лечения этих состояний.
Человек может поговорить со своим врачом, если у него есть какие-либо опасения по поводу своего кровяного давления.
Критическая роль астроцитов в гиперкапнической вазодилатации головного мозга
Реферат
Церебральный кровоток (CBF) контролируется артериальным кровяным давлением, артериальным CO 2 , артериальным O 2 и активностью мозга и в значительной степени постоянен в состояние бодрствования.Хотя небольшие изменения артериального CO 2 особенно эффективны для изменения CBF (изменение CBF на 1 мм рт.ст. в артериальном CO 2 изменяет CBF на 3% –4%), механизм связывания не полностью изучен. Мы проверили гипотезу о том, что астроцитарный простагландин E 2 (PgE 2 ) играет ключевую роль в реактивности цереброваскулярного CO 2 , и что сохраненный синтез глутатиона необходим для полного развития этого ответа. Мы объединили двухфотонную визуализационную микроскопию в срезах мозга с in vivo на крысах и мышах C57BL / 6J, чтобы изучить гемодинамические ответы на CO 2 и соматосенсорную стимуляцию до и после ингибирования синтеза астроцитарного глутатиона и PgE 2 .Мы демонстрируем, что гиперкапния (увеличение CO 2 ) вызывает увеличение количества астроцитов [Ca 2+ ] i и стимулирует активность COX-1. Фермент, расположенный ниже ЦОГ-1, который синтезирует PgE 2 (микросомальная простагландин Е-синтаза-1), критически зависит от его сосудорасширяющей активности от уровня глутатиона в головном мозге. Мы показываем, что при снижении уровней глутатиона вызываемое кальцием высвобождение PgE 2 астроцитами снижается и вазодилатация запускается увеличением астроцитов [Ca 2+ ] i in vitro и гиперкапнией in vivo составляет подавлено.Синтетические пути астроцитов, зависящие от глутатиона, участвуют в цереброваскулярной реактивности к CO 2 . Снижение уровня глутатиона при старении, инсульте или шизофрении может привести к дисфункциональной регуляции CBF и последующему повреждению нейронов.
ЗНАЧИМОЕ ЗАЯВЛЕНИЕ Активность нейронов приводит к выработке CO 2 , который, как ранее было показано, вызывает увеличение мозгового кровотока (CBF) за счет высвобождения вазодилататора PgE 2 .Мы демонстрируем, что гиперкапния (повышенный уровень CO 2 ) вызывает усиление передачи сигналов кальция астроцитами, что, в свою очередь, стимулирует активность COX-1 и генерирует последующую продукцию PgE 2 . Мы демонстрируем, что вызванная кальцием продукция вазодилататора PgE 2 , вызванная кальцием, критически зависит от уровней антиоксиданта глутатиона в мозге. Эти данные предполагают новую роль астроцитов в регуляции ответов CBF, вызванных CO 2 . Кроме того, эти результаты предполагают, что истощенные уровни глутатиона, которые возникают при старении и инсульте, вызывают дисфункциональную регуляцию CBF и могут привести к последующему повреждению нейронов.
Введение
Переходные процессы астроцитов [Ca 2+ ] и показали, что они напрямую изменяют диаметр церебральных артериол в экспериментах с использованием либо прямой стимуляции астроцитов, либо выделения кальция в астроцитах молодых особей (Zonta et al., 2003; Mulligan и MacVicar, 2004; Gordon et al., 2008) или взрослых животных (Takano et al., 2006). Однако несколько лабораторий опубликовали противоречивые данные о том, вызывается ли у взрослых животных передача сигналов астроцитов [Ca 2+ ] и синаптической активностью, ведущей к нейроваскулярному соединению (Zonta et al., 2003; Петцольд и др., 2008; Schulz et al., 2012; Lind et al., 2013; Otsu et al., 2015) или нет (Nizar et al., 2013; Takata et al., 2013; Bonder, McCarthy, 2014). Совсем недавно было показано, что астроциты [Ca 2+ ] i изменяют базальный тонус артериол у взрослых животных (Rosenegger et al., 2015). Таким образом, до сих пор плохо известно, когда, как и при каких условиях передача сигналов астроцитов [Ca 2+ ] i способствует регуляции церебрального кровотока (CBF).
В этой работе мы исследовали механизмы, лежащие в основе ответов CBF на повышенные концентрации CO в крови 2 (гиперкапния) и потенциальный вклад астроцитов в эти ответы CBF. Артериальный CO 2 оказывает сильное влияние на CBF с вариацией на 1 мм рт. Ст., Вызывающей изменение CBF на 3–4% (Hauge et al., 1980). Однако механизм, связывающий изменение CO 2 с изменением CBF, не совсем понятен. Существуют параллели между вазоактивными сигналами, генерируемыми астроцитами, и теми, что лежат в основе ответов CBF, вызванных гиперкапнией.Было показано, что астроциты напрямую изменяют диаметр артериол, когда их внутриклеточный [Ca 2+ ] i увеличивается, активируя астроцитарную фосфолипазу A 2 (PLA 2 ) (He et al., 2012) и тем самым генерируя арахидоновую кислоту. (AA) и несколько вазоактивных метаболитов, включая PgE 2 , который вызывает расширение сосудов (Zonta et al., 2003; Takano et al., 2006; Gordon et al., 2008; Attwell et al., 2010). В дополнение к их роли в сосудисто-нервном взаимодействии, активность PgE 2 (Wagerle and Mishra, 1988; Wagerle and Degiulio, 1994) и циклооксигеназы-1 (COX-1) (Niwa et al., 2001) участвуют в увеличении CBF во время гиперкапнии. Мы исследовали потенциальную связь между астроцитами и увеличением CBF во время гиперкапнии, потому что астроциты экспрессируют ферменты, которые участвуют в синтезе PgE 2 из AA во время вызванных гиперкапнией изменений CBF (Niwa et al., 2001). Например, мРНК как COX-1, так и микросомальной простагландин E-синтазы-1 (mPgES-1), как сообщается в исследованиях транскриптомов, высоко экспрессируется в астроцитах, но не в нейронах (например, ptgs1, также известный как COX-1, имеет 15- раз больше в астроцитах, чем в нейронах) (Cahoy et al., 2008; Zhang et al., 2014). Астроциты иммунореактивны как к ферментным белкам COX-1 (Takano et al., 2006; Gordon et al., 2008), так и к mPgES-1 (см. Рис. 3 A и Tachikawa et al., 2012). mPgES-1, форма простагландин E-синтазы, экспрессируемая в астроцитах, требует кофактора глутатиона (GSH) (Jakobsson et al., 1999; Murakami et al., 2000), который присутствует в больших количествах в астроцитах (см. рис. 3 ). B и Сан и др., 2006; Брагин и др., 2010; Робиллард и др., 2011).Мы исследовали, может ли гиперкапния вызывать увеличение количества астроцитов [Ca 2+ ] i in vivo и, если да, то приводит ли это к активации опосредованной PgE 2 вазодилатации. При этом мы демонстрируем новый GSH-зависимый механизм регуляции CBF, который включает астроциты и GSH-чувствительное высвобождение PgE 2 .
Материалы и методы
Подготовка срезов
Срезы гиппокампа-неокортекса размером 400 мкм получали от самцов и самок молодых (постнатальный возраст 16-21 день) крыс Sprague Dawley.Лечение животных было одобрено Комитетом по уходу и использованию животных Университета Британской Колумбии. Как описано ранее (Gordon et al., 2008), крыс анестезировали галотаном, декапитировали и мозг удаляли в ледяной раствор для срезов, содержащий следующее (в мм): 2,5 KCl, 26 NaHCO 3 , 0,5 CaCl 2 , 10 MgSO 4 , 1,25 NaH 2 PO 4 , 10 глюкозы, 230 сахарозы, насыщенный 95% O 2 /5% CO 2 . Поперечные полусрезы 400 мкм инкубировали при 32 ° C-34 ° C в aCSF, содержащем следующее (в мм): 126 NaCl, 2.5 KCl, 26 NaHCO 3 , 2,0 CaCl 2 , 2,0 MgCl 2 , 1,25 NaH 2 PO 4 , 10 глюкоза, насыщенная 95% O 2 /5% CO 2 для 60 мин. Для экспериментов срезы были при 22 ° C-24 ° C, aCSF был насыщен 20% O 2 /5% CO 2 , сбалансирован N 2 и перфузирован со скоростью ~ 2 мл / мин. Здоровые ломтики можно поддерживать в 20% O 2 , что обеспечивает pO 2 на нижнем конце физиологического диапазона (Gordon et al., 2008). Астроциты были загружены заключенным в клетку соединением IP 3 , NV-IP 3 / AM (5 мкг / мл) и / или индикатором Ca 2+ rhod-2 / AM (10 мкм, Invitrogen), как ранее. описан (Mulligan, MacVicar, 2004; Gordon et al., 2008). Срезы загружали монохлорбиманом (MCB, Fluka) в темноте при комнатной температуре в течение 30 минут, как описано ранее (Robillard et al., 2011).
Двухфотонная визуализация и снятие каркаса в острых срезах головного мозга
Двухфотонный лазерный сканирующий микроскоп (Zeiss LSM510-Axioskop-2 с 40 × -W / 1.0), соединенный с Ti: сапфировым лазером Chameleon ultra II (импульсы ∼140 фс, 80 МГц, когерентный), обеспечивал возбуждение rhod-2 и использовался для извлечения IP 3 . Изображения были получены на 50–100 мкм ниже поверхности среза. Флуоресцентная визуализация Rhod-2 и двухфотонное снятие каркаса были выполнены с использованием настроек лазера и фильтров излучения, как описано ранее (Gordon et al., 2008). MCB возбуждали на длине волны 780 нм и детектировали с помощью ФЭУ на длине волны 512–562 нм, как описано ранее (Robillard et al., 2011). Артериолы (определяемые как сосуды диаметром> 10 мкм, окруженные видимым слоем гладкомышечных клеток) были визуализированы путем получения проходящего лазерного света и с использованием оптики IR-DIC.
Глутатион и PgE
2 измеренияПротоколы в инструкциях поставщиков соблюдались для PgE 2 ELISA и анализов глутатиона. При измерении высвобождения PgE 2 из острых срезов головного мозга добавляли ТТХ (1 мкм, Alamone Labs) для подавления активации нейронов.Высвобождение PgE 2 из острых срезов головного мозга измеряли с использованием набора ELISA для специфических параметров PgE 2 (системы R&D). Уровни тканевого глутатиона измеряли с использованием специального набора для анализа общего глутатиона от BioVision или Assay Designs.
Иммуногистохимия
Крыс анестезировали галотаном, внутрибрюшинно вводили уретан (0,5 мл 30% уретана на 50 г веса тела) и перфузировали физиологическим раствором (0,9% NaCl в 0,1 м фосфатном буфере) с последующим введением 4% PFA (в 0.1 м ФБС). Мозг экстрагировали, фиксировали (10% сахарозы в 4% PFA) в течение ночи и подвергали криозащите (30% сахарозы в PBS) в течение ночи. С помощью криостата были собраны серийные срезы размером 40 мкм в горизонтальной плоскости по всему мозгу. Свободно плавающие срезы блокировали 10% нормальной козьей сывороткой (Jackson ImmunoResearch Laboratories) и 0,4% Triton X-100 в PBS в течение 1 ч и инкубировали в PBS, содержащем 0,1% Triton X-100 и первичные антитела против синтазы PgE 2 ( anti-mPgES-1) (Olajide et al., 2014; Tuure et al., 2015) (Agrisera, каталог № AS03 031, 1: 200), а также фенотипический маркер астроцитов (анти-GFAP (Lathia et al., 2008) (Sigma, каталог № G3893, клон № GA-5). , 1: 500) в течение ночи при 4 ° C.Ткань промывали и инкубировали в козьих антимышиных антителах AlexaFluor-488 и козьих против кроличьих вторичных антител AlexaFluor-546 (Invitrogen: разведенный 1: 500 в PBS, 2,5% нормальной козьей сыворотки 0,4% Triton X-100) при комнатной температуре в течение 1,5 ч. Ткань промывали, наносили на предметные стекла и закрывали с помощью монтажной среды Fluorsave (Calbiochem).Изображения были получены с помощью конфокального микроскопа Olympus Fluoview FV1000.
Лекарства
транс-ACPD (tACPD), клонидин, норадреналин (NE; Sigma) и PgE 2 (Cayman Chemicals) наносили в ванну на 5–10 мин. SC560 (Sigma) предварительно инкубировали в течение 30 минут (Blanco et al., 2008) с последующим нанесением ванны и бутионинсульфоксимином (BSO; Sigma) предварительно инкубировали в течение 2,5 часов (Sun et al., 2006) с последующим нанесением ванны на протяжении всего эксперимента. NV-IP 3 / AM был синтезирован Г.Эллис-Дэвис.
Животные:
in vivo измерений кровотока у крысВсе процедуры были одобрены Комитетом по этике Оксфордского университета и соответствовали требованиям Закона о животных (научные процедуры) 1986 года, Соединенное Королевство. Животных помещали в помещение для животных с 12-часовым чередованием цикла свет: темнота с доступом ad libitum к пище и воде. Использовали крыс-самцов линии Вистар (256–367 г).
Внутримозговая инъекция
Для хирургических процедур крыс анестезировали 4% изофлураном и поддерживали на уровне 1.5–2% изофлурана в 30% O 2 и 70% N 2 . Каждую крысу помещали в стереотаксическую рамку и обнажали череп. Отверстие для фрезы было просверлено на 1 мм каудально и на 4,2 мм латеральнее брегмы, и твердая мозговая оболочка была тонко иссечена, чтобы обнажить кору. Двадцать мкл 80 мг / мл BSO (Pileblad and Magnusson, 1989) или 0,9% физиологического раствора вводили с помощью микроинфузионного насоса со скоростью 2 мкл / мин в кору правого ствола усов на глубине 2,3 мм от поверхности мозга. Ранее было показано, что эта доза BSO адекватно снижает GSH в течение 24 часов после введения (Pileblad and Magnusson, 1989), и мы показали, что BSO, введенный таким образом, может снизить уровни GSH в ипсилатеральной коре головного мозга на 45% через 24 часа после инъекции. (см. рис.5 C ), и в ипсилатеральном полосатом теле на 31% (GSH, измеренный в обработанном физиологическим растворе: 0,61 ± 0,03 мМ, обработанном BSO: 0,42 ± 0,08 мМ, p = 0,045, n = 7 на группу, среднее ± стандартная ошибка среднего). После инфузии костный воск накладывали на фрезовое отверстие и рану закрывали 3–0 швами. Животные выздоравливали в течение 24 часов до оценки уровней GSH ( n = 7 на группу) или вызванных реакций кровотока ( n = 6–10 на группу).
Стимуляция подушечек усов и гиперкапния:
in vivo измерения кровотокаЧерез 24 часа после обработки BSO / физиологическим раствором животным канюлировали левую бедренную артерию для измерения газов крови, трахеотомировали и вентилировали 1.25% изофлурана в 30% O 2 и 70% N 2 . Лазерный доплеровский зонд (Perimed) для контроля относительного CBF помещали над корой правого цилиндра усов (где производилась внутримозговая инъекция), а биполярные стимулирующие электроды помещали в левую подушечку усов. Для некоторых экспериментов электрод потенциала локального поля (LFP) для нейрональной активности также помещали на облученную кору для контроля нейрональной активности. Перед началом экспериментов у всех животных был стабильный газ крови (таблица 1).
Таблица 1.Газы крови для эксперимента BSO (газы крови Nota Bene, взятые через 24 часа после приема препарата, но до экспериментов с гиперкапнией и стимуляцией усов) a
Электрический стимул (10 Гц, продолжительность 16 с, 1,6 мА , Ширина импульса 0,3 мс, интервал между стимуляциями 60 с), чтобы вызвать реакцию кровотока в коре головного мозга правого уса, выполняли для 10 испытаний на животное. После этого животные подвергались воздействию 10% CO 2 в течение 30 секунд с 3-минутными интервалами, повторяемыми 4 или 5 раз для индукции гиперкапнических реакций кровотока.Животных умерщвляли, и корковый слой анализировали для измерения уровней GSH.
Для экспериментов SC560 наивных крыс анестезировали изофлураном. Анестезию вызывали 4% изофлураном и поддерживали во время операции 2% изофлураном. Во время стимуляции анестезия поддерживалась 1,25% изофлураном. Изофлуран содержался в 30% O 2 и 70% N 2 . Крысам канюлировали левую бедренную артерию и вену, а также трахеотомировали и вентилировали. Лазерная спекл-камера (Moor Instruments) использовалась для мониторинга относительного CBF над тонким окном черепа над корой правого бочонка усов, в то время как электрод LFP для нейронной активности вводили через отверстие заусенца.Биполярные стимулирующие электроды помещали в левую подушечку усов. У животных был стабильный газ крови до и после введения лекарства (таблица 2). Электрический стимул (10 Гц, продолжительность 16 с, 1,6 мА, ширина импульса 0,3 мс, интервал между стимуляцией 60 с), чтобы вызвать реакцию кровотока в коре правого ствола усов, выполняли для 10 испытаний на животное. После этого животные подвергались воздействию 10% CO 2 в течение 30 с с 3-минутными интервалами, повторяемыми четыре раза для индукции реакции гиперкапнического кровотока.Затем животным внутривенно вводили 5 мг / кг SC560 или 10% ДМСО (носитель). SC560 является высоколипофильным ингибитором ЦОГ-1 и широко распределяется в тканях (Teng et al., 2003), и эта доза была выбрана для максимальной эффективности мишени (Zhang et al., 2003). Через 20 минут измеряли эффект ингибирования СОХ-1 на вызванные ответы CBF на стимуляцию усов и гиперкапнию.
Таблица 2.Газы крови для внутривенного эксперимента SC560 (газы крови Nota Bene, взятые до и после введения лекарства) a
Животные:
in vivo визуализация кальцияДля in vivo экспериментов, все Процедуры с участием животных были одобрены Датским национальным этическим комитетом в соответствии с руководящими принципами, изложенными в Конвенции Совета Европы о защите позвоночных животных, используемых в экспериментальных и других научных целях.Использовали самцов мышей C57BL / 6J в возрасте 8-10 недель.
In vivo визуализация кальцияДля экспериментов на мышах анестезию вызывали болюсными инъекциями агониста α2-адренорецепторов ксилазина (10 мг / кг внутрибрюшинно) и антагониста NMDA-рецепторов кетамина (60 мг / кг внутрибрюшинно) . Анестезия поддерживалась во время операции дополнительными дозами кетамина (30 мг / кг / 20 мин внутрибрюшинно). По завершении всех хирургических вмешательств анестезию переключили на непрерывную инфузию α-хлоралозы (50 мг / кг / ч внутривенно.v.).
Активность кальция во время гиперкапнии была измерена in vivo у восьми мышей C57BL / 6J. Трепанацию черепа над соматосенсорной корой покрывали агарозой и частично закрывали покровным стеклом. Oregon Green Bapta-1 / AM (OGB; Invitrogen) растворяли в ДМСО и Pluronic F-127 (10%, BASF Global) и разбавляли в aCSF до конечной концентрации красителя 0,8 мМ. Его смешивали с маркером астроцитов сульфородамин 101 (SR101; Sigma-Aldrich, 100 мкм) (Nimmerjahn et al., 2004) и вводили под давлением (4-6 фунтов на квадратный дюйм, 4 с) в соматосенсорную кору через микропипетку на глубине на 100–150 мкм ниже кортикальной поверхности.Визуализацию Ca 2+ выполняли с использованием коммерческого двухфотонного микроскопа (многофотонный / конфокальный лазерный сканирующий микроскоп SP5; Leica) и титан-сапфирового лазера Mai Tai HP (Millennia Pro, Spectra Physics) с числовой апертурой 20 × 1.0. водно-иммерсионный объектив (Leica). Длина волны возбуждения 820 нм. Излучаемый свет фильтровали для сохранения как красного, так и зеленого света с использованием фильтра TRITC / FITC.
Проблема гиперкапнии была представлена следующим образом: после 1-минутной записи исходного уровня вводили 10% CO 2 в воздухе на 30 с, а визуализацию продолжали в течение последующих 4 минут.Было проведено пять испытаний с интервалом 3 мин между испытаниями. Для каждого животного выбирали второе поле зрения и повторяли провокацию гиперкапнией. Газы крови отбирали после каждого эксперимента, и все мыши имели pCO 2 в диапазоне 30–40 мм рт. Ст. И pO 2 в диапазоне 95–130 мм рт.
Сбор, анализ и статистика данных
Данные in vitro .Изображение (512 × 512 пикселей) было собрано за 7,86–12,68 с с использованием 8-строчного усреднения. Измерения диаметра просвета и изменений Ca 2+ были выполнены в автономном режиме с помощью Zeiss LSM (версия 3.2) программное обеспечение и ImageJ (Национальные институты здравоохранения). Как описано ранее (Gordon et al., 2008), сигналы флуоресценции были определены как F / F 0 (%) = [( F 1 — B 1 ) / ( F 0 — B 0 )] 100, где F 1 и F 0 представляют собой флуоресценцию в данный момент времени и среднюю флуоресценцию в течение контрольного периода, соответственно. B 1 и B 0 — соответствующие сигналы фоновой флуоресценции, взятые из нейропиля. Псевдоцветные изображения показывают абсолютные изменения флуоресценции (ImageJ, 16-цветная линейная Lut). Экспериментальные значения представляют собой среднее значение ± стандартная ошибка среднего; n — количество проведенных экспериментов или, в случае изменений кальция, количество проанализированных астроцитов. Для сравнения между несколькими группами использовался либо двусторонний тест Стьюдента t , либо односторонний дисперсионный анализ с апостериорным тестом Newman – Keuls , и p <0.05 считали статистически значимым. Поскольку это были новые эксперименты, величина эффекта до начала эксперимента была неизвестна. Таким образом, оценки размера выборки были основаны на нашем предыдущем опыте. Эксперименты поочередно проводили в условиях контроля или обработки с произвольно выбираемыми срезами для каждого эксперимента. Данные исключались из анализа, если во время визуализации происходило одно из следующих событий: нестабильный исходный диаметр сосудов или уровни кальция в астроцитах, или движение, приводящее к значительным изменениям фокуса во время эксперимента.Для проведения статистического анализа предполагалось, что данные имеют нормальное распределение.
Данные in vivo .Все данные лазерного доплера и LFP были собраны с помощью программного обеспечения Spike 2, тогда как данные о лазерных спеклах были собраны с помощью программного обеспечения Moor FLPI. Количественная оценка изменений CBF и электрофизиология были выполнены в MATLAB (The MathWorks, версия 7.12). Чтобы получить область интереса (ROI) для расчета изменений CBF с использованием лазерной спекл-визуализации, был использован анализ основных компонентов, чтобы определить фокус изменения в ответ на стимуляцию.В данных по каждому животному использовалась одна и та же интересующая область. Экспериментальные значения представляют собой среднее значение ± SEM, а n — количество животных. Для проведения статистического анализа предполагалось, что данные имеют нормальное распределение. Тест F использовался для сравнения дисперсий статистически сравниваемых групп. Для данных CBF для сравнения средних значений между группами использовался односторонний тест t с поправкой Велча (поскольку группы имели значительно различающиеся дисперсии). Двусторонний тест t использовался для сравнения средних значений групп для обоих анализов GSH (см.рис.5 C ) и данные электрофизиологии в ответ на стимуляцию подушечек усов (с поправкой Велча для эксперимента SC560, см. Фиг. 6 C ). Для данных электрофизиологии, собранных во время экспериментов с заражением гиперкапнией, для сравнения средних значений между группами использовали двусторонний дисперсионный анализ с поправкой Бонферрони для множественных сравнений. p <0,05 считалось статистически значимым. Для экспериментов с участием крыс, поскольку размер эффекта до эксперимента был неизвестен, оценки размера выборки основывались на ранее опубликованных размерах выборки (например,г., Нива и др., 2001). Распределение животных чередовалось между экспериментальной и контрольной группами, и ни эксперименты, ни анализ не были слепыми. Три животных были исключены из анализа всех данных (1 для SC560 и 2 для BSO) из-за технических проблем с экспериментальным оборудованием.
Для визуализации кальция in vivo размер кадра во время записи составлял 256 × 256 пикселей (189–207 мс / кадр). Изменения Ca 2+ оценивали как среднее изменение флуоресценции относительно исходного уровня в ROI.Области интереса были размещены на основе морфологии нейрональной или астроцитарной сомы или нейропиля. Из-за движения астроцитов во время гиперкапнии, в пределах или вне фокуса, ROI оценивали на основе уровня нагрузки SR101 в красном канале. Если происходило значительное изменение, ROI не принимался во внимание во всех последующих оценках. Увеличение флуоресценции в пределах ROI было классифицировано как кальциевый ответ, если среднее значение флуоресценции в период гиперкапнии было> 2 SD от базовой активности.Задержку ответа Ca 2+ находили путем вычитания времени начала сигнала из времени, когда животному была введена гиперкапния. Чтобы оценить время начала и окончания ответа, данные были подобраны, и были рассчитаны производные первого и второго порядка. Время начала реакции определяли путем взятия максимального пика производной второго порядка подобранных данных. Затем определяли продолжительность ответа Ca 2+ путем вычитания времени начала ответа из времени окончания ответа.Время прекращения ответа определялось как момент времени, когда подобранные данные опустились ниже среднего базового уровня Ca 2+ или когда запись закончилась. Экспериментальные значения выражены как среднее ± SEM. Для получения данных визуализации кальция использовали парный тест t , каждое животное служило отдельным контролем. Статистически значимым было принято значение p <0,05. Для экспериментов с мышами, поскольку не было предыдущих исследований, сообщающих об изменениях кальция в астроглии во время гиперкапнии, было невозможно оценить ожидаемое значение для изменения флуоресценции или ее SD.Следовательно, невозможно было произвести расчет размера выборки. Однако мы ожидали изменений кальция, аналогичных тем, которые мы наблюдаем при низкочастотной стимуляции усов, поэтому размеры выборки были основаны на наших предыдущих экспериментах (6–8 мышей). Сигналы кальция, полученные во время гиперкапнии, превышали SNR 4: 1, и у каждого тестируемого животного регистрировались индуцированные гиперкапнией кальциевые ответы. Поскольку все мыши были подвержены гиперкапнии, метод рандомизации не использовался. Контрольные измерения активности кальция (т.е. активность без применения гиперкапнии) были взяты в случайные моменты времени во время эксперимента. Анализ изменений кальция не был слепым, оценка этих изменений была основана на программе MATLAB, которая анализирует последовательности изображений беспристрастным образом, а не путем визуального осмотра.
Результаты
Повышение концентрации CO
2 вызывает [Ca 2+ ] i ответы в астроцитах in vivoПовышение концентрации CO в тканях 2 , которое может быть вызвано метаболизмом нейронов, известно расширяют церебральные кровеносные сосуды в процессе, зависящем от образования PgE 2 (Wagerle and Mishra, 1988; Wagerle and Degiulio, 1994) за счет активности COX-1 (Niwa et al., 2001). Однако клетки, которые оба отвечают за восприятие CO 2 и которые также экспрессируют ферменты для синтеза PgE 2 (COX-1 и PgES), не были разделены. Астроциты могут продуцировать PgE 2 , но неизвестно, генерируют ли астроциты сигналы [Ca 2+ ] i в ответ на CO 2 . Поэтому мы проверили, вызывает ли увеличение вдыхаемого CO 2 (гиперкапния) in vivo астроцит [Ca 2+ ] i , когда он также вызывает увеличение CBF.
Двухфотонная лазерная сканирующая микроскопия (2PLSM) in vivo была использована для изучения одновременных реакций нейронов и астроцитов на гиперкапнию в интактном мозге в качестве первого шага для исследования того, какой тип клеток может быть основным датчиком CO 2 (рис.1). Примечательно, что мы обнаружили последовательное и значительное увеличение [Ca 2+ ] i в соме и кончиках астроцитов в корковых слоях II / III мышей (рис. 1) в период гиперкапнии.Резкое увеличение, которое мы наблюдали в астроцитах, имело значительно более высокую амплитуду (Рис. 1 A – C ; p <0,01), чем увеличение [Ca 2+ ] i , наблюдаемое в соме нейронов в период гиперкапния. Число астроцитов с ответами [Ca 2+ ] i также было намного больше при гиперкапнии по сравнению с числом, показывающим спонтанную активность кальция (контрольный период времени: Фиг.1 D ; p <0.01). Хотя нейроны могли отображать повышенное [Ca 2+ ] i во время гиперкапнии, с временем начала в течение нескольких секунд (рис. 1 B , C , E ), не было существенной разницы в количестве нейронов. с ответами [Ca 2+ ] i во время гиперкапнии по сравнению с числом, показывающим спонтанную активность кальция (контрольный период времени: фиг. 1 D ). Измерения, проведенные в нейропиле, где не было определенных клеточных тел, и трудно отделить сигналы в тонких отростках астроцитов от нейрональных процессов, не показали коррелированных изменений сигналов [Ca 2+ ] и во время гиперкапнии (рис.1 D ). Ответы астроцитов [Ca 2+ ] и (рис. 1 B, E , F ), по-видимому, происходят в те же временные рамки, что и увеличение CBF, вызванное гиперкапнией (по данным лазерной спекл-контрастной визуализации и лазерная доплеровская флоуметрия у крысы; см. рис. 5 ( A , D соответственно). Во время гиперкапнии повышенное количество сомы астроцитов (рис. 1 D ) отображалось повышенным [Ca 2+ ] и с началом в течение нескольких секунд (рис.1 B , E ) и переменной продолжительности в десятки секунд (рис. 1 B, F ). Хотя не было различий между тремя группами (астроцитарная сома, нейрональная сома и нейропил) в отношении задержки индуцированных гиперкапнией ответов Ca 2+ (средняя задержка ответа Ca 2+ [Рис. 1 E ]: сома нейрона = 12,14 ± 1,19 с ( n = 33), нейропиль = 12,83 ± 4,18 с ( n = 3) и сома астроцита = 14,57 ± 1,55 с ( n = 47)), средняя продолжительность отклика Ca 2+ (рис.1 F ) оказался значительно длиннее в астроцитах, чем в нейронах: сома нейрона = 119,41 ± 8,82 с ( n = 33), сома астроцита = 155,47 ± 8,32 с ( n = 47) ( p <0,05, ANOVA).
Рисунок 1.Астроцит [Ca 2+ ] i переходные процессы вызваны CO 2 in vivo . A , Примеры неподвижных изображений кортикального слоя II / III мыши из 2PLSM. OGB используется в качестве индикатора кальция ( Ai – Aiii ), а сульфородамин 101 (SR101, Aiv , среднее изображение для всей записи) используется для окрашивания астроцитов.Цветовая шкала относится к изображениям Ai – Aiii . Белые стрелки указывают на астроциты, которые показывают ответ Ca 2+ на CO 2 , по крайней мере, в два раза превышающий исходное колебание Ca 2+ . В этом случае стимул CO 2 начинается при t = 0 с и применяется в течение 36 с. Aiii , Немедленное извлечение CO 2 индуцировал переходный процесс Ca 2+ . Масштабные линейки 40 мкм. Bi , Biii , Дополнительные примеры изображений кортикального слоя II / III мыши из 2PLSM, показывающие пример размещения области интереса.Объедините изображения, показывающие OGB и SR101 ( Bi , Biii ). Красный ROI1 указывает на конец стопы астроцита. Красный RO12 указывает на сому астроцитов (слой II: n = 181, 8 мышей). Зеленая область интереса указывает на сому нейрона (слой II: n = 153, 8 мышей). Синий ROI указывает на нейропиль (слой II: n = 104, 8 мышей). Масштабная линейка 20 мкм. Пример временного ряда ( Bii , Biv ) ответа [Ca 2+ ] i в областях интереса астроцитов и нейронов сомы (как указано в Bi , Biii ) .Синий прямоугольник показывает время, в течение которого увеличивается уровень просроченного CO 2 . C , средний отклик Ca 2+ в ROI. Цвета представляют области интереса, расположенные, как показано в Bi . D , Процент ROI для каждого типа клеток, которые показали ответ Ca 2+ со стимулом гиперкапнии и без него. Для отсутствия гиперкапнии (контроль) n = 170 сом астроцитов, n = 148 сома нейронов и n = 96 областей интереса нейропиля, n = 8 мышей.Цвета соответствуют описанию в B . E , Задержка от времени начала гиперкапнии до начала ответа Ca 2+ в ROI. F , Продолжительность ответа Ca 2+ в каждой области интереса в ответ на стимул CO 2 . E , F , прямоугольные диаграммы представляют среднее значение (маленький квадрат). Края рамки представляют 25% и 75% данных. Конечные строки указывают максимальное и минимальное значения.Данные представляют собой среднее значение ± стандартная ошибка среднего. ** p <0,01. *** р <0,001.
Астроцитарные [Ca
2+ ] i сигналы вызывают последующее GSH-зависимое высвобождение PgE 2 высвобождениеПродемонстрировав in vivo , что гиперкапния вызывает увеличение количества астроцитов [Ca 2+ ] i , Затем мы использовали комбинацию измерений 2PLSM и PgE 2 с использованием ELISA на острых срезах головного мозга для определения механистических связей между ответами астроцитов [Ca 2+ ] i и регуляцией CBF.Используя биохимическую модель, мы исследовали роль GSH в генерации PgE 2 .
В отличие от ситуации in vivo , трудно надежно вызвать сигналы астроцитов [Ca 2+ ] i и вазодилатацию путем нанесения CO 2 на острые срезы головного мозга. Таким образом, нам понадобился альтернативный метод повышения астроцитов [Ca 2+ ] i в острых срезах головного мозга. Хотя было показано, что взрослая мышь (Sun et al., 2013) и крыса (Duffy and MacVicar, 1995) не экспрессируют функциональный mGluR5, известно, что нанесение в ванну агониста mGluR tACPD увеличивает количество астроцитов [Ca 2+ ] i у молодых животных (Mulligan, MacVicar, 2004).Таким образом, tACPD использовался, чтобы вызвать надежные воспроизводимые повышения астроцитов [Ca 2+ ] и в острых срезах головного мозга молодых крыс. Чтобы вызвать повсеместное увеличение количества астроцитов [Ca 2+ ] и , срезы гиппокампа и неокортекса перфузировали tACPD, агонистом mGluR. Применение tACPD (100 мкм) на срезах головного мозга (от молодых крыс) вызывало общее увеличение количества астроцитов [Ca 2+ ] i , наблюдаемое с помощью 2PLSM (рис. 2 A – C ), что дало нам возможность измерения последующего синтеза PgE 2 .Применение tACPD приводило к образованию и оттоку PgE 2 , как измерено с помощью ELISA (фиг. 2 D ). Первый шаг в превращении AA в PgE 2 в астроцитах осуществляется посредством COX-1 (Рис. 7) (Takano et al., 2006; Gordon et al., 2008; Font-Nieves et al., 2012). Нейроны, напротив, экспрессируют ЦОГ-2, но не ЦОГ-1 (Nogawa et al., 1997). В подтверждение центральной роли ЦОГ-1 мы обнаружили, что, хотя вызванное tACPD увеличение количества астроцитов [Ca 2+ ] i не изменилось (рис.2 C ) в присутствии ингибитора COX-1 SC560 (Smith et al., 1998; 100 нм: Blanco et al., 2008), в результате образования и оттока PgE 2 , как измерено с помощью ELISA, был отменен ( p <0,001; рис. 2 D ). Таким образом, активность СОХ-1 астроцитов необходима для последующего высвобождения PgE 2 в острых срезах головного мозга, которое запускается сигналами астроцитов [Ca 2+ ] i .
Рисунок 2.Сигналы астроцитов [Ca 2+ ] i вызывают COX-1- и GSH-зависимые вазодилатации in vitro . A , 2PLSM-визуализация: пример Ca 2+ и изменения диаметра артериол в ответ на tACPD с BSO и без него. Изображения представляют собой наложение псевдоокрашенных изменений Ca 2+ и изображений в проходящем свете. Пунктирная линия указывает начальный диаметр сосуда. Шкала 10 мкм. B , Среднее время увеличения количества астроцитов [Ca 2+ ] i в ответ на tACPD. Цветной прямоугольник представляет время применения tACPD. Контроль, n = 56 из 26 крыс; BSO, n = 39 из 18 крыс. C , Среднее увеличение астроцитов, вызванное tACPD [Ca 2+ ] i . tACPD, n = 56 из 26 крыс; tACPD + SC560, n = 12 из 7 крыс; tACPD + BSO, n = 39 из 18 крыс. D , Среднее tACPD-вызванное высвобождение PgE 2 , измеренное с помощью ELISA. Внутри группы в каждом эксперименте ( n ) используются ткани от разных крыс (т. Е. Контрольная, n = 8 от 8 крыс). E , Средняя концентрация GSH в тканях; данные по 4 крысам в каждой группе. F , Среднее время изменения диаметра просвета, вызванного tACPD. Цветной прямоугольник представляет время применения tACPD. Контроль, n = 31 срез от 26 крыс; BSO, n = 21 ломтик от 18 крыс. G , Средние изменения диаметра просвета, вызванные tACPD и клонидином. tACPD, n = 31 срез от 26 крыс; SC560 + tACPD, n = 7 срезов от 7 крыс; BSO + tACPD, n = 21 срез от 18 крыс; клонидин, n = 8 срезов от 8 крыс; BSO + клонидин, n = 8 срезов от 7 крыс. H , Средние изменения диаметра просвета, вызванные PgE 2 и NE. PgE 2 , n = 5 срезов от 4 крыс; BSO + PgE 2 , n = 3 среза от 3 крыс; NE, n = 14 срезов от 11 крыс; BSO + NE, n = 8 срезов от 7 крыс. Данные представляют собой среднее значение ± стандартная ошибка среднего. ** p <0,01. *** р <0,001. n — количество проведенных экспериментов или, для измерений кальция, количество проанализированных ROI астроцитов.
Ниже COX-1 синтез PgE 2 включает фермент mPgES-1 (Tachikawa et al., 2012), форму простагландин E-синтазы, экспрессируемой в астроцитах (Fig. 3 A ) (Tachikawa et al. ., 2012), которому необходим кофактор GSH (Jakobsson et al., 1999; Murakami et al., 2000). Известно, что GSH присутствует в больших количествах в астроцитах (Sun et al., 2006; Bragin et al., 2010; Robillard et al., 2011), что обнаружено при окрашивании ткани мозга MCB, GSH-чувствительным красителем. (Рисунок.3 В ). Поэтому мы исследовали, снижается ли образование PgE 2 при снижении уровней GSH. Мы исследовали, имеет ли место снижение высвобождения PgE 2 , вызванного астроцитами [Ca 2+ ] в срезах гиппокампа после обработки BSO (ингибитор γ-глутамилцистеинсинтетазы) в течение 2,5 часов (Sun et al. , 2006), что снизило концентрацию GSH в тканях на 27% ( p = 0,009; рис. 2 E ). Когда уровни GSH были снижены, хотя базальный отток PgE 2 не изменился (рис.2 D ) или в амплитуде сигналов астроцитов, вызванных tACPD [Ca 2+ ] i (рис. 2 A – C ), поразительно, что отток PgE 2 , вызванный tACPD, уменьшился на 64 % ( p <0,001; рис.2 D ).
Рисунок 3.Астроциты экспрессируют mPGES-1 и содержат высокие уровни GSH. A , Иммуногистохимия, показывающая астроцитарную экспрессию GSH-зависимого mPGES-1 в СА3 гиппокампа. Маркер астроцитов, GFAP (красный), mPGES-1 (зеленый) и слияние (желтый).Масштабная линейка 20 мкм. B , нагруженные MCB срезы гиппокампа и неокортекса. Астроциты (обозначенные SR101, красные, белые стрелки) содержат более высокие уровни GSH (на что указывает окрашивание MCB, зеленый цвет), чем нейроны (белые стрелки). Слияние (желтый). Масштабная линейка 20 мкм.
Сигналы астроцитов [Ca
2+ ] i вызывают ЦОГ-1 и GSH-зависимое расширение сосудов в срезах мозгаАктивность ЦОГ-1 (Niwa et al., 2001) и высвобождение PgE 2 (Wagerle and Mishra, 1988; Wagerle and Degiulio, 1994), как было показано, приводит к увеличению CBF в ответ на гиперкапнию, мы исследовали, вызывает ли ЦОГ-1-зависимый выброс PgE 2 , вызванный сигналами астроцитов [Ca 2+ ] i запускается приложением tACPD или IP 3 распаковка приводит к расширению сосудов.
Перфузия в ванне вызванной tACPD дилатацией артериол в острых срезах головного мозга (рис. 2 A , F , G ), которая была отменена в присутствии SC560 ( p <0,01; рис. 2 G ), тогда как амплитуда вызванных сигналов астроцитов [Ca 2+ ] i не изменилась ( p > 0,05; рис. 2 C ). Таким образом, в сочетании с результатами, обсужденными выше, эти данные подтверждают, что активность СОХ-1 астроцитов и последующее высвобождение PgE 2 необходимы для расширения сосудов в острых срезах головного мозга, которые запускаются сигналами астроцитов [Ca 2+ ] i .
Как обсуждалось ранее, ниже COX-1, синтез PgE 2 вовлекает экспрессируемый астроцитами, GSH-зависимый фермент mPgES-1 (Tachikawa et al., 2012). Следовательно, роль астроцитов в регуляции диаметра артериол будет поддержана, если вызванная [Ca 2+ ] i вазодилатация будет ослаблена при снижении уровней GSH. Мы исследовали, есть ли уменьшение последующих вазодилатаций в срезах гиппокампа после лечения BSO.Когда уровни GSH были снижены, сигналы астроцитов [Ca 2+ ] и , вызванные tACPD, не изменились (рис. 2 A – C ). Однако вазодилатация, вызванная этими сигналами [Ca 2+ ] i , была отменена (рис. 2 A , F , G ; p <0,01). Сужение сосудов, вызванное NE (100 мкм) или агонистом α 2 клонидином (10 мкм), которые действуют непосредственно на гладкомышечные клетки артериол (Busija and Leffler, 1987), не изменялись в присутствии BSO (рис.2 A , G , H ), что указывает на то, что артериолы не были повреждены обработкой BSO. Кроме того, лечение BSO не изменило вазодилатацию, вызванную либо 1 мкм PgE 2 (Рис. 2 H ), либо высоким [K + ] (10 мм), что вызывает расширение сосудов за счет гиперполяризующих клеток гладких мышц артериол (Filosa et al., 2006) (K + : 8,6 ± 2,3%, n = 5 срезов от 5 крыс; BSO + K + : 6,5 ± 0,8%, n = 6 срезов от 3 крыс, р = 0.37).
Увеличение количества астроцитов [Ca 2+ ] и может быть вызвано двухфотонным распаковкой IP 3 в теле клетки астроцита. Используя эту технику, мы непосредственно исследовали эффект снижения уровней GSH на [Ca 2+ ] и , вызванных астроцитами дилатации артериол. В астроциты в срезах гиппокампа молодых крыс загружали помещенное в клетку соединение IP 3 , NV-IP 3 / AM. Двухфотонный фотолиз был использован, чтобы освободить IP 3 внутри сомы астроцитов, что привело к увеличению [Ca 2+ ] i внутри сомы, отростков и конечностей.Это локальное увеличение [Ca 2+ ] i может вызвать увеличение [Ca 2+ ] i в соседних астроцитах (рис. 4 A , B представляет локальные и распространенные ответы) и вызывает расширение сосудов соседней артериолы (рис. 4 C ). Хотя сигналы астроцитов [Ca 2+ ] i не изменились после обработки BSO для снижения уровней GSH ( p = 0,1; Рис. 4 A , B ), дилатации не наблюдали, и теперь вызывались сужения сосудов. ( п. = 0.008; Рис.4 C ). Таким образом, когда уровни GSH снижены, сигналы астроцитов [Ca 2+ ] и больше не могут вызывать вазодилатацию, обычно запускаемую высвобождением PgE 2 .
Рисунок 4.Астроцит [Ca 2+ ] i кратковременные вызванные вазодилатации являются GSH-зависимыми in vitro . A , Среднее IP 3 — вызвало увеличение астроцитов [Ca 2+ ] i . Контроль, n = 21 от 6 крыс; + BSO, n = 11 от 4 крыс. B , Среднее время увеличения количества астроцитов [Ca 2+ ] i . Пунктирная линия указывает время фотолиза IP 3 в клетке. n , как описано в A . C , Изменение среднего диаметра просвета в ответ на снятие клетки IP 3. Uncage IP 3 , n = 11 срезов от 6 крыс; + BSO, n = 6 срезов от 4 крыс. Данные представляют собой среднее значение ± стандартная ошибка среднего. ** p <0.01. n — количество проведенных экспериментов или, для измерения содержания кальция, количество проанализированных ROI астроцитов.
In vivo вызванные гиперкапнией ответы CBF являются GSH-зависимымиОпределив в острых срезах головного мозга вазодилататорные молекулы, лежащие в основе астроцитов [Ca 2+ ] i , вызванные расширением сосудов, мы исследовали, были ли эти же ферменты и молекулы участвует в ответе CBF, который происходит после CO 2 -вызванного астроцита [Ca 2+ ] i ответов in vivo .Гиперкапния in vivo вызвала увеличение CBF в стволовой коре взрослой крысы (фиг.5 A , B , D , E ), тогда как нервная активность не изменилась (фиг.5 F ) . Расчетная площадь под кривой (AUC) ответа CBF была значительно ослаблена SC560 ( p = 0,032; рис. 5 A , B ), подтверждая, что ЦОГ-1 играет критическую роль в вызванной гиперкапнией. CBF увеличивает in vivo на (Niwa et al., 2001).
Рисунок 5.CO 2 вызванных CBF-ответов in vivo зависят от GSH. A , Средние следы местного ответа CBF на гиперкапнию, измеренные с помощью лазерной спекл-контрастной визуализации у животных, которым вводили носитель (DMSO) — (синий) и SC560- (красный). n = 7 крыс в каждой группе. Цветной рамкой обозначено время применения CO 2 . Данные показаны в виде частичного изменения с исходным уровнем 0 (исходный уровень взят в течение 60 с перед проверкой) и пиком до лечения, равным 1 (черная пунктирная линия на графике). B , Средняя AUC CBF-ответа на гиперкапнию в присутствии носителя (ДМСО) или SC560 (нормализованная до максимумов до лечения для каждого животного). n = 7 крыс в каждой группе. C , Уровни GSH в тканях через 24 часа после инъекции BSO или физиологического раствора в кору головного мозга ( n = 7 крыс). D , Средний след местного ответа CBF на гиперкапнию, измеренный с помощью лазерной доплеровской флоуметрии, у крыс, которым вводили физиологический раствор (синий) и BSO (красный). n = 6 крыс в каждой группе. E , Средние значения AUC CBF-ответа на гиперкапнию. n = 6 крыс в каждой группе. F , G , Нейронная активность. Мощность в частотных диапазонах. F , Во время исходного уровня (Базовый) и в ответ на гиперкапнию (HCN) для животных, обработанных физиологическим раствором (синий) и BSO (красный). n = 3 крысы. G , Гиперкапния (HCN) / исходный уровень (Base).Лечение BSO не изменяет влияние гиперкапнии на нервную активность. n = 3 крысы. Данные представляют собой среднее значение ± стандартная ошибка среднего. * p <0,05.
Мы исследовали влияние снижения уровня GSH в тканях на увеличение CBF, вызванное CO 2, in vivo . Чтобы снизить уровни GSH in vivo , BSO вводили в кору головного мозга крысы. Через 24 часа уровни GSH в тканях ипсилатеральной коры головного мозга снизились на 45% (рис. 5 C ; p = 0,018). Лечение BSO снижало вызванный гиперкапнией ответ CBF (рис.5 D, E ; AUC снижена на 65%, р ( = 0,048). Нервная активность не отличалась у крыс, получавших BSO, по сравнению с крысами, получавшими физиологический раствор (фиг. 5 G ). Объединение всех данных, описанных до сих пор, позволяет предположить, что вызванное гиперкапнией, связанное с астроцитами [Ca 2+ ] i увеличение CBF требует высвобождения PgE 2 и, таким образом, нарушается, когда уровни GSH в головном мозге снижаются.
Это открытие было характерно для увеличения CBF, вызванного гиперкапнией. Мы исследовали влияние снижения уровня GSH in vivo в тканях на функциональную гиперемию в соматосенсорной коре.Стимуляция подушечками усов (10 Гц) вызвала усиление кровотока в коре ствола (рис. 6 A ). В соответствии с предыдущими результатами (Niwa et al., 2000), ингибирование ЦОГ-1 с помощью SC560 не влияло ни на ответ CBF на стимуляцию подушечек усов (рис. 6 A , B ; p = 0,10). или вызванная нервная активность (LFP) (рис. 6 C ; p = 0,91). Кроме того, AUC вызванного стимуляцией ответа CBF существенно не различалась у животных, получавших BSO (фиг.6 D ; p = 0,14) по сравнению с животными, получавшими физиологический раствор, демонстрируя, что реакция CBF не является чувствительной к GSH. Величина нейронного ответа на стимуляцию подушечек усов не зависела от BSO (рис. 6 E ; p = 0,68). Эти результаты показывают, что в этих экспериментальных условиях ЦОГ-1 и GSH играют небольшую роль, если вообще играют, в ответе CBF на соматосенсорную стимуляцию. Эти данные подтверждают, что существует несколько различных путей, которые объясняют регуляцию CBF в разных условиях и в ответ на разные стимулы.
Рисунок 6.CBF-ответы на стимуляцию подушечек усов in vivo не зависят от GSH. A , Среднее время локального ответа CBF на стимуляцию подушечек усов, измеренное с помощью лазерной контрастной визуализации спеклов у крыс, которым вводили носитель (ДМСО) (синий) и SC560- (красный). Цветной прямоугольник обозначает время стимуляции. Пунктирная черная линия показывает пик перед обработкой, равный 1. B , средняя AUC ответа CBF на стимуляцию подушечек усов. n = 7 крыс в каждой группе. C , Величина среднего нейронного ответа (LFP) на стимул подушечки усов (суммированный по общей длине стимула 16 с). Ответы нормализованы по первому импульсному отклику для каждой крысы. n = 4 крысы, обработанные ДМСО; n = 3 крысы, получавшие SC560. D , Средняя AUC CBF-ответа, вызванного стимуляцией подушечек усов, у крыс, которым вводили физиологический раствор (синий) и BSO (красный). n = 10 крыс в каждой группе. E , Величина средней нервной реакции (LFP) на стимуляцию подушечек усов (суммированная по общей длине стимула 16 с).Ответы нормализованы по первому импульсному отклику для каждой крысы. n = 3 крысы в каждой группе. Данные представляют собой среднее значение ± стандартная ошибка среднего.
Обсуждение
Мы демонстрируем новый механизм регуляции CBF с участием астроцитов, который зависит от GSH. Ранее Niwa et al. (2001) продемонстрировали, что увеличение CBF, вызванное гиперкапнией, в основном зависит от ЦОГ-1. В этом исследовании мы изучили механизм такой регуляции CBF как выше, так и ниже по течению от вызванного гиперкапнией повышения активности ЦОГ-1 (рис.7). Мы демонстрируем in vivo , что перед вызванной активностью COX-1 CO 2 увеличивает [Ca 2+ ] i в астроцитах. Эти данные демонстрируют новый сигнал (гиперкапния), который активирует кальций астроцитов и специфически идентифицирует участие астроцитов в регуляции CBF в ответ на изменения артериального CO 2 .
Рисунок 7.Увеличение астроцитарного [Ca 2+ ] i может привести к GSH-зависимой, PgE 2 -опосредованной вазодилатации.Схематическая диаграмма, показывающая, как CO 2 -вызванное увеличение астроцитарного [Ca 2+ ] i может привести к PgE 2 -опосредованной вазодилатации. В результате повышенного [Ca 2+ ] i активируется PLA 2 . PLA 2 генерирует AA из плазматической мембраны. AA может обрабатываться локально ферментами COX с образованием производных AA, таких как простагландин H 2 (PgH 2 ). PgE 2 продуцируется из PgH 2 ферментом PGE, который требует GSH в качестве кофактора (Jakobsson et al., 1999; Мураками и др., 2000; Tanioka et al., 2000). PgE 2 высвобождается из кончиков астроцитов, которые прилегают к гладкомышечному слою, окружающему артериолы, что приводит к активации каналов K + , снижению поступления Ca 2+ в гладкомышечные клетки и расширению сосудов.
In vitro , используя срезы мозга молодых животных, на которых можно исследовать кальциевые сигналы путем массовой загрузки индикаторного красителя кальция, мы подтверждаем, что увеличение количества астроцитов [Ca 2+ ] i приводит к последующему высвобождению PgE 2 и расширение сосудов, которые зависят от активности ЦОГ-1 (рис.7). Наше предположение о том, что вызванный ответ у молодых срезов крыс такой же, как у взрослых крыс в отношении зависимости от ЦОГ-1, подтверждается тем фактом, что такая же зависимость от ЦОГ-1 была показана у взрослых мышей (Takano et al., 2006) . Мы демонстрируем, что эти результаты содержат in vivo , подтверждая предыдущие данные на взрослых мышах (Niwa et al., 2001). Концы астроцитов, которые прилегают к гладкой мускулатуре сосудов головного мозга, экспрессируют все механизмы, необходимые для синтеза PgE 2 (COX-1) (Takano et al., 2006; Gordon et al., 2008), mPgES-1 (Рис.3 A ) (Tachikawa et al., 2012) и GSH: (Рис.3 B ) (Sun et al., 2006; Bragin et al. ., 2010; Robillard et al., 2011), что дает дополнительные доказательства участия астроцитов в регуляции ответов CBF на гиперкапнию. mPgES, фермент, избирательно экспрессируемый в астроцитах по сравнению с нейронами (Tachikawa et al., 2012), является ферментом, ответственным за продукцию PgE 2 ниже активности ЦОГ-1. Интересно, что образование PgE 2 регулируется доступностью GSH в астроцитах, поскольку PgES требует GSH в качестве кофактора (Jakobsson et al., 1999; Мураками и др., 2000). In vitro , мы демонстрируем, что вазодилатация, вызванная астроцитами [Ca 2+ ] i , ослабляется при истощении уровней GSH, тогда как in vivo , мы демонстрируем, что вызванное CO 2 увеличение CBF происходит через GSH-зависимый механизм. Поскольку астроциты содержат высокие уровни GSH (рис. 3 B ) (Sun et al., 2006; Bragin et al., 2010; Robillard et al., 2011), зависимость CBF-ответа, вызванного CO 2 на GSH — еще одно свидетельство вовлечения астроцитов.В совокупности наши результаты предполагают новый механизм регуляции CBF, вызванной астроцитами, который зависит от GSH. Мы предполагаем, что повышенные уровни CO 2 вызывают [Ca 2+ ] i ответы в астроцитах, впоследствии активируя сигнальный путь, включающий COX-1 и GSH-зависимый PgES, что приводит к высвобождению вазодилататора PgE. 2 . Таким образом, увеличение CO 2 приводит к управляемой астроцитами, GSH-зависимой вазодилатации (рис. 7).
Этот GSH-зависимый механизм регуляции CBF существует наряду с другими COX-1 и GSH-нечувствительными механизмами.Например, мы не обнаружили эффекта блокирования активности ЦОГ-1 или снижения уровня GSH на ответы CBF после стимуляции подушечек усов с частотой 10 Гц. Хотя возможно, что кальциевый ответ астроцитов (и, следовательно, GSH-чувствительный механизм регуляции CBF) может быть вызван интенсивным сенсорным стимулом (Schulz et al., 2012; Sekiguchi et al., 2016), наши результаты таковы. в соответствии с предыдущими исследованиями, предполагающими, что ЦОГ-1 участвует в ответах CBF на гиперкапнию (Niwa et al., 2001), но не в сенсорной стимуляции (Niwa et al., 2000). Хотя мы не видели доказательств того, что этот путь важен для функционального (вызванного нейрональной активностью) увеличения CBF в наших экспериментальных условиях, астроциты, по-видимому, являются важным посредником для физиологического (вызванного гиперкапнией) увеличения CBF. Наши результаты предполагают, что регуляция CBF может включать астроциты и их сигналы [Ca 2+ ] i при определенных условиях, а не при других.
Предыдущие исследования предоставили доказательства нескольких механизмов, связывающих увеличение концентрации астроцитов [Ca 2+ ] i, и изменение концентрации CO 2 .Например, в дыхательном центре повышенное содержание астроцитов [Ca 2+ ] i, и астроцитарное высвобождение АТФ может быть вызвано снижением pH, вызванным CO 2 (Gourine et al., 2010). Это увеличение [Ca 2+ ] i, может быть результатом увеличения котранспорта Na + / HCO 3 — и обратного переноса Na + / Ca 2+ (Туровский и др. ., 2016). Неизвестно, происходит ли этот механизм также в коре головного мозга.В качестве альтернативы, повышенный уровень CO 2 может вызывать опосредованное гемиканалом высвобождение АТФ (Huckstepp et al., 2010), который может действовать на пуринергические рецепторы астроцитов, вызывая повышение [Ca 2+ ] i (Pelligrino et al. ., 2011). В зависимости от механизма, связывающего увеличение CO 2 с ответами астроцитов [Ca 2+ ] и , следовательно, астроциты могут действовать как сенсор pH или CO 2 . Хотя определение связи между увеличением CO 2 и увеличением количества астроцитов [Ca 2+ ] i выходит за рамки данной статьи, мы продемонстрировали, что истощение уровней GSH приводит к снижению в способности астроцитов высвобождать PgE 2 после такого повышения [Ca 2+ ] i, и, таким образом, снижает их способность вызывать вазодилатацию в ответ на гиперкапнию.Это происходит потому, что астроциты экспрессируют GSH-зависимый mPgES-1.
Наше открытие, что ответы CBF на повышенный CO 2 являются GSH-чувствительными, предполагает, что глобальная регуляция CBF, которая чувствительна к парциальному давлению артериального CO 2 (Ainslie and Duffin, 2009), будет затронута в условиях, когда Уровни GSH истощены. Изменения окислительно-восстановительного статуса ткани головного мозга, которые в конечном итоге связаны с клеточными уровнями GSH, наблюдались при многочисленных неврологических и психических расстройствах (Slivka and Cohen, 1993; Tohgi et al., 1995, 1999; Ансари и Шефф, 2010; Zhang et al., 2012; Кулак и др., 2013). Следовательно, влияние изменений уровня GSH на чувствительность регуляции вазодилатации астроцитами может способствовать возникновению нескольких патологий ЦНС. Таким образом, очень важно понимать сигнальные пути, лежащие в основе изменений CBF, как при здоровье, так и при болезни.
Ранее было показано, что, помимо астроцитарной продукции PgE 2 посредством активности COX-1 / mPgES, нейроны (которые экспрессируют COX-2, но не COX-1) (Nogawa et al., 1997; Lecrux et al., 2011), способны продуцировать происходящий из COX-2 PgE 2 (который способствует нейроваскулярному сцеплению) (Lecrux et al., 2011; Lacroix et al., 2015). В этом исследовании мы использовали фармакологический подход для увеличения количества астроцитов [Ca 2+ ] i и ингибирования синтеза глутатиона de novo или активности ЦОГ-1, в частности, чтобы продемонстрировать, что ниже по течению от увеличение количества астроцитов [Ca 2+ ] и , активности ЦОГ-1 и глутатиона необходимы для вазодилатации.Однако, поскольку этому фармакологическому подходу не хватает клеточной специфичности, нельзя полностью исключить вклад продуцируемого нейронами PgE 2 в вызванный гиперкапнией ответ CBF. Тем не менее, наш вывод о том, что PgE 2 , происходящий из астроцитов, ЦОГ-1, а не PgE 2 , происходящий из нейронов ЦОГ-2, участвует в ответе CBF на гиперкапнию, согласуется с предыдущими выводами (Niwa et al., 2001 ). В будущих исследованиях можно использовать генетическую стратегию, специфичную для астроцитов (например, клеточно-специфический нокаут) (Casper et al., 2007), чтобы подтвердить, что вызванные гиперкапнией вазодилатации, происходящие ниже ответа астроцитов [Ca 2+ ] и , зависят от уровней глутатиона астроцитов и активности ЦОГ-1.
В заключение, мы демонстрируем новый механизм, с помощью которого астроциты обнаруживают гиперкапнию и посредством сигналов [Ca 2+ ] i увеличивают CBF в ответ на CO 2 . Следовательно, астроциты способны обнаруживать метаболическую активность нейронов и соответствующим образом изменять тонус сосудов для доставки глюкозы и O 2 .Этот важный путь может быть нарушен в условиях, когда окислительный стресс снижает уровни GSH в астроцитах, что приводит к нарушению ответов CBF и изменению сосудистых считываний нервной активности.
Сноски
Эта работа была поддержана стипендией сэра Генри Веллкома для получения докторской степени, стипендией правительства Канады для постдокторских исследований в СН, стипендией Фонда Майкла Смита для исследований в области здравоохранения для докторской степени, а также Стипендия Совета по естественным наукам и инженерным исследованиям для докторантуры Дж.MPP, докторантура канадских институтов исследований в области здравоохранения в РК, кафедра нейробиологии Канады для BAM, операционные гранты канадских институтов исследований в области здравоохранения 148397, 8545, 115121 и TCE-117869 в рамках ERA-NET NEURON для BAM , Fondation Leducq для BAM, AMB и ML, Human Frontiers Science Program для BAM и G.E.-D., Национальные институты здравоохранения, гранты GM053395 и NS069720 для G.E.-D., Heart and Stroke Foundation, B.A.M. и H.B.C., Wellcome Trust C.M., Исследовательская стипендия Университета Королевского общества для CM, Cancer Research United Kingdom C5255 / A12678 для NRS, Благотворительный фонд Генри Смита для AMB, Фонд NORDEA для Центра здорового старения для ML, Фонд Lundbeck для ML, Фонд NOVO-Nordisk в ML и Датский совет по медицинским исследованиям в ML Мы благодарим Дэвида Аттвелла за обсуждение этой работы.
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
- Переписку следует направлять по одному из следующих адресов: Dr.Брайан А. Маквикар, Центр здоровья мозга Джавада Мовафагиана, 2215 Wesbrook Mall, Университет Британской Колумбии, Ванкувер, Британская Колумбия V6T 1Z3, Канада, bmacvicar {at} brain.ubc.ca; или доктор Аластер М. Бьюкен, Программа лечения острого инсульта, Медицинский факультет Рэдклиффа, Оксфордский университет, Оксфорд, OX3 9DU, Великобритания, alastair.

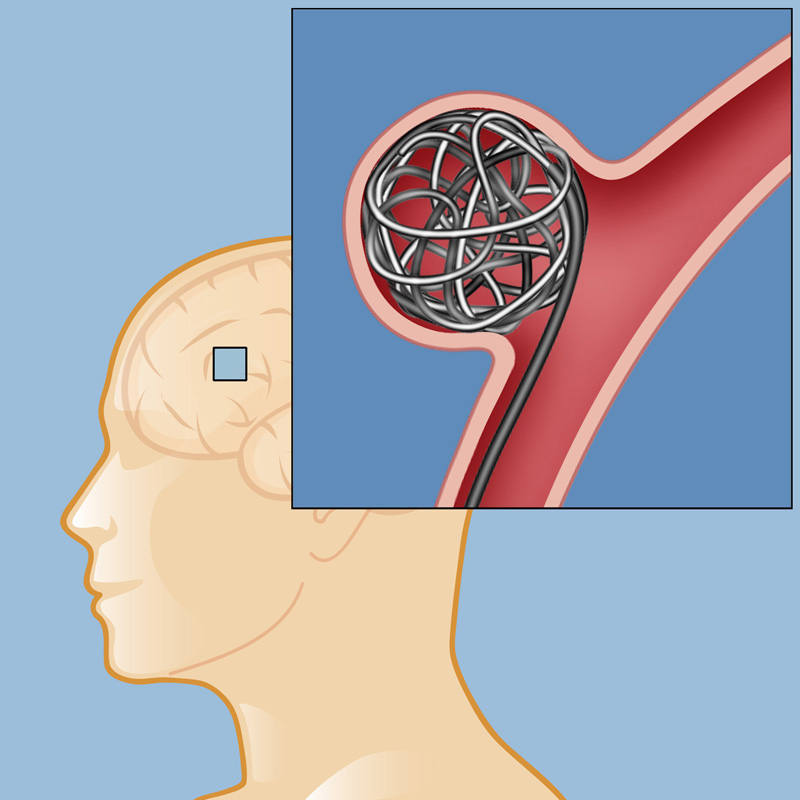 В основном, это нерегулярный режим питания. Кроме того, некоторые люди чувствительны к определенным видам продуктов (сыр, шоколад, кофе, цитрусовые). Алкоголь, особенно красное вино, пиво, шампанское, коктейли – частые триггеры головной боли.
В основном, это нерегулярный режим питания. Кроме того, некоторые люди чувствительны к определенным видам продуктов (сыр, шоколад, кофе, цитрусовые). Алкоголь, особенно красное вино, пиво, шампанское, коктейли – частые триггеры головной боли.
 На следующий день к смеси добавьте чайную ложку свежего лимонного сока и смешайте. Полученную жидкость принимайте 3 раза в день за 30 минут перед едой.
На следующий день к смеси добавьте чайную ложку свежего лимонного сока и смешайте. Полученную жидкость принимайте 3 раза в день за 30 минут перед едой. Ноги расставлены по ширине плеч. 2-3 минуты делайте круговые движения головой по часовой и против часовой стрелки.
Ноги расставлены по ширине плеч. 2-3 минуты делайте круговые движения головой по часовой и против часовой стрелки. Кроме того, аллицин препятствует образованию холестериновых бляшек.
Кроме того, аллицин препятствует образованию холестериновых бляшек. Они расслабляют стенки сосудов, снижают периферическое сопротивление артерий и вен, регулируют тонус и снижают кровяное давление. Препараты: Дибазол, Апрессин, Нитропруссид натрия.
Они расслабляют стенки сосудов, снижают периферическое сопротивление артерий и вен, регулируют тонус и снижают кровяное давление. Препараты: Дибазол, Апрессин, Нитропруссид натрия.