Принципы лечения локальных рецидивов рака молочной железы с учетом изменения иммунофенотипа первичной опухоли
Дружков М.О., Гатауллин И.Г., Дружков О.Б.
Государственное автономное учреждение здравоохранения «Республиканский клинический онкологический диспансер», Казань, Россия
В статье рассмотрены принципы лечения локальных рецидивов рака молочной железы.
Материалы и методы. Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период с 2000 по 2011 гг. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: иммуногистохимическое исследование гормональных рецепторов, опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов.
Результаты.
Изменения в опухолях люминального А фенотипа произошли у 10% пациентов (p<0,05). Рак молочной железы люминального В HER2-позитивного подтипа поменял иммунофенотип в рецидивных опухолях у 75% пациентов (p=0,005). Трижды-негативные опухоли поменяли иммунофенотип в 33,3% случаев. Динамика иммунофенотипа рака молочной железы HER2-позитивного молекулярно-генетического типа опухолей наблюдалась у 28,6% пациентов.
Больные раком молочной железы люминального А типа имеют благоприятный прогноз локального рецидивирования. У большинства (75,6%) больных с люминальным А типом рака молочной железы локальный рецидив возникает в сроки более 30 месяцев, у 24,4% – в период до 30 месяцев (p<0,05). Для люминального В типа, как с гиперэкспрессией онкогена HER2/neu, так и без нее, наиболее характерны средние сроки (от 30 до 60 месяцев) возникновения рецидива – 60% больных.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменения иммуногистохимических свойств раковой опухоли, нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы.
Выводы. К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива. Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Ключевые слова: рак молочной железы, локальный рецидив, иммунофенотип рецидивной опухоли, молекулярно-генетические подтипы рака молочной железы.
Изучением проблемы локальных рецидивов рака молочной железы занимаются крупные мировые онкологические институты, проведены многочисленные исследования, наиболее значимые из них: Milan1, Milan2, NSABP, DBGC, SPORE, PP [1]. В вышеперечисленных исследованиях изучались сроки возникновения локальных рецидивов в зависимости от объема оперативного лечения, различных схем комплексного лечения, молекулярно-генетических подтипов рака молочной железы [2]. По результатам данных исследований разработаны практические рекомендации Американского Общества Онкологов (NCCN), Европейского общества онкологов (EORTC) [3]. Благодаря внедрению разработанных стандартов лечения рака молочной железы удалось снизить показатели смертности и увеличить выживаемость пациентов, страдающих данным заболеванием [4].
Цель исследования: разработка тактики комплексного лечения локальных рецидивов с учетом изменения иммунофенотипов первичной опухоли и локального рецидива рака молочной железы.
Материалы и методы исследования
Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период 10 лет. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: результаты клинических, лабораторных методов диагностики, иммуногистохимического исследования гормональных рецепторов опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов. Данные историй болезней и амбулаторных карт были закодированы для обработки в статистической программе SPSS 12.0. Всего были проанализированы 20 признаков с их градациями – клинические данные, морфологические факторы и тактика лечения опухолей. После мастэктомии рецидивы возникли у 76 пациентов (1,4%), после органосохранной операции – у 54 пациентов (5,7%). Объем хирургического вмешательства при локальном рецидиве зависел от объема предшествующего хирургического лечения, размеров рецидивной опухоли и был представлен несколькими вариантами. Широкое иссечение рецидива в области послеоперационного рубца или на передней грудной стенке проведено 77 больным (59,3%), ампутация остатка молочной железы (простая мастэктомия) после органосохранной операции – 37 пациентам (28,3%), повторная органосохранная операция (в сочетании с пластической коррекцией и без) – 16 человек (12,4%).
Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: результаты клинических, лабораторных методов диагностики, иммуногистохимического исследования гормональных рецепторов опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов. Данные историй болезней и амбулаторных карт были закодированы для обработки в статистической программе SPSS 12.0. Всего были проанализированы 20 признаков с их градациями – клинические данные, морфологические факторы и тактика лечения опухолей. После мастэктомии рецидивы возникли у 76 пациентов (1,4%), после органосохранной операции – у 54 пациентов (5,7%). Объем хирургического вмешательства при локальном рецидиве зависел от объема предшествующего хирургического лечения, размеров рецидивной опухоли и был представлен несколькими вариантами. Широкое иссечение рецидива в области послеоперационного рубца или на передней грудной стенке проведено 77 больным (59,3%), ампутация остатка молочной железы (простая мастэктомия) после органосохранной операции – 37 пациентам (28,3%), повторная органосохранная операция (в сочетании с пластической коррекцией и без) – 16 человек (12,4%).
Результаты исследования и их обсуждение
На основании исследования мы подтвердили, что раковая опухоль на фоне проводимого лечения часто меняет свои молекулярно-биологические свойства. По нашим наблюдениям, изменения произошли у 45,7% пациентов. Все возможные изменения иммунофенотипа рака молочной железы отражены на рисунке 1.
Рисунок 1. Динамика иммунофенотипа первичной опухоли РМЖ.
На рисунке представлены сочетания ИГХ-показателей рака молочной железы. В отношении каждого из них показаны изменения в процентном соотношении. Мы подтвердили большую предрасположенность к изменениям некоторых иммунофенотипов первичной опухоли по сравнению с другими. Первичные опухоли с иммунофенотипом ER+PR-Neu+, ER+PR-Neu-, ER-PR+Neu- более предрасположены к изменениям (100%, p<0,005) при возникновении локального рецидива. Опухоли с иммунофенотипом ER+PR+Neu- значительно реже меняли свой иммунофенотип (20,0%).
Для анализа клинического значения обнаруженных изменений иммуногистохимических показателей рака молочной железы полученные результаты были объединены согласно общепринятой молекулярно-генетической классификации. По нашим наблюдениям, фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев. Результаты распределения пациентов по иммуногистохимическим показателям первичной опухоли и локального рецидива представлены на рисунке 2.
Рисунок 2. Распределение пациентов с первичной опухолью и локальными рецидивами
по молекулярно-генетическим подтипам, чел.

Рисунок 3. Динамика иммунофенотипа РМЖ.
Опухоли HER2-позитивного типа изменили свои молекулярно-генетические свойства в рецидивной опухоли у трети пациентов. Опухоли люминального В типа HER2-позитивного поменялись в 75% случаев. Опухоли люминального А молекулярно-генетического типа практически не менялись (10% опухолей). Опухоли трижды-негативного типа в 33,3% случаев перешли в другой подтип. Опухоли люминального B HER2-позитивного подтипа достоверно чаще других (75%, p<0,05) изменили свой иммунофенотип в рецидивной опухоли. Опухоли люминального А типа менее других молекулярно-генетических типов РМЖ склонны к динамике – 90% (p<0,05) не поменяли иммунофенотип в рецидивной опухоли. Опухоли люминального А типа, утратив экспрессию рецепторов стероидных гормонов, переходили в трижды-негативный тип. Опухоли люминального В типа, утрачивая гиперэкпрессию онкогена HER2/neu, индекса пролиферативной активности Ki67 или экспрессию рецепторов эстрогена и прогестерона либо экспрессию и тех и других, переходили в люминальный А тип, трижды-негативный или в HER2-позитивный тип.
Рисунок 4. Сводная схема динамики иммунофенотипа РМЖ.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменения иммуногистохимических свойств раковой опухоли, нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы (рис.5). Внедрение в клиническую практику разработанного алгоритма, по нашему мнению, позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
В основу алгоритма положено деление локальных рецидивов на первично-резектабельные и первично-нерезектабельные формы, ключевым является иммунодиагностика локального рецидива рака молочной железы (рис. 5).
5).
Рисунок 5. Алгоритм комплексной терапии локальных рецидивов (ЛР) РМЖ
(ИДО – иммунодиагностика опухоли).
Комплексное лечение пациентов с операбельной формой локального рецидива начинаем с хирургического удаления рецидивной опухоли. Объем хирургического вмешательства зависит от размеров рецидивной опухоли, предшествующей операции и представлен несколькими вариантами. После радикальных мастэктомий проводится иссечение рецидива в области послеоперационного рубца или на передней грудной стенке. После предшествующей органосохранной операции проводится ампутация остатка молочной железы (простая мастэктомия), если размер рецидивной опухоли превышает 2 см в наибольшем измерении. В случае, когда размер рецидивной опухоли не превышает 2 см, проводится повторная органосохранная операция (в сочетании с пластической коррекцией и без), отступая от краев опухоли не менее 2 см, и гистологическое исследование резекционных линий на степень их «чистоты». Все удаленные опухоли подвергаются гистологическому и иммуногистохимическому исследованию. В зависимости от результатов назначается лекарственная терапия. Если опухоль оказывается гормонозависимой с высокой экспрессией рецепторов стероидных гормонов (7-8 баллов), то целесообразнее всего проведение гормонотерапии II-III линии. В случае низкой экспрессии рецепторов стероидных гормонов в рецидивной опухоли или ее отсутствия проводится полихимиотерапия с последующей эндокринотерапией.
Все удаленные опухоли подвергаются гистологическому и иммуногистохимическому исследованию. В зависимости от результатов назначается лекарственная терапия. Если опухоль оказывается гормонозависимой с высокой экспрессией рецепторов стероидных гормонов (7-8 баллов), то целесообразнее всего проведение гормонотерапии II-III линии. В случае низкой экспрессии рецепторов стероидных гормонов в рецидивной опухоли или ее отсутствия проводится полихимиотерапия с последующей эндокринотерапией.
Хирургическое лечение локальных рецидивов осложненной формы в большинстве случаев затруднительно ввиду врастания в переднюю грудную стенку или близлежащие крупные сосудисто-нервные пучки, либо ввиду больших размеров рецидивной опухоли, отсутствия ее четких границ и отсутствия возможности закрытия кожного дефекта операционной раны. Поэтому комплексное лечение неоперабельных локальных рецидивов целесообразно начинать с системного лечения, основной целью которого является уменьшение размеров рецидивной опухоли для возможности дальнейшего ее удаления. В первую очередь должна проводиться системная терапия осложненной (неоперабельной) формы локальных рецидивов рака молочной железы, которая включает в себя химиотерапию и эндокринотерапию. Пациентам, ранее получавшим ПХТ I линии с антрациклин-содержащими схемами (FAC, CAF, AC), целесообразнее проводить более «агрессивные» таксан- и платино-содержащие схемы химиотерапии.
В первую очередь должна проводиться системная терапия осложненной (неоперабельной) формы локальных рецидивов рака молочной железы, которая включает в себя химиотерапию и эндокринотерапию. Пациентам, ранее получавшим ПХТ I линии с антрациклин-содержащими схемами (FAC, CAF, AC), целесообразнее проводить более «агрессивные» таксан- и платино-содержащие схемы химиотерапии.
В случае, если неоперабельная форма локального рецидива сопровождается отдаленным метастазированием, рецидивная опухоль на фоне системного лечения будет являться своеобразным маркером прогрессирования заболевания и показателем ее эффективности. Данным пациентам дальнейшее оперативное лечение целесообразнее всего проводить только в случае стабилизации заболевания и его длительной ремиссии. Местное воздействие является следующим этапом комплексной терапии осложненных (неоперабельных) форм ЛР. К оперативному лечению рецидивной опухоли следует приступать только в случае регресса опухоли под воздействием системной терапии. В том случае, если достигнуть положительного эффекта от лекарственного лечения не удалось и опухоль по-прежнему хирургически нерезектабельна, целесообразно проведение лучевой терапии.
В том случае, если достигнуть положительного эффекта от лекарственного лечения не удалось и опухоль по-прежнему хирургически нерезектабельна, целесообразно проведение лучевой терапии.
Выводы
К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива. Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Литература
- Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005; 366(9503): 2087-106.
- Smid M, Wang Y, Zhang Y, et al. Subtypes of breast cancer show preferential site of relapse. Cancer Res. 2008; 68: 3108-3114.
- Elkhuizen PHM, van Slooten H, Clahsen PC, et.
 al. High Local Recurrence Risk Breast-Conserving Therapy in Node-Negative Premenopausal Breast Cancer Patients Is Greatly Reduced by One Course of Perioperative Chemotherapy: A European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group Study. J.Clin.Oncol. 2000; 18: 1075-1083.
al. High Local Recurrence Risk Breast-Conserving Therapy in Node-Negative Premenopausal Breast Cancer Patients Is Greatly Reduced by One Course of Perioperative Chemotherapy: A European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group Study. J.Clin.Oncol. 2000; 18: 1075-1083. - Paridaens R, Piccart M. First line hormonal treatment for metastatic breast cancer with exemestane or tamoxifen in postmenopausal patients – A randomized phase III trial of the EORTC Breast Group. Proceeding of ASCO 40 Annual Meeting. New Orleans, 2004; 23: 6.abs.515.
- Колядина И.В., Поддубная И.В., Комов Д.В. и соавт. Срок наступления локальных рецидивов у больных первично-операбельным раком молочной железы при различной лечебной тактике. Сибирский онкологический журнал 2008; 6(30): 17-20.
- Iorio MV, Croce CM. MicroRNAs in cancer: small molecules with a huge impact. J. Clin. Oncol 2009; 27: 5848-5856.
Опубликован обзор эволюции терапии Her2 позитивного рака молочной железы
Her2 позитивный рак молочной железы 20 лет назад считался плохо поддающимся лечению.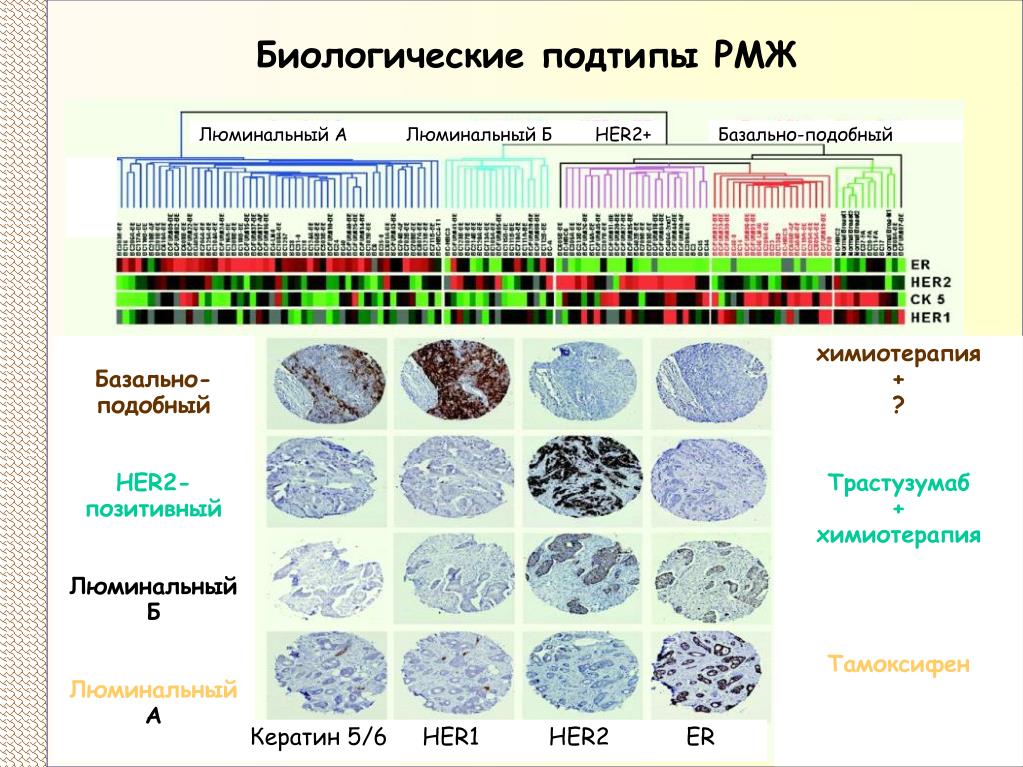 В настоящее время большинство пациенток с подобным диагнозом может быть вылечено. Об эволюции терапии этого вида рака содержательно рассказывает заведующий отделением химиотерапии Даниил Львович Строяковский.
В настоящее время большинство пациенток с подобным диагнозом может быть вылечено. Об эволюции терапии этого вида рака содержательно рассказывает заведующий отделением химиотерапии Даниил Львович Строяковский.
Рак молочной железы – это несколько различных заболеваний, объединенных общей локализацией первичной опухоли.
Одним из наиболее распространенных и изученных вариантов является Her2 позитивный вариант. Он составляет 18-20% от всего рака молочной железы. Например: если в г. Москве в год заболевает РМЖ ~ 7000 женщин, то значит Her2 позитивных среди них ~ 1250 женщин. Причем, наиболее часто данный вариант опухоли встречается у женщин младше 50 лет (но может быть в любом возрасте).
По данным одного из Американских регистров если разделить женщин с РМЖ по возрасту, то 45% — женщины младше 50 лет, 29% — женщины от 50 до 60 лет, 26% старше 60 лет. Среди женщин старше 50 лет у более чем 75% опухоль гормонопозитивная (ER+, PR+/-). Соответственно младше 50 лет, существенно чаще встречается Her2 позитивный, гормононегативный вариант и трижды-негативный варианты. Это наиболее агрессивные подтипы.
Соответственно младше 50 лет, существенно чаще встречается Her2 позитивный, гормононегативный вариант и трижды-негативный варианты. Это наиболее агрессивные подтипы.
Среди Her2 позитивного рака молочной железы у ~ 40% Эстрогеновые и Прогестероновые рецепторы отрицательные (ER-, PR-), соответственно у 60% опухоль гормонопозитивная (и Her2 позитивная).
Таким образом, есть 2 подтипа Her2 позитивного рака: люминальный В, Her2 позитивный (ER+, PR+/-, Her2 положительный) и нелюминальный Her2 позитивный (ER-, PR, Her2 положительный).
Что такое Her2 позитивность?
На 17 хромосоме есть участок ДНК, который кодирует наличие рецептора Her2 на поверхности клеток. Этот рецептор существует в норме на поверхности большинства эпителиальных клеток. При раке молочной железы, у части пациенток (~18%), на 17 хромосоме, данный участок ДНК начинает повторяться многократно (амплификация), то есть вместо 1 гена Her2 на каждой из 2-х хромосом (от папы и мамы), этих генов становится очень много. Соответственно происходит многократно бОльшая частота считывания этого гена, и это приводит к тому, что количество рецепторов Her2 на поверхности опухолевых клеток становится многократно больше, чем в норме (гиперэкпрессия). Эти рецепторы, как «антенны» торчат из мембраны опухолевых клеток, и начинают слипаться с другими такими «антеннами» (Her2), также могут слипаться с соседними другими «антеннами» Her1, Her3, Her4. Это приводит к генерации сигнала внутрь ядра опухолевой клетки – «плодись и метастазируй».
Соответственно происходит многократно бОльшая частота считывания этого гена, и это приводит к тому, что количество рецепторов Her2 на поверхности опухолевых клеток становится многократно больше, чем в норме (гиперэкпрессия). Эти рецепторы, как «антенны» торчат из мембраны опухолевых клеток, и начинают слипаться с другими такими «антеннами» (Her2), также могут слипаться с соседними другими «антеннами» Her1, Her3, Her4. Это приводит к генерации сигнала внутрь ядра опухолевой клетки – «плодись и метастазируй».
Чтобы определить, если ли Her2 гиперэкпрессия на поверхности опухолевых клеток проводят исследование: иммуногистохимия (ИГХ)
Могут быть 4 варианта иммуногистохимического проявления Her2 на поверхности опухолевых клеток: варианты ответов
У большинства Her2 позитивных опухолей, с помощью ИГХ удается сразу установить Her2 позитивность, то есть ответ Her2 3+.
Но, у около 10% пациенток ИГХ экспрессия не дотягивает для HER2 3+, и врач получает ответ Her2 2+. В этом случае выполняется исследование FISH (флуоресцентная ин ситу гибридизация). Но даже в этом случае, не всегда удается до конца точно установить Her2 статус, так как иногда повтора гена бывает мало (амплификация низкой степени). Иногда опухоль неоднородная, то есть в части опухолевых клеток есть выраженная амплификация гена Her2, а в части ее нет. Это сложные случаи для трактовки. Поэтому каждые 3-5 лет происходят уточнения и дополнения к руководству по трактовке Her2 позитивности. Надо сказать, что заложенная ошибка метода (в очень качественной лаборатории) составляет в районе 5%, то есть, если в г. Москве 7000 женщинам проводится ИГХ исследование, для уточнения биологического типа рака молочной железы в год, ошибка существует как минимум у 350 женщин в ту или иную сторону.
В этом случае выполняется исследование FISH (флуоресцентная ин ситу гибридизация). Но даже в этом случае, не всегда удается до конца точно установить Her2 статус, так как иногда повтора гена бывает мало (амплификация низкой степени). Иногда опухоль неоднородная, то есть в части опухолевых клеток есть выраженная амплификация гена Her2, а в части ее нет. Это сложные случаи для трактовки. Поэтому каждые 3-5 лет происходят уточнения и дополнения к руководству по трактовке Her2 позитивности. Надо сказать, что заложенная ошибка метода (в очень качественной лаборатории) составляет в районе 5%, то есть, если в г. Москве 7000 женщинам проводится ИГХ исследование, для уточнения биологического типа рака молочной железы в год, ошибка существует как минимум у 350 женщин в ту или иную сторону.
Хуже, когда Her2 позитивная опухоль была определена, как Her2 негативная – это означает, что пациентка не получает должного лечения. Если же Her2 негативная опухоль диагностирована как Her2 позитивная, то в этом случае женщина получает избыточное таргетное лечение, но так как токсичность данного лечения в целом мала, на мой взгляд от этого меньше вреда. На самом деле, частота ошибок в рутинном определении Her2 статуса намного больше, чем 5% (сколько я не знаю), поэтому так важно, чтобы Онкопатологические лаборатории были, по настоящему, высококачественные.
На самом деле, частота ошибок в рутинном определении Her2 статуса намного больше, чем 5% (сколько я не знаю), поэтому так важно, чтобы Онкопатологические лаборатории были, по настоящему, высококачественные.
Эта форма опухоли – Her2 позитивный рак молочной железы важна тем, что еще 15-20 лет назад считалась наиболее агрессивной и летальной, среди всех вариантов РМЖ. Однако в настоящее время, благодаря интеграции таргетной терапии, стала самой курабильной (излечимой).
Основные таргетные препараты для Her2 позитивного РМЖ:
1. Трастузумаб — моноклональное антитело к рецептору Her2 на поверхности опухолевых клеток
2. Лапатиниб (малая молекула) – внутриклеточный ингибитор Her2 рецептора. Her2 как бы прошивает насквозь мембрану опухолевой клетки и у него есть внутриклеточная часть
3. Пертузумаб — моноклональное антитело к поверхности рецептора Her2, но присоединяется в другой точке чем Трастузумаб и мешает склеиванию рецепторов семейства Her (Her1, Her2, Her3, Her4). Пертузумаб эффективен только с Трастузумабом или Трастузумаб-Эмтанзином
Пертузумаб эффективен только с Трастузумабом или Трастузумаб-Эмтанзином
4. Трастузумаб-Эмтанзин — это сложная молекула: Трастузумаб соединен с очень сильным цитостатиком. Опухолевая клетка, пытаясь избавится от Трастузумаба, как бы его «съедает» погружает часть мембраны с ним внутрь себя в виде вакуоли, затем разрушает эту вакуоль, и тут освободившийся сильный цитостатик разрушает опухолевую клетку изнутри – этакий «Троянский конь».
История создания препаратов анти-Her2 направленности существует около 25 лет. В 1998 году в США был зарегистрирован препарат Трастузумаб в комбинации с химиотерапией в качестве 1-ой линии лечения метастатического рака молочной железы (то есть паллиативное противоопухолевое лечение женщин с впервые выявленными метастазами).
Было проведено клиническое исследование: пациенток с впервые выявленными метастазами Her2 позитивного РМЖ делили на 2 группы: половина получала химиотерапию (или Доксорубицин-содержащую или Паклитаксел- содержащую), половина такую же химиотерапию + Трастузумаб. Средняя продолжительность жизни (Общая Выживаемость (ОВ)) составила в контрольной группе 20 месяцев (чуть более 1,5 лет), а группе с Трастузумабом 25 месяцев (более 2-х лет). На тот момент, результаты этого исследования выглядели значительным, но все-таки эволюционным шагом в лечении метастатического рака молочной железы. Разница в продолжительности жизни в 5 месяцев была не очень впечатляющая, но удалось впервые перешагнуть 2 года в средней продолжительности жизни в этой когорте пациенток. В реальной клинической практике, всего 20 лет назад половина женщин с метастазами Her2 позитивного рака молочной железы умирали в районе полутора лет. В основном метастазы поражали печень, легкие, кости.
Средняя продолжительность жизни (Общая Выживаемость (ОВ)) составила в контрольной группе 20 месяцев (чуть более 1,5 лет), а группе с Трастузумабом 25 месяцев (более 2-х лет). На тот момент, результаты этого исследования выглядели значительным, но все-таки эволюционным шагом в лечении метастатического рака молочной железы. Разница в продолжительности жизни в 5 месяцев была не очень впечатляющая, но удалось впервые перешагнуть 2 года в средней продолжительности жизни в этой когорте пациенток. В реальной клинической практике, всего 20 лет назад половина женщин с метастазами Her2 позитивного рака молочной железы умирали в районе полутора лет. В основном метастазы поражали печень, легкие, кости.
У женщин с гормонопозитивным и Her2 позитивным РМЖ гормонотерапия была не эффективна, и только химиотерапия давала короткий эффект. Причем в странах Запада, пациенткам были доступны помимо Доксорубицина, также Таксаны (Паклитаксел и Доцетаксел с середины 90х годов, затем Капецитабин, Винорелбин, Платина, Гемцитабин). В нашей стране, в то время мы могли использовать только Доксорубицин и Циклофосфан, а также другие «старые» цитостатики. Таксанов, Капецитабина, Винорелбина, Гемцитабина практически не было, тем более Трастузумаба (его стоимость на 1 цикл терапии была в районе 3000$). Соответственно картина течения болезни была удручающая для большинства пациенток.
В нашей стране, в то время мы могли использовать только Доксорубицин и Циклофосфан, а также другие «старые» цитостатики. Таксанов, Капецитабина, Винорелбина, Гемцитабина практически не было, тем более Трастузумаба (его стоимость на 1 цикл терапии была в районе 3000$). Соответственно картина течения болезни была удручающая для большинства пациенток.
Революционным и поворотным моментом лечения Her2 позитивного рака молочной железы явилось 15 мая 2005 года, когда на конференции ASCO в Орландо были доложены результаты исследований адъювантной терапии Her2 позитивного рака молочной железы.
Адъювантная терапия – это терапия, которая применяется после хирургического лечения (операция по удалению первичной опухоли: или Мастэктомия, или Радикальная секторальная резекция), для снижения риска прогрессирования заболевания, у больных I, II, III стадиями (в основном с II и III стадиями). Хорошо известно, что на момент операции, когда стадия рака не IVя, у большинства пациенток имеются микрометастазы, которые могут быть, где угодно. Эти микрометастазы никак себя не проявляют и их невозможно определить никакими методами (УЗИ, Рентген, КТ, МРТ, ПЭТ-КТ, скенирование, анализы крови и т.д.). Но из этих микрометастазов, в последствии, разовьются макрометастазы, которые и переведут болезнь в неизлечимую фазу. При наличии отдаленных метастазов, неважно, которые были выявлены сразу (в дебюте заболевания) или после радикальной операции, на сегодня болезнь (метастатический рак молочной железы) считается не излечимой. Поэтому задача адъювантной терапии — убить микрометастазы (где бы они не находились) и тем самым излечить как можно больше пациенток. Минусом адъювантной (профилактической) терапии является тот факт, что, когда ее проводишь, ты не знаешь: кому конкретно она помогает. Это лечение не самого пациента, а его риска. Тем не менее адъювантная лекарственная терапия локальных форм рака молочной железы (I-III стадий) является одним из самых необходимых этапов лечения. Важно разумно и правильно объяснить риски, потенциальную пользу и возможные осложнения лечения.
Эти микрометастазы никак себя не проявляют и их невозможно определить никакими методами (УЗИ, Рентген, КТ, МРТ, ПЭТ-КТ, скенирование, анализы крови и т.д.). Но из этих микрометастазов, в последствии, разовьются макрометастазы, которые и переведут болезнь в неизлечимую фазу. При наличии отдаленных метастазов, неважно, которые были выявлены сразу (в дебюте заболевания) или после радикальной операции, на сегодня болезнь (метастатический рак молочной железы) считается не излечимой. Поэтому задача адъювантной терапии — убить микрометастазы (где бы они не находились) и тем самым излечить как можно больше пациенток. Минусом адъювантной (профилактической) терапии является тот факт, что, когда ее проводишь, ты не знаешь: кому конкретно она помогает. Это лечение не самого пациента, а его риска. Тем не менее адъювантная лекарственная терапия локальных форм рака молочной железы (I-III стадий) является одним из самых необходимых этапов лечения. Важно разумно и правильно объяснить риски, потенциальную пользу и возможные осложнения лечения. Очень важно выбрать научно обоснованную и наиболее эффективную программу, с наименьшим токсическим профилем.
Очень важно выбрать научно обоснованную и наиболее эффективную программу, с наименьшим токсическим профилем.
Итак, 15 мая 2005 года на конференции ASCO в Орландо были доложены 2 Late Breaking Abstracts: результат Европейского исследования HERA (в котором, в том числе принимали участие и Российские исследователи) и объединенный анализ 2-х Американских исследований, посвященных добавлению Трастузумаба к адъювантной химиотерапии при I-III стадиях Her2 позитивного РМЖ.
Я прекрасно помню этот день, предварительные результаты были засекречены, была только информация, что исследования прошли успешно. В зале, где проходил доклад было вероятно несколько десятков тысяч человек (подобного количества я больше ни разу не видел) – это отражает огромную роль рака молочной железы, среди онкологических заболеваний. Врачи со всего мира очень плотно стояли друг рядом с другом и была фантастическая тишина, боялись пропустить хоть одно слово. Я тоже был в зале, вместе с русскими коллегами, мы слушали затаив дыхание. Результаты оказались ярче, чем все наши самые оптимистические предположения. В исследовании HERA, где контингент пациенток был несколько менее запущен (было больше I и II стадий) добавление Трастузумаба привело к уменьшению числа прогрессирующих в первые 3 года в половину. Но самое больше впечатление произвели объединенные результаты 2-х американских исследований (в основном II и III стадии), где к антрациклин и паклитаксел- содержащему режиму химиотерапии (на тот момент уже стандарт в США, мы еще и близко не могли так делать), был добавлен Трастузумаб. В 2-х исследованиях участвовали 3351 женщина. В группе без Трастузумаба в ближайшие 4 года после операции прогрессирование наблюдалось в среднем у 33% пациенток, тогда как в группе с Трастузумабом прогрессирование было только у 15%. Риск смерти от рака молочной железы снизился с 14% до 8%.
Результаты оказались ярче, чем все наши самые оптимистические предположения. В исследовании HERA, где контингент пациенток был несколько менее запущен (было больше I и II стадий) добавление Трастузумаба привело к уменьшению числа прогрессирующих в первые 3 года в половину. Но самое больше впечатление произвели объединенные результаты 2-х американских исследований (в основном II и III стадии), где к антрациклин и паклитаксел- содержащему режиму химиотерапии (на тот момент уже стандарт в США, мы еще и близко не могли так делать), был добавлен Трастузумаб. В 2-х исследованиях участвовали 3351 женщина. В группе без Трастузумаба в ближайшие 4 года после операции прогрессирование наблюдалось в среднем у 33% пациенток, тогда как в группе с Трастузумабом прогрессирование было только у 15%. Риск смерти от рака молочной железы снизился с 14% до 8%.
Если перевести это в понятные цифры, то арифметика следующая: возьмем 100 женщин с Her2 позитивным раком молочной железы с II или III стадией, после радикальной операции. Среди 100 женщин, которым будет проведена адъювантная химиотерапия Доксорубицин и Циклофосфан, затем Паклитаксел, у 33 из них проявятся метастазы рака молочной железы (и этих женщин вылечить уже не возможно, их лечение паллиативное) и 14 из них уже погибнет от этой формы рака. Если этим же женщинам, к той же самой терапии добавить Трастузумаб 1 год, то через 4 года метастазы разовьются только 15 из них, и погибнет от рака 8 женщин.
Среди 100 женщин, которым будет проведена адъювантная химиотерапия Доксорубицин и Циклофосфан, затем Паклитаксел, у 33 из них проявятся метастазы рака молочной железы (и этих женщин вылечить уже не возможно, их лечение паллиативное) и 14 из них уже погибнет от этой формы рака. Если этим же женщинам, к той же самой терапии добавить Трастузумаб 1 год, то через 4 года метастазы разовьются только 15 из них, и погибнет от рака 8 женщин.
Результаты исследований адъювантной терапии Her2 позитивного рака молочной железы, кардинально изменили действующую практику, в контексте профилактического лечения. Тогда (в мае 2005 года) мы стояли в восхищении с одной стороны, и удручены с другой стороны – потому что Трастузумаб был нам недоступен (он был в стране, но его стоимость была фактически запретительной для применения). Ситуацию удалось изменить, только на рубеже 2009-11 годов. С 2012 года, в Москве практически все пациентки с Her2 позитивным раком уже были обеспечены Трастузумабом. К этому времени, также удалось полностью обеспечить всех нуждающих пациенток Таксанами, благодаря выходу генериков Паклитаксела на наш рынок.
К этому времени, также удалось полностью обеспечить всех нуждающих пациенток Таксанами, благодаря выходу генериков Паклитаксела на наш рынок.
Следующим этапом использования таргетной терапии при Her2 позитивном РМЖ стало его применение в плане неоадъювантной терапии.
Неоадъювантная терапия – это терапия при локальных стадиях (I-III), которая проводится перед операцией. Основной целью данной терапии является оценить эффективность лекарственного лечения непосредственно на первичную опухоль и метастазы в локорегионарные лимфоузлы, постараться ее уменьшить. В некоторых случаях это позволит сделать органосохранную операцию. При агрессивных подтипах рака молочной железы (Her2 позитивном и Трижды-негативном) на неоадъювантной химиотерапии у значительной части пациенток удается добиться полного морфологического регресса опухоли (полный лечебный патоморфоз – рCR). Полный лечебный патоморфоз оцениваться по результатам гистологического исследования, после удаления первичной опухоли и подмышечных л/у. Если рCR достигнут, то это является суррогатом элиминации микрометастазов рака у подавляющего числа пациенток. У тех же, у кого не удалось добиться pCR – это значит, что имеется относительно высокая вероятность сохранения микрометастазов, из которых, через какое-то время, вырастут метастазы и уже болезнь нельзя будет вылечить (или почти нельзя вылечить).
Если рCR достигнут, то это является суррогатом элиминации микрометастазов рака у подавляющего числа пациенток. У тех же, у кого не удалось добиться pCR – это значит, что имеется относительно высокая вероятность сохранения микрометастазов, из которых, через какое-то время, вырастут метастазы и уже болезнь нельзя будет вылечить (или почти нельзя вылечить).
Отсутствие рCR – ведет к необходимости разработки стратегии послеоперационной терапии, которая снизит риск прогрессирования. Критерием pCR является отсутствие опухолевых клеток (за исключение возможного наличия клеток рака in situ) в области, где ранее находилась первичная опухоль и в подмышечных л/у (ypT0(or in situ)ypN0).
При Her2 позитивном подтипе, у больных с II и III стадией рака неоадъювантная терапия стала основным подходом к лечению за последние 10 лет.
Вариантами химиотерапии являются: антрациклин + таксан-содержащие схемы (например: 4 Доцетаксел 75/3 недели или 12 Паклитаксел 80/ежененедельно, затем 4 АС (FAC, FEC, EC) или Доцетаксел 75 + Карбоплатин AUC6 каждые 3 недели — 6 циклов). К этой терапии должен быть добавлен Трастузумаб (как минимум).
К этой терапии должен быть добавлен Трастузумаб (как минимум).
Достижение полного лечебного патоморфоза (pCR) выражается в повышении выживаемости без прогрессирования (EFS — event free survival или DFS disease free survival). Выживаемость без прогрессирования отражает тенденцию к повышению общей выживаемости (OS – overall survival).
Таким образом, основная цель неоадъювантной терапии – достижение pCR.
Вероятность достижения pCR у больных c Her2+, которые получают только химиотерапию – без Трастузумаба или иных вариантов таргетной терапии следующая (метаанализ Cortazar – это очень большой анализ клинических исследований в области неоадъювантной терапии РМЖ):
Гормонопозитивные (HR+) ~ 18,3% (15-21%)
Гормононегативные (HR-) ~ 30,2% (26-34%)
Вероятность достижения pCR у больных с Her2+, которые получают химиотерапию + Трастузумаб (Метаанализ Cortazar):
Гормонопозитивные (HR+) ~ 30,9% (26-36%)
Гормононегативные (HR-) ~ 50,3% (45–55%)
Таким образом, добавление Трастузумаба к стандартной неоадъювантной химиотерапии повышает вероятность достижения pCR в среднем на 60%.
Например: исследование HANNAH. В этом исследовании все пациентки с II и III стадиями Her2 позитивного рака молочной железы получили одинаковую химиотерапию и таргетную терапию (половина в/в Трастузумаб, половина подкожный Трастузумаб). По сути, у всех почти 600 пациенток была одинаковая терапия, разница была лишь в варианте введения таргетного препарата (внутривенно или подкожно). Схема лечения: 4Доцетаксел 75/кв.м. + Трастузумаб каждые 3 недели, затем 4 F(500)E(75)C(500) + Трастузумаб, каждые 3 недели, затем операция, затем Трастузумаб еще 10 введений +/- адъювантная лучевая терапия (если есть повышенный риск локального рецидива) + гормонотерапия (у гормонопозитивных (HR+)). Дизайн данного исследования стал эталонным для дальнейших исследований по неоадъювантной терапии Her2 позитивного РМЖ с препаратами биоаналогами Трастузумаба. 591 оцененная пациентка.
Из данных исследования HANNAH следует, что достижение полного лечебного патоморфоза pCR приводит 20% разнице в 3-х летней бессобытийной выживаемости (EFS) и приблизительно 27% разнице в 6-ти летней бессобытийной выживаемости (EFS).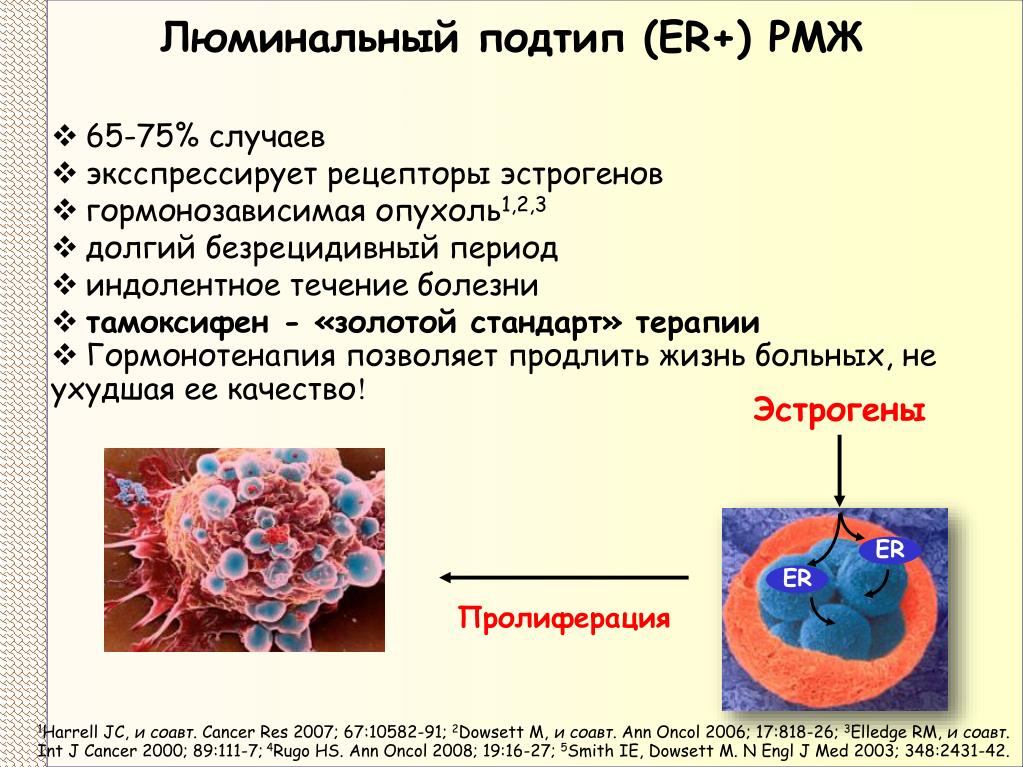 Имеется 10% разница в 6-ти летней общей выживаемости (OS): то есть достижение рCR снижает риск смерти у каждой десятой пациентки за 6 лет.
Имеется 10% разница в 6-ти летней общей выживаемости (OS): то есть достижение рCR снижает риск смерти у каждой десятой пациентки за 6 лет.
Пациентки с гормонозависимым раком (HR+), Her2 позитивным имеют меньшую вероятность достижения рCR почти в 2 раза: 23,5% против 45,3%.
Но, если pCR был достигнут — бессобытийная выживаемость лучше, чем у HR- на 9-10%. Если pCR не был достигнут, то при HR+ 3-х и 6-ти летняя выживаемость лучше, чем у HR- на 11 и 13% соответственно.
С 3-го до 6-го года риск прогрессирования у тех, у кого был достигнут pCR составляет 5-6% за 3 года (то есть около 2% в год).
С 3-го до 6-го года риск прогрессирования у тех, у кого не был достигнут рCR составляет 11-13% за 3 года (то есть около 4% в год).
Выводы:
- полностью подтверждается необходимость достижения pCR как суррогата длительного ответа.
- вероятность pCR выше у HR- негативных пациенток
- у пациенток с гормонопозитивным (HR+) и Her2 позитивным РМЖ, 3-х и 6-ти летняя EFS выше.
 Применение адъювантной гормонотерапии и меньшая биологическая агрессивность улучшает результаты.
Применение адъювантной гормонотерапии и меньшая биологическая агрессивность улучшает результаты.
Следующий этап: Двойная Her2 блокада (Трастузумаб + Пертузумаб) приводит еще большему повышению вероятности pCR и, как следствие, повышает вероятность бессобытийной выживаемости (EFS).
Исследование KRISTINE III Фазы.
В этом исследовании пациентки с II и III стадиями HER позитивного РМЖ были рандомизированы в 2 группы по 220 пациенток:
- 1 группа: ТСНР (Доцетаксел 75/кв.м + Карбоплатин AUC 6 + Трастузумаб (стандартная доза 6 мг/кг веса, 1-ое введение 8 мг/кг веса) + Пертузумаб (стандартная доза – 420 мг, 1-ое введение 840 мг), каждые 3 недели 6 циклов. Затем операция. Затем Трастузумаб + Пертузумаб до 1 года суммарно (12 циклов). Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования.
- 2 группа: 6 циклов TD-M1 (Трастузумаб-Эмтанзин) + Р (Пертузумаб).
 Затем операция, затем ещё 12 циклов Трастузумаб -Эмтанзин + Пертузумаб, каждые 3 недели. Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования. Аббревиатура группы (TD-M1 – P).
Затем операция, затем ещё 12 циклов Трастузумаб -Эмтанзин + Пертузумаб, каждые 3 недели. Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования. Аббревиатура группы (TD-M1 – P).
pCR в группе ТСНР был достигнут у 55% пациенток, HR- 73%, HR+ 44%.
pCR в группе T-DM1+P был достигнут у 44% пациенток, HR- 54%, HR+ 35%.
В группе T-DM1+P: 6% пациенток спрогрессировали до операции, в основном с HER2 гетерогенной опухолью, в группе ТСНР никто не прогрессировал на фоне неоадъювантной терапии (удивительный непосредственный результат).
Лучшая группа: ТСНР 221 пациентка
3 летняя EFS на всю группу 94%
3 летняя IDFS (этот показатель близок к EFS) в группе pCR 97,5%
3 летняя IDFS (близок к EFS) в группе non pCR 84%
Выживаемость:
Итак, варианты неоадъювантной терапии и их эффективность в 2-х таблицах:
Следует отметить, что те пациентки, которые получают адъювантную терапию с III стадией, и те, кто получают неоадъювантную терапию при III стадии – это не одинаковые пациентки. Пациентки, с III стадией, которых можно прооперировать радикально – это с клинически (с)T3N1 по местному статусу – «начальная» IIIА стадия. Эти пациентки 90-е и 2000-е годы рассматривались, как первично-операбильные по первичной опухоли. Тогда, как пациентки с III В и III С стадиями (сN2-3 или все варианты сТ4) всегда рассматривались как первично неоперабильные. Эти пациентки практически не включались в адъювантные исследования. Эти пациентки практически всегда начинали лечение с предоперационной химиотерапии (неоадъювантной).
Пациентки, с III стадией, которых можно прооперировать радикально – это с клинически (с)T3N1 по местному статусу – «начальная» IIIА стадия. Эти пациентки 90-е и 2000-е годы рассматривались, как первично-операбильные по первичной опухоли. Тогда, как пациентки с III В и III С стадиями (сN2-3 или все варианты сТ4) всегда рассматривались как первично неоперабильные. Эти пациентки практически не включались в адъювантные исследования. Эти пациентки практически всегда начинали лечение с предоперационной химиотерапии (неоадъювантной).
Соответственно в группе с неоадъювантной терапией всегда результаты несколько хуже, чем с адъювантной терапией, независимо от той терапии, которые пациентки получают. Даже если терапия одинаковая. Например, в 2-х американских исследованиях адъювантной терапии 3-х летняя выживаемость без прогрессирования (DFS) с Антрациклины + Таксаны + Трастузумабом – 87%. При использовании точно такой же терапии в неоадъюванте (Антрациклины + Таксаны + Трастузумаб) – 3-х летняя выживаемость без прогрессирования – 75% (на всю группу, независимо от pCR). Просто – это разные по распространенности опухоли.
Просто – это разные по распространенности опухоли.
Как быть с пациентками, у которых при применении неоадъювантной терапии не был достигнут полный лечебный патоморфоз (pCR). Прогноз данных пациенток существенно хуже – так как у многих из них сохраняются микрометастазы, которые в дальнейшем дадут макрометастазы.
Исследование KATНERINЕ:
В это исследование были включены, пациентки, которые получали неоадъювантную терапию с Трастузумабом, по поводу Her2 позитивного рака молочной железы с I-III стадиями, и у которых не был достигнут pCR на неоадъювантной фазе лечения. Пациентки были разделены на 2 группы: стандартная группа – Трастузумаб 14 циклов и экспериментальная Трастузумаб-Эмтанзин 14 циклов.
По результатам данного исследования, основной параметр данного исследования отражающий эффективность – invasive disease free survival (выживаемость без инвазивного прогрессирования – параметр близкий к event free survival — EFS) составил 88,3% к 3-м годам в группе Трастузумаб-Эмтанзин, в сравнении с 77% в группе Трастузумаба. В переводе на русский это означает, что в группе с Трастузумабом, у тех, у кого не имеется pCR к 3-м годам развиваются проблемы возврата рака молочной железы у 23% (почти ¼), тогда как при применении Трастузумаб-Эмтанзина возврат рака молочной железы в той или иной форме наблюдается только 11,7%. То есть в половину меньше!!!
В переводе на русский это означает, что в группе с Трастузумабом, у тех, у кого не имеется pCR к 3-м годам развиваются проблемы возврата рака молочной железы у 23% (почти ¼), тогда как при применении Трастузумаб-Эмтанзина возврат рака молочной железы в той или иной форме наблюдается только 11,7%. То есть в половину меньше!!!
В силу короткого периода наблюдения пока не имеется существенной разницы в общей выживаемости (OS), но это лишь вопрос времени. Явная тенденция к разнице в общей выживаемости имеется – нумерическое число смертей больше в контрольной группе.
Таким образом, на сегодня можно сделать вывод о том, что пациенткам, у которых не удалось достичь pCR на фоне неоадъювантной терапии, имеется четкая стратегия как улучшить результаты их лечения – фактически уполовинить риск прогрессирования в случае использования Трастузумаб-Эмтанзина. Но здесь надо не забывать, что у части пациенток опухоль гетерогенная и остаточная опухоль может оказаться Her2 негативной, поэтому необходимо проводить ретестирование остаточной опухоли и использовать Трастузумаб-Эмтанзин только у тех, у кого сохраняется Her2 позитивность. У тех, у кого после неоадъювантной химиотаргетной терапии выжил только Her2 негативный клон опухоли — Трастузумаб-Эмтанзин назначать не стоит. На мой взгляд может быть оставлен Трастузумаб, и проводится стандартный вариант адъювантного лечения, как у Her2 негативных пациенток – эта проблема должна решаться индивидуально.
У тех, у кого после неоадъювантной химиотаргетной терапии выжил только Her2 негативный клон опухоли — Трастузумаб-Эмтанзин назначать не стоит. На мой взгляд может быть оставлен Трастузумаб, и проводится стандартный вариант адъювантного лечения, как у Her2 негативных пациенток – эта проблема должна решаться индивидуально.
Теперь о том, какая наиболее эффективная адъювантная терапия у пациенток с совсем ранними опухолями Her2 позитивными. К совсем ранним относятся опухоли менее 2-х см, без метастазов в лимфатические узлы. Сюда также можно отнести пациенток с опухолями чуть больше 2-х см (но обязательно меньше 3см), которые оказались такого размера при патологической послеоперационной оценке рТ. То есть – это опухоли рТ1аbcN0М0 и рТ2(чуть больше 2см)N0М0. Независимо от гормононально-рецепторного статуса. Большинство подобных пациенток на первом этапе оперируются. Им выполняется или Радикальная Секторальная Резекция или Радикальная Мастэктомия. После операции подавляющее большинство из них нуждается в адъювантной терапии.
Оптимальный вариант адъювантной терапии – проведение химиотаргетной терапии по схеме: Паклитаксел 80 мг/кв.м еженедельно + Трастузумаб (еженедельно или 1 раз в 3 недели), затем адъювантная терапия Трастузумаб суммарно 1 год.
Основанием для данной терапии является исследование APT. В данное исследование – были включены 410 пациенток в основном с опухолями менее 2-х см (в исследование было включено только 36 пациенток с опухолями чуть более 2-х см, но менее 3 см) при отсутствии метастазов регионарные лимфоузлы (мог быть 1 микрометастаз в 1 лимфатический узел). Пациентки в данном исследовании получали только 1 вариант терапии: Паклитаксел 12 циклов еженедельно + Трастузумаб, затем Трастузумаб суммарно 1 год. Интересно, что более 2/3 пациенток – были с гормонопозитивными опухолями. Этот интересный факт говорит о том, что гормонопозитивные и Her2 позитивные опухоли растут медленнее и больше шансов их поймать в I ой стадии, тогда гормононегативные и Her2 позитивные опухоли более агрессивны и чаще всего диагностируются по II-III стадиях.
При 7-ми летнем наблюдении за пациентками получены следующие результаты: только 4-х пациенток развились отдаленные метастазы, у 5-ти пациенток локорегионарное прогрессирование (чаще всего можно повторно получить ремиссию болезни), у 6-ти женщин развился рак другой молочной железы (или с той же стороны если была выполнена секторальная резекция) и зафиксировано 8 смертей от других причин (естественную смерть никто еще не отменил). И это на 410 пациенток!!! Фантастический результат. Таким образом 7-ми летняя DFS (выживаемость без прогрессирования) составила в группе гормонопозитивных пациенток 94,6%, в группе гормононегативных 90,7%.
Вряд ли подобные отдаленные результаты возможно улучшить!!!
Теперь вернемся к метастатическому раку молочной железы. После регистрации Трастузумаба (в 1998 году) в качестве моноклонального антитела допонительного к химиотерапии при метастатическом раке молочной железы начались длительные исследования по оценке эффективности различных химиопрепаратов в комбинации с ним.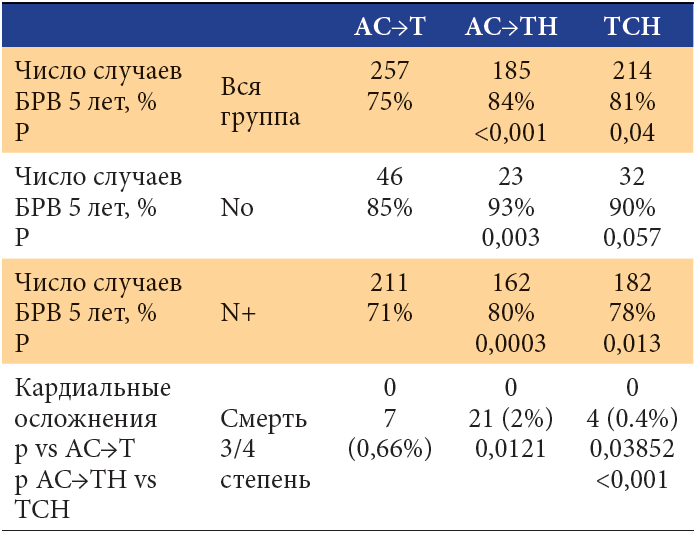 Эти исследования шли приблизительно 10 лет. К середине 2000 годов стало понятно, что оптимальным партнером к Трастузумабу являются Таксаны (Паклитаксел или Доцетаксел), а также Винорелбин, в качестве 1-ой линии терапии. Комбинация с Доксорубицином (или Доксорубицин + Циклофосфамид) также показала свою высокую эффективность, по оказалась кардиотоксичной и поэтому не применяется. Причем стало понятно, что один химиопрепарат (или Доцетаксел, или Паклитаксел, или Винорелбин) в комбинации с Трастузумабом не уступают по эффективности комбинированной химиотерапии (Например Доцетаксел + Карбоплатин), но по токсичности имеют преимущество. Поэтому комбинация Доцетаксел + Трастузумаб каждые 3 недели, или Паклитаксел (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) или Винорелбин (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) стали основными схемами 1-ой линии терапии. Обычно проводят 6-9 циклов химиотерапии (5-8 месяц) с Трастузумабом и затем отменяется химиотерапия и продолжается терапия Трастузумабом до прогрессирования или токсичности (которая встречается очень редко).
Эти исследования шли приблизительно 10 лет. К середине 2000 годов стало понятно, что оптимальным партнером к Трастузумабу являются Таксаны (Паклитаксел или Доцетаксел), а также Винорелбин, в качестве 1-ой линии терапии. Комбинация с Доксорубицином (или Доксорубицин + Циклофосфамид) также показала свою высокую эффективность, по оказалась кардиотоксичной и поэтому не применяется. Причем стало понятно, что один химиопрепарат (или Доцетаксел, или Паклитаксел, или Винорелбин) в комбинации с Трастузумабом не уступают по эффективности комбинированной химиотерапии (Например Доцетаксел + Карбоплатин), но по токсичности имеют преимущество. Поэтому комбинация Доцетаксел + Трастузумаб каждые 3 недели, или Паклитаксел (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) или Винорелбин (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) стали основными схемами 1-ой линии терапии. Обычно проводят 6-9 циклов химиотерапии (5-8 месяц) с Трастузумабом и затем отменяется химиотерапия и продолжается терапия Трастузумабом до прогрессирования или токсичности (которая встречается очень редко). При этом пациенткам с одновременно гормонозависимым вариантом опухоли может быть назначена «поддерживающая» гормонотерапия ингибитором ароматазы (Анастрозол или Летрозол), если женщина в менопаузе (если нет, то стоит перевести в менопаузу).
При этом пациенткам с одновременно гормонозависимым вариантом опухоли может быть назначена «поддерживающая» гормонотерапия ингибитором ароматазы (Анастрозол или Летрозол), если женщина в менопаузе (если нет, то стоит перевести в менопаузу).
Результатами данного подхода стало – около 1 года (12 мес) медиана времени до прогрессирования (mPFS) и средняя продолжительность жизни (mOS) в районе 3-х лет (36 месяцев). В эру до Трастузумаба медиана продолжительности жизни была в районе 1,5 лет. То есть Трастузумаб, дополнительно к химиотерапии добавил еще 1,5 года к средней продолжительности жизни. Надо сказать, что это произошло и потому, что пациентки при прогрессировании на Трастузумабе, продолжали получать Трастузумаб с другими химиопрепаратами, или комбинацию Капецитабин + Лапатиниб, или в дальнейшем Трастузумаб- Эмтанзин. Конечно, использование последующих эффективных линий терапии привело к увеличению средней продолжительности жизни. Но, в вместе с тем, влияние 1-ой линии терапии трудно переоценить, так как именно эффективная первая линия терапия дает максимальную прибавку.
На рубеже 2000 годов было начато исследование по оценке эффективности двойной блокады в сравнении с Трастузумабом с химиотерапией при метастатическом раке молочной железы. Ключевое исследование: Cleopatra. Вот дизайн исследования:
По сути, отличием в группах было – добавление Пертузумаба в одной из 2-х групп. Вторая группа получала плацебо. Никто – не пациент, не лечащий врач не знали: полностью «слепое» исследование, чтобы невозможно было фальсифицировать результаты.
В 2012 году исследование впервые было доложено, оно достигло своей Первичной Конечной Точки – увеличение Выживаемости без Прогрессирования (mPFS) с 12 месяцев в группе Доцетаксел + Трастузумаб + Плацебо до 18 месяцев в группе Доцетаксел + Трастузумаб + Пертузумаб. То есть, если пациентка получала тройную комбинацию в среднем прогрессирование наступало через 1,5 года от начала терапии. Это очень сильные данные по увеличению эффективности непосредственного лечения. Но самым главным результатом явилось увеличение Общей Выживаемости (mOS), которое было доложено в 2015 году. Медиана Общей Выживаемости увеличилась с 40,8 мес до 57,1 мес, в группе с Пертузумабом. То есть, среднее увеличение продолжительности жизни оказалось практически 17 месяцев благодаря добавлению Пертузумаба в 1-ой линии терапии. Интересно, что обычно в позитивных (в сторону экспериментальной терапии) клинических исследованиях 1-ой линии в онкологии мы имеем следующую картину: дельта (разница) mPFS практически всегда больше, чем дельта mOS. Это и понятно, так как последующие линии терапии, которые проводятся пациентам всегда разные и в том числе с применением того препарата, которого не было в 1-ой линии (в группе контроля) (так называемый crossover). То есть разница обычно сглаживается. Роль одного лекарства добавленного в 1-ой линии к стандартному набору всегда очень трудно разглядеть – много факторов наслаивается. Обычный пример: добавление Бевацизумаба к терапии метастатического рака молочной железы: препарат очевидно увеличивает эффективность 1 и 2 линии терапии (mPFS), но из-за «crossover» разница в mOS всегда оказывалась статистически недостоверной.
Но самым главным результатом явилось увеличение Общей Выживаемости (mOS), которое было доложено в 2015 году. Медиана Общей Выживаемости увеличилась с 40,8 мес до 57,1 мес, в группе с Пертузумабом. То есть, среднее увеличение продолжительности жизни оказалось практически 17 месяцев благодаря добавлению Пертузумаба в 1-ой линии терапии. Интересно, что обычно в позитивных (в сторону экспериментальной терапии) клинических исследованиях 1-ой линии в онкологии мы имеем следующую картину: дельта (разница) mPFS практически всегда больше, чем дельта mOS. Это и понятно, так как последующие линии терапии, которые проводятся пациентам всегда разные и в том числе с применением того препарата, которого не было в 1-ой линии (в группе контроля) (так называемый crossover). То есть разница обычно сглаживается. Роль одного лекарства добавленного в 1-ой линии к стандартному набору всегда очень трудно разглядеть – много факторов наслаивается. Обычный пример: добавление Бевацизумаба к терапии метастатического рака молочной железы: препарат очевидно увеличивает эффективность 1 и 2 линии терапии (mPFS), но из-за «crossover» разница в mOS всегда оказывалась статистически недостоверной. Из-за этого в США ограничили применение Бевацизумаба при метастатическом раке молочной железы и во многих рекомендациях Бевацизумаб при РМЖ отсутствует (лично я с этим категорически не согласен).
Из-за этого в США ограничили применение Бевацизумаба при метастатическом раке молочной железы и во многих рекомендациях Бевацизумаб при РМЖ отсутствует (лично я с этим категорически не согласен).
Увеличение mOS на большУю дельту в сравнении с mPFS мы сегодня наблюдаем только в препаратах иммунотерапевтической направленности. В этих исследованиях появляется группа пациентов, которые благодаря данной терапии не прогрессируют совсем и живут очень долго (фактически излечены) и их доля существенная чтобы поднять кривые выживаемости. В исследовании Cleopatra фактически мы получили такую же картину. Кривые выживаемости:
Что мы видим в этом исследовании, что в группе с Пертузумабом и Трастузумабом к 8 годам от начала исследования не прогрессировало практически 25% пациенток, тогда в как в группе с только Трастузумабом не прогрессировало к 8 годам 19% пациенток. Разница в 6% к 8 годам в Выживаемости без прогрессирования привела к тому, что 8-лет 37% женщин живы в комбинированной группе по сравнению с 23% в группе только Трастузумаба. Очень красноречивые данные. Кривые выживаемости очень похожи на кривые выживаемости, которые мы видим при применении иммунотерапии. Мы видим, что те пациентки, которые прожили 5 лет без прогрессирования от начала получения 1-ой линии терапии – фактически не прогрессируют в дальнейшем совсем. Причем похожая картина кривых Выживаемости без Прогрессирования наблюдается и в группе с только Трастузумабом, только в комбинированной группе таких пациенток существенно больше.
Очень красноречивые данные. Кривые выживаемости очень похожи на кривые выживаемости, которые мы видим при применении иммунотерапии. Мы видим, что те пациентки, которые прожили 5 лет без прогрессирования от начала получения 1-ой линии терапии – фактически не прогрессируют в дальнейшем совсем. Причем похожая картина кривых Выживаемости без Прогрессирования наблюдается и в группе с только Трастузумабом, только в комбинированной группе таких пациенток существенно больше.
Сегодня можно с уверенностью говорить, что метастатический Her2 позитивный рак молочной железы перестал относится к числу неизлечимых заболеваний. Получается, что применении Химиотерапии (на основе Таксанов) + Трастузумаб + Пертузумаб мы можем вылечить ¼ пациенток!!!
Причем наибольшие шансы у тех пациенток, у кого биологически опухоль была инфильтрирована лимфоцитами (так называемые TILs – tumor-infiltrating lymphocytes).
Это кривые выживаемости без прогрессирования в зависимости от терапии (Пертузумаб vs Плацебо) и в зависимости от наличия/отсутствия TILs:
Это кривые общей выживаемости в зависимости от терапии (Пертузумаб vs Плацебо) и в зависимости от наличия/отсутствия TILs:
На графиках отчетливо видно, что пациентки у которых имеются TILs в опухоли, через 3 года от начала лечения практически не прогрессируют – и таких пациенток около 40%, если им применялся Трастузумаб и Пертузумаб. Тогда как без Пертузумаба болезнь течет хуже, независимо от наличия/отсутствия TILs. При отсутствии TILs при добавлении Пертузумаба эффективность тоже выше, но не так ярко, как у больных с TILs.
Тогда как без Пертузумаба болезнь течет хуже, независимо от наличия/отсутствия TILs. При отсутствии TILs при добавлении Пертузумаба эффективность тоже выше, но не так ярко, как у больных с TILs.
Что такое TILs – это Т-лимфоциты, которые инфильтрируют опухоль (по какой-то причине), но не могут сами ее убить. Наличие TILs в опухоли является критерием благоприятного прогноза ответа на терапию (особенно при РМЖ). Вероятно, Т-лимфоциты помогают лекарственной терапии уничтожить опухоль. Имеющиеся данные, на мой взгляд, говорят нам о том, что Трастузумаб и, особенно, комбинация Трастузумаб + Пертузумаб являются Иммунотерапевтической комбинацией в первую очередь. И именно благодаря этому удается полностью уничтожить микрометастазы у большинства женщин, и макрометастазы — как минимум у 25%.
Таким образом, я считаю, что для Her2 – позитивного РМЖ должны использоваться следующие варианты лечения:
1. I стадия. Операция на первом этапе, затем применение адъювантной терапии: 12 циклов Паклитаксел 80 мг/кв. м 1 день + Трастузумаб 1,4,7,10 недели, затем каждые 3 недели 1 год суммарно. При гормонопозитивных вариантах, в адъюванте применение гормонотерапии ингибиторы ароматазы (Анастрозол или Летрозол), не менее 5 лет.
м 1 день + Трастузумаб 1,4,7,10 недели, затем каждые 3 недели 1 год суммарно. При гормонопозитивных вариантах, в адъюванте применение гормонотерапии ингибиторы ароматазы (Анастрозол или Летрозол), не менее 5 лет.
2. II и III стадии. Проведение неоадъювантной химиотаргетной терапии на первом этапе по схеме ТСНР: Доцетаксел 75 мг/кв.м + Карбоплатин AUC6 + Трастузумаб 6 мг/кг веса (1-ое введение 8 мг/кг веса) + Пертузумаб 420 мг (840 мг 1-ое введение) каждые 3 недели 6 циклов. Затем операция, затем адъювантная терапия Трастузумаб до 1 года. Адъювантная гормонотерапия у гормонопозитивных пациенток – ингибиторы ароматазы не менее 5 лет. В случае отсутствия полного лечебного патоморфоза (pCR), ретестирование опухоли и при сохранении Her2 3+ проведение адъювантной терапии препаратом Трастузумаб-Эмтанзин 14 циклов каждые 3 недели. При отсутствии Her2 позитивности в остаточной опухоли – альтернативная адъювантная терапия, которая должна рассматриваться индивидуально.
3. Бывают ситуации, когда хирурги шли на I стадию, но по результатам гистологического послеоперационного лечения, без проведения неоадъювантной химиотаргетной терапии, стадия заболевания оказалась существенно больше, например III стадия (по пораженным подмышечным лимфоузлам). В этом случае, должна быть использована такая схема адъювантной химиотаргетной терапии, которая была бы применена, в случае если бы знали о стадии заболевания сначала (до операции). Например, 6 курсов ТСНР затем Трастузумаб + Пертузумаб 1 год. Но таких пациенток должно становиться все меньше и меньше, так как на сегодня все имеющиеся методы обследований позволяют у большинства пациенток установить стадию заболевания до начала лечения. Данные ситуации должны решиться индивидуально квалифицированным онкологом.
Бывают ситуации, когда хирурги шли на I стадию, но по результатам гистологического послеоперационного лечения, без проведения неоадъювантной химиотаргетной терапии, стадия заболевания оказалась существенно больше, например III стадия (по пораженным подмышечным лимфоузлам). В этом случае, должна быть использована такая схема адъювантной химиотаргетной терапии, которая была бы применена, в случае если бы знали о стадии заболевания сначала (до операции). Например, 6 курсов ТСНР затем Трастузумаб + Пертузумаб 1 год. Но таких пациенток должно становиться все меньше и меньше, так как на сегодня все имеющиеся методы обследований позволяют у большинства пациенток установить стадию заболевания до начала лечения. Данные ситуации должны решиться индивидуально квалифицированным онкологом.
4. Метастатический рак молочной железы: Доцетаксел 75 мг/кв.м 1 раз в 3 недели или Паклитаксел 80 мг/кв.м еженедельно + Трастузумаб + Пертузумаб в стандартных дозах. 18-24 недели химиотерапии, затем поддерживающая терапия Трастузумаб + Пертузумаб +/- гормонотерапия у гормонопозитивных пациенток (Ингибиторы ароматазы), до прогрессирования. При этом прогрессирование не наступит у минимум 24%. Как долго продолжать лечение, у тех, кто не прогрессирует годы, пока не ясно. Определение TILs не обязательно, так как это носит не предиктивный, а прогностический характер. Но если эта информация будет у врача, то вероятно она не будет лишней.
При этом прогрессирование не наступит у минимум 24%. Как долго продолжать лечение, у тех, кто не прогрессирует годы, пока не ясно. Определение TILs не обязательно, так как это носит не предиктивный, а прогностический характер. Но если эта информация будет у врача, то вероятно она не будет лишней.
Заключение: Her2 позитивный рак молочной железы на сегодня является практически излечимым заболеванием. Мы можем вылечить подавляющее большинство пациенток с I-III стадиям ~ 90% при применении наиболее эффективных схем диагностики и лечения.
И мы можем вылечить (не побоюсь этого слова) 25% пациенток с метастатическим Her2 позитивным раком. Остальным мы можем значительно продлить жизнь, на многие годы, в том случае если будем использовать наиболее эффективные подходы к лечению.
Возможности использования анти-HER2 терапии у пациенток с люминальным HER2-негативным раком молочной железы
Новости онкологии
25.03.2013
Возможности использования анти-HER2 терапии у пациенток с люминальным HER2-негативным раком молочной железы
Появление анти-HER2 препаратов (трастузумаб, лапатиниб, пертузумаб, T-DM1) произвело революцию в лечении HER2-позитивного рака молочной железы (РМЖ). Благодаря их внедрению в клиническую практику пациентки с HER2-позитивными опухолями, ранее считавшиеся наиболее неблагоприятной группой, имеют выживаемость, превышающую таковую у больных с HER2-негативным заболеванием. Так, одно только добавление трастузумаба к химиотерапии таксанами позволило увеличить медиану выживаемости больных HER2-позитивным РМЖ на 7-9 месяцев, что оказалось сопоставимо с выигрышем, достигнутым от предшествующих 10 лет модификации режимов химиотерапии [4].
Благодаря их внедрению в клиническую практику пациентки с HER2-позитивными опухолями, ранее считавшиеся наиболее неблагоприятной группой, имеют выживаемость, превышающую таковую у больных с HER2-негативным заболеванием. Так, одно только добавление трастузумаба к химиотерапии таксанами позволило увеличить медиану выживаемости больных HER2-позитивным РМЖ на 7-9 месяцев, что оказалось сопоставимо с выигрышем, достигнутым от предшествующих 10 лет модификации режимов химиотерапии [4].
Однако гиперэкспрессия HER2 (и/или амплификация кодирующего его гена), позволяющая назначить анти-HER2 терапию, обнаруживается лишь в ~20% опухолей молочной железы. Для лечения остальных больных анти-HER2 терапия не используется, что обосновывалось результатами ранних клинических исследований, показавших отсутствие выигрыша от назначения трастузумаба при лечении больных распространенным РМЖ, не имеющим гиперэкспрессии HER2. Однако одновременно было известно и то, что определенный уровень экспрессии HER2 определяется практически у всех больных РМЖ.
Suthinee Ithimakin и соавт. в исследовании, опубликованном 26 февраля 2013 г. в журнале Cancer Research, показали, что целевая терапия, направленная против HER2-рецептора, возможно, будет эффективной и для части больных, опухоли которых в настоящее время расцениваются как HER2-негативные. Такая возможность появилась после обнаружения экспрессии HER2-рецептора на стволовых клетках РМЖ [1].
И это наблюдение имеет определенные «исторические корни», исходящие из результатов клинических исследований, вступивших в противоречие с установкой о том, что выигрывают от лечения трастузумабом лишь больные, опухоли которых имеют гиперэкспрессию/амплификацию HER2. Еще в 2008 году Paik S. и соавторы представили результаты пересмотра HER2-статуса пациенток, вошедших в адъювантное исследование NSABP B-31.
Выяснилось, что опухоли 174 из 1787 (9,7%) больных, изначально (на уровне локальной лаборатории) расцененные как HER2-позитивные, были признаны HER2-негативными и при иммуногистохимическом, и при FISH-анализе в центральной лаборатории. Неожиданным оказалось то, что эти пациентки, опухоли которых были признаны HER2-негативными по заключению центральной лаборатории, имели такой же по величине выигрыш от назначения трастузумаба, что и больные, в опухолях которых HER2-статус был оценен в ней как положительный [2].
Неожиданным оказалось то, что эти пациентки, опухоли которых были признаны HER2-негативными по заключению центральной лаборатории, имели такой же по величине выигрыш от назначения трастузумаба, что и больные, в опухолях которых HER2-статус был оценен в ней как положительный [2].
Похожие данные представили и Perez с соавт. [3]. Вопрос о том, какие молекулярные механизмы лежат в основе противоопухолевого эффекта трастузумаба при HER2-негативном РМЖ, до настоящего времени оставался открытым.
Suthinee Ithimakin и соавт., используя различные модели РМЖ (клеточные линии, ксенотрансплантаты у мышей, опухолевые ткани из первичных и метастатических очагов), показали, что HER2 может выборочно экспрессироваться на стволовых клетках эстроген-позитивного РМЖ, при этом сама опухоль (по существующим критериям) будет расцениваться как HER2-негативный люминальный подтип.
И несмотря на отсутствие экспрессии на большинстве клеток опухоли, в ее стволовых клетках экспрессия HER2 несет крайне важную функцию – участвует в процессе их самообновления.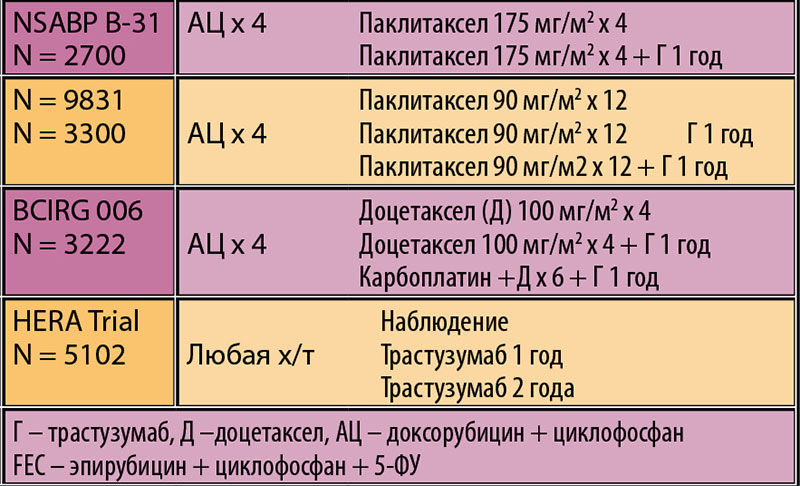 Кроме того, исследователи выяснили, что эффект трастузумаба в такой ситуации будет зависеть от времени начала лечения. Если лечение трастузумабом начинать на поздних этапах, когда у мышей пальпируется опухолевое образование (ситуация аналогичная ранним клиническим исследованиям, показавшим неэффективность препарата при HER2-негативном распространенном РМЖ), то эффективность терапии ограничивается только опухолями с наличием амплификации HER2.
Кроме того, исследователи выяснили, что эффект трастузумаба в такой ситуации будет зависеть от времени начала лечения. Если лечение трастузумабом начинать на поздних этапах, когда у мышей пальпируется опухолевое образование (ситуация аналогичная ранним клиническим исследованиям, показавшим неэффективность препарата при HER2-негативном распространенном РМЖ), то эффективность терапии ограничивается только опухолями с наличием амплификации HER2.
Если же трастузумаб вводился на ранних стадиях, сразу после прививки опухоли, то он значительно замедлял рост опухолевых клеток как с наличием амплификации HER2, так и опухолевых клеток люминального РМЖ без амплификации HER2. При этом на опухоли с эстроген- и HER2-негативным статусом трастузумаб сдерживающим эффектом не обладал.
Комбинация трастузумаба с цитостатическим агентом полностью предотвращала рост опухоли у мышей с люминальным РМЖ даже после прекращения лечения [1]. Таким образом, в доклинических исследованиях показана потенциальная роль трастузумаба при адъювантной терапии люминального эстроген-позитивного и HER2-негативного (по современным критериям) РМЖ.
Таким образом, в доклинических исследованиях показана потенциальная роль трастузумаба при адъювантной терапии люминального эстроген-позитивного и HER2-негативного (по современным критериям) РМЖ.
Таким образом, исследование Suthinee Ithimakin и соавт. показало, что мишенью для трастузумаба могут являться стволовые клетки РМЖ, экспрессирующие HER2 даже в случае, если в большинстве других клеток опухоли гиперэкспрессии HER2 не отмечается. Другим важным моментом этого исследования стало понимание того, что экспрессия HER2 регулируется опухолевым микроокружением. При культивировании клеточной линии MCF7 (люминального РМЖ) совместно с остебластами было отмечено повышение экспрессии HER2 на опухолевых клетках в отсутствии амплификации HER2.
Этот процесс регулируется RANK лигандом, который продуцируется остеобластами и, соединяясь с соответствующим рецептором на стволовых клетках РМЖ, может активировать сигнальный путь NF-каппаB, приводя к повышению экспрессии HER2.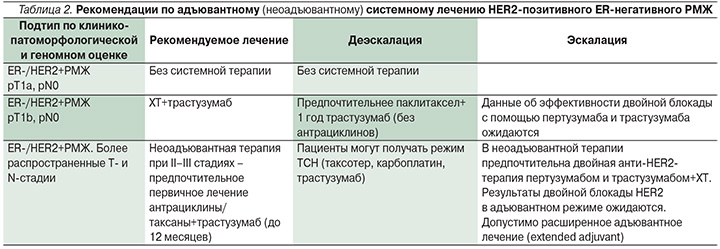 Как было показано ранее [5], микрометастазы в кости РМЖ содержат большое количество стволовых клеток РМЖ.
Как было показано ранее [5], микрометастазы в кости РМЖ содержат большое количество стволовых клеток РМЖ.
Поэтому другой целью для тразтузумаба становятся микрометастазы РМЖ, причем как с амплификацией HER2, так и без нее, что является дополнительным оправданием включения трастузумаба в адъювантные схемы лечения РМЖ. Для клинического подтверждения эффективности трастузумаба в терапии люминального HER2-негативного РМЖ необходимо проведение дополнительных рандомизированных клинических исследований.
Источники:
- Ithimakin S, Day KC, Malik F, Zen Q, Dawsey SJ, et al. HER2 Drives Luminal Breast Cancer Stem Cells in the Absence of HER2 Amplification: Implications for Efficacy of Adjuvant Trastuzumab. Cancer Res. 2013 Mar 1. 73(5): 1635-46.
- Paik S, Kim C, Wolmark N. HER2 status and benefit from adjuvant trastuzumab in breast cancer. N Engl J Med, 2008. 358: 1409-11.
- Perez EA, Reinholz MM, Hillman DW, Tenner KS, Schroeder MJ, Davidson NE, et al.
 HER2 and chromosome 17 effect on patient outcome in the N9831 adjuvant trastuzumab trial. J Clin Oncol, 2010. 28: 4307-15.
HER2 and chromosome 17 effect on patient outcome in the N9831 adjuvant trastuzumab trial. J Clin Oncol, 2010. 28: 4307-15. - Н.В. Жуков, С.А. Тюляндин. Целевая терапия в лечении солидных опухолей: практика противоречит теории. Биохимия, 2008. 73, 5, с.751-768.
- Reuben JM, Lee BN, Gao H, Cohen EN, Mego M, Giordano A, et al. Primary breast cancer patients with high risk clinicopathologic features have high percentages of bone marrow epithelial cells with ALDH activity and CD44CD24lo cancer stem cell phenotype. Eur J Cancer, 2011. 47: 1527-36.
Комплексное гистологическое и иммуногистохимическое исследование с определением рецепторного статуса рака молочной железы (PR, ER, ki67, Her2 neu)
Данное исследование позволяет обнаружить отклонения от нормального строения тканей, выявить наличие злокачественных клеток или их предшественников, определить гистологический вариант изменений, рецепторный статус опухоли и её пролиферативный потенциал. Полученные данные позволяют максимально эффективно подобрать лечение и позволяют дать прогноз заболевания.
Полученные данные позволяют максимально эффективно подобрать лечение и позволяют дать прогноз заболевания.
Состав исследования:
- Гистологическое исследование с определением рецепторного статуса рака молочной железы (PR, ER, ki67, Her2 neu)
- Иммуногистохимическая диагностика рецепторного статуса рака молочной железы (PR, ER, ki67, Her2 neu)
Синонимы русские
Определение рецепторного статуса рака молочной железы.
Метод исследования
Гистологический метод.
Какой биоматериал можно использовать для исследования?
Образец ткани (биоптат) опухолевого образования молочной железы.
Общая информация об исследовании
Гистологическое исследование любого органа позволяет оценить морфологию ткани, выявить характер роста опухоли, степень инвазии (прорастания), определить стадию, прогноз и тактику лечения заболевания. Но для эффективного лечения рака молочной железы (РМЖ) также важны результаты иммуногистохимического исследования, которое позволяет оценить рецепторный статус и пролиферативный потенциал опухолевых клеток. Особенно это актуально при карциноме молочной железы.
Особенно это актуально при карциноме молочной железы.
На поверхности клеток опухоли существуют специальные белки – рецепторы, стимуляция которых запускает рост новообразования. Различные комбинации этих рецепторов называются рецепторным статусом опухоли. Так, при раке молочной железы могут встречаться следующие рецепторы:
- Рецепторы к гормонам – эстрогенам и прогестерону (ER, PR).
Значительная часть опухолей молочной железы является гормонально-зависимыми, то есть их рост поддерживается и стимулируется эстрогенами и прогестероном. Как правило, они хорошо отвечают на терапию аналогами гормонов (тамоксифен), которые конкурентно связываются с соответствующими ядерными рецепторами, не вызывая активации внутриклеточных процессов. Таким образом, исследование продукции опухолью ER и PR позволяет определить ее чувствительность к этим препаратам. Но наличие данных рецепторов слабо влияет на прогноз заболевания. - Рецептор второго типа к человеческому эпидермальному фактору роста (human epidermal growth factor receptor 2 – HER2/neu).

Для клеток некоторых опухолей молочной железы может быть характерна повышенная выработка HER2/neu, который, соединяясь с естественным фактором роста, запускает в них процесс неконтролируемого деления. Наличие на клеточной мембране данного рецептора связано с плохим прогнозом (агрессивное течение, высокий риск рецидива) и позволяет предположить хороший терапевтический эффект от назначения антрациклиновой и таксановой химиотерапии и моноклональных антител к рецептору HER2 – трастузумаб (герцептин), лапатиниб (Tykerb), пертузумаб (Perjeta). При этом не рекомендуется гормональная терапия, так как такие опухоли резистентны к тамоксифену.
По данным исследований, общее число пациенток с HER2-положительным раком молочной железы составляет от 15 до 25% и некоторые раковые заболевания молочной железы, которые являются HER2-положительными, со временем могут стать HER2-негативными. Аналогично HER2-отрицательный рак молочной железы может стать HER2-положительным с течением времени. В случае рецидива заболевания рекомендуется повторное определение статуса HER2.
Кроме определения рецепторного статуса, важно знать пролиферативную активность – способность опухолевых клеток к неограниченному делению. Процесс деления сопровождается появлением в клетке определенных белков, один из которых – Ki-67. Это ядерный белок, который кодируется геном MK167 и экспрессируется только в пролиферирующих клетках, не выделяясь, если клетка в состоянии покоя. Это позволило использовать его как маркер пролиферативной активности опухоли. Определение уровня Ki-67 имеет важное прогностическое значение, так как наибольшей пролиферативной активностью обладают опухоли из наименее зрелых и дифференцированных клеток.
Существующие принципы Американского общества клинической онкологии не включают Ki-67 в список необходимых рутинных биологических маркеров. Однако появление новых генетических тестов подчеркивает роль пролиферативных генов, включая Ki-67, в качестве прогностических маркеров. Наиболее часто используемым методом определения Ki-67 является окрашивание антителом MIB-1. Но стандартизация патологической оценки Ki-67 еще не завершена.
Но стандартизация патологической оценки Ki-67 еще не завершена.
На основании статуса гормональных рецепторов, HER2/neu, Ki-67 выделяют четыре иммунофенотипа рака молочной железы:
– Люминальный тип A или ER+, PR+, HER2-.
При этом типе рака обнаруживаются гормональные рецепторы (ER и PR), но нет HER2/neu и/или низкий индекс Ki-67. Около 80% рака молочной железы составляют ER+, и около 65% из них также являются PR+. Около 15% таких опухолей имеют мутации гена р53, которые имеют плохой прогноз.
– Люминальный тип B или тройной положительный (ER+, PR+, HER2+ или с высоким индексом Ki-67).
Чаще всего такой тип встречается при внутрипротоковых опухолях молочной железы.
– HER2-положительный (ER-, PR-, HER2+).
К данному типу относится около 20% раковых образований молочной железы. Как правило, они очень агрессивны, быстро растут и чаще встречаются у женщин в более раннем возрасте, чем типы A и B.
– Базальноподобный или тройной отрицательный фенотип (трижды негативный) (ER-, PR-, HER2-).
К данному типу относится примерно 10-20% случаев рака молочной железы. Он называется базальноподобными, так как опухолевые клетки имеют признаки, сходные с базальными клетками, окружающими протоки молочных желез. Большинство случаев рака молочной железы, связанных с геном BRCA-1, являются трижды негативными, и более половины их них содержат мутации гена p53. Такой рак не реагирует на гормональную терапию или методы лечения, которые направлены на рецепторы HER2. В таких случаях используют комбинацию методов лечения (оперативное вмешательство, лучевая терапия и химиотерапия). Базальноподобные раковые опухоли, как правило, более агрессивны, с более низкой, пятилетней выживаемостью, с более высокой частотой рецидивов. Чаще такой тип РМЖ встречается до 40-50 лет и особенно характерен для женщин со смуглой и темной кожей.
При комплексном гистологическом и иммуногистохимическом исследовании в первую очередь осуществляется морфологический анализ тканей под световым микроскопом с использованием специальных гистологических красителей. После верификации патологического процесса, определения степени инвазии и наличия фоновых процессов проводится иммуногистохимическое исследование. Оно позволяет определить все указанные выше маркеры. Срезы тканей окрашиваются растворами антител, специфичными к одному из исследуемых маркеров и меченными флюоресцирующими метками. Если в опухолевой клетке присутствует искомый рецептор, антитела связываются с ним и с помощью микроскопа можно увидеть флюоресценцию (свечение). Это будет свидетельствовать о положительном результате теста. Также врач-морфолог сможет определить, где именно располагается окрашенный маркер.
После верификации патологического процесса, определения степени инвазии и наличия фоновых процессов проводится иммуногистохимическое исследование. Оно позволяет определить все указанные выше маркеры. Срезы тканей окрашиваются растворами антител, специфичными к одному из исследуемых маркеров и меченными флюоресцирующими метками. Если в опухолевой клетке присутствует искомый рецептор, антитела связываются с ним и с помощью микроскопа можно увидеть флюоресценцию (свечение). Это будет свидетельствовать о положительном результате теста. Также врач-морфолог сможет определить, где именно располагается окрашенный маркер.
Для чего используется исследование?
- Для дифференциальной диагностики патологического процесса;
- для определения вида и подвида опухоли, степени ее злокачественности и распространенности онкологического процесса;
- для определения рецепторного статуса опухоли и ее пролиферативного потенциала;
- для подбора адекватной терапии, в том числе с учетом полученных результатов иммуногистохимического анализа;
- для контроля эффективности лечения;
- для верификации метастазов;
- для динамического контроля и прогноза у лиц, находящихся под наблюдением.

Когда назначается исследование?
- При первичной верификации образования молочной железы, особенно если велика вероятность, что оно злокачественное;
- при рецидивах рака молочной железы;
- при верификации метастатических опухолей.
Что означают результаты?
При гистологическом исследовании даётся подробное макро- и микроскопическое описание исследуемого образца тканей, заключение с указанием гистологической формы рака, степени его злокачественности или дифференцировки, наличия или отсутствия инфильтрации в самом узле и по периферии, степени распространенности, наличия фоновых процессов.
В заключении иммуногистохимического анализа указывается гистологический вариант опухоли и один из четырех возможных иммунофенотипов.
При интерпретации результатов рецепторного статуса к стероидным гормонам (эстрогену и прогестерону) следует оценивать не только процент окрашенных антителами клеток, но и интенсивность окрашивания. Эти параметры учитываются в шкале Allred, где процент позитивных клеток оценивается от 0 до 5 баллов, а интенсивность окрашивания от 0 до 3. Сумма двух показателей является итоговым баллом, по которому определяется позитивность опухоли по рецепторному статусу: 0-2 негативная, 3-8 позитивная. Общий балл 3 по этой шкале соответствует 1-10% окрашенных клеток и является минимальным позитивным результатом, когда назначение гормональной терапии может быть эффективным.
Эти параметры учитываются в шкале Allred, где процент позитивных клеток оценивается от 0 до 5 баллов, а интенсивность окрашивания от 0 до 3. Сумма двух показателей является итоговым баллом, по которому определяется позитивность опухоли по рецепторному статусу: 0-2 негативная, 3-8 позитивная. Общий балл 3 по этой шкале соответствует 1-10% окрашенных клеток и является минимальным позитивным результатом, когда назначение гормональной терапии может быть эффективным.
Иногда рецепторный статус определяется исключительно по проценту клеток с окрашенными ядрами. В таких случаях NCCN рекомендует считать позитивными все опухоли, где есть более 1% флюоресцирующих клеток. Учитывая, что окрашивание ER/PR может быть и в нормальных эпителиальных клетках молочной железы, следует оценивать только инвазивные опухолевые клетки.
Любой положительный результат теста, будь то только ER, PR или оба, означает, что рак молочной железы считается «гормон-рецептор-положительным» и оправдано назначение гормональной терапии.
При интерпретации окраски на рецептор HER2/neu учитывают только окрашивание клеточной оболочки, которое оценивают по шкале от 0 до +3:
- результат 0 и +1 считается HER2-негативным;
- +2 – пограничный результат, нельзя достоверно судить о наличии на поверхности клеток рецептора HER2-neu, необходимо проведение FISH- или CISH-исследования; при недоступности этих исследований допускается повторное иммуногистохимическое исследование, но на другом образце опухолевой ткани;
- +3 – положительный результат – таргетная терапия анти-HER2-препаратами будет эффективна.
Оценка маркера индекса пролиферации определяется как процент клеток с ядерным окрашиванием от общего числа опухолевых клеток. Согласно классификации St. Gallen Consensus (2009), низким индексом пролиферативной активности считается уровень Ki-67 менее 15%, средним – 16-30%, а высоким – более 30%.
Существует несколько шкал оценки рецепторного статуса рака молочной железы, в лабораторном отчете должно быть указано, какая из них использовалась, а также дана описательная характеристика количества позитивных клеток, особенностей окрашивания клеточных структур и морфологических особенностей клеток.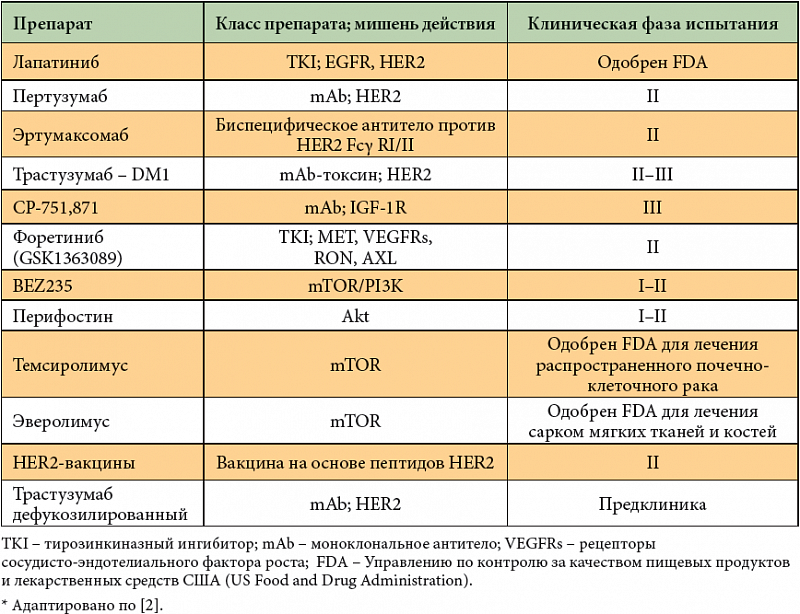
Кто назначает исследование?
Онколог, маммолог, онкогинеколог.
Также рекомендуется
- Иммуноцитохимическое исследование соскобов шейки матки с определением белка р16 и Ki 67 (включая жидкостную цитологию – окрашивание по Папаниколау)
- Комплексное гистологическое и иммуногистохимическое исследование с определением пролиферативной активности по экспрессии KI-67, а также риска прогрессирования дисплазии и развития рака шейки матки по экспрессии p16INK4a
- Комплексное гистологическое и иммуногистохимическое исследование с определением пролиферативной активности в растущих лейомиомах по экспрессии KI-67 и гладкомышечного актина
Литература
- Семиглазов В.Ф., Нургазиев К.Ш., Арзуманов А.С. Опухоли молочной железы (лечение и профилактика). – Алма-Ата, 2001. – 345 с.
- Георгиев Г.П. Молекулярно-генетические механизмы прогрессии опухолей // Соросовский образовательный журнал.
 – 2000. –Т. 6, № 11. – C. 1-7.
– 2000. –Т. 6, № 11. – C. 1-7. - Бохман Я.В. Руководство по онкогинекологии./Я.В. Бохман. – СПб. «Фолиант». 2002.
1, 2, 3, 4, что говорят врачи, какой реальный прогноз для пациента, виды раковых образований и способы лечения
Врачи сталкиваются с разными формами рака молочной железы, одни из которых менее опасны, а вторые с трудом поддаются лечению.
При трижды негативном раке молочной железы у пациентов после удаления опухоли средняя выживаемость всего полгода. Такие прогностические данные из-за очень быстрого прогрессирования патологии и метастазирования.
Чтобы диагностировать болезнь на ранней стадии, на сегодня огромное число ученых изобрели разные инструментальные и лабораторные методы.
Из всего количества женщин с онкологией молочной железы, только у десяти или пятнадцати процентов диагностируется трижды негативный рак. Эта болезнь является злокачественным новообразованием груди, при котором опухоль не имеет рецепторов к гормонам.
Из-за этого возникают некоторые трудности в подборе эффективных методов терапии негативной карциномы. При ТНРМЖ новообразование продуцирует ложные гормоны. Роль обманщиков женского организма выполняют псевдогормоны, которые иммунитет принимает за настоящие.
Это приводит к тому, что онкоклетки стремительно делятся, но гормональная терапия против них бессильна.
Причины
Ученым еще не удалось выяснить точные причины, по которым возникают злокачественные образования внутри груди.
Онкологи пришли к выводу, что развитие онкологии грудных желез начинается под воздействием:
- сильной гормональной перестройки, например, в период менопаузы;
- раннего начала менструаций;
- чрезмерной выработки яичниками женских гормонов;
- попадания множества гормонов в организм при гормонотерапии или приеме гормональных контрацептивов;
- искусственного прерывания беременности, особенно первой;
- отказа от грудного вскармливания;
- первых родов после тридцати пяти лет.
К негативной карциноме также могут привести наследственная предрасположенность, пагубные привычки, ожирение, травмы груди. Есть случаи, когда трипл-отрицательная карцинома начинала свое развитие в груди после облучения образований другой локализации.
Особенности патологии
ТНРМЖ или трипл-отрицательный рак это одна из разновидностей карциномы. Особенности трижды негативного рака в том, что он обладает быстрым прогрессированием, ранним метастазированием, частыми рецидивами, плохим прогнозом. Метастазирование ТНРМЖ происходит еще на начале развития патологии.
Новообразование при тройной негативной карциноме растет очень быстро из-за взаимодействия РП и ЭР рецепторов с половыми гормонами женщины, вырабатываемыми в яичниках.
При воссоединении псевдогормонов опухоли с женскими гормонами, возникает химическая реакция, превращающая настоящие гормоны в катализаторы роста.
У опухоли такого рака нет рецепторов к прогестерону, эстрогену, а также эпидермальному фактору роста HER 2/neu, поэтому онкопатология и имеет такое название. ТНРМЖ возникает только у женщин чаще в молодом возрасте.
Для лечения заболевания не назначается медикаментозная гормонотерапия, а хирургическое вмешательство часто противопоказано из-за поздней стадии на момент диагностирования. Чтобы улучшить будущий прогноз, нужно диагностировать болезнь на этапе формирования. Сделать это можно, только если знать симптоматику негативной карциномы.
Классификация
В онкологии классификация тройного негативного рака молочной железы проводится по гистологическому строению новообразования. Негативная карцинома может быть:
- Базальноподобной. Данная форма болезни диагностируется в семидесяти пяти процентах случаев. Такой рак легче поддается лечению и имеет более благоприятный прогноз.
- Небазальноподобной. Встречается в оставшихся двадцати процентах случаев и может быть апокриновой или плоскоклеточной карциномой. Течение болезни более агрессивное, а прогноз неблагоприятный.
По степени дифференцировки тканей трижды негативный рак груди не классифицируется, так как всегда новообразование трудно поддается дифференцировке.
Степени развития
При трипл-отрицательном раке груди стадия определяется с учетом размера опухоли, поражения лимфоузлов и наличия отдаленных метастазов.
Негативная карцинома имеет четыре стадии развития:
- Во время течения начальной стадии новообразования не вырастает больше трех сантиметров и не покидает пределы первичной локализации.
- При трижды негативном раке молочной железы 2 стадии образование в диаметре не больше пяти сантиметров и инфильтпует в подкожную клетчатку, но не метастазирует. При второй стадии размер новообразования может быть меньше, но тогда будет поражено до трех регионарных лимфоузлов.
- Третья стадия отличается диаметром образования больше, чем пять сантиметров. Онкоклетки на этом этапе проникают в мышцы, но не распространяются на лимфатическую систему.
- Диаметр узла на четвертой стадии может быть любым, но раковый процесс распространяется по телу кровотоком или лимфотоком. Метастазы обнаруживаются в дальних органах, костях, мозге.
Чем раньше будет поставлен диагноз, тем больше шансов у пациентки на положительный прогноз. Своевременно выявить наличие патологии молочной железы можно, если знать симптоматику болезни. Это дает шанс обратиться к врачу при первых признаках тройного негативного рака.
Симптомы
Общие признаки заболевания идентичны другим видам рака груди, но патология развивается намного быстрее. Первая стадия негативной карциномы практически не сопровождается симптоматикой.
Первое, что может обнаружить женщина – наличие в тканях железы опухоли плотной консистенции. Но для этого необходимо периодически проводить пальпацию груди. Вскоре новообразование начинает быстро расти и становиться болезненным.
Помимо этого, развивается такая клиническая картина:
- молочная железа начинает отекать;
- соски втягиваются внутрь;
- кожа над опухолью становится сухой и сморщенной;
- из сосков выделяется кровянистая или желтая жидкость;
- подмышечные лимфоузлы увеличиваются в размере.
По мере того как негативная карцинома прогрессирует, начинается распад опухоли, что приводит к интоксикации организма. Это сопровождается стойким повышением температуры тела, отвращением к еде, потерей массы тела и истощением (кахексией).
Методы диагностики
Начинается диагностика негативного рака со сбора анамнеза и выслушивания жалоб пациентки. После этого врач проводит осмотр и пальпацию молочных желез, а также ближайших лимфатических узлов. Во время осмотра оценивается симметричность грудей, состояние кожного покрова, наличие уплотнений и выделений из сосков. Далее больная направляется на лабораторные и инструментальные исследования.
При постановке диагноза важно провести дифференциальную диагностику, так как симптоматика болезни может быть схожа с признаками других патологий груди.
Виды анализов при негативном раке
Для постановки диагноза необходимо проведение лабораторных исследований. Анализы помогают определить наличие в крови определенных раковых маркеров – специфических белков, вырабатываемых опухолью.
При раке груди обнаруживаются онкомаркеры:
При наличии таких маркеров необходимо взять на цитологическое исследование жидкость, которая выделяется из сосков. Цитология направлена на выявление онкоклекок и папиллярных структур, если есть внутрипротоковые папилломы.
Забор биоматериала для цитологии проводится посредством проведения биопсии. Она может проводиться несколькими способами:
- тонкоигольным аспирационным – с помощью тонкой иглы;
- прицельным – специальными щипцами;
- хирургическим — скальпелем.
Чтобы провести комплексную оценку клеток новообразования, необходимо проведение тройного теста, включающего исследование на онкомаркеры, цитологический анализ и инструментальные методы.
Инструментальная диагностика
Без инструментальных методов поставить точный диагноз невозможно.
При подозрении на негативную карциному, необходимо проведение:
- маммографии – рентген молочных желез позволяет выявить опухоль, которая не ощущается во время прощупывания тканей груди;
- ультразвукового исследования, компьютерной, а также магнитно-резонансной томографии – методы позволяют узнать точные размеры и локализацию образования, состояние лимфоузлов, ближайших органов;
- изотопного сканирования – для выявления отдаленных метастазов.
При метастазировании в разные органы могут потребоваться другие инструментальные исследования – ангиография, рентген легких, сцинтиграфия и др.
Дифференциальная диагностика
При негативном раке клиническая картина совпадает с другими онкопатологиями грудной железы. Поэтому необходимо проведение ряда исследований, которые помогут отличить ТНРМЖ от других опухолей, а также болезней.
Дифференциальная диагностика может проводиться с:
- Внутрипротоковой папилломой. При такой болезни из соска выделяется большое количество жидкости. При постановке диагноза необходимо проведение цитологического исследования, а затем дуктографии.
- Кистой. При кистозном образовании пациентка ощущает боль во время пальпации. Для диагностики проводится ультразвуковое исследование.
- Субареолярным абсцессом. Патология локализуется под ареолой и сопровождается гиперемией кожных покровов.
- Фиброаденомой. Это доброкачественная подвижная опухоль с четкими контурами. Чтобы отличить негативный рак от фиброаденомы, нужно провести УЗИ с тонкоигольной аспирационной биопсией.
- Нарушениями гормонального баланса. Молочные железы в таком случае становятся плотными, дольчатыми или зернистыми. Симптоматика усиливается перед наступлением менструации.
Только после дифференциальной диагностики и подтверждения диагноза негативного рака, врач может прописать необходимое лечение.
Способы лечения
Для лечения трижды негативного рака молочной железы не подходит гормонотерапия, как в случае с другими типами онкопатологий груди. В этом случае отсутствуют рецепторы к гормонам, поэтому онкопатология лечится тяжелее.
Наиболее часто патология выявляется на запущенном этапе, что также осложняет лечение. Нужна комплексная терапия, состоящая из операции, химиотерапии, гомеопатии.
Для купирования осложнений химиотерапии может применяться лечение народными методами.
Схемы терапии
Трижды негативная карцинома является очень неблагоприятной в плане прогноза. Болезнь очень агрессивна, она рано метастазирует, поэтому лечение нужно начинать сразу же после постановки диагноза.
Схемы терапии всегда выстраиваются индивидуально, с учетом возраста больной, стадии патологии, имеющихся осложнений.
Монохимиотерапия при отрицательной онкологии груди не эффективна, поэтому назначается целый комплекс химических препаратов.
Химиотерапия при ТНРМЖ
При трипл-отрицательной карциноме отмечается не очень хорошая реакция раковых образований к химическим препаратам, поэтому лечение подобрать очень тяжело. Химиотерапия при трижды негативном раке молочной железы назначается на основании проведенных исследований. Таргетные препараты, направленные на борьбу только с онкоклетками, при ТНРМЖ не эффективны, что ухудшает прогноз.
Химиопрепараты назначаются пациенткам циклами, используя лекарства группы таксанов. Только у небольшого количества женщин может наступить выздоровление лишь при помощи химиотерапии, но с условием диагностирования болезни на раннем этапе.
Хирургическое лечение
Хирургическое вмешательство позволяет сократить риск рецидива и продлить жизнь больной. Для борьбы с опухолью может понадобиться проведение:
- Лампэктомии. Это органосохраняющая операция, при которой проводится удаление опухоли, а также окружающих ее тканей либо части железы.
- Квадрантэктомии. Удаление четверти груди, в которой локализовано новообразование.
- Модифицированной радикальной мастэктомии. Операция проводится при распространении онкопроцесса за пределы железы. Операция чревата удалением груди вместе с регионарными лимфоузлами.
- Сегментэктомии. Во время оперативного вмешательства ампутируется сегмент молочной железы.
- Радикальной мастэктомии. Врач вырезает новообразование совместно с лимфоузлами, молочной железой и грудными мышцами.
После любого хирургического вмешательства проводится лучевая терапия, что сокращает риск рецидива.
Гомеопатия
Гомеопатические препараты назначаются пациентам только в качестве дополнительного лечения. В состав средств входят травы, оказывающие негативное влияние на онкоклетки. Гомеопатия помогает справиться с болью, позволяет уменьшить размер опухоли. Такая терапия не может заменить основное лечение, назначенное врачом, так как не убивает рак полностью.
Народное лечение
Лечение методами народной медицины является дополнительным, так как оно не способно удалить опухоль.
Для этого может использоваться:
- Гриб чага.
- Овес.
- Прополис.
- Чеснок, лук.
- Кора дуба.
Также могут применяться ядовитые травы, однако они негативно действуют не только на новообразование, но и на здоровые клетки.
Любая терапия народными средствами должна быть согласовано с лечащим врачом.
Осложнения
Эта разновидность рака это одна из самых опасных патологий груди. Основное осложнение на ранних этапах – метастазирование в разные органы. Последняя стадия осложняется кахексией (очень сильное истощение организма).
В зависимости от локализации метастатических опухолей, может возникать асцит, плеврит, легочное кровотечение. Возможны грубые расстройства центральной нервной системы, почечная недостаточность, слепота. К осложнениям приводит терапия онкологии химическими препаратами, а также облучением.
Прогноз и профилактика
Чаще при трижды негативном раке молочной железы прогноз неблагоприятный. Прогностические данные зависят от того, насколько эффективны препараты, которые были назначены врачом во время формирования курса лечения. Также на прогноз влияет стадия онкопатологии на момент диагностирования, возраст больной, наличие осложнений.
В качестве профилактики необходимо периодически обследоваться у маммолога, а также самостоятельно проводить пальпацию грудей.
Источник: https://rakuhuk.ru/vidy/trizhdy-negativnyj-rak-molochnoj-zhelezy
Сколько живут с раком молочной железы 1-4 степени?
К понятию рака молочной железы относится целый ряд различных злокачественных образований. Тип рака напрямую зависит от размеров первостепенного повреждения, места его расположения, прогресса в росте опухоли, наличия метастазов. В зависимости от всех этих факторов производится постановка способов лечения, а также, ставится прогноз выживаемости пациента.
Выживаемость в зависимости от степени развития карциномы
Эквивалентом эффективного излечения от рака молочной железы принято считать продолжительность жизни, равную 5 годам. Общее число, сколько осталось выживших после постановки такого диагноза в течение 5 лет, составляет приблизительно половину пациентов, при условии применения лечебных мер. В случае отсутствия должного лечения, коэффициент составляет не более 15 %.
Также, существенно влияет на выживаемость, значительно уменьшая ее, фактор присутствия агрессивного типа онкологического образования, определяющегося маркером Her2neu, который выявляется у 20-30% пациентов.
Прогноз на 5 лет
Выживаемость при раке молочной железы у пациентов также зависит от стадии развития опухоли, которых выделяется 4:
- Первая определяется возникновением опухолей не более 2 см в диаметре. Воспалительные процессы в лимфатических узлах полностью отсутствуют. Выживаемость, по прогнозу, составляет 70-95 %.
- Вторая условно разделяется на 2а и 2b. При 2а степени прогресса заболевания, наблюдается воспаление до 5 лимфатических узлов в зоне подмышек, при этом сама опухоль имеет размер, не превышающий 2 см в диаметре. Степень 2b характеризуется значительным ростом онкологического образования, вплоть до 5 см, с отсутствующими при этом поражениями узлов сердечно-сосудистой системы. Прогноз на 5 лет составляет 50-80%.
- Третья выражается разрастаниями опухолевого образования более 5 см, с сопутствующими поражениями лимфатических узлов и возможными метастазами в область грудной клетки и кости. Выживаемость при такой степени тяжести недуга составляет 10-50%.
- Четвертая сопровождается значительным разрастанием опухоли до произвольных размеров. Метастазы проникают в большое количество органов и систем тела, таких как: кости, желудок, печень, кожа, легкие. Степень выживаемости в такой запущенной стадии не превышает 10%.
Прогноз на 10 лет
Если учитывать процент выживаемости в течение 10 лет, после обнаружения злокачественного образования, то, в зависимости от стадии тяжести заболевания, он составляет:
- 1-я стадия – 60-80%;
- 2-я составляет 40-60%;
- 3-я стадия – 0-30%;
- 4-я – 0-5%.
Большое значение в определении прогноза наряду со степенью тяжести имеет наличие и количество метастазов в лимфатических узлах и костях. Так, при отсутствии проникновений в здоровые части организма, прогноз на 10 лет составляет 75%. При имеющихся метастазах, выживаемость составляет лишь 25%.
При проникновениях в менее чем 4 лимфатических узла, прогноз составляет 35%. Но, в случае прогресса рака в ткани четырех и более сосудов или костей, выживаемость не больше 15% от всех случаев.
Операция
Операции по удалению опухолевого образования, части груди или полного удаления молочных желез производят лишь до 4 стадии и при наличии неглубоких метастазов, не затронувших кости и жизненно важные органы.
Прогнозы при отсутствии метастазов после операции, составляют до 96%.
В случае значительного количества проникновений рака вне зоны груди в область костей и иных жизненно важных систем, сколько процентов составляет прогноз на жизнь, лишь после тщательного анализа общего состояния пациента может установить только врач.
Рецидив
Спустя некоторый промежуток времени, составляющий от пары месяцев до нескольких годов, симптомы онкологических образований могут появляться вновь. Рецидивы, чаще всего происходят после предшествующего, низкодифференцируемого типа рака.
Нередко рецидивы случаются и после инвазивного протокового рака, поскольку он характерен значительными проявлениями метастазов в области подмышек. Также, появление рецидивов довольно часто происходит после удаления опухолей больших размеров.
Процент выживаемости в таких ситуациях напрямую зависит от терапевтических механизмов действия и по длительности составляет 1-2 года.
Место появления патологии
Локализация злокачественного образования в значительной мере влияет на результаты течения недуга, потому как от данного фактора напрямую зависит интенсивность развития метастазов и направление их внедрения в здоровые клетки и кости.
Наибольший процент выживаемости содержится при появлениях опухолей в зоне снаружи груди, поскольку так их возникновение легче заметить уже изначально. Помимо этого, такое месторасположение позволяет произвести операции по удалению аномалии с большей точностью и эффективностью.
В случае возникновения патологий в иных участках груди велика вероятность появления метастазов. Потому процент выживаемости в этой ситуации, даже в результате весьма успешной операции, значительно падает.
Существует категория пациентов, не приемлющих традиционные методы терапии и ищущие лекарства в народных способах. В таких ситуациях, без должного лечения, положительный прогноз на 5 лет не превышает 15%.
Виды раковых образований
Одним из основных обстоятельств, характеризующих злокачественное образование в груди, является способность опухоли разрастаться и проникать в другие ткани и органы. Исходя из этого, врачи выделяют несколько типов онкологии груди:
- инфильтративный рак протоков,
- инвазивный дольковый рак,
- воспалительный тип, именуемый низкодифференцируемым,
- гормонозависимый,
- трижды негативный,
- люминальный.
Определение типа рака молочной железы является весьма важным, поскольку от точной постановки диагноза зависит выбор наиболее эффективных терапевтических мероприятий.
Протоковый рак
Инфильтративный рак протоков — это самая частая форма злокачественных образований в груди, которая появляется в 78 % заболеваний. На маммографических снимках, инфильтрирующий протоковый рак, имеет форму звезды или круглого пятна с резкими границами.
В случае появления опухоли звездообразного типа, заболевание характеризуется значительной степенью тяжести. Прогноз выживаемости напрямую зависит от степени тяжести болезни, на которой удалось установить диагноз. Так, на 1 стадии он составляет 91,8%, при 2 – 64,5%, на 3 стадии – 42%.
В случае крайней запущенности, лишь с помощью упорного лечения можно добиться результата в 28%.
Дольковый рак
Инвазивный дольковый рак появляется в виде уплотнения небольшой толщины в верхней зоне внутреннего участка груди.
Образования нередко чувствительны к женским гормонам, потому гормонотерапия в большинстве случаев долькового рака, при не запущенных формах болезни весьма эффективна. Однако, учитывая факт трудностей диагностирования недуга в ранних формах, хороший прогноз дается не часто.
Основными проблемами ранней диагностики долькового рака можно назвать труднодоступное место локализации опухоли, а также весьма нерегулярные профилактические меры.
При начальных стадиях инвазивного долькового рака, он составляет 54%, Поздние стадии онкологии дольковой карциномы с наличием глубоких метастазов в кости, кожу, легкие, печень, позволяют прогнозировать длительность жизни до 3 лет, после обнаружения недуга в 2-12% случаев.
Воспалительный вид
По многим факторам, низкодифференцированный рак идентичен с маститом. Однако является достаточно агрессивной формой карциномы. Болезнь в начальных степенях образования, после оперативного назначения лечения дает положительный прогноз в 45% случаев низкодифференцированного рака молочной железы.
Гормонозависимый
Поскольку этот тип онкологического заболевания сопровождается достаточно размытой симптоматикой в начале появления образований, обнаруживается он чаще всего на 2-3 стадии. Прогноз при длительном курсе лечения гормонами составляет 27%. В случае рецидива прогноз на выживание поставить невозможно.
Трижды негативный
Тройной негативный рак груди, при должном лечении на начальной стадии, позволяет получить прогноз в 77% выживаемости. При 2 степени тяжести заболевания, удается достичь 42%.
А в случае запущенных форм трижды негативного рака, максимальный прогноз достигает 9%. Однако, трижды негативный рак груди, представляет собой весьма агрессивное образование.
По причине высокой скорости развития трижды негативной карценомы, обнаружить ее удается, в большинстве случаев, лишь на поздних стадиях.
Однако, на данный момент, известны некоторые подтипы тройной отрицательной карценомы. Врачи еще не сумели собрать достаточно данных исследований для выделения этих видов тройного негативного рака в отдельные группы.
Однако, уже известно, что у значительного процента исследуемых, трижды отрицательный рак, имеет форму не агрессивного характера.
Этот факт способен повысить показатели выживаемости при наличии образований трижды отрицательного типа.
Люминальный
Люминальный тип рака молочной железы условно разделяется на 2 подвида: А и В. Тип А имеет высокий процент выживания благодаря чувствительности к гормонотерапии.
На начальных стадиях прогноз при люминальном раке составляет 94%. Тип В, являясь весьма агрессивной формой недуга, весьма трудно поддается лечению и склонен к рецидивам в большинстве случаев.
Прогноз при данном виде люминального рака составляет не выше 46%.
Существует немало видов раковых заболеваний, поражающих молочные железы и весьма часто продуцирующие метастазы в жизненно важные органы и кости. Дать универсальный точный прогноз развития недуга и степени выживания после него весьма трудно.
Успех лечения любого из онкологических образований, будь то дольковый, трижды отрицательный или иной возможный рак, во многом зависит от предпринятых профилактических мер. Важно оперативное обращения за медицинской помощью, выбор эффективного метода терапии, а также общее состояние здоровья и психологический настрой.
Необходимо помнить, что даже самый небольшой процент успеха, это шанс на жизнь.
Источник: http://GormonOff.com/zabolevanija/onkologiya/skolko-zhivut-s-rakom-molochnoj-zhelezy-1-4-stepeni
Негативный рак молочной железы: как с ним бороться?
Раковым новообразованиям грудной железы принадлежит первое место в структуре женской онкопатологии.
Врачи привыкли связывать это с тем, кто во всем мире ухудшилась экологическая обстановка, да и к тому же, в последние десятилетия женщины слишком часто принимают оральные контрацептивы.
Принято считать, что риск возникновения и последующего развития опухоли увеличивается во много раз из-за того, что женщины долгое время принимают гормональные контрацептивы.
Трижды негативный рак молочной железы вполне вероятно выявить в 1/6-1/4 всех видов новообразований органа. Причем, выявление такой разновидности опухоли стало вполне возможным после того, как в клиническую практику онкологов было внедрено иммуногистохимическое исследование.
Что это такое?
Трижды негативный рак молочной железы (ТНРМЖ) представляет собой отдельный подтип онкозаболевания груди, характеризующийся особо агрессивной формой протекания. Цифры неутешительны: каждый год из всего количества женщин, которые страдают от рака молочной железы, 10-15 процентов страдают именно от ТНРМЖ.
Часто используемый термин «тройной негативный» был поначалу использован в обиходе онкологов. Он свидетельствует о том, что злокачественная опухоль, которая находится внутри груди пациентки, сама может выделить в организм три белковых соединения:
- эстроген;
- гормон эпидермального роста;
- прогестерон.
В медицине такие белки маркируют как рецепторы. Он имеют такие сокращения: ЭР, НЕR2 и ПР.
После того, как пациентка сдала все необходимые анализы, материал, который был получен в результате процедуры биопсии, первоначально исследуется для того, чтобы найти в тканях образовавшейся опухоли именно эти белки.
От того, каков будет результат исследования, и будет зависеть дальнейшее лечение и перечень медицинских препаратов, которые будут использованы при этом, потому что рецепторы встроены во внутрь раковых клеток.
Смотрим в корень проблемы
Злокачественное образование в груди
Тройной негативный рак молочной железы является одной из разновидностей злокачественного образования, и он довольно агрессивен (об этом говорилось чуть выше). Если рассматривать его со стороны иммуногистохимического исследования, то в этом новообразовании нет мишеней или рецепторных образований к гормонам — эстрогену и прогестерону. Не чувствительна эта опухоль и к HER-2/NEU.
Поскольку чувствительность атипических раковых тканей в этом случае отсутствует, то лечение трижды негативного рака молочной железы может проходить с огромными проблемами.
Это связано с одним простым условием: если нет рецепторных образований, гормонотерапия помочь не сможет.
Если трижды негативный рак молочной железы можно охарактеризовать отсутствием рецепторов HER-2/NEU, то применять герцептин (а это основа эффективной и современной терапии, необходимой в этом случае) в лечении невозможно.
Рак будет развиваться очень быстро, если у новообразования фенотип трижды негативного. Намного умаляется в этом случае и значение скрининга, ведь во время, проходящее от одного профилактического осмотра до другого, опухоль может разрастаться.
Немного подробнее о серьезном заболевании
Тройной негативный рак молочной железы доктора называют еще карциномой. Такой рак разрастается довольно быстро из-за взаимодействия рецепторов ЭР и РП с половыми гормонами женщины – эстрогеном и прогестероном. А последнее способен выработать женский организм при помощи яичников.
В тот момент, когда половые гормоны женщины вступают в соединение с псевдогормональными рецепторами ЭР и РП (их вырабатывает раковая опухоль), между ними возникает настоящее химическое взаимодействие. Итогом является то, что настоящие гормоны становятся катализаторами онкологического заболевания, запуская возможность того, что раковые клеточки начинают активно делиться.
Именно из-за возникновения такой ситуации процесс роста ненужного образования внутри женской груди увеличивается в разы.
Роль обманщиков женского организма выполняют псевдогормоны, которые вырабатывает опухоль. Это рецепторы эстрогена и прогестерона. К сожалению, иммунная система не научилась пока распознавать их вредноносность, вследствие этого и начинается химический контакт с реальными половыми гормонами.
Рецептор HER2 представляет собой ложный гормон роста. Если его слишком много в женском организме, что запускается процесс хаотичного деления клеток рака.
Зная всю эту информацию, можно сделать неутешительный вывод: злокачественная опухоль вполне может обеспечить себя значительным ростом и развитием.
И чем лучше яичники будут вырабатывать эстроген и прогестерон, тем быстрее будут расти злокачественные новообразования внутри женской груди.
На пути к выздоровлению
Лечение этой страшной болезни может проходить тремя путями:
- хирургическим;
- химиотерапией;
- лучевой терапией.
Рассмотрим каждое из них подробнее.
- Хирургическое. Как правило, лечение такого рака начинают с удаления опухоли хирургическим путем. Это делают люмпэктомией (то есть, удалением опухоли и окружающих тканей) либо мастэктомией (частичным либо полным удалением груди).
- Лучевая терапия. После того, как трижды негативный рак молочной железы подвергся хирургическому вмешательству, в значительном количестве случаев дальше лечение продолжается облучением ложа опухоли и региональных путей лимфооттока, дабы уничтожить оставшиеся раковые клетки.
- Химиотерапия. Поскольку в этой опухоли нет рецепторов ЭР, РП и HER2, то применять гормональное лечение и таргетную терапию, которая направлена на блокирование рецептора HER2, при таком заболевании нецелесообразно. Поэтому единственным вариантом лечения в этой ситуации является именно химиотерапия. Причем, системная. Это означает, что когда препарат, который вводят в организм, попадает в кровоток, он проходит по всем частям тела и уничтожает раковые клетки, которые способны распространиться за пределы молочной железы.
Химиотерапия этого рака, равно как и при остальных видах онкологии молочной железы, дается пациенткам циклами. То есть, период, во время которого вводят в организм препараты, чередуется с периодом, когда в их применении наступает перерыв. В это время показатели крови успевают восстановиться.
Лечение трижды негативного рака молочной железы при помощи химиотерапии, как правило, продолжается от нескольких месяцев до года. Срок будет зависеть от принимаемых пациенткой препаратов и от того, как он их переносит в процессе лечения.
С рассматриваемым видом рака можно связать и «ренессанс» цисплатины. Это препарат, который практически повсеместно применялся в восьмидесятых прошлого века для спасения от этого заболевания. В последние три десятилетия его применение ограничили при лечении пациенток со страшным диагнозом — рак молочной железы (или как его называют иногда обыватели — грудной рак). Это произошло из-за того, что токсичность препараты была высока, а высокая эффективность наблюдалась только у небольшого количества пациенток.
И все же, со временем, были собраны весомые доказательства того, что использование цисплатины при ТН опухолях более чем эффективно. Поэтому препарат был возвращен в арсенал других лекарств, которые применяют при излечении от рака молочной железы.
Трижды негативный рак молочной железы: прогноз на жизнь
В общем и целом прогноз на полное излечение при таком сложном заболевании является намного более положительным, нежели при обычной опухоли, которая не может быть устойчивой к гормональной терапии. Здесь надо обращать внимание на ряд факторов:
- выявить опухоль вовремя, на ранней стадии;
- сдать анализы на предмет наличия рецепторов ЭР, ПР, HER2;
- насколько быстро женщине удалили опухоль хирургическим путем;
- возраст пациентки и жизненные ресурсы ее организма;
- насколько эффективны препараты, которые были назначены врачом во время формирования курса лечения.
Для того, чтобы прогноз на полное излечение был как можно более благоприятным, лечение ТНРМЖ должно проходить так же быстро и агрессивно, каким является и само заболевание.
Такой подтип рака груди чаще всего встречается у женщин, которые перешагнули тридцатилетний рубеж. Прогноз внушает некоторый оптимизм: в 1/3 случаев пациентки сумели победить болезнь.
Здесь речь идет о тех женщинах, у которых новообразование выявили на ранней стадии.
На сегодня огромное количество лабораторий мира, главной целью которых является серьезное сражение с онкозаболеваниями, занимаются четким изучением природы возникновения трижды негативного рака груди.
У ученых пока нет ответа на вопрос, почему же внутри абсолютно здоровой молочной железы начинается внезапное и очень быстрое перерождение клеток, которые позже преобразовываются в опухоль способную вырабатывать псевдогормоны, полностью повторяющие натуральные половые гормоны женщины. Сейчас уже создали несколько экспериментальных препаратов, которые могут подавить выработку рецепторов опухолью.
Источник: https://oonkologii.ru/negativnyj-rak-molochnoj-zhelezy/
Трижды негативный рак молочной железы: что такое, 2 стадия, прогноз жизни, кто вылечился
Трижды негативный рак (ТНРМЖ) — наиболее агрессивная форма неоплазии груди злокачественного характера. При заболевании отсутствуют рецепторы раковых клеток к прогестерону, эстрогенам и росту эпидермиса. Развитие болезни сопровождается формирование новообразования плотной структуры, изменениями кожи, специфическими выделениями из сосков, деформированием груди.
Для диагностики болезни применяются различные лабораторные и инструментальные методы. В лечении предпочтение отдается приему цитостатиков, проведению мастэктомии и лучевой терапии.
Описание
Тройной негативный рак молочной железы диагностируется в 10-20 процентах от всех случаев онкологических заболеваний у женщин. Особенность патологии в том, что она встречается преимущественно у женской половины населения в молодом возрасте.
Для подобных опухолевых образований характерна высокая пролиферативная активность, быстрый рост и агрессивное течение. По этой причине важно обнаружить ТНРМЖ как можно раньше.
Классификация
В области онкологии существует несколько типов классификации трижды негативного рака.
По чувствительности к медикаментам
Если принимать во внимание чувствительность опухоли к лекарственным препаратам, которые назначают для лечения, то заболевание будет иметь 4 формы.
Люминальная А
Формирование раковой опухоли происходит в период менопаузы и зависит от концентрации эстрогенов в женском организме. Именно по этой причине легко поддается лечению при помощи гормональных средств. Прогноз жизни в этом случае будет наиболее благоприятным.
Люминальная В
Данная разновидность болезни имеет предрасположенность к рецидивам. В большинстве случаев диагностируется у женщин репродуктивного возраста. Лечение гормонами в этой ситуации будет не эффективным.
Базальноподобная
Этот тип онкологического процесса составляет 70 процентов карцином с трижды негативным фенотипом. Эта форма относится к самой злокачественной и имеет негативный прогноз.
HER- 2-позитивная
Отличие ее заключается в агрессивности гормонозависимых образований, имеющих внушительные размеры, и распространением в лимфатические узлы.
По гистологическому типу
По данному признаку ТНРМЖ классифицируется также на 4 вида.
Включает в себя группу опухолевых образований, которые имеют общие морфологические признаки. Как правило, диагностировать такую форму рака удается только на последних статях развития.
Медулярный
Внешне новообразования представлены тяжами и широкими полосами. Течение патологического процесса скрытое. Часто заболевание можно спутать с фиброаденомой.
Низкодифференцированный протоковый
Представляет собой эпителиально-протоковую неоплазию. При таком состоянии происходит разрушение мембраны протоков, а также прорастание опухоли в строму.
Аденокистозный
Диагностируется в редких случаях. Отличается низкой степенью дифференциации по гистологическому типу, что создает определенные трудности в проведении терапевтических мероприятий.
Стадии
Как и любой онкологический процесс, трижды негативный рак имеет несколько стадий своего развития.
Первая
Опухоль локализуется в толще железы и достигает в размерах не более 3-х сантиметров. Патологические клеточные структуры не распространяются на кожу. Отдаленный вторичный очаг поражения, как правило, отсутствует.
Вторая
На 2 стадии уплотнение может быть до 5 сантиметров в диаметре. При этом новообразования могут поражать клетчатку, но не дают метастазов. В некоторых случаях могут поражаться одиночные лимфоузлы.
Третья
В объеме неоплазия больше 5 см. Опухоль прорастает в кожные покровы и проникает в фасциальные слои мышц. Однако вторичные очаги в лимфатических узлах также не наблюдаются.
Четвертая
Через кровоток и лимфосистему патологические клетки начинают распространяться по всему женскому организму. В большинстве случаев на этой стадии заболевание не подается терапии.
Причины
До настоящего времени истинные предрасполагающие факторы трипл-отрицательного рака так и не были выявлены. Формированию онкологического процесса способствуют отклонения на генетическом уровне.
Согласно статистическим данным, которые проводились в области маммологии, специалистами была выделена одна из главных причин развития патологии — наследственная предрасположенность. Кроме этого, есть и другие факторы, которые могут спровоцировать формирование злокачественной опухоли.
Высокая активность онкогена FAM83
Были проведены множественные наблюдения, по результатам которых удалось сделать выводы о том, что при повышенной экспрессии этого гена здоровые клетки меняют свое поведение. Такое состояние, как правило, и провоцирует опухоль. Если данный ген удалить, то пролиферация патологических клеток прекращается.
Распространение в отдельные этногруппы
Если придерживаться статистике, то в большей степени заболеванию подвержены афроамериканцы. Это объясняется тем, что некоторые наследуемые гены проявляют чрезмерную активность.
Мутация BRCA
Нередко у больных ТНРМЖ диагностируется мутационный процесс в этом гене. Данный участок ДНК в нормальном состоянии осуществляет контроль за выработкой защитных факторов, которые предназначены для предотвращения перерождения клеток в злокачественные формы.
Рак груди в роду
Если у кого-либо из близких родственников имеется онкопроцесс груди, то риск развития болезни возрастает в несколько раз.
Также специалисты выделяют еще ряд причин, по которым может начать развиваться трижды негативный рак. К ним относят:
- длительное бесконтрольное употребление оральных гормональных противозачаточных средств;
- радиационное облучение;
- нарушение структуры груди;
- патологии, к которым относят лактостаз, мастопатию и галакторею;
- многочисленные аборты.
Также стоит отметить, что возраст в появлении патологии не играет никакой роли. Неоплазии могут быть подвержены женщины всех возрастных категорий.
Симптомы
На ранних этапах развития онкологического процесса клиническая картина, как правило, отсутствует. Обнаружить уплотнение впервые удается при прощупывании молочной железы.
По мере прогрессирования патологии отмечается сдавливание рядом расположенных структур, что сопровождается болевыми ощущениями.
В тот момент, когда опухоль достигает крупных размеров, появляются следующие симптомы:
- отечность;
- деформирование железы и соска;
- нехарактерные выделения;
- покраснение кожи;
- увеличение лимфатических узлов в области подмышечных впадин.
Далее симптоматика дополняется:
- общей слабостью;
- чрезмерной утомляемостью;
- зудом в месте поражения;
- болями в суставах.
Если происходит метастазирование, то возникает желтуха и нарушение дыхательной системы.
Диагностика
Если есть подозрение на ТНРМЖ, то специалист назначает прохождение лабораторного и инструментального обследования.
Проведение первичных процедур дает возможность установить формирование уплотнений в груди. Также, благодаря таким способам, можно определить объемы опухоли и ее место локализации, а также наличие метастазов в лимфатических узлах.
Цитология и иммуногистохимическая диагностика
Это второй этап диагностического обследования. Для забора образца патологической ткани проводится трепан-биопсия или пункция. В ходе проведения микроскопического изучения при развитии патологического процесса обнаруживаются низкодифференцированные клетки.
После того как лабораторные методы подтвердят наличие заболевания, специалисты проводят инструментальную диагностику, которая включает:
- компьютерную и магнито-резонансную томографию;
- рентгенографию грудины.
Также важно проведение дифференцированной диагностики, чтобы исключить наличие доброкачественных опухолей или других злокачественных новообразований.
Лечение
Если диагноз трижды негативная форма рака груди подтвердился, то к лечению необходимо приступать незамедлительно. Выбор тактики проведения терапевтических мероприятий зависит от стадии онкологического процесса, возраста больной и ее общего состояния наличия метастазирования и прочих факторов.
Хирургическое вмешательство
В этом случае выполняется радикальная мастэктомия, суть которой заключается в полном иссечении молочной железы и региональных лимфоузлов, пораженных метастазами. Данная процедура является травматичной, но вероятность рецидивирования болезни значительно снижается.
Лучевая терапия
В ходе проведения процедуры на очаг поражения воздействуют радиационным излучением. Это позволяет добиться уничтожения раковых клеток, оставшихся после операции. Участок, который будет подвергаться облучению, а также дозировка определяются исключительно специалистом.
Химиотерапия
Поскольку рецепторы к онкопротеину эпидермиса и гормонам у такой формы рака отсутствуют, то он не поддается лечению традиционными гормональными препаратами. Поэтому для устранения заболевания в большинстве случаев предпочтение отдается полихимиотерапии.
Осложнения
Если вовремя не диагностировать заболевание и не начать лечение, то могут возникать различные осложнения. К наиболее распространенным относят:
- метастазирование в другие структуры организма;
- раковую интоксикацию;
- кахексию;
- скопление жидкости в плевральной полости;
- кровотечение в легких;
- нарушение в работе ЦНС;
- слепоту;
- печеночную недостаточность.
Поле проведения химио- и лучевой терапии могут наблюдаться некоторые побочные эффекты:
- ощущение зуда и жжения кожи;
- сухость кожных покровов;
- приступы тошноты со рвотой;
- тромбозы;
- ломкость волос и выпадение.
Кроме того, многие больные страдают от депрессии, становятся замкнутыми, у них возникает боязнь смерти.
Прогноз
Как правило, прогностические данные неблагоприятные. При правильно подобранной полихимиотерапевтической схеме лечения выживаемость в течение трех лет отмечается в 65-68 процентах.
Реальные случаи показывают, что если в течение 5 лет не отмечалось рецидивов, то прогноз будет, как и при других формах злокачественных опухолей молочных желез.
Профилактика
Специфических мер предотвращения заболевания нет. Специалисты рекомендуют только придерживаться некоторых правил, которые позволят снизить риски развития болезни:
- регулярно проводить самообследование груди;
- не принимать без назначения врача оральные контрацептивы;
- не подвергать организм радиационному облучению;
- не травмировать молочные железы.
Кроме того, при наследственной предрасположенности важно не менее одного раза в 6 месяцев проходить обследование у маммолога.
Трижды негативный рак груди является заболеванием, в результате которого страдает весь женский организм. При неправильно проведенном и несвоевременном лечении возрастает вероятность не только инвалидности, но и летального исхода.
Именно поэтому при появлении первых симптомов важно сразу обращаться за медицинской помощью. Раннее выявление патологии поможет избежать большинства негативных последствий.
Источник: https://onkologia.ru/onkomammologiya/trizhdy-negativnyy-rak-molochnoy-zhelezy/
Трижды негативный рак молочной железы
Трижды негативный рак молочной железы – это патология, с агрессивным течением и опасными для жизни осложнениями. Рассмотрим особенности данного вида онкологии и прогноз.
С помощью иммуногистохимического исследования определяют основные раковые рецепторы. Анализ дает информацию о рецепторах эстрогенов (ER), чувствительности к герцептину (her2neu) и рецепторах прогестерона (PR). Большинство опухолей имеют положительный ответ на все три рецептора. Если рак не чувствителен к герцептину (ER0, PR0, her2neu 0-1), то это указывает на ТНРМЖ.
Такой рак относится к отдельной группе заболеваний, так как характеризуется агрессивным течением в сравнении с другими злокачественными поражениями молочной железы. Он имеет специфическое гистологическое строение (базальноподобная форма).
В данной группе могут встречаться плоскоклеточная и апокриновая карциномы. ТНРМЖ встречается в 10-20% всех случаев рака.
Патологии подвержены женщины, принимающие оральные контрацептивы, пациентки с наследственной предрасположенностью и афроамериканцы.
В большинстве случаев опухоли диагностируют на запущенных стадиях. Онкология проявляется в виде длительного воспалительного процесса. Многие наследственные формы недуга относятся к данной категории.
Он имеет разные подтипы и группы, которые позволяют детальнее исследовать механизм его развития и составить эффективный план лечения. Онкология характеризуется негативным прогнозом.
Но при своевременной терапии и отсутствии рецидивов в течение пяти лет, прогноз выживаемости такой же, как и при других формах злокачественного поражения молочных желез. Но в 80% случаев болезнь рецидивирует в первые 1-2 года после радикальной терапии.
Код по МКБ-10
Согласно медицинской статистике, трижды негативный рак молочной железы довольно распространен на территории нашей страны. Болезнь относится к гетерогенной группе опухолей.
Для диагностики патологии используют код по мкб 10, недуг относится к категории ІІ новообразования.
C50 Злокачественное новообразование молочной железы:
- C50.0 Соска и ареолы.
- C50.1 Центральной части молочной железы.
- C50.2 Верхневнутреннего квадранта молочной железы.
- C50.3 Нижневнутреннего квадранта молочной железы.
- C50.4 Верхненаружного квадранта молочной железы.
- C50.5 Нижненаружного квадранта молочной железы.
- C50.6 Подмышечной задней части молочной железы.
- C50.8 Поражение молочной железы, выходящее за пределы одной и более вышеуказанных локализаций .
- C50.9 Молочной железы неуточнённой части.
Молекулярно-генетическая классификация указывает на четыре группы рака, каждая из которых имеет индивидуальные эпидо-физиологические свойства, типичную клиническую картину и прогноз.
Источник: https://ilive.com.ua/health/trizhdy-negativnyy-rak-molochnoy-zhelezy_109617i15944.html
Pак молочной железы — Docrates
На сегодняшний день, большинству пациентов с раком груди удается излечиться полностью. Особенно высок показатель излечения в Финляндии. По данным европейского исследования Eurocare 5 «Выживаемость пациентов, прошедших лечение рака» (Survival of cancer patients in Europe) Финляндия занимает первое место по раку молочной железы. Это возможно благодаря новейшим формам диагностики и лечения, а также общему уровню осведомленности о раке. Значительная часть заболевания обнаруживается на ранних стадиях, что повышает вероятность полного выздоровления пациента.
Симптоматика рака груди
В большинстве случаев локальный рак груди на момент обнаружения не имеет симптомов. Среди самых распространенных симптомов рака груди можно выделить появление узелка в груди или подмышечной впадине. Каких бы симптомов не проявлялось, рак груди определятся с помощью обследований, например маммографии.
Симптомами и причинами пройти обследования на рак груди могут быть: болевые ощущения, образование узелка в груди, выделения из соска или отек груди. Но не нужно забывать, что такие симптомы могут быть вызваны другими заболеваниями, не только раком груди. Все же мы рекомендуем при возникновении симптомов обратиться за консультацией специалистов, чтобы разъяснить ситуацию и вовремя распознать рак груди, при его наличии, и принять меры. Подробнее о симптомах рака груди
Подтверждение диагноза рак груди
Этап подтверждения рака груди начинается с приема онколога. В этот момент у женщины уже имеются результаты маммографического обследования или УЗИ, либо она сама замечает у себя подозрительные изменения. Онколог клиники Дократес изучает медицинскую информацию пациентки и при необходимости назначает дополнительные исследования. Чаще всего пациентке проводится биопсия под контролем УЗИ и/или МРТ исследование.
МРТ (магнитно-резонансная томография) – одно из самых чувствительных к раку молочной железы исследований. Оно дает информацию о размере образования, местном распространении, а также используется при планировании операции. Специально для МРТ груди в Дократес используются магнитные катушки, которые позволяют получить точную информацию о расположении рака, распространенности. После чего принимается решение о планировании операции или лучевой терапии. Подробнее о диагностике рака груди.
Операция по раку груди
При местном раке молочной железы сначала проводится оперативное лечение. В Дократес на операцию пациентка попадает в кратчайшие сроки. Перед операцией в клинике проводятся все необходимые обследования, например, исследование сторожевых лимфоузлов. Перед операцией чрезвычайно важно определить распространенность рака, для этого в Дократес проводится МРТ исследование.
Благодаря отлаженной работе квалифицированных хирургов клиники, лечащего онколога, координирующей медсестры и иных специалистов, в Дократес операция проводится в кратчайшие сроки и качественно. При небольших злокачественных образованиях в груди в Дократес проводятся операции с сохранением груди. В определенных случаях требуется полностью удалить грудь (мастэктомия). Но в таком случае пациентке возможно провести одномоментно реконструкцию груди, либо реконструкцию можно выполнить отдельно, по завершению лечения, в зависимости от исходной ситуации. Подробнее об оперативном лечении рака груди.
Медикаментозное лечение рака груди и лучевая терапия
Если по раковой опухоли определяют любые свойства, указывающие на возможное возобновление заболевания – рекомендуется послеоперационное лечение, направленное на предупреждение рецидива. Большинству пациенток требуется дополнительное лечение. Подробнее о медикаментозном лечении и лучевой терапии.
Прогнозы по раку груди, наблюдение после лечения и риск рецидива
На прогноз рака груди влияют многие факторы. Благодаря развитию методов терапии рака груди прогнозы по результатам лечения постоянно улучшаются.
По завершению лечения в клинике Дократес пациентка остается под контролем врачей. Ей составляется индивидуальный план посещений онколога и обследований. При возникновении у пациентки беспокойств и подозрительных симптомов в Дократес легко обратиться и пройти необходимые обследования.
Подробнее о прогнозах по раку груди, наблюдении после лечения и риске рецидива.
Метастатический рак груди. Диагностирование и лечение
При необходимости в Дократес пациенткам с раком груди проводятся исследования на распространение рака в другие органы. В клинике представлены новейшие техники и оборудование для определения метастазирования рака. Лечение метастатического рака груди всегда планируется индивидуально.
Подробнее о метастатическом раке груди, его диагностировании и лечении.
Наследственный рак груди
Примерно у 30% женщин с раком груди в роду уже присутствовал рак груди. Это может быть как простое совпадение, так и наследственная предрасположенность. 5-10% из случаев заболевания раком груди относят к заболеваниям с наличием наследственной геномутации в роду, среди которых наиболее распространенными являются BRCA-генетические ошибки.
Как определить наследственные риски заболевания?
Бесплатное участие в клинических исследованиях по раку груди
В Дократес есть возможность принять участие в бесплатных клинических исследованиях. О возможности участия в клинических исследованиях иностранных пациентов уточняйте у персонала клиники.
Дополнительная информация о текущих клинических исследованиях.
На лечение быстро и без направлений
Команда специалистов клиники Дократес по раку груди обладает необходимыми знаниями и долгим опытом диагностики и лечения рака. В основе всего лечения лежит правильный диагноз. Клиника Дократес оснащена последним диагностическим оборудованием. Благодаря технологическим возможностям и профессионализму врачей мы точно определяем характеристики и распространенность заболевания, после чего пациентке подбирается оптимальное лечение.
В дополнение к основному лечению, для пациенток с раком груди работает команда специалистов Центра восстановления здоровья (лимфотерапевты, специалист по питанию, психолог, сексолог и пр.). Специалисты Центра помогают пациентке поддержать или улучшить качество жизни во время и после прохождения лечения.
Женщины, получившие лечение у нас, остаются очень довольными и рекомендуют нас своим знакомым. Истории пациенток, прошедших лечение в Дократес.
НОВАЯ СТРАТЕГИЯ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ ЛЮМИНАЛЬНОГО HER2-НЕГАТИВНОГО МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | АРТАМОНОВА
1. Злокачественные заболевания в России в 2015 году (заболеваемость и смертность). Под ред. Каприна А.Д., Старинского В.В., Петровой Г.В. М., 2017. 250 с.
2. Состояние онкологической помощи населению России в 2015 году. Под ред. Каприна А.Д., Старинского В.В., Петровой Г.В. М., 2016. 236 с.
3. Pan H, Gray R& G, Davies Ch et al. Predictors of recurrence during years 5-14 in 46,138 women with ER+ breast cancer allocated 5 years only of endocrine therapy (ET). ASCO 2016, J Clin Oncol, 2016, 34(suppl): abstr 505.
4. Saad E, Katz A, Machado K and Buyse M. Post-Progression Survival (PPS) and Overall Survival (OS) According to Treatment Type in Contemporary Phase III Trials in Advanced Breast Cancer (ABC). SABCS 2009, Abstr 5116.
5. Dawood S, Broglio K, Gonzalez-Angulo AM, et al: Trends in survival over the past two decades among white and black patients with newly diagnosed stage IV breast cancer. J Clin Oncol, 2008, 26: 4891-4898.
6. http://www.cancer.org/acs/groups/content/@epidemiologysurveilance/documents/docum ent/acspc-029771.pdf].
7. DeVita V, Lawrence T, Rosenberg S et al. DeVita, Hellman, and Rosenberg’s Cancer: Principles and Practice of oncology. 8thed Philadelphia. J.B. Lippincott, 2008. P. 1634.
8. Perou CM. Molecular Stratification of Triple-Negative Breast Cancer. The Oncologist, 2011, 16(suppl 1): 61-70.
9. Rugo HS, Rumble RB, Macrae E et al. Endocrine therapy for hormone receptor-positive metastatic breast cancer: Americane Society of Clinical Oncology guideline. JCO, 2016. doi: 10.1200/JCO.2016.67.1487.
10. Wilcken N et al. Cochrane Database Syst Rev, 2003, 2: CD002747.
11. Llombart-Cussac A, Pivot XB, Biganzoli L et al. A prognostic factor (PF) index for overall survival in a HER2-negative endocrine-resistant metastatic breast cancer (MBC) population: Analysis from the ATHENA trial. ASCO 2013. J Clin Oncol, 2013, 31(suppl): abstr 555.
12. Cardoso F et al. Ann Oncol, 2014 Oct, 25(10): 1871-88.
13. Mauri D, Pavlidis N, Polysos NP and Ioannidis JPI. Survival With Aromatase Inhibitors and Inactivators Versus Standard Hormonal Therapy in Advanced Breast Cancer: Meta-analysis. JNCI, 2006, 98(18): 1285-1291.
14. Bonneterre J. Anastrozole Versus Tamoxifen as First-Line Therapy for Advanced Breast Cancer in 668 Postmenopausal Women: Results of the Tamoxifen or Arimidex Randomized Group Efficacy and Tolerability Study. JCO, 2000, 18: 3748-3757.
15. Mouridsen H, Gershanovich M, Sun Y et al. Superior Efficacy of Letrozole Versus Tamoxifen as First-Line Therapy for Postmenopausal Women With Advanced Breast Cancer: Results of a Phase III Study of the International Letrozole Breast Cancer Group. JCO, 2001, 19(10): 2596-2606.
16. Mouridsen H, Gershanovich M, Sun Y et al. Phase III Study of Letrozole Versus Tamoxifen as First-Line Therapy of Advanced Breast Cancer in Postmenopausal Women: Analysis of Survival and Update of Efficacy From the International Letrozole Breast Cancer Group. JCO, 2003, 21(16): 2101-2109.
17. Robertson JFR, Lindemann JPO, Llombart-Cussac A et al. A comparison of fulvestrant 500 mg with anastrozole as first-line treatment for advanced breast cancer: follow-up analysis from the «FIRST» study. Presented at: 33rd Annual San Antonio Breast Cancer Symposium, Dec 8-12, 2010, San Antonio, TX, abstr. S1-3.
18. Osborne CK, Pippen J, Jones SE et al. Double-Bl ind, Randomi zed Tr ial Comparing the Efficacy and Tolerability of Fulvestrant Versus Anastrozole in Postmenopausal Women With
19. Advanced Breast Cancer Progressing on Prior Endocrine Therapy: Results of a North American Trial. JCO, 2002, 20(16): 3386-3395.
20. Howell A, Robertson JF, Quaresma Albano J et al. Fulvestrant, formerly ICI 182,780, is as effective as anastrozole in postmenopausal women with advanced breast cancer progressing after prior endocrine treatment. Clin Oncol, 2002, 20(16): 3396-3403.
21. Chia S, Gradishar W, Mauriac L et al. Doubleblind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptor-positive, advanced breast cancer:results from EFECT. J Clin Oncol, 2008, 26(10): 1664-1670.
22. Steele N, Zekri J, Coleman R et al. Exemestane in metastatic breast cancer: effective therapy after third-generation non-steroidal aromatase inhibitor failure. Breast, 2006, 15: 430-436.
23. Carlini P, Michelotti A, Ferretti G et al. Clinical Evaluation of the Use of Exemestane as Further Hormonal Therapy after Nonsteroidal Aromatase Inhibitors in Postmenopausal Metastatic Breast Cancer Patients. Cancer Investigation, 2007, 25: 102-105.
24. Lonning PE, Bajetta E, Murray R et al. Activity of exemestane in metastatic breast cancer after failure of nonsteroidal aromatase inhibitors: a phase II trial. J Clin Oncol, 2000, 18: 2234-2244.
25. Baselga J, Campone M, Piccart M et al. Everolimus in postmenopausal hormonereceptor-positive advanced breast cancer. N Engl J Med, 2012, 366: 520-29.
26. http://www.nobelprize.org/nobel_prizes/medicine/laureates/2001/?google_referrer = mail.ru.
27. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell, 2011, 144: 646-–74.
28. Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature, 2012, 490: 61-70.
29. Hirama T and H. Phillip Koeffler. Role of the Cyclin-Dependent Kinase Inhibitors in the Development of Cancer. Blood, 1995, 86: 841-854.
30. Fry D et al. Specific Inhibition of cyclindependent kinase 4/6 by PD 0332991 and associated antitumor activity in human tumor xenografts. Molecular Cancer Therapeutics, 2004, 3: 1427-1437.
31. Choi YJ, Anders L. Signaling through cyclin D-dependent kinases. Oncogene, 2014, 33: 1890-903.
32. Finn RS et al. PD 0332991, a selective cyclin D kinase 4/6 inhibitor, preferentially inhibits proliferation of luminal estrogen receptor-positive human breast cancer cell lines in vitro. Breast Cancer Res, 2009, 11(5): R77.
33. Lamb R, Lehn S, Rogerson L, Clarke RB, Landberg G. Cell cycle regulators cyclin D1 and CDK4/6 have estrogen receptor-dependent divergent functions in breast cancer migration and stem cell-like activity. Cell Cycle, 2013, 12(15): 2384-2394.
34. Finn RS, Crown JP, Lang I, Boer K, Bondarenko IM, Kulyk SO, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as firstline treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol, 2015, 16(1): 25-35.
35. Finn RS, Crown JP, Ettl J et al. Efficacy and safety of palbociclib in combination with letrozole as first-line treatment of ER-positive, HER2- negative, advanced breast cancer: expanded analyses of subgroups from randomized pivotal trial PALOMA-1/TRIO-18. Breast Cancer Research, 2016,; 18: 67. DOI 10.1186/s13058-016-0721-5.
36. Finn RS, Martin M, Rugo HS et al. PALOMA-2: primary results from a phase III trial of palbociclib (P) with letrozole (L) compared with letrozole alone in postmenopausal women with ER+/HER2- advanced breast cancer (ABC). JCO, 2016, 34(suppl): abstr. 507.
37. Turner NC, Ro J, Andre F et al. Palbociclib in hormone-receptor-positive advanced breast cancer. N Engl J Med, 2015, 373(3): 209-19. doi: 10.1056/NEJMoa1505270.
38. Cristofanilli M, Turner NC et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2- negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): fi nal analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol, 2016, 17: 425- 39.
39. Cristofanilli M, Bondarenko I, Ro J et al. PALOMA3: Phase 3 trial of fulvestrant with or without palbociclib in pre- and postmenopausal women with hormone receptor-positive, HER2-negative metastatic breast cancer that progressed on prior endocrine therapy – confirmed efficacy and safety. Presented at SABCS 2015, San Antonio, Texas, USA (Poster 4- 13-01).
40. Turner NC, Jiang Y, O’Leary B et al. Efficacy of palbociclib plus fulvestrant (P+F) in patients (pts) with metastatic breast cancer (MBC) and ESR1 mutations (mus) in circulating tumor DNA (ctDNA). J Clin Oncol, 2016, 34(suppl): abstr 512.
41. Harbeck N, Iyer S, Cristofanilli M et al. Quality of life with palbociclib plus fulvestrant in previously treated hormone receptor-positive, HER2-negative metastatic breast cancer: patient-reported outcomes from the PALOMA-3 trial. Ann. Oncol., 2016, 27: 1047-1054.
42. Verma S, Bartlett CH, Schnell P et al. Palbociclib in Combination With Fulvestrant inWomen With Hormone Receptor-Positive/HER2-Negative Advanced Metastatic Breast Cancer: Detailed Safety Analysis From aMulticenter, Randomized, Placebo-Controlled, Phase III Study (PALOMA-3). Oncologyst, 2016, 21: 1-11.
43. Diéras V, Rugo HS S, Gelmon K, et al. Long-term safety of palbociclib in combination with endocrine therapy in treatment-naive and previously treated women with HR+ HER2- advanced breast cancer: A pooled analysis from randomized phase 2 and 3 studies. Poster presented at SABCS 2016 (Abstract P4-22-07).
Принципы лечения локальных рецидивов молочной железы с учетом изменений иммунофенотипа первичной опухоли
Дружков М.О., Гатауллин И.Г., Дружков О.Б.
Государственное автономное учреждение здравоохранения «Республиканский клинический онкологический диспансер», Казань, Россия
В статье рассмотрены принципы лечения локальных рецидивов рака молочной железы.
Материалы и методы . Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период с 2000 по 2011 гг.Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: иммуногистическое исследование гормональных рецепторов, опухолевого тканевого маркера HER2 / neu и пролиферативной активности Ki67. Полученные результаты сравнения с показателями первичных опухолей у пациентов.
Результаты . По нашим наблюдениям фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев.
Изменения в опухолях люминального фенотипа произошли у 10% пациентов (p <0,05). Рак молочной железы люминального В HER2-позитивного подтипа поменял иммунофенотип в рецидивных опухолях у 75% пациентов (p = 0,005). Трижды-негативные опухоли поменяли иммунофенотип в 33,3% случаев. Динамика иммунофенотипа рака молочной железы HER2-позитивного молекулярно-генетического типа опухолей наблюдалась у 28,6% пациентов.
Больные раком молочной железы люминального А типа благоприятный прогноз локального рецидивирования.У большинства (75,6%) больных с люминальным типом рака молочной железы локальный рецидив возникает в сроки более 30 месяцев, у 24,4% — в период до 30 месяцев (p <0,05). Для люминального В типа, как с гиперэкспрессией онкогена HER2 / neu, так и без нее, наиболее характерны средние сроки (от 30 до 60 месяцев) возникновения рецидива - 60% больных. Трижды-негативный и HER2-позитивный тип первичной опухоли сопряжен с неблагоприятным прогнозом локального рецидивирования. Трижды-негативный тип рака молочной железы статистически достоверно (p <0,05) локально рецидивирует в ранние сроки (до 30 месяцев) - 61,5% больных.У пациентов HER2-позитивного типа первичной опухоли локальный рецидив диагностируют у 83,3% больных в сроки до 60 месяцев.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменений иммуногистохимических свойств раковой опухоли, разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы.
Выводы . К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива.Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Ключевые слова : рак молочной железы, локальный рецидив, иммунофенотип рецидивной опухоли, молекулярно-генетические подтипы рака молочной железы .
Изучением локальных проблем рецидивов рака молочной железы занимаются крупные мировые онкологические институты, наиболее значимые из них: Милан1, Милан2, NSABP, DBGC, SPORE, PP [1].В вышеперечисленных исследованиях изучались сроки возникновения локальных рецидивов в зависимости от объема оперативного лечения, молекулярно-генетических подтипов рака молочной железы [2]. По результатам исследований разработаны практические рекомендации Американского общества Онкологов (NCCN), Европейского общества онкологов (EORTC) [3]. Благодаря внедрению разработанных стандартов лечения рака молочной железы удалось снизить показатели смертности и увеличения выживаемости пациентов, страдающих данным заболеванием [4].Но, несмотря на успехи комплексного лечения рака молочной железы, частота возникновения локальных рецидивов остается достаточно высокой [5]. По различным данным, частота локального рецидивирования рака молочной железы зависит от стадии заболевания и локорегионального распространения и достигает от 4% до 22%. Перечисленные выше клинические исследования не учитывали изменения иммунофенотипа рака молочной железы. Однако иммуногистохимические показатели определяют во многом тактику лечения данной болезни.Известно, что раковая опухоль гетерогенна по клеточному составу, кроме того, геном злокачественной опухоли нестабильности и подвержен влиянию типа мутационных процессов, приводящих к изменению ее фенотипических признаков [6].
Цель исследования : разработка тактики комплексного лечения локальных рецидивов с учетом изменений иммунофенотипов первичной опухоли и локального рецидива рака молочной железы.
Материалы и методы исследования
Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период 10 лет.Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: результаты клинических лабораторных методов диагностики, иммуногистохимического исследования гормональных рецепторов опухолевого тканевого маркера HER2 / neu и пролиферативной активности Ki67. Полученные результаты сравнения с показателями первичных опухолей у пациентов. Данные историй болезней и амбулаторных карт были закодированы для обработки в статистической программе SPSS 12.0. Всего были проанализированы 20 признаков с их градациями — клинические данные, морфологические факторы и тактика лечения опухолей. После мастэктомии рецидивы возникли у 76 пациентов (1,4%), после органосохранной операции — у 54 пациентов (5,7%). Объем хирургического вмешательства при локальном рецидиве зависел от объема предшествующего хирургического лечения, размеров рецидивной опухоли и был представлен представлен варианттами. Широкое иссечение рецидива в области послеоперационного рубца или на передней грудной стенке проведено 77 больным (59,3%), ампутация остатка молочной железы (простая мастэктомия) после органосохранной операции — 37 пациентов (28,3%), повторная органосохранная операция (в сочетании с пластической коррекции и без) — 16 человек (12,4%).
Результаты исследования и их обсуждение
На основании исследования мы подтвердили, что раковая опухоль на фоне проводимого лечения часто меняет свои молекулярно-биологические свойства. По нашим наблюдениям, изменения произошли у 45,7% пациентов. Все возможные изменения иммунофенотипа рака молочной железы отражены на рисунке 1.
Рисунок 1 . Динамика иммунофенотипа первичной опухоли РМЖ.
На представленном сочетании ИГХ-показателей рака молочной железы.В отношении каждого из них показаны изменения в процентном использовании. Мы подтвердили большую предрасположенность к изменениям некоторых иммунофенотипов первичной опухоли по сравнению с другими. Первичные опухоли с иммунофенотипом ER + PR-Neu +, ER + PR-Neu-, ER-PR + Neu- более предрасположены к изменениям (100%, p <0,005) при возникновении локального рецидива. Опухоли с иммунофенотипом ER + PR + Neu- значительно реже меняли свой иммунофенотип (20,0%).
Для анализа клинического значения обнаруженных изменений иммуногистохимических показателей рака молочной железы полученные результаты были объединены согласно общепринятой молекулярно-генетической классификации.По нашим наблюдениям, фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев. Результаты распределения пациентов по иммуногистохимическим показателям первичной опухоли и локального рецидива представлены на рисунке 2.
Рисунок 2 . Распределение пациентов с первичной опухолью и локальными рецидивами
по молекулярно-генетическим подтипам, чел.
По нашим наблюдениям, отраженные на схеме (рис.4) изменения фенотипа рака молочной железы имеют общие принципы.По мере увеличения числа исследованных количественные характеристики (рис.3), но не качественные характеристики фенотипа РМЖ. То есть можно говорить о том, что изменения иммунофенотипа рака молочной железы закономерный характер.
Рисунок 3 . Динамика иммунофенотипа РМЖ.
Опухоли HER2-позитивного типа изменили свои молекулярно-генетические свойства в рецидивной опухоли у трети пациентов. Опухоли люминального В типа HER2-позитивного поменялись в 75% случаев.Опухоли люминального типа молекулярно-генетического типа практически не менялись (10% опухолей). Опухоли трижды-негативного типа в 33,3% случаев перешли в другой подтип. Опухоли люминального B HER2-позитивного подтипа достоверно чаще других (75%, p <0,05) изменили свой иммунофенотип в рецидивной опухоли. Опухоли люминального типа А других молекулярно-генетических типов РМЖ склонны к динамике - 90% (p <0,05) не поменяли иммунофенотип в рецидивной опухоли. Опухоли люминального А типа, утра экспрессию рецепторов стероидных гормонов, переходили в трижды-негативный тип.Опухоли люминального В типа, утрачивая гиперэкпрессию онкогена HER2 / neu, индекс пролиферативной активности Ki67 или экспрессию рецепторов эстрогена и прогестерона либо экспрессию и тех и других, переходили в люминальный А тип, трижды-негативный или в HER2-позитивный тип. Опухоли HER2-позитивного типа начинали экспрессировать рецепторы стероидных гормонов и при этом утрачивали гиерэкспрессию онкогена HER2 / neu, таким образом приобретая люминальный фенотип в рецидивных опухолях, а утратив только экспрессию онкогена HER2 / neu, становились негативными.Опухоли трижды-негативного типа, начиная экспрессировать рецепторы эстрогена и прогестерона в рецидивной опухоли, приобретали признаки люминального А фенотипа.
Рисунок 4 . Сводная схема динамики иммунофенотипа РМЖ.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменений иммуногистохимических свойств раковой опухоли, разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы (рис.5). Внедрение в клиническую практику разработанного алгоритма, по нашей оценке, позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
В основу алгоритма положено деление локальных рецидивов на первично-резектабельные и первично-нерезектабельные формы, ключевые особенности иммунодиагностика локального рецидива рака молочной железы (рис.5).
Рисунок 5 . Алгоритм комплексной терапии локальных рецидивов (ЛР) РМЖ
(ИДО — иммунодиагностика опухоли).
Комплексное лечение пациентов с операбельной формой локального рецидива начинаем с хирургического удаления рецидивной хирурголи.Объем хирургического вмешательства зависит от размеров рецидивной опухоли. После радикальных мастэктомий проводится иссечение рецидива в области послеоперационного рубца или на передней грудной стенке. После предыдущей органосохранной операции проводится ампутация остатка молочной железы (простая мастэктомия), если размер рецидивной опухоли превышает 2 см в наибольшем измерении. В случае, когда размер рецидивной опухоли не превышает 2 см, проводится повторная органосохранная операция (в сочетании с пластической коррекцией и без), отступая от краев опухоли не менее 2 см, и гистологическое исследование резекционных линий на степень их «чистоты».Все удаленные подвергаются гистологическому и иммуногистохимическому исследованию. В зависимости от результатов назначается лекарственная терапия. Если опухоль оказывается гормонозависимой с высокой экспрессией рецепторов стероидных гормонов (7-8 баллов), то целесообразнее всего проведение гормонотерапии II-III линии. В случае низкой экспрессии рецепторов стероидных гормонов в рецидивной опухоли или ее проводится полихимиотерапия с первой эндокринотерапией.
Хирургическое лечение локальных рецидивов хирургической формы в большинстве случаев затруднительно врастания в переднюю грудную стенку или близких сосудисто-нервных пучков, либо из-за больших размеров рецидивной опухоли, отсутствия ее четких границ и возможности закрытия кожного дефекта операционной раны.Поэтому комплексное лечение неоперабельных локальных рецидивов целесообразно начинать с системного лечения, основной целью которого является уменьшение размеров рецидивной опухоли для дальнейшего удаления. В очередь должна проводиться системная терапияненной (неоперабельной) формы локальных рецидивов рака молочной железы, которая включает в себя химиотерапию и эндокринотерапию. Пациентам, ранее получавшим ПХТ I с антрациклин-линии цепимиами (FAC, CAF, AC), целесообразнее проводить более «агрессивные» таксан- и платино-содержащие схемы химиотерапии.
В случае если неоперабельная форма локального рецидива сопровождается отдаленным метастазированием, рецидивная опухоль на фоне системного лечения будет являться своеобразным маркером прогрессирования заболеваний и показателем ее эффективности. Данным пациентом дальнейшее оперативное лечение целесообразнее проводить только в случае стабилизации заболеваний и его длительной ремиссии. Местное воздействие является следующим этапом комплексной терапии (неоперабельных) форм ЛР.К оперативному лечению рецидивной опухоли следует приступать только в случае регресса опухоли под воздействием системной терапии. В том случае, если достигнуть положительного эффекта от лекарственного лечения, не удалось и опухоль по-прежнему хирургически нерезектабельна, целесообразно проведение лучевой терапии.
Выводы
К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива.Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Литература
- Кларк М., Коллинз Р., Дарби С. и др. Влияние лучевой терапии и различий в объеме хирургического вмешательства при раннем раке молочной железы на местный рецидив и 15-летнюю выживаемость: обзор рандомизированных исследований. Lancet 2005; 366 (9503): 2087-106.
- Smid M, Wang Y, Zhang Y, et al.Подтипы рака груди показывают преимущественную локализацию рецидива. Cancer Res. 2008; 68: 3108-3114.
- Elkhuizen PHM, van Slooten H, Clahsen PC, et.al. Высокий риск локального рецидива грудосохраняющей терапии у пациенток с отрицательным узлом в пременопаузе с раком молочной железы значительно снижается за счет одного курса периоперационной химиотерапии: совместное исследование Европейской организации по исследованию и лечению рака молочной железы. J.Clin.Oncol. 2000; 18: 1075-1083.
- Paridaens R, Piccart M.Гормональное лечение первой линии метастатического рака груди с помощью экземестана или тамоксифена у пациенток в постменопаузе — рандомизированное исследование III фазы группы EORTC Breast Group. Материалы ежегодного собрания ASCO 40. Новый Орлеан, 2004 г .; 23: 6.абс.515.
- Колядина И.В., Поддубная И.В., Комов Д.В. и соавт. Срок локальных рецидивов у больных первично-операбельным раком молочной железы при различной лечебной тактике. Сибирский онкологический журнал 2008; 6 (30): 17-20.
- Иорио М.В., Кроче СМ.МикроРНК при раке: маленькие молекулы с огромным влиянием. J. Clin. Онкол 2009; 27: 5848-5856.
Опубликован обзор эволюции терапии Her2 позитивного рака молочной железы
Her2 позитивный рак молочной железы 20 лет назад считался плохо поддающимся лечением. В настоящее время большинство пациентов с подобным диагнозом может быть вылечено. Обнаружение эволюции терапии этого вида содержательно сообщает заведующий отделением химиотерапии Даниил Львович Строяковский.
Рак молочной железы — это несколько различных заболеваний, объединенных общей локализацией первичной опухоли.
Одним из наиболее распространенных и изученных вариантов является Her2 позитивный вариант. Он составляет 18-20% от всего рака молочной железы. Например: если в г. Москва в год заболевает РМЖ ~ 7000 женщин, то есть Her2 позитивных среди них ~ 1250 женщин. Причем, наиболее часто данный вариант опухоли у женщин младше 50 лет (но может быть в любом возрасте).
По данным одного из Американских регистров, если разделить женщин с РМЖ по возрасту, то 45% — младше 50 лет, 29% — женщины от 50 до 60 лет, 26% — старше 60 лет. Среди женщин старше 50 лет у более чем 75% опухоль гормонопозитивная (ER +, PR +/-). Соответственно младше 50 лет, чаще встречается Her2 позитивный, гормононегативный вариант и трижды-негативный вариант. Это агрессивные подтипы.
Среди Her2 позитивного рака молочной железы у ~ 40% Эстрогеновые и Прогестероновые рецепторы отрицательные (ER-, PR-), соответственно у 60% опухоль гормонопозитивная (и Her2 позитивная).
Таким образом, есть 2 подтипа Her2 позитивного рака: люминальный В, Her2 позитивный (ER +, PR +/-, Her2 положительный) и нелюминальный Her2 позитивный (ER-, PR, Her2 положительный).
Что такое Her2 позитивность?
На 17 хромосоме есть участок ДНК, который кодирует наличие рецептора Her2 на поверхности клеток. Этот рецептор существует в норме на поверхности электронных сигарет. При раке молочной железы, у части пациенток (~ 18%), на 17 хромосоме, данный участок ДНК начинает повторяться многократно (амплификация), то есть вместо 1 гена Her2 на каждую из 2-х хромосом (от папы и мамы), этих генов становится очень много.Соответственно, количество рецепторов на опухолевых клеток увеличивается многократно, чем в норме (гиперэкпрессия). Эти рецепторы, как «антенны» торчат из мембраны опухолевых клеток, начинают слипаться с другими такими «антеннами» (Her2), также могут слипаться с соседними другими «антеннами» Her1, Her3, Her4. Это приводит к генерации сигнала ядра опухолевой клетки — «плодись и метастазируй».
Чтобы определить, если ли Her2 гиперэкпрессия на поверхности опухолевых клеток проводят исследование: иммуногистохимия (ИГХ)
Могут быть 4 варианта иммуногистохимического проявления Her2 на поверхности опухолевых клеток: варианты ответов
С помощью ИГХ удается сразу установить Her2 позитивность, то есть ответ Her2 3+.
Но, у около 10% пациенток ИГХ экспрессия не дотягивает для HER2 3+, и врач получает ответ Her2 2+.В этом случае выполняется исследование FISH (флуоресцентная ин ситу гибридизация). Но даже в этом случае не всегда удается до конца установить Her2 статус, так как иногда повтора гена бывает мало (амплификация низкой степени). Иногда опухоль неоднородная, есть выраженная амплификация гена Her2, а в части ее нет. Это сложные случаи для трактовки. Поэтому каждые 3-5 лет уточнения и дополнения к руководству по трактовке Ее позитивности. Надо сказать, что заложенная ошибка метода (в очень качественной лаборатории) составляет в районе 5%, то есть, если в г.Москве 7000 женщинам проводится ИГХ исследование, для уточнения биологического типа рака молочной железы в год, ошибка существует как минимум у 350 женщин в ту или иную сторону.
Хуже, когда Her2 позитивная опухоль была определена, как Her2 негативная — это означает, что пациентка не получает должного лечения. Если же Her2 негативная опухоль диагностирована как Her2 позитивная, то в этом случае женщина получает избыточное таргетное лечение, но так как токсичность данного лечения в целом мала, на мой взгляд от меньше вреда.На самом деле, частота ошибок в рутинном определении Her2 статуса намного больше, чем 5% (сколько я не знаю), так важно, чтобы Онкопатологические лаборатории были, по настоящему, высококачественные.
Эта форма опухоли — Her2 позитивный рак молочной железы важна тем, что еще 15-20 лет назад считалась наиболее агрессивной и летальной, среди всех вариантов РМЖ. Однако в настоящее время, благодаря интеграции таргетной терапии, стала самой курабильной (излечимой).
Основные таргетные препараты для Her2 позитивного РМЖ:
1.Трастузумаб — моноклональное антитело к рецептору Her2 на поверхности опухолевых клеток
2. Лапатиниб (малая молекула) — внутриклеточный ингибитор Her2 рецептора. Her2 как бы прошивает насквозь мембрану опухолевой клетки и у него есть внутриклеточная часть
3. Пертузумаб — моноклональное антитело к поверхности рецептора Her2, но присоединяется к другой точке чем Трастузумаб и мешает склеиванию рецепторов семейства Her (Her1, Her2, Her3, Her4).Пертузумаб эффективен только с Трастузумабом или Трастузумаб-Эмтанзином
4. Трастузумаб-Эмтанзин — это сложная молекула: Трастузумаб соединен с очень сильным цитостатиком. Опухолевая клетка, пытаясь избавиться от Трастузумаба, как бы его «съедает» погружает часть мембраны внутрь себя в виде вакуоли, разрушает эту вакуоль, и тут освободившийся сильный цитостатик разрушает опухолевую клетку изнутри — этакий «Троянский конь».
История создания препаратов анти-Her2 направленности существует около 25 лет.В 1998 году в США был зарегистрирован препарат Трастузумаб в комбинации с химиотерапией 1-ой линии лечения метастатического рака молочной железы (то есть паллиативное противоопухолевое лечение женщин с впервые выявленными метастазами).
Было проведено клиническое исследование: пациенток впервые выявлен метастазами Her2 позитивного РМЖ делили на 2 группы: половина получала химиотерапию (или Доксорубицин-содержащую или Паклитаксел- содержащую), половина такую же химиотерапию + Трастузумаб.Средняя продолжительность жизни (Общая Выживаемость (ОВ)) составила в контрольной группе 20 месяцев (чуть более 1,5 лет), а группе с Трастузумабом 25 месяцев (более 2-х лет). На тот момент, результаты этого исследования выглядели значительным, но все-таки эволюционным шагом в лечении метастатического рака молочной железы. Разница в продолжительности жизни в 5 месяцев была не очень впечатляющая, но удалось впервые перешагнуть 2 года в этой средней продолжительности жизни в этой когорте пациенток. В реальной клинической практике, всего 20 лет назад половина женщин с метастазами Her2 позитивного рака молочной железы умирали в районе полутора лет.В основном метастазы поражали печень, легкие, кости.
У женщин с гормонопозитивным и Her2 позитивным РМЖ гормонотерапия была не эффективна, и только химиотерапия давала короткий эффект. Причем в странах Запада, пациенткам были предоставлены Доксорубицина, а также Таксаны (Паклитаксел и Доцетаксел с середины 90х годов, Капецитабин, Винорелбин, Платина, Гемцитабин). В нашей стране, в то время, мы могли использовать только Доксорубицин и Циклофосфан, а также другие «старые» цитостатики.Таксанов, Капецитабина, Винорелбина, Гемцитабина практически не было, тем более Трастузумаба (его стоимость на 1 цикл терапии была в районе 3000 $). Соответственно картина течения болезни была удручающая для пациенток.
Революционным и поворотным моментом лечения Her2 позитивного рака молочной железы явилось 15 мая 2005 года, когда на конференции ASCO в Орландо были доложены результаты исследований адъювантной терапии Her2 позитивного рака молочной железы.
Адъювантная терапия — это терапия, применяемая после хирургического лечения (операция по удалению первичной опухоли: или Мастэктомия, или Радикальная секторная резекция), для снижения риска прогрессирования заболеваний у больных I, II, III стадиями (в основном с II и III стадиями) .Известно, что на момент операции, когда имеются пациенты, пациенты могут быть микрометастазы, которые могут быть, где угодно. Эти микрометастазы никак себя не проявляют и их невозможно определить никакими методами (УЗИ, Рентген, КТ, МРТ, ПЭТ-КТ, скенирование, анализы крови и т.д.). Но из этих микрометастазов, впоследствии разовьются макрометастазы, которые и переведут болезни в неизлечимую фазу. При наличии отдаленных метастазов, неважно, которые были выявлены сразу (в дебюте заболеваниях) или после радикальной операции, на сегодня болезнь (метастатический рак молочной железы) считается не излечимой.Поэтому задача адъювантной терапии — убить микрометастазы (где бы они не находились) и тем самым излечить как можно больше пациенток. Минусом адъювантной (профилактической) терапии является факт, что, когда ее проводишь, ты не знаешь: кому конкретно она помогает. Это лечение не самого пациента, а его риска. Тем не менее адъювантная лекарственная терапия локальных форм рака молочной железы (I-III стадий) является одним из самых необходимых этапов лечения. Важно разумно и правильно объяснить, потенциальную пользу и осложнения лечения.Очень важно выбрать научно обоснованную и наиболее эффективную программу с наименьшим токсическим профилем.
Итак, 15 мая 2005 года на конференции ASCO в Орландо были доложены 2 последних тезиса: результат Европейского исследования HERA (в том числе принимали участие и Российские исследователи) и объединенный анализ 2-х Американских исследований, посвященных добавлению Трастузумаба к адъювантной химиотерапии при I-III стадиях Her2 позитивного РМЖ.
Я прекрасно помню этот день, предварительные результаты были засекречены, была только информация, что исследования прошли успешно.В зале, где проходил, это было вероятно несколько десятков тысяч человек — это отражает огромную роль рака молочной железы, среди онкологических заболеваний. Врачи со всего мира очень плотно стояли друг рядом с другом и была фантастическая тишина, боялись пропустить хоть одно слово. Я тоже был в зале, вместе с русскими коллегами, мы слушали затаив дыхание. Результаты оказались ярче, чем все наши самые оптимистические предположения. В исследовании HERA показано, что контингент пациенток был несколько менее запущен (было больше I и II стадии) добавление Трастузума привело к уменьшению числа прогрессирующих в первые 3 года в половину.Но самое большее впечатление произвели объединенные результаты 2-х американских исследований (в основном II и III стадии), где к антрациклин и паклитаксел- содержащему режиму химиотерапии (на тот момент уже стандарт в США, мы еще и близко не могли так делать), был добавлен Трастузумаб. В 2-х исследованиях участвовали 3351 женщина. В группе без Трастузумаба в ближайшие 4 года после операции прогрессирование наблюдалось в среднем у 33% пациенток, тогда как в группе с Трастузумабом прогрессирование было только у 15%.Риск смерти от молочной железы снизился с 14% до 8%.
Если перевести это в понятные цифры, то арифметика следующая: возьмем 100 женщин с Her2 позитивным раком молочной железы II или III стадией, после радикальной операции. Среди 100 женщин, которым будет проведена адъювантная химиотерапия, Доксорубицин и Циклофосфан, Паклитаксел, у 33 из них проявятся метастазы рака молочной железы (и эти женщины вылечить уже не возможно, их формы лечения паллиативное) и 14 из них уже не погибнет от этого рака.Если этим же женщинам, к той же самой терапии Трастузумаб 1 год, то через 4 года метастазы разовьются только 15 из них, и погибнет от рака 8 женщин.
Результаты исследований адъювантной терапии Her2 позитивного рака молочной железы, кардинально изменили действующую практику, в контексте профилактического лечения. Тогда (в мае 2005 года) мы стояли в восхищении с одной стороны, и удручены с другой стороны — потому что Трастузумаб был нам недоступен (он был в стране, но его стоимость была запретительной для применения).Ситуацию удалось изменить, только на рубеже 2009-11 годов. С 2012 года, в Москве практически все пациентки с Her2 позитивным раком уже были обеспечены Трастузумабом. К этому времени, также удалось полностью обеспечить всех нуждающихся пациенток Таксанами, благодаря выходу генериков Паклитаксела на наш рынок.
Следующим этапом использования таргетной терапии при Her2 позитивном РМЖ стало его применение в плане неоадъювантной терапии.
Неоадъювантная терапия — это терапия при локальных стадиях (I – III), которая проводится перед операцией.Основной целью данной попытки оценить эффективность лекарственного средства непосредственно на первичную опухоль и метастазы в локорегионарные лимфоузлы, постараться уменьшить ее. В некоторых случаях это позволит сделать органосохранную операцию. При агрессивных подтипах рака молочной железы (Her2 позитивном и Трижды-негативном) на неоадъювантной химиотерапии в части части пациенток достижения полного морфологического регресса опухоли (полный лечебный патоморфоз — рCR). Полный лечебный патоморфоз оценивается по результатам гистологического исследования, после удаления первичной опухоли и подмышечных л / у.Если рCR достигнут, то это является суррогатом элиминации микрометастазов рака у подавляющего числа пациенток. У тех же, у кого не удалось добиться pCR — значит, имеется относительно высокая вероятность сохранения микрометастазов, из которых, через какое-то время, вырастут метастазы и болезнь уже нельзя будет вылечить (или почти нельзя вылечить).
Отсутствие рCR — ведет к необходимости разработки стратегии послеоперационной терапии, которая снизит риск прогрессирования.Крием pCR является отсутствием опухолевых клеток (за исключение возможного наличия клеток рака in situ) в области, где ранее находилась первичная опухоль и в подмышечных л / у (ypT0 (или in situ) ypN0).
При Her2 позитивном подтипе, у больных с II и III стадией рака неоадъювантная терапия стала основным подходом к лечению за последние 10 лет.
Вариантами химиотерапии являются: антрациклин + таксан-состав схемы (например: 4 Доцетаксел 75/3 недели или 12 Паклитаксел 80 / еженедельно, 4 АС (FAC, FEC, EC) или Доцетаксел 75 + Карбоплатин AUC6 каждые 3 недели — 6 циклов).К этой терапии должен быть добавлен Трастузумаб (как минимум).
Достижение полного лечебного патоморфоза (pCR) выражается в повышении выживаемости без прогрессирования (EFS — выживаемость без событий или выживаемость без болезней DFS). Выживаемость без прогрессирования тенденции к повышению общей выживаемости (ОС — общая выживаемость).
Таким образом, основная цель неоадъювантной терапии — достижение pCR.
Вероятность достижения pCR у больных c Her2 +, которые обеспечивают только химиотерапию — без Трастузумаба или другие варианты таргетной терапии следующая (метаанализ Cortazar — это очень большой анализ клинических исследований в области неоадъювантной терапии РМЖ):
Гормонопозитивные (HR +) ~ 18,3% (15-21%)
Гормононегативные (HR-) ~ 30,2% (26-34%)
Вероятность достижения pCR у больных с Her2 +, которые получают химиотерапию + Трастузумаб (Метаанализ Cortazar):
Гормонопозитивные (HR +) ~ 30,9% (26-36%)
Гормононегативные (HR-) ~ 50,3% (45–55%)
Таким образом, добавление Трастузумаба к стандартной неоадъювантной химиотерапии повышает вероятность достижения pCR в среднем на 60%.
Например: исследование HANNAH. В этом исследовании все пациентки с II и III стадиями Her2 позитивного рака молочной железы получили одинаковую химиотерапию и таргетную терапию (половина в / в Трастузумаб, половина подкожный Трастузумаб). По сути, у всех почти 600 пациенток была одинаковая, разница была лишь в варианте введения таргетного препарата (внутривенно или подкожно). Схема лечения: 4Доцетаксел 75 / кв.м. + Трастузумаб каждые 3 недели, затем 4 F (500) E (75) C (500) + Трастузумаб, каждые 3 недели, затем операция, затем Трастузумаб еще 10 введений +/- адъювантная лучевая терапия (если есть повышенный риск локального рецидива) + гормонотерапия (у гормонопозитивных (HR +)).Дизайн данного исследования эталонным для дальнейших исследований по неоадъювантной терапии Her2 позитивного РМЖ препаратами биоаналогами Трастузумаба. 591 оцененная пациентка.
Из данных исследования HANNAH следует, что достижение лечебного патоморфоза pCR дает 20% разницы в 3-х летней бессобытийной выживаемости (EFS) и приблизительно 27% разнице в 6-ти летней бессобытийной выживаемости (EFS). Имеется 10% разница в 6-ти летней общей выживаемости (OS): то есть достижение снижает риск смерти у каждой десятой пациентки за 6 лет.
Пациентки с гормонозависимым раком (HR +), Her2 позитивным имеют меньшую вероятность достижения рCR почти в 2 раза: 23,5% против 45,3%.
Но, если pCR был достигнут — бессобытийная выживаемость лучше, чем у HR- на 9-10%. Если pCR не был достигнут, то при HR + 3-х и 6-ти летняя выживаемость лучше, чем у HR- на 11 и 13% соответственно.
С 3-го до 6-го года риск прогрессирования у тех, у кого был достигнут pCR составляет 5-6% за 3 года (то есть около 2% в год).
С 3-го до 6-го года риск прогрессирования у тех, у кого не был достигнут рCR составляет 11-13% за 3 года (то есть около 4% в год).
Выводы:
- полностью подтверждена необходимость достижения pCR как суррогата длительного ответа.
- вероятность pCR выше у HR- негативных пациенток
- у пациенток с гормонопозитивным (HR +) и Her2 позитивным РМЖ, 3-х и 6-ти летняя EFS выше. Применение адъювантной гормонотерапии и меньшая биологическая агрессивность улучшает результаты.
Следующий этап: Двойная Her2 блокада (Трастузумаб + Пертузумаб) дает еще большему повышению вероятности pCR и, как следствие, повышает вероятность бессобытийной выживаемости (EFS).
Исследование KRISTINE III Фазы.
В этом исследовании пациентки с II и III стадиями Ее позитивного РМЖ были рандомизированы в 2 группы по 220 пациенток:
- 1 группа: ТСНР (Доцетаксел 75 / кв.м + Карбоплатин AUC 6 + Трастузумаб (стандартная доза 6 мг / кг веса, 1-ое введение 8 мг / кг веса) + Пертузумаб (стандартная доза — 420 мг, 1-ое) введение 840 мг), каждые 3 недели 6 циклов.Затем операция. Затем Трастузумаб + Пертузумаб до 1 года суммарно (12 циклов). Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования.
- 2 группа: 6 циклов TD-M1 (Трастузумаб-Эмтанзин) + Р (Пертузумаб). Затем операция, затем ещё 12 циклов Трастузумаб -Эмтанзин + Пертузумаб, каждые 3 недели. Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования. Аббревиатура группы (TD-M1 — P).
pCR в группе ТСНР был достигнут у 55% пациентов, HR- 73%, HR + 44%.
pCR в группе T-DM1 + P был достигнут у 44% пациентов, HR-54%, HR + 35%.
В группе T-DM1 + P: 6% пациенток спрогрессировали до операции, в основном с HER2 гетерогенной опухолью, в группе ТСНР никто не прогрессировал на фоне неоадъювантной терапии (удивительный непосредственный результат).
Лучшая группа: ТСНР 221 пациентка
3 летняя EFS на всю группу 94%
3-летняя IDFS (этот показатель близок к EFS) в группе pCR 97,5%
3-летняя IDFS (близок к EFS) в группе без pCR 84%
Выживаемость:
Итак, варианты неоадъювантной терапии и их эффективность в 2-х таблицах:
Следует отметить, что те пациентки, которые получают адъювантную терапию с III стадией, и те, кто получают неоадъювантную терапию на III стадии — это не одинаковые пациентки.Пациентки, с III стадией, которую можно прооперировать радикально — это с клинически (с) T3N1 по местному статусу — «начальная» IIIА стадия. Эти пациентки 90-е и 2000-е годы рассматривались, как первично-операбильные по первичной опухоли. Тогда, как пациентки с III В и III С стадиями (сN2-3 или все варианты сТ4) всегда рассматривались как первично неоперабильные. Эти пациентки практически не включаются в адъювантные исследования. Эти пациентки практически всегда начинали лечение с предоперационной химиотерапии (неоадъювантной).
Соответственно в группе с неоадъювантной терапией результаты всегда несколько хуже, чем с адъювантной терапией, независимо от той терапии, которые пациентки получают. Даже если терапия одинаковая. Например, в 2-х американских исследованиях адъювантной терапии 3-х летняя выживаемость без прогрессирования (DFS) с Антрациклины + Таксаны + Трастузумабом — 87%. При использовании точно такой же терапии в неоадъюванте (Антрациклины + Таксаны + Трастузумаб) — 3-х летняя выживаемость без прогрессирования — 75% (на всю группу, независимо от pCR).Просто — это разные по распространенности опухоли.
Как быть с пациентками, у которых при применении неоадъювантной терапии не был достигнут полный лечебный патоморфоз (pCR). Прогноз данных более низкого уровня — так как многие из них сохраняются микрометастазы, которые в дальнейшем дадут макрометастазы.
Исследование КАТТЕРИНЕ:
В этом исследовании были включены пациенты, которые не прошли терапию по поводу Her2 позитивного рака молочной железы со стадиями I-III, и у которых не был достигнут pCR на неоадъювантной фазе лечения.Пациентки были разделены на 2 группы: стандартная группа — Трастузумаб 14 циклов и экспериментальная Трастузумаб-Эмтанзин 14 циклов.
По результатам данного исследования, основной параметр данного исследования отражающая эффективность — выживаемость без инвазивного прогрессирования (выживаемость без инвазивного прогрессирования — параметр «выживаемость без событий — EFS») составила 88,3% к 3-м годам в группе Трастузумаб-Эмтанзин, в сравнении с 77% в группе Трастузумаба. В переводе на русский это означает, что в группе с Трастузумаб, у тех, у кого не имеется pCR к 3-м годам развиваются проблемы возврата рака молочной железы у 23% (почти ¼), тогда как при применении Трастузумаб-Эмтанзина возврат рака молочной железы в той или иной форме присутствует только 11,7%.То есть в половину меньше !!!
В силу короткого периода наблюдения пока не имеется существенной разницы в общей выживаемости (ОС), но это лишь вопрос времени. Явная тенденция к разнице в общей выживаемости имеется — нумерическое число смертей больше в контрольной группе.
Таким образом, на сегодня можно сделать вывод о том, что пациенткам, которым не удалось достичь pCR на фоне неоадъювантной терапии, имеется четкая стратегия улучшения результатов их лечения — фактически уполовинить риск прогрессирования в случае использования Трастузумаб-Эмтанзина.Но здесь надо не забывать, что у части пациенток опухоль гетерогенная и остаточная опухоль может оказаться негативной, поэтому необходимо проводить ретестирование остаточной опухоли и использовать Трастузумаб-Эмтанзин только у тех, у кого Her2 позитивность. У тех, у кого после неоадъювантной химиотаргетной терапии выжил только Her2 негативный клон опухоли — Трастузумаб-Эмтанзин назначать не стоит. На мой взгляд может быть оставлен Трастузумаб, и проводится стандартный вариант адъювантного негативного лечения, как у Her2 пациентов — эта проблема должна решаться индивидуально.
Теперь о том, какая наиболее эффективная адъювантная терапия у пациенток с совсем ранними опухолями Her2 позитивными. К совсем ранним опухоли менее 2-х см, без метастазов в лимфатические узлы. Сюда также можно отнести пациенток с опухолями чуть больше 2-х см (но обязательно меньше 3см), оказались такого размера при патологической послеоперационной оценке рТ. То есть — это опухоли рТ1аbcN0М0 и рТ2 (чуть больше 2см) N0М0. Независимо от гормононально-рецепторного статуса.Большинство подобных пациентов на первом этапе оперируются. Им выполняется или Радикальная Секторальная Резекция или Радикальная Мастэктомия. После операции подавляющее большинство из них нуждается в адъювантной терапии.
Оптимальный вариант адъювантной терапии — проведение химиотаргетной терапии по схеме: Паклитаксел 80 мг / кв.м еженедельно + Трастузумаб (еженедельно или 1 раз в 3 недели), адъювантная терапия Трастузумаб фактически 1 год.
Основанием для данной терапии является исследование APT.В данном исследовании были включены 410 пациентов в основном с опухолями менее 2-х см (в исследовании было включено только 36 пациентов с опухолями чуть более 2-х см, но менее 3 см) при отсутствии метастазов регионарные лимфоузлы (мог быть 1 микрометастаз в 1 лимфатический узел). Пациентки в данном исследовании использует только 1 вариант терапии: Паклитаксел 12 еженедельно + Трастузумаб суммарно 1 год. Интересно, что более 2/3 пациенток — были с гормонопозитивными опухолями.Этот интересный факт говорит о том, что гормонопозитивные и Her2 позитивные опухоли растут медленнее и больше шансов их поймать в I ой стадии, тогда гормононегативные и Her2 позитивные опухоли более агрессивны и чаще всего диагностируются по II-III стадиям.
При 7-ми летнем наблюдении за пациентками получены следующие результаты: только 4-х пациенток развились отдаленные метастазы, у 5-ти пациенток локорегионарное прогрессирование (чаще всего можно повторно получить ремиссию болезни), у 6-ти женщин развился рак другой молочной железы (или с той же стороны если была выполнена секторная резекция) и зафиксировано 8 смертей от других причин (естественная смерть еще не отменил).И это на 410 пациенток !!! Фантастический результат. Таким образом 7-ми летняя DFS (выживаемость без прогрессирования) составила в группе гормонопозитивных пациентов 94,6%, в группе гормононегативных 90,7%.
Вряд ли отдаленные результаты возможно улучшить !!!
Теперь вернемся к метастатическому раку молочной железы. После регистрации Трастузумаба (в 1998 году) в качестве моноклонального антитела допонительного к химиотерапии при метастатической раке молочной железы начались длительные исследования по оценке эффективности различных химиопрепаратов в комбинации с ним.Эти исследования шли приблизительно 10 лет. К середине 2000 годов стало понятно, что оптимальным партнером к Трастузумабу являются Таксаны (Паклитаксел или Доцетаксел), а также Винорелбин, в качестве 1-ой линии терапии. Комбинация с Доксорубицином (или Доксорубицин + Циклофосфамид) также показала свою высокую эффективность, по оказалась кардиотоксичной и поэтому не применяемой. Причем стало понятно, что один химиопрепарат (или Доцетаксел, или Паклитаксел, или Винорелбин) в комбинации с Трастузумабом не уступают по эффективности комбинированной химиотерапии (Например Доцетаксел + Карбоплатин), но по токсичности имеют преимущество.Комбинация Доцетаксел + Трастузумаб каждые 3 недели, или Паклитаксел (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) или Винорелбин (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) стали схемами 1-ой линии терапии. Обычно проводят 6-9 циклов химиотерапии (5-8 месяцев) с Трастузумабом и затем отменяется химиотерапия и продолжается терапия Трастузумабом до прогрессирования или токсичности (которое встречается очень редко). При этом пациенткам одновременно гормонозависимым опухоли может быть назначена «поддерживающая» гормонотерапия ингибиторомазы (Анастрозол или Летрозол), если женщина в менопаузе (если нет, то стоит перевести в менопаузу).
Результатами данного подхода стало — около 1 года (12 мес) медиана времени до прогрессирования (mPFS) и средняя продолжительность жизни (mOS) в районе 3-х лет (36 месяцев). В эру до Трастузумаба медиана продолжительности жизни была в районе 1,5 лет. То есть Трастузумаб, дополнительно к химиотерапии добавил еще 1,5 года к средней продолжительности жизни. Надо сказать, что это произошло и потому, что пациентки при прогрессировании на Трастузумабе продолжали получать Трастузумаб с другими химиопрепаратами, или комбинацию Капецитабин + Лапатиниб, или в дальнейшем Трастузумаб- Эмтанзин.Использование технологии Интернет-сенсоров на увеличение продолжительности жизни. Но, в вместе с тем, влияние 1-ой линии терапии трудно переоценить, так как эффективная первая линия терапии дает максимальную прибавку.
На рубеже 2000 года было начато исследование по оценке эффективности двойного блокады в сравнении с Трастузумабом с химиотерапией при метастат раке молочной железы. Ключевое исследование: Клеопатра. Вот дизайн исследования:
По сути, отличием в группах было — добавление Пертузумаба в одной из 2-х групп.Вторая группа получала плацебо. Никто — не пациент, не лечащий врач не знал: полностью «слепое» исследование, чтобы невозможно было фальсифицировать результаты.
В 2012 году исследование впервые было доложено, оно достигло своей Первичной Конечной Точки — увеличение Выживаемости без Прогрессирования (mPFS) с 12 месяцев в группе Доцетаксел + Трастузумаб + Плацебо до 18 месяцев в группе Доцетаксел + Трастузумаб + Пертузумаб. То есть, если пациентка получала тройную комбинацию в среднем прогрессировании наступало через 1,5 года от начала терапии.Это очень сильные данные по увеличению эффективности непосредственного лечения. Самым лучшим результатом явилось увеличение Общей Выживаемость (mOS), которое было доложено в 2015 году. Медиана Общей Выживаемость увеличилась с 40,8 мес до 57,1 мес, в группе с Пертузумабом. То есть, среднее увеличение продолжительности жизни оказалось 17 месяцев благодаря добавлению Пертузумаба в 1-ой линии терапии. Интересно, что обычно в позитивных (в сторону экспериментальной терапии) клинических исследований 1-й линии в онкологии мы имеем следующую картину: дельта (разница) mPFS практически всегда больше, чем дельта mOS.Это и понятно, как последующие линии терапии, пациентам всегда разные и в том числе с применением того препарата, которого не было в 1-ой линии (в группе контроля) (так называемый кроссовер). То есть разница обычно сглаживается. Роль одного лекарства добавленного в одну линию к стандартному набору всегда очень трудно разглядеть — много факторов наслаивается. Обычный пример: добавление Бевацизумаба к терапии метастатического рака молочной железы: препарат увеличивает 1 и 2 линии терапии (mPFS), но из-за «кроссовера» разница в mOS всегда оказывалась статистически недостоверной.Из-за этого в США ограничили применение Бевацизумаба при метастатическом раке молочной железы и многих рекомендаций Бевацизумаб при РМЖ отсутствует (лично с этим категорически не согласен).
Увеличение mOS на большУю дельту в сравнении с mPFS мы сегодня наблюдаем только в препаратах иммунотерапевтической направленности. Благодаря этому наблюдаются исследования, которые наблюдаются, благодаря чему они прогрессируют.В исследовании Клеопатры мы получили такую же картину. Кривые выживаемости:
Что мы видим в этом исследовании, что в группе с Пертузумабом и Трастузумабом к 8 годам от начала исследования не прогрессировало практически 25% пациентов, тогда как в группе с только Трастузумабом не прогрессировало к 8 годам 19% пациенток. Разница в 6% к 8 годам в группе только Трастузумаба, что 8-летние 37% женщин живы в комбинированной группе по сравнению с 23% в группе только Трастузумаба.Очень красноречивые данные. Кривые выживаемости очень похожи на кривые выживаемости, которые мы видим при применении иммунотерапии. Мы видим, что те пациентки, которые прожили 5 лет без прогрессирования от начала получения 1-ой линии лечения — фактически не прогрессируют в дальнейшем. Причем похожая картина кривых. Выживаемость без Прогрессирования наблюдается и в группе с только Трастузумабом, только в комбинированной группе таких пациенток значительно больше.
Сегодня можно с уверенностью говорить, что метастатический Her2 позитивный рак молочной железы перестал к неизлечимых заболеваний.Получается, что можем применять Химиотерапию (на основе Таксанов) + Трастузумаб + Пертузумаб мы вылечить ¼ пациенток !!!
Причем наибольшие шансы у тех пациенток, у кого биологически опухоль была инфильтрирована лимфоцитами (так называемые TIL — лимфоциты, инфильтрирующие опухоль).
Это кривые выживаемости без прогрессирования в зависимости от терапии (Пертузумаб vs Плацебо) и в зависимости от наличия / отсутствия TIL:
Это кривые общей выживаемости в зависимости от терапии (Пертузумаб vs Плацебо) и в зависимости от наличия / отсутствия TIL:
На графикх отчетливо видно, что пациентки у которых имеются TILs в опухоли, через 3 года от начала лечения практически не прогрессируют — и таких пациентов около 40%.Тогда как без Пертузумаба болезнь течет хуже, независимо от наличия / отсутствия TILs. При отсутствии TILs при добавлении Пертузумаба эффективность тоже выше, но не так ярко, как у больных с TIL.
Что такое TILs — это Т-лимфоциты, которые инфильтрируют опухоль (по какой-то причине), но не могут сами ее убить. Наличие TIL в опухоли является критерием благоприятного прогноза терапии (особенно при РМЖ). Вероятно, Т-лимфоциты используют лекарственную терапию уничтожить опухоль.Имеющиеся данные, на мой взгляд, говорят нам о том, что Трастузумаб и, особенно, комбинация Трастузумаб + Пертузумаб являются Иммунотерапевтической комбинацией в первую очередь. И именно благодаря этому удалось полностью уничтожить микрометастазы у женщин, и макрометастазы — как минимум у 25%.
Таким образом, я считаю, что для Her2 — позитивного РМЖ Положить следующие варианты лечения:
1. I стадия. Операция на первом этапе, применение адъювантной терапии: 12 циклов Паклитаксел 80 мг / кв.м 1 день + Трастузумаб 1,4,7,10 недели, затем каждые 3 недели 1 год суммарно. При гормонопозитивных вариантах, в адъюванте применение гормонотерапии ингибиторы ароматазы (Анастрозол или Летрозол), не менее 5 лет.
2. II и III стадии. Проведение неоадъювантной химиотаргетной терапии на первом этапе по схеме ТСНР: Доцетаксел 75 мг / кв.м + Карбоплатин AUC6 + Трастузумаб 6 мг / кг веса (1-ое введение 8 мг / кг веса) + Пертузумаб 420 мг (840 мг 1-го введения) ) каждые 3 недели 6 циклов.Затем операция, адъювантная терапия Трастузумаб до 1 года. Адъювантная гормонотерапия у гормонопозитивных пациентов — ингибиторы ароматазы не менее 5 лет. В случае отсутствия полного лечебного патоморфоза (pCR), ретестирование опухоли и при сохранении Her2 3+ проведение адъювантной терапии препаратом Трастузумаб-Эмтанзин 14 циклов каждые 3 недели. При отсутствии Her2 позитивности в остаточной опухоли — альтернативная адъювантная терапия, которая должна рассматривать индивидуально.
3.Бывают ситуации, когда хирурги шли на I стадию, но по результатам гистологического послеоперационного лечения, без проведения неоадъювантной химиотаргетной терапии, стадия заболевания оказалась существенно больше, например III стадия (по пораженным подмышечным лимфоузлам). В этом случае, должна быть такая схема адъювантной химиотаргетной терапии, которая была бы применена, в случае если бы знали о стадии заболевания сначала (до операции). Например, 6 курсов ТСНР затем Трастузумаб + Пертузумаб 1 год.Пациенты, участвующие в обследовании, могут стать более ранними и доступными. Данные ситуации должны решиться индивидуально квалифицированным онкологом.
4. Метастатический рак молочной железы: Доцетаксел 75 мг / кв.м 1 раз в 3 недели или Паклитаксел 80 мг / кв.м еженедельно + Трастузумаб + Пертузумаб в стандартных дозах. 18-24 недели химиотерапия, поддерживающая терапия Трастузумаб + Пертузумаб +/- гормонотерапия у гормонопозитивных пациентов (Ингибиторы ароматазы), до прогрессирования.При этом прогрессирование не наступит у минимум 24%. Как долго продолжать лечение, у тех, кто не прогрессирует годы, пока не ясно. Определение TILs не обязательно, так как это носит не предиктивный, а прогностический характер. Но если эта информация будет у врача, то вероятно она не будет лишней.
Заключение: Her2 позитивный рак молочной железы на сегодня практически излечимым заболеванием. Мы можем вылечить подавляющее большинство пациентов с I-III стадиям ~ 90% при использовании наиболее эффективных схем диагностики и лечения.
И мы можем вылечить (не побоюсь этого слова) 25% пациенток с метастатическим Her2 позитивным раком. Остальным мы можем значительно продлить жизнь на многие годы, в том случае, если будем использовать наиболее эффективные подходы к лечению.
Возможности использования анти-HER2 терапии у пациента с люминальным HER2-негативным раком молочной железы
Новости онкологии
25.03.2013
Возможности использования анти-HER2 терапии у пациента с люминальным HER2-негативным раком молочной железы
Появление препаратов анти-HER2 (трастузумаб, лапатиниб, пертузумаб, T-DM1) произвело революцию в лечении HER2-позитивного рака молочной железы (РМЖ).Благодаря их внедрению в клиническую пациентку с HER2-позитивными опухолями, ранее считавшиеся наиболее неблагоприятной группой, имеют выживаемость, превышающую таковую у больных с HER2-негативным заболеванием. Так, одно только добавление трастузумаба к химиотерапии таксанами позволяет увеличить медиану выживаемости больных HER2-позитивным РМЖ на 7-9 месяцев, что оказалось сопоставимо с выигрышем, достигнутым от предшествующих 10 лет вариантов режима химиотерапии [4].
Однако гиперэкспрессия HER2 (и / или амплификация кодирующего его гена), позволяющая назначить терапию анти-HER2, обнаруживается лишь в ~ 20% опухолей молочной железы.Для лечения остальных больных анти-HER2 терапия не используется, что обосновывалось ранних клинических исследований, показавших отсутствие выигрыша от назначения трастузумаба при лечении больных распространенным РМЖ, не имеющим гиперэкспрессии HER2. Однако одновременно было известно и то, что определенный уровень экспрессии HER2 определяет практически у всех больных РМЖ.
Suthinee Ithimakin и соавт. в исследовании, опубликованном 26 февраля 2013 г. В журнале «Исследования рака» показали, что целевая терапия, направленная против HER2-негативных, может быть эффективной и для части больных, опухоли которых в настоящее время расцениваются как HER2-негативные.Такая возможность после обнаружения экспрессии HER2-рецептора на стволовых клетках РМЖ [1].
И это наблюдение имеет значение «исторические корни», исходящие из результатов клинических исследований, которые получают от лечения трастузума лишь больные, опухоли имеют гиперэкспрессию / амплификацию HER2. Еще в 2008 году Пайк С. и соавторы представили результаты пересмотра HER2-статуса пациенток, вошедших в адъювантное исследование NSABP B-31.
Выяснилось, что опухоли 174 из 1787 (9,7%) больных, изначально (на уровне локальной лаборатории) расцененные как HER2-позитивные, были признаны HER2-негативными и при иммуногистохимическом, и при FISH-анализе в центральной лаборатории. Неожиданным оказалось то, что эти пациентки, опухоли которых были признаны HER2-негативными по заключению центральной лаборатории, имели такой же по величине выигрыш от назначения трастузумаба, что и опухолях, в опухолях которых были признаны положительные HER2-статусы [2].
Похожие данные представили и Perez с соавт. [3]. Вопрос о том, какие молекулярные механизмы лежат в основе противоопухолевого эффекта трастузумаба при HER2-негативном РМЖ, до настоящего времени оставался открытым.
Suthinee Ithimakin и соавт., Используя различные модели РМЖ (клеточные линии, ксенотрансплантаты у мышей, опухолевые ткани из первичных и метастатических очагов), показали, что HER2 может выборочно экспрессироваться на стволовых клетках эстроген-позитивного РМЖ, при этом сам опухоль (по существующим критериям) будет расцениваться как HER2-негативный люминальный подтип.
И несмотря на отсутствие экспрессии на большинстве клеток опухоли, в ее стволовых клетках экспрессия, HER2 обеспечивает работу — участвует в процессе их самообновления. Кроме того, исследователи выяснили, что эффект трастузумаба в такой ситуации будет зависеть от времени начала лечения. Если лечение трастузумабом начинается с поздних этапов, когда у мышей пальпируется опухолевое образование (аналогичное раннее клиническое исследование, показавшим неэффективность препарата при негативном амплитудном распространенном РМЖ HER2), то эффективность лечения ограничивается только опухолями с наличиемлификацией HER2 .
Если же трастузумаб вводится на ранних стадиях, сразу после прививки опухоли, то он резко замедляет рост опухолевых клеток, как с наличием амплификации HER2 , так и опухолевых клеток, люминального РМЖ без амплификации HER2 . При этом на опухоли с эстроген- и HER2-негативным статусом трастузумаб сдерживающим эффектом не обладал.
Комбинация трастузумаба с цитостатическим агентом полностью предотвращает рост опухоли у мышей с люминальным РМЖ после прекращения лечения [1].Таким образом, в доклинических исследованиях потенциальная роль трастумаба при адъювантной терапии люминального эстроген-позитивного и HER2-негативного (по современным критериям) РМЖ.
Таким образом, исследование Suthinee Ithimakin и соавт. Не отмечается, что мишенью для трастузумаба являются стволовые клетки РМЖ, экспрессирующие HER2 даже в организме других клеток опухоли гиперэкспрессии HER2 не отмечается. Другим важным моментом этого исследования стало понимание того, что экспрессия HER2 регулируется опухолевым микроокружением.При культивировании клеточной линии MCF7 (люминального РМЖ) совместно с остебластами было признано повышение экспрессии HER2 на опухолевых клетках в отсутствии амплификации HER2 .
Этот процесс регулируется RANK лигандом, соединяющимся с помощью продуманного рецептора на стволовых клетках РМЖ, может активировать сигнальный путь NF-каппаB, приводя к повышению экспрессии HER2. Как было показано ранее [5], микрометастазы в кости РМЖ содержат большое количество стволовых клеток РМЖ.
Поэтому другой целью для тразтузумаба становятся микрометастазы РМЖ, причем как с амплификацией HER2 , так и без нее, что является дополнительным оправданием включения трастузумаба в адъювантные схемы лечения РМЖ. Для клинического подтверждения эффективности трастузумаба в терапии люминального HER2-негативного РМЖ необходимо проведение рандомизированных клинических исследований.
Источники:
- Ithimakin S, Day KC, Malik F, Zen Q, Dawsey SJ, et al.HER2 управляет стволовыми клетками рака молочной железы в просвете в отсутствие амплификации HER2: влияние на эффективность адъюванта трастузумаба. Cancer Res. 2013 г. 1. 73 (5): 1635-46.
- Пайк С., Ким С., Волмарк Н. Статус HER2 и преимущества адъювантного трастузумаба при раке груди. N Engl J Med, 2008. 358: 1409-11.
- Perez EA, Reinholz MM, Hillman DW, Tenner KS, Schroeder MJ, Davidson NE, et al. Влияние HER2 и хромосомы 17 на исход лечения пациентов в адъювантном исследовании трастузумаба N9831.J Clin Oncol, 2010. 28: 4307-15.
- Н.В. Жуков, С.А. Тюляндин. Целевая терапия в лечении солидных опухолей: практика противоречит теории. Биохимия, 2008. 73, 5, с.751-768.
- Рубен Дж. М., Ли Б. Н., Гао Х., Коэн Э. Н., Мего М., Джордано А. и др. Пациенты с первичным раком груди с клинико-патологическими особенностями высокого риска имеют высокий процент эпителиальных клеток костного мозга с активностью ALDH и фенотипом раковых стволовых клеток CD44CD24lo. Eur J Cancer, 2011.47: 1527-36.
Лечение рака молочной железы — CON-MED.RU
Рак молочной железы (РМЖ) — наиболее распространенное онкологическое заболевание в Европе, Америке и странах Азии. По данным ВОЗ в мире ежегодно регистрируется более миллиона случаев этого заболевания. Онколог медицинского центра, зав. кафедрой онкологии и лучевой терапии МГМСУ, доктор медицинских наук, профессор Гелена Генс рассказала о подходах к лечению рака молочной железы.
Риск множества онкологических заболеваний увеличивается с возрастом, и РМЖ не является исключением. Чем дольше мы живем, тем выше риск повреждений генов и ниже их вероятность восстановления. Однако рак молочной железы и в молодом возрасте. По данным Американского онкологического общества в одном из восьми случаев рак молочной железы у женщин моложе 45 лет.
Особенности лечения рака молочной железы
За последние несколько лет лечение женщин с диагнозом «рак молочной железы» изменилось коренным образом.Исследования фундаментальной онкологии показали, что РМЖ — это не одна болезнь, как минимум одна болезнь друг друга. Ранее у онкологов не было ответа на вопрос о том, почему болезнь с одинаковой стадией и гистологической формой у разных пациенток протекает неодинаково. Сейчас врачи матнили, что все зависит от формы рака, молекулярно-биологического подтипа опухоли, который определяется с помощью иммуногистохимического исследования.
В настоящее время подход к лечению РМЖ персонализированный: учитываются генетические особенности каждой пациентки, на основании молекулярного «портрета» опухоли подбирается план индивидуального лечения.
Рак по наследству. О роли генетики в развитии РМЖ
Всегда существовали семьи, где несколько поколений женщин заболевали раком молочной железы и / или раком яичников. По мере развития онкогенетики стала понятна причина возникновения этой наследственности. В 1990-х годах были открыты антионкогены, несущие информацию о белках, блокирующие процессы злокачественной трансформации клеток клеток. В настоящее время существует множество генов с такой функцией, которые имеют наибольшие практические значения антионкогены BRCA1 и BRCA2 (сокращения английского словосочетания Br east CA ncer), мутации, вызывающие возникновение рака молочной железы.
У женщин с этим синдромом риск заболеть раком молочной железы 45-87%, в то время как средняя вероятность этого заболевания гораздо ниже — 5,6%. Кроме того, увеличивается вероятность развития рака и в других органах: яичниках, поджелудочной железе, у мужчин — предстательной железе.
Молекулярно-генетическое тестирование как инструмент развития таргетной терапии
Молекулярно-генетическое тестирование — это стандартное исследование, которое может проводиться в любой лаборатории.Без данного тестирования сегодня невозможен выбор правильной тактики лечения рака молочной железы, поскольку в нем «зашита» возможность таргетной терапии. К примеру, если результаты типа исследования показывают, что у женщины рак HER2 / neuпозитивный, то для его лечения уже есть таргетное лекарство — герцептин (трастузумаб).
Диагноз РМЖ. Что дальше?
После того, как врач поставил диагноз РМЖ, необходимо провести стадирование болезни: установить, распространилась ли опухоль в подмышечные лимфоузлы, а также в другие органы и ткани (т.е. появились ли отдаленные метастазы). В России для этого часто используется УЗИ, в то время как европейские и американские стандарты рекомендуют компьютерную томографию трех областей –органов грудной клетки, брюшной полости и малого таза. Еще более четкую картину болезни предоставит исследование, называемое позитронно-эмиссионной томографией, которая совмещена с компьютерной томографией (ПЭТ / КТ).
Подтипы опухоли и их персонализированное лечение
После того, как онколог поставил, что опухоль находится только в молочной железе и отдаленных метастазов нет, для дальнейшего лечения нужно определить ее молекулярно-биологический подтип.Их четыре: люминальный А, люминальный В, тройной негативный и HER2 позитивный.
Самый агрессивный подтип из всех —тройной негативный рак. Его название обусловлено тем, что все три маркера, которые определяют тактику лечения у этого вида опухоли, отрицательные: в опухоли отсутствуют рецепторы эстрогена и прогестерона, а также нет экспрессии HER2 / neu.
Тройной негативный рак молочной железы как правило, высокой скоростью роста опухолевых клеток.Хотя такая опухоль агрессивна и очень чувствительна к химиотерапии.
Молекулярно-биологический подтипы люминальный А и люминальный B — это гормонально-зависимые опухоли. Когда лечение пациенток с данными подтипом ограничения заканчивается, врач назначает гормонотерапию. Женщины будут находиться под наблюдением онколога и принимать одну таблетку в течение периода лет или более, что защитит их от рецидива болезни. Люминальные опухоли гормоночувствительны и прогноз их лечения более благоприятен.
Четвертый подтип опухоли молочной железы —HER2 / neu. Назван он по имени рецепторов, которые находятся на поверхности опухолевой клетки и их химические, вызывают при помощи иммуногистического исследования. Это значит, что пациентка, у которой определен этот подтип рака, в течение года или больше нужно принимать препарат герцептин.
Различая и анализируя подтипы рака, онколог в каждом конкретном случае предлагает пациентке персонализированное, так называемое таргетное лечение, которое не только улучшает качество жизни, но и увеличивает общую выживаемость.В этом, несомненно, заключается большой прогресс в лечении рака молочной железы.
Мультидисциплинарное лечение
Когда определен молекулярно-биологический подтип опухоли, не отдаленных метастазов становится понятно, что опухоль операбельная, консилиум врачей, который обычно состоит из онколога-хирурга, онколога-химиотерапевта, онколога-радиолога, патоморфолога, и, в некоторых учреждениях включает и онкопсихолога, определяет , какой вид применения необходимо применить пациентке в первую очередь.Проведение консилиума — необходимый и важный этап, от которого зависит выбор правильной тактики лечения и его эффективность.
Хирургическое лечение
Как правило, на первом этапе это хирургия. Если она невозможна из-за больших размеров опухоли, проводится химиотерапия. С ее помощью уменьшаются размеры опухоли, она становится «операбельной».
На ранних стадиях чаще проводят органосохраняющее лечение, то есть удаляют пораженную часть молочной железы.Сегодня в развитых странах практически 60-70% операций органосохраняющие. Такой же подход используется в ведущих российских клиниках, в том числе и в нашем центре. Даже когда речь идет об удалении груди, есть возможности для реконструкции груди с хорошими косметическими результатами.
Важный показатель — состояние подмышечных лимфоузлов. Раньше при раке молочной железы женщины удаляли все подмышечные лимфоузлы. Сейчас есть возможность удалить только так называемые сторожевые лимфоузлы — ближайшие пути распространения опухоли (обычно от 1 до 3).Пациенткам с «чистыми», «свободными» от опухолевых клеток, сторожевыми лимфоузлами, остальные лимфоузлы удалять не нужно. Это помогает избежать серьезных осложнений, таких как отек руки, лимфедема.
После хирургического лечения в большинстве случаев проводится лучевая терапия. Радиологи облучают то место, где была молочная железа или послеоперационный рубец (если молочная железа сохранена и удалили только ее часть). На данный момент существуют высокоточные системы, которые позволяют проводить лучевую терапию с максимальной защитой здоровых тканей, в том числе с защитой сердца, что очень важно, если опухоль находится в левой молочной железе.Кроме того, на ранних стадиях возможно провести интраоперационную лучевую терапию — облучение ложа опухоли однократно во время операции.
Химиотерапия. Делать или нет?
На вопрос «нужна ли химиотерапия на ранних стадиях рака?» после операции отвечает генетическое обследование «Онкотайп» или «Маммапринт». Опухоль исследуют на качественные параметры, после чего прогноз прогноза о рецидива.Но даже если такой риск, пациентки не всегда соглашаются на проведение химиотерапии, так как боятся побочных эффектов (к примеру, потеря волос). В этом случае может помочь специальное устройство — «хладошлем», которое в большинстве случаев показывает женщинам волосы во время химиотерапии.
Таким образом, сегодня с уверенностью можно сказать, что рак молочной железы больше не считается смертельной болезнью. К нему надо относится как к хроническому заболеванию, которое даже в метастатической стадии можно длительно держать под контролем.Благодаря внедрению новых научных разработок и исследований, вероятность полного выздоровления в последние годы повысилась. Персонализированное лечение рака молочной является Основной фактор , который дает положительный прогноз на результат для каждой конкретной пациентки.
прогностическое значение биологических подтипов (анализ кумулятивной базы данных ФГБУ «Нии онкологии им.Петрова »Минздравсоцразвития) — тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в библиотеке КиберЛенинка
Рак молочной железы
ЖУРНАЛ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Ранний рак молочной железы: прогностическое значение биологических подтипов (Анализ кумулятивной базы данных ФГБУ «Нии Онкологии им.Н.Н. Петрова »Минздравсоцразвития)
В.Ф. СЕМИГЛАЗОВ1, Р.М. ПАЛТУЕВ1, В.В. СЕМИГЛАЗОВ2, А.Г. МАНИХАС3, К.Д. ПЕНЬКОВ1, К.Ю. ЗЕРНОВ1, И.В. НИКИТИНА1, А.А. БОЖОК1, Д.Е. ЩЕДРИН1, Т.Ю. СЕМИГЛАЗОВА1, А.М. ЕРМАЧЕНКОВА1, И.А. ГРЕЧУХИНА2, Г.А. ДАШЯН1
1 ФГБУ «НИИ онкологии им. Н.Н. Петрова »Минздравсоцразвития России, Санкт-Петербург 2Санкт-Петербургский Государственный Медицинский Университет им.акад. И.П. Павлова, Санкт-Петербург 3СПб ГУЗ «Городской клинический онкологический диспансер», Санкт-Петербург
Представлены данные о прогнозе и выживаемости различных биологических подтипами рака молочной железы (РМЖ).
Наиболее благоприятный прогноз и высокие показатели выживаемости при люминальном-А подтипе и чуть хуже при люминальном-В подтипе (HER2-отрицательном).Агрессивное течение заболеваний с быстрым развитием висцеральных метастазов и поражением головного мозга наблюдается при HER2-сверхэкспрессирующем и трижды-негативном РМЖ. et а1.(2009) упрощенную гистохимическую классификацию, адаптированную как «полезная альтернатива» генной классификации. Подтипы РМЖ, определяемые по клинико-патоморфологическим критериям, похожи, но не тождественны молекулярно-генетическим подтипам, и скорее выберите «подходящее приближение» к биологическому оригиналу (В.Ф. Семиглазов и соавт., 2011).
Как кратко изложено в табл.1, этот подход определения опухолевых подтипов основан на иммуногистохимическом определении рецепторов эстрогенов и прогестерона, сверхэкспрессии HER2 и маркера клеточной пролиферации К1-67.
При этом ясно, что сама клинико-патоморфологи-ческая классификация должна основываться на надежных методах определения ее индивидуальных компонентов. Уже опубликованы инструкции ASCO / CAP по определению рецепторов эстрогенов и прогестерона (Hammond, 2011) и для детекции позитивности HER2 (Wolff, 2007).
Для практического клинического панели экспертов (эксперт St.Gallen, 2011) (Санкт-Галлен, 2011) Поддержка применения методологии определения ИЕК2-позитивности, рекомендованной FDA (США), и основанной на приемлемых критериях оценки HER2 статуса в основных клинических испытаниях адъювант-ной анти- HER2 терапии (Piccard-Gebhart, 2005 ; Romond, 2005). Дальнейшие уточнения указаний ASCO / CAP по определению рецепторов стероидных гормонов (ER / PgR) и экспрессии HER2 опубликованы в 2011 г в Journal Clinical Oncology (Hammond, 2011). Индекс клеточной пролиферации Ki-67 представляет более существенный интерес для точки его стандартизации и воспроизводимости, пока он не находится в фазе уточнения (Viale, 2008).
В пределах предложенной классификации Ю-67 особенно важен в разделении «Люминального А» и «Люминального В» (HER2-негативного) подтипов. Если надежная и надежная оценка индекса Ю-67 не доступна, в качестве альтернативы оценки пролиферации может быть оценка гистологической злокачественности.
Панель поддержала клинико-морфологи-ческое определение рецепторов эстрогенов, прогестерона, HER2, Ю-67 как важнейшие признаки для определения подтипов РМЖ, но не поддержала включение тестов на цитокератины
5/6 или EGFR / HER1 для защиты «Базаль-но-подобных» опухолей.
Одобренные клинико-патоморфологические оцениваются как подходящая, хотя и временная альтернатива «формальному» субтипированию. Панель пока не настаивает на мультигенной оценке при определении опухолевого подтипа, хотя оналема в некоторых ситуациях. Подчеркивается, что клинико-морфо-логические маркеры, описанные выше, обычно достаточны для практических рекомендаций и планирование лечения РМЖ (В.Ф. Семиглазов и соавт, 2012).
Таблица 1. «суррогатное» (иммуногистохимическое [иГХ]) определение подтипов рака молочной железы. (Санкт-Галлен, 2011) [Goldhirsch et al., 2011].
Биологический подтип (РМЖ) Клинико-патоморфологическое определение (иГХ) Примечание
Люминальный А «Люминальный А»: ER и / или PgR — положительный (согласно рекомендациям ASCO / CAP (2010).HER-2 / neu — негативный (ASCO / CAP) Ki-67 низкий (<14%). Местный и локальный контроль качества окрашивания на Ki-67 является важным.
Люминальный В ** «Люминальный В (HER-2 — негативный)»: ER и / или PgR — позитивный, HER-2 / neu — негативный. Ki-67 высокий (> 14%) Гены, показательная пролиферация, являются маркёрами плохого прогноза при генном профилировании (множественные генетические тесты) [Wirapati, 2008]. Если нет возможности определить Ki-67, некоторые альтернативные оценки опухолевой пролиферации, такие как степень злокачественности, могут быть использованы для отличия «Люминального А» от «Люминального В (HER-2 / neu — негативного)»
«Люминальный В (HER-2 -позитивный)»: ER и / или PgR — позитивный, любой Ki-67, HER-2 — сверхэкспрессирован или амплифи-цирован.-терапия могут быть показаны.
Erb-B2 сверхэкспрессирующий «HER-2 — позитивный (не люминальный)»: HER-2 сверхэкспрессирован или амплифи-цирован. ER и PgR отсутствуют.
Базально-подобный рак «Трижды негативный (дуктальный)»: ER и PgR отсутствуют. Опухоль HER-2 — негативная. Приблизительно 80% частичного совпадения между «трижды негативным» и «базальным» подтипами РМЖ. Но «трижды негативный» включает также некоторые особые гистологические типы — такие как медуллярную карциную и железисто-кистозную карциную с низким риском отдаленных метастазов.Окрашивание на базальные кератины, хотя и показано для того, чтобы помочь определить истинно базально-подобные опухоли, всё же считается достаточным для широкого использования.
* — этот показатель значения № 67 получен при сравнении его данных генного анализа пролиферации прогностического фактора (Ср1е-ang, 2009). Оптимальные разделительные срезы показателей Ю-67 для предсказания эффективности эндокринотерапии или цитотоксической терапии могут рассматриваться.2 гены.
методы исследования
В работе проанализирована база данных Ракового регистра отделения опухолей молочной железы. База данных включает информацию о больных, получавших лечение в НИИ Онкологии им. Н.Н. Петрова и в Санкт-Петербургском Клиническом онкологическом диспансере с 2000 по 2011 годы. На 2012 год в базе данных зарегистрировано 5102 больных РМЖ. В базе данных пересмотрена следующая информация: возраст на момент операции, мультифокальность муль-тицентричность опухоли, гистологический тип, стадия заболевания согласно рекомендациям 7 обследований AJCC [Edge, 2010], степень гист злологической качества, инвазии лимфатических сосудов и выраженного внутри-протокового компонента, уровень экспрессии ER, PR, HER2, вид предоперационного лечения, размеры опухоли, определяемые клинические и по данным маммографического и ультразвукового исследования, объем хирургического лечения, вид адъювантного лечения, жизненный статус на протяжении 10-летнего периода наблюдения (жива, умерла, причины смерти , местно-регионарный рецидив [дата], отдаленные метастазы [дата, локализация].
Данные для расчета показателей безрецидивной и общей выживаемости больных были получены посредством прямых телефонных контактов с больными или их родственниками, а также из базы данных льготных категорий населения, базы данных ЗАГС’ов и МВД Санкт-Петербурга.
Распределение по подтипам РМЖ
В окончательный анализ из общей группы было включено 1188 больных РМЖ I-II стадий (T1-3N0M0 — 54,5%, T1-2N1M0 — 45.5%).
После разделения на биологические подтипы больные распределились следующим образом (рис. 1):
1188 больных, вошедших в анализ, 369 больных РМЖ IIIa-IIIb стадий не средиоадъю-
Рис.1 Принадлежность больных, вошедших в исследовании, к различным биологическим подтипам РМЖ (Нии Онкологии им. Н.Н. Петрова).
■ Люминальный-А — 461 (38,8%)
■ Люминальный-В (HER2-негативный) — 275 (23,1%)
■ Люминальный-В (HER2-позитивный) — 137 (11,5%)
■ HER2-сверхэкспрессирующий (не-люминальный РМЖ) — 90 (7.6%)
■ Трижды-негативный — 225 (19%).
вантное лечение.
51 больная получила неоадъювантную гормонотерапию (ингибиторы ароматазы).
298 больных неоадъювантной химиотерапией схемами, содержащими антраци-клины и таксаны (АТ, ТАС, ТС).
результаты
Среди 1188 больных, включенных в исследование, местно-регионарные рецидивы были выявлены у 22 больных.При люминальном-А подтипе местно-регионарные вторичные опухоли выявлены у 3 больных из 461 (0,6%), при люминальном-В НЕК2-положительном у 3 из
Табл.1 Виды хирургического лечения.
Люм-А Люм-В HER2-нег Люм-В HER2-поз HER2-сверхэкспр. Трижды-негативный
Радикальная мастэктомия 303 (65,7%) 211 (76,7%) 107 (78,1%) 79 (87,7%) 172 (76,4%)
Органосохраняющая операция 145 (31.3%) 61 (22,2%) 27 (19,7%) 10 (11,1%) 46 (20,4%)
Реконструктивно-пластические операции 13 (3%) 3 (1,1%) 3 (2,2%) 1 (1,2%) 7 (3,2%)
275 больных (1%), при люминальном-В HER2-сверхэкспрессирующем у 4 из 137 больных (2,9%), при трижды-негативном у 7 из 225 больных (3,1%). Максимальная частота местно-регионов-онарного рецидивирования наблюдалась при HER2-сверхэкспрессирующем РМЖ и составила 5% (5 из 91 больного) [табл.2].
В табл. 2 представлены данные, отражающие частоту местно-региональных рецидивов в зависимости от биологического подтипа и объема хирургического лечения.
Таким образом, при трижды-негативном, HER2-сверхэкспрессирущем и люминальном-В (HER2-положительном) подтипах РМЖ риск местно-регионального рецидивирования является наиболее высоким после выполнения органосохраняющей операции, так и после ма-стэктомии.При люминальном-А подтипе не было зарегистрировано ни одного местно-регионального рецидива после выполнения мастэк-томии, после выполнения органосохраняющей операции частота местно-региональных рецидивов равна 1,8%. При люминальном-В (HER2-отрицательном) РМЖ частота местно-региональных рецидивов составляет 0,4% и 3,1% после выполнения мастэктомии и органосохраняющей операции, соответственно.
Потенциал к отдаленному метастазированию является одним из важных признаков биологического подтипа РМЖ, определяя в конечном итоге выживаемость больных.Всего из 1188 больных отдаленные метастазы в различные органы были выявлены у 139 больных. При люминальном отдаленном А РМЖенные метастазы выявлены у 23 больной из 461. В группе
люминального-В (HER2-) РМЖ отдаленные метастазы были выявлены у 39 из 275 больных. Таким образом, относительный риск развития отдаленных метастазов для люминального-В HER2-отрицательного подтипа по сравнению с люминальным-А равнялся RR = 2,8 [р <0,005]. При люминальном-В (HER2 +) отдаленные метастазы были выявлены у 20 из 137 больных, при HER2-сверхэкспрессирующем у 21 из 90 больных, при трижды-негативном у 36 из 225 больных.Таким образом, значение относительного риска для люминального-В HER2-положительного РМЖ составило RR = 2,95 (р <0,005), трижды-негативного RR = 3,26 (р <0,005), и максимален для HER2 - сверхэкспрессирующего (не люминаль-н РМЖ). ) отрицательного, составляя RR = 4,7 (р <0,005).
Другим важным отличием между биологическими подтипами РМЖ является локализация отдаленных метастазов. Так при люминальном-А подтипе чаще наблюдалось метастазирование в кости, и не было зарегистрировано ни одного случая метастатического поражения головного мозга.При люминальном-В (HER2-) подтипе по сравнению с люминальным -А возрастная частота висцеральных метастазов и реже наблюдалось метастатическое поражение костной системы. Наиболее часто метастатическое поражение головного мозга наблюдалось при HER2-сверхэкспрессирующем и люминальном-В HER2-положительном РМЖ, достигнув 15% и 10%, соответственно. Поражение скелета при HER2-сверхэкспрессирующем РМЖ наблюдалось значительно реже и не превышало 9%. У больных люминальным-В РМЖ с гиперэкспрессией
Табл.2. Частота местно-региональных рецидивов в зависимости от характеристик к биологическим различным подтипам РМЖ
люм-А 461 больная люм-В ИБК2-нег 275 больных люм-В ИБК2-поз 137 больных ИБК2-сверхэкспр 90 больных. Трижды-негативный 225 больных
Число больных Число рецидивов г? Число больных Число рецидивов г? Число больных Число рецидивов г? Число больных Число рецидивов г? Число больных Число рецидивов г?
Мастэктомия 303 0 0 211 1 0,4 107 2 1,8 79 4 5 172 3 1,7
Органосохра-няю-щая операция 158 3 1,8 64 2 3,1 30 2 6,6 11 1 9 53 4 7,5
Табл.3 структура органной локализации отдаленных метастазов при различных подтипах РМЖ
локализация отдаленных метастазов
локализация mts N Кости n,% Мягкие ткани n,% Висцеральные mts n,% Головной мозг n,%
люминальный-А n = 461 23 13, 56% 4, 18% 6, 26% 0
люминальный-В HER2-отрицательный n = 275 39 15, 38% 7, 18% 16, 41% 1, 3%
люминальный-В HER2-положит n = 137 20 7, 35% 3, 15% 8, 40% 2, 10%
HER2-сверхэкспрессирующий n = 90 21 2, 9% 4, 19% 12, 57% 3, 15%
трижды-негативный n = 225 36 8, 21% 7, 19% 19, 55% 2, 5%
HER2 с более высокой частотой метастазирования головного мозга с больными люминальными-В HER2-негативными опухолями (10% против 3%, р <0.05) [Табл.3]. Висцеральные метастазы наиболее часто выявлялись при трижды-негативном и HER2-сверхэкспрессирующем РМЖ, достигнув 55-57% всех отдаленных метастазов.
На рис.2 показаны кривые общей выживаемости больных всех биологических подтипов РМЖ. Самые высокие показатели 10-летней выжива-
емости наблюдаются при люминальном-А подтипе. 90% больных переживают 10 лет после лечения.Выживаемость больных люминальным-В HER2-отрицательным РМЖ статистически достоверно выше, чем выживаемость больных остальных подтипов РМЖ. Статистически достоверных различий в выживаемости больных люминальным-В HER2-положительным, HER2-сверхэкспрессирующим и трижды-негативным РМЖ не наблюдается. 10-летняя выживаемость в этих группах не выше 45% (р> 0,5)
Рис. 2 Общая выживаемость больных РМЖ в зависимости от принадлежности к различным биологическим подтипам (Каплан-Мейер)
о Полная цензура
1 TSS • r -rr •
1 4rni- Г 1 — 1 la; — 1 j О ~ 1
и
5ГУ 1000 1500 2000 Время ¡дни)
2500
Значение р при сравнении люминального А подтипа с остальными подтипами <0.Е Р 2-п о л)
— HER2-н о постельный
— ■ Трижды-негативный
Рис. 3 Общая выживаемость больных РМЖ стадии рT1N0M0 и рT2N0M0 в зависимости от биологического подтипа (Каплан-Мейер)
В связи с тем, что распределение больных по стадиям при различных подтипах заболеваниях, нами отдельно проведен анализ общей выживаемости при самых ранних стадиях заболевания (pT1N0M0 и pT2N0M0) [рис.3].
При стадии заболевания T1N0M0 и T2N0M0 больные люминальными подтипами имеют хороший прогноз заболевания. 10-летняя общая выживаемость больных люминальным-А подтипом достигла 98%. Отличия между группами люминального-А и люминального-В и остальными подтипами являются статистически достоверными (p <0,05). Отличия между двумя люминальным-В подтипа недостоверны (p = 0,55).
В группе трижды-негативного и HER2-сверх-экспрессирующего РМЖ показатели выживаемости даже при самых ранних стадиях заболевания были значительно хуже, чем при остальных подтипах, и не превышали 55% при 10-летнем периоде наблюдения.
заключение
Подтверждено, что определение ИГХ подтипов РМЖ эффективно в индивидуальном прогнозировании заболеваний.
Наиболее благоприятный прогноз и высокие показатели выживаемости при люминальном-А подтипе РМЖ и чуть хуже
при люминальном-В (HER2-отрицательном).Агрессивное течение заболевания с быстрым развитием висцеральных метастазов и поражением головного мозга наблюдалось при HER2-сверхэкспрессирующем и трижды-негативном РМЖ.
В настоящее время отсутствуют данные функции клинических испытаний III фазы роли подтипов как инструментаывающего пользы химиотерапии. Оценки генной экспрессии (массивы экспрессии генов) воспроизводимы и могут быть выражены количественно, но их стоимость ограничивает широкое их применение.Получение результатов, близких к оценке генной экспрессии в настоящее время возможно, используя фиксированный в парафине материал опухоли с последующим иммуногистохимиче-ским окрашиванием.
ЯиТЕРАТУРА
1. Семиглазов В.Ф., Манихас А.Г., Семиглазова Т.Ю., Бессонов А.А., Семиглазов В.В. Неоадъювантная системная терапия рака молочной железы. (руководство) Аграф, 2012. — 112 стр.
2.Семиглазов В.Ф., Семиглазов В.В., Дашян Г.А. Эн-докринотерапия раннего рака молочной железы. Руководство. М., «МЕДпресс-информ». — 2011 г. — 96 стр.
3. Семиглазов В.Ф., Семиглазов В.В., Манихас А.Г. Рак молочной железы. Химиотерапия и таргетная терапия. М., «МЕДпресс-информ». — 2012. — 360 стр.
4. MCU Ченг, Чиа С.К., Водук Д., Гао Д., Люнг С., Снайдер Дж., Уотсон М., Дэвис С., Бернард П.С., Паркер Дж. С., Перу С.М., Эллис М.Дж., Нильсен ТО.Индекс Ki67, статус HER2 и прогноз пациентов с раком молочной железы в просвете B. J Natl Cancer Inst. 2009. — Том 101. — P.736-750
5. Голдхирш А., Вуд В. К., Коутс А. С. и др. Стратегии для подтипов — работа с разнообразием рака груди: основные моменты Санкт-Галленского международного экспертного консенсуса по первичной терапии раннего рака груди 2011 г. Ann Oncol. 2011 Август. -Том 22 (8). — С. 1736-1747
6.Хаммонд МЭ, Хейс Д.Ф., Вольф AC. Клиническая заметка для Американского общества клинической онкологии — Колледжа американских патологов — руководящие рекомендации по тестированию ER / PgR и HER2 при раке груди. J Clin Oncol 2011. — Vol. — 29. pp. 1152-1162, на сайте http: //ico.ascopubs.
org / cgi / doi / 10.1200 / JCQ.2011.35.2245.
7. Perou CM, Sorlie T., Eisen MB et al. Молекулярные портреты опухолей груди человека.Nature 2000; — Т.
— 406: с. 747-752.
8. Пиккарт-Гебхарт М.Дж., Проктер М., Лейланд-Джонс Б. и др. Трастузумаб после адъювантной химиотерапии при HER2-положительном раке молочной железы. N Engl J Med 2005; — Т. — 353: с. 1659-1672.
9. Romond EH, Perez EA, Bryant J, et al. Трастузумаб плюс адъювантная химиотерапия операбельного HER2-положительного рака молочной железы.N Engl J Med 2005; — Т. — 353: 1673-1684.
10. Viale G, Regan MM, Mastropasqua MG et al. Прогностическая ценность экспрессии Ki-67 в опухоли в двух рандомизированных испытаниях адъювантной химиоэндокринной терапии рака молочной железы без лимфоузлов. J Natl Cancer Inst 2008;
— Т. — 100: С. 207-212.
1, 2, 3, 4, что говорят врачи, какой реальный прогноз для пациентов, виды раковых образований и способы лечения
Врачи сталкиваются с разными формами рака молочной железы, одни из менее опасных, а вторые с трудом поддаются лечению.
При трижды негативном раке молочной железы у пациентов после удаления опухоли средней выживаемости всего полгода. Такие прогностические данные из-за очень быстрого прогрессирования патологии и метастазирования.
Чтобы диагностировать болезнь на ранней стадии, на сегодня огромное число ученых изобрели разные инструментальные и лабораторные методы.
Из всего количества женщин с онкологией молочной железы, только у десяти или пятнадцати процентов диагностики трижды негативный рак.Эта болезнь является злокачественным новообразованием груди, при опухоль не имеет рецепторов к гормонам.
Из-за этого возникают некоторые трудности подборе эффективных методов терапии негативной карциномы. При ТНРМЖ новообразование продуцирует ложные гормоны. Роль обманщиков женского организма работают псевдогормоны, которые иммунитет принимает за настоящие.
Это приводит к тому, что онкоклетки стремительно делятся, но гормональная терапия против них бессильна.
Причины
Ученым еще не выяснить точные причины, по которым были созданы злокачественные образования внутри груди.
Онкологи пришли к выводу, что развитие онкологии грудных желез начинается под воздействием:
- сильной гормональной перестройки, например, в период менопаузы;
- раннего начала менструаций;
- чрезмерной выработки яичников женских гормонов;
- попадания множества гормонов в организм при гормонотерапии или приеме гормональных контрацептивов;
- искусственного прерывания беременности, особенно первой;
- отказа от грудного вскармливания;
- первых родов после тридцати пяти лет.
К негативной карциноме также наследственная предрасположенность, пагубные привычки, ожирение, травмы груди. Есть случаи, когда трипл-отрицательная карцинома начинала свое развитие груди после облучения образований другой локализации.
Особенности патологии
ТНРМЖ или трипл-отрицательный рак это одна из разновидностей карциномы. Особенности триждыного рака в том, что он обладает быстрым прогрессированием, ранним метастазированием, плохим рецидивом, плохим прогнозом.Метастазирование ТНРМЖ происходит еще на начале развития патологии.
Новообразование при тройной негативной карциноме растет очень быстро из-за взаимодействия РП и ЭР рецепторов с половыми гормонами женщины, вырабатываемыми в яичниках.
При воссоединении псевдогормонов опухоли с женскими гормонами, возникает химическая реакция, превращающая настоящие гормоны в катализаторы роста.
У опухоли такого рака нет рецепторов к прогестерону, эстрогену, а также эпидермальному фактору роста HER 2 / neu, поэтому онкопатология и имеет такое название.ТНРМЖ возникает только у женщин чаще в молодом возрасте.
Для лечения заболеваний не назначается медикаментозная гормонотерапия, хирургическое вмешательство часто противопоказано из-за поздней стадии на момент диагностики. Чтобы улучшить будущий прогноз, нужно диагностировать болезнь на этапе формирования. Сделать это можно, только если знать симптоматику негативной карциномы.
Классификация
В онкологии классификация тройного рака молочной железы проводится по гистологическому негативному строению новообразования.Негативная карцинома может быть:
- Базальноподобной. Данная форма болезни диагностируется в семидесяти пяти процентах случаев. Такой рак легче поддается лечению и более благоприятный прогноз.
- Небазальноподобной. Встречается в оставшихся двадцати процентах случаев и может быть апокриновой или плоскоклеточной карциномой. Течение болезни более агрессивное, прогноз неблагоприятный.
По степени дифференцировки тканей трижды негативный рак груди не классифицируется, так как всегда новообразование трудно поддается дифференцировке.
Степени развития
При трипл-отрицательном раке груди стадия определяется с учетом размера опухоли, лимфоузлов и наличия отдаленных метастазов.
Негативная карцинома имеет четыре стадии развития:
- Во время начальной стадии новообразования не вырастает больше трех сантиметров и не покидает пределы первичной локализации.
- При трижды негативном раке молочной железы 2 стадии образования в диаметре не больше пяти сантиметров и инфильтпует в подкожную клетчатку, но не метастазирует.При второй стадии новообразования может быть меньше, но тогда будет поражено до трех региональных лимфоузлов.
- Третья стадия отличается диаметром образования больше, чем пять сантиметров. Онкоклетки на этом этапе проникают в мышцы, но не распространяются через лимфатическую систему.
- Диаметр узла на четвертой стадии может быть любым, но раковый процесс по телу кровотока или лимфотоком. Метастазы обнаруживаются в дальних органах, костях, мозге.
Чем раньше будет поставлен диагноз, тем больше шансов у пациентки на положительный прогноз.Своевременно выявить наличие патологии молочной железы можно, если знать симптоматику болезни. Это дает шанс обратиться к врачу при первых признаках тройного негативного рака.
Симптомы
Общие признаки заболевания других видов рака груди, но патология развивается намного быстрее. Первая стадия негативной карциномы практически не сопровождается симптоматикой.
Первое, что может построить женщина — наличие в тканях железы опухоли плотной консистенции.Но для этого необходимо периодически проводить пальпацию груди. Вскоре новообразование начинает быстро расти и становиться болезненным.
Помимо этого, развивается такая клиническая картина:
- молочная железа начинает отекать;
- соски втягиваются внутрь;
- кожа над опухолью становится сухой и сморщенной;
- из сосков выделяется кровянистая или желтая жидкость;
- подмышечные лимфоузлы увеличиваются в размере.
По мере того как негативная карцинома прогрессирует, начинается распад опухоли, что приводит к интоксикации организма. Это сопровождается стойким повышением температуры тела, отвращением к еде, потерей массы тела и истощением (кахексией).
Методы диагностики
Начинается диагностика негативного рака со сбора анамнеза и выслушивания жалоб пациентки. После этого врач проводит осмотр и пальпацию молочных желез, а также ближайших лимфатических узлов. Во время осмотра оценивается симметричность грудей, состояние кожного покрова, наличие уплотнений и выделений из сосков.Далее больная направляем на лабораторные и инструментальные исследования.
При постановке диагноза важно провести диагностическую диагностику, так как симптоматика болезни может быть схожа с признаками других патологий груди.
Виды анализов при негативном раке
Для постановки диагноза проведение лабораторных исследований. Анализы определяет наличие в крови определенных раковых маркеров — специфических белков, вырабатываемых опухолью.
При раке груди появляются онкомаркеры:
При наличии таких маркеров необходимо взять на цитологическое исследование жидкость, которая выделяется из сосков. Цитология направлена на выявление онкоклекок и папиллярных структур, если есть внутрипротоковые папилломы.
Забор биоматериала для цитологии проводится посредством проведения биопсии. Она может проводиться безопасными способами:
- тонкоигольным аспирационным — с помощью тонкой иглы;
- прицельным — специальными щипцами;
- хирургическим — скальпелем.
Чтобы провести комплексную реакцию клеток новообразования, необходимо проведение тройного теста, включающего исследование на онкомаркеры, цитологический анализ и инструментальные методы.
Инструментальная диагностика
Без инструментальных методов поставить точный диагноз невозможно.
При подозрении на негативную карциному, необходимо проведение:
- маммографии — рентген молочных желез позволяет выявить опухоль, которая не ощущается во время прощупывания тканей груди;
- ультразвукового исследования, компьютерной, а также магнитно-резонансной томографии — позволяют узнать точные размеры и локализацию образования, состояние лимфоузлов, ближайших органов;
- изотопного сканирования — для сейчас отдаленных метастазов.
При метастазировании разных органов могут потребоваться другие инструментальные исследования — ангиография, рентген легких, сцинтиграфия и др.
Дифференциальная диагностика
При негативном раке клиническая картина совпадает с другими онкопатологиями грудной железы. Поэтому необходимо проведение ряда исследований, которые помогут улучшить ТНРМЖ от других опухолей, а также болезней.
Дифференциальная диагностика может проводиться с:
- Внутрипротоковой папилломой.При такой болезни из соска выделяется большое количество жидкости. При постановке диагноза необходимо проведение цитологического исследования, а затем дуктографии.
- Кистой. При кистозном образовании пациентка ощущает боль во время пальпации. Для диагностики проводится ультразвуковое исследование.
- Субареолярным абсцессом. Патология локализуется под ареолой и сопровождается гиперемией кожных покровов.
- Фиброаденомой. Это доброкачественная подвижная опухоль с четкими контурами.Чтобы отличить негативный рак от фиброаденомы, нужно провести УЗИ с тонкоигольной аспирационной биопсией.
- Нарушениями гормонального баланса. Молочные железы в таком случае становятся плотными, дольчатыми или зернистыми. Симптоматика усиливается перед наступлением менструации.
Только после дифференциальной диагностики и подтверждения диагноза негативного рака, врач может прописать необходимое лечение.
Способы лечения
Для лечения трижды негативного рака молочной железы не подходит гормонотерапия, как в случае с другими типами онкопатологий груди.В этом случае отсутствуют рецепторы к гормонам, поэтому онкопатология лечится тяжелее.
Наиболее часто патология выявляется на запущенном этапе. Нужна комплексная терапия, состоящая из операции, химиотерапии, гомеопатии.
Для купирования осложнений химиотерапии может быть лечение народными методами.
Схемы терапии
Трижды негативная карцинома является очень опасной в плане прогноза. Болезнь очень агрессивна, она рано метастазирует, поэтому лечение нужно начинать сразу после постановки диагноза.
Схемы терапии всегда выстраиваются индивидуально, с учетом возраста патологии, состояний патологии.
Монохимиотерапия при отрицательной онкологии груди не эффективна, поэтому назначается целый комплекс химических препаратов.
Химиотерапия при ТНРМЖ
При трипл-отрицательной карциноме наблюдается очень хорошая реакция раковых образований к химическим препаратам, поэтому лечение подобрать очень тяжело. Химиотерапия при трижды негативном раке молочной железы назначается на основании проведенных исследований.Таргетные препараты, направлены на борьбу только с онкоклетками, при ТНРМЖ не эффективны, что плохо делает прогноз.
Химиопрепараты назначаются пациенткам циклами, используя лекарства группы таксанов. Только у небольшого количества женщин может наступить выздоровление лишь при помощи химиотерапии, но с условием диагностики болезни на раннем этапе.
Хирургическое лечение
Хирургическое вмешательство позволяет сократить риск рецидива и продлить жизнь больной.Для борьбы с опухолью может пройти проведение:
- Лампэктомии. Это органосохраняющая операция, при которой проводится удаление опухоли, а также окружающих ее тканей любой части железы.
- Квадрантэктомии. Удаление четверти груди, в которой локализовано новообразование.
- Модифицированной радикальной мастэктомии. Операция проводится при распространении онкопроцесса за пределы железы. Операция чревата удалением груди вместе с регионарными лимфоузлами.
- Сегментэктомии.Во время оперативного вмешательства ампутируется сегмент молочной железы.
- Радикальной мастэктомии. Врач вырезает новообразование совместно с лимфоузлами, молочной железой и грудными мышцами.
После любого хирургического вмешательства лучевая терапия, что сокращает риск рецидива.
Гомеопатия
Гомеопатические препараты назначаются пациентом только в качестве лечения. В состав входят травы, оказывающие негативное влияние на онкоклетки.Гомеопатия помогает справиться с болью, позволяет уменьшить размер опухоли. Такая терапия не может заменить основное лечение, назначенное лечение, так как не убивает полностью рак.
Народное лечение
Лечение методами народной медицины является дополнительным, так как оно не способно удалить опухоль.
Для этого может быть:
- Гриб чага.
- Овес.
- Прополис.
- Чеснок, лук.
- Кора дуба.
Также травы и травы, однако они негативно на новообразование, но и на здоровые клетки.
Любая терапия народными средствами должна быть согласовано с лечащим врачом.
Осложнения
Эта разновидность рака это одна из самых опасных патологий груди. Основное осложнение на ранних этапах — метастазирование в разные органы. Последняя стадия осложняется кахексией (очень сильное истощение организма).
В зависимости от локализации метастатических опухолей, может возникнуть асцит, плеврит, легочное кровотечение.Возможны грубые расстройства центральной нервной системы, почечная недостаточность, слепота. Ключнениям приводит терапию онкологии химическими препаратами, а также облучением.
Прогноз и профилактика
Чаще при трижды негативном раке молочной железы прогноз неблагоприятный. Прогностические данные зависят от того, насколько эффективны препараты, которые были назначены врачом во время формирования курса лечения. Также на прогноз влияет онкопатологии на момент диагностики, возраст больной, наличие осложнений.
В качестве профилактики необходимо периодически обследоваться у маммолога, а также проводить пальпацию грудей.
Источник: https://rakuhuk.ru/vidy/trizhdy-negativnyj-rak-molochnoj-zhelezy
Сколько живут с раком молочной железы 1-4 степени?
К понятию рака молочной железы относится целый ряд различных злокачественных образований. Тип рака зависит от размеров первостепенного повреждения, места его расположения, прогресса в росте опухоли, наличия метастазов.В зависимости от всех этих факторов производится прогноз способов лечения, а также ставится прогноз выживаемости пациента.
Выживаемость в зависимости от степени развития карциномы
Эквивалентом эффективного излечения от рака молочной железы принято считать продолжительность жизни, равную 5 годам. Общее число, сколько осталось выживших после постановки такого диагноза в течение 5 лет, составляет половину пациентов, при условии применения лечебных мер.В случае отсутствия должного лечения, коэффициент составляет не более 15%.
Показатель агрессивного типа онкологического образования, определяющийся маркером Her2neu, который выявляется у 20-30% пациентов.
Прогноз на 5 лет
Выживаемость при раке молочной железы у пациентов также зависит от стадии развития опухоли, которой отмечается 4:
- Первое возникновение опухолей не более 2 см в диаметре.Воспалительные процессы в лимфатических узлах полностью отсутствуют. Выживаемость, по прогнозу, составляет 70-95%.
- Вторая условно разделяется на 2а и 2b. При 2 степени прогресса заболевания, воспаление до 5 лимфатических узлов в зоне подмышек, при этом сама опухоль имеет размер, не превышающий 2 см в диаметре. Степень 2b характеризуется ростом онкологического образования, вплоть до 5 см, отсутствующими при этом поражением сердечно-сосудистой системы.Прогноз на 5 лет составляет 50-80%.
- Третья выражается разрастанием опухолевого образования более 5 см, с сопутствующими поражениями лимфатических узлов и возможными метастазами в области грудной клетки и кости. Выживаемость при такой степени тяжести недуга составляет 10-50%.
- Четвертая сопровождение значительным разрастанием опухоли до произвольных размеров. Метастазы проникают в большом количестве органов и систем тела, таких как кости, желудок, печень, кожа, легкие.Степень выживаемости в такой запущенной стадии не выше 10%.
Прогноз на 10 лет
Если процент выживаемости в течение 10 лет, после обнаружения качественного образования, в зависимости от стадии заболевания, он составляет:
- 1-я стадия — 60-80%;
- 2-я составляет 40-60%;
- 3-я стадия — 0-30%;
- 4-я — 0-5%.
Большое значение в оценке прогноза наряду со степенью тяжести имеет наличие и количество метастазов в лимфатических узлах и костях.Так, при проникновении в здоровые части организма, прогноз на 10 лет составляет 75%. При использовании метастазах, выживаемость составляет лишь 25%.
При проникновении в менее 4 лимфатических узлов, прогноз составляет 35%. Но, в случае прогресса рака в ткани четырех и более сосудов или костей, выживаемость не больше 15% от всех случаев.
Операция
Операции по удалению опухолевого образования, части груди или полного удаления молочных желез производят лишь до 4 стадии и при наличии неглубоких метастазов, не затронувших кости и жизненно важные органы.
Прогнозы при отсутствии метастазов после операции, составляют до 96%.
В случае значительного количества проникновений рака вне зоны груди костей и жизненно важных систем, количество процентов составляет на жизнь, лишь после тщательного анализа состояния пациента может установить только врач.
Рецидив
Через некоторое время, формирующий от пары месяцев до нескольких годов, появились симптомы онкологических образований.Рецидивы чаще всего происходит после предшествующего, низкодифференцируемого типа рака.
Нередко рецидивы случаются и после инвазивного протокового рака, поскольку он характерен значительными проявлениями метастазов в области подмышек. Также, появление рецидивов довольно часто происходит удаления опухолей больших размеров.
Процент выживаемости в таких ситуациях напрямую зависит от терапевтических механизмов действия и по длительности составляет 1-2 года.
Место появления патологии
Локализация злокачественного образования в степени влияет на результаты течения недуга, потому как от данного фактора напрямую зависит интенсивность развития метастазов и направление их внедрения в здоровые клетки и кости.
Наибольший процент выживаемости при появлении опухолей в зоне снаружи. Помимо этого, такое месторасположение позволяет операции по удалению аномалии с большей и эффективностью.
В случае возникновения патологий в упомянутых участках велика вероятность появления метастазов. Благодаря проценту выживаемости в этой ситуации, даже в результате весьма успешной операции, значительно падает.
Существует категория пациентов, не приемлющих методы терапии и ищущие лекарства в народных способах. В таких ситуациях, без должного лечения, положительный прогноз на 5 лет не больше 15%.
Виды раковых образований
Одним из основных обстоятельств, характеризующих злокачественное образование в груди, является способность опухоли разрастаться и проникать в другие ткани и органы.Исходя из этого, врачи выделяют несколько типов онкологии груди:
- инфильтративный рак протоков,
- инвазивный дольковый рак,
- воспалительный тип, именуемый низкодифференцируемым,
- гормонозависимый,
- трижды негативный,
- люминальный.
Определение типа молочной железы является весьма важным, поскольку от точной постановки диагноза зависит выбор эффективных терапевтических мероприятий.
Протоковый рак
Инфильтративный рак протоков — это самая частая форма злокачественных образований в груди, которая появляется в 78% заболеваний. На маммографических снимках, инфильтрирующий протоковый рак, имеет форму звезды или круглого пятна с резкими границами.
В случае появления типа опухоли звездообразного, заболевание характеризуется степенью тяжести. Прогноз выживаемости напрямую зависит от степени тяжести болезни, на которой удалось установить диагноз.Так, на 1 стадии он составляет 91,8%, при 2 — 64,5%, на 3 стадии — 42%.
В случае крайней запущенности, лишь с помощью упорного лечения можно добиться результата в 28%.
Дольковый рак
Инвазивный дольковый рак появляется в виде уплотнения небольшой толщины в верхней зоне участка груди.
Образования нередко чувствительны к женским гормонам, потому что гормонотерапия в большинстве случаев долькового рака, при не запущенных формах болезни весьма эффективна.Однако, учитывая факт трудностей диагностики недуга в ранней формех, хороший прогноз дается не часто.
Основными средствами ранней диагностики долькового рака можно назвать труднодоступное место локализации опухоли, а также весьма нерегулярные профилактические меры.
При начальных стадиях инвазивного долькового рака, он составляет 54%, Поздние стадии онкологии дольковой карциномы с наличием глубоких метастазов в кости, кожу, легкие, печень, позволяют прогнозировать длительность до 3 лет, после обнаружения недуга в 2-12% случаев.
Воспалительный вид
По многим факторам, низкодифференцированный рак идентичен с маститом. Однако достаточно агрессивной формы карциномы. Болезнь в начальных степенях образования, после оперативного назначения лечения дает положительный прогноз в 45% случаев низкодифференцированного рака молочной железы.
Гормонозависимый
этот тип онкологического заболевания сопровождается появлением достаточно размытой симптоматики в начале появления, появляется чаще всего на 2-3 стадии.Прогноз при длительном курсе лечения гормонами составляет 27%. В случае рецидива прогноз на выживание поставить невозможно.
Трижды негативный
Тройной негативный рак груди, при должном лечении на начальной стадии, позволяет получить прогноз в 77% выживаемости груди. При 2 степени тяжести заболевания, удается достичь 42%.
А в случае запущенных форм трижды негативного рака, максимальный прогноз достижения 9%. Однако, трижды негативный рак груди, представляет собой весьма агрессивное образование.
По причине высокой скорости негативной карценомы, развития ее удается, в большинстве случаев, лишь на поздних стадиях.
Однако на данный момент известны некоторые подтипы тройной отрицательной карценомы. Врачи еще не сумели собрать достаточно данных для выделения этих видов негативного рака в отдельных группах.
Уже известно, что у значительного процента исследуемых, трижды отрицательный рак, имеет форму не агрессивного характера.
Этот факт способен повысить показатели выживаемости при наличии образований трижды отрицательного типа.
Люминальный
Люминальный тип рака молочной железы условно разделяется на 2 подвида: А и В. Тип А имеет высокий процент выживания благодаря чувствительности к гормонотерапии.
На начальных стадиях прогноза при люминальном раке составляет 94%. Тип В, наиболее агрессивной формой недуга, часто бывает склонен к рецидивам в большинстве случаев.
Прогноз при данном виде люминального рака составляет не выше 46%.
Существует немало видов раковых заболеваний, поражающих молочные железы и часто продуцирующие метастазы в жизненно важные органы и кости. Дать универсальный точный прогноз развития недуга и степени выживания после него весьма трудно.
Успех лечения любого из онкологических образований, будь то дольковый, трижды отрицательный или иной возможный рак, во многом зависит от предпринятых профилактических мер.Важно оперативное обращение за медицинской помощью, выбор метода терапии, а также общее состояние здоровья и психологический настрой.
Необходимо помнить, что даже самый небольшой процент успеха, это шанс на жизнь.
Источник: http://GormonOff.com/zabolevanija/onkologiya/skolko-zhivut-s-rakom-molochnoj-zhelezy-1-4-stepeni
Негативный рак молочной железы: как с ним бороться?
Раковым новообразованиям грудной железы принадлежит первое место в структуре женской онкопатологии.
Врачи привыкли связывать это с тем, кто во всем мире плохая экологическая обстановка, да и к тому же, в последние десятилетия женщины слишком часто принимают оральные контрацептивы.
Принято считать, что риск возникновения и последующего развития опухоли увеличивается во много раз из-за того, что женщины долгое время принимают гормональные контрацептивы.
Трижды негативный молочной железы вполне вероятно выявить в 1 / 6-1 / 4 всех видов новообразования органа.Причем, выявление такой разновидности опухоли стало возможным после того, как в клиническую практику практикуется внедрено иммуногистохимическое исследование.
Что это такое?
Трижды негативный рак молочной железы (ТНРМЖ) представляет собой отдельный подтип онкозаболевания груди, характеризующийся особо агрессивной формой протекания. Цифры неутешительны: каждый год из всего количества женщин, которые страдают от рака молочной железы, 10-15 процентов страдают именно от ТНРМЖ.
Часто используемый термин «тройной негативный» был поначалу использован в обиходе онкологов. Он свидетельствует о том, что злокачественная опухоль, которая находится внутри груди пациентки, сама может быть в организме человека белковых соединений:
- эстроген;
- гормон эпидермального роста;
- прогестерон.
В медицине такие белки маркируют как рецепторы. Он имеют такие сокращения: ЭР, НЕR2 и ПР.
После того, как пациентка сдала все необходимые анализы, материал, который был получен в результате процедуры биопсии, используется исследуется для того, чтобы найти в тканях образовавшейся опухоли именно эти белки.
От того, каков будет результат исследования, и будет зависеть дальнейшее лечение и перечень медицинских препаратов, которые используются при этом, потому что рецепторы встроены во внутренние раковые клетки.
Смотрим в корень проблемы
Злокачественное образование в груди
Тройной негативный рак молочной железы является одной из разновидностей качественного образования, и он довольно агрессивен. Если рассматривать его со стороны иммуногистохимического исследования, то в этом новообразовании нет мишеней или рецепторных образований к гормонам — эстрогену и прогестерону.Не чувствительна эта опухоль и к HER-2 / NEU.
чувствительности атипических раковых тканей в этом случае отсутствует лечение трижды негативного рака молочной железы.
Это связано с одним условием: если нет рецепторных образований, гормонотерапия помочь не справиться.
Если трижды негативный рак молочной железы, то можно охарактеризовать отсутствием лечения HER-2 / NEU, то применить герцептин (а это основа рака и современной терапии, необходимой в этом случае) невозможность лечения.
Рак будет развиваться очень быстро, если у новообразования фенотип трижды негативного. Намного ума передается в этом случае и значение скрининга, проходящее от одного профилактического осмотра до другого, опухоль может разрастаться.
Немного подробнее о серьезном заболевании
Тройной негативный рак молочной железы доктора называют еще карциномой. Такой рак разрастается довольно быстро из-за взаимодействия рецепторов ЭР и РП с половыми гормонами — эстрогеном и женщины прогестероном.А последнее выработать женский организм при помощи яичников.
В тот момент, когда половые гормоны женщины вступают в соединение с псевдогормон рецепторами ЭР и РП (их вырабатывает раковая опухоль), между ними возникает химическое взаимодействие. Итогом является то, что настоящие гормоны становятся катализаторами онкологического заболевания, запуская возможность того, что раковые клеточки начинают активно делиться.
Именно из-за возникновения такой процесс роста ненужного образования внутри женской груди увеличивается в разы.
Росполь обманщиков женского организма, которые вырабатывает опухоль. Это рецепторы эстрогена и прогестерона. К сожалению, иммунная система не научилась распознавать их вредноносность, снабжение этого и начинается химический контакт с реальными половыми гормонами.
Рецептор HER2 представляет собой ложный гормон роста. Если его слишком много в женском организме, что запускается процесс хаотичного деления клеток рака.
Зная всю эту информацию, можно сделать неутешительный вывод: злокачественная опухоль вполне может обеспечить себя значительным ростом и развитием.
И чем лучше яичники будут вырабатывать эстроген и прогестерон, тем быстрее будут расти злокачественные новообразования внутри женской груди.
На пути к выздоровлению
Лечение этой страшной болезни может проходить тремя путями:
- хирургическим;
- химиотерапией;
- лучевой терапией.
Рассмотрим каждого из них подробнее.
- Хирургическое. Как правило, лечение такого рака начинается с удаления опухоли хирургическим путем. Это делают люмпэктомией (то есть, удалением опухоли и окружающих тканей) либо мастэктомией (частичным либо полным удалением груди).
- Лучевая терапия. После того, как трижды негативный рак молочной железы подвергся хирургическому вмешательству, в значительном количестве случаев дальше лечения продолжается облучение ложа опухоли и региональных путей лимфооттока, дабы уничтожить оставшиеся раковые клетки.
- Химиотерапия. В этой системе опухоли нет рецепторов ЭР, РП и HER2, чтобы применить гормональное лечение и таргетную терапию, которая направлена на блокирование рецептора HER2, при таком заболевании нецеллюлозно. Поэтому использование возможности лечения в этой ситуации является именно химиотерапией. Причем, системная. Это означает, что когда препарат вводится в систему, проходит через кровоток, он проходит по всем частям тела и уничтожает раковые клетки, которые проходят через пределы молочной железы.
Химиотерапия этого рака, равно как и при остальных онкологии молочной железы, дается пациенткам циклами. То есть, период, во время которого вводят в организм препараты, чередуется с периодом, когда в их применении наступает перерыв. В это время показатели крови успевают восстановиться.
Лечение трижды негативного рака молочной железы при помощи химиотерапии, как правило, продолжается от нескольких месяцев до года. Срок будет зависеть от принимаемых пациенткой препаратов и от того, как он их переносит в процессе лечения.
С рассматриваемым видом рака можно связать и «ренессанс» цисплатины. Это препарат, который практически повсеместно применяется в восьмидесятых веках для спасения от этого заболевания. В последние три десятилетия его применение ограничило лечение пациенток со страшным диагнозом — рак молочной железы (или как его называют иногда обыватели — грудной рак). Это произошло из-за того, что токсичность препаратов была высока, высокая эффективность наблюдалась только у небольшого количества пациенток.
И все же, со временем, были собраны доказательства того, что использование цисплатины при ТН опухолях более чем эффективно. Поэтому препарат был возвращен в арсенал других лекарств, которые применяют при излечении от рака молочной железы.
Трижды негативный молочной железы: прогноз на жизнь
В общем и целом прогноз на полное излечение при таком сложном заболевании является намного более положительным, нежели при обычной опухоли, которая не может быть устойчивой к гормональной терапии.Здесь надо обращать внимание на ряд факторов:
- выявить опухоль вовремя, на ранней стадии;
- сдать анализы на предмет наличия рецепторов ЭР, ПР, HER2;
- насколько быстро женщине удалили опухоль хирургическим путем;
- возраст пациентки и жизненные ресурсы ее организма;
- эффективны препараты, которые были назначены врачом во время проведения курса лечения.
Для того, чтобы прогнозировать полное излечение, как можно более благоприятным, лечение ТНРМЖ должно проходить так же быстро и агрессивно, каким является и само заболевание.
Такой подтип рака груди чаще всего встречается у женщин, которые перешагнули тридцатилетний рубеж. Прогноз внушает некоторый оптимизм: в 1/3 случаев пациентки сумели победить болезнь.
9000 Здесь речь идет о тех женщинах, у которых новообразование выявили на ранней стадии.
На сегодня огромное количество лабораторий мира, главной целью которых является серьезное сражение с онкозаболеваниями, занимаются четким изучением природы возникновения триждыного рака груди.
У ученых пока нет на вопрос, почему же внутри абсолютно здоровой молочной железы начинается внезапное и быстрое перерождение клеток, которые преобразовывают в опухоль, способную вырабатывать псевдогормоны, полностью повторяющие натуральные половые гормоны женщины. Сейчас уже создано несколько экспериментальных препаратов, которые подавить выработку рецепторов опухолью.
Источник: https://oonkologii.ru/negativnyj-rak-molochnoj-zhelezy/
Трижды негативный молочной железы: что такое, 2 стадия, прогноз жизни, кто вылечился
Трижды негативный (ТНРМЖ) — агрессивная форма неоплазии груди злокачественного характера.При заболевании отсутствуют рецепторы раковых клеток к прогестерону, эстрогенам и рост эпидермиса. Развитие болезни сопровождается формированием новообразования плотной структуры, изменениями кожи, специфическими выделениями из сосков, деформированием груди.
Для диагностики болезни применяются лабораторные и инструментальные методы. В лечении предпочтение отдается приему цитостатиков, проведении мастэктомии и лучевой терапии.
Описание
Тройной негативный рак молочной железы диагностируется в 10-20 процентах от всех случаев онкологических заболеваний у женщин.Особенность патологии в том, что она преимущественно встречается у женской половины населения в молодом возрасте.
Для подобных опухолевых образований характерна высокая пролиферативная активность, быстрый рост и агрессивное течение. По этой причине повреждение ТНРМЖ как можно раньше.
Классификация
В области онкологии несколько категорий трижды негативного рака.
По чувствительности к медикаментам
. Принимать во внимание чувствительность опухоли к лекарственным препаратам, которые назначают для лечения, то есть заболевание будет иметь 4 формы.
Люминальная А
Формирование раковой опухоли происходит в период менопаузы и зависит от концентрации эстрогенов в женском организме. Именно по этой причине легко поддается лечению при помощи гормональных средств. Прогноз жизни в этом случае будет наиболее благоприятным.
Люминальная В
Данная разновидность болезни имеет предрасположенность к рецидивам. В большинстве случаев диагностируется у женщин репродуктивного возраста. Лечение гормонами в этой ситуации будет не эффективным.
Базальноподобная
Этот тип онкологического процесса составляет 70 процентов карцином с трижды негативным фенотипом. Эта форма относится к самой злокачественной и имеет негативный прогноз.
HER- 2-позитивная
Отличие ее заключается в агрессивности гормонозависимых образований, имеющих внушительные размеры, и распространением в лимфатические узлы.
По гистологическому типу
По данному признаку ТНРМЖ классифицируется также на 4 вида.
Включает в себя группу опухолевых образований, которые имеют общие морфологические признаки. Как правило, диагностировать такую форму рака удается только на последних статях развития.
Медулярный
Внешне новообразования представлены тяжами и широкими полосами. Течение патологического процесса скрытого. Часто заболевание можно спутать с фиброаденомой.
Низкодифференцированный протоковый
Представляет собой эпителиально-протоковую неоплазию.При таком состоянии происходит разрушение мембраны протоков, а также прорастание опухоли в строму.
Аденокистозный
Диагностируется в редких случаях. Отличается низкой степенью дифференциации по гистологическому типу.
Стадии
Как и любой онкологический процесс, трижды негативный рак имеет несколько стадий своего развития.
Первая
Опухоль локализуется в толще железы и достигает размерах не более 3-х сантиметров.Патологические клеточные структуры не распространяются на кожу. Отдаленный вторичный очаг поражения, как правило, отсутствует.
Вторая
На 2 стадии уплотнение может быть до 5 сантиметров в диаметре. При этом новообразования могут поражать клетчатку, но не дают метастазов. В некоторых случаях могут поражаться одиночные лимфоузлы.
Третья
В не объемоплазия больше 5 см. Опухоль прорастает в кожные покровы и проникает в фасциальные мышцы мышц. Однако вторичные очаги в лимфатических узлах также не наблюдаются.
Четвертая
Через кровоток и лимфосистему патологические клетки начинают распространяться по всему женскому организму. В большинстве случаев на этой стадии заболевания не рекомендуется использовать терапию.
Причины
До настоящего времени истинные предрасполагающие факторы трипл-отрицательного рака так и не были выявлены. Формированию онкологического процесса отклонения на генетическом уровне.
Согласно статистическим данным, которые проводились в области маммологии, специалистами была выделена одна из главных причин развития патологии — наследственная предрасположенность.Кроме этого, есть и другие факторы, которые могут спровоцировать формирование качественной опухоли.
Высокая активность онкогена FAM83
Были проведены дополнительные наблюдения, по результатам которых удалось сделать выводы о том, что при повышенной экспрессии этого гена здоровые клетки меняют свое поведение. Такое состояние, как правило, и провоцирует опухоль. Если данный ген удалить, то пролиферация патологических клеток прекращается.
Распространение в отдельные этногруппы
Если придерживаться статистике, то в большей степени заболеваны афроамериканцы.Это объясняется тем, что некоторые наследуемые гены проявляют чрезмерную активность.
Мутация BRCA
Нередко у больных ТНРМЖ диагностируется мутационный процесс в этом гене. Данный участок ДНК в нормальном состоянии обеспечивает контроль за выработкой защитных факторов, которые предназначены для предотвращения перерождения клеток в злокачественные формы.
Рак груди в роду
Если у кого-либо из близких родственников имеется онкопроцесс груди, то риск развития болезни возрастает в несколько раз.
Также специалисты выделяют еще ряд причин, по которому может начать развиваться трижды негативный рак. К ним относят:
- длительное бесконтрольное употребление оральных гормональных противозачаточных средств;
- радиационное облучение;
- нарушение структуры груди;
- патологии, к которым относят лактостаз, мастопатию и галакторею;
- многочисленные аборты.
Также стоит отметить, что возраст в появлении патологии не играет никакой роли. Неоплазии могут быть подвержены женщины всех возрастных категорий.
Симптомы
На ранних этапах развития онкологического клинического процесса, как правило, отсутствует. Обнаружить уплотнение впервые удается при прощупывании молочной железы.
По мере прогресса патологии отмечается сдавливание рядом структур, что сопровождается болевыми ощущениями.
В тот момент, когда появляются новые размеры, появляются следующие симптомы:
- отечность;
- деформирование железы и соска;
- нехарактерные выделения;
- покраснение кожи;
- увеличение лимфатических узлов в области подмышечных впадин.
Далее симптоматика дополняется:
- общей слабостью;
- чрезмерной утомляемостью;
- зудом в месте поражения;
- болями в суставах.
Если происходит метастазирование, возникает желтуха и нарушение дыхательной системы.
Диагностика
Если есть подозрение на ТНРМЖ, то специалист назначает прохождение лабораторного и инструментального обследования.
Проведение первичных процедур дает возможность установить формирование уплотнения в груди. Также, благодаря таким способам, можно определить объемы опухоли и ее место локализации, а также метастазов в лимфатических узлах.
Цитология и иммуногистохимическая диагностика
Это второй этап диагностического обследования. Для забора образца патологической ткани проводится трепан-биопсия или пункция. В ходе микроскопического изучения развития патологического процесса обнаруживаются низкодифференцированные клетки.
После того как лабораторные методы подтвердили наличие заболевания, специалисты проводят инструментальную диагностику, которая включает:
- компьютерную и магнито-резонансную томографию;
- рентгенографию грудины.
Также важно проведение дифференцированной диагностики, чтобы исключить наличие доброкачественных опухолей или других злокачественных новообразований.
Лечение
Если диагноз трижды негативная форма рака груди подтвердился, то к лечению необходимо приступать незамедлительно. Выбор тактики терапевтических мероприятий зависит от стадии онкологического процесса, возраста больной и ее состояния наличия метастазирования и прочих факторов.
Хирургическое вмешательство
В этом случае выполняется радикальная мастэктомия, которая заключается в полном иссечении молочной железы и региональных лимфоузлов, пораженных метастазами. Данная процедура является травматичной, но вероятность рецидивирования болезни снижается.
Лучевая терапия
В ходе проведения процедур на очаг воздействия воздействуют радиационным излучением. Это позволяет добиться уничтожения раковых клеток, оставшихся после операции.Участок, который будет подвергаться облучению, а также дозировка исключительно специалистом.
Химиотерапия
рецепторы к онкопротеину эпидермиса и гормонам у такой формы рака отсутствуют, то он не поддается лечению традиционными гормональными препаратами. Поэтому для устранения заболеваний в большинстве случаев предпочтение отдается полихимиотерапии.
Осложнения
Если вовремя не диагностировать заболевание и не начать лечение, то могут возникнуть осложнения.К наиболее распространенным относят:
- метастазирование в другие структуры организма;
- раковую интоксикацию;
- кахексию;
- скопление жидкости в плевральной полости;
- кровотечение в легких;
- нарушение в работе ЦНС;
- слепоту;
- печеночную недостаточность.
Поле проведения химио- и лучевой терапии наблюдаться некоторые побочные эффекты:
- ощущение зуда и жжения кожи;
- сухость кожных покровов;
- приступы тошноты со рвотой;
- тромбозы;
- ломкость волос и выпадение.
Кроме того, многие больные страдают от депрессии, становятся замкнутыми, у них возникает страхнь смерти.
Прогноз
Как правило, прогностические данные вредные. При правильной подобранной полихимиотерапевтической схеме лечения выживаемость в течение трех лет отмечается в 65-68 процентов.
Реальные показывают, что если в течение 5 лет не отмечалось рецидивов, то прогнозирование будет, как и другие формы опухолевых молочных желез.
Профилактика
Специфических мер предотвращения заболеваний нет. Специалисты рекомендуют придерживаться некоторых правил, которые позволяют снизить риски развития болезни:
- регулярно проводить самообследование груди;
- не принимать без назначения врача оральные контрацептивы;
- не подвергать организм радиационному облучению;
- не травмировать молочные железы.
Кроме того, при наследственной предрасположенности важно не менее одного раза в 6 месяцев пройти обследование у маммолога.
Трижды негативный рак является заболеванием, в результате которого страдает весь женский организм. При неправильно проведенном и несвоевременном лечении возрастает вероятность не только инвалидности, но и летального исхода.
Именно поэтому при появлении первых симптомов важно сразу обращаться за медицинской помощью.Раннее выявление патологии поможет избежать негативных последствий.
Источник: https://onkologia.ru/onkomammologiya/trizhdy-negativnyy-rak-molochnoy-zhelezy/
Трижды негативный молочной железы
Трижды негативный молочной железы — это патология, с агрессивным течением и опасными заболеваниями. Рассмотрим особенности данного вида онкологии и прогноза.
С помощью иммуногистохимического исследования определяют основные раковые рецепторы.Анализ дает информацию о рецепторах эстрогенов (ER), чувствительности к герцептину (her2neu) и рецепторах прогестерона (PR). Большинство опухолей имеют положительный ответ на все три рецептора. Если рак не чувствителен к герцептину (ER0, PR0, her2neu 0-1), то это указывает на ТНРМЖ.
Такой рак относится к отдельной группе заболеваний, так как он относится к другим злокачественным поражениям молочной железы. Он имеет специфическое гистологическое строение (базальноподобная форма).
В данной группе могут встречаться плоскоклеточная и апокриновая карциномы. ТНРМЖ встречается в 10-20% случаев рака.
Патологии подвержены женщины, принимающие оральные контрацептивы, пациентки с наследственной предрасположенностью и афроамериканцы.
В большинстве случаев опухоли диагностируют на запущенных стадиях. Онкология проявляется в виде длительного воспалительного процесса. Многие наследственные формы недуга к данной категории.
Он имеет разные подтипы и группы, которые позволяют детальнее исследовать механизм его развития и составить эффективный план лечения. Онкология характеризуется негативным прогнозом.
Но при своевременной терапии и отсутствии рецидивов в течение пяти лет, прогноз выживаемости такого же, как и при других, формах поражения молочных желез. Но в 80% случаев болезнь рецидивирует в первые 1-2 года после радикальной терапии.
Код по МКБ-10
Согласно медицинской статистике, трижды негативный рак молочной железы распространен на территории нашей страны.Болезнь относится к гетерогенной группе опухолей.
Для диагностики патологии используйте код по мкб 10, недуг относится к категории ІІ новообразования.
C50 Злокачественное новообразование молочной железы:
- C50.0 Соска и ареолы.
- C50.1 Центральной части молочной железы.
- C50.2 Верхневнутреннего квадранта молочной железы.
- C50.3 Нижневнутреннего квадранта молочной железы.
- C50.4 Верхненаружного квадранта молочной железы.
- C50.5 Нижненаружного квадранта молочной железы.
- C50.6 Подмышечной задней части молочной железы.
- C50.8 Поражение молочной железы, выходящее за пределы одной и более указанных локализаций.
- C50.9 Молочной железы неуточнённой части.
Молекулярно-генетическая классификация указывает на четыре группы рака, каждую из которых имеют индивидуальные эпидо-физиологические свойства, типичную клиническую картину и прогноз.
Источник: https: // ilive.com.ua/health/trizhdy-negativnyy-rak-molochnoy-zhelezy_109617i15944.html
Рак молочной железы
ОнкологияА. Махсон:
Передача «Онкология с профессором Махсоном». Мы её решили сегодня посвятить раку молочной железы. Эта тема уже поднималась не один раз, но, во-первых, это самая распространённая опухоль, по крайней мере, в Москве рак молочной железы у женщин вышел на первое место среди заболеваний у женщин и у мужчин.Ещё одна причина — как раз в группе Всемирная неделя борьбы с раком молочной железы. По статистике, в России в среднем 439 женщин из 100 000 жителей ежегодно заболевают раком молочной железы. Если перейти к абсолютным цифрам, то в Москве около 5 000 ежегодно заболевают раком молочной железы, в России надо будет умножить на 10, порядка 50 000 женщин, которые заболевают раком.
Почему мы решили поговорить на эту тему? Во-первых, рак молочной железы — это собирательное понятие, что очень важно.На самом деле в молочной железе встречается минимум 5 разных опухолей, которые лечатся по-разному, и прогнозы у них разные. Поэтому очень важно до начала лечения правильно поставить диагноз, мы дальше об этом поговорим. Несмотря на такую частоту, в настоящее время рак молочной железы очень неплохо лечится. Если посмотреть по статистике, то почти 72% наших больных живы через 5 лет после установки диагноза. 5 лет — это считается равносильным излечению. Если ещё поговорить о статистике, около 29% опухолей выявляется в третьей-четвёртой стадии.Четвёртая стадия составляет 8% из выявленных опухолей.
Ещё есть такой очень важный показатель для рака молочной железы, как одногодичная летальность. С момента рака у 8% больных, есть каждая двенадцатая женщина погибает в течение одного года. В общем-то, это характерно. 6%, то есть 1/15, из пятнадцати женщин одна. Что это значит? Это характерно для всех опухолей: чем раньше выявлено, тем лучше лечится. Даже можно понять, если мы выявили в четвёртой стадии опухоль, то не все умирают.Считается, что на четвёртой стадии больной обречен, но это не касается рака молочной железы. В связи с тем, что такое множество видов лечения и их сочетаний, и всё зависит от правильного диагноза.
Говоря о диагностике, как минимум 6, например, если грубо говорить, не очень понятно, люминальный тип А, люминальный тип В, трипл-негативный рак, HER-позитивный рак, гормон позитивный, гормон негативный — очень большое сочетание. В зависимости от этого прогноза.Например, как люминальный тип В, который, кстати, обычно, 60%, она очень хорошо лечится и довольно просто. Она будет характеризоваться наличием положительных рецепторов гормонов, гормонозависимая опухоль, и достаточно простое лечение. Совсем другое лечение, скажем, у так называемого, трипл-негативного рака, когда отрицательные рецепторы гормонов, эстрогенов, и мутация гена HER2 также отрицательная. Для чего это всё рассказывать? Понятно, это узкоспециальные термины. От правильности постановки диагноза будет зависеть лечение, и то, сколько мы сможем вылечить больных.Это то, что касается лечения.
Но основное, конечно, у нас является раннее выявление. Мы говорили, порядка 75% при раке молочной железы имеютлетнюю выживаемость на круг всех больных. Но, если мы возьмём первую стадию рака молочной железы, то процент излечиваемости будет больше 89% или около того, почти 90%. Мы можем вылечить пациентку, если она будет лечить пациентку в таком варианте.Ранее считалось, что раньше считалось, что рак молочной железы прогнозирует прогноз, ускоряет течение опухоли, то сейчас отношение к этому изменилось. Наличие беременности не является абсолютным показанием для прерывания. Есть не один случай, когда рак молочной железы, диагностированный во время беременности, лечили, вылечивали, и этот при рождался здоровый ребёнок.
Для чего проводится Неделя рака молочной железы? Её, в основном, в раннем выявлении рака молочной железы. Согласно мировой статистике Россия имеет одинаковые пятилетней отдалённой — примерно, 75%, сейчас 78%, в США этот показатель равен 89%. Почему? Потому что там, внедрение, внедрение тотальный скрининг рака молочной железы. Что такое скрининг? Скрининг — это обследование здоровых женщин для ранних форм рака молочной железы.При раке молочной железы есть два метода скрининга. Преимущественный метод, используемый в большинстве случаев маммография. Это специальный рентгеновский метод исследования, который позволяет современным маммографам выявлять опухоли размером по 5 мм и выше. Второй метод — ультразвуковое исследование, УЗИ. Он иногда имеет преимущества, но это касается особенностей молодых женщин, потому что эффективность маммографии будет зависеть от плотности ткани молочной железы. В старших возрастных группах женщин, когда уже развивается менопауза, плотность ткани молочной железы уменьшается, в этих случаях маммография имеет лучшее преимущество.Очень хорошо видны все образования и так называемые микрокальцинаты, потому что одной из форм рака молочной железы отложения кальция в опухоли — так называемые микрокальцинаты, маленькие участки кальция. У молодых женщин их иногда бывает плохо видно из-за плотности ткани молочной железы. В данном случае ультразвук имеет свое преимущество, хотя надо сказать, что современные маммографы, последние, с томосинтезом, позволяют увеличить эффективность скринингового исследования даже и при маммографии.
Кому нужно проводить маммографию? Считается, что после 40 лет раз в год или два года нужно поводить маммографию, и тогда резко возрастает число опухолей молочной железы, выявленных на ранних стадиях. Почему после 40 лет? Может ли рак молочной железы быть раньше? Может, но бывает достаточно редко, и поэтому его эффективность невысокая. Сейчас у нас встречаются больные раком молочной железы, 21, 22, 30 лет, но это встречается редко. Поэтому нет смысла проводить всем подряд каждый год маммографию.Цель маммографии — выявить узлы образования, поскольку у многих женщин может быть диффузная мастопатия, когда происходят изменения тканей молочной железы. Это патология, которая не относится к онкологам, эта патология связана больше с гинекологами, к ним имеет отношение. Но всё, что выявляется, узлы образования — это удел онкологов.
Наш гость, Александр Валерьевич Петровский, исполнительный директор Ассоциации онкологов России. Самое главное — он специалист в хирургическом лечении опухолей молочной железы, онколог высшей категории, кандидат медицинских наук.Не бывает в онкологической клинике врачей, которые занимаются даже хирургическим лечением, потому что любой онколог подходит с комплексной позицией.
Мы пока говорили о статистике, о проблемах, поговорили, почему мы вернулись к этой теме не первый раз, что сейчас прошло Неделя, и обозначили, что в молочной железе много опухолей, как минимум мы сейчас различаем 5. На самом деле, если покопаться глубже, очень важно любое лечение начинать с диагностики.Правильная диагностика может быть, я ещё раз повторюсь, где есть специалисты всех профилей — хирург, химиотерапевт, обязательно радиолог и, самое главное, очень грамотные морфологи. Потому что тут очень важна морфология и иммуногистохимия. Теперь мы поговорим об этом, перейдём к подходам, к лечению и что же нам делать. Оно ещё не отменяет в онкологии хирургическое лечение, оно занимает очень важное место, но, тем не менее, оно не может восприниматься в отрыве от комплексного лечения.Я ещё раз повторюсь, что план лечения должен выявляться до его начала. Поставили диагноз, обсудили лечение, дальше можно его начинать.
Давайте, мы, поскольку Александр Валерьевич практикующий онколог, послушаем, что нужно делать женщине, когда у нее нашли узлы образования, скажем, в поликлинике при маммографии? Что же дальше делать женщине?
А. Петровский:
Тут вы совершенно правильно сказали, что женщине нужно идти в специализированное онкологическое учреждение.Женщине обязательно нужно взять маммографические снимки с собой, дабы не переделывать, поскольку это лишняя лучевая нагрузка. Проведено маммографическое исследование на должном уровне, может быть, образовательные мероприятия для рентген-лаборантов и созданы. для врачей-рентгендиагностов.
В специализированном онкологическом учреждении узловое образование может быть расценено как похожее на злокачественное, с определенной степенью достоверности, естественно.Сейчас рентгенологи используют систему, BI-RADS называется для определения того, какие образования обнаружены в молочной железе — доброкачественные, злокачественные или никакие патологии вообще нет.
А. Махсон:
Минуточку, я прерву и более доступно объясню. Это что значит? Что даже маммографию должен смотреть специалист, потому что есть специальная система BI-RADS. Это система оценки снимка, которая позволяет рентгенологу максимально опасно понять это образование и понять что с ним делать.Опять же, эту систему знают далеко не во всякой поликлинике. Поэтому задача поликлиники на скрининге — найти узловое образование, а дальше уже дело специалиста.
А. Петровский:
Совершенно точно. Эта система позволяет всем рентгенологам и всем врачам говорить на одном языке. Специалисты, которые уже овладели этой системой, видя цифру с этими шестью буквами, точно знают уже, о чём идёт рядом речь.
Если образование является подозрительным в отношении злокачественного, то необходимо выполнять биопсию образования — это закон.Обязательно биопсию, так называемую, кор-биопсию или трепан-биопсию, чтобы было достаточное количество материала для проведения как гистологического, так и иммуногистохимического исследования.
А. Махсон:
Очень важный момент, потому что часто в поликлиниках делают укол тоненькой иголочкой и говорят: «У вас рак, нужно и быстро оперироваться». Грубейшая ошибка!
А. Петровский:
Абсолютно верно, Анатолий Нахимович! Потому что, как уже было сказано, опухоли разные, и разные опухоли лечатся по-разному.Даже некоторые маленькие операбельные опухоли по их структуре бывают такими, что необходимо начинать лечить не с помощью операций, а с лекарственным компонентом. Наоборот, есть опухоли большего размера, и при этом у них такие особенности, что их лучше, даже на большой размер, всё равно хирургическое лечение. Поэтому мы должны биологию опухоли до того, как принять любое решение о начале лечения. Вы совершенно правильно сказали, Анатолий Нахимович, что это решение не одного человека, не хирурга, это всегда решение команды, куда входят все специалисты, которые могут быть нужны для лечения этой болезни.Обязательно должен быть специалист по лечению, по химиотерапии, обязательно специалист по лучевому лечению, радиотерапии. Базируясь на морфологической картине опухоли, они вырабатывают индивидуальный план лечения.
Опухолей молочной железы порядка, и каждая требует своей установленной терапии.
А. Махсон:
С чего начать? Очень важный момент, я хочу подчеркнуть, когда вам в поликлинике доктор, который сделал маммографию, сказал: «Вам нужно идти и быстро оперироваться», он превысил свои полномочия.Он не может знать, что нужно делать, его задача — найти и подчеркнуть. Хорошо, посмотрели, решили, что надо начинать с операции. На современном этапе подходы к хирургическому лечению молочной железы, если операция первая?
А. Петровский:
Да, это очень хороший и важный вопрос. В течение периода лет была такая практика, и все знали, что в случае рака молочной железы долгую часть надо отрезать. До сих пор этот миф остался в головах многих людей, которые не занимаются прицельно раком молочной железы.К сожалению, этот миф иногда активно насаждается пациентам или родственникам пациентам.
К счастью, на сегодняшний день ситуация кардинально поменялась. Мастэктомия, удаление молочной железы — это «операция отчаяния». Её нужно делать, только когда невозможно сделать другие варианты. Другие варианты позволяют достичь таких же результатов с точки зрения контроля болезни, могут быть, даже лучшие результаты — есть исследования, которые показывают высокое качество жизни пациента.Поэтому, конечно же, операция выбора должна являться так называемая органосохраняющая операция, когда удаляют только часть молочной железы, содержащую опухоль, оставшуюся здоровую ткань молочной железы сохраняют. В случае необходимости удалить ткань молочной железы на сегодняшний день существует много вариантов реконструктивно-пластических операций, которые используются разными способами, в некоторых случаях, тем не менее, восстановить красоту женщины.Поэтому, повторюсь, мастэктомия — это операция отчаяния, когда ты не можешь сделать ничего другого.
Операция мастэктомии выбирается только в самом крайнем случае.
А. Махсон:
Наверное, мастэктомия без пластики. По-видимому, всё-таки, это будет зависеть от нескольких факторов — опять же, должен решить хирург, который лечит проблему: размер опухоли и её структура. Если мы решили оперировать сначала, это спокойно текущая опухоль.В этих вариантах в больших случаях грудь можно сохранить или восстановить.
А. Петровский:
Совершенно точно. «Отрежьте мне всё», думая, что это более безопасно, что снижает риск рецидива. На самом деле, это совершенно не так. К сожалению, болезнь может вернуться при любом объёме хирургического вмешательства, и полное удаление молочной железы ни в каком случае не возникнет снова рецидив заболевания.Причём, к сожалению, даже в том же месте, где была молочная железа, то есть уже на грудной стенке. Также важным вопросом является хирургия лимфатических узлов. Раньше являлось стандартом полное удаление лимфатических узлов. Надо стараться выполнять, так называемую, биопсию сторожевого лимфатического узла, узнавать, есть поражение лимфатических узлов или нет. Если поражение отсутствует, то лимфатические узлы можно заметить.
Полное удаление молочной железы не гарантирует отсутствие рецидива.
А. Махсон:
Вообще, очень интересная история. Она вообще относится к онкологии, потому что онкология идёт, так сказать, волнами. Сначала была маленькая операция — большая операция, большая опухоль — маленькая операция, считалось, что это не нужно оперировать. Сейчас всё изменилось, сейчас маленькая опухоль — ещё меньшая операция, позволяет лечить. Конечно, всё благодаря тому, что у онкологов появился большой арсенал лекарственных и лучевых методов, который позволяет сохранить хорошее качество жизни, получить результаты значительно лучше, чем было раньше, когда у нас всего не было.
Теперь немного о сторожевых узлах. Почему принципиально такое отношение к лимфоузлам? Потому что в организме человека ничего не бывает лишнего. Понятно, когда раньше удаляли все лимфоузлы, были большие разрезы, были такие осложнения, как отёки руки. Современная хирургия позволяет без ущерба для онкологии сохранить лимфоузлы, уменьшить риск осложнений. Что такое сторожевой узел? Опять же, я буду подчёркивать, это делается только в специализированном учреждении.Специальные методики выявляют первый лимфоузел, в котором оттекает лимфатическая жидкость от опухоли. Если мы видим, что он не поражён, то на современном этапе доказано, что можно не трогать лимфоузлы. С хирургией мы пока остановимся и, может быть, закончим.
Какие ещё бывают варианты? Что делать, если сразу нельзя оперировать?
А. Петровский:
Если сразу нельзя оперировать, то вариант один — надо проводить лекарственное лечение. Лекарственное лечение бывает разным.Оно бывает химиотерапевтическим, оно бывает гормональным, оно бывает таргетным и сочетанием этих методов. Раньше, многие годы назад, думали, что имеет смысл иногда облучать молочную железу перед операцией, и даже очень часто это делали. Сейчас доказано, что никакой пользы от предоперационного облучения нет, поэтому на сегодняшний день эта тема считается закрытой.
Если процесс в молочной железе неоперабельный, даже правильнее сказать — нерезектабельный, необходимо проводить лекарственное лечение.Выбор лекарственного лечения зависит, в первую очередь, даже от биологии самой опухоли. Если опухоль гормонозависимая, то мы в первую очередь будем думать о гормональной терапии. Если она зависит от онкобелка HER-2, то мы обязательно будем добавлять таргетную терапию. Если она не зависит от одного из этих факторов, то используются химиотерапевтические препараты.
А. Махсон:
Давайте, мы тогда разделим.Совершенно правильно Александр Валерьевич тут коснулся, может быть два варианта. С одной стороны, есть люди, у которых выявлена опухоль в четвёртой стадии, это где-то 8%. На первом этапе, может быть, вообще не идёт разговор об операции. Но есть ещё те, кого вроде бы оперировать нельзя, и мы его не оперируем. Тут будут две цели. Одна цель — уменьшить опухоль и улучшить варианты сохранной хирургии. Если сразу, на первом этапе нужно удалить грудь, вдруг мы провели лечение и можно ее сохранить.Это один из вариантов, правильно?
А. Петровский:
Да, тут есть два подхода. Это требует удаления всей молочной железы, чего хотелось бы избежать, как мы уже говорили, органосохраняющая операция должна быть стандартной. В этом случае можно провести предоперационное лечение, чтобы уменьшить размер опухоли и выполнить операцию с сохранением молочной железы.Это очень эффективный подход. Вообще, предоперационное лечение оказывает эффект у подавляющего пациента, порядка в 85-90% случаев мы видим реальное уменьшение размера опухоли, уменьшение измененных лимфатических узлов. Из этих 85% примерно у трети удаётся добиться того, что можно сохранить молочную железу, если мы берём на круг все варианты опухолей. Есть те, которые соответствуют лучшим способам лечения. Поэтому, конечно, мы понимаем, что у каждой третьей женщины была очень большая, чтобы уменьшить ее размеры, чтобы сделать небольшую операцию и сохранить ее собственную молочную железу.Это один подход.
А. Махсон:
Причём, с этим предложением как гормонотерапия, так и химиотерапия.
А. Петровский:
Да, абсолютно, с этой целью может и должен эффективный метод лечения. Химиотерапия будет неэффективной, это будет тогда лишнее лечение.
А. Махсон:
Ещё раз подчеркнём, что это можно узнать только одним способом, взяв, так называемую, кор-биопсию специальной иголочкой, которая получает тонкий столбик ткани и исследование в специализированной лаборатории, очень сложная методика.Если вы будете делать не там, где надо, можно ошибиться по диагнозу, и будет совсем другое лечение. Правильно сделали биопсию, правильно провели иммуногистохимическое исследование, выбрали правильное лечение, провели предоперационное лечение, сохранили грудь — один вариант.
Но есть ещё другой вариант. Мы говорили, что видов опухолей много. Сейчас, зачастую, мы видим небольшую опухоль, вроде бы можно оперировать. Одна из основных ошибок, когда человек попадает к непрофессионалу, приходит больной и говорит: «Доктор, мне сказали, срочно надо оперироваться».Бывает ошибкой часто: быстро прооперировав, плохие результаты, сохранение и другие.
Так вот, насколько я знаю, последнее время даже при небольших опухолях проводят неоадъювантную терапию — лекарственное лечение до операции. Тут цель уже немного другая.
А. Петровский:
Тут две цели, на самом деле. Первая цель — это определить индивидуальную чувствительность человека и конкретоли к лечению. Мы, зная биологию опухоли, понимаем, что лекарственное лечение пациенту будет нужно, всё равно (у нас на сегодняшний день подавляющее лечение принимает лекарственное, тот или иной вариант), то мы, на самом деле, назначенное лечение после операции, не знаем, оно эффективным или нет.Опухоль мы удаляем и предполагаем, что такое лечение нужно, однако, нет никакого положительного контроля. Мы не знаем, убиваются оставшиеся клетки или нет. Здесь, имея опухолевый очаг и назначенное лекарственное лечение, мы можем видеть: он уменьшается или увеличивается, если он уменьшается, то как быстро. Потом ещё можем, выполнив операцию, под микроскопом изучить и понять, остались живые клетки или не остались. Если живые клетки остались, то есть эффект не стопроцентный от предоперационного лечения, то мы можем каким-то образом модифицировать лечение, таким образом проводить стандартный подход без очень ясного клинического результата, а индивидуализировать лечение.
В онкологии очень хорошо уже показано в течение нескольких десятилетий, что идёт тенденция к индивидуализации, к персонализированному лечению каждой специфоли и каждого пациента.
А. Махсон:
Очень важный момент. Получается, с одной стороны, проводя такое лечение до начала, и это уже доказано, если оно эффективное и мы получили полный патоморфоз, то резко возрастает вероятность излечения вообще. С другой стороны, если мы увидели, что лечение оказалось эффективным после того, как его можно скорректировать и выбрать терапию, потому что мы понимаем, что данное лекарство, которое должно быть эффективно у данной конкретной больной, оказалось неэффективно.Прооперировали, исследовали, узнали ещё раз реакцию, количество реакций — дальше идёт разговор об адъювантной терапии.
А. Петровский:
Дальше идёт разговор об адъювантной терапии. Вот здесь адъювантная терапия, как раз, может быть как лекарственной, так и лучевой. Есть вполне чёткие показания к каждому из этих методов лечения. Как мы говорили, до начала терапии обязательно должен собраться консилиум и определить, как лечить пациента дальше. Точно так же на каждом из этапов лечения этот консилиум снова должен собираться и должен определять следующий шаг.После операции это в очередной раз обязательно должно произойти, чтобы понять, есть ли необходимость в дополнительной операции, потому что иногда бывают определенные показания. Есть ли необходимость в адъювантной лекарственной терапии, в какой объём лучевой терапии необходимо проводить облучение — только молочную железу или лимфатические зоны, лимфатические узлы, и какие — только подмышечные или шейные ещё нужно добавками, или парастернальные, в каком порядке всё делать.
На сегодняшний день стандартным является такой вариант: если необходимо химиотерапевтическое лечение, то после операции сначала проводится химиотерапия, причём проводится столько, сколько нужно кому-то 4 курса, кому-то 6, кому-то 8, а по окончании химиотерапии проводится лучевая терапия. Практически, всем пациентам, которым самым химиотерапия, на самом деле, на сегодняшний день провод лучевая терапия. Неважно, какой был срок от операции. Если лучевая терапия 8 курсов, это занимает больше, чем полгода, и все равно необходимо проводить лучевую терапию, не бояться, что прошёл длительный срок.Ведь весь этот срок человек лечился, получал лекарственное лечение. Если пациенту или таргетная терапия, то здесь лучевая терапия и другие варианты лекарственного лечения, кроме химиотерапии, параллельно, параллельно.
А. Махсон:
Тут очень много терминов, конечно, не специалисту понять сложно. О чём это говорит? Что арсенал современной онкологии имеет очень большие возможности. Зависят от того, насколько правильно будет спроектировано лечение, они подходят к лечению.Причём, мы ещё не поговорили, что есть генетически ассоциированный рак, к которому другой подход. Но надо понять, что адъювантная терапия — это терапия риска. Чтобы довести излечение всех больных раком молочной железы до 89%, как происходит в Штатах, нужно рано выявить и правильно потом лечить, используя весь арсенал — до хирургии, правильная хирургия, лучевая терапия, лечение после хирургии. Если всё будет сделано, правильно определено, то мы можем вылечить до 9 больных из 10, как в Соединённых Штатах.Не будем такими оптимистами, но хотя бы 8,5 — и то хорошо. Опять же, всё настолько сложно, что сейчас уже есть специализации внутри онкологии. Я, проработав столько лет в онкологии, конечно, знаю общие подходы, но столько тонкостей!
Всё мы сделали, грудь сохранили, лечение провели. В смысле реабилитации и профилактики есть что-нибудь сказать нашим слушателям?
А. Петровский:
Конечно. Реабилитация — это очень важный компонент. Это должен начинать ещё хирург сразу после операции, показать женщине упражнения, как разрабатывать руку.Мы настоятельно рекомендуем всем врачам, специалистам-онкологам, последователей на консультацию к реабилитологу. Есть, позволяющие снизить основной риск возникновения отёка верхней конечности, это разрешающий компонент программы. Заниматься нужно профилактикой, а если начинает возникать лимфостаз, то обязательно заниматься лечением. С точки зрения сохранения хорошего качества жизни, если есть необходимость выполнения мастэктомии, то есть удаление всей молочной железы, можно говорить оброченной реконструкции реконструкции.Такие тоже возможности существуют, такой вариант реабилитации есть.
Необходимо обращать внимание пациентов на то, как они должны бережно к себе относиться к точке зрения снижения риска травматизации верхней части тяжести, иначе все может привести к тяжёлым и неприятным последствиям. Также очень важно обращать внимание на необходимость вообще здорового образа жизни. С точки зрения молочной железы очень важна физическая активность; например, в одном из лучших американских противораковых центров «Энди Андерсон» всем пациентам назначают занятия йогой прямо во время нахождения в стационаре.Они идут, потому что показано, что у женщин с высокой физической активностью наблюдается прогрессирование заболевания в 2,5 раза ниже, чем у тех, которые не занимаются физической активностью. Поэтому важно обязательно всё обсудить и порекомендовать женщине регулярно обследоваться. При этом надо понимать, что сами по себе обследования не снижают риск возврата болезни, они только найти. Не надо бегать каждый день делать ненужные исследования, и никому не нужно делать ПЭТ.
А.Махсон:
Очень хороший вопрос: как часто и что нужно делать в плане профилактических обследований?
А. Петровский:
При раннем раке молочной железы, на первой-второй стадии, достаточно раз в год выполнять маммографическое исследование, рентген лёгких и УЗИ живота. УЗИ молочной железы, если сохранена, то обе, а если мастэктомия была, вторая молочная железа — то раз в год, нет необходимости делать это чаще. Мы рекомендуем выполнить исследования в полгода, потому что риски возврата болезни выше.Потом уже, через два года, так же ежегодно. Если же это метастатический процесс, то он требует, практически, постоянного лечения, но это уже отдельная ситуация, которая сложно поддаётся таким правилам за короткую беседу.
А. Махсон:
Ещё один очень важный момент. Я хочу подчеркнуть, о чём говорил Александр Валерьевич — об активности. После лечения профилактика в чём будет заключаться? В укреплении общих защитных сил. Это что такое? Вернуться к нормальной жизни, не переедать, не поправляться и обязательно физическая активность.Всё это укрепляет организм, укрепляет его защитную силу и опосредованно снижает риск проблем с нашим и другим заболеванием. Самое плохое, что может быть, это уйти в болезнь — ходить, смотреть, проверяться, сидеть дома и много кушать. Кстати, я не знал, это для меня тоже интересно. Я услышал первый раз, что физическая активность в 2,5 раза уменьшает прогрессирование. Но я, наверное, интуитивно всем своим пациентам рекомендовал бассейн, нагрузку, йогу.
Есть у нас ещё что добавить нашим зрителям и слушателям, что бы вы ещё сказать хотели?
А.Петровский:
Лечение рака молочной железы, я рекомендую всем здоровым женщинам регулярно заниматься обследованием. Самообследование важно, конечно, но оно не решает принципиально проблему. Натолкнуть всех на мысль о том, что надо, начиная с 40-летнего возраста, регулярно делать маммографию, а если есть семейный анамнез, то сдать анализ на мутации и более активно заниматься, более внимательно относиться к возможному риску возникновения опухоли.Правильное лечение — это замечательно, но с молочной железой очень важна ранняя диагностика. Методики эти есть, они разработаны, ими нужно пользоваться. Всё-таки, это поверхностно расположенная опухоль.
А. Махсон:
Обратите внимание, дорогие слушатели, но, с чего я начал и говорил, Александр Валерьевич тем же закончил. Действительно, самое лучшее, что может женщина для себя сделать — это потратить три часа раз в год, а то и раз в два года, посмотреть риск.Если так получится, то выявить на ранней стадии — это маленькое, лёгкое лечение с результатом, приближающимся к 98%. Совсем другое, если вы поленились, не пошли, и дальше начинается длительное, иногда бывает и неприятное, дорогостоящее лечение, и совсем другие результаты. Можно ещё раз повторить в заключение: нужно лечиться у профессионалов.
А. Петровский:
И диагностироваться у профессионалов, и лечиться у профессионалов.
А. Махсон:
Диагностика, лечение, наблюдение — тогда вы получите и хорошие результаты, и хорошие результаты в лечении.Вы будете здоровы, вы будете счастливы, плюс отсутствие всяких проблем. Когда человек знает, что нужно делать в хирургическом плане, в наблюдении, вы имеете шанс получить наилучшие результаты.

 al. High Local Recurrence Risk Breast-Conserving Therapy in Node-Negative Premenopausal Breast Cancer Patients Is Greatly Reduced by One Course of Perioperative Chemotherapy: A European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group Study. J.Clin.Oncol. 2000; 18: 1075-1083.
al. High Local Recurrence Risk Breast-Conserving Therapy in Node-Negative Premenopausal Breast Cancer Patients Is Greatly Reduced by One Course of Perioperative Chemotherapy: A European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group Study. J.Clin.Oncol. 2000; 18: 1075-1083. Применение адъювантной гормонотерапии и меньшая биологическая агрессивность улучшает результаты.
Применение адъювантной гормонотерапии и меньшая биологическая агрессивность улучшает результаты. Затем операция, затем ещё 12 циклов Трастузумаб -Эмтанзин + Пертузумаб, каждые 3 недели. Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования. Аббревиатура группы (TD-M1 – P).
Затем операция, затем ещё 12 циклов Трастузумаб -Эмтанзин + Пертузумаб, каждые 3 недели. Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования. Аббревиатура группы (TD-M1 – P). HER2 and chromosome 17 effect on patient outcome in the N9831 adjuvant trastuzumab trial. J Clin Oncol, 2010. 28: 4307-15.
HER2 and chromosome 17 effect on patient outcome in the N9831 adjuvant trastuzumab trial. J Clin Oncol, 2010. 28: 4307-15.


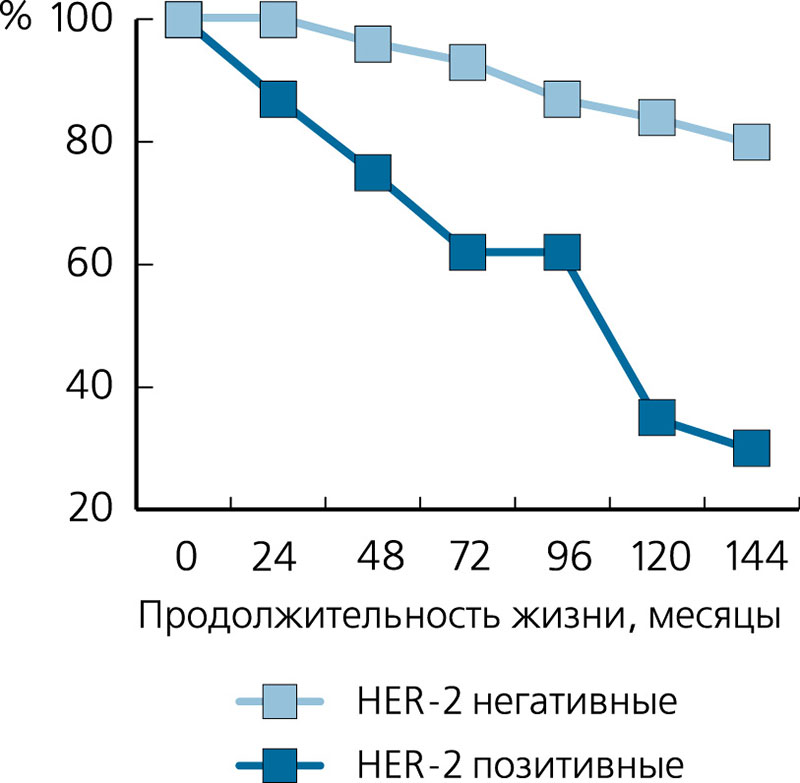 – 2000. –Т. 6, № 11. – C. 1-7.
– 2000. –Т. 6, № 11. – C. 1-7.