Исследование гемостаза
Любое оперативное вмешательство, профилактика тромбоэмболических осложнений, ведение пациентов с тромбозами различной локализации невозможны без оценки состояния свертывающей системы крови.
Подготовка к исследованию свертывающей системы крови
В лабораторном отделении проводятся основные скрининговые тесты:
1. Протромбиновый тест.
Коагуляционный тест, который используют как способ оценки дефицита факторов протромбинового комплекса (I, II, V, VII, X) и активности внешнего пути свертывания. Его используют для контроля терапии непрямыми антикоагулянтами.
Результаты протромбинового теста могут быть представлены в различной форме:
1. Протромбиновое время (сек).
2. Протромбин по Квику (%) — позволяет определять активность протромбинового комплекса плазмы пациента в сравнении с измеренным протромбиновым временем контрольной плазмы. Такой способ представления результатов является более точным, особенно в области низких значений. Норма: 70-130%.
Расчет протромбина по Квику в настоящее время является общепринятым способом.
3. МНО (Международное нормализованное отношение), латинская аббревиатура INR (International Normalized Ratio) — дополнительный способ представления результатов протромбинового теста, рекомендованный для контроля терапии непрямыми антикоагулянтами комитетом экспертов ВОЗ.
МНО — математическая коррекция, при помощи которой производится стандартизация протромбинового времени, измеренного с помощью различных тромбопластинов, имеющих разную чувствительность. МНО и протромбин по Квику коррелируют отрицательно — снижение протромбина по Квику соответствует повышению МНО
Оптимальные пределы МНО, которые должны быть достигнуты в ходе лечения непрямыми антикоагулянтами, зависят от терапевтических целей и определяются лечащим врачом.
Диапазон МНО при лечении непрямыми антикоагулянтами (например, варфарином) рекомендуемые Британским обществом гематологов:
|
Клинические показания |
МНО |
|
Профилактика постоперационных тромбозов глубоких вен (общая хирургия) |
2,0-2,5 |
|
Профилактика постоперационных тромбозов глубоких вен во время хирургических операций и переломов бедра |
2,0-3,0 |
|
Инфаркт миокарда, профилактика венозной тромбоэмболии |
2,0-3,0 |
|
Лечение тромбозов вен |
2,0-3,0 |
|
Лечение легочной эмболии |
2,0-3,0 |
|
Преходящие ишемические атаки, профилактика |
2,0-3,0 |
|
Ткань клапанов сердца, профилактика |
2,0-3,0 |
|
Предсердная фибрилляция, профилактика |
2,0-3,0 |
|
Заболевания клапанов, профилактика |
2,0-3,0 |
|
Тромбоз глубоких возвратных вен и легочная эмболия, профилактика |
3,0-4,5 |
|
Механические протезы клапанов, профилактика |
3,0-4,5 |
|
Возвратная системная эмболия, профилактика |
3,0-4,5 |
2. АЧТВ (АПТВ) — активированное частичное (парциальное) тромбопластиновое время, кефалин-каолиновое время. Норма: 26-38 сек.
АЧТВ (АПТВ) — активированное частичное (парциальное) тромбопластиновое время, кефалин-каолиновое время. Норма: 26-38 сек.
АЧТВ — скрининговый тест, используемый преимущественно для оценки эффективности внутреннего пути свертывания и мониторинга пациентов, получающих гепариновую терапию, в диагностике ДВС с другими тестами.
3. Фибриноген. Норма: взрослые — 1,8-3,5 г/л;
4. Д-димер. Норма: менее 550 мкг/л.
D-димер – продукт расщепления фибрина. Д-димер – маркер процессов тромбообразования и фибринолиза (растворения внутрисосудистых тромбов и внесосудистых отложений фибрина). Исследование этого показателя применяется в диагностике тромботических состояний, тромбоза глубоких вен, легочной эмболии, ДВС-синдрома и при осложнениях беременности.
5. Антитромбин III. Норма: 75 — 125 %.
При снижении активности до 40-60% повышается риск спонтанных тромбозов и эмболий
.В большинстве случаев снижение плазменного уровня антитромбина III носит приобретенный характер: уменьшение биосинтеза, пассивная потеря с биологическими жидкостями и потребление на инактивацию сериновых протеаз при активации свертывающей системы крови. Уменьшение биосинтеза антитромбина III обнаружено при заболеваниях печени, увеличение пассивной потери наблюдается при нефротических протеинуриях и энтеропатиях. В 1982 г показано, что при всех формах дефицита антитромбина III возникает ДВС-синдром. Введение гепарина сопровождается снижением уровня антитромбина III.
Показания к назначению анализа:
- Наследственный дефицит антитромбина III;
- Применение антикоагулянтов для профилактики тромбоэмболических осложнений при длительной неподвижности, хирургических вмешательствах, травме, беременности, родах.
Протромбин, МНО (протромбиновое время, PT, Prothrombin, INR)

Технология для исследования протромбина (и МНО). Подробнее
Один из важнейших лабораторных показателей коагулограммы, характеризующих состояние свертывающей системы.
Коагуляционный тест, в котором определяют время свёртывания плазмы пациента после добавления к ней смеси тканевого тромбопластина и ионов кальция.
Определение протромбинового времени и протромбина по Квику — способ оценки дефицита факторов протромбинового комплекса и активности внешнего пути свёртывания. Результаты теста, при нормальном содержании и качестве фибриногена, зависят от содержания факторов II, V, VII, X (активности протромбинового комплекса). Образование основных факторов протромбинового комплекса происходит в печени, поэтому этот тест часто используют для оценки ее белоксинтезирующей функции. Синтез этих факторов свёртывания в печени зависит от присутствия в организме витамина К, антагонистами которого являются непрямые антикоагулянты или антикоагулянты непрямого действия (АНД), поэтому протромбиновый тест используют для контроля терапии непрямыми антикоагулянтами.
Наиболее часто используемыми АНД являются производные 4-гидроксикумарина — монокумаролы (фенпрокумарол, аценокумарол), среди которых преимущественной популярностью пользуется варфарин (warfarin, синонимы — Aldocumar, Athrombin — K1, Cofarin, Coumadin, Coumadine, Cumatox, Omefin, Orfarin, Marevan, Panwarfin, Prothromadin, Warfilone, Warnerin).
Результаты протромбинового теста могут быть представлены в различной форме
1. Протромбин по Квику (%) — как и протромбиновый индекс, позволяет определять активность протромбинового комплекса плазмы пациента в сравнении с измеренным протромбиновым временем контрольной плазмы. Но при этом расчёт проводится по кривой зависимости протромбинового времени от % содержания факторов протромбинового комплекса, построенной с использованием разных разведений контрольной плазмы.
2. МНО (Международное нормализованное отношение), латинская аббревиатура INR (International Normalized Ratio) — дополнительный способ представления результатов протромбинового теста, рекомендованный для контроля терапии непрямыми антикоагулянтами комитетом экспертов ВОЗ, Международным комитетом по изучению тромбозов и гемостаза и Международным комитетом по стандартизации в гематологии.
МНО рассчитывается по формуле:
INR (МНО) = (Протромбиновое время пациента / Нормальное среднее протромбиновое время)isi,
где ISI (International Sensitivity Index of thromboplastin), он же МИЧ (Международный индекс чувствительности) — показатель чувствительности тромбопластина, стандартизующий его относительно международного стандарта.
МНО — математическая коррекция, при помощи которой производится стандартизация протромбинового времени, измеренного с помощью различных тромбопластинов, имеющих разную чувствительность. Оптимальные пределы МНО, которые должны быть достигнуты в ходе лечения непрямыми антикоагулянтами, зависят от терапевтических целей и определяются лечащим врачом. МНО и протромбин по Квику коррелируют отрицательно — снижение протромбина по Квику соответствует повышению МНО.
3. Протромбиновое время (в секундах) отражает время свёртывания плазмы после добавления тромбопластин-кальциевой смеси. Такое представление результата протромбинового теста не позволяет проводить сравнительную оценку результатов, поскольку разные лаборатории используют различные методы и аппаратуру, а главное — тромбопластин разной активности и различного происхождения.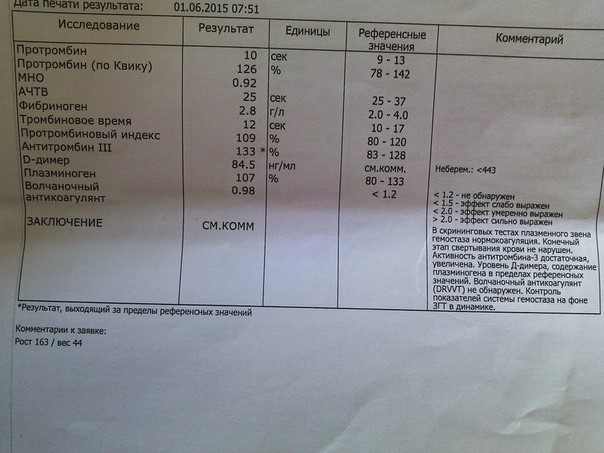
4. Протромбиновый индекс — отношение времени свёртывания контрольной («нормальной») плазмы к времени свёртывания плазмы пациента, выраженное в %. Показатель в области низких значений значительно зависит от чувствительности используемых реактивов.
Важно! В настоящее время не рекомендуется в рутинной лабораторной практике использовать вышеприведённые (протромбиновое время и протромбиновый индекс) способы представления результатов протромбинового теста, так как они не позволяют стандартизировать исследование и сравнивать результаты, полученные в разных лабораториях.
Исследование системы гемостаза (коагулограмма) в диагностическом центре им. Вытнова Д.И.
Значение анализа: коагулограмма (лат. coagulatio свертывание, сгущение + греч, gramma линия, изображение) или гемостазиограмма — сложный комплексный анализ. Врач оценивает не столько каждый конкретный показатель в отдельности, сколько цельную картину свертывания крови.
Забор крови
Не допускается в течение 8 часов (желательно 12) до сдачи анализов прием пищи, в том числе, сок, чай, кофе, алкоголь. Можно пить воду. Забор крови на гемостазиограмму проводится в специальные пробирки с голубой крышкой, содержащие цитрат натрия. Цитрат натрия связывает ионы кальция и предотвращает процесс свертывания крови. Кровь необходимо набирать точно до метки, нанесенной на пробирку. При нарушении соотношения кровь-цитрат интерпретация тестов затруднительна. После забора кровь тщательно и аккуратно перемешивается с цитратом без резкого встряхивания. При сдаче гемостазиограммы на фоне или после приема лекарственных препаратов влияющих на свертывание крови, их необходимо обязательно указывать в направительном бланке.
Тесты коагулограммы
АЧТВ
АЧТВ (активированное частичное тромбопластиновое время). Тест на внутренний путь свертывания крови. В свертывании крови по внутреннему пути участвуют 3 витамин К- зависимых фактора (II, IX, X), фактор XII, высокомолекулярный кининоген (ВМК), прекалликреин (ПК), а также антигемофильные глобулины А (фактор VIII:C), В (фактор X) и С (фактор XI). Активация внутреннего пути в организме происходит при повреждении сосудистой стенки, контакте с чужеродной поверхностью, при избытке адреналина, биогенных аминов, циркулирующих иммунных комплексов и др. Снижение активности — при недостаточности факторов, в том числе антгемофильных глобулинов, избытке антикоагулянтов (гепарин, волчаночные антикоагулянты и др.).
Активация внутреннего пути в организме происходит при повреждении сосудистой стенки, контакте с чужеродной поверхностью, при избытке адреналина, биогенных аминов, циркулирующих иммунных комплексов и др. Снижение активности — при недостаточности факторов, в том числе антгемофильных глобулинов, избытке антикоагулянтов (гепарин, волчаночные антикоагулянты и др.).
Показания к исследованию:
- Скрининговый тест состояния свертывающей системы.
- Исследование патологии свертывания крови.
- Контроль гемостаза при лечении гепарином.
- Диагностика гемофилии.
- Диагностика антифосфолипидного синдрома.
Клиническая интерпретация
Укрочение АЧТВ — признак тромбофилии или синдрома ДВС. Удлинение АЧТВ: ДВС, снижение синтеза факторов свертывания при заболеваниях печени, массивные гемотрансфузии, введение гепарина (удлинение АЧТВ в 1,5-2 раза), дефицит факторов внутреннего пути, дефицит витамина К, присутствие ингибиторов свертывания, наличие волчаночного антикоагулянта (ВА), наличие гемофилии.
Протромбиновый тест (ПТ)
ПТ является тестом на внешний (быстрый) механизм гемокоагуляции. В свертывании крови по внешнему пути участвуют витамин К-зависимые факторы VII, Х, фактор V, и тканевой фактор (ТФ) или тканевой тромбопластин, который запускает реакцию свертывания крови. При физиологических условиях ТФ попадает в кровь из поврежденных или разрушенных клеток, в том числе лейкоцитов, макрофагов, клеток опухолей, и активирует процесс свертывания крови. Снижение активности наблюдается при недостатке факторов свертывания крови из-за естественного или индуцированного лекарствами снижения синтеза.
Проторомбиновый тест в коагулограмме выражается двумя показателями:
Активность факторов протромбинового комплекса по Квику в %.
Это принятый в мире способ выражения ПТ. Расчет проводится по калибровочному графику, построенному при разведении донорской (контрольной) плазмы.
 Не соответствует принятому только в России протромбиновому индексу (ПТИ).
Не соответствует принятому только в России протромбиновому индексу (ПТИ).Показания к исследованию:
- Скриниговый тест исследования свертывающей системы крови.
- Исследование патологии свертывания крови.
- Контроль гемостаза при лечении антикоагулянтами непрямого действия.
- Оценка синтеза в печени факторов протромбинового комплекса.
Клиническая интерпретация:
Повышение активности (увеличение %) — склонность к тромбофилии.
Снижение активности (снижение %):
- Наследственный или приобретенный дефицит I, II, V, VII и X факторов.
- Идиопатическая семейная гипопротромбинемия.
- Приобретенная и наследственная гипофибриногенемия.
- Дефицит витамина К в диете (II, VII, IХ и X факторы образуются в гепатоцитах в присутствии витамина К).
- Дефицит витамина К у матери (геморрагический диатез у новорожденного).
- Прием лекарственных средств — антагонистов витамина К (антикоагулянтов непрямого действия — варфарина и др.), и усиливающих их действие препаратов: анаболических стероидов, клофибрата, глюкагона, тироксина, индометацина, неомицина, оксифенбутазона, салицилатов; гепарина, урокиназы и др.).
МНО (международное нормализованное отношение).
Используется только при лечении антикоагулянтами непрямого действия (варфарин и др.). Для скринига и оценки функции печени не используется.
Оптимальные пределы МНО, которые должны быть достигнуты в ходе лечения антикоагулянтами непрямого действия, зависят от терапевтических целей и определяются лечащим врачом.
МНО и протромбин по Квику коррелируют отрицательно — снижение протромбина по Квику соответствует повышению МНО.
При применении варфарина рекомендуется выполнять следующие правила:
- Применять варфарин в соответствии со сроком годности.
- При приеме варфарина ограничивать потребление витамина К.
- Отодвигать прием варфарина от приема пищи, т.
 к. препарат сорбируется пищей.
к. препарат сорбируется пищей. - Помнить, что ряд лекарственных средств тормозит действие препарата: барбитураты, кортикостероиды, пероральные контрацептивы, мепробамат и др.
Тромбиновое время
Тромбиновое время — это срок, в течение которого происходит превращение фибриногена в фибрин в цитратной плазме после добавления к ней тромбина. Скорость образования фибринового сгустка зависит, главным образом, от количества и функциональной полноценности фибриногена и присутствия в крови антикоагулянтов. Тест на конечный этап свертывания крови.
Показания к назначению исследования.
- Скриниговый тест исследования свертывающей системы крови.
- Определение дефицита или дефективности фибриногена.
- Оценка состояния пациента при диссеминированном внутрисосудистом свертывании (ДВС-синдроме).
- Снижение синтетической функции печени.
- Выявление присутствия в крови вторичных антикоагулянтов — продуктов деградации фибрина/фибриногена (ПДФ).
Клиническая интерпретация.
Укорочение — склонность к тромбофилии, риск тромбозов.
Удлинение: гипо- и дисфибриногенемия, наличие физиологических (гепарин) и патологических (ПДФ, моноклональные антитела) ингибиторов тромбина, парапротеинемия, уремия, иногда волчаночные антикоагулянты (ВА).
Фибриноген
Фибриноген — по международной номенклатуре фактор I (первый) свертывающей системы крови. Вырабатывается печенью и поступает в кровь. Под действием тромбина растворимый фибриноген превращается в нерастворимый фибрин, который и составляет основу сгустка. Образование фибрина проходит несколько этапов (образование мономеров фибрина, полимеризация, стабилизация сгустка).
Фибриноген является белком острой фазы воспаления, поэтому повышается при воспалительных и некротических процессах, влияет на величину СОЭ (с повышением концентрации фибриногена скорость оседания эритроцитов увеличивается). Рост концентрации фибриногена в плазме повышает вязкость крови и коррелирует с увеличением риска тромботических осложнений сердечно-сосудистых заболеваний. В ходе беременности происходит физиологическое увеличение содержание фибриногена плазмы крови.
Рост концентрации фибриногена в плазме повышает вязкость крови и коррелирует с увеличением риска тромботических осложнений сердечно-сосудистых заболеваний. В ходе беременности происходит физиологическое увеличение содержание фибриногена плазмы крови.
Показания к назначению анализа:
- Патология свертывания крови.
- Предоперационное обследование.
- Обследование при беременности.
- Наличие сердечно-сосудистой патологии.
Клиническая интерпретация.
Увеличение: воспаление, некроз, курение, заболевания почек, коллагенозы, новообразования, атеросклероз, введение эстрогенов (в том числе пероральных контроцептивов), беременность, др.
Снижение: врожденный дефицит, ДВС, печеночно-клеточная недостаточность, острый фибринолиз, лейкозы, инфекционный мононуклеоз, токсикоз беременности, змеиные яды, введение некоторых лекарственных препаратов (рептилаза, фибраты, фенобарбитал, анаболические гормоны, андрогены, вальпроевая кислота и др.) и фибринолитиков (стрептокиназа, урокиназа, актилизе и др.).
Антитромбин III (АТ III)
Антитромбин III — основной фермент противосвертывающей системы крови, на долю которого приходится до 75% антикоагулянтной активности. Это гликопротеин, который синтезируется в клетках печени. Без гепарина инактивация тромбина антитромбином III протекает медленно. При наличии гепарина процесс инактивации развертывается очень быстро. Поэтому АТ III называют плазменным кофактором гепарина. В случае значительного снижения уровня АТ III гепарин почти не оказывает своего антикоагулянтного действия. При уровне АТ III в плазме ниже 60% резко возрастает риск тромбозов.
Показания к применению.
- Наследственный дефицит АТ III.
- Лечение гепарином профилактическое и при ДВС-синдроме.
- Хирургические вмешательства.
- Беременность и роды.
Клиническая интерпретация.
Повышение уровня: воспалительные процессы; острый гепатит; холестаз; дефицит витамина К; прием варфарина, острый панкреатит; менструация; прием анаболических стероидов.
Снижение уровня: нарушение синтеза в печени, быстрое потребление при введении гепарина в больших дозах, массивное образование тромбина (ДВС-синдром), врожденный дефицит, лечение L-аспарагиназой поздних гестозов, прием пероральных контроцептивов, 3 триместр беременности.
Фибринолитическая активность (ХЗФ)
Фибринолитическая активность — это скорость растворения фибринового сгустка плазмином и другими фибринолитиками, содержащимися в плазме крови. При определение фибринолиза традиционным эуглобулиновым методом тест у здорового человека длится 3-5 часов, что несовместимо с современными требованиями к лабораторным исследованиям. Поэтому в качестве теста для оценки скорости растворения фибрина отечественными производителями был предложен так называемый XIIа-зависимый или Хагеман-зависимый фибринолиз (фактор XII — это фактор Хагемана). Он проходит при активации контактной фазы каолином и у здорового человека длится всего 4-12 мин. Метод является базовым, так как чувствителен к различной патологии в плазменных протеолитических системах. При ДВС-синдроме начинается закономерное угнетение данного вида фибринолиза уже на 1 стадии. Тест также может применяться для оценки эффективности тромболитической терапии.
Клиническая интерпретация.
Активация фибринолиза (укорочение времени растворения сгустка) встречается достаточно редко и связано, как правило, со снижением уровня фибриногена или увеличением содержания плазминогена и его активаторов (панкреатит, онкологические заболевания, шок, цирроз печени, патология беременности, терминальные состояния и др.).
Угнетение фибринолиза (удлинение времени растворения сгустка) отмечается при гиперфибриногенемии, врожденном снижении и дефекте плазминогена, гепаринотерапии, дефиците плазминогена и его факторов (рецидивирующие венозные тромбозы, системные васкулиты, сепсис, нефротический синдром, снижение синтеза плазминогена в печени), при нарушении активности плазменной калликреин-кининовой системы.
Оценка уровня тромбинемии (активации внутрисосоудистой системы свертывания крови)
У здорового человека в крови присутствует преимущественно фибриноген. Остальные промежуточные продукты превращения фибриногена в фибрин находятся в минимальном количестве. При ряде форм патологии, характеризующихся внутрисосудистым свертыванием крови (ДВС, тромбозы, тромбофилии) под действием свободного тромбина идет постоянный процесс трансформации фибриногена в фибрин и накопление фибрин-мономерных комплексов.
Активация фибринолиза сопровождается образованием продуктов деградации фибрина/фибриногена (ПДФ), которые взаимодействуют с фибрин-мономерами, увеличивая количество растворимых фибрин-мономерных комплексов (РФМК).
Специфическими продуктами деградации фибрина под действием плазмина и других фибринолитиков являются Д-димеры. Их концентрация в крови пропорциональна активности фибринолиза и количеству лизируемого фибрина.
Используемые лабораторные тесты
РФМК
Тест позволяет оценить количественно уровень растворимого фибрина плазмы, или, другими словами, уровень тромбинемии. Рост количества РФМК наблюдается при тромбозе, тромбофилими, на поздних сроках беременности в соответствии с ростом содержания фибриногена. Тест также может использоваться для оценки эффективности и достаточности антикоагулянтной терапии по конечному ее результату — ликвидации тромбинемии (полученные величины в пределах референтных значений).
Этаноловый тест
При повышении уровня тромбинемии и наличии в исследуемой плазме комплексов фибрин-мономеров с продуктами фибринолиза и фибриногеном под влиянием этанола образуется желеобразный сгусток (положительный результат, 1). Коррелирует с РФМК. У здорового человека сгустка не образуется (тест отрицательный, 0).
Д-димеры
Повышенный уровень D-димера обнаруживается при многочисленных состояниях, связанных с активацией коагуляции (синдром диссеминированного внутрисосудистого свертывания крови, тромбоз глубоких вен, тромбоэмболия легочной артерии, массивные повреждения тканей или хирургические операции, сердечная недостаточность, инфекции, воспаления, неопластические состояния).
Несмотря на ограниченную специфичность теста (около 50%), определение D-димера имеет преимущества по сравнению с измерением других маркеров коагуляции и фибринолиза, так как D-димер образуется только из конечного продукта превращения фибриногена в фибрин — нерастворимого фибрина, то есть он является продуктом лизиса тромба. При первичном фибринолизе и дисфибриногенемиях уровень D-димера не меняется.
На концентрацию D-димера в крови влияют такие факторы как величина тромба, время от начала клинических проявлений до назначения антикоагулянтной терапии и др. На фоне приема антикоагулянтов уровень D-димера постепенно снижается, а тромболитическая терапия вызывает повышение уровня D-димера.
Для теста наиболее характерна отрицательная диагностическая значимость (около 100%), т. е. отрицательный результат с высокой долей вероятности позволяет исключить диагноз тромбоза.
У беременных женщин, начиная с ранних сроков беременности, уровень D-димера в крови постепенно повышается. К концу срока беременности значения его могут быть в 3-4 раза выше исходного уровня. Значительно более высокие показатели D-димера отмечаются у женщин с осложненным течением беременности (с гестозом, преэклампсией), а также у беременных, больных диабетом, заболеваниями почек.
Повышение уровня D-димера установлено у лиц старше 80 лет.
Показания к назначению анализа.
- Диагностика тромботических состояний. Тромбоз глубоких вен (тест исключения). Тромбэмболия легочной артерии (ТЭЛА).
- Синдром диссеминированного внутрисосудистого свертывания крови (ДВС).
- Осложненное течение беременности.
- Мониторинг тромболитической терапии.
Повышение уровня.
- Артериальные и венозные тромбы (в т. ч. тромбоз глубоких вен, тромбоэмболия легочной артерии).
- ДВС-синдром.
- Инфекции, сепсис.
- Воспаление (небольшое повышение).
- Болезни печени.
- Обширные гематомы.
- Наличие ревматоидного фактора.

- Беременность.
- Хирургические вмешательства.
- Возраст старше 80 лет.
- Онкологические заболевания.
- Тромболитическая терапия.
Суммарный средний индекс тромбогенности
Суммарный средний индекс тромбогенности (ССИТ) — это расчетный показатель, который позволяет оценить направление сдвига в системе гемостаза пациента, результат взаимодействия всех систем гемостаза: свертывающей, противосвертывающей, фибринолитической, антифибринолитической. При превышении референтных пределов (ССИТ > 1,1) пациент склонен к гиперкоагуляции, при снижении (ССИТ < 0,8) — к гипокоагуляции. Оценка результатов конкретных тестов позволяет определить, за счет каких механизмов гемостаза нарушилось равновесие и какие меры необходимо предпринять для его восстановления.
Сдать анализ в Москве в ВАО, СВАО, ЮВАО, СЗАО
Коагулограмма или гемотест — это анализ свертываемости крови. Помогает своевременно выявить такие аномалии, как пониженную свертываемость, когда вследствие незначительного пореза человек может потерять довольно большое количество крови. Так и повышенную свертываемость – гиперкоагуляцию — наиболее частую причину тромбозов, инфарктов и инсультов.
Опасность заключается в том, что эти аномалии могут никак не проявлять себя в повседневной жизни, но очень критичны при возникновении открытых и закрытых кровотечений вследствие операции или случайного пореза.
Также коагулограмму назначают в тех случаях, когда человеку предстоит операция, связанная с частичной потерей крови (например, донору при пересадке костного мозга, различных нарушениях функционирования печени или варикозных заболеваниях).
Сдать анализ коагулограмма вы можете как по назначению нашего врача, так и придти с назначениями от врачей других клиник. Записываться не нужно. Если вас интересует конкретный вид исследований или вы хотите проконсультироваться по подготовке к сдаче, позвоните администратору в ближайшую к вам клинику и вам предоставят всю необходимую информацию:
- Клиника на Щелковской 8 (495) 221-21-14 (ВАО: Измайлово, Гольяново, Первомайская, Щелковская, Партизанская)
- Клиника в Текстильщиках 8 (499) 322-23-97 (ЮВАО: Волгоградский проспект, Рязанский проспект, Люблино, Кузьминки, Печатники)
- Клиника в Марьиной Роще 8 (495) 221-21-16 (СВАО: ВДНХ, Савеловская, Рижская, Алексеевская, Сущевский вал)
- Клиника в Митино 8 (495) 212-90-47 (СЗАО: Пятницкое шоссе, Митино, Дубравная, Павшино, Павшинская пойма, Красногорск)
Коагулограмма: расшифровка показателей
Протромбин — фактор свертывания крови, один из важнейших показателей коагулограммы, характеризующий состояние свертывающей системы крови. Изменение его количества в крови отражает нарушение свертывания крови. Повышается протромбин при склонности к тромбозам. Норма 78-142%.
Протромбиновое время — время свертывания плазмы в секундах после добавления к ней тромбопластин-кальциевой смеси. Норма 11-16 секунд.
МНО (международное нормализованное отношение) — расчетный показатель коагулограммы, показывающий отношение протромбинового времени пациента к нормальному среднему протромбиновому времени. Определение МНО необходимо для контроля терапии непрямыми антикоагулянтами (противосвертывающими препаратами — варфарин, фенилин). Таким пациентам необходимо контролировать МНО не реже 1 раза в 3 мес. Чрезмерное повышение МНО является указанием на склонность к кровотечениям. Снижение показателя свидетельствует о недостаточном эффекте противосвертывающих средств и указывает на сохраняющийся повышенный риск тромбообразования. Норма 0,85-1,35.
Протромбиновый индекс — отношение времени свертывания нормальной плазмы к времени свертывания плазмы пациента, выраженное в %. Повышается при повышении свертывания и склонности к тромбообразованию, а понижается при наклонности к кровотечениям. Норма 80-120%.
Фибриноген — это белок, который составляет основу кровяного сгустка при свертывании крови. Повышается в крови при воспалительных процессах и отражает риск развития сердечно-сосудистых осложнений за счет повышения свертываемости крови. Понижается — при склонности к кровотечениям, в том числе и врожденных дефектах, при нарушении функции печени и др. Норма 5,9-11,7 мкмоль/л.
АЧТВ (активированное частичное тромбопластиновое время) — используется для скрининга оценки свертывания крови, а также для контроля за пациентами, получающим гепарин. Данный тест определяет время образования сгустка крови после добавления специальных реагентов. Укорочение АЧТВ свидетельствует о повышенной свертываемости крови и склонности к тромбообразованию, а удлинение — о пониженной свертываемости и склонности к кровотечениям. Норма 24-35 секунд.
Антитромбин III — естественный антикоагулянт, угнетает факторы свертывания крови (инактивирует тромбин), способствует уменьшению свертывания крови. Исследуется в крови при рецидивирующих тромбозах, при лечении гепарином.
В клиниках «Диамед» вы можете сдать любые анализы по выгодной цене без предварительной записи. Основные виды анализов прописаны в рубрике Лабораторная диагностика (анализы).
Высокий протромбин что делать. Установленные нормы индекса протромбинов. Как повысить протромбин
Из-за чего может быть низкий протромбин в крови? Это сложный белок, являющийся показателем . На его выработку в организме влияет количество витамина K в печени.При проведении лабораторного исследования можно определить болезни печени или желудка по его показателям. Этот анализ характеризует уровень свёртываемости крови и является составляющим компонентом гемостазиограммы.
Протромбиновый индекс
Гомеостаз крови влияет на функционирование всего организма и обеспечивает его нормальную работу.
Чтобы состояние крови было нормальным, необходимо:
- Соблюдение определенной температуры.
- Густота биоматериала должна быть допустимой.
- Поддержание кислотности на оптимальном уровне.
- Стенки сосудов должны быть с нормальной проницаемостью.
При проведении лабораторного исследования называют соотношение времени свёртываемости плазмы. Нормой принято считать от 95 до 100%.
Анализ проводят несколькими способами. Точность может завить от используемых реактивов. Принято считать, что самым точным результатом является метод Квинке. Он основан на активности протромбина и измеряется в процентах. По этому методу принято считать нормальным такие показатели 78-142%.
Анализ проводят при наличии показаний.
Такими могут являться:
- патологии в процессе свертывания крови;
- обследование печени;
- большое количество выкидышей;
- нехватка витамина K.
Направление на проведение исследования выдает врач при ряде показаний, результаты зависят от метода анализа.
Низкий уровень протромбина
Снижение уровня протромбина может происходить в следующих ситуациях:
- недостаточное количество протромбинового комплекса;
- факторы, что провоцируют плохую свертываемость крови, их называют синдромом ДВС или диссеминированного внутрисосудистого свертывания;
- болезни, спровоцированные плохой свёртываемостью крови;
- гипофибриногенемия, при которой уменьшается уровень фибрина в крови;
- большое наличие гепарина в крови;
- наличие фактора, который будет способствовать плохому свёртыванию крови;
- сложные болезни печени;
- нехватка витамина K. Особенно это относится к пациентам, которые соблюдает диетическое питание;
- использование лекарственных препаратов, способных влиять на плохую свертываемость крови;
- болезни, связанные с нарушением белкового обмена;
- большая отечность у пациента;
- патологии поджелудочной;
- онкологические заболевания;
- болезни крови;
- использование пациентом различных лекарственных препаратов способных выполнять слабительные функции, например, хинина.
При этом у пациента будут наблюдаться характерные признаки плохой свертываемости. Возникает опасность при получении любой травмы быстрой потери большого количества крови, а это является реальной угрозой жизни.
Подобный анализ делают на голодный желудок. Рекомендуется его проводить не ранее, чем через несколько часов после еды. Если пациент принимал любые лекарственные препараты, об этом нужно обязательно сообщить врачу, чтобы результаты анализа были правильно истолкованы. Особенно это относится к медсредствам, которые способны разжижать кровь.
Уровень свертываемости обозначают в секундах. По методу Квинке это делают в процентах. Протромбиновый индекс — это отношение протромбинового времени у здорового к таким же показателям у больного.
Увеличение количества сложного белка происходит в некоторых случаях:
- на поздних сроках беременности;
- в начальной стадии развития тромбоза;
- при повышенном количестве эритроцитов;
- при появлении онкологических болезней;
- если происходит бесконтрольный прием лекарственных препаратов.
Проведение забора материала для исследования обычно проводят утром. Это позволяет пациенту не нарушать обычный ритм жизни. Если он принимает лекарства, которые способны разжижать биоматериал для исследования, об этом обязательно сказать лаборанту. Полученные результаты помогут установить диагноз и выбрать нужное лечение.
Любому человеку лучше проводить профилактику сложных болезней и вести здоровый образ жизни, чем потом лечиться.
На состояние крови может влиять фитотерапия. Этот метод подойдет пациентам, имеющим значения протромбинового индекса, близкие к низким показателям.
Рецепты народной медицины:
- Птичий горец со спорышом. Из этой смеси готовят отвар или настойку. Но есть одно ограничение, при диагностировании тромбофлебита этот способ не подходит.
- Настойка из двудомной крапивы. В ее составе есть витамины, которые способны улучшить качественные показатели крови и ее свертываемость. Еще это поможет стабилизировать работу органов пищеварения и функционирование сердца.Все препараты с содержанием крапивы хорошо влияют на работу сосудистой системы, способны остановить кровотечение. Их применяют при астме, кровотечении в легких, анемии, атеросклерозе. Но в случаях с большой густотой крови, повышенном давлении эти препараты противопоказаны.
- Испытанным средством можно считать тысячелистник. По своим свойствам он способен остановить воспаление, расширить сосуды, уменьшить боль. Еще это растение является противоаллергическим средством.
- Отвар из ореховой скорлупы. Этот метод применяют при кровотечениях, геморрое, болезнях десен.
Использовать народную медицину можно пациентам с низким уровнем протромбина в крови. Но перед этим нужно посоветоваться со своим лечащим врачом.
Профилактическим мерами при любом заболевании будет ведение здорового образа жизни.
В него входят:
- Отказ от алкоголя и никотина.
- Сбалансированное питание.
- Занятия спортом.
- Недопустимость переутомления и физических перегрузок.
Эти жизненные принципы помогут сохранить здоровье, не допустить появления болезней крови, сердца, сосудов. Но если все-таки это произошло, необходимо пройти обследование и не заниматься самолечением. Пониженный протромбин можно поднять медикаментозными и народными средствами.
Анализ на свертывание крови — достаточно важное исследование, которое помогает установить причину ряда серьезных заболеваний. Оно помогает вовремя предотвратить тромбообразование или кровотечение.
ПТИ (протромбиновый индекс) — что это такое? В момент исследования в анализе крови можно определить, за какое время свертывается плазма определенного человека, и сравнить значение с установленными нормами. Соотношение этой разницы переводят в проценты . Допустимая норма в крови — 78-142%, протромбиновый индекс по Квику — 95-105%.
Протромбин — такой белок, который является предшественником тромбина. А тромбин, в свою очередь, играет не последнюю роль в тромбообразовании. Вырабатывается протромбин в печени. Способствует этому витамин К. В случае если витамина К не хватает, могут быть спровоцированы кровотечения вследствие снижения количества протромбина.
Когда делается анализ
Анализ свертываемости необходим в следующих случаях:
- в преддверии операции;
- для пациентов, которые употребляют антикоагулянты, чтобы предотвратить тромбообразование;
- при беременности;
- пациенты с проблемой свертываемости крови, страдающие варикозом;
- у людей, страдающих нарушениями в сердечно-сосудистой системе;
- при дефиците витамина К;
- при циррозе печени.
Назначить такой анализ могут следующие специалисты:
- врач-травматолог;
- терапевт;
- педиатр;
- кардиолог;
- хирург;
- пульмонолог.
Как сдавать анализ
Прежде чем отправиться в медицинское учреждение для сдачи анализа, нужно подготовиться.
- Для получения максимально точного результата лучше сдавать анализ на голодный желудок в период с 8 до 11 часов. В идеале промежуток между последним приемом пищи и сдачей анализа должен составлять от 8 до 14 часов. Обратите внимание: это время не должно превышать 14 часов.
- Накануне не следует употреблять жирную, острую пищу, стоит отказаться от употребления алкогольных напитков. За час до анализа нельзя курить.
- Противопоказания касаются приема лекарственных препаратов. Если вы принимаете курсом определенные препараты, стоит отложить анализ до прекращения лечения. Бывают ситуации, когда прием лекарств невозможно прервать. В таких случаях пациент обязан предоставить всю информацию о дозировке и названии препаратов.
Кровь на анализ берут из вены. Она собирается в пробирку с цитратом натрия. Затем с помощью центрифуги отделяется плазма от клеток крови.
Расшифровка результатов
Причины низкого показателя:
- Дефицит витамина К.
- Болезнь печени.
- Наследственность.
Повышен процент из-за:
- Врожденные проблемы свертываемости.
- Дефицит витамина К.
- Гепарин.
- Онкологические болезни.
- Употребление антибиотиков широкого спектра.
Норма у беременных
Протромбиновый индекс при беременности повышается до показателя 90-120%. Это можно списать на гормональные преобразования в организме беременной женщины.
Анализ ПТИ, особенно во время беременности, важно проводить от двух до четырех раз. Большой упор на него стоит сделать в последнем триместре, потому что до родов остается совсем мало времени и необходимо проследить динамику.
Когда процент поднимается до показателя 150, это может стать угрозой отслоения плаценты. Когда показатель опускается ниже 90%, можно ожидать сильного кровотечения во время или после родов.
Если у беременной женщины обнаруживаются сбои в процентном показателе, не стоит отказываться от стационарного наблюдения при роддоме. Будущей маме важно находиться под наблюдением специалистов.
Показатели по Квику
Анализ по Квику делают для дополнительного исследования ЖКТ, а также печени.
Анализ по Квику выполняют в случаях:
- Когда нарушена свертываемость.
- Есть недуги, связанные с печенью.
- Идет процесс повышенного тромбообразования.
- При таком заболевании, как рак крови.
- В случаях, связанных с дефицитом витамина К.
Какие пределы показателей приемлемы:
- До 6 лет — 80-100.
- От 6 до 12 — 79-102.
- От 12 до 18 — 78-110.
- От 18 до 25 — 82-115.
- От 25 до 45 — 78-135.
- От 45 до 65 — 78-142.
Норма для женщин и норма для мужчин независимо от возраста идентичны.
Протромбиновое время — показатель, отражающий секунды, за которые сворачивается плазма после добавления к ней нужной смеси.
- У детей, особенно новорожденных, этот показатель составляет 14-18 секунд.
- Для взрослых нормальный показатель 10-15. Оптимальное значение протромбинового времени колеблется в пределах 9-12 сек.
МНО — международное нормализованное отношение
МНО — специальный метод, который применяется для контроля окончательного результата теста на протромбин. Применение данного метода настоятельно рекомендуют представители международных организаций здравоохранения.
Благодаря тем результатам, которые специалист получает после данного исследования, он может проследить, насколько эффективно проходит лечение синтетическими средствами.
- Норма МНО составляет 0,85-1,15.
- Если речь идет о лечении или профилактике тромбоза венозного, легочных заболеваний или деформации сердечных клапанов, то норма МНО может достигать 3.0.
Протромбин повышен
Если протромбин по Квику повышен, что могло вызвать такой результат и какие меры принимать? О повышении говорит показатель протромбина более 150%.
К этому могут привести следующие факторы:
- Многие заболевания, характеризующиеся снижением витамина К.
- Синдром ДВС.
- Недуги, которые препятствуют нормальному произведению фибрина.
- Наследственность и прочие патологии, которые могут привести к проблеме свертывания.
- Повышение показателя могут вызвать лекарственные препараты при их долгом употреблении, например:
- Аспирин.
- Антибиотики широкого спектра действия.
- Гепарин.
- Анаболик.
- Слабительные средства.
- Метотрексат.
- Кислота никотиновая.
Чаще всего протромбин у женской и мужской части населения повышается в возрасте 45-50 лет. Данный показатель у женщин может быть повышен из-за приема гормональных препаратов.
Если у женщины обнаружено серьезное сердечно-сосудистое заболевание, применение гормональных противозачаточных таблеток следует срочно отменять. Можно заменить их на аналог в виде свечей или кольца вагинального.
Что делать с повышенным показателем протромбина
Как снизить показатель протромбина? Данной категории людей необходимо придерживаться определенной диеты и образа жизни.
Нужно употреблять в пищу как можно больше продуктов, которые способствуют разжижению крови. Важно понимать, что существует ряд продуктов питания, которые могут привести к загустению крови.
Перечень необходимых ингредиентов для понижения уровня протромбина:
- Всем известная овсяная каша. Овсянка не просто помогает стабилизации пищеварения, но и препятствует загустению крови. В идеале нужно употреблять данное блюдо в качестве завтрака. При желании можно дополнить кашу свежими ягодами.
- Томатный сок, особенно когда он приготовлен из свежих овощей самостоятельно. Многие делают грубую ошибку, добавляя в сок соль.
- Свекла — идеальный овощ, который помогает снизить показатель протромбина.
- Какая диета без имбиря! Его можно добавлять в чай. Корень имбиря разжижает кровь, противостоит образованию тромбов.
- Масло льняное, оливковое.
- Рыбий жир. В настоящее время его можно приобрести в аптеках в виде капсул. Это отличный вариант без запаха и привкуса.
- В процессе приготовления блюд рекомендуется применять яблочный уксус.
- Ананас. Его достаточно съесть совсем немного, чтобы запустить в организме полезные процессы.
Какие правила стоит соблюдать во время диеты:
- Отдавать предпочтение овощам, фруктам и свежим ягодам.
- Мясо может присутствовать на столе, но в минимальных дозах.
- Мясо можно заменить рыбой.
- Ограничить употребление выпечки.
- Готовить лучше всего в пароварке.
- Питаться нужно чаще, но дозировано.
- Обязательно регулярное питье.
Что есть и пить нельзя:
- Копчености.
- Жирные, наваристые супы.
- Консервы.
- Алкогольные напитки.
Пониженный протромбин
Если протромбиновый индекс понижен, это может говорить о чрезмерной активности белка протромбина. Наблюдаться снижение может у беременных женщин, у страдающих полицитемией (это повышенная вязкость крови), больных венозным тромбозом.
Снижение показателя может сигнализировать о следующих заболеваниях:
- Болезни ЖКТ.
- Дисбактериоз.
- Дефицит протромбина.
- Гиповитаминоз.
- Онкологические болезни.
- Аллергическая реакция.
Чаще всего снижение данного показателя происходит из-за рациона и встречается у представителей сильной половины человечества. Именно мужчины делают выбор в пользу мясных продуктов, употребляя мало овощей и фруктов.
Что делать если показатель протромбина понижен?
Обычно специалисты выписывают своим пациентам применение таких лекарственных препаратов, как гепарин, варфарин.
В совокупности с медикаментозным лечением нужно следить за своим питанием. Вот перечень продуктов, которые не рекомендуют употреблять при пониженном уровне протромбина:
- Животные жиры.
- Каша гречневая.
- Свекла, капуста краснокочанная, красный перчик.
- Изделия хлебобулочные.
- Соления и копчения.
- Зелень.
- Бобовые.
Сбои в показателях протромбина могут привести к кровотечениям. Их можно предотвратить, если в качестве профилактических мер включить свой рацион правильные продукты:
- Рыба и жир рыбий.
- Лук и чеснок.
- Цитрусы, особенно лимон.
- Имбирный корень.
- Зеленый чай и какао.
- Овсянка.
- Клюква, малина или инжир.
Фибриноген
Белок фибриноген производится печенью. Именно он принимает участие в тромбообразовании. Анализ на протромбиновый индекс и белок фибриноген характеризует звенья одной цепочки.
Когда активизируется тромбин, это влечет за собой изменение фибриногена. А он уже, в свою очередь, преобразуется в волокна — фибрин. Эти неразрывные волокна предстают в виде тромба, который уже играет непосредственную роль в закупоривании сосуда.
Белок фибриноген достигает апогея в первые несколько дней после перенесенного инсульта, инфаркта, воспалительных процессах и гриппа. Наблюдать увеличение данного показателя можно у курильщиков, беременных, у людей, страдающих заболеваниями эндокринной системы, и при продолжительном приеме гормональных медикаментов.
Понижение показателя белка фибриногена наблюдается у людей:
- с заболеваниями печени и ЖКТ;
- с недостатком витамина В12;
- в период беременности, токсикоза;
- в период приема анаболиков;
- при приеме определенной группы медикаментов.
Единственной действенной профилактикой любых заболеваний являются отказ от вредных привычек, правильное питание, дозированная физическая нагрузка и своевременное обследование.
Он был разработан в 1935 г. американским врачом и исследователем Armand James Quick. Намного позже, в 80-е годы XX в., был предложен вычисляемый показатель INR (МИЧ) для учета результатов ПТ у пациентов, получающих непрямые антикоагулянты. Возможность эффективного контроля действия непрямых антикоагулянтов, прежде всего варфарина, обусловила востребованность и широкое распространение этой коагуляционной методики.
Принцип метода
ПТ основан на определении времени коагуляции после добавления к БТП тромбопластина. Последний является прокоагулянтной субстанцией биологического происхождения, содержащей фосфолипиды и тканевой фактор. Индукция коагуляции в ПТ происходит за счет активации проконвертина тканевым фактором в присутствии фосфолипидов и ионов Са ++ .
Реактивы и оборудование
- Тромбопластин-кальциевый реагент.
- Физиологический 0,9% раствор натрия хлорида (используют для разведения образцов БТП при исследовании протромбиновой активности по Квику).
- Образец нормальной БТП.
- Коагулометр (при отсутствии коагулометра — водяная баня и секундомер).
Образцы крови для исследования Для определения ПВ используют БТП. Особенности подготовки образцов БТП детально рассмотрены в приложении 3.
Оценка результатов исследования
Нормальные значения ПВ, как правило, указывает производитель тромбопластин-кальциевого реагента, однако эту информацию следует использовать лишь для приближенной оценки диапазона нормы, поскольку результаты исследования зависят от техники его выполнения, серии реагента и многих других факторов. Для более эффективной оценки результатов ПТ принято использовать расчетные показатели (ПО, MHO и др.), основанные на результатах определения ПВ в исследуемом и контрольном (нормальном) образцах.
Протромбиновое отношение (ПО).
Для вычисления ПО используют следующую формулу:
ПО = ПВ(б) / ПВ(к), где ПВ(б) — протромбиновое время пациента, ПВ(к) — протромбиновое время нормальной БТП.
ПО не учитывает способность тромбопластинов по-разному взаимодействовать с декарбоксилированными коагуляционными факторами (PIVKA), поэтому этот показатель пригоден лишь для скрининговой оценки внешнего механизма свертывания у пациентов, не получающих непрямые антикоагулянты (при циррозе, ДВС-синдроме и др.). Б отличие от ПВ на результаты вычисления ПО межсерийная вариация тромбопластина не оказывает существенного влияния.
В норме ПО не превышает 1,3. Снижение этого показателя менее 0,8 часто свидетельствует о дефектах преаналитического этапа исследования или погрешности при измерении ПВ образца нормальной БТП.
Международное нормализованное отношение.
Известно, что гипокоагуляционный эффект непрямых антикоагулянтов основан на угнетении эпоксидредуктазы витамина К (VKOR), которая регулирует способность глутамил-карбоксилазы карбоксилировать факторы протромбинового комплекса (II, VII, IX и X) и физиологические антикоагулянты (протеины С и S).
Назначение пациенту непрямых антикоагулянтов закономерно обусловливает нарушение внешнего пути коагуляции, однако степень удлинения ПВ существенно зависит от используемого тромбопластина. Вычисляемый показатель MHO, принятый в 1983 г. Комитетом по стандартизации в гематологии ВОЗ, предназначен для стандартизации результатов определения ПТ у больных, получающих непрямые антикоагулянты. Для его вычисления необходима информация о МИЧ тромбопластина.
MHO = (ПО)мич, где ПО — протромбиновое отношение, МИЧ — международный индекс чувствительности тромбопластина.
Нормальный диапазон показателя MHO указывать не принято, поскольку этот показатель предназначен прежде всего для пациентов, принимающих непрямые антикоагулянты. Терапевтический интервал MHO для большинства клинических ситуаций, связанных с необходимостью профилактики тромботических нарушений антикоагулянтами непрямого действия, находится в диапазоне 2-3. Однако в ряде ситуаций этот диапазон должен быть иным. Снижение этого показателя менее 0,8 часто свидетельствует о дефектах преаналитического этапа исследования или погрешности при измерении ПВ образца нормальной БТП.
Показатель протромбиновой активности по Квику.
Еще одним вариантом теста является определение протромбиновой активности по Квику. Техника определения этого показателя не отличается от таковой при оценке ПО и MHO, однако дополнительно необходимо измерить ПВ в разведенных образцах нормальной БТП. Результаты получают с помощью калибровочного графика, отражающего зависимость времени коагуляции нормальной БТП от степени ее разведения. Протромбиновую активность неразведенной нормальной пулированной плазмы расценивают как 100 %, время свертывания этой же плазмы, разведенной в 2 раза, — как 50 %, в 4 раза — 25 %, в 8 раз — 12,5 %.
Протромбиновая активность плазмы по Квику не считается стандартизованным показателем, поэтому результаты определения отличаются при использовании различных тромбопластинов. Этот показатель пригоден для оценки внешнего пути коагуляции у пациентов, которые не получают непрямые антикоагулянты (при циррозе, ДВС-синдроме и др.).
У здоровых лиц показатель протромбиновой активности плазмы по Квику зависит от варианта используемого тромбопластина, применяемого оборудования и других факторов, поэтому для каждой лаборатории целесообразно уточнить локальный диапазон нормы. Увеличение этого показателя более 120 % часто свидетельствует о дефектах преаналитического этапа исследования или погрешности при измерении ПВ образца нормальной БТП.
Протромбиновый индекс.
Протромбиновый индекс — устаревший способ оценки результатов учета ПТ. В настоящее время этот показатель применять не следует.
Интерпретация результатов исследование
ПТ является одним из базовых методов исследования коагуляционного гемостаза. Удлинение ПТ (увеличение ПО, MHO, снижение протромбиновой активности по Квику) наблюдается при низкой активности или функциональной неполноценности следующих коагуляционных факторов: VII, V, X, II и фибриногена. Именно поэтому ПТ у пациентов с заболеваниями печени и желчных путей нередко выявляет дисфункцию внешнего механизма свертывания. Кроме того, при наличии в крови ингибиторов, коагулопатии потребления и применении прямых антикоагулянтов этот тест также демонстрирует патологические значения.
Врожденные дефициты фактора Стюарта-Прауэр и протромбина, а также гипопроконвертинемия, дефицит витамина К, гипо-, дис- и афибриногенемия в клинической практике встречаются весьма редко, однако об их существовании следует всегда помнить при обнаружении удлиненного ПТ у пациента с геморрагическим синдромом и нормальной функцией печени.
При лечении рекомбинантным фактором Vila происходит существенное укорочение ПВ.
Стандартизация ПТ в настоящее время осуществляется на основе результатов определения ПВ в образцах плазмы, содержащих факторы PIVKA, и вычисления МИЧ тромбопластина, поэтому более или менее воспроизводимые результаты получают лишь при использовании показателя MHO у пациентов, применяющих непрямые антикоагулянты. К сожалению, при коагулопатиях, обусловленных недостаточностью коагуляционных факторов I, И, V, VII, X, болезнях печени и желчных путей ПТ при использовании тромбопластинов разных производителей (даже при вычислении MHO) существенно варьирует.
Причины ошибок
- Попадание в исследуемую кровь гепарина из венозного катетера.
- Гемолиз.
- Использование так называемого протромбинового индекса и нестандартизованных тромбопластинов служит причиной грубых ошибок интерпретации ПТ.
- Отсутствие или неэффективность системы внутреннего контроля качества.
- Одновременное использование разных показателей оценки результатов ПТ (например, MHO и протромбиновой активности плазмы по Квику) у больных, получающих непрямые антикоагулянты, закономерно приводит к путанице при оценке результатов. Для контроля лечения непрямыми антикоагулянтами обязательным и необсуждаемым требованием является вычисление показателя MHO.
Другие аналитические технологии
Для определения ПВ используют различные тромбопластины. Эти реагенты существенно отличаются технологией приготовления, источником сырья (мозг кролика, плацента и др.), а также своей способностью обнаруживать разные дефекты внешнего механизма свертывания.
Другим вариантом ПТ является исследование плазмы по Оурену. Для осуществления такого варианта оценки внешнего пути коагуляции в реагент дополнительно добавляют коагуляционный фактор V и фибриноген, что позволяет исключить влияние этих двух компонентов коагуляционного каскада на результаты ПТ.
В некоторых специальных коагулометрах реализованы технологии определения показателя MHO, основанные на использовании методов сухой химии (МНО-детекторы).
Для обнаружения эффектов ингибиторов волчаночного типа целесообразно использовать разведенный тромбопластин, способный коагулировать нормальную БТП за 40-45 с.
Современная медицина оперирует множественными диагностическими методами. И один из них – это анализ крови. Протромбин по Квику: что это такое и чем особенна данная процедура – разберемся далее.
Основная терминология и все самое главное об этой проблеме
Важно отметить, что это предшественник тромбина, того белка, который способен образовывать тромбы. Вырабатывается белок в печени, а для этого нужен витамин К.
Когда же делается анализ на протромбин?
- Для оценки работы печени.
- Для оценки функционирования пищеварительной системы.
- И для определения процессов свертываемости крови.
Так, в результате исследования на протромбин медики определяют протромбиновый индекс, протромбиновое время, МНО (то есть международное соотношение) и протромбин по Квику.
Протромбин по Квику: норма и определение
В далеком 1935 году ученый А.Квик предложил данный анализ для того, чтобы определять свертываемость крови по уровню в ней протромбина. Результаты анализа показывают, насколько в процентах активен протромбин в растворах нормальной плазмы.
Нужно отметить, что на сегодняшний день это один из самых популярных анализов на протромбин. Ведь он эффективен, малозатратный и дающий верные результаты.
Каковы же нормальные показатели, которые свидетельствуют о том, что с организмом все в порядке? Так, цифры должны находиться в диапазоне от 78 до 142.
В каких случаях нужно сдавать кровь на протромбин по Квику
- При всевозможных нарушениях, которые касаются свертываемости крови.
- В случае если надо выявить патологии печени.
- Для определения дефицита в организме витамина К4.
- Для контроля за свертываемостью крови во время приема антикоагулянтов.
Когда показатели бывают повышены
Бывает так, что протромбин по Квику повышен. Что же это может означать? Такое возможно в следующих ситуациях:
- Во время приема препаратов, которые называются антикоагулянты. А также при лечении антибиотиками и диуретиками.
- При таких проблемах, как онкологические опухоли, ДВС-синдром, лейкоз.
- Также показатели могут быть завышены в результате недостатка свертываемости крови, как приобретенного, так и врожденного.
Когда показатели могут быть понижены
Если речь идет о пониженных показателях, то это в первую очередь чревато различной сложностью кровотечениями. Иные ситуации, когда подобное явление может также наблюдаться:
- Если в организме недостаток витамина К, который улучшает свертываемость крови.
- При использовании определенных препаратов, которые способны влиять на свертываемость крови.
- Если в крови недостаток неких факторов (приобретенный или врожденный).
- Если в печени протекают патологические процессы, связанные со свертываемостью.
Чтобы сдать анализ на протромбин по Квику, для этого придется подготовиться. Так, кровь берут натощак, чаще всего – в утреннее время. За сутки до анализа лучше всего отказаться от жирной и жареной пищи. Ну и лучше всего не нагружать тело физическими и эмоциональными нагрузками. Перед анализом надо дать телу отдохнуть.
Рейтинг статьи 3.5 /5 — 2 оценокЛабораторный анализ может показать, что протромбиновый индекс понижен, поэтому пациент должен знать, что это значит. Исследования проводятся для того, чтобы оценить, в каком состоянии находится система свертываемости крови. Таким образом, выявляется величина протромбинового индекса (ПТИ). Из-за воздействия конкретных факторов показатели могут снижаться либо увеличиваться, что говорит о серьезном риске для здоровья.
Способ определения ПТИ
Кровь будет нормально сворачиваться, если в процессе активно участвует протромбин – белок, синтезируемый печеночными клетками. Чтобы вещество вырабатывалось в достаточном количестве, необходимо наличие многих микроэлементов, особенно витамина К. Вот почему при дефиците данного витамина появляются молекулы, которые образовывают тромбы.
Протромбин занимается налаживанием свертываемости жидкой ткани. Благодаря определению протромбинового числа, который является показателем сворачиваемости крови, можно узнать о присутствии какой-либо болезни. Для определения протромбина существуют разные виды исследований.
В частности, проводится вычисление:
- ПТИ по Квику. Данный метод исследования считается самым точным. Он помогает увидеть степень активности белка. Анализ предусматривает оценку соотношения показателя плазмы больного к контрольному образцу. Вычисляется ПТИ в процентах.
- Протромбинового времени. То есть устанавливается, на протяжении какого времени происходит сворачивание крови.
- Индекса протромбина – соотношения протромбинового времени, которое является нормой, к данным исследуемого.
- Протромбинового индекса МНО. При помощи такого теста проводится наблюдение за лечением больных, которым назначаются непрямые антикоагулянты – лекарства, которые замедляют процесс сворачиваемости и сокращают уровень белка.
Самые расширенные данные можно получить благодаря анализу по Квику, поскольку именно он дает возможность даже при наличии некоторых погрешностей устанавливать ПТИ и протромбиновое время максимально точно.
Норма ПТИ и показания к тестированию
Назначение на анализ возможно, если:
- пациент страдает от длительных кровотечений, что является следствием ;
- отмечается снижение функционирования печени и ее ферментов;
- врач подозревает развитие онкологического поражения крови;
- требуется проконтролировать степень сворачиваемости во время лечения антикоагулянтами.
В обязательном порядке коагулограмму проходят беременные, чтобы заранее выявить, к примеру, снижение протромбинового индекса.
Также направляются на анализ женщины от 45 лет, поскольку из-за трансформации гормонального фона происходят изменения в:
- структуре крови;
- ее составе – количественном и качественном.
В каждой лаборатории данные будут расшифровываться по-разному.
Подобное объясняется:
- Индивидуально установленными нормами.
- Качеством используемых реагентов и степенью модернизации оборудования.
- Особенностями анамнеза исследуемого.
Для мужчин и женщин нормальным является показатель – 78-142 % (если используется методика Квика). Когда результаты показывают ПТИ ниже 77 %, это говорит о том, что у пациента присутствует низкий протромбиновый индекс. Если он превышает 120 %, значит, индекс увеличенный.
ПТИ, по большому счету, зависит от наличия в организме патологии. Половая принадлежность особой роли не играет. Другое дело, если женщина в положении.
Важность определения ПТИ во время беременности
Любой женщине, вынашивающей малыша, обязательно назначается коагулограмма, при помощи которой устанавливается величина протромбинового индекса. Это необходимо для того, чтобы избежать сильных кровопотерь при родоразрешении либо не допустить тромбообразования.
Норма ПТИ, установленная для будущих мамочек, — 85-152 %. Когда отмечается снижение ПТИ, если данные показывают 80 % и меньше, возникает серьезная угроза для кровотечений. В таком случае прописываются коагулянты. Соответственно, если коэффициент увеличен, понадобятся препараты, с помощью которых можно устранить повышенную сворачиваемость крови.
Также необходимо определить протромбиновое время. Почему это настолько важно?
Когда врачу будет известно, за какой временной промежуток кровь сворачивается у роженицы, то удастся избежать:
- появления кровотечения;
- возникновения гемолитического шока, который является результатом сильных кровопотерь и из-за которого женщины при родах часто умирают.
Некоторые беременные отказываются выполнять врачебные рекомендации, будучи уверенными в том, что сдача анализов в большом количестве негативным образом сказывается на здоровье. Однако без сведений о величине ПТИ врач не сможет оказать своевременную помощь. Если индекс понижен, плацента может отслоиться либо начнутся послеродовые кровоизлияния. Тромбоз сосудов плаценты не исключается при повышении показателей.
Почему индекс снижается?
Тестирование для того и проводится, чтобы подтвердить или исключить отклонения от нормы. Естественно, когда ПТИ оказался пониженным, значит, существуют причины, которые необходимо установить. После анализа пациенту выдается результат в виде таблицы, где указывается величина индекса, а также снижающий фактор, из-за которого сдвиг произошел.
ПТИ будет понижен при:
- дефиците витамина К;
- недостатке протромбина врожденного или приобретенного характера;
- сбоях в функционировании печени и поджелудочной;
- употреблении препаратов на протяжении длительного срока, которые воздействуют на степень сворачиваемости крови.
Всегда необходимо помнить, насколько опасно состояние, при котором индекс протромбина существенно снижается. Чем показатель становится ниже, тем больше риска возникновения чрезмерной кровопотери, причем не исключается летальный исход.
Об уменьшении индекса можно догадываться по симптомам, которые указывают на проблемы с печенью и ЖКТ.
Больной будет страдать от:
- Слабости.
- Потери массы тела.
- Изменений вкуса.
Но главный и наиболее опасный признак – сильное кровотечение даже при небольшом порезе. Обычная ссадина на локте при низком ПТИ может обернуться потерей около 300 мл крови.
Никогда не стоит отказываться от прохождения анализов, ведь только так можно вовремя заметить первые нарушения в организме. Особенно внимательными к своему состоянию должны быть будущие мамы, потому что от их действий зависит не только их здоровье, но и жизнь ребенка, который должен появиться на свет.
Факторы тромбогенного риска у беременных.
При наличии в анамнезе женщины случаев привычного невынашивания беременности или потери плода в позднем сроке беременности, токсикозов второй
половины беременности, внутриутробной задержки развития плода, отслойки плаценты или инфаркта плаценты, ей показано проведение обследования на тромбофилию.
Гипергомоцистеинемия, которая развивается иногда под влиянием наследственного генетического полиморфизма, ассоциирована с поздним токсикозом и принимает участие в развитии инфарктов и отслойки плаценты. Воспаление эндотелиальной выстилки сосудов на фоне повышенного уровня гомоцистеина, вызывает повышенный риск как венозного, так и артериального тромбоза. К гипергомоцистеинемии может приводить наличие в организме измененных форм фермента метилентетрагидрофолатредуктазы (MTHFR), который в норме участвует в превращении гомоцистеина в метионин.
Наследственный полиморфизм фактора Лейдена (V), имеющий сильную предрасположенность к тромбозам, встречается с повышенной частотой у женщин с привычным невынашиванием.
Среди пациенток с привычным невынашиванием беременности, аномальные формы фактора V Лейден наиболее часто встречаются у женщин, имеющих выкидыши во втором триместре беременности.
Гипергомоцистеинемия сама по себе не имеет значительной ассоциации с потерей плода на раннем сроке беременности, что свидетельствует о том, что дефицит фолиевой кислоты и полиморфизм MTHFR могут действовать через дополнительные, пока еще неизвестные факторы. Повышенный уровень гомоцистеина также выявляется при беременностях, осложненных гестозом, и это повышение сохраняется после родов.
Другие причины плацентарного тромбоза.
Беременность может способствовать проявлению генетического дефекта, так как при ней развиваются следующие особенности:
- Физиологическое повышение коагуляции крови.
- Подавление растворения фибринового сгустка (фибринолиза).
- Снижение содержания и активности естественных антикоагулянтов крови.
- Повышение функциональной активности тромбоцитов.
- Эти изменения при беременности имеют охранительное значение, они предотвращают обильную кровопотерю в родах, но при этом они же провоцирую развитие тромбоза в сосудах плаценты, особенно при наличии врожденной патологии в системе гемостаза.
- Низкое сосудистое сопротивление плаценты и медленный кровоток в ее сосудах, является ключевым моментов в обеспечении хорошего кровоснабжения плода, но при этом создаются условия для отложения фибрина и образования тромбов.
- Нормальное увеличение уровня фибриногена и свертывающих белков во время беременности также может провоцировать тромбообразование. Понижение доступности фолиевой кислоты, поступающей с пищей, происходит при курении, и это может вызвать еще большее повышение уровня гомоцистеина.
Риск тромбоза при наследуемых формах тромбофилий может быть снижен путем применения небольших доз аспирина, гепарина, фолиевой кислоты, внутривенного введения иммуноглобулина G, или концентратов гематогенных факторов. Для носителей наследуемой тромбофилии с повторяющимися неблагоприятными исходами беременности, заслуживают внимания два варианта профилактического лечения: назначение низкомолекулярного гепарина (эноксапарина) женщинам с привычной поздней потерей плода и лечение фолиевой кислотой при тяжелом токсикозе 2-ой половины беременности.
У всех лиц — беременных и нет, потребление фолиевой кислоты значительно снижает уровень гомоцистеина. Эффективность является высокой в случаях, когда перед лечением уровень гомоцистеина был самым высоким и наименьшая, если уровень гомоцистеина был сравнительно небольшим. Уменьшение уровня гомоцистеина наблюдается при применении фолиевой кислоты в дозе от 0.5 мг до 5 мг в день в сочетании с витамином B6.
Высока вероятность тромбоэмболических осложнений и при наличии сердечнососудистых заболеваний, избыточной массы тела, анемии, перенесенном позднем токсикозе . Повышается риск тромбоза и у женщин в возрастной группе после 40 лет, при наличии злокачественных образований, малоподвижном образе жизни. Затяжные, длительные роды, кесарево сечение также предрасполагают к осложнениям. К группе очень высокого риска по развитию тромбозов, в том числе и в послеродовом периоде, относятся женщины с варикозной болезнью нижних конечностей.
Причины тромбозов
Прежде всего, развитие послеродового тромбоза связано с изменениями в свертывающей системе крови. Во время естественных родов или кесарева сечения теряется кровь. Объем кровопотери может быть разным — от минимального (физиологического) до значительного (патологического), что зависит от конкретной ситуации. В любом случае, организм стремится прекратить дальнейшее истечение крови, вырабатывая большое количество факторов, способствующих повышению свертывания крови путем образования сгустков-пробок в просвете сосудов. И чем больше кровопотеря, тем активнее эти процессы. Кроме того, при отхождении плаценты или из-за механического повреждения тканей во время операции повреждается и стенка сосудов, происходит выбрасывание в кровь особых белков и ферментов эндотелия (внутренней выстилки сосуда), что также немаловажно для сдвига процессов в сторону повышения свертывания крови.
Для снижения риска венозных тромбоэмболических осложнений во время беременности рекомендуется применение низкомолекулярных гепаринов (НМГ) в профилактических и промежуточных дозах в виде подкожных инъекций. Однако в настоящее время решение о назначении НМГ беременным женщинам принимается лишь на основании наличия тромботического анамнеза или при выявлении той или иной тромбофилии (мутации фактор V Лейден, мутации протромбина, дефицита антитромбина, носительства антифосфолипидных антител и др.). Эти показания для назначения НМГ субъективны, поскольку они не основываются на точных лабораторных данных измерения избыточной (тромбоопасной) активации свертывания крови в разные сроки беременности. Соответственно, использование этих показаний приводит к неоправданно широкому применению гепаринов во время беременности.
Вероятность образования тромбов во время беременности увеличивают врожденная тромбофилия (состояние повышенной свертываемости крови), кесарево сечение, зрелый возраст роженицы и избыточный вес. Если женщина ранее рожала три и более раз или имеет многоплодную беременность (двойня и более) риск тромбоза также повышается. Дополнительными факторами риска образования тромбов выступают: гипертония, сердечно-сосудистые заболевания и сахарный диабет; применение оральных контрацептивов перед беременностью; обезвоживание.
Важно отметить, что риск образования тромбов сохраняется в течение двух месяцев после родов.
Лечение тромбозов — сложный процесс, который обязательно должен происходить под контролем врача. Поэтому при наличии факторов риска рекомендуется проводить профилактику тромбоза. Профилактика может быть немедикаментозная и медикаментозная. Врач определяет степень риска для каждого пациента – низкую, умеренную, высокую. После этого подбирается метод профилактики. Как правило, одной немедикаментозной профилактики людям с повышенным риском развития тромбоза мало, поэтому вместе с ней проводится медикаментозная профилактика. В этом случае применяются специальные препараты, препятствующие образованию тромбов.
Антифосфолипидный синдром (АФС) является причиной многих акушерских осложнений, таких как синдром потери плода, HELLP-синдром, преждевременные роды. Высокий риск неблагоприятных акушерских исходов при АФС обусловливает необходимость планирования беременности и подбора адекватной терапии беременной с данной патологией.
На сегодняшний день АФС является одной из актуальных проблем в акушерской практике. Клиническими проявлениями АФС в акушерстве являются синдром потери плода, задержка внутриутробного развития плода, HELLP-синдром, маловодие, фето-плацентарная недостаточность, преждевременные роды, гестоз (преэклампсия и эклампсия). Синдром потери плода на сегодняшний день рассматривается как специфический маркер АФС. Прерывание беременности при АФС может произойти на любом сроке беременности, и очень часто самопроизвольный выкидыш является единственным симптомом, позволяющим заподозрить АФС у пациентки.
Высокий риск неблагоприятных акушерских исходов при АФС диктует необходимость планирования беременности у данных пациенток, тщательного подбора медикаментозной терапии и постоянного контроля за состоянием матери и плода.
На этапе планирования беременности у пациентки с АФС необходимо исключить сопутствующие факторы риска развития тромбозов. Спектр профилактических мероприятий включает в себя коррекцию избыточного веса, лечение сопутствующей артериальной гипертензии, коррекцию нарушений липидного спектра, отказ от курения, а также использование компрессионного трикотажа при посттромбофлебитическом синдроме.
Беременным с АФС с момента зачатия назначают низкие дозы АСК (50-100 мг в сутки, но не более 150 мг в сутки ) и низкомолекулярные гепарины до момента родов. Отменяют низкомолекулярные гепарины за 12-24 часа до родоразрешения. Лечение гепаринами возобновляют через 12 часов после родов на срок не менее 4-6 недель.
Своевременная диагностика и адекватная терапия АФС у беременных, тщательный контроль за показателями системы гемостаза, регулярный контроль за состоянием плода, совместное ведение беременности акушером-гинекологом и смежными специалистами позволяет улучшить перинатальные исходы.
Прием гематолога
Гематолог (гемостазиолог) – это врач, который проводит диагностику, лечение и профилактику болезней крови и различных отклонений в её состоянии, а также органов, принимающих участие в кроветворении.
Гематолог поможет будущим мамам избежать различных осложнений, возможных во время прохождения протокола ЭКО и повысить шанс на положительный исход процедуры. Причины неудачного завершения программы ЭКО часто связаны именно с нарушениями системы гемостаза.
Беременность, наступившая в результате ЭКО, обычно требует гормональной поддержки. Это может привести к проблемам со свертываемостью крови или нарушению процесса кровообращения.
Планируя визит к гематологу, следует иметь при себе результаты следующих исследований:Среди причин невынашивания плода на втором месте (после акушерско-гинекологических) стоят проблемы, связанные с системой гемостаза.
— Общий анализ крови (+ тромбоциты)
— Коагулограмма
— УЗИ сосудов нижних конечностей
Если ранее проводилось обследование системы гемостаза или генотипа, то результаты данных исследований также необходимо взять с собой на приём.
Если есть в наличии заключения смежных специалистов (эндокринолог, ревматолог, сосудистый хирург, кардиолог), то их тоже желательно предъявить специалисту.
В переводе с греческого языка слово гомеостаз обозначает haima – кровь, а stasis – стояние. Это сложный биологический процесс в организме, обеспечивающий его жизнеспособность. Он отвечает за поддержание определенного объема крови, предупреждает или тормозит кровопотери при травме или заболевании. Процесс свертывания крови является важнейшим механизмом гемостаза — остановки кровотечения.Свертывающая система крови — это фактически несколько взаимосвязанных реакций, протекающих при участии ферментов.На каждой стадии данного процесса происходит активация тринадцати видов белков (факторов свертывания крови). Их принято обозначать римскими цифрами (например, ФVII — фактор VII), а для активированной формы добавляют индекс «а» (ФVIIa — активированный фактор VIII). Уменьшение содержания или активности факторов свертывания во время беременности может сопровождаться повышенной кровоточивостью, например, из десен.
Избыточная же активация гемостаза приводит к развитию тромбозов (тромбофилии). Тромбофилия может стать причиной дисфункции яичников с неправильным дозреванием фолликула и формированием неполноценных яйцеклеток, что приводит к ановуляторному бесплодию. При наличии у женщины наследственной и приобретённой формы тромбофилии, возможны возможны выкидыш, остановка развития плода, отслоение плаценты, преждевременные роды и, как самый трагический исход — гибель плода в утробе матери.На этапе подготовки к зачатию ребёнка обязательно следует посетить врача-гематолога, если у будущей матери:70% осложнений течения беременности связаны с нарушениями в свертывающей системе крови!
— Уровень гемоглобина ниже 90 г/л
— Уровень тромбоцитов ниже 80*10/9
— Две и более репродуктивные потери в анамнезе на сроке более 10-ти недель(при этом, есть основания считать причиной невынашивания нарушения, связанные с системой гемостаза)
— Наличие тромбозов у беременной и родственников первой линии (до 50 лет)
— Если в анамнезе присутствуют заболевания, связанные с нарушением норм СОЭ
Приём гематолога показан беременной женщине в следующих случаях:
— снижение уровня тромбоцитов (гестационная тромбоцитопения),
— нарушение кровотока при УЗИ,
— изменения в анализе «коагулограмма»,
— повышение гомоцистеина,
— резус-конфликт,
— антифосфолипидный синдром.
Выше перечисленные изменения формулы крови являются тревожным сигналом. Важно своевременно их выявить и принять меры по предотвращению развития патологического процесса. Это поможет сохранить здоровье будущей матери и плода.
Заболевания крови имеют симптоматику, схожую с рядом других патологий. Поэтому, чаще всего к гематологу направляют специалисты других профилей.
Поводом обращения к гематологу могут быть:
— Регулярное повышение температуры тела при отсутствии других заболеваний.— Постоянная слабость, усталость.
— Потеря веса при нормальном питании.
— Чрезмерная потливость.
— Изменение цвета кожных покровов.
— Чрезмерное покраснение лица, устойчивый «багряный» оттенок.
— Постепенное снижение аппетита.
— Хрупкость, ломкость сосудов, капилляров, постоянное образование синяков.
— Регулярное ощущение покалывания в пальцах рук и ног.
— Повышение или снижение гемоглобина, выходящие за рамки нормы.
— Увеличение лимфоузлов.
— Медленное заживление царапин, ран, кровоточивость.
— Хроническая головная боль неясной этиологии.
— Низкий уровень иммунитета (часто диагностируются вирусные или простудные заболевания).
— Планирование беременности.
— Проживание в зоне с повышенным радиоактивным фоном.
Показатели свертывающей системы крови (коагулограмму) исследуют трижды во время беременности! Если нет подозрений на патологию со стороны свертывающей системы крови, гематологу обычно достаточно оценки показателей АЧТВ, фибриногена и протромбина. Дополнительно исследуются показатели уровней гомоцистеина и Д-димера.
Чем отличается врач-гематолог от врача-гемостазиолога?
Врач-гемостазиолог занимается исключительно гемостазом, то есть проблемами нарушения свёртываемости крови. К специалисту нужно обращаться при повышенной кровоточивости либо, напротив, при образовании тромбов.
Врач-гематолог это специалист широкого профиля. Он занимается проблемами всего кровяного русла, онкоскриннингом, дифференциальной диагностикой лимфоаденопатии (увеличение подчелюстных, шейных, подмышечных, паховых лимфатических узлов) и спленомегалии, диагностикой и лечением опухолей кроветворной системы.Протромбиновое время
Протромбиновое времяПротромбин время
Протромбиновое время или PT — оценка внешнего и общие пути. PT — это специальный и единственный лабораторный тест, используемый для измерения эффективности кумаринового ряда антикоагулянтные препараты, такие как варфарин натрия (кумадин). Самые распространенные методы сообщить PT — это время (в секунд) и международного нормализованного отношения ( INR ).
- PT указывается как время в секундах, показывает, сколько времени требуется пробе плазмы для сгусток после добавления смеси тромбопластина и кальция. Если у пациента в крови меньше протромбина, чем в норме (или «контроле»), или снижение других факторов свертывания, влияющих на протромбиновое время, PT время в секундах будет больше контрольных значений. Нормальные значения для PT время в секундах составляет от 11 до 13 секунд, в зависимости от метода, используемого лабораторией.
- Отдать PT ценит последовательную основу для сравнения от лаборатории к лаборатории, Всемирная организация здравоохранения ввела INR, единое значение, в котором PT выражается в виде отношения. В последние несколько лет INR становится все более общий метод измерения и составления отчетов PT . Целевые значения МНО варьируются в зависимости от причины антикоагуляции. Для Например, пациент, перенесший операцию на бедре, которому вводят антикоагулянты для предотвращения тромбоз глубоких вен может иметь целевой МНО от 2 до 3.Предотвращать артериальный тромбоз у пациента с искусственным сердечным клапаном, МНО терапевтическое цель может находиться в диапазоне от 2,5 до 3,5.
Поскольку оральный кумадин имеет относительно длительное начало действия, для достижения терапевтического эффекта требуется несколько дней терапии. уровень. Когда пациенту будет назначен кумадин перорально, ему или ей могут назначить и гепарин, и кумадин, а затем отменяют гепарин. Если PT увеличивается сверх терапевтического уровня, доза кумадина может быть уменьшена, или пациенту можно вводить витамин К. парентерально.Лекарства, увеличивающие или продлевающие PT раз включают антибиотики, циметидин (тагамет), салицилаты и сульфаниламиды. Барбитураты, оральные контрацептивы, и витамин К в поливитаминных препаратах или в жидких пищевых добавках. уменьшите время PT .
При терапии кумадином Начинают, дозу ориентируют, отслеживая протромбиновое время. Лечебный уровни обычно от 1,5 до 2 раз выше нормы, в зависимости от состояния пациента. необходимость антикоагуляции.Выраженный в единицах INR, диапазон находится между 2.0 и 3.0. Обычная доза составляет от 5 до 7,5 мг. ежедневно. В некоторых Пациентам с устойчивостью к кумадину дозировка может быть намного выше. Если пациент с продленным PT должен иметь хирургии, важно, чтобы PT быть приведенным в нормальный диапазон перед операцией. Часто это делают с витамином. K инъекций. Цельная кровь или свежезамороженная плазма должны быть доступны для хирургический пациент с аномалией PT .
Читайте о проблемах, связанных с тестированием антикоагулянтной терапии, в Международный нормализованный коэффициент (INR) (Скорая медицинская помощь) Мир ! Роберт К. Нис, RN, MSN, CEN )
Мгновенная обратная связь:
The МНО становится все более важным способом измерения и регистрации протромбина. время.
RnCeus Домашняя страница | Курс каталог | Скидка цены | Авторизоваться | Уход вакансии | Помощь
Протромбиновое время и международное нормализованное отношение (PT / INR)
Протромбиновое время (PT) — это тест, который помогает оценить вашу способность соответствующим образом формировать тромбы.Международное нормализованное соотношение или МНО — это расчет, основанный на результатах ПК, который используется для наблюдения за пациентами, которые получают разжижающий кровь препарат (антикоагулянт) варфарин (кумадин®).
PT измеряет количество секунд, необходимое для образования сгустка в вашем образце крови после добавления веществ (реагентов). PT часто выполняется вместе с частичным тромбопластиновым временем (PTT), и вместе они оценивают количество и функцию белков, называемых факторами свертывания крови, которые являются важной частью правильного образования сгустка крови.
В организме при травме и кровотечении начинается процесс свертывания крови, называемый гемостазом. Этот процесс частично включает серию последовательных химических реакций, называемых каскадом коагуляции, в котором факторы свертывания или «свертывания» активируются один за другим и приводят к образованию сгустка. Для нормального свертывания крови должно быть достаточное количество каждого фактора свертывания, и каждый должен функционировать должным образом. Слишком мало может привести к обильному кровотечению; слишком много может привести к чрезмерному свертыванию.
В пробирке во время лабораторного исследования есть два «пути», которые могут инициировать свертывание, так называемые внешние и внутренние пути. Оба они затем сливаются в общий путь для завершения процесса свертывания крови.
- Тест PT оценивает, насколько хорошо все факторы свертывания во внешних и общих путях каскада коагуляции работают вместе. Включены: факторы I (фибриноген), II (протромбин), V, VII и X.
- PT / INR можно проводить одновременно с PTT, который оценивает факторы свертывания, которые являются частью внутренних и общих пути: XII, XI, IX, VIII, X, V, II (протромбин) и I (фибриноген), а также прекалликреин (PK) и высокомолекулярный кининоген (HK).
PT и PTT оценивают общую способность образовывать сгусток за разумный промежуток времени, и, если какой-либо из этих факторов недостаточен в количестве или не функционирует должным образом, результаты теста будут продлены.
PT обычно измеряется в секундах и сравнивается с нормальным диапазоном, который отражает значения PT у здоровых людей. Поскольку реагенты, используемые для проведения теста PT, меняются от одной лаборатории к другой и даже в пределах одной и той же лаборатории с течением времени, нормальные диапазоны также будут колебаться.Для стандартизации результатов в различных лабораториях США и мира комитет Всемирной организации здравоохранения (ВОЗ) разработал и рекомендовал использовать интернационализированное нормализованное отношение (INR) , рассчитанное на основе результата теста PT, для людей, которые получают антикоагулянт варфарин (Coumadin®). Варфарин назначают людям с различными заболеваниями, такими как тромбоз глубоких вен (ТГВ) и некоторыми сердечно-сосудистыми заболеваниями (ССЗ), такими как фибрилляция предсердий, для «разжижения» их крови и предотвращения неправильного свертывания крови.
INR — это расчет, который корректируется с учетом изменений в реагентах для ПК и позволяет сравнивать результаты из разных лабораторий. Большинство лабораторий сообщают значения PT и INR всякий раз, когда проводится тест PT. Однако МНО должно применяться только для тех, кто принимает разжижающий кровь препарат варфарин.
Полиморфизм протромбина G20210A (rs1799963) увеличивает риск инфаркта миокарда в зависимости от возраста: систематический обзор и метаанализ
Характеристики выявленных исследований
Как показано на рис.1, 199 исследований были найдены в PubMed, 508 исследований — в EMBASE, 460 исследований — в Web of Science и 142 исследования — в CNKI; Из ссылок в обзорах были отобраны 3 дополнительные статьи, чтобы сделать наш поиск всеобъемлющим. После исключения повторяющихся записей было идентифицировано 523 опубликованных записи. Триста девяносто шесть записей были исключены после оценки названия / реферата. Полнотекстовые статьи из остальных 127 записей были оценены на соответствие критериям. Изо всех сил стараясь связаться с первыми и соответствующими авторами для получения необходимых данных, в конечном итоге было выбрано 34 исследования для нашего метаанализа 4,5,6,8,10,11,12,13,14,15,16 , 17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39 .
Рисунок 1Блок-схема включенных исследований для метаанализа полиморфизма протромбина G20210A и риска инфаркта миокарда.
Было проведено одно проспективное исследование 6 и 33 поперечных исследования случай – контроль. Двадцать два исследования включали пациентов европеоидной расы 4,6,11,13,14,16,18,20,21,23,24,25,26,27,29,33,34,35,36,37,38, 39 , 9 включали неевропейцев 8,10,12,15,17,19,28,30,32 , а 3 не отражали этническую принадлежность субъектов 5,22,31 .Поскольку исследуемая популяция частично совпадала в двух отчетах 6,39 , данные Марен 39 оценивались только в анализе подгруппы> 55 лет, а не в общем анализе.
Всего в метаанализ было включено 14 611 случаев и 84 358 контролей. Основные характеристики, включая первого автора, год публикации, страну исследования, этническую принадлежность, возрастную категорию пациентов с ИМ, источник контроля, метод генотипирования, частоты генотипов и частоты минорных аллелей, представлены в дополнительной таблице S1.Номер аллеля, но не частота генотипа, был доступен в одном исследовании 27 , которое, следовательно, было включено только в анализ аллельной модели. Поскольку было только одно подходящее исследование 19 гомозиготных и рецессивных моделей в некавказском анализе подгруппы, гомозиготный и рецессивный анализ не проводился в некавказской подгруппе.
Протромбин G20210A и инфаркт миокарда
В целом, в 33 исследованиях был проведен метаанализ 13 488 случаев и 77 085 контролей.Средний возраст составил 48,41 года в случаях и 47,16 года в контрольной группе. Связь между распределением аллелей аденина (A) протромбина G20210A и риском инфаркта миокарда рассчитывалась по сравнению с аллелем гуанина (G) дикого типа в модели аллелей (A против G). Точно так же связь между частотой конкретного генотипа и риском инфаркта миокарда оценивалась в доминантной модели (AG + AA против GG), рецессивной модели (AA против AG + GG), гомозиготной модели (AA против GG) и гетерозиготной модели ( AG vs. GG) соответственно. Статистически значимая ассоциация была обнаружена в модели аллелей (мутация аллеля [A] по сравнению с аллелем [G] дикого типа, модель случайных эффектов [REM], отношение шансов [OR] = 1.43, 95% доверительный интервал [95% ДИ]: 1,18–1,72, p = 0,0002; Рис. 2), гетерозиготная модель (GA против GG, REM OR = 1,41, 95% CI: 1,16–1,72, p = 0,0007; рис. 3) и доминантная модель (GA + AA против GG, REM OR = 1,41, 95% ДИ: 1,15–1,72, p = 0,0007; рис. 4). Однако не было обнаружено значимой связи у гомозигот (AA против GG, модель фиксированных эффектов [FEM] OR = 1,42, 95% CI: 0,58–3,48, p = 0,45; дополнительный рисунок S1) и рецессивных (AA против GA + GG, FEM OR = 1,39, 95% ДИ: 0,56–3,42, p = 0,48; дополнительный рисунок S2) сравнение.Результаты сведены в Таблицу 1 и Дополнительную Таблицу S2.
Рисунок 2Лесной график для общего анализа ассоциации полиморфизма протромбина G20210A и риска инфаркта миокарда в модели аллелей (аллель A против аллеля G). CI: доверительный интервал, OR: отношение шансов, MI: инфаркт миокарда.
Рисунок 3Лесной график для общего анализа ассоциации полиморфизма протромбина G20210A и риска инфаркта миокарда в гетерозиготной модели (GA vs.ГГ). CI: доверительный интервал, OR: отношение шансов, MI: инфаркт миокарда.
Рисунок 4Лесной график для общего анализа ассоциации полиморфизма протромбина G20210A и риска инфаркта миокарда в доминантной модели (GA + AA против GG). CI: доверительный интервал, OR: отношение шансов, MI: инфаркт миокарда.
Таблица 1 Сводные OR для ассоциации SNP протромбина G20210A с инфарктом миокарда.Кроме того, SNP протромбина G20210A был аналогичным образом связан с ИМ в трех генетических моделях у европеоидов (аллельная модель, REM OR = 1.40, 95% ДИ: 1,14–1,72, p = 0,0012; модель гетерозиготы, REM OR = 1,37, 95% CI: 1,11–1,70, p = 0,0039; доминантная модель, REM OR = 1,37, 95% CI: 1,10–1,69, p = 0,0045), но не у неевропейцев (аллельная модель, OR FEM = 1,51, 95% CI: 1,06–2,14, p = 0,022; гетерозиготная модель, FEM OR = 1,51, 95% CI: 1,05–2,15, p = 0,0244; доминирующая модель, OR FEM = 1,52, 95% CI: 1,06–2,16, p = 0,022). В таблице 1 представлены результаты общего анализа и анализа подгрупп.
Протромбин G20210A и риск инфаркта миокарда до и после 55 лет
Двадцать отчетов 4,10,11,12,13,14,15,16,17,18,19,20,21,22,23 , 24,25,26,27,28 (по 5 294 пациентам и 8 149 контрольным) предоставили данные по субъектам моложе 55 лет.Четыре исследования 14,32,38,39 набрали 2 174 пациента с ИМ и 8 261 контрольную группу без ИМ старше 55 лет, соответственно. Средний возраст составил 41,75 года в случаях и 42,03 года в контрольной группе в подгруппе до 55 лет и 64,33 года в случаях и 56,96 года в контроле в подгруппе старше 55 лет. Метаанализ подгруппы показал, что в трех генетических моделях была обнаружена значимая связь между протромбином G20210A и ИМ у пациентов моложе 55 лет (аллельная модель, REM OR = 1,76, 95% CI: 1.32–2,35, p = 0,0001; модель гетерозиготы, REM OR = 1,70, 95% CI: 1,24–2,33, p = 0,0011; доминантная модель, REM OR = 1,70, 95% CI: 1,24–2,34, p = 0,001), но не у лиц старше 55 лет (аллельная модель, OR REM = 1,43, 95% CI: 0,84–2,43, p = 0,18; гетерозиготная модель , OR FEM = 1,34, 95% CI: 0,98–1,84, p = 0,07; доминирующая модель, OR FEM = 1,35, 95% CI: 0,99–1,85, p = 0,06) (дополнительные рисунки S3 – S8).
Анализ чувствительности и систематическая ошибка публикации
Независимые исследования были последовательно опущены, чтобы проверить, значительно ли отличаются пересчитанные OR по сравнению с исходными комбинированными эффектами.Мы не обнаружили явных изменений на протяжении всего анализа, что позволяет предположить, что наши результаты стабильны (дополнительный рисунок S9).
Систематическая ошибка публикации исследований была оценена качественно с помощью воронкообразного графика Бегга и теста линейной регрессии Эггера. Значения p составляли 0,28 (модель аллеля), 0,62 (модель гомозиготы), 0,13 (модель гетерозиготы), 0,13 (доминантная модель) и 0,62 (рецессивная модель) на графике воронки Бегга (рис. 5) и 0,27 (модель аллеля). 0,43 (модель гомозиготы), 0,09 (модель гетерозиготы), 0.09 (доминирующая модель) и 0,40 (рецессивная модель) в тесте Эггера (дополнительный рисунок S10). На основании этих результатов в выбранных нами статьях не было обнаружено предвзятости публикации.
Рисунок 5Оценка систематической ошибки публикации о взаимосвязи между полиморфизмом G20210A и восприимчивостью к ИМ с помощью воронкообразных графиков Бегга в пяти генетических моделях.
D-димер и протромбиновое время являются важными индикаторами тяжелого COVID-19 и плохого прогноза
Цель .Изучить значение показателей коагуляции D-димера (DD), протромбинового времени (PT), активированного частичного тромбопластинового времени (APTT), тромбинового времени (TT) и фибриногена (Fg) в прогнозировании тяжести и прогноза COVID-19. Методы . Всего было включено 115 пациентов с подтвержденным COVID-19, которые были госпитализированы в больницу Тянью Уханьского университета науки и технологий в период с 18 января 2020 года по 5 марта 2020 года. Были протестированы динамические изменения DD, PT, APTT и Fg, а также изучена корреляция с компьютерной томографией, клинической классификацией и прогнозом. Результатов . Нарушение свертывания крови возникло на ранней стадии инфекции COVID-19, у 50 (43,5%) пациентов была повышена DD, а у 74 (64,3%) пациентов — Fg. Уровни DD и Fg коррелировали с клинической классификацией. Среди 23 умерших пациентов у 18 была повышена DD при первом лабораторном тесте, у 22 — DD увеличилась при втором и третьем лабораторных исследованиях, а у 18 — увеличилась продолжительность PT при третьем тесте. Результаты ROC-анализа риска смертности показали, что AUC DD были равны 0.742, 0,818 и 0,851 в трехкратном тестировании соответственно; PT составил 0,643, 0,824 и 0,937. Кроме того, с прогрессированием заболевания изменение изображения КТ было тесно связано с увеличением значения DD (). Выводы . Дисфункция свертывания крови чаще встречается у тяжелых и критических пациентов. DD и PT могут быть использованы в качестве значимых индикаторов при прогнозировании смертности от COVID-19.
1. Введение
COVID-19, который возник в Ухане, провинция Хубэй, Китай, вызван коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2).Обычно он передается воздушно-капельным путем и при тесном контакте. Основное клиническое проявление — поражение легких [1, 2]. У большинства пациентов прогноз благоприятный, но у некоторых быстро развиваются тяжелые и критические случаи с респираторным дистресс-синдромом, дисфункцией свертывания крови, полиорганной недостаточностью и т. Д. [3, 4]. Поэтому раннее определение степени тяжести очень важно для клинической диагностики и лечения COVID-19. Обычно используемые клинические лабораторные индексы коагуляции, такие как D-димер (DD), протромбиновое время (PT), активированное частичное тромбопластиновое время (APTT), тромбиновое время (TT) и фибриноген (Fg), могут точно отражать состояние свертывания крови тело.
Целью отчета является исследование роли динамических изменений DD, PT, APTT, TT и Fg в прогнозировании тяжести и прогноза у пациентов с COVID-19.
2. Материалы и методы
2.1. Источник пациентов и критерии диагностики
Была собрана информация о 115 пациентах с подтвержденным COVID-19, которые были госпитализированы в больницу Тянью при Уханьском университете науки и технологий в период с 18 января 2020 г. по 5 марта 2020 г. .Подтвержденные пациенты имели положительный результат теста на нуклеиновую кислоту SARS-CoV-2 с помощью флуоресцентной RT-PCR в реальном времени. Были проведены три клинические оценки болезни с использованием собранных лабораторных данных. Изучены случаи выписки из стационара, смерти и лечения при длительности госпитализации более 14 дней до 5 марта 2020 года. Случаи с неполными лабораторными данными или с продолжительностью госпитализации менее 14 дней до 5 марта 2020 г. были исключены. Это исследование было одобрено Наблюдательным советом по медицинской этике Уханьского университета науки и технологий (No.202009).
2.2. Клинические классификации
2.2.1. Идентификация случая
В соответствии с Руководством по коронавирусным заболеваниям 2019 г .: Профилактика, контроль, диагностика и лечение, редактируемым Национальной комиссией здравоохранения Китайской Народной Республики, все случаи были разделены на четыре категории: легкие, обычные и тяжелые. случаи и критические случаи. (1) Легкие случаи имели легкие клинические симптомы и отсутствие проявлений пневмонии на изображениях. (2) В обычных случаях наблюдались такие симптомы, как лихорадка и симптомы со стороны дыхательных путей, а проявление пневмонии можно увидеть на изображениях.(3) В тяжелых случаях встречалось любое из следующего: респираторная недостаточность, количество вдохов / мин; насыщение кислородом менее 93% в состоянии покоя; или артериальное парциальное давление (). Пациенты с прогрессированием поражения> 50% в течение 24-48 часов при визуализации легких рассматривались как тяжелые случаи. (4) В критических случаях встречалось одно из следующих: возникает дыхательная недостаточность и требуется искусственная вентиляция легких; происходит шок; или осложнен недостаточностью других органов, требующей наблюдения и лечения в отделении интенсивной терапии.
2.2.2. Исход болезни
В зависимости от клинического прогрессирования исходы по конечным точкам были разделены на четыре типа: выписка из больницы, улучшение, обострение и смерть.
2.3. Сбор данных
Лабораторные данные были собраны в трех временных точках: госпитализация, 3-5 дней госпитализации и комбинированная конечная точка. DD, PT, APTT и Fg были получены и обозначены как DD1-3, PT1-3, APTT1-3, TT1-3 и Fg1-3 соответственно. Тем временем были определены идентификация случая, идентификация с помощью изображений и исход болезни.
2.4. Статистические методы
Статистический анализ проводился с использованием программного обеспечения SPSS 25.0. Описательная статистика включала средние значения и стандартные отклонения. Для анализа различий между группами использовались критерий Краскела-Уоллиса и критерий хи-квадрат независимой выборки. Кривая рабочих характеристик приемника (ROC-кривая) использовалась для расчета площади под кривой (AUC) DD и PT, чтобы оценить чувствительность и специфичность этих факторов при прогнозировании смертности и выписки из больницы.Анализ ранговой корреляции Спирмена был использован для измерения степени корреляции между иерархически упорядоченными переменными в этом исследовании. Статистически значимым считалось значение <0,05.
2,5. Вовлечение пациентов и общественности
Это было ретроспективное исследование серии случаев, и пациенты не принимали непосредственного участия в дизайне исследования, постановке вопросов исследования или оценке результатов. Пациентов не просили дать совет относительно интерпретации или записи результатов.
3. Результаты и обсуждение
3.1. Демографические характеристики
Среди 115 пациентов с COVID-19 средний возраст составлял (27-96) лет, мужчины — 66 (57,4%), женщины — 49 (42,6%) и старше 60 лет — 78 ( 67,8%) случаев. На момент поступления легкие и обычные пациенты составляли 39 (33,9%) случаев, тяжелые пациенты — 48 (41,7%) случаев, критические пациенты — 28 (24,3%) случаев (таблица 1). В этом исследовании больше пациентов составляли мужчины и больше пациентов старше 60 лет, что согласуется с предыдущим литературным отчетом [1].
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Взаимосвязь между динамическими изменениями DD, PT, APTT, TT, Fg и прогнозом COVID-19Были обнаружены значительная разница () и положительная корреляция между DD, PT и результатами в составных конечных точках. Корреляция при третьем обнаружении была сильнее, чем при первом и втором обнаружении. Среди 23 умерших пациентов у 18 (78,3%) случаев был повышен DD1, у 12 из 18 — DD1 в два раза выше (> 1,10 мг / л), у 22 случаев — DD2 и DD3, у 21 из 22 — DD2 и DD3 два раза. раз выше (> 1.10 мг / л). В восьми случаях у пациентов с обострением отмечалось повышение DD2 и DD3 все выше (1,10 мг / л) (Таблица 3).
3.4. Анализ DD и PT в прогнозировании выписки из больницы и смертности от COVID-19Мы использовали анализ кривой ROC для оценки диагностической ценности выписки из больницы и смертности у 115 пациентов. AUC DD1, DD2 и DD3 для прогнозирования выписки из больницы и смертности составляли 0,742, 0,818 и 0,851 соответственно (рис. 1 (а)). AUC для PT1, PT2 и PT3 для прогнозирования выписки из больницы и смертности составляли 0,643, 0,824 и 0,937 соответственно (рис. 1 (b)). 3.5. Динамические изменения КТ-изображений грудной клетки, DD и CTA у пациентов с COVID-19На ранней стадии заболевания корреляция между изменениями компьютерной томографии и значением DD не была очевидна; однако по мере прогрессирования заболевания изменение CT было тесно связано с увеличением значения DD, и наблюдалась значительная статистическая разница (Таблица 4).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Не соответствует принятому только в России протромбиновому индексу (ПТИ).
Не соответствует принятому только в России протромбиновому индексу (ПТИ). к. препарат сорбируется пищей.
к. препарат сорбируется пищей.