Принцип метода диализа, его практическое значение. — Студопедия.Нет
Молекулярная масса, размеры и формы молекул белков. Общая характеристика физико-химических свойств белков. Растворимость и осаждаемость белков. Факторы стабилизации белковые молекулы в растворах.
Белки — высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков — и от количества входящих в него протомеров (или субъединиц).
По форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
1) большая молекулярная масса, которая колеблется в диапазоне от 6000 до нескольких миллионов дальтон.
2) растворимость, хорошо растворимы в воде. Причем растворы белков в воде весьма устойчивы. Первой причиной растворимости белков является наличие на поверхности молекул белков заряда, благодаря чему белковые молекулы практически не образуют нерастворимые в воде агрегаты. Второй причиной устойчивости белковых растворов является наличие у белковой молекулы гидратной (водной) оболочки. Гидратная оболочка отделяет белки друг от друга.
3) высаливание, то есть способность выпадать в осадок под действием водоотнимающих средств. Высаливание – процесс обратимый. Эта способность то переходить в раствор, то выходить из него очень важна для проявления многих жизненных свойств.
4) амфотерность, то есть наличие, как кислотных, так и основных свойств. Амфотерность связана с наличием в составе некоторых аминокислот свободных карбоксильных групп и аминогрупп. Это приводит к тому, что в кислой среде белки проявляют щелочные свойства, а в щелочной среде – кислотные. Однако при определенных условиях белки проявляют нейтральные свойства. Значение рН, при котором белки проявляют нейтральные свойства, называется изоэлектрической точкой. Изоэлектрическая точка для каждого белка индивидуальна. Белки по этому показателю делят на два больших класса – кислые и щелочные, так как изоэлектрическая точка может быть сдвинута либо в одну, либо в другую сторону.
5) способность к денатурации, Денатурация — это потеря белком нативности. Она заключается в постоянном или временном нарушении вторичной и третичной структуры белка, но при этом первичная структура сохраняется. Помимо температуры (выше 50 градусов) денатурацию могут вызвать другие физические факторы: излучении, ультразвук, вибрация, сильные кислоты и щелочи. Денатурация может быть обратимой и необратимой.
Полярные группы белков способны взаимодействовать с водой, а также с низкомолекулярными органическими соединениями и ионами. Количество воды, связанной с белком, достигает 30-50 г на 100 г белка. Гидрофильных полярных групп значительно больше на поверхности белковой глобулы, чем внутри ее, эти группы образуют так называемую гидратную оболочку белковой молекулы. Но есть и гидрофобные белки, они нерастворимы в воде, но растворяются в жирах (липидах) и встречаются в основном в клеточных мембранах.
Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка.
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции.
Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренатурация. Иногда достаточно просто удалить денатурирующий объект.
Высаливание – это добавление растворов нейтральных солей (Na2SO4, (Nh5)2SO4). Анионы (SO42–) и катионы (Na+, Nh5+) взаимодействуют с зарядами белка (группы Nh5+ и COO–). В результате заряд исчезает
При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки, но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, антисептическое действие этанола.
Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда, уменьшению гидратной оболочки и снижению растворимости молекулы.
Факторы стабилизации белка в растворе.
ГИДРАТНАЯ ОБОЛОЧКА- это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами. Вода гидратной оболочки обладает особыми свойствами: она не является свободной, а связана с белковой молекулой. Это — “связанная” вода. Она принадлежит белку, и поэтому имеет особые свойства.
а) Температура кипения выше 1000С.
б) Температура замерзания ниже 0ОС.
в) В воде гидратной оболочки не растворяются различные соли и другие гидрофильные вещества.
г) Окружая каждую молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться, соединиться и выпасть в осадок.
ЗАРЯД БЕЛКОВОЙ МОЛЕКУЛЫ-Поверхность большинства белковых молекул заряжена потому, что в каждой молекуле белка есть свободные заряженные СОО-и Nh4+группы. Изоэлектрическая точка (ИЭТ) большинства белков организма находится в слабокислой среде. Это означает, что у таких белков количество кислотных (СООН) групп больше количества основных групп (Nh4). рН плазмы крови около 7,36 — это выше ИЭТ большинства белков, поэтому в плазме крови белки имеют отрицательный заряд.
Принцип метода диализа, его практическое значение.
Диализ – очистка коллоидных растворов, в том числе и искусственное очищение крови и других жидкостей человеческого организма от скопившихся шлаков. Без диализа все пациенты с неработающими почками умерли бы от скопления токсинов в организме.
Электрические свойства белков. Механизм возникновения электрического заряда белков. Изоэлектрическая точка. Электрофоретическое разделение белков сыворотки крови на бумаге, протеинограмма здорового человека.
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды
Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда.
Как работает диализ?
Диализ удаляет из организма продукты обмена веществ и жидкости, которые ваши почки не в состоянии удалить. Целью диализа также является поддержание баланса организма путем корректировки уровней различных токсических веществ в крови. Без диализа все пациенты с неработающими почками умерли бы от скопления токсинов в организме.
Принципы диализа
.
Полупроницаемая мембрана
В процессе диализа полупроницаемая мембрана отделяет кровь от диализного раствора. Эта мембрана пропускает через себя только определенные вещества. Она позволяет удалить продукты обмена веществ, воду, электролиты и другие вещества из крови в диализный раствор (и иногда в другом направлении) посредством процесса, называемого диффузией. Перемещение продуктов жизнедеятельности и других веществ зависит от проницаемости мембраны, размера и структуры различных веществ, состава диализного раствора и подачи крови к мембране.
Кровоснабжение
Чем эффективнее подача крови к мембране, тем выше качество диализной терапии. При гемодиализе подача крови может контролироваться диализным аппаратом.
Диализирующий раствор
В случае применения любого из двух методов диализа диализирующий раствор обеспечивает удаление из крови продуктов обмена веществ. Кроме этого, он содержит определенные вещества, помогающие корректировать дисбаланс, являющийся результатом почечной недостаточности.
Удаление жидкости
Удаление жидкости при гемодиализе достигается путем очень разных процессов (в отличие от перитонеального диализа). При гемодиализе диализный аппарат использует разницу давлений, чтобы спровоцировать жидкость выходить из крови через мембрану в диализирующий раствор. При перитонеальном диализе в диализном растворе используется глюкоза. Это дает эффект стимулирования перемещения избыточной жидкости из крови в диализный раствор, который периодически сливают. Цель диализа
Цель диализа
Какой бы метод диализа не использовался, он преследует следующие цели: удаление продуктов обмена веществ, удаление лишней жидкости, корректировка электролитного дисбаланса и корректировка уровня pH организма.
Компенсационный диализ и вивидиализ
Для очистки биологических жидкостей, представляющих собой коллоидные системы, применяют компенсационный диализ,в котором вместо чистого растворителя используют физиологические растворы, содержащие в своем составе те же низкомолекулярные вещества (и в том же количестве), что в норме должны присутствовать в дисперсной системе. В результате из крови удаляются только чужеродные «шлаки», т.е. продукты метаболизма, распада тканей.
Компенсационный диализ используется для исследования состава биологических жидкостей, избирательной очистки их от строго определенных низкомолекулярных примесей. В этом случае омываемый раствор содержит только те вещества, которые нужно сохранить в исходной системе.
С помощью компенсационного диализа можно не только определить природу тех или иных примесей в биологической жидкости, но и установить их концентрацию. Разновидностью компенсационного диализа является вивидиализ, в ходе которого очистку биологической жидкости (крови) осуществляют «вживую». При этом в концы перерезанного кровеносного сосуда вставляются стеклянные канюли. Их разветвленные части соединяются между собой трубочками, стенки которых образованы полупроницаемым материалом. Вся система снаружи омывается физиологическим раствором (рис. 55).
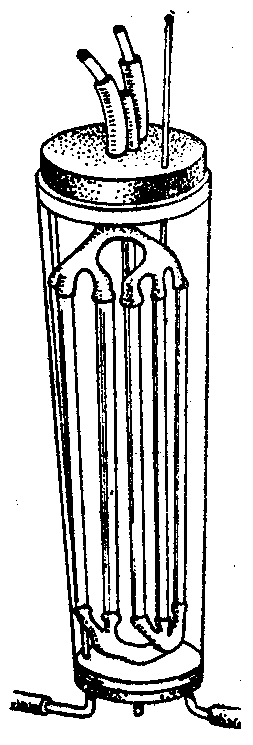 Рис.
55. Схема аппарата для вивидиализа
Рис.
55. Схема аппарата для вивидиализа
Сочетание вивидиализа и ультрафильтрации используется в аппарате «искусственная почка», предназначенном для очистки крови при острой почечной недостаточности.
Данное устройство оперативным путем подключают к системе кровообращения больного. Кровь под давлением, создаваемым специальным насосом, протекает в узком зазоре между двумя мембранами, омываемыми снаружи физиологическим раствором. Благодаря большой рабочей поверхности мембран (~15 000 см2) «шлаки» достаточно быстро (в течение нескольких часов) удаляются из крови, а жизненно необходимые низкомолекулярные вещества (неорганические соли, глюкоза, аминокислоты и т.п.) остаются в ней.
Молекулярно-кинетические свойства золей
На начальном этапе развития коллоидной химии утверждалось, что дисперсным системам, в отличие от истинных растворов не присущи такие молекулярно-кинетические свойства, как тепловое движение частиц дисперсной фазы, диффузия и осмос.
Эта особенность золей считалась одним из отличительных признаков. Однако использование более точных методов исследования показало, что это не так. Более того, изобретение ультрамикроскопа (1903 г.) позволило непосредственно наблюдать движение коллоидных частиц, связать интенсивность этого движения с коэффициентом диффузии.
Полученные данные показали, что в этом плане золи принципиально ничем не отличаются от истинных растворов. Только при одинаковой весовой концентрации растворенного вещества молекулярно-кинетические свойства золей в количественном соотношении выражены значительно слабее. Это объясняется бóльшими размерами коллоидных частиц и меньшей их концентрацией по сравнению с молекулами и ионами истинных растворов.
Броуновское движение
Важнейшим фактором, влияющим на молекулярно-кинетические свойства золей, является броуновское движениечастиц дисперсной фазы. Оно названо в честь английского ботаника Роберта Броуна, который впервые наблюдал его в 1827 г., исследуя под световым микроскопом взвесь цветочной пыльцы в воде. Ученый обнаружил, что частицы пыльцы непрерывно двигаются по сложным траекториям, ни на мгновение не оставаясь в покое. Причину данного движения долгое время установить не могли и считали его проявлением особенностей исключительно живой материи. Однако такое объяснение вскоре было отвергнуто, т.к. обнаружили, что подобное непрерывное движение могут совершать и неорганические частицы, взвешенные в жидкости или газе.
Таким образом, была установлена универсальность броуновского движения.
Дальнейшие исследования показали, что отдельные частицы двигаются совершенно независимо одна от другой. Их перемещение происходит тем интенсивнее, чем меньше размеры частиц и вязкость среды и совершенно не зависят от природы измельченного вещества.
В свободно-дисперсных системах с газовой или жидкой дисперсионной средой коллоидные частицы также не зафиксированы в каких-то определенных позициях. Они участвуют в броуновском движении, которое является прямым следствием теплового движения молекул растворителя и их беспорядочных ударов о данную частицу. Причем чем меньше размеры частицы, тем меньшее число молекул ударяется о ее поверхность. Это, в свою очередь, приводит к тому, что различия по числу и силе ударов с каждой стороны частицы становятся более значительными. Частица в любой момент времени движется в ту сторону, с которой результирующая величина ударов меньше. Само ее движение является скачкообразным и хаотическим. Скачки совершаются с большой частотой и в произвольном направлении, то есть независимо от того, каким был предшествующий скачок. Кроме того, скачки имеют разную длину. Установлено, что коллоидная частица изменяет направление своего движения приблизительно 1012раз за 1 секунду. Проследить действительный путь частицы при

Мариан Смолуховский (1872 – 1917), польский физик-теоретик. Окончил университет в Вене (1894), в 1896-1897 работал в университетах Парижа, Глазго и Берлина. С 1900 профессор Львовского университета (позднее ректор), с 1913 профессор Краковского университета. Основные труды по статистической физике. Работы Смолуховского по теории флуктуаций (1904) и броуновского движения (1906) наряду с работами Альберта Эйнштейна являются основополагающими в этой области. Смолуховский создал на основе теории броуновского движения кинетическую теорию коагуляции коллоидов, теорию электрокинетических явлений, заложив фундамент кинетической теории коллоидных систем.
таком движении не представляется возможным. Поэтому за меру, характеризующую интенсивность броуновского движения, принимают так называемое смещение частицы или ее сдвиг (∆Х).Это проекция расстояния между двумя положениями частицы (А и В) за времяt, разделяющее два смежных наблюдения (рис. 56).
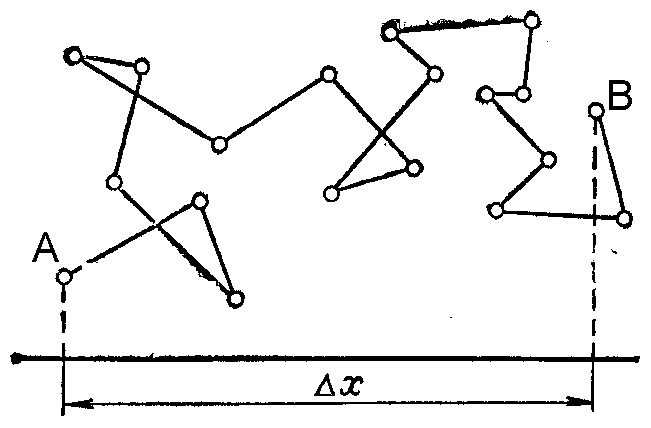
Рис. 56. Схема броуновского движения частицы
Смещения частицы
за одинаковые промежутки времени tобычно не совпадают как по величине,
так и по направлению, поэтому на практике
используют так называемый среднеквадратичный
сдвиг частицы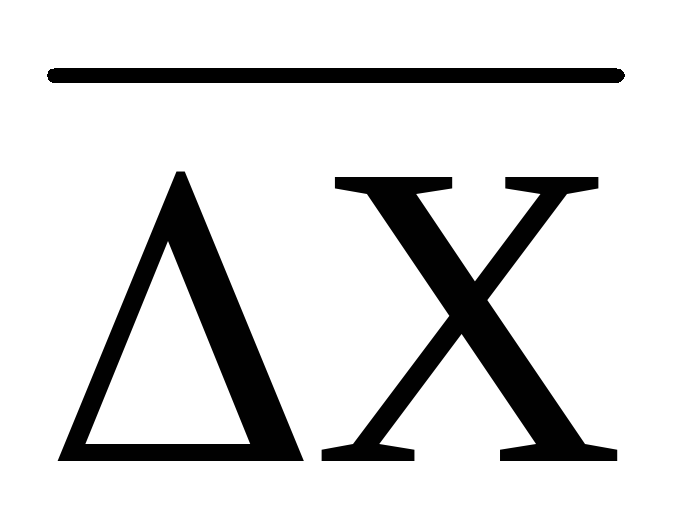 :
:
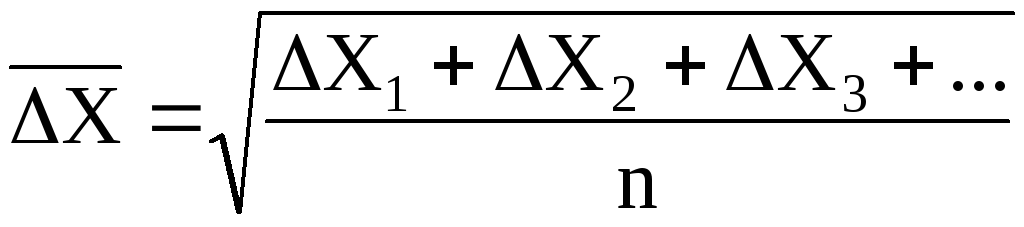
где ∆Х1, ∆Х2, ∆Х3, … – отдельные проекции смещения частицы за одно и то же время t; n – число определяемых проекций смещения частицы за определенное время t.
Точную количественную оценку броуновского движения частицы можно дать с помощью уравнения Смолуховского-Эйнштейна:
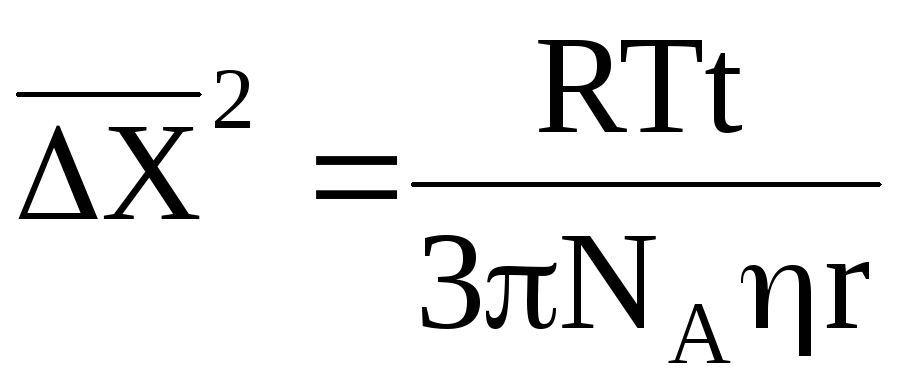
где NА – число Авогадро;
η – вязкость дисперсионной среды;
r – радиус частицы дисперсной фазы;
T – температура раствора;
t – время, за которое происходит смещение частицы.
Таким образом, скорость броуновского движения коллоидных частиц изменяется лишь в зависимости от их радиуса и вязкости дисперсионной среды. При этом природа самой частицы на ее движение влияния не оказывает.
Если размеры и масса частиц дисперсной фазы превышают определенные пределы, вероятность взаимной компенсации ударов с различных направлений оказывается значительно выше.
Так, частицы размером 4 · 10–6 м ÷ 5 · 10–6 м совершают только небольшие колебательные движения около некоторого центра. При более крупных размерах частиц их броуновское движение в любом виде не наблюдается.
В связи с этим грубодисперсные системы не обладают молекулярно-кинетическими свойствами. Именно на этом отличии базируется классификация дисперсных систем на высокодисперсные и грубодисперсные.
Основной причиной движения крупных дисперсных частиц служит различие плотностей дисперсной фазы (ρф) и дисперсионной среды (ρс). Если плотность дисперсной фазы больше (ρф> ρс), то частицы постепенно оседают вниз под действием силы тяжести. Этот процесс называютседиментацией. Более легкие дисперсные частицы (ρс> ρф), наоборот, постепенно всплывают вверх. Этот процесс называютобратной седиментацией.
3.2. Лабораторная работа: «Диализ белков».
Диализом называют процесс разделения высокомолекулярных веществ (например, белков) и низкомолекулярных (например, солей) с помощью полупроницаемых мембран.
Полупроницаемыми называют мембраны, диаметр пор которых позволяет проходить только низкомолекулярным соединениям. Примером естественных полупроницаемых мембран могут быть капсулы Боумена—Шумлянского почек. Широко используют искусственные полупроницаемые мембраны: целлофан, коллодий, на основе которых созданы диализаторы, в том числе «искусственная почка».
Метод диализа используют в научных лабораториях, в промышленности, в клинической практике.
Цель работы
Доказать, что низкомолекулярное соединение NaCl проходит через полупроницаемую мембрану, а высокомолекулярный белок не проходит и остается в диализируемом растворе.
Принцип метода
Метод основан на том, что низкомолекулярные вещества легко диффундируют через полупроницаемые мембраны в чистый растворитель, образуя диализат. Диффузия будет продолжаться, пока не произойдет выравнивание концентраций диффундируемого вещества между диализируемым раствором и диализатом. Процесс возобновится, если диализат заменить чистым растворителем или, если эта смена будет происходить постоянно (проточный диализ).
Выполнение работы
Подготовка диализатора: полупроницаемой мембраной могут быть диализные трубки или целлофановые диализные мешочки. Целлофан (квадрат 10х10 см) смачивают дистиллированной водой, делают в нем углубление и получают диализный мешочек.
Приготовление диализируемого раствора: в диализный мешочек помещают 20 капель разведенного яичного белка в 5 % растворе NaCl (белок одного яйца разводят в 300 мл 5% раствора NaCl) и перемешивают. Края целлофана зажимают между двумя стеклянными палочками, скрепленными между собой резиновыми кольцами.
Диализ. Мешочек с солевым раствором белка помещают в стакан с дистиллированной водой так, чтобы часть мешочка с раствором белка была полностью погружена в воду. Сразу же, на просвет можно заметить струйки солевого раствора, опускающиеся из мешочка на дно стакана, что обусловлено изменением рефракции воды.
Анализ результатов диализа. Через 60 мин после начала диализа проводят качественные пробы на белок (биуретовую реакцию) и на NaCl (с AgNO3) в соответствии с таблицей.
Реактивы | Проба на белок в диализате | Проба на белок в диализируемой жидкости | Проба на ионы Cl— в диализате |
Диализат | 10 капель | – | 10 капель |
Диализируемый раствор | – | 10 капель | – |
10 % NaOH | 5 капель | 5 капель | – |
1 % CuSO4 | 1 капля | 1 капля | – |
10 % HNO3 | – | – | 1 капля |
1 % AgNO3 | – | – | 1 капля |
Наблюдения |
Выводы Занятие 4. Коллоквиум I по темам «Простые белки, сложные белки, нуклеиновые кислоты»
Вопросы, для самостоятельной подготовки:
1) Белки — основа живых организмов. Биологическая роль белков. Методы выделения и очистки белков. Аминокислотный состав белков. Классификация аминокислот. Характер связей остатков аминокислот в молекуле белка. Заменимые и незаменимые аминокислоты. Понятие о кормовой ценности белков. Полипептиды и их строение. Биологически активные пептиды.
2) Физико-химические свойства белков. Уровни структурной организации белков: первичная, вторичная, третичная, четвертичная cтруктуры белков. Фолдинг белковых молекул. Понятие о шаперонах. Связь структуры и функции белков.
3) Классификация белков. Простые белки: протамины и гистоны, проламины и глутелины, альбумины и глобулины.
4) Представление о химическом строении и структуре нуклеиновых кислот. Пуриновые и пиримидиновые основания; рибоза, дезоксирибоза, нуклеозиды, мононуклеотиды. Характер связи мононуклеотидов в полинуклеотидной цепи нуклеиновых кислот. Структура и функции ДНК и РНК.
5) Комплементарность азотистых оснований. Правило Чаргаффа, понятие о видовой специфичности.
Варианты письменной части коллоквиума
Вариант 1.
Написать формулу трипептида: глутамилпролиллизин
Соединить в динуклеотид: ЦМФ и ГМФ
Какими методами можно разделить альбумины и глобулины?
Как можно определить наличие в растворе: трп?
Вариант 2.
Написать формулу трипептида: аспартиллизилпролин
Соединить в динуклеотид: дЦМФ и ТМФ
Какими методами можно разделить казеин и продукты его гидролиза?
Как можно определить наличие в растворе: мет?
Вариант 3.
Написать формулу трипептида: пролиларгинилглутамат
Соединить в динуклеотид: дАМФ и ТМФ
Какими методами можно разделить гис и гли?
Как можно определить наличие в растворе: глобулинов?
Вариант 4.
Написать формулу трипептида: гистидиллизилсерин
Соединить в динуклеотид: АМФ и ГМФ
Какими методами можно разделить асп и арг ?
Как можно определить наличие в растворе: цис ?
Варианты заданий на компьютерном тестировании
Инструкция к тесту: Выбрать все правильные ответы
Заменимая аминокислота для человека:
фенилаланин
тирозин
триптофан
треонин
метионин
Гидрофобная аминокислота:
глутамин
серин
треонин
фенилаланин
гистидин
При денатурации белка не нарушаются связи:
дисульфидные
водородные
пептидные
ионные
гидрофобные
Величина Rf при бумажной хроматографии будет наибольшей для амиинокислоты:
глицина
треонина
серина
глутамата
валина
Отрицательно заряженной АМК является:
глутамин
аланин
глутамат
лизин
триптофан
Биуретовая реакция не дает окраски с
простыми белками
дипептидами
трипептидами
альбуминами
желатином
Наиболее прочные связи в молекуле белка:
водородные
дисульфидные
пептидные
ионные
гидрофобные
Нуклеотидом является:
аденин
аденозингидролаза
цитидин
прион
аденозинмонофосфат
В молекуле ДНК неверно:
А+Ц=Г+Т
А=Т
Г=Ц
А+Т=Г+Ц
Г+А=Ц+Т
Молекула гемоглобина:
мономер
димер
тример
тетрамер
гексамер
Незаменимая аминокислота для человека:
аспарагин
глутаминовая кислота
орнитин
валин
цистеин
Денатурация белка может произойти при добавлении:
конц. азотной кислоты
сульфата меди
азотнокислого серебра
конц. КОН
любого из вышеперечисленных соединений
Простетическая группа гликопротеинов:
галактоза
глюкозамин
глюкуроновая кислота
нейраминовая кислота
все вышеперечисленные вещества
Нуклеиновые кислоты отличаются от белков тем, что:
это высокомолекулярные соединения
имеют сложную пространственную структуру
поглощают свет в УФ области спектра
состоят из мономеров
не содержат аминокислотных остатков
Нуклеозидом является:
цитозин
урацил
тимин
гуанозин
аденозинтрифосфат
Сульфгидрильную группу (тиогруппу) содержит аминокислота:
аспарагин
гистидин
лизин
цистеин
глутамин
Методом ионообменной хроматографии нельзя разделить одну из следующих пар аминокислот:
глутамат и лизин
глутамат и лейцин
лейцин и лизин
лейцин и валин
валин и глутамат
Денатурация белка заключается в:
нарушении третичной структуры
нейтрализации зарядов
снятии гидратной оболочки
образовании функциональных комплексов с другими белками
появлении сине-фиолетового окрашивания
Вторичную структуру белков стабилизируют химические связи:
амидные
гидрофобные
водородные
ионные
ковалентные
Нингидриноая реакция не дает окраски с:
простыми белками
дипептидами
трипептидами
свободными аминокислотами
карбоновыми кислотами
Неокрашенный белок:
пепсин
каталаза
миоглобин
гемоглобин
цитохром С
В состав РНК не входит:
АМФ
ГМФ
ТМФ
ЦМФ
УМФ
Серповидно-клеточная анемия связана с заменой в молекуле гемоглобина:
глу на вал
глу на асп
вал на лей
вал на цис
гли на асп
Заменимая аминокислота
лейцин
лизин
фенилаланин
пролин
изолейцин
Гидрофобная аминокислота:
серин
треонин
триптофан
аспартат
глутамин
Альбумины нерастворимы в:
дистиллированной воде
фосфатном буфере, рН 6,8
насыщенном растворе хлористого натрия
полунасыщенном растворе сульфата аммония
насыщенном растворе сульфата аммония
Смесь белков с различной молекулярной массой нельзя разделить:
гель-фильтрацией
ионообменной хроматографией
диализом
электрофорезом
высаливанием
В образовании третичной структуры белков непосредственно не участвуют связи:
дисульфидные
гидрофильные
ионные
пептидные
водородные
Положительную ксантопротеиновую реакцию дает:
цистеин
метионин
триптофан
аргинин
аспарагин
Молекулярную массу белков можно определить:
ультрацентрифугированием
диализом
ионообменной хроматографией
колориметрически
гидролизом
Незаменимая аминокислота для человека:
изолейцин
аланин
глицин
цистеин
тирозин
Гидрофильная аминокислота:
валин
фенилаланин
лейцин
лизин
изолейцин
К простым белкам нельзя отнести:
протамин
коллаген
гистоны
альбумины
гемоглобин
Для очистки белков от низкомолекулярных примесей используют метод:
гель-фильтрации
электрофореза
ионообменной хроматографии
гидролиза
все вышеперечисленные
Положительную реакцию Фоля дает:
триптофан
гистидин
метионин
треонин
серин
Число белковых субъединиц в молекуле гемоглобина:
одна
две
три
четыре
пять
Чем отличаются разные типы РНК:
первичной структурой
молекулярной массой
последовательностью нуклеотидов
функциями в клетке
всеми вышеперечисленными параметрами
Гемопротеином не является:
миоглобин
цитохром С
каталаза
гемоглобин
казеин
Белки с различной молекулярной массой можно разделить, используя:
трихлоруксусную кислоту
гидроокись натрия
сульфат меди
сульфат аммония
все вышеперечисленные соединения
Олигомерные белки:
состоят из нескольких пептидных цепей
не содержат α-спиральных участков
проходят через полупроницаемую мембрану
не обладают четвертичной структурой
Подборка по базе: Титульный лист для реферата.doc, Педагогическая система Яна Аммоса Коменского.docx, Математические методы.Нелинейное программирован….doc, Основные производители операционных систем реферат.docx, Виды имплантатов и особенности различных имплантационных систем., Английский реферат ГОТОВО.docx, АЛКАЛОИДЫ РЕФЕРАТ.docx, адвокатура реферат (rtf).rtf, Рак ротовой полости реферат работа мамы.docx, Б-план РЕФЕРАТ.doc. КАФЕДРА ХИМИИ И ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ Реферат «Методы очистки коллоидных систем: диализ, электродиализ, компенсационный диализ, вивидиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки» Выполнил: студент 106 гр. лечебного факультета Муратов К.А. Проверил: доцент, к. техн.н. Авшистер О. Д. Оренбург, 2018 План Введение………………………………………………………………………..3 Методы очистки коллоидных систем: метод диализа.………………………………………………………………….……..5 Методы очистки коллоидных систем: электродиализ………………………8 Методы очистки коллоидных растворов: компенсационный анализ и вивидиализ……………………………………………………………………10 Методы очистки коллоидных систем: ультрафильтрация……………………………………………………………12 Физико-химические принципы функционирования искусственной почки……………………………………………………………………………………………..……………13 Заключение……………………………………………………………………22 Список литературы…………………………………………………………..23 Введение Актуальность темы. Дисперсные системы широко представлены в природе. Для биологии и медицины особенно важно изучение физико-химических свойств коллоидных растворов и студней, образуемых белками и другими биополимерами, играющих большую роль в свойственных живым организмам процессах обмена веществ. Нормальное или патологическое функционирование организма человека во многом определяется характером протекания коллоидных процессов, в которых принимают участие такие высокомолекулярные соединения, как белки, нуклеиновые кислоты, крахмал, гликоген, пектины, целлюлоза и другие. В биологических и медицинских исследованиях широко используют методы коллоидной химии: диализ и электродиализ для очистки и изучения ферментов, гормонов, токсинов, антибиотиков, антител и других; ультрафильтрация для разделения и фракционирования сложных полидисперсных систем; коагуляция, с помощью которой определяют состояние полидисперсных систем крови и других биологических жидкостей; ультрацентрифугирование, для получения различных физико-химических характеристик белков и других веществ. В практической медицине используют разнообразные коллоидные лекарственные средства, например, золи серебра, как антисептическое средство под названием «протаргол» или «колларгол», в которых мельчайшие частицы серебра — мицеллы из сотен атомов каждая. К коллоидным поверхностно-активным веществам можно отнести мыла, белки, желчные кислоты. Целью работы является изучение основных методов очистки коллоидных растворов, их особенностей. Для достижения поставленной цели был составлен следующий список задач:
Объектом исследования являются дисперсные системы. Предметом исследования являются методы очистки коллоидных систем.
Диализ (от греч. Dyalisis – отделение) был разработан Грэмом в 1861 году. Диализ – это процесс очистки коллоидных систем от ионов и молекул низкомолекулярных примесей в результате их диффузии в чистый растворитель через полупроницаемую перегородку – мембрану. Диализ основан на разнице в скорости диффузии небольших молекул или ионов и частиц коллоидных размеров через мембрану. Для этих целей применяют мембраны, изготовленные из животных и растительных перепонок, желатина, мембраны из коллодия, ацетата целлюлозы и целлофана, пергаментной бумаги, керамических пористых материалов и др. Небольшие молекулы и ионы из золя проникают через мембрану и диффундируют в воду, контактирующую с мембраной, а молекулы воды при этом проникают через мембрану в обратном направлении. В результате после очистки коллоидная система оказывается разбавленной. Очистка коллоидных растворов таким способом требует значительного времени (дни, недели, месяцы). Для ускорения диализа можно применять разные приемы, например, увеличивать площадь мембраны, уменьшать слой очищаемой жидкости или часто менять внешнюю жидкость (воду), повышать температуру, прикладывать электрическое поле (электродиализ). В частности, электродиализ позволяет закончить процесс диализа в течение нескольких часов. В производственных условиях диализом очищают от солей белки (желатин, агар-агар, гуммиарабик), красители, силикагель, дубильные вещества и др. В процессе ультрафильтрации мембраной задерживаются частицы дисперсной фазы или макромолекулы, а дисперсионная среда с нежелательными низкомолекулярными примесями проходит через мембрану. Ультрафильтрация относится к баромембранным процессам, в отличие от диализа ее проводят под давлением. При ультрафильтрации достигают высокой степени очистки золей при одновременном их концентрировании. Иногда говорят, что ультрафильтрация – это диализ, проводимый под давлением, хотя это и не совсем верно. Применение мембран с определенным размером пор позволяет разделить коллоидные частицы на фракции по размерам и ориентировочно определить эти размеры. Так были найдены размеры некоторых вирусов. Все это говорит о том, что ультрафильтрация является не только методом очистки коллоидных систем, но и может быть использована как способ дисперсионного анализа и для препаративного разделения дисперсных систем. Интересным примером сочетания диализа и ультрафильтрации является аппарат «Искусственная почка», предназначенный для временной замены функции почек при острой почечной недостаточности. Он воспроизводит такие функции почек, как выделение отработанных продуктов из крови, регулирование кровяного давления и водно-электролитного баланса. В искусственной почке из плазмы (плазма – жидкая часть крови) удаляются мочевина, мочевая кислота, креатинин, ионы калия, токсины и другие вещества Аппарат оперативным путем подключается к системе кровообращения больного. Кровь под давлением, создаваемым пульсирующим насосом («искусственное сердце»), протекает в узком пространстве между двумя мембранами, омываемыми снаружи физиологическим раствором (физиологические растворы – это водные растворы, близкие по солевому составу, величине рН и другим свойствам к крови здорового человека, например, раствор, содержащий 0,9% NaCl и 4,5% глюкозы). Благодаря большой площади мембран (15000 Размер пор мембран для ультрафильтрации составляет величину от 1 до 10 нм. Если использовать мембраны с более тонкими порами (менее 1 нм), то происходит задержка не только дисперсных частиц, но и относительно крупных молекул и даже ионов (размер ионов в водном растворе довольно значителен благодаря образованию гидратной оболочки). Правда для проведения такого процесса требуется рабочее давление большее, чем в случае ультрафильтрации. Этот баромембранный процесс называется гиперфильтрацией или обратным осмосом. Интересно отметить, что метод гиперфильтрации наряду с методом перегонки применяется в быту и промышленности для очистки и деионизации воды.[4] В результате диализа и ультрафильтрации из золей за счет избирательного переноса частиц через мембрану удаляются электролиты. Различия между этими процессами заключаются в механизме и движущей силе переноса вещества. В случае диализа очистка осуществляется за счет диффузии ионов или молекул, которые преимущественно имеют размер, существенно меньший, чем размер коллоидных частиц, а в случае ультрафильтрации разделение ионов, молекул и коллоидных частиц происходит по принципу сита. Движущая сила ультрафильтрации – градиент давления, а не градиент концентрации, как в случае диализа. В процессе очистки диализом золь разбавляется, а при ультрафильтрации – концентрируется.
Схема простейшего диализатора тп — полупроницаемая перегородка (мембрана)
Электродиализ — это метод очистки коллоидных систем (коллоидных растворов, суспензий и др., а также растворов высокомолекулярных веществ, например белков) от примесей низкомолекулярных веществ, растворенных в дисперсионной среде. Электродиализ основан на ускорении диффузии ионов через мембрану под действием постоянного электрического поля. Электродиализатор обычно состоит из трех последовательно расположенных камер, разделенных диализационными мембранами; в средней камере находится очищаемый раствор, в боковых — дистиллированная вода. В боковых отделениях укреплены электроды, соединенные с полюсами источника постоянного тока. В качестве анода употребляют материалы, не растворяющиеся в условиях электролиза: платину, графит или уголь. В процессе электродиализа раствор, находящийся в среднем отделении, размешивают стеклянной мешалкой. Иногда в электродиализаторах применяют концентрическое расположение камер. Электродиализ растворов веществ, окисляющихся на воздухе, проводят в атмосфере инертных газов. За ходом электродиализа следят, измеряя электропроводность получаемого в результате электродиализа раствора (электродиализата) или концентрацию в нем электролитов. Большое значение при электродиализе имеет выбор материала мембран. В зависимости от заряда поверхности и других условий их можно приготовить таким образом, чтобы они легко пропускали ионы, несущие заряд одного знака, и были практически непроницаемы для ионов, имеющих заряд другого знака. Мембраны, легко пропускающие катионы, устанавливают вблизи катода; мембраны, избирательно проницаемые для анионов,— у анода. Метод электродиализа широко применяют в биохимических исследованиях при очистке (и выделении) белков, гормонов, антибиотиков и других биологически активных веществ. Электродиализ находит применение также в производстве для очистки растворов белков, красителей, дубителей и др. Иногда используют приборы, в которых электродиализ сочетают с ультрафильтрацией.[3]
Электродиализатор Паули: 1 – коллоидный раствор; 2 – электроды
Методы очистки коллоидных растворов: компенсационный анализ и вивидиализ. Для исследования биологических жидкостей Михаэлисом и Рона был предложен метод, позволяющий определять концентрацию тех или иных низкомолекулярных веществ, находящихся в свободном состоянии в коллоидных растворах. Сущность компенсационного диализа заключается в том, что жидкость в диализаторе омывается не чистым растворителем, а растворами с различными концентрациями определяемого вещества. Так, например, сахар в сыворотке крови, не связанный с белками, определяется путем диализа сыворотки против изотонического раствора, к которому прибавляют различные количества сахара. Концентрация сахара в солевом растворе при диализе не меняется лишь в том случае, если оно равно концентрации свободного сахара в сыворотке. Этот метод позволяет судить об истинных концентрациях веществ в исследуемых коллоидных растворах. Таким путем, например, было выявлено наличие глюкозы и мочевины в крови в свободном состоянии. Примерно на том же принципе основано прижизненное определение низкомолекулярных составных частей крови методом вивидиализа (вивидиффузия по Абелю). В концы перерезанного кровеносного сосуда вставляют стеклянные канюли, разветвленные части которой соединяются между собой трубочками из коллодия и вся система погружается в сосуд, заполняемый физиологическим раствором NaCl или водой. Было установлено, что аммиакаты в крови, так же как и глюкоза, могут находиться в свободном состоянии. На принципе компенсационного вивидиализа был сконструирован аппарат, получивший название «искусственной почки», при помощи которого можно освобождать кровь от продуктов обмена веществ и, следовательно, временно замещать функцию больной почки. Показаниями к применению «искусственной почки» является острая почечная недостаточность, например, при отравлении сулемой, сульфаниламидными препаратами, при уремии после переливания крови, при тяжелых ожогах, токсикозе беременности и т.п.
Схема аппарата для вивидиализа Методы очистки коллоидных систем: ультрафильтрация Ультрафильтрация. Одним из важных методов очистки коллоидных растворов является ультрафильтрация, которая сводится к отделению дисперсной фазы от дисперсионной среды. Для этого производится фильтрование коллоидного раствора через мембраны, не пропускающие коллоидные частицы или макромолекулы. При ультрафильтрации дисперсная фаза остается на фильтре. Следует упомянуть, что через поры обычной фильтровальной бумаги (от 1,5 до 5∙
Физико-химические принципы функционирования искусственной почки Почка искусственная. В основе работы аппарата искусственной почки лежит принцип диализа за счет диффузии и разницы осмотических давлений с обеих сторон целлофановой пластинки, обладающей свойствами полупроницаемой мембраны. Мелкие молекулы ионов Среди многих моделей аппаратов искусственной почки можно различить два основных типа: аппараты с целлофановой мембраной, имеющей форму трубки диаметром 25 — 35 мм, и аппараты с пластинчатой целлофановой мембраной. Наиболее широко за рубежом применяют двухкатушечную искусственную почку Колффа — Уочингера. Важным преимуществом этой модели искусственной почки является то, что катушки с намотанными целлофановыми шлангами поступают с завода в стерильном состоянии и при надобности могут быть немедленно использованы. Простота установки и обращения, значительная диализирующая поверхность создали большую популярность этой модели. Недостатки аппарата — большая емкость по крови и значительное сопротивление току крови вследствие тугой обмотки двух диализирующих шлангов. Поэтому на входе в диализатор устанавливается насос.[5]
Советская модель искусственной почки, сконструированная в Научно-исследовательском институте хирургической аппаратуры и инструмента (НИИХАИ), относится к типу диализаторов с пластинчатой целлофановой мембраной. Большой клинический опыт советских и зарубежных клиницистов показывает высокую эффективность гемодиализа в лечении больных почечной недостаточностью. Однако искусственная почка не заменяет других лечебных мероприятий. Она является одним из важнейших звеньев комплексной терапии. Искусственная почка не может полностью заменить многогранную функцию заболевших почек, притом на длительное время. В СССР искусственную почку впервые стали применять с 1958 г. в урологической клинике 2-го ММИ на базе 1-й Городской больницы. В настоящее время искусственной почкой оснащено свыше 50 отделений клинических больниц. Соединение аппарата с больным обычно осуществляют двумя методами: артериально-венозным или вено-венозным. В первом случае после обнажения артерии (чаще лучевой) забор крови в аппарат производят сосудистым катетером, введенным в ее просвет. Обратное поступление крови из аппарата к больному происходит через зонд, введенный в какую-либо поверхностную вену (чаще локтевую). При вено-венозным способе соединения пункцией или обнажением крупной вены на бедре достигается зондирование и забор крови из нижней полой вены. Обратное поступление крови происходит через какую-либо вену предплечья. В настоящее время получил распространение пункционный метод катетеризации сосудов. Производят пункцию бедренной артерии и вены под пупартовой связкой и по проводнику вводят в сосуды соответствующие катетеры, которые при помощи коммутирующих магистралей соединяют с аппаратом. Если в ходе лечения больного предполагается многократное применение гемодиализа, то устанавливают на предплечье постоянный артериовенозный шунт по Скрибнеру. Сущность метода заключается в зондировании на предплечье лучевой артерии и расположенной рядом вены. Эти зонды соединяют специальными устройствами, и кровь поступает из артерии непосредственно в вену. Для проведения гемодиализа смена соединителя позволяет за несколько минут соединить кровеносную систему больного с аппаратом искусственной почки. После гемодиализа шунт вновь восстанавливают при помощи полукруглого соединителя. Искусственную гемофилию осуществляют периодическим введением гепарина (по 2 мг/кг). После гемодиализа действие гепарина в крови больного нейтрализуют введением раствора протаминсульфата. Все части аппарата, соприкасающиеся с кровью больного, должны быть силиконированы и стерилизованы. Схема советской модели искусственной почки представлена на рисунке ниже. Кровь от больного поступает по катетеру (1) при помощи насоса (2) в диализатор (3). Проходя между целлофановыми пластинками последнего (по каждой из его 11 секций), кровь больного через целлофановую пластинку соприкасается с протекающим навстречу диализирующим раствором. Состав его обычно стандартный и содержит все основные ионы крови (
В настоящее время сконструирована новая модель искусственной почки. Основной принцип ее работы остается прежним. Аппарат имеет две самостоятельные секции с площадью диализирующей поверхности по 8000
Наиболее эффективными и удобными для клинического применения являются те модели искусственной почки, которые удовлетворяют следующим основным требованиям: высокая интенсивность диализа крови, простота и безопасность обращения с аппаратом, небольшой объем крови. Это аппараты НИИХАИ (СССР), Колффа — Уочингера (США) и Дольотти (Италия). Они особенно хороши при лечении больных острой почечной недостаточностью. При хронической почечной недостаточности наиболее удобными аппаратами считают модернизированную модель Колффа и двухпластинчатую искусственную почку системы Киля. Каденом предложена оригинальная модель аппарата искусственной почки для лечения хронической почечной недостаточности. Важным достоинством ее являются портативность и невысокая стоимость. Применение хронического гемодиализа в современных условиях является важной задачей. По данным III Международного конгресса нефрологов, в некоторых странах (США) на 100 млн. населения ежегодно нуждается в применении хронического гемодиализа до 50 тыс. больных хронической почечной недостаточностью различной этиологии. Применяя искусственную почку у больного хронической почечной недостаточностью дважды в неделю, удается сохранить на субнормальных цифрах уровень азотемии, нормальный водно-электролитный баланс и удовлетворительное общее состояние больного. Таким образом, жизнь больных в терминальной стадии хронической почечной недостаточности может быть продлена на многие месяцы, и даже годы. Искусственную почку начинают применять в домашних условиях, правда, пока в редких случаях. Многократный повторный гемодиализ у больных хронической почечной недостаточностью сопряжен с рядом существенных трудностей и различными осложнениями. К ним в первую очередь относится тромбоз артериовенозных шунтов. Применение тефлоново-силастикового материала позволило продлить сроки службы шунта до 6 — 9 месяцев. Некоторые больные страдают нередко тяжело протекающей периферической нефропатией. Нарушается обмен кальция, что проявляется метастатической кальцификацией и остеопорозом. Анемия требует постоянных переливаний крови. Частые осложнения — интермиттирующая инфекция и гипертония. Тестикулярная атрофия (у мужчин) и аменорея (у женщин) — вполне обычные явления. Наконец, в ходе повторных гемодиализов могут развиться гиперкальциемия, тяжелая анемия, септицемия, пирогенные реакции. Более целесообразно применять хронический гемодиализ у больных в истинно терминальных стадиях хронической почечной недостаточности, учитывая возможную в ходе лечения гомо- и гетеротрансплантацию почки. У больных острой почечной недостаточностью гемодиализ позволяет за несколько часов достигнуть значительного клинического эффекта за счет освобождения организма от азотистых шлаков, нормализации водно-электролитного баланса, ликвидации ацидоза. Этот подчас может быть и временный эффект позволяет организму усилить регенеративные процессы в почках и печени, способствуя восстановлению их функции. Поэтому при большинстве этиологических форм острой почечной недостаточности показано применение искусственной почки. К их числу относят такие состояния, при которых функция почек оказывается часто глубоко нарушенной: коллапс периферического круга кровообращения вследствие тяжелых операций, травм, кровотечения, постабортной инфекции, несовместимого переливания крови, при отравлении нефротоксическими ядами, остром анурическом гломерулонефрите, окклюзии мочевых путей. При хронической почечной недостаточности в стадии обострения неоднократно примененный гемодиализ может существенно улучшить функцию почек. Важное значение при определении показаний к гемодиализу имеет учет состояния нервной системы, органов дыхания, сердечно-сосудистой системы и функционального состояния печени. Применение искусственной почки у больных в состоянии уремической комы следует рассматривать как позднее мероприятие, и, естественно, успех лечения не всегда бывает положительным. Среди биохимических нарушений ведущим показанием к гемодиализу является гиперазотемия, когда остаточный азот сыворотки крови составляет 150 — 200 мг % (содержание мочевины 350 — 400 мг %), содержание креатинина 12 — 15 мг %. Повышение содержания калия в сыворотке крови до 7 мэкв/л и выше, снижение щелочного резерва до 10 мэкв/л в совокупности с другими водно-электролитными нарушениями являются показаниями к неотложному гемодиализу. Среди больных острой почечной недостаточностью у 35 — 45% болезнь протекает не слишком тяжело. Несмотря на наличие анурии, азотемии и других нарушений, лечение этих больных можно проводить без применения гемодиализа. Среди противопоказаний следует учитывать декомпенсацию сердечно-сосудистой системы, печеночную недостаточность, активный септический процесс в организме в фазе интермиттирующего бактериемического шока. Свежий очаг кровотечения не считают абсолютным противопоказанием к гемодиализу. Применение при помощи особой аппаратуры регионарной (только в аппарате искусственной почки) гепаринизации позволяет избежать усиления кровотечения. Применение искусственной почки по строгим показаниям с выполнением всех мер предосторожности и при тщательном наблюдении за больным во время диализа и после него практически безопасно и не грозит какими-либо осложнениями.[6] Заключение Я считаю, что поставленные задачи — раскрытие сущности понятия и процесса диализа, выявление его основных разновидностей; раскрытие сущности понятия и процесса ультрафильтрации; получение основных знаний об основных принципах функционирования искусственной почки – были выполнены. Тем самым, есть основания полагать, что мы достигли своей цели, а именно изучили основные методы очистки коллоидных растворов, их особенности. Список литературы
|
74. Методы очистки коллоидных растворов. Фильтрация, ультрафильтрация, диализ. Электродиализ. Вивидиализ. Принцип работы искусственной почки.
Диализ – удаление с помощью мембраны низкомолекулярных соединений , освобождение коллоидных растворов от примисей .очистка этим способом протекает медленно(недели –месяцы).
Электродиализ — ускоренный процесс очистки коллоидных растворов с применением электрического тока .
Вивидиализ -используется для исследования биологических жидкостей , позволяющий определять концетрацию тех или иных низкомолекулярных веществ, находящихся в свободном состоянии в коллоидных растворах.
Ультрафильтрация- идёт отделение дисперсной фазы от дисперсной среды, для этого производится фильтрование коллоидного раствора через мембраны не пропускающие коллоидные частицы или макромолекулы. При ультрафильтрации дисперсная фаза остаётся на фильтре.
На принципе компенсационной вивидиффузии был сконструирован аппарат искусственной почки, при помощи которого можно освобождать кровь от продуктов обмена веществ. И следовательно временно заменять функцию больной почки в организме.(стеклянные канюли разветвленные по всему сосуду, которые соединяются между собой трубочками из Колодия, и весь этот сосуд заливается раствором из NaCl или водой.)
75. Электрокинетические явления. Электрофорез и Электроосмос. Строение коллоидной частицы. Мицелла, гранула, адсорбционный и диффузный слой. Стабилизация структуры мицеллы.
Электрокинетические явления – наличие электрического заряда у коллоидных частиц (гранул) обуславливает возможность движения их в постоянном электрическом поле.
Электрофорез –движение заряжённых коллоидных частиц и частиц грубых взвесий к противоположному заряженному электроду.
Электоосмос – перемещение дисперсной среды относительно неподвижной дисперсной фазы к электроду, происходящее под влиянием внешней разности потенциалов .
Электрофорез и электроосмос наблюдаются при прохождении тока через ткани живых организмов . электрофорез приобрел свое большое практическое значение в в иследовательско-и клинико лабораторной практике.
76. Устойчевость коллоидных систем. Агрегативная и кинетическая устойчевость коллоидных систем. Явление коагуляции.
Порог коагуляции.Правило Шульца- Гарди. Значение коллоидной защиты и пептизации в медицине.


 ) из крови за 3-4 часа удаляются все вышеперечисленные «шлаки».
) из крови за 3-4 часа удаляются все вышеперечисленные «шлаки». [1]
[1]
 [2]
[2] м) коллоидные частицы легко проходят, а поэтому при ультрафильтрации пользуются специальными фильтрами (например, целлофаном или фильтровальной бумагой, пропитанной коллодием и др.). Применяя полупроницаемые мембраны для ультрафильтрации с определенной степенью пористости, можно в известной мере разделить коллоидные частицы и приближенно определить их размеры. Необходимая пористость мембраны обеспечивается подбором соответствующего растворителя коллодия и условий сушки полученной пленки. Ультрафильтрация, как правило, протекает очень медленно, а поэтому ее чаще проводят под давлением, для чего из расположенного под фильтром сосуда (приемника) откачивают воздух или в сосуд, расположенный над фильтром, нагнетают воздух.
м) коллоидные частицы легко проходят, а поэтому при ультрафильтрации пользуются специальными фильтрами (например, целлофаном или фильтровальной бумагой, пропитанной коллодием и др.). Применяя полупроницаемые мембраны для ультрафильтрации с определенной степенью пористости, можно в известной мере разделить коллоидные частицы и приближенно определить их размеры. Необходимая пористость мембраны обеспечивается подбором соответствующего растворителя коллодия и условий сушки полученной пленки. Ультрафильтрация, как правило, протекает очень медленно, а поэтому ее чаще проводят под давлением, для чего из расположенного под фильтром сосуда (приемника) откачивают воздух или в сосуд, расположенный над фильтром, нагнетают воздух.
 ,
,  ,
,  ,
,  ,
,  ,
,  и таких простых органических соединений, как мочевина, креатинин, фенолдериваты, свободно проникают через поры целлофана. В то же время молекулы белка, форменные элементы крови с одной стороны и возможные бактерии с другой не могут преодолеть целлофановый барьер.
и таких простых органических соединений, как мочевина, креатинин, фенолдериваты, свободно проникают через поры целлофана. В то же время молекулы белка, форменные элементы крови с одной стороны и возможные бактерии с другой не могут преодолеть целлофановый барьер.
 ,
,  ,
,  =
=  и насыщают карбогеном с таким расчетом, чтобы рН его составляла 7,4. При помощи насоса (9) диализирующий раствор подается в диализатор. Скорость кровотока в диализаторе обычно равна 250 — 300 мл/мин. Клиренс аппарата составляет по мочевине 140 мл/мин.
и насыщают карбогеном с таким расчетом, чтобы рН его составляла 7,4. При помощи насоса (9) диализирующий раствор подается в диализатор. Скорость кровотока в диализаторе обычно равна 250 — 300 мл/мин. Клиренс аппарата составляет по мочевине 140 мл/мин.
