Липопротеины — это… Что такое Липопротеины?
 Липопротеины. Структура
Липопротеины. СтруктураЛипопротеи́ны (липопротеиды) — класс сложных белков, простетическая группа которых представлена каким-либо липидом. Так, в составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Липопротеины представляют собой комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-ЛП) и липидов, связь между которыми осуществляется посредством гидрофобных и электростатических взаимодействий.
Липопротеины подразделяют на свободные, или растворимые в воде (липопротеины плазмы крови, молока и др.), и нерастворимые, т. н. структурные (липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений).
Среди свободных липопротеинов (они занимают ключевое положение в транспорте и метаболизме липидов) наиболее изучены липопротеины плазмы крови, которые классифицируют по их плотности. Чем выше содержание в них липидов, тем ниже плотность липопротеинов. Различают липопротеины очень низкой плотности (ЛПОНП), низкой плотности (ЛПНП), высокой плотности (ЛПВП) и хиломикроны. Каждая группа липопротеинов очень неоднородна по размерам частиц (наиболее крупные — хиломикроны) и содержанию в ней апо-липопротеинов. Все группы липопротеинов плазмы содержат полярные и неполярные липиды в разных соотношениях.
Виды липопротеинов
| Вид | Размеры | Функция |
|---|---|---|
| Липопротеины высокой плотности (ЛВП) | 8-11 нм | Транспорт холестерина от периферийных тканей к печени |
| Липопротеины низкой плотности (ЛНП) | 18-26 нм | Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям |
| Липопротеины промежуточной (средней) плотности ЛПП (ЛСП) | 25-35 нм | Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям |
| Липопротеины очень низкой плотности (ЛОНП) | 30-80 нм | Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Нековалентная связь в липопротеинах между белками и липидами имеет важное биологическое значение. Она обусловливает возможность свободного обмена липидов и модуляцию свойств липопротеинов в организме.
Липопротеины являются:
Метаболизм липопротеинов
 Метаболизм липопротеинов
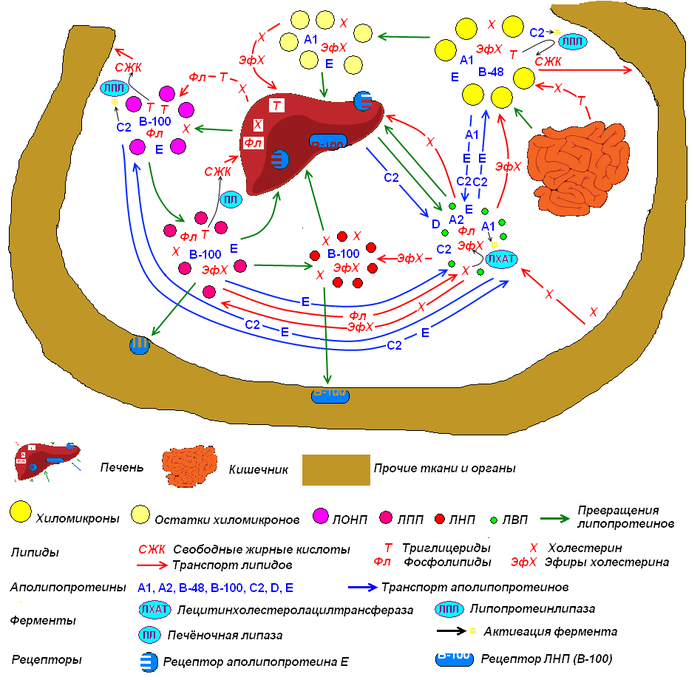
Метаболизм липопротеиновХиломикроны образуются в лимфатической системе ворсинок кишечника. Они переносят до половины всех триацилглицеролов и холестерина лимфы. Новосинтезированные хиломикроны содержат интегральный белок В-48. Апопротеин В встраивается в липопротеины в гЭПР, где синтезируются триацилглицеролы. В аппарате Гольджи к белкам добавляются углеводы. Они высвобождаются из клеток кишечника обратным пиноцитозом. После этого хиломикроны поступают в лимфатические сосуды ворсинок и уносятся лимфой. Попадая в кровоток, они получают апопротеины С и Е от ЛВП. На стенках капилляров находится липопротеинлипаза (ЛПЛ) (прикрепляется к ним протеогликановыми цепями гепарансульфата). В печени также есть своя липаза, но она менее эффективно атакует хиломикроны. Апопротеин С2 активирует липопротеинлипазу, которая расщепляет триглицериды хиломикрона до ди- и моноглицеридов, а затем — до свободной жирной кислоты и глицерола. Жирные кислоты транспортируются в мышечные и жировые ткани или связываются с альбумином в крови. По мере липолиза хиломикроны теряют большинство своих триацилглицеролов, относительное содержание холестерина и его эфиров увеличивается. Диаметр остатка хиломикрона уменьшается. Апопротеин С2 возвращается на ЛВП, апопротеин Е сохраняется. Остатки хиломикронов поглощаются печенью. Поглощение осуществляется через рецепторный эндоцитоз, с помощью рецепторов апопротеина Е. В печени эфиры холестерина и триацилглицеролы окончательно гидролизуются.
ЛОНП переносят триацилглицеролы, а также фосфолипиды, холестерин и его эфиры из печени в другие ткани. Метаболизм ЛОНП похож на метаболизм хиломикронов. Интегральным белком их является другой апопротеин В, В-100. ЛОНП высвобождаются из клеток печени обратным пиноцитозом, после чего через слой эпителиальных клеток поступают в капилляры печени. В крови на них переносятся апопротеины С2 и Е с ЛВП. Триацилглицеролы ЛОНП, как в случае с хиломикронами, расщепляются при активации ЛПЛ с помощью апопротеина С2, свободные жирные кислоты поступают в ткани. По мере расщепления триацилглицеролов диаметр ЛОНП уменьшается, и они превращаются в ЛПП. Эфир-холестерин-переносящий белок (апопротеин D в составе ЛВП) переносит на ЛОНП эфиры холестерина от ЛВП в обмен на фосфолипиды и триглицериды.
Половина ЛПП поглощается печенью с помощью рецепторного эндоцитоза через рецепторы апопротеина Е и B-100. Триацилглицериды ЛПП гидролизуются печёночной липазой. Апопротеины С2 и Е возвращаются на ЛВП. частица превращается в ЛНП. Относительное содержание холестерина в ЛНП значительно увеличивается, диаметр частицы сокращается. (Они также переносят триглицериды, каротиноиды, витамин Е и др.) ЛНП поглощаются клетками печени (70%) и внепечёночных тканей с помощью рецепторного эндоцитоза. Однако лигандом теперь, в основном, служит белок В-100. Рецептор называется «рецептором ЛНП».
ЛВП обеспечивают обратный транспорт холестерина из внепечёночных тканей к печени. ЛВП синтезируются в печени. В новообразованных ЛВП содержатся апопротеины А1 и А2. Апопротеин А1 синтезируется также в кишечнике, где входит в состав хиломикронов, но при липолизе в крови быстро переносятся на ЛВП. Апопротеин С синтезируется в печени, выделяется в кровоток и уже в кровотоке переносится на ЛВП. Новообразованный ЛВП похож на диск: фосфолипидный бислой, включающий свободный холестерин и апопротеин. Апопротеин А1 — активатор фермента лецитинхолестеринацилтрансферазы (ЛХАТ). Этот фермент связан с поверхностью ЛВП в плазме крови. ЛХАТ катализирует реакцию между фосфолипидом ЛВП и свободным холестерином частицы. При этом образуются эфиры холестерина и лизолецитин. Неполярные эфиры холестерина перемещаются внутрь частицы, освобождая место на поверхности для захвата нового холестерина, лизолецитин — на альбумин крови. Неполярное ядро раздвигает бислой, ЛВП приобретает сферическую форму. Этерифицированный холестерин переносится с ЛВП на ЛОНП, ЛНП и хиломикроны специальным белком ЛВП — переносчиком эфиров холестерола (апопротеин D), в обмен на фосфолипиды и триглицериды. ЛВП поглощается клетками печени с помощью рецепторного эндоцитоза через рецептор апопротеина Е.
Специфичности рецепторов апопротеинов Е и В-100 частично пересекаются. Они находятся на поверхности мембран клеток в клатриновой кавеоле. При соединении с лигандами кавеола замыкается в везикулу и липопротеин эндоцитируется. В лизосомах эфиры холестерина гидролизуются и холестерин поступает в клетку.
Литература
- www.humuk.ru.
- Кольман Я., Рём К.-Г., «Наглядная биохимия», пер.с нем., М., «Мир», 2009.
- Марри Р., Греннер Д., Мейес П., Родуэлл В. «Биохимия человека», в 2 т. М., «Мир», 2003.
ЛИПОПРОТЕИДЫ — Большая Медицинская Энциклопедия
ЛИПОПРОТЕИДЫ (греч. lipos жир + протеиды; син. липопротеины) — комплексы липидов с белками; входят в состав всех живых организмов, выполняют важнейшую функцию транспорта и запасания липидов, являются необходимой составляющей различных морфологических структур клетки; содержание липопротеидов в крови является важным диагностическим тестом при ряде заболеваний. Л., как и другие группоспецифические вещества, используются в суд.-мед. практике для идентификации вещественных доказательств, а также при установлении спорного отцовства или материнства.
Л. условно делят на свободные, или растворимые в водной среде (Л. плазмы крови, молока, желтка яиц и др.), и структурные (Л. мембран клеток, миелиновой оболочки нервов, хлоропластов растений и др.).
Классификация Л. основана гл. обр. на их поведении при ультрацентрифугировании (см.) и электрофорезе (см.). Л., в отличие от других белков, имеют сравнительно низкую плотность, поэтому при ультрацентрифугировании в солевых р-рах они флотируют (всплывают). Скорость флотации характеризуется коэффициентом флотации sf и выражается в сведбергах (S). Символ sf обычно используют тогда, когда плотность растворителя равна 1,063 г/мл; если же плотность растворителя равна 1,21 г/мл, для обозначения коэффициента флотации исиользуют символ F1,21. При электрофорезе Л. движутся в зоне α- и β-глобулинов, отсюда и обозначения: альфа-липопротеиды, пре-бета-липопротеиды, бета-липопротеиды. Белковые компоненты Л. (аполипопротеиды) по одной номенклатуре обозначают как апо-А, апо-В, апо-С и т. д., по другой — по их С-концевым аминокислотным остаткам: аполипопротеид-ала, аполипопротеид-глу и т. п. В каждом классе Л. имеется обычно несколько аполипопротеидов.
Наиболее изученными являются Л. плазмы крови человека. Они делятся на четыре класса: хиломикроны, Л. очень низкой плотности (ЛОНП), Л. низкой плотности (ЛИП) и Л. высокой плотности (ЛВП). По электрофоретической подвижности Л. подразделяют на пре-бета-липопротеиды (ЛОНП), бета-липопротеиды (ЛНП), альфа-липопротеиды (ЛВП).
Помимо этих классов Л., в плазме крови иногда обнаруживают необычные Л. Примером могут служить так наз. флотирующие (всплывающие) бета-липопротеиды. Такие Л. флотируют подобно липопротеидам очень низкой плотности при плотности р-ра 1,006 г/мл, но обладают электрофоретической подвижностью, близкой к электрофоретической подвижности (бета-липопротеидов.
Л. значительно различаются по хим. составу, напр, отношение количества белка к количеству липидов в хиломикронах составляет примерно 1 : 99, а у Л. высокой плотности — 50 : 50. В норме Л. сыворотки крови содержат —350 мг% альфа-липопротеидов и —450 мг% липопротеидов.
Большие различия наблюдаются и в физ.-хим. свойствах Л. (табл. 1).
Л. имеют мицеллярное строение. Возможно, что мицеллы состоят из ядра, образованного гидрофобными компонентами липидов, и наружного слоя, состоящего из белка и полярных групп фосфолипидов. Детали строения Л. пока не известны.
Образование хиломикронов и небольшой части Л. низкой и очень низкой плотности происходит в эпителиальных клетках тонкой кишки; Л. очень низкой плотности и Л. высокой плотности синтезируются гл. обр. в печени; Л. низкой плотности образуются в крови в результате действия на Л. очень низкой плотности фермента липопротеидлипазы (см.). Период полураспада хиломикронов меньше часа, Л. очень низкой плотности — 2—4 часа, Л. низкой плотности — 2—4 сут., Л. высокой плотности — 5 сут.
Функции Л. в организме весьма разнообразны. Хиломикроны осуществляют транспорт жиров нищи, Л. очень низкой плотности переносят к месту утилизации триглицериды эндогенного происхождения, а Л. низкой плотности переносят в клетки холестерин; функции Л. высокой плотности пока полностью пе выяснены, однако некоторые авторы отмечают их антиатерогенные свойства.
Для определения концентрации Л. в плазме крови необходимо предварительно провести их фракционирование. Напр., Л. очень низкой плотности и Л. низкой плотности можно осадить гепарином (см. Бурштейна метод), при этом Л. высокой плотности остаются в надосадочной жидкости. Лучшим способом разделения Л. является препаративное ультрацентрифугирование.
Гистохимические методы определения липопротеидов в тканях
Л. входят в состав клеточных мембран, мембран митохондрий, ядра, микро-сом, пластинчатого комплекса (аппарата Гольджи). Гистохим, методы определения Л. в тканях основаны на экстрагировании липидов из липидно-белкового комплекса Л., поэтому методы определения Л. идентичны методам определения липидов в тканях (см .Липиды). Однако в связи с гем, что липиды в Л. прочно связаны с белком, ткани нуждаются в предварительной обработке. Так, именно при окраске мазков крови на липиды было обнаружено, что при обработке мазков органическими к-тами (уксусной, лимонной, щавелевой, муравьиной) с последующим окрашиванием созревающим р-ром судана черного В в 70% спирте усиливается окраска митохондрий в лимфоцитах, начинают окрашиваться тромбоциты. Многие структуры, содержащие Л., начинают окрашиваться также после длительного промывания срезов или после сушки их в горячем воздухе, а также после нагревания до кипения в спиртовом р-ре судана черного В.
Число методов определения Л. в тканях (связанных липидов) очень невелико. Наиболее распространен метод Беренбаума с применением судана черного В, растворенного в ацетоне, при окрашивании к-рым связанные липиды хроматина, ядрышек, гранул нейтрофильных лейкоцитов приобретают черный цвет. Для научно-исследовательской работы при определении Л. в замороженных срезах рекомендуют бенз(а)пирен — кофеиновый метод Берга. Среди методов электронной гистохимии также существует очень небольшое число методов для определения Л. При этом часто приходится прибегать к параллельному исследованию с помощью световой микроскопии. При фиксации тканей для электронно-микроскопического исследования в р-ре четырехокись осмия — йодид цинка интенсивно контрастируются такие компоненты клетки, как пластинчатый комплекс, лизосомы, гранулярная эндоплазматическая сеть, митохондрии. Считают, что эту реакцию дают Л., входящие в состав мембран клеточных органелл.
Нарушения липопротеидного обмена
Нарушения обмена Л. разнообразны. Они могут быть связаны с нарушением скорости образования Л. в печени и катаболизма Л. в организме или скорости трансформации одного класса Л. плазмы крови в другой, а также с образованием в печени аномальных или патол. Л. и, наконец, с формированием аутоиммунных комплексов липопротеид — антитело. В целом концентрация в крови того или иного класса Л. зависит гл. обр. от сбалансированности двух процессов: скорости их образования и поступления в кровь и быстроты их элиминации из крови.
О нарушениях обмена Л. обычно судят по качественным и количественным изменениям их содержания в плазме (сыворотке) крови. Такие изменения объединяют общим термином «дислипопротеинемии». Сюда входят такие понятия, как гипер- и гиполипопротеинемия — повышенное или пониженное содержание в плазме крови одного, реже двух классов Л.; алипопротеинемия — отсутствие какого-то класса Л. в крови.
Гиперлипопротеинемия
Фредриксон (D. S. Fredrickson) и соавторы предложили классификацию гиперлипопротеинемий, включающую наиболее часто встречающиеся нарушения обмена Л. у человека. В 1970 г. она была одобрена экспертами ВОЗ с небольшими дополнениями. В соответствии с этой классификацией различают следующие пять типов гиперлипопротеинемии.
I тип — гиперхиломикронемия («индуцированная жирами Липемия»). Основное изменение в Л. крови заключается в постоянном и высоком содержании хиломикронов. Концентрация триглицеридов в крови резко повышена, концентрация холестерина либо в пределах нормы, либо слегка повышена, величина отношения холестерин : триглицериды всегда меньше 0,15. В основе этого типа гиперлипопротеинемии лежит недостаточность фермента липопротеидлипазы, носящая, очевидно, наследственный характер.
Клинически этот тип нарушения обмена Л. проявляется в раннем детском возрасте прежде всего отложением липидов в коже в виде эруптивных ксантом (см.), в печени и селезенке (гепатоспленомегалия). Часто наблюдаются приступы кишечной колики. Этот тип гиперлипопротеинемии встречается крайне редко, обычно носит семейный характер и для него не характерно развитие атеросклероза.
II тип — гипербеталипопротеинемия. Этот тип гиперлипопротеинемии делят на два подтипа: Па, характеризующийся высоким содержанием в крови Л. низкой плотности бета-липопротеидов), и IIб, характеризующийся высоким содержанием одновременно двух классов Л.— Л. низкой плотности (бета-липопротеидов) и Л. очень низкой плотности (пре-бета-липопротеидов). При II типе гиперлипопротеинемии отмечается высокое, а в некоторых случаях очень высокое содержание холестерина в крови. Иногда при высокой гиперхолестеринемии (см.) может наблюдаться отложение холестерина в кожу в виде бугорчатых и плоских ксантом, а также в сухожилия и роговицу глаза (липоидная дуга роговицы). Содержание триглицеридов в крови может быть либо нормальным (IIа тип), либо повышенным (IIб тип).
При II типе гиперлипопротеинемии развивается ишемическая болезнь сердца (см.). Внезапная смерть от инфаркта миокарда в детском и юношеском возрасте наблюдается, как правило, у лиц со II типом гиперлипопротеинемии с гомозиготной наследственностью. У гетерозигот со II типом гиперлипопротеинемии ишемическая болезнь сердца развивается в более позднем возрасте и протекает пе столь остро.
III тип — «флотирующая» гиперлипопротеинемия, или дисбеталипопротеинемия. Основное изменение в качественном составе Л. крови заключается в появлении Л. с необычно высоким содержанием холестерина и высокой электрофоретической подвижностью (патологические, или флотирующие, бета-липопротеиды или Л. очень низкой плотности). Эти патол. Л. накапливаются в крови вследствие нарушения превращения пре-бета-липопротеидов в бета-липопротеиды.
При этом типе гиперлипопротеинемии в крови повышено содержание холестерина и триглицеридов, причем величина отношения концентрации холестерина к концентрации триглицеридов часто бывает близка к 1, хотя может варьировать от 0,3 до 2.
Нередко у больных с III типом гиперлипопротеинемии наблюдается патол, толерантность к углеводам. Углеводная диета у таких больных приводит к стойкому и наиболее выраженному по сравнению с другими типами гиперлипопротеинемии нарастанию содержания триглицеридов в крови. III тип гиперлипопротеинемии часто сочетается с различными проявлениями атеросклероза (см.), в т. ч. с ишемической болезнью сердца и поражением сосудов ног. У части больных при особенно высоком содержании холестерина и триглицеридов в крови наблюдается отложение липидов в коже в виде плоских, бугорчатых и эруптивных ксантом.
III тип гиперлипопротеинемии встречается редко и преимущественно у взрослых.
IV тип — гиперпребеталипопротеинемия («индуцированная углеводами Липемия»). Основное изменение в Л. крови состоит в повышении концентрации Л. очень низкой плотности (пре-бета-липопротеидов). Этот тип гиперлипопротеинемии характеризуется высоким содержанием в крови триглицеридов при нормальном или относительно невысоком уровне холестерина.
V части больных с IV типом гиперлипопротеинемии отмечается снижение толерантности к углеводам; в ответ на углеводную диету у таких больных нарастает концентрация триглицеридов в крови, однако в меньшей степени, чем у больных с III типом гиперлипопротеинемии. Клинически IV тип гиперлипопротеинемии характеризуется развитием атеросклероза коронарных сосудов, проявляющегося ишемической болезнью сердца. У ряда больных гиперпребеталипопротеинемия сочетается с ожирением (см.) и сахарным диабетом (см. Диабет сахарный).
При очень высокой концентрации триглицеридов в крови липиды могут откладываться в коже в виде эруптивных ксантом. Гиперлипопротеинемия IV типа развивается преимущественно у взрослых людей и представляет собой весьма распространенный тип гиперлипопротеинемии.
V тип — гиперхиломикронемия и гиперпребеталипопротеинемия («смешанная гиперлипемия»). Основные изменения в Л. крови заключаются в повышении концентрации хиломикронов и Л. очень низкой плотности (пре-бета-липопротеидов), причиной к-рого является пониженная активность липопротеидлипазы. Содержание триглицеридов в крови таких больных повышено, в некоторых случаях до очень высоких цифр, концентрация холестерина в норме или несколько повышена. Величина отношения холестерин : триглицериды колеблется от 0,15 до 0,6. Клинически V тип гиперлипопротеинемии проявляется теми же симптомами, что и I тип. Иногда V тип гиперлипопротеинемии сочетается со скрытым или умеренно выраженным сахарным диабетом. Обычно при этом типе нарушения обмена Л. реже наблюдается ишемическая болезнь сердца, чем при II, III и IV типах. В отличие от I типа гиперлипопротеинемии, при к-ром наблюдается резко выраженная недостаточность липопротеидлипазы, при V типе активность этого фермента только слегка понижена. Первичная гиперлипопротеинемия V типа встречается у взрослых и не имеет широкого распространения.
Перечисленные типы гиперлипопротеинемии могут быть генетически обусловленными, и в этом случае они относятся к первичным заболеваниям семейного характера. Однако, несмотря на наследственную природу, течение и выраженность семейных гиперлипопротеинемий во многом зависят от алиментарных, гормональных, эмоциональных и других факторов. Повышение содержания Л. в крови, обусловленное какими-либо заболеваниями, относится к категории вторичных гиперлипопротеинемий и их течение во многом определяется этими заболеваниями.
Гиперальфалипопротеинемия. Описаны случаи семейной гиперальфалипопротеинемии, а также повышение относительного содержания Л. этого класса в крови у спортсменов — бегунов на дальние дистанции. Обычно критерием гиперальфалипопротеинемии служит содержание холестерина и фракции альфа-липопротеидов, легко определяемое в плазме крови после предварительного осаждения бета- и пре-бета-липопротеидов гепарином в присутствии ионов марганца или кальция (см. Бурштейна метод). Так, если концентрация альфа-липопротеидного холестерина в крови мужчин среднего возраста превышает 80 мг%, есть основания расценивать это как признак гиперальфалипопротеинемии. Гиперальфалипопротеинемию следует рассматривать как благоприятную для организма «патологию», поскольку альфа-липопротеиды обладают антиатерогенным действием. Некоторые авторы относят гиперальфалипопротеинемию к факторам долголетия.
Алипопротеинемия
Реже, чем повышение содержания Л. некоторых классов в крови, встречается другое нарушение обмена, проявляющееся снижением или даже полным отсутствием в крови Л. того или иного класса.
Известно наследственное заболевание — танжерская болезнь, или аальфалипопротеинемия, впервые обнаруженная у жителей Танжера и характеризующаяся отсутствием в крови нормальных Л. высокой плотности (a-липопротеидов) и появлением аномальных Л., обозначаемых как Л. высокой плотности Т. Концентрация общего холестерина в крови у больных танжерской болезнью ниже нормы, однако относительное содержание этерифицированного холестерина повышено. В связи с этим отмечают накопление эфиров холестерина в ретикулоэндотелиальной системе, сопровождающееся гепатоспленомегалией. Для танжерской болезни характерны изменения со стороны небных миндалин — тонзиллит с оранжевым и желто-серым налетом. Несмотря на низкую концентрацию общего холестерина в крови, у больных танжерской болезнью наблюдают раннее развитие атеросклероза и ишемической болезни сердца, что, очевидно, связано с отсутствием в крови нормальных Л. высокой плотности.
Другая наследственная патология такого типа — абеталипопротеинемия (см.) характеризуется отсутствием в крови не только бета-липопротеидов, как считали ранее, но и пре-бета-липопротеидов и хиломикронов. Главный метаболический дефект в этом случае связан с угнетением в печени синтеза белка апо-В, необходимого для формирования Л. перечисленных выше классов. У лиц, страдающих абеталипопротеинемией, отмечается нарушение всасывания пищевых жиров. Часто наблюдается атаксическая невропатия, пигментный ретинит и акантоз.
Гиполипопротеинемия
Менее выражено с клин, точки зрения протекают гипоальфа- и гипобеталипопротеинемия. Гипоальфалипопротеинемия нередко встречается у лиц с повышенным содержанием р- или пре-Р~липопротеидов в крови (соответствует II, IV и V типам гиперлипопротеинемии). Долгое время гипоальфалипопротеинемия не привлекала к себе пристального внимания, особенно если она обнаруживалась на фоне гипер-бета- и гиперпре-бета-липопротеинемии, которые в основном и вызывали озабоченность врача. Вместе с тем сочетание гипоальфалипопротеинемии с перечисленными выше типами гиперлипопротеинемии в значительной степени усиливает риск развития атеросклероза и связанных с ним осложнений. По-видимому, в большинстве случаев гипоальфалипопротеинемия имеет вторичную природу.
Семейная гипобеталипопротеинемия чрезвычайно редкое заболевание. Оно характеризуется низким содержанием p-липопротеидов в крови. Клин, признаки гипобеталипопротеинемии или отсутствуют или проявляются нарушением всасывания жиров в кишечнике. У взрослых людей с гипобеталипопротеинемией ишемическая болезнь сердца не выявлена.
Известно наследственное заболевание, называемое ЛХАТ-недостаточность. В основе его лежит врожденное подавление синтеза фермента лецитин-холестерин-ацилтрансферазы (ЛХАТ), который катализирует этерификацию холестерина в плазме крови. Вследствие нарушения этерификации холестерина изменяется хим. состав и морфология Л. всех классов. Наиболее характерное изменение в Л. высокой плотности — это появление фракции дискообразных частиц, представляющих собой двухслойные мембраны, содержащие неэтерифицированный холестерин, фосфолипиды и белки — апопротеиды. Во фракции Л. низкой плотности появляются так наз. липопротеиды-X, состоящие в основном из неэтерифицированного холестерина, фосфолипидов, апопротеидов С и альбумина. Для этого заболевания характерно отложение и накопление неэтерифицированного холестерина в почках, селезенке, роговице глаза, мембране эритроцитов. Клинически эти изменения проявляются гипохромной анемией (см.), почечной недостаточностью (см.), спленомегалией (cм.), помутнением роговицы (см.) и др. Появление липопротеидов-Х наблюдается также при обтурационной болезни печени.
При определенных условиях Л. плазмы крови могут функционировать как аутоантигены (см.), вызывая образование антител и в конечном счете — аутоиммунных комплексов антиген — антитело. Появление таких комплексов установлено при миеломной болезни, ревматоидном синдроме, макроглобулинемии, а также при атеросклерозе. Существует, по-видимому, несколько разновидностей аутоиммунных комплексов липопротеид — антитело, отличающихся как по антигену, так и по антителу. Антиген в таких комплексах содержит значительные количества липидов и образование комплексов часто сопровождается гиперлипидемией. Согласно аутоиммунной теории патогенеза атеросклероза, предложенной А. Н. Климовым с сотр., аутоиммунные комплексы обладают большей атерогенностью, чем сами Л., и способны инициировать атеросклеротический процесс.
Лечение нарушений липопротеидного обмена. Если нарушения обмена Л. имеют вторичную природу, т. е. вызваны каким-то заболеванием или действием таких факторов, как переедание, малоподвижный образ жизни, хрон, употребление алкоголя и т. п., главное внимание должно быть направлено на лечение основного заболевания или устранение вредных факторов. Уже одно это часто приводит к нормализации содержания Л. в крови. При V типе гиперлипопротеинемии успешно применяют внутривенное введение гепарина, который активирует липопротеидлипазу, в результате чего плазма крови просветляется (при I типе гиперлипоиротеинемии, при к-рой нарушен синтез липопротеидлипазы, введение гепарина не дает эффекта).
При лечении первичных гиперлипопротеинемий на первое место следует поставить диетотерапию, напр, замену природных жиров синтетическими, содержащими короткоцепочечные жирные к-ты, при гиперлипопротеинемии I типа. В тех случаях, когда диета недостаточно корригирует нарушения обмена Л., рекомендуется применение средств, снижающих концентрацию холестерина и триглицеридов в крови (табл. 2)
Методы лечения алипопротеинемий пока не разработаны.
Таблицы
Таблица 1 Показатели, характеризующие физикохимические свойства липопротеидов плазмы крови человека
Показатель | Хиломикроны | Липопротеиды очень низкой плотности | Липопротеиды низкой плотности | Липопротеиды высокой плотности |
Плотность, г/мл | 0,93 | 0,9 7 | 1,035 | 1,13 |
Коэффициенты флотации | ||||
sf | >400 | 20 — 400 | 0-20 | — |
F1,21 | — | — | — | 0 — 9 |
Молекулярный вес (масса), дальтон | 500 млн. | 20 млн. | 2,5 млн. | 0,25 млн. |
Диаметр частиц, нм | более 120 | 30 — 100 | 21-25 | 7—15 |
Таблица 2. Лечебные подходы при различных типах гиперлипопротеинемии
Тип гиперлипопротеинемии | Липопротеид, концентрация которого в плазме крови повышена | Частота и степень поражения сосудов при атеросклерозе | Рекомендуемая диета и гиполипидемические препараты (в порядке убывания эффективности) |
I | Хиломикроны | Поражение сосудов не встречается | Диета с низким содержанием жира (25—35 г в сутки) |
IIа | бета-Липопротеиды | Наблюдается часто, резко выражено и рано появляется | Диета с низким содержанием холестерина (меньше 300 мг в сутки). Холестирамин, никотиновая к-та, мисклерон, |
II6 | бета-Липопротеиды и пре-бетаипопротеиды | Наблюдается часто, резко выражено | бета-ситостерин, препараты ненасыщенных жирных к-т |
III | Флотирующие бета-липопротеиды | Наблюдается редко | Диета с низким содержанием холестерина (меньше 30 0 мг в сутки) и ограничением углеводов. Мисклерон, никотиновая к-та, препараты ненасыщенных жирных к-т |
IV | Пре-бета-липо- протеиды | Наблюдается часто | Ограничение углеводов и умеренное ограничение холестерина в пище (до 3 00—500 мг в сутки). Мисклерон, никотиновая к-та, p-ситостерин, препараты жирных к-т |
V | Хиломикроны и пре-бета-липопротеиды | Наблюдается редко | Диета с низким содержанием жиров, ограничением углеводов и умеренным ограничением холестерина (до 3 00—5 00 мг в сутки). Мисклерон, никотиновая к-та, препараты ненасыщенных жирных к-т, внутривенное введение гепарина. |
Библиография: Гайер Г. Электронная гистохимия, пер. с нем., с. 49, М., 1974; Карманский И. М., Левитова E. Н. иШпикитер В. О. Свойства, строение и роль липопротеидов сыворотки крови, в кн.: Успехи биол, хим., под ред. Б. Н. Степаненко, т. 16, с. 89, М., 1975; Климов А. Н. Липопротеиды плазмы крови, в кн.: Липиды, Структура, биосинтез, превращения и функции, под ред. С. Е. Северина, с. 57, М., 1977; К л и-м о в А. H. и H и к у л ь ч e в а H. Г. Типы гиперлипопротеинемий, их связь с атеросклерозом и лечение, Кардиология, т. 12, № 6, с. 133, 1972, библиогр.; К л и-мов А. Н., Никульчева Н. Г. иКриворученко И. В. Фенотипи-рование гиперлипопротеинемий, там ше, т. 14, № 12, с. 103, 1974; Превентивная кардиология, под ред. Г. И. Косицкого, с. 260, М., 1977; Туманов А. К. и T о м и л и н В. В. Наследственный полиморфизм изоантигенов и ферментов крови в норме и патологии человека, М., 1969; Blood lipids and lipoproteins, quantitation, composition and metabolism, ed. by G. J. Nelson, N. Y.— L., 1972; Hyperli-pidemia, diagnosis and therapy, ed. by B. M. Rifkind a. R. I. Levy, N. Y.. 1977; The metabolic basis of inherited disease, ed. by J. B. Stanbury a. o., N. Y., 1972; Structural and functional aspects of lipoproteins in living systems, ed. by E. Tria a. A. M. Scanu, L.— N. Y., 1969.
В. О. Шпикитер; T. H. Дрозд (гист.), А. Н. Климов (нарушение обмена).
2.3. Классификация и роль липопротеинов
Существует несколько классификаций липопротеинов (ЛП), основанных на различиях в их свойствах: гидратированной плотности, скорости флотации, электрофоретической подвижности, а также на различиях в апопротеиновом составе частиц. Наибольшее распространение получила классификация, использующая поведение отдельных ЛП в гравитационном поле при ультрацентрифугировании. Применяя набор солевых плотностей, можно изолировать отдельные фракции ЛП: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП).
Различная электрофоретическая подвижность по отношению к глобулинам плазмы крови положена в основу другой классификации ЛП, согласно которой различают ХМ (остаются на старте аналогично γ-глобулинам), β-ЛП, пре-β-ЛП, α-ЛП, занимающие положение β- и α1— и α2-глобулинов соответственно. Электрофоретическая подвижность фракций ЛП, выделенных путем ультрацентрифугирования, соответствует подвижности отдельных глобулинов, поэтому иногда применяют их двойное обозначение: ЛПОНП (пре-β-ЛП), ЛПНП (β-ЛП), ЛПВП (α-ЛП). Состав и функции различных липопротеинов плазмы крови представлены в таблице 1, а рис. 17
служит иллюстрацией их судьбы в организме.
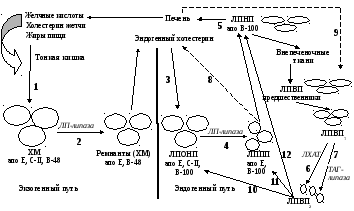 Рис.
17. Судьба липопротеинов в организме
Рис.
17. Судьба липопротеинов в организме
Пищевые липиды (ТАГ, холестерин) после всасывания доставляются к клеткам с помощью хиломикронов (ХМ) (1). Их эндогенные аналоги, синтезированные в печени, как отмечено выше, включены в ЛПОНП (3). Обе транспортные формы, продвигаясь по сосудам, подвергаются действию липопротеинлипазы, фиксированной на поверхности эндотелия капилляров, которая гидролизует ТАГи, содержащиеся в белковых комплексах; освободившиеся ВЖК и глицерол специфически метаболизируются тканями.
Таблица 1.
Состав липопротеинов крови, их функции
Типы ЛП | ХМ | ЛПОНП | ЛППП | ЛПНП | ЛПВП |
Состав, % | |||||
Белки | 2 | 10 | 11 | 22 | 50 |
ФЛ | 3 | 18 | 23 | 21 | 27 |
ХС | 2 | 7 | 8 | 8 | 4 |
ЭХС | 3 | 10 | 30 | 42 | 16 |
ТАГ | 85 | 55 | 26 | 7 | 3 |
Функ-ции | Транспорт экзогенных липидов из энтероцитов | Транспорт эндогенных липидов, синтезируе-мых в гепатоцитах | Промежуточ-ная форма превращения ЛПОНП в ЛПНП под действием ЛП-липазы | Транспорт ХС в ткани | Удаление избытка ХС из клеток и других ЛП. Донор апо-протеинов А, С-II |
Место образования | Эпителий тонкого кишечника | Клетки печени | Кровь | Кровь (из ЛПОНП и ЛППП) | Клетки печени – ЛПВП-предшественники |
Плот-ность, г/мл | 0,92-0,98 | 0,96-1,00 | 1,00-1,06 | 1,06-1,21 | |
Диаметр частиц, нм | Больше 120 | 30-100 | 21-100 | 7-15 | |
Основ-ные апоЛП | В-48 С- II Е | В-100 С-II Е | В-100 Е | В-100 | А-I (II) С-II Е |
Остаточные ХМ (ремнанты), а также получившиеся последовательно из ЛПОНП – ЛППП, а далее ЛПНП, захватываясь рецепторами гепатоцитов (реакции 5 и 8) и других тканей, подвергаются эндоцитозу.
П редшественники
ЛПВП формируются в тонком кишечнике и
печени (реакция9).
ЛПВП3,
обогащаясь ХС в крови, обратимо
превращаются в ЛПВП2 (реакции 6 и 7)
под действием ферментов ЛХАТ
(лецитин-холестерол-ацилтрансферазы)
и печеночной ТАГ-липазы.
Первый энзим катализирует следующую
реакцию:
редшественники
ЛПВП формируются в тонком кишечнике и
печени (реакция9).
ЛПВП3,
обогащаясь ХС в крови, обратимо
превращаются в ЛПВП2 (реакции 6 и 7)
под действием ферментов ЛХАТ
(лецитин-холестерол-ацилтрансферазы)
и печеночной ТАГ-липазы.
Первый энзим катализирует следующую
реакцию:
Специфический белок апоД, транспортирует образовавшиеся ЭХС с ЛПВП на ЛПОНП, ЛППП и ЛПНП (реакции 10,11, 12), которые доставляют его в гепатоциты. Таким образом, эффективность удаления холестерола из кровотока зависит от концентрации ЛПВП, которые играют главную роль в его переносе из периферических тканей в печень, где он становится доступным для синтеза желчных кислот и последующего выведения из организма.
Липопротеины имеют огромное клиническое значение
К липопротеинам, строго говоря, принадлежат только белки, содержащие ковалентно связанные липиды.
Однако традиционно к липопротеинам относят и надмолекулярные образования, переносящие липиды в плазме крови, и состоящие из белков и молекул всех классов липидов.
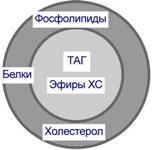
Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется скорлупа и ядро. «Скорлупа» липопротеина является гидрофильной, ядро – гидрофобное. Ядро формируют неполярные эфиры холестерола (ХС) и триацилглицеролы (ТАГ). В поверхностном слое («скорлупе») находятся фосфолипиды, холестерол, белки.
Белки в липопротеинах называются апобелками, их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки.
Схема строения липопротеина | Строение липопротеина |
Выделяют четыре основных класса липопротеинов:
липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП),
липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП),
липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП),
хиломикроны (ХМ).
Концентрация и соотношение в крови тех или иных липопротеинов играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз.
Свойства и функции липопротеинов разных классов зависят от состава, т.е. от соотношения триацилглицеролов, холестерола и его эфиров, фосфолипидов, белков:
Типы липопротеинов | По направлению сверху вниз происходят изменения состава |
Хиломикроны (до 90% липидов) ЛПОНП ЛПНП ЛПВП (до 80% белков) | Увеличение количества белка Увеличение количества фосфолипидов Уменьшение количества триацилглицеролов |
Функцией липопротеинов является перенос в крови триацилглицеролов и холестерола и его эфиров.
Для гликопротеинов характерна структурная роль
Класс под названием гликопротеины или, более корректно, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85% по массе.
Выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между этими подклассами имеются существенные отличия:
Гликопротеины | Протеогликаны |
|
|
Гликопротеины
Для собственно гликопротеинов характерно низкое содержание углеводов. Они присоединены либо N-гликозидной связью к амидному азоту аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина, треонина, гидроксилизина. Углевод имеет нерегулярное строение и содержит маннозу, галактозу, глюкозу, их аминопроизводные, N-ацетилнейраминовую кислоту.
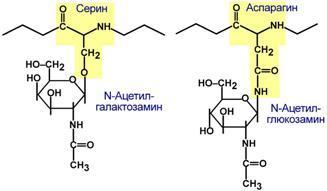
Способ присоединения углевода к белку Функцией гликопротеинов являются:
1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин.
2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген).
Схема строения белка-рецептора |
4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны.
5. Ферментативная – холинэстераза, нуклеаза.
6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.
1. Свободные липопротеины.
Липопротеины плазмы крови, молока, растворимы в воде.
2. Структурные протеолипиды.
Входят в состав биомембран, растворимы в жирах.
Липид – белковые комплексы в качестве небелковой части содержат липидные компоненты.
Высшие жирные кислоты
С17 Н35 СООН | Предельная Стеариновая |
С15 Н31 СООН | Пальмитиновая |
С17 Н33 СООН | Олеиновая |
С17 Н31 СООН | Линолевая |
С17 Н29 СООН | Линоленовая |
С19Н29СООН | Арахидоновая |
1.Свободные липопротеины.
Содержатся в плазме крови, все они имеют разную плотность (от 0,92 до 1,21 кг/л) благодаря липидному компоненту. В крови человека присутствуют несколько фракций ЛП, отличающихся по плотности, что связазано с различным соотношением липидного и белкового компонента в молекуле.
ФРАКЦИИ ЛП:
А) Хиломикроны ( ХМ ). Это самая низкая по плотности фракция, т.к. в составе их преобладают липидные комплексы и на долю белка приходится до 2 %. Плотность 0,95 кг/л. Хиломикроны появляются в сыворотке крови после приема жирной пищи;
Б) Липопротеины очень низкой плотности ( ЛПОНП ).или пре-b-липопротеины, их плотность 0,94 – 1,006 кг/л;
В) Липопротеины низкой плотности ( ЛПНП ) или b-липопротеины. Плотность их 1,006 – 1,063 кг/л;
Г) Липопротеины высокой плотности (ЛПВП ) или a-липопротеины.Плотность их 1,063 – 1,210 кг/л. В составе их преобладает белковый компонент.
РОЛЬ СВОБОДНЫХ ( ПЛАЗМЕННЫХ ) ЛИПОПРОТЕИНОВ.
Свободные ЛП играют транспортную роль, поэтому их называют — транспортными формами липидов. Благодаря своей растворимости в водной среде они могут переносить липиды, поступающие в кровь при всасывании из кишечника, а также распределять липиды между тканями, одни из которых их синтезируют, а другие используют.
ЛП переносят триацилглицеролы, фосфолипиды, стероиды, а также небольшое количество жирорастворимых витаминов, b-каротина.
В настоящее время доказана роль фракций липопротеинов в патогенезе атеросклероза – они называются атерогенными ЛП. К ним относятся ЛПНП и ЛПОНП, а фракцию ЛПВП называют антиатерогенной, так как её увеличение препятствует развитию атеросклероза.
2.Структурные липопротеины ( протеолипиды ).
Они входят в состав биологических мембран и растворяются в неполярных растворителях (хлороформ, метанол). Причина такого поведения протеолипидов в том, что белок составляет сердцевину их молекулы, а оболочку образует липидный компонент. Содержание белка в протеолипидах 65 – 85 %. Они обнаружены в сердце, почках, легких, скелетных мышцах. В клетках перечисленных органов они представляют основу биологических мембран, образуя двойной липидный слой, в формировании которого участвуют фосфо- и гликолипиды. Состав протеолипидов в различных органах неодинаков.
Нуклеопротеины
Нуклепротеины – это сложные белки, небелковая часть которых представлена нуклеиновыми кислотами. Поскольку нуклеиновые кислоты бывают двух типов, нуклеопротеины делятся по составу на 2 группы: рибонуклеопротеины и дезоксирибонуклеопротеины.
Нуклеиновые кислоты – это высокомолекулярные соединения, состоящие из мононуклеотидов, т.е. их структурной единицей является мононуклеотид (нуклеотид). Каждый нуклеотид включает 3 химически различных компонента: моносахарид, азотистое основание, остаток фосфорной кислоты. Нуклеотиды, входящие в РНК и ДНК, отличаются друг от друга по составу.
Соединение основания и пентозы называют нуклеозидом, связь между пентозой и азотистым основанием (b — гликозидная) образована — первым атомом углерода пентозы с первым атомом азота в пиримидиновых нуклеозидах и девятым атомом азота в пуриновых нуклеозидах.
Нуклеотиды представляют собой соединения нуклеозидов с фосфорной кислотой (связь сложно – эфирная). В составе РНК и ДНК по 4 нуклеозидмонофосфата (нуклеотида).
Номенклатура наиболее распространенных нуклеотидов.
РИБОНУКЛЕОЗИДМОНОФОСФАТЫ:
1. Аденозинмонофосфат ( АМФ ), адениловая кислота.
2. Гуанозинмонофосфат ( ГМФ ), гуаниловая кислота.
3. Цитидинмонофосфат ( ЦМФ ), цитидиловая кислота.
4. Уридинмонофосфат (УМФ), уридиловая кислота
ДЕЗОКСИРИБОНУКЛЕОЗИДМОНОФОСФАТЫ:
1. д.Аденозинмонофосфат ( д.АМФ ).
2. д.Гуанозинмонофосфат ( д.ГМФ ).
3. д.Цитидинмонофосфат ( д.ЦМФ ).
4. Тимидинмонофосфат ( д.ТМФ ).
Структура нуклеиновых кислот.
Первичные структуры РНК и ДНК построены однотипно, они представляют собой линейные полимеры – полинуклеотиды, состоящие из мононуклеотидов, соединенных 3′,5′ – фосфодиэфирными связями.
При этом сложноэфирная связь образована фосфатным остатком одного мононуклеотида и 3′ – гидроксильной группой пентозного остатка другого мононуклеотида (3′,5′ – фосфодиэфирная связь).
Концы полинуклеотидов различаются по структуре: на одном конце имеется свободная 5′ – фосфатная группа (5′ – конец), на другом – свободная 3′ – ОН — группа (3′ – конец). Уникальность структуры и функциональная индивидуальность молекул ДНК и РНК определяется их первичной структурой.
Вторичная структура ДНК.
Особенностью нуклеотидного состава ДНК является то, что число адениловых нуклеотидов равно числу цитидиловых: А=Т, Г=Ц, следовательно, А+Г=Т+Ц, т.е. число пуриновых нуклеотидов равно числу пиримидиновых (правила Чаргаффа). Такие соотношения не свойственны РНК. Исходя из правил Чаргоффа о нуклеотидном составе ДНК и из рентгеноструктурных исследований, Дж. Уотсон и Ф. Крик (Великобритания) предложили модель строения ДНК (1953)
Согласно этой модели молекула ДНК представляет собой двойную спираль, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидные цепи в ней антипараллельны, т.е. если одна из них ориентирована в направлении 3′ a 5′ , то вторая – в направлении 5′ a 3′. Поэтому на каждом из концов молекулы ДНК расположены 5′ – конец одной цепи и 3′ – конец другой цепи.
Все основания цепей ДНК (гидрофобные по свойствам) расположены внутри двойной спирали, а пентозы и остатки фосфорной кислоты – снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счет водородных связей, образующихся за счет специфического взаимодействия между парами комплементарных оснований. Комплементарными являются А и Т, они образуют две водородные связи, а также Г и Ц образуют три водородные связи.
Кроме водородных связей в стабилизации вторичной структуры ДНК участвуют гидрофобные взаимодействия возникающие за счет гидрофобных азотистых оснований, обращенных внутрь спирали. Гидрофобные взаимодействия вносят основной вклад в стабилизацию двойной спирали, больший чем водородные связи между цепями. Рибозофосфатные связи располагаются по периферии, образуя ковалентный остов спирали
Особенности структуры РНК.
Первичная структура РНК аналогична первичной структуре ДНК и представляет полинуклеотидную цепь, состоящую из мононуклеотидов, соединенных 3′ a 5′ – фосфодиэфирными связями.
Вторичная структура РНК.
Молекулы РНК построены из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли «шпильки», за счет водородных связей между комплементарными азотистыми основаниями А-У и Г-Ц. Участки цепи РНК в таких спирализованных участках антипараллельны, но не всегда полностью комплементарны. Наличие спирализованных участков характерно для всех типов РНК. Такие спирализованные участки содержат небольшое число нуклеотидных пар (до 20-30) и чередуются с неспирализованными участками.
Основные типы РНК.
По особенностям структуры и функциям различают 3 типа рибонуклеиновых кислот – транспортные РНК (тРНК), матричные РНК (мРНК) и рибосомальные РНК (рРНК). Они различаются по первичной структуре, молекулярной массе, конформации, продолжительности жизни и по функциональной активности.
1. Транспортные РНК (тРНК)
Пространственную структуру тРНК, независимо от различий в последовательности нуклеотидов, описывают универсальной моделью «клеверного листа». В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним в частности, относят участок, ответственный за связывание с аминокислотой на 3′-конце молекулы и антикодон – специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК. Транспортные РНК составляют около 15% всей РНК клетки, они участвуют в транспорте аминокислот.

Строение транспортных РНК.
1. Рибосомные РНК (рРНК) – компоненты рибосом. На долю рРНК приходится около 80% всей РНК клетки.
2. Матричные РНК (мРНК) составляют около 2% от всей РНК клетки. Матричные РНК называются также информационными РНК (иРНК).
Третичная структура нуклеиновых кислот.
Одноцепочные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путем взаимодействия спирализованных участков вторичной структуры. Третичная структура РНК стабилизируется ионами двухвалентных металлов, например ионами Mg2+.
Исследование некоторых ДНК вирусов митохондрий, хлоропластов при помощи физических, физико-химических методов показало, что двойная спираль ДНК на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы.
Суперспиральная структура (суперскрученная) обеспечивает экономную упаковку огромной молекулы ДНК в хромосоме вместо 8 см длины, которую она могла бы иметь в вытянутой форме, в хромосоме человека молекула ДНК настолько плотно упакована, что ее длина укладывается в 5 нм.
Имеющиеся данные о структуре тРНК свидетельствуют о том, что нативные молекулы тРНК имеют примерно одинаковую третичную структуру, которая отличается от плоской структуры «клеверного листа» большей компактностью, образованной за счет складывания различных частей молекулы.
ФОСФОПРОТЕИНЫ.
Фосфопротеины – это сложные белки, содержащие в своем составе в качестве простетической части фосфорную кислоту. Фосфорная кислота связана сложно – эфирной связью с белковой частью молекулы через гидроксильные группы оксиаминокислот (серин, треонин).
Установлено, что фосфопротеины в клетках синтезируются в результате фосфорилирования при участии протеинкиназ.
К фосфопротеинам относится казеиноген молока, который представляет собой белок с сильно выраженными гидрофильными свойствами. Казеиноген в молоке находится в виде кальциевой соли. Поэтому организм получает с молоком необходимые аминокислоты, кальций, лабильно связанный фосфор, находящиеся в казеиногене.
Предыдущий раздел | Раздел верхнего уровня | Следующий раздел |

Липопротеинов ▷ Перевод На Английский
КАК ПО АНГЛИЙСКИ ЛИПОПРОТЕИНОВ
Результатов: 40, Время: 0.0618
Русский перевод
Примеры использования «Липопротеинов» в предложение и их переводы
Анализ взаимодействия липопротеинов и стероидных гормонов. The analysis of interaction between lipoproteins and steroid hormones. Наиболее высокое сродство к стероидам обнаружено для липопротеинов высокой плотности. High density lipoproteins have revealed the highest affinity to steroids for. В многофакторной модели ни одно из изменений в профиле липопротеинов и липидов, связанных с приемом фенофибратов, не улучшило эндотелий зависимую дилатацию через 4 месяца. In multivariable models, none of the fenofibrate-related changes in lipoproteins and lipids were significantly associated with improved FMD on fenofibrate at 4 months. Рассчитанные константы комплексообразования липопротеинов со стероидными гормонами свидетельствуют о специфичности связывания. The calculated constants formation of the complexes of lipoproteins with steroid hormones testifies to specificity of linkage. Связь субфракционного спектра липопротеинов низких плотностей с уровнем триглицеридов в крови при разной степени стенозов коронарных артерий- стp. Relationship of low densities lipoprotein subfractions with triglycerides level in patients with different grade of coronary arteries stenosis- p. Соотношение белка и липида определяет плотность этих липопротеинов и служит основой для их классификации. The relative protein and lipid determine the density of these lipoproteins and provide the basis on which to begin their classification. С возрастом содержание общего холестерина и холестерина липопротеинов низкой плотности в сыворотке крови повышается, соответственно увеличивается и индекс атерогенности. With the age, the levels of total cholesterol and low density lipoprotein cholesterol in serum increases, correspondingly increases the atherogenic index. При употреблении вина в крови повышается уровень высокомолекулярных липопротеинов, которые выводят из организма низкомолекулярный холестерин. Drinking wine increases the level of high-molecular lipoproteins in blood, which are able to cleanse the body of low-molecular cholesterol. Уровни холестерина липопротеинов высокой плотности и триглицеридов в обеих половых группах соответствовали нормальным значениям. Levels of high density lipoprotein cholesterol and triglyceride in both of sex groups were normal. Характерными проатерогенными нарушениями липидного обмена у пациентов с сочетанной патологией являются гипертриглицеридемия и повышение холестерина липопротеинов низкой плотности( ХС ЛПНП). Typical proatherogenic disorders of lipid metabolism in patients with comorbidity are hypertriglyceridemia and increased low density lipoprotein cholesterol(LDL-C). Этапы формирования в крови и диагностическое значение модифицированных липопротеинов низкой плотности- стр. Stages of formation in blood plasma and diagnostic value of modified low density lipoproteins— p.|
|
ЛИПОПРОТЕИНЫ (липопротеиды), комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-липопротеины) и липидов, связь между к-рыми осуществляется посредством гидрофобных и электростатич. взаимодействий. Липопротеины подразделяют на свободные, или р-римые в воде (липопротеины плазмы крови, молока, желтка яиц и др.), и нерастворимые, т. наз. структурные (липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений). Нековалентная связь в липопротеинах между белками и липидами имеет важное биол. значение. Она обусловливает возможность своб. обмена липидов и модуляцию св-в липопротеинов в организме.
Среди своб. липопротеинов (они занимают ключевое положение в транспорте и метаболизме липидов) наиб. изучены липопротеины плазмы крови, к-рые классифицируют по их плотности. Чем выше содержание в них липидов, тем ниже плотность липопротеинов (табл. 1). Различают липопротеины очень низкой плотности (ЛОНП), низкой плотности (ЛНП), высокой плотности (ЛВП) и хиломикроны. Каждая группа липопротеинов очень неоднородна по размерам частиц (самые крупные — хиломикроны) и содержанию в ней апо-липопротеинов. Все группы липопротеинов плазмы содержат полярные и неполярные липиды в разных соотношениях.
Во всех липопротеинах плазмы имеется ядро, состоящее из эфиров холестерина и триацилглицеринов, к-рое покрыто мономолекулярным слоем холестерина, фосфолипидов и гидрофильной частью молекул апо-липопротеинов. Предполагают, что домены апо-липопротеинов имеют две грани, одна из к-рых гидрофобная, а другая — гидрофильная. Первая грань контактирует с жирно-кислотными цепями фосфолипидов, вторая — ассоциирована с полярной группой фосфолипидов на пов-сти раздела липид — вода. Хиломикроны и ЛОНП образуются соотв. в кишечнике и печени, ЛВП — в кишечнике, печени, а также в крови из др. липопротеинов. Идентифицированы нек-рые апо-липопротеины (см. табл. 2), каждый из к-рых обладает определенными св-вами, связанными с превращением липопротеинов в организме. Хиломикроны и ЛОНП, попадая в кровоток, захватывают апо-липопротеин С-II из ЛВП и активируют мембраносвязанную липопротеинлипазу, катализирующую расщепление в них триацилглицеринов. Во время катаболизма ацилглицеринов апо-липопротеин С-II возвращается к ЛВП, а хиломикроны и ЛОНП превращаются в ЛНП — осн. источник клеточного холестерина. ЛНП поступают во все клетки организма, взаимодействуя со спец. рецептором мембраны, активность к-рого понижается с увеличением концентрации внутриклеточного холестерина. ЛВП, наоборот, способны выводить холестерин из клеток. Предполагают, что высокое содержание в плазме ЛНП при низком содержании ЛВП — важный фактор возникновения атеросклероза (заболевания, обусловленного образованием обильных отложений холестерина и его эфиров на внутр. пов-сти кровеносных сосудов). Апо-липопротеин A-I — основной белок ЛВП. Он активирует сывороточный фермент лецитин : холестерол ацилтрансферазу (ЛХАТ), к-рый катализирует одновременно расщепление фосфолипидов и ацилирование холестерина, переводя его в биологически неактивную форму. Выделяют липопротеины плазмы крови обычно методом флотации, используя водные р-ры бромидов Na или К разл. плотности. К структурным липопротеинам относятся комплексы липидзависимых ферментов (напр., аденилатциклаза), рецспторные комплексы (напр., рецептор ацетилхолина), к-рые входят в состав мембран биологических. Их строение и биол. св-ва очень разнообразны. === Исп. литература для статьи «ЛИПОПРОТЕИНЫ»: Климов А. Н., в сб.: Биохимия липидов и их роль в обмене веществ, М., 1981, с. 45-75; Structural and functrond aspects of lipoproteins in living systems, ed. by E. Tria, A. M. Scanu, L. N. Y., 1969. Н. В. Проказова. Страница «ЛИПОПРОТЕИНЫ» подготовлена по материалам химической энциклопедии. Еще по теме: |