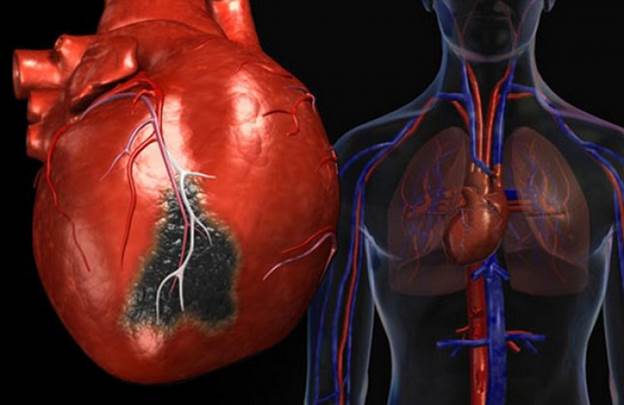
2.Венозная гиперемия, этиология, патогенез.
Венозная гиперемия развивается вследствие увеличения кровенаполнения органа или участка ткани в результате затрудненного оттока крови по венам.
Причины:закупорка вен тромбом или эмболом, сдавление рубцом, опухолью.
Предрасполагающие факторы:наследственная слабость эластического аппарата вен, недостаточное развитие и пониженный тонус гладкомышечных элементов их стенок, длительное пребывание в вертикальном положении.
Венозная гиперемия развивается также при ослаблении функции правого желудочка сердца, уменьшении присасывающего действия грудной клетки при экссудативном плеврите, затруднении кровотока в малом круге кровообращения (пневмосклероз, эмфизема легких, ослабление функции левого желудочка).
Клиника:увеличение органа или участка ткани, цианоз, местное понижение температуры, отек, замедление кровотока, диапедез эритроцитов.
Длительное расширение вен приводит к растяжению их стенки, что может сопровождаться гипертрофией мышечной оболочки ее и явлениями фибосклероза и варикозного расширения вен.
Продолжительный венозный застой приводит к значительным изменениям стенки вен, их атрофии и гибели. На участке венозной гиперемии происходит заместительное разрастание соединительной ткани.
Например, цирроз печени при недостаточности функций сердца.
Основным фактором, обусловливающим местные изменения при венозной гиперемии, является кислородное голодание (гипоксия) ткани.
Помимо местных изменений при венозной гиперемии возможны и общие гемодинамические нарушения. Они возникают при закупорке крупных венозных коллекторов и сопровождаются резким снижением артериального давления, нарушением питания жизненно важных органов. Вследствие недостаточности сердца или паралича дыхания возможен смертельный исход.
Венозная гиперемия начинается с максимального расширения прекапиллярных сфинктеров, которые становятся нечувствительными к вазоконстрикторным стимулам и венозный отток затрудняется. После этого замедляется ток крови в капиллярах и приносящих артериолах.
Главной причиной развития венозной гиперемии является экссудация — выход жидкой части крови из микроциркуляторного русла в окружающую ткань. Экссудация сопровождается повышением
вязкости крови, периферическое сопротивление кровотоку возрастает, скорость тока крови падает. Кроме того, экссудат сдавливает венозные сосуды, что затрудняет венозный отток и также усиливает венозную гиперемию. Развитию венозной гиперемии способствует набухание в кислой среде форменных элементов крови, сгущение крови, нарушение десмосом, краевое стояние лейкоцитов, образование микротромбов. Кровоток постепенно замедляется и приобретает новые качественные особенности из-за повышения гидростатического давления в сосудах: кровь начинает двигаться толчкообразно, когда в момент систолы сердца кровь продвигается вперед, а в момент диастолы кровь останавливается. При дальнейшем повышении гидростатического давления кровь в систолу продвигается вперед, а в момент диастолы возвращается обратно — т.е.возникает маятникообразное движение. Толчкообразное и маятникообразное движение крови определяет возникновение пульсирующей боли. Постепенно экссудация вызывает развитие стаза — обычное явление при воспалении. Как правило, стаз возникает в отдельных сосудах венозной части микроциркуляторного русла из-за резкого повышения ее проницаемости. При этом жидкая часть крови быстро переходит во внесосудистое пространство и сосуд остается заполненным массой плотноприлежащих друг к другу форменных элементов крови. Высокая вязкость такой массы делает невозможным продвижение ее по сосудам и возникает стаз. Эритроциты образуют «монетные столбики», границы между ними постепенно стираются и образуется сплошная масса в просвете сосуда — сладж (от англ. sludge — тина, грязь).
Ишемия, виды, этиология, патогенез, признаки.
Ишемия — нарушение периферического кровообращения, в основе которого лежит ограничение или полное прекращение притока артериальной крови.
Клиника:побледнение участка органа, снижение температуры, нарушение чувствительности в виде парестезии, болевой синдром, уменьшение скорости кровотока, уменьшение органа в объеме, понижение артериального давления на участке артерии, расположенном ниже препятствия, снижение тургора ткани, нарушение функции органа или ткани, дистрофические изменения.
компрессионная ишемия возникает при сдавлении приводящей артерии рубцом, опухолью и т. д.;
обтурационная ишемия возникает при частичном или полном закрытии просвета артерии тромбом или эмболом. Воспалительные и продуктивно-инфильтративные изменения стенки артерии при атеросклерозе, облитерирующем эндартериите, узловатом периартериите также приводит к ограничению местного кровотока по типу обтурационной ишемии;
ангиоспастическая ишемия возникает вследствие раздражения сосудосуживающего аппарата сосудов и их рефлекторного спазма.
Причины:эмоции (страх, боль, гнев), физические факторы (холод, травма), химические агенты, биологические раздражители (токсины) и т. д.
Ангиоспазм приводит к замедлению кровотока вплоть до его полной остановки.
Развивается чаще всего по типу сосудистых безусловных рефлексов с соответствующих интерорецепторов. Может также иметь условно-рефлекторный характер.
Раздражение сосудодвигательного центра токсинами, механическое раздражение подкорковых образований, регулирующих сосудистый тонус, наличие патологического процесса в области промежуточного мозга также часто приводят к выраженным ангиоспастическим явлениям.
В развитии ангиоспастической ишемии имеет значение не только раздражение различных отделов рефлекторной дуги, но и функциональное состояние мышечных волокон стенки сосудов, электролитного и других видов обмена в ней.
Например, ионы натрия, накапливаясь в мышечных волокнах сосуда, повышают его чувствительность к прессорным веществам — катехоламинам, вазопрессину и ангиотензину.
Характер всех видов изменений в ишемизированном участке ткани или органа определяется степенью кислородного голодания, тяжесть которого зависит от скорости развития и типа ишемии, ее продолжительности, локализации, характера коллатерального кровообращения, функционального состояния органа или ткани.
Ишемия жизненно важных органов имеет более тяжелые последствия. Мозг, сердце характеризуются высоким уровнем энергетического обмена, но, несмотря на это их коллатеральные сосуды функционально абсолютно или относительно неспособны компенсировать нарушение кровообращения. Скелетные мышцы и особенно соединительная ткань, благодаря низкому уровню энергетического обмена в них, более устойчивы в условиях ишемии.
Ишемия в условиях повышенной функциональной активности органа или ткани более опасна, чем в состоянии покоя.
Венозная гиперемия
Венозная гиперемия развивается вследствие увеличения кровенаполнения органа или участка ткани в результате затрудненного оттока крови по венам.
Причины ее развития: закупорка вен тромбом или эмболом, сдавление опухолью, рубцом, увеличенной маткой. Тонкостенные вены могут сдавливаться также в участках резкого повышения тканевого и гидростатического давления (в очаге воспаления, в почках при гидронефрозе).
В отдельных случаях предрасполагающим моментом венозной гиперемии является конституциональная слабость эластического аппарата вен, недостаточное развитие и пониженный тонус гладкомышечных элементов их стенок. Нередко такое предрасположение носит семейный характер.
Профессии, требующие ежедневного длительного (в течение многих часов) пребывания в вертикальном положении, способствуют венозной гиперемии в дистальных отделах нижних конечностей у лиц с конституционально обусловленной неполноценностью эластических и гладкомышечных элементов стенки венозных сосудов.
Вены, как и артерии, хотя и в меньшей степени, представляют собой богатые рефлексогенные зоны, что позволяет предполагать возможность нервно-рефлекторной природы венозной гиперемии. Морфологической основой вазомоторной функции вен является нервно-мышечный аппарат, включающий гладкомышечные элементы и эффекторные нервные окончания.
Венозная гиперемия развивается также при ослаблении функции правого желудочка сердца, уменьшении присасывающего действия грудной клетки (экссудативный плеврит, гемоторакс), затруднении кровотока в малом круге кровообращения (пневмосклероз, эмфизема легких, ослабление функции левого желудочка).
Клинически венозная гиперемия проявляется увеличением органа или участка ткани, цианозом, местным понижением температуры, отеком, повышением давления в венах и капиллярах застойной области, замедлением кровотока, диапедезом эритроцитов. На завершающем этапе гиперемии возможны маятникообразное движение крови и стаз.
Длительное расширение вен приводит к растяжению их стенки, что может сопровождаться гипертрофией мышечной оболочка ее и явлениями флебосклероза и варикозного расширения вен.
Продолжительный венозный застой сопровождается значительными изменениями функциональных элементов стенки вены, их атрофией и гибелью. Наряду с этим на участке венозной гиперемии происходит заместительное разрастание соединительной ткани. Классическим примером является цирроз печени при недостаточности функции сердца, вызванный венозным застоем.
Особенно тяжелые последствия возникают при одновременном венозном и лимфатическом застое.
Основным фактором, обусловливающим местные изменения при венозной гиперемии, является кислородное голодание (гипоксия) ткани.
Гипоксия при этом первоначально обусловлена ограничением притока артериальной крови, затем действием на тканевые ферментные системы продуктов нарушения обмена, следствием чего является нарушение утилизации кислорода. Кислородное голодание при венозной гиперемии обусловливает нарушение тканевого обмена, вызывает атрофические и дистрофические изменения и избыточное, разрастание соединительной ткани.
Наряду с местными изменениями при венозной гиперемии, особенно если она вызвана общими причинами и имеет генерализованный характер, возможен и ряд общих гемодинамических нарушений с весьма тяжелыми последствиями. Чаще всего они возникают при закупорке крупных венозных коллекторов — воротной, нижней полой вены. Скопление крови в указанных сосудистых резервуарах (до 90 % всей крови) сопровождается резким снижением артериального давления, нарушением питания жизненно важных органов (сердце, мозг). Вследствие недостаточности сердца или паралича дыхания возможен смертельный исход.
Ишемия. Причины, виды. Характеристика симптомов и механизмы их развития. Исходы ишемии. Факторы, влияющие на исходы ишемии.
Ишемия
Нарушение периферического кровообращения, в основе которого лежит ограничение или полное прекращение притока артериальной крови, называется ишемией (от греч. ischeim — задерживать, останавливать; haima — кровь) или местным малокровием. Ишемия характеризуется следующими признаками: побледнением ишемизированного участка органа, снижением температуры, нарушением чувствительности в виде парестезии (ощущение онемения, покалывания, «ползания мурашек»), болевым синдромом, уменьшением скорости кровотока и объема органа, понижением артериального давления на участке артерии, расположенном ниже препятствия, понижением напряжения кислорода в ишемизированном участке органа или ткани, уменьшением образования межтканевой жидкости и снижением тургора ткани, нарушением функции органа или ткани, дистрофическими изменениями.
Причиной ишемии могут быть различные факторы: сдавление артерии, обтурация ее просвета, действие на нервно-мышечный аппарат артериальной стенки. В соответствии с этим различают компрессионный, обтурационный и ангиоспастический типы ишемии.
Компрессионная ишемия возникает от сдавления приводящей артерии лигатурой, рубцом, опухолью, инородным телом и др.
Обтурационная ишемия является следствием частичного сужения или полного закрытия просвета артерии тромбом или эмболом. Продуктивно-инфильтративные и воспалительные изменения стенки артерии, возникающие при атеросклерозе, облитерирующем эндартериите, узелковом периартериите, также приводят к ограничению местного кровотока по типу обтурационной ишемии.
Ангиоспастическая ишемия возникает вследствие раздражения сосудосуживающего аппарата сосудов и их рефлекторного спазма, вызванного эмоциональным воздействием (страх, боль, гнев), физическими факторами (холод, травма, механическое раздражение), химическими агентами, биологическими раздражителями (токсины бактерий) и т. д. В условиях патологии ангиоспазм характеризуется относительной продолжительностью и значительной выраженностью, что может быть причиной резкого замедления кровотока, вплоть до полной остановки его. Чаще всего ангиоспазм развивается в артериях относительно крупного диаметра внутри органа по типу сосудистых безусловных рефлексов с соответствующих интерорецепторов. Эти рефлексы характеризуются значительной инертностью и автономностью. Примером такого типа сосудистых реакций может служить спазм венечных артерий сердца при раздражении рецепторов внутренних органов (кишок, желчных путей, мочеточников, мочевого пузыря, легких, матки), рефлекторный спазм сосудов парного органа (почки, конечности) при раздражении противоположно расположенного. Ангиоспастическая ишемия может также иметь условно-рефлекторный характер. Наконец, прямое раздражение расположенного в подкорковой области сосудодвигательного центра токсическими веществами, содержащимися в омывающей его крови, механическое раздражение подкорковых образований, регулирующих сосудистый тонус (при опухолевом процессе в головном мозге, кровоизлияниях в мозг, при повышении внутричерепного давления), наличие патологического, в частности воспалительного процесса в области промежуточного мозга также часто приводят к выраженным ангиоспастическим явлениям.
Таким образом, развитие ангиоспазма достигается прежде всего вследствие активации нейрогенных а-адренэргических, h2-гистаминэргических, серотонинэргических, дофаминэргических механизмов. Источником биогенных немедиаторной природы аминов являются надпочечники (катехоламины) и клетки диффузной нейроэндокринной системы (APUD — система захвата предшественников аминов и их декарбоксилирования), разбросанные по разным органам и тканям, обладающие способностью вырабатывать 5-гидрокситриптамин (серотонин), гистамин и дофамин. В рыхлой соединительной ткани источником гистамина, кроме того, являются тканевые базофилы, в крови — базофилы (гистамин) и тромбоциты (гистамин, серотонин). В развитии ангиоспазма определенную роль играют простагландины (ПГF и тромбоксан А2). Последний образуется в тромбоцитах, его выделение особенно резко возрастает при их адгезии и агрегации на поврежденной стенке сосудов. Наконец, ангиоспастическим действием обладают вазоактивные пептиды — вазопрессин и ангиотензин II.
Непосредственный механизм активации сократительных белков гладкомышечных клеток для такого широкого по происхождению и химической природе спектра биологически активных веществ до конца не установлен. Посредником служат специфические рецепторы гладкомышечных клеток. Применительно к катехоламинам это, в частности, α-адренорецепторы. При их возбуждении, по-видимому, прежде всего изменяются электрические свойства мембраны гладкомышечных клеток вследствие повышения проницаемости клеточной мембраны для ионов Na+, Са2+, К+, Сl-. Во время потенциала действия, вызванного норадреналином, особая роль принадлежит ионам Са2+, которые поступают через клеточную мембрану из межклеточной жидкости и, кроме того, освобождаются из саркоплазматического ретикулума. Следствием этого является активация сократительных белков гладкомышечных клеток и развитие их сокращения. Используя блокаторы медленных кальциевых каналов (антагонисты Ca2+ — верапамил, нифедипин, бефидил), можно предотвратить (в среднем на 50%) сокращение, вызванное норадреналином. Ангиотензин II — одно из самых мощных сосудосуживающих веществ — оказывает свое прямое действие на гладкомышечные клетки путем их деполяризации вследствие увеличения проводимости ионов Na+. Большую роль в возникновении ангиоспастической ишемии играет изменение чувствительности мышечных элементов стенки сосудов по отношению к норадреналину и вазоактивным пептидам. Например, ионы натрия, накапливаясь в мышечных волокнах сосуда, повышают его чувствительность к прессорным веществам — катехоламинам, вазопрессину и ангиотензину. В последнее время установлено участие эндотелия в нормальном функционировании механизма сокращения — расслабления гладких мышц сосудов. Повреждение эндотелия лишает его способности выделять фактор релаксации, вследствие чего усиливаются спастические реакции. Последние могут возникать даже на ацетилхолин и брадикинин, которые в норме вызывают расширение сосудов.
Характер обменных, функциональных и структурных изменений в ишемизированном участке ткани или органа определяется степенью кислородного голодания, тяжесть которого зависит от скорости развития и типа ишемии, ее продолжительности, локализации, характера коллатерального кровообращения, функционального состояния органа или ткани.
Ишемия, возникающая на участке полной обтурации или компрессии артерий, при прочих равных условиях вызывает более тяжелые изменения, чем при спазме. Быстро развивающаяся ишемия, как и длительная, протекает более тяжело по сравнению с медленно развивающейся или непродолжительной. Особенно большое значение в развитии ишемии имеет внезапная обтурация артерий, так как при этом может присоединиться рефлекторный спазм системы разветвлений данной артерии.
Ишемия жизненно важных органов (мозг, сердце) имеет более тяжелые последствия, чем ишемия почек, селезенки, легких, а ишемия последних — более тяжелые по сравнению с ишемией скелетной, мышечной, костной или хрящевой ткани. Указанные органы характеризуются высоким уровнем энергетического обмена, в то же время их коллатеральные сосуды функционально абсолютно или относительно не способны компенсировать нарушение кровообращения. Напротив, скелетные мышцы и особенно соединительная ткань, благодаря низкому уровню энергетического обмена в них, более устойчивы в условиях ишемии.
Наконец, большое значение в развитии ишемии имеет предшествующее функциональное состояние органа или ткани. Затруднение притока артериальной крови в условиях повышенной функциональной активности органа или ткани более опасно, чем в состоянии покоя. Особенно велика роль несоответствия функции органа и его кровоснабжения при наличии органических изменений в артериях. Это связано с тем, что органические изменения сосудистой стенки, с одной стороны, ограничивают ее способность к расширению при повышенной нагрузке, а с другой, делают ее более чувствительной к различным спазматическим влияниям. Кроме того, возможность усиления коллатерального кровообращения в склеротически измененных сосудах также весьма ограничена.
Схематически изменения в тканях при ишемии можно разделить на несколько последовательных стадий.
Снижение эффективности цикла Кребса, повышение интенсивности гликолиза и пентозного цикла, снижение интенсивности энергетического обмена в целом. Нарушение образования энергии на участке ишемии патогенетически связано с недостаточной доставкой кислорода и необходимых для окисления субстратов, снижением активности и синтеза ферментов, выходом ферментов из поврежденных клеток в связи с повышением проницаемости клеточных мембран, разобщением процессов окисления и фосфорилирования.
Истощение запасов макроэргических фосфатов сопровождается суммарным приростом содержания Ca2+ в клетке, особенно после длительных периодов ишемии.
В результате может развиться вторая фаза ишемической реакции, которая включает активацию Са2+-чувствительных протеаз и фосфолипаз, необратимые изменения структуры и целостности клеточной мембраны, потерю внутриклеточных адениновых оснований (предшественников синтеза АТФ), дальнейшее массивное поступление Са2+ из внеклеточного пространства.
В связи с указанными изменениями нарушаются специфические функции клеток (сокращение, секреция и др.), работа ионных насосов, развивается некробиоз.
Первые признаки ультраструктурных изменений обнаруживаются через несколько минут с момента возникновения ишемии и характеризуются изменениями внутренней структуры митохондрий. Наблюдается их набухание, постепенное накопление жировых капель, последующее исчезновение крист и замещение их гранулярной субстанцией. Дальнейший распад митохондрий, а также эндоплазматического ретикулума и клеточных ядер может закончиться образованием очага некроза — инфаркта. Это, как правило, происходит в паренхиматозных органах, которые отличаются повышенной чувствительностью к кислородному голоданию и особенностями ангиоархитектоники, не позволяющими достаточно быстро и эффективно устранить нарушение кровообращения вследствие развития коллатералей. Продолжительная ишемия кожи, скелетных мышц и костной ткани не вызывает столь грозных функциональных и морфологических последствий.
Попытки предупредить развитие постишемических некробиотических изменений с помощью реперфузии не дали положительных результатов, поскольку в условиях реперфузии происходит дальнейшее повышение тканевого содержания кальция и усугубление повреждения мембран и митохондрий.
Впервые это было установлено при ишемии миокарда. Такую реперфузию проводят под защитой антагонистов кальциевого входа.
3. Стадия усиленного биосинтеза основных биохимических компонентов соединительной ткани — коллагена, кислых и нейтральных гликозаминогликанов, являющихся основой для последующего склерозирования ишемизированного участка ткани или органа. Необходимым условием для его осуществления является усиление синтеза нуклеиновых кислот.
Патогенез ишемических повреждений головного мозга и сердца. Реперфузионный синдром. Патогенез.
Реперфузионный синдром — это синдром, возникающий вследствие возобновления кровотока в игпемизированном участке миокарда, т.е. в результате реперфузии.
Возобновление венечного кровообращения может быть обусловлено прекращением коронарного ангиоспазма, лизисом тромба, разрушением агрегатов клеток крови, хирургическим удалением тромба, снятием лигатуры.
Клинически реперфузионный синдром проявляется значительным увеличением интенсивности повреждения миокарда сразу же после возобновления венечного кровотока. Вследствие этого состояние больного резко ухудшается. Минимальная продолжительность ишемии, после| которой возникает выраженный реперфузионный синдром составляет 40 мин. Если продолжительность ишемии меньше 20 мин, указанныйсиндром не развивается (такая продолжительность характерна для) приступов стенокардии). При продолжительности ишемии 20-40 мин иногда могут проявлятся реперфузионные повреждения сердца.
Патогенетической основой реперфузионного синдрома является так называемый «кислородный парадокс». Сущность феномена состоит в следующем. Если сердце перфузировать раствором, который не содержит кислород (или содержит его мало), а через 40 мин и более перейти на перфузию раствором с нормальным напряжением 02, то в результате такой перфузии нарушения, обусловленные предыдущей гипоксией, не только не уменьшаются, как этого следовало бы ожидать, а становятся более выраженными (парадокс!). Основу указанного парадокса составляет резкая активация процессов пероксидного окисления липидов, обусловленная поступлением кислорода в клетки, в которых содержится большое количество восстановленных компонентов дыхательной цепи. Происходит сбрасывание электронов в обход дыхательной цепи непосредственно на молекулы кислорода, вследствие чего образуется большое количество свободных радикалов. Последние инициируют реакции пероксидного окисления липидов, являющиеся важным молекулярным механизмом повреждения клеточных мембран
Стаз. Виды. Причины. Профилактика.
Стаз (от грея, stasis — стояние) — замедление и остановка тока крови в капиллярах, мелких артериях и венах. Различают истинный (капиллярный) стаз, возникающий вследствие патологических изменений в капиллярах или нарушения реологических свойств крови, ишемический — вследствие полного прекращения притока крови из соответствующих артерий в капиллярную сеть и венозный.
Венозный и ишемический стазы являются следствием простого замедления и остановки кровотока. Эти состояния возникают по тем же причинам, что и венозная гиперемия и ишемия. Венозный стаз может быть результатом сдавления вен, закупорки их тромбом или эмболом, а ишемический — следствием спазма, сдавления или закупорки артерий. Устранение причины стаза ведет к восстановлению нормального кровотока. Напротив, прогрессирование ишемического и венозного стазов способствует развитию истинного.
При истинном стазе столб крови в капиллярах и мелких венах становится неподвижным, кровь гомогенизируется, эритроциты набухают и теряют значительную часть своего пигмента. Плазма вместе с освободившимся гемоглобином выходит за пределы сосудистой стенки. В тканях очага капиллярного стаза отмечаются признаки резкого нарушения питания, омертвение.
Причиной истинного стаза могут быть физические (холод, тепло), химические (яды, концентрированный раствор натрия хлорида и других солей, скипидар, горчичное и кротоновое масло) и биологические (токсины микроорганизмов) факторы.
Механизм развития истинного стаза объясняется внутрикапиллярной агрегацией эритроцитов, т. е. их склеиванием и образованием конгломератов, затрудняющих кровоток. При этом повышается периферическое сопротивление.
Агрегация возникает в результате изменения физических свойств плазмолеммы эритроцитов под непосредственным действием факторов, проникающих внутрь капиллярного сосуда. При электронно-микроскопическом изучении феномена агрегации эритроцитов оказалось, что их поверхность, гладкая в нормальных условиях, становится при усиленной агрегации неровной, «пушистой». При этом изменяются сорбционные свойства эритроцитов по отношению к некоторым красителям, что свидетельствует о нарушении их физико-химического состояния.
В патогенезе истинного стаза важное значение имеет замедление кровотока в капиллярных сосудах вследствие сгущения крови. Ведущую роль при этом играет повышенная проницаемость стенки капиллярных сосудов, расположенных в зоне стаза. Этому способствуют этиологические факторы, вызывающие стаз, и метаболиты, образующиеся в тканях. Особое значение в механизме стаза отводится биологически активным веществам (серотонин, брадикинин, гистамин), а также ацидотическому сдвигу тканевой реакции среды и ее коллоидному состоянию. В результате отмечается повышение проницаемости сосудистой стенки и расширение сосудов, ведущие к сгущению крови, замедлению кровотока, агрегации эритроцитов и, как следствие, — стазу.
Особенно важным является выход в ткани плазменных альбуминов, способствующих понижению отрицательного заряда эритроцитов, что может сопровождаться выпадением их из взвешенного состояния.
Воспаление. Этиология. Альтерация первичная и вторичная. Характеристика физико-химических изменений и нарушения обмена веществ в очаге воспаления.
Воспаление — типический патологический процесс, который развивается при повреждении тканей и проявляется нарушением кровообращения, изменением крови и соединительной ткани в виде альтерации, экссудации и пролиферации. В этот, преимущественно местный, процесс в той или иной мере вовлекается весь организм и прежде всего такие системы, как иммунная, эндокринная и нервная.
Возникнув на ранних этапах эволюции, этот процесс постепенно меняет свой характер, усложняется, но в нем всегда можно обнаружить два качества. С одной стороны — это повреждение с угрозой для органа и даже для всего организма, а с другой — это процесс благоприятный, помогающий организму в борьбе за выживание. Таким образом, воспаление в истории животного мира сформировалось как двуединый процесс, в котором имеются и всегда действуют элементы защитные и вредные элементы, опасные, требующие вмешательства врача.
Основные признаки воспаления. Этот патологический процесс был известен врачам всегда. Описание его признаков можно найти в древних книгах. Цельс и Гален свели все разнообразие этих признаков к пяти кардинальным: tumor, rubor, calor, dolor, functio laesa (рис. 12.1).
Хотя со времен Цельса и Галена прошли столетия, но ученые и сегодня стараются глубже понять, как и почему на месте воспаления образуется припухлость, каковы механизмы появления красноты и жара, почему возникает боль и как, в конце концов, нарушается функция воспаленного органа.
Венозная гиперемия
Венозная гиперемия развивается вследствие увеличения кровенаполнения органа или участка ткани в результате затрудненного оттока крови по венам.
Причины ее развития: закупорка вен тромбом или эмболом, сдавление опухолью, рубцом, увеличенной маткой. Тонкостенные вены могут сдавливаться также в участках резкого повышения тканевого и гидростатического давления (в очаге воспаления, в почках при гидронефрозе).
В отдельных случаях предрасполагающим моментом венозной гиперемии является конституциональная слабость эластического аппарата вен, недостаточное развитие и пониженный тонус гладкомышечных элементов их стенок. Нередко такое предрасположение носит семейный характер.
Профессии, требующие ежедневного длительного (в течение многих часов) пребывания в вертикальном положении, способствуют венозной гиперемии в дистальных отделах нижних конечностей у лиц с конституционально обусловленной неполноценностью эластических и гладкомышечных элементов стенки венозных сосудов.
Вены, как и артерии, хотя и в меньшей степени, представляют собой богатые рефлексогенные зоны, что позволяет предполагать возможность нервно-рефлекторной природы венозной гиперемии. Морфологической основой вазомоторной функции вен является нервно-мышечный аппарат, включающий гладкомышечные элементы и эффекторные нервные окончания.
Венозная гиперемия развивается также при ослаблении функции правого желудочка сердца, уменьшении присасывающего действия грудной клетки (экссудативный плеврит, гемоторакс), затруднении кровотока в малом круге кровообращения (пневмосклероз, эмфизема легких, ослабление функции левого желудочка).
Клинически венозная гиперемия проявляется увеличением органа или участка ткани, цианозом, местным понижением температуры, отеком, повышением давления в венах и капиллярах застойной области, замедлением кровотока, диапедезом эритроцитов. На завершающем этапе гиперемии возможны маятникообразное движение крови и стаз.
Длительное расширение вен приводит к растяжению их стенки, что может сопровождаться гипертрофией мышечной оболочка ее и явлениями флебосклероза и варикозного расширения вен.
Продолжительный венозный застой сопровождается значительными изменениями функциональных элементов стенки вены, их атрофией и гибелью. Наряду с этим на участке венозной гиперемии происходит заместительное разрастание соединительной ткани. Классическим примером является цирроз печени при недостаточности функции сердца, вызванный венозным застоем.
Особенно тяжелые последствия возникают при одновременном венозном и лимфатическом застое.
Основным фактором, обусловливающим местные изменения при венозной гиперемии, является кислородное голодание (гипоксия) ткани.
Гипоксия при этом первоначально обусловлена ограничением притока артериальной крови, затем действием на тканевые ферментные системы продуктов нарушения обмена, следствием чего является нарушение утилизации кислорода. Кислородное голодание при венозной гиперемии обусловливает нарушение тканевого обмена, вызывает атрофические и дистрофические изменения и избыточное, разрастание соединительной ткани.
Наряду с местными изменениями при венозной гиперемии, особенно если она вызвана общими причинами и имеет генерализованный характер, возможен и ряд общих гемодинамических нарушений с весьма тяжелыми последствиями. Чаще всего они возникают при закупорке крупных венозных коллекторов — воротной, нижней полой вены. Скопление крови в указанных сосудистых резервуарах (до 90 % всей крови) сопровождается резким снижением артериального давления, нарушением питания жизненно важных органов (сердце, мозг). Вследствие недостаточности сердца или паралича дыхания возможен смертельный исход.
ИШЕМИЯ
Нарушение периферического кровообращения, в основе которого лежит ограничение или полное прекращение притока артериальной крови, называется ишемией (от греч. ischeim — задерживать, останавливать; haima — кровь) или местным малокровием. Ишемия характеризуется следующими признаками: побледнением ишемизированного участка органа, снижением температуры, нарушением чувствительности в виде парестезии (ощущение онемения, покалывания, «ползания мурашек»), болевым синдромом, уменьшением скорости кровотока и объема органа, понижением артериального давления на участке артерии, расположенном ниже препятствия, понижением напряжения кислорода в ишемизированном участке органа или ткани, уменьшением образования межтканевой жидкости и снижением тургора ткани, нарушением функции органа или ткани, дистрофическими изменениями.
Причиной ишемии могут быть различные факторы: сдавление артерии, обтурация ее просвета, действие на нервно-мышечный аппарат артериальной стенки. В соответствии с этим различают компрессионный, обтурационный и ангиоспастический типы ишемии.
Компрессионная ишемия возникает от сдавления приводящей артерии лигатурой, рубцом, опухолью, инородным телом и др.
Обтурационная ишемия является следствием частичного сужения или полного закрытия просвета артерии тромбом или эмболом. Продуктивно-инфильтративные и воспалительные изменения стенки артерии, возникающие при атеросклерозе, облитерирующем эндартериите, узелковом периартериите, также приводят к ограничению местного кровотока по типу обтурационной ишемии.
Ангиоспастическая ишемия возникает вследствие раздражения сосудосуживающего аппарата сосудов и их рефлекторного спазма, вызванного эмоциональным воздействием (страх, боль, гнев), физическими факторами (холод, травма, механическое раздражение), химическими агентами, биологическими раздражителями (токсины бактерий) и т. д. В условиях патологии ангиоспазм характеризуется относительной продолжительностью и значительной выраженностью, что может быть причиной резкого замедления кровотока, вплоть до полной остановки его. Чаще всего ангиоспазм развивается в артериях относительно крупного диаметра внутри органа по типу сосудистых безусловных рефлексов с соответствующих интерорецепторов. Эти рефлексы характеризуются значительной инертностью и автономностью. Примером такого типа сосудистых реакций может служить спазм венечных артерий сердца при раздражении рецепторов внутренних органов (кишок, желчных путей, мочеточников, мочевого пузыря, легких, матки), рефлекторный спазм сосудов парного органа (почки, конечности) при раздражении противоположно расположенного. Ангиоспастическая ишемия может также иметь условно-рефлекторный характер. Наконец, прямое раздражение расположенного в подкорковой области сосудодвигательного центра токсическими веществами, содержащимися в омывающей его крови, механическое раздражение подкорковых образований, регулирующих сосудистый тонус (при опухолевом процессе в головном мозге, кровоизлияниях в мозг, при повышении внутричерепного давления), наличие патологического, в частности воспалительного процесса в области промежуточного мозга также часто приводят к выраженным ангиоспастическим явлениям.
Таким образом, развитие ангиоспазма достигается прежде всего вследствие активации нейрогенных а-адренэргических, H1-гистаминэргических, серотонинэргических, дофаминэргических механизмов. Источником биогенных немедиаторной природы аминов являются надпочечники (катехоламины) и клетки диффузной нейроэндокринной системы (APUD — система захвата предшественников аминов и их декарбоксилирования), разбросанные по разным органам и тканям, обладающие способностью вырабатывать 5-гидрокситриптамин (серотонин), гистамин и дофамин. В рыхлой соединительной ткани источником гистамина, кроме того, являются тканевые базофилы, в крови — базофилы (гистамин) и тромбоциты (гистамин, серотонин). В развитии ангиоспазма определенную роль играют простагландины (ПГF и тромбоксан А2). Последний образуется в тромбоцитах, его выделение особенно резко возрастает при их адгезии и агрегации на поврежденной стенке сосудов. Наконец, ангиоспастическим действием обладают вазоактивные пептиды — вазопрессин и ангиотензин II.
Непосредственный механизм активации сократительных белков гладкомышечных клеток для такого широкого по происхождению и химической природе спектра биологически активных веществ до конца не установлен. Посредником служат специфические рецепторы гладкомышечных клеток. Применительно к катехоламинам это, в частности, α-адренорецепторы. При их возбуждении, по-видимому, прежде всего изменяются электрические свойства мембраны гладкомышечных клеток вследствие повышения проницаемости клеточной мембраны для ионов Na+, Са2+, К+, Сl—. Во время потенциала действия, вызванного норадреналином, особая роль принадлежит ионам Са2+, которые поступают через клеточную мембрану из межклеточной жидкости и, кроме того, освобождаются из саркоплазматического ретикулума. Следствием этого является активация сократительных белков гладкомышечных клеток и развитие их сокращения. Используя блокаторы медленных кальциевых каналов (антагонисты Ca2+ — верапамил, нифедипин, бефидил), можно предотвратить (в среднем на 50%) сокращение, вызванное норадреналином. Ангиотензин II — одно из самых мощных сосудосуживающих веществ — оказывает свое прямое действие на гладкомышечные клетки путем их деполяризации вследствие увеличения проводимости ионов Na+. Большую роль в возникновении ангиоспастической ишемии играет изменение чувствительности мышечных элементов стенки сосудов по отношению к норадреналину и вазоактивным пептидам. Например, ионы натрия, накапливаясь в мышечных волокнах сосуда, повышают его чувствительность к прессорным веществам — катехоламинам, вазопрессину и ангиотензину. В последнее время установлено участие эндотелия в нормальном функционировании механизма сокращения — расслабления гладких мышц сосудов. Повреждение эндотелия лишает его способности выделять фактор релаксации, вследствие чего усиливаются спастические реакции. Последние могут возникать даже на ацетилхолин и брадикинин, которые в норме вызывают расширение сосудов.
Характер обменных, функциональных и структурных изменений в ишемизированном участке ткани или органа определяется степенью кислородного голодания, тяжесть которого зависит от скорости развития и типа ишемии, ее продолжительности, локализации, характера коллатерального кровообращения, функционального состояния органа или ткани.
Ишемия, возникающая на участке полной обтурации или компрессии артерий, при прочих равных условиях вызывает более тяжелые изменения, чем при спазме. Быстро развивающаяся ишемия, как и длительная, протекает более тяжело по сравнению с медленно развивающейся или непродолжительной. Особенно большое значение в развитии ишемии имеет внезапная обтурация артерий, так как при этом может присоединиться рефлекторный спазм системы разветвлений данной артерии.
Ишемия жизненно важных органов (мозг, сердце) имеет более тяжелые последствия, чем ишемия почек, селезенки, легких, а ишемия последних — более тяжелые по сравнению с ишемией скелетной, мышечной, костной или хрящевой ткани. Указанные органы характеризуются высоким уровнем энергетического обмена, в то же время их коллатеральные сосуды функционально абсолютно или относительно не способны компенсировать нарушение кровообращения. Напротив, скелетные мышцы и особенно соединительная ткань, благодаря низкому уровню энергетического обмена в них, более устойчивы в условиях ишемии.
Наконец, большое значение в развитии ишемии имеет предшествующее функциональное состояние органа или ткани. Затруднение притока артериальной крови в условиях повышенной функциональной активности органа или ткани более опасно, чем в состоянии покоя. Особенно велика роль несоответствия функции органа и его кровоснабжения при наличии органических изменений в артериях. Это связано с тем, что органические изменения сосудистой стенки, с одной стороны, ограничивают ее способность к расширению при повышенной нагрузке, а с другой, делают ее более чувствительной к различным спазматическим влияниям. Кроме того, возможность усиления коллатерального кровообращения в склеротически измененных сосудах также весьма ограничена.
Схематически изменения в тканях при ишемии можно разделить на несколько последовательных стадий.
1. Снижение эффективности цикла Кребса, повышение интенсивности гликолиза и пентозного цикла, снижение интенсивности энергетического обмена в целом. Нарушение образования энергии на участке ишемии патогенетически связано с недостаточной доставкой кислорода и необходимых для окисления субстратов, снижением активности и синтеза ферментов, выходом ферментов из поврежденных клеток в связи с повышением проницаемости клеточных мембран, разобщением процессов окисления и фосфорилирования.
2. Истощение запасов макроэргических фосфатов сопровождается суммарным приростом содержания Ca2+ в клетке, особенно после длительных периодов ишемии.
На рис. 10.3 показаны как источники и механизмы повышения цитоплазматической концентрации Са2+, так и последовательность событий, обусловленных его (Са2+) избыточным содержанием. В результате может развиться вторая фаза ишемической реакции, которая включает активацию Са2+-чувствительных протеаз и фосфолипаз, необратимые изменения структуры и целостности клеточной мембраны, потерю внутриклеточных адениновых оснований (предшественников синтеза АТФ), дальнейшее массивное поступление Са2+ из внеклеточного пространства.
В связи с указанными изменениями нарушаются специфические функции клеток (сокращение, секреция и др.), работа ионных насосов, развивается некробиоз.
Первые признаки ультраструктурных изменений обнаруживаются через несколько минут с момента возникновения ишемии и характеризуются изменениями внутренней структуры митохондрий. Наблюдается их набухание, постепенное накопление жировых капель, последующее исчезновение крист и замещение их гранулярной субстанцией. Дальнейший распад митохондрий, а также эндоплазматического ретикулума и клеточных ядер может закончиться образованием очага некроза — инфаркта. Это, как правило, происходит в паренхиматозных органах, которые отличаются повышенной чувствительностью к кислородному голоданию и особенностями ангиоархитектоники, не позволяющими достаточно быстро и эффективно устранить нарушение кровообращения вследствие развития коллатералей. Продолжительная ишемия кожи, скелетных мышц и костной ткани не вызывает столь грозных функциональных и морфологических последствий.
Попытки предупредить развитие постишемических некробиотических изменений с помощью реперфузии не дали положительных результатов, поскольку в условиях реперфузии происходит дальнейшее повышение тканевого содержания кальция и усугубление повреждения мембран и митохондрий.
Впервые это было установлено при ишемии миокарда. Такую реперфузию проводят под защитой антагонистов кальциевого входа.
3. Стадия усиленного биосинтеза основных биохимических компонентов соединительной ткани — коллагена, кислых и нейтральных гликозаминогликанов, являющихся основой для последующего склерозирования ишемизированного участка ткани или органа. Необходимым условием для его осуществления является усиление синтеза нуклеиновых кислот.
Венозная гиперемия. Патологическая физиология
Венозная гиперемия
Венозная гиперемия – это состояние повышенного кровенаполнения органа или ткани, обусловленное затрудненным оттоком крови по венам.
Венозное полнокровие может быть местным и распространенным. Местное венозное полнокровие возникает при затруднении оттока крови по крупным венозным стволам вследствие закупорки их тромбом, эмболом или при сдавлении вены извне опухолью, рубцом, отеком и т. д.
Условием, способствующим венозному застою, является длительное нефизиологическое положение той или иной части тела, неблагоприятное для местного оттока крови. При этом формируется гипостаз – гравитационная венозная гиперемия.
Причинами распространенного венозного полнокровия наиболее часто являются:
1) недостаточность функции сердца при ревматических и врожденных пороках его клапанов, миокардитах, инфаркте миокарда;
2) декомпенсация гипертрофированного сердца;
3) уменьшение присасывающего действия грудной клетки при экссудативном плеврите, гемотораксе и т. д.
По темпу развития и длительности существования данная патология может носить острый и хронический характер. Длительная венозная гиперемия возможна только при недостаточности коллатерального венозного кровообращения.
Микроциркуляторные расстройства при венозной гиперемии характеризуются:
1) расширением капилляров и венул;
2) замедлением кровотока по сосудам микроциркуляторного русла вплоть до стаза;
3) утратой деления кровотока на осевой и плазматический;
4) повышением внутрисосудистого давления;
5) маятникообразным или толчкообразным движением крови в венулах;
6) уменьшением интенсивности кровотока в области гиперемии;
7) нарушением лимфообращения;
8) увеличением артериовенозной разницы по кислороду.
К внешним признакам венозной гиперемии относятся:
1) увеличение, уплотнение органа или ткани;
2) развитие отека;
3) возникновение синюшности, т. е. цианотичной окраски.
При остром венозном полнокровии может наблюдаться выход эритроцитов из мелких сосудов в окружающие ткани. При скоплении значительного их количества в слизистых и серозных оболочках, коже формируются мелкие, точечные кровоизлияния. Вследствие усиления транссудации в тканях накапливается отечная жидкость. Количество ее может быть весьма значительным в подкожной клетчатке (анасарка), плевральных полостях (гидроторакс), брюшной полости (асцит), перикарде (гидроперикард), желудочках мозга (гидроцефалия). В условиях гипоксии в клетках паренхиматозных органов развиваются зернистая и жировая дистрофия, мукоидное набухание межуточного вещества. Эти изменения носят, как правило, обратимый характер и при устранении причины острое венозное полнокровие завершается полным восстановлением структуры и функции тканей.
При хроническом венозном полнокровии происходят развитие дистрофических процессов в тканях, атрофия паренхиматозных элементов с одновременным заместительным разрастанием клеток стромы и накоплением в ней коллагеновых волокон. Необратимое склерозирование и уплотнение органа сопровождается нарушением его функций и называется цианотической индурацией.
Поделитесь на страничкеСледующая глава >
Венозная гиперемия: особенности болезни, лечение


Кардиолог
Высшее образование:
Кардиолог
Кубанский государственный медицинский университет (КубГМУ, КубГМА, КубГМИ)
Уровень образования — Специалист
1993-1999
Дополнительное образование:
«Кардиология», «Курс по магнитно-резонансной томографии сердечно-сосудистой системы»
НИИ кардиологии им. А.Л. Мясникова
«Курс по функциональной диагностике»
НЦССХ им. А. Н. Бакулева
«Курс по клинической фармакологии»
Российская медицинская академия последипломного образования
«Экстренная кардиология»
Кантональный госпиталь Женевы, Женева (Швейцария)
«Курс по терапии»
Российского государственного медицинского института Росздрава
Контакты: [email protected]
Сопровождающаяся чрезмерным наполнением кровью, являющейся по своим характеристикам «пассивной», венозная гиперемия выражается в нарушении оттока венозной крови виду образования на ее пути механического препятствия или затруднений в кровообращении. Имея ряд характерных внешних проявлений, венозная гиперемия может быть своевременно выявлена, однако для этого требуется внимательное отношение к собственному здоровью, быстрое реагирование на любые негативные изменения в процессе кровообращения и обращение к врачу-флебологу, который на основании проведенных исследований сможет поставить правильный диагноз и назначить лечение, стабилизирующее состояние вен и кровотока в них.
Венозная гиперемия на ранних стадиях может сопровождаться незначительными неприятными ощущения и болезненностью в пораженной области, однако наиболее явным проявлением начала патологического процесса в венах является появление выраженной отечности тканей, изменение их цвета и понижение местной температуры тела. Врач при перечисленных симптомах с легкостью поставит предварительный диагноз, однако его уточнение потребует проведения ряда диагностических мероприятий, которые дадут возможность установить такое поражение вен, как венозная гиперемия.

Характерная симптоматика
Любой вид гиперемии сопровождается внешними изменениями кожных покровов, поскольку от того, насколько активно движется кровь в тканях, насколько задействованы сосуды и капилляры во многом зависит оттенок кожи. Так, признаки венозной гиперемии обычно следующие:
- возникновение на коже сиреневатого оттенка;
- понижение температуры кожи в пораженной области в связи с замедлением тока крови;
- слизистые в области поражения также меняют свой цвет на синеватый;
- ткани в районе поражения отекают, становятся болезненными при пальпации.
Венозная гиперемия характеризуется возникновением явных застойных процессов в области поражения вен, нарушения в процессах кровообращения сопровождаются значительным замедлением снижением скорость обмена веществ, что также негативно влияет на состояние области поражения.
Механизм изменения тканей и кровообращения, которым сопровождается венозная гиперемия, объясняет и изменения цвета кожи в пораженной части тела, и причины опасности для здоровья человека. Ввиду усугубления застойных процессов при прогрессировании болезни отмечается снижение скорости движения крови, которая приводит к замедлению выведения из организма шлаков. Происходит интоксикация, и при появлении вторичной инфекции в пораженной области может развиться гангрена, при отсутствии активных лечебных действий приводящая к необходимости ампутации. Такой механизм развития венозной гиперемии определяет появление измененной окраски кожных покровов, нарушение их функциональности.

Причины возникновения
Застой крови, который принято считать наиболее характерным проявлением венозной гиперемии, может возникать по ряду причин как внешнего, так и внутреннего характера. Различные заболевания кровеносной системы, изменения показателей крови способны вызвать нарушение процесса кровообращения.
К причинам данного заболевания следует отнести:
- Механические препятствия в движении крови, которые мешают нормальному передвижения всего объема крови, в результате чего отмечается появление мест с пониженной скоростью передвижения крови. Такими препятствиями могут стать беременная матка, грыжа, появившиеся после оперативного вмешательства коллоидные рубцы. Также механическим препятствием для крови может стать сгусток крови, который тромбирует просвет вены.
- Увеличение вязкости крови, что также негативно влияет на скорость и качество движения крови.
- Повышение показателя свертываемости крови.
- Появление признаков варикозного поражения вен, которому сопутствует сбой в работе клапанной системы сердца, неспособность вен удерживать кровь в вертикальном состоянии.
Венозная гиперемия причины может иметь разные, они могут варьироваться у разных людей и при наличии параллельно текущих органических поражений в разной стадии запущенности, что влияет на симптоматику рассматриваемого заболевания вен. Понижение скорости и ритма сердечных сокращений также может стать провоцирующим фактором к появлению нарушений в процессе передвижения крови по венам, поскольку при их недостаточности происходит значительное ослабление движения крови ввиду неспособности сердечной мышцы перекачать весь объем крови. При этом происходит появление признаков полнокровия — именно таким термином иногда называют переполненность вен кровью.

При резком падении скорости системного кровотока отмечается значительное ухудшение качества выведения шлаков из организма и кислородное голодание тканей, сопровождающиеся отеками. Высока вероятность быстрого усугубления патологического процесса, потому своевременное диагностирование начинающегося заболевания позволит остановить его и предупредить вероятность необратимых последствий.
Диагностика заболевания
Выявление такой патологии, как гиперемия, обусловленная нарушением состояния вен, ведет к постепенному стойкому кислородному голоданию тканей, что влечет за собой не только органические изменения в организме больного, но и становится причиной развития психических и нервных отклонений. Отсутствие необходимого лечебного воздействия приводит к быстрому усугублению патологии, становясь опасностью для здоровья больного.
Потому диагностирование болезни, которая течет в начальной стадии, считается наиболее важным условием успешно проводимого лечения. Методики диагностики венозной гиперемии могут различаться, однако существует ряд определенных диагностических мероприятий, которые позволяют скорее устранить как внешние проявления данной патологии, так и предупредить ее усугубление.
К диагностическим действиям при подозрении на венозную гиперемию следует отнести следующие:
- осмотр глазного дна, которое проводится врачом-офтальмологом. Именно осмотр глаз позволяет обнаружить начальные стадии текущего конъюктивита, который зачастую становится показателем венозного нарушения и относится к наиболее часто проявляющимся симптомам рассматриваемого заболевания;
- ультразвуковое исследование пораженной области выявляет наиболее полную картину патологии;
- допплерографическое исследование.
Для постановки предварительного диагноза может быть достаточно внешнего осмотра пораженного участка. Но при уточнении следует пройти полное обследование, которое даст информацию врачу для стадии болезни, ее локализации и даст возможность подобрать наиболее действенную схему лечебного воздействия.
Специфика лечения
Обнаружение капиллярных изменений позволяет начать максимально раннее лечение, что позволяет минимизировать вероятность развития осложнений болезни. Поскольку гиперемия, связанная с венозной недостаточностью, имеет тенденцию быстро прогрессировать с ухудшением общего состояния больного, лечение должно начинать применяться уже с момента диагностирования болезни.
Наиболее действенным способом воздействия при поставленном диагнозе может считаться устранение первопричин данного состояния. В качестве дополнительных методов положительного воздействия используется активное употребление витаминов и необходимых микроэлементов, которые положительно влияют на состояние стенок сосудов и вен, возвращая им эластичность. Это витамины группу В, которые воздействуют именно на клетки стенок сосудов и предотвращают вероятность нарушения венозного кровообращения.
Также врачом назначается комплексный прием таких медикаментозных препаратов, как лекарства, увеличивающие показатель сократительной деятельности миокарда, снижающие вязкость и свертываемость крови, а также флеботоники, которые обеспечивают повышенную атонию конечностей. Врачом-флебологом назначается курс приема перечисленных препаратов, а также проводится полный контроль течения лечения.
Для очистки внутренней поверхности вен и при образовании тромбов используется шунтирование сосудов. При значительных механических препятствиях току крови может быть назначено хирургическое вмешательство, которое устранит такие преграды для нормального кровообращения, как шипы на позвонках, рубцы и тромбы, образующиеся в сосудах и венах.
Венозный застой — Википедия
Венозный застой (венозный стаз, венозная гиперемия, пассивная гиперемия) — состояние затруднения венозного оттока при нормальном притоке крови по артериям, наиболее часто наблюдаемое в нижних конечностях в рамках хронической венозной недостаточности. Венозный застой в системе воротной вены является причиной портальной гипертензии.
Пациенты с венозным застоем более склонны к формированию венозного тромбоза и тромбоэмболий. Помимо замедления кровотока, венозный застой проявляется расширением вен и капилляров, снижением температуры тканей и формированием отёков, цианозом (синюшностью) тканей.
Причиной венозной гиперемии может являться длительное пребывание в неподвижном состоянии (например, из-за продолжительных поездок на автомобиле).[1][2] Помимо этого, к причинам венозной гиперемии относится сдавление или сужение просвета вен, сердечная недостаточность.
- ↑ Barbara G. Wells, Joseph T. DiPiro, Terry L. Schwinghammer, Gary R. Matzke, Gary C. Yee, Robert L. Talbert, L. Michael Posey. Pharmacotherapy Handbook (неопр.). — McGraw-Hill Education, 2008. — С. 163. — ISBN 9780071485012.
- ↑ Online Health Advice: What is venistasis (недоступная ссылка)
 | Это заготовка статьи по медицине. Вы можете помочь проекту, дополнив её. Это примечание по возможности следует заменить более точным. |
| Патогистология |
|
|---|---|
| Типовые патологические процессы |
|
| Лабораторная диагностика и аутопсия |
|
Венозная гиперемия, механизмы, причины, проявления, значение.(экзамен)
Венозная гиперемия (В.Г.)-увеличение кровенаполнения органа, ткани, обусловленное затруднением оттока крови по венам при нормальном ее притоке по артериям.
Признаки:
- темно-красная окраска, цианоз слизистой оболочки, кожи, ногтей, органов из-за увеличения в них венозной крови, бедной кислородом
- снижение температуры ткани вследствие падения в них интенсивности обмена веществ
- отек ткани в результате кислородного голодания
- на коже видны расширенные, переполненные кровью извитые вены, в которых давление повышено, а скорость кровотока снижена
- повышение проницаемости стенок сосудов микроциркуляторного русла и выхода в окружающую ткань плазмы крови
- увеличение объема органов и тканей из-за скопления в них венозной крови и отека.
Виды венозной гиперемии:
1. Местная — застой в венах конечностей крови при их закупорке тромбом
2. Общая — проявление сердечной недостаточности
Значение ВГ- приводит к тканевой гипоксии(кислородное голодание тканей)
В.Г. — нарушение тканевого обмена → разрастание соединительной ткани, дистрофические изменения вплоть до некроза клеток. Развитие застойного отека.
Ишемия, признаки, причины. Значение коллатерального кровообращения.(экзамен)
Ишемия (местное малокровие)
-уменьшение или полное прекращение притока артериальной крови к органу, ткани.
В основе развития ишемии — уменьшение количества крови, протекающей через орган.
Признаки:
— Ткань в зоне ишемии бледнеет вследствие уменьшения притока к ней артериальной крови
— Понижение температуры ишемизированной ткани вследствие уменьшения притока теплой артериальной крови и снижением в ней интенсивности метаболизма.
— В артериальных сосудах при ишемии понижается кровяное давление, уменьшается скорость кровотока
— снижение лимфообразования
Микроциркуляторные изменения проявляются снижением числа капилляров с эритроцитами (истинные капилляры) и появление капилляров, лишенных эритроцитов и заполненных плазмой (плазменные капилляры). В капиллярах также уменьшается скорость кровотока вплоть до его остановки.
В зоне ишемии больной чувствует онемение, покалывание, «ползанье мурашек», боль, нарушение функции.
Виды ишемии:
1. Ангиоспастическая — возникает под влияние психических (бледность лица от испуга), химических, физических факторов, раздражающих рецепторный аппарат и приводящих к рефлекторному спазму мелких артерий.
2. Обтурационная — вызывается полным закрытием просвета сосуда тромбом или эмболом, частичным закрытием просвета сосуда (при атеросклерозе).
3. Компрессионная — возникает в результате сдавления приводящей артерии (опухолью, рубцом, жгутом, отечной тканью).
Коллатеральное кровообращение (окольное, обходное)
-представлено сетью мелких сосудов, соединяющих более крупные артерии или вены.
Коллатерали слабо развиты в сердце, почках, мозге, но хорошо + в подкожной клетчатке, кишечнике, сальнике.
В остальных органах коллатерали промежуточного типа и частично компенсируют кровообращение в зоне ишемии.
В норме коллатеральные сосуды находятся в спавшемся состоянии (не функционируют), за них работают магистральные сосуды; но начинают функционировать при возникновении препятствия току крови по магистральным сосудам.
Также начинают образовываться новые капилляры, от скорости их образования зависит компенсация ишемии и ее исход.
Коллатеральное кровообращение часто не способно компенсировать ишемию, поэтому развивается некроз.
Некроз ткани, связанный с острым нарушением кровообращения, называется инфаркт.
Инфаркт развивается в органах, где коллатерали развиты слабо.
Последствия изначениеишемии. Килородное голодание тканей(гипокия) – главный патогенный фактор ишемии.Развивающиеся при этом изменения связаны с продолжительностью и тяжестью гипоксии, чувствительностью к ней органов и наличием коллатерального кровообращения в ишемизированной ткани. Наиболее чувствительны к гипоксии головной мозг, миокард, почки.
Значение ишемии — это снижение функций ишемизированных органов, которое может быть обратимым, если ишемия продолжалась недолго и в тканях обратимые дистрофические изменения. Если в ишемизированных тканях развиваются некротические изменения с утратой их функций, то это приводит к тяжелой инвалидности и смерти.