Гемоцианин — Википедия
Гемоцианин (от др.-греч. αἷμα — кровь и др.-греч. κυανoῦς — лазурный, голубой) — дыхательный пигмент из группы металлопротеинов, является медьсодержащим функциональным аналогом гемоглобина[1]. Встречается в крови моллюсков, членистоногих[2] и онихофор[3]. В пределах типа моллюсков гемоцианин широко распространён среди головоногих и некоторых брюхоногих. В пределах типа членистоногих — среди мечехвостов, ракообразных, паукообразных[4] и многоножек[5], а в 2003 году обнаружен и у представителя класса насекомых[6]. Следует отметить, что гемоцианин моллюсков и членистоногих различается по структуре и некоторым свойствам, кроме того, существуют гемоцианины, выполняющие иные функции помимо переноса кислорода тканям — не только (и не столько) дыхания, а прежде всего в процессах питания[2][7]. Так что можно говорить о гемоцианинах как о группе сходных металлопротеинов[2].
Восстановленная форма гемоцианина бесцветна. Окисленная форма окрашивается в голубой цвет, наблюдается флуоресценция[2].
Уже в конце XVIII века было замечено, что кровь моллюсков имеет голубой цвет. В частности, это отмечал знаменитый французский естествоиспытатель Жорж Кювье (1795)[8].
В 1833 году венецианский химик Бартоломео Бицио (it:Bartolomeo Bizio) обнаружил медь в составе крови морских брюхоногих моллюсков семейства иглянок[9].
В 1878 году бельгийский физиолог Леон Фредерик (фр. Léon Fredericq) выделил голубой пигмент из крови осьминога Octopus vulgaris. Было отмечено, что при прохождении крови через жабры бесцветная кровь приобретала голубой цвет. Фредерик предположил, что это вещество переносит кислород к органам и тканям. Он же предложил название этого пигмента — «гемоцианин», по аналогии с гемоглобином (от др.-греч. κυανoῦς — лазурный, голубой). Фредерик выдвинул предположение, что гемоцианин — полный структурный и функциональный аналог гемоглобина, в котором медь включена в комплекс с порфириновым кольцом, аналогично гему гемоглобина [9][8].
В первой половине XX века были открыты различия в структуре гемоглобина и гемоцианина. В частности, было установлено, что гемоцианин не имеет порфиринового кольца. Предполагаемая простетическая группа гемоцианина была названа «гемокуприн»[8]. Позднее стало известно, что медь в субъединице гемоцианина связана непосредственно с белковыми цепями, и простетическая группа как таковая отсутствует[9][8].
Во второй половине XX века изучались различные уровни структуры гемоцианина, его свойства, различия гемоцианинов у различных видов. Исследовалась и генетическая последовательность гемоцианинов, на основе чего были выдвинуты новые предположения о родстве различных групп членистоногих и моллюсков. Изучается возможность применения гемоцианина в медицине[9].
Фотография молекул гемоцианина морского блюдечка (Субъединица гемоцианина членистоногих имеет молекулярный вес около 72 килодальтон и подразделяется на 3 домена, каждый из которых характеризуются разной третичной структурой: домен I содержит 5 или 6 альфа-спиралей, домен Il — 4 альфа-спирали и активный центр, домен III — антипараллельный бета-баррель (en:beta-barrel), состоящий из 7 бета-листов[11][12]. Молекулярный вес субъединицы гемоцианина моллюсков значительно выше, чем у членистоногих, и в среднем составляет 350—400 кДа[2], однако может достигать и 550 кДа[10]. Субъединица содержит 7 или 8 функциональных элементов. Каждый функциональный элемент подразделяется на 2 домена. Домен α содержит 4 альфа-спирали и активный центр, домен β — состоящий из 7 Β-листов антипараллельный бета-баррель [13]. Таким образом, α-домен и β-домен гемоцианина моллюсков функционально соответствуют доменам II и III гемоцианина членистоногих.
Строение активного центра одинаково у гемоцианинов членистоногих и моллюсков. Он содержит два близко расположенных друг к другу катиона меди, которые обратимо связывают молекулу кислорода в комплекс. Каждый катион меди координирован тремя имидазольными группами (гистидиновыми остатками), при оксигенации молекула кислорода оказывается зажатой между этими катионами. Пептидная цепь образует петли, то приближаясь к активному центру, то удаляясь от него, самая большая петля (разделяющая гистидиновые остатки His204 и His324) состоит из 119 аминокислотных остатков[14].
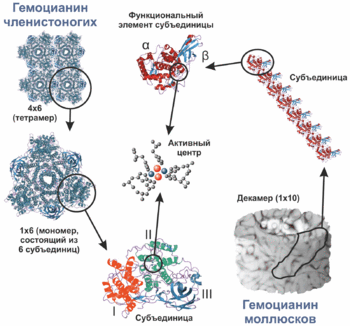 Уровни структуры гемоцианина членистоногих и моллюсков. Цифрами I, II, III и буквами α, β обозначены домены
Уровни структуры гемоцианина членистоногих и моллюсков. Цифрами I, II, III и буквами α, β обозначены доменыСубъединица гемоцианина представляет собой комплекс меди и белка. В отличие от гемоглобина, атомы металла связаны непосредственно с аминокислотой, а не с простетической группой[15].
Мономер гемоцианина членистоногих состоит из 6 субъединиц и имеет октаэдрическую форму. У членистонигих гемоцианин представлен в виде мономеров (1×6), димеров (2×6), тетрамеров (4×6), гексамеров (6×6) и октамеров (8×6) [2][4].
Субъединица гемоцианина моллюсков, как уже отмечалось, состоит из 7 или 8 активных центров, в отличие от гемоцианина членистоногих, субъединица которого имеет лишь один активный центр. Форма молекулы напоминает полый цилиндр[2]. Гемоцианин у моллюсков может быть представлен в виде декамеров (1×10) и дидекамеров (2×10), однако нередко соединяется в очень большие ансамбли[2]. Так, молекулы гемоцианина виноградной улитки могут достигать молекулярной массы свыше 9 миллионов дальтон, являясь одним из самых больших органических соединений[16]. Такие большие размеры гемоцианина позволяют лучше проявляться его кооперативным свойствам.
В 2002 году гемоцианин был обнаружен у представителя типа онихофор[3]. По строению это вещество аналогично гемоцианину членистоногих
 Строение деоксигенированного и оксигенированного активного центра гемоцианина
Строение деоксигенированного и оксигенированного активного центра гемоцианинаГемоцианин, как и гемоглобин, проявляет кооперативность, то есть при присоединении молекулы кислорода одной субъединицей увеличивает сродство к кислороду соседних субъединиц. Кооперативность гемоцианина моллюсков сравнительно невелика (коэффициент Хилла составляет около 2), кооперативность гемоцианина членистоногих значительно выше (значение коэффициента Хилла может достигать 9)[2].
В отличие от гемоглобина, входящего в состав эритроцитов, молекулы гемоцианина растворены в гемолимфе[2]. Благодаря этому мономеры гемоцианина могут объединяться в очень большие комплексы, что позволяет лучше проявляться его кооперативным свойствам и в целом лучше переносить кислород. Это особенно важно для организмов, живущих в условиях с малым содержанием кислорода. Содержание гемоцианина в гемолимфе моллюсков колеблется от 1—3 % у хитона en:Cryptochiton stelleri до 11 % у осьминога Octopus vulgaris[17]. Содержание в гемолифме ракообразных также варьирует у разных видов в довольно широких пределах, от 3 до 10 %[18]. При хронической гипоксии концентрация гемоцианина в гемолимфе значительно растёт, компенсируя нехватку кислорода в воде[18]. Анализ содержания гемоцианина в крови морских ракообразных может использоваться для наблюдения за состоянием окружающей среды[18].
На профиль связывания кислорода значительно влияет содержание ионов в гемолимфе и pH-фактор[19][20]. Установлено, что изменение температуры тела членистоногих приводит к изменению pH-фактора гемолимфы. Рост температуры на 10 градусов уменьшает pH на 0,3[19][20]. Таким образом, через изменения pH гемолимфы членистоногие адаптируют способность к переносу кислорода и кооперативные свойства гемоцианина к условиям среды
Гемоцианин может связываться не только с кислородом, но и с угарным газом, образуя карбоксигемоцианин. При этом также обнаруживается кооперативный эффект[22].
Синтез гемоцианина у брюхоногих моллюсков осуществляется поровыми клетками соединительной ткани. У головоногих моллюсков местом синтеза гемоцианина являются стенки жаберных сердец[23].
Гемопоэз членистоногих изучен более подробно. Специализированные органы кроветворения у них отсутствуют, отдельные очаги кроветворения могут находиться в соединительной ткани и в стенках кровеносных сосудов. У ракообразных синтез гемоцианина осуществляется особыми клетками крови — цианоцитами, развивающимися из цианобластов. Зрелые цианоциты выделяют гемоцианин в гемолимфу [24]. У мечехвостов очаги кроветворения представляют собой разобщённые группы гемоцитов в соединительной ткани и синусных пространствах, там же из них формируются цианоциты, аналогичные цианоцитам ракообразных[25][26].
Гемоцианин может выступать не только в качестве переносчика кислорода, но и выполнять другие функции.
Иногда гемоцианины выполняют функции тирозиназы — фермента, катализирующего окисление тирозина. В составе таких гемоцианинов отсутствуют аминокислоты, препятствующие подходу фенолов к активным центрам фермента. Следует отметить, что гемоцианины и тирозиназы имеют общее происхождение и разделились около 700 миллионов лет назад. Хелицеровые, такие как пауки и скорпионы, могут катализировать синтез меланина с помощью гемоцианина
У некоторых ракообразных обнаружено близкое к гемоцианину соединение, названное криптоцианин (англ. cryptocyanin). Криптоцианин утратил способность связывать кислород и является структурным белком, управляющим процессами линьки ракообразных[28].
В организме насекомых присутствует белок гексамерин. Предполагается, что он произошёл от гемоцианина, однако утратил атомы меди и, как следствие, способность связывать кислород[29]. Гексамерин насекомых служит в качестве резерва питательных веществ[29]. Интересно отметить, что в 2003 году гемоцианин — переносчик кислорода обнаружен и у насекомого — веснянки Perla marginata. При этом структура этого гемоцианина отличается от гемоцианина остальных членистоногих — его субъединица содержит два активных центра и, соответственно, 4 атома меди[6].
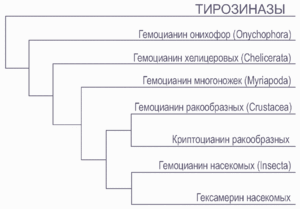
Гемоцианины как членистоногих, так и моллюсков происходят от тирозиназ[30]. Однако их эволюционный путь в этих типах животных различается. На первом этапе эволюции гемоцианина членистоногих произошла дупликация гена тирозиназы (или подобного ей фермента), благодаря чему появился белок, имеющий 2 атома меди и способный связывать кислород. Впоследствии этот белок приобрёл способность к полимеризации, что было важно для проявления кооперативных свойств[31]. Гемоцианин моллюсков прошёл через 3 дупликации гена, в результате чего субъединица гемоцианина моллюсков содержит 8 активных центров[31]. Гемоцианины членистоногих и моллюсков имеют значительные различия как по четвертичной структуре, так по своей генетической последовательности. Это позволяет предположить, что они возникли в этих группах независимо друг от друга[30].
Расхождение гемоцианинов хелицеровых и ракообразных произошло около 600 миллионов лет назад. Гемоцианин хелицеровых имеет достаточно консервативную структуру. Дивергенция гемоцианина паукообразных от остальных хелицеровых произошла 550—450 миллионов лет назад. Возраст дивергенции гемоцианинов высших раков (Malacostraca) и гексамеринов насекомых оценивается в 430—440 миллионов лет. Расхождение гемоцианинов внутри группы ракообразных началось гораздо позже, около 200 миллионов лет назад. Криптоцианины десятиногих раков (Decapoda), не выполняющие функции переносчиков кислорода, отделились от основной линии примерно 215 миллионов лет назад. Время дивергенции гемоцианинов в различных группах членистоногих может свидетельствовать в пользу теории общего происхождения шестиногих и высших раков[32][29][33]. Можно отметить тенденцию к уменьшению количества мономеров гемоцианина в субъединице в процессе эволюции[30].
Открытый в 2002 году гемоцианин онихофор отделился от общей ветви членистоногих раньше, чем началась дивергенция внутри группы членистоногих, тем не менее эти гемоцианины имеют общее происхождение[3].
Изучение эволюции гемоцианинов позволило уточнить родственные отношения различных групп членистоногих и моллюсков[29].
Изучается возможность применения гемоцианина в медицине как компонента противоопухолевых вакцин. При образовании конъюгатов с опухолевыми антигенами он существенно повышает их иммуногенность. Этот адъювант способствует преодолению иммунологической толерантности или усиливают иммунный ответ на ганглиозидные антигены (GM2, GD2, GD3). Обнаружен высокий уровень Т-клеточного иммунного ответа при использовании конъюгатов гемоцианина с муцином[34][35]. Предполагается, что они также могут применяться в технологии получения дендритных вакцин. Проводятся клинические исследования противоопухолевых вакцин с использованием этого адъюванта совместно с идиотипическими антителами при В-клеточной лимфоме и антиидиотипическими антителами при колоректальной карциноме[36][37].
- ↑ У глубоководных голотурий (Echinodermata) кровь также не красная, а голубая — в ней вместо железа содержится ванадий.
Справочник химика - ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Heinz Decker, Nadja Hellmann, Elmar Jaenicke, Bernhard Lieb, Ulrich Meissner, and Jürgen Markl. Minireview: Recent progress in hemocyanin research (англ.) // Integrative and Comparative Biology. — 2007. — Vol. 47, no. 4. — P. 631—644.
- ↑ 1 2 3 4 Kristina Kusche, Hilke Ruhberg, and Thorsten Burmester. A hemocyanin from the Onychophora and the emergence of respiratory proteins (англ.) // Proc Natl Acad Sci USA. — 2002. — Vol. 99, no. 16. — P. 10545—10548.
- ↑ 1 2 Jürgen Markl. Hemocyanins in spiders (англ.) // Journal of Comparative Physiology. — 1980. — Vol. 140, no. 3. — P. 199—207.
- ↑ Elmar Jaenicke, Heinz Decker, Wolfgang Gebauer, Jürgen Markl and Thorsten Burmester. Identification, Structure, and Properties of Hemocyanins from Diplopod Myriapoda (англ.) // The Journal of Biological Chemistry. — 1999. — Vol. 274. — P. 29071–29074.
- ↑ 1 2 Silke Hagner-Holler et al. A respiratory hemocyanin from an insect (англ.) // Proc Natl Acad Sci. — 2004. — Vol. 101, no. 3. — P. 871—874.
- ↑ Справочник химика
- ↑ 1 2 3 4 J. Leiden Webb. Magnetic properties of Hemocyanin (англ.) // California Institute of Technology : Доклад. — 1940. — P. 971—972.
- ↑ 1 2 3 4 A. Ghiretti-Magaldi and F. Ghiretti. The pre-history of hemocyanin. The discovery of copper in the blood of molluscs (англ.) // Cellular and Molecular Life Sciences. — 1992. — Vol. 48, no. 10. — P. 971—972.
- ↑ 1 2 Bernhard Lieb, Wolfgang Gebauer, Christos Gatsogiannis, Frank Depoix, Nadja Hellmann, Myroslaw G Harasewych, Ellen E Strong and Jürgen Markl. Molluscan mega-hemocyanin: an ancient oxygen carrier tuned by a ~550 kDa polypeptide (англ.) // Frontiers in Zoology. — 2010. — Vol. 7, no. 14.
- ↑ Volbeda A, Hol W. Crystal structure of hexameric hemocyanin from Panulirus interruptus refined at 3.2Å resolution (англ.) // J Mol Biol. — 1989. — Vol. 209. — P. 249—279.
- ↑ Magnus K, Hazes B, Ton-That H, Bonaventura C, Bonaventura J, Hol W. Crystallographic analysis of oxygenated and deoxygenated states of arthropod hemocyanin shows unusual differences (англ.) // Proteins. — 1994. — Vol. 19. — P. 302—309.
- ↑ Cuff M, Miller K, van Holde K, Hendrickson W. Crystal structure of a functional unit from Octopus hemocyanin (англ.) // J Mol Biol. — 1998. — Vol. 278. — P. 855—870.
- ↑ 1 2 Яценко А. В. Комплексные соединения в процессах дыхания живых существ (рус.).
- ↑ Bonaventura C. and Bonaventura J. The Mollusca Volume 2. — New York: Academic Press, 1983. — С. 26—29.
- ↑ Бриттон Г. Биохимия природных пигментов. — Москва: Мир, 1986. — С. 177. — 422 с. — 3050 экз.
- ↑ Michael E. Q. Pilson. Variation of hemocyanin concentration in the blood of four species of Haliotis (англ.) // The Biological Bulletin. — 1965. — Vol. 128. — P. 459—472.
- ↑ 1 2 3 Brouwer Marius, Denslow Nancy. Molecular Indicators of Dissolved Oxygen Stress in Crustaceans (англ.) : Доклад. — 2003.
- ↑ 1 2 Monod J, Wyman J, Changeux J. On the nature of allosteric transitions: a plausible model (англ.) // J Mol Biol. — 1965. — No. 12. — P. 88–118.
- ↑ 1 2 Robert C, Decker H, Richey B, Gill S, Wyman J. Nesting: hierarchies of allosteric interactions (англ.) // Proc Natl Acad Sci USA. — 1987. — No. 84. — P. 1891—1895.
- ↑ Sterner R, Vogl T, Hinz HJ, Penz F, Hoff R, Foll R, Decker H. Extreme thermostability of tarantula hemocyanin (англ.) // FEBS Lett. — 1995. — Vol. 364, no. 1. — P. 9-12.
- ↑ Richey B, Decker H, Gill SJ. Binding of oxygen and carbon monoxide to arthropod hemocyanin: an allosteric analysis (англ.) // Biochemistry. — 1985. — Vol. 24, no. 1. — P. 109-117.
- ↑ Житенева Л. Д., Макаров Э. В., Рудницкая О. В. Эволюция крови. — Ростов-на-Дону: Азовский научно-исследовательский институт рыбного хозяйства (АзНИИРХ), 2001. — 104 с.
- ↑ Gupta A. P. Arthropod Phylogeny. — New York: Van Nostrand Reinhold Company, 1979. — С. 717—724. — 735 с.
- ↑ Raymond F. Sis, Don H. Lewis, Tom Caceci. The Hemocytes and Hemopoietic organs of a Penaeid Shrimp (Penaeus vannamei) (англ.) : Доклад. — 1987.
- ↑ A. Ghiretti-Magaldi, C. Milanesi and G. Tognon. Hemopoiesis in crustacea decapoda: origin and evolution of hemocytes and cyanocytes of Carcinus maenas (англ.) // Cell Differentiation. — 1977. — Vol. 6, no. 3-4. — P. 167—186. (недоступная ссылка)
- ↑ Heinz Decker and Thomas Rimke. Tarantula Hemocyanin Shows Phenoloxidase Activity (англ.) // The Journal of Biological Chemistry. — 1998. — Vol. 273, no. 40. — P. 25889–25892.
- ↑ N. B. Terwilliger, M. C. Ryan and D. Towle. Evolution of novel functions: cryptocyanin helps build new exoskeleton in Cancer magister (англ.) // Journal of Experimental Biology. — 2005. — Vol. 208. — P. 2467—2474.
- ↑ 1 2 3 4 Thorsten Burmester, Klaus Scheller. Common Origin of Arthropod Tyrosinase, Arthropod Hemocyanin, Insect Hexamerin, and Dipteran Arylphorin Receptor (англ.) // Journal of Molecular Evolution. — 1996. — Vol. 42, no. 6. — P. 713—728.
- ↑ 1 2 3 Anupam Nigam, Jimmy Ng, and Trustin Ennacheril. The Molecular Evolution of Arthropod & Molluscan Hemocyanin. Evidence for Apomorphic origin and convergent evolution in oxygen binding sites (англ.). — 1997. — Vol. 41. — P. 199—228.
- ↑ 1 2 van Holde K. E., Miller K. I. Hemocyanins (англ.) // Adv Protein Chem. — 1995. — No. 47. — P. 66—68.
- ↑ Thorsten Burmester. Molecular Evolution of the Arthropod Hemocyanin Superfamily (англ.) // Molecular Biology and Evolution. — 2001. — No. 18. — P. 184—195.
- ↑ C. P. Mangum, J. L. Scott, R. E. Black, K. I. Miller, and K. E. Van Holde. Centipedal hemocyanin: its structure and its implications for arthropod phylogeny (англ.) // Proc Natl Acad Sci USA. — 1985. — Vol. 82, no. 11. — P. 3721—3725.
- ↑ Soo Kie Kim, Govindaswami Ragupathi, Musselli C. et al. Livingston comparison of the effect of different immunological adjuvants on the antibody and T-cell response ot immunization with MUC1-KLH and GD3-KLH conjugate cancer vaccines (англ.) // Vaccine. — 1999. — Vol. 18, no. 12. — P. 597—603.
- ↑ Р. Н. Степаненко, Р. Я. Власенко, Ю. Е. Цветков, Е. А. Хатунцева, Е. М. Новикова, И. К. Вернер, Н. Э. Нифантьев, Р. В. Петров. Гуморальный иммунный ответ мышей на конъюгат синтетических углеводных фрагментов опухольассоциированного антигена ганглиозной природы с белком гемоцианином — прототип противоопухолевой вакцины (рус.) // Иммунология. — 2010. — № 2. Архивировано 23 сентября 2010 года.
- ↑ Hsu FJ, Caspar CB, Czerwinski D et al. Tumor-specific idiotype vaccines in the treatment of patients with B-cell lymphoma — long-term results of a clinical trial (англ.) // Blood. — 1997. — Vol. 89. — P. 3129—3135.
- ↑ Birebent B, Koido T, Mitchell E et al. Anti-idiotypic antibody (Ab2) vaccines: coupling of Ab BR3E4 to KLH increases humoral and/or cellular immune responses in animals and colorectal cancer patients (англ.) // J Cancer Res Clin Oncol. — 2001. — Vol. 127. — P. 27—33.
- Алякринская И. О. Гемоглобины и гемоцианины беспозвоночных. — Москва: Наука, 1979. — 155 с.
- Житенева Л. Д., Макаров Э. В., Рудницкая О. В. Эволюция крови. — Ростов-на-Дону: Азовский научно-исследовательский институт рыбного хозяйства (АзНИИРХ), 2001. — 104 с.
- Стид Дж. В., Этвуд Дж. Л. Супрамолекулярная химия. — Москва: Академкнига, 2007. — 896 с. — ISBN 978-5-94628-303-8.
- Яценко А. В. Комплексные соединения в процессах дыхания живых существ (рус.).
- Heinz Decker, Nadja Hellmann, Elmar Jaenicke, Bernhard Lieb, Ulrich Meissner, and Jürgen Markl. Minireview: Recent progress in hemocyanin research (англ.) // Integrative and Comparative Biology. — 2007. — Vol. 47, no. 4. — P. 631—644.
- Van Holde K. E., Miller K. I. Hemocyanins (англ.) // Adv Protein Chem. — 1995. — No. 47. — P. 1—81.
- Bernhard Lieb, Benjamin Altenhein and Jürgen Markl. The Sequence of a Gastropod Hemocyanin (Hth2 from Haliotis tuberculata) (англ.) // The Journal of Biological Chemistry. — 2000. — Vol. 275. — P. 5675—5681.
- C. P. Mangum, J. L. Scott, R. E. Black, K. I. Miller, and K. E. Van Holde. Centipedal hemocyanin: its structure and its implications for arthropod phylogeny (англ.) // Proc Natl Acad Sci USA. — 1985. — Vol. 82, no. 11. — P. 3721—3725.
Биохимия крови
Тест 1. Объем крови у взрослого человека обычно равен:
а) 1-2 л
б) 3-4 л
в) 5-6 л
г) 8-9 л
Тест 2. Объем плазмы крови у взрослого человека обычно равен:
а) 10-15 %
б) 50-55 %
в) 70-75%
г) 80-85 %
Тест 3. Альбуминно-глобулиновый коэффициент крови в покое у взрослого человека равен:
а) 0,5-1
б) 1,5-2
в) 3-4
г) 6-7
Тест 4. В покое концентрация белков в плазме крови у здорового человека:
а) 1-2 %
б) 6-8 %
в) 15-20 %
г) 20-30 %
Тест 5. У здорового человека в состоянии покоя и натощак концентрация глюкозы в крови:
а) 40-50 мг%
б) 70-110 мг%
в) 150-170 мг%
г) 200-220 мг%
Тест 6. Гипергликемии соответствует концентрация глюкозы в крови:
а) 1-1,5 ммоль/л
б) 2-3 ммоль/л
в) 4-6 ммоль/л
г) 7-8 ммоль/л
Тест 7. В плазме крови всегда содержится конечный продукт белкового обмена:
а) ацетоуксусная кислота
б) мочевая кислота
в) мочевина
г) цитозин
Тест 8. В плазме крови всегда содержатся промежуточные продукты жирового обмена:
а) a-аминокислоты
б) тиокислоты
в) кетоновые тела
г) нуклеозиды
Тест 9. В покое величина рН капиллярной крови равна:
а) 7,0
б) 7,4
в) 7,8
г) 8,0
Тест 10. Гипогликемии соответствует концентрация глюкозы в крови:
а) 2-3 ммоль/л
б) 4-5 ммоль/л
в) 7-8 ммоль/л
г) 9-10 ммоль/л
Тест 11. Повышение концентрации глюкозы в крови имеет название:
а) гематурия
б) гипогликемия
в) гипергликемия
г) глюкозурия
Тест 12. Перенос кровью кислорода и углекислого газа осуществляется с участием белка:
а) альбумина
б) гемоглобина
в) протромбина
г) фибриногена
Тест 13. В свертывании крови участвует белок:
а) альбумин
б) гемоглобин
в) миоглобин
г) фибриноген
Тест 14. Накопление в крови молочной кислоты приводит:
а) к алкалозу
б) к ацидозу
в) к гипергликемии
г) к гиперпротеинемии
Тест 15. Главной буферной системой крови является:
а) ацетатная
б) бикарбонатная
в) гемоглобиновая
г) фосфатная
Тест 16. В покое в крови у здорового человека содержание эритроцитов:
а) 200-300 тыс./мм3
в) 800-900 тыс./мм3
б) 4-5 млн./мм3
г) 8-9 млн./мм3
Тест 17. В состав белка крови гемоглобина входит металл:
а) железо
б) калий
в) магний
г) хром
Тест 18. Белок крови гемоглобин участвует в транспорте:
а) аммиака
б) жирных кислот
в) кислорода
г) нуклеотидов
Тест 19. В свертывании крови участвуют клетки:
а) лимфоциты
б) моноциты
в) тромбоциты
г) эритроциты
Тест 20. Фактором свертывания крови являются ионы:
а) калия
б) кальция
в) магния
г) хлора
Тест 21. В ответ на поступления антигена в организме синтезируются белки:
а) альбумины
б) γ-глобулины
в) нуклеопротеиды
г) хромопротеиды
Тест 22. В свертывании крови участвует белок:
а) альбумин
б) гемоглобин
в) миоглобин
г) протромбин
Соотношение элементов крови
15.09.2016Общее количество крови в организме взрослого человека в норме составляет 6-8% массы тела и равно примерно 4,5-6 л. В покое в сосудистой системе находится 60-70% крови (циркулирующая кровь). Другая часть крови (30-40%) содержится в специальных кровяных депо (депонированная, или резервная).
Кровь состоит из жидкой части — плазмы и взвешенных в ней клеток — форменных элементов: эритроцитов, лейкоцитов и тромбоцитов. На долю форменных элементов в циркулирующей крови приходится 40-45%, на долю плазмы — 55-60%. В депонированной крови наоборот: форменных элементов — 55-60%, плазмы — 40-45%. Объемное соотношение форменных элементов и плазмы (или часть объема крови, приходящаяся на долю эритроцитов) называется гематокритом (греч. haema, haematos — кровь, kritos — отдельный, отделенный). Относительная плотность (удельный вес) цельной крови равна 1,050-1,060, эритроцитов — 1,090, плазмы — 1,025-1,034. Вязкость цельной крови по отношению к воде составляет около 5, а вязкость плазмы — 1,7-2,2. Вязкость крови обусловлена наличием белков и особенно эритроцитов.
Плазма содержит 90-92% воды и 8-10% сухого остатка — беяков (7-8%) и минеральных солей (1%). Белки плазмы (их более 30) включают 3 группы:
-
альбумины (около 4,5%) обеспечивают онкотическое давление,связывают лекарственные вещества, витамины, гормоны, пигменты;
-
глобулины (2-3%) обеспечивают транспорт жиров, липоидов в составе липопротеинов, глюкозы — в составе гликопротеинов, меди, железа — в составе трансферрина, выработку антител, а также а- и р-агглютининов крови;
-
фибриноген (0,2-0,4%) участвует в свертывании крови.
Небелковые азотсодержащие соединения плазмы включают: аминокислоты, полипептиды, мочевину, креатинин, продукты распада нуклеиновых кислот. Половина общего количества небелкового азота в плазме (остаточного азота) приходится на долю мочевины. В норме остаточного азота в плазме содержится 10,6-14,1 ммоль/л , а мочевины — 2,5-3,3 ммоль/л. В плазме находятся также безазотистые органические вещества: глюкоза 4,44-6,67 ммоль/л, нейтральные жиры, липоиды. Минеральные вещества плазмы составляют около 1% (катионы Na+, К+, Са2+, анионы С1-, НСО3-, НРО4-). В плазме содержится также более 50 различных гормонов и ферментов.
-
Эритроцит (греч. erythros — красный, cytus — клетка) — безъядерный форменный элемент крови, содержащий гемоглобин. Имеет форму двояковогнутого диска диаметром 7-8 мкм, толщиной 1-2,5 мкм. Эритроциты содержат 60-65% воды и 35-40% составляет сухой остаток.
-
Лейкоцит (греч. leukos — белый, cytus — клетка), или белое кровяное тельце, — это бесцветная ядерная клетка, не содержащая гемоглобина. Размер лейкоцитов — 8-20 мкм.
-
Тромбоцит (греч. thrombos — сгусток крови, cytus — клетка), или кровяная пластинка, — участвующий в свертывании крови форменный элемент, необходимый для поддержания целостности сосудистой стенки.Представляет собой округлое или овальное безъядерное образование диаметром 2-5 мкм.
Слева направо: эритроцит, тромбоцит и лейкоцит (сканирующая электронная микроскопия)
Центрифугирование. С помощью центрифуги можно разделить жидкие смеси с компонентами разной удельной плотности, так как при очень быстром вращении смеси расслаиваются и частицы разных компонентов в центробежном поле осаждаются с разной скоростью, которая зависит от их размера и плотности. Например, при центрифугировании крови в пробирке образуются несколько слоев: верхний желтый слой — плазма, нижний темный слой — клетки крови (эритроциты, лейкоциты и тромбоциты). При этом у границы жидкости можно заметить тонкий сероватый слой тромбоцитов.
1. Белки крови, их количественное содержание и выполняемая функция. Причины изменения содержания белков в плазме крови. Причины появления белков в моче.
Биохимия крови и мочи
Содержание
Белок общий в плазме — 65 — 85гр/л
Подразделяются на:
альбумины 40-50гр/л
глобулины 20-30гр/л
Фибриноген 2-4гр/л
При электрофорезе на бумаге удается получить несколько белковых фракций из плазмы крови
альбумины 54-58%
1глобулины — 6-7%, 2глобулины 8-9%, глобулины 13-14%, глобулины 11-12%
Функции белков.
транспортная. Соединяясь с рядом веществ (холистерин, билирубин и др.), а так же с рядом лекарственных веществ (пинициллин) они (белки) переносят их в ткани
поддержание рН
резерв аминокислот
защитная. Принимают активное участие в свертывании крови. Фибриноген — основной компонент системы свертывания крови. Важная роль в процессах иммунитета.
поддержание уровня катионов
поддержание осмотического давления (0,02 атм плазмы крови). Являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла
Характеристика некоторых белков
Сывороточный альбумин.
Состоит из 1-й полипептидной цепи содержащий около 585 аминокислот, имеет 17 дисульфидных мостиков. Выделяют 3 домена. Структуры доменов сходны. Молекула представляет собой эллипсоид размером 3 на 15 нм. Это типичный простой белок. Концентрация в плазме чуть выше 50 гр/л.
Основная функция — участие в осмотической регуляции. В кровяном русле находится только 40% альбуминов, остальная часть входит в состав внеклеточной тканевой жидкости. Около 5% альбумина за 1 час покидает русло крови и возвращается с лимфой через грудной лимфатический проток.
Транспортная. Заключается в переносе свободных жирных кислот, перенос бирирубина, перенос перидоксаля, глютатиона, Са, Zn. Кроме того альбумины переносят часть стероидов, участвуют они в транспорте многих лекарственных веществ, (например сульфаниламидных препоратов, пиницилина, аспирина и др.)
Резерв белков в организме
Период полураспада примерно 7 суток.
Синтезируются в печени 13-18 гр/сут.
Фракция альбуминов при электрофорезе делится на 2
Альбумины А
Альбумины Б
Возможна анальбуминемия — отсутствие альбуминов в плазме крови. При этой патологии нарушается транспорт липидов, повышается уровень холистерола, ЛП и фосфоглицеридов.
Если концентрация альбуминов снижается ниже 30гр/л, то обычно развивается отеки.
Причина изменения содержания.
Повышение показателя имеет место при дегидратации, шоке, гемоконцентрации, внутривенном введении больших количеств концентрированных «растворов» альбумина.
Снижение показателя имеет место при недоедании, симндроме малабсорбции, острой и хронической печеночной недостаточности, опухолях, лейкозах.
1глобулин и 2глобулины.
Ингибиторы протеиназ. 1антитрипсин, 2макроглобулин, интер--трипсиновый ингибитор. Они выполняют роль ингибиторов ферментов свертывания крови, разрушают протеиназы, поступающие в кровь при повреждении клеток. Ткань легких очень чувствительна к протеиназам.
У взрослых людей с недостаточностью 1антитрипсином обычно развивается эмфизема легких.
Церулоплазмин.
Относится к фракции 2глобулинов. Медьсодержащий гликопротеин плазмы, обладающий оксидазной активностью. При недостатке возникает болезнь Коновалова-Вильсона. Характеризуется накоплением меди в печени и головном мозге, в результате развивается поражение печени и достаточно выраженные неврологические симптомы. Гаптоглобины.
Составляют 25% всех 2глобулинов. Это белки связывающие гемоглобин, которые появляются в крови в результате сосудистого гемолиза. Такое связывание предотвращает потерю из организма железа с одной стороны, а с другой защищает почки от повреждения гемоглобином. Далее этот комплекс (гаптоглобин связавший гемоглобин) поглощается клетками ретикулоэндотелиальной системы. Низкий уровень этих белков наблюдается у больных с гемолитической анемией.
Для ряда белков -глобулиновой фракции функции неизвестны. Это такие как:
Глобулины.
Так же состоят из различных белков.
Трансферин.
Обеспечивает связывание и перенос железа. Он связывает 2 атома железа на молекулу и предотвращает потерю железа из организма. Трансферин, насыщен железом примерно на 1/3 в норме. Его концентрация повышается при недостатке железа.
Гемопексин.
Связывает свободный гем, предотвращая выделения с мочой и потеря железа. Комплекс гем-гемопексин улавливается печенью, где железо высвобождается для последующего использования. (Синтезируется в печени. Каждая молекула гемопексина связывает одну молекулу гема.)
С-реактивный белок.
Острофазный белок. Его определение используется в качестве показателя остроты патологических процессов наиболее часто при ревматизме.
Значительная часть белков фракций и глобулинов являются гликопротеидами и липопротеидами.
Синтез и распад гликопротеинов.
Гликопротеины синтезируются в большинстве своем в печени. Их гетероолигосахаридный компонент содержит галактозу, моннозу, фукозу, рамнозу, аминосахара, сиаловые кислоты. У гликопротеинов концевым свободным углеводным остатком чаще всего является сиаловая кислота. Потеря данным белком сиаловой кислоты приводит к поглощению его гепатоцитами и последующим разрушению. Оказывается в мембранах гепатоцитах имеются рецепторы, которые связывают D-сиало-гликопротеины (гликопротеины лишившиеся сиаловой кислоты). Например концентрация D-виало-гликопротеинов у больных циррозом печени увеличивается в 3-4 раза.
-Глобулины.
Это белки плазмы, входящие в группу иммуноглобулинов. Они относятся к белкам, выполняющим защитную функцию. Иммуноглобулины вырабатываются в ответ на попадание во внутреннюю среду организма чужеродных веществ — антигены. Антитела способны связывать антигены и тем самым устранять чужеродные вещества. Иммуноглобулины высоко специфичны.
Все иммуноглобулины — белки с четвертичной структурой. Все иммуноглобулины содержат тяжелые Н-цепи и легкие L-цепи. По 2.
Эти цепи соединены между собой дисульфидными мостиками. Некоторые из иммуноглобулинов являются олигомерами, т.е. состоят из нескольких 4-х цепочечных структур.
В зависимости от состава Н и L цепей иммуноглобулины делятся на классы:
IgG
IgA основные
IgM IgDIgE минорные
Изучение структуры антител показало, что у всех легких и тяжелых цепей можно выделить вариабельные (В) и постоянные (С).
Вариабельные участи расположены на n-концах L и H цепей в области В участка, расположены антигенсвязывающие центры, последние специфичны для каждого индивидуального антитела и позволяет узнавать за счет комплементарности свой антиген. Именно В участки обеспечивают специфичность.
С-участки отвечают за другие функции (например работают при связывании комплемента — еще одна защитная система, обеспечивающая перенос антител через плацентарный барьер).
Углеводные гетероолигосахаридные группировки С-участков определяют скорость разрушения антител.
Причина изменения содержания.
Повышение показателя имеет место при болезнях печени, инфекционнонм гепатите, билиарном циррозе, гемохроматозе, системной красной волчанке, плазмоклеточной миеломе, лимфопро лиферативных заболеваниях, саркоидозе, острых и хронических инфекциях, особенно при лимфогранулеме, обусловленной венерическим заболеванием, тифе, лейшманиозе, шистоматозе, малярии
Снижение показателя имеет место при недостаточном питании, врожденной агаммаглобулине мии, лимфолейкозе.
Фибриноген плазмы.
Норма 2-6 г/л СИ (0,2-0,6 г% )
Повышение показателя имеет место при гломеру лонефрите, нефрозе (иногда), инфекциях
Снижение показателя имеет место при диссеми-нированном внутрисосудистом свертывании крови (случаи беременности с отслойкой плаценты, эмболии околоплодными водами, стремительные роды), при менингококковом менингите, раке простаты с метастазами, лейкозах, при острой и хронической печеночной недостаточности, врож денной фибрино генопении
Изменение белков при патологии.
Гиперпротеинемии. Увеличенное содержание белков плазмы крови. Возникают при больших потерях воды вследствие ожогов, диарея у детей, рвота при непроходимости верхних отделов кишечника. Резкое увеличение -глобулинов при миеломной болезни (интенсивно образуются миеломные белки). Содержание белка может достигать 150-160 гр/л, т.е. увеличиваться в 2 раза по сравнению с нормой.
Гипопротеинемия. Снижения содержания общего белка в плазме крови. Развивается за счет снижения содержания альбуминов. Общий белок может снижаться до 3-4- гр/л. Причины. Голодание, тяжелое поражение печени, нефрозы, увеличение проницаемости стенок капилляров.
Диспротеинемии. Нарушение % соотношения отдельных фракций. Часто оно характерно для тех или иных заболеваний.
“Белки острой фазы”.
Организм наш на тканевые повреждения, инфекцию и др. воздействия отвечает комплексом направленных реакций, обозначаемых как “острофазный ответ”.
Внешнее проявление этого ответа: лихорадка, лейкоцитоз, ускоренная СОЭ. В организме происходят более глубокие изменения, в том числе и изменение экспрессии генов в клетках разных тканей, которое проявляется через изменение содержания белков в празме крови. В плазме при разных воздействиях нарастает концентрация так называемых — острофазных белков: С-реактивный белок его активность может увеличиваться в 1000-2000 раз, сывороточный амилоид — в 100 раз, 2макроглобулин — в 300 раз, кислый 1-гилкопротеин в 15 раз, острофазный 1глобулин — в 10-16 раз, 1антитрипсин, церулоплазмин, фибриноген — в 2-3 раза.
Многие члены этого семейства играют важную роль в защите организма от чужеродных инвазий, от патогенных агентов и тканевых повреждений, действие одних белков ограничивается областью тканевых повреждений, другие участвуют в очистке организма от чужеродных агентов, третьи инициируют тканевую рапорацию. Отличительной особенностью является то, что многие из острофазных белков являются ингибиторами протеиназ, т.е. эти белки нейтрализуют протеиназы, поступающие во внеклеточную среду или кровь при гибели клеток в результате воздействия повреждения или инфекций.
Ингибиторами протеиназ являются:
Острофазный 1глобулин (цистиинпротеиназный ингибитор).
1антитрипсин — ингибитор сериновых протеиназ
2макроглобулин — ингибитор широкого спектра действия.
Некоторые из белков являются модуляторами воспалительных и иммунных ответов (С-реактивный белок, кислый 1гликопротеин, сывороточный амилоидный протеин).
Синтез и выделение острофазных белков контролируется целой системой тканевых гормонов типа интерлейкинов, так же интерфероном, глюкокортикоидами и др. факторами, регулирующими экспрессию генов острофазных белков. Таким образом острофазные белки наделены многими гомеостатическими функциями и являются одним из главных факторов неспецифической системы защиты организма.
Причины появления в моче.
Белок. В нормальной моче имеется незначительное количество белка, которое не обнаруживается качественными пробами, поэтому считается, что белка в моче нет.При ряде заболеваний в моче появляется белок — протеинурия.
1. Внепочечные протеинурии наблюдаются при циститах, пиелитах, простатитах, уретритах и т. д. Количество белка, как правило, не превышает 1%.
Почечные протеинурии при функциональных, нарушениях — неорганического поражения паренхимы, повышена проницаемость почечного фильтра. Это может быть при охлаждении, физическом и психическом напряжении.
Ортастатическая протеинурия развивается чаще у детей дошкольного и школьного возраста.
Органические протеинурии — поражена паренхима и увеличена проницаемость клубочковых капилляров, наблюдается при острых и хронических гломерулонефритах, нефрозах, инфекционных и токсических состояниях, застойных явлениях в почках.
Качественный состав белков мочи (электрофорез) не показал специфических изменений при различных видах протеинурии, за исключением протеинурии при парапротеинемиях, в особенности при миеломной болезни, болезни Вальденстрема.
