Оптимальная кислотность для роста и развития кишечных бактерий (пробиотиков)
ОПТИМАЛЬНАЯ КИСЛОТНОСТЬ ДЛЯ РОСТА И РАЗВИТИЯ ПОЛЕЗНОЙ МИКРОФЛОРЫ и УГНЕТЕНИЯ УСЛОВНО-ПАТОГЕННОЙ
Кислотность (лат. aciditas) — характеристика активности ионов водорода в растворах и жидкостях.
Водородный показатель pH
В растворах неорганические вещества: соли, кислоты и щелочи разделяются на составляющие их ионы. При этом ионы водорода H+ являются носителями кислотных свойств, а ионы OH− – носителями щелочных свойств. В сильно разбавленных растворах кислотные и щелочные свойства зависят от концентраций ионов H+ и OH−. В обычных растворах кислотные и щелочные свойства зависят от активностей ионов аН
рН = — lg (аН).
Т.е. водородный показатель pH показывает концентрацию свободных ионов водорода в воде. Водородный показатель pH — это отрицательный десятичный логарифм концентрации ионов водорода в воде. Исходя из того, что в нейтральной среде а Н = аOН и из выполнения равенства для чистой воды при 22 °С: аН × аOН = Кw = 10−14 , получаем, что кислотность чистой воды при 22 °С (то есть нейтральная кислотность) = 7 ед. pH.
Растворы и жидкости в отношении их кислотности считаются:
• нейтральными при рН = 7
• кислыми при pH < 7
• щелочными при рН > 7
Большинство микроорганизмов развивается при нейтральной или слабощелочной реакции среды. Есть среди бактерий кислотоустойчивые, например, молочнокислые, и некоторые уксуснокислые бактерии.
При подкислении среды до рН 4 развитие большинства бактерий практически прекращается. К колебаниям рН в пределах от 6 до 9 бактерии сравнительно малочувствительны.
Пропионовокислые бактерии растут в пределах температуры — (15-40)
Оптимальная температура развития классических пропионовокислых бактерий — (30±1) 0С. (для бифидобактерий 37°С)
Оптимальная величина рН роста пропионовокислых бактерий — 6,5-7,0, максимальная — 8,0, минимальная — 4,5.
Например, исследованные штаммы пропионовокислых бактерий Propionibacterium freudenreichii subsp freudereichii АС-2500, P. cyclohexanicum Kusano АС-2259, P. freudenreichii subsp. shemanii AC–2503, P. cyclohexa-nicum Kusano АС-2260, P. freudenreichii subsp. shermanii – КМ 186. проявили устойчивость к высокой концентрации желчи (40%), NaCl (6%) и развивались в среде с низким рН (4,5), что указывает на высокую выживаемость данных культур в неблагоприятных условиях ЖКТ человека.
Кислотность… Некоторые заблуждения
Если кто-то из пациентов говорит, что у него «нулевая кислотность», то это не более, чем оборот речи, означающий, скорее всего, что у него нейтральное значение кислотности (рН=7). В организме человека величина кислотности не может быть меньше 0,86 рН. Также распространено заблуждение, что величины кислотности могут быть только в диапазоне от 0 до 14 pH. В технике возможна кислотность и отрицательная, и больше 20.
Когда говорят о кислотности кого-либо органа, важно при этом понимать, что часто в различных частях органа кислотность может значительно отличаться. Кислотность содержимого в просвете органа и кислотность на поверхности слизистой оболочки органа также часто бывает не одинаковой. Для слизистой оболочки тела желудка характерно, что кислотность на поверхности слизи, обращенной в просвет желудка кислотность 1,2–1,5 рН, а на стороне слизи, обращённой к эпителию — нейтральная (7,0 рН).
Кислотность в желудке. Повышенная и пониженная кислотность
Максимальная теоретически возможная кислотность в желудке 0,86 рН, что соответствует кислотопродукции 160 ммоль/л. Минимальная теоретически возможная кислотность в желудке 8,3 рН, что соответствует кислотности насыщенного раствора ионов HCO3-. Нормальная кислотность в просвете тела желудка натощак 1,5–2,0 рН. Кислотность на поверхности эпителиального слоя, обращённого в просвет желудка 1,5–2,0 рН. Кислотность в глубине эпителиального слоя желудка около 7,0 рН. Нормальная кислотность в антруме желудка 1,3–7,4 рН.
Кислотность в кишечнике
Нормальная кислотность в луковице двенадцатиперстной кишки 5,6–7,9 рН. Кислотность в тощей и подвздошной кишках нейтральная или слабощелочная и находится в пределах от 7 до 8 рН. Кислотность сока тонкой кишки 7,2–7,5 рН. При усилении секреции достигает 8,6 рН. Кислотность секрета дуоденальных желез — от рН от 7 до 8 рН.
Кислотность сока толстой кишки 8,5–9,0 рН.
Кислотность кала
Кислотность кала здорового человека, питающегося смешанной пищей обусловлена жизнедеятельность микрофлоры толстой кишки и равна 6,8–7,6 рН. Нормальной считается кислотность кала в диапазоне от 6,0 до 8,0 рН. Кислотность мекония (первородного кала новорожденных) — около 6 рН. Отклонения от нормы при кислотности кала:
- резко-кислая (рН менее 5,5) бывает при бродильной диспепсии
- кислая (рН от 5,5 до 6,7) может быть из-за нарушения всасывания в тонкой кишке жирных кислот
- щелочная (рН от 8,0 до 8,5) может быть из-за гниения белков пищи, не переваренных в желудке и тонкой кишке и воспалительного экссудата в результате активации гнилостной микрофлоры и образования аммиака и других щёлочных компонентов в толстой кишке
- резкощелочная (рН более 8,5) бывает при гнилостной диспепсии (колите)
Таблица 1. Величины кислотности некоторых распространенных продуктов и чистой воды при разной температуре
Продукт | Кислотность, ед. рН |
Лимонный сок | 2,1 |
Вино | 3,5 |
Томатный сок | 4,1 |
Апельсиновый сок | 4,2 |
Черный кофе | 5,0 |
Чистая вода при 100 °С | 6,13 |
Чистая вода при 50 °С | 6,63 |
Свежее молоко | 6,68 |
Чистая вода при 22 °С | 7,0 |
Чистая вода при 0° С | 7,48 |
(Прим. к табл. — Лимон – кислый продукт, но, не смотря на это, он снижает кислотность в желудке.)
Водородный показатель pH (кислотно-щелочной показатель среды пищевых продуктов)
Таблица 2 Водородный показатель среды некоторых пищевых продуктов | ||
Наименование продукта | Уровень кислотности PH (визуальная шкала) | Значение pH |
Абрикосовый нектар | 3.8 | |
Абрикосы | 3.3 — 4.8 | |
Авокадо | 6.3 — 6.6 | |
Алое Вера | 6.1 | |
Апельсины | 3.0 — 4.0 | |
Арахисовое масло | 6.3 | |
Арбуз | 5.2 — 5.6 | |
Артишоки | 5.5 — 6.0 | |
Бананы | 4.5 — 5.2 | |
Батат (сладкий картофель) | 5.3 — 5.6 | |
Батат вареный | 5.5 — 6.8 | |
Белый хлеб | 5.0 — 6.2 | |
Бобы | 5.6 — 6.5 | |
Брокколи | 5.3 | |
Вино | 2.8 — 3.8 | |
Виноград | 3.5 — 4.5 | |
Вишня | 3.2 — 4.5 | |
Газированные напитки | 2.0 — 4.0 | |
Горох | 5.8 — 6.4 | |
Горчица | 3.5 — 6.0 | |
Грейпфрут | 3.0 — 3.7 | |
Груши | 3.6 — 4.0 | |
Дыня | 6.0 — 6.7 | |
Ежевика | 3.9 — 4.5 | |
Изюм | 2.8 — 3.0 | |
Кактус | 4.7 | |
Кальмары | 5.8 | |
Каперсы | 6.0 | |
Капуста | 5.2 — 5.4 | |
Каракатица | 6.3 | |
Карп | 6.0 | |
Картофель | 5.6 — 6.0 | |
Кетчуп | 3.9 | |
Кислая капуста | 3.4 — 3.6 | |
Кленовый сироп | 4.6 — 5.5 | |
Клубника, земляника | 3.0 — 3.9 | |
Клубничный (земляничный) джем | 3.0 — 3.4 | |
Клюквенный сок | 2.3 — 2.5 | |
Кокос | 5.5 — 7.8 | |
Кокосовое молоко | 6.1 — 7.0 | |
Крабовое мясо | 6.5 — 7.0 | |
Красный перец | 4.6 — 5.2 | |
Креветки | 6.8 — 7.0 | |
Крекеры | 6.5 — 8.5 | |
Крыжовник | 2.8 — 3.1 | |
Кукуруза | 5.9 — 7.3 | |
Курага( сушеные абрикосы) | 3.4 — 3.8 | |
Лайм | 1.8 — 2.0 | |
Лаймовый сок | 2.0 — 2.4 | |
Лимоны | 2.2 — 2.4 | |
Лимонный сок | 2.0 — 2.6 | |
Лосось | 6.1 — 6.3 | |
Лук-порей | 5.5 — 6.2 | |
Малина | 3.2 — 3.6 | |
Мамалыга | 6.8 — 8.0 | |
Манго | 5.8 — 6.0 | |
Маслины | 6.0 — 7.0 | |
Масло | 6.1 — 6.4 | |
Меласса (черная патока) | 4.9 — 5.4 | |
Молоко | 6.4 — 6.8 | |
Морковь | 5.9 — 6.3 | |
Морское ушко | 6.1 — 6.5 | |
Мука пшеничная | 5.5 — 6.5 | |
Мякоть томата | 4.3 — 4.5 | |
Нектарины | 3.9 — 4.2 | |
Овощной сок | 3.9 — 4.3 | |
Окунь, морской, жаренный | 6.6 — 6.8 | |
Оливки | 3.6 | |
Пахта | 4.4 — 4.8 | |
Персики | 3.4 — 4.1 | |
Печень трески | 6.2 | |
Пиво | 4.0 — 5.0 | |
Питьевая вода | 6.5 — 8.0 | |
Помидоры | 4.3 — 4.9 | |
Ревень | 3.1 — 3.2 | |
Сардины | 5.7 — 6.6 | |
Свежие яйца | 7.6 — 8.0 | |
Свекла | 4.9 — 6.6 | |
Сельдерей | 5.7 — 6.0 | |
Сельдь | 6.1 | |
Сидр | 2.9 — 3.3 | |
Соевое молоко | 7.0 | |
Соевый соус | 4.4 — 5.4 | |
Соус Карри | 6.0 | |
Соус Чили | 2.8 — 3.7 | |
Спаржа | 6.0 — 6.7 | |
Сыр | 4.8 — 6.4 | |
Томатный сок | 4.1 — 4.6 | |
Тунец | 5.9 -6.1 | |
Турнепс (репа) | 5.2 — 5.6 | |
Тыква | 4.8 — 5.2 | |
Уксус | 2.4 — 3.4 | |
Уксус яблочный | 3.1 | |
Устрицы | 5.7 — 6.2 | |
Финики | 6.5 — 8.5 | |
Фруктовое желе | 2.8 — 3.4 | |
Фруктовый джем | 3.5 — 4.0 | |
Фруктовый коктейль | 3.6 — 4.0 | |
Херес | 3.4 | |
Хрен | 5.4 | |
Чай | 7.2 | |
Черника | 3.1 — 3.4 | |
Шпинат | 5.5 — 6.8 | |
Яблоки | 3.3 — 3.9 | |
Фрукты, овощи и травы, угнетающие рост условно-патогенной микрофлоры
Благодаря химическому составу и, что немаловажно, в совокупности со своими отличительными значениями pH, некоторые растительные продукты могут создавать неблагоприятные условия для развития условно-патогенных (патогенных) микроорганизмов.
Абрикос оказывает бактерицидное действие на гнилостные бактерии, протей;
Барбарис — на стафилококков, стрептококков, дизентерийных бактерий;
Брусничный сок — грибы кандида;
Гранат (сок), порошок из корки граната — дизентерийные бактерии;
Земляника лесная — подавляет рост стафилококков;
Кизил (сок) — дизентерийные и брюшнотифозные палочки;
Клюква (ягода) — кишечно-тифозные и гнилостные бактерии;
Клюквенный сок — повышает активность пенициллина;
Малина, рябина, черноплодная рябина — подавляют стафилококк;
Смородина черная — задерживает рост золотистого стафилококка, вульгарного протея, водный настой повышает активность тетрациклина, биомицина, окситетрациклина;
Черника — активна в отношении стафилококков и шигелл Зонне;
Шиповник — подавляет рост Грам (+) бактерий (кроме дрожжей), активность повышается при добавлении аскорбиновой кислоты;
Яблоки — кишечная палочка;
Горчица, редис, редька черная, чеснок, лук — повышают иммунный ответ организма;
Морковь — активна в отношении дрожжей, спороносных анаэробов;
Перец стручковый — плесневые грибы.
дополнительная информация:
Таблица 3. Растения, обладающие антибактериальным действием по отношению к определенным родам и видам микроорганизмов. (Баранова А.А., Щербаков П.Л. и др. 2005)
Растения | Микроорганизмы |
Абрикос | Гнилостные микроорганизмы, род Proteus, Pseudomonas aeroginosa, роды Enterobacter и Klebsiella |
Барбарис (берберин) | Гемолитические стафилококки и стрептококки, дизентерийные бактерии и представители рода Enterobacter |
Брусника (сок) | Candida |
Земляника (плоды) | Золотистый стафилококк, и представители рода Enterobacter |
Клюква (ягоды) | Гнилостные бактерии и рода Proteus и Klebsiella |
Смородина черная (антоцианиды, эфирные масла) | Грибы, золотистый стафилококк (и другие грамположительные бактерии), Proteus vulgaris, вирусы гриппа А2 и В, бактерии рода Proteus и Klebsiella |
Черника | Стафилококк, штаммы Shigella sonnei, бактерии рода Proteus, Enterobacter и Klebsiella |
Шиповник (флавоновые гликозиды) | Грамположительные бактерии (не действуют на дрожжевые грибы) |
Яблоки | Патогенные кишечные палочки, бактерии рода Proteus и Klebsiella, вирусы гриппа группы А |
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ДИСБАКТЕРИОЗ
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
8. Таблица Ph продуктов. | Академия успешных поваров
1. Графическое понимание водородного показателя
PH.
2. Водородный показатель
(pH) некоторых распространенных продуктов питания.
3. Таблица содержания кальция в продуктах.
1.Графическое понимание водородного показателя PH
— меры активности ионов водорода в растворе, и количественно выражающая его кислотность.

2.Водородный показатель
(pH)
некоторых распространенных продуктов питания.
Водородный показатель (pH) некоторых распространенных продуктов питания. | |||
Продукт | Приблизительный | Продукт | Приблизительный |
Абрикосовый нектар | 3.8 | Малина | 3.2 — 3.6 |
Абрикосы | 3.3 — 4.8 | Мамалыга | 6.8 — 8.0 |
Авокадо | 6.3 — 6.6 | Манго | 5.8 — 6.0 |
Алое Вера | 6.1 | Маслины | 6.0 — 7.0 |
Апельсины | 3.0 — 4.0 | Масло | 6.1 — 6.4 |
Арахисовое масло | 6.3 | Меласса (черная патока) | 4.9 — 5.4 |
Арбуз | 5.2 — 5.6 | Молоко | 6.4 — 6.8 |
Артишоки | 5.5 — 6.0 | Морковь | 5.9 — 6.3 |
Бананы | 4.5 — 5.2 | Морское ушко | 6.1 — 6.5 |
Батат (сладкий картофель) | 5.3 — 5.6 | Мука пшеничная | 5.5 — 6.5 |
Батат (сладкий | 5.5 — 6.8 | Мякоть томата | 4.3 — 4.5 |
Белый хлеб | 5.0 — 6.2 | Нектарины | 3.9 — 4.2 |
Бобы | 5.6 — 6.5 | Овощной сок | 3.9 — 4.3 |
Брокколи | 5.3 | Окунь, морской, жаренный | 6.6 — 6.8 |
Вино | 2.8 — 3.8 | Оливки | 3.6 — 3.6 |
Виноград | 3.5 — 4.5 | Пахта | 4.4 — 4.8 |
Вишня | 3.2 — 4.5 | Персики | 3.4 — 4.1 |
Газированные напитки | 2.0 — 4.0 | Печень трески | 6.2 |
Горох | 5.8 — 6.4 | Пиво | 4.0 — 5.0 |
Горчица | 3.5 — 6.0 | Питьевая вода | 6.5 — 8.0 |
Грейпфрут | 3.0 — 3.7 | Помидоры | 4.3 — 4.9 |
Груши | 3.6 — 4.0 | Ревень | 3.1 — 3.2 |
Дыня | 6.0 — 6.7 | Сардины | 5.7 — 6.6 |
Ежевика | 3.9 — 4.5 | Свежие яйца | 7.6 — 8.0 |
Изюм | 2.8 — 3.0 | Свекла | 4.9 — 6.6 |
Кактус | 4.7 | Сельдерей | 5.7 — 6.0 |
Кальмары | 5.8 | Сельдь | 6.1 |
Каперсы | 6.0 | Сидр | 2.9 — 3.3 |
Капуста | 5.2 — 5.4 | Соевое молоко | 7.0 |
Каракатица | 6.3 | Соевый соус | 4.4 — 5.4 |
Карп | 6.0 | Соус Карри | 6.0 |
Картофель | 5.6 — 6.0 | Соус Чили | 2.8 — 3.7 |
Кетчуп | 3.9 | Спаржа | 6.0 — 6.7 |
Кислая капуста | 3.4 — 3.6 | Сыр | 4.8 — 6.4 |
Кленовый сироп | 4.6 — 5.5 | Томатный сок | 4.1 — 4.6 |
Клубника, земляника | 3.0 — 3.9 | Тунец | 5.9 -6.1 |
Клубничный (земляничный) джем | 3.0 — 3.4 | Турнепс (репа) | 5.2 — 5.6 |
Клюквенный сок | 2.3 — 2.5 | Тыква | 4.8 — 5.2 |
Кокос | 5.5 — 7.8 | Уксус | 2.4 — 3.4 |
Кокосовое молоко | 6.1 — 7.0 | Уксус яблочный | 3.1 |
Крабовое мясо | 6.5 — 7.0 | Устрицы | 5.7 — 6.2 |
Красный перец | 4.6 — 5.2 | Финики | 6.5 — 8.5 |
Креветки | 6.8 — 7.0 | Фруктовое желе | 2.8 — 3.4 |
Крекеры | 6.5 — 8.5 | Фруктовый джем | 3.5 — 4.0 |
Крыжовник | 2.8 — 3.1 | Фруктовый коктейль | 3.6 — 4.0 |
Кукуруза | 5.9 — 7.3 | Херес | 3.4 |
Курага( сушеные абрикосы) | 3.4 — 3.8 | Хрен | 5.4 |
Лайм | 1.8 — 2.0 | Чай | 7.2 |
Лаймовый сок | 2.0 — 2.4 | Черника | 3.1 — 3.4 |
Лимоны | 2.2 — 2.4 | Шпинат | 5.5 — 6.8 |
Лимонный сок | 2.0 — 2.6 | Яблоки | 3.3 — 3.9 |
Лосось | 6.1 — 6.3 |
|
|
Лук-порей | 5.5 — 6.2 |
|
|
3.Таблица содержания кальция в продуктах.
Наименование | Содержание мг в 100гр |
Молоко | 100 |
Йогурт | 128 |
Бри | 510 |
Моцарелла | 720 |
Сливочный сыр | 800 |
Мороженое | 120 |
Соевая мука | 210 |
Кунжут | 980 |
Инжир | 250 |
Миндаль | 240 |
Шпинат | 280 |

9. Рецепты «Сферификация».
Ионное произведение воды. Водородный показатель
Вода является практически незаменимым растворителем в экспериментальной и прикладной химии, поэтому необходимо изучение ее свойств. Остановимся на таких понятиях как ионное произведение воды и водородный показатель pH.
Ионное произведение воды
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно донором и акцептором протонов по отношению к самой себе.
2H2O ↔ H3O+ + OH—
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+ заменить на H+
H2O ↔ H+ + OH—
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH—]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]·[OH—]
При температуре 25ºС KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH—] = 1·10-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14)
Водородный показатель pH
Кислотно – основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H+] и [OH—] — переменные, то по их величинам можно говорить о кислотности или щелочности раствора. При нейтральном характере раствора, т.е. [H+] = [OH—], получаем следующее:
[H+] = [OH—] = (KН2О)1/2 = (1·10-14)1/2 = 10-7 М
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды. Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
| Нейтральная среда | [H+] = [OH—] = 10-7 М |
| Кислая среда | [H+] > [OH—], [H+] > 10-7 М, [OH—] ˂ 10-7 М |
| Щелочная среда | [H+] ˂ [OH—], [H+] ˂ 10-7 М, [OH—] > 10-7 М |
Следует помнить, что не зависимо от характера среды, в водных растворах всегда существуют оба иона.
Выражение характера среды данным способом информативно, но сопряжено с некоторыми трудностями в случае выражения небольших значений концентрации иона водорода. Более удобно пользоваться отрицательным логарифмом этой величины, называемой водородным показателем pH:
pH = -lg[H+] = lg (1/[H+])
Отметим, что изменению [H+] в 10 раз соответствует изменение pH всего на 1 единицу.
pOH = -lg[OH—] = lg (1/[OH—])
pH и pOH нейтрального раствора равен 7:
pH = -lg[H+] = -lg(1·10-7) = 7
| Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
| Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
| Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
На следующем рисунке наглядно показано зависимость характера среды от величины pH
шкала pH
Все рассмотренные нами представления об ионном произведении воды справедливы для случая диссоциации химически чистой воды. Если же равновесные концентрации H+ или ОH— составляют большие величины, то ионное произведение воды выражается формулой:
aH+aOH— = K`H2O
где aH+ и aOH— — соответственно активности ионов водорода и ионов гидроксила;
K`H2O — истинная константа, значение которой не зависит от величины ионной силы раствора.
Учитывая, что
aH+ = [H+] · fH+ , aOH— = [OH—] · fOH—
преобразуем выражение:
[H+]·[OH—] = K`H2O/(fH+· fOH— )
где fH+· fOH— — коэффициенты активности
Для определения характера среды раствора существует много методов, самый простой из них – применение индикаторов. Далее приведены некоторые индикаторы и зависимость изменения их окраски от концентрации ионов водорода.
изменение окраски индикатора в зависимости от характера среды«Водородный показатель». 11-й класс (интегрировнный урок химии и математики с применением ИКТ)
Тип: интегрированный урок химии и математики, с применением ИКТ (Приложение 1).
Цель: сформировать понятие о pH, ионном произведении воды, константе её диссоциации.
Оборудование: слайды, проектор, компьютер.
Реактивы: H2O, растворы индикаторов, кислот, щелочей.
Ход урока
Организационный момент.
Цель и задачи.
Устный опрос по теме “Вода””.
Объяснение нового материала.
Водородный показатель
Вода – слабый электролит, диссоциирующий на ионы H+ и OH— — анионы.
Этому процессу соответствует константа диссоциации воды:
,
так как диссоциирует ничтожная часть молекул воды, то [H2O] – постоянная величина,
Кд* [H2O] = К h3O = [H+] [OH—] – ионное произведение воды,
К h3O = 1*10-14 (при 25° С)
К h3O – величина постоянная. Зная [H+] , можно вычислить [OH—] и наоборот.
При [H+] = [OH—] = 10 -7 моль/л – среда нейтральная
При [H+] > [OH—], [H+ ] > 10-7 моль/л – среда кислая
При [H+] < [OH—], [H+ ] < 10-7 моль/л – среда щелочная
Для характеристики среды растворов используют водородный показатель pH , который определяется как отрицательный десятичный логарифм концентрации ионов водорода [H+]
pH = — lg [H+]
если pH = 7 – среда нейтральная
pH > 7 — среда щелочная
pH < 7 — среда кислотная
В частности, при 25°С pH + pOH = pH2O = 14
Определить pH можно с помощью индикаторов.
Индикатор – вещество, способное существовать в двух формах – кислой и щелочной, в которых он имеет различную окраску.
Учитель химии демонстрирует изменение цвета индикатора в зависимости от среды растворов на примере лакмуса, метилового оранжевого, фенолфталеина.
Учитель математики:
Что же такое логарифм?
Слайд
lg 1=0
lg 105 =5
lg 10-2 =-2
lg a*b = lga + lgb
lg a/b =lga – lgb
lg an = n(lga)
lg a1/n =1/n(lga)
Вычисление десятичного логарифма на калькуляторе.
Учитель химии:
Вычислим pH нейтрального раствора, т.е. раствора, когда [H+] = [OH—] = 1*10-7
pH = -lg [H] = -lg (1*10-7) = — lg1 + (-lg 10-7 )= 0 +7*1=7=> pH нейтрального раствора равен 7
Задача 1. Вычислите значения pH для двух растворов из предыдущей задачи: вычислить [H+] в растворе:
где
а) [OH—] = 0,01 моль/л => [H+] = 1*10-12 раствор щелочной
б) [OH—] = 2*10-9 моль/л => [H+] = 5*10-5 раствор кислый
Слайд: Решение:
а) в первом случае установлено, что [H+] = 1*10-12
pH = -lg (1*10-12 )= -(-12)=12
среда = ?
б) для второго раствора [H+] = 1*10-6
pH = -lg (5*10-6)= -(lg5 + lg10-6 ) = -(0,699-6) = 5,3
среда = ?
Слайд:
Задача 2. Определите pH раствор с [H+] = 0,015М (моль/л)
Слайд:
Решение:
pH = -lg[H+] = -lg 0,015 = -lg (1,5*10-2 ) = -lg 1,5 – lg (10-2 ) = -0,18 +2 =1,82
pH < 7, среда кислая
Вывод:
Кислотно — основные свойства имеют большое значение практически во всех областях народного хозяйства.
От кислотности или основности воды очень сильно зависит разложение химических загрязнителей в сточных водах, скорость коррозии металлических предметов, находящихся в воде, а также пригодность водной среды к обитанию в ней рыб и растений.
pH крови человека в норме 7,34 – 7,44 уменьшение этой величины ниже 6,8 и увеличение их до 8,0 приводит к гибели организма.
Таблица 1
pH некоторых жидкостей
раствор |
pH |
раствор |
pH |
| Томатный сок Вода Кровь Раствор соды Na2CO3 (1% — ный) Нашатырный спирт Известковая вода Раствор гидроксида натрия (14%-ный) |
4,1 7,0 7,4 11,6 11,9 12,9 15,0 |
Черный кофе Слёзы Желудочный сок Сок щавеля Яблочный сок: “Антоновка” “Коричное” Соляная кислота (37%-ная) |
5,0 7,0 1,4 3,7
2,5 3,7 -1,1 |
Задача 3. Определить концентрацию ионов водорода в растворе, pH которого равен 4,60.
Решение. Согласно условию задачи, -lg[H+] = 4,6. Следовательно lg[H+] = -4,60 = 5,40. Отсюда по таблице логарифмов находим [H+] = 2,5*10-5 моль/л.
Задача 4. Чему равна концентрация гидроксид – ионов в растворе, pH которого равен 10,80?
Решение. Из соотношения pH + pOH =14 находим:
pOH = 14- pH = 14 – 10,80 = 3,20.
Отсюда – lg [OH—] = 3,20 или lg [OH—] = -3,20 =4,80.
Этому значению логарифма соответствует значение [OH—] = 6,31*10-4 моль/л.
5. Обобщение.
Домашнее задание: §16, с.68 №8,9 (учебник Г.Е.Рудзитис, Ф.Г.Фельдман, “Химия-11”).
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Кислотность pH. Водородный показатель pH. Таблицы показателей pH. Перевод единиц кислотности. / / Водородный показатель (pH) некоторых распространенных продуктов питания. Кислотность. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Что такое ph в химии ℹ️ как рассчитать водородный показатель, как определить показатель ph раствора, шкала кислотности среды

Теоретические основы
Вода является средой, в которой растворяются органические и неорганические химические вещества, и обладает способностью распадаться на ионы. Одна молекула отдает свой протон другой, поэтому в воде постоянно находится некоторое количество положительно заряженных ионов водорода H и отрицательно заряженных гидроксид-ионов OH. Этот процесс называется электролитической диссоциацией.
Говоря об ионе водорода, делается упрощение, так как на самом деле положительно заряженный ион в воде — это ион гидроксония h4O. Он образуется из целой молекулы воды и протона, оторванного от другой молекулы. Чем больше таких ионов в воде, тем больше и ее кислотность.
Ионы очень подвижны и постоянно переходят от одной молекулы к другой. Таким образом, процесс распада и процесс соединения в новую молекулу идут постоянно и уравновешивают друг друга, т. е. диссоциация воды находится в равновесии.

Количество ионов H+ и мера их активности в большинстве растворов очень малы, их записывают в виде числа с отрицательной степенью, что очень неудобно. Поэтому датским биохимиком Сёреном Сёренсеном в 1909 году было предложено выражать это число в виде показателя кислотности (водородного показателя) pH, который вычисляется как десятичный логарифм от меры активности ионов H+ с обратным знаком: pH = — lg [H+].
С. Сёренсен руководил химико-физиологической лабораторией при пивоваренном заводе Carlsberg, где разработал шкалу для измерения показателя pH. На ее основе были созданы специальные приборы: pH-метры, которые применяются для измерения кислотности растворов и жидкостей в промышленности, и ацидогастрометры для диагностики желудочно-кишечных заболеваний в медицине.
Показатель основности раствора, выражающийся десятичным логарифмом с отрицательным знаком от концентрации в растворе гидроксид-ионов: pOH = — lg [OH-], применяется гораздо реже. Величины pH и pOH могут быть как положительными, так и отрицательными.
Важно не путать pH с понятиями кислотности и щелочности. Главное различие заключается в том, что pH — это показатель не количества, а активности.
Он отражает степень кислотности или щелочности среды, а не количественное содержание в воде химических веществ. В разбавленных растворах мера активности эквивалентна концентрации, поэтому при определенном допущении один термин заменяют другим.
Влияние pH на свойства среды
С помощью несложных математических вычислений можно доказать, что сумма показателей pH и pOH для воды — величина постоянная и равна 14. Например, если рН = 5, то рОН = 9; для рН = -2 pOH = 16. У чистой воды без примесей (дистиллированной) и у водных растворов, образуемых неэлектролитами, pH = 7, а значит и рОН = 7, т. е. кислотный и основной (щелочной) показатели уравновешивают друг друга, и получается нейтральная среда.

При попадании в воду многих химических соединений происходит их гидролиз. Растворяемое вещество распадается на катионы и анионы, которые могут соединяться с ионами, получившимися в результате диссоциации воды. При этом получается смещение равновесия диссоциации воды. Показатель pH определяет, в какую сторону оно произошло. Если pH < 7, то получилась кислотная среда, когда pH > 7 — щелочная.
Показатель pH влияет на протекание химических реакций как на производстве, так и в природе и является универсальным показателем состояния среды. С помощью его контроля производят все виды горючего, краски, удобрения, средства личной гигиены и косметику. В пищевой промышленности проверяется качество изготовления напитков, молокопродуктов, изделий из злаков. Все живые обитатели природных почв и вод могут жить только при определенных значениях водородного показателя, от него же зависит и урожайность многих растений, поэтому ведется наблюдение за pH в почвоведении и земледелии, особенно в гидропонике.
При этом обычно необходимо поддерживать постоянное значение pH в течение длительного времени. Для этого используют так называемые буферные растворы. Они представляют собой смеси слабого основания и его соли или слабой кислоты и ее соли, в которых мера активности ионов водорода постоянна и устойчива.
Измерение водородного показателя
Формулы для расчета pH зависят от того, к какому классу относится химическое вещество, входящее в исследуемый раствор, и приведены в специальных справочниках. Более точное значение получают другими методами. Цели и условия проведения исследований определяют, как будет измеряться водородный показатель.
Индикаторные способы
Приблизительно оценить меру активности ионов водорода можно с помощью кислотно-основных индикаторов. Такие вещества обычно относятся к органическим соединениям и имеют свойство изменять свой цвет в разных средах:

- Лакмус меняет цвет от красного в кислой среде через фиолетовый в нейтральной до синего в щелочной.
- Фенолфталеин становится синим в щелочной среде, оставаясь бесцветным в остальных.
- Метилоранж розового цвета соответствует повышенной кислотности, оранжевого — показывает нейтральность среды, в щелочах становится синим.
Изменение происходит для каждого индикатора в своём диапазоне кислотности, обычно составляющем 1—2 единицы. При этом методе результат можно получить быстрый и наглядный при небольших затратах, но недостаточно точный, с большой погрешностью при исследовании очень слабых растворов, окрашенных или мутных вод. Используется, когда нужно найти предварительное определение pH.

Более широкий диапазон и выше точность у универсального индикатора. Он соединяет в себе несколько индикаторов и градуируется в соответствии со значениями pH от единицы до десяти. Соответствие значения водородного показателя и цвета:
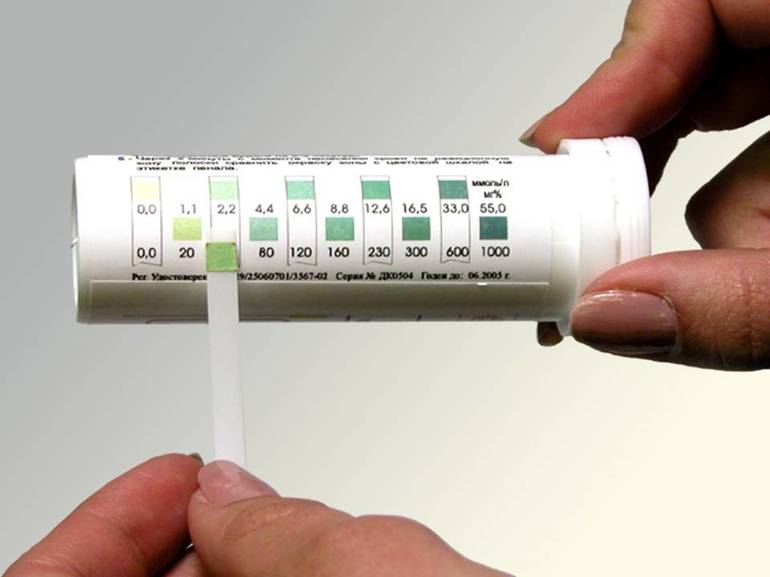
- 1 — красный;
- 2 — розовато-оранжевый;
- 3 — оранжевый;
- 4 — темно-желтый;
- 5 — желтый;
- 6 — желтовато-зеленый;
- 7 — светло-зеленый;
- 8 — насыщенный зеленый;
- 9 — сине-зеленый;
- 10 — сине-серый.
Аналитический объемный метод
Кислотно-основное титрирование — метод определения водородного показателя среды с помощью так называемых титрантов. В основном для этого используются сильные кислоты (серная, соляная) и сильные щелочи (едкий калий, каустическая сода).

Раствор-титрант добавляют в исследуемую жидкость по каплям. При этом они вступают в химическую реакцию. Когда она завершается, наступает точка эквивалентности, т. е. момент отчетливого изменения окраски исследуемого раствора. По установленному в результате опыта объему титранта, необходимому для получения точки эквивалентности, и известному значению его концентрации можно рассчитать pH с высокой точностью.
Измерительный прибор pH-метр
Ионометрический метод, при котором кислотный показатель можно измерить с помощью специализированного прибора — pH-метра, является наиболее точным (до сотых от единицы pH), удобным и имеет широкий диапазон измерения. PH-метр представляет собой милливольтметр, способный измерять разность потенциалов со стеклянных электродов. У него также есть система пересчета напряжения в pH.

В исследуемый раствор погружают индикаторный электрод и электрод сравнения, замыкая таким образом гальваническую цепь. Величина электродвижущей силы в ней зависит от активности ионов H+ в растворе, т. е. является функцией только его pH. Индикаторный электрод состоит из стеклянной трубки, заполненной специальной суспензией в растворе соляной кислоты, и погруженной в нее серебряной проволоки.
Полезный сигнал возникает на границе соприкосновения раствора и индикаторного электрода и передается через металлический проводник на вход pH-метра. Таким способом можно измерять pH любых жидкостей, в том числе непрозрачных и цветных.
Специализированный прибор, применяемый в медицине для исследований pH жидкостей желудочно-кишечного тракта, называется ацидогастрометром. Включает в себя регистрирующий блок и один или несколько зондов. Для измерения уровня pH таких биологических жидкостей, как слюна и моча, применяются электронные pH-метры.
Кислотно-щелочной баланс человека
Организмом человека вырабатываются разные жидкости, каждая из которых должна иметь определенное значение pH. Отклонение в ту или иную сторону может привести к развитию множества серьезных заболеваний. Вовремя обнаруженные изменения можно исправить, если повысить или понизить кислотность потребляемых продуктов и питьевой воды. Механизм регулирования пропорционального соотношения кислот и щелочей в клеточных и межклеточных жидкостях называют кислотно-щелочным балансом (равновесием). По значению pH можно определить, в каком состоянии находятся многие органы человека.

На pH почек и печени оказывают влияние не только метаболические процессы в самом организме, но также пища и вода. Излишнюю кислотность потребленных продуктов организм выводит через мочу. Низкий уровень pH мочи говорит о том, что почки работают на пределе. Когда излишняя кислота не может быть выведена из организма естественным путем, она скапливается в подкожной жировой прослойке, имеющей кислотный pH. Это приводит к излишнему весу. В борьбе с этим явлением помогает щелочная вода, снижая нагрузку на почки.
В желудке среда резко кислая, в момент пищеварения pH равен 1,8−3. Вопреки распространненому мнению, причиной таких неприятных симптомов, как изжога и дискомфорт в желудке, является пониженная, а не повышенная кислотность желудочного сока. Нормальный уровень pH создает благоприятные условия для развития правильных бактерий и запускает механизм переваривания пищи, а болезнетворные микроорганизмы и гельминты расщепляются пищеварительными ферментами.

pH крови организм поддерживает в постоянном состоянии на уровне 7,4—7,45. Малейшее отклонение его от нормы может привести к тяжелым последствиям для человека. При понижении pH ниже 7,35 возникает ацидоз. При превышении нормы — алкалоз. Это не самостоятельные заболевания, они свидетельствуют о нарушениях в работе легких, почек, печении. Такие состояния сопровождаются очень опасными для здоровья симптомами, приводящими иногда даже к коме. По мнению врачей, ацидоз переносится легче алкалоза.
Кровеносные сосуды питают слюнные железы, поэтому за уровнем pH крови можно следить по pH слюны. Поддержание кислотно-щелочного баланса в кровеносной системе — это важнейшая функция организма человека. Внешние факторы не оказывают влияния на pH крови, он регулируется только внутренними механизмами тела человека:
- Буферные системы крови поддерживают устойчивость среды.
- Легочная (респираторная) система удаляет излишки углекислого газа из крови.
- Выделительная система (почки). Самый медленный, но и самый мощный механизм, может полностью восстанавливать pH организма путем выведения ионов водорода через мочу.
Таким образом, хотя кислотный показатель крови совершенно не подвержен внешнему влиянию, механизмы его поддержания на нужном уровне имеют зависимость от того, чем человек питается и какую воду пьет. Мясо и молоко повышают общую кислотность организма, а зелень и зеленые овощи лучше всего нейтрализуют ее. Кислотность и щелочность различных пищевых продуктов можно узнать из специальных таблиц. Оптимальное значение pH для воды находится в пределах от 6 до 9.
Придерживаясь принципов правильного питания для поддержания кислотно-щелочного равновесия в своем организме, человек надолго сохранит молодость, красоту и здоровье.
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Кислотность pH. Водородный показатель pH. Таблицы показателей pH. Перевод единиц кислотности. / / Таблица значений PH кислот. (Растворов). Кислотность. Таблица водородных показателей Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
