Клинический анализ крови: общий анализ, лейкоформула, СОЭ (с обязательной «ручной» микроскопией мазка крови*)
Метод определения См. в описании
Исследуемый материал Смотрите в описании
Доступен выезд на дом
Кровь — это жидкая ткань, выполняющая различные функции, в том числе, транспорта кислорода и питательных веществ к органам и тканям и выведения из них шлаковых продуктов. Состоит из плазмы и форменных элементов: эритроцитов, лейкоцитов и тромбоцитов.
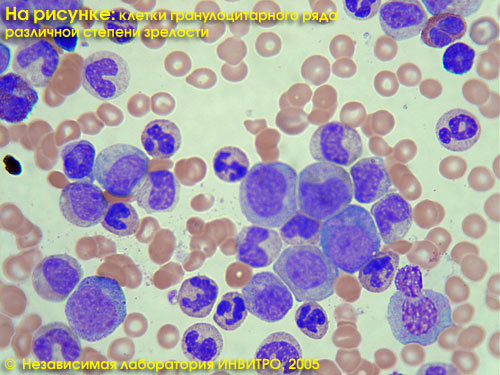 Общий анализ крови в лаборатории ИНВИТРО включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC). Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 911, СОЭ — см. тест № 139.
Общий анализ крови в лаборатории ИНВИТРО включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC). Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 911, СОЭ — см. тест № 139.Лейкоцитарная формула — это процентное соотношение различных видов лейкоцитов (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы).
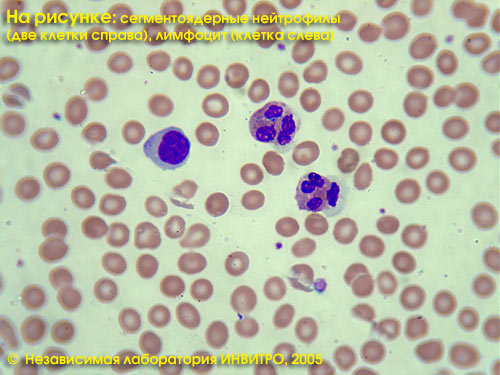 Лейкоцитарная формула в Независимой лаборатории ИНВИТРО включает в себя определение (в %) нейтрофилов, лимфоцитов, эозинофилов, базофилов, моноцитов. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 911, СОЭ — см. тест № 139.
Лейкоцитарная формула в Независимой лаборатории ИНВИТРО включает в себя определение (в %) нейтрофилов, лимфоцитов, эозинофилов, базофилов, моноцитов. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 911, СОЭ — см. тест № 139. Скорость оседания эритроцитов (СОЭ) — неспецифический показатель воспаления. СОЭ — показатель скорости разделения крови в пробирке с добавленным антикоагулянтом на 2 слоя: верхний (прозрачная плазма) и нижний (осевшие эритроциты). Скорость оседания эритроцитов оценивается по высоте образовавшегося слоя плазмы (в мм) за 1 час. Удельная масса эритроцитов выше, чем удельная масса плазмы, поэтому в пробирке при наличии антикоагулянта (цитрата натрия) под действием силы тяжести эритроциты оседают на дно.
Процесс оседания (седиментации) эритроцитов можно разделить на 3 фазы, которые происходят с разной скоростью. Сначала эритроциты медленно оседают отдельными клетками. Затем они образуют агрегаты — «монетные столбики», и оседание происходит быстрее. В третьей фазе образуется очень много агрегатов эритроцитов, их оседание сначала замедляется, а потом постепенно прекращается.
Показатель СОЭ меняется в зависимости от множества физиологических и патологических факторов. Значения СОЭ у женщин несколько выше, чем у мужчин. Изменения белкового состава крови при беременности ведут к повышению СОЭ в этот период.
Снижение содержания эритроцитов (анемия) в крови приводит к ускорению СОЭ и, напротив, повышение содержания эритроцитов в крови замедляет скорость седиментации. В течение дня возможно колебание значений, максимальный уровень отмечается в дневное время. Основным фактором, влияющим на образование «монетных столбиков» при оседании эритроцитов является белковый состав плазмы крови. Острофазные белки, адсорбируясь на поверхности эритроцитов, снижают их заряд и отталкивание друг от друга, способствуют образованию «монетных столбиков» и ускоренному оседанию эритроцитов.
Повышение белков острой фазы, например, С-реактивного белка, гаптоглобина, альфа-1-антитрипсина, при остром воспалении приводит к повышению СОЭ. При острых воспалительных и инфекционных процессах изменение скорости оседания эритроцитов отмечается через 24 часа после повышения температуры и увеличения числа лейкоцитов. При хроническом воспалении повышение СОЭ обусловлено увеличением концентрации фибриногена и иммуноглобулинов.
Определение СОЭ в динамике, в комплексе с другими тестами, используют в контроле эффективности лечения воспалительных и инфекционных заболеваний. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 911, СОЭ — см. тест № 139.Биоматериал – 2 пробирки:
Обращаем внимание, что при выполнении клинического анализа крови (№1515) и подсчете лейкоцитарной формулы (№119), если в пробах выявлены значимые отклонения и результат требует проведения ручной микроскопии, ИНВИТРО дополнительно бесплатно проводит ручной подсчет лейкоцитарной формулы с подсчетом молодых форм нейтрофилов (в том числе точным подсчетом палочкоядерных нейтрофилов) и количественной оценкой всех патологических форм лейкоцитов (при их наличии). *просмотр мазка крови под микроскопом врачом-гематологом с дополнительным уточнением лейкоцитарной формулы и описанием морфологии клеток.Маркер развития Ph’-негативных хронических миелопролиферативных заболеваний (ХМПЗ): качественная оценка наличия соматической мутации V617F гена JAK2. (ПЦР, качеств)
Метод определения ПЦР
Исследуемый материал Цельная кровь
Доступен выезд на дом
Уважаемые пациенты. Дни приема биоматериала уточняйте, пожалуйста, по телефону.
Диагностический критерий Всемирной организации здравоохранения (ВОЗ) для ХМПЗ. Молекулярно-генетическая диагностика.
Миелопролиферативные заболевания (МПЗ) – заболевания, характеризующиеся избыточной пролиферацией (выработкой клеток) одного или нескольких ростков кроветворения. Нарушения возникают на уровне стволовых клеток.
Классические Ph’-негативные ХМПЗ – группа болезней, включающая в себя эритремию (истинную полицитемию, ИП), эссенциальную тромбоцитемию (ЭТ) и идиопатический миелофиброз (ИМФ). Это хронические лейкозы с поражением на уровне клетки-предшественницы гемопоэза с характерной для опухоли неограниченной пролиферацией этой клетки, потомки которой дифференцируются по всем росткам кроветворения. При этом для эритремии свойственно преобладание красного ростка, для эссенциальной тромбоцитемии – мегакариоцитов и тромбоцитов. Классические ХМПЗ и некоторые другие менее распространенные миелопролиферативные заболевания чаще всего являются приобретенными, спорадическими нарушениями гемопоэза.
Молекулярные события, лежащие в основе патогенеза ХМПЗ, связаны с дефектами генов, которые кодируют белки, ответственные за нормальное поддержание миелопоэза. Для всех ХМПЗ характерна аномальная тирозинкиназная активность.
Белок JAK2 принадлежит семейству нерецепторных тирозинкиназ (Janus-киназ), которое включает в себя четыре белка: JAK1, JAK2, JAK3 и TYK2. Для гемопоэза особое значение среди них имеет киназа JAK2, которая осуществляет передачу сигнала не только от эритропоэтина, но и от тромбопоэтина и колониестимулирующего фактора гранулоцитов (G-CSF). Функция белков JAK заключается в том, что они служат промежуточным звеном между рецепторами на мембране клетки и сигнальными молекулами (цитокинами, факторами роста и пр.). Эти молекулы, связываясь с рецепторами JAK-киназ на поверхности клетки, активируют их, что приводит к активации сигнальных путей с участием ряда белков, которые передают сигналы для транскрипции, пролиферации и дифференцировки бластных предшественников.
При появлении соматической мутации
JAK2 1849G/T (617V/F) является соматической мутацией, возникающей в гемопоэтических клетках-предшественницах. Она встречается у подавляющего большинства больных ХМПЗ, что делает эту мутацию очень удобным диагностическим маркером. Наличие точечной мутации JAK2 1849G/T (617V/F) – феномен, характерный исключительно для поражений миелоидного ростка, и не описан ни для солидных опухолей, ни для опухолей лимфоидного происхождения.
______________________________________
1 Мутация 1849G/T (617V/F) является соматической, т. е.:
- Возникает у человека спонтанно, а не передается по наследству от родителей.
- Мутантный аллель выявляется в основном в виде гетерозиготного генотипа.
- Возможно возникновение мутации через несколько лет после проведения данного анализа, следовательно, при необходимости целесообразно повторное проведение анализа.
Таблица 1. Молекулярные аномалии, связанные с «классическими» миелопролиферативными заболеваниями
| Генетическая аномалия | Нозология | Частота, % |
| JAK2 1849G/T (617V/F) | Истинная полицитемия | > 95 |
| Эссенциальная тромбоцитемия | 50-70 | |
| Первичный миелофиброз | 40-50 |
Мутация JAK2 1849G/T (617V/F) – диагностический маркер, при помощи которого можно проводить первичную и дифференциальную диагностику ХМПЗ, а также молекулярный мониторинг минимальной остаточной болезни (количественный тест).
Алгоритм проведения молекулярной диагностики МПЗ (рис. 1)
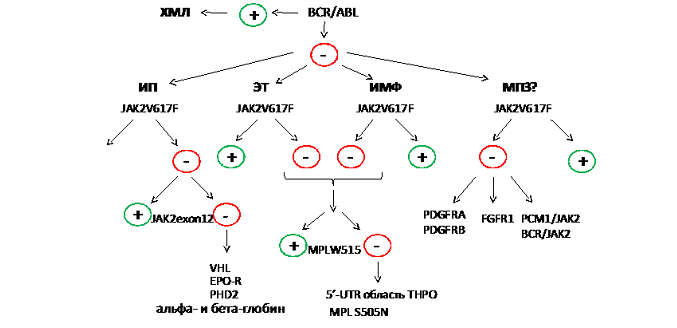
Определение химерного онкогена BCR/ABL позволяет провести дифференциальный анализ хронического миелоидного лейкоза (ХМЛ) и Ph’-негативных МПЗ. Если в случае Ph’-негативных МПЗ мутация JAK2 1849G/T (617V/F) не найдена, то в случае ИП следует осуществить поиск мутаций в двенадцатом экзоне гена JAK2, а в случае ЭТ и ИМФ – мутаций MPL W515L/K. В случае отрицательного результата следует исключить возможность наследственных дефектов генов VHL, EPO-R, PHD2, THPO, MPL и генов глобинов. При редких видах МПЗ, негативных по JAK2 V617F, целесообразно осуществить поиск химерных онкотирозинкиназ.
Сейчас молекулярное исследование входит в диагностические критерии ВОЗ 2008 г., а тест на наличие мутации JAK2 стал стандартным методом диагностики ХМПЗ. Выявление мутации указывает на наличие клонального ХМПЗ и исключает возможность реактивного эритроцитоза, тромбоцитоза или миелофиброза.
Таблица 2. Диагностические критерии ВОЗ для ХМПЗ (2008)
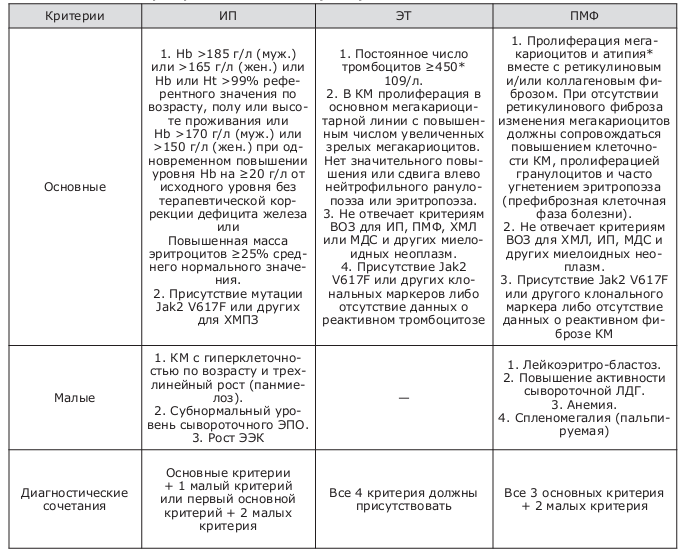
В настоящее время исследование на наличие мутации JAK2 1849G/T (617V/F) – необходимое условие для установления правильного диагноза и определения дальнейшей тактики ведения пациента.
Клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов)
Метод определения См. в описании
Исследуемый материал Смотрите в описании
Доступен выезд на дом
Кровь — это жидкая ткань, выполняющая различные функции, в том числе, транспорта кислорода и питательных веществ к органам и тканям и выведения из них шлаковых продуктов. Состоит из плазмы и форменных элементов: эритроцитов, лейкоцитов и тромбоцитов.
 Общий анализ крови в лаборатории ИНВИТРО включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC). Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139.
Общий анализ крови в лаборатории ИНВИТРО включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC). Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139.Лейкоцитарная формула — это процентное соотношение различных видов лейкоцитов (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы).
 Лейкоцитарная формула в Независимой лаборатории ИНВИТРО включает в себя определение (в %) нейтрофилов, лимфоцитов, эозинофилов, базофилов, моноцитов. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139.
Лейкоцитарная формула в Независимой лаборатории ИНВИТРО включает в себя определение (в %) нейтрофилов, лимфоцитов, эозинофилов, базофилов, моноцитов. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139. Скорость оседания эритроцитов (СОЭ) — неспецифический показатель воспаления. СОЭ — показатель скорости разделения крови в пробирке с добавленным антикоагулянтом на 2 слоя: верхний (прозрачная плазма) и нижний (осевшие эритроциты). Скорость оседания эритроцитов оценивается по высоте образовавшегося слоя плазмы (в мм) за 1 час. Удельная масса эритроцитов выше, чем удельная масса плазмы, поэтому в пробирке при наличии антикоагулянта (цитрата натрия) под действием силы тяжести эритроциты оседают на дно.
Процесс оседания (седиментации) эритроцитов можно разделить на 3 фазы, которые происходят с разной скоростью. Сначала эритроциты медленно оседают отдельными клетками. Затем они образуют агрегаты — «монетные столбики», и оседание происходит быстрее. В третьей фазе образуется очень много агрегатов эритроцитов, их оседание сначала замедляется, а потом постепенно прекращается.
Показатель СОЭ меняется в зависимости от множества физиологических и патологических факторов. Значения СОЭ у женщин несколько выше, чем у мужчин. Изменения белкового состава крови при беременности ведут к повышению СОЭ в этот период.
Снижение содержания эритроцитов (анемия) в крови приводит к ускорению СОЭ и, напротив, повышение содержания эритроцитов в крови замедляет скорость седиментации. В течение дня возможно колебание значений, максимальный уровень отмечается в дневное время. Основным фактором, влияющим на образование «монетных столбиков» при оседании эритроцитов является белковый состав плазмы крови. Острофазные белки, адсорбируясь на поверхности эритроцитов, снижают их заряд и отталкивание друг от друга, способствуют образованию «монетных столбиков» и ускоренному оседанию эритроцитов.
Повышение белков острой фазы, например, С-реактивного белка, гаптоглобина, альфа-1-антитрипсина, при остром воспалении приводит к повышению СОЭ. При острых воспалительных и инфекционных процессах изменение скорости оседания эритроцитов отмечается через 24 часа после повышения температуры и увеличения числа лейкоцитов. При хроническом воспалении повышение СОЭ обусловлено увеличением концентрации фибриногена и иммуноглобулинов.
Определение СОЭ в динамике, в комплексе с другими тестами, используют в контроле эффективности лечения воспалительных и инфекционных заболеваний. Общий анализ — см. тест № 5, Лейкоцитарная формула — см. тест № 119, СОЭ — см. тест № 139.Биоматериал – 2 пробирки:
Обращаем внимание, что при выполнении клинического анализа крови (№1515) и подсчете лейкоцитарной формулы (№119), если в пробах выявлены значимые отклонения и результат требует проведения ручной микроскопии, ИНВИТРО дополнительно бесплатно проводит ручной подсчет лейкоцитарной формулы с подсчетом молодых форм нейтрофилов (в том числе точным подсчетом палочкоядерных нейтрофилов) и количественной оценкой всех патологических форм лейкоцитов (при их наличии).Скрытая кровь в кале (колоректальные кровотечения), количественный иммунохимический метод FOB Gold (quantitative immunochemical Fecal Occult Blood Test FOB Gold)
Метод определения Иммунохимический (FOB Gold). Метод специфичен по отношению к человеческому гемоглобину.
Исследуемый материал Кал
 |
| Чтобы скачать брошюру, кликните на картинке |
Колоректальный рак.
Актуальность проблемы.
Ранняя
профилактика
колоректального рака.
Чувствительный, специфичный в отношении человеческого гемоглобина тест, направленный на выявление кровотечений нижних отделов кишечного тракта, используемый в алгоритмах скрининга на колоректальный рак.
Предлагаемый новый иммунохимический вариант теста на скрытую кровь в кале предназначен для диагностики скрытых кровотечений из нижних отделов желудочно-кишечного тракта. Новый метод лишен недостатков старых, менее специфичных химических методов (гваяковая, бензидиновая пробы). Эти химические пробы на гемоглобин давали положительную реакцию не только на гемоглобин человека, но и на гемоглобин и миоглобин животного происхождения, поступающий с пищей, а также на некоторые химические вещества, содержащиеся в пищевых продуктах, витаминах, поэтому требовали строгой преаналитической подготовки к исследованию в течение нескольких дней перед исследованием. Иммунохимический вариант теста на скрытую кровь в кале строго специфичен по отношению к гемоглобину человека, он существенно более удобен, поскольку не требует ограничений в диете. Иммунохимический вариант теста на скрытую кровь в кале направлен на выявление различных видов патологии нижних отделов желудочно-кишечного тракта, характеризующихся кровотечениями (полипы толстого кишечника, колоректальный рак, болезнь Крона, язвенный колит). Сосуды на поверхности колоректального полипа или злокачественного новообразования часто бывают хрупкими и легко повреждаются при прохождении каловых масс. При этом в фекалии выделяется небольшое количество крови, которое редко заметно на глаз. Результат теста не несет информацию о том, в какой части пищеварительного тракта имеет место кровотечение и чем оно вызвано. Поэтому в случае положительного результата теста рекомендуют провести колоноскопию, чтобы понять причину появления крови в кале (полип, рак, язвы, геморроидальные узлы, дивертикулез, воспалительные заболевания кишечника). В иммунохимических тестах на скрытую кровь используют антитела к интактному человеческому гемоглобину и глобину (в отличие от пероксидазных проб, гваяковой и бензидиновой, в основе которых лежит реакция с гемом). Поэтому иммунохимический метод, проявляя более высокую чувствительность и специфичность в выявлении кровотечений на уровне ободочной и прямой кишки, в то же время нечувствителен к скрытым кровотечениям в верхних отделах желудочно-кишечного тракта, где белковая часть гемоглобина подвергается перевариванию (в отношении кровотечений в верхних отделах более чувствителен тест № 240). Колоректальный рак (рак ободочной и прямой кишки) – одна из наиболее частых причин смертности от онкологических заболеваний в России, как и в других европейских странах. Раннее выявление этой патологии кардинально влияет на прогноз заболевания. Доказана целесообразность применения тестов на скрытую кровь в кале в скрининговых программах для раннего выявления колоректального рака, с рекомендацией последующей колоноскопии при положительном результате теста. Такой алгоритм скрининга населения, по оценкам, позволяет снизить смертность от этого заболевания на 25%. В возрасте после 50 лет (а в группе риска, в случае наследственной предрасположенности после 40-45 лет) такое исследование целесообразно проводить ежегодно. Более информативно 2-3-кратное взятие проб кала. По оценкам, около трети пациентов на стадии, когда опухоль еще не выходит за пределы слизистой оболочки (по классификации Dukes A) могут быть не обнаружены при единичном скрининговом тесте на скрытую кровь в кале. Результаты исследования следует трактовать в комплексе с результатами других видов исследования, анамнезом и клинической картиной.Литература
1. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России. Вестник РОНЦ им. Н.Н.Блохина РАМН, том 22, №3 (85), прил.1.Июль-сентябрь 2011 г. 172 с.2. Z.Levl et al A quantitative immunochemical fecal occult blood test for colorectal neoplasia.Ann.Int.Med. 2007 146 244-255.
3. D.K.Sohn et al. Single immunochemical fecal occult blood test for detection of colorectal neoplasia. Cancer Research and Treatment. 2005. 37(1). 20-23
4. Tietz Clinical guide to laboratory tests. 4-th ed. Ed. Wu A.N.B.- USA,W.B Sounders Company, 2006,1798
5. Всемирная организация здравоохранения
Количественное определение соотношения нормального и мутантного аллелей 617V/617F в 14 экзоне гена JAK2
Метод определения Real-Тime PCR.
Исследуемый материал Цельная кровь (с ЭДТА)
Диагностический критерий Всемирной организации здравоохранения (ВОЗ) для ХМПЗ. Молекулярно-генетическая диагностика. Количественное определение является важным для оценки ответа больных на терапию, для мониторинга динамики заболевания.
Миелопролиферативные заболевания (МПЗ) – заболевания, характеризующиеся избыточной пролиферацией (выработкой клеток) одного или нескольких ростков кроветворения. Нарушения возникают на уровне стволовых клеток. Классические Ph’-негативные ХМПЗ – группа болезней, включающая в себя эритремию (истинную полицитемию, ИП), эссенциальную тромбоцитемию (ЭТ) и идиопатический миелофиброз (ИМФ). Это хронические лейкозы с поражением на уровне клетки-предшественницы гемопоэза с характерной для опухоли неограниченной пролиферацией этой клетки, потомки которой дифференцируются по всем росткам кроветворения. При этом для эритремии свойственно преобладание красного ростка, для эссенциальной тромбоцитемии – мегакариоцитов и тромбоцитов. Классические ХМПЗ и некоторые другие менее распространенные миелопролиферативные заболевания чаще всего являются приобретенными, спорадическими нарушениями гемопоэза.
Молекулярные события, лежащие в основе патогенеза ХМПЗ, связаны с дефектами генов, которые кодируют белки, ответственные за нормальное поддержание миелопоэза. Для всех ХМПЗ характерна аномальная тирозинкиназная активность.
Белок JAK2 принадлежит семейству нерецепторных тирозинкиназ (Janus-киназ), которое включает в себя четыре белка: JAK1, JAK2, JAK3 и TYK2. Для гемопоэза особое значение среди них имеет киназа JAK2, которая осуществляет передачу сигнала не только от эритропоэтина, но и от тромбопоэтина и колониестимулирующего фактора гранулоцитов (G-CSF). Функция белков JAK заключается в том, что они служат промежуточным звеном между рецепторами на мембране клетки и сигнальными молекулами (цитокинами, факторами роста и пр.). Эти молекулы, связываясь с рецепторами JAK-киназ на поверхности клетки, активируют их, что приводит к активации сигнальных путей с участием ряда белков, которые передают сигналы для транскрипции, пролиферации и дифференцировки бластных предшественников.
При появлении соматической мутации1 JAK2 (1849G/T (617V/F)) эти сигналы активируются автономно, независимо от связывания цитокина со своим рецептором, что приводит к избыточной пролиферации того или иного ростка клеток.
Ген JAK2 расположен в локусе 9р24.1. Соматическая мутация 1849G/T (617V/F) выражается в замене нуклеотида G→T в позиции 1849 (четырнадцатый экзон), которая в свою очередь приводит к замене фенилаланина (F) на валин (V) в 617 позиции аминокислотной последовательности белка.
JAK2 1849G/T (617V/F) является соматической мутацией, возникающей в гемопоэтических клетках-предшественницах. Она встречается у подавляющего большинства больных ХМПЗ, что делает эту мутацию очень удобным диагностическим маркером. Наличие точечной мутации JAK2 1849G/T (617V/F) – феномен, характерный исключительно для поражений миелоидного ростка, и не описан ни для солидных опухолей, ни для опухолей лимфоидного происхождения.
______________________________________________ 1Мутация 1849G/T (617V/F) является соматической, т. е.:- Возникает у человека спонтанно, а не передается по наследству от родителей.
- Мутантный аллель выявляется в основном в виде гетерозиготного генотипа.
- Возможно возникновение мутации через несколько лет после проведения данного анализа, следовательно, при необходимости целесообразно повторное проведение анализа.
Таблица 1. Молекулярные аномалии, связанные с «классическими» миелопролиферативными заболеваниями
| Генетическая аномалия | Нозология | Частота, % |
| JAK2 1849G/T (617V/F) | Истинная полицитемия | > 95 |
| Эссенциальная тромбоцитемия | 50-70 | |
| Первичный миелофиброз | 40-50 |
Мутация JAK2 1849G/T (617V/F) – диагностический маркер, при помощи которого можно проводить первичную и дифференциальную диагностику ХМПЗ, а также молекулярный мониторинг минимальной остаточной болезни (количественный тест).
Алгоритм проведения молекулярной диагностики МПЗ (рис. 1)

Определение химерного онкогена BCR/ABL позволяет провести дифференциальный анализ хронического миелоидного лейкоза (ХМЛ) и Ph’-негативных МПЗ. Если в случае Ph’-негативных МПЗ мутация JAK2 1849G/T (617V/F) не найдена, то в случае ИП следует осуществить поиск мутаций в двенадцатом экзоне гена JAK2, а в случае ЭТ и ИМФ – мутаций MPL W515L/K. В случае отрицательного результата следует исключить возможность наследственных дефектов генов VHL, EPO-R, PHD2, THPO, MPL и генов глобинов. При редких видах МПЗ, негативных по JAK2 V617F, целесообразно осуществить поиск химерных онкотирозинкиназ.
Сейчас молекулярное исследование входит в диагностические критерии ВОЗ 2008 г., а тест на наличие мутации JAK2 стал стандартным методом диагностики ХМПЗ. Выявление мутации указывает на наличие клонального ХМПЗ и исключает возможность реактивного эритроцитоза, тромбоцитоза или миелофиброза.
Таблица 2. Диагностические критерии ВОЗ для ХМПЗ (2008)
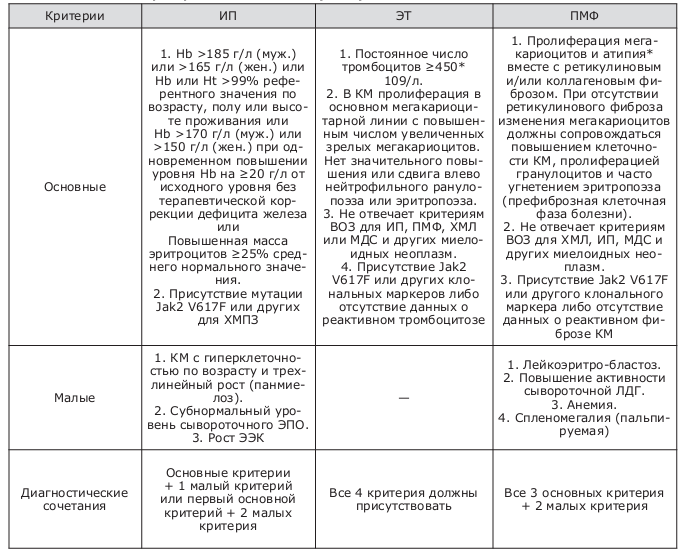
В настоящее время исследование на наличие мутации JAK2 1849G/T (617V/F) – необходимое условие для установления правильного диагноза и определения дальнейшей тактики ведения пациента.
Литература
- Абдулкадыров К.М., Шуваев В.А., Мартынкевич И.С. Критерии диагностики и современные методы лечения первичного миелофиброза. Вестник гематологии. — М. 2013;3(9):44-78.
- Мисюрин А.В. Молекулярный патогенез миелопролиферативных заболеваний. Клиническая онкогематология. — М. 2009;3(2):211-220.
- Саврилова А.М., Костерина А.В., Ахмадеев А.Р. Выявление мутации JAK2 V617F при хронических Ph-негативных заболеваниях. Генетика, Практическая Медицина. Инновационные Технологии в Медицине. — М. 2014;4(14):100-102.
- Материалы фирмы-производителя тест-системы.
Количественное определение соотношения нормального и мутантного аллелей 617V/617F в 14 экзоне гена JAK2
Метод определения Real-Тime PCR.
Исследуемый материал Цельная кровь (с ЭДТА)
Доступен выезд на дом
Диагностический критерий Всемирной организации здравоохранения (ВОЗ) для ХМПЗ. Молекулярно-генетическая диагностика. Количественное определение является важным для оценки ответа больных на терапию, для мониторинга динамики заболевания.
Миелопролиферативные заболевания (МПЗ) – заболевания, характеризующиеся избыточной пролиферацией (выработкой клеток) одного или нескольких ростков кроветворения. Нарушения возникают на уровне стволовых клеток. Классические Ph’-негативные ХМПЗ – группа болезней, включающая в себя эритремию (истинную полицитемию, ИП), эссенциальную тромбоцитемию (ЭТ) и идиопатический миелофиброз (ИМФ). Это хронические лейкозы с поражением на уровне клетки-предшественницы гемопоэза с характерной для опухоли неограниченной пролиферацией этой клетки, потомки которой дифференцируются по всем росткам кроветворения. При этом для эритремии свойственно преобладание красного ростка, для эссенциальной тромбоцитемии – мегакариоцитов и тромбоцитов. Классические ХМПЗ и некоторые другие менее распространенные миелопролиферативные заболевания чаще всего являются приобретенными, спорадическими нарушениями гемопоэза.
Молекулярные события, лежащие в основе патогенеза ХМПЗ, связаны с дефектами генов, которые кодируют белки, ответственные за нормальное поддержание миелопоэза. Для всех ХМПЗ характерна аномальная тирозинкиназная активность.
Белок JAK2 принадлежит семейству нерецепторных тирозинкиназ (Janus-киназ), которое включает в себя четыре белка: JAK1, JAK2, JAK3 и TYK2. Для гемопоэза особое значение среди них имеет киназа JAK2, которая осуществляет передачу сигнала не только от эритропоэтина, но и от тромбопоэтина и колониестимулирующего фактора гранулоцитов (G-CSF). Функция белков JAK заключается в том, что они служат промежуточным звеном между рецепторами на мембране клетки и сигнальными молекулами (цитокинами, факторами роста и пр.). Эти молекулы, связываясь с рецепторами JAK-киназ на поверхности клетки, активируют их, что приводит к активации сигнальных путей с участием ряда белков, которые передают сигналы для транскрипции, пролиферации и дифференцировки бластных предшественников.
При появлении соматической мутации1 JAK2 (1849G/T (617V/F)) эти сигналы активируются автономно, независимо от связывания цитокина со своим рецептором, что приводит к избыточной пролиферации того или иного ростка клеток.
Ген JAK2 расположен в локусе 9р24.1. Соматическая мутация 1849G/T (617V/F) выражается в замене нуклеотида G→T в позиции 1849 (четырнадцатый экзон), которая в свою очередь приводит к замене фенилаланина (F) на валин (V) в 617 позиции аминокислотной последовательности белка.
JAK2 1849G/T (617V/F) является соматической мутацией, возникающей в гемопоэтических клетках-предшественницах. Она встречается у подавляющего большинства больных ХМПЗ, что делает эту мутацию очень удобным диагностическим маркером. Наличие точечной мутации JAK2 1849G/T (617V/F) – феномен, характерный исключительно для поражений миелоидного ростка, и не описан ни для солидных опухолей, ни для опухолей лимфоидного происхождения.
______________________________________________ 1Мутация 1849G/T (617V/F) является соматической, т. е.:- Возникает у человека спонтанно, а не передается по наследству от родителей.
- Мутантный аллель выявляется в основном в виде гетерозиготного генотипа.
- Возможно возникновение мутации через несколько лет после проведения данного анализа, следовательно, при необходимости целесообразно повторное проведение анализа.
Таблица 1. Молекулярные аномалии, связанные с «классическими» миелопролиферативными заболеваниями
| Генетическая аномалия | Нозология | Частота, % |
| JAK2 1849G/T (617V/F) | Истинная полицитемия | > 95 |
| Эссенциальная тромбоцитемия | 50-70 | |
| Первичный миелофиброз | 40-50 |
Мутация JAK2 1849G/T (617V/F) – диагностический маркер, при помощи которого можно проводить первичную и дифференциальную диагностику ХМПЗ, а также молекулярный мониторинг минимальной остаточной болезни (количественный тест).
Алгоритм проведения молекулярной диагностики МПЗ (рис. 1)

Определение химерного онкогена BCR/ABL позволяет провести дифференциальный анализ хронического миелоидного лейкоза (ХМЛ) и Ph’-негативных МПЗ. Если в случае Ph’-негативных МПЗ мутация JAK2 1849G/T (617V/F) не найдена, то в случае ИП следует осуществить поиск мутаций в двенадцатом экзоне гена JAK2, а в случае ЭТ и ИМФ – мутаций MPL W515L/K. В случае отрицательного результата следует исключить возможность наследственных дефектов генов VHL, EPO-R, PHD2, THPO, MPL и генов глобинов. При редких видах МПЗ, негативных по JAK2 V617F, целесообразно осуществить поиск химерных онкотирозинкиназ.
Сейчас молекулярное исследование входит в диагностические критерии ВОЗ 2008 г., а тест на наличие мутации JAK2 стал стандартным методом диагностики ХМПЗ. Выявление мутации указывает на наличие клонального ХМПЗ и исключает возможность реактивного эритроцитоза, тромбоцитоза или миелофиброза.
Таблица 2. Диагностические критерии ВОЗ для ХМПЗ (2008)

В настоящее время исследование на наличие мутации JAK2 1849G/T (617V/F) – необходимое условие для установления правильного диагноза и определения дальнейшей тактики ведения пациента.
Литература
- Абдулкадыров К.М., Шуваев В.А., Мартынкевич И.С. Критерии диагностики и современные методы лечения первичного миелофиброза. Вестник гематологии. — М. 2013;3(9):44-78.
- Мисюрин А.В. Молекулярный патогенез миелопролиферативных заболеваний. Клиническая онкогематология. — М. 2009;3(2):211-220.
- Саврилова А.М., Костерина А.В., Ахмадеев А.Р. Выявление мутации JAK2 V617F при хронических Ph-негативных заболеваниях. Генетика, Практическая Медицина. Инновационные Технологии в Медицине. — М. 2014;4(14):100-102.
- Материалы фирмы-производителя тест-системы.
Сдать анализ СОЭ (Cкорость Оседания Эритроцитов, ESR)
Метод определения См. в описании.Важно! Результаты, полученные методами Панченкова и Вестергрена, совпадают в области нормальных значений, в зоне повышенных значений результаты, полученные методом Вестергрена обычно выше, чем полученные методом Панченкова.
Исследуемый материал Смотрите в описании
Доступен выезд на дом
Неспецифический показатель, отражающий изменения белкового состава плазмы крови. В основном, используется для диагностики воспалительных состояний и мониторинга их течения. Классический принцип измерения СОЭ заключается в том, что, при помещении определенного объема крови, смешанного с цитратом натрия, в вертикально стоящую пробирку или капилляр, эритроциты под влиянием силы тяжести будут оседать вниз, тогда как силы отталкивания, возникающие между отрицательно заряженными мембранами эритроцитов, будут этому оседанию препятствовать. Величина СОЭ измеряется как высота столбика плазмы над форменными элементами, образовавшегося за 1 час. Соответственно, единицы измерения СОЭ – миллиметры в час (мм/час). При появлении в плазме крови большого количества белков острой фазы воспаления, к которым относят фибриноген, С-реактивный белок, альфа- и гамма-глобулины и др., или парапротеинов, сила отталкивания между эритроцитами снижается, и эритроциты оседают быстрее. На скорость оседания эритроцитов также оказывают влияние их морфология (пойкилоцитоз эритроцитов исследуемой пробы приводит к занижению СОЭ, сглаживание формы эритроцитов, напротив, может СОЭ ускорять), а также величина гематокрита (снижение гематокрита приводит к завышению СОЭ). При острых воспалительных заболеваниях СОЭ обычно повышается спустя сутки после начала заболевания, тогда как нормализация этого показателя после выздоровления происходит медленнее, и может занять от нескольких дней до двух, и более, недель. Также в современной лабораторной практике применяются модифицированные методики измерения СОЭ, позволяющие ускорить и автоматизировать выполнение этого теста. С помощью математического алгоритма результаты, полученные этими методами, приводятся к шкалам классических методов (по Вестергрену и по Панченкову), и так же выдаются в привычных единицах, мм/час. В ИНВИТРО для выполнения исследования СОЭ используется три методики: СОЭ из венозной крови в ИНВИТРО выполняют из отдельных пробирок с цитратом натрия, с использованием автоматического анализатора СОЭ SRS II (Greiner Bio-One, Австрия). В тех случаях, когда это невозможно, исследование может быть выполнено микрометодом (TEST1, Alifax, Италия) или по Панченкову из ЭДТА-стабилизированной крови.
Сравнение методов определения СОЭ, используемых в ИНВИТРО
| Название метода | Принцип | Анализатор/ручная методика | Шкала |
| СОЭ по Вестергрену | Измерение высоты столбика плазмы над форменными элементами | SRS II | 0 – 200 мм/час |
| СОЭ по Панченкову | Измерение высоты столбика плазмы над форменными элементами | Ручная методика | 0 – 100 мм/час |
| Микрометод | Измерение скорости агрегации эритроцитов в проточной камере | TEST1 | 0 – 200 мм/час |
Из капиллярной крови в ИНВИТРО СОЭ выполняют только по методу Панченкова (шкала измерения – 100 мм). В любом случае, методика, по которой было проведено исследование, указывается при выдаче результата.
Исследуемый материал:
Венозная кровь – отдельная пробирка с цитратом / ЭДТА-стабилизированная цельная кровь.
Капиллярная кровь – цельная кровь, стабилизированная ЭДТА.
