Коагуляционный (вторичный) гемостаз — Мегаобучалка
Лекция
Тема: «Нарушение свертывание крови у хирургических больных и методы ее коррекции»
Система гемостаза
Гемостаз — это сложный процесс, который предотвращает или останавливает истечение крови из просвета сосуда, обеспечивает возникновение свертка фибрина, необходимого для восстановления целостности ткани, и, наконец, удаляет фибрин, когда нужда в нем отпадает. В этом процессе участвуют три основных физиологических механизма:
— сосудисто-тромбоцитарный (первичный) гемостаз
— коагуляционный (вторичный) гемостаз – внешний, внутренний и общий путь
— фибринолиз
Механизмы гемостаза запускаются при повреждении эндотелия (травмы, операции, другие патологические процессы), когда кровь вступает в контакт с соединительной тканью субэндотелиального слоя.
Сосудисто-тромбоцитарный (первичный) гемостаз
Под сосудисто-тромбоцитарным (первичным) гемостазом понимают прекращение или уменьшение кровопотери за счет сокращения (спазма) травмированного сосуда и образования тромбоцитного агрегата в зоне повреждения сосуда.
Данные реакции в совокупности обеспечивают полную остановку кровотечения из капилляров и венул, но кровопотеря из вен, артериол и артерий прекращается лишь частично. Это обусловлено тем, что кровь в них движется под относительно высоким давлением, и поэтому рыхлая структура тромбоцитного агрегата не образует непроницаемую преграду для истечения крови. Кроме того, цепь гемостатических реакций не заканчивается образованием «тромбоцитной пробки». То есть, первичный гемостаз является лишь первым этапом в остановке кровотечения. Этот процесс начинается в первые секунды после повреждения и играет ведущую роль в остановке кровотечения из капилляров, мелких артериол и венул.
Важнейшие этапы сосудисто-тромбоцитарного гемостаза:
— повреждение эндотелия
— адгезия тромбоцитов
— активация и дегрануляция тромбоцитов
— агрегация тромбоцитов
— выделение БАВ
— формирование тромбоцитарного сгустка
Нарушения на любом из этих этапов могут привести к кровоточивости.
Адгезия тромбоцитов
Адгезия тромбоцитов — это прилипание тромбоцитов к компонентам субэндотелия (в частности, к коллагену).
Адгезия тромбоцитов осуществляется путем связывания гликопротеинов мембран тромбоцитов с коллагеном при посредстве комплекса фактора свертывания VIII.
Описаны врожденные формы кровоточивости, обусловленные нарушениями адгезии тромбоцитов. Они отмечаются при дефиците гликопротеина мембран тромбоцитов (болезнь Бернара-Сулье), недоразвитии субэндотелия (болезнь Рандю-Ослера) и дефиците одного из компонентов комплекса фактора VIII, а именно, фактора Виллебранда ( болезнь Виллебранда).
Адгезия тромбоцитов к волокнам коллагена происходит в первые секунды после повреждения. Стабилизация образовавшегося соединения фактором Виллебранда не позволяет току крови смывать тромбоциты. В результате адгезии тромбоциты активируются и выбрасывают ряд активных веществ.
Активация тромбоцитов
При перерезке или разрыве сосуда становится возможным контакт тромбоцитов с субэндотелиальными структурами стенки сосуда (коллаген, микрофибриллы), способными активировать тромбоциты. Активация тромбоцитов приводит к изменению дисковидной формы тромбоцитов на сферическую, образованию у них отростков (псевдоподий тромбоцитов) и адгезии тромбоцитов к субэндотелиальным структурам, в частности к коллагену.
Результатом активации являются также начальная агрегация тромбоцитов и высвобождение из них ряда веществ, служащих сильными стимуляторами тромбоцитов (АДФ, серотонин, адреналин, простагландины, тромбоксан А2).
Агрегация тромбоцитов
Агрегация тромбоцитов — склеивание (слипание) тромбоцитов между собой под действием специфических стимуляторов.
Реакция освобождения тромбоцитов приводит к выделению из них индукторов агрегации (АДФ, серотонин, адреналин, простагландины, тромбоксан А2). Наряду со стимуляторами, попадающими в кровоток из поврежденных тканей и других форменных элементов крови, они вызывают агрегацию других тромбоцитов, которые быстро покидают кровоток и оседают на уже адгезировавших и начавших агрегировать тромбоцитах. Образуется тромбоцитный агрегат.
Коагуляционный (вторичный) гемостаз
Протекает в течение нескольких минут и представляет собой каскад реакций между плазменными белками, заканчивающийся образованием нитей фибрина. Благодаря этому останавливается кровотечение из крупных сосудов и предотвращается его возобновление через несколько часов или суток.
В процессе вторичного гемостаза на основе тромбоцитного агрегата формируется сгусток крови, который на завершающей стадии гемостаза подвергается самопроизвольному сжатию (ретракция сгустка крови). Таким образом, первичная или временная гемостатическая пробка, представляющая собой рыхлый тромбоцитный агрегат, превращается во вторичную или окончательную гемостатическую пробку, в которой тромбоцитный агрегат консолидируется фибрином и подвергается дополнительному уплотнению в процессе спонтанного сокращения сгустка крови. Вторичный или окончательный гемостаз обеспечивает полную остановку кровотечения из вен, артериол и артерий.
Процесс свертывания можно разделить на несколько реакций, которые завершаются образованием тромбина в количестве, достаточном для превращения части фибриногена в фибрин.
Каждая из этих реакций представляет собой образование активной протеазы из ее предшественника путем протеолиза; все они идут на фосфолипидных мембранах, требуют присутствия Са2+ и кофакторов.
Существует два механизма активации каскада свертывания: внутренний и внешний.
— Внутренний механизм активации каскада начинается с контакта факторов свертывания с коллагеном в месте повреждения стенки сосуда.
— Внешний механизм запускается тканевыми факторами (гликопротеинами).
— После активации фактора Х(Ха) внутренний и внешний механизмы становятся единим механизмом. Фактор Ха превращает протромбин в тромбин, благодаря тромбину фибриноген превращается в фибрин. Образуется сгусток крови, затем происходит его ретракция, результат – закупорка дефекта сосудистой стенки.
За исключением тромбопластина, фактора VIII и ионов кальция все остальные факторы свертывания крови синтезируются в печени.
Стадии коагуляционного гемостаза:
— Выделение тканевого тромбопластина (внешний путь) и контакт эндотелия с IX фактором (внутренний путь) с последующей активацией X фактора (общий путь.
— Переход протромбина в тромбин.
— Превращение фибриногена в фибрин.
Сосудисто-тромбоцитарный и коагуляционный гемостаз тесно связаны друг с другом. Так, активированные тромбоциты ускоряют процесс свертывания, а продукты свертывания (например, тромбин) активируют тромбоциты.
Фибринолиз
Сразу после образования фибринового тромба начинается его разрушение – фибринолиз. Восстановление проходимости сосуда обеспечивается за счет лизиса свертков фибрина и действия антитромбина III, который нейтрализует некоторые протеазы каскада свертывания. Фибринолиз зависит от плазмина, который получается из его предшественника — плазменного белка плазминогена. Плазмин лизирует фибрин.
Сегодня известно три активатора фибринолиза:
— фрагменты фактора XII;
— урокиназа;
— тканевый активатор плазминогена.
Из них наиболее важны последние два. Эти вещества выходят из эндотелиальных клеток и превращают адсорбированный на нитях фибрина плазминоген в плазмин. К средствам, угнетающим фибринолиз, относят аминокапроновую кислоту и апротинин (контрикал, гордокс).
Первичный гемостаз, этапы сосудисто-тромбоцитарного гемостаза
Человеческий организм — чрезвычайно сложная конструкция, в ней имеется множество разнообразных взаимосвязанных между собой биологических систем, каждая из которых отвечает за жизненно важный элемент этой самой конструкции.
Для примера рассмотрим систему гемостаза. Ее предназначение — в сохранении крови в состоянии жидкости. Но если в результате травмы стенок сосуда возникнет кровотечение — система гемостаза немедленно отреагирует и направит свою работу на остановку кровотечения.
После успешного ее завершения система гемостаза создаст условия для растворения тромбов — они уже выполнили свою работу и более не должны находиться в кровеносной системе.
Содержание
- Что такое первичный гемостаз
- Этапы сосудисто-тромбоцитарного гемостаза
- Вторичный (коагуляционный) гемостаз
- Исследование гемостаза
Что такое первичный гемостаз
Клетки крови, которые отвечают за функцию свертывания:
- тромбоциты,
- плазменные факторы свертывания и их ингибиторы.
За процесс гемостаза отвечают такие структурные компоненты:
- Стенки кровеносных сосудов
- Кровяные клетки
- Плазменно-ферментные системы
Гемостаз представляет собой нераздельно совмещенные системы. Его работа осуществляется под воздействием нейрогуморального регулирования. В этой системе безупречно работают механизмы отрицательной и положительной связи, именно это дает возможность быстрого создания сгустка, и после — моментального его растворения.
Неразрывно совмещены между собой работа внутренней оболочки кровеносных сосудов и тромбоцитов, они вместе создают механизм который зовется — первичный сосудисто-тромбоцитарный гемостаз.
Первичный тромбоцитарный гемостаз являет собою ряд реакций, главная функция которых заключается в том чтобы уменьшить или прекратить кровопотерю. Первичный гемостаз отвечает за остановку крови сразу после ушиба капилляров, в течение первых двух-трёх минут.
Этапы сосудисто-тромбоцитарного гемостаза
Сосудисто-тромбоцитарный гемостаз подразделяют на следующие этапы. Первой реакцией сосуда на повреждение является спазм, продолжительность которого не превышает 1 минуту, а сужение просвета сосуда может достигать трети его изначального диаметра.
На сегодня медицина не имеет однозначного мнения по поводу механизма спазма сосуда. Предполагается, что он — результат нейрогенного воздействия, сопровождающегося выделением серотонина и тромбоксана из тромбоцитов, которые были активированы.
Процесс адгезии реализуется в результате приобретения стенкой сосуда положительного заряда. Поскольку заряд тромбоцитов отрицателен, то они скапливаются вблизи точки ранения. Их форма изменяется, они приобретают удлиненную форму и контактируют с соединительными тканями стенок сосудов.
Далее происходит агрегация тромбоцитов.
Она разделена на несколько фаз:
- Обратная — заключающаяся в образовании неплотного тромбоцитарного сгустка, на этот процесс оказывают влияние физиологически активные вещества. Плазма свободно проникает сквозь образовавшийся сгусток.
- На фазе необратимой агрегации происходит образование плотного гомогенного тромбоцитарного сгустка более крупных размеров. Наступление этой фазы связано с освобождением содержимого тромбоцитарных гранул. Отличительная характеристика сгустка — неспособность пропускать плазму.
Далее происходит уплотнение тромба, образованного тромбоцитами.
Нарушения в течении упомянутых стадий может закончиться возникновением кровотечения.
Нарушение баланса в выработке тромбоцитов грозит развитием заболеваний и патологических состояний, в частности — если тромбоцитов слишком мало, то о качественной адгезии говорить не приходится, ведь компоненты для склеивания отсутствуют.
Адгезия формирует тромб, который, даже при довольно сильном потоке крови, не даст погибнуть человеку. Но когда количество тромбоцитов слишком большое они могут увеличиваться в размере, отрываться и перемещаться по кровеносным сосудам, это очень нежелательное и опасное явление.
К сожалению, бывают патологии, при которых факт тромбообразования совсем нежелателен — он может нарушить процесс питания жизненно важных органов (при инсульте, инфаркте миокарда). Агрегация испытывает патологические изменения, медикам приходится разрабатывать схему применения различных лекарственных средств.
Выделение биологически активных веществ, происходит при освобождении тромбоцитов:
- АДФ
- Серотонин
- Адреналин
- Простагландины
- Тромбоксаны А2
Эти вещества стимулируют агрегацию остальных тромбоцитов, которые мгновенно выходят из кровотока, а потом фиксируются на агрегированных тромбоцитах, в следствии формируется тромбоцитный агрегат.
Вторичный (коагуляционный) гемостаз
Связь между первичным и вторичным гемостазом просматривается достаточно четко. Коагуляционный гемостаз длится пару минут, по сути является реакцией, происходящей между плазменными белками, в результате которой происходит формирование фибриновых нитей. Этот процесс приводит к прекращению кровотечения из поврежденного сосуда и предотвращает возобновление кровотечения по истечению некоторого времени.
Далее происходит сжатие кровяного сгустка, образованного в результате вторичного гемостаза, т.е. происходит ретракция. Завершается процесс образованием гемостатической пробки, которая в результате сокращения кровяного сгустка приобретает большую плотность. Наступает полная остановка кровотечения.
Ряд реакций которые происходят при свертывании ведут к окончанию создания тромбина и его количества вполне достаточно для того чтобы часть фибриногена преобразовалась в фибрин.
Вторичный гемостаз может активироваться двумя механизмами.
Внешний
Происходит когда в кровь попадает тканевый тромбопластин. Началом этого процесса является контакт коллагена с фактором свертывания на месте травмированного сосуда.
Внутренний
Когда из внешней среды не попадает тромбоплатин, этот процесс запускают тканевые факторы.
Когда начинает действовать внешний механизм, то фактор ІІІ начинает взаимодействовать с фактором VII и тут же начинает активироваться фактор Х. Уже активированный фактор Х совместно с фактором V (это фосфолипидный фактор) вырабатывают протромбин.
А при действии внутреннего механизма начинают работать факторы ХІІ, ХІ, ІХ, VIII, вместе с факторами X, V которые принимают участие и у внешнем механизме. Данный механизм начинает действовать, когда изменяется состояние сосудистой стеки.
В момент прикосновения крови до поврежденной части сосуда начинает активизироваться фактор ХІІ, который в свою очередь начинает переводить в активное состояние фактор ХІ. В активном состоянии он воздействует на фактор ІХ и такая сцепная активация всех факторов способствует образованию тромбокиназы.
Внутренний и внешний механизмы неразрывно связанны между собою. Такую связь обеспечивают калликреины кинины, они являют собою белковые вещества.
Тромбин образовывается на второй фазе, путем расщепления молекул протромбиназа на части, одна из этих частей с помощью фактора Ха превращается в тромбин.
Третья фаза заключается в том, что образовывается фибрин который есть основою сгустка. Фактор ХІІІа приводит к стабилизации молекул фибрина и участвует в образовании глютамин-лизиновых связей между молекулами фибрина.
На четвертой фазе (посткоагуляционной) происходят процессы уплотнения, сжатия и растворения сгустка.
Как только фибриновый тромб образовался сразу же начинается такой процесс как фибринолиз – во время которого растворяется тромб и сгустки крови.
Свертывание крови работает очень слаженно, даже небольшая частица факторов свертывания мгновенно образует активную форму. Именно это не позволяет тромбу распространиться за область поврежденной части сосуда.
Для организма очень важна слаженная работа этого процесса потому что способность свертывания 1 миллилитра крови может привести к свертыванию за 15 секунд всего фибриногена, который есть в организме.
Исследование гемостаза
Когда проводят оценку свертываемости крови, в обязательном порядке собирают анамнез, больному могут задать ряд вопросов таких как:
- Были ли у пациента случаи переливания крови?
- Сталкивался ли пациент с необъяснимо сильными кровотечениями при хирургических вмешательствах?
- Возможно были у больного кровотечения при небольших операциях?
- Били ли неожиданные кровоизлияния?
- Страдал ли кто-то из родственников такой проблемой?
Перед тем как собрать анамнез медики исследуют пациента на наличие различных заболеваний, которые могли повлиять на процесс гемостаза.
Исследование гемостаза в лаборатории заключается в изучении количества тромбоцитов. Тромбоцитопения — это понижение уровня тромбоцитов.
Причинами ее возникновения могут бить:
- Инфекции
- Миелодисплазия
- Радиация
- Дефицит В12
- Миелопролиферативное заболевание
Спонтанно могут возникнуть если кровь содержит много тромбоцитов. Они могут возникнуть и когда функция тромбоцитов работает не правильно, изъяны тромбоцитов оценивают при исследовании агрегации.
К веществам которые подавляют функцию тромбоцитов относят:
- Гепарин
- Аспирин
- Алкоголь
- НПВС
- Употребление в больших количествах пенициллина
В большинстве случаев ухудшению функций тромбоцитов способствуют совмещение употребления аспирина и алкоголя одновременно. После употребления всех выше перечисленных веществ должно пройти как минимум двадцать четыре часа чтобы функция тромбоцитов возобновилась.
Возобновление тромбоцитов происходит ежедневно, в пределах от двадцати до тридцати процентов, он если говорить про воздействие аспирина то следует помнить, что аспирин ухудшает функции тромбоцитов навсегда.
В ходе исследования системы гемостаза особое внимание уделяют процессу образования тромбов. Повышение уровня тромбоцитов исследуют смотря на разные отрасли в медицине. Эмбология тромбов может стать причиной большого количества мозговых импульсов, инфаркт миокарда может случиться в случаи тромбозов коронарных сосудов.
Также может возникнуть угроза ампутации нижней конечности при закупорке основных артерий конечностей. Некроз кишечника случается в случае когда у больного появляется венозный и артериальный тромбоз в артериальных сосудах.
Более наглядно о первичном гемостазе — на видео:
Коагуляционный (вторичный) гемостаз
Протекает в течение нескольких минут и представляет собой каскад реакций между плазменными белками, заканчивающийся образованием нитей фибрина. Благодаря этому останавливается кровотечение из крупных сосудов и предотвращается его возобновление через несколько часов или суток.
В процессе вторичного гемостаза на основе тромбоцитного агрегата формируется сгусток крови, который на завершающей стадии гемостаза подвергается самопроизвольному сжатию (ретракция сгустка крови). Таким образом, первичная или временная гемостатическая пробка, представляющая собой рыхлый тромбоцитный агрегат, превращается во вторичную или окончательную гемостатическую пробку, в которой тромбоцитный агрегат консолидируется фибрином и подвергается дополнительному уплотнению в процессе спонтанного сокращения сгустка крови. Вторичный или окончательный гемостаз обеспечивает полную остановку кровотечения из вен, артериол и артерий.
Процесс свертывания можно разделить на несколько реакций, которые завершаются образованием тромбина в количестве, достаточном для превращения части фибриногена в фибрин.
Каждая из этих реакций представляет собой образование активной протеазы из ее предшественника путем протеолиза; все они идут на фосфолипидных мембранах, требуют присутствия Са2+ и кофакторов.
Существует два механизма активации каскада свертывания: внутренний и внешний.
— Внутренний механизм активации каскада начинается с контакта факторов свертывания с коллагеном в месте повреждения стенки сосуда.
— Внешний механизм запускается тканевыми факторами (гликопротеинами).
— После активации фактора Х(Ха) внутренний и внешний механизмы становятся единим механизмом. Фактор Ха превращает протромбин в тромбин, благодаря тромбину фибриноген превращается в фибрин. Образуется сгусток крови, затем происходит его ретракция, результат – закупорка дефекта сосудистой стенки.
За исключением тромбопластина, фактора VIII и ионов кальция все остальные факторы свертывания крови синтезируются в печени.
Стадии коагуляционного гемостаза:
— Выделение тканевого тромбопластина (внешний путь) и контакт эндотелия с IX фактором (внутренний путь) с последующей активацией X фактора (общий путь.
— Переход протромбина в тромбин.
— Превращение фибриногена в фибрин.
Сосудисто-тромбоцитарный и коагуляционный гемостаз тесно связаны друг с другом. Так, активированные тромбоциты ускоряют процесс свертывания, а продукты свертывания (например, тромбин) активируют тромбоциты.
Фибринолиз
Сразу после образования фибринового тромба начинается его разрушение – фибринолиз. Восстановление проходимости сосуда обеспечивается за счет лизиса свертков фибрина и действия антитромбина III, который нейтрализует некоторые протеазы каскада свертывания. Фибринолиз зависит от плазмина, который получается из его предшественника — плазменного белка плазминогена. Плазмин лизирует фибрин.
Сегодня известно три активатора фибринолиза:
— фрагменты фактора XII;
— урокиназа;
— тканевый активатор плазминогена.
Из них наиболее важны последние два. Эти вещества выходят из эндотелиальных клеток и превращают адсорбированный на нитях фибрина плазминоген в плазмин. К средствам, угнетающим фибринолиз, относят аминокапроновую кислоту и апротинин (контрикал, гордокс).
Механизм первичного гемостаза.
При травме сосудистой стенки оголяется коллаген, имеющий положительный заряд, на границе тромбоцит-сосудистая стенка образуется потенциал, способствующий прилипанию тромбоцитов и эритроцитов к эндотелию и субэндотелиальным структурам (адгезия тромбоцитов). Под влиянием АДФ, который выделяется из поврежденного сосуда, наступает агрегация тромбоцитов по 3 и более клеток как у места поврежденного сосуда, так и в кровотоке. При электронной микроскопии видно, как тромбоциты при этом меняют дискоидную форму на сферическую, одновременно выбрасывая псевдоподии.
Агрегация тромбоцитов сопровождается также процессом агглютинации, т.е. склеиванием тромбоцитов между собой.
Одновременно с прохождением адгезии, агрегации, агглютинации из тромбоцитов высвобождаются тромбоцитарные факторы, поступающие в кровоток, серотонин, адреналин которые усиливают сокращение сосудистой стенки, и АДФ, усиливающий агрегацию тромбоцитов. Это реакция освобождения первого порядка. В начале агрегация обратима, а затем под влиянием небольших доз тромбина, образующегося в зоне повреждения, она становится необратимой.
Вазоконстрикция сосуда первоначально связана, очевидно, с влиянием нервной симпатической системы, а затем поддерживается, главным образом, серотонином и другими биологически активными веществами.
Спазм сосуда значительно уменьшает объем вытекаемой крови и обычно продолжается 1-3 минуты при повреждении мелких сосудов. За это время образуется белый тромбоцитарный тромб. Необратимая агрегация тромбоцитов сопровождается реакцией освобождения 2-ого порядка: высвобождаются гидролазы, АДФ в высоких концентрациях и вазоактивные вещества, а так же фибринектин и фактор Виллебранда. Под воздействием этих веществ в крови и формируется белый или тромбоцитарный тромб. После образования первичного тромба полностью блокируется кровотечение из сосудов микроциркуляции.
Для нормального функционирования первичного гемостаза необходимо, чтобы сосудистая стенка и тромбоциты были функционально полноценными, устойчивыми к нагрузкам.
Основным субстратом мембраны эндотелия является гиалуроновая кислота, разрушение которой ферментом гиалуронидазой или недостаточный синтез способствует повышению сосудистой проницаемости и выходу эритроцитов за пределы сосудистой стенки. В синтезе гиалуроновой кислоты принимают участие аскорбиновая кислота, рутин, глюконат кальция, глюкокортикоиды. Активность гиалуронидазы частично повышается при СКВ, слеродермии тяжелых заболеваниях почек, ревматизме, дерматомиозите, что приводит к появлению петехиальных кровоизлияний.
При тромбоцитопениях и тромбоцитопатиях нарушается первичный гемостаз, адгезия и агрегация тромбоцитов, проницаемость сосудистой стенки, в результате появляются носовые, десневые, маточные и другие кровотечения, а так же геморрагии на коже и слизистых.
Вторичный гемостаз (плазменная ферментная система свертывания крови).
Первичный гемостаз не может обеспечить остановку кровотечения из макрососудов и сосудов среднего калибра. Под давлением крови кровотечение будет продолжаться. Первичный тромб рыхлый и не в состоянии закрыть просвет крупных сосудов. На базе тромбоцитарного тромба в результате взаимодействия плазменных факторов формируется окончательный кровяной тромб или фибриновый сгусток, способствующий остановке кровотечения. Образование фибринового сгустка является результатом каскада ферментативных реакций, которые приводят к образованию фибрина из фибриногена (фибрин не растворим в плазме).
Наука, изучающая процесс свертывания крови, называется коагулологией, а при изучении и первичного гемостаза – гемостазиологией.
44. Система вторичного (гемокоагуляционного) гемостаза, стадии, механизмы действия плазменных факторов.
Под термином «гемостаз» понимают комплекс реакций, направленных на остановку кровотечения при травме сосудов. Значение системы гемостаза намного сложнее и шире. Факторы гемостаза принимают участие в сохранении жидкого состояния крови, регуляции транскапиллярного обмена, резистентности сосудистой стенки, влияют на интенсивность репаративных процессов и др.
По современным представлениям, в остановке кровотечения задействовано два механизма:
1) первичный гемостаз (сосудисто-тромбоцитарный), в котором принимают участие стенки сосудов, тромбоциты и отчасти эритроциты; 2) вторичный гемостаз, когда в процесс свертывания крови включаются белки плазмы крови (плазменные факторы свертывания крови). Следует отметить, что деление гемостаза на клеточные и плазменные является условным, так как в организме эти два звена свертывающей системы крови тесно связаны.
Процесс свертывания крови
При повреждении крупных кровеносных сосудов (артерий, вен, артериол), также происходит образование тромбоцитарной пробки, но она неспособна остановить кровотечение, так как легко вымывается током крови. Основное значение в этом процессе принадлежит свертыванию крови, сопровождающемуся в конечном итоге образованием плотного фибринового сгустка.
Плазменные и клеточные факторы свертывания крови
В свертывании крови принимает участие комплекс белков, находящихся в плазме (плазменные факторы гемокоагуляции), большинство из которых является проферментами. В отличие от тромбоцитарных факторов они обозначаются римскими цифрами.
Механизм свертывания крови
Процесс свертывания крови представляет собой преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свертывания крови. Подобная активация может носить последовательный и ретроградный характер.
Процесс свертывания крови может быть разделен на три фазы: первая включает комплекс последовательных реакций, приводящих к образованию протромбиназы, во вторую фазу осуществляется переход протромбина (фактор II) в тромбин (фактор IIа) и в третью фазу из фибриногена образуется фибрин.
Первая фаза фаза активации— образование протромбиназы может происходить по внешнему и внутреннему механизму. Внешний механизм предполагает обязательное присутствие тромбопластина (фактор III), внутренний же связан с участием тромбоцитов (фактор Р3) или разрушенных эритроцитов. Вместе с тем внутренний и внешний пути образования протромбиназы имеют много общего, так как активируются одними и теми же факторами (фактор ХIIа, калликреин, ВМК и др.), а также приводят в конечном итоге к появлению одного и того же активного фермента — фактора Ха, выполняющего функции протромбиназы. При этом и полный, и частичный тромбопластин служат матрицами, на которых в присутствии ионов Са2+ развертываются ферментативные реакции.
Формирование протромбиназы по внешнему пути начинается с активации фактора VII при его взаимодействии с тромбопластином и фактором ХIIа. Кроме того, фактор VII может переходить в деятельное состояние под влиянием факторов XIa, IXa, Ха, IIа и калликреина. В свою очередь фактор VIIa не только переводит фактор X в Ха (ведет к появлению протромбиназы), но и активирует фактор IX, участвующий в образовании протромбиназы по внутреннему механизму.
Образование протромбиназы по внешнему пути происходит чрезвычайно быстро (за 20—30 с), ведет к появлению небольших порций тромбина (IIа), который способствует необратимой агрегации тромбоцитов, активации факторов VIII и V и значительно ускоряет формирование протромбиназы по внутреннему механизму. Инициатором внутреннего механизма образования протромбиназы является фактор XII, который активируется травмированной поверхностью стенки сосуда, кожей, коллагеном, адреналином, в лабораторных условиях — при контакте со стеклом, после чего переводит фактор XI в XIa. В этой реакции может принимать участие калликреин (активируется фактором ХIIа) и ВМК (активируется калликреином). Фактор XIa оказывает непосредственное влияние на фактор IX, переводя его в фактор IXa. Специфическая деятельность последнего направлена на протеолиз фактора X и протекает при обязательном участии фактора VIII (или VIIIa).
Следует заметить, что активация фактора X под влиянием комплекса факторов VIII и IXa получила название теназной реакции.
Вторая фаза процесса свертывания крови фаза коагуляции — переход фактора II в фактор IIа осуществляется под влиянием протромбиназы (фактор Ха) в присутствии фактора V (Va) и сводится к протеолитическому расщеплению протромбина, благодаря чему появляется фермент тромбин, обладающий свертывающей активностью.
Третья стадия процесса свертывания крови фаза ретракции — переход фибриногена в фибрин — носит этапный характер. Под влиянием фактора IIа от фибриногена отщепляются фибринопептиды и образуется фибрин-мономер (фактор Im). Из него благодаря процессу полимеризации формируются олигомеры и димеры фибрина (фактор Iо и Id), из которых за счет продольного и поперечного связывания образуются протофибриллы — легкорастворимый фибрин, или фибрин S, быстро лизирующийся под влиянием протеаз (плазмина, трипсина). В дальнейшем в процесс образования фибрина вмешивается фактор XIII (фибриназа, фибринстабилизирующий фактор), который после активации тромбином в присутствии ионов Са2+ «прошивает» фибринполимеры дополнительными перекрестными связями, в результате чего появляется труднорастворимый фибрин, или фибрин i (insoluble). В результате этой реакции сгусток становится резистентным к фибринолитическим (протеолитическим) агентам и плохо поддается разрушению.
Последняя стадия — лизис (растворение) тромба. Это также многоступенчатый процесс, в котором протекают ферментативные взаимодействия многих веществ, в конечном итоге приводящих к появлению активного фермента — фибринолизина. Фибринолизин разрушает связи между нитями фибрина и переводит его вновь в нерастворимый фибриноген. В настоящее время принято говорить о существовании самостоятельной фибринолитической системы организма. Конечно, эти процессы в организме протекают значительно сложнее, и в них принимают участие гораздо большее число факторов.
45.
Внешний путь активации свёртывания крови
Основным путём активации свёртывания крови in vivo считается внешний путь. Компоненты этого пути следующие: тканевой фактор (ТФ, фактор III, тканевая тромбокиназа, тканевой тромбопластин), его ингибитор (ингибитор пути тканевого фактора, ИПТФ) и плазменный фактор VII. Тканевой фактор представляет собой внутренний мембранный гликопротеин, имеющийся во многих клетках; он не поступает в кровь до тех пор, пока не образуются протеазы или не произойдёт повреждение клеток in vivo. Тканевой фактор функционирует в качестве кофактора/рецептора, который в присутствии ионов кальция активирует фактор VII. Активация фактор VII приводит к открытию его активного серинового центра. Активация фактора VII может также происходить за счёт незначительного протеолитического действия других сериновых протеаз (тромбина, ФXIIa, ФIXa, и ФXa), а также за счёт самоактивации, однако самоактивация in vivo идёт незначительно. Комплекс ТФ/ФVIIa/Ca 2+ действует на два субстрата: фактор X (запуск общего пути) и ФIX (фактор внутреннего пути).
Внутренний путь активации свёртывания крови
Компонентами внутреннего пути являются факторы XII, XI, IX, XIII, кофакторы – высокомолекулярный кининоген (ВМК) и прекалликреин (ПК), а также их ингибиторы.
Внутренний путь запускается при повреждении эндотелия, когда обнажается отрицательно заряженная поверхность (например, коллаген) в пределах сосудистой стенки. Контактируя с такой поверхностью, активируется ФXII (образуется ФXIIa). Фактор XIIa активирует ФXI и превращает прекалликреин (ПК) в калликреин, который активирует фактор XII (петля положительной обратной связи). Механизм взаимной активации ФXII и ПК отличается большей быстротой по сравнению с механизмом самоактивации ФXII, что обеспечивает многократное усиление системы активации. Фактор XI и ПК связываются с активирующей поверхностью посредством высокомолекулярного кининогена (ВМК). Без ВМК активации обоих проферментов не происходит. Связанный ВМК может расщепляться калликреином (К) или связанным с поверхностью ФXIIa и инициировать взаимную активацию систем ПК-ФXII.
Фактор XIa активирует фактор IX. Фактор IX может также активироваться под действием комплекса ФVIIa/ФIII (перекрёст с каскадом внешнего пути), причём считается, что in vivo это доминирующий механизм. Активированный ФIXa требует наличия кальция и кофактора (ФVIII), для прикрепления к тромбоцитарному фосфолипиду и превращения фактора X в фактор Xa (переход с внутреннего на общий путь). Фактор VIII действует в качестве мощного ускорителя завершающей ферментативной реакции.
Фактор VIII, который также называют антигемофильным фактором, кодируется большим геном, расположенным на конце X-хромосомы. Он активируется под действием тромбина (основной активатор), а также факторов IXa и Xa. ФVIII циркулирует в крови, будучи связанным с фактором фон Виллебранда (ФВ) – большим гликопротеином, продуцируемым эндотелиальными клетками и мегакариоцитами . ФВ служит внутрисосудистым белком-носителем для ФVIII. Связывание ФВ с ФVIII стабилизирует молекулу ФVIII, увеличивает её период полусуществования внутри сосуда и способствует её транспорту к месту повреждения. Однако чтобы активированный фактор VIII мог проявить свою кофакторную активность, он должен отсоединиться от ФВ. Воздействие тромбина на комплекс ФVIII/ФВ приводит к отделению ФVIII от несущего протеина и расщеплению на тяжёлую и лёгкую цепи ФVIII, которые важны для коагулянтной активность ФVIII.
последовательность процессов, оценка состояния системы вторичного гемостаза.
Ферментативная теория свертывания. Первая теория, объясняющая процесс свертывания крови работой специальных ферментов, была разработана в 1902 г. русским ученым Шмидтом. Он считал, что свертывание протекает в две фазы. В первую фазу один из белков плазмы протромбин под влиянием освобождающихся из разрушенных при травме клеток крови, особенно тромбоцитов, ферментов (тромбокиназы) и ионов Са переходит в фермент тромбин. На второй стадии под влиянием фермента тромбина растворенный в крови фибриноген превращается в нерастворимый фибрин, который и заставляет кровь свертываться. В последние годы жизни Шмидт стал выделять в процессе гемокоагуляции уже 3 фазы: 1- образование тромбокиназы, 2- образование тромбина. 3- образование фибрина.
Дальнейшее изучение механизмов свертывания показало, что это представление весьма схематично и не полностью отражает весь процесс. Основное заключается в том, что в организме отсутствует активная тромбокиназа, т.е. фермент, способный превратить протромбин в тромбин (по новой номенклатуре ферментов этот следует называть протромбиназой). Оказалось, что процесс образования протромбиназы очень сложен, в нем участвует целый ряд т.н. тромбогенных белков-ферментов, или тромбогенных факторов, которые, взаимодействуя в каскадном процессе, все необходимы для того, чтобы свертывание крови осуществилось нормально. Кроме того, было обнаружено, что процесс свертывания не кончается образованием фибрина, ибо одновременно начинается его разрушение. Таким образом, современная схема свертывания крови значительно сложнее Шмидтовой.
Современная схема свертывания крови включает в себя 5 фаз, последовательно сменяющих друг друга.
Фазы эти следующие: образование протромбиназы, образование тромбина, образование фибрина, полимеризация фибрина и организация сгустка, фибринолиз.
Современная схема гемостаза. Цепная реакция свертывания крови начинается с момента соприкосновения крови с шероховатой поверхностью раненного сосуда или тканью. Это вызывает активацию тромбопластических факторов плазмы и затем происходит поэтапное образование двух отчетливо различающихся по своим свойствам протромбиназ — кровяной и тканевой..
Однако прежде, чем закончится цепная реакция образования протромбиназы, в месте повреждения сосуда происходят процессы, связанные с участием тромбоцитов (т.н. сосудисто-тромбоцитарный гемостаз). Тромбоциты за счет своей способности к адгезии налипают на поврежденный участок сосуда, налипают друг на друга, склеиваясь тромбоцитарным фибриногеном. Все это приводит к образованию т.н. пластинчатого тромба («тромбоцитарный гемостатический гвоздь Гайема»). Адгезия тромбоцитов происходит за счет АДФ, выделяющейся из эндотелия и эритроцитов. Этот процесс активируется коллагеном стенки, серотонином, XIII фактором и продуктами контактной активации. Сначала (в течение 1-2 минут) кровь еще проходит через эту рыхлую пробку, но затем происходит т.н. вискозное перерождение тромба, он уплотняется и кровотечение останавливается. Понятно что такой конец событий возможен только при ранении мелких сосудов, там, где артериальное давление не в состоянии выдавить этот «гвоздь».
1 фаза свертывания. В ходе первой фазы свертывания, фазе образования протромбиназы, различают два процесса, которые протекают с разной скоростью и имеют различное значение. Это — процесс образования кровяной протромбиназы, и процесс образования тканевой протромбиназы. Длительность 1 фазы составляет 3-4 минуты. однако, на образование тканевой протромбиназы тратится всего 3-6 секунд. Количество образующейся тканевой протромбиназы очень мало, ее недостаточно для перевода протромбина в тромбин, однако тканевая протромбиназа выполняет роль активатора целого ряда факторов, необходимых для быстрого образования кровяной протромбиназы. В частности, тканевая протромбиназа приводит к образованию малого количества тромбина, который переводит в активное состояние V и VIII факторы внутреннего звена коагуляции. Каскад реакций, заканчивающихся образованием тканевой протромбиназы (внешний механизм гемокоагуляции), выглядит следующим образом:
1. Контакт разрушенных тканей с кровью и активация III фактора — тромбопластина.
2. III фактор переводит VII в VIIa (проконвертин в конвертин).
3.Образуется комплекс (Ca++ + III + VIIIa)
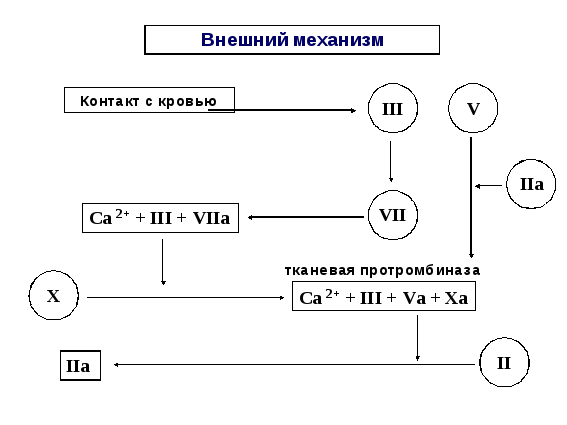
Рис. 17. Внешний механизм образования протромбназы в первую фазу гемокоагуляции.
4. Этот комплекс активирует небольшое количество Х фактора — Х переходит в Ха.
5. (Хa + III + Va + Ca) образуют комплекс, который и обладает всеми свойствами тканевой протромбиназы. Наличие Va (VI) связано с тем, что в крови всегда есть следы тромбина, который активирует V фактор.
6. Образовавшееся небольшое количество тканевой протромбиназы переводит небольшое количество протромбина в тромбин.
7. Тромбин активирует достаточное количество V и VIII факторов, необходимых для образования кровяной протромбиназы.
В случае выключения этого каскада (например, если со всею предосторожностью с использованием парафинированных игл, взять кровь из вены, предотвратив ее контакт с тканями и с шероховатой поверхностью, и поместить ее в парафинированную пробирку), кровь свертывается очень медленно, в течение 20-25 минут и дольше.
Ну, а в норме одновременно с уже описанным процессом запускается и другой каскад реакций, связанных с действием плазменных факторов, и заканчивающийся образованием кровяной протромбиназы в количестве, достаточном для перевода большого количества протромбина с тромбин. Реакции эти следующие ( внутренний механизм гемокоагуляции):
 Рис.
18. Внутренний механизм образовании
протромбиназы в первую фазу гемокоагуляции.
Рис.
18. Внутренний механизм образовании
протромбиназы в первую фазу гемокоагуляции.
1. Контакт с шероховатой или чужеродной поверхностью приводит к активации XII фактора : XII — XIIa. Одновременно начинает образовываться гемостатический гвоздь Гайема (сосудисто-тромбоцитарный гемостаз).
2.Активный ХII фактор превращает XI в активное состояние и образуется новый комплекс XIIa +Ca++ +XIa + III(ф3)
3. Под влиянием указанного комплекса IX фактор активизируется и образуется комплекс IXa + Va + Cа++ +III(ф3).
4. Под влиянием этого комплекса происходит активация значительного количества Х фактора, после чего в большом количестве образуется последний комплекс факторов: Xa + Va + Ca++ + III(ф3), который и носит название кровяная протромбиназа. а весь этот процесс затрачивается в норме около 4-5 минут, после чего свертывание переходит в следующую фазу.
2 фаза свертывания — фаза образования тромбина заключается в том, что под влиянием фермента протромбиназы II фактор (протромбин) переходит в активное состояние (IIa). Это протеолитический процесс, молекула протромбина расщепляется на две половинки. Образовавшийся тромбин идет на реализацию следующей фазы, а также используется в крови для активации все большего количества акцелерина (V и VI факторов). Это пример системы с положительной обратной связью. Фаза образования тромбина продолжается несколько секунд.
3 фаза свертывания — фаза образования фибрина — тоже ферментативный процесс, в результате которого от фибриногена благодаря воздействию протеолитического фермента тромбина отщепляется кусок в несколько аминокислот, а остаток носит название фибрин-мономер, который по своим свойствам резко отличается от фибриногена. В частности, он способен к полимеризации. Это соединение обозначается как Im.
4 фаза свертывания — полимеризация фибрина и организация сгустка. Она тоже имеет несколько стадий. Вначале за несколько секунд под влиянием рН крови, температуры, ионного состава плазмы происходит образование длинных нитей фибрин-полимера Is который, однако, еще не очень стабилен, так как способен растворяться в растворах мочевины. Поэтому на следующей стадии под действием фибрин-стабилизатора Лаки-Лоранда (XIII фактора) происходит окончательная стабилизация фибрина и превращение его в фибрин Ij. Он выпадает из раствора в виде длинных нитей, которые образуют сетку в крови, в ячейках которой застревают клетки. Кровь из жидкого состояния переходит в желеобразное (свертывается). Следующей стадией этой фазы является длящаяся достаточно долго (несколько минут) ретракия (уплотнение) сгустка, которая происходит за счет сокращения нитей фибрина под действием ретрактозима (тромбостенина). В результате сгусток становится плотным, из него выжимается сыворотка, а сам сгусток превращается в плотную пробку, перекрывающую сосуд — тромб.
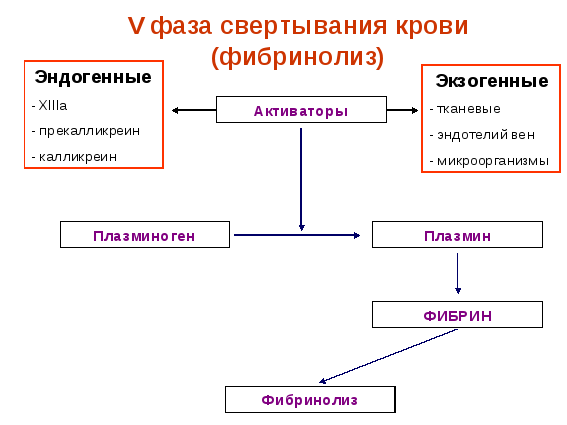
Рис. 19. Схема образования плазмина и фибринолиз
5 фаза свертывания — фибринолиз. Фибринолиз — это процесс растворения фибрина. Хотя он фактически не связан с образованием тромба, фибринолиз считают послефазой гемокоагуляции, так как в ходе его происходит ограничение тромба только той зоной, где он действительно необходим. Если тромб полностью закрыл просвет сосуда, то в ходе этой фазы этот просвет восстанавливается (происходит реканализация тромба). Практически фибринолиз всегда идет параллельно с образованием фибрина, предотвращая генерализацию свертывания и ограничивая процесс.
Растворение фибрина обеспечивается протеолитическим ферментом плазмином (фибринолизином) который содержится в плазме в неактивном состоянии в виде плазминогена (профибринолизина). Переход плазминогена в активное состояние осуществляется специальным активатором, который в свою очередь образуется из неактивных предшественников (проактиваторов), высвобождающихся из тканей, стенок сосудов, клеток крови, особенно тромбоцитов. В процессах перевода проактиваторов и активаторов плазминогена в активное состояние большую роль играют кислые и щелочные фосфатазы крови, трипсин клеток, тканевые лизокиназы, кинины, реакция среды, XII фактор. Плазмин расщепляет фибрин на отдельные полипептиды, которые затем утилизируются организмом.
Фибринолиз, как и процесс свертывания крови, может протекать по внешнему и внутреннему механизму (пути). Внешний механизм активации фибринолиза осуществляется при участии тканевых активаторов, которые синтезируются главным образом в эндотелии сосудов. К ним относятся тканевый активатор плазминогена (ТАП) и урокиназа. Последняя также образуется в юкстагломеруляриом комплексе почки. Внутренний механизм активации фибринолиза осуществляется плазменными активаторами, а также активаторами форменных элементов крови — лейкоцитов, тромбоцитов и эритроцитов и разделяется на Хагеман-зависимый и Хагеман-независимый. Хагеман-зависимый фибринолиз протекает под влиянием факторов XIIа и калликреина, которые переводят плазминоген в плазмин. Хагеман-независимый фибринолиз осуществляется наиболее быстро и носит срочный характер. Его основное назначение сводится к очищению сосудистого русла от нестабилизированного фибрина, образующегося в процессе внутрисосудистого свертывания крови.
В плазме находятся и ингибиторы фибринолиза. Важнейшими из них являются α2-антиплазмин, связывающий плазмин, трипсин, калликреин, урокиназу, ТАП и, следовательно, вмешивающийся в процесс фибринолиза как на ранних, так и на поздних стадиях. Сильным ингибитором плазмина служит α1-протеазный ингибитор. Кроме того, фибринолиз тормозится α2-макроглобулином, C1-протеазным ингибитором, а также рядом ингибиторов активатора плазминогена, синтезируемых эндотелием, макрофагами, моноцитами и фибробластами.
Фибринолитическая активность крови во многом определяется соотношением активаторов и ингибиторов фибринолиза. При ускорении свертывания крови и одновременном торможении фибринолиза создаются благоприятные условия для развития тромбозов, эмболии и ДВС-синдрома. Наряду с ферментативным фибринолизом, по мнению профессора Б. А. Кудряшова, существует так называемый неферментативный фибринолиз, который обусловлен комплексными соединениями естественного антикоагулянта гепарина с ферментами и гормонами. Неферментативный фибринолиз приводит к расщеплению нестабилизированного фибрина, очищая сосудистое русло от фибрин-мономеров и фибрина s (Fs).
Антикоагулянты. Несмотря на то, что в циркулирующей крови имеются все факторы, необходимые для образования тромба, в естественных условиях при наличии целостности сосудов кровь остается жидкой. Это обусловлено наличием в кровотоке противосвертывающих веществ, получивших название естественных антикоагулянтов, или фибринолитического звена системы гемостаза.
Естественные антикоагулянты делят на первичные и вторичные. Первичные антикоагулянты всегда присутствуют в циркулирующей крови, вторичные — образуются в результате протеолитического расщепления факторов свертывания крови в процессе образования и растворения фибринового сгустка.
Первичные антикоагулянты можно разделить на три основные группы: 1) антитромбопластины — обладающие антитромбопластическим и антипротромбиназным действием; 2) антитромбины — связывающие тромбин; 3) ингибиторы самосборки фибрина — дающие переход фибриногена в фибрин. Следует заметить, что при снижении концентрации первичных естественных антикоагулянтов создаются благоприятные условия для развития тромбозов и ДВС-синдрома.
К вторичным антикоагулянтам относят «отработанные» факторы свертывания крови (принявшие участие в свертывании) и продукты деградации фибриногена и фибрина (ПДФ), обладающие мощным антиагрегационным и противосвертывающим действием, а также стимулирующие фибринолиз. Роль вторичных антикоагулянтов сводится к ограничению внутрисосудистого свертывания крови и распространения тромба по сосудам.
Основные естественные антикоагулянты
Первичные антикоагулянты | |
Антитромбин III | γ2-Глобулин. Синтезируется в печени. Прогрессивно действующий ингибитор тромбине, факторов Ха, IXa, XIa, ХIIa, калликреина и в меньшей степени — плазмина и трипсина. Плазменный кофактор гепарина |
Гепарин | Сульфатированный полисахарид. Трансформирует антитромбин III из прогрессивного в антикоагулянт немедленного действия, значительно повышая его активность. Образует с тромбогенными белками и гормонами комплексы, обладающие антикоагулянтным и неферментным фибринолитическим действием |
α2-Антиплазмин | Белок. Ингибирует действие плазмина, трипсина, химотрипсина, калликреина, фактора Ха, урокиназы |
α2-Макроглобулин | Прогрессивный ингибитор тромбина, калликреина, плазмина и трипсина |
α2-Антитрипсин | Ингибитор тромбина, трипсина и плазмина |
C1-эстеразный ингибитор | α2-Нейроаминогликопротеид. Инактивирует калликреин, предотвращая его действие на кининоген, факторы ХIIа, IXa, XIa и плазмин |
Липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ) | Ингибирует комплекс тромбопластин—фактор VII, инактивирует фактор Ха |
Аполипопротеин А-11 | Ингибирует комплекс тромбопластин—фактор VII |
Протеин С | Витамин К-зависимый белок. Образуется в печени и в эндотелии. Обладает свойствами сериновой протеазы. Вместе с протеином S связывает факторы Va и VIIIa и активирует фибринолиз |
Протеин S | Витамин К-зависимый белок, образуется эндотелиальными клетками. Усиливает действие протеина С |
Тромбомодулин | Кофактор протеина С, связывается с фактором IIa Образуется эндотелиальными клетками |
Вторичные антикоагулянты (образуются в процессе протеолиза — при свертывании крови, фибринолизе и т. д.) | |
Антитромбин I | Фибрин. Адсорбирует и инактивирует тромбин |
Продукты деградации протромбина Р, R, Q и др. | Ингибируют факторы Ха, Va |
Фибринопептиды | Продукты протеолиза фибриногена тромбином; ингибируют фактор IIа |
Продукты деградации фибриногена и фибрина | Нарушают полимеризацию фибрин-мономера, блокируют фибриноген и фибрин-мономер (образуют с ними комплексы), ингибируют факторы ХIа, IIа, фибринолиз и агрегацию тромбоцитов |
В естественных условиях фибринолитическая активность крови находится в зависимости от депо плазминогена, плазменного активатора, от условий, обеспечивающих процессы активации, и от поступления этих веществ в кровь. Спонтанная активность плазминогена в здоровом организме наблюдается при состоянии возбуждения, после инъекции адреналина, при физических напряжениях и при состояниях, связанных с шоком. Среди искусственных блокаторов фибринолитической активности крови особое место занимает гамма аминокапроновая кислота (ГАМК). В норме в плазме содержится количество ингибиторов плазмина, превышающее в 10 раз уровень запасов плазминогена в крови.
Состояние процессов гемокоагуляции и относительное постоянство или динамическое равновесие факторов свертывания и антисвертывания связано с функциональным состоянием органов системы гемокоагуляции (костного мозга, печени, селезенки, легких, сосудистой стенки). Деятельность последних, а следовательно, и состояние процесса гемокоагуляции, регулируется нервно-гуморальными механизмами. В кровеносных сосудах имеются специальные рецепторы, воспринимающих концентрацию тромбина и плазмина. Эти два вещества и программируют деятельность указанных систем.
Регуляция процессов гемокоагуляции и антигоагуляции. Установлено, что при острой кровопотере, гипоксии, интенсивной мышечной работе, болевом раздражении, стрессе свертывание крови значительно ускоряется, что может привести к появлению фибрин-мономеров и даже фибрина s в сосудистом русле. Однако благодаря одновременной активации фибринолиза, носящего защитный характер, появляющиеся сгустки фибрина быстро растворяются и не наносят вреда здоровому организму.
Ускорение свертывания крови и усиление фибринолиза при всех перечисленных состояниях обусловлены повышением тонуса симпатической части автономной нервной системы и поступлением в кровоток адреналина и норадреналина. При этом активируется фактор Хагемана, что приводит к запуску внешнего и внутреннего механизма образования протромбиназы, а также стимуляции Хагеман-зависимого фибринолиза. Кроме того, под влиянием адреналина усиливается образование апопротеина III — составной части тромбопластина, и наблюдается отрыв клеточных мембран от эндотелия, обладающих свойствами тромбопластина, что способствует резкому ускорению свертывания крови. Из эндотелия также выделяются ТАП и урокиназа, приводящие к стимуляции фибринолиза
.В случае повышения тонуса парасимпатической части автономной нервной системы (раздражение блуждающего нерва, введение АХ, пилокарпина) также наблюдаются ускорение свертывания крови и стимуляция фибринолиза. В этих условиях происходит выброс тромбопластина и активаторов плазминогена из эндотелия сердца и сосудов. Следовательно, основным эфферентным регулятором свертывания крови и фибринолиза является сосудистая стенка. Напомним также, что в эндотелии сосудов синтезируется Pgl2, препятствующий в кровотоке адгезии и агрегации тромбоцитов. Вместе с тем развивающаяся гиперкоагуляция может смениться гипокоагуляцией, которая в естественных условиях носит вторичный характер и обусловлена расходом (потреблением) тромбоцитов и плазменных факторов свертывания крови, образованием вторичных антикоагулянтов, а также рефлекторным выбросом в сосудистое русло в ответ на появление фактора IIа, гепарина и антитромбина III.
При многих заболеваниях, сопровождающихся разрушением эритроцитов, лейкоцитов, тромбоцитов и тканей, развивается ДВС-синдром, значительно отягощающий течение патологического процесса и даже приводящий к смерти больного. В настоящее время ДВС-синдром обнаружен более чем при 100 различных заболеваниях. Особенно часто он возникает при переливании несовместимой крови, обширных травмах, отморожениях, ожогах, длительных оперативных вмешательствах на легких, печени, сердце, предстательной железе, всех видах шока, краш-синдроме (длительное сдавление конечностей), а также в акушерской практике при попадании в кровоток матери околоплодных вод, насыщенных тромбопластином плацентарного происхождения. При этом возникает гиперкоагуляция, которая из-за интенсивного потребления тромбоцитов, фибриногена, факторов V, VIII, XIII и др. в результате интенсивного внутрисосудистого свертывания крови сменяется вторичной гипокоагуляцией вплоть до полной неспособности крови к образованию фибриновых сгустков, что приводит к трудно поддающимся терапии кровотечениям. Знание основ физиологии гемостаза позволяет клиницисту избрать оптимальные варианты борьбы с заболеваниями, сопровождающимися тромбозами, эмболиями, ДВС-синдромом и повышенной кровоточивостью.
Рефлекторные влияния. Важное место среди многих раздражителей, падающих на организм, занимает болевое раздражение. Боль приводит к изменению деятельности почти всех органов и систем, в том числе и системы свертывания. Кратковременное или длительное болевое раздражение ведет к ускорению свертывания крови, сопровождаемое тромбоцитозом. Присоединение к боли чувства страха приводит к еще более резкому ускорению свертывания. Болевое раздражение, нанесенное анестезированному участку кожи, не вызывает ускорения свертывания. Такой эффект наблюдается с первого дня рождения.
Большое значение имеет продолжительность болевого раздражения. При кратковременной боли сдвиги менее выражены и возврат к норме совершается в 2-3 раза быстрей, чем при длительном раздражении. Это дает основание полагать, что в первом случае принимает участие лишь рефлекторный механизм, а при длительном болевом раздражении включается и гуморальное звено, обусловливая продолжительность наступающих изменений. Большинство ученых полагает, что таким гуморальным звеном при болевом раздражении является адреналин.
Значительное ускорение свертывания крови происходит рефлекторно также при действии на организм тепла и холода. После прекращения теплового раздражения период восстановления до исходного уровня в 6-8 раз короче, чем после холодового.
Свертывание крови является компонентом ориентировочной реакции. Изменение внешней среды, неожиданное появление нового раздражителя вызывают ориентировочную реакцию и одновременно ускорение свертывания крови, что является биологически целесообразной защитной реакцией.
Эндокринная система и свертывание. Эндокринные железы являются важным активным звеном механизма регуляции свертывания крови. Под влиянием гормонов процессы свертывания крови претерпевают ряд изменений, а гемокоагуляция либо ускоряется, либо замедляется. Если сгруппировать гормоны по их действию на свертывание крови, то к ускоряющим свертывание будут относиться АКТГ, СТГ, адреналин, кортизон, тестостерон, прогестерон, экстракты задней доли гипофиза, эпифиза и зобной железы; замедляют свертывание тиреотропный гормон, тироксин и эстрогены.
Во всех приспособительных реакциях, в особенности протекающих с мобилизацией защитных сил организма, в поддержании относительного постоянства внутренней среды вообще и системы свертывания крови, в частности, гипофизарно-анреналовая система является важнейшим звеном нейрогуморального механизма регуляции.
Имеется значительное количество данных, свидетельствующих о наличии влияния коры головного мозга на свертывание крови. Так, свертывание крови изменяется при повреждении полушарий головного мозга, при шоке, наркозе, эпилептическом припадке. Особый интерес представляют изменения скорости свертывания крови в гипнозе, когда человеку внушают, что он ранен, и в это время свертываемость возрастает так: как будто это происходит в действительности.
Противосвертывающая система крови. Еще в 1904 году известный немецкий ученый Моравиц впервые высказал предположение о наличие в организме противосвертывающей системы, которая сохраняет кровь в жидком состоянии, а также о том, что свертывающая и антисвертывающая системы, находятся в состоянии динамического равновесия. Позже эти предположения подтвердились в лаборатории, возглавляемой профессором Кудряшовым. В 30-е годы был получен тромбин, который вводился крысам с целью вызвать свертывание крови в сосудах. Оказалось, что кровь в этом случае вообще перестала свертываться. Значит, тромбин активизировал какую-то систему, которая препятствует свертыванию крови в сосудах. На основании этого наблюдения Кудряшов пришел к выводу о наличии противосвертывающей системы.
Под противосвертывающей системой следует понимать совокупность органов и тканей, которые синтезируют и утилизируют группу факторов, обеспечивающих жидкое состояние крови, то есть препятствующих свертыванию крови в сосудах. К таким органам и тканям относятся сосудистая система, печень, некоторые клетки крови и др. Эти органы и ткани вырабатывают вещества, которые получили на звание ингибиторов свертывания крови или естественных антикоагулянтов. Они вырабатываются в организме постоянно, в отличие от искусственных, которые вводятся при лечении претромбических состояний.
Ингибиторы свертывания крови действуют по фазам. Предполагается, что механизм их действия заключается либо в разрушении, либо в связывании факторов свертывания крови.
В 1 фазе в качестве антикоагулянтов срабатывают: гепарин (универсальный ингибитор) и антипротромбиназы.
Во 2 фазе срабатывают ингибиторы тромбина: фибриноген, фибрин с продуктами своего распада — полипептиды, продукты гидролиза тромбина, протромбин 1 и II, гепарин и естественный антитромбин 3, который относится к группе глюкозоаминогликанов.
При некоторых патологических состояниях, например, заболевания сердечно — сосудистой системы, в организме появляются дополнительные ингибиторы.
Наконец, имеет место ферментативный фибринолиз, ( фибринолити-ческая система) протекающий в 3 фазы. Так, если в организме много образуется фибрина или тромбина, то моментально включается фибринолитическая система и происходит гидролиз фибрина. Большое значение в сохранении жидкого состояния крови имеет неферментативный фибринолиз.
По Кудряшову различают две противосвертывающие системы:
Первая имеет гуморальную природу. Она срабатывает постоянно, осуществляя выброс всех уже перечисленных антикоагулянтов, исключая гепарин. Вторая — аварийная противосвертывающая система, которая обусловлена нервными механизмами, связанными с функциями определенных нервных центров. Когда в крови накапливается угрожающее количество фибрина или тромбина, происходит раздражение соответствующих рецепторов, что через нервные центры активизирует противосвертывающую систему.
Свертывающая и антисвертывающая системы взаимосвязаны, находятся под контролем как нервных, так и гуморальных механизмов.
Можно предположить, что существует функциональная система, обеспечивающая свертывание крови, которая состоит из воспринимающего звена, представленного специальными хеморецепторами, заложенными в сосудистых рефлексогенных зонах (дуга аорты и синокаротидная зона), которые улавливают факторы, обеспечивающие свертывание крови. Второе звено функциональной системы — это механизмы регуляции. К ним относятся нервный центр, получающий информацию с рефлексогенных зон. Эксперименты над животными показывают, что при раздражении задней части гипоталамуса имеет место чаще гиперкоагуляция, а при раздражении передней части — гипокоагуляция.
Как работает функциональная система поддержания жидкого состояния крови? Если концентрация каких — либо факторов обеспечивающих процесс свертывания крови, возрастает или падает, то это воспринимается хеморецепторами. Информация от них идет в центр регуляции свертывания крови, а затем на органы — исполнители, и по принципу обратной связи их выработка или тормозится или увеличивается.
Воспринимающее звено этой функциональной системы находится в сосудистых рефлексогенных зонах и представлено специфическими хеморецепторами, улавливающими концентрацию антикоагулянтов. Второе звено представлено нервным центром противосвертывающей системы. По данным Кудряшова, он находится в продолговатом мозге, что доказывается рядом экспериментов. Если, например, выключить его такими веществами, как аминозин, метилтиурацил и другими, то кровь начинает свертываться в сосудах. К исполнительным звеньям относятся органы, синтезирующие антикоагулянты. Это сосудистая стенка, печень, клетки крови. Срабатывает функциональная система, препятствующая свертыванию крови следующим образом: много антикоагулянтов — их синтез тормозится, мало — возрастает (принцип обратной связи).
Механизм первичного гемостаза.
⇐ ПредыдущаяСтр 2 из 7Следующая ⇒При травме сосудистой стенки оголяется коллаген, имеющий положительный заряд, на границе тромбоцит-сосудистая стенка образуется потенциал, способствующий прилипанию тромбоцитов и эритроцитов к эндотелию и субэндотелиальным структурам (адгезия тромбоцитов). Под влиянием АДФ, который выделяется из поврежденного сосуда, наступает агрегация тромбоцитов по 3 и более клеток как у места поврежденного сосуда, так и в кровотоке. При электронной микроскопии видно, как тромбоциты при этом меняют дискоидную форму на сферическую, одновременно выбрасывая псевдоподии.
Агрегация тромбоцитов сопровождается также процессом агглютинации, т.е. склеиванием тромбоцитов между собой.
Одновременно с прохождением адгезии, агрегации, агглютинации из тромбоцитов высвобождаются тромбоцитарные факторы, поступающие в кровоток, серотонин, адреналин которые усиливают сокращение сосудистой стенки, и АДФ, усиливающий агрегацию тромбоцитов. Это реакция освобождения первого порядка. В начале агрегация обратима, а затем под влиянием небольших доз тромбина, образующегося в зоне повреждения, она становится необратимой.
Вазоконстрикция сосуда первоначально связана, очевидно, с влиянием нервной симпатической системы, а затем поддерживается, главным образом, серотонином и другими биологически активными веществами.
Спазм сосуда значительно уменьшает объем вытекаемой крови и обычно продолжается 1-3 минуты при повреждении мелких сосудов. За это время образуется белый тромбоцитарный тромб. Необратимая агрегация тромбоцитов сопровождается реакцией освобождения 2-ого порядка: высвобождаются гидролазы, АДФ в высоких концентрациях и вазоактивные вещества, а так же фибринектин и фактор Виллебранда. Под воздействием этих веществ в крови и формируется белый или тромбоцитарный тромб. После образования первичного тромба полностью блокируется кровотечение из сосудов микроциркуляции.
Для нормального функционирования первичного гемостаза необходимо, чтобы сосудистая стенка и тромбоциты были функционально полноценными, устойчивыми к нагрузкам.
Основным субстратом мембраны эндотелия является гиалуроновая кислота, разрушение которой ферментом гиалуронидазой или недостаточный синтез способствует повышению сосудистой проницаемости и выходу эритроцитов за пределы сосудистой стенки. В синтезе гиалуроновой кислоты принимают участие аскорбиновая кислота, рутин, глюконат кальция, глюкокортикоиды. Активность гиалуронидазы частично повышается при СКВ, слеродермии тяжелых заболеваниях почек, ревматизме, дерматомиозите, что приводит к появлению петехиальных кровоизлияний.
При тромбоцитопениях и тромбоцитопатиях нарушается первичный гемостаз, адгезия и агрегация тромбоцитов, проницаемость сосудистой стенки, в результате появляются носовые, десневые, маточные и другие кровотечения, а так же геморрагии на коже и слизистых.
Вторичный гемостаз
(плазменная ферментная система свертывания крови).
Первичный гемостаз не может обеспечить остановку кровотечения из макрососудов и сосудов среднего калибра. Под давлением крови кровотечение будет продолжаться. Первичный тромб рыхлый и не в состоянии закрыть просвет крупных сосудов. На базе тромбоцитарного тромба в результате взаимодействия плазменных факторов формируется окончательный кровяной тромб или фибриновый сгусток, способствующий остановке кровотечения. Образование фибринового сгустка является результатом каскада ферментативных реакций, которые приводят к образованию фибрина из фибриногена (фибрин не растворим в плазме).
Наука, изучающая процесс свертывания крови, называется коагулологией, а при изучении и первичного гемостаза – гемостазиологией.
Характеристика плазменных факторов (прокоагулянтов).
Все плазменные факторы свертывания находятся в крови в неактивном состоянии и обозначаются римскими цифрами в порядке их открытия. За исключением фибриногена и протромбина практически все факторы были открыты при сравнении плазмы больных людей, имеющих различные наследственные нарушения свертывания крови, с плазмой здорового человека; и чаще все они названы по фамилии больного, у которого обнаруживали дефицит этого фактора, или реже по фамилии исследователя.
В свертывающую систему входят около 15 веществ (факторов) свертывания, содержащихся в плазме. По своей природе они относятся к белкам. Неотъемлемыми факторами свертывания являются ионы кальция и 3-й тромбоцитарный фактор.
Международный комитет по гемостазу и тромбозу присвоил арабскую нумерацию тромбоцитарным и римскую — плазменным факторам.
Факторы свертывания крови вырабатываются организмом в неактивном состоянии. Если факторы из неактивных (проферментов) становятся активными ферментами, к их обозначению добавляется буква «а» (например, Х — неактивная форма фактора свертывания X, Ха — его активная форма). Если активным действием начинает обладать один из фрагментов фактора, к нему тоже добавляется буква «а». Некоторые факторы свертывания называют по выполняемой ими функции (например, факторы VIII и IX—антигемофильными глобулинами А и В), по фамилиям больных с впервые обнаруженным у них дефицитом соответствующего фактора, например, Х — фактор Стюарта — Прауэр, фактор XII — фактор Хагемана и др.), реже по фамилиям исследователей (фактор XI — фактор Розенталя и др.).
Факторы пронумерованы в порядке их открытия и доказательства роли фактора в гемокоагуляции.
За последнее десятилетие доказана существенная роль в свертывании крови факторов Виллебранда, Флетчера и Фитцжеральда.
Фактор I — фибриноген — гликопротеин с молекулярной массой около 340 000 дальтон, состоящий из 2946 последовательных аминокислот. Молекула фибриногена представляет димер, в каждой единице которого содержатся три полипептидные цепи (М. Blomback, 1973; Р. Gaffney, 1978) — Аa, Вb и g с молекулярной массой соответственно 67 000, 58 000 и 47 000 дальтон, соединенные дисульфидными мостиками. Общая формула молекулы фибриногена: (Аa, Вb и g). Целостность этой молекулы во многом определяется оставшимися дисульфидными связями.
Фактор I в том виде, в каком он вырабатывается паренхиматозными клетками печени и поступает в кровь, называется фибриногеном А, в отличие от фибриногена В, который осаждается из плазмы витамином К (производным b-нафтохинона). Под действием тромбина фибриноген превращается в нерастворимый в крови фибриллярный белок — фибрин, основное вещество (субстрат) тромба (сгустка).
При различных воспалительных процессах уровень фибриногена А в крови повышается. Поэтому фибриноген А иногда называют фибриногеном воспаления. Быстрое увеличение концентрации фибриногена в крови во время воспалительных процессов преимущественно обусловлено ускорением его биосинтеза, а не замедлением скорости распада.
В клинической практике по уровню фибриногена оценивается острота воспалительного процесса (ревмокардита, пневмонии, гепатита, нефрита, лимфогранулематоза и др.).
В результате увеличения концентрации фибриногена в крови резко повышаются СОЭ, вязкость крови, но не усиливается гемокоагуляция. Однако тромбы, образуемые в крови с высоким содержанием фибриногена, значительно плотнее, чем появляющиеся в крови здорового человека. Поэтому они медленнее лизируются фибринолизином. Уменьшением количества фибриногена А ниже 1 г/л иногда обусловлены кровотечения только из-за недостатка фибриногена (гипофибриногенемия).
Гипо- и афибриногенемия (полное отсутствие фибриногена в крови) бывают врожденными и приобретенными. Встречается и дисфибриногенемия — состояние, когда под действием тромбина фибриноген крови не превращается в фибрин вследствие функциональной неполноценности молекулы фибриногена. Тем самым нарушается образование кровяного сгустка и создаются условия для кровоточивости. Приобретенные гипо- и афибриногенемии особенно часто выявляют акушеры и хирурги у больных с развивающимся острым ДВС-синдромом, реже возникновение фибриногенопении связано с тяжелым нарушением функции печени. Фибриноген А не осаждается b-нафтолом, 50 % раствором этанола и протамином в небольших концентрациях.
Фибриноген под влиянием тромбина превращается в фибрин по типу протеолитического дробления молекулы фибриногена. Вначале тромбин отщепляет от молекулы фибриногена пептиды А, образуя дес-А-мономеры фибрина (неполноценные мономеры фибрина). Затем отщепляются пептиды В и возникают дес-АВ-мономеры, или полные мономеры фибрина.
Фибринопептиды А иногда появляются в циркулирующей крови. Их можно определять иммунологически антисыворотками против соответствующего фибринопептида. Отражая наличие в циркулирующей крови тромбина, фибринопептид А в крови свидетельствует и о ранних этапах развития ДВС-синдрома.
Оставшаяся молекула фибриногена — фибрин-мономер, ее формула: (a, b, g)2. Эта молекула приобретает способность соединяться с себе подобными и образовывать фибрин-полимер (a, b, g), который представляет гель (или сгусток). Сборка мономеров фибрина проходит этапы формирования димеров, из которых при продольном и поперечном сшивании образуются полимеры фибрина — протофибриллы, а затем нити фибрина. Этот фибрин растворим в 5—7 М раствора мочевины или в 2 % растворе монохлоруксусной кислоты. Тромб из такого фибрина легко растворяется фибринолизином и потому не может обеспечить полноценный гемостаз. Это нередко бывает причиной кровоточивости и плохого заживления ран. Подобный фибрин называется растворимым (фибрин S, soluble). Полноценным, то есть устойчивым к фибринолизину, он может стать под действием фибриназы (факто pa XIIIa). Фактор XIIIa катализирует формирование g-глютамил-Е-лизиновых мостиков между остатками лизина одного полимера и остатками глютаминовой кислоты другого полимера. Таким путем обеспечиваются ковалентные связи между a- и g-цепями фибрина, придавая структуре фибринового каркаса антипротеазную устойчивость. Образовавшийся фибрин называется нерастворимым фибрином (фибрин I, insoluble). Полимеризация мономеров фибрина до их волокнисто-нитчатой стадии происходит при высокой концентрации этих веществ, как правило, вследствие появления тромбина в большом количестве. Однако уровень тромбина в связи с его нейтрализацией антитромбинами нарастает медленно, и при образовании мономеров фибрина не сразу возникает фибрин-полимер. Поэтому мономеры фибрина формируют короткоцепочечные полимеры мономеров фибрина, не выпадающие в виде нитей, а циркулирующие в крови как растворимые комплексы мономеров фибрина (РКМФ). Мономеры фибрина могут создавать РКМФ и другого рода. Так, мономеры фибрина комплексируются с фибриногеном, фибринопептидами А и В и также образуют циркулирующие РКМФ. Кроме того, мономеры фибрина нередко комплексируются с продуктами деградации фибрина и фибриногена (ПДФ), образуя РКМФ.
Факт обнаружения РКМФ имеет диагностическое значение, так как их наличие свидетельствует об активации свертывания вплоть до появления тромбина и о развитии гиперкоагуляции или ДВС-синдрома. РКМФ [ (фибрин-мономер + фибрин-мономер) • (n— 1), фибрин-мономер + фибриноген, фибрин-мономер + фибринопептид А или фибринопептид В, их более комплексные формы] под действием тромбина сворачиваются, и находящийся в них фибриноген включается в структуру фибринового сгустка (В. Е. Иванов, 1986, 1987).
РКМФ, состоящие из мономеров фибрина с продуктами деградации фибрина и фибриногена — X, Y и, особенно, с фрагментами Е и D, плохо включаются в фибрин. Они представляют заблокированный фибрин-мономер, который выключается из гемостатического процесса. Создается ситуация «заблокированной» гипо- или даже афибриногенемии, нередко сопровождающей ДВС крови. По мнению 3. С. Баркагана (1986), биологический смысл и санационное значение образования РКМФ заключаются в том, что они способствуют поддержанию крови при тромбинемии в жидком состоянии, препятствуют отложению больших масс фибрина в сосудах и уменьшают блокаду микроциркуляции. По данным Р. Gaffney (1982), РКМФ быстрее, чем фибрин-полимер, лизируются плазмином, РКМФ легко взаимодействуют с b-нафтолом, этанолом и протамином и выпадают в осадок. Вот почему результаты определения этого преобразованного под действием тромбина фибриногена и его комплексов используют для диагностики тромбинемии по b-нафтоловой, этаноловой и протаминовой пробам (паракоагу-ляционным тестам). При этом b-нафтоловая и этаноловая пробы больше специфичны для РКМФ, а протаминовая — для РКМФ, представляющих растворимые комплексы мономеров фибрина с ПДФ (В. Е. Иванов, 1986). Под влиянием фибринолизина молекула фибриногена последовательно расщепляется на фрагменты X, Y (ранние продукты деградации фибриногена, ПДФ), D, Е (поздние продукты деградации фибриногена), которые проявляют антикоагулянтные, антиагрегационные и антиполимеризационные свойства.
Такие же продукты деградации образуются и при расщеплении фибрина.
Результаты определения ранних и поздних ПДФ имеют большое значение для оценки фибринолиза и фибриногенолиза, ранней диагностики изменений фибринолитической активности, стадий ДВС-синдромов, дифференциации первичного и вторичного фибринолиза.
Фактор II — протромбин — относится к эуглобулинам. Является гликопротеидом с массой молекулы 72 000—100 000, по другим данным — 65 000.
Под действием протромбиназы образуются a, b, g-тромбины. a-тромбин (масса молекулы 38 000) обладает сильной свертывающей активностью в отношении фибриногена, но быстро нейтрализуется антитромбином III. b-тромбин (масса молекулы около 26 000) резистентен по отношению к гепарину и AT III. g-тромбин не имеет свертывающей активности, но ему присуще эстеразное и фибринолитическое действие (Р. Machowich et al., 1976).
Фактор II адсорбируется на сернокислом барии, гидроокиси алюминия и других адсорбентах. Синтезируется в печени при участии витамина К. Если нарушается функция печени, концентрация протромбина в крови снижается. Резкое снижение протромбина в крови больного инфекционным гепатитом — крайне неблагоприятный признак тяжелого поражения печеночной паренхимы.
Уровень протромбина, или его функция, снижается при эндо- или экзогенной недостаточности витамина К, когда синтезируется неполноценный протромбин (белки PIVKA).
Скорость свертывания крови нарушается лишь при уменьшении концентрации протромбина ниже 40 %.
Повышенный уровень фактора II способствует развитию тромбозов. Как правило, гиперпротромбинемия остается фактором риска, если появляется активная протромбиназа, снижаются активность антитромбина III и гепарина, а также угнетен фибринолиз.
Фактор III — тканевый тромбопластин (неактивная тканевая протромбиназа, апопротеин С—термостабильный липопротеид). Разрушается лишь при 75 °С. Его много в легких, тканях мозга, сердца, кишечника, матки, в эндотелии. У здоровых людей, как правило, тканевый тромбопластин не попадает в циркулирующую кровь в больших количествах. Он, в основном, участвует в локальном гемостазе. При контакте с плазменными факторами (VIIa, IV) способен активировать фактор Х (это внешний путь формирования протромбиназы). С тканевым тромбопластином связывают большинство случаев возникновения ДВС-синдромов и послеоперационных тромбозов, тромбоэмболии и тромбоваскулитов. Из форменных элементов тканевый тромбопластин могут синтезировать только моноциты (3.С.Баркаган, 1986). Эритроциты, тромбоциты, лейкоциты содержат лишь липидный фактор (3 тф, эритроцитин, эритрофосфатид). Они, как и мозговой кефалин, способны заменить один 3 тф, но не полный тканевый тромбопластин. Это особенно очевидно, когда выполняется аутокоагуляционный тест у больных гемофилией, у которых нарушен внутренний путь образования протромбиназы, но остается внешний путь и в достаточном количестве липидный фактор тромбоцитов и эритроцитов. Несмотря на это, протромбиназная активность, когда резко снижена активность VIII и IX, достаточна активность VII и 3-го липидного факторов, очень низкая (на 8—10 мин — до 300 с, при норме 10 с). Между тем после введения в тест тканевого тромобопластина (экстракта серого вещества головного мозга) выход тромбина нормальный.
Фактор IV — ионы кальция — имеет первостепенное значение для активации протромбиназы и превращения протромбина в тромбин. Ускоряет фибриноген-фибриновую реакцию. Ионы кальция необходимы для взаимодействия факторов свертывания с фосфолипидной поверхностью клеток. У здоровых людей фактор IV определяется в концентрации 2—2,75 ммоль/л.
Феномен связывания ионов кальция лимоннокислым натрием или ЭДТА используется для предотвращения коагуляции консервируемой крови и для лабораторного исследования системы свертывания, фибринолиза и тромбоцитов в стабилизированной крови.
В процессе свертывания крови фактор IV не расходуется, поэтому его можно обнаружить в сыворотке крови. Кальций способен связывать гепарин, благодаря чему свертывание крови ускоряется. Без кальция нарушается агрегация тромбоцитов и ретракция кровяного сгустка. Ионы кальция ингибируют фибринолиз.
Фактор V — проакселерин, лабильный фактор, или Ас-глобулин,— образуется в печени, но, в отличие от других печеночных факторов протромбинового комплекса (II, VII, IX и X), не зависит от витамина К. Термолабилен, не адсорбируется сернокислым барием. Относится к глобулинам. В хранящейся цитратной плазме фактор V разрушается при +4°С за 2 нед, при 37 °С — за 48 ч. В оксалатной плазме интенсивность этого процесса удваивается. Проакселерин плохо сохраняется в консервированной крови. Он необходим для образования внутренней (кровяной) протромбиназы, при этом заметно активирует фактор X, и для превращения протромбина в тромбин, когда в комплекс включаются фактор Ха, Са++ и фосфолипид. Во время свертывания крови фактор потребляется, как и фактор II, поэтому в сыворотке не обнаруживается. В случаях дефицита фактора V в различной степени нарушаются внешний и внутренний пути образования протромбиназы. В коагулограмме это, прежде всего, выражается удлинением протромбинового времени (снижением протромбинового индекса), нарушением теста генерации тромбопластина, каолин-кефалинового и аутокоагуляционного тестов. Тромбиновое время остается в пределах нормы. После добавления ВаS04-плазмы здорового человека, содержащей фактор V, эти изменения корригируются и названные выше тесты нормализуются.
Наследственный дефицит фактора V проявляется парагемофилией. Тип наследования — аутосомно-доминантный с неполной экспрессивностью патологического гена или аутосомно-рецессивный (3. С. Баркаган, 1980). Клинически тип нарушений гемостаза у больных парагемофилией (болезнью Оурена) — петехиально-пятнистый. Подкожные и внутримышечные гематомы, кровоизлияния в суставы и внутренние органы для болезни Оурена не характерны.
Фактор VI — акселерин, или сывороточный Ас-глобулин,—активная форма фактора V. В связи с тем, что отдельным фактором признается только неактивная, профакторная, форма коагулянта, акселерин исключен из употребления и номенклатуры факторов свертывания.
Фактор VII —проконвертин, или конвертин, — синтезируется в печени при участии витамина К. Долго остается в стабилизированной крови, хорошо переносит нагревание, поэтому называется стабильным фактором. Хорошо адсорбируется сернокислым барием, гидроокисью алюминия, задерживается асбестовыми фильтрами Зейца. Факторы XIIa, Ха, калликреин могут превращать фактор VII в VIIa. В основном способствуют образованию тканевой протромбиназы и превращению протромбина в тромбин. Фактор VII в циркулирующей крови активирует фактор X. Это действие особенно усиливается после активации проконвертина тканевым тромбопластином. У больных с поражением печени и у подвергаемых лечению антикоагулянтами непрямого действия активность фактора VII снижается. Врожденным недостатком фактора VII обусловлено развитие геморрагического диатеза (болезни Александера). Фактор VII, подобно факторам XIIa, XI, X, IX,IIа и калликреину, является сериновой протеазой с аргинин-эстераз-ной активностью.
Фактор VIII— антигемофильный глобулин А, или плазменный тромбопластический фактор А, — относится к сложным гликопротеидам с молекулярной массой около 1,12—4,5х106. Место его синтеза точно не установлено. Доказан синтез фактора VIII в печени, селезенке, клетках эндотелия, лейкоцитах, почках. Антигемофильный глобулин А быстро инактивируется при 20°С и 37°С. Он стабилен несколько часов при +4°С и несколько недель при — 20°С. Быстро исчезает из консервированной крови. Фактор VIII дольше активен в присутствии цитрата натрия при рН 6,2—6,9, но быстро теряет активность в среде с ЭДТА. Он не адсорбируется на сульфате бария и гидроокиси алюминия. Этим пользуются для отделения фактора VIII от факторов II, VII, IX и X.
В крови этот фактор циркулирует в виде комплекса из трех субъединиц, обозначаемых VIIIк (коагулирующая единица), VIII-АГ (основной антигенный маркер) и VIII-фВ (фактор Виллебранда, связанный с VIII-АГ). VIII-фВ регулирует синтез коагулянтной части антигемофильного глобулина—VIIIк.
При свертывании крови фактор VIII находится в сыворотке в неактивном состоянии.
Врожденным недостатком фактора VIII обусловлено развитие гемофилии А. В крови больных ею фактора VIII нет (гемофилия А-) или он находится в функционально неполноценной форме, которая не может принимать участие в свертывании (гемофилия А+). Результатами иммунологических исследований доказано, что у 90—92 % больных гемофилией антиген фактора VIIIк не обнаруживается (гемофилия А-) и лишь у 8—10 % больных диагностируется гемофилия А+. У страдающих болезнью Виллебранда снижена активность как VIII-фВ, участвующего в тромбоцитарно-сосудистом гемостазе и являющегося основным маркером комплекса фактора VIII (фактор Виллебранда), так и viiik. У больных гемофилией резко снижено содержание VIIIк, а количество VIII-фВ находится в пределах нормы. По этой разнице различаются клинические формы геморрагического диатеза:
q гематомная форма возникает у больных гемофилией,
q петехиально-гематомная форма — у страдающих болезнью Виллебранда.
Время кровотечения удлинено у больных болезнью Виллебранда и нормальное у больных гемофилией. Концентрация фактора VIII значительно повышается после спленэктомии и иногда значительно снижается при развитии ДВС-синдрома.
Фактор IX — Кристмас-фактор, антигемофильный глобулин В, плазменный тромбопластиновый компонент (plasma thromboplastin component— РТС) — адсорбируется сульфатом бария и асбестовым фильтром. Хорошо сохраняется в консервированной крови и в замороженной плазме (через 2 мес хранения его остается до 90 %). Относится к b2-глобулинам. Выработка фактора IX регулируется геном в Х-хромосоме, в локусе, отстоящем от такового фактора VIII. Этот ген мутирует в 7—10 раз реже, чем ген фактора VIII. Вот почему из всех гемофилий гемофилия А обнаруживается у 87— 94 % больных, а гемофилия В (врожденный недостаток фактора IX, болезнь Кристмаса) — у 8—15 % больных.
3. С. Баркаган (1980) в зависимости от уровня атнигемофильных факторов А и В в крови разделил клинические формы гемофилии А и В: если концентрация этих факторов от 0 до 1 % — крайне тяжелая форма; если от 1 до 2 % — тяжелая форма; от 2 до 5 % — форма средней тяжести и если выше 5 % — легкая форма. Последняя, легкая форма клинически проявляется после травм и хирургических вмешательств.
Фактор IX образуется в печени, поэтому его содержание в крови больных гепатитами, циррозами печени, а также у принимающих производные дикумарина и индандиона уменьшено.
В процессе свертывания крови фактор IX не потребляется и остается в сыворотке еще в более активном состоянии, чем в плазме. Его гемостатический уровень (25 %) достаточен для выполнения хирургических вмешательств.
В коагулограмме крови больных гемофилией, как правило, значительно изменены показатели активации протромбиназы: удлинено общее время свертывания крови и рекальцификации, увеличено активированное парциальное тромбопластиновое (каолин-кефалиновое) время, снижена активность аутокоагулограммы. Протромбиновое и тромбиновое время, содержание фибриногена, активность фибриназы нормальные.
Гемофилии А и В дифференцируются по данным теста генерации тромбопластина или аутокоагулограммы. Для этого можно использовать и результаты обменных проб: нарушенное время свертывания крови больных гемофилией А и В после смешивания образцов крови от обоих больных становится нормальным.
Фактор Х — фактор Стюарта — Прауэр — гликопротеин с массой молекулы 54200-56000. Вырабатывается в печени в неактивном состоянии при участии витамина К. Фактор Х состоит из двух полипептидных цепей:
q тяжелой (с молекулярной массой 38000), на которой находится активный центр,
q легкой — с остатком карбоксиглютаминовой кислоты, необходимой для присоединения к фосфолипидам. Быстро денатурирует при 56 °С. В консервированной крови при 4 °С сохраняется 2 мес.
В современной схеме свертывания крови активный фактор Х — Ха относится к центральному фактору протромбиназы, преобразующей протромбин в тромбин. В активную форму фактор Х превращается под действием факторов VIIa и III (внешний, тканевый путь образования протромбиназы) или под влиянием фактора IХа вместе с фактором VIIIa и фосфолипидом при участии ионов кальция (внутренний, кровяной путь образования протромбиназы). Для обеспечения гемостаза достаточно 10 % фактора X.
Уровень фактора Х в крови связан с протромбиновым временем. Так, если в крови фактора Х менее 1 %, то протромбиновое время будет более 90 с (при норме 12—14 с), если от 1 до 2 % — около 70—90 с, если же от 2 до 5 % — 40—70 с, а если от 5 до 10 % — 15—40 с (данные С. Rizza — цит. по 3.С.Баркагану, 1980).
Фактор Х активируется трипсином и ферментом из яда гадюки. Последним — в присутствии ионизированного кальция, который, видимо, необходим для образования комплекса белков и фосфолипидов (Д. М. Зубаиров, 1978). Фактор Х трансформируется в Ха под действием солевых растворов с высокой ионной силой.
Для приобретенного или врожденного недостатка фактора Х характерно удлинение протромбинового времени, нормализующегося «старой» сывороткой, но не BaS04—плазмой (нарушена «внешняя» система). Кроме того, нарушена и «внутренняя» система: удлинено каолин-кефалиновое время, снижено потребление протромбина, изменены тест генерации тромбопластина (ТГТ) и аутокоагулограмма.
Вследствие врожденного недостатка фактора X, наследуемого по неполному аутосомному типу, возникает болезнь Стюарта — Прауэр, которая встречается как у мужчин, так и у женщин. Наклонность к кровоточивости определяется только у гомозиготных особей.
Содержание фактора Х снижено в крови больных системным амилоидозом, миеломной болезнью, туберкулезом, с поражениями печени, недостатком витамина К, получающих непрямые антикоагулянты.
Фактор XI — РТА (plasma thromboplastin anticedent) — плазменный предшественник тромбопластина. Это гликопротеин с массой молекулы 160 000. Термолабилен, разрушается при 56 °С. В крови здоровых людей его содержится 50—185 %. На 2/3 остается в плазме после адсорбции гидроокисью алюминия или сернокислым барием.
В процессе свертывания крови он не потребляется, поэтому обнаруживается в большом количестве в сыворотке. Активная форма этого фактора (ХIа) образуется при участии факторов XIIа, Флетчера и Фитцжеральда — Фложе. Форма ХIа активирует фактор IX, который превращается в фактор IХа. Эта реакция осуществляется и трипсином в присутствии ионов кальция.
Врожденная недостаточность фактора XI, обнаруженная в 1953 году R. Rosenthal et al., наследуется по аутосомно-рецессивному типу. Эта недостаточность выявляется у мужчин и женщин. Кровоточивость в основном отмечается после травм и операций.
В случаях недостатка фактора XI в коагулограмме больных удлинено время рекальцификации, изменены ТГТ, каолин-кефалиновое время, аутокоагулограмма. В коррекционных пробах тесты нормализуются как нормальной ВаS04-плазмой, так и сывороткой здорового человека.
По такому же типу изменяются коррекционные тесты у людей с недостаточностью фактора XII. Однако у больных с дефицитом фактора Хагемана значительнее, чем у больных с РТА-недостаточностью, изменяются время свертывания крови по Ли-Уайту и каолин-кефалиновое время. Заметно нарушенная свертываемость крови у первых контрастирует с полным отсутствием каких-либо геморрагических явлений.
Фактор XII — фактор контакта Хагемана — соединение с массой молекулы 80 000. Не адсорбируется на сульфате бария, гелях гидроокиси алюминия и фосфата кальция, но хорошо связывается целитом и каолином, сорбируется стеклом. Хорошо сохраняется в консервированной крови. При 4°С половина фактора Хагемана остается в крови более месяца. Много его и в сыворотке.
Фактор XII вырабатывается в неактивном состоянии. Место его синтеза не известно. В лабораторных условиях активируется при соприкосновении с поверхностью кварца и стекла, каолина, целита, асбеста, углекислого бария; а в организме — при контакте с кожей, волокнами коллагена, хондроитинсерной кислотой, мицеллами насыщенных жирных кислот, бактериальными липополисахаридами, содержащими радикалы жирных кислот, эндотоксином, адреналином и норадреналином.
Фактор Хагемана — «инициатор» внутрисосудистой коагуляции. Кроме того, фактор ХIIа активирует прекалликреины плазмы, которые превращаются в ферменты калликреины, освобождающие кинины. Активный фактор XII служит активатором фибринолиза. Такие кинины, как брадикинин и каллидин, увеличивают проницаемость сосудов, способствуют сокращению гладких мышц, снижают кровяное давление, возбуждают болевые рецепторы, создают условия для прилипания лейкоцитов к стенке мелких кровеносных сосудов и их миграции в экстраваскулярное пространство. Калликреин активирует фактор XII в 10 раз сильнее, чем плазмин и фактор ХIа. В жидкой среде фактор Флетчера оказывается наиболее важным активатором фактора Хагемана.
В крови есть ингибитор активного фактора Хагемана.
Впервые врожденный дефицит фактора XII был описан в 1955 году R. Ratnoff et al. У больного Джо Хагемана они не выявили признаков кровоточивости, но установили, что время свертывания крови у него значительно удлинено.
Болезнь наследуется по аутосомно-рецессивному типу. Описано около 100 больных с дефицитом фактора Хагемана. У большинства из них не было ни спонтанной, ни спровоцированной травмой кровоточивости. Смерть больного Хагемана от посттравматической легочной эмболии оставила вопрос о роли фактора XII в гемостазе открытым. Возможно, что кроме контактной активации этого фактора существует другой путь включения внутренней системы коагуляции.
У больных с недостатком фактора XII в коагулограмме резко удлиняется время свертывания крови (особенно в силиконированной пробирке), время рекальцификации, каолин-кефалиновое время без клинических признаков кровоточивости. Не сокращается время коагуляции активаторами контактной фазы — каолином, бентонином и другими. Эти показатели коагулограммы нормализуются после добавления ВаS04-плазмы, прогретой 15 мин при 56 °С, и остаются прежними после добавления плазмы цыплят, у которых практически нет фактора Хагемана.
Фактор XIII — фибринстабилизирующий фактор, фибриназа, фактор Лаки — Лоранда — a2-гликопротеид с массой молекулы 300 000 — 340 000. Менее термостабилен, чем фибриноген.
Определяется в сосудистой стенке, тромбоцитах, эритроцитах, почках, легких, мышцах, плаценте. В плазме находится в виде профермента, соединенного с фибриногеном. Фактор XIII под влиянием тромбина превращается в активную форму (XIIIa). В крови здоровых людей его содержится 80—120% (сгусток растворяется за 50—100 с). 10% фибриназы обеспечивают полноценный гемостаз, 2 % этого фактора достаточны для остановки кровотечения.
Фактор XIII является трансамидазой, которая катализирует синтез ковалентных связей между лизилом и глютаминилом фибринмономера (действуя как e-лизил-g-глутамил-аминоацилтрансфераза) и тем самым соединяет мономерные единицы в фибрин-полимере. Активность фибриназы обусловлена наличием сульфгидрильных групп. Она хорошо сохраняется при —20°С (лиофилизированные препараты теряют около трети активности за 3 нед). При комнатной температуре активность фермента падает в течение 2—3 дней. В результате прогревания плазмы или сыворотки до 60°С фибриназа инактивируется за 10 мин. В инкубируемых растворах фибриногена при 40°С фибриназа разрушается в течение 3 ч.
Тромбы, образовавшиеся в присутствии фибриназы, очень медленно подвергаются лизису. Если активность фактора XIII снижается, свертки очень быстро распадаются, даже когда фибринолитическая активность крови нормальная.
Установлено, что снижение активности фибриназы сопровождается уменьшением адгезивности и агрегации кровяных пластинок, и, наоборот, при повышении активности фибриназы эти свойства тромбоцитов повышаются. Вот почему снижение или повышение активности фибриназы свидетельствуют об опасности развития геморрагии или тромбоза.
У больных с тромбоэмболическими осложнениями, атеросклерозом, у оперированных, родильниц, после введения адреналина, глюкокортикоидов, питуитрина активность фибриназы повышена, а у больных С-авитаминозом, лучевой болезнью, лейкозом, циррозами, лимфомой, с ДВС-синдромами, у перенесших адреналэктомию, после приема непрямых антикоагулянтов ее активность снижена.
Описан врожденный дефицит фибриназы, который наследуется аутосомно-рецессивным способом, преимущественно мужчинами. Первым клиническим признаком дефицита фибриназы у 80% больных бывает длительное (в течение дней, иногда недель) кровотечение из пупочной раны. Кровоточивость проявляется по петехиальному типу. Случаются кровоизлияния в мозг. Отмечается медленное заживление ран, часто образуются послеоперационные грыжи. Плохо также заживают переломы. Все параметры коагулограммы, кроме снижения уровня фактора XIII в плазме, остаются совершенно нормальными.
Фактор Флетчера — плазменный прекалликреин, участвующий в реакциях коагуляции в контактной фазе. Открыт в 1965 году W. Hathaway et al.
Если фактора Флетчера нет в организме, нарушается общее время свертывания, хотя факторы I—XIII содержатся в крови в пределах нормы. При этом замедляется внутренняя система активации протромбина во время контакта плазмы со стеклом, каолином и эллаговой кислотой. Однако после 6—14-минутного контакта плазмы без фактора Флетчера с каолином нормализуется ее свертывание, в отличие от плазмы с недостатком факторов XII и XI. Фактор Флетчера активирует факторы VII и IX. Тем самым он связывает внутреннюю и внешнюю системы активации фактора X. Прекалликреин трансформируется в калликреин под влиянием фактора ХIIа (Т. С. Пасхина, 1976).
Дефицит фактора Флетчера, подобно недостатку фактора Хагемана, клинически ничем не проявляется.
Фактор Фитцжеральда (Фитцжеральда — Фложе) — высокомолекулярный кининоген плазмы (ВМ-кининоген), который переводится калликреином в кинин и участвует в активации фактора XI, ускоряя действие на последний фактора ХIIа. Фактор стабилен в цитратной плазме, сохраняет свою активность 4 мес при —40°С. Осаждается с эуглобулиновой фракцией плазмы. Активность фактора снижается наполовину после суточного хранения при 37 °С.
В процессе свертывания крови этот фактор не потребляется. Его активность не снижается под влиянием непрямых антикоагулянтов. После инфузии крови время полужизни фактора у одной больной было около 6,5 сут (Д. М. Зубаиров, 1978).
Если фактора Фитцжеральда нет в организме, нарушается активация внутренней системы каолином.
Недостаток фактора Фитцжеральда обнаруживается у больных случайно, потому что у них не бывает геморрагического диатеза.
