Осмотическая концентрация. Осмолярность. Осмоляльность
Осмотическая концентрация — суммарная концентрация всех осмотически-активных частиц в растворе. Осмотическая концентрация выражаться как осмолярность (осмоль — рассчитывается на литр раствора) и как осмоляльность (осмоль — рассчитывается на кг растворителя).
Осмотическую концентрацию растворов вычисляют по формуле:
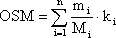 ,
где
,
где
Mi — молекулярная масса растворенного вещества i;
mi – количество растворенного вещества: если в 1 л раствора – то рассчитывают осмолярность; если в 1 кг растворителя – то осмоляльность;
ki –
Так, если NaCl при растворении диссоциирует на Na+ и Cl—, и в разбавленных растворах диссоциирует нацело (α = 1), то осмолярность 1-молярного раствора NaCl составит 2 осмоль/л, в концентрированных растворах α может быть 0,8, тогда осмолярность 1- молярного раствора NaCl составит 1,6 осмоль/л.
Теоретически возможно рассчитать осмолярность лишь для простых разбавленных растворов (одно-, двухкомпонентных), и только в том случае, если известны константы диссоциации и механизмы диссоциации растворяемых веществ. В растворах сложного состава, многокомпонентных, а также при высоких концентрациях растворяемые вещества могут влиять на диссоциацию друг друга, в настоящее время это влияние прогнозировать сложно, практически невозможно.
Фактическая осмолярность понижается по сравнению с теоретически рассчитанной. В таких случаях, а также для растворов новых, малоизученных ЛВ осмолярность определяют экспериментально.
ГФ РБ регламентирует экспериментальное определение осмолярности (осмоляльности).
Осмометрия
От осмотической концентрации (осмолярности/осмоляльности) зависят так называемые каллигативные свойства растворов (свойства, зависящие от числа частиц в растворенном веществе и не зависящие от его природы):
— осмотическое давление,
— повышение точки начала кипения (чем выше осмолярность, тем выше температура кипения),
— понижение температуры начала кристаллизации (чем выше осмолярность, тем ниже температура замерзания раствора),
Повышение температуры начала кипения раствора по сравнению с чистым растворителем (ΔТкип) и понижение температуры начала замерзания (ΔТзам) обусловлено понижением давления пара растворителя (водяных паров в случае водных растворов) над раствором. Повышение пропорционально мольной доле растворенного вещества.
ΔТкип = КкипС, где
Ккип — эбуллиоскопическая констаната растворителя, показывает, на сколько градусов повысится температура кипения раствора, если в 1000 г растворителя внести 1 моль вещества;
С – моляльная концентрация, выраженная в молях растворенного вещества в 1000 г растворителя
Измерения с применением этого метода назывют эбуллиоскопией (от латинского ebullire – выкипать). Эбуллиоскопия менее точна по сравнению с криоскопией, так как эбуллиоскопические константы Ккип(для воды = 0,51°), как правило, меньше криоскопических Кзам.
В этой связи именно криоскопический метод
считается более точным в измерении осмоляльности:ΔТзам = Кзам·С, где
ΔТзам – понижение температуры начала кристаллизации раствора по сравнению с чистым растворителем, эту величину называют температурной депрессией кристаллизации.
Для плазмы крови ΔТзам = 0,52°.
С – моляльная концентрация, выраженная в молях растворенного вещества в 1000 г растворителя;
Кзам – криоскопическая константа растворителя (замерзания). Показывает, на сколько градусов понизится температура замерзания раствора, если в 1000 г растворителя внести 1 моль вещества. Для воды Кзам = 1,86°.
Таким
образом, измерив температурную депрессию кристаллизации
(ГФ РБ:
замерзания) раствора ΔТ
OSM = 1000 · ΔТзам/1,86° (мОсмоль/кг)
Температурную депрессию замерзания раствора согласно ГФ РБ определяют с помощью аналитических приборов — осмометров.
Миллиосмометр-криоскоп термоэлектрический МТ-5 — аналитический прибор, предназначенный для измерения методом криоскопии осмотических концентраций биологических жидкостей и водных растворов, а также для измерения температур замерзания, соответствующих этим концентрациям. Прибор работает в автоматическом режиме. Управление осуществляется с помощью встроенного микроконтроллера.
Составные части:
— Приспособление для охлаждения измерительной кюветы
— Система измерения температуры (по силе тока или разности потенциалов). Измерительное устройство м.б. градуировано непосредственно в единицах осмоляльности, либо в град. понижения температуры (град.температурной депрессии).
Миллиосмометры-криоскопы МТ-5 могут быть рекомендованы для использования в аналитических лабораториях с целью анализа качества лекарственных препаратов, как при их производстве, так и в процессе контроля, в соответствии с ОФС, ФС и ФСП.
Формула осмолярности, как ее вычислить и разница с осмоляльностью / химия | Thpanorama
осмолярность является параметром, который измеряет концентрацию химического соединения в литре раствора, если он способствует коллигативному свойству, известному как осмотическое давление указанного раствора.
В этом смысле осмотическое давление раствора относится к количеству давления, необходимому для замедления процесса осмоса, которое определяется как избирательное прохождение частиц растворителя посредством полупроницаемой или пористой мембраны из раствора. от более низкой концентрации к более концентрированной.
Кроме того, единицей измерения количества растворенных частиц является осмол (символом которого является Осм), который не является частью Международной системы единиц (СИ), используемой почти во всем мире. Поэтому концентрация растворенного вещества в растворе определяется в единицах осмолей на литр (Осм / л).
индекс
- 1 Формула
- 1.1 Определение переменных в формуле осмолярности
- 2 Как рассчитать?
- 3 Различия между осмолярностью и осмоляльностью
- 4 Ссылки
формула
Как упоминалось ранее, осмолярность (также известная как осмотическая концентрация) выражается в единицах, определенных как осм / л. Это связано с его взаимосвязью с определением осмотического давления и измерением диффузии растворителя с помощью осмоса..
На практике осмотическая концентрация может быть определена как физическая величина с использованием осмометра..
Осмометр — это инструмент, используемый для измерения осмотического давления раствора, а также для определения других коллигативных свойств (таких как давление пара, повышение температуры кипения или снижение температуры замерзания) для получения значения осмолярности раствора.
Таким образом, для расчета этого параметра измерения используется следующая формула, которая учитывает все факторы, которые могут повлиять на это свойство..
Осмолярность = ΣφЯNЯСЯ
В этом уравнении осмолярность определяется как сумма, полученная в результате умножения всех значений, полученных по трем различным параметрам, которые будут определены ниже..
Определение переменных в формуле осмолярности
Во-первых, это осмотический коэффициент, представленный греческой буквой φ (фи), который объясняет, как далеко удаляется решение идеального поведения, или, другими словами, степень неидеальности, которую растворенное вещество проявляет в решении.
Проще всего, φ относится к степени диссоциации растворенного вещества, которая может иметь значение от нуля до единицы, где максимальное значение единицы представляет собой диссоциацию 100%; то есть абсолют.
В некоторых случаях, таких как сахароза, эта величина превышает единицу; в то время как в других случаях, таких как влияние солей, влияние электростатических взаимодействий или сил вызывает осмотический коэффициент со значением, меньшим единицы, даже если происходит абсолютная диссоциация.
С другой стороны, значение n указывает количество частиц, в которых молекула может быть диссоциирована. В случае ионных частиц в качестве примера приведен хлорид натрия (NaCl), значение n которого равно двум; тогда как в неионизированной молекуле глюкозы значение n равно единице.
Наконец, значение с представляет концентрацию растворенного вещества, выраженную в мольных единицах; и нижний индекс i относится к идентичности конкретного растворенного вещества, но он должен быть одинаковым при умножении трех факторов, упомянутых выше, и, таким образом, получении осмолярности.
Как рассчитать?
В случае ионного соединения KBr (известного как бромид калия), если у вас есть раствор с концентрацией, равной 1 моль / л KBr в воде, предполагается, что он имеет осмолярность, равную 2 осмоль / л..
Это связано с его сильным электролитным характером, что способствует его полной диссоциации в воде и позволяет высвобождению двух независимых ионов (K+ и Br—), которые имеют некоторый электрический заряд, так что каждый моль KBr равен двум осмолам в растворе.
Аналогично для раствора с концентрацией, равной 1 моль / л BaCl2 (известный как хлорид бария) в воде, он имеет осмолярность, равную 3 осмоль / л.
Это связано с тем, что выделяются три независимых иона: ион Ва2+ и два иона Cl—. Затем каждый моль BaCl2 эквивалентно трем осмолам в растворе.
С другой стороны, неионные вещества не подвергаются такой диссоциации и генерируют один осмол на каждый моль растворенного вещества. В случае раствора глюкозы с концентрацией, равной 1 моль / л, это равняется 1 осмоль / л раствора.
Различия между осмолярностью и осмоляльностью
Осмол определяется как количество частиц, которые растворяются в объеме, равном 22,4 л растворителя, при температуре 0 ° С и которые вызывают образование осмотического давления, равного 1 атм. Следует отметить, что эти частицы считаются осмотически активными.
В этом смысле свойства, известные как осмолярность и осмоляльность, относятся к одному и тому же измерению: концентрация растворенного вещества в растворе или, другими словами, содержание общих частиц растворенного вещества в растворе..
Принципиальное различие, которое установлено между осмолярностью и осмоляльностью, заключается в единицах, в которых каждый представлен:
Осмолярность выражается в количестве вещества на объем раств
Методичка по химии Учение о растворах

Рис. 6. Схема возникновения осмотического давления
Вант Гофф предложил эмпирическое уравнение для расчета осмотического давления разбавленных растворов неэлектролитов:
Росм(Х) = с(Х) R T,
где с(Х) – молярная концентрация вещества в растворе, моль/л.
По форме это уравнение аналогично уравнению КлапейронаМенделеева для идеальных газов, поэтому несмотря на то, что эти уравне-
ния описывают разные процессы, Вант Гофф сформулировал следующий закон:
Осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии, занимало при той же температуре объем, равный объему раствора.
Как упоминалось выше, коллигативные свойства не зависят от природы растворѐнного вещества, следовательно, они характерны для идеальных растворов, в которых отсутствуют межмолекулярные взаимодействия и которые не существуют в природе. Для учѐта межмолекулярных взаимодействий в реальных растворах Вант-Гофф предложил использовать изотонический коэффициент.
Изотонический коэффициент (i) – это параметр, учитывающий межмолекулярные взаимодействия в реальных растворах:
20

i | число частиц растворенного вещества | ||
|
| ||
число частиц исходного вещества | |||
| |||
i = 1 – для разбавленных растворов неэлектролитов; i > 1 – для разбавленных растворов электролитов;
i < 1 – для коллоидных растворов, содержащих ассоциаты.
Взаимосвязь изотонического коэффициента со степенью диссоциации ( ) выражается уравнением:
i = 1 + (n–1)
где n – число ионов, образующих данный электролит.
Для растворов электролитов осмотическое давление рассчитывается по формуле:
Росм(Х) = i с(Х) R T
Для плазмы крови Росм = 740–780 кПа.
Плазма крови сложная многокомпонентная система, поэтому для учѐта еѐ осмотических свойств было введено понятие осмолярной (осмолярность) или осмоляльной (осмоляльность) концентраций, разница между которыми незначительна вследствие относительной разбавленности биологических растворов.
Осмолярная концентрация – количество всех кинетически активных частиц, содержащихся в 1 л раствора, независимо от их формы, размера и природы.
сосм = i с(Х)
Осмолярная концентрация плазмы крови равна
0,29–0,31 осмоль/л.
Осмоляльность – концентрация осмотически активных частиц в растворе, выраженная в количестве осмоль на килограмм растворителя (осм/кг).
Внорме осмоляльность плазмы (Опл) определяется концентрацией Na+, мочевины и глюкозы.
Внорме осмоляльность плазмы составляет 275-290 мосм/кг. Осмоляльность плазмы сохраняется постоянной благодаря механизмам, способным реагировать на изменения, равные 1-2% ее исходной величины
Осмоляльность является показателем осмотической концентрации и
связана с числом растворенных частиц. Она определяется степенью диссоциации или, наоборот, ассоциации молекул, присутствующих в данной массе раствора. Осмоляльность выражается в (ммоль/кг. Осмоляльность
часто путают с осмолярностью, которая определяется как количество частиц в данном объеме раствора (т.е. в ммоль/л). Осмолярность и осмоляльность такого раствора как моча обычно совпадают и различить их расхождения в обычной биохимической лаборатории не представляется возможным. Осмоляльность мочи или других тканевых жидкостей может быть выражена через осмотическое давление. Если раствор отделить от растворителя полупроницаемой мембраной, то растворитель будет стремиться перейти в раствор. Гидростатическое давление, которое должно уравнять давление растворителя, и будет соответствовать осмотическому давлению, определяемому осмоляльностью раствора. В случае клеточной мембраны осмотическое давление зависит от концентрации частиц, которые не проходят через мембрану («эффективная» осмомоляльность или тоничность среды).
Одна из основных функций почек – экскреция растворимых веществ и их производных. Большинство веществ выводятся из организма именно через почки. Так как имеется почечный порог для большинства компонентов мочи, то основными растворенными в моче веществами являются хлорид натрия и мочевина. Количество экскретируемого хлорида натрия составляет от 5 до 25 граммов за 24 часа; количество мочевины за это же время составляет от 10 до 40 граммов. Количество солей в моче отражает их содержание в пище, количество мочевины — потребление белка.
Относительная плотность или удельный вес, которая определяется количеством растворенных веществ в моче, является одним из самых традиционных тестов, который входит в состав общего анализа мочи. Осмоляльноть является более строгим показателем, чем относительная плотность. Она зависит от числа частиц, содержащихся в растворе, тогда как относительная плотность зависит как от числа, так и от характера растворенных частиц. Осмоляльность и плотность мочи тесно связаны между собой, однако преимуществом использования единиц осмоляльности является возможность сравнения мочи с кровью, что предоставляет большие возможности в распознавании почечной активности. Одним из принципиальных преимуществ измерения осмоляльности, а не плотности мочи является то, что белок и глюкоза не так сильно влияют на осмоляльность, как на плотность (удельный вес). На увеличение в моче глюкозы, белка, лекарств или их метаболитов, маннитола или декстранов (в результате внутривенного введения) косвенно указывает нарушение линейной связи между относительной плотностью и осмоляльностью при значениях относительной плотности свыше 1,030 г/мл.
Измерение осмоляльности мочи и сыворотки позволяет определить концентрирующую способность почек. У здоровых людей осмоляльность может меняться от 50 до 1000 ммоль/кг, что соответствует колебанию относительной плотности от 1,001 до 1,030 г/мл. Нормальные почки здоро-
вого человека способны разводить и концентрировать мочу с минимальных значений 50-80 ммоль/кг, что соответствует относительной плотности 1,001-1,002 г/мл, до максимальных значений 1400 ммоль/л. Осмоляльность (или относительная плотность) наиболее высока в первой утренней порции мочи и составляет, как правило, более 700 ммоль/л (1,020 г/мл). Нормальный диапазон осмоляльности мочи составляет от 200 до 1000 ммоль/л (1,005-1,030 г/мл), но обычно осмоляльность мочи составляет 350-850 ммоль/л (относительная плотность 1,010-1,025 г/мл). Нормальный диапазон концентрирования мочи для пациентов при обычном потреблении воды и пищи от 550 до 850 ммоль/л (1,015-1,025 г/мл).
Изотонические растворы – растворы с одинаковым осмотическим давлением.
При контакте с изотоническим раствором осмотической ячейки, представляющей собой систему, отделѐнную от окружающей среды мембраной с избирательной проницаемостью, между ними происходит равновесный обмен растворителем. Все клетки живых организмов являются осмотическими ячейками. Раствор, который изотоничен плазме крови, называется физиологическим, например, 0,9%-ный раствор NaCI.
Гипертонический раствор – раствор, обладающий большим осмотическим давлением по сравнению с контактируемым раствором.
При контакте осмотической ячейки с гипертоническим раствором наблюдается экзосмос — движение растворителя из осмотической ячейки в окружающий еѐ гипертонический раствор. Наблюдаемое при этом явление называется плазмолизом.
Плазмолиз – сжатие и сморщивание клеток за счѐт экзосмоса в гипертоническом растворе.
При внутривенном введении больному гипертонического по отношению к плазме крови раствора происходит осмотический конфликт – обезвоживание и сморщивание клеток вследствие экзоосмоса. При резком плазмолизе клетки могут погибнуть.
Гипертонические растворы используют для промывания гнойных ран, в качестве слабительных препаратов (горькая соль MgSO4∙7h3O, глауберова соль Na2SO4∙10h3O), диуретиков.
Гипотонический раствор – раствор, обладающий меньшим осмотическим давлением по сравнению с контактируемым раствором.
При контакте осмотической ячейки с гипотоническим раствором происходит эндосмос – движение растворителя в осмотическую ячейку из окружающего еѐ гипотонического раствора, приводящее к набуханию клетки и даже ее разрыву.
Гемолиз – набухание и разрушение за счѐт эндосмоса клеточных мембран эритроцитов в гипотоническом растворе, приводящее к выделе-
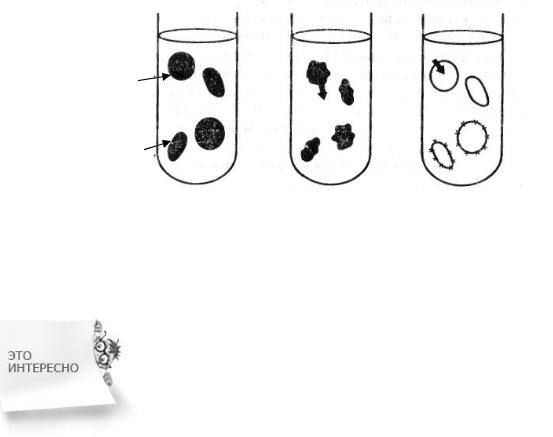
нию гемоглобина в плазму (лаковая кровь). Разрушение клеток называют лизисом.
При внутривенном введении больному гипотонического по отношению к плазме крови раствора происходит осмотический «шок» – разрушение клеток вследствие эндосмоса. При разрушении эритроцитов гемоглобин попадает в плазму крови и не может выполнять свою основную функцию – транспорт кислорода, поэтому наступает гипоксия тканей.
Уменьшение осмотического давления за счет потери солевых компонентов может привести к рвоте, судорогам, потере сознания. В связи с этим, например, рабочие горячих цехов, у которых происходит сильное потоотделение, пьют подсоленную воду. Увеличение осмотического давления за счет избытка соли приводит к перераспределению жидкости в организме, которая скапливается в тканях, содержащих избыток соли, вызывая тем самым отѐк.
| Изотонический | Гипертонический | Гипотонический | |
|
| раствор | раствор | раствор |
|
|
|
|
|
|
|
| ||
Вид спереди |
|
|
| |
|
|
|
| |
|
|
| ||
Вид в профиль |
|
|
| |
|
|
|
|
|
| Нормальные | Сморщиваюшиеся | Набухшие клетки | |
| клетки (осмотичеклетки (зубчатые) | (гемолизирован- | ||
| ское равновесие) |
| ные) | |
Рис. 7. Действие осмотического давления на клетки
У животных, которые способны менять количество потребляемой воды в зависимости от обстоятельств, действует особая система осморегуляции. Например, осмолярность мочи бобра, не испытывающего дефицита воды, равна 0,6 осмоль/л, а у живущего в пустыне тушканчика – 9 осмоль/л. У пресноводных рыб тка
невые жидкости гипертоничны по отношению к пресной воде, поэтому такие рыбы накачивают воду путем осмоса через жаберные щели, выводя ее потом из организма с большим объемом разведенной мочи. Напротив, у морских рыб тканевые жидкости гипотоничны по отношению к морской воде, поэтому они через жаберные щели выделяют воду, а для ее компенсации пьют морскую воду. Моча, выделяемая такими рыбами, изотонична морской воде и объем ее очень мал.


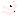 При снижении осмотического давления крови до 400-350 кПа наступает гибель организма.
При снижении осмотического давления крови до 400-350 кПа наступает гибель организма.
Онкотическое давление – осмотическое давление, создаваемое за счѐт наличия белков в биожидкостях организма. Оно составляет 0,5% от суммарного осмотического давления плазмы крови. В результате понижения онкотического давления при гипопротеинемии происходит перераспределение жидкости в сторону ткани и возникновение онкотических отѐков («голодных» или «почечных»).
Давление насыщенного пара растворителя над раствором
Давление насыщенного пара над растворителем (ро) – давление,
при котором при данной температуре в системе «жидкость–пар» наступает динамическое равновесие, характеризующееся равенством скоростей испарения и конденсации.
Давление насыщенного | Давление насыщенного |
пара растворителя | р0 > p пара растворителя |
Чистый растворитель | Раствор |
– частица растворителя; | – частица растворенного нелетучего вещества |
Рис. 8. Испарение чистого растворителя и испарение растворителя из раствора
Если в растворитель ввести нелетучий неэлектролит (рис. 8), то испарение молекул растворителя уменьшится вследствие:
 уменьшения подвижности молекул растворителя за счѐт межмолекулярного и ион-дипольного взаимодействия растворитель–вещество;
уменьшения подвижности молекул растворителя за счѐт межмолекулярного и ион-дипольного взаимодействия растворитель–вещество;
 уменьшения поверхности испарения, т.к. часть поверхности занята молекулами нелетучего вещества;
уменьшения поверхности испарения, т.к. часть поверхности занята молекулами нелетучего вещества;  уменьшения молярной доли растворителя и нарушения за счѐт этого
уменьшения молярной доли растворителя и нарушения за счѐт этого
равновесия жидкость-пар. В соответствии с принципом Ле Шателье начинает протекать процесс, стремящийся ослабить влияние воздействия, т.е. конденсация, что и приводит к уменьшению количества пара, а, следовательно, и к снижению его давления над раствором по сравнению с растворителем.

Давление насыщенного пара растворителя над раствором
всегда меньше, чем над чистым растворителем.
Математически это выражается с помощью I закона Рауля.
I закон Рауля – относительное понижение давления насыщенного пара растворителя над раствором в сравнении с его давлением над растворителем, равно молярной доле растворенного вещества (N):
Ро | Р | N (Х) ; | P |
| n(X) | , |
Ро |
| P |
| n(X) n(р — ля) | ||
|
|
|
| |||
|
|
| o |
|
|
|
где Ро – давление насыщенного пара над растворителем; Р – давление насыщенного пара над раствором;
n(X) и n(р-ля) – количество растворенного вещества и растворителя.
Для растворов электролитов в математическое выражение I закона Рауля вводится изотонический коэффициент:
Ро | Р | iN (Х) |
Ро |
| |
|
|
Температуры кипения и кристаллизации растворов непосредственно связаны с давлением над ними насыщенного пара растворителя.
Повышение температуры кипения и понижение температуры кристаллизации раствора по сравнению с растворителем
Температура кипения жидкости – это температура, при которой давление еѐ паров становится равным внешнему атмосферному давлению.
Например, при давлении 101,3 кПа температура кипения воды равна 100оС, а в горах при пониженном атмосферном давлении соответственно будет и ниже температура еѐ кипения.
Понижение давления пара растворителя в результате растворения в нѐм нелетучего вещества приводит к увеличению скорости конденсации пара и, следовательно, к нарушению равновесия жидкость-пар. Для восстановления этого равновесия, т.е. для повышения давления насыщенного пара над раствором, необходимо повысить температуру, следовательно, температура кипения раствора будет выше температуры кипения растворителя.
Температура кристаллизации (замерзания) растворителя – это температура, при которой давление пара над жидкостью становится равным давлению пара над его твѐрдой фазой.

Растворение нелетучего вещества в растворителе приводит к уменьшению молярной доли растворителя и, соответственно, к нарушению равновесия жидкость–твѐрдая фаза. Для восстановления этого равновесия, т.е. для повышения молярной доли растворителя будет происходить плавление твѐрдой фазы, поэтому для кристаллизации раствора необходимо понизить температуру. Таким образом, температура кристаллизации раствора будет ниже температуры кристаллизации растворителя. При этом температуру кристаллизации следует фиксировать при выделении из раствора первого кристаллика твѐрдой фазы, т.к. при образовании большего количества твѐрдой фазы концентрация растворѐнного вещества будет возрастать и температура замерзания раствора будет понижаться.
Математически эти зависимости выражаются с помощью II закона Рауля.
II закон Рауля – повышение температуры кипения и понижение температуры кристаллизации раствора пропорционально моляльной концентрации сm(X) растворенного вещества:
Ткип = Е сm(X) | Ткрист = K сm(X), |
где Е, K – соответственно, эбулиоскопическая и криоскопическая постоянные, зависящие только от природы растворителя.
Математически Е = Ткип и K = Ткрист при сm(X) = 1 моль/кг. Однако, при такой концентрации растворенного вещества раствор нельзя считать
разбавленным, поэтому для нахождения этих величин строят график зависимости экспериментально измеренных Ткип и Ткрист от сm(X) и экстрапалируют полученную зависимость на ось ординат. Отсекаемые при этом отрезки и будут равны величинам Е и K. В приложении приведены значения Е и K для некоторых жидкостей.
Для растворов электролитов в математическое выражение II закона Рауля вводится изотонический коэффициент i:
Ткип = i Е сm(X) Ткрист = i K сm(X)
Ткрист = i K сm(X)
На измерении температур кипения и кристаллизации растворов основаны экспериментальные методы эбулиоскопия и криоскопия, которые применяются для определения молярных масс веществ, изотонического коэффициента, степени диссоциации слабых электролитов.
После подстановки в математическое выражение II закона Рауля формулы для расчета сm(X) и преобразования этого выражения получим формулы для расчета молярной массы:
27
M | E m(X) | ; | M | K m(X) |
|
| |||
Tкип m(р ля) | Tкрист m(р ля) |
где m(Х) – масса растворенного вещества, г; m(р-ля) – масса растворителя, кг.
Экспериментально измерив Ткип и Ткрист, можно рассчитать M(Х). На практике чаще используют криоскопический метод определения молярных масс. Особенно он удобен для изучения органических веществ: исследуемое вещество растворяют в бензоле и с помощью термометра Бекмана точно измеряют Тзам.
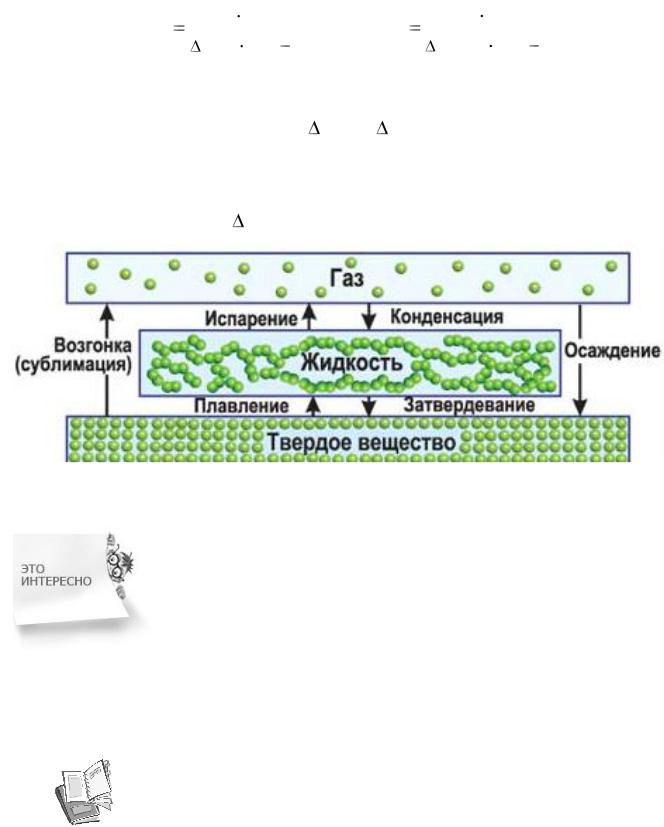
Рис. 9. Фазовые переходы
Высоко в горах при низком внешнем атмосферном давлении температура кипения воды может достигать только 60оС. При этой температуре не удается сварить мясо, поэтому у жителей высокогорных сѐл особый рацион питания.
Вы, наверное, замечали, что вода в кастрюле под закрытой крышкой быстрее закипает, а в кастрюле-скороварке быстрее готовится пища, так как благодаря ее особой конструкции, предусматривающей герметичность закрывания крышки, температура кипения воды достигает 104оС. В автоклавах, используемых для дезинфекции медицинского инструментария, температура кипения может достигать 250оС.
Типовые упражнения и задачи с решениями
Задача № 1
В закрытом сосуде находятся два стакана: с чистой водой и с раствором серной кислоты в воде. Какие процессы будут наблюдаться при этом?
Решение:
Согласно I закону Рауля давление насыщенного пара над чистой водой будет выше, чем над раствором, поэтому будет происходить диффузия
молекул воды в закрытом сосуде от стакана с чистой водой к стакану с раствором. Это приведѐт к нарушению равновесия и протеканию в результате этого следующих процессов:
а) давление насыщенного пара над чистой водой уменьшится, поэтому скорость испарения превысит скорость конденсации, что приведѐт к понижению уровня чистой воды в стакане и уменьшению еѐ температуры вследствие протекания эндотермического процесса испарения; б) давление насыщенного пара над раствором повысится, поэтому ско-
рость конденсации превысит скорость испарения, что приведѐт к повышению уровня раствора в стакане, понижению концентрации растворѐнного вещества и повышению температуры вследствие протекания экзотермического процесса растворения серной кислоты в воде. Понижение концентрации вызовет, в свою очередь, постепенное уменьшение давления насыщенного пара над раствором и, соответственно, уменьшение скорости диффузии молекул воды в закрытом сосуде.
Задача № 2
Почему для чистой воды мы говорим «температура плавления», а для раствора – «температура начала кристаллизации» или «температура появления первых кристаллов»?
Решение:
Для чистой воды температура фазового перехода вода–лѐд остаѐтся неизменной в течение всего процесса. Согласно II закону Рауля температура кристаллизации раствора будет ниже, чем у растворителя, поэтому при понижении температуры будут образовываться кристаллы растворителя, что приведѐт к постепенному увеличению концентрации растворѐнного вещества и, соответственно, к дальнейшему постепенному понижению температуры кристаллизации. В связи с этим температуру замерзания растворов следует фиксировать при появлении первых кристаллов льда, т.к. это практически будет соответствовать первоначальной концентрации раствора.
Задача № 3
Вбольшом сосуде кипит вода; в этот сосуд поместили другой сосуд также с водой. Закипит ли в нѐм вода? В большой сосуд добавили некоторое количество хлорида натрия. Что произойдѐт в малом сосуде?
Решение:
Впервом случае температура кипения воды будет неизменной, т.к. подводимая к ней теплота затрачивается на эндотермический процесс еѐ испарения, поэтому вода в другом, помещѐнном в неѐ сосуде не закипит. В результате добавления в большой сосуд хлорида натрия температура кипения раствора согласно II закону Рауля увеличится и станет выше темпера-
Осмолярность плазмы что это такое норма причины отклонения
Осмоляльность (кровь)
Ключевые слова: почечная недостаточность несахарный диабет кровь
Осмоль — при определении концентрации раствора в показателях количества частиц вместо граммов используют единицу, называемую осмолем.
Один осмоль является 1 грамм-молекулой осмотически активного растворенного вещества. Так, 180 г глюкозы, т.е. 1 грамм-молекула глюкозы, эквивалентны 1 осмолю глюкозы, поскольку глюкоза не диссоциирует на ионы. Если растворенное вещество диссоциирует на 2 иона, 1 грамм-молекула растворенного вещества будет соответствовать 2 осмолям, поскольку число осмотически активных частиц в этом случае вдвое больше, чем для недиссоциирующего вещества. При полной диссоциации 1 грамм-молекула хлорида натрия, или 58,5 г, эквивалентна 2 осмолям (т.е. осмолярность 1-молярного раствора NaCl составит 2 осмоль/л).
О растворе, содержащем 1 осмоль растворенного вещества в каждом килограмме воды, говорят, что его осмоляльность равна 1 осмоль на 1 кг. Раствор, содержащий 1/1000 осмоля растворенного вещества на 1 кг, имеет осмоляльность 1 миллиосмоль (мосм) на 1 кг. Нормальная осмоляльность внеклеточной и внутриклеточной жидкостей равна примерно 300 мосм на 1 кг воды.
Осмоляльность сыворотки крови — количественная мера осмотически активных веществ, растворенных в сыворотке крови т. е. сумма концентраций концентраций катионов, анионов и неэлектролитов, выражающаяся в миллиосмолях на килорамм воды (мОсм/кг Н 2 О). К основным анионам, определяющим осмоляльность сыворотки относят натрий и другие анионы (ионы калия, хлора, гидрокарбоната и др.). Более точное измерение учитывает также содержание глюкозы и мочевины, находя выражение в формуле:
Осмоляльность сыворотки= 2Na + + глюкоза сыворотки + мочевина (азот мочевины)
Осмоляльность плазмы можно определить, зная концентрацию основных осмотических компонентов внеклеточной жидкости — натрия, глюкозы и мочевины. Например: натрий составляет 140 мэкв/л, глюкоза — 4 ммоль/л, мочевина крови — 6 ммоль/л . Осмоляльность плазмы = 2 х Na + глюкоза (ммоль/л) + мочевина (ммоль/л) = 2 х (140) + 4 + 6 = 290 мосм/кг Н2О
Одним из основных факторов, регулирующим секрецию антидиуретического гормона (АДГ) и жажду, является осмоляльность плазмы крови. Осморецепторы, находящиеся в гипоталамусе чувствительны к колебаниям осмоляльности. Изменение на 1% уже приводит к заметным изменениям секреции АДГ.
При определении осмоляльности крови выделяют два основных состояния — гиперосмоляльность и гипоосмоляльность.
Гиперосмоляльность вызывается повышением осмоляльности сыворотки крови, что является одной из частых причин возникновения комы при сахарном диабете, дегидратации головного мозга. При повышении осмоляльности крови секреция АДГ усиливается. При достижении осмоляльности около 295 мосм/кг, концентрация АДГ становится достаточной для обеспечения максимального антидиуретического эффекта (объем мочи менее 2 л/сут; осмоляльность мочи более 800 мосм/кг). Одновременно активируется и механизм утоления жажды, что приводит к увеличению потребления воды и препятствует дегидратации организма.
Гипоосмоляльность — снижение осмоляльности крови. Гипоосмоляльность может приводить к осмотическому отеку мозга и развитию синдрома внутричерепной гипертензии. Причиной снижения осмоляльности могут послужить различные факторы, например, превышение содержания свободной воды, содержащейся в плазме крови относительно объема растворенных в ней кинетических частиц. При снижении осмоляльность крови ниже порогового уровня (около 280 мосм/кг), секреция АДГ тормозится. Это приводит к выведению большого объема максимально разведенной мочи. Повышенное выведение воды предотвращает дальнейшее снижение осмоляльности плазмы, даже при значительном потреблении воды.
Осмоляльная концентрация мочи колеблется от 50 до 1400 мосмоль/л ( в плазме 295 мосмоль/л). Когда осмоляльная концентрация мочи выше, чем плазмы, то разность между этими величинами показывает количество удаленных из плазмы растворенных веществ без эквивалентной потери воды. Например, если при суточном объеме мочи 2 литра осмоляльность составляет 100 мосмоль/л, то клиренс составит 1,43 литра свободной воды за этот период. Наиболее низкая осмоляльность наблюдается при неконтролируемом несахарном диабете.
Осмоляльность крови норма (таблица). Осмоляльность крови повышена или понижена — что это значит
Осмоляльностью называют количество осмолей различных частичек и соединений, находящихся в 1 килограмме крови. Осмоль – это 1 моль нерастворимого вещества. Осмоляльность крови зависит, главным образом, от присутствующих в ней ионов хлора и натрия, и лишь в небольшой степени она зависит от мочевины и глюкозы. Осмоляльность принято выражать в миллиосмолях на килограмм (мосм/кг). Тест крови на осмоляльность считается одним из самых сложных лабораторных тестов. Между тем, он позволяет выявить самые разнообразные патологии, присутствующие в организме еще на ранних их стадиях.

Если выразиться более простым языком, то можно сказать, что осмоляльность – это густота крови. Если кровь становится слишком густой или слишком жидко, в организме человека возникают различные нарушения.
При снижении осмоляльности, как правило, у пациента наблюдаются следующие симптомы:
- быстрая утомляемость,
- значительная общая слабость,
- приступы тошноты и рвоты,
- головные боли.
Повышение осмоляльности также имеет свои симптомы:
- угнетенность сознания,
- невозможность сконцентрироваться,
- снижение отделения мочи,
- снижение температуры тела,
- влажность тела и слизистых,
- апатия, безразличие,
- нарушение жевательного и глотательного рефлексов,
- парез лицевых нервов.
Норма осмоляльности крови. Расшифровка результата (таблица)
Тест крови на осмоляльность имеет важное диагностическое значение, например, при сахарном диабете, поскольку при этом заболевании осмоляльность крови, как правило, повышается. Кроме того, подобный анализ, фактически контролирующий состояние плазмы крови, может помочь подобрать более точное и успешное лечение.
Анализ осмоляльности сыворотки крови также проводят для того чтобы оценить уровень натрия, мочевины, глюкозы. Мочевина – это один из продуктов распада белка в организме. Тест на осмоляльность помогает оценить водно-солевой баланс организма пациента. Врач может заказать этот анализ крови, если он подозревает, что у пациента развивается одно из следующих состояний:
- дегидратация, обезвоживание организма,
- дефицит натрия в крови – гипонатриемия,
- почечная недостаточность,
- отравление этанолом, этиленгликолем, метанолом.
Забор крови производится из вены, с утра, натощак. Перед сдачей анализа рекомендуется не принимать пищу в течение 6 часов, а также не употреблять никаких жидкостей, кроме чистой воды.
Норма осмоляльности крови обычных людей и беременных женщин:

Если осмоляльность повышена, что это значит?
Повышенной считается осмоляльность крови, которая превышает значение 295 миллиосмолей на кг крови. Она может возникнуть в результате следующих патологических состояний:
- обезвоживание организма,
- несахарный диабет,
- различные травмы головы,
- инсульт,
- повышенный уровень глюкозы – гипергликемия,
- повышенная концентрация натрия в крови – гипернатриемия,
- уремия – состояние, при котором почки не справляются с выводом из организма вредных веществ, в результате чего возникает интоксикация,
- отравление этанолом, метанолом или этиленгликолем.
Если осмоляльность понижена, что это значит?
В случае если норма осмоляльности крови снижается и опускается ниже 275 миллиосмолей на кг крови, она считается аномально пониженной. Подобное состояние может быть обусловлено несколькими причинами:
- чрезмерным употреблением жидкости — гипергидратацией,
- снижением концентрации натрия в крови – гипонатриемией,
- паранеопластическим синдромом, вызванным злокачественной опухолью,
- синдромом Пархона – синдром неадекватной секреции антидиуретческого гормона.
Одни из этих причин более серьезны, другие – менее. После получения результатов анализа врач должен сопоставить их с результатами других исследований, поставить точный диагноз и назначить соответствующее лечение.
Осмолярность мочи Что это такое, чем оно служит, исчисление
осмолярность мочи концентрация активных осмотических растворов в моче. Это несколько двусмысленное понятие, которое будет объяснено на самом классическом примере: смесь. Вся жидкая смесь состоит из растворителя, обычно воды, как в случае с мочой, и одного или нескольких растворенных веществ..
Даже когда они «смешаны», они не «объединены»; то есть ни один из компонентов смеси не теряет своих собственных химических характеристик. Такое же явление происходит в моче. Его основной компонент, вода, служит растворителем для ряда растворенных веществ или частиц, которые покидают организм через это.
Его концентрация может быть измерена или рассчитана с помощью ряда формул или оборудования. Эта концентрация известна как осмолярность мочи. Разница с осмоляльностью заключается в том, что она измеряется количеством частиц на килограмм, а не на литр, как в осмолярности..
Однако в моче, являющейся в основном водой, расчет очень похож, если только нет патологических состояний, которые сильно их изменяют..
- 1 Из чего он состоит??
- 1.1 Концентрация и разведение мочи
- 2 Для чего он используется??
- 2.1 Последствия повышенной осмоляльности мочи
- 2.2 Последствия снижения осмолярности мочи
- 3 Как рассчитывается??
- 3.1 Вторая формула
- 3.2 Осмолярная депурация
- 4 нормальных значения
- 4.1 Тест на лишение воды
- 4.2 Экзогенное введение десмопрессина
- 4.3 Тест на перегрузку жидкостью
- 5 ссылок
Из чего он состоит??
Процесс, с помощью которого моча концентрируется или разбавляется, является очень сложным, требующим правильной интеграции двух независимых почечных систем: создания градиента растворенных веществ и активности антидиуретического гормона..
Концентрация и разбавление мочи
Создание осмолярного градиента растворенных веществ происходит в петле Генле и в мозговом веществе почки. Там осмолярность мочи увеличивается от значений, аналогичных значениям плазмы (300 мОсм / кг), до уровней, близких к 1200 мОсм / кг, все это благодаря реабсорбции натрия и хлора в толстой части восходящей петли Генле.
После этого моча проходит через кортикальные и медуллярные собирающие канальцы, где реабсорбируются вода и мочевина, что способствует созданию осмотических градиентов..
Аналогичным образом, тонкая часть восходящей петли Генле способствует снижению осмолярности мочи благодаря ее проницаемости для хлора, натрия и, в меньшей степени, для мочевины..
Как следует из названия, антидиуретический гормон предотвращает или уменьшает выброс мочи, чтобы в нормальных условиях экономить воду.
Этот гормон, также известный как вазопрессин, затем активируется в ситуациях с высокой осмолярностью плазмы (> 300 мОсм / кг) для поглощения воды, которая в конечном итоге разбавляет плазму, но концентрирует мочу..
Для чего это??
Осмолярность мочи — это лабораторное исследование, в котором показано, что концентрация мочи определена с большей точностью, чем та, которая определяется по плотности мочи, поскольку она измеряет не только растворенные вещества, но и количество молекул на литр мочи..
Он показан во многих медицинских состояниях, как острых, так и хронических, при которых может иметь место повреждение почек, гидроэлектролитические нарушения и нарушение обмена веществ..
Последствия повышенной осмолярности мочи
— Высокое потребление белка.
— Синдром неадекватной секреции антидиуретического гормона.
— Хронические заболевания печени.
— Септический и гиповолемический шок.
Последствия снижения осмолярности мочи
— Острые инфекции почек.
— Острая или хроническая почечная недостаточность.
Как рассчитывается?
Первая формула
Самым простым методом для вычисления осмолярности мочи является определение плотности мочи и применение следующей формулы:
Осмолярность мочи (мОсм / кг или л) = плотность мочи — 1000 x 35
В этом выражении значение «1000» представляет собой осмолярность воды, а значение «35» представляет собой постоянную осмолярность почек..
К сожалению, на этот результат влияют многие факторы, такие как введение определенных антибиотиков или присутствие белков и глюкозы в моче..
Вторая формула
Чтобы использовать этот метод, необходимо знать концентрацию электролитов и мочевины в моче, потому что элементами с осмотической силой в моче являются натрий, калий и вышеупомянутая мочевина..
Осмолярность мочи (мОсм / K или L) = (Na u + K u) x 2 + (мочевина u / 5,6)
В указанном выражении:
Na u: мочевой натрий.
K u: Мочевой калий.
Мочевина U: мочевина мочевина.
Моча может быть устранена в разных концентрациях: изотонической, гипертонической и гипотонической. Термины изоосмолярный, гиперосмолярный или гипоосмолярный обычно не используются для какофонии, но относятся к тому же.
Осмолярная депурация
Для определения концентрации растворенных веществ используют формулу осмолярной очистки:
C osm = (Osm) моча x V min / Osm) кровь
C osm: осмолярная депурация.
(Osm) моча: осмолярность мочи.
V min: минутный объем мочи.
(Osm) кровь: осмолярность плазмы.
Из этой формулы можно сделать вывод, что:
— Если моча и плазма имеют одинаковую осмолярность, они исключаются из формулы, и осмолярный клиренс будет равен объему мочи. Это происходит в изотонической моче.
— Когда осмоляльность мочи превышает осмолярность плазмы, мы говорим о гипертонической или концентрированной моче. Это означает, что осмолярный клиренс больше, чем поток мочи.
— Если осмолярность мочи ниже, чем осмотическая плазма, моча является гипотонической или разбавленной, и делается вывод, что осмолярный клиренс меньше, чем поток мочи..
Нормальные значения
В зависимости от условий, в которых берутся пробы мочи, результаты могут отличаться. Эти модификации в коллекции сделаны специально для определенных целей..
Тест водной депривации
Пациент прекращает употреблять жидкости в течение не менее 16 часов, употребляя только сухие продукты на обед. Результаты колеблются между 870 и 1310 мОсм / кг со средним значением 1090 мОсм / кг..
Экзогенное введение десмопрессина
Десмопрессин выполняет роль, аналогичную вазопрессину или антидиуретическому гормону; то есть он реабсорбирует воду из мочи в плазму, уменьшая количество выделяемой мочи и, следовательно, увеличивая ее концентрацию.
Нормальные значения, полученные в этом тесте, составляют от 700 до 1300 мОсм / кг, в зависимости от возраста и клинических условий пациента..
Тест на перегрузку жидкостью
Хотя способность разводить мочу не представляет большого клинического интереса, она может быть полезна для диагностики определенных центральных нарушений в управлении осмолярностью мочи, как в случае несахарного центрального диабета или синдрома несоответствующей секреции антидиуретического гормона..
В течение короткого времени вводят 20 мл / кг воды, а затем мочу собирают в течение 3 часов. Обычно дело в том, что осмолярность мочи падает до значений, которые составляют около 40 или 80 мОсм / кг, если нет связанных патологий.
Все эти сильно различающиеся результаты ценны только тогда, когда они изучаются врачом-специалистом, оцениваются в лабораториях и в клинике пациента..
Осмолярность мочи: что это, диагностика и показатели
Исследование мочи позволяет доктору делать выводы о наличии определенных заболеваний в человеческом организме. Одним из показателей является осмолярность.
Осмолярность мочи – что это
Анализы мочи характеризуют способность системы почек задерживать определенные элементы, выполнять фильтрующую функцию. Также они дают оценку состояния сердечно-сосудистой системы, показывают нарушения в эндокринной сфере, указывают на наличие воспалительного процесса.
Особое внимание при исследовании мочи уделяют осмолярности. На изменение этого показателя влияют лейкоциты, бактерии и белок.

Под осмолярностью понимают значение, характеризующее концентрационную функцию системы почек. Удельный вес урины связан с весовой концентрацией и прямо пропорционален осмолярности. Представление об осмолярности тесно связано с осмотическим давлением, которое характеризует динамическое соотношение жидкости и растворенных в ней частиц соли.
Важность выявления осмолярности в том, что нарушения водно-минерального баланса провоцируют изменение метаболических процессов и приводят к появлению множества заболеваний.
Диагностика и как определить
Для определения осмолярности применяют специальные приборы, которые называются осмометрами. Они бывают разных типов.
Работа их базируется на определенных законах физики:
- Давление пара. Для проведения анализа требуется минимальный объем мочи. Действие основано на уменьшении давления пара растворителя над раствором. Обычно метод применяют в практике педиатрии для новорожденных детей.
- Понижение точки замерзания. Чем процесс замерзания длится дольше, тем осмолярность выше. Криоскопическое оборудование широко используется медиками.
- Мембранные осмометры. Принцип их работы состоит в том, что урина пропускается через природную либо искусственную мембрану. В этот момент специалист выполняет нужные замеры.
- Повышение точки кипения. Чем позже закипает раствор, тем осмолярность выше. В медицине такие приборы применяются крайне редко. Обычно они используются для исследования небиологических жидкостей.

Подготовка
Чтобы результаты анализа получились достоверными, надо определенным образом подготовиться к процедуре.
Пациенту рекомендуется придерживаться правил:
- Перед сбором урины вымыть половые органы.
- Первые капли мочи следует спустить в унитаз, а потом собрать оставшуюся биологическую жидкость в емкость.
- Женщинам перед наполнением сосуда уриной лучше прикрыть тампоном влагалище.
- Для сбора желательно купить специальный стерильный контейнер в аптеке.
- За 12 часов до забора пробы надо прекратить прием жидкости.
- За сутки до прохождения обследования стоит откорректировать рацион питания согласно советам доктора.
- Если человек на днях проходил рентгеновское обследование с применением контрастного вещества, ему следует отложить анализ на осмолярность минимум на пять дней. Иначе результаты будут искаженными.
Проведение исследования
Диагностика проводится просто и безболезненно. Пациенту нужно собрать 50-100 мл утренней урины и отнести ее в лабораторию. Мочу лучше долго не хранить, а направить на анализ сразу после забора. Специалист проведет исследование биологической жидкости при помощи специального прибора и выдаст заключение. Обычно результаты готовы на следующий день.
На точность диагностики способны повлиять медикаменты, которые содержат декстран и сукрозу. Поэтому при прохождении лечебного курса такими препаратами пациент должен поставить в известность специалиста: сообщить о том, какие именно таблетки он принимает и в какой дозировке.
Результаты и расшифровка
Полученные результаты позволяют доктору определить характер патологии, тяжесть протекания болезни. Нормальным признан показатель осмолярности, находящийся в пределах от 800 до 1200 мосм/л.
Если результат показал гипоосмолярность, это может означать такие патологии:
- Пиелонефрит.
- Недостаточность почек.
- Несахарный диабет.
- Некроз почечных канальцев.
- Нарушение водно-солевого обмена.
- Задержка жидкости в организме.
Выраженность нарушений можно определить по степени отклонения показателя от нормы:
- 400-600 мосм/л свидетельствует об умеренном снижении фильтрующей функции почек.
- 600-800 мосм/л отражает первичные изменения в работе системы почек.
- Ниже 400 мосм/л говорит о значительных нарушениях в мочеполовой сфере.
Гиперосмолярное состояние (при котором значение превышает отметку 1200 мосм/л) характеризуется формированием отеков, гипертензией, неполадками в работе сердца.
Такое отклонение от нормы провоцируют:
- Застойная сердечная недостаточность.
- Стеноз почечной артерии.
- Дегидратация.
- Глюкозурия.
- Обезвоживание.
- Пиелонефрит.
- Шок.
Сильное превышение концентрации осмолярности приводит к серьезным нарушениям в работе органов, коме.
Точную расшифровку обследования способен провести только доктор. При этом врач учитывает и другие анализы, сданные пациентом. Изучение клинической картины и результатов исследований дает основание поставить верный диагноз и подобрать действенную схему лечения.
Осмоляльность и Осмолярность 2020
Осмоляльность против Осмолярности
Осмоляльность и осмолярность являются единицами измерения. Осмоляльность — это количество осмолей растворенного вещества в килограмме растворителя, а осмолярность — количество осмолей растворенного вещества в литре раствора. Осмол представляет собой один моль любого нерасщепляемого вещества. Он будет содержать 6,02 × 1023 частиц.
Осмолярность представляет собой концентрацию осмотического раствора. Обычно это измеряется в осмолях. Осмолярность также используется для определения определенных заболеваний, таких как растворенные частицы в моче. Объем раствора будет изменяться с добавлением растворенных веществ, а также с любым изменением температуры или давления. Поэтому осмолярность иногда трудно определить.
Осмолальность имеет дело с концентрацией частиц, которые растворяются в жидкости. В медицинской науке осмоляльность используется для определения нескольких состояний, таких как диабет, обезвоживание и шок. Для обнаружения этих условий осмоляльность сыворотки проверяется и известна как осмоляльность плазмы. Рассчитывают концентрацию таких веществ, как хлорид, натрий, калий, глюкоза и мочевина.
Объем растворителя остается неизменным независимо от любых изменений давления или температуры, поэтому относительно легко определить осмоляльность. В связи с этим осмоляльность является общим методом измерения в осмометрии.
Осмоляльность измеряет количество частиц в единице веса растворителя и не зависит от формы, размера или массы частиц. Свойства, на основе которых измеряется концентрация частиц, известны как коллигативные свойства. Свойствами являются депрессия давления пара, депрессия точки замерзания, повышение температуры кипения и осмотическое давление.
Обычно осмолярность выражается как Osm / L и осмоляльность как Osm / Kg. Для измерения осмоляльности используется инструмент, известный как осмометр, и он работает с использованием метода депрессии замерзания.
Разница между расчетной осмолярностью и измеренной осмоляльностью известна как осмолярный зазор. Значения представлены в разных единицах, и это связано с различием в методе расчета и измерения. Аббревиатурой для измеренной осмоляльности является МО, а для расчетной осмолярности — СО. Осмолярный зазор представлен как OG. Если концентрация растворенных веществ в данной жидкости очень низкая, то осмоляльность и осмолярность считаются эквивалентными.
Резюме:
1. Если осмоляльность — это количество осмолей растворенного вещества в килограмме растворителя, то осмолярность — это количество осмолей растворенного вещества в литре раствора. 2. Осмолярность имеет дело с концентрацией осмотического раствора, а осмоляльность — с концентрацией частиц в жидкости. 3. Легче определить осмоляльность, ч
Что такое осмолярность и осмоляльность детской смеси
Осмоляльность 300 или осмолярность 400 — одни значения подходят организму грудного ребенка, другие приведут к сбою в работе его кишечника и увеличат нагрузку на почки. Что такое осмолярность детской смеси и почему для нее не может быть одной правильной цифры? Этот вопрос хотя бы раз задавала каждая мама врачу своего ребенка на искусственном вскармливании. В поисках ответа мы вновь обратились к врачу-педиатру и ведущему эксперту онлайн-школы для будущих и состоявшихся родителей «SMART Mama» Полине Александровне Кизино.
— Полина Александровна, поговорим сегодня, казалось бы, об одинаковых понятиях — осмоляльности и осмолярности смеси. Что это такое?
— Эти два понятия достаточно похожи, но означают не одно и то же. Вспомним основы химии и физики — что такое осмос и осмотическое давление.
- Осмос — процесс движения воды из менее концентрированного раствора в более концентрированный, чтобы разбавить последний и сделать концентрацию одинаковой.
- Осмотическое давление — создается частицами (белками и солями детской смеси) между двумя растворами с меньшей и большей концентрацией. Чем больше таких частиц в растворе, тем больше осмотическое давление.
- Осмолярность и осмоляльность отражают количество частиц, которые создают осмотическое давление. Осмолярность питания показывает концентрацию белков и солей, создающих давление в одном литре смеси. Осмоляльность детских смесей — по сути, то же самое: количество частиц, создающих давление, но уже в одном килограмме. Таким образом, у питания может быть разная осмолярность и осмоляльность в зависимости от того, сколько весит один литр смеси.
— Какова осмолярность грудного молока?
— Грудное молоко — это непостоянный раствор. Его концентрация меняется в зависимости от времени суток и окружающих условий, поэтому у него нет постоянной осмолярности. Средний показатель — 240—280 мл/осмоль на литр.

— Почему осмолярность у молочных смесей может быть чуть выше, чем у грудного молока?
— Адаптированная молочная смесь призвана покрыть основные потребности ребенка в питательных веществах. И для того чтобы грудничок получил максимально нужное количество нутриентов, но не перебрал с объемом смеси, нужно найти золотую середину в соотношении между концентрацией и объемом. Именно из-за того, что в смеси собрано максимально возможное количество питательных веществ, ее осмолярность может быть немного выше, что некритично. Адаптированная молочная смесь имеет осмолярность, которая легко и хорошо переносится ребенком.
— Осмолярность детской смеси — чем в данном случае адаптированные смеси отличаются от обычных и от цельного молока?
— Осмолярность цельного молока — около 400 мл/осмоль на литр — это слишком высокая концентрация белков и солей. Она тяжело переносится и не подходит для питания грудного ребенка. Поэтому цельное молоко с точки зрения осмолярности — не самое лучшее питание для малыша первых трех лет. Концентрация и пропорции белков молочной смеси изменены и адаптированы под особенности детского организма для более комфортного переваривания и усвоения.
Неадаптированные молочные смеси по белковому составу, осмолярности и другим компонентам являются неподходящими для ребенка младшего возраста.
— Норма осмолярности для детской смеси — какой коридор значений допустим?
— Верхняя граница нормы — 320 мл/осмоль на литр, нижняя — около 280 мл/осмоль на литр. Смесь с низкой осмолярностью, например, в 200 мл/осмоль на литр, содержит мало белков, солей и питательных веществ. И для того чтобы покрыть потребности ребенка в них, придется дать ему большее количество смеси, что совершенно неправильно. Поэтому производители стараются держать показатель осмолярности именно в обозначенном коридоре.
— Каковы последствия высокого/низкого показателя осмолярности для ребенка?
— Важно, чтобы родители всегда придерживались рекомендаций по разведению смеси, которые дает производитель. Бытует мнение, что если ребенок голоден, то смесь можно сделать насыщеннее, если жарко — сильнее развести водой. Такие вещи делать ни в коем случае нельзя, потому что завышение или занижение осмолярности нарушает движение воды в организме ребенка. Либо в кишечник будет привлекаться очень много воды, чтобы растворить очень концентрированную смесь, либо, наоборот, вода из очень водянистой смеси будет более активно всасываться кишечником ребенка. Все должно быть в меру.
Читайте также: о нуклеотидах в детских молочных смесях.
— Как осмолярность смеси влияет на ЖКТ (желудочно-кишечный тракт)?
— Осмолярность влияет на транспорт воды в организме, поскольку со смесью ребенок получает не только питательные вещества, но и необходимую воду.
Работа желудочно-кишечного тракта напрямую от осмолярности не зависит.
Но очень концентрированная смесь, насыщенная белками и прочими питательными веществами, может с трудом продвигаться по кишечнику и приводить к запорам. Менее концентрированная смесь, наоборот, будет приводить к разжижению стула. Концентрация смеси важна для того, чтобы пищеварительная система маленького ребенка работала правильно, стул не был слишком плотным или слишком жидким.
— Как узнать, какова осмоляльность или осмолярность смеси? Как ее обозначают производители?
— Самый верный источник — упаковка смеси. На оборотной этикетке, обычно в самом низу, производитель указывает осмолярность или осмоляльность смеси. Они примерно одинаковые (1 литр смеси весит примерно 1 кг), и сильных расхождений обычно не бывает.
Осмоляльность смеси MAMAKO® Premium
- 1 формула – 300 мОсмс/кг
- 2 формула – 300 мОсмс/кг
- 3 формула – 300 мОсмс/кг
Осмоляльность и осмолярность отражают насыщенность смеси белками и солями. В случае со смесью расхождения в этих показателях минимальные. Кроме того, они близки к показателям грудного молока, чтобы ребенок легко усваивал питание. Именно поэтому в кормлении малыша стоит использовать адаптированную молочную смесь, которая будет соответствовать его потребностям.
Врач-педиатр
Полина Александровна Кизино
*Идеальным питанием для грудного ребенка является молоко матери. ВОЗ рекомендует исключительно грудное вскармливание в первые 6 мес. МАМАКО® поддерживает данную рекомендацию. Перед введением в рацион малыша новых продуктов проконсультируйтесь со специалистом.
2.2.35. Осмоляльность
Осмоляльность — это показатель, позволяющий оценить суммарный вклад различных растворенных веществ в осмотическое давление раствора. Приближенный расчет осмоляльности %m водного раствора проводят по формуле:
где:
J — суммарное число ионов, образующихся из одной молекулы растворенного
вещества в результате диссоциации. В случае, если растворенное
вещество не диссоциирует на ионы, J = 1; т — моляльность раствора, т.е. число молей растворенного вещества на
килограмм растворителя; Ф — моляльный осмотический коэффициент, учитывающий взаимодействие между
ионами противоположного знака в растворе и зависящий от величины т.
По мере усложнения состава раствора усложняется и определение
величины Ф.
Единицей осмоляльности является осмоль на килограмм растворителя (осмоль/кг), но на практике обычно используется единица милллиосмоль на килограмм растворителя (мосмоль/кг).
Осмоляльность определяют по понижению температуры замерзания раствора, если нет других указаний в частной статье. Зависимость между осмоляльностью и понижением температуры замерзания ЛТ выражают соотношением:
DT
X m = 100 мосмоль / кг
1,86
Прибор. Составными частями прибора (осмометра) являются:
приспособление для охлаждения сосуда с измерительной кюветой;
система для измерения температуры, состоящая из чувствительного к температуре сопротивления (термистора) с соответствующим устройством для измерения тока или разности потенциалов. Измерительное устройство может быть градуировано в градусах понижения температуры или непосредственно в единицах осмоляльности;
как правило, приспособление для перемешивания образца.
Методика. Готовят стандартные растворы в соответствии с таблицей 2.2.35.1.
Устанавливают нулевое значение на шкале прибора, используя воду Р. Проводят градуировку прибора, используя стандартные растворы: помещают от 50 мкл до 250 мкл стандартного раствора в измерительную ячейку и начинают охлаждение системы. Чтобы предотвратить переохлаждение, измерительное устройство, как правило, программируют на работу при температурах более низких, чем ожидаемое криоскопическое понижение температуры.Соответствующее устройство указывает на достижение равновесия. Перед каждым измерением ячейку ополаскивают соответствующим стандартным раствором.
Те же операции проводят с испытуемым раствором. При этом перед каждым измерением кювету ополаскивают испытуемым раствором. Результаты либо непосредственно определяют по шкале прибора, либо рассчитывают по измеренному понижению температуры замерзания. Результаты считают достоверными, если полученное значение осмоляльности испытуемого раствора не выходит за пределы значений осмоляльности двух стандартных растворов, использованных для калибровки.
Наряду с понятием «осмоляльность» в практике используется понятие «осмолярность». Аналогично осмоляльности осмолярность — показатель, позволяющий оценить суммарный вклад различных растворенных веществ в осмотическое давление раствора.
Осмоляльность — количество осмолей на 1 кг растворителя;
Осмолярность — количество осмолей на 1 л раствора.
Для идеальных растворов масса осмоля, в граммах, представляет собой отношение грамм-молекулярной массы вещества к числу частиц или ионов, образующихся при его растворении.
Для разбавленных растворов, близких к идеальным, осмоляльность и осмолярность могут быть рассчитаны теоретически.
Осмолярность идеальных растворов может быть рассчитана по формуле: концентрация вещества ■ количество частиц
Осмолярность =
молекулярная масса
где:
концентрация вещества — количество растворенного вещества на литр раствора, в граммах;
количество частиц — число частиц или ионов, образующихся при растворении одной молекулы вещества.
# Единицей осмолярности является осмоль на литр раствора (осмоль/л), но на практике обычно используется единица миллиосмоль на литр раствора (мосмоль/л).
При повышении концентрации раствора взаимодействие между частицами вещества возрастает и фактическая осмолярность понижается по сравнению с осмолярностью идеального раствора. Теоретический расчет осмолярности растворов веществ с большой молекулярной массой (например, белковых гидролизатов) и высококонцентрированных растворов невозможен. В таких случаях определяют осмоляльность экспериментальным путем по понижению температуры замерзания раствора или по понижению давления пара над раствором. Понижение температуры замерзания на 1.86°С и понижение давления пара на 0.3 мм рт.ст. при температуре 25°С соответствует 1 осмолю на килограмм воды.
Растворы, равные по осмоляльности (осмолярности) 0.9 % раствору натрия хлорида, называют изотоничными.
Наряду с прибором, описанным выше, для определения осмоляльности могут использоваться также осмометры, основанные на измерении давления пара над раствором. Они требуют малого объема вводимой пробы (около 5 мкл), при этом точность и правильность определения сравнима с величинами, получаемыми на приборах, основанных на измерении температуры замерзания.
В осмометрах, основанных на измерении понижения температуры замерзания, объем вводимой пробы образца можно варьировать.
Указание значения осмоляльности (осмолярности) в маркировке препаратов. Значение осмоляльности (осмолярности) необходимо указывать на этикетках инфузионных растворов.
