| +Более подробно о показаниях к реваскуляризации миокарда при хронической ИБС для специалистовПоказания к реваскуляризации миокарда при хронической ИБС базируются на трех основных критериях: тяжести клинической картины заболевания, характере поражения коронарного русла, состоянии сократительной функции миокарда. Основным клиническим показанием к реваскуляризации миокарда является тяжелая стенокардия резистентная к медикаментозной терапии. Тяжесть стенокардии оценивается по субъективным показателям (функциональный класс), а также по объективным критериям – толерантность к физической нагрузке, определяемая по данным велоэргометрии или тредмил-теста. Следует учитывать, что степень клинических проявлений заболевания не всегда отражает тяжесть поражения коронарного русла. Существует группа больных, у которых при относительно скудной клинической картине заболевания отмечаются выраженные изменения ЭКГ покоя в виде так называемой безболевой ишемии по данным Холтеровского мониторирования. Эффективность медикаментозной терапии зависит от качества препаратов, правильно подобранных дозировок, и в большинстве случаев современная медикаментозная терапия весьма эффективна в смысле устранения болевого синдрома и ишемии миокарда. Однако следует помнить, что катастрофы в течении ИБС связаны обычно с нарушением целостности атеросклеротической бляшки и поэтому степень и характер поражения коронарного русла по данным коронарографии являются наиболее важными факторами при определении показаний к операции АКШ. Селективная коронарография остается на сегодняшний день наиболее информативным методом диагностики, позволяющим верифицировать диагноз ИБС, определить точную локализацию, степень поражения коронарных артерий и состояние дистального русла, а также прогнозировать течение ИБС и ставить показания к хирургическому лечению. Коронарограмма левой коронарной артерии: критический стеноз ствола ЛКА с хорошим дистальным руслом Одним из важнейших условий выполнения прямой реваскуляризации миокарда является наличие проходимого русла дистальнее гемодинамически значимого стеноза. Принято различать хорошее, удовлетворительное и плохое дистальное русло. Под хорошим дистальным руслом подразумевают проходимый до концевых отделов, без неровности контуров, удовлетворительного диаметра участок сосуда ниже последнего гемодинамически значимого стеноза. Об удовлетворительном дистальном русле говорят при наличии неровности контуров или гемодинамически незначимых стенозов в дистальных отделах коронарной артерии. Под плохим дистальным руслом понимают резкие диффузные изменения сосуда на всем протяжении или отсутствие контрастирования его дистальных отделов. Коронарограмма: диффузное поражение коронарных артерий с вовлечением дистального русла Важнейшим фактором успеха операции считается сохранная сократительная функция, интегральным показателем которой является фракция выброса (ФВ) левого желудочка (ЛЖ), определяемая по эхокардиографии или по рентгеноконтрастной вентрикулографии. Принято считать, что нормальное значение ФВ составляет 60-70%. При снижении ФВ менее 40% риск операции значительно возрастает. Снижение ФВ может быть как результатом рубцового поражения, так и ишемической дисфункции. В последнем случае оно обусловлено «гибернацией» миокарда, представляющей собой приспособительный механизм в условиях хронического дефицита кровоснабжения. При определении показаний к АКШ в этой группе больных важнейшим является дифференциация необратимой рубцовой и смешанной рубцово-ишемической дисфункции. Стресс-эхокардиография с добутамином позволяет выявить локальные нарушения сократимости в зонах миокарда и их обратимость. Ишемическая дисфункция потенциально обратима и может регрессировать при успешной реваскуляризации, что дает основания рекомендовать этим больным хирургическое лечение.Техника операции реваскуляризации миокарда Операция АКШ заключается в создании обходного пути для крови минуя пораженный (стенозированный или окклюзированный) проксимальный сегмент коронарной артерии. Существует два основных метода создания обходного пути: маммарокоронарный анастомоз и обходное аортокоронарное шунтирование аутовенозным (собственной веной) или аутоартериальным (собственной артерией) трансплантатом (кондуитом). Маммарокоронарное шунтирование. Схематическое изображение наложения маммарно-коронарного анастомоза (шунта между внутренней грудной артерией и коронарной артерией)При маммарокоронарном шунтировании используют внутреннюю грудную артерию (ВГА), ее обычно «переключают» на коронарное русло путем анастомозирования с коронарной артерией ниже стеноза последней. ВГА заполняется естественным путем из левой подключичной артерии, от которой она отходит. Аортокоронарное шунтирование. Схематическое изображение наложения аорто-коронарного анастомоза (шунта между аортой и коронарной артерией)При аортокоронарном шунтировании используют так называемые «свободные» кондуиты (из большой подкожной вены, лучевой артерии или ВГА) дистальный конец анастомозируют с коронарной артерией ниже стеноза, а проксимальный – с восходящей аортой. Прежде всего, важно подчеркнуть, что АКШ – это микрохирургическая операция, поскольку хирург работает на артериях диаметром 1,5-2,5 мм. Именно осознание данного факта и внедрение прецизионной микрохирургической техники обеспечило тот успех, который был достигнут в конце 70-х – начале 80-х гг. прошлого века. Операцию проводят с использованием хирургических бинокулярных луп (увеличение х3-х6), а некоторые хирурги оперируют с применением операционного микроскопа, позволяющего достичь увеличения х10 – х25. Специальный микрохирургический инструментарий и тончайшие атравматические нити (6/0 – 8/0) дают возможность максимально прецизионно сформировать дистальные и проксимальные анастомозы. Операцию проводят под общим многокомпонентным обезболиванием, а в ряде случаев, особенно при выполнении операций на бьющемся сердце дополнительно используют высокую эпидуральную анестезию. Техника аортокоронарного шунтирования. Операцию осуществляют в несколько этапов: Многочисленные исследования убедительно доказали, что операции прямой реваскуляризации миокарда увеличивают продолжительность жизни, снижают риск развития инфаркта миокарда и улучшают качество жизни по сравнению с медикаментозной терапией, особенно в группах больных с прогностически неблагоприятным поражением коронарного русла. Как подготовиться к операции коронарного шунтирования? |
Маммарокоронарное шунтирование из левосторонней торакотомии на современном этапе развития коронарной хирургии — Кардиология и сердечно-сосудистая хирургия — 2014-02
Общепризнанными пионерами в сфере разработки и становления маммарокоронарного шунтирования (МКШ) были отечественные ученые. В.П. Демихов в начале 50-х годов XX века разработал методику маммарокоронарного анастомоза в эксперименте на собаках. МКШ из левосторонней торакотомии посвящены работы В.И. Колесова [5, 21].
В феврале 1964 г. В.И. Колесов успешно выполнил плановую операцию МКШ из левосторонней торакотомии с наложением дистального анастомоза конец в конец, причем операция выполнялась на работающем сердце.
В 1967 г. им опубликованы результаты 24 подобных операций с хорошими результатами. В.И. Колесов одним из первых в 1968 г. выполнил операцию бимаммарного шунтирования, применив двусторонний торакотомный доступ.
В 1967 г. R. Favaloro открыл эру коронарного шунтирования в условиях искусственного кровообращения (ИК). Для доступа ко всем коронарным артериям идеально подходила срединная стернотомия. Методика в кратчайшие сроки была успешно внедрена в ведущих клиниках мира, и операции МКШ из левосторонней торакотомии надолго стали редким вариантом, носящим в основном исторический аспект. Целые поколения хирургов не только никогда их не выполняли, но даже не видели эти операции в исполнении своих учителей.
В середине 80-х годов вновь возник интерес хирургов к операциям МКШ из левосторонней торакотомии. Окклюзия или бифуркационный стеноз передней межжелудочковой ветви (ПМЖВ) и диагональной ветви (ДВ) является основным показанием к МКШ из левосторонней торакотомии. Авторы отмечали многочисленные трудности и ограничения методики — отсутствие специализированного инструментария для мобилизации внутренней грудной артерии (ВГА) и, как следствие, оставление функционирующей первой межреберной ветви, вариабельность расположения ПМЖВ и невозможность выбрать адекватное место для наложения дистального анастомоза из ограниченного доступа, интрамиокардиальный ход ПМЖВ, невозможность быстрой конверсии к ИК в случае нестабильной гемодинамики [9, 11].
Неоспоримым преимуществом МКШ из левосторонней торакотомии все авторы считают возможность его выполнения без срединной стернотомии и ИК [1-4, 10].
Операции МКШ из левосторонней торакотомии снова были практически забыты с появлением коронарных стентов. Однако техническая невозможность реканализации хронической окклюзии ПМЖВ и тщательное изучение отдаленных результатов стентирования проксимального отдела ПМЖВ, показавшее преимущество МКШ, заставило хирургов вернуться к выполнению МКШ из левосторонней торакотомии [13, 17, 24, 25].
Период с 1995 г. до начала 2000 г. можно охарактеризовать как бум коронарной хирургии на работающем сердце, в частности МКШ из левосторонней торакотомии, хотя рассмотрение лишь длины разреза в качестве определяющего фактора, снижающего операционную травму, не совсем верно. Позже ряд авторов [4, 18, 27] указали, что отказ от ИК, кардиоплегии, переливания крови и длительной искусственной вентиляции легких снижает риск для пациента в большей степени, чем длина или локализация хирургического доступа.
«Второму рождению» МКШ из левосторонней торакотомии в СССР мы обязаны выдающемуся кардиохирургу и новатору, академику Г.М. Соловьеву [8], коллектив под руководством которого еще в 1989 г. начал успешно выполнять подобные операции. В настоящее время опытом подобных операций располагают ряд российских хирургов — В.Ю. Мерзляков, В.А. Подкаменный [6, 7].
Со временем большинство ограничений и противопоказаний стало носить формальный и исторический характер, появляются сообщения о МКШ из левосторонней торакотомии при тяжелом многососудистом поражении, о возможности конверсии к ИК из торакотомии; специальные наборы инструментов позволили облегчить полную мобилизацию ВГА до подключичной артерии [14, 16, 23].
Совершенствование хирургической техники, инструментария и анестезиологического пособия позволяют в настоящее время быстро и безопасно выполнить полную мобилизацию ВГА, вакуумную стабилизацию миокарда и под контролем зрения наложить качественный анастомоз с ПМЖВ [15, 19, 20].
Важным фактором, позволяющим ожидать еще большего увеличения количества МКШ из левосторонней торакотомии, следует считать рождение и развитие гибридной хирургии, когда в дополнение к маммарокоронарному анастомозу с ПМЖВ проводится стентирование других коронарных бассейнов и достигается полная реваскуляризация миокарда из малотравматичного доступа без ИК. К преимуществам такого подхода можно отнести возможность достижения полной реваскуляризации миокарда без ИК и срединной стернотомии у больных с высоким риском развития раневых осложнений (при хронической обструктивной болезни легких, сахарном диабете, выраженном ожирении) [12, 22, 26].
С 2009 г. в отделении кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова мы начали выполнять операции МКШ из левосторонней торакотомии у больных как с изолированным поражением ПМЖВ или ДВ, так и с многососудистым поражением. К настоящему времени выполнено 14 операций, серьезных осложнений и летальных исходов не было, 2 больным с тяжелым многососудистым поражением коронарного русла в разные сроки выполняли второй этап хирургического лечения — транслюминальную баллонную ангиопластику со стентированием в бассейнах ОА и ПКА.
Материал и методы
Всего МКШ из левосторонней торакотомии выполнено 14 больным. У 2 больных МКШ сочеталось с каротидной эндартерэктомией. В одном случае выполнена конверсия доступа ввиду выраженного атеросклеротического поражения целевой артерии и невозможности визуализировать дистальный отдел ПМЖВ из торакотомии.
Все больные прошли стандартное обследование перед операцией: изучены анамнестические данные, результаты клинических и инструментальных исследований, наиболее важные клинические данные отражены в табл. 1.
Все операции выполнены одним хирургом, имеющим опыт реваскуляризации миокарда в условиях ИК и на работающем сердце. Операции выполнялись по стандартной методике в условиях комбинированного эндотрахеального наркоза, однолегочную вентиляцию легких не использовали ни в одном случае. На первых 3 операциях больного укладывали в положении на правый бок под углом 350° с фиксацией левой руки над головой, однако в последующем от данной методики отказались и использовали стандартную укладку больного прямо на спине.
В 2 случаях, учитывая гемодинамически значимое поражение внутренней сонной артерии, больным выполняли сочетанные операции — каротидную эндартерэктомию и МКШ. Первым этапом всегда выполняли реваскуляризацию головного мозга. Для оценки адекватности коллатерального кровотока головного мозга использовали мониторинг скорости кровотока в средней мозговой артерии на стороне операции до и после пробного пережатия. Ни в одном случае показаний к применению временного шунтирования кровотока во внутренней сонной артерии не было.
Для интраоперационной оценки функции маммарокоронарного шунта у 5 пациентов применяли метод ультразвуковой допплеровской флоуметрии (VeriQ, «Medistim», Норвегия).
Все операции выполнены с использованием оптического увеличения 3,5 («Design ForVision», США) и ксенонового источника света с волоконно-оптическим световодом («Luxtec», США).
После обработки грудной клетки пациента операционное поле заклеивали хирургической пленкой, с обязательной визуализацией ключицы, грудины, яремной вырезки, эпигастральной области и передней подмышечной линии. В зависимости от конституциональных особенностей пациента и предполагаемого места наложения дистального анастомоза выполняли переднюю торакотомию в четвертом или пятом межреберье длиной от 6 до 12 см, медиальный край разреза проходил по парастернальной линии. Для разведения раны использовали малый торакальный расширитель. Легкое отводили тупфером латерально и вниз, после чего осуществляли визуализацию левой ВГА. Мобилизацию ВГА проводили сначала в каудальном, потом в краниальном направлении, на протяжении от шестого-седьмого межреберья до подключичной артерии, по методике полной скелетизации. Специальные ретракторы и инструменты мы не использовали, но их применение возможно и желательно. После введения полной дозы гепарина выполняли клипирование и отсечение ВГА в дистальном направлении и дилатацию раствором папаверина (1 мл в 30 мл изотонического раствора натрия хлорида) c помощью шприца с ограничением давления до 100 мм рт.ст. Следующим этапом оценивали гемостаз и проводили визуальный контроль для выявления возможных дефектов ВГА (травма, отслоение интимы, гематомы). На короткое время снимали зажим с проксимального конца ВГА и вводили 3-5 мл раствора папаверина в подключичную артерию. Убедившись в хорошей пульсации, наличии удовлетворительного свободного кровотока и качественном гемостазе, клипировали дистальный конец ВГА. Внутреннюю грудную артерию накрывали салфеткой, пропитанной раствором папаверина, с целью профилактики ее спазма и сохраняли в ней до микрохирургического этапа операции.
Перикард вскрывали в продольном направлении, предварительно удалив жировые подвески и визуализировав диафрагмальный нерв. Края перикарда прошивали швами-держалками (n=6). Проводили ревизию сердца и выбирали оптимальное место для наложения дистального анастомоза ВГА с ПМЖВ. В случае необходимости производили тракцию за швы-держалки Ethiloop, проведенные под ПМЖВ в дистальном и проксимальном направлении. Место дистального анастомоза фиксировали вакуумным стабилизатором Guidant. Затем выполняли проверку артерии бужом в дистальном направлении. В случае появления признаков ишемии миокарда осуществляли установку временного внутрипросветного шунта максимально возможного диаметра. По стандартной методике накладывали маммарокоронарный анастомоз нитью пролен 8/0. После пуска кровотока проводили контроль гемостаза и инородных тел, в обязательном порядке подшивали 2 электрода к левому желудочку. Перикард не дренировали и не зашивали. Нейтрализацию гепарина протамином применяли выборочно. Устанавливали 1-2 дренажа в левую плевральную полость (к диафрагме по средней подмышечной линии и/или к верхушке по среднеключичной линии). Послойно ушивали рану. Дренажи подключали на активную аспирацию.
Всего у 14 пациентов выполнено 14 маммарокоронарных анастомозов: в 13 случаях с ПМЖВ и в 1 случае с ДВ ввиду выраженного атеросклеротического поражения ПМЖВ. У 1 больного выполнена конверсия доступа в срединную стернотомию ввиду выраженного атеросклеротического поражения целевой артерии и невозможности визуализировать дистальный отдел ПМЖВ из торакотомии. У 3 пациентов отмечено интрамиокардиальное расположение ПМЖВ, что не помешало выполнить операцию из торакотомии.
Основные особенности операции, технические моменты и послеоперационные осложнения представлены в табл. 2.
Общая длительность операции составила от 120 до 220 мин (в среднем 149 мин). Все пациенты переведены на самостоятельное дыхание и экстубированы в течение 12 ч после окончания операции. В течение 24 ч все больные были переведены в отделение кардиохирургии.
Несмотря на выборочную и не всегда полную нейтрализацию гепарина, количество отделяемого по дренажам составило от 50 до 400 мл (в среднем 169 мл).
Из специфических осложнений, связанных с торакотомным доступом и выявленных в послеоперационном периоде, можно отметить пневмоторакс у 3 больных, потребовавший временного аспирационного дренирования, у 2 из них он сопровождался развитием выраженной подкожной эмфиземы. У 1 больного на 4-е сутки после операции выявлено нагноение послеоперационной раны на уровне большой грудной мышцы, отграниченное от плевральной полости. Проводилось открытое лечение, на 22-е сутки пациент с наложенными вторичными швами выписан на амбулаторное долечивание.
Таких осложнений операции, как инфаркт миокарда, острое нарушение мозгового кровообращения, транзиторная ишемическая атака, гематома шеи и повреждение проксимальных отделов черепных нервов, не зафиксировано.
У 4 больных операция МКШ ПМЖВ из левосторонней торакотомии проведена при тяжелом многососудистом поражении. У 2 из них имелось неоперабельное диффузное дистальное поражение бассейнов огибающей и правой коронарной артерий. У 2 больных в раннем послеоперационном периоде выполнена успешная транслюминальная баллонная ангиопластика и стентирование правой коронарной артерии по поводу гемодинамически значимого стенотического поражения с хорошим клиническим и ангиографическим результатом.
У 5 больных выполнена шунтография с помощью мультиспиральной компьютерной томографии и у 2 пациентов — прямая коронарошунтография. Во всех случаях выявлено, что левая ВГА была без признаков стенозирования, маммарокоронарный анастомоз проходим, а ПМЖВ хорошо заполняется контрастным препаратом дистальнее анастомоза.
Пациенты выписаны на амбулаторный этап лечения на 6-22-е сутки после операции в удовлетворительном состоянии.
В настоящее время МКШ из левосторонней торакотомии — редкая операция. Единичные хирурги выполняют ее на постоянной основе и могут передать свой опыт этой операции, которая последние годы опять переживает бурное развитие. На это указывает появление большого количества публикаций ведущих европейских и американских центров и новейшего специализированного инструментария от ведущих производителей.
Основная сложность этой операции обусловлена необходимостью работы в ограниченном пространстве и скромными возможностями расширения хирургического доступа без применения срединной стернотомии. Для увеличения операционного поля можно применить «вылущивание» выше- и нижележащего ребер из реберно-грудинных сочленений.
Крайне важным аспектом операции является полное доверие и взаимопонимание между всеми участниками операции, так как при возникновении нештатной ситуации (нестабильная гемодинамика, неуправляемое кровотечение) возможности для конверсии к ИК очень ограничены. В настоящее время существует 2 варианта конверсии: экстренная стернотомия с подключением аппарата ИК по стандартной схеме и периферическая артериальная канюляция в комбинации с канюляцией легочного ствола для венозного возврата.
МКШ является «золотым стандартом» реваскуляризации миокарда. Возможность безопасного выполнения этой операции из минимального доступа на работающем сердце у пациентов с тяжелой сопутствующей патологией обеспечивает хороший как непосредственный, так и отдаленный клинический эффект и снижает необходимость в повторных вмешательствах в сравнении со стентированием проксимального отдела ПМЖВ.
Немаловажной особенностью операции является хороший косметический эффект и редкие осложнения, связанные с расхождением краев раны, нагноением послеоперационной раны, отсутствием ограничений двигательного режима и умеренным болевым синдромом.
Пациенты со сниженной фракцией выброса также могут быть успешно оперированы из левосторонней торакотомии при наличии показаний.
Возможность дополнительного стентирования бассейнов огибающей и правой коронарной артерий позволяет выполнить полную реваскуляризацию миокарда и значительно снижает риск развития послеоперационных осложнений у группы пациентов с хронической обструктивной болезнью легких, сахарным диабетом и ожирением по сравнению с коронарным шунтированием в условиях ИК.
Таким образом, МКШ из левосторонней торакотомии — безопасная, эффективная и воспроизводимая методика, сопряженная с небольшим количеством послеоперационных осложнений. Применение этой методики с успехом возможно как у пациентов с изолированным поражением проксимального отдела ПМЖВ и ДВ, так и у больных с тяжелым многососудистым поражением в качестве первого этапа гибридной реваскуляризации миокарда или самостоятельного лечения при наличии диффузного дистального поражения в бассейнах огибающей и правой коронарной артерий.
Маммарокоронарное шунтирование — цены от 264000 руб. в Санкт-Петербурге, 1 адрес
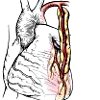
Маммарокоронарное шунтирование (МКШ) – метод реваскуляризации сердечной мышцы с созданием анастомоза между коронарными и внутренними грудными (маммарными) артериями. Левая маммарная артерия используется для анастомозирования с левой коронарной артерией, правая — с правой коронарной или межжелудочковой передней артерией. Преимущества МКШ заключаются в большем диаметре, долговечности и устойчивости маммарной артерии к атеросклерозированию, тромбированию, меньшей частоте рецидивов стенокардии. Специальными показаниями к маммокоронарному шунтированию служат варикоз вен и флебэктомия в анамнезе, необходимость повторного АКШ при дисфункции ранее наложенных аортокоронарных шунтов.
Стоимость маммарокоронарного шунтирования в Санкт-Петербурге
- Маммарокоронарное шунтирование (без ИК) ~ 264 000р.1 цена
Цены: от 264000р. до 264000р.
1 адрес, 1 цена, средняя цена 264000р.
|
без ИК в условиях ИК |
Сбросить
сбросить фильтр
Найдено 1 центр
Скрыть фильтр
|
КБ №122 им. Л.Г. Соколова
пр-т Культуры, д. 4 |
пр-т Культуры, д. 4 | ||||
|
|||||
Цены в других городах
5.2.2. Техника маммарокоронарного шунтирования в условиях искусственного кровообращения
Наряду с использованием аутове-нозных трансплантатов при операциях АКШ широкое признание получил метод маммарокоронарного шунтирования (МКШ), имеющий как преимущества, так и недостатки. К преимуществам метода МКШ можно отнести использование артериального кондуита, однородного с КА, оптимальное соотношение диаметров ВГА и КА и высокую линейную скорость кровотока. Недостатками использования ВГА следует считать ее высокую склонность к спазмированию и тот факт, что в 25 % случаев отмечается ее малый диаметр и низкий объемный кровоток. В связи с этим перед тем как создать анастомоз между внутренней грудной и коронарной артериями, необходимо выполнить контрольное измерение объемной скорости кровотока по ВГА путем кровопускания в мерную емкость. Обыч-
534
но объемная скорость кровотока по ВГА варьирует от 40 до 180 мл/мин при средних значениях артериального давления в ней 50—60 мм рт.ст. [Rankir J.S. et al., 1986]. Кровоток, превышающий 40 мл/мин, считается вполне приемлемым для использования ее при шунтировании коронарных артерий малых размеров. Однако для шунтирования коронарных артерий больших размеров и при выполнении последовательных маммарокоронарных анастомозов для достижения хороших результатов необходим кровоток, приближающийся к 100 мл/мин и более. При введении папаверина в просвет артерии диаметр ВГА колеблется от 1,5 до 3,5 мм, составляя в среднем 2 мм.
Техника маммарокоронарного шунтирования (МКШ) состоит в следующем: после выполнения срединной стернотомии выделяют левую и правую ВГА на всем протяжении. Боковые ветви клипируют, лигируют или коагулируют. Предпочтительно анастомоз между ВГА и КА выполнять нитью 7/0 (рис. 5.3). Анализируя собственный опыт наложения дистальных анастомозов как с аутовеной, так и с внутренней грудной артерией, мы пришли к заключению, что предпочтительно накладывать первые швы не к «пятке» с последующим непрерывным швом с обеих сторон двумя иглами навстречу друг другу, а накладывать первый П-образный шов на боковую стенку ВГА или аутовены. Это позволяет раскрыть просвет шунтируемой коронарной артерии и под контролем зрения, с хорошей ее экспозицией выполнить непрерывный сосудистый шов. Такая техника почти в 100 % случаев гарантирует проходимость анастомоза (рис. 5.4).
При множественной реваскуля-ризации миокарда анастомоз между ВГА и КА выполняют в последнюю очередь, после наложения аутове-нозных аортокоронарных шунтов.
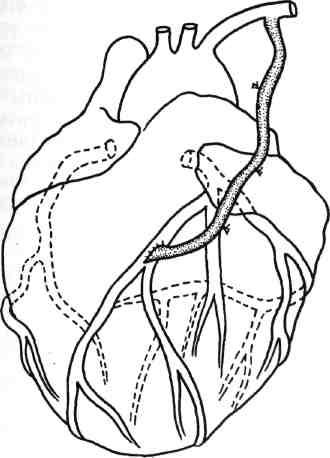
Рис. 5.3. Маммарокоронарное шунтирование.
Это позволяет избежать дополнительной травмы ВГА. Для увеличения объема прямой реваскуляризации миокарда (т.е. числа шунтированных сосудов) с использованием ВГА применяют последовательное, или секвенциальное, МКШ (рис. 5.5). МКШ чаще всего производят для шунтирования ПМЖВ и ДВ. При использовании ВГА для последовательного шунтирования коронарных артерий in situ ее диаметр должен быть не менее 2—2,5 мм, кровоток — 100 мл/мин и более, она должна быть достаточной по длине, чтобы без натяжения достигнуть места дистальных анастомозов.
При последовательном шунтировании ПМЖВ и ДВ используют параллельную технику, однако при шунтировании комбинации ОВ и краевых ветвей, когда угол между проксимальным (первым) и диста-льным (вторым) анастомозами составляет 90°, используют так называемый анастомоз диамонд. При
этом следует учитывать, что слишком большая артериотомия приводит к характерному стенозу в виде крыльев чайки, описанному C.M.Grondin и др. Во избежание этого зоны коронарных артерий с выраженным кальцинозом нельзя шунтировать при помощи анастомоза бок в бок; нельзя также выполнять их при интрамиокардиаль-ном расположении коронарных артерий, так как ВГА может перегибаться при выходе из глубокой миокардиальной борозды.
При ВГА для двух или трех анастомозов необходимо избегать ее
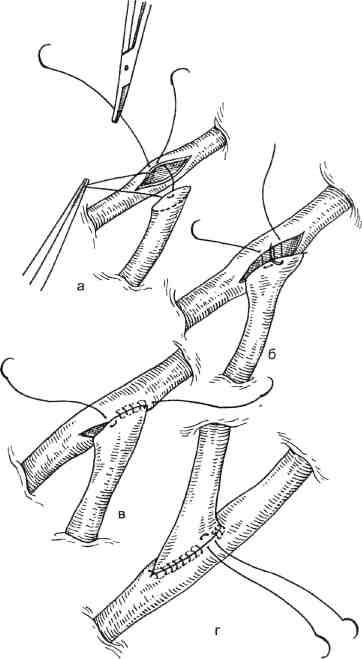
Рис. 5.4. Наложение анастомоза с коронарной артерией (методика автора).
а — начало наложения анастомоза; б, в — последующие этапы; г — окончательный вид анастомоза.
535
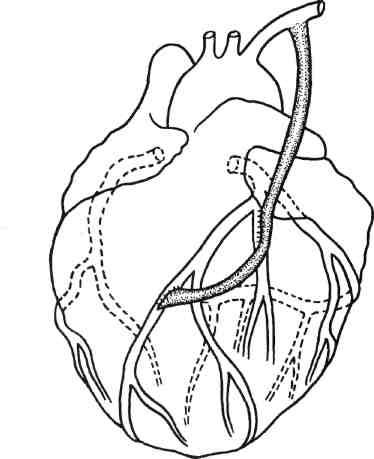
сильных изгибов, которые значительно снижают кровоток в дис-тальные артериальные сегменты. Следует отметить, что увеличенные в объеме легкие во время операции могут сместить ВГА медиально и привести к ошибке при ориентировке ВГА.
Непосредственные результаты аортокоронарного шунтирования. Большой опыт, накопленный более чем за 30-летний период использования КШ в лечении ИБС, постоянное совершенствование хирургической техники, методик анестезиологического и реаниматологического пособия, а также перфузио-логии позволили существенно снизить риск операции и добиться положительных результатов хирургического лечения.
По данным разных авторов, в группе пациентов старше 65 лет без выраженных нарушений сократительной способности ЛЖ риск операции составляет не более 1 %, а для пациентов моложе 65 лет с ФВ
536
менее 35 % — не превышает 5 %. Частота периоперационного инфаркта миокарда колеблется от 2,2 до 5,0 %, кровотечения в послеоперационном периоде возможны у 2,2 % больных, нарушения ритма сердца, в том числе фибрилляция желудочков (ФЖ), встречаются с различной частотой — от 3 до 31 % случаев, а необходимость в ино-тропной поддержке в послеоперационном периоде возникла у 34 % больных [CartierR., 1966, 1998].
Неврологические расстройства — наиболее часто встречающееся осложнение после операций с ИК: их частота составляет от 0,4 до 80 % [Mora C.T., 1995]. Тяжесть неврологических осложнений варьирует от легкого нарушения тонких психических функций до очаговых неврологических расстройств, ступора и комы. При этом летальность при первом виде мозговых осложнений достигает 10 %, а во втором — 21 %. Наиболее вероятной причиной развития неврологической симптоматики после операций, выполненных в условиях ИК, является микроэм-болизация. Частота развития послеоперационных осложнений напрямую зависит от длительности проведения ИК. Так, при продолжительности ИК более 180 мин, отек мозга возникает у 14,3 % больных, при ИК в пределах 150—180 мин — у 4 %, а при ИК менее 150 мин мозговых осложнений не наблюдалось. Согласно последним данным Дьюкского университета, около 50 % пациентов, перенесших операцию КШ в условиях ИК, впоследствии страдают слабоумием.
Частым осложнением (1—4 %) после операций КШ является меди-астинит. В исследованиях, проведенных J.Braxton и соавт. (2000), были детально изучены причины и факторы риска медиастинита. По утверждению авторов, наибольшему риску развития этого осложнения подвержены пациенты, которым операция выполнялась в экст-
ренном порядке, а также пациенты с различными сопутствующими заболеваниями, с выраженной сердечной недостаточностью и ФВ менее 40 %. Особое значение в развитии этого осложнения отводится ожирению, в зависимости от степени выраженности которого вдвое повышается риск медиастинита. Риск раннего закрытия шунтов при медиастините значительно выше: через 12 мес после перенесенного медиастинита закрытыми оказались 38 % шунтов по сравнению с 9 % у пациентов с неосложненным послеоперационным течением.
Пережатие аорты, необходимое при выполнении операций в условиях ИК, приводит к ишемии миокарда во время наложения дисталь-ных анастомозов. Напряженный поиск методов защиты миокарда, проводимый на протяжении почти 30 лет, способствовал созданию достаточно эффективных кардиопле-гических растворов, однако ни один из них не является идеальным [Lichtenstein S. et al., 1991]. Исследования, начатые в этом направлении W.Bigelow и соавт. (1950) и N.Shumway и соавт. (1959), продолженные D.Cooley и соавт. (1972), S.Lichtenstein и соавт. (1991), позволили создать теорию реперфузи-онного повреждения и возникновения феномена «оглушенного миокарда». Он заключается в резком уменьшении уровня энергетических фосфатов, внутриклеточной перегрузке кальцием, образовании супероксидных радикалов и нарушении микроциркуляторного русла. Вследствие этого возникают обратимые и необратимые повреждения митохондрий, актинмиозиновых связей, собственно миофибрилл [Benetti F. et al., 1986], что вызывает нарушение сократительной способности миокарда. Тяжесть «оглушения» зависит от длительности пережатия аорты и исходного состояния миокарда [Akins C.W. et al., 1984]. Таким образом, пациенты с
исходно низкой фракцией выброса, с нестабильной стенокардией и острым ИМ, а также повторно оперируемые больные образуют группу повышенного риска при операциях с ИК и пережатием аорты.
Состояние после операции МКШ — Кардиология
анонимно, Мужчина, 44 года
Здравствуйте.Год и два месяца после бимаммарокоронарного шунтирования ПМЖА и ВТК(ПВГА и ЛВГА in situ) в условиях ИК и ФХКП. ХСН 1 ФК Дислипидемия. Операцию делали в другом городе,нет возможности проконсультироваться с кардиологом по месту жительства. В течении года после операции состояние было более менее стабильным общий холестерин 4.3-3.9 alt26-29 ast 37.8-37.4 ,креатинин 69-69,глюкоза 5.4-4,94 ммоль HB 126-142 лекоциты 3.5-5.9 тромбоциты 269 СОЭ 2-4 Давление в состоянии покоя утро-вечер 115,120 на 60,пульс 60.когда нервиничаю бывает 130 на 80,редко 150 на 70в основном давление низкое даже после пробежки Препараты :Бравадин 5 мг,аторвастатин 40 мг,тромбасс 100 мг. Много хожу 5-10 км ежедневно,небольшая одышка только в гору. Четыре месяца не проверялся.Подскочил общий холестерин.Хотя соблюдаю все предписания и диеты.Раз в месяц к нам приезжают врачи из районного центра.Решил проверится.Назначили биохимию,общий анализ,холтер экг.Результаты glu-d 5.08,CRE-62,LDL-D 2.92,AST 31.9,ALT-35.8,TRIGH -2.36,UA-269,TP-73.6,TB-FS-14.0-H-14.0,DB-FS отр,UREH-4.6,Kali-4.72,CHOLE-5.1,AMY-53.3Общийэритроциты-5.08 гемоглобин 166.тромбоциты 239.лейкоциты 6.0 СОЭ-4 Результаты суточного ХОЛТЕР ЭКГ:Основной ритм синусовый с нормальной средней дневной и ночной чсс,эпизодами бради и тахикардии.Мин чсс 28 в мин.в дневые час 130 чсс в мин.при нагрузке.Эктопическая активность незначительная,одиночных наджелудочковых экстрасистол всего 20,желудочковых монотопных полиморфных экстрасистол всего 22На всем протяжении зафиксированы эпизоды АВ блокады 1 ст.с макс интер 0,34 сек переходящие в АВ блокады 2 ст.1 типа с максимальной паузой 2.82 секво время сна при чсс 28 в мин.Вариабельность сердечного ритма умеренно снижена.На всем протяжении на канале AVF (потенциалы нижней стенки)зафиксирована ишемия в виде инверсии з.Т при нагрузке сопровождается кратковременным эпизодом инверсии з.Т на каналах V2 V5(потенциалы переднебоковой стенки)Вариабильность сердечного ритма умеренно снижена. Вручив мне данные анализы и протокол ХОЛТЕР ЭКГ заезжий кардиолог сказал что всё не очень хорошо:отменил бравадин,аторвастатин 40 мг заменил на розувастатин 20 мг и был таков,ничего внятно не объяснив. Очень растроен конечно,не знаю к чему ещё готовится,может быть у меня серьёзные проблемы и мне стоит опять ехать в клинику, где делали операцию?БУДУ ПРИЗНАТЕЛЕН ЗА ЛЮБОЙ СОВЕТ.
