Нейтрофіли — Вікіпедія
Нейтрофіли (англ. neutrophils), або нейтрофільні гранулоцити — один з видів лейкоцитів із гранулами всередині цитоплазми. Нейтрофіли беруть участь у захисних реакціях організму людини та хребетних при бактеріальних чи інфекційних хворобах.
Нейтрофіли містять лізосомні ферменти, що руйнують бактерії, а також ферменти, за допомогою яких в крові утворюються активні протимікробні речовини. Останні мають жовто-зелений колір — колір нейтрофілів і гною, який утворюється в місці запалення із суміші збудників, нейтрофілів і продуктів розпаду клітин запальної тканини. При гострих бактеріальних інфекційних захворюваннях число нейтрофілів швидко зростає. Вони здатні отримувати енергію шляхом анаеробного гліколізу (одержання глюкози як джерела енергії без доступу кисню) і тому можуть існувати навіть у тканинах, бідних киснем (запалених, оточених, тих, які погано забезпечуються кров’ю). Лізосомні ферменти, що вивільняються при розпаді нейтрофілів, спричинюють розм’якшення навколишніх тканин — формування гнійного вогнища запалення.
У нормі в крові є певна кількість не тільки дозрілих (сегментованих) нейтрофілів, але і їх попередників — незрілих клітин: паличкоядерних (1-6 %), юних (0,1-1 %). При нейтрофільному лейкоцитозі (нейтрофільозі) число цих незрілих форм наростає. При цьому в крові можуть з’явитися попередники юних клітин — мієлоцити.
Нейтрофіли безперервно утворюються в червоному кістковому мозку.
Зрілий нейтрофіл має сегментовані ядра, незрілий має паличкоподібне (у вигляді букви S чи С) чи бобоподібне ядро. Плазматична мембрана нейтрофілів містить кілька мембранних каналів, адгезивні білки, рецептори для різних лігандів (молекул, які зв’язуються зі специфічними білками), йонні насоси та ектоферменти (ферменти, розташовані на зовнішній поверхні клітини).
Нейтрофіли мають складний цитоскелет, який відповідає за хемотаксис, фагоцитоз і екзоцитоз. Білки, що входять до складу цитоскелету, включають актин, актин-зв’язуючий білок, альфа-актинін, міозин, профілін і тропоміозин.
Нейтрофіли містять велику кількість глікогену та ліпідів у цитоплазмі, які забезпечують нейтрофілів енергією.
Нейтрофіли складають 65-70 % від загального числа лейкоцитів. Діаметр клітини у свіжій краплі крові становить 7-9 мкм, в мазку — 10-12 мкм. Цитоплазма їх забарвлюється слабо оксифільно. Зернистість дрібна, її погано видно як на свіжих, так і у фіксованих забарвлених препаратах. При фарбуванні за методом Романовського—Гімзи зернистість набуває рожево — фіолетового відтінку. Розміри гранул 0,1-0,8 мкм. Гранули нейтрофілів поділяють на первинні (азурофільних, неспецифічні) і вторинні (нейтрофільні, специфічні).
- Первинні гранули — це спеціалізовані лізосоми, що мають маркерний фермент — кислу фосфотазу. Вони містять різні гідролази, мієлопероксидази, арілсульфатазу, серинові протеази, еластази, а також білки з бактерицидними властивостями, зокрема лізоцим.
- Вторинні гранули — це специфічна зернистість, її зміст 80-90 % від усієї зернистості в зрілих нейтрофілах. Для хімічного складу вторинних гранул нейтрофілів характерна наявність лужної фосфатази (як маркерний фермент), основних катіонних білків, фагоцитинів, лактоферинів, амінопептидаз, лізоциму, тут відсутні лізосомальні ферменти і пероксидаза.
У цитоплазмі нейтрофілів слабко розвинені органели: є небагато мітохондрій, невеликим є комплекс Гольджі, іноді зустрічають елементи редукованої ендоплазматичної сітки. Характерна наявність включень — глікогену, ліпідів. Таким чином, нейтрофіли містять повний набір речовин, за допомогою яких вони руйнують фагоцитовані мікроорганізми. Нейтрофіли мають здатність активно рухатися, пересуватися в тканинах до вогнища запалення і фагоцитувати мікроорганізми та інші дрібні частинки.
Різновиди нейтрофілів[ред. | ред. код]
- Юні нейтрофіли (бобоподібні) — наймолодша форма, в крові з’являються рідко (0,1 — 0,5 %), тільки при наявності виразного запалення;
- Паличкоядерні нейтрофіли — мають велике ядро у вигляді букви С, S, їх кількість складає 1 — 6 % від загальної;
- Сегментоядерні нейтрофіли — ядро має 2-3 сегменти, іноді більше, розділених тонкими перетяжками, складають 49 — 72 %;
Порушення нормального співвідношення нейтрофілів бувають декількох видів.
Ядерний зсув нейтрофілів вліво — стан, коли в крові з’являється багато молодих, а саме юних і паличкоядерних нейтрофілів, а також з’являються дегенеративні форми нейтрофілів. Таке зазвичай характерно для:
При цьому розрізняють два види зсуву нейтрофілів вліво — регенеративний і дегенеративний.
- Регенеративний зсув нейтрофілів — це означає, що збільшується кількість паличкоядерних та юних нейтрофілів на тлі загального лейкоцитозу. Це говорить про підвищену діяльності кісткового мозку, який, як відомо, є органом кровотворення. Такий стан організму характерний для гнійно-септичних і запальних процесів (пневмонія, апендицит, тощо).
- Дегенеративний зсув — збільшується кількість тільки паличкоядерних нейтрофілів; при цьому з’являються дегенеративні зміни в клітинах. Це говорить про те, що функція кровотворення (кісткового мозку) пригнічена.
Утворюються у червоному кістковому мозку протягом 7 діб, після того виходять у кровообіг; циркулюють у крові 8-12 годин і виходять у сполучну тканину.
Головна функція нейтрофілів — фагоцитоз, тобто поглинання і розчинення чужорідних частинок, але вони здатні розчиняти тільки дрібні частинки або клітини, і після їх розчинення гинуть.[1] Кожна клітина здатна тільки до однієї фагоцитарної події. Клітина при цьому створює певний респіраторний вибух. Протягом дихального вибуху, NADPH (нікотинамід-аденін-динуклеотид фосфат) — ензим, який виробляє велику кількість супероксиду (реактивний кисень), активується. Супероксид спонтанно мутує до перекисю водню, який потім перетвориться в HOCI.
Нейтрофіли здійснюють процес хемотаксису, що дозволяє їм мігрувати в напрямку вогнищ інфекції або запалення. Рецептори клітинної поверхні нейтрофілів дають можливість виявити хімічні градієнти молекул, таких як інтерлейкін-8 (IL-8), гаммаінтерферон (γ-IFN), С5а, і лейкотрієн B4, який ці клітини використовують, щоб направити на шлях міграції.
Нейтрофіли мають різні специфічні рецептори, включаючи рецептори комплементу, рецепторів цитокінів, хемокінів, лектинів і білків, Fc-рецептори опсоніна тощо.[2]
Кількість нейтрофілів в крові[ред. | ред. код]
Норма нейтрофілів в крові[ред. | ред. код]
Кількість нейтрофілів у нормі в крові у дорослих коливається в межах від 45 % до 70 % від загальної кількості лейкоцитів у крові, або 1,8-6,5 * 109/л.
Підвищення кількості нейтрофілів в крові[ред. | ред. код]
Збільшення кількості нейтрофілів в крові більше 6,5 * 109/л називають нейтрофільозом.
Основною причиною підвищення нейтрофілів в крові є запалення в організмі, особливо при гнійних процесах. За збільшенням вмісту абсолютної кількості нейтрофілів в крові при запальному процесі можна судити про запалення та адекватність імунної відповіді на запальний процес в організмі. Підвищення нейтрофілів в крові до 10,0 * 10
Помірне збільшення кількості нейтрофілів в крові можна спостерігати також і при деяких фізіологічних станах, наприклад при посиленій фізичній роботі, після прийому їжі, при сильних психоемоційних напружених, під час вагітності.
Зниження кількості нейтрофілів в крові[ред. | ред. код]
Зниження нейтрофілів у периферичній крові нижче 1,6 * 109/л називають нейтропенією.
Причиною зменшення нейтрофілів у периферичній крові може бути пригнічення кістковомозкового кровотворення органічного або функціонального характеру, посилене руйнування нейтрофілів, виснаження організму на тлі тривалих захворювань.
Найбільш часто нейтропенія відзначають при:
- Вірусних інфекціях (грип, кір, краснуха, ВІЛ-інфекція тощо), деяких бактеріальних інфекціях (черевний тиф, паратифи, бруцельоз), протозойних інфекціях (неускладнена малярія, токсоплазмоз).
- Запальних захворюваннях, що перебігають у тяжкій формі і набувають характеру генералізації.
- Побічній дії деяких медикаментів (цитостатики, сульфаніламіди, анальгетики, рибавірин)
- Радіаційному опроміненні, променевої терапії.
- Гіпопластичній і апластичній анемії.
- Гіперспленізмі (надмірному і тривалому збільшенні селезінки).
- Агранулоцитозі.
- Вираженому дефіциті маси тіла з розвитком кахексії.[3]
- ↑ Edwards, Steven W. (1994). Biochemistry and physiology of the neutrophil. Cambridge University Press. p. 6. ISBN 0-521-41698-1.
- ↑ Charles N. Serhan, Peter A. Ward, Derek W. Gilroy (2010). Fundamentals of Inflammation. Cambridge University Press. pp. 53-54. ISBN 0-521-88729-1. Jump up ^
- ↑ Neutrophils: Molecules, Functions and Pathophysiological Aspects.Véronique Witko-Sarsat, Philippe Rieu, Béatrice Descamps-Latscha, Philippe Lesavre and Lise Halbwachs-Mecarelli. 8 February 2000. section II
Нетоз — Википедия
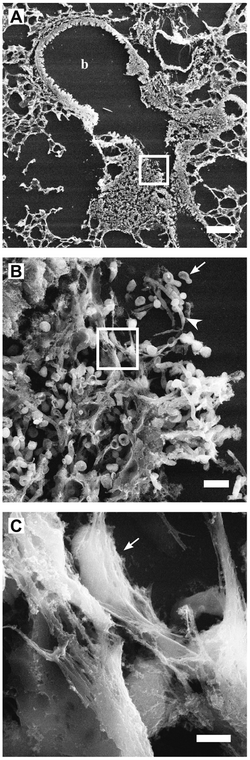 Микрофотография внеклеточных нитей нейтрофилов (NET), опутывающих грибковую клетку. Изображение получено с помощью сканирующей электронной микроскопи[1]
Микрофотография внеклеточных нитей нейтрофилов (NET), опутывающих грибковую клетку. Изображение получено с помощью сканирующей электронной микроскопи[1]Нето́з[2] (англ. NETosis от англ. Neutrophil extracellular traps) — вид программируемой клеточной гибели, происходящей у нейтрофилов. Сопровождается выбрасыванием из погибающих нейтрофилов нитей, состоящих в основном из ДНК. Благодаря нетозу нейтрофилы убивают внеклеточных патогенов, минимизируя вред для других клеток[3].
В условиях in vitro у нейтрофилов нетоз запускается под действием форболмиристатацетата[en], интерлейкина 8 (IL-8) и липополисахарида. При этом нейтрофилы высвобождают гранулы белков и хроматина (в основном эти гранулы состоят из ДНК), которые во внеклеточном пространстве формируют фибриллы (нити), опутывающие клетку патогена[3]. Нетоз не всегда сопровождается гибелью нейтрофила: описан так называемый витальный нетоз, при котором ДНК упаковывается в везикулы, отшнуровывающиеся от клеточного ядра[4]. Ниже будет описан механизм суицидального нетоза, при котором нейтрофил гибнет.
Молекулярный механизм запуска нетоза не до конца ясен, однако известны несколько ключевых белков этого процесса. Считается, что нетоз запускается при активации NADPH-оксидазы, которая начинает вырабатывать активные формы кислорода. Под их действием запускается фермент протеин-аргининдеиминаза[en] 4 (PAD4). PAD4 вызывает цитруллинирование гистонов в ядре нейтрофила, в результате чего хроматин декомпактизируется. В ядро входят миелопероксидаза и нейтрофилэластаза[en], которые стимулируют дальнейшую декомпактизацию хроматина и в конце концов приводят к разрушению ядерной оболочки. Деконденсированный хроматин выходит в цитоплазму, где к нему присоединяются дополнительные белки, формируя так называемые внеклеточные нити нейтрофилов (англ. Neutrophil extracellular traps, NETs)[4]. Образование NETs регулируется липоксигеназным путём. При некоторых способах запуска нетоза (например, при контакте с бактериальной клеткой) нейтрофил-5-липоксигеназа взаимодействует с фосфолипидами, и продукты реакции ингибируют образование NETs[5]. Из внеклеточной среды NETs убирают макрофаги, которые фагоцитируют и разрушают их[6].
При суицидальном нетозе выбрасывание NETs сопровождается гибелью нейтрофилов посредством механизма, отличного от апоптоза и некроза[7]. В случае суицидального нетоза после формирования внеклеточных нитей разрушается клеточная мембрана нейтрофила, в результате чего нити оказываются во внеклеточном пространстве. Суицидальный нетоз может быть запущен при активации Toll-подобных рецепторов (TLRs), Fc-рецепторов и рецепторов комплемента[en] различными лигандами, такими как антитела или форболмиристатацетат[4][8]. Считается, что при активации этих рецепторов в конечном счёте происходит выход ионов кальция из эндоплазматического ретикулума, который далее активирует NADPH-оксидазу[8]. Процесс суицидального нетоза может занимать несколько часов, даже при воздействии высоких концентрации форболмиритатацетата, в то время как витальный нетоз происходит в течение нескольких минут[4].
Витальный нетоз запускается липополисахаридом и другими антигенами бактериального происхождения, TLR4-активированными тромбоцитами или белками комплемента совместно с лигандами TLR2[4]. При витальном нетозе происходит блеббинг (то есть отшнуровывание пузырьков) ядра, в результате чего в клетке появляются везикулы, заполненные ДНК, которую они выделяют наружу путём экзоцитоза без повреждения клеточной мембраны[4]. Такие везикулы формируются и выбрасывают своё содержимое во внеклеточное пространство очень быстро, причём нейтрофил при этом не гибнет, хотя и остаётся без ДНК. Вопрос о том, можно ли считать живым нейтрофил без ДНК, является спорным. После витального нетоза нейтрофилы могут продолжить фагоцитировать и убивать клетки микроорганизмов[8].

Сканирующая электронная микроскопия высокого разрешения показала, что NETs состоят из тяжей ДНК, связанной с глобулярными белковыми доменами, диаметром 15—17 нм и 25 нм соответственно. Тяжи сворачиваются в более толстые волокна диаметром 50 нм[3]. Однако в некоторых условиях NETs могут формировать большие скопления, достигающие сотен нм в длину и ширину[9].
Иммунофлуоресцентный анализ показал, что NETs содержат белки из азурофильных гранул[en] (нейтрофилэластаза, катепсин G и миелопероксидаза), специфичных гранул[en] (лактоферрин), третичных гранул (желатиназа[en]) и цитоплазмы. Однако в состав NETs не входят многие многочисленные цитоплазматические белки, такие как CD63, актин и тубулин[3][10].
Противомикробное действие NETs обусловлено тем, что они содержат белки с соответствующими свойствами — нейтрофилэластазу и катепсин G, кроме того, входящие в NETs гистоны обладают высоким сродством к ДНК[11]. NETs обеспечивают повышенную локальную концентрацию молекул с антимикробными свойствами и обездвиживают клетки патогена. Кроме того, NETs образуют физический барьер, препятствующий распространению клеток патогена. NETs действуют не только на бактериальные клетки, но и на патогенных грибов, таких как дрожжи Candida albicans. Нетоз вызывается как отдельными дрожжевыми клетками, так и гифами C. albicans[12]. Имеется сообщение, что NETs могут взаимодействовать с малярийным плазмодием Plasmodium falciparum[13].
Хотя изначально предполагалось, что NETs выполняют свои функции непосредственно в очаге бактериальной или грибковой инфекции, было показано, что при сепсисе NETs могут формироваться внутри кровеносных сосудов (а именно капилляров в лёгких и синусоидах печени[en]). Формирование NETs внутри сосудов находится под жёстким контролем тромбоцитов, которые получают сигналы о сильной инфекции через TLR4-рецепторы, связываются с нейтрофилами и активируют нетоз. Образование NETs, запускаемое тромбоцитами, происходит очень быстро (в течение нескольких минут) и может быть результатом как суицидального, так и витального нетоза[14]. В кровеносных сосудах на NETs могут застревать бактерии, циркулирующие по кровотоку[9].
Нетоз может оказывать негативное влияние на организм, поскольку выход гистонов во внеклеточную среду может запустить развитие аутоиммунных заболеваний, таких как системная красная волчанка[15]. NETs могут также участвовать в развитии воспалительных заболеваний; так, NETs были выявлены в случае преэклампсии[en]* — связанного с беременностью воспалительного расстройства, при котором происходит активация нейтрофилов[16]. NETs были обнаружены в слизистой толстого кишечника у пациентов с язвенным колитом[17]. Была выявлена связь NETs с образованием антител к ядерной двуцепочечной ДНК у детей, заражённых P. falciparum[13]. NETs также выявляются у пациентов с онкологическими заболеваниями[18]. Доклинические исследования[en] свидетельствуют, что NETs могут играть в роль в развитии таких болезней, как тромбоз, сердечный приступ[19][20][21], отказ органов, а также метастазировании[22].
NETs вовлечены в патогенез вируса иммунодефицита человека и вируса иммунодефицита обезьян[en]. NETs захватывают вирионы ВИЧ и разрушают их[23]. По ходу ВИЧ-инфекции образование NETs увеличивается, однако снижается под действием противовирусных препаратов. Кроме того, NETs могут захватывать и многие иммунные клетки, такие как CD4+ и CD8+ T-клетки, B-клетки и моноциты. Этот эффект удалось пронаблюдать в кишечнике, лёгких, печени и кровеносных сосудах. NETs, возможно, вносят вклад в способность к гиперкоагуляции вирионов ВИЧ, захватывая тромбоциты, которые экспрессируют фактор свёртывания крови III[24].
Таким образом, имеется ряд свидетельств в пользу того, что NETs играют важную роль в патогенезе инфекционных, воспалительных и тромботических заболеваний[25][26][27].
- ↑ Urban C. F., Ermert D., Schmid M., Abu-Abed U., Goosmann C., Nacken W., Brinkmann V., Jungblut P. R., Zychlinsky A. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans. (англ.) // PLoS Pathogens. — 2009. — October (vol. 5, no. 10). — P. e1000639—1000639. — doi:10.1371/journal.ppat.1000639. — PMID 19876394. [исправить]
- ↑ Плескова С. Н., Горшкова Е. Н., Боряков А. В., Крюков Р. Н. Морфологические особенности быстрого и классического нетоза // Цитология. — 2019. — Т. 81, № 9. — С. 704—712. — doi:10.1134/S0041377119090098.
- ↑ 1 2 3 4 Brinkmann V., Reichard U., Goosmann C., Fauler B., Uhlemann Y., Weiss D. S., Weinrauch Y., Zychlinsky A. Neutrophil extracellular traps kill bacteria. (англ.) // Science (New York, N.Y.). — 2004. — Vol. 303, no. 5663. — P. 1532—1535. — doi:10.1126/science.1092385. — PMID 15001782. [исправить]
- ↑ 1 2 3 4 5 6 Jorch S. K., Kubes P. An emerging role for neutrophil extracellular traps in noninfectious disease. (англ.) // Nature Medicine. — 2017. — 7 March (vol. 23, no. 3). — P. 279—287. — doi:10.1038/nm.4294. — PMID 28267716. [исправить]
- ↑ Clark S. R., Guy C. J., Scurr M. J., Taylor P. R., Kift-Morgan A. P., Hammond V. J., Thomas C. P., Coles B., Roberts G. W., Eberl M., Jones S. A., Topley N., Kotecha S., O’Donnell V. B. Esterified eicosanoids are acutely generated by 5-lipoxygenase in primary human neutrophils and in human and murine infection. (англ.) // Blood. — 2011. — 10 February (vol. 117, no. 6). — P. 2033—2043. — doi:10.1182/blood-2010-04-278887. — PMID 21177434. [исправить]
- ↑ Farrera C., Fadeel B. Macrophage clearance of neutrophil extracellular traps is a silent process. (англ.) // Journal Of Immunology (Baltimore, Md. : 1950). — 2013. — 1 September (vol. 191, no. 5). — P. 2647—2656. — doi:10.4049/jimmunol.1300436. — PMID 23904163. [исправить]
- ↑ Fuchs T. A., Abed U., Goosmann C., Hurwitz R., Schulze I., Wahn V., Weinrauch Y., Brinkmann V., Zychlinsky A. Novel cell death program leads to neutrophil extracellular traps. (англ.) // The Journal Of Cell Biology. — 2007. — 15 January (vol. 176, no. 2). — P. 231—241. — doi:10.1083/jcb.200606027. — PMID 17210947. [исправить]
- ↑ 1 2 3 Yang H., Biermann M. H., Brauner J. M., Liu Y., Zhao Y., Herrmann M. New Insights into Neutrophil Extracellular Traps: Mechanisms of Formation and Role in Inflammation. (англ.) // Frontiers In Immunology. — 2016. — Vol. 7. — P. 302—302. — doi:10.3389/fimmu.2016.00302. — PMID 27570525. [исправить]
- ↑ 1 2 Clark S. R., Ma A. C., Tavener S. A., McDonald B., Goodarzi Z., Kelly M. M., Patel K. D., Chakrabarti S., McAvoy E., Sinclair G. D., Keys E. M., Allen-Vercoe E., Devinney R., Doig C. J., Green F. H., Kubes P. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. (англ.) // Nature Medicine. — 2007. — April (vol. 13, no. 4). — P. 463—469. — doi:10.1038/nm1565. — PMID 17384648. [исправить]
- ↑ Urban C. F., Ermert D., Schmid M., Abu-Abed U., Goosmann C., Nacken W., Brinkmann V., Jungblut P. R., Zychlinsky A. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans. (англ.) // PLoS Pathogens. — 2009. — October (vol. 5, no. 10). — P. e1000639—1000639. — doi:10.1371/journal.ppat.1000639. — PMID 19876394. [исправить]
- ↑ Thomas M. P., Whangbo J., McCrossan G., Deutsch A. J., Martinod K., Walch M., Lieberman J. Leukocyte protease binding to nucleic acids promotes nuclear localization and cleavage of nucleic acid binding proteins. (англ.) // Journal Of Immunology (Baltimore, Md. : 1950). — 2014. — 1 June (vol. 192, no. 11). — P. 5390—5397. — doi:10.4049/jimmunol.1303296. — PMID 24771851. [исправить]
- ↑ Urban C. F., Reichard U., Brinkmann V., Zychlinsky A. Neutrophil extracellular traps capture and kill Candida albicans yeast and hyphal forms. (англ.) // Cellular Microbiology. — 2006. — April (vol. 8, no. 4). — P. 668—676. — doi:10.1111/j.1462-5822.2005.00659.x. — PMID 16548892. [исправить]
- ↑ 1 2 Baker V. S., Imade G. E., Molta N. B., Tawde P., Pam S. D., Obadofin M. O., Sagay S. A., Egah D. Z., Iya D., Afolabi B. B., Baker M., Ford K., Ford R., Roux K. H., Keller TC 3rd. Cytokine-associated neutrophil extracellular traps and antinuclear antibodies in Plasmodium falciparum infected children under six years of age. (англ.) // Malaria Journal. — 2008. — 29 February (vol. 7). — P. 41—41. — doi:10.1186/1475-2875-7-41. — PMID 18312656. [исправить]
- ↑ Caudrillier A., Kessenbrock K., Gilliss B. M., Nguyen J. X., Marques M. B., Monestier M., Toy P., Werb Z., Looney M. R. Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury. (англ.) // The Journal Of Clinical Investigation. — 2012. — July (vol. 122, no. 7). — P. 2661—2671. — doi:10.1172/JCI61303. — PMID 22684106. [исправить]
- ↑ Hakkim A., Fürnrohr B. G., Amann K., Laube B., Abed U. A., Brinkmann V., Herrmann M., Voll R. E., Zychlinsky A. Impairment of neutrophil extracellular trap degradation is associated with lupus nephritis. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2010. — 25 May (vol. 107, no. 21). — P. 9813—9818. — doi:10.1073/pnas.0909927107. — PMID 20439745. [исправить]
- ↑ Gupta A. K., Hasler P., Holzgreve W., Gebhardt S., Hahn S. Induction of neutrophil extracellular DNA lattices by placental microparticles and IL-8 and their presence in preeclampsia. (англ.) // Human Immunology. — 2005. — November (vol. 66, no. 11). — P. 1146—1154. — doi:10.1016/j.humimm.2005.11.003. — PMID 16571415. [исправить]
- ↑ Bennike T. B., Carlsen T. G., Ellingsen T., Bonderup O. K., Glerup H., Bøgsted M., Christiansen G., Birkelund S., Stensballe A., Andersen V. Neutrophil Extracellular Traps in Ulcerative Colitis: A Proteome Analysis of Intestinal Biopsies. (англ.) // Inflammatory Bowel Diseases. — 2015. — September (vol. 21, no. 9). — P. 2052—2067. — doi:10.1097/MIB.0000000000000460. — PMID 25993694. [исправить]
- ↑ Rayes R. F., Mouhanna J. G., Nicolau I., Bourdeau F., Giannias B., Rousseau S., Quail D., Walsh L., Sangwan V., Bertos N., Cools-Lartigue J., Ferri L. E., Spicer J. D. Primary tumors induce neutrophil extracellular traps with targetable metastasis promoting effects. (англ.) // JCI Insight. — 2019. — 25 July (vol. 5). — doi:10.1172/jci.insight.128008. — PMID 31343990. [исправить]
- ↑ Laridan E., Denorme F., Desender L., François O., Andersson T., Deckmyn H., Vanhoorelbeke K., De Meyer S. F. Neutrophil extracellular traps in ischemic stroke thrombi. (англ.) // Annals Of Neurology. — 2017. — August (vol. 82, no. 2). — P. 223—232. — doi:10.1002/ana.24993. — PMID 28696508. [исправить]
- ↑ Ducroux C., Di Meglio L., Loyau S., Delbosc S., Boisseau W., Deschildre C., Ben Maacha M., Blanc R., Redjem H., Ciccio G., Smajda S., Fahed R., Michel J. B., Piotin M., Salomon L., Mazighi M., Ho-Tin-Noe B., Desilles J. P. Thrombus Neutrophil Extracellular Traps Content Impair tPA-Induced Thrombolysis in Acute Ischemic Stroke. (англ.) // Stroke. — 2018. — March (vol. 49, no. 3). — P. 754—757. — doi:10.1161/STROKEAHA.117.019896. — PMID 29438080. [исправить]
- ↑ Vallés J., Lago A., Santos M. T., Latorre A. M., Tembl J. I., Salom J. B., Nieves C., Moscardó A. Neutrophil extracellular traps are increased in patients with acute ischemic stroke: prognostic significance. (англ.) // Thrombosis And Haemostasis. — 2017. — 5 October (vol. 117, no. 10). — P. 1919—1929. — doi:10.1160/Th27-02-0130. — PMID 28837206. [исправить]
- ↑ Cedervall J., Zhang Y., Olsson A. K. Tumor-Induced NETosis as a Risk Factor for Metastasis and Organ Failure. (англ.) // Cancer Research. — 2016. — 1 August (vol. 76, no. 15). — P. 4311—4315. — doi:10.1158/0008-5472.CAN-15-3051. — PMID 27402078. [исправить]
- ↑ Saitoh T., Komano J., Saitoh Y., Misawa T., Takahama M., Kozaki T., Uehata T., Iwasaki H., Omori H., Yamaoka S., Yamamoto N., Akira S. Neutrophil extracellular traps mediate a host defense response to human immunodeficiency virus-1. (англ.) // Cell Host & Microbe. — 2012. — 19 July (vol. 12, no. 1). — P. 109—116. — doi:10.1016/j.chom.2012.05.015. — PMID 22817992. [исправить]
- ↑ Sivanandham R., Brocca-Cofano E., Krampe N., Falwell E., Venkatraman SMK, Ribeiro R. M., Apetrei C., Pandrea I. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. (англ.) // The Journal Of Clinical Investigation. — 2018. — 1 November (vol. 128, no. 11). — P. 5178—5183. — doi:10.1172/JCI99420. — PMID 30204591. [исправить]
- ↑ Fuchs T. A., Brill A., Duerschmied D., Schatzberg D., Monestier M., Myers Jr. D. D., Wrobleski S. K., Wakefield T. W., Hartwig J. H., Wagner D. D. Extracellular DNA traps promote thrombosis. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2010. — 7 September (vol. 107, no. 36). — P. 15880—15885. — doi:10.1073/pnas.1005743107. — PMID 20798043. [исправить]
- ↑ Brill A., Fuchs T. A., Savchenko A. S., Thomas G. M., Martinod K., De Meyer S. F., Bhandari A. A., Wagner D. D. Neutrophil extracellular traps promote deep vein thrombosis in mice. (англ.) // Journal Of Thrombosis And Haemostasis : JTH. — 2012. — January (vol. 10, no. 1). — P. 136—144. — doi:10.1111/j.1538-7836.2011.04544.x. — PMID 22044575. [исправить]
- ↑ Borissoff J. I., ten Cate H. From neutrophil extracellular traps release to thrombosis: an overshooting host-defense mechanism? (англ.) // Journal Of Thrombosis And Haemostasis : JTH. — 2011. — September (vol. 9, no. 9). — P. 1791—1794. — doi:10.1111/j.1538-7836.2011.04425.x. — PMID 21718435. [исправить]
Естественные киллеры — Википедия
Материал из Википедии — свободной энциклопедии
 Активация NK-клетки отсутствием комплекса ГКГС-I на инфицированной клетке.
Активация NK-клетки отсутствием комплекса ГКГС-I на инфицированной клетке.Естественные киллеры, натуральные киллеры, NK-клетки (англ. Natural killer cells (NK cells)) — большие гранулярные лимфоциты, обладающие цитотоксичностью против опухолевых клеток и клеток, заражённых вирусами. В настоящее время NK-клетки рассматривают как отдельный класс лимфоцитов. NK выполняют цитотоксические и цитокин-продуцирующие функции. NK являются одним из важнейших компонентов клеточного врождённого иммунитета.
NK формируются в результате дифференцировки лимфобластов (общих предшественников всех лимфоцитов). Они не имеют Т-клеточных рецепторов, CD3 или поверхностных иммуноглобулинов, но обычно несут на поверхности маркеры CD16 и CD56 у людей или NK1.1/NK1.2 у некоторых линий мышей. Около 80 % NK несут CD8.
Эти клетки были названы естественными киллерами, поскольку, по ранним представлениям, они не требовали активации для уничтожения клеток, не несущих маркеров главного комплекса гистосовместимости I типа.
Основная функция NK — уничтожение клеток организма, не несущих на своей поверхности MHC1 и таким образом недоступных для действия основного компонента противовирусного иммунитета — Т-киллеров. Уменьшение количества MHC1 на поверхности клетки может быть следствием трансформации клетки в раковую или действия вирусов, таких как папилломавирус и ВИЧ.
Способность NK распознавать «своё» и «чужое» на клетках определяется поверхностными рецепторами. У NK существует сложная система рецепторов, распознающих молекулы собственных клеток организма. Кроме того, NK имеют множество рецепторов к стресс-индуцированным клеточным лигандам, которые свидетельствуют о повреждении клетки. К таким рецепторам относятся естественные рецепторы цитотоксичности (natural cytotoxicity receptors (NCRs), NKG2D. Они активируют цитотоксические функции NK.
- Цитокиновые рецепторы
- Цитокины играют ключевую роль в активации NK. Поскольку эти молекулы секретируются клетками при вирусной инфекции, они служат сигналом для NK о присутствии вирусных патогенов. В активации NK принимают участие цитокины IL-12, IL-15, IL-18, IL-2 и CCL5.
- NK, как и макрофаги, нейтрофилы и тучные клетки, несут Fc-рецепторы, которые активируют клетку при связывании с Fc-фрагментами антител. Это позволяет NK атаковать инфицированные клетки одновременно с гуморальным ответом и лизировать клетки с помощью антител-зависимого цитотоксического действия.
- Активирующие и ингибирующие рецепторы
 Общая схема. Ингибирующий и активирующий сигналы NK.
Общая схема. Ингибирующий и активирующий сигналы NK.- Для предотвращения атаки на неповрежденные клетки на поверхности NK имеется система регуляторных рецепторов (inhibitory NK cell receptors). Эти рецепторы можно разделить на 2 больших семейства:
- Регуляторные рецепторы, связываясь с неповреждёнными молекулами MHC I, индуцируют ингибиторный сигнал, подавляя активацию NK.
Связывание активирующих рецепторов NK со своими лигандами (присутствующими только на повреждённых клетках) активирует цитотоксическую функцию NK.
NK являются цитотоксичными; в их цитоплазме находятся маленькие гранулы, содержащие перфорин и протеазы. Перфорин выделяется непосредственно возле инфицированной клетки и образует поры в её клеточной мембране, через которые заходят протеазы и другие молекулы, приводя к апоптозу или осмотическому лизису клетки. Выбор между апоптозом и лизисом имеет большое значение, поскольку при лизисе зараженной вирусом клетки произойдет освобождение вирионов, а апоптоз приведет к разрушению вирусов вместе с клеткой.
В предварительных экспериментах южнокорейскими учеными было обнаружено, что экзосомы, полученные из естественных клеток-убийц, оказывают терапевтический эффект на клетки меланомы, поскольку они переносят два функциональных белка клеток-убийц, а именно перфорин и FasL (Fas ligand)[1][2].
- Immunobiology 7 PB (Janeway’s Immunobiology) Garland Science; 7 edition 2007 ISBN 0-8153-4123-7
- Roitt I, Brostoff J, Male D (2001). Immunology (6th ed.), 480p. St. Louis: Mosby, ISBN 0-7234-3189-2
Иммунитет — Википедия
Иммуните́т (лат. immunitas) — невосприимчивость, сопротивляемость организма к инфекционным агентам и чужеродным веществам, которые вызывают деструкцию его клеток и тканей. Иммунитет характеризуется изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Простейшие защитные механизмы, имеющие своей целью распознавание и обезвреживание патогенов, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые препятствуют заражению бактерии вирусом[1]. Одноклеточные эукариотные организмы применяют токсичные пептиды, чтобы предотвратить проникновение бактерий и вирусов в свои клетки.
По мере эволюции сложно организованных многоклеточных организмов у них формируется многоуровневая иммунная система, важнейшим звеном которой становятся специализированные клетки, противостоящие вторжению генетически чужеродных объектов[2].
У таких организмов иммунный ответ происходит при столкновении данного организма с самым различным чужеродным в антигенном отношении материалом, включая вирусы, бактерии и другие микроорганизмы, обладающие иммуногенными свойствами молекулы (прежде всего белки, а также полисахариды и даже некоторые простые вещества, если последние образуют комплексы с белками-носителями — гаптены[3]), трансплантаты или мутационно изменённые собственные клетки организма. Как отмечает В. Г. Галактионов, «иммунитет есть способ защиты организма от всех антигенно чужеродных веществ как экзогенной, так и эндогенной природы; биологический смысл подобной защиты — обеспечение генетической целостности особей вида в течение их индивидуальной жизни». Биологическим смыслом такой защиты является обеспечение генетической целостности особей вида на протяжении их индивидуальной жизни, так что иммунитет выступает как фактор стабильности онтогенеза[4].
Характерные признаки иммунной системы[5]:
- способность отличать «своё» от «чужого»;
- формирование памяти после первичного контакта с чужеродным антигенным материалом;
- клональная организация иммунокомпетентных клеток, при которой отдельный клеточный клон способен, как правило, реагировать лишь на одну из множества антигенных детерминант.
Иммунная система исторически описывается состоящей из двух частей — системы гуморального иммунитета и системы клеточного иммунитета. В случае гуморального иммунитета защитные функции выполняют молекулы, находящиеся в плазме крови, а не клеточные элементы. В то время как в случае клеточного иммунитета защитная функция связана именно с клетками иммунной системы.
Иммунитет так же классифицируют на врождённый и адаптивный.
Врождённый (неспецифический, наследственный[6]) иммунитет обусловлен способностью идентифицировать и обезвреживать разнообразные патогены по наиболее консервативным, общим для них признакам, дальности эволюционного родства, до первой встречи с ними. В 2011 году была вручена Нобелевская премия в области медицины и физиологии за изучение новых механизмов работы врождённого иммунитета (Ральф Стайнман, Жюль Хоффман и Брюс Бётлер).
Осуществляется большей частью клетками миелоидного ряда, не имеет строгой специфичности к антигенам, не имеет клонального ответа, не обладает памятью о первичном контакте с чужеродным агентом.
Адаптивный (устар. приобретённый, специфический) иммунитет имеет способность распознавать и реагировать на индивидуальные антигены, характеризуется клональным ответом, в реакцию вовлекаются лимфоидные клетки, имеется иммунологическая память, возможна аутоагрессия.
Классифицируют на активный и пассивный.
- Приобретённый активный иммунитет возникает после перенесённого заболевания или после введения вакцины.
- Приобретённый пассивный иммунитет развивается при введении в организм готовых антител в виде сыворотки или передаче их новорождённому с молозивом матери или внутриутробным способом.
Другая классификация разделяет иммунитет на естественный и искусственный.
- Естественный иммунитет включает врождённый иммунитет и приобретённый активный (после перенесённого заболевания), а также пассивный иммунитет при передаче антител ребёнку от матери.
- Искусственный иммунитет включает приобретённый активный после прививки (введение вакцины) и приобретённый пассивный (введение сыворотки).
Выделяют центральные и периферические органы иммунной системы. К центральным органам относят красный костный мозг и тимус, а к периферическим — селезёнку, лимфатические узлы, а также местноассоциированную лимфоидную ткань: бронхассоциированную (БАЛТ), кожноассоциированную (КАЛТ), кишечноассоциированную (КиЛТ, пейеровы бляшки).
Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Тимус — центральный орган иммунной системы. В нём происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга.
Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из плотной соединительной ткани, которая содержит гладкомышечные клетки, позволяющие ей при необходимости сокращаться. Паренхима представлена двумя функционально различными зонами: белой и красной пульпой. Белая пульпа составляет 20 %, представлена лимфоидной тканью. Здесь имеются В-зависимые и Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %. Она выполняет следующие функции:
- Депонирование зрелых форменных элементов крови.
- Контроль состояния и разрушения старых и повреждённых эритроцитов и тромбоцитов.
- Фагоцитоз инородных частиц.
- Обеспечение дозревания лимфоидных клеток и превращение моноцитов в макрофаги.
К иммунокомпетентным клеткам относят макрофаги и лимфоциты. Эти клетки совместно участвуют в инициации и развитии всех звеньев адаптивного иммунного ответа (система трёхклеточной кооперации).
Клетки, участвующие в иммунном ответе[править | править код]
T-Лимфоциты[править | править код]
Субпопуляция лимфоцитов, отвечающая главным образом за клеточный иммунный ответ. Включает в себя субпопуляции Т-хелперов (дополнительно разделяются на Th2, Th3, а также выделяют Treg, Th9, Th27, Th32,), цитотоксических Т-лимфоцитов,NKT. Включает в себя эффектор, регуляторы и долгоживущие клетки-памяти. Функции разнообразны: как регуляторы и администраторы иммунного ответа (Т-хелперы), так и киллеры (цитотоксические Т-лимфоциты).
B-Лимфоциты[править | править код]
Субпопуляция лимфоцитов синтезирующая антитела и отвечающая за гуморальный иммунный ответ.
Натуральные киллеры[править | править код]
Натуральные киллеры (NK-клетки) — субпопуляция лимфоцитов, обладающая цитотоксичной активностью, то есть они способны: контактировать с клетками-мишенями, секретировать токсичные для них белки, убивать их или отправлять в апоптоз. Натуральные киллеры распознают клетки, поражённые вирусами и опухолевые клетки.
Нейтрофилы[править | править код]
Нейтрофилы — это неделящиеся и короткоживущие клетки. Они составляют 65-70 % от гранулоцитов. Нейтрофилы содержат огромное количество антибиотических белков, которые содержатся в различных гранулах. К этим белкам относятся лизоцим (мурамидаза), липопероксидаза и другие антибиотические белки. Нейтрофилы способны самостоятельно мигрировать к месту нахождения антигена, так как у них есть рецепторы хемотаксиса (двигательная реакция на химическое вещество). Нейтрофилы способны «прилипать» к эндотелию сосудов и далее мигрировать через стенку к месту нахождения антигенов. Далее проходит фагический цикл, и нейтрофилы постепенно заполняются продуктами обмена. Далее они погибают и превращаются в клетки гноя.
Эозинофилы[править | править код]
Эозинофилы составляют 2—5 % от гранулоцитов. Способны фагоцитировать микробы и уничтожать их. Но это не является их главной функцией. Главным объектом эозинофилов являются гельминты. Эозинофилы узнают гельминтов и экзоцитируют в зону контакта вещества — перфорины. Эти белки встраиваются в билипидный слой клеток гельминта. В них образуются поры, внутрь клеток устремляется вода, и гельминт погибает от осмотического шока.
Базофилы[править | править код]
Базофилы составляют 0,5-1 % от гранулоцитов. Существуют две формы базофилов: собственно базофилы, циркулирующие в крови, и тучные клетки, находящиеся в ткани. Тучные клетки располагаются в различных тканях, лёгких, слизистых и вдоль сосудов. Они способны вырабатывать вещества, стимулирующие анафилаксию (расширение сосудов, сокращение гладких мышц, сужение бронхов). При этом происходит взаимодействие с иммуноглобулином Е (IgE). Таким образом они участвуют в аллергических реакциях. В частности, в реакциях немедленного типа.
Моноциты[править | править код]
Моноциты превращаются в макрофаги при переходе из кровеносной системы в ткани, существуют несколько видов макрофагов в зависимости от типа ткани, в которой они находятся, в том числе:
- Некоторые антигенпредставляющие клетки, в первую очередь дендритные клетки, роль которых — поглощение микробов и «представление» их Т-лимфоцитам.
- Клетки Купфера — специализированные макрофаги печени, являющиеся частью ретикулоэндотелиальной системы.
- Альвеолярные макрофаги — специализированные макрофаги лёгких.
- Остеокласты — костные макрофаги, гигантские многоядерные клетки позвоночных животных, удаляющие костную ткань посредством растворения минеральной составляющей и разрушения коллагена.
- Микроглия — специализированный класс глиальных клеток центральной нервной системы, которые являются фагоцитами, уничтожающими инфекционные агенты и разрушающими нервные клетки.
- Кишечные макрофаги и т. д.
Функции их разнообразны и включают в себя фагоцитоз, взаимодействие с адаптивной иммунной системой и инициацию и поддержание иммунного ответа, поддержание и регулирование процесса воспаления, взаимодействие с нейтрофилами и привлечение их в очаг воспаления, выделение цитокинов, регуляция репарации, регуляция процессов свертывания крови и проницаемости капилляров в очаге воспаления, синтез компонентов системы комплемента.
Макрофаги, нейтрофилы, эозинофилы, базофилы и натуральные киллеры обеспечивают прохождение врождённого иммунного ответа, который является неспецифичным (в патологии неспецифичный ответ на альтерацию называют воспалением, воспаление является неспецифической фазой последующих специфических иммунных).
В некоторых частях организма млекопитающих и человека появление чужеродных антигенов не вызывает иммунного ответа. К таким областям относятся мозг и глаза, семенники, эмбрион и плацента. Нарушение иммунных привилегий может становиться причиной аутоиммунных заболеваний.
Аутоиммунные заболевания[править | править код]
При нарушении иммунной толерантности или повреждении тканевых барьеров возможно развитие иммунных реакций на собственные клетки организма. Например, патологическая выработка антител к ацетилхолиновым рецепторам собственных мышечных клеток вызывает развитие миастении[7].
Иммунодефицит[править | править код]
- ↑ Bickle T. A., Krüger D. H. Biology of DNA restriction // Microbiological Reviews. — 1993. — Vol. 57, no. 7. — P. 434—450. — PMID 8336674.
- ↑ Travis J. On the Origin of the Immune System // Science. — 2009. — Vol. 324, no. 5927. — P. 580—582. — doi:10.1126/science.324_580. — PMID 19407173.
- ↑ Genetics of the Immune Response / Ed. by E. Möller and G. Möller. — New York: Plenum Press, 2013. — viii + 316 p. — (Nobel Foundation Symposia, vol. 55). — ISBN 978-1-4684-4469-8. — P. 262.
- ↑ Галактионов, 2005, с. 8.
- ↑ Галактионов, 2005, с. 8, 12.
- ↑ Иммунитет // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2.
- ↑ Галактионов, 2005, с. 392.
- Галактионов В. Г. . Эволюционная иммунология. — М.: Академкнига, 2005. — 408 с. — ISBN 5-94628-103-8.
- Хаитов Р. М. . Иммунология. — М.: ГЕОТАР, 2006. — 320 с. — ISBN 978-5-9704-1288-6.
- Ярилин А. А. . Иммунология. — М.: ГЕОТАР, 2010. — 737 с. — ISBN 978-5-9704-1319-7.
Антигенпредставляющие клетки — Википедия
Материал из Википедии — свободной энциклопедии
 Взаимодействие Т-клеток с презентированным антигеном стимулирует их превращение в CD8+ цитотоксические Т-клетки или CD4+ Т-хелперы
Взаимодействие Т-клеток с презентированным антигеном стимулирует их превращение в CD8+ цитотоксические Т-клетки или CD4+ Т-хелперыАнтигенпредставляющие клетки или антигенпрезентирующие клетки (АПК, англ. antigen-presenting cell, APC) — клетки, которые экспонируют чужеродный антиген в комплексе с молекулами главного комплекса гистосовместимости (англ. MHC) на своей поверхности. Т-лимфоциты могут распознавать такие комплексы при помощи Т-клеточных рецепторов (англ. TCR). Антигенпредставляющие клетки процессируют антиген и представляют его Т-клеткам.
Выделяют два типа антигенпрезентирующих клеток: «профессиональные» и «непрофессиональные».
Т-клетки не способны распознавать и, соответственно, реагировать на «чистый» антиген. Только антиген, который был предварительно процессирован другими клетками и представлен ими в комплексе с молекулами главного комплекса гистосовместимости, становится «видимым» для Т-клеток. Многие клетки организма способны представлять антигены CD8+ Т-лимфоцитам при участии молекул главного комплекса гистосовместимости I класса, то есть, по сути, они действуют как антигенпредставляющие клетки. Однако этот термин обычно применяется только в отношении тех специализированных клеток, которые способны активировать наивные Т-лимфоциты (Т-лимфоциты, которые ещё никогда не встречались с антигеном). Эти клетки, как правило, синтезируют молекулы главного комплекса гистосовместимости I и II классов и могут, соответственно, активировать не только CD8+цитотоксические Т-лимфоциты, но и CD4+Т-хелперы.
Для того чтобы деление на типы было более понятным, «профессиональными» антигенпрезентирующими клетками обычно называют те, которые экспрессируют молекулы главного комплекса гистосовместимости II класса.
«Профессиональные» антигенпредставляющие клетки[править | править код]
«Профессиональные» антигенпредставляющие клетки очень эффективно захватывают антиген путём фагоцитоза или рецептор-опосредованного эндоцитоза и затем представляют фрагмент этого антигена на своей мембране в комплексе с молекулами главного комплекса гистосовместимости II класса. Т-клетки распознают этот комплекс на мембране и взаимодействуют с ним. После этого антигенпредставляющие клетки продуцируют дополнительные ко-стимуляторные молекулы, что приводит к активации Т-клетки. Экспрессия этих ко-стимуляторных молекул является характерной чертой «профессиональных» антигенпрезентирующих клеток.
Существует несколько основных типов «профессиональных» антигенпрезентирующих клеток:
- дендритные клетки, которые, вероятно, являются наиболее важными антигенпредставляющими клетками. Активированные дендритные клетки являются особенно эффективными активаторами Т-хелперов, потому что на их поверхности присутствуют ко-стимуляторные молекулы, такие, как белок B7.
- макрофаги, которые являются CD4-положительными клетками и потому могут быть инфицированы вирусом иммунодефицита человека.
- B-лимфоциты, которые несут на своей поверхности (как В-клеточный рецептор) и секретируют специфичные антитела, а также могут захватывать антиген, связавшийся с В-клеточным рецептором, процессировать его и представлять в комплексе с молекулами главного комплекса гистосовместимости II класса. По отношению к другим видам антигенов В-лимфоциты неактивны как антигенпрезентирующие клетки.
- некоторые активированные эпителиальные клетки.
«Непрофессиональные» антигенпредставляющие клетки[править | править код]
«Непрофессиональные» антигенпредставляющие клетки в норме не содержат молекул главного комплекса гистосовместимости II класса, а синтезируют их только в ответ на стимуляцию определёнными цитокинами, например, γ-интерфероном.
К «непрофессиональным» антигенпредставляющим клеткам относятся:
После того, как антигенпредставляющая клетка фагоцитировала антиген, она, как правило, мигрирует в систему лимфатических сосудов и переносится током лимфы в ближайший лимфатический узел. В лимфатических узлах осуществляется взаимодействие антигенпредставляющих клеток, таких, как дендритные клетки, с Т-клетками. Привлечение антигенпредставляющих клеток в лимфатические узлы осуществляется за счёт хемотаксиса: клетки реагируют на присутствие хемокинов, которые могут экспрессироваться на поверхности других клеток (например, на поверхности клеток сосудов) или выделяться во внеклеточное пространство. В ходе миграции в лимфатический узел дендритные клетки созревают: они теряют способность захватывать новые патогены и приобретают свойства, которые позволяют им лучше взаимодействовать с Т-клетками. Внутриклеточные ферменты расщепляют захваченный патоген на небольшие фрагменты, содержащие эпитопы, которые затем представляются Т-клеткам в комплексе с молекулами главного комплекса гистосовместимости.
Исследования показывают, что презентируются только определённые эпитопы патогена, потому что они обладают свойством иммунодоминантности, которое, по-видимому, проявляется в их аффинности к молекулам главного комплекса гистосовместимости. Более прочное связывание позволяет комплексу оставаться стабильным достаточно долго для того, чтобы он мог быть узнан Т-клеткой.
Kindt, TJ & Goldsby, RA, 2007 , Kuby immunology , 6th ed, W.H. Freeman, New York, N.Y.
Нейтрофилы — это… Что такое Нейтрофилы?
Нейтрофильные гранулоциты или нейтрофилы, сегментоядерные нейтрофилы, нейтрофильные лейкоциты — подвид гранулоцитарных лейкоцитов, названный нейтрофилами за то, что при окраске по Романовскому они интенсивно окрашиваются как кислым красителем эозином, так и основными красителями, в отличие от эозинофилов, окрашиваемых только эозином, и от базофилов, окрашиваемых только основными красителями.
Зрелые нейтрофилы имеют сегментированное ядро, то есть относятся к полиморфноядерным лейкоцитам, или полиморфонуклеарам.
Зрелые сегментоядерные нейтрофилы в норме являются основным видом лейкоцитов, циркулирующих в крови человека, составляя от 47% до 72% общего количества лейкоцитов крови. Еще 1-5% в норме составляют юные, функционально незрелые нейтрофилы, имеющие палочкообразное сплошное ядро и не имеющие характерной для зрелых нейтрофилов сегментации ядра — так называемые палочкоядерные нейтрофилы.
Нейтрофилы способны к активному амебоидному движению, к экстравазации (эмиграции за пределы кровеносных сосудов), и к хемотаксису (преимущественному движению в направлении мест воспаления или повреждения тканей).
Нейтрофилы способны к фагоцитозу, причём являются микрофагами, то есть способны поглощать лишь относительно небольшие чужеродные частицы или клетки. После фагоцитирования чужеродных частиц нейтрофилы обычно погибают, высвобождая большое количество биологически активных веществ, повреждающих бактерии и грибки, усиливающих воспаление и хемотаксис иммунных клеток в очаг. Нейтрофилы содержат большое количество миелопероксидазы, фермента, который способен окислять анион хлора до гипохлорита — сильного антибактериального агента. Миелопероксидаза как гем-содержащий белок имеет зеленоватый цвет, что определяет зеленоватый оттенок самих нейтрофилов, цвет гноя и некоторых других выделений, богатых нейтрофилами. Погибшие нейтрофилы вместе с клеточным детритом из разрушенных воспалением тканей и гноеродными микроорганизмами, послужившими причиной воспаления, формируют массу, известную как гной.
Повышение процента нейтрофилов в крови называется относительным нейтрофилезом, или относительным нейтрофильным лейкоцитозом. Повышение абсолютного числа нейтрофилов в крови называется абсолютным нейтрофилезом. Снижение процента нейтрофилов в крови называется относительной нейтропенией. Снижение абсолютного числа нейтрофилов в крови обозначается как абсолютная нейтропения.
Нейтрофилы играют очень важную роль в защите организма от бактериальных и грибковых инфекций, и сравнительно меньшую — в защите от вирусных инфекций. В противоопухолевой или антигельминтной защите нейтрофилы практически не играют роли.
Нейтрофильный ответ (инфильтрация очага воспаления нейтрофилами, повышение числа нейтрофилов в крови, сдвиг лейкоцитарной формулы влево с увеличением процента «юных» форм, указывающий на усиление продукции нейтрофилов костным мозгом) — самый первый ответ на бактериальные и многие другие инфекции. Нейтрофильный ответ при острых воспалениях и инфекциях всегда предшествует более специфическому лимфоцитарному. При хронических воспалениях и инфекциях роль нейтрофилов незначительна и преобладает лимфоцитарный ответ (инфильтрация очага воспаления лимфоцитами, абсолютный или относительный лимфоцитоз в крови).
Wikimedia Foundation. 2010.
