Мочевина
Мочевина является главным конечным продуктом обмена аминокислот. Синтезируется мочевина из аммиака, который постоянно образуется в организме при окислительном и неокислительном дезаминировании аминокислот, при гидролизе амидов глутаминовой и аспарагиновой кислот, а также при распаде пуриновых и пиримидиновых нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего — на центральную нервную систему. Несмотря на то, что аммиак постоянно продуцируется в тканях, он содержится в периферической крови лишь в следовых количествах, так как быстро удаляется из кровеносной системы печенью, где входит в состав глутамата, глутамина и мочевины. Биосинтез мочевины является основным механизмом обезвреживания аммиака в организме.
Биосинтез мочевины
Синтез мочевины происходит в печени в цикле Кребса-Гензелейта (другое название — орнитиновый цикл мочевинообразования Кребса) в несколько этапов с участием ряда ферментных систем. Синтез сопровождается поглощением энергии, источником которой является АТФ.
Весь цикл мочевинообразования можно представить следующим образом:
На первом этапе синтезируется карбамоилфосфат в результате конденсации ионов аммония, двуокиси углерода и фосфата (поступающего из АТФ) под действием фермента карбамоилсинтетазы. Карбамоилфосфат — это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза ряда других азотистых соединений.
На втором этапе мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитинкарбамоилтрансфераза.
На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая, сводится к конденсации цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинатсинтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента — аргининосукцинатлиазы.
На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменении количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.) также сопровождаются активацией орнитинового цикла.
Выведение мочевины
Синтезированная в печени мочевина попадает в кровь, затем в почки и в итоге выводится с мочой. Мочевина является беспороговым веществом: все образующееся количество фильтруется в просвет проксимальных канальцев, а затем часть (около 35 %) реабсорбируется обратно за счет реабсорбции воды. В связи с этим величина экскреции мочевины является менее информативным показателем клубочковой фильтрации, чем показатель, основывающийся на экскреции креатинина (который, в отличие от мочевины, практически не реабсорбируется).
Нормальные значения мочевины в крови и моче
Основные статьи:
Мочевина в крови. Клинико-диагностическое значение определения мочевины в крови
Мочевина в моче. Клинико-диагностическое значение определения мочевины в моче
Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 2,5 — 8,3 ммоль/л (660 мг/л). У женщин, по сравнению со взрослыми мужчинами, концентрация мочевины в сыворотке крови обычно ниже. У пожилых людей (старше 60 лет) наблюдается некоторое увеличение концентрации мочевины в сыворотке крови (примерно на 1 ммоль/л по сравнению с нормой здоровых взрослых людей), что обусловлено снижением у пожилых способности почек концентрировать мочу.
У детей уровень мочевины ниже, чем у взрослых, однако у новорожденных в первые 2 — 3 дня содержание ее может достигать уровня взрослого (проявление физиологической азотемии, обусловленной повышенным катаболизмом на фоне недостаточного поступления жидкости в первые 2 — 3 сут жизни и низкого уровня клубочковой фильтрации). В условиях гипертермии, эксикоза цифры мочевины могут возрасти еще больше. Нормализация наступает к концу первой недели жизни. Уровень мочевины в крови у недоношенных 1 нед. — 1,1 — 8,9 ммоль/л (6,4 — 63,5 мг/100 мл), у новорожденных — 1,4 — 4,3 ммоль/л (8,6 — 25,7 мг/100 мл), у детей после периода новорожденности — 1,8 — 6,4 ммоль/л (10,7 — 38,5 мг/100 мл).
Экскреция мочевины с мочой (при диете со средним содержанием белка) в норме составляет у взрослых 333,0 — 587,7 ммоль/сут (20 — 35 г/сут). У детей суточная экскреция мочевины с мочой ниже и увеличивается с возрастом: 1-я нед — 2,5 — 3,3 ммоль/сут, 1 мес — 10,0 — 17,0 ммоль/сут, 6 — 12 мес — 33 — 67 ммоль/сут, 1 — 2 года — 67 — 133 ммоль/сут, 4 — 8 лет — 133 — 200 ммоль/сут, 8 — 15 лет — 200 — 300 ммоль/сут.
См. также: Методы определения мочевины
Литература:
- Комаров Ф. И., Коровкин Б. Ф., Меньшиков В. В. — Биохимические исследования в клинике — Элиста, АПП «Джангар», 1999 г.
- Слепышева В. В., Балябина М. Д., Козлов А. В. — Методы определения мочевины
- Березов Т. Т., Коровкин Б. Ф. — Биологическая химия — Москва, «Медицина», 1990 г.
- Марри Р., Греннер Д., Мейес П., Родуэлл В. — Биохимия человека — том 1 — Москва, «Мир», 1993 г.
- Биохимия — под редакцией Северина Е. С. — Москва, ГЭОТАР-МЕД, 2004 г.
- Клиническая оценка лабораторных тестов — под редакцией Н. У. Тица — Москва, «Медицина», 1986 г.
- Папаян А. В., Савенкова Н. Д. — «Клиническая нефрология детского возраста», Санкт-Петербург, СОТИС, 1997 г.
Цикл мочевины — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 декабря 2017; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 декабря 2017; проверки требуют 2 правки.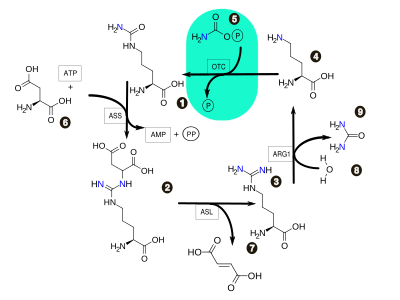
ОТС-орнитинтранскарбомоилаза, ASS-аргининосукцинатсинтетаза, ASL-аргининосукцинатлиаза, ARG1-аргиназа
Цикл мочевины или орнитиновый цикл (цикл Кребса-Гензелейта) — последовательность биохимических реакций млекопитающих и некоторых рыб, в результате которой азотсодержащие продукты распада преобразуются в мочевину, которая в свою очередь выделяется почками. В большинстве случаев таким образом происходит превращение аммиака. У птиц и рептилий конечным продуктом выделения является не мочевина, а мочевая кислота. Земноводные и большинство рыб не преобразуют аммиак в другие соединения, поскольку вследствие постоянного контакта с водой происходит быстрый вывод аммиака из организма через жабры или поверхность кожи в результате осмоса. Впервые описан Хансом Кребсом в 1932 году.
Необходимость в данном цикле реакций возникает вследствие того, что высокие концентрации аммиака, образующиеся в больших количествах в результате деградации нуклеотидов, оказывают угнетающее воздействие на нейроны. Мочевина же, являясь нейтральным соединением с небольшими размерами и высокой растворяемостью в физиологических жидкостях, способна легко проникать через биологические мембраны, легко переносится кровью и выделяется с мочой.
Реакции цикла мочевины локализованы исключительно в клетках печени и протекают частью в митохондриях, а частью в цитозоле, в результате чего возникает необходимость в переносчиках.
Реакции в митохондрии[править | править код]
Реакции в цитоплазме[править | править код]
- В цитоплазме цитруллин с аспарагиновой кислотой при участии фермента аргининсукцинат-синтетазы образует совместно аргининосукцинат. В ходе данной реакции расходуется энергия превращения одной молекулы АТФ в АМФ (что эквивалентно превращению двух молекул АТФ в АДФ). Образовавшийся в ходе реакции дифосфат гидролизируется для обеспечения необратимости процесса (на схеме не показано).
- Под действием фермента аргининосукцинат-лиазы аргининосукцинат распадается на фумарат и аргинин.
- Аргинин в свою очередь гидролизируется при участии аргиназы (аргининогидролазы) с образованием мочевины и орнитина, который сразу же переносится в митохондрию и цикл повторяется вновь.
Суммарное уравнение реакций[править | править код]
NH3 + CO2 + 3ATФ + аспарагиновая кислота + 2H2O → мочевина + фумарат + 2AДФ +2Фн
+ АМФ + ФФнЭнергетический выход цикла составляет затрату четырёх макроэргических связей на одну молекулу мочевины, поскольку пирофосфат далее превращается до фосфата.
Следует заметить, что полученная в процессе реакции аргининосукциназы молекула фумарата снижает энергетическую стоимость цикла. Фумарат, реагируя с молекулой воды в цитозоле, дает малат. Малат же вступает в цикл Кребса и с помощью НАД окисляется. Продуктами этой реакции являются НАДH и оксалоацетат. НАДH вступает в дыхательную электронтранспортную цепь. Окисление НАДH дает примерно 2,5 молекул АТФ, следовательно, стоимость цикла мочевины после этих дополнительных реакций составляет 1,5 молекул АТФ.
Нарушения цикла мочевины, например, в силу мутаций генов, кодирующих участвующие в цикле ферменты, приводят к заболеваниям цикла мочевины. Большинство таких заболеваний приводят к гипераммониемии.

— удаление аммиака — Биохимия
Практически весь аммиак удаляется из организма:
- с мочой в виде мочевины, которая синтезируется в печени,
- в виде образующихся в эпителии канальцев почек солей иона аммония.
В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах.
В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония).
Реакция дезаминирования глутамина
Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота.
В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака.
Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Определение концентрации мочевины в крови является ценным диагностическим показателем.
Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
Реакция синтеза карбамоилфосфата и орнитиновый цикл
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
В противоположность аммиаку мочевина является нетоксичным и нейтральным соединением. При хронической почечной недостаточности, когда продукты азотистого обмена не выводятся из организма, токсичное действие на организм оказывает совсем не мочевина, а совокупность более чем 200 других веществ.
Синтез аммонийных солей
Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей.
Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза, гидролизующая амидную группу с образованием глутамата. Глутамат, в свою очередь, дезаминируется глутаматдегидрогеназой и полученный α-кетоглутарат сгорает в ЦТК. Также, особенно при голодании, α-кетоглутарат вовлекается в синтез глюкозы.
Параллельно в эпителии происходят процессы клеточного дыхания, сопровождающиеся образованием угольной кислоты, которая диссоциирует на ион Н+ и карбонат-ион НСО3−. Ионы водорода секретируются в первичную мочу, карбонат-ионы – в кровь.
Выделяемый аммиак
- либо диффундирует в просвет канальца, где соединяется с ионом Н+, образуя ионы аммония NH4+. Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот),
- либо связывается с ионом ионом Н+ в самой клетке, образуя ионы аммония Nh5+, который секретируется в обмен на ионы Na+.
Реакции синтеза аммонийных солей
При сдвигах кислотно-основного равновесия происходит адаптивное изменение активности глутаминазы. При ацидозе (закислении крови) необходимость выведения ионов Н+ вызывает увеличение синтеза фермента и возрастание экскреции солей аммония. При алкалозе (защелачивании крови) активность глутаминазы снижается и ионы Н+ сберегаются в организме.
1.Образование и обезвреживание аммиака. Биосинтез мочевины, последовательность реакций. Роль печени в мочевинообразовании. Возрастные особенности.
Пути образования аммиака
Аммиак образуется во всех тканях, особенно в головном мозге, а обезвреживается в печени и почках.
Пути образования:
1)дезаминирование а/к-т;
2)дезаминирование пуриновых оснований;
3)распад пиримидиновых оснований;
4)дезамидирование амидов;
5)дезаминирование биогенных аминов;
6)распад гексозаминов
Дезаминирование – основной путь распада (катаболизма) а/к-т. В сутки подвергается дезаминированию ок.70 г а/к-т.
Виды:
1)гидролитический
2)восстановительное дезаминирование
3)внутримолекулярное (асп,асн и гис),
4)окислительное (этот вид является основным(глу).
Процесс происходит под действием фермента – глутаматДГ, который находится в активном виде.
Пути обезвреживания аммиака.
Аммиак в малых дозах – это физиологический раздражитель, в больших – токсическое вещество. Поэтому концентрация аммиака в организме должна находиться на низком уровне – 60 мкМ/л. Гомеостаз аммиака поддерживается за счет его обезвреживания в тканях.
Пути:
1)амидирование;
2)аммонийгенез;
3)восстановительное аминирование;
4)синтез мочевины.
Аммиак, образующийся при дезамидировании в печени, обезвреживается, используясь на синтез мочевины. В почках — на образование аммонийных солей(аммонийгенез). В печени и других тканях аммиак обезвреживается в р-те реакции восстановительного аминирования. Преимущественно в печени идет процесс образования мочевины, являющийся основным путем обезвреживания аммиака.
Образование мочевины получило название орнитиновый цикл, или цитруллиновая теория. Синтез мочевины протекает в МТХ печени. Предварительно в МТХ под действием карбамоилфосфатсинтетазы I с затратой 2АТФ аммиак связывается с СО2 с образованием карбамоилфосфата:

1.В МТХ орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется — цитруллин:

2.В цитозоле аргининосукцинатсинтетаза с затратой 1АТФ(2макроэргических связей)связывает цитруллин с аспартатом и образуется аргининосукцинат(аргининоянтарная к-та).Фермент нуждается в Mg2+.мАспартат-источник 2ого атома азота мочевины.

3.В цитозоле аргининосукцинатлиаза(аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).

Фумарат в ЦТК.
4.В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+,ингибиторы-высокие концентрации орнитина и лизина.

Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Мочевина в кровь->почки->выводится.
Общее уравнение синтеза мочевины:
CO2+Nh4+асп+3АТФ+2Н2О→мочевина+ фумарат+2АДФ+АМФ+2Фн+ФФн.
На синтез 1 молекулы мочевины расходуются 4 макроэргических связи 3АТФ.
Ф-ии цикла:
1.превращает азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов,главным образом аммиака.
2.синтез аргинина и пополнение его фонда в организме.
Нарушение цикла:
1.Гипераммониемия 1 типа — дефект карбомаилфосфат синтетазы.
2.Гипераммониемия 2типа
3.Цитруллинемия
4.Оргининсукцинатомия
5.Гиперарининемия.
Мочевинообразование—одна из важнейших дезинтоксикационных функций печени, заключающихся в преобразовании ядовитых осколков белковой молекулы в нетоксичное вещество. При дезаминировании а/к-т, нуклеотидов и др.азотистых соединений печень принимает участие в синтезе аммиака, превышение предельно допустимых концентраций которого становится высокотоксичным для организма. Дезинтоксикация аммиака происходит посредством использования его для синтеза мочевины.
2.2. .Биосинтез мочевины как основной механизм предотвращения накопления аммиака. Клиническое
значение определения мочевины.
Еще в прошлом веке русские ученые М.В. Ненцкий и С.С. Салазкин показали, что в печени происходит образование мочевины из углекислого газа и аммиака.
Кребс и Гензеляйт установили, что синтез мочевины представляет собой циклический процесс, в котором ключевым соединением, замыкающим цикл, является орнитин. Кохен и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата.

В печени аммиак связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Затем под действием орнитин-карбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на орнитин и образуется цитруллин. В следующей реакции аргининосукцинатсинтетаза связывает его с аспартатом и образуется аргининоянтарная кислота. Аспартат – источник второго атома азота мочевины. Далее происходит расщепление аргининоянтарной кислоты на аргинин и фумарат (идет в ЦТК). Аргинин гидролизуется под действием аргиназы на орнитин и мочевину. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции происходят в митохондриях гепатоцитов. Затем цитруллин транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Орнитиновый цикл в печени выполняет 2 функции:
1. превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных
продуктов — аммиака;
2. синтез аргинина и пополнение его в организме.
Отмечается, что у детей первых месяцев жизни функция печени развита недостаточно, что проявляется в том, что у ребенка количество аммиака по сравнению с взрослым человеком увеличено в 2-2,5 раза. У новорожденных – 20-30% общего азота падает на азот мочевины.
Мочевина – безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть ферменты мочевинообразования. В головном мозге имеются все ферменты синтеза мочевины, кроме карбамоилфосфатазы, поэтому в нем мочевина не образуется. Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. В норме экскрекция мочевины – 25-30 г/сут. При повышении количества потребляемых с пищей белков увеличивается выделение мочевины.
2.3. Синтез креатина, креатин-фосфата, значение этого синтеза для организма. Клиническое
значение определения креатинина.
Конечным продуктом распада аминокислот в организме, наряду с мочевиной, является креатинин, который образуется в мышечной ткани из креатинфосфата. Креатин и креатинфосфат – важнейшие азотистые вещества мышц, участвующие в химических процессах, связанных с ресинтезом АТФ, являющегося участником мышечного сокращения. Это небелковые азотистые вещества мышц. Креатин синтезируется в почках и печени из трех аминокислот, затем поступает в мышечную ткань.

Эта реакция является одним из путей ресинтеза АТФ и протекает в работающей мышце. Креатинин удаляется в составе мочи. Содержание креатинина в моче зависит от развития мышечной массы. Т.о. следует подчеркнуть, что мочевина, креатинин, соли аммония являются конечными продуктами обмена аминокислот, а определение их в моче является диагностическим показателем. В норме мочевины за сутки у взрослого выделяется около 25- 30г, креатинина – 1,5-2,4 г., солей аммония – 0,5-1,2 г.
Количество креатинина в моче повышается при распаде белков, усиленной мышечной работе, акромегалии, гипотиреозе.
Креатин в норме у взрослого в моче не обнаруживается, а у детей в связи с повышенным обменом веществ может наблюдаться креатинурия.
Креатин в моче появляется при авитаминозе витаминов »С» и »Е», сахарном диабете, голодании, а также при всех заболеваниях, связанных с распадом мышечной ткани.
1. Реакции синтеза мочевины
Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота. Источником

одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием
Рис. 9-13. Глюкозо-аланиновый цикл.
481

Рис. 9-14. Обмен аммиака. Основной источник аммиака — аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени. Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными и обусловливают скорость процессов образования и обезвреживания аммиака.

Рис. 9-15. Количество азотсодержащих веществ в моче (%) при нормальном белковом питании.
карбамоилфосфата под действием карбамоилфосфатсинтетазы I (см. схему А ниже).
Далее под действием орнитинкарбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота — цитруллин (см. схему Б на с. 483).
В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат — источник второго атома азота мочевины (см. схему А на с. 483).

Схема А

482

Схема Б


Схема А

Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина (см. схему Б ниже).
Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента:


Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения (рис. 9-16).
Суммарное уравнение синтеза мочевины:
СО2 + Nh4 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + h5P2O7.
Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень с кровью ворот-вены. Роль других источников, в том числе гсительного дезаминирования глутаминовой эты в печени, существенно меньше.
Аспартат, необходимый для синтеза аргининокцината, образуется в печени путём трансаминирования

Схема Б


Рис. 9-16. Орнитиновый цикл Кребса-Гензелейта. Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: • одна аминогруппа — в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля.
аланина с оксалоацетатом. Алании поступает главным образом из мышц и клеток кишечника. Источником оксалоацетата, необходимого для этой реакции, можно считать превращение фумарата, образующегося в реакциях орнитинового цикла. Фумарат в результате двух реакций цитратного цикла превращается в оксалоацетат, из которого путём трансаминирования образуется аспартат (рис. 9-17). Таким образом, с орнитиновым циклом сопряжён цикл регенерации аспартата из фумарата. Пиру ват, образующийся в этом цикле из аланина, используется для глюконеогенеза.
Ещё одним источником аспартата для орнитинового цикла является Трансаминирование глутамата с оксалоацетатом.
Карбамид (мочевина) | справочник Пестициды.ru
Физические и химические свойства
– бесцветные кристаллы без запаха.- Растворимость в воде (в 100 г): при +20°C – 51,8 г, при +60°C – 71,7 г, при +120 °C – 95,0 г.
- Карбамид растворим в метаноле, этаноле, изопропаноле, изобутаноле, этилацитате, не растворим в хлороформе.
- Мочевина способна образовывать соединения с включением неорганических веществ и с органическими веществами.
- Температура плавления – +132,7°C.
- Плотность при +25°C – 1330 кг/м3
- При нагревании до 150°C и выше карбамид превращается в NH4NCO, затем NH3 и CO2, биурет, циануровую кислоту.
- В разбавленных растворах при 200°C возможен полный гидролиз мочевины с образованием NH3 и CO2.[7]
- Массовая доля биурета не должна превышать 1,4 %.
- Массовая доля воды по методу высушивания – не более 0,3 %.
- Рассыпчатость – не менее 100 %.[3]
Применение
Выпускается две марки карбамида: А – для промышленности и Б – для растениеводства.[3]
Сельское хозяйство
Карбамид применяют под все сельскохозяйственные культуры в качестве основного удобрения (для основного внесения), для ранневесенней подкормки озимых культур с немедленной заделкой в почву, а также для подкормки овощных и пропашных культур при помощи культиваторов-растениепитателей. Карбамид идеально подходит для некорневых подкормок растений[8] и фертигации.[6]
Зарегистрированные и допущеные к использованию в сельском хозяйстве на территории России марки карбамида размещены в таблице справа.[4]
Промышленность
Карбамид используется в промышленности в качестве сырья при изготовлении смол, клеев, а также в животноводстве в качестве кормовой добавки.[3]
Поведение в почве
Мочевина в почве растворяется почвенным раствором и под влиянием уробактерий, выделяющих уразу (пециальный фермент), за два-три дня аммонифицируется и превращается в углекислый аммоний:
CO(NH2)2 + 2H2O → (NH4)2CO3
Углекислый аммоний – соединение нестойкое, на воздухе разлагается, образуя бикарбонат аммония и аммиака:
(NH4)2CO3 → NH4HCO3 + NH3
По этой причине при внесении мочевины без заделки в почву в отсутствие осадков часть азота в виде аммиака теряется. Такие потери значительнее в почвах с нейтральной и щелочной реакцией.
Углекислый аммоний, заделанный в почву, подвергается гидролизу. При этом образуется бикарбонат аммония и гидроксид аммония:
(NH4)2CO3 + H2O → NH4HCO3 + NH4OH
Образующийся при внесении в почву карбомида аммоний поглощается коллоидной фракцией и постепенно усваивается растениями. Установлено, что мочевина может быть поглощена корнями и листьями растений без предварительного превращения. Но существует опасность вымывания из почвы мочевины, не прошедшей аммонификацию.
По мере процесса аммонификации мочевины происходит временное локальное подщелачивание почвы из-за гидролиза углекислого аммония. По истечении некоторого времени аммоний подвергается нитрификации, образуя кислоту и двигая реакцию в сторону подкисления:
2NH3 + 3O2 → 2HNO2 + 2H2O
2HNO2 + O2 → 2HNO3
Таким образом, карбамид является биологически кислым удобрением. Но после усвоения растениями азота из данного удобрения в почве не остается ни кислотных, ни щелочных остатков.[2]
Применение на различных типах почв
Карбамид применяется в качестве основного удобрения на всех почвах под различные сельскохозяйственные культуры.[8]
в зоне достаточного увлажнения и при орошении на сероземах карбамид более эффективен, чем аммиачная селитра. при основном внесении карбамид равнозначен аммиачной селитре.[5]необходимо при внесении немедленно заделывать карбамид в почву для уменьшения потерь азота.[1]Способы внесения
Мочевину применяют до посева и в подкормку.[2]
В качестве основного удобрения карбамид применяется на всех почвах и под все сельскохозяйственные культуры.
Ранневесенняя подкормка озимых проводится с немедленной заделкой удобрения в почву боронованием в целях сокращения потерь аммиака.
Подкормка овощных и пропашных культур проводится с использованием культиваторов-растениепитателей.
Карбамид считается лучшей формой азотных удобрений для некорневых подкормок растений, поскольку не обжигает листья и способен поглощаться ими в виде целой молекулы, без разложения.[8]
Уже через 48 часов после опрыскивания карбамидом азот обнаруживается в составе белка растений.[2]
Карбамид – одно из удобрений, рекомендуемых при фертигации.[6]
Влияние на сельскохозяйственные культуры
Карбамид – ценное азотное удобрение. Эффективен при применении под различные культуры. По действию на урожай стоит в одном ряду с аммиачной селитрой.[5]
. Применение мочевины на свекле (все виды) и рапсе до посева может привести к гибели проростков.[2]. Применение карбамида в качестве некорневой подкормки значительно повышает содержание белка в зерне.[2]Получение
Карбамид получают синтезом из аммиака и диоксида углерода (CO2) при высоком давлении и температуре. Для улучшения физических и химических свойств кристаллическую мочевину гранулируют. Гранулы для уменьшения слеживаемости покрывают тонкой пленкой жировой добавки.[6]
