Что такое микроцитоз? Симптоматика
Фото представлено рекламодателем
Термин «микроцитоз» имеет непосредственное отношение к медицине. Таким словом принято называть избыток эритроцитов в составе крови, при этом последние не отличаются большим размером. К причинам возникновения патологий можно отнести: железодефицитную анемию, наследственный сфероцитоз и талассемию.
Если всё-таки было принято решение провести анализ крови и микроцитоз подтверждён, то в данном случае медлить нельзя. Необходимо срочно обращаться к профильным специалистам, с целью в оптимально короткий срок избавиться от проблемы. Спровоцировать диагноз способны и врождённые проблемы, но часто это связано с отравлением свинцом. В последнем случае эритроциты принимают особенную форму (их центральный участок становится более насыщенного цвета). Их продуцирует костный мозг, они стабильно появляются в пределах организма человека.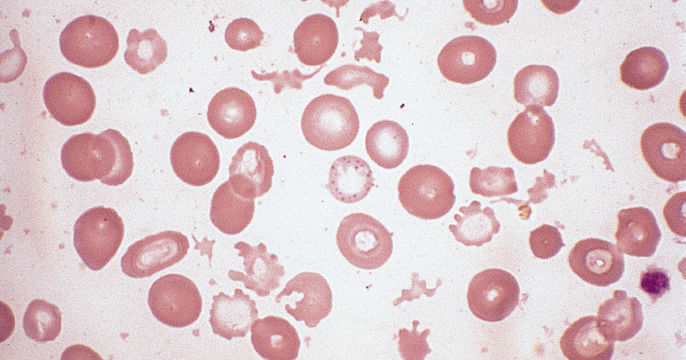
Обычно микроцитоз сопровождается следующей симптоматикой: сильные головокружения; ощущение слабости во всём теле; бледность, проступающая на лице; образование отдышки; частое сердцебиение; раздражительность и нервозность.
Понятно, что признаки носят общий характер, но они должны послужить причиной экстренного обращения к врачу. Он должен провести обследования и взять необходимые анализы. От правильности диагностики будет зависеть очень многое.
О процессе лечения сложно говорить без знания причин, которые повлекли за собой развитие заболевания. Каждый случай может носить индивидуальный характер.
Для борьбы с недугом могут применяться консервативные или медикаментозные методы либо практиковаться оперативное вмешательство. Иногда причина банальна и кроется в нехватке железа, неправильном питании или недостаточном количестве гемоглобина. Такие потери легко восполнить при помощи определённого набора продуктов или исправить ситуацию диетой.
На правах рекламы
Железодефицитные анемии (ЖДА).Причины, клинические и лабораторные проявления ЖДА.
Железодефицитные анемии – гипохромные анемии, при которых организм оказывается в условиях дефицита железа (Fe). Содержание железа снижается в костном мозге, тканях, сыворотке крови и депо. В результате этого нарушается образование гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях. Развитию анемии предшествует скрытый латентный период дефицита Fe в организме.
В среднем в организме человека имеется 4,5 г железа. Железо находится в соединении с белками:
1) 60% содержится в составе гемоглобина и называется гемовое или геминовое Fe — это функциональное железо. Функция гемоглобина состоит в переносе кислорода от легких к тканям. Геминовое Fe входит в состав миоглобина, цитохромов, каталазы, лактопероксидазы.
Геминовое Fe входит в состав миоглобина, цитохромов, каталазы, лактопероксидазы.
2) Белки, содержащие железо запасов – это ферритин и гемосидерин. Ферритин водорастворимый белок, содержащий 20% 3-х валентного железа.Его много в печени,мышцах, костном мозге, селезенке; немного – в плазме.
Гемосидерин – нерастворимый в воде белок, производное ферритина, еще больше содержит 3-х валентного железа (около 30%).
3) Белок, содержащий транспортное Fe – трансферин, относится к b-глобулинам, синтезируется в печени и переносит Fe в нужное место. Трансферин на 1/3 связан с железом и 2/3 в свободном состоянии. Сколько могут связать эти 2/3 и определяется как общая железосвязывающая способность (ОЖСС).
% распределение Fe в организме человека:
— в составе эритроцитов и эритрокариоцитов костного мозга – 65%
— тканевое железо – 15%
— Fe запасов – 20%
— транспортное Fe – 0,1-0,2%
Суточная потребность: мужчины – 1 мг в сутки
женщины – 2-3мг в сутки
В сутки поступает 12-15 мг Fe, а всасывается 5-10% (0,75-1,5 мг).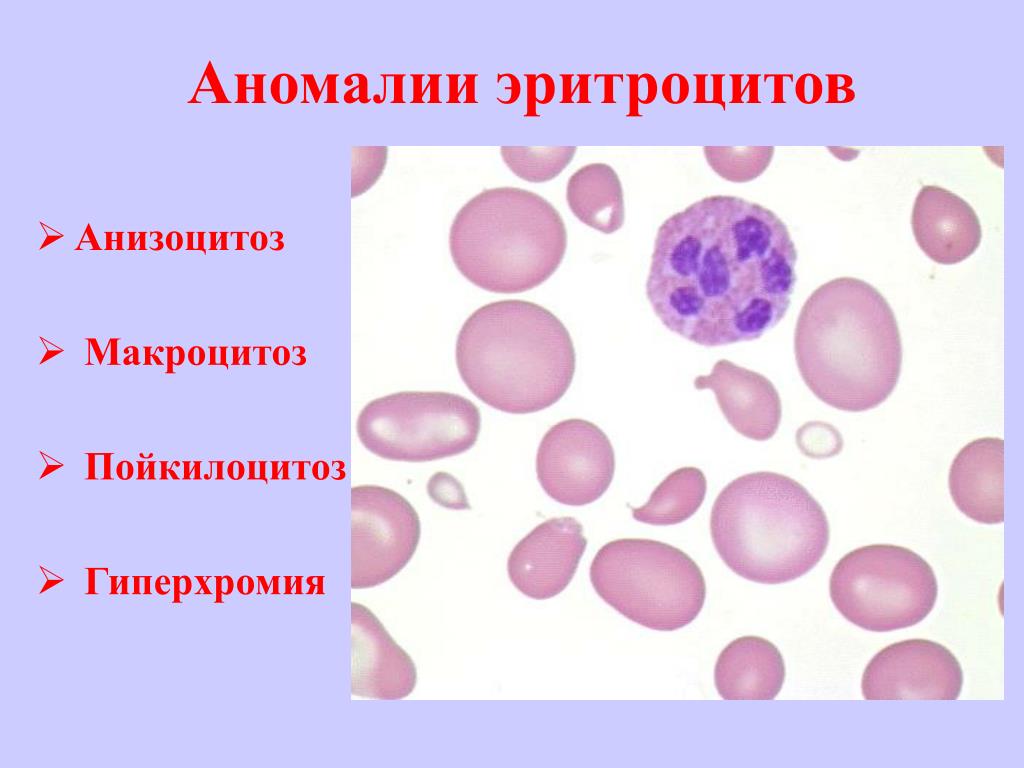 Через желудочно-кишечный тракт естественным путем может всосаться 2,5 мг Fe. Лучше всего усваивается Fe – гема, которым богаты мясные продукты: телятина, печень.
Через желудочно-кишечный тракт естественным путем может всосаться 2,5 мг Fe. Лучше всего усваивается Fe – гема, которым богаты мясные продукты: телятина, печень.
Причины железодефицитных анемий (общие):
— потери железа больше, чем в норме
— недостаточное поступление железа
— повышенный расход железа
1) потери Fe – кровопотери, небольшие по объему, но постоянные и длительные. Чаще всего страдают женщины (менструации, роды, аборты, лактация). Потеря 2 мл крови » 1 мг Fe. Женщина за менструацию не должна терять больше 60 мл крови – считают гематологи. Гинекологи считают, что женщина может терять 100- 200 мг. При больших кровопотерях у женщин потребность железа до 3 мг в сутки. 30-40% женщин репродуктивного возраста имеют ЖДА, а каждая 2-я – латентный период дефицита железа. Во время беременности – суточная потребность железа до 3,5 мг.
У мужчин кровопотери в основном из ЖКТ (эррозии, дивертикулы, грыжи, язвы, геморрой).
Железодефицитные анемии возникают при хронических носовых, десневых кровотечениях, при гематурии.
Ятрогенные потери железа:
1) донорство ( у мужчин доноров потребность Fe – 3-3,8 мг/сут, у женщин – 3,7-5,3 мг/сут). После каждой сдачи крови рекомендуется 2 недели принимать препараты железа.
2) экстракорпоральные очищения крови (гемодиализ и др.)
Потери в замкнутой полости:
1) эндометриоз, не связанный с полостью матки ( в толще стенки матки и других органов формируются полости; в эти полости при менструации выбрасыватся кровь, кровь всасывается, а Fe превращается в гемосидерин (не растворимый в воде), который не всасывается.
2) в кистах (такой же механизм)
3) изолированный легочный сидероз (формирование полостей; происходит так же, как при эндометриозе).
У детей первого года жизни, младшего возраста,подростков наблюдается дефицит железа (связано с недостаточным исходным уровнем Fe).
Если не удается найти источника потери Fe, железодефицитная анемия называется эссенциальной или идиопатической (но до тех пор, пока не обнаружится источник кровопотери).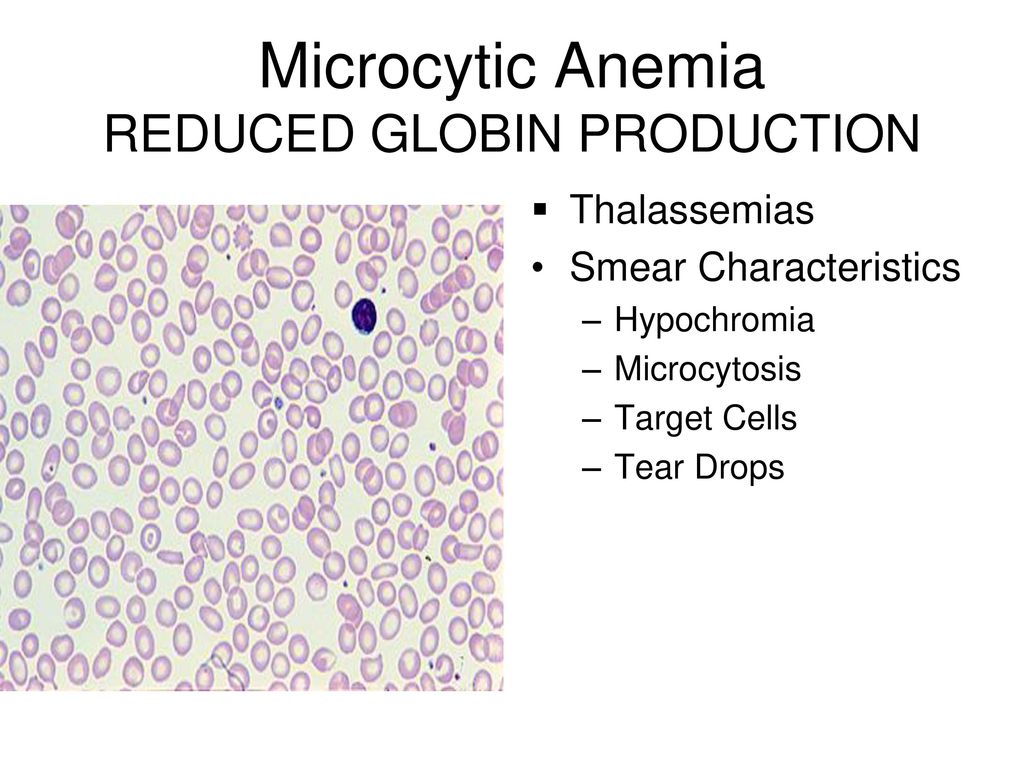
Линические проявления ЖДА.
* симптомы гипоксии (бледность без признаков эктерии, слабость, головокружения, сердцебиение, одышка, обмороки)
*симптомы сидеропении:
— секутся и выпадают волосы
— ногти становятся ломкими, изменения формы ногтей (выпуклость может смениться уплощением и даже вогнутостью)
— появляются трещины в углах губ (заеды)
— глоссит, атрофия сосочков языка
— извращения вкуса и запаха (больным нравится мел, зубной порошок, запах бензина, выхлопных газов, ацетона и др.)
— мышечная слабость (при кашле, чихе непроизвольное мочеиспускание; у девочек ночное недержание мочи).
Лабораторные проявления ЖДА.
— снижение гемоглобина
— низкий цветовой показатель
— эритроциты в норме или близко к норме
— снижение содержания гемоглобина в одном эритроците МСН
— снижение концентрации гемоглобина в эритроците МСНС
— гипохромия, анизоцитоз ( в сторону микроцитоза), в тяжелых случаях –пойкилоцитоз
— может быть ретикулоцитоз
— снижено сывороточное железо
— ОЖСС повышена
— содержание ферритина понижено.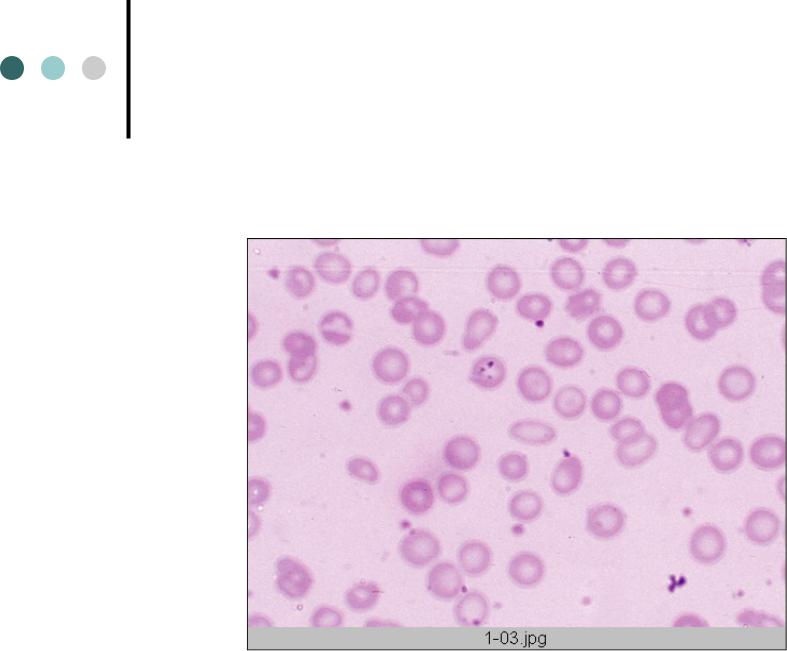
Ломанова Л.В.
Практические подходы к диагностике и лечению железодефицитной анемии :: ТРУДНЫЙ ПАЦИЕНТ
О.А. Низовцева
ГУ МЦ Биомедицинских технологий РАМН, Москва
Железодефицитная анемия (ЖДА) – это гипохромная микроцитарная анемия, возникающая вследствие снижения содержания железа в организме. Распространённость дефицита железа среди населения зависит от пола, возраста, экономического благосостояния населения, особенностей питания и распространённости заболеваний, сопровождающихся потерей железа [1].
По данным ВОЗ, во всем мире ЖДА страдает свыше 700 млн человек [2]. ЖДА наблюдается у 10-30 % взрослого населения и является наиболее распространённой формой анемий (80-95 %). У женщин ЖДА возникает значительно чаще, чем у мужчин. По разным оценкам, до 20 % женщин страдают ЖДА. Часто отмечается развитие анемии у грудных детей, находящихся на искусственном вскармливании. Частота анемий у беременных колеблется от 15 до 56 % в зависимости от места жительства и социально-экономического положения [3].
Железо участвует в функционировании всех биологических систем. Суточная потребность в железе составляет для мужчин 10 мг, для женщин 18 мг (в период беременности – 38 мг, лактации – 33 мг) [4]. Общее количество железа в организме составляет 4-4,5 г. Железо является обязательным и незаменимым компонентом различных белков и ферментативных систем, обеспечивающих необходимый уровень системного и клеточного аэробного метаболизма, а также окислительно-восстановительного гомеостаза в организме в целом. Железо играет важную роль в поддержании высокого уровня иммунной резистентности, адекватное его содержание в организме способствует полноценному функционированию факторов неспецифической защиты, клеточного и местного иммунитета [4, 5]. Нормальное содержание железа необходимо для полноценного фагоцитоза, высокой активности естественных киллеров и бактерицидной способности сыворотки, а также синтеза лизоцима, интерферона.

Мужчины при полноценном питании ежедневно получают примерно 15-20 мг железа, а женщины только 10-15 мг. Мужчинам для возмещения потерь железа со слущивающимся эпителием кожи и слизистых достаточно, чтобы всосалось всего 1-2 мг железа. У женщин детородного возраста из-за потерь железа при менструациях потребности в нём гораздо больше. Потребности в железе повышены также у активных доноров. У детей и подростков из-за повышенных потребностей растущего организма и недостаточного поступления железа с пищей баланс железа нередко нарушается. Тоже относится и к беременным. Во II и III триместрах суточная потребность в железе достигает 5-6 мг, и обеспечить её можно только за счёт увеличения содержания в пище железа гема или с помощью препаратов железа [7].
 Железо в составе гема всасывается намного лучше. Люди, употребляющие в пищу мясо, получают больше железа гема (в составе миоглобина), чем вегетарианцы. У строгих вегетарианцев со временем может развиться дефицит железа, поскольку овощи и злаки содержат вещества, препятствующие всасыванию железа, в частности фосфаты [1, 5]. Из желудочно-кишечного тракта (ЖКТ) железо абсорбируется только в двухвалентном состоянии, перевод в которое обеспечивается органическими кислотами, в частности аскорбиновой. Основная доля абсорбированного железа в составе транспортного белка – трансферрина переносится к костному мозгу, где оно используется для синтеза гемсодержащих соединений (гемоглобина, миоглобина, ферментов), негемовых ферментов (например, НАДН-дегидрогеназы), металлопротеидов. В тканях железо депонируется в форме ферритина и гемосидерина, с преимущественным отложением в печени, селезёнке и мышцах.
Железо в составе гема всасывается намного лучше. Люди, употребляющие в пищу мясо, получают больше железа гема (в составе миоглобина), чем вегетарианцы. У строгих вегетарианцев со временем может развиться дефицит железа, поскольку овощи и злаки содержат вещества, препятствующие всасыванию железа, в частности фосфаты [1, 5]. Из желудочно-кишечного тракта (ЖКТ) железо абсорбируется только в двухвалентном состоянии, перевод в которое обеспечивается органическими кислотами, в частности аскорбиновой. Основная доля абсорбированного железа в составе транспортного белка – трансферрина переносится к костному мозгу, где оно используется для синтеза гемсодержащих соединений (гемоглобина, миоглобина, ферментов), негемовых ферментов (например, НАДН-дегидрогеназы), металлопротеидов. В тканях железо депонируется в форме ферритина и гемосидерина, с преимущественным отложением в печени, селезёнке и мышцах.Дефицит железа в организме развивается, когда потери его превышают 2 мг/сутки [12, 13]. Причиной дефицита железа является нарушение баланса его в сторону преобладания расходования железа над поступлением, наблюдаемое при различных физиологических состояниях или заболеваниях:
• Снижение поступления железа в организм вследствие общего голодания, значительного уменьшения в рационе продуктов питания, содержащих железо, нарушения всасывания железа в ЖКТ (хронические гастриты, энтериты, резекции желудка и особенно тонкой кишки).
• Увеличение потерь железа при хронических, повторных кровопотерях (желудочных, кишечных, маточных и др.).
• Возрастание расходования железа организмом при беременности и последующем вскармливании ребёнка.
В норме соотношение поступления железа с пищей и его потерь таково, что любое, даже очень небольшое снижение поступления или увеличение потерь железа может привести к его дефициту. Однако не всякий дефицит железа сопровождается анемией – выделяют также прелатентный и латентный дефициты железа [1, 5]. Прелатентный дефицит развивается, когда поступление железа с пищей не соответствует физиологическим потребностям (рост организма, менструации, беременность), но недостаточное поступление железа покрывается за счёт запасов железа. При этом запасы железа истощаются. Латентный дефицит – это следующая стадия, на которой снижается поступление железа к клеткам эритроидного ростка и ограничивается продукция эритроцитов. Железодефицитная анемия с гипохромией и микроцитозом развивается в исходе длительного отрицательного баланса железа, когда снижается синтез гемоглобина.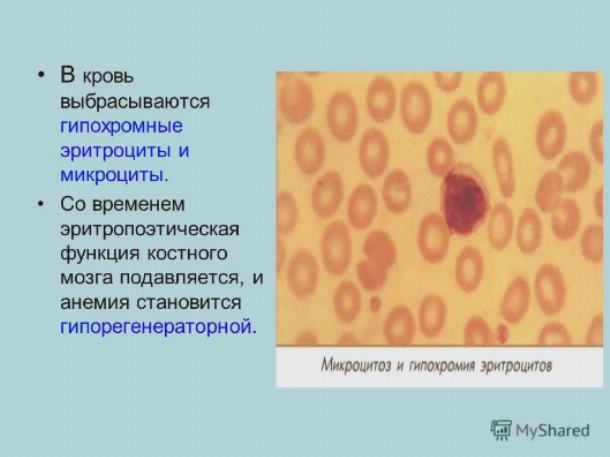
При выраженном дефиците железа симптомы отражают, прежде всего, тяжесть анемии и включают утомляемость, бледность и снижение переносимости физической нагрузки, так называемый общеанемический синдром [10]. В рамках сидеропенического синдрома может отмечаться мышечная слабость, не соответствующая степени анемии и обусловленная снижением уровня железосодержащих ферментов мышц. С недостатком ферментов, содержащих железо, связаны трофические расстройства: выпадение волос, ломкость ногтей, сухость кожи, трещины в углах рта, извращение вкуса. При длительном глубоком дефиците железа могут появиться глоссит, дисфагия, койлонихия (ложкообразные ногти), нарушение желудочной секреции, недержание мочи при смехе, кашле. Однако чувствительность и специфичность этих симптомов невелика; дефицит железа диагностируют в основном лабораторными методами [9].
В лабораторной диагностике ЖДА основное практическое значение имеют три показателя: сывороточные концентрации железа, ферритина и общая железосвязывающая способность сыворотки (ОЖСС) [8, 12]. Сывороточная концентрация железа отражает содержание железа, связанного с трансферином – важный лабораторный показатель, на основании которого возможно проведение дифференциальной диагностики анемий и определение тактики лечения. Так, если при анемии отмечается снижение уровня сывороточного железа наряду со снижением ферритина сыворотки, это свидетельствует о железодефицитной этиологии анемии. В другом случае сниженный уровень сывороточного железа сочетается с нормальным уровнем ферритина. Это встречается при железоперераспределительных анемиях, при которых развитие гипохромной анемии связано с нарушением процесса высвобождения железа из депо. ОЖСС – это общее количество железа, которое может связаться с трансферрином. В норме сывороточная концентрация железа составляет 9-27 мкмоль/л (50-150 мкг%), а ОЖСС – 54-64 мкмоль/л (300-360 мкг%). При определении ОЖСС в исследуемую сыворотку добавляют определённое количество железа. Часть добавленного железа связывается в сыворотке с белками-переносчиками, а железо, которое не связалось с белками, удаляют из сыворотки и определяют его количество.
Сывороточная концентрация железа отражает содержание железа, связанного с трансферином – важный лабораторный показатель, на основании которого возможно проведение дифференциальной диагностики анемий и определение тактики лечения. Так, если при анемии отмечается снижение уровня сывороточного железа наряду со снижением ферритина сыворотки, это свидетельствует о железодефицитной этиологии анемии. В другом случае сниженный уровень сывороточного железа сочетается с нормальным уровнем ферритина. Это встречается при железоперераспределительных анемиях, при которых развитие гипохромной анемии связано с нарушением процесса высвобождения железа из депо. ОЖСС – это общее количество железа, которое может связаться с трансферрином. В норме сывороточная концентрация железа составляет 9-27 мкмоль/л (50-150 мкг%), а ОЖСС – 54-64 мкмоль/л (300-360 мкг%). При определении ОЖСС в исследуемую сыворотку добавляют определённое количество железа. Часть добавленного железа связывается в сыворотке с белками-переносчиками, а железо, которое не связалось с белками, удаляют из сыворотки и определяют его количество. При железодефицитных анемиях сыворотка пациента связывает больше железа, чем в норме – регистрируется увеличение ОЖСС.
При железодефицитных анемиях сыворотка пациента связывает больше железа, чем в норме – регистрируется увеличение ОЖСС.
Обычно рассчитывают также насыщение трансферрина (процентное соотношение связанного с трансферрином железа к ОЖСС). Основным белком-переносчиком железа в сыворотке крови является трансферрин. Одна молекула трансферрина может связать два атома железа. В норме этот показатель колеблется от 30 до 50 %, при дефиците железа падает ниже 20 %, а клинически значимая перегрузка железом наступает при насыщении трансферрина свыше 50-60 %. Сывороточная концентрация ферритина находится в равновесии с содержанием ферритина в тканях и отражает величину запасов железа в организме. Нормальные значения сывороточной концентрации ферритина различаются в зависимости от возраста и пола. Для мужчин они составляют 50-150 мкг/л, а для женщин – 15-50 мкг/л. Уровень ферритина ниже 15 мкг/л указывает на истощение запасов ферритина [7, 12].
Для каждой из трёх стадий – прелатентного дефицита железа, латентного дефицита железа и ЖДА – характерны определённые изменения показателей обмена железа [4]. Прелатентный дефицит запасов железа в организме диагностируется на основании сывороточной концентрации ферритина и окраски костного мозга на железо. Пока же запасы железа полностью не истощены, его сывороточная концентрация, ОЖСС остаются в пределах нормы. На этой стадии нет анемии, а морфология эритроцитов не изменена.
Прелатентный дефицит запасов железа в организме диагностируется на основании сывороточной концентрации ферритина и окраски костного мозга на железо. Пока же запасы железа полностью не истощены, его сывороточная концентрация, ОЖСС остаются в пределах нормы. На этой стадии нет анемии, а морфология эритроцитов не изменена.
Если не происходит адекватного восполнения дефицита железа на первой стадии, наступает вторая стадия железодефицитного состояния – латентный дефицит железа. На стадии латентного дефицита железа в организме более выражены изменения в лабораторных показателях. Регистрируются не только истощение запасов железа в депо – снижение концентрации ферритина сыворотки, но и снижение содержания железа в сыворотке и белках-переносчиках. Эти нарушения по-прежнему не отражаются на морфологии эритроцитов, но снижают регенераторную способность костного мозга, что приводит к лёгкой нормоцитарной нормохромной анемии с концентрацией гемоглобина 100-120 г/л.
При развитии ЖДА в биохимическом анализе крови будут регистрироваться: уменьшение концентрации сывороточного ферритина; уменьшение концентрации сывороточного железа; повышение ОЖСС; уменьшение насыщения трансферрина железом.
В общем анализе крови при ЖДА обычно выявляют гипохромную микроцитарную анемию, анизоцитоз, пойкилоцитоз. Среднее содержание гемоглобина в одном эритроците (MCН – Mean Corpuscular Hemoglobin) и средняя концентрация гемоглобина в эритроците (MCНC – Mean Corpuscular Hemoglobin Concentration) снижаются при наличии ЖДА.
Основными гипохромными анемиями, с которыми следует проводить дифференциальный диагноз ЖДА, являются талассемии и сидеробластная анемия [11]. Талассемии носят семейный характер и сопровождаются признаками усиленного гемолиза: увеличение размеров селезёнки, ретикулоцитоз, повышение уровня непрямого билирубина. Количество эритроцитов при талассемиях нормально или повышено. Анемия, резистентная к терапии препаратами железа, признаки усиленного гемолиза с характерной морфологией эрироцитов (гипохромия, мишеневидность) – признаки талассемий. Сидеробластная анемия – гипохромная микроцитарная анемия, возникающая вследствие нарушения утилизации внутриклеточного железа для синтеза гемоглобина на фоне нормального или повышенного содержания железа в митохондриях эритробластов. Как следствие этого, в костном мозге увеличивается количество нормобластов с характерным кольцевидным расположением гранул железа вокруг ядра при специальной окраске на железо. В клинической картине имеет место анемия, гемолиз, гемосидероз органов, повышенная концентрация железа и ферритина в сыворотке крови. Лечение препаратами железа в данном случае противопоказано.
Как следствие этого, в костном мозге увеличивается количество нормобластов с характерным кольцевидным расположением гранул железа вокруг ядра при специальной окраске на железо. В клинической картине имеет место анемия, гемолиз, гемосидероз органов, повышенная концентрация железа и ферритина в сыворотке крови. Лечение препаратами железа в данном случае противопоказано.
Важное значение в лечении ЖДА имеет место устранение причин её развития (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.) В большинстве случаев, радикальное устранение причины ЖДА не представляется возможным (например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных, а также при некоторых других ситуациях). Основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами [6, 15].
Препараты железа (ПЖ) подразделяются на следующие группы: для перорального и парентерального применения, высоко- и низкодозированные, односоставные и комбинированные. Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией. Терапия железодефицитных состояний проводится преимущественно препаратами железа для перорального приёма. Парентеральное введение препаратов железа показано лишь по специальным показаниям: синдром нарушенного кишечного всасывания, состояние после обширной резекции верхних отделов тонкой кишки. Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки [16, 17]. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения ЖКТ. Лечение препаратами железа должно быть длительным. Содержание гемоглобина повышается только к концу третьей недели терапии железодефицитной анемии. Нормализация показателей красной крови имеет место через 5-8 недель лечения. При выборе лекарственного ПЖ следует ориентироваться не только на содержание в нём общего количества, но, главным образом, на количество двухвалентного железа, так как только оно всасывается в кишечнике.
Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией. Терапия железодефицитных состояний проводится преимущественно препаратами железа для перорального приёма. Парентеральное введение препаратов железа показано лишь по специальным показаниям: синдром нарушенного кишечного всасывания, состояние после обширной резекции верхних отделов тонкой кишки. Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки [16, 17]. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения ЖКТ. Лечение препаратами железа должно быть длительным. Содержание гемоглобина повышается только к концу третьей недели терапии железодефицитной анемии. Нормализация показателей красной крови имеет место через 5-8 недель лечения. При выборе лекарственного ПЖ следует ориентироваться не только на содержание в нём общего количества, но, главным образом, на количество двухвалентного железа, так как только оно всасывается в кишечнике.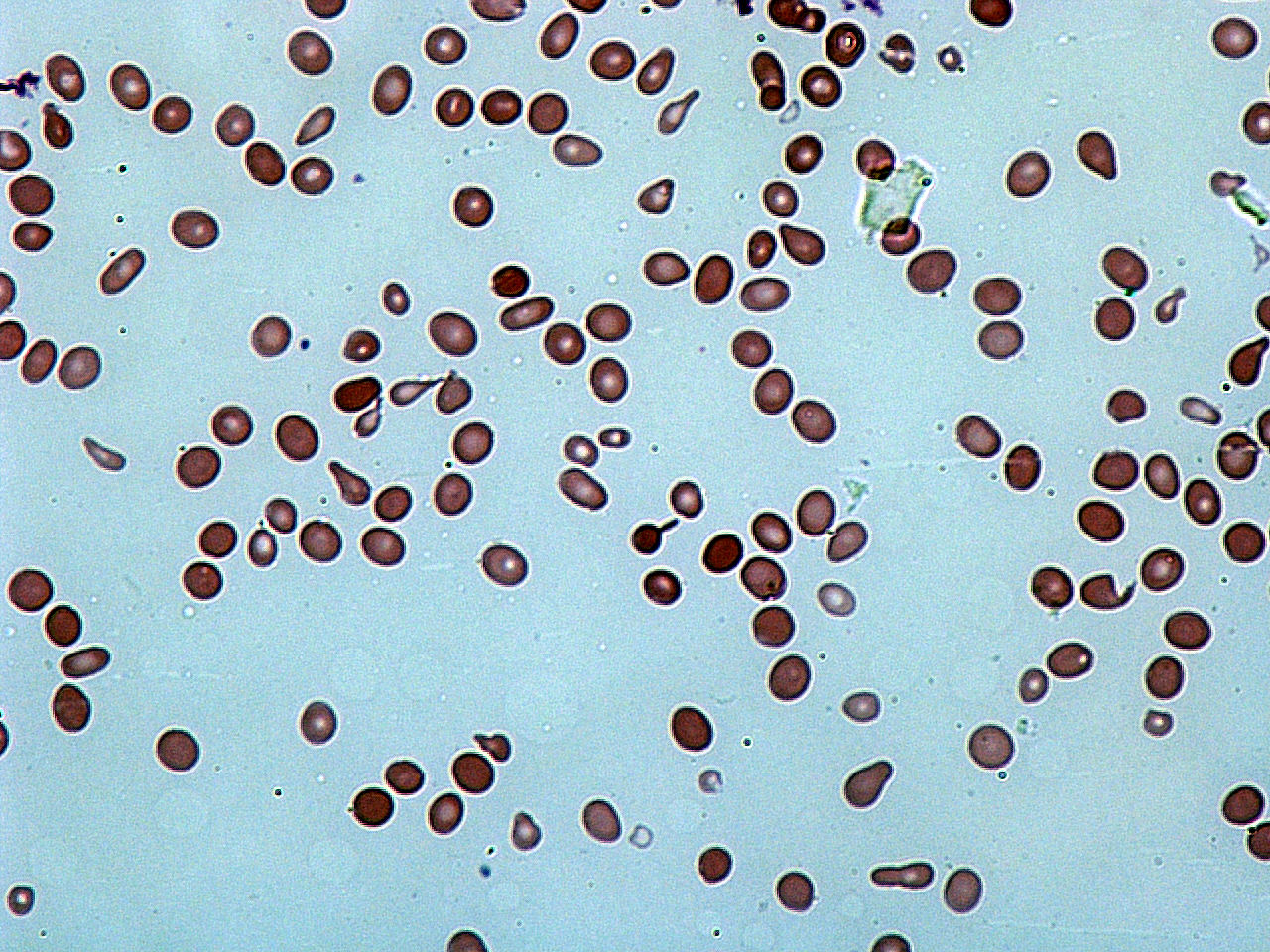
При выборе препаратов железа необходимо учитывать и их состав [6, 8]. Присутствие витамина С (аскорбиновая кислота) улучшает всасываемость ионов железа в кишечнике, предотвращая переход из двухвалентной формы в трёхвалентную, а также ускоряет транспортировку железа и его включение в гем. Витамин В12 необходим для образования гемоглобина, эритроцитов, метаболизма белков, жиров, углеводов, производства энергии. Фолиевая кислота – важнейший фактор в предотвращении аномалий развития плода, который требуется для синтеза ДНК и РНК, метаболизма белков и образования красных кровяных клеток. Поэтому, чаще всего, самым оптимальным выбором в лечении и профилактике железодефицитной анемии являются препараты, содержащие все эти компоненты [19].
Одним из таких лекарственных средств является Ферро-Фольгамма®. В одной капсуле препарата содержится уникальная комбинация необходимых веществ, включающая 100 мг сульфата безводного железа (соответствует 37 мг железа), 5 мг фолиевой кислоты, 10 мкг цианокобаламина, 100 мг аскорбиновой кислоты. Активные компоненты препарата Ферро-Фольгамма® находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание, главным образом, в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата со стороны ЖКТ. Скорость всасывания лекарственных субстанций не зависит от pН и двигательной активности желудочно-кишечного тракта и позволяет поддерживать стабильную концентрацию в крови железа и витаминов, предотвращает опасность передозировки. Препарат не содержит искусственных красителей, жира и дрожжей, особо показан вегетарианцам, поскольку витамин В12 полностью отсутствует в растительной пище. Он, несомненно, может быть признан препаратом выбора для лечения и профилактики ЖДА, при беременности и кормлении грудью, обильных менструациях, неполноценном питании, алкоголизме, нарушениях всасывания, длительном приёме противосудорожных и контрацептивных препаратов, гемодиализе, острых и хронических кровопотерях, состояниях после оперативных вмешательств [10].
Активные компоненты препарата Ферро-Фольгамма® находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание, главным образом, в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата со стороны ЖКТ. Скорость всасывания лекарственных субстанций не зависит от pН и двигательной активности желудочно-кишечного тракта и позволяет поддерживать стабильную концентрацию в крови железа и витаминов, предотвращает опасность передозировки. Препарат не содержит искусственных красителей, жира и дрожжей, особо показан вегетарианцам, поскольку витамин В12 полностью отсутствует в растительной пище. Он, несомненно, может быть признан препаратом выбора для лечения и профилактики ЖДА, при беременности и кормлении грудью, обильных менструациях, неполноценном питании, алкоголизме, нарушениях всасывания, длительном приёме противосудорожных и контрацептивных препаратов, гемодиализе, острых и хронических кровопотерях, состояниях после оперативных вмешательств [10].
Хороший клинический эффект препарата подтверждён данными многих исследований. В открытом контролируемом исследовании было проведено сравнение эффективности и переносимости препарата Ферро-Фольгамма® и ряда других железосодержащих препаратов (В.В. Городецкий и др., 2004). Было показано, что препарат действительно хорошо переносится пациентами (отсутствовали диспепсические явления или другие жалобы), и по этой характеристике он входит в группу препаратов с наименьшей частотой побочных эффектов. На фоне проводимой терапии быстро купировались субъективные и объективные клинические признаки железодефицитной анемии: общая слабость, головокружение, одышка при физической нагрузке, бледность слизистых оболочек, тахикардия. При этом клиническое улучшение предшествовало нормализации показателей красной крови.
Использование современных методов диагностики, профилактики и лечения ЖДА с применением имеющихся различных форм препаратов железа имеет важное значение в решении проблемы железодефицитных состояний. Лечение железодефицитных анемий необходимо начинать сразу после верификации диагноза и установления причин дефицита железа. В соответствие с рекомендациями ВОЗ показано использовать пероральные препараты (их отличает удобство применения, лучшая переносимость), препараты двухвалентного железа с лучшей абсорбцией, сульфат железа (лучшая абсорбция, эффективность) и препараты с замедленным выделением железа (лучшая абсорбция и переносимость). Суточная доза для профилактики анемии и лечения лёгкой формы заболевания – 50-60 мг Fe2+, а для лечения выраженной анемии – 100-120 мг Fe2+. Желательным требованием к железосодержащим препаратам, является наличие дополнительных компонентов, таких как аскорбиновая и фолиевая кислоты, цианокобаламин. С учётом данных рекомендаций в ряде случаев оптимальным является использование в лечении железодефицитных состояний препарата Ферро-Фольгамма®.
Лечение железодефицитных анемий необходимо начинать сразу после верификации диагноза и установления причин дефицита железа. В соответствие с рекомендациями ВОЗ показано использовать пероральные препараты (их отличает удобство применения, лучшая переносимость), препараты двухвалентного железа с лучшей абсорбцией, сульфат железа (лучшая абсорбция, эффективность) и препараты с замедленным выделением железа (лучшая абсорбция и переносимость). Суточная доза для профилактики анемии и лечения лёгкой формы заболевания – 50-60 мг Fe2+, а для лечения выраженной анемии – 100-120 мг Fe2+. Желательным требованием к железосодержащим препаратам, является наличие дополнительных компонентов, таких как аскорбиновая и фолиевая кислоты, цианокобаламин. С учётом данных рекомендаций в ряде случаев оптимальным является использование в лечении железодефицитных состояний препарата Ферро-Фольгамма®.
Литература
1. Хиллман Р. Железодефицитная и другие гипорегенераторные анемии // Внутренние болезни по Тинсли Р. Харриссону. 2005; 2: 770.
Харриссону. 2005; 2: 770.
2. ВОЗ. Официальный ежегодный отчёт. Женева. 2002.
3. Шехтман М.М. Железодефицитная анемия и беременность // Гинекол. 2000; 2: 6: 164-171.
4. Белошевский В.А, Минаков Э.В. Анемия при хронических заболеваниях. Издательство Воронежского университета. 1995; 34-37.
5. Волков B.C., Кириленко Н.П. Железодефицитные состояния // Кардиология, 1991; 6: 31: 64-67.
6. Дворецкий Л.И. Лечение железодефицитной анемии // Русский медицинский журнал. 2006; 6: 20: 1312-1316.
7. Казакова Л.М. Железодефицитная анемия у беременных // Мед. Помощь. 1993; 1: 157.
8. Городецкий В.В., Годулян О.В. Железодефицитные состояния и железодефицитная анемия: диагностика и лечение. 2005.
9. Гороховская Г.Н., Пономаренко О.П., Парфенова Е.С. Состояние сердечно-сосудистой системы при железодефицитных анемиях. // Кремлевская медицина, клинический вестник. 1998; 2: 34-37.
10. Серов В.Н., Шаповаленко С.А., Флакс Г.А. Диагностика и лечение железодефицитных состояний у женщин в различные периоды жизни // Атмосфера. Кардиология. 2008; 2: 17-20.
Кардиология. 2008; 2: 17-20.
11. Козловская Л.В. Гипохромные анемии: дифференциальный диагноз и лечение // Новый мед. журн. 1996; 56: 8-12.
12. Долгов В.В., Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная диагностика анемий. М.: 2001; 84.
13. Аркадьева Г.В. Диагностика и лечение железодефицитных анемий (учебно-методическое пособие). 1999; М.: 58.
14. Казюкова Т.В., Самсыгина Г.А., Калашникова Г.В. и др. Новые возможности ферротерапии железодефицитной анемии // Клиническая фармакология и терапия. 2000; 2: 88-91.
15. Bucala R. // J. Leukoc. Biol. 2004; 75: 3: 398.
16. Sibai B. et al. // Lancet. 2005; 365: 785.
17. Zimmermann R., Breymann C., Richter C. et al. RhEPO treatment of postpartum anemia // J. Perinat. Med. 1995; 23: 111-117.
18. Provan D. Mechanisms and management of iron deficiency anemia // Br J Haematol. 1999; 105: Suppl 1: 19-26.
19. Strai S.K.S., Bomford A., McArdle H.I. Iron transport across cell membranes:molecular uder-standing of duodenal and placental iron uptake // Best Practise & Research Clin Haem.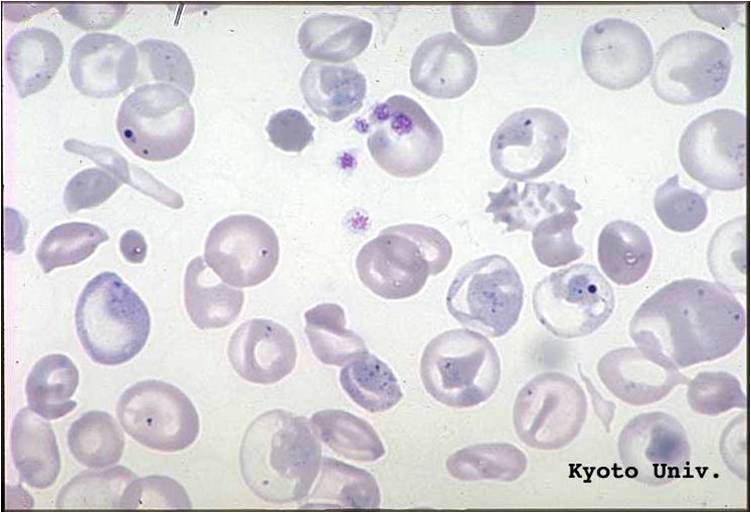 2002; 15: 2: 243-259.
2002; 15: 2: 243-259.
Общий анализ крови
Общий анализ крови — лабораторный анализ, позволяющий определить концентрацию гемоглобина, количество эритроцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), количество лейкоцитов и тромбоцитов, дополнительно количество ретикулоцитов. А также общий клинический анализ крови не является полным без микроскопии лейкоцитарной формулы и определения неспецифического показателя воспаления — скорости оседания эритроцитов (СОЭ).
Лейкоцитарная формула – это процентное соотношение различных видов лейкоцитов – бластов, промиелоцитов, миелоцитов, метамиелоцитов, палочкоядерных нейтрофилов, сегментоядерных нейтрофилов, эозинофилов, базофилов, моноцитов, лимфоцитов. Кроме этого врач при микроскопии окрашенного мазка крови описывает различные изменения клеток, например, изменения эритроцитов (анизоцитоз, пойкилоцитоз, микроцитоз, макроцитоз, гипохромия, гиперхромия и т.п.). Метод незаменим в диагностике гематологических заболеваний, так как позволяет обнаружить и описать бласты и юные клетки, заподозрить лейкоз.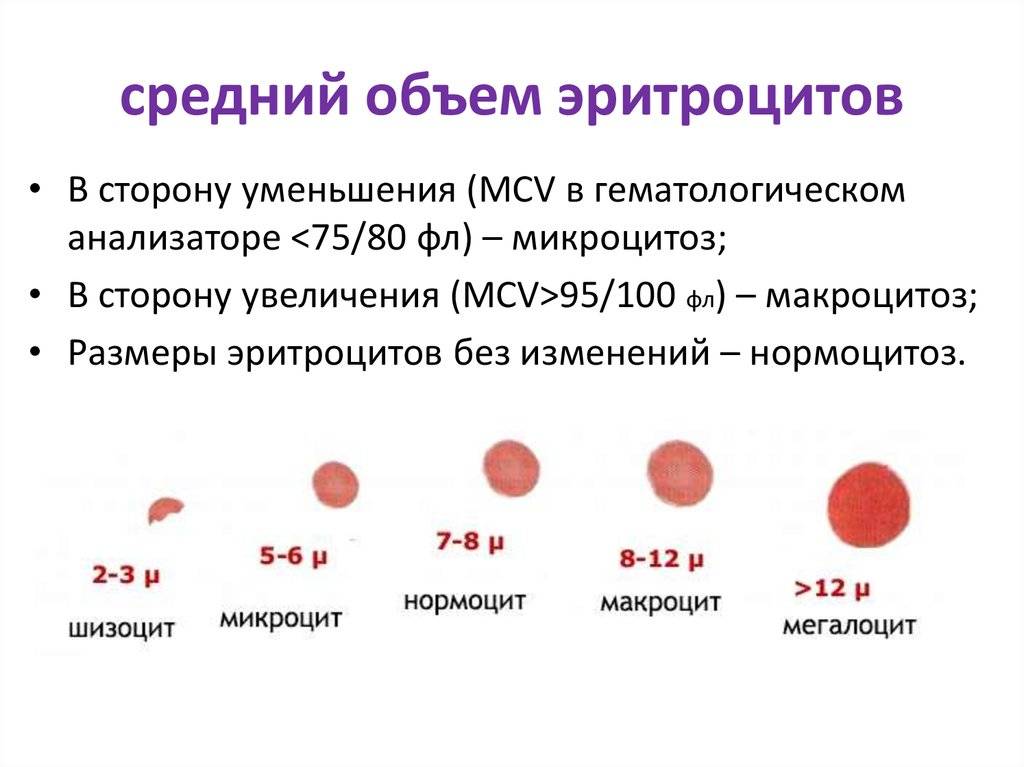
Бласты, промиелоциты, миелоциты, метамиелоциты в норме в периферической крови не обнаруживаются.
Подсчет лейкоцитарной формулы проводится не только в целях диагностики заболеваний крови, но и для выявления изменений, характерных для инфекционных, воспалительных заболеваний, а также используется для оценки тяжести состояния и эффективности проводимой терапии.
Ретикулоциты – юные формы эритроцитов, которые содержат зернистонитчатую субстанцию, выявляемую при помощи специальной окраски. Ретикулоциты образуются в костном мозге из нормобластов, где дозревают в течение 1 — 2 дней, после чего поступают в периферическую кровь. Время созревания ретикулоцитов до зрелых эритроцитов в периферической крови около 2-х дней. Число ретикулоцитов в крови отражает регенеративные свойства костного мозга и используется для дифференциальной диагностики вида анемии.
Целесообразно для оценки тяжести анемии использовать «ретикулоцитарный индекс»:
% ретикулоцитов х гематокрит больного / 45 х 1,85
(где: 45 — нормальный гематокрит, а 1,85 — количество суток необходимых для поступления новых ретикулоцитов в периферическую кровь).
- индекс < 2 — свидетельство гипопролиферативного компонента анемии;
- индекс > 2 — 3 — свидетельство увеличения образования эритроцитов.
Скорость оседания эритроцитов (СОЭ) – неспецифический показатель воспаления. При острых воспалительных и инфекционных процессах изменение скорости оседания эритроцитов отмечается через 24 часа после повышения температуры и увеличения числа лейкоцитов. При хроническом воспалении повышение СОЭ обусловлено увеличением концентрации фибриногена и иммуноглобулинов. Определение СОЭ в динамике, в комплексе с другими тестами, используют в контроле эффективности лечения воспалительных и инфекционных заболеваний.
Страница статьи : Клиническая лабораторная диагностика
Птушкин В.В. Анемия и дефицит железа у онкологических больных. Клиническая онкогематология. 2013; 6 (1): 91-6.
Снеговой А. В., Ларионова В.Б., Манзюк Л.В., Кононенко И.Б. Анемии в онкологии: возможности поддерживающей терапии. Клиническая онкогематология. 2016; 3(9): 326-35.
В., Ларионова В.Б., Манзюк Л.В., Кононенко И.Б. Анемии в онкологии: возможности поддерживающей терапии. Клиническая онкогематология. 2016; 3(9): 326-35.
Barrett-Lee P. J., LudwigH., Birgegard G., Bokemeyer C., Gascon P., Kosmidis P.A., Krzakowski M., Nortier J.W., Kongable G., Schneider M., Schrijvers D., VanBelle S.J. Independent risk factors for anemia in cancer patients receiving chemotherapy: results from the European Cancer Anemia Survey. Oncology.2006;70 (1): 34-4.
Pigeon C., Iigin G., Courselaud. A new mouse liverspecific protein homologous to human antibacterial peptid hepcidin is overexpressed during iron overload. Journal Biological Chemistry. 2001; 276: 7811-9.
Мазуренко Н.Н, Кущлинский Н.Е. Молекулярно-генетические маркеры немелкоклеточного рака легкого. Молекулярная медицина. 2014; 4: 4-13.
Pietrangelo A. Hepcidin in human iron disorders; therapeutic implication. J. hepatology. 2011; 54(1): 173-81.
J. hepatology. 2011; 54(1): 173-81.
Блиндарь В.Н., Зубрихина Г.Н, Матвеева И.И. Новая концепция диагностики анемии с нарушением метаболизма железа. Вестник РОНЦ им. Н.Н. Блохина. 2015-2016; 4-1 (26): 77-85.
Nemeth E., Rivera S., Gabajan V. IL6 mediates hypoferremia inducing the synthesis of the iron regulatory hormone hepcidin. Journal Clinical Investigation. 2004;113(9): 1271-6.
Алехнович, Л. И. Характеристика биохимических маркеров метаболизма костной ткани. Рецепт.2009; 2: 17-25.
Ibricevic-Balic L. Dilemma: Correlation Betwween Serum Level of Hepsidin and IL-6 Anemic Myeloma Patients. Med. Arch. 2016;70 (6): 429-32.
Kan Zhai, Yong Yang, Zhi-Gang Gao, Jie Ding. Interleukin-6-174G>C gene promoter polymorphism and prognosis in patients with cancer. Oncotarget. 2017; 8(27): 44490-7.
Brugnara C., Schiller B., Moran J. Reticulocyte hemoglobin equivalent (Ret-He) and assessment of iron-deficient states. Clin. Laboratory Hematology. 2006; 28(5): 303-8.
Зубрихина Г.Н., Блиндарь В.Н., МатвееваИ.И. Возможности современного автоматизированного клинического анализа крови в дифференциальной диагностике истинного и перераспределительного (функционального) дефицита железа при анемическом синдроме онкологических больных. Клиническая лабораторная диагностика. 2014; 5: 21-5.
Sasu B. J., Cooke K. S., Arvedson T. L., Plewa, C., Ellison A. R., Sheng J. Antihepcidin antibody treatment modulates iron metabolism and effective in a mouse model of inflammation-induced anemia. Blood. 2010; 115 (17): 3616-24.
Рукавицин О.А. Актуальные вопросы диагностики и лечения анемии при хронических заболеваниях. Онкогематология. 2012; 5(4): 296-304.
Nemeth E., Ganz T. Anemia of Inflammation. Hematol. Oncol.Clin.North Am. 2014 ; Aug; 28(4): 671-68.
Saroj Vadhan-Raj1, Rafat Abonour, Jonathan W. Goldman, David A. Smith, Christopher A. Slapak, Robert L., Ilaria Jr, Ramon V. Tiu, Xuejing Wang, Sophie Callies, Joanne Cox, Jay L. Tuttle, Yiu-Keung Lauand, Eric J. Roeland. A first-in-human phase 1 study of a hepcidin monoclonal antibody, LY2787106, in cancer-associated anemia. Journal of Hematology Oncology. 2017;10:73.
Сахин В.Т., Кремнева Н.В., Гордиенко А.В., Крюков Е.В., Рукавицын О.А. Эритроферрон: современные представления о значении в регуляции обмена железа. Клиническая онкогематология. 2017; 10 (1): 25-8.
Schrijvers D., de Samblanx H., Roila F. Erythropoiesis-stimulating agents the treatment of anemia in cancer patients: ESMO Clinical Practice for use. Annals Oncology. 2010; 21: 244-7.
Железодефицитная анемия как основное проявление грыжи пищеводного отверстия диафрагмы
В статье отражены проблемы диагностики и лечения железодефицитной анемии. Рассмотрен случай хронической постгеморрагической железодефицитной анемии у больного с грыжей пищеводного отверстия диафрагмы больших размеров.
Общие положения Железодефицитная анемия (ЖДА) – это гипохромная микроцитарная анемия, возникающая из-за снижения ресурсов железа в организме. ЖДА – одно из самых частых заболеваний всех возрастных групп [1, 2]. В организме взрослого человека содержится около 3–4 г железа. По данным Всемирной организации здравоохранения (ВОЗ), во всем мире около 1,8 млрд человек страдает ЖДА и 3,6 млрд – скрытым дефицитом железа [3]. ЖДА встречается у 10–15% взрослого населения России, среди женщин детородного возраста частота ЖДА достигает 30% [4]. Дефицит железа в организме приводит к нарушению синтеза гемоглобина и уменьшению его содержания в эритроцитах. Железо также входит в состав миоглобина, ферментов (каталаз, пероксидаз, цитохромов), отвечающих за транспорт кислорода к клеткам. Дефицит железа приводит к нарушениям окислительно-восстановительных реакций, функционирования иммунной и нервной систем [4]. Железодефицитная анемия развивается постепенно, после длительного периода латентного дефицита железа, который характеризуется уменьшением количества железа в депо (результаты анализа крови показывают сниженный уровень ферритина). Затем возникает дефицит транспортного железа (уменьшается процент насыщения трансферрина железом, возрастает железосвязывающая способность сыворотки крови). После истощения депо нарушается эритропоэз, увеличивается количество гипохромных эритроцитов и концентрация протопорфирина в эритроцитах. На всех этих этапах показатели периферической крови остаются в норме, что значительно усложняет диагностику железодефицита [5, 6]. Диагностика железодефицитной анемии основывается на клинической картине и результатах клинического анализа крови. Согласно рекомендациям ВОЗ критерием анемии является снижение концентрации гемоглобина для женщин менее 120 г/л, для мужчин – менее 130 г/л. По степени тяжести различают легкую анемию (гемоглобин крови выше 90 г/л), среднюю (70–89 г/л) и тяжелую (менее 70 г/л) [7]. Основные клинические симптомы анемии – слабость, повышенная утомляемость, головокружение, тахикардия. При латентном дефиците железа отмечается снижение иммунитета за счет уменьшения количества Т-лимфоцитов, нарушения синтеза интерлейкинов [5, 8]. Из-за нарушения структуры и функции эпителиальных тканей у больных отмечается ломкость и выпадение волос, ломкость ногтей, сухость кожи, ангулярный стоматит, атрофические изменения слизистой оболочки пищевода и желудка [1, 5]. Для ЖДА характерны извращения вкуса и запаха. При ЖДА развиваются выраженные метаболические нарушения – боли в мышцах при физической нагрузке, парестезии, гипотермия, вазомоторные расстройства. Общий анализ крови показывает снижение уровня гемоглобина, гематокрита, гипохромию, микроцитоз и анизоцитоз эритроцитов. Ферритин сыворотки считается важнейшим показателем для оценки запасов железа в организме. Его снижение свидетельствует о дефиците железа, даже если остальные показатели в норме. Низкие значения ферритина в сочетании со сниженными показателями эритроцитов или гемоглобина указывают на железодефицитный характер анемии [9]. Процент насыщения трансферрина железом позволяет оценить состояние транспортного пула железа. Общая железосвязывающая способность сыворотки (ОЖСС) – это потенциальная способность сыворотки крови к связыванию железа.Железодефицитная анемия – частый симптом многих гастроэнтерологических заболеваний.
Основными причинами возникновения анемии являются кровотечения из желудочно-кишечного тракта (ЖКТ), нарушения всасывания железа, его недостаточное поступление с пищей [2, 7]. Хроническая постгеморрагическая ЖДА развивается вследствие длительных оккультных (скрытых) кровопотерь [1]. Основная задача врачей – найти причину развития анемии. Сделать это достаточно сложно, необходимо провести множество исследований. Источниками кровопотери, особенно у лиц пожилого возраста, часто бывают кровоточащие злокачественные и доброкачественные опухоли. Другими причинами постгеморрагической ЖДА могут быть грыжа пищеводного отверстия диафрагмы, дивертикулы, варикозное расширение вен пищевода, эрозивно-язвенные поражения (язвенная болезнь желудка и двенадцатиперстной кишки, болезнь Крона, язвенный колит), сосудистые мальформации, геморрой [1, 10]. Как показали результаты проведенных в последние годы исследований, у 2,2–15,9% больных ЖДА диагностируется целиакия. Характерные при целиакии повреждения слизистой оболочки начальных отделов тонкой кишки приводят к нарушению всасывания железа [11]. Клинический случай Больной А. 78 лет обратился в клинику с жалобами на выраженную слабость, головокружение в течение последних 2–3 лет. При обследовании в общем анализе крови отмечено снижение гемоглобина до 58 г/л. При осмотре обращала на себя внимание бледность кожных покровов и слизистых оболочек. С учетом того что наиболее частыми причинами развития ЖДА в пожилом и старческом возрасте являются кровотечения из ЖКТ и онкологические заболевания, больной прошел соответствующее обследование. В общем анализе крови отмечено снижение уровня гемоглобина до 62 г/л, эритроцитов до 3,98 × 106/мм3 (4,3–5,7), гематокрита до 21,8 (35,0–50,0), имелись гипохромия, микроцитоз, анизоцитоз. Биохимический анализ крови показал снижение концентрации сывороточного железа до 1,0 мкмоль/л (12,5–32,2), уровень ферритина – 120 мкг/л (20–300), трансферрина – 480 мг/дл (200–360), латентная железосвязывающая способность сыворотки – 78 мкмоль/л (2,8–53,7), ОЖСС – 75 мкмоль/л (44,8–71,6). Онкомаркеры РЭА (раково-эмбриональный антиген), СА 19-9, СА 242, ПСА, альфа-фетопротеин в пределах референсных значений. Анализ кала: реакция на скрытую кровь отрицательная. При эзофагогастродуоденоскопии выявлена большая грыжа пищеводного отверстия диафрагмы (желудок вплоть до антрального отдела расположен выше диафрагмы, на слизистой оболочке имеются эрозии до 0,5 см). Взята биопсия из залуковичного отдела двенадцатиперстной кишки для исключения целиакии. По результатам морфологического исследования отмечен хронический слабо выраженный неактивный бульбит и дуоденит. При УЗИ органов брюшной полости обнаружены признаки хронического холецистита. По данным колоноскопии патологии не выявлено. По данным рентгенологического исследования пищевода, желудка, тонкой кишки дистальный отдел пищевода огибает грыжевое выпячивание, в состав которого входит большая часть желудка (кардия, тело желудка и антральный отдел), при этом свод желудка расположен поддиафрагмально. При КТ органов брюшной полости, грудной клетки выявлена грыжа пищеводного отверстия диафрагмы (ГПОД) больших размеров.По данным УЗИ мочевого пузыря, предстательной и щитовидной желез патологии не выявлено.
Для исключения наличия источника кровопотери в тонкой кишке проведена капсульная эндоскопия. Признаков продолжающегося и состоявшегося кровотечения нет. На основании полученных результатов можно сделать вывод, что причиной ЖДА у больного является ГПОД с пролабированием желудка в грудную полость, сопровождающимся многолетними оккультными кровотечениями. От предложенного хирургического лечения ГПОД больной пока отказался. Пациенту назначены препараты железа (Ферро-Фольгамма по 1 таблетке 3 раза в день). На фоне приема препарата уже к концу недели отмечалась положительная динамика в виде уменьшения слабости, увеличения толерантности к физической нагрузке. Через 10 дней уровень гемоглобина возрос до 80 г/л. Терапия железодефицитной анемии Терапия ЖДА должна быть направлена на устранение причины развития анемии и восполнение содержания железа в организме. Пациентам рекомендуется соблюдать диету с высоким содержанием железа (мясо, говяжья печень, гречневая крупа, яблоки, гранат и др.) и одновременно принимать аскорбиновую кислоту для улучшения всасывания железа в тонкой кишке. Кроме того, аскорбиновая кислота способствует частичной ионизации пищевого железа Fe3+ и образованию ионов Fe2+. Однако следует помнить, что возместить дефицит железа с помощью одной диетотерапии невозможно. Необходим длительный прием препаратов железа не только до нормализации уровня гемоглобина в крови, но и до пополнения депо железа. Предпочтение следует отдавать пероральным препаратам железа ввиду длительности их приема. Наиболее эффективными являются ионные препараты, содержащие соли двухвалентного железа (Fe2+), в частности сульфат железа (II). Они обладают хорошей растворимостью и высокой способностью к диссоциации, легко проникают в кровь путем пассивной диффузии. Парентеральное введение железа более эффективно, но чаще сопровождается выраженными побочными действиями. Такое введение целесообразно только при нарушении всасывания железа в кишечнике, отсутствии эффекта от перорального приема, наличии противопоказаний к пероральному приему [5, 8]. В последнее время было убедительно показано, что повышение эффективности лечения ЖДА пероральными железосодержащими препаратами может быть достигнуто путем включения в их состав дополнительных компонентов, существенно облегчающих всасывание Fe2+ в тонкой кишке и способствующих его быстрому включению в процесс костномозгового кроветворения [9]. Ферро-Фольгамма: эффективность и безопасность Ферро-Фольгамма – комбинированный антианемический препарат, содержащий двухвалентное железо в виде простой соли сульфата железа, витамин В12, фолиевую и аскорбиновую кислоту. Аскорбиновая кислота улучшает всасывание железа в тонкой кишке. Витамин В12 и фолиевая кислота участвуют в образовании и созревании эритроцитов. Активные компоненты препарата находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание главным образом в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата. Ферро-Фольгамма назначается по 1–2 капсулы 3 раза в день после еды. Длительность приема зависит от степени тяжести ЖДА. Высокая эффективность и безопасность применения препарата Ферро-Фольгамма у больных ЖДА подтверждена результатами многочисленных клинических исследований. Авторы, изучавшие эффективность длительного лечения Ферро-Фольгаммой больных ЖДА, отмечают исключительно хорошую переносимость препарата и крайне редкое развитие нежелательных побочных эффектов [9].Эффективность терапии ЖДА зависит не только от устранения причин, вызвавших анемию, но и от правильного выбора эффективного комбинированного железосодержащего препарата.
Алгоритм верификации характера анемии на основе корректной трактовки показателей клинического анализа крови | Заплатников А.Л., Кузнецова О.А., Воробъева А.С., Радченко Е.Р., Свинцицкая В.И., Гавеля Н.В., Бражникова О.В., Ивахненко Ю.И.
Представлен алгоритм верификации характера анемии на основе трактовки показателей клинического анализа крови
Введение
Анемия – одно из наиболее частых патологических состояний органов кроветворения у детей [1–3]. Основным лабораторным критерием анемии является концентрация гемоглобина ниже нормы. В связи с этим необходимо напомнить, что нормативные значения гемоглобина у детей имеют четкие возрастные особенности (табл. 1). Так, для детей раннего неонатального периода нижняя граница нормы гемоглобина – 170 г/л, на 2-й неделе жизни– 145 г/л, в возрасте 3–4 нед. – 120 г/л. У детей дошкольного возраста анемию констатируют в тех случаях, когда концентрация гемоглобина уменьшается до 110 г/л и ниже, а у школьников младших классов – ниже 115 г/л. В возрасте 13–15 лет и старше в нормативных значениях гемоглобина появляются половые различия: у девушек нижней границей нормы считают концентрацию гемоглобина 120 г/л, у юношей – 130 г/л. Особо следует подчеркнуть, что любые случаи снижения уровня гемоглобина, в т. ч. сопровождающиеся нормальным и даже повышенным количеством эритроцитов в гемограмме, однозначно должны трактоваться как анемия [1–4].Диагностика
Адекватная коррекция анемии возможна только в том случае, если проводится этиопатогенетическое лечение. В свою очередь, поиску причин анемии способствует корректный анализ изменений гемограммы. Это позволяет не только избежать диагностических ошибок, но и существенно сокращает объем необязательных исследований. Особо следует подчеркнуть, что непременным условием диагностики является проведение так называемого развернутого анализа крови, в котором представлены значения гемоглобина, эритроцитов, эритроцитарных индексов, ретикулоцитов, тромбоцитов и их индексов, лейкоцитов, а также «лейкоцитарная формула» [1, 2, 4–8]. Выявление лабораторных признаков анемии влечет необходимость одновременной оценки значений и других показателей гемограммы. При этом в первую очередь целесообразно уточнить, является ли анемия изолированной или сочетается с лейкопенией и/или тромбоцитопенией. В случае выявления у ребенка 2- или 3-ростковой цитопении план обследования необходимо согласовать с гематологом, т. к. среди возможных причин указанных нарушений могут быть не только витамин В12- и/или фолиеводефицитные состояния, но и более серьезные заболевания (апластическая анемия, лейкоз и др.).В тех случаях, когда анемия не сопровождается лейко- и/или тромбоцитопенией, вопрос о необходимости привлечения гематолога для курации пациента решается в зависимости от выраженности анемического синдрома. Тяжесть анемии определяется степенью снижения гемоглобина. Так, в постнеонатальном периоде для оценки тяжести анемии у детей традиционно используют критерии, представленные в таблице 2. При этом снижение гемоглобина до 90 г/л рассматривают в качестве признака легкой степени анемии. К анемии средней степени относят случаи, когда концентрация гемоглобина находится в пределах 70–90 г/л. Снижение уровня гемоглобина ниже 70 г/л говорит о тяжелой анемии (см. табл. 2).
Таким образом на первом этапе расшифровки гемограммы, корректный анализ изменений уровней гемоглобина позволяет не только своевременно диагностировать анемию, но и определить степень ее тяжести. Далее необходимо сопоставить уровень гемоглобина с количеством эритроцитов, оценив соответствие их значений, поскольку адекватное функционирование эритроцитов возможно только при строго определенном их насыщении гемоглобином. Степень насыщения эритроцитов гемоглобином оценивают с помощью цветового показателя (ЦП) или используя такие эритроцитарные индексы, как MCH (Mean Corpuscular Hemoglobin) и МСНС (Mean Corpuscular Hemoglobin Сoncentration) (рис. 1). В зависимости от степени насыщения эритроцитов гемоглобином выделяют нормохромию (адекватное насыщение), гипохромию (недостаточное насыщение) и гиперхромию (избыточное насыщение). Соответственно различают нормохромные, гипохромные и гиперхромные анемии.
Особо следует отметить, что наиболее достоверно уровень насыщения эритроцитов гемоглобином отражает индекс МСН. Индекс МСНС определяется не только уровнем гемоглобина и количеством эритроцитов, но и объемом самих эритроцитов (MCV). Так, установлено, что в тех случаях, когда одновременно имеют место микроцитоз эритроцитов и недостаточное их насыщение гемоглобином, значения МСНС могут привести к ошибочному заключению о нормо- или даже гиперхромии. В свою очередь, при макроцитозе эритроцитов и нормальном уровне их насыщения гемоглобином оценка МСНС может привести к ошибочному выводу о гипохромии. Это объясняется тем, что при вычислении данного индекса объем эритроцитов, независимо от его абсолютных значений, принимается за 100%, а непосредственно МСНС характеризует ту часть объема, которую занимает гемоглобин. Поэтому МСНС может как занижать истинное насыщение эритроцитов гемоглобином (при макроцитозе), так и завышать его (при микроцитозе). Приведенные примеры свидетельствуют о низкой специфичности индекса МСНС, что ограничивает его применение для оценки насыщения эритроцитов гемоглобином. В целом МСНС можно использовать только в тех случаях, когда средний объем эритроцитов соответствует нормативным показателям. В связи с этим на практике для оценки насыщения эритроцитов гемоглобином наиболее часто применяют ЦП и индекс МСН.
Адекватная оценка насыщения эритроцитов гемоглобином очень важна для расшифровки генеза анемии, т. к. позволяет определить направление диагностического поиска. Так, при гипохромной анемии дифференциальный диагноз проводят между анемиями, обусловленными железодефицитным состоянием, сидеробластозом и талассемией. Нормохромный характер анемии отмечают при гемолитических состояниях, аплазии костного мозга, злокачественных заболеваниях. В свою очередь, при гиперхромной анемии необходимо исключить витаминодефицитные состояния, т. к. причиной анемии в этом случае может быть недостаточное содержание в организме фолиевой кислоты и/или витамина В12 (рис. 2).
Очень важную информацию для уточнения генеза анемии дает анализ показателя, характеризующего средний объем эритроцитов – MCV (Mean Сorpusculare Volume). Это обусловлено тем, что для целого ряда анемий определенные значения MCV являются патогномоничным признаком (рис. 3). Поэтому уже на первых этапах расшифровки причин анемического синдрома целесообразно выделять, в зависимости от значений MCV, нормоцитарные, микроцитарные и макроцитарные анемии. В тех случаях, когда при анемии выявляется микроцитоз эритроцитов (микроцитарная анемия), необходимо проводить дифференциальный диагноз между такими заболеваниями, как железодефицитная анемия, талассемия, наследственные микроцитарные гемолитические анемии и др. При выявлении макроцитарной анемии исключения требуют витаминодефицитные состояния (дефицит фолиевой кислоты, витамина В12), апластические анемии, дизэритропоэз, миелодиспластический синдром. Следует отметить, что значения среднего объема эритроцитов имеют возрастные различия, и их необходимо учитывать, особенно у детей первого полугодия жизни (табл. 3).
Поиск причин анемии значительно упрощается, если в анализе крови, наряду с показателями среднего объема эритроцитов, насыщения их гемоглобином (ЦП, МСН и МСНС), представлены данные о количестве ретикулоцитов. В связи с тем что гематологические анализаторы, имеющиеся в настоящее время в лечебно-профилактических учреждениях, в большинстве случаев не обладают возможностью подсчета ретикулоцитов, их подсчет проводится классическим методом («микроскопия мазка»), а это возможно только после предварительной договоренности с лабораторий. В то же время гематологические анализаторы последнего поколения позволяют не только определять количество ретикулоцитов, но и представлять данные об уровне их насыщения гемоглобином (Ret-Hb), а также степени их зрелости (LFR, MFR, HFR, IFR) (рис. 4). Уменьшение значений Ret-Hb ниже нормы и увеличение Delta-Hb свидетельствуют о снижении насыщения ретикулоцитов гемоглобином, что способствует выявлению гипохромных состояний на самых ранних стадиях, когда еще не развились анемия и гипохромия эритроцитов [5–8]. Увеличение таких показателей, как MFR, HFR, IFR, отмечается при появлении в кровотоке незрелых форм ретикулоцитов, что отражает расторможение эритроидного ростка костного мозга и может использоваться для оценки эффективности лечения дефицитных анемий (железодефицитной, витамин-В12-дефицитной, фолиеводефицитной) на первых этапах терапии.
Основные причины гиперрегенераторной анемии (анемия с ретикулоцитозом) – гемолиз и постгеморрагические состояния. Постгеморрагическая анемия относится к железодефицитным анемиям, которые характеризуются гипохромией и микроцитозом. Однако в отличие от железодефицитной анемии алиментарного генеза, типичным признаком постгеморрагической анемии является ретикулоцитоз. Увеличение количества ретикулоцитов отмечается также и при гемолитических анемиях. При этом особо следует подчеркнуть, что в определенных случаях (например, при внутрикостномозговом гемолизе, парвовирус-В-19-ассоциированном транзиторном апластическом кризе и др.) гемолитический синдром может не сопровождаться ретикулоцитозом. Речь идет о тех патологических состояниях, когда разрушение предшественников эритроцитов происходит непосредственно в костном мозге. Снижение количества ретикулоцитов отмечается при витаминодефицитных и апластических анемиях, что позволяет характеризовать указанные анемии как гипорегенераторные (см. рис. 4).
Гипохромная анемия
Учитывая, что наиболее часто в педиатрической практике встречаются гипохромные анемии, считаем целесообразным обратить особое внимание именно на эти патологические состояния. Как уже отмечено ранее, гипохромные анемии развиваются при железодефицитных состояниях, талассемии и сидеробластозе.Основными причинами железодефицитной анемии у детей являются недоношенность, недостаточное поступление железа в организм из-за особенностей диеты (вскармливание младенцев неадаптированными смесями или коровьим молоком; несбалансированное питание, содержащее недостаточное количество мясных продуктов; «мучной рацион»; веганство, вегетариантство и др.), синдром мальабсорбции, кровопотеря и др. Все железодефицитные анемии являются гипохромными и микроцитарными. При этом для железодефицитной анемии, развившейся в результате кровопотери (постгеморрагическая анемия), типичными проявлениями являются не только гипохромия и микроцитоз эритроцитов, но также и повышение уровня ретикулоцитов (гиперрегенераторная анемия), тогда как железодефицитная анемия, в основе которой лежат алиментарные факторы, характеризуется нормальным уровнем ретикулоцитов (норморегенераторная анемия).
Шаблонное представление о гипохромной анемии как проявлении исключительно железодефицитного состояния в ряде случаев становится причиной диагностических ошибок. В связи с этим следует еще раз напомнить, что к гипохромным анемиям, помимо железодефицитных, относятся также талассемия и сидеробластная анемия.
Талассемия, так же как и железодефицитная анемия, характеризуется гипохромией и микроцитозом эритроцитов. Талассемии – группа наследственных заболеваний, обусловленных нарушением синтеза альфа- или бета-цепей гемоглобина. Установлено, что талассемия имеет четкую этническую зависимость. Так, бета-талассемия чаще всего встречается у выходцев из Средиземноморья, Среднего Востока и Индии, а альфа-талассемия – у выходцев из Африки и Юго-Восточной Азии [1–3, 9]. Учитывая это, при выявлении гипохромной, микроцитарной анемии у ребенка с указанной этнической принадлежностью, помимо поиска типичных клинических (легкая иктеричность, гепатоспленомегалия) и лабораторных (мишеневидность эритроцитов) проявлений талассемии, необходимо уточнить семейный анамнез, обращая особое внимание на состояние здоровья ближайших родственников (хроническая анемия, гепатоспленомегалия, холелитиаз с молодого возраста и др.).
Для проведения дифференциального диагноза между железодефицитной анемией и талассемией показано исследование ферростатуса (определение в сыворотке крови железа, железосвязывающей способности, ферритина), осмотической резистентности эритроцитов, типов гемоглобина (электрофорез гемоглобина), молекулярно-генетическое исследование. При этом на первых этапах диагностики в пользу талассемии свидетельствуют нормальные или повышенные уровни сывороточного железа и ферритина, а также повышение осмотической резистентности эритроцитов. У детей в возрасте старше 1 года подтверждением бета-талассемии служит повышение удельного веса фетального гемоглобина.
В основе сидеробластной анемии лежит нарушение эритропоэза, которое обусловлено наследственными или приобретенными дефектами ферментных систем, участвующих в синтезе гема и утилизации железа эритроцитарными клетками. Установлено, что наследственный сидеробластоз встречается редко. При этом отмечена его гетерогенность: встречаются варианты с разным типом наследования, как связанные с полом, так и имеющие аутосомный характер. Развитие приобретенной сидеробластной анемии может быть обусловлено различными заболеваниями и патологическими состояниями (инфекции, хронические воспалительные процессы, системные заболевания органов кроветворения, интоксикация медикаментами или солями свинца и др.), при которых снижается активность ферментов, обеспечивающих включение железа в структуру гемоглобина [1, 2, 10]. Особо следует отметить, что сидеробластная анемия, так же как и талассемия, характеризуется нормальным или повышенным уровнем сывороточного железа и ферритина. Принимая во внимание представленную выше информацию, в диагностически сложных случаях уточнение причин гипохромной анемии невозможно без дополнительного исследования уровня железа, железосвязывающей способности и ферритина сыворотки крови (рис. 5). Важно помнить при этом, что ферритин обладает свойствами белка острой фазы воспаления и поэтому его уровень может быть повышен при воспалительных процессах в организме. В связи с этим одновременно с определением ферритина необходимо исследовать С-реактивный белок.
Лечение
В тех случаях, когда выявляется гипохромная, микроцитарная анемия и имеются точные данные в пользу железодефицитного ее генеза, терапией выбора является применение препаратов железа. При этом в подавляющем большинстве случаев препараты железа назначаются перорально, если нет противопоказаний (синдром мальабсорбции, обострение язвенной болезни желудка и двенадцатиперстной кишки, состояние после резекции желудка и/или тонкой кишки, болезнь Крона) [1, 2, 11–14]. В настоящее время применяются различные препараты железа: солевые, гидроксид-полимальтозные комплексы. Для адекватной коррекции железодефицитной анемии с помощью солевых пероральных препаратов железа рекомендуются следующие суточные дозы (по элементарному железу): детям в возрасте до 3-х лет – 3 мг/кг/сут; детям старше 3-х лет – 45–60 мг/сут; подросткам — до 120 мг/сут. У детей в возрасте 6 лет и старше, а также у подростков для лечения железодефицитной анемии может с успехом применяться Тардиферон – пролонгированный препарат сульфата железа (II). В 1 таблетке препарата Тардиферон содержится 80 мг элементарного железа, что позволяет рекомендовать следующий его режим дозирования: детям от 6 до 10 лет – 1 таблетка в сутки; детям старше 10 лет и подросткам – 1–2 таблетки в сутки [15]. Тардиферон содержит оптимальную комбинацию действующих веществ — двухвалентного железа, аскорбиновой кислоты и мукопротеозы, защищающей органы от негативного воздействия ионов железа и обеспечивающей постепенное высвобождение железа в зоне максимального всасывания. Это значит, что железо в составе препарата равномерно усваивается в течение 12 часов, не создавая пиков, опасных для слизистой оболочки кишечника. Препарат Тардиферон принимают не разжевывая, перед или во время приема пищи, запивая большим количеством воды. Следует помнить: не рекомендуется одновременно с препаратом Тардиферон использовать антациды и тетрациклины; всасывание в кишечнике железа из солевых препаратов уменьшается при одновременном использовании продуктов, содержащих полифенолы (бобов, орехов, чая, кофе, некоторых овощей), фитаты (зерновых, бобовых, овощей, орехов) и большое количество пищевых волокон [1, 4, 9, 11–14].При правильно установленном диагнозе «железодефицитная анемия», адекватном выборе препаратов железа и корректно подобранной дозе на 10–14-й день терапии в клиническом анализе крови отмечается увеличение ретикулоцитов, а к концу 3–4-й недели лечения – прирост гемоглобина на 10 г/л. Нормализуется уровень гемоглобина через 4–8 нед. от начала терапии, сроки зависят от тяжести железодефицита. Продолжительность применения препаратов железа в полной лечебной дозе также зависит от тяжести анемии. Так, при анемии легкой степени продолжительность терапии составляет 3 мес., при среднетяжелой степени – до 4,5 мес., при тяжелой – до 6 мес. [11]. Если на фоне адекватно проводимой терапии нет позитивных сдвигов гемограммы в декретируемые сроки, следует усомниться в корректности диагноза. Учитывая, что гипохромия эритроцитов встречается не только при железодефицитной анемии, но и при сидеробластозе и талассемии, необходимо исключить указанные патологические состояния (см. рис. 5).
Таким образом, правильная интерпретация значений всех показателей гемограммы дает возможность уже при первичном обращении очертить круг основных причин выявленной анемии и своевременно наметить основные диагностические направления для расшифровки генеза заболевания.
.
Микроцитарная гипохромная анемия — StatPearls
Continuing Education Activity
Микроцитарная гипохромная анемия, как следует из названия, представляет собой тип анемии, при которой циркулирующие эритроциты меньше обычного размера эритроцитов (микроцитов) и имеют уменьшенный красный цвет ( гипохромный). Наиболее частой причиной этого типа анемии является снижение запасов железа в организме, которое может быть вызвано несколькими причинами. Это может быть связано с пониженным содержанием железа в рационе, плохим усвоением железа из кишечника, острой и хронической кровопотерей, повышенным потреблением железа в определенных ситуациях, таких как беременность, восстановление после серьезной травмы или операции.В этом упражнении рассматривается оценка и лечение микроцитарной гипохромной анемии. и подчеркивает роль межпрофессиональной группы в распознавании и лечении этого состояния.
Цели:
Опишите рекомендуемые методы лечения микроцитарной гипохромной анемии.
Обрисуйте типичное представление пациента с микроцитарной гипохромной анемией.
Обзор патофизиологии микроцитарной гипохромной анемии.
Объясните стратегии межпрофессиональной группы для улучшения координации оказания помощи и коммуникации в отношении ведения пациентов с микроцитарной гипохромной анемией.
Введение
Анемия определяется как уменьшение массы циркулирующих эритроцитов ниже нормального уровня. Анемия — очень распространенное заболевание, широко распространенное среди людей. Циркулирующие эритроциты (эритроциты) содержат белок, известный как гемоглобин, этот белок имеет четыре полипептидных цепи и одно гемовое кольцо, содержащее железо в восстановленной форме.Железо является основным компонентом гемоглобина и основным переносчиком кислорода. Снижение запасов железа в организме влияет на выработку гемоглобина, который впоследствии препятствует транспортировке кислорода к системам органов тела. Анемия снижает способность крови переносить кислород и приводит к гипоксии тканей. Обычно это диагностируется по гематокриту (отношение упакованных эритроцитов к объему крови) и концентрации гемоглобина. [1] [2] [3] [4]
Этиология
Микроцитарная гипохромная анемия, как следует из названия, представляет собой тип анемии, при котором циркулирующие эритроциты меньше обычного размера эритроцитов (микроцитарные) и имеют пониженный красный цвет (гипохромные).Наиболее частой причиной этого типа анемии является снижение запасов железа в организме, которое может быть вызвано несколькими причинами. Это может быть связано с пониженным содержанием железа в рационе, плохим усвоением железа из кишечника, острой и хронической кровопотерей, повышенным спросом на железо в определенных ситуациях, таких как беременность или восстановление после серьезной травмы или операции.
Эпидемиология
Согласно эпидемиологическим данным Всемирной организации здравоохранения (ВОЗ) 24,8% населения в настоящее время страдает анемией, большая часть из которых вызвана железодефицитной анемией.Гипохромная микроцитарная анемия чаще встречается у женщин в пременопаузе, поскольку они теряют кровь с каждым менструальным циклом. Среди женского населения почти 41% всех беременных женщин страдают анемией, в то время как среди небеременных женщин в пременопаузе 30% женщин борются с анемией. Мужское население обычно устойчиво к анемии из-за уровня циркулирующего тестостерона. Однако во всем мире анемией страдают 12,7% взрослых мужчин. После женского населения дети дошкольного возраста больше всего страдают от анемии из-за нехватки железа в их основном рационе.Грудное молоко содержит 0,3 мг / л железа, которого недостаточно. С другой стороны, коровье молоко содержит вдвое больше железа, но это железо имеет низкую биодоступность [5].
Патофизиология
Взрослому человеку требуется от 1 до 2 мг железа в день. Обычная западная диета содержит от 10 до 20 мг железа. Железо животного происхождения находится в форме железа Haeme, биодоступность которого составляет от 10% до 20% по сравнению с негемовым железом, имеющим ограниченную биодоступность от 1% до 5%.Причина низкой биодоступности негемового железа связана с его взаимодействием с дубильными веществами, фосфатами и другими компонентами пищи. Средний мужчина содержит 6 граммов железа, а женщина — 2,5 грамма железа. Этой диеты обычно достаточно для поддержания здорового запаса железа. Проглоченное железо освобождается от других пищевых компонентов с помощью HCL желудочного сока, в то время как аскорбиновая кислота (витамин С) предотвращает осаждение трехвалентного железа. Впоследствии железо всасывается из двенадцатиперстной кишки и верхних частей тощей кишки через переносчик железа, называемый (ферропортин), в то время как белок трансферрин переносит это железо в кровь.Железо хранится в форме ферритина — повсеместно распространенного белка железа, который находится преимущественно в печени, селезенке, костном мозге и скелетных мышцах. В печени он хранится в паренхимных клетках, а в других тканях — в макрофагах. Этот процесс абсорбции железа из кишечника контролируется гепсидином, белком, который регулирует количество железа, абсорбируемого с пищей.
Гипохромная микроцитарная анемия вызывается любым фактором, уменьшающим запасы железа в организме. Гемоглобин — это глобулярный белок, который является основным компонентом эритроцитов. Он вырабатывается в костном мозге клетками-предшественниками эритроидов.Он имеет четыре цепи глобина, две из которых являются цепями альфа-глобина, а две другие — цепями бета-глобина, эти четыре цепи присоединены к порфириновому кольцу (гему), центр которого содержит железо в форме двухвалентного (восстановленного железа), способного связывать четыре молекулы кислорода. Сниженные запасы железа останавливают производство цепей гемоглобина, и его концентрация начинает снижаться во вновь образованных эритроцитах, поскольку красный цвет эритроцитов обусловлен гемоглобином; цвет вновь образованных эритроцитов начинает блекнуть, отсюда и название — гипохромный.Поскольку вновь полученные эритроциты содержат меньшее количество гемоглобина, они имеют относительно небольшой размер по сравнению с нормальными эритроцитами, отсюда и название — микроцитарные.
Железодефицитная гипохромная микроцитарная анемия возникает из-за нарушения поступления железа в рацион из-за пониженного содержания железа в рационе, патологии тонкого кишечника, такой как спру, и хронической диареи, гастрэктомии и дефицита витамина С в рационе. Это может быть из-за острой или хронической кровопотери, а также из-за внезапно возросших требований во время беременности или серьезной травмы или операции.
Пониженный гемоглобин в эритроцитах снижает количество кислорода, доставляемого к периферическим тканям, что приводит к тканевой гипоксии.
Гистопатология
Снижение количества гемоглобина в эритроцитах приводит к уменьшению размера эритроцитов. Нормальные эритроциты содержат центральную зону бледности, которая обычно составляет одну треть размера эритроцитов; однако при гипохромной микроцитарной анемии этот размер увеличивается, и гемоглобин обычно присутствует только в периферическом крае эритроцитов. Нормальный размер эритроцитов составляет от 80 до 100 фемтолитров / эритроцитов (фл / эритроцитов), однако при железодефицитной анемии этот размер уменьшается ниже 80 фл / эритроцитов.Железо, хранящееся в нормальном костном мозге, дает черно-синий цвет при реакции с красителем берлинской синей, но при гипохромной микроцитарной анемии содержание окрашиваемого железа заметно снижается или даже отсутствует в тяжелых случаях. Также характерны пойкилоциты в виде маленьких удлиненных эритроцитов (клеток-карандашей).
Анамнез и физическое состояние
Типичный анамнез показывает:
Пониженное потребление железа с пищей
Повышенная кровопотеря при менструации
Кровотечение из желудка, особенно из язв желудка и двенадцатиперстной кишки
Злокачественные новообразования или толстая кишка
Серьезная травма, после которой запасы железа истощаются.
В некоторых случаях может присутствовать пика. Это предпочтение есть непитательные вещества, такие как глина, лед и мука.
Пациент также мог жаловаться на застревание пищи внутри грудной клетки из-за перепонок пищевода вместе с опухшим языком (глоссит). Наряду с анемией это определяется как синдром Пламмера-Винсона, который является редким проявлением дефицита железа.
При медицинском осмотре у пациента может быть очевидная бледность рук, а также конъюнктивит, тахикардия, учащенное дыхание, истощение, койлонихия (ногти в форме ложки).Тяжелая анемия также может привести к появлению признаков и симптомов стенокардии из-за снижения доставки кислорода к сердечным миоцитам.
Оценка
Первый тест, который нужно выполнить, — это полный анализ крови (CBC), который укажет на наличие анемии после тщательного медицинского осмотра. CBC покажет разные индексы RBC, такие как MCV и MCHC. Эти параметры указывают на количество гемоглобина в эритроцитах, они оба обычно уменьшаются при гипохромной микроцитарной анемии.Следующим тестом, который необходимо выполнить, являются исследования железа, в которых изучается насыщение трансферрина, общая связывающая способность железа и ферритин. TIBC обычно увеличивается при железодефицитной анемии, тогда как насыщение трансферрина заметно снижается при железодефицитной анемии. Уровень ферритина ниже 12 нг / мл при отсутствии цинги является надежным индикатором железодефицитной анемии. Однако низкий или нормальный уровень ферритина не исключает диагноза железодефицитной анемии, поскольку ферритин является белком-реагентом острой фазы, и его уровень повышается во время инфекций.Когда уровень железа падает, уровень трансферрина увеличивается в качестве компенсации. [6] [7] [8]
Периферический мазок покажет маленькие эритроциты с карандашными клетками. Микроцитарные клетки будут иметь большую зону центральной бледности и небольшой периферический край гемоглобина.
Лечение / ведение
После установления диагноза гипохромной микроцитарной анемии можно начинать заместительную терапию железом. Терапия включает 325 мг сульфата железа 3 раза в день внутрь. Из этого количества до 10 мг железа может абсорбироваться из кишечника, и это предпочтительное начальное лечение.Тошнота и запор — это побочные эффекты, которые ограничивают приверженность этой терапии. Комплаентность можно повысить, постепенно увеличивая дозу лечения, наблюдая за пациентом на предмет побочных эффектов. Для восполнения утраченного железа обычно выбирается максимально переносимая доза. Эффект от этого лечения обычно проявляется через 3 недели, а полный эффект проявляется через 2 месяца. [9] [10] [11]
Препараты для парентерального введения железа могут использоваться в следующих случаях:
Пероральные препараты вызывают неумолимые побочные эффекты
Анемия устойчива к пероральной терапии
Имеются некоторые заболевания кишечника, препятствующие правильному всасыванию железа
Там же продолжающаяся кровопотеря, которую нельзя исправить пероральными добавками.
Препарат железа с сорбитом медленно вводится в течение 5 минут в дозе 50 мг / кг веса тела у мужчин и 35 мг / кг веса тела у женщин. Парентеральная доза обычно представляет собой дефицит железа плюс один дополнительный грамм железа для восполнения запасов железа в организме.
Дифференциальный диагноз
Дифференциальный диагноз гипохромной микроцитарной анемии может включать талассемию, анемию хронического заболевания, отравление свинцом и Х-сцепленную сидеробластную анемию.
Улучшение результатов команды здравоохранения
Диагностика и лечение гипохромной микроцитарной анемии проводится межпрофессиональной командой, в которую входят лечащий врач, практикующая медсестра, гинеколог, гематолог, хирург и гастроэнтеролог. Главное — найти причину анемии. После установления диагноза гипохромной микроцитарной анемии можно начинать заместительную терапию железом. Терапия включает 325 мг сульфата железа 3 раза в день внутрь.Из этого количества до 10 мг железа может абсорбироваться из кишечника, и это предпочтительное начальное лечение. Тошнота и запор — это побочные эффекты, которые ограничивают приверженность этой терапии. Комплаентность можно повысить, постепенно увеличивая дозу лечения, наблюдая за пациентом на предмет побочных эффектов. Для восполнения утраченного железа обычно выбирается максимально переносимая доза. Эффект от этого лечения обычно проявляется через 3 недели, а полный эффект проявляется через 2 месяца.Необходимо тщательное наблюдение, чтобы убедиться, что гематокрит пациента улучшается. [12]
Дополнительное обучение / обзорные вопросы
Рисунок
Изображение периферической крови пациента с большой бета-талассемией, показывающее гипохромные микроцитарные эритроциты вместе с клетками-мишенями. Предоставлено Hamza Bajwa, MD
Рисунок
Гипохромная микроцитарная анемия. Изображение предоставлено S Bhimji MD
Ссылки
- 1.
- Gebreweld A, Bekele D, Tsegaye A.Гематологический профиль беременных женщин в Медицинском колледже Миллениум больницы Святого Павла, Аддис-Абеба, Эфиопия. BMC Hematol. 2018; 18:15. [Бесплатная статья PMC: PMC6038189] [PubMed: 30002836]
- 2.
- Needs T, Gonzalez-Mosquera LF, Lynch DT. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 23 мая 2020 г. Бета-талассемия. [PubMed: 30285376]
- 3.
- Farashi S, Harteveld CL. Молекулярные основы α-талассемии. Blood Cells Mol Dis. 2018 Май; 70: 43-53.[PubMed: 2
- 40]
- 4.
- Warner MJ, Kamran MT. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 10 августа 2020 г. Железодефицитная анемия. [PubMed: 28846348]
- 5.
- Будневский А.В., Воронина Е.В., Овсянников Е.С., Цветикова Л.Н., Жусина Ю.Г., Лабжания Н.Б. [АНЕМИЯ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ КАК СИСТЕМНОЕ ПРОЯВЛЕНИЕ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ]. Клин Мед (Моск). 2017; 95 (3): 201-6. [PubMed: 30303337]
- 6.
- Буттарелло М.Лабораторная диагностика анемии: полезны ли старые и новые параметры эритроцитов при классификации и лечении, как? Int J Lab Hematol. 2016 Май; 38 Приложение 1: 123-32. [PubMed: 27195903]
- 7.
- Бранкалеони В., Ди Пьерро Е., Мотта И., Каппеллини, доктор медицины. Лабораторная диагностика талассемии. Int J Lab Hematol. 2016 Май; 38 Прил.1: 32-40. [PubMed: 27183541]
- 8.
- Кавабата Х. [Железорезистентная железодефицитная анемия]. Риншо Кецуэки. 2016 Февраль; 57 (2): 104-9. [PubMed: 26935626]
- 9.
- Fazal MW, Andrews JM, Thomas J, Saffouri E. Выявление и лечение дефицита железа в стационаре: как работают врачи общей практики и гастроэнтерологи в больнице третичного уровня? Intern Med J. 2017 августа; 47 (8): 928-932. [PubMed: 28509435]
- 10.
- Herklotz R, Risch L, Huber AR. [Гемоглобинопатии — клинические симптомы и диагностика талассемии и аномальных гемоглобинов]. Ther Umsch. 2006 Янв; 63 (1): 35-46. [PubMed: 16450733]
- 11.
- Hassoun H, Pavlovsky M, Mansoor S, Stopka T.Диагностика истинной полицитемии у больного анемией. South Med J. 2000 июл; 93 (7): 710-2. [PubMed: 10923962]
- 12.
- Барлас Р.С., Макколл С.Дж., Беттанкур-Сильва Дж.Х., Кларк А.Б., Боулз К.М., Меткалф А.К., Мамас М.А., Поттер Дж. Ф., Мьинт ПК. Влияние анемии на исходы острого инсульта зависит от типа анемии: данные британского регистра инсультов. J Neurol Sci. 2017 15 декабря; 383: 26-30. [PubMed: 29246615]
Какие состояния связаны с микроцитарной гипохромной анемией?
Автор
Джозеф Э. Маакарон, доктор медицины Научный сотрудник, Отделение внутренней медицины, Отделение гематологии / онкологии, Медицинский центр Американского университета Бейрута, Ливан
Раскрытие: Ничего не разглашать.
Соавтор (ы)
Али Т. Тахер, доктор медицины, доктор медицинских наук, FRCP , профессор медицины, младший научный сотрудник отделения внутренней медицины, отделение гематологии / онкологии, директор по исследованиям, Центр рака Базиля Н.К., Медицинский центр Американского университета Бейрута, Ливан
Раскрытие информации: раскрывать нечего.
Марсель Конрад, доктор медицины Заслуженный профессор медицины (на пенсии), Медицинский колледж Университета Южной Алабамы
Марсель Конрад, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская ассоциация содействия развитию науки , Американская ассоциация банков крови, Американское химическое общество, Американский колледж врачей, Американское физиологическое общество, Американское общество клинических исследований, Американское общество гематологии, Ассоциация американских врачей, Ассоциация военных хирургов США, Международное общество гематологов, Общество по экспериментальной биологии и медицине, SWOG
. Раскрытие информации: Партнер не получил никаких финансовых интересов ни для кого.
Главный редактор
Эммануэль Беса, доктор медицины Почетный профессор кафедры медицины, отделение гематологических злокачественных новообразований и трансплантации гемопоэтических стволовых клеток, Онкологический центр Киммеля, Медицинский колледж Джефферсона Университета Томаса Джефферсона
Эммануэль Беса, доктор медицины, является членом следующих медицинских организаций. общества: Американская ассоциация по образованию в области рака, Американское общество клинической онкологии, Американский колледж клинической фармакологии, Американская федерация медицинских исследований, Американское общество гематологии, Нью-Йоркская академия наук
Раскрытие: нечего раскрывать.
Благодарности
Jose A Perez Jr, MD, MBA, MSEd Консультант, Отделение Медицины, Методистская больница; Доцент клинической медицины, Медицинский колледж Вайля Корнелла
Хосе А Перес-младший, доктор медицины, магистр делового администрирования, магистр медицины и медицины является членом следующих медицинских обществ: Американского колледжа врачей, Американского колледжа врачей, Общества общей внутренней медицины и Общества госпитальной медицины
Раскрытие: Ничего не раскрывать.
Рональд Захер, MB, BCh, MD, FRCPC Профессор, внутренняя медицина и патология, директор Хоксвортского центра крови, Академический центр здоровья Университета Цинциннати
Рональд Захер, MB, BCh, MD, FRCPC является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской ассоциации банков крови, Американской клинической и климатологической ассоциации, Американского общества клинической патологии, Американского общества Гематология, Колледж американских патологов, Международное общество переливания крови, Международное общество по тромбозу и гемостазу и Королевский колледж врачей и хирургов Канады
Раскрытие: Глаксо Смит Клайн Гонорария Выступление и обучение; Членство в совете директоров Talecris Honoraria
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
болезнь крови | Типы, причины и симптомы
Болезнь крови , любое заболевание крови, связанное с эритроцитами (эритроцитами), лейкоцитами (лейкоцитами) или тромбоцитами (тромбоцитами) или тканями, в которых эти элементы образуются — костный мозг, лимфатические узлы, и селезенка — или кровотечение и свертывание крови.
Британская викторина
Медицинские термины и викторина для первопроходцев
Кто открыл основные группы крови? Что вызывает заболевание крови талассемией? Проверьте, что вы знаете о медицине, пройдя этот тест.
Задолго до того, как стали известны природа и состав крови, заболеванию крови приписывали множество симптомов.Эритроциты не распознавались до 17 века, и прошло еще 100 лет, прежде чем был описан один из типов белых кровяных телец, лимфоциты и свертывание крови (коагуляция). В 19 веке были открыты другие формы лейкоцитов, выделен ряд заболеваний крови и кроветворных органов. Морфологические изменения — изменения формы и структуры — которые происходят в крови во время болезни, а также признаки и симптомы различных заболеваний крови были описаны в 19 веке и в первой четверти 20 века.В последующие годы начал развиваться более физиологический подход, связанный с механизмами, лежащими в основе развития болезни крови, и с путями коррекции отклонений.
Некоторые особенности медицинского осмотра особенно важны при диагностике заболеваний крови. К ним относятся отмечать наличие или отсутствие бледности или, наоборот, избытка цвета; желтуха, красный язык и увеличение сердца, печени, селезенки или лимфатических узлов; маленькие пурпурные пятна или более крупные синяки на коже; и нежность костей.
Поскольку кровь циркулирует по всему телу и несет в себе питательные вещества, а также продукты жизнедеятельности, ее исследование может быть важным для выявления наличия болезни. Исследование крови можно разделить на две категории: анализ плазмы (неклеточная часть крови) и исследование клеток крови. Исследование плазмы включает определение белков плазмы, сахара в крови (глюкозы), солей (электролитов), липидов, ферментов, мочевины и различных гормонов.Такие измерения также полезны для идентификации заболеваний, которые не классифицируются как болезни крови, например диабета, болезни почек и болезни щитовидной железы. Для определения статуса свертывания крови могут проводиться специальные исследования плазмы или ее компонентов. Лабораторные исследования клеток крови, особенно ценные для диагностики заболеваний, включают (1) определение количества и характеристик эритроцитов (т.е. наличие анемии или полицитемии), (2) изучение количества и пропорций типов белых клеток, и (3) подсчет тромбоцитов и исследование процесса свертывания крови.Микроскопическое исследование пленок крови, высушенных на предметных стеклах и окрашенных анилиновыми красителями, позволяет наблюдать изменения размера и цвета и другие аномалии отдельных эритроцитов, а также позволяет исследовать лейкоциты и тромбоциты. Иногда необходимо исследовать костный мозг или лимфатический узел под микроскопом, а рентгенологические исследования могут потребоваться для обнаружения увеличения органа или лимфатического узла или костных аномалий. В более необычных случаях может потребоваться дополнительное обследование — e.g., специальные серологические (связанные с сывороткой) или биохимические процедуры или различные измерения с использованием радиоактивных изотопов для определения органа или количественного определения объема крови.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасНарушения, влияющие на эритроциты
Количество красных кровяных телец (эритроцитов) у нормальных людей зависит от возраста и пола, а также от внешних условий, в первую очередь от атмосферного давления. На уровне моря у среднего человека их 5.4 миллиона эритроцитов на кубический миллиметр крови. С физиологической точки зрения важно количество гемоглобина в крови, поскольку этот железосодержащий белок необходим для транспортировки кислорода из легких в ткани. Красные клетки несут в среднем 16 граммов гемоглобина на 100 миллилитров крови. Если такую кровь центрифугировать так, чтобы эритроциты были упакованы в специальную пробирку, известную как гематокрит, обнаруживается, что в среднем они занимают 47 процентов объема крови.У средней женщины нормальные показатели ниже (количество эритроцитов 4,8 миллиона; гемоглобин 14 граммов; объем упакованных эритроцитов 42 процента). У новорожденного эти значения выше, но снижаются в течение первых нескольких недель постнатальной жизни до уровней ниже, чем у нормальной женщины; после этого они постепенно поднимаются. Различия в мужской и женской крови начинают проявляться примерно в период полового созревания.
Красные клетки образуются в костных полостях центральных костей скелета взрослого человека (череп, позвоночник, ребра, грудина, кости таза).У здорового человека производство эритроцитов (эритропоэз) настолько хорошо приспособлено к разрушению эритроцитов, что уровни эритроцитов и гемоглобина остаются постоянными. Скорость производства эритроцитов костным мозгом обычно контролируется механизмом физиологической обратной связи, аналогичным термостатическому контролю температуры в комнате. Этот механизм запускается снижением содержания кислорода в тканях (гипоксия) и действует за счет действия гормона эритропоэтина, в образовании которого почки играют важную роль.Высвобождается эритропоэтин, который стимулирует дальнейший эритропоэз. Когда потребности в кислороде удовлетворяются, производство эритропоэтина и эритроцитов снижается.
При заболевании, а также в определенных ситуациях, когда происходят физиологические изменения, количество гемоглобина может снижаться ниже нормального уровня, состояние, известное как анемия, или может повышаться выше нормы, что приводит к полицитемии (также называемой эритроцитозом) .
Микроцитарная анемия: симптомы, типы и лечение
Микроцитарная анемия — это состояние, при котором ткани и органы организма не получают достаточного количества кислорода.
Эта нехватка кислорода может произойти из-за того, что в организме недостаточно эритроцитов, или из-за того, что красные кровяные тельца не содержат достаточного количества гемоглобина, который является белком, который переносит кислород в кровь. Когда в эритроците не хватает гемоглобина, клетка меньше по размеру и может переносить меньше кислорода.
Микроцитарная анемия — это не одно состояние, а скорее описывает несколько различных типов анемии.
Многие люди не имеют симптомов микроцитарной анемии на ранних стадиях.Американская академия семейных врачей (AAFP) заявляет, что врачи обнаруживают это случайно, когда человек сдает анализ крови по другой причине.
Симптомы у пациентов с более тяжелой анемией могут включать:
- бледная кожа, которая выглядит серой
- бледный цвет внутри век или под ногтями
- слабость или усталость
- раздражительность
- одышка
- учащенное сердце оценка
- pica, то есть желание есть лед, грязь и глина
Микроцитарная анемия может быть вызвана несколькими различными состояниями здоровья, от легких проблем до более серьезных. Важно работать с командой медиков, чтобы найти первопричину.
В статье в Международном журнале лабораторной гематологии говорится, что микроцитарная анемия обычно вызывается одним из следующих состояний, названия которых образуют аббревиатуру ХВОСТ:
Талассемия
Талассемия — это наследственное заболевание крови, от которого могут передаваться родители. их дети в результате аномальных генов.
Если кто-то болен талассемией, его организм не производит достаточного количества определенного белка, обычно содержащегося в гемоглобине.
Без этого белка эритроциты не будут формироваться должным образом или работать так, как должны. Недостаток этого белка вызывает анемию, которая может варьироваться от легкой до тяжелой в зависимости от того, сколько генов поражено.
В статье BMJ говорится, что железодефицитная анемия и талассемия являются наиболее частыми причинами микроцитарной анемии.У некоторых людей эти два состояния могут встречаться вместе.
Анемия хронического заболевания
Определенные хронические заболевания и состояния могут вызывать микроцитарную анемию. Обычно это называется анемией воспаления и хронического заболевания (AI / CD).
Хронические инфекции или воспаления могут влиять на процесс переработки железа в организме. Примерно от четверти до одной трети этих типов анемии классифицируются как микроцитарные.
Некоторые из состояний, которые могут вызывать этот тип анемии, включают:
- заболевание почек
- определенные виды рака, такие как болезнь Ходжкина, неходжкинская лимфома и рак груди
- воспалительные заболевания, такие как диабет, сердечная недостаточность, болезнь Крона. болезнь, воспалительное заболевание кишечника, ревматоидный артрит и волчанка
- инфекционные заболевания, включая ВИЧ, СПИД, туберкулез и некоторые сердечные и костные инфекции
железодефицитная анемия
AAFP заявляет, что дефицит железа является наиболее частой причиной микроцитарной анемии.
Причина дефицита железа часто зависит от возраста и пола человека.
У детей недостаток питания обычно является причиной железодефицитной анемии.
У женщин в период менструации менструальная кровопотеря является наиболее частой причиной дефицита железа.
Наиболее частой причиной дефицита железа у взрослых мужчин и женщин без менструации является кровопотеря. Чаще всего кровопотеря происходит в кишечнике, что может быть результатом кровоточащей язвы желудка.
В некоторых случаях опухоль в кишечнике может вызвать кровотечение. Некоторым людям может потребоваться дополнительное обследование, чтобы найти опухоль или исключить ее.
Пожилые люди могут болеть железодефицитной анемией из-за того, что в их рационе не хватает определенных питательных веществ, или потому, что у них есть особые хронические заболевания, которые препятствуют способности их организма усваивать железо. В статье American Family Physician было обнаружено, что распространенность анемии у пожилых мужчин колеблется от 8 до 44 процентов.
Отравление свинцом
Дети, которые подвергаются воздействию краски на основе свинца из-за того, что они живут в более старом доме, или потому, что она находится на игрушках или других предметах, могут получить отравление свинцом, когда они кладут предметы в рот.
Загрязненная вода и сильное промышленное загрязнение также могут вызывать отравление свинцом, хотя и реже.
Сидеробластная анемия
Врожденная сидеробластная анемия — это наследственное заболевание крови, которое влияет на способность костного мозга вырабатывать эритроциты. Хотя он может вызывать микроцитарную анемию, он встречается реже, чем другие причины.
Людям, у которых развивается анемия любого типа, следует обратиться к врачу за лечением, даже если симптомы отсутствуют.
Хотя человек, страдающий анемией легкой степени, может чувствовать себя хорошо, со временем это состояние может привести к повреждению важнейших органов тела. Тяжелая или продолжительная анемия может даже привести к смерти.
Лечение зависит от первопричины микроцитарной анемии. Врачам может потребоваться провести некоторые тесты, чтобы определить причину, чтобы они могли составить план лечения.
Врачи могут порекомендовать препараты железа, которые часто излечивают микроцитарную анемию у детей. Если они не помогают, могут потребоваться дополнительные анализы для проверки кровопотери или другой возможной причины.
Другие варианты лечения включают:
- антибиотики для лечения хронических инфекций, вызывающих анемию
- гормонов для лечения обильных менструальных кровотечений
- лекарство, которое стимулирует организм вырабатывать больше эритроцитов
- переливание крови (в более тяжелых случаях ).
- Операция по коррекции кровоточащей язвы желудка или опухоли в кишечнике
Также можно использовать хелатирование — терапию, которая помогает снизить уровень свинца в организме.Эта терапия иногда помогает детям с анемией, потому что анемия повышает вероятность отравления свинцом.
В некоторых случаях, например при наследственном заболевании, нет доказанного способа полностью предотвратить микроцитарную анемию.
Сбалансированная диета с высоким содержанием железа, витамина B12, витамина C и фолиевой кислоты может быть полезна практически любому человеку, страдающему анемией.
Людям, которые не получают достаточного количества железа в своем рационе, возможно, потребуется принимать добавки под наблюдением врача.
Американская академия педиатрии утверждает, что младенцам нельзя давать коровье молоко, особенно до достижения ими 12-месячного возраста. Слишком раннее кормление коровьего молока ребенку может вызвать потерю крови с калом и нарушить всасывание железа.
Родители должны узнать у педиатров, в каком возрасте можно вводить коровье молоко.
Младенцы на грудном вскармливании обычно получают достаточно железа от матери до 4-месячного возраста. Когда ребенок будет готов к твердой пище, включите в его рацион продукты с добавлением железа.Давайте детям на искусственном вскармливании смесь, содержащую необходимое количество железа.
Детское и коровье молоко
Дети старшего возраста обычно могут потреблять до 2 чашек цельного коровьего молока в день. Употребление большего количества алкоголя может привести к железодефицитной анемии.
Анемия может возникнуть по следующим причинам:
- молоко естественно с низким содержанием железа
- молоко может насытить ребенка, оставляя меньше места для продуктов, богатых железом в рационе
- молоко содержит кальций и казеин, которые влияют на способности организма для поглощения железа
Хорошие источники железа в пище
Люди любого возраста могут получить пользу от продуктов, богатых железом, которые могут помочь предотвратить некоторые виды анемии.Кроме того, продукты с высоким содержанием витамина С, такие как цитрусовые, помогают организму лучше усваивать железо.
Организм наиболее эффективно усваивает животную форму железа, поэтому вегетарианцам, возможно, нужно быть внимательнее к получению достаточного количества железа.
Некоторые из наиболее распространенных продуктов, богатых железом, включают:
- красное мясо
- яичные желтки
- обогащенные зерна и злаки
- фасоль
- листовые, зеленые овощи
- помидоры
- картофель
- изюм
Долгосрочная перспектива для людей с микроцитарной анемией во многом зависит от причины анемии.Большинство случаев легкие, особенно те, которые вызваны небольшим дефицитом железа.
Более тяжелые формы или формы, вызванные талассемией, язвами или опухолями, могут потребовать дополнительной медицинской помощи.
Ключом к более высокому качеству жизни с микроцитарной анемией является ее выявление и лечение как можно скорее.
Регулярный общий анализ крови (ОАК) может помочь диагностировать анемию у тех, у кого нет симптомов. Это приводит к более раннему лечению основной причины и, как правило, к лучшему качеству жизни в целом.
Микроцитоз — обзор | Темы ScienceDirect
Микроцитарная анемия (MCV
<80 fl)Дифференциальный диагноз микроцитоза может быть оценен на основании анамнеза, физического осмотра и лабораторных параметров: тяжелое «хроническое заболевание» должно быть очевидным при анемии хронического заболевания, вызывающего микроцитоз. источник кровопотери при микроцитарной анемии из-за дефицита железа. Талассемия и гемоглобин Е имеют генетическую и семейную предрасположенность. Индексы эритроцитов также дают ключ к разгадке талассемии и гемоглобина Е: в отличие от дефицита железа, когда количество эритроцитов снижено, часто количество эритроцитов нормальное или немного повышенное при талассемии и Hb E.Часто количество ретикулоцитов повышено при талассемии и Hb E, но может быть нормальным при α-талассемии. Напротив, как анемия при хроническом заболевании, так и дефицит железа представляют собой гипопролиферативные анемии, характеризующиеся нормальным или низким количеством ретикулоцитов.
В мазке периферической крови есть характерные признаки, которые помогают дифференцировать причины микроцитарной анемии. Дефицит железа характеризуется повышенным пойкилоцитозом с сигарообразными клетками и случайными клетками-мишенями.Бета-талассемия и большая α-талассемия характеризуются повышенной базофильной штриховкой эритроцитов, повышенной полихромазией и клетками-мишенями.
Дополнительные тесты для оценки микроцитарной анемии включают определение сывороточного ферритина и электрофорез гемоглобина. Ни сывороточное железо, ни общая железосвязывающая способность не являются достаточно чувствительными, чтобы отличить дефицит железа от тяжелой анемии хронического заболевания. В качестве реагента острой фазы сывороточный ферритин повышается при анемии, вызванной хроническим заболеванием, и снижается при дефиците железа.Сложность возникает, когда дефицит железа сочетается с анемией при хроническом заболевании, при котором ферритин ложно повышается с характерно низкого уровня до нормального уровня. Использование порогового значения для ферритина менее 100 нг / мл позволяет успешно идентифицировать 98% железодефицитных анемий, когда запасы железа в костном мозге используются в качестве золотого стандарта. 9 Как описано ранее, отношение растворимого рецептора трансферрина к концентрации ферритина может лучше отличить изолированную ACD от сопутствующей ACD с железодефицитной анемией. 9 Электрофорез гемоглобина может идентифицировать β-талассемические синдромы и гемоглобинопатии (Hb C, E, S), но является нормальным для вариантов α-талассемии с одно- и двухцепочечной делецией. Гемоглобинопатии и талассемический синдром, постоянная пружина гемоглобина, проявляются как отдельная полоса гемоглобина при гель-электрофорезе; бетаталассемия определяется по повышенному уровню HbA2 и HbF. На рисунке 46.7 представлен алгоритм оценки микроцитарной анемии.
(PDF) Микроцитоз и гипохромия эритроцитов в дифференциальной диагностике дефицита железа и признака-талассемии
опубликованных статей, чувствительность предложенных показателей
ces при обнаружении носителей b-талассемии и IDA
составляет примерно 100%.Однако недавние исследования
не подтвердили эти результаты (Ntaios et al., 2007).
Чтобы быть полезным при отборе образцов микроцитов для тестирования
b-талассемии, индекс должен определять максимальное количество пациентов с талассемией
(высокая чувствительность
), при этом исключая как можно больше неталассемических
(высокая специфичность) . Измерение микро-
,цитарных и гипохромных эритроцитов показывает противоположные результаты
у пациентов с неосложненной и нелеченой асемией b-thal-
и ЖДА (d ‘Onofrio et al., 1992). Отношение
между% микроцитарных и% гипохромных эритроцитов,
, измеренное с помощью Advia 2120, M / H, оказалось очень полезным для различения этих двух общих типов
микроцитарных анемий. Больные b-талассемией имеют
высокий уровень микроцитоза в результате хронического
увеличения эритропоэза.
Наши результаты показывают, что железодефицитный эритропоэз
характеризуется образованием эритроцитов с пониженной концентрацией гемоглобина на
, высоким уровнем гипохромных клеток
, тогда как микроциты b-талассемии обычно на
меньше, с более сохраненной концентрацией гемоглобина. .
b-талассемия характеризуется увеличением на
процента эритроцитов с объемом <60 fl, микроцитов,
, в то время как основной особенностью ЖДА является высокий уровень эритроцитов
с MCHC <28 г / дл, гипохромный клетки.
Образец гистограммы Mie Map
дает простой ключ к предварительной классификации пациентов
с микроцитозом. Отношение M / H выше 3,5 является очень подозрительным признаком b-талассемии
, поэтому HbA
2
должен быть определен количественно
, чтобы подтвердить наличие болезни.Дискриминантная эффективность
отношения M / H со значением решения
, равным 3,5, была выше, чем у всех других единичных измерений —
, 91,5%, AUC = 0,984, все пациенты с ЖДА включали в оценку
. Когда рассматривались только пациенты с легким дефицитом железа
(Hb 9–11 г / дл), как
MI, так и соотношение M / H показали худшие результаты, с более низкими чувствительностью и специфичностью
.
Если бы все пациенты с ЖДА были включены, дискриминантная эффективность
оказалась бы одинаковой для обоих индексов, но результаты
предполагают, что M / H является более надежным индексом из-за его более высокой чувствительности, меньшего количества ложноотрицательных результатов когда
пациентов имеют легкую анемию и дифференциальный диагноз
более труден.Карта Ми и соотношение M / H
могут быть эффективными для использования в качестве инструмента предварительного скрининга
при исследовании микроцитарных анемий, но для точный дифференциальный диагноз
ЖДА и b-талассемии.
ССЫЛКИ
Bentley S.A., Ayscue L.H., Watson J.M. и
Ross D.W. (1989) Клиническая полезность
дискриминантных функций для дифференциальной диагностики микроцитарных анемий.
Клетки крови 15, 575–582.
Бейан К., Каптан К. и Ифрам А. (2007)
Прогностическая ценность дискриминационных показателей
в дифференциальной диагностике железа
дефицитная анемия и бталасемия
признак. Европейский журнал гематологии
78, 524–526.
Bothwell T.H. И Чарльтон Р.В. (1981).
Дефицит железа у женщин, Фонд питания
, Вашингтон, округ Колумбия.
Brugnara C. (2003) Дефицит железа и
эритропоэз: новый диагностический подход
чес.Клиническая химия 49, 1573–1578.
Демир А., Ярали Н., Фисгин Т., Дуру Ф. и
Кара А. (2002) Наиболее надежные показатели в
дифференциации между признаком талассемии
и железодефицитной анемией. Pediatrica
International 44, 612–616.
Элдибани М.М., Тотончи К.Ф., Джозеф
Н.Дж. и Рон Д. (1999). Полезность
определенных индексов эритроцитов в диагностике
и дифференциации признака талассемии
от железодефицитной анемии.American
Journal of Clinical Pathology 111, 676–
682.
England J.M., Bain B.J. & Fraser P.M.
(1973) Дифференциация дефицита железа
по признаку талассемии. The Lancet 1,
1514.
Грин Р. и Кинг Р. (1989) Новый дискриминант красных клеток
, включающий объемную дис-
персию для дифференциации железодефицитной анемии
от малой талассемии.
Blood Cells 15, 481–495.
Hallberg L. (1992) Требования к железу
комментирует методы и некоторые важные концепции
в питании железом. Биологический
Исследование микроэлементов 35, 25–45.
Jayabose S., Giamelli J., Levondoglu-
Tugal O., Sandoval C. & Ozkaynak F
& Visintainer P. (1999) Дифференциация
железодефицитной анемии от талассо-
mia minor с помощью RDWMia minor на основе индекса
. Журнал детской гематологии
Онкология 21, 314.
Lafferty J.D., Crowther M.A., Ali M.A. &
Levine M. (1996) Оценка
различных математических индексов RBC и
их эффективности в различении
талассемических и неталассемических микроцитоз
. Американский клинический журнал
Патология 106, 201–205.
Mentzer W.C., Jr (1973) Дифференциация дефицита железа
от признака талассемии.
The Lancet 1, 882.
Ntaios G., Chatzinikolau A., Saouli Z.,
Girtovitis F., Tsapanidou M., Kaiafa G.,
Kontoninas Z., Nikolaiodu A., Savopou-
los C. & Pidonia I. (2007) Discrimina-
индексов в качестве скринингового теста для b
2008 Автор
Сборник журнала 2008 Blackwell Publishing Ltd,
Int. Jnl. Лаборатория. Подол.
2009, 31, 528–534
E. УРРЕЧАГА ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА МИКРОЦИТИЧЕСКОЙ АНЕМИИ 533
ГИПОХРОМИЧЕСКАЯ МИКРОЦИТИЧЕСКАЯ АНЕМИЯ ДЕТСКОГО: ДЕПЛЕЦИЯ ЖЕЛЕЗА КАК ФАКТОР
9В этой работе автор попытался разобраться в значении истощения запасов железа с помощью 4 простых расчетов, обоснование которых можно найти в недавних статьях.Это: (а) железо, с которым рождается младенец; (б) железо, оставшееся из пищи; (в) железо используется тканями и, следовательно, недоступно для гемоглобина, и (г) железо в сочетании с общей массой гемоглобина. С помощью этих 4 цифр можно оценить железо, еще потенциально доступное для использования («запасы» или «камни»). Когда разница между a + b и c + d достигает примерно нуля, считается, что существует истощение.
Можно выделить следующие характеристики истощения:
Истощение — результат увеличения веса и максимально возможного использования железа.Следовательно, это нормальный результат роста и не обязательно ассоциировать с анемией.
Как только происходит истощение, организм становится зависимым от текущего поглощения железа. Обычно этого достаточно, даже при диете, состоящей только из молока, для поддержания адекватной концентрации гемоглобина примерно в возрасте от 8 до 10 месяцев.
Тяжелая анемия, вызванная только истощением, практически характерна только для недоношенных детей, относительная прибавка в весе которых происходит быстро.
Тяжелая анемия у недоношенных детей является результатом ряда факторов, из-за которых железо становится недоступным или фактически направляется из гемоглобина в хранилище.
Ответ на лечение препаратами железа значительно лучше у младенцев с истощением, чем у тех, у которых присутствует какой-либо фактор, препятствующий утилизации железа и не связанный с простым введением железа.
Зависимость от текущего потребления, будь то результат истощения или недоступности, вносит определенную ненадежность, которая, очевидно, характерна для этого времени жизни.
