Острый миелоидный лейкоз. Симптомы и курс
Острый миелоидный лейкоз
Острый миелоидный лейкоз (ОМЛ) является редкими, злокачественными заболеваниями кроветворной системы. Во-первых, здесь затрагивается костный мозг (мозговой оссиум), в котором образуются красные (эритроциты) и белые (лейкоциты) клетки крови.
В костном мозге происходит так называемый блок дифференциации. Незрелые клетки крови (бласты) накапливаются в крови и костном мозге, что (в простых выражениях) приводит к подавлению нормального формирования крови.
Контроль уровня крови в лейкемии
Самые важные факты:
- Острый миелоидный лейкоз является злокачественным заболеванием гемопоэтической системы.
- При отсутствии лечения эта болезнь вызывает смерть.
- Симптомы острый миелоидного лейкоза: первые признаки — неспецифические симптомы, такие как увеличение физической слабости, бледности и восприимчивости к инфекции.
- Острый миелоидный лейкоз в первую очередь лечится химиотерапией и трансплантацией стволовых клеток.
- Курс при остром миелоидном лейкозе: шансы на ремиссию снижаются с возрастом.
В результате из-за недостатка мощности новые незрелые клетки все чаще высвобождаются в кровоток, которые не могут или недостаточно выполняют свои фактические задачи. Таким образом, кратковременные и среднесрочные функциональные клетки крови отсутствуют. Это заболевание встречается примерно у трех четвертей всех случаев в зрелом возрасте. Оставленный без лечения, он приводит к смерти.
Острый курс миелоидного лейкоза и формы заболевания
Острый миелоидный лейкоз и его формы подразделяются по-разному, в зависимости от издательского общества.
Необходимым условием для набора являются соответствующие обширные лабораторные анализы крови. Были широко использованы предложения Французско-Американско-Британской кооперативной группы (FAB), которая различает острый миелоидный лейкоз, например, в соответствии с дифференциацией, созреванием и другими формами.
В последние годы определение Всемирной организации здравоохранения (ВОЗ), в котором более четко учитываются характеристики БД и дифференциации, становится все более распространенным явлением.

Острые симптомы миелоидной лейкемии
Первоначально острый миелоидный лейкоз показывает симптомы, которые расположены в более обобщенной области.
Может случиться, что эти симптомы изначально неверно истолкованы. Признаки заболевания возникают из-за нарушения кровообращения (гемопоэза) и результирующего процесса репрессий.
Острый миелоидный лейкоз показывает симптомы или может быть выражен следующим образом:
- Те, кто пострадал, часто замечают неспецифические признаки, такие как усталость, слабость, снижение работоспособности, одышка, ночной пот, диффузные проблемы с пищеварением и потеря аппетита. Иногда из-за анемии возникает заметная бледность.
- Особенно у детей есть явное нежелание играть и общее отсутствие интереса.
- Из-за отсутствия функционирующих белых кровяных клеток (лейкоцитов) возникает общая восприимчивость к инфекции, которая характеризуется появлением грибковых инфекций во рту (молочница). Эти грибковые инфекции, в свою очередь, могут быть обобщены и распространены на другие органы. Часто эта восприимчивость к инфекции связана с темпиратурой. Нередко возникает тонзиллит.
- В качестве дальнейших признаков инфекции может развиться пневмония.
Кроме того, видимым симптомом является повышенная склонность к кровотечению, длительные кровотечения из носа, точечные или пятнистые кровотечения под кожей (петехии, синяки), кровотечение десен и слизистых оболочек, а также увеличение или удлинение менструаций у женщин. Они вызваны расстройством свертывания крови из-за отсутствия тромбоцитов. - По мере развития болезни существует вероятность того, что незрелые лейкоциты в крови значительно возрастут. Это может привести к неврологическим симптомам (ощущение дискомфорта, боли, сильного зуда и покалывания, головная боль, жесткость шеи, помутнение зрения), к общей недостаточности организма с кислородом и кровотечением сетчатки.
- Опухоль лимфатических узлов, а также увеличение печени, яичек и селезенки являются дальнейшими возможными побочными эффектами.
Из-за распространения патологических типов клеток (бластов) в суставах и костях возможна соответствующая болевая симптоматика.
Симптомы острого миелоидного лейкоза — Интерпретация симптомов
Важно: значительная часть описанных выше симптомов также присутствует во многих других, относительно безвредных заболеваниях. Определенно требуется правильный диагноз врача или онколога.
Курс острой миелоидной лейкемии
Как описано, AML (острый миелоидный лейкоз) является острым заболеванием с соответствующим быстрым началом заболевания, которое требует немедленного начала лечения (обычно это химиотерапевтический подход и / или трансплантация стволовых клеток).
Острый миелоидный лейкоз демонстрирует такие симптомы, как увеличение количества бластов в крови за короткий промежуток времени. Они могут соответственно оседать в органах (печени, селезенке).
Процесс болезни всегда фатален без терапии из-за выраженного ослабления иммунной системы организма, это может произойти через несколько недель после появления первых симптомов.
Курс острой миелоидной лейкемии — Возможное осложнение
Иногда это может привести к так называемому «синдрому лизиса опухоли». Из-за увеличения содержания калия, мочевой кислоты, LDH и фосфата в крови с одновременным низким уровнем кальция может произойти почечная недостаточность, которая срочно требует интенсивных медицинских мер.
Острый миелоидный лейкоз. Прогноз курса
Основываясь на нескольких исследованиях, долгосрочная выживаемость людей с ПОД, зависит от возраста.
У пациентов в возрасте до 60 лет, она не выше 40 процентов у пациентов старше 60 лет не более чем 20 процентов.
Острый миелоидный лейкоз. Появление и лечение рецидива
После обнаружения лейкемии необходимы регулярные и обширные проверки для своевременного обнаружения любого возможного возврата болезни (рецидива) и обеспечить соответствующий ответ.
Специфические факторы риска рецидива включают пожилой возраст на момент первого заболевания (55 или старше) или доказательства так называемого вторичного ОМЛ. Органы управления включают в себя исследования костного мозга и пострадавших органических мест.
Несмотря на полную морфологическую ремиссию (CR) после первичной терапии, подавляющее большинство пациентов рецидивирует. В зависимости от исследования упоминается от 50 до 80 процентов.
Рецидивы чаще возникают либо в первые 12 месяцев после ЧР, либо в первые 2 года после первого диагноза. Повторение также требует лечения AML с помощью химиотерапии или трансплантации стволовых клеток, часто в сочетании.
В случае отказа этих терапевтических вариантов указывается паллиативный подход, включая профилактику инфекции и поставку продуктов крови.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Миелолейкоз: причины, симптомы и лечение миелоидного лейкоза | Лечение болезней

Хронический и острый миелобластный лейкоз крови
В международной классификации болезней, миелобластный лейкоз – это группа болезней под общим названием «Миелоидный лейкоз (миелолейкоз)» C92, в которую включены 8 типов заболеваний, относящихся к злокачественным новообразованиям кроветворной ткани. Самыми распространённые среди них считаются острый (С92.0) и хронический (С92.1) миелоидные лейкозы.
В целом, такие лейкозы характерны видоизменением миелобластов – клеток, предшествующих лейкоцитам. Благодаря нарушениям в разных хромосомах, которые к тому же возникают на разных стадиях клеточного формирования, бластные клетки не только останавливаются в развитии, но и прекращают узконаправленную специализацию до зрелых форм лейкоцитов: нормобластов, лимфоцитов, моноцитов, эозинофилов и базофилов. Комбинация таких генных изменений с мутацией, вызывающей утрату контроля клеточного размножения, собственно и вызывают лейкоз.
Острый миелоидный лейкоз

Острый миелоидный лейкоз (ОМЛ) – это раковое заболевание крови, которое характеризуется большим содержанием аномальных незрелых лейкоцитов, размножающихся очень быстро. Этот тип лейкоза поражает 20% детей с раковыми заболеваниями крови. Благодаря успехам в области терапии и клинических исследований лечение острого миелоидного лейкоза у детей является достаточно перспективным. При этом важную роль играет своевременная диагностика рака крови и профессиональное лечение.
Причины развития острого миелоидного лейкоза
Точные причины возникновения острого миелоидного лейкоза неизвестны, но онкологи выделяют некоторые условия, которые способствуют повышению риска заболевания.
Риски включают в себя унаследованные генетические проблемы, такие, как синдром Дауна, нейрофиброматоз, а также анемия Фанкони и прочие наследуемые патологии костного мозга. Ненаследуемые заболевания – миелодиспластический синдром и апластическая анемия, также могут увеличить риск развития острой лейкемии.
ОМЛ чаще встречается у детей, которые были подвержены лучевой или химиотерапии, и является наиболее распространенным типом вторичного рака у детей.
Если у одного из близнецов диагностировали лейкемию в возрасте до 6 лет, то вероятность развития острого миелоидного лейкоза у второго ребенка составляет 20-25%. Дети, имеющие сестер и братьев с лейкемией, заболевают в два раза чаще. Облучение во время беременности может вызвать заболевание у развивающегося плода. Некоторые экологические факторы также могут провоцировать лейкоз.
Симптомы острого миелоидного лейкоза
Первые признаки рака крови нередко похожи на симптомы других заболеваний. Наблюдается вялость, появление небольших красных пятнышек на коже, боль в костях, суставах и животе. У ребенка появляются безболезненные на ощупь комочки под кожей на шее, в паху и других местах расположения лимфатических узлов. При обнаружении таких симптомов необходимо немедленно обратиться к специалисту.
Диагностика ОМЛ
Полный анализ крови, назначающийся при первых признаках рака крови, дает врачу Центра Лечения Рака Крови важную информацию о количестве нормальных клеток крови в организме, а также о том, насколько хорошо функционируют печень, селезенка и другие органы.
Аспирация и биопсия необходимы для изучения костного мозга. Врач вводит иглу в большую кость, как правило, бедренную, и берет небольшое количество костного мозга для проверки его на наличие раковых клеток.
Рентген, МРТ и УЗИ помогают обнаружить увеличение органов и исключить симптомы других заболеваний.
Спинномозговая пункция – процедура для диагностики рака крови, при которой берется немного спинномозговой жидкости для исследования в лаборатории.
Для идентификации подтипов ОМЛ проводятся хромосомные тесты. При этом для анализа ДНК берутся клетки крови и костного мозга.
Если ребенок нуждается в трансплантации стволовых клеток, то проводится тест тканевого типирования для изучения человеческого лейкоцитарного антигена. Тест осуществляется путем сравнения белков-антигенов ребенка с аналогичными белками потенциального донора. Чем больше схожи эти белки, тем более велики шансы на то, что трансплантация будет успешной.
Лечение острого миелоидного лейкоза
Острый миелоидный лейкоз прогрессирует быстро, поэтому своевременная диагностика играет особенно важную роль. Онкологи не выделяют промежуточных стадий ОМЛ, а характеризуют заболевание либо как вновь диагностированное, либо как находящееся в стадии ремиссии. Ремиссия – состояние, при котором нет никаких признаков присутствия болезни в организме.
Лечение состоит из двух этапов. Первый этап, или фаза индукции, преследует цель убить как можно большее количество раковых клеток в организме и достигнуть состояния ремиссии. Второй этап, или фаза пост-ремиссии, предназначен для поддержания эффекта терапии и преодоления последствий лечения. I и II этапы могут включать несколько видов терапии, использующихся независимо или совместно друг с другом.
Химиотерапия – это уничтожение раковых клеток специальными препаратами. Интерканальная терапия осуществляется через поясничный прокол и обеспечивает поступление лекарства непосредственно в спинномозговую жидкость, где может скапливаться большое количество пораженных лейкоцитов.
В случае необходимости, после химиотерапии проводится трансплантация костного мозга. Новые здоровые стволовые клетки нужны для восстановления нормального состояния иммунной системы и крови.
[contact-form-7 404 «Not Found»]
Типы и разновидности миелобластного лейкоза
В большинстве случаев, когда употребляются медицинские термины «острый» и «хронический», то речь идёт о стадии развития или форме одного и того же заболевания. Но в данном случае, острый и хронический миелобластные лейкозы – это 2 разных типа болезни крови, которые отличаются причинами, условиями и механизмом зарождения, поздними симптомами, течением, терапией и прогнозом выживаемости.
Острый тип
Острый миелобластный лейкоз (ОМЛ) – это злокачественное новообразование миелоидного ростка крови, для которого характерно неконтролируемое и очень быстрое деление изменённых форм лейкоцитов.
Накапливаясь в красном костном мозге, они угнетают его работу по воспроизводству других форменных элементов крови — эритроцитов и тромбоцитов. Тем самым это заболевание представляет реальную угрозу жизни – без советующей терапии и в зависимости от разновидности, больной проживёт всего несколько месяцев или недель.

Эта болезнь настолько разнообразна, что существует несколько её классификаций, основная задача которых заключается в оказании помощи онкологам и гематологам – чёткая и углублённая дифференциация помогает принять правильную стратегию терапии.
По классификация Всемирной системы острый миелобластный лейкоз разделён на подгруппы по причинам возникновения:
- генетические видоизменения – описано 9 мутаций генных комбинаций;
- с предшествующей миелодисплазией – 3 подтипа с 17-ю комбинациями генов;
- как следствие предыдущей лучевой или химиотерапии;
- миелоидная саркома;
- сопутствующая болезни Дауна;
- вызванная бластным плазмацитоидным дендритноклеточным новообразованием;
- другие причины, в том числе 10 конкретно описанных разновидностей.
Версия франко-британско-американской классификации (ФАБ)
| ПОДВИД | УТОЧНЁННОЕ НАЗВАНИЕ ОМЛ | ГЕННЫЕ ИЗМЕНЕНИЯ В КЛЕТКАХ |
| М0 | с min дифференциацией | в бластных лейкоцитах отсутствуют гранулы |
| М1 | без созревания | преобладают юные миелоидные клетки |
| М2 | с созреванием | мутация 8 и 21 хромосом |
| М3 | промиелоцитарный | преобладание данных незрелых гранулоцитов |
| М4 | миеломоноцитарный | довлеют миелобласты, монобласты, промоноциты |
| М4ео | с эозинофилией косного мозга | инверсия 16 хромосомы (возможно 8-12 и 11-19) |
| М5 | монобластный и моноцитарный | баланс между монобластами и промоноцитами |
| М6 | 5 типов эритроидного лейкоза | мутация предшественников эритробластов |
| М7 | мегакариобластный | преобладают юные изменённые тромбоциты |
| М8 | базофильный | мутация разных форм незрелых базофилов |
Острый миелобластный лейкоз, в самой упрощённой версии, включает в себя 5 подтипов:
- Миелоидный;
- Миелоидномоноцитарный;
- Моноцитарный;
- Эритроидный;
- Мегакариоцитарный.
В отличии от острого лимфобластного лейкоза, поражающего в основном детей, острый миелобластный лейкоз может возникнуть в любом возрасте. При этом наблюдается закономерность – чем старше возрастная группа, тем больше количество заболевших. И хотя доля острых миелоидных лейкозов со смертельным исходом в общей массе злокачественных заболеваний крови достаточно мала (1,5-2%), тенденция к старению всего населения Земли, делает такую разновидность болезней всё чаще встречающейся.

Подтип, заслуживающий пристального внимания и медицинских исследований – М4-миеломоноцитарный. По статистике он составляет до 15% от всех ОМЛ. Большая часть заболевших составляют латиноамериканцы в возрастной категории около 30 лет.
Хронический тип
Основным отличием хронического миелоидного лейкоза от острого является место скопления мутировавших лимфоцитных бластных клеток.
Хронический миелобластный лейкоз (ХМЛ) – это злокачественная патология, для которой характерно нерегулируемое деление зрелых и юных нейтрофилов, эозинофилов и базофилов.
Быстро и бесконтрольно размножаясь в костном мозге, они скапливаются не в нём, а в крови. Именно этот факт способствует более благоприятному течению болезни и прогнозу продолжительности жизни.
Исторически, ХМЛ стал первым лейкозом у которого была установлена конкретная причина его зарождения. По месту работы её первооткрывателей, эту специфическую мутацию 8 и 22 хромосом назвали «филадельфийской».
Возрастная категория больных с хроническим типом миелоидного лейкоза более молодая, чем у ОМЛ – болезнь чаще всего диагностируют после 30-40 лет, а самое большое количество болеющих – 50-летние.
Признаки и симптомы
Как правило, оба типа миелоидных лейкозов дебютируют без симптомов и на первой стадии своего развития обнаруживаются случайно – при выполнении общего (клинического) анализа крови, обусловленного плановой диспансеризацией или другими причинами. Если при таком исследовании фиксируется повышенное содержания базофилов, эозинофилов, разного «возраста» гранулоцитов и созревших миелоидных клеток, то можно предположить, что есть вероятность миелоидного лейкоза.
При сравнении симптомов острого и хронического разных типов миелобластных лейкозов, можно найти как одинаковые признаки, так и характерные отличия. Для острого типа характерны следующие симптомы:
- повышенная и быстрая утомляемость;
- потеря аппетита и веса тела;
- бледность кожных покровов;
- лихорадочные состояния;
- снижение сопротивления инфекциям;
- кровоточивость и подкожные гематомы;
- селезёнка и печень не увеличены;
- боль в костях и суставах;
- увеличение лимфоузлов встречается редко;
- у 10% развивается кожный лейкоз;
- синдром Свита – красные бляшки и папулы на лице;
- синдром ДВС.
Хронический миелобластный лейкоз, в его второй (хронической) фазе, можно распознать по таким симптомам:
- чувство переполнения живота;
- общее недомогание;
- потливость;
- снижение веса тела;
- подагра;
- учащение случаев инфекционных болезней;
- изменение количества тромбоцитов;
- повышенная кровоточивость;
- увеличение объёма селезёнки и печени;
- сердечные боли и аритмия;
- длительное повышение температуры в пределах 37,1-37,5 °C.
Диагностика
Для уточнения диагноза по типу и дифференциации подтипа применяются следующие диагностические методы и лабораторные анализы:
- биохимиия крови с лейкоцитарной формулой и СОЭ;
- цитостатика и цитохимия лейкоцитов крови и состава костного мозга, в том числе с применением светового микроскопирования, поточной цитометрии и флуоресцентной гибридизации in situ.
В диагностике ОМЛ важно точно установить тип и подвид лейкоза, а также отбросить наличие предлейкозных состояний, поскольку все они лечатся по-разному.
Для хронического типа важно квалифицировано определить присутствие филадельфийской хромосомы. Зачастую, такая аномалия может маскироваться другими дефектами.
Лечение острого и хронического миелоидного лейкоза
Лечение острого миелобластного лейкоза состоит из двух этапов:
- Индукция – направлен на уничтожение изменённых клеток. Для всех подтипов ОМЛ (исключение МЗ) применяется индукционная химиотерапия «7+3» (цитрабин + антрациклиновый антибиотик в первые 3 дня).
- Консолидация – длительное поддерживающее лечение, основная цель которого состоит в закреплении достигнутой полной ремиссии, преодолении последствий химиотерапии и предотвращении рецидивов. В зависимости от подтипа ОМЛ и состояния больного это может быть дополнительные 3-5 курсов химиотерапии или трансплантация стволовых клеток (в случае предшествование миелодисплазии или первичном рецидиве).
Своевременно начатое лечение хронического миелобластного лейкоза позволяет остановить развитие болезни в его второй фазе и не дать наступить следующим – фазе акселерации и бластному кризу, которые могут перерасти в ОМЛ.
Первичная (таргетная) терапия ХМЛ состоит в применении ингибиторов тирозинкиназы. Второй и самый главный метод – трансплантация гемопоэтических стволовых клеток. Если больному не показана трансплантация, то применяют гидреа- и интерферон-альфа-с или без цитарабина.
Прогноз выживаемости
Острый тип
Для острого миелобластного лейкоза общий долгосрочный прогноз выживаемости колеблется в пределах от 20 до 40 процентов, а для молодых пациентов, перенёсших трансплантацию – от 40 до 50%. Для детей (до 15 лет) прогноз лучше, чем у взрослых. Можно рассчитывать на 5-летнюю выживаемость в 70%.
Самый неблагоприятный прогноз для жизни – всего лишь 15% и частотой возникновения рецидивов около 80%, можно отнести к ОМЛ с мутациями в 3,5 и 7 хромосомах. Лучшими шансами обладают больные с подтипами М2, М3 и М4. У них 5-летняяя выживаемость равна 70%, а риск развития рецидива снижен до 30%.
Хронический тип
Для хронического миелоидного лейкоза прогноз гораздо выше:
- 5-летняя выживаемость при своевременно начатой терапии «7+3» – 90%;
- при пересадке костного мозга – более 15 лет.
Если же ХМЛ вовремя не диагностировали, то прогноз для продления жизни крайне неблагоприятен.
Как развивается миелолейкоз
Если представить себе роль костного мозга, как производителя всего многообразия кровяных телец, то миелолейкоз будет выглядеть некой диверсией на этом отлаженном производстве.
Дело в том, что нарушение работы костного мозга при миелоидном лейкозе сопровождается выбросом в систему производства крови огромного числа «несозревших», или недоразвитых белых кровяных телец миелобластов – лейкоцитов, которые еще не обрели свою иммунную функцию, но при этом стали бесконтрольно размножаться. В результате такой мутации нарушается слаженный процесс регулярного обновления лейкоцитов в крови и начинается быстрое вытеснение полноценных кровяных телец аномальными клетками-предшественниками. При этом вытесняются не только лейкоциты, но и красные кровяные тельца (эритроциты), и тромбоциты.
Разновидности миелоидного лейкоза
Ввиду того, что сама по себе мутация клеток крови редко развивается в организме в «чистом» виде, но чаще всего сопровождается другими мутациями стволовых клеток и прочими патологиями, существует множество различных форм и видов миелолейкозов.
Если до недавних времен насчитывалось 8 основных видов, разделенных в соответствии с происхождением лейкозных образований, то сегодня учитываются и мутации, произошедшие в клетках на генетическом уровне. Все эти нюансы влияют на патогенез и прогнозы продолжительности жизни при той или иной форме болезни. Кроме того, определение разновидности заболевания острый миелоидный лейкоз позволяет выбрать релевантную схему лечения.
Согласно ФАБ, варианты миелолекоза выделены в следующие подгруппы:
| Острый не дифференцированный лейкоз | M0 |
| Острый миелобластный лейкоз без признаков созревания | M1 |
| Острый миелоидный лейкоз с признаками созревания | M2 |
| Острый промиелоцитарный лейкоз | M3 |
| Острый миеломонобластный лейкоз | M4 |
| Острый монобластный лейкоз | M5 |
| Острый эритроцитарный лейкоз | M6 |
| Острый мегакарциоцитарный лейкоз | M7 |
Особенности острого промиелоцитарного лейкоза
ОПЛ, или ОПМЛ, расшифровывающийся как острый промиелоцитарный лейкоз, относится к подвиду миелолейкоза M3 в соответствии с ФАБ (франко-американо-британской классификацией). При этом злокачественном заболевании в крови и костном мозге пациентов скапливается аномальное количество промиелоцитов, являющихся несозревшими гранулоцитами.
Острый промиелоцитарный лейкоз определяется по типичной транслокации хромосом, приводящей к образованию аномальных онкопротеинов и бесконтрольному делению мутированных промиелоцитов. Был обнаружен в середине XX века и долгое время считался одной из фатальных и сверх-острых форм миелолейкоза.
В настоящее время острый промиелоцитарный лейкоз показывает уникальный ответ на такие средства лечения как триоксид мышьяка и транс-ретиноевая кислота. Благодаря этому ОПЛ стал одним из самых благоприятно прогнозируемых и излечимых подвидов заболевания острый миелоидный лейкоз.
Прогноз продолжительности жизни при этом варианте ОМЛ в 70% случаев составляет 12 лет без обострений.
Диагностируется промиелоцитарный лейкоз путем исследований костного мозга, анализа крови и дополнительных цитогенетических исследований. Наиболее точную диагностическую картину удается получить благодаря исследованию ПЦР (полимеразной цепной реакции).
Характеристики острого монобластного лейкоза
Острый монобластный лейкоз относится к межобластной форме ОМЛ в соответствии с классификацией ФАБ – вариант M5, который в 2,6% случаев встречается у детей и в 6-8% случаев у взрослых (чаще всего – пожилых).
Показатели клинической картины практически не отличаются от острого миелолейкоза, хотя общие симптомы дополняются более выраженной интоксикацией и высокой температурой тела.
Также аболеванию характерны признаки нейтропении с преобладанием некротических изменений слизистой носоглотки и ротовой полости, а также воспаления языка.
Основным очагом локализации заболевания является костный мозг, однако наблюдается еще и увеличение селезенки и отдельных групп лимфоузлов. В дальнейшем возможно возникновение инфильтрации десны и миндалин, а также метастазирования опухоли во внутренние органы.
Однако при своевременном проведении анализов, обнаружении злокачественной патологии и применении современных схем лечения, в 60% случаев прогнозируется значительное улучшение состояния больного.
Характеристика эозинофильного лейкоза
Острый эозинофильный лейкоз развивается вследствие злокачественной трансформации эозинофилов и может протекать на фоне аденокарциномы щитовидной железы, матки, кишечника, желудка, рака бронхов и носоглотки. Эта разновидность миелолейкоза схожа с реактивной эозинофилией, присущей острому лимфобластному (ОЛЛ) или миелобластному лейкозам. Поэтому для дифференциации диагностики прибегают к исследованиям специфических клеточных маркеров крови.
Наиболее характерными для этого подвида миелолейкоза являются увеличение числа эозинофилов и базофилов в анализе крови, и разрастание размеров печени и селезенки.
Особенности миеломоноцитарного лейкоза
Особую озабоченность современных онкогематологов вызывает такая подгруппа ОМЛ, как миеломоноцитарный лейкоз, разновидности которого чаще всего поражают детскую возрастную категорию. Хотя среди пожилых слоев населения риск заболевания этим видом миелолейкоза также высок.
Миелоцитарному лейкозу свойственно острое и хроническое течение, а одной из форм хронического вида является ювенильный миеломоноцитарный лейкоз, характерный для детей от первого года жизни до 4 лет. Особенностью этого подвида является частота его развития у маленьких пациентов и большая склонность к заболеванию мальчиков.
Почему развивается миелолейкоз
Несмотря на то, что точных причин возникновения лейкозов установить до сих пор не удается, в гематологии существует определенный список провоцирующих факторов, которые способны оказать деструктивное влияние на деятельность костного мозга:
- радиационное облучение;
- неблагоприятные экологические условия проживания;
- работа на вредном производстве;
- влияние канцерогенов;
- побочные действия от химиотерапии при других формах рака;
- хромосомные патологии – анемия Фанкони, синдромы Блума и Дауна;
- наличие таких патологий как вирус Эпштейна-Барра, лимфотропный вирус или ВИЧ;
- другие состояния иммунодефицита;
- вредные привычки, особенно курение родителей больного ребенка;
- наследственный фактор.
Как проявляется миелоидный лейкоз?
Ввиду того что симптоматика миелолейкозов разнится в зависимости от форм и разновидностей ОМЛ, выделение общих клинических показателей в категорию симптомов весьма условно. Как правило, первые тревожные сигналы обнаруживаются в результатах анализа крови, что заставляет врача назначить дополнительные методы диагностики.
ОМЛ у детей
В случае с маленькими детьми, наиболее подверженными такой разновидности как ювенильный миеломоноцитарный лейкоз, наличие следующих симптомов должно насторожить родителей и заставить обратиться к врачу:
- Если ребенок плохо прибавляет в весе;
- Если имеются задержки или отклонения в физическом развитии;
- Повышенная утомляемость, слабость, бледность кожи на фоне железодефицитной анемии;
- Наличие гипертермии;
- Частые инфекционные поражения;
- Увеличение печени и селезенки;
- Припухлость периферических лимфатических узлов.
Конечно, наличие одного или нескольких вышеуказанных симптомов не означает, что у ребенка точно развивается ювенильный миелоцитарный лейкоз, ведь такие показатели характерны многим другим болезням. Но, как известно, лечение сложных заболеваний наиболее эффективно на ранних стадиях, поэтому сдать анализы крови и пройти другие диагностические процедуры будет не лишним.
ОМЛ у взрослых
У взрослой категории пациентов, особенно в возрасте старше 50 лет, миелолейкозы проявляются следующими симптомами:
- хронической усталостью, общей слабостью;
- потерей веса и аппетита;
- склонностью к внутренним кровоизлияниям, появлению синяков, повышенной кровоточивостью;
- повышенной хрупкостью костей;
- частыми головокружениями и ознобом;
- неустойчивостью к инфекционным патологиям;
- тошнотой;
- постоянной бледностью.
Понятно, что и эти симптомы не могут служить единственным фактором в определении ОМЛ, поэтому не стоит самостоятельно диагностировать у себя рак.
Диагностические процедуры при ОМЛ
Первым и основополагающим диагностическим мероприятием для верификации миелоидного лейкоза является развернутый анализ крови. При обнаружении патологического разрастания определенных групп кровяных телец назначается костномозговая биопсия. Для определения распространения раковых клеток в организме используются:
- рентгеновское и ультразвуковое исследования;
- скелетная сцинтиграфия;
- компьютерная и магнитно-резонансная томография.
Как правило, все диагностические процедуры проводятся в клиниках гематологии и онкологии, и при подтверждении диагноза ОМЛ немедленно составляется план лечения. Поскольку патогенез (протекание) разных форм болезни различается на клеточно-молекулярном уровне, прогноз продолжительности жизни пациента целиком зависит от точности диагноза и адекватности выбранного способа лечения.
Терапевтические меры
Сегодня лечение миелолейкоза состоит из 4 этапов терапевтических мер:
- Индукционный с интенсивным применением химиотерапии, призванной в кратчайшие сроки уничтожить как можно большее количество миелобластных клеток для достижения ремиссионного периода.
- Консолидационный с интенсивной терапией комбинированных и дополнительных химиотерапевтических доз для уничтожения оставшихся опухолевых клеток, и снижения риска возвращения болезни.
- Лечение центральной нервной системы, проводимое с целью недопущения лейкозных клеток в области спинного и головного мозга, для профилактики метастазирования. При падании лейкозных клеток в ЦНС может быть назначен курс лучевой терапии.
- Пролонгированная поддерживающая терапия, назначаемая на длительный период (год и более) и проводимая в амбулаторных условиях с целью уничтожения выживших раковых клеток.
Побочные эффекты химиотерапии
Несмотря на результативность химиотерапевтического лечения, не каждый пациент соглашается на применение высоких доз химиотерапии, поскольку у этой методики есть существенный недостаток – побочные осложнения.
- Наиболее частым побочным явлением считается цитопения, развивающаяся в результате нарушения кроветворного процесса (миелотоксичности). Большую опасность представляет возникновение лейкопении, поскольку из-за нехватки белых кровяных телец организм теряет иммунную защиту от инфекционных поражений, сопряженных с опасностью для жизни.
- Не меньшую проблему (иногда даже фатальную) составляют подтвержденные анализами тромбоцитопения и железодефицитная анемия, в борьбе с которой организм иногда перенасыщают элементами железа, что приводит к вторичным изменениям внутренних органов.

- Прием цитостатиков приводит к тошноте и рвотам, крайне плохо переносимым пациентами. Продолжительные рвоты приводят к обезвоживанию и нарушению электролитного баланса, анорексии (полной потере аппетита) и даже желудочным кровотечениям.
- Частым проявлением побочного эффекта является алопеция (облысение), поражение почек и сердечной мышцы, желтуха, изъязвления слизистых и другие симптомы побочных осложнений, которые возникают в зависимости от возраста пациента, стадии заболевания, комбинации препаратов и других факторов.
Можно ли победить лейкоз?
О полной победе над лейкозами сегодня говорить еще рано. Но увеличение продолжительности жизни после интенсивных методов терапии хотя бы на 5-7 лет отмечают в среднем у 60% больных. Правда, прогнозы для пациентов старше 60 лет не поднимаются выше 10%-ного показателя. Поэтому не стоит ожидать наступления преклонного возраста для того, чтобы вплотную заняться собственным здоровьем. Проходить профилактические осмотры, следить за своим питанием и образом жизни, сдавать кровь и мочу на анализы нужно регулярно.
симптомы, что это такое, прогноз, лечение
Миелоидный лейкоз хронический (ХМЛ) — это крайне опасное онкологическое заболевание системы кроветворения, характеризующееся поражением клеток костного мозга. В норме в этом органе происходит выработка лейкоцитов, тромбоцитов и эритроцитов.

Прогрессирование данного заболевания приводит к появлению незрелых бластов, отличающихся измененной структурой. Эти элементы блокируют рост нормальных клеток крови. Незрелые клетки в дальнейшем провоцируют нарушение работы костного мозга и начинают накапливаться во всех органах.
Причины
Точные причины развития этого заболевания еще не установлены. Большинство исследователей такого патологического состояния, как хронический миелобластный лейкоз, сходятся во мнении, что проблема кроется в приобретенной мутации в хромосоме всего 1 клетки костного мозга. Возможно, такой сбой происходит при случайном обмене генетическим материалом между клетками, которые располагаются рядом, но находятся на разных стадиях развития. От других форм лейкоза это нарушение отличает возможностью созревания молодых злокачественных до зрелых форм.
По мере прогрессирования заболевания наблюдается снижение числа большинства разновидностей лейкоцитов, отвечающих за иммунитет. При этом вырабатываются в большом количестве гранулоциты, которые в норме отвечают за поглощение чужеродных частиц и принимают участие в аллергических реакциях и воспалительных процессах.
Несмотря на то, что механизм появления мутации в стволовой клетке костного мозга еще не до конца изучен, выделяется ряд факторов, которые могут способствовать развитию данного нарушения. К ним относятся:
Как часто Вы сдаете анализ крови?Poll Options are limited because JavaScript is disabled in your browser.Только по назначению лечащего врача 30%, 1223 голоса
1223 голоса 30%
1223 голоса — 30% из всех голосов
Один раз в год и считаю этого достаточно 17%, 688 голосов
688 голосов 17%
688 голосов — 17% из всех голосов
Только когда болею 16%, 632 голоса
632 голоса 16%
632 голоса — 16% из всех голосов
Как минимум два раза в год 15%, 610 голосов
610 голосов 15%
610 голосов — 15% из всех голосов
Чаще чем два раза в год но меньше шести раз 11%, 445 голосов
445 голосов 11%
445 голосов — 11% из всех голосов
Я слежу за своим здоровьем и сдаю раз в месяц 6%, 252 голоса
252 голоса 6%
252 голоса — 6% из всех голосов
Боюсь эту процедуру и стараюсь не сдавать 4%, 170 голосов
170 голосов 4%
170 голосов — 4% из всех голосов
Всего голосов: 4020
21.10.2019
×
Вы или с вашего IP уже голосовали.- радиационное излучение;
- длительный прием противоопухолевых препаратов;
- воздействие некоторых химических веществ;
- вирусные заболевания;
- длительная инсоляция;
- воздействие электромагнитного излучения.

В особую группу риска входят люди, страдающие синдромом Дауна и Клайнфельтера. Особенно часто хронический миелоидный лейкоз диагностируется у пациентов, имеющих наследственную форму данных генетических заболеваний. Чаще эта опухоль системы кроветворения развивается у людей от 45 до 55 лет. У детей встречается крайне редко.
Симптомы
Симптомы хронического миелоидного лейкоза различаются в зависимости от стадии запущенности процесса. На начальных стадиях патологии наблюдается снижение гемоглобина. Это приводит к появлению признаков нормохромной нормоцитарной анемии. При исследовании мазков крови выявляется преобладание незрелых гранулоцитов. При этом присутствуют отклонения в степени зернистости и составе цитоплазмы.
Хроническая стадия
Средняя продолжительность течения хронической стадии составляет от 2 до 3 лет. В редких случаях она затягивается на 10 лет. На этой стадии не наблюдается появления выраженных признаков заболевания. На наличие патологии могут указывать следующие симптомы:
- общая слабость;
- апатия;
- снижения работоспособности;
- чувство тяжести в животе;
- небольшое недомогание.

При проведении исследований крови могут быть выявлены некоторые отклонения. В ряде случаев обнаруживается увеличение размеров селезенки и появление болей в правом подреберье. Кроме того, могут появляться симптомы общей интоксикации организма.
Акселеративная
О переходе заболевания в эту стадию процесса свидетельствует не только ухудшение лабораторных показателей, но и стремительное нарастание клинических проявлений. Общее состояния человека, страдающего хроническим миелоидным лейкозом, стремительно ухудшается. Клиническая картина акселеративной стадии включает следующие симптомы:
- нарастание слабости;
- увеличение селезенки и печени;
- бледность кожных покровов;
- приступы головокружения;
- ночная потливость;
- частые носовые кровотечения;
- петехиальные высыпания на коже.
Кроме того, наблюдается повышение температуры тела до 37-38°C. На этой стадии процесса у пациентов стремительно снижается масса тела. Продолжительность этой стадии заболевания в среднем составляет около года.
Терминальная
Терминальная стадия характеризуется резким ухудшением общего состояния пациента. Могут быть выявлены дополнительные хромосомные аномалии. Таким образом, моноклональная опухоль преобразовывается в поликлональную. При проведении анализов крови может быть выявлено множество клеток, отличающихся атипичным строением. При этом нарастает угнетение нормальных ростков кроветворения, поэтому функционировавших клеток становится мало.

На этой стадии заболевания присутствуют выраженные симптомы тромбоцитопении и анемии. При терминальном лейкозе усиливаются все ранее присутствовавшие симптомы. Пациенты теряют аппетит. Стремительно снижается масса тела. Может развиться кахексия. Часто на этой стадии процесса возникают инфекционные осложнения и массированные кровотечения.
Уделите время для прохождения онлайн тестов:
Диагностика
Для постановки диагноза проводится оценка имеющейся у пациента симптоматики и результатов лабораторных исследований крови. Общий анализ крови позволяет определить количество всех типов элементов. При хронической лейкемии выявляется повышенный уровень незрелых белых клеток и уменьшение количества тромбоцитов и эритроцитов. При проведении биохимического анализа выявляются признаки дисфункции селезенки и печени из-за проникновения в них раковых клеток.
Для подтверждения диагноза часто назначается цитогенетический анализ, позволяющий исследовать хромосомный набор и выявить аномалию. Этот метод помогает точно определить тип лейкоза. Кроме того, нередко выполняются анализы гибридизации и полимеразной цепной реакции. Может проводиться биопсия костного мозга. К дополнительным исследованиям, применяющимся для оценки состояния внутренних органов, относятся КТ, МРТ и УЗИ.
Как лечить
Лечение хронического миелоидного лейкоза подбирается с учетом стадии запущенности процесса. На раннем этапе может быть рекомендовано применение витаминов и минералов, а также других препаратов, обладающих общеукрепляющим действием. В этот период течения болезни рекомендована специальная диета. При появлении признаков перехода заболевания в акселеративную стадию требуется химиотерапия и облучение. При быстром прогрессировании патологии назначаются процедуры удаления селезенки и пересадки костного мозга.

Лечение лекарствами
Проведение химиотерапии позволяет уменьшить число аномальных клеток крови и улучшить общее состояние пациента. Терапия проводится цитостатиками и интерферонами. К наиболее часто использующимся медикаментам относятся:
- Миелосан.
- Аллопуринол.
- Миелобромол.
- Бусульфан.
- Милеран.
- Гидреа.
- Гидроксиуреа.
- Литалир.
- Интерферон альфа.
- Цитозар.
- Спрайсел.
- Гливек.
Несмотря на то, что химиотерапия крайне эффективна при лечении данной опухоли крови, применение этих препаратов приводит к появлению сильнейших побочных реакций. У пациентов может присутствовать рвота, тошнота, диарея, снижение массы тела, боли в мышцах, депрессивные расстройства и другие симптомы.
Пересадка костного мозга
Трансплантация костного мозга у более половины пациентов позволяет излечить заболевание. В остальных случаях такая терапия помогает увеличить продолжительность жизни больных. Материал для пересадки может браться как у родственного, так и неродственного донора. Подготовительный этап занимает около 10 дней. В этот период проводится химио- и лучевая терапия для уничтожения максимального количества раковых клеток.

После подготовки выполняется процедура пересадки. Еще примерно 4 недели пациент должен провести в условиях стерильной комнаты, т. к. в этот период наблюдается сильное снижение иммунитета. По мере приживления донорских клеток состояние человека стабилизируется.
Лучевая терапия
Лучевая терапия назначается, когда применение препаратов химиотерапии не дает положительного результата. В первую очередь выполняется облучение селезенки. Режим и доза облучения подбирается врачом индивидуально.
Удаление селезенки
При этом патологическом состоянии удаление селезенки, т.е. спленэктомия, выполняется редко. Показанием для данного метода лечения является выраженная тромбоцитопения и некротическое поражение данного органа. Наиболее часто оперативное вмешательство назначается на терминальной стадии заболевании, когда удаление селезенки позволяет устранить из организма и большинство злокачественных клеток, которые накапливаются в этом органе.
Очистка крови
Для улучшения состояния пациента и устранения из крови лейкоцитов часто назначается лейкоферез. Эта процедура предполагает забор крови у пациента, которая пропускается через специальную центрифугу, чтобы отделить патологические компоненты. После этого кровь подогревается и возвращается в тело больного. Данная процедура позволяет избежать развития тяжелых осложнений.

Осложнения и прогноз
Миелоидный лейкоз часто осложняется массированными кровотечениями. Из-за снижения уровня функциональных лейкоцитов повышен риск развития тяжело протекающих инфекций. Данный онкологический процесс может создать условия для формирования микротромбозов. К опасным осложнениям относится отек сетчатки.
Прогноз жизни зависит от многих факторов, в т. ч. возраста и своевременности начала лечения. Средняя продолжительность жизни составляет около 3 лет. При интенсивной терапии пациенты живут около 5 лет. Только у 25% больных удается добиться длительной ремиссии.
ДВС синдром
Этот синдром развивается из-за гибели большого количества лейкозных клеток. Это приводит к поражению тромбами мелких кровеносных сосудов. Для устранения проявлений ДВС синдрома требуется введение глюкокортикоидов и Гепарина.
Ретиноидный синдром
Данное состояние сопровождается скоплением выпота в перикардиальной и плевральной полостях, появлением лихорадки и одышки. Наблюдается падение АД. Если миелолейкоз сопровождается ретиноидным синдромом, велика вероятность летального исхода.
стадии, виды и составление лечебной программы
Миелоидный (миелобластный) лейкоз – одно из заболеваний, поражающее клетки крови. Новообразования поражают не только кровь, но и другие внутренние органы, нарушая нормальную работу организма.
Отличительные черты недуга

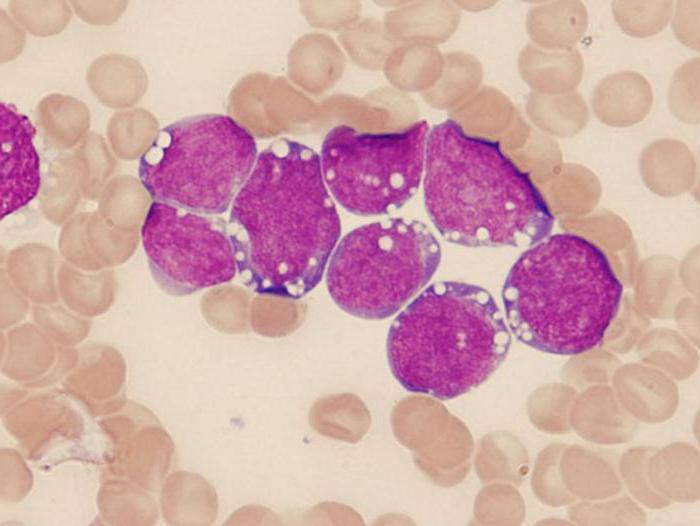
Вид крови под микроскопом, пораженной раковыми клетками
Лейкоциты в организме человека ведут борьбу с инфекциями, обеспечивая ему защиту. При раке крови белые клетки мутируют, перерождаясь, они начинают быстро расти, становятся причиной нарушений в работе организма. Когда в крови скапливается большое количество неправильно развитых лейкоцитов, развивается такое заболевание, как лейкоз.
Этой болезни подвержены люди разного пола и разного возраста.
Недуг имеет две формы:
- острая;
- хроническая.
В отличие от других онкологических заболеваний, где острая форма может переходить в хроническую стадию, формы миелоидного типа не переходят друг в друга. Это разные болезни со своими особенностями.
Острый миелоидный лейкоз характеризуется чрезмерным ростом незрелых, бластных клеток. Процесс развития болезни очень стремительный и требует своевременного лечения.
Острый лейкоз имеет несколько стадий течения:
| Начальная | Часто протекает незамеченной. При проведении лабораторных исследований, могут наблюдаться изменения в биохимических показателях крови. У пациента обостряются хронические болезни, развиваются бактериальные инфекции |
| Развернутая стадия | Проявляются симптомы болезни. В некоторых случаях наблюдается чередование обострения и стадии ремиссии. Часто заканчивается полной ремиссией. Если выздоровление не наступает, болезнь обостряется, переходит в третью стадию |
| Терминальная стадия болезни | Отличается глобальным нарушением процесса нормального кроветворения |
Острый миелоидный рак крови, заболевание, которое может развиться в любом возрасте, но чаще он свойственен возрастной категории старше 55 лет. Это одна из самых распространенных форм лейкоза среди детей и подростков. Это заболевание занимает второе место, уступая только острому лимфолейкозу. У детей острый миелоидный лейкоз составляет почти 20%.
Хроническая форма миелоидного лейкоза отличается чрезмерным патологическим ростом зрелых и созревающих клеток лейкоцитарного ряда. Болезнь протекает очень медленно, не имеет на первых стадиях ярко выраженных симптомов. Часто диагноз устанавливается случайно, при лабораторном исследовании крови по поводу другого заболевания. Хронический лейкоз, как и острый, также имеет 3 стадии:
| Доброкачественная | Может длиться несколько лет без проявления каких-либо симптомов, проявляется постоянным увеличением уровня лейкоцитов |
| Развернутая | Наблюдаются клинические признаки болезни, количество лейкоцитов увеличивается |
| Терминальная | У больного резко ухудшается здоровье, наблюдается низкая чувствительность к назначенной терапии, развиваются инфекционные осложнения |
Хронической формой чаще всего болеют взрослые люди, но у детей он тоже встречается. На долю детей приходится около 2% случаев.
Группа хронических миелоидных лейкозов включает хроническую форму моноцитарного рака крови, эритромиелоз, сублейкемический миелоз, другие миелоидные лейкозы.
Сублейкемический вариант хронического миелоидного лейкоза чаше всего наблюдается у пациентов в пожилом возрасте. Заболевание сопровождается разрастанием соединительной ткани костного мозга, что в итоге приводит к его замещению рубцовой соединительной тканью. Особенностью течения болезни является отсутствие жалоб в течение многих лет. С развитием недуга у больного могут наблюдаться следующие симптомы:
- увеличение размера селезенки;
- общая слабость;
- покраснение кожи лица;
- быстрая утомляемость;
- частые боли в суставах;
- головные боль.
Проявляется геморрагический синдром, который обусловлен нарушением способности крови к свертыванию.
1 стадия характеризуется:
- незначительным увеличением размера селезенки;
- легкой анемией;
- повышением уровня тромбоцитов.
2 стадия сублейкемического варианта хронического миелоидного лейкоза, промежуточная, характеризуется:
- существенным увеличением размера селезенки;
- анемией легкой степени тяжести;
- присутствием в крови пациента каплевидных эритроцитов;
- отсутствием неблагоприятных факторов.
3 стадия, продвинутая, характеризуется:
- анемией средней степени тяжести;
- наличием одного или более неблагоприятных факторов.
Чаще всего эта болезнь является доброкачественной. С установленным диагнозом при условии правильно назначенной терапии, продолжительность жизни больного может достигать 20-30 лет. При неблагоприятном варианте, когда заболевание имеет стремительное развитие, наблюдается резкое увеличение размеров селезенки, состояние больного отягощается сопутствующими осложнениями. Присоединение вторичных инфекций, резкая дистрофия, недостаточность кроветворения часто становятся причиной летального исхода.
Причины болезни
Что является причиной возникновения миелоидного лейкоза, на данный момент не существует. Однако установлен ряд причин, существенно увеличивающих риск развития заболевания.
Консультация израильского онкологаТакими причинами могут быть генетические проблемы, такие как синдром Дауна, нейрофиброматоз. Заболевание, особенно его острая форма, часто наблюдается у детей, прошедших курс химиотерапии или лучевой терапии по поводу другого диагноза.
Лейкоз: основные симптомы
Симптомы миелоидного лейкоза подобны симптомам других видов лейкозов. Для острой формы болезни характерно их быстрое проявление. К ним можно отнести:
- легко образующиеся гематомы, частые подкожные кровоизлияния, кровоточивость десен;
- повышенная температура;
- ночные потоотделения;
- бледность кожи;
- сильная одышка при ходьбе, легких физических нагрузках;
- стремительное снижение веса;
- утомляемость;
- частые и сильные боли в суставах;
- учащенное сердцебиение.
Хронический миелоидный лейкоз на начальной стадии протекает бессимптомно. Только результат анализа крови может указать на развитие данной патологии. Часто больные жалуются на общее недомогание, тяжесть после приема пищи.

При любом изменении в организме и самочувствии, следует незамедлительно обращаться к врачу
Для развернутой стадии характерными симптомами являются:
- упадок сил;
- снижение веса;
- обильное потоотделение;
- повышенная температура;
- расстройство желудка;
- увеличение размеров печени.
Терминальная стадия, проявляются следующие симптомы:
- увеличение размеров селезенки;
- резкое повышение температур;
- кровоизлияния под кожей;
- снижение массы тела;
- отсутствие реакции на проводимое лечение.
Показатели лабораторных исследований дадут четкую картину заболевания.
Общий анализ крови выявит:
- снижение уровня эритроцитов;
- снижение уровня ретикулоцитов;
- лейкоциты имеют сильные колебания, от высоких до низких показателей;
- уровень тромбоцитов снижен;
- отсутствие базофилов и эозинофилов в периферической крови;
- повышенный уровень СОЭ.
Анализ костного мозга отражает:
- более 20% наличия миелобластных клеток;
- снижение уровня других ростковых клеток костного мозга.
Лечение недуга
Лечение хронического миелоидного лейкоза не требует госпитализации и может проводиться в амбулаторных условиях. Терапия назначается сразу, после установления диагноза. При хронической фазе основным заданием терапии есть снижение уровня лейкоцитов.

Процедура пересадки стволовых клеток, как один из методов лечения болезни
Лечение данного заболевания возможно путем:
- пересадки стволовых клеток;
- химиотерапии;
- симптоматической терапии.
Первый курс лечения предполагает прохождение химиотерапии, что позволяет уничтожить пораженные патологией раковые клетки. Курс химиотерапии не является гарантией полного излечения. Трансплантация костного мозга позволяет говорить о полном выздоровлении, но ремиссия может длиться достаточно длительный период. Химиотерапия является единственным методом лечения если:
- из-за физического состояния противопоказана лучевая терапия;
- больной отказывается подвергать себя высокому риску;
- невозможно найти донора.
Химиотерапия кроме пораженных клеток разрушает и клеток костного мозга. Пересадка донорских клеток является очень эффективной методикой лечения. Производится отбор и заморозка клеток. При благополучной пересадке клетки начинают приживаться в организме. Далее идет их созревание и развитие. Из них получаются полноценные элементы крови. Существуют 2 способа пересадки клеток: в одном из них используют донорские клетки, в другом – самого пациента.
Важно! Острый миелоидный лейкоз стремительно развивается, поэтому важно своевременно ставить правильный диагноз и назначать адекватное лечение.
Для данного вида болезни не существует промежуточных стадий. Различают вновь установленный диагноз, или заболевание на стадии ремиссии.

Важно помнить, что регулярное обращение к специалистам и осмотры помогут предотвратить недуг
Лечение состоит из двух фаз:
- фаза индукции: назначается терапия, направленная на уничтожение как можно большего количества пораженных клеток, что приводит к ремиссии;
- фаза постремиссии направлена поддержание положительного терапевтического эффекта.
Как в случае с хронической формой, лечение миелоидного вида проводится с использованием, следующих методов:
- химиотерапия;
- назначается курс лучевой терапии;
- проводится симптоматическое лечение;
- пересадка стволовых клеток.
Прогнозы на выздоровление
На прогноз течения миелоидного лейкоза могут влиять многие факторы. Он может ухудшается в случаях, когда:
- возраст пациента более 60 лет;
- имеет место другое онкологическое заболевание;
- наличие генетических мутаций в клетках;
- на момент постановки диагноза очень высокий уровень белых клеток;
- необходимость проведения двух и более курсов химиотерапии.
Внимание! Успешное лечение и благоприятный прогноз при миелоидном лейкозе имеет большую зависимость от возраста человека.
Взрослые люди с острым миелоидным лейкозом имеют следующий прогноз:
- выживаемость 5 лет для пожилых людей составляет в 25% случаев;
- для людей возрастом в 45 лет выживаемость составляет около 50% случаев, причем в некоторых случаях имеет место шанс на полное избавление от болезни;
- для возрастной категории старше 65 лет выживаемость в 5 лет составляет 12%;
- у пациентов более молодого возраста шансов больше на полное выздоровление.
Каким будет прогноз хронического миелоидного лейкоза, во многом зависит от стадии заболевания в момент постановки диагноза. Огромную роль играет реакция организма пациента на назначенный доктором курс лечения. Показатель продолжительности жизни в 5 лет при хроническом миелоидном лейкозе в среднем составляет 90%. Современные методы биологической терапии позволяет добиваться стойкой ремиссии. Если перечисленные методы лечения не возымеют должного эффекта, может быть применена пересадка стволовых клеток. Такая процедура продлевает срок жизни пациентов до 10-15 лет и больше. Неблагоприятный прогноз может быть в случаях крайне позднего выявления и диагностирования недуга.
что это такое? Хронический миелоидный лейкоз: причины, лечение, прогноз
Развитие опухолевых процессов с каждым годом набирает обороты. Большинство ученых мира изучают возможные факторы развития состояния и основные методы терапии для излечения пациентов, а профилактическими мероприятиями занимаются все виды лечебных учреждений. Развитие опухолевого процесса может коснуться любого органа или системы организма. Миелолейкоз – что это такое? Основные причины этого заболевания, методы диагностики и терапии рассмотрим далее.
Общие понятия
Система кроветворения основывается на созревании молодых клеток – тромбоцитов, эритроцитов и лейкоцитов в костном мозге. Параллельно с этим процессом происходит уничтожение старых клеток печенью и селезенкой.
Форменных элементов в крови столько же, сколько и плазмы. При этом самое большое количество приходится на белые кровяные клетки – лейкоциты. Они отвечают за реакцию организма на воздействие чужеродных агентов и соединений и позволяют поддерживать иммунную систему на должном уровне.
Неконтролируемая выработка большого количества лейкоцитов называется миелоидным лейкозом. Это опухолевое заболевание, которое сопровождается критическим увеличением в кровеносном русле незрелых форм. Со временем происходит распространение патологических форм клеток во все органы и системы организма, что вызывает прогрессирование болезни.
Этиология заболевания
На данном этапе однозначные факторы, приводящие к развитию заболевания, не определены. Существует несколько версий возникновения патологического состояния:
- Появление патологических клонов – это процесс развития патологических изменений в структуре стволовых клеток. Происходит мутация, во время которой клетки не только приобретают изменения в себе, но и передают их остальным структурам, создавая свои клоны. Это состояние излечить с помощью цитостатических препаратов невозможно.
- Воздействие химических веществ.
- Действие радиоактивного излучения на организм, которое происходит не только по профессиональной необходимости. Например, использование в анамнезе лучевой терапии для лечения другой опухоли.
- Прием цитостатиков и химиотерапевтических препаратов для терапии опухолей других органов может послужить пусковым механизмом развития миелолейкоза.
- Генетические заболевания, наследственность.
- Болезни, имеющие вирусный генез.

Кроме того, на появление опухолевого процесса влияют пол, возраст пациента и воздействие радиационного облучения в зоне проживания.
Хроническая форма болезни
Проявление симптоматики опухолевого процесса крови зависит от формы болезни. Наиболее распространенная форма – хронический миелоидный лейкоз. Это состояние имеет злокачественный характер.
Хронический миелолейкоз – что это такое? Это состояние, которое возникает вследствие того, что в организме появляется аномальный ген, который поражает кровяные клетки. Место локализации гена – костный мозг. С током крови происходит распространение патологических клеток по всем органам.
Заболевание не имеет острого начала и яркой клинической картины. Для него характерно медленное течение. Опасность состоит в том, что эта форма болезни может перейти в острую фазу в любой период, что может закончиться летальным исходом для пациента.
Миелоидный лейкоз имеет несколько стадий развития:
- хроническая;
- стадия акселерации;
- терминальная стадия.
Первая стадия хронической формы
Большинству пациентов ставят диагноз именно в этой стадии. Начало заболевания точно определить невозможно, поскольку оно имеет бессимптомный характер или легкие проявления. Сначала появляется утомляемость, тяжесть в желудке или в левом подреберье, одышка.
Во время приема пищи пациенты жалуются на чувство переполненности в эпигастрии. Пальпаторно ощущается увеличение селезенки. Осмотр сопровождается болезненными ощущениями со стороны селезенки, иррадиирущими в спину. В анализе крови определяется лейкоцитоз, нарастающий в динамике, а также тромбоцитоз и увеличение количества гранулоцитов.
Часто больные обращаются к врачу при развитии инфаркта селезенки. Появляется резкий болевой синдром в ее проекции, симптомы интоксикации организма, повышается температура тела.
Стадия акселерации
В этой стадии заболевание практически не имеет проявлений. У больного нет жалоб, кроме периодического подъема температуры до субфебрильных показателей и усталости. Продолжает увеличиваться уровень миелоцитов и лейкоцитов в крови.
Уровень базофилов увеличивается на треть. После этого больных начинает беспокоить чувство жара и желание чесаться. Это связано с увеличением выработки гистамина.
Острая стадия (терминальная)
Развитие третьей стадии описывает клиническую картину, схожую с острым течением болезни. Хронический миелоидный лейкоз прогрессирует, и появляется яркая клиническая картина. Пациенты жалуются на такие проявления:
- резкая слабость;
- высокая температура тела;
- боли в суставах;
- резкое уменьшение веса больного.
При обследовании пациента можно обнаружить увеличение различных групп лимфатических узлов, печени, селезенки, развитие геморрагического синдрома. Бластный криз – финальная стадия болезни, которая характеризуется следующими клиническими проявлениями:
- лимфо- или миелобластов становится больше на 20 % в костном мозге или кровеносном русле;
- биопсия костного мозга определяет большие группы бластов;
- развитие миелоидной саркомы – злокачественной опухоли из незрелых белых клеток крови.

На этой стадии заболевания жизнь пациента зависит исключительно от уровня паллиативной терапии.
Острый миелоидный лейкоз
Клиническая картина развивается быстро, имеет яркие признаки заболевания. Без назначения адекватной терапии результат может быть неблагоприятным уже по истечении нескольких недель или месяцев.
Острый миелолейкоз – что это такое? Это злокачественный опухолевый процесс миелоидного ростка крови. Больные клетки не способны противостоять инфекциям, хотя это является их основной функцией. Параллельно с увеличением бластных структур происходит уменьшение остальных форменных элементов крови.
Эритропения и недостаток гемоглобина проявляются бледностью кожных покровов, одышкой, усталостью. Снижение количества тромбоцитов приводит к увеличению склонности кожи к повреждениям, повышенной кровоточивости, появлению петехий и гематом.
Первые симптомы не являются специфичными. Очень легко перепутать их с проявлениями респираторной вирусной инфекции. Кроме того, острый миелолейкоз сопровождается прогрессированием болевых ощущений в костях и суставах.
Диагностические мероприятия
Успешность начала лечения зависит от скорости проведения диагностики и постановки правильного диагноза. Чтобы определить общее состояние и фазу заболевания пациента, у которого подозрение на миелолейкоз, анализы проводятся в следующих направлениях:
- Анализ периферической крови развернутый – фиксируется уровень всех форменных элементов крови в динамике.
- Биохимия крови показывает нарушения в работе печени и селезенки, которые вызваны развитием болезни.
- Биопсия костномозгового аспирата проводится после забора необходимого материала из бедренной кости. Определяется наличие бластных форм.
- Гибридизация позволяет определить мутационную или аномальную хромосому.
- ПЦР направлена на выявление аномального гена.
- Цитогенетические анализы направлены на определение аномальной хромосомы в лейкозной клетке.
- По необходимости проводится компьютерная томография, магнитно-резонансная томография и ультразвуковое исследование.
Принципы терапии заболевания
Миелоидный лейкоз требует безотлагательного начала лечения. Врач-онколог определяет схему терапии, исходя из стадии заболевания, его проявлений. На ранней стадии назначается витаминная диета, общеукрепляющие препараты.
Лечение миелолейкоза основывается на применении препаратов, способных угнетающе действовать на онкоген. Основные средства:
- «Иматиниб» — средство угнетает активность белка, который вырабатывается онкогеном миелолейкоза;
- «Дазатиниб» — препарат используется в случае неэффективности или непереносимости пациентом «Иматиниба»;
- «Нилотиниб» — средство с аналогичным действием, относящееся ко второму поколению онкогенных ингибиторов;
- «Понатиниб» — один из новых препаратов, сильный по своей эффективности против бластных клеток, но способен вызывать тяжелые осложнения со стороны организма больного.
Также для укрепления иммунной системы пациентам назначается прием «Интерферона». Препарат не способен самостоятельно справиться с заболеванием, однако его применяют в комплексной терапии в виде ежедневных подкожных инъекций.
Химиотерапия проводится с использованием цитостатических средств. Эту часть терапии используют как дополнительное лечение при трансплантации клеток костного мозга. Эффективными считаются «Гидроксикарбамид», «Бусульфан», «Винбластин», «Винкристин», «Цитарабин».
Облучение при онкологии проводится при помощи высокоэнергетических лучей, а также их частиц. Применяется индивидуально, в зависимости от необходимости. При миелолейкозе лучевая терапия используется для уменьшения болевых синдромов в костях и суставах. Также облучение при онкологии кроветворной системы используют перед трансплантацией костного мозга.
Трансплантация клеток костного мозга
Хирургическое вмешательство является довольно распространенным методом лечения, но при этом дорогостоящим. Не каждый пациент в состоянии себе это позволить. Онкоцентр на Каширке – один из знаменитых институтов терапии опухолевых новообразований – проводит подобные оперативные вмешательства, помогая излечиться своим пациентам.
Пересадка самого костного мозга сейчас используется не так часто, как трансплантация стволовых клеток, которые берут из периферической крови. Существуют два варианта проведения процедуры:
- Используют гемопоэтические клетки костного мозга донора. Это может быть кто-то из родственников, поскольку достаточно тяжело найти подходящего донора, который не состоял бы в родственных связях с больным.
- Пересадка собственных периферических клеток. Эта процедура сложна тем, что вместе со здоровыми клетками могут быть изъяты и бластные.
Онкоцентр на Каширке не только проводит хирургические вмешательства, которые позволили снизить смертность пациентов, но и использует современные методы термоаблации, криотермоаблации и радиоволновой хирургии.
Заключение
В статье был рассмотрен термин «миелолейкоз». Что это такое, вам теперь известно. Благоприятный исход возможен при полном курсе лечения начальных стадий заболевания. Терминальная стадия предполагает исключительно паллиативную терапию. Поздние и злокачественные стадии болезни приводят к летальному исходу у пациентов.
Хронический миелоидный лейкоз — клиника, диагностика, лечение
Хронический миелоидный лейкоз (ХМЛ) является неопластическим клональным заболеванием мультипотентной гемопоэтической стволовой клетки с преимущественным вовлечением гранулоцитарной клеточной линии.Заболевание впервые было описано Р. Вирховым в середине XIX века под названием «селезеночная лейкемия». На долю ХМЛ приходится примерно 20% всех лейкозов в Европе.
Чаще заболевают люди среднего и пожилого возраста с медианой возраста около 50 лет, хотя ХМЛ может развиваться в любом возрасте.
Нет зависимости в заболеваемости от половой и этнической принадлежности.
Этиология ХМЛ неизвестна. Среди выживших после атомных бомбардировок в Японии повышение заболеваемости ХМЛ наблюдалось после трехлетнего латентного периода с достижением пика через 7 лет. В группе пациентов в Великобритании, которым проводили лучевую терапию по поводу анкилозирующего спондилита, отмечено повышение заболеваемости хроническим миелоидным лейкоз после латентного периода в 13 лет.
В целом воздействие ионизирующего излучения отмечено в анамнезе менее чем у 5% больных ХМЛ. Контакт с миелотоксическими агентами выявлен в единичных случаях. Хотя при ХМЛ отмечено повышение частоты экспрессии антигенов HLA-Cw3 и HLA-Cw4, нет сообщений о случаях семейного ХМЛ. Заболеваемость ХМЛ составляет 1,5 на 100000 населения.
В 1960 г. G.Nowell и D.Hungerford обнаружили у больных ХМЛ укорочение длинного плеча одной хромосомы (Хр), как они считали, 21-й пары. Эта хромосома ими была названа филадельфийской, или Ph-хромосомой.
Однако в 1970 г. T.Caspersson и соавт. установили, что при хроническом миелоидном лейкозе имеется делеция одной из Хр 22-й пары. В 1973 г. J.Rowley показала, что образование Ph-хромосомы обусловлено реципрокной транслокацией (взаимным переносом части генетического материала) между Хр9 и Хр22. Эта измененная хромосома из 22-й пары с укороченным длинным плечом и обозначается как Ph-хромосома.
В начальном периоде цитогенетического изучения ХМЛ были описаны два варианта — Ph+ и Ph-. Однако теперь следует признать, что Ph- ХМЛ не существует, а описанные случаи, вероятно, относились к миелодиспластическим состояниям. Ph-хромосома, t (9; 22) (q34; q11) обнаруживается у 95-100% больных ХМЛ.
В остальных случаях возможно наличие следующих вариантов транслокации:
— сложные транслокации, вовлекающие Хр9, 22 и какую-либо третью хромосому,
— маскированные транслокации с такими же молекулярными изменениями, но не определяемыми обычными цитогенетическими методами,
— наличие t (9; 22) без переноса участка Хр22 на Хр9.
Таким образом, во всех случаях ХМЛ существуют изменения Хр9 и Хр22 с одинаковой перестройкой генов в определенной области Хр22 (2).
На длинном плече Хр9 (q34) расположен протоонкоген ABL (Абельсона), который кодирует через синтез специфической мРНК образование белка р145 , относящегося к семейству тирозинкиназ (ТК) — энзимов, катализирующих процессы фосфорилирования аминокислот в клеточном цикле. На длинном плече Хр22 (q 11) расположен район M-BCR (Major breakpoint cluster region).
Ген, расположенный в этом районе, обозначается как ген BCR. Он кодирует образование белка p160BCR, который участвует в регуляции некоторых функций нейтрофилов. В результате транслокации t(9;22)(q34;q11) протоонкоген с-аcr переносится в район bcr Хр22.
Обычно разрыв гена BCR происходит между экзонами b2 и b3 или экзонами b3 и b4, причем происходит слияние экзона 2 гена ABL с оставшейся на Хр22 частью гена BCR (с экзоном b2 или b3). В результате этого формируется химерный ген BCR-ABL, кодирующий аномальную 8,5кб рибонуклеиновую кислоту (мРНК), которая продуцирует фузионный протеин p210BCR-ABL, обладающий тирозинкиназной активностью.
Иногда точка разрыва гена BCR находится в районе m-BCR (minor breakpoint cluster region), при этом продукцией химерного гена является 7,5 кб мРНК, кодирующая белок p190BCR-ABL. Такой тип транслокации ассоциирован с вовлечением в процесс клеток лимфоидной линии и часто обуславливает развитие Ph+ острого лимфобластного лейкоза (ОЛЛ).
В связи с активацией гена ABL, возникающей при его слиянии с геном BCR, белок р210BCR-ABL имеет значительно более выраженную тирозинкиназную активность, чем его нормальный прототип p145ABL. ТК фосфорилируют тирозин в белках, которые регулируют рост и дифференцировку клеток, в том числе и гемопоэтических.
Мутации тирозинкиназ с повышением их активности приводят к нерегулируемому фосфорилированию тирозина и, соответственно, к нарушению процессов роста и дифференцировки клеток. Однако это не единственный и не главный механизм в патогенезе симптомов ХМЛ.
Биологический эффект химерного гена BCR-ABL сводится к следующим основным нарушениям в жизнедеятельности клетки:
— увеличению митогенной активности в связи с усилением передачи сигнала пролиферации путем активации рецепторов гемопоэтических клеток благодаря усилению фосфорилирования. Это не только усиливает пролиферацию, независимо от регулирующего влияния ростовых факторов, но и нарушает дифференцировку клеток-предшественников;
— нарушению адгезии клеток к строме, что ведет к снижению времени взаимодействия строма/гемопоэтические клетки. Следствием этого является нарушение нормальной последовательности пролиферация/созревание, поэтому клетки-предшественники находятся дольше в поздней прогениторной пролиферативной фазе перед дифференцировкой. Это приводит к увеличению пролиферации и времени циркуляции клеток-предшественников и появлению очагов экстрамедуллярного кроветворения;
— ингибированию апоптоза вследствие защитного действия белка р210 и активации гена MYC, являющегося ингибитором апоптоза, а также вследствие гиперэкспрессии гена BCL-2. Вследствие этого лейкоциты при ХМЛ живут дольше, чем нормальные клетки. Характерной особенностью белка p210BCR-ABL является способность к аутофосфорилированию, приводящей к автономной активности клетки и практически полной ее независимости от внешних регуляторных механизмов;
— возникновению нестабильного генома клетки в связи со снижением функции гена ABL, поскольку при его делеции снижается его роль как супрессора опухолевого роста. Вследствие этого не происходит остановки клеточной пролиферации. Кроме того, в процессе пролиферации активируются другие клеточные онкогены, что ведет к дальнейшему усилению пролиферации клеток.
Итак, усиление пролиферативной активности, снижение чувствительности к апоптозу, нарушение процессов дифференцировки, повышенная способность незрелых гемопоэтических клеток-предшественников к выходу из костного мозга в периферическую кровь являются основными характеристиками лейкемических клеток при хроническом миелоидном лейкоз.
Хронический миелолейкоз: фазы развития, критерии групп риска
В своем развитии ХМЛ проходит три фазы: хроническая фаза (ХФ), фаза акселерации (ФА) и фаза бластного криза (БК).Хроническая фаза (ХФ) болезни в большинстве случаев протекает почти или вовсе бессимптомно. Жалобы на повышенную утомляемость, слабость, иногда тяжесть в эпигастрии. При обследовании можно обнаружить увеличение селезенки и крайне редко — печени.
Клинико-гематологическая картина может быть бессимптомной, количество лейкоцитов и тромбоцитов может быть нормальным или незначительно увеличенным; в лейкоцитарной формуле может наблюдаться умеренный левый сдвиг — единичные метамиелоциты и миелоциты, иногда небольшое повышение количества базофилов. При цитологическом исследовании выявляется лишь Ph-хромосома без дополнительных изменений со стороны других хромосом.
В фазе акселерации пациенты отмечают повышенную утомляемость при выполнении привычной работы, дискомфорт в левом подреберье; потеря веса, периодические «немотивированные» повышения температуры тела отражают наличие гиперкатаболизма. Как правило, определяется увеличение селезенки и в 20-40% случаев — увеличение печени.
Основным признаком перехода заболевания в ФА являются изменения в анализах крови: нарастает неконтролируемый цитостатическими препаратами лейкоцитоз с количественным преобладанием незрелых форм лейкоцитов, возрастает количество базофилов, реже нарастает количество эозинофилов или моноцитов.
Количество тромбоцитов может увеличиваться с развитием тромботических осложнений в начале ФА с последующим развитием тромбоцитопении с проявлениями геморрагического синдрома по петехиально-пятнистому типу. В костном мозге в ФА выявляется некоторое увеличение количества бластных клеток (обычно менее 20%) и увеличение содержания промиелоцитов и миелоцитов. При цитогенетическом исследовании в ФА, помимо наличия Ph-хромосомы, можно выявить добавочные изменения других хромосом, что свидетельствует о появлении более злокачественного клеточного клона.
В фазе бластного криза появляются резкая общая слабость, выраженные оссалгии за счет поднадкостничной инфильтрации бластными клетками, периодическая лихорадка, потливость, выраженное снижение массы тела. Нарастает гепатоспленомегалия. Как правило, отмечается выраженный геморрагический диатез. Гематологические проявления характеризуются увеличением количества бластных клеток в периферической крови и/или костном мозге выше 20% при вариабильном количестве лейкоцитов.
Преобладающим по частоте вариантом БК является миелобластный вариант — примерно 50% всех случаев; лимфобластный и недифференцированный варианты — около 25% случаев каждый. Лимфобластный БК имеет чрезвычайно злокачественный характер, что связано с изменениями бластных клонов и в связи с этим с резистентностью к проводимой терапии.
Иногда БК характеризуется резким увеличением количества базофилов разной степени зрелости в периферической крови и костном мозге без большого количества бластных клеток. В некоторых случаях базофилия сменяется моноцитозом.
Обычно отмечается нормохромная анемия и тромбоцитопения разной степени тяжести, нормобластоз и фрагменты мегакариоцитов в мазке крови. Примерно у 10-15% больных в фазе БК появляются экстрамедуллярные бластные инфильтраты.
Реже наблюдаются поражения центральной нервной системы с симптомами нейролейкемии или поражение периферических нервов. У некоторых больных при БК бывают кожные лейкемиды или приапизм в результате лейкостаза и лейкозной инфильтрации пещеристых тел. Следует отметить, что в некоторых случаях при наличии экстрамедуллярных очагов бластной инфильтрации картина периферической крови и костного мозга может не иметь признаков перехода ХМЛ в фазу БК.
Согласно классификации ВОЗ (2002 г.), выделены следующие критерии для ФА и БК.
Фаза акселерации при наличии одного или более признаков:
— бласты 10-19% в периферической крови или костном мозге,
— базофилы менее 20% в периферической крови,
— персистирующая тромбоцитопения (менее 100,0х109/л) или персистирующий тромбоцитоз более 1000,0х109/л, несмотря на проводимую терапию,
— увеличение размеров селезенки и повышение уровня лейкоцитов, несмотря на проводимую терапию,
— цитогенетические данные в пользу клональной эволюции (в дополнение к цитогенетическим аномалиям, выявленным во время установления диагноза ХФ ХМЛ),
— мегакариоцитарная пролиферация в виде кластеров в сочетании со значительным ретикулиновым и коллагеновым фиброзом и/или выраженной гранулоцитарной дисплазией.
Фаза властного криза при наличии одного или более признаков:
— бласты 20% и более в периферической крови или костном мозге,
— экстрамедуллярная пролиферация бластов,
— большие скопления или кластеры бластов в костном мозге при трепанобиопсии.
Хроническая фаза ХМЛ устанавливается при отсутствии критериев ФА и фазы БК.
Спленомегалия и гепатомегалия любых размеров не являются признаками ФА и БКХМЛ.
Важно определять не только фазу ХМЛ, но и группу риска прогрессии болезни в дебюте заболевания с учетом данных первичного обследования пациента. J.E.Sokal и соавт. в 1987 г. предложили прогностическую модель с учетом четырех признаков: возраста больного в момент установления диагноза, размеров селезенки, числа тромбоцитов и числа бластов в крови. Эта модель получила наибольшее распространение и используется в большинстве исследований.
Расчет прогностического индекса проводится по формуле:
Индекс Sokal = exp(0,0116(возраст — 43,4) + 0,0345(размер селезенки — 7,51) + 0,188[(число тромбоцитов : 700)2 — 0,563] + 0,0887(число бластов в крови — 2,10)}.
Exp (экспонента) -2,718 возводится в степень того числа, которое получается в фигурных скобках.
При индексе менее 0,8 — группа низкого риска; при индексе 0,8-1,2 — группа среднего риска; при индексе более 1,2 — группа высокого риска.
Методы диагностики хронического миелолейкоза
Дифференциальную диагностику ХМЛ необходимо проводить с лейкемоидными реакциями по миелоидному типу и с заболеваниями, представляющими хронические миелопролиферативные новообразования.К обязательным методам обследования пациентов для установления диагноза ХМЛ относятся:
— морфологическое исследование периферической крови с подсчетом лейкоцитарной формулы и количества тромбоцитов,
— морфологическое исследование пунктата костного мозга,
— поскольку единственным достоверным критерием диагноза хронический миелоидный лейкоз является наличие Ph- хромосомы, необходимо цитогенетическое исследование костного мозга с анализом не менее 20 метафазных пластинок; при негативном ответе — отсутствии t (9; 22) (q34; q11) — при высокой возможности диагноза ХМЛ необходимо использовать молекулярно-генетические методики-FISH (fluorescence in situ hybridization) или полимеразной цепной реакции (ПЦР),
— пальпаторное и УЗИ-определение размеров селезенки, печени, лимфатических узлов. Поскольку спленомегалия или гепа-томегалия любых размеров не являются критериями ФА или фазы БК, специфическое поражение любых других органов и тканей следует рассматривать как признак трансформации болезни в БК,
— HLA- типирование для потенциальных кандидатов на аллогенную трансплантацию гемопоэтических стволовых клеток (алло-ТГСК) показано больным ХМЛ в ФА и БК, не имеющим противопоказаний к использованию этого метода лечения,
— пациентам в фазе БК ХМЛ для определения типа бластов показано цитохимическое исследование и иммунофенотипирование.
К факультативным методам обследования относятся:
— трепанобиопсия для оценки наличия и распространенности процесса фиброза в костном мозге,
— инструментальные методы обследования — ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ), люмбальная пункция с целью определения наличия экстрамедуллярных очагов кроветворения,
— до начала терапии ингибиторами тирозинкиназы (ИТК) целесообразно выполнение ПЦР для определения начального уровня экспрессии гена BCR-ABL.
Терапия хронического миелолейкоза
В течение нескольких десятилетий терапия ХМЛ оставалась паллиативной. Лечение гидроксимочевиной (HU), бусульфаном (миелосан, милеран) улучшало качество жизни пациентов, но не увеличивало общую выживаемость.Стандартная терапия Ph+ ХМЛ, рекомендованная экспертами Американского гематологического общества в 1998 г., включала HU, рекомбинантный интерферон a (rINF) без или в сочетании с низкими дозами цитозара (LDAC), ИТК (ингибиторы тирозинкиназы) — иматиниб мезилат и алло-ТГСК. Было выявлено преимущество сочетания rINF + LDAC в сравнении с HU; преимущество применения ИМ в дозе 400 мг/сутки в сравнении с rINF+LDAC.
Стандартная алло-ТГСК вызвала длительную молекулярную ремиссию или выздоровление у 50% больных со значительной разницей при учете групп риска. В странах, где доступна терапия ИТК и осуществляется алло-ТГСК, обе эти стратегии не являются взаимоисключающими, хотя после внедрения ИТК в клиническую практику заметно снижение ежегодного количества алло-ТГСК в последние 7 лет.
Эффективность проводимой терапии определяется по следующим критериям:
1. Наличие гематологической ремиссии: данные анализов крови:
— полная клинико-гематологическая ремиссия (CHR):
— тромбоциты ниже 450,0×10%,
— лейкоциты ниже 10,0×10%,
— в лейкограмме бласты менее 5%, отсутствуют незрелые гранулоциты.
2. Наличие цитогенетической ремиссии: наличие Ph хромосомы:
— полная — 0%,
— частичная — 1-35%,
— малая — 36-65%,
— минимальная — 66-95%.
3. Наличие молекулярной ремиссии: наличие BCR-ABL транскрипта:
— полная — транскрипт не определяется,
— большая — 0,1%.
Полная цитогенетическая (CCyR) и частичная цитогенетическая ремиссия (PCyR) в комбинации могут рассматриваться как большая цитогенетическая ремиссия (MCyR). Большая молекулярная ремиссия (MMolR) является эквивалентом 1000-кратной редукции от базового уровня в 100%.
Полная молекулярная ремиссия (CMolR) констатируется, если транскрипт BCR-ABL не определяется методом RQ-PCR (real-time quantitative polymerase chain reaction).
Варианты терапии хронического миелоидного лейкоза
В настоящее время применение гидроксимочевины (HU) может быть рекомендовано:— с целью достижения циторедукции,
— при беременности для поддержания гематологического ответа,
— в случаях резистентности и/или непереносимости препаратов интерферона или ИТК,
— при невозможности выполнения алло-ТГСК,
— при невозможности обеспечения больных ХМЛ достаточным количеством ИТК.
Обычно терапия HU заключается в назначении данного препарата в дозе 2-3,0 грамма в сутки в сочетании с приемом аллопуринола в суточной дозе 600-800 мг при достаточной гидратации. Доза корригируется в зависимости от степени снижения уровня лейкоцитов, при снижении их ниже 10,0х109/л переходят на прием поддерживающей дозы — 0,5 г/сутки с или без приема аллопуринола. Желательно количество лейкоцитов поддерживать на уровне не выше 6-8,0х109/л.
В случае снижения количества лейкоцитов ниже 3,0х109/л прием препарата временно прекращается. Переносимость препарата достаточно хорошая, но при длительном применении возможно образование язв желудка.
Внедрение в практику препаратов rINF позволило получить у части больных ХМЛ не только длительную клинико-гематологическую, но и цитогенетическую ремиссии, хотя частота полного цитогенетического ответа (CCyR) была низкой — 1015%. Сочетание препаратов rINF+LDAC несколько увеличило частоту CCyR (25-30%), однако рано или поздно практически у всех больных этой группы заболевание прогрессировало.
Методика лечения препаратами rINF
Вначале пациентам назначают HU с целью снижения количества лейкоцитов до10,0х109/л, после чего назначают rINF в следующей дозировке:— 1-я неделя: по 3 млн. Ед/м2 подкожно ежедневно,
— 2-я и 3-я недели: по 5 млн. Ед/м подкожно ежедневно,
— в дальнейшем препарат назначают по 5 млн ЕД/м подкожно ежедневно или 3 раза в неделю.
Препарат может вызывать аллергические реакции, повышение температуры тела, зуд кожи, боли в мышцах (обычно в начале применения). Терапия обычно продолжается в течение 2-х лет, в дальнейшем наблюдается уход из-под контроля препарата.
При комбинации rINF+LDAC (цитозар в дозе 20 г/м2 подкожно 2 раза в день в течение 10 дней ежемесячно) цитогенетический ответ был выше, чем при терапии только rINF, но различий в общей выживаемости не было.
Сравнение результатов применения rINF в дозе 3 млн. Ед/м 3 раза в неделю и в дозе 5 млн. ЕД/м ежедневно показало, что малые дозы такие же по эффективности, как и высокие дозы, но переносятся лучше. Однако у всех пациентов, находящихся на такой терапии, определялось наличие минимальной остаточной болезни, что предполагает неизбежность развития рецидива.
В рутинной клинической практике последовательное или сочетанное применение ИМ или новых ИТК с препаратами rINF пока не рекомендуется, поскольку неизвестны результаты проводимых клинических исследований. В настоящее время применение rINF можно рекомендовать в тех же случаях, в которых рекомендуется терапия гидроксимочевиной.
Проведение алло-ТГСК в качестве терапии первой линии при наличии донора, совместимого по системе HLA, а также возраста больного ниже 50-55 лет, с начала 90-х годов 20-го века стало стандартной рекомендацией для пациентов с первично диагностированным ХМЛ. Алло-ТГСК считается единственным методом, способным полностью элиминировать из организма лейкозный клон клеток.
Тем не менее, существует несколько проблем, которые ограничивают ее широкое применение у больных ХМЛ:
— преобладание в популяции больных ХМЛ возрастной группы 50-60 лет,
— невозможность для большинства пациентов найти HLA-совместимого родственного или неродственного донора,
— летальность до 20% в раннем посттрансплантационном периоде от осложнений полихимиотерапии (ПХТ) или реакции «трансплантат против хозяина» (РТПХ).
В ФА решение о проведении алло-ТГСК должно приниматься с учетом следующих данных:
— оценка степени риска прогрессии хронического миелоидного лейкоза (по индексу Sokal),
— определение эффективности ИТК с учетом цитогенетики и данных ПЦР,
— оценка риска трансплантационных и посттрансплантационных осложнений,
— наличие доступного донора.
Согласно рекомендациям ЕВМТ, при ХМЛ выполнение алло-ТГСК в ХФ, в ФА или в поздней ХФ показано от родственного или неродственного совместимого донора, не показано от неродственного несовместимого донора; проблема выполнения ауто-ТГСК находится в стадии разработки. В фазе БК выполнение алло- или ауто-ТГСК не показано.
Если принято решение о выполнении алло-ТГСК, встает вопрос о том, какой режим кондиционирования предложить пациенту: миелоаблативный или немиелоаблативный. Одним из миелоаблативных режимов при проведении алло-ТГСК у пациентов ХМЛ является BuCy: бусульфан в дозе 4 мг/кг веса в день и циклофосфан 30 мг/кг веса в день в течение 4-х дней до алло-ТГСК.
Немиелоаблативный (редуцированный) режим Bu-Flu-ATG состоит из однократного введения комбинации бусульфана в дозе 8 мг/кг веса, флюдарабина 150мг/м и кроличьего антитимоцитарного глобулина в дозе 40 мг. Однако в связи с отсутствием рандомизированных исследований не рекомендуется применять этот вариант в качестве стандарта лечения.
Осознание роли тирозинкиназной активности (ТКА) белка BCR-ABL в процессе миелопролиферации привело к синтезу новой серии препаратов, таргентных в отношении кодируемых BCR-ABL протеинов. Ингибирование ТКА приводит к прерыванию сигналов, контролирущих лейкемический фенотип. Первый из ингибиторов ТКА, иматиниб мезилат (ИМ), обладает высокой и относительно специфической биохимической активностью при ХМЛ, что привело к его быстрому внедрению в клиническую практику.
С появлением ИТК показания к алло-ТГСК резко изменились. В ранней ХФ ХМЛ алло-ТГСК показана при развитии резистентности или непереносимости к ИТК, поэтому ее выполнение взрослым пациентам в качестве терапии первой линии на сегодняшний день не рекомендовано.
Однако из этого правила есть два исключения:
— в педиатрической практике предпочтительнее в качестве первичной терапии применять алло-ТГСК при наличии HLA-совместимого родственного донора,
— если стоимость предполагаемого лечения ИТК значительно превышает стоимость алло-ТГСК.
В целом, большинству пациентов с ХМЛ в ХФ, если возможно, рекомендуется проводить начальную терапию ИМ.
Иматиниб мезилат (ИМ) — гливек, являющийся ингибитором тирозинкиназы, применен в клинике в 1995 г. ИМ (2-фениламинопиримидин) эффективно блокирует киназную активность белка BCR-ABL и может блокировать другие белки с протеинкиназной активностью, необходимые для нормального выживания клетки.
Исследования показали, что ИМ избирательно ингибирует пролиферацию клеток при хроническом миелоидном лейкозе. Препарат преимущественно элиминируется печенью, 50% снижение его концентрации в плазме составляет около 18 часов. Рекомендуемая начальная доза препарата составляет 400 мг/день, что позволяет достичь полной клинико-гематологической ремиссии (CHR) в 95% и CCyR в 76% случаев. В группе пациентов с CCyR большая молекулярная ремиссия (MMolR) определялась только в 57% случаев.
Применение ИМ в «поздней» ХФ в такой же дозировке позволяет достичь CCyR в 41-64% со свободной от прогрессирования выживаемсти в 69% больных. При применении ИМ в ФА в дозе 600 мг/день CHR была достигнута в 37%, CCyR в 19% случаев и трехлетняя PFS у 40% больных. При применении ИМ в той же дозе в БК ХМЛ CHR была достигнута в 25%, PFS составила менее 10 месяцев, общая выживаемость свыше 3-х лет — в 7% случаев.
Поскольку частота CCyR очень высока у пациентов при лечении ИМ, необходимо измерение уровня BCR-ABL транскрипта для определения наличия минимальной остаточной болезни (МОБ). Частота отсутствия данного транскрипта рассматривается как CMolR, весьма вариабельна и колеблется в пределах 4-34%.Показано, что Ph+ стволовые клетки менее чувствительны к ИМ, чем поздние Ph+ прогениторы.
В случае субоптимального эффекта от применения ИМ в ХФ в дозе 400 мг/день предлагается эскалация дозы препарата до 600-800 мг/день при условии, что резистентность к ИМ не связана с дополнительными мутациями BCR-ABL. Прием ИМ в дозе 600 мг в сутки значительно более эффективен в ФА и БК. У пациентов в ХФ с гематологической и цитогенетической резистентностью к ИМ в дозе 400 мг/день повышение дозы ИМ до 800 мг в день обусловило CHR у 65% и CCyR — у 18% пациентов.
При применении ИМ могут наблюдаться некоторые осложнения:
— анемия и/или панцитопения,
— инфраорбитальный отек, редко — генерализованный отек,
— боли в костях и суставах,
— повышение уровня печеночных ферментов,
— снижение уровня кальция и фосфора в крови,
— зуд кожи.
На сегодняшний день существует два препарата группы ИТК, зарегистрированные к применению в качестве препаратов 2-й линии терапии ХМЛ в случаях развития резистентности к ИМ: дазатиниб и нилотиниб.
Дазатиниб (спрайсел) является ингибитором ABL-киназ (всего ингибирует около 50 киназ) и отличается от ИМ тем, что может связывать как активные, так и неактивные (открытые и закрытые) конформации киназного ABL-домена, а также ингибирует семейство киназ Src, включая Srk и Lyn.
Его можно рассматривать как двойной ингибитор. Дазатиниб в 300 раз более активен, чем ИМ, и к тому же активен против большинства ИМ-резистентных мутантных субклонов, за исключением клона T315I и, вероятно, мутантного клона F317L. Препарат применяется для лечения пациентов ХМЛ при резистентности или непереносимости ИМ. Ремиссия наблюдалась в одинаковой степени у пациентов при наличии и при отсутствии мутаций киназы, кроме мутаций T315I.
Препарат может вызывать осложнения в виде нейтропении, тромбоцитопении, рвоты, диареи, желудочно-кишечных кровотечений, генерализованного отека, кожных высыпаний, гипертензии, ХОБЛ. У единичных пациентов может наблюдаться плевральный и перикардиальный выпот. Для коррекции осложнений следует сделать перерыв в приеме препарата, назначить диуретики, кортикостероиды, при необходимости — торакоцентез.
Доза препарата 100 мг один раз в день сопоставима по эффективности с дозой 70 мг два раза в день, но обладает лучшей переносимостью.
Нилотиниб (тасигна) является дериватом аминопиримидина, т.е. модифицированным производным ИМ, что объясняет их схожий спектр ингибирования (ингибирует четыре ТК). Препарат обладает повышенной способностью связывать район АТФ онкопротеина BCR-ABL. Он в 20-50 раз более эффективен в сравнении с ИМ в отношении чувствительных к ИМ лейкемических клеток, а также активен в отношении всех ИМ-резистентных клеточных линий с мутациями киназного ABL-домена, за исключением мутации T315I и, вероятно, мутантного клона Y253H.
В группе больных в ХФ ХМЛ, резистентных к ИМ, достигнута CHR у 71% и CCyR — у 48% пациентов. Общая 2-летняя выживаемость в этой группе составила 95%. Не было различий в количестве ремиссий у пациентов при наличии или отсутствии мутации киназного ABL-домена. При применении препарата в ФА спустя один месяц после начала терапии в 55% случаев была зарегистрирована CHR, общая выживаемость спустя 12 месяцев составила 82%. В фазе БК при проведении терапии в течение 12 месяцев общая выживаемость составила 47%.
Рекомендуемая суточная доза препарата — 800 мг (по 400 мг 2 раза в сутки). Возможные осложнения при терапии нилотинибом:
— кожный зуд,
— запоры,
— повышение уровня печеночных ферментов,
— повышение уровня непрямого билирубина,
— высыпания на коже.
Для дазатиниба 50% снижение уровня в плазме составляет 3-5 часов, для нилотиниба и ИМ — 15-18 часов. Для дазатиниба длительное ингибирование протеина BCR-ABL не означает обязательную элиминацию лейкемических клеток при хроническом миелоидном лейкозе. Поэтому постулат о превалировании эффективности длительного ингибирования киназ в лечении ХМЛ неприменим в отношении дазатиниба.
В общем, дазатиниб и нилотиниб обладают примерно равной активностью у пациентов при отсутствии эффекта от терапии ИМ. Однако ни один из них не рекомендуется для применения у пациентов с мутантным клоном N315I.
В стадии клинических испытаний находится препарат босутиниб, ингибирующий киназы ABL и Srk, и поэтому являющийся двойным ингибитором киназ. Он активен против клеточных линий, несущих мутации трех из четырех киназных доменов. Однако следует учитывать, что применение вышеуказанных препаратов не обеспечивает полного излечения.
Поэтому пациентам с ХМЛ рекомендуется следующая тактика терапии:
— после применения иматиниба в случае развития резистентности к препарату, при его непереносимости или выраженных осложнениях пациентам должна быть предложена терапия ИТК 2-й линии терапии;
— выбор препарата должен определяться степенью его токсичности.
Алло-ТГСК предлагается при:
— наличии мутаций T315I и других мутаций,
— отсутствии эффекта при лечении ИТК в ФА и БК,
— отсутствии эффекта при лечении ИТК 2-й линии терапии.
А.Т. Фиясь
Опубликовал Константин Моканов

