Липопротеины
4
Липиды 200401ХИМИЯ И ОБМЕН ЛИПИДОВ.
ЛИПИДЫ — органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге.
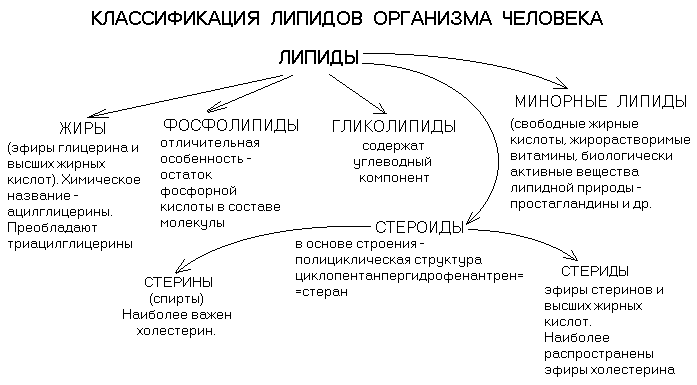
Группы липидов отличаются по степени гидрофобности. Фосфолипиды и гликолипиды являются полярными липидами.
Холестерин занимает промежуточное положение между полярными и абсолютно гидрофобными липидами.
Абсолютно гидрофобными являются триглицериды и эфиры холестерина.
Большинство липидов (кроме стеринов и некоторых минорных липидов) содержат высшие жирные кислоты (ВЖК).
ЖИРНЫЕ КИСЛОТЫ, ХАРАКТЕРНЫЕ ДЛЯ ОРГАНИЗМА ЧЕЛОВЕКА
Кислота называется жирной, если число углеродных атомов в ее молекуле больше четырех. Преобладают длинноцепочечные жирные кислоты (число атомов углерода 16 и выше). Количество углеродных атомов и двойных связей обозначается двойным индексом. Например: С18:1 (9-10). В данном случае 18 – число атомов углерода и 1 – количество двойных связей. В скобках указывается местоположение двойных связей (по номерам углеродных атомов).
Студенты должны знать количество углеродных атомов и двойных связей в молекулах следующих жирных кислот:
С16:0 — пальмитиновая,
С18:0 — стеариновая,
С18:1 – олеиновая (9:10),
С18:2 – линолевая (9-10,12-13),
- С18:3 — линоленовая (9-10, 12-13, 15-16),
С20:4 — арахидоновая (5-6, 8-9, 12-13, 15-16).
Жирные кислоты, имеющие двойную связь в положении 3, обладают очень выраженным антиатеросклеротическим действием (линоленовая). Особенно много 3-содержащих жирных кислот находится в рыбьем жире и других морепродуктах. В организме человека такие жирные кислоты не синтезируются.
Жирные кислоты, входящие в состав организма человека, имеют общие черты строения:
Чётное число атомов углерода.
Линейная (неразветвлённая) углеродная цепь.
Полиненасыщенные жирные кислоты имеют ТОЛЬКО ИЗОЛИРОВАННЫЕ двойные связи (между соседними двойными связями не меньше двух одинарных).
Двойные связи имеют только цис-конфигурацию.
По количеству двойных связей жирные кислоты можно разделить на НАСЫЩЕННЫЕ (нет двойных связей), МОНОНЕНАСЫЩЕННЫЕ (есть одна двойная связь) и ПОЛИНЕНАСЫЩЕННЫЕ (две или более двойных связей).
Свободные жирные кислоты встречаются в очень небольшом количестве. В основном они находятся в составе других липидов. При этом они связаны с другими компонентами липидов сложноэфирной связью (эстерифицированы).
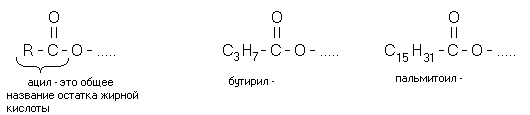
ФОРМЫ СУЩЕСТВОВАНИЯ ЛИПИДОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА
Жировые включения, которых больше всего в адипоцитах. Это форма существования триглицеридов.
Биомембраны. Они не содержат триглицеридов, зато в них присутствуют фосфолипиды, гликолипиды и холестерин.
Липопротеины. Могут включать в себя липиды всех классов.
Липопротеины — это сферические частицы, в которых можно выделить гидрофобную сердцевину, состоящую из триглицеридов (ТРГ) и эфиров холестерина (ЭХС) и амфифильную оболочку, в составе которой – фосфолипиды, гликолипиды и белки.

Белки оболочки называются апобелками. Холестерин (ХС) обычно занимает промежуточное положение между оболочкой и сердцевиной. Компоненты частицы связаны слабыми типами связей и находятся в состоянии постоянной диффузии – способны перемещаться друг относительно друга.
Основная роль липопротеинов – транспорт липидов, поэтому обнаружить их можно в биологических жидкостях.
При изучении липидов плазмы крови оказалось, что их можно разделить на группы, так как они отличаются друг от друга по соотношению компонентов. У разных липопротеинов наблюдается различное соотношение липидов и белка в составе частицы, поэтому различна и плотность.
Липопротеины
разделяют по плотности методом
ультрацентрифугирования, при этом они
не осаждаются, а всплывают (флотируют).
Мерой всплывания является

Липопротеины можно разделить и методом электрофореза. При классическом щелочном электрофорезе разные липопротеины ведут себя по-разному. При помещении липопротеинов в электрическое поле хиломикроны остаются на старте. ЛОНП и ЛПП можно обнаружить во фракции пре-глобулинов, ЛНП — во фракции -глобулинов, а ЛВП — -глобулинов:
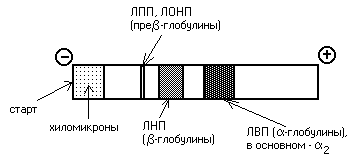
Определение липопротеинового спектра плазмы крови применяется в медицине для диагностики атеросклероза.
Все эти липопротеины отличаются по своей функции.
1. Хиломикроны (ХМ) — образуются в клетках кишечника, их функция: перенос экзогенного жира из кишечника в ткани (в основном — в жировую ткань), а также — транспорт экзогенного холестерина из кишечника в печень.
2. Липопротеины Очень Низкой Плотности (ЛОНП) — образуются в печени, их роль: транспорт эндогенного жира, синтезированного в печени из углеводов, в жировую ткань.
3. Липопротеины Низкой Плотности (ЛНП) — образуются в кровеносном русле из ЛОНП через стадию образования Липопротеинов Промежуточной Плотности (ЛПП). Их роль: транспорт эндогенного холестерина в ткани.
4. Липопротеины Высокой Плотности (ЛВП) — образуются в печени, основная роль — транспорт холестерина из тканей в печень, то есть удаление холестерина из тканей, а дальше холестерин выводится с желчью.
При
определении содержания в крови
липопротеинов различной плотности их
обычно разделяют методом электрофореза.
При этом ХМ остаются на старте, ЛОНП
оказываются во фракции пре-глобулинов,
ЛНП и ЛПП находят во фракции -глобулинов,
а ЛВП —
РОЛЬ АПОБЕЛКОВ В СОСТАВЕ ЛИПОПРОТЕИНОВ
Белковые компоненты липопротеинов особенно важны. Они называются «аполипопротеинами» и обозначаются латинскими буквами (апоА, апоВ, апоС и так до апоG).
ФУНКЦИИ АПОБЕЛКОВ.
1. Апобелки выполняют функцию эмульгаторов, потому что являются амфифильными веществами.
2. Некоторые из аполипопротеинов являются регуляторами активности ферментов липидного обмена.
3. Могут обладать собственной ферментативной активностью.
Могут выступать в качестве лигандов клеточных рецепторов для липопротеинов.
Многие апобелки осуществляют транспорт липидов из одного липопротеина в другой.
ОБМЕН ЖИРА (ТРИАЦИЛГЛИЦЕРИНА)
Химическое название жиров — ацилглицерины, то есть жиры. Это сложные эфиры глицерина и высших жирных кислот. «Ацил-» — это означает «остаток жирных кислот» (не путать с «ацетил-» — остатком уксусной кислоты). В зависимости от количества ацильных радикалов жиры разделяются на моно-, ди- и триглицериды. Если в составе молекулы 2 радикала жирных кислот, то жир называется ДИАЦИЛГЛИЦЕРИНОМ. Если в составе молекулы 1 радикал жирных кислот, то жир называется МОНОАЦИЛГЛИЦЕРИНОМ.
В организме человека и животных преобладают ТРИАЦИЛГЛИЦЕРИНЫ (содержат три радикала жирных кислот).
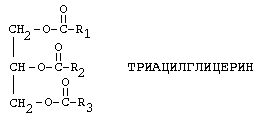
Свойства жира определяются составом жирных кислот.
Функции жира:
1. ЭНЕРГЕТИЧЕСКАЯ.
В отличие от углеводов жиры составляют энергетический резерв организма. Преимущество жира в качестве энергетического резерва заключается в том, что жиры являются более восстановленными веществами по сравнению с углеводами (в молекулах углеводов при каждом углеродном атоме есть кислород – группы “–CHOH-“; у жира имеются длинные углеводородные радикалы, в которых преобладают группы “-CH2-“ — в них нет кислорода). От жира можно отнять больше водорода, который затем проходит по цепи митохондриального окисления с образованием АТФ.
Калорийность углеводов и белков: ~ 4 ккал/грамм.
Калорийность жира: ~ 9 ккал/грамм.
Преимуществом жира как энергетического резерва, в отличие от углеводов, является гидрофобность – он не связан с водой. Это обеспечивает компактность жировых запасов — они хранятся в безводной форме, занимая малый объем.
В среднем, у человека запас чистых триацилглицеринов составляет примерно 13 кг. Этих запасов могло бы хватить на 40 дней голодания в условиях умеренной физической нагрузки. Для сравнения: общие запасы гликогена в организме – примерно 400 гр.; при голодании этого количества не хватает даже на одни сутки.
2.ЗАЩИТНАЯ.
Жировая ткань:
а) защищает органы от механических повреждений.
б) участвует в терморегуляции.
Образование запасов жира в организме человека и некоторых животных рассматривается как приспособление к нерегулярному питанию и к обитанию в холодной среде. Особенно большой запас жира у животных, впадающих в длительную спячку (медведи, сурки) и приспособленных к обитанию в условиях холода (моржи, тюлени). У плода жир практически отсутствует, и появляется только перед рождением.
ИСТОЧНИКИ ЖИРА В ОРГАНИЗМЕ:
1. Пищевой жир (экзогенный)
2. Эндогенный жир, синтезируется в печени из углеводов.
состав, строение, классификация функции, диагностическое значение определения.
Транспорт липидов в организме идет двумя путями:
1) ЖК транспортируются в крови с помощью альбуминов;
2) липиды транспортируются в крови в составе липопротеинов.
ЛП – это надмолекулярные комплексы сферической формы, состоящие из липидов, белков и углеводов. ЛП имеют гидрофильную оболочку и гидрофобное ядро. В гидрофильную оболочку входят белки и амфифильные липиды. В гидрофобное ядро входят гидрофобные липиды и эфиры. ЛП хорошо растворимы в воде.
В организме синтезируются несколько видов ЛП, они отличаются химическим составом, образуются в разных местах и осуществляют транспорт липидов в различных направлениях:
1) хиломикроны образуются в энтероцитах, транспортируют к тканям экзогенные липиды пищи;
2) ЛПОНП (липопротеины очень низкой плотности) образуются в гепатоцитах, транспортируют к тканям эндогенные липиды печени;
3) ЛПП (липопротеины промежуточной плотности) образуются в крови из ЛПОНП, транспортируют к тканям эндогенные липиды печени;
4) ЛПНП (липопротеины низкой плотности) образуются в крови из ЛППП, транспортируют холестерин в ткани;
5) ЛПВП (липопротеины высокой плотности) образуются в гепатоцитах, удаляет избыток холестерина из тканей, донор апо А, С, Е.
5. Катаболизм триглицеридов в белой жировой ткани: реакции, механизмы регуляции активности липазы жировых клеток, роль гормонов, значение.
Жиры депонируются в специализированных клетках жировой ткани – адипоцитах. Мобилизация депонированных жиров происходит путем их гидролиза до жирных кислот и глицерина липазами жировых клеток. ЖК поступают в кровь, где образуют нековалентные соединения с альбумином, и в такой форме транспортируются по кровеносному руслу. Глирерин транспортируется в растворенном состоянии и улавливается главным образом печенью; в печени глицерин превращается в а-глицоролфосфат, который может вступать в реакции глюконеогенеза или окисляться в реакциях гликолиза и общего пути катаболизма. Адреналин активирует мобилизацию депонированных жиров, действуя по тому же механизму, как и в случаях мобилизации гликогена: синтез цАМФ, активация протеинкиназы и фосфорилирование липазы. Катаболизм триглицеридов актуален при длительном голодании и физических нагрузках.
6. Биосинтез триглицеридов: реакции, механизмы регуляции, роль гормонов, значение.
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения.
В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата: [глицерин+ АТФ (глицеролкиназа)→ глицерол-3-фосфат + АДФ].
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза: [дигидроксиацетонфосфат + НАДН2 (глицеролфосфатдегидрогеназа)↔ глицерол-3-фосфат + НАД].
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты, в результате образуется фосфатидная кислота: [глицерол-3-фосфат (глицеролфосфатацилтрансфераза)↔ фосфатидная к-та].
Далее фосфатидная к-та гидролизуется фосфатидатфосфогидролазой до 1,2-диглицерида (1,2-диацилглицерола): [фосфатидная к-та + Н2О (фосфатидатфосфогидролаза)→ 1,2-диглицерид].
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол): [1,2-диглицерид (диацилглицеролацилтрансфераза)↔ Триглицерид]. Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров.
11. Строение и функции разных классов липопротеидов
Липопротеи́ны (липопротеиды) — класс сложных белков, простетическая группа которых представлена каким-либо липидом. Так, в составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Липопротеины представляют собой комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-ЛП) и липидов, связь между которыми осуществляется посредством гидрофобных и электростатических взаимодействий.
Липопротеины подразделяют на свободные, или растворимые в воде (липопротеины плазмы крови, молока и др.), и нерастворимые (структурные)-(липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений).
Среди свободных липопротеинов (они занимают ключевое положение в транспорте и метаболизме липидов) наиболее изучены липопротеины плазмы крови, которые классифицируют по их плотности. Чем выше содержание в них липидов, тем ниже плотность липопротеинов. Различают липопротеины очень низкой плотности (ЛПОНП), низкой плотности (ЛПНП), высокой плотности (ЛПВП) и хиломикроны. Каждая группа липопротеинов очень неоднородна по размерам частиц (наиболее крупные — хиломикроны) и содержанию в ней апо-липопротеинов. Все группы липопротеинов плазмы содержат полярные и неполярные липиды в разных соотношениях.
-Липопротеины высокой плотности (ЛВП)-Транспорт холестерина от периферийных тканей к печени
-Липопротеины низкой плотности (ЛНП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
-Липопротеины промежуточной (средней) плотности ЛПП (ЛСП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
-Липопротеины очень низкой плотности (ЛОНП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
-Хиломикроны-Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень.
Нековалентная связь в липопротеинах между белками и липидами имеет важное биологическое значение. Она обусловливает возможность свободного обмена липидов и модуляцию свойств липопротеинов в организме.
Липопротеины являются:
структурными элементами мембран клеток животных организмов;
транспортными белками, транспортирующими холестерин и другие стероиды, фосфолипиды и др.
12. Строение желчных кислот. Их роль в метаболизме.
Же́лчные кисло́ты (синонимы:холевые кислоты, холиевые кислоты, холеновые кислоты) — монокарбоновые гидроксикислоты из класса стероидов.
Желчные кислоты — производные холановой кислоты С23Н39СООН, отличающиеся тем, что к её кольцевой структуре присоединены гидроксильные группы.
Основными типами желчных кислот, имеющимися в организме человека, являются так называемые первичные желчные кислоты (первично секретируемые печенью): холевая кислота, а также вторичные (образуются из первичных желчных кислот в толстой кишке под действием кишечной микрофлоры): дезоксихолевая кислота, литохолевая, аллохолевая и урсодезоксихолевая кислоты. Из вторичных в кишечно-печёночной циркуляции во влияющем на физиологию количестве участвует только дезоксихолевая кислота, всасываемая в кровь и секретируемая затем печенью в составе желчи.
Аллохолевая, урсодезоксихолевая и литохолевая кислоты являются стереоизомерами холевой и дезоксихолевой кислот.
Все желчные кислоты человека имеют в составе своих молекул 24 атома углерода.
В желчи желчного пузыря человека желчные кислоты представлены так называемыми парными кислотами: гликохолевой, гликодезоксихолевой, гликохенодезоксихолевой, таурохолевой, тауродезоксихолевой и таурохенодезоксихолевой кислотой — соединениями (конъюгатами) холевой, дезоксихолевой и хенодезоксихолевой кислот с глицином и таурином.
|
|
В последние годы достигнут определенный прогресс в выяснении химической природы и структуры липопротеинов (ЛП). Этот класс сложных белков состоит из белка и простетической группы, представленной каким-либо липидом. В частности, в составе липопротеинов открыты нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды. Липо-протеины широко распространены в природе: в растениях, тканях животных и у микроорганизмов – и выполняют разнообразные биологические функции. Они входят в состав клеточной мембраны и внутриклеточных биомембран ядра, митохондрий, микросом (структурированные липопро-теины), а также присутствуют в свободном состоянии (главным образом в плазме крови). К липопротеинам относятся, кроме того, тромбопласти-ческий белок ткани легких, липовителлин желтка куриного яйца, некоторые фосфолипиды молока и т.д. Установлено, что липопротеины участвуют в структурной, комплексной организации миелиновых оболочек, нервной ткани, хлоропластов, фоторецепторной и электронно-транспортной систем, палочек и колбочек сетчатки и др. Большинство ЛП синтезируется в печени или в слизистой оболочке кишечника. Они содержат гидрофобное липидное ядро, окруженное полярными липидами и оболочкой из белков, получивших название апобелки. Различают 8 типов апобелков: апо-AI, АII, В, CI, СII, CIII, D и Е. Обычно ЛП содержат до 5% углеводов (глюкоза, галактоза, гексозамины, фукоза, сиаловая кислота), поэтому некоторые из них являются и гликопротеинами. Липопротеины сыворотки крови подразделяют на отдельные классы в зависимости от электрофоретической подвижности (с белками крови) и от плотности при ультрацентрифугировании. Различают ЛП низкой плотности (ЛПНП), очень низкой плотности (ЛПОНП), высокой плотности (ЛПВП), очень высокой плотности (ЛПОВП) и ЛП промежуточной плотности (ЛППП) (табл. 2.3). Функции и значение отдельных классов ЛП в развитии артерио- и атеросклероза подробно рассматриваются в главе 17. Механизм связывания белкового компонента с липидами. Имеются данные, что в образовании липопротеинов участвуют нековалентные силы различной природы, определяемые наличием или отсутствием у липидного компонента ионизированных групп атомов. Если в образовании липопро-теина участвуют фосфолипиды, то между ними и белковой молекулой возникает ионный тип связи (рис. 2.4). Доказано также существование гидрофобных взаимодействий между неполярными группами липидного компонента (например, радикалы жирных кислот) и белковой молекулы. Чаще в липопротеинах действуют комбинированно разные нековалентные силы, способствуя образованию в высшей степени упорядоченной двойной белково-липидной структуры биомембран. Предыдущая страница | Следующая страница СОДЕРЖАНИЕ Еще по теме: |
Липопротеины. НАГЛЯДНАЯ БИОХИМИЯ. Ян Кольман, Клаус-Генрих Рем, Юрген Вирт
Липопротеины
Липопротеины плазмы подразделяются на
две группы: белки, связанные с липидами ковалентно, и белки, связанные с
липидами нековалентными связями. Липид, ковалентно связанный с
липопротеином, служит якорем, с помощью которого белки прикрепляются к мембране
(см. рис. 231). Липопротеины второй группы не имеют строго определенного состава.
Они скорее представляют собой агрегаты липидов с белками. Эти липопротеиновые
комплексы имеют переменные размеры и состав. В плазме крови они обеспечивают
транспорт водонерастворимых липидов.
А. Состав липопротеиновых
комплексов
Липопротеиновые комплексы представляют
собой шаровидные агрегаты, состоящие из ядра, образованного неполярными
липидами (триацилглицеринами и ацилхолестеринами), и оболочки толщиной
примерно 2 нм, построенной из апопротеинов и амфифильных липидов (фосфолипидов и
холестерина). Наружная сторона оболочки полярна, вследствие этого липиды
растворимы в плазме. Чем больше липидное ядро, т. е. чем большую часть
составляют неполярные липиды, тем меньше плотность липопротеинового
комплекса.
Липопротеиновые комплексы делятся на
пять групп. Ниже они приведены в порядке уменьшения размера и увеличения
плотности: это хиломикроны и остатки хиломикронов, липопротеины очень
низкой плотности [ЛОНП (VLDL от англ. very low density lipoproteins)],
липопротеины промежуточной плотности [ЛПП (IDL от англ. intermediate
density lipoproteins)], липопротеины низкой плотности [ЛНП (LOL от англ.
low density lipoproteins)], липопротеины высокой плотности [ЛВП (HDL от
англ. high density lipoproteins)]. Липопротеиновые комплексы несут на внешней
поверхности характерный апопротеин, который «плавает» на оболочке (здесь
в качестве примера ЛНП). Апопротеины играют решающую роль в функционировании
липопротеинов: они служат молекулами узнавания для мембранных рецепторов (см.
ниже) и необходимыми партнерами для ферментов и белков, которые участвуют в
метаболизме и обмене липидов.
Б. Транспорт триацилглицеринов и
холестерина
Хиломикроны обеспечивают
транспорт пищевых липидов от кишечника к тканям. Хиломикроны образуются в
слизистой кишечника и транспортируются в кровь лимфатической системой (см. с.
266). В мышцах и жировой ткани они разрушаются липазой липопротеинов,
активирующейся апопротеином С-II. Под действием этого фермента хиломикроны
быстро теряют бóльшую часть своих триацилглицеринов. Остатки хиломикронов
утилизируются печенью.
ЛОНП, ЛПП и ЛНП тесно
связаны между собой. Они транспортируют триацилглицерины, холестерин и
фосфолипиды от печени к тканям. ЛОНП образуются в печени (см. рис. 165) и могут
превращаться, как и хиломикроны, в ЛПП и ЛНП путем отщепления жирных кислот.
Образующиеся ЛНП снабжают холестерином различные ткани организма.
ЛВП возвращают избыточный
холестерин, образующийся в тканях, обратно в печень. Во время транспорта
холестерин ацилируется жирными кислотами из лецитина (см. рис. 57). В этом
процессе участвует лецитинхолестеринацилтрансфераза (КФ 2.3.1.43). Между
ЛВП и ЛОНП также происходит обмен липидами и белками.
Эндоцитоз, опосредованный
рецептором. При потреблении холестерина клетки с помощью мембранных
рецепторов, узнающих апо-В-100 и апо-Е, связывают ЛНП. «ЛНП-рецепторы»
захватывают эти комплексы путем эндоцитоза. Поглощение происходит в так
называемых «окаймленных ямках» — областях мембран, у которых внутренняя
поверхность выстлана белком клатрином. Клатрин облегчает включение
в ямку и содействует отделению везикулы («окаймленная везикула»). Внутри
клетки клатрин отделяется от везикулы и используется повторно. Везикула
связывается с лизосомой, которая переваривает ее содержимое (см. рис.
229).
18. Обмен и функции липопротеинов.
Поскольку жиры нерастворимы в воде и жидкостях организма, для транспорта этих веществ с кровью необходимы специальные механизмы. Транспорт осуществляется в составе особых частиц – липопротеинов.
18.1. Классификация липопротеинов.
Существует несколько классификаций липопротеинов, основанных на различиях в их свойствах: скорости флотации, ЭФ подвижности, а также на различиях в апопротеиновом составе частиц. Наибольшее распространение получила классификация, основанная на поведении ЛП в процессе ультрацентрифугирования. Согласно этой классификации различают хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Различная ЭФ подвижность по отношению к глобулинам плазмы положена в основу другой классификации ЛП, согласно которой различают ХМ (остаются на линии старта подобно -глобулинам),-ЛП, пре--ЛП и-ЛП, занимающие положение-,1— и2-глобулинов, соответственно.
18.2. Строение лп.
Плазменные ЛП имеют сферическую форму. Внутри находится жировая “капля”, содержащая неполярные липиды (ТАГ, ЭХС) и формирующая ядро ЛП-частицы. Оно окружено оболочкой из ФЛ, НЭХС и белка. Этот поверхностный гидрофильный слой защищает гидрофобное ядро от водной среды, а также обеспечивает растворимость и транспорт ЛП-частиц в водной среде.
В составе ЛП обнаружено несколько разных белков – апопротеинов: А-I, А-II, А-IV, В-48, В-100, С-I, С-II, С-III, D, E. Для всех этих белков характерно наличие гидрофильной и гидрофобной частей. Гидрофильная часть контактирует с плазмой крови, гидрофобная – с липидами ядра ЛП.
18.3. Образование и функции лп.
ЛП образуются в клетках слизистой оболочки кишечника (ХМ и ЛПВП), в гепатоцитах (ЛПОНП и ЛПВП), в плазме крови (ЛППП и ЛПНП).
Механизмы образования ХМ и ЛПОНП имеют много общего. Апопротеин В синтезируется рибосомами в шероховатом эндоплазматическом ретикулуме и встраиваются в ЛП в гладком эндоплазматическом ретикулуме, который является основным местом синтеза ТАГ. Затем ЛП прозодят через аппарат Гольджи и освобождаются из клетки в лимфу или кровь путем экзоцитоза.
ХМ и ЛПОНП служат для транспорта жиров по кровяному руслу (за сутки они распределяют по органам и тканям 70-150 г экзогенных и эндогенных жиров), а ЛПНП и ЛПВП – для транспорта холестерина. Жиры, образующиеся в печени, упаковываются в ЛПОНП, которые поступают в кровь. Печень взрослого человека выделяет в кровь 25-50 г жиров в сутки.
Жиры, синтезирующиеся в клетках кишечника из продуктов переваривания, в этих же клетках включаются в ХМ. ХМ поступают в лимфатические капилляры кишечника, затем через лимфатические сосуды брыжейки в грудной лимфатический проток и оттуда через яремную вену в общий кровоток. Ввиду своих размеров ХМ и ЛПОНП не способны выходить из кровяного русла и проникать в межклеточное пространство. Поэтому они сначала катаболизируются под действием липопротеинлипазы (ЛПЛ), локализованной на стенках капилляров ряда органов (жировой ткани, сердца) до менее крупных частиц, называемых соответственно ремнантами ХМ и ЛППП. Для проявления активности ЛПЛ требуется апопротеин С-II. ЛПЛ гидролизует ТАГ липопротеинов, при этом освободившиеся жирные кислоты поступают в клетки жировой и мышечной тканей или связываются с альбуминами и транспортируются к отдаленным органам. Ремнанты ХМ узнаются специфическими рецепторами печени по апопротеину Е и захватываются гепатоцитами. Здесь происходит распад белкового компонента и освобождение липидов, обогащенных НЭХС.
ЛППП либо узнаются рецепторами ЛПНП по апо Е или апо В100 (маркерный апопротеин ЛПОНП) и захватываются периферическими клетками, либо подвергаются дальнейшему катаболизму под действием печеночной липазы (ПЛ), превращаясь в ЛПНП. ЛПНП узнаются специфическими рецепторами и захватываются клетками периферических органов. В клетках ЛПНП подвергаются распаду с выделением НЭХС. Последний на генетическом уровне вызывает репрессию гидроксиметилглутарил-КоА-редуктазы – ключевого фермента биосинтеза эндогенного ХС.
ЛПВП имеют сложное происхождение. Липидный компонент включает НЭХС и ФЛ, высвобождающиеся при липолизе ХМ и ЛПОНП, а также НЭХС, поступающий из периферических клеток. Основной апопротеин ЛПВП – апо А-1 синтезируется в печени и тонком кишечнике. Вновь синтезированные ЛПВП представлены фракцией ЛПВП3. Под действием ЛХАТ (лецитин-холестерол-ацилтрансферазы), входящей в состав ЛПВП, происходит этерификация ХС (для активации ЛХАТ требуется апо А-I) и ЛПВП3 превращаются при этом в ЛПВП2. ЛПВП2 под действием ПЛ могут снова превращаться в ЛПВП3, либо захватываться путем эндоцитоза клетками печени.
— холестерин — Биохимия
Холестерин — одноатомный спирт, в молекуле которого имеется ядро циклопентанпергидрофенатрена. Он является компонентом клеточных мембран, предшественником при синтезе желчных кислот, стероидных гормонов (глюкокортикоидов, альдостерона, половых гормонов), витамина D, обнаруживается во всех тканях и жидкостях организма как в свободном состоянии, так и в виде эфиров с жирными кислотами, преимущественно с линолевой (около 10% всего холестерина). Синтез холестерина происходит во всех клетках организма. Основными транспортными формами в крови являются α‑, β‑ и преβ‑липопротеины (или, соответственно, липопротеины высокой, низкой и очень низкой плотности). В плазме крови холестерин находится главным образом в форме сложных эфиров (60‑70%). Эфиры образуются либо в клетках в реакции катализируемой ацил-КоA-холестерин-ацилтрансферазой, использующей в качестве субстрата ацил‑КоA, либо в плазме в результате работы фермента лецитин-холестерин-ацилтрансферазы, осуществляющей перенос жирной кислоты со второго атома углерода фосфатидилхолина на гидроксильную группу холестерина. В плазме крови главными источниками холестерина и фосфатидилхолина для реакции служат липопротеины высокой и низкой плотности, этим путем образуется большая часть эфиров холестерина плазмы.
Для определения содержания холестерина в крови используют следующие методы:
- Титрометрические.
- Гравиметрические.
- Нефелометрические.
- Тонкослойная и газожидкостная хроматография.
- Полярографические методы, позволяют определять общий и свободный холестерин в присутствии ферментов холестеролоксидаз и холестеролэстераз.
- Флюориметрия по реакции с о‑фталевым альдегидом и другими реактивами.
- Ферментативные методы — определение протекает в одной пробирке, но в несколько этапов: ферментативный гидролиз эфиров холестерина, окисление холестерина кислородом воздуха с образованием холест‑4‑ен‑3‑ола и перекиси водорода. В качестве ферментов применяются холестеролоксидаза, холестеролэстераза, пероксидаза, каталаза. Ход реакции можно регистрировать:
- спектрофотометрически по накоплению холестенола.
- по убыли кислорода в среде.
- по изменению окраски раствора, в качестве хромогенов — индикаторов протекания реакций — используются 4‑гидроксибензоат, 4‑аминофеназон, 4‑аминоантипирин.
Все эти методы весьма специфичны и хорошо воспроизводимы.
- Колориметрические методы, в основе которых лежат следующие цветные реакции:
- реакция Биоля‑Крофта с использованием персульфата калия, уксусной и серной кислоты и с появлением красного окрашивания.
- реакция Ригли, базирующаяся на взаимодействии холестерина с реактивом, в составе которого имеются метанол и серная кислота.
- реакция Чугаева, в которой появляется красное окрашивание после реакции холестерина с ацетилхлоридом и хлористым цинком.
- реакция Либермана‑Бурхарда, при которой холестерин окисляется в сильно кислой абсолютно безводной среде с образованием сопряженных двойных связей. В результате образуется соединение холестагексаена с концентрированной серной кислотой изумрудно‑зеленого цвета с максимумом абсорбции при 410 и 610 нм. Особенностью этой реакции является отсутствие стабильности окрашивания. В литературе можно встретить разное соотношение ингредиентов в реактиве Либерман-Бурхарда: чем выше содержание уксусного ангидрида, тем с большей скоростью протекает реакция. Протеканию реакции способствуют сульфосалициловая, паратолуенсульфоновая, диметилбензол‑сульфоновая кислоты. С эфирами холестерина реакция идет медленнее, чем со свободным холестерином, скорость возрастает при повышении температуры, свет оказывает разрушающее воздействие на продукты реакции. Все методы, основанные на реакции Либерман-Бурхарда, подразделяются на прямые и непрямые:
| ◊ к непрямым относятся методы Энгельгарда‑Смирновой, Раппопорта‑Энгельберга, Абеля и заключаются в предварительной экстракции холестерина из сыворотки с последующим определением его концентрации. Из этой группы методов наиболее известен метод Абеля с экстракцией свободного и этерифицированного холестерина изопропанолом или петролейным эфиром, гидролизом эфиров холестерина и последующей реакцией Либерман-Бурхарда. Методы этой группы более воспроизводимы и специфичны; |
| ◊ в прямых методах (Илька, Мрскоса‑Товарека, Златкис‑Зака) холестерин предварительно не экстрагируется, а цветная реакция осуществляется непосредственно с сывороткой. Выявлено, что определение концентрации холестерина по Ильку при сравнении с методом Абеля дает более высокие (по разным авторам на 6%, на 10‑15%) значения, что необходимо учитывать при типировании гиперлипопротеинемий. |
- реакция Калиани‑Златкиса‑Зака, заключающаяся в появлении красно‑фиолетового окрашивания раствора при окислении холестерина хлорным железом в уксусной и концентрированной серной кислотах. Эта реакция в 4‑5 раз чувствительнее, чем реакция Либерман‑Бурхарда, но менее специфична.
Унифицированными методами являются колориметрические методы Илька и Калиани-Златкис-Зака.
Определение содержания общего холестерина
в сыворотке крови методом Илька
Принцип
Основан на реакции Либерман‑Бурхарда: в сильно кислой среде в присутствии уксусного ангидрида происходит дегидратация холестерина с образованием окрашенного в зеленовато‑синий цвет бисхолестадиенилмоносульфоновой кислоты.
Нормальные величины
| Сыворотка (указанный метод) | 0 ‑ 1 год | 1.81‑4.53 ммоль/л |
| до 20 лет | 3.10‑5.80 ммоль/л | |
| 20 ‑ 29 | 3.40‑5.80 ммоль/л | |
| 30 ‑ 39 | 3.70‑6.20 ммоль/л | |
| 40 ‑ 49 | 3.70‑6.80 ммоль/л | |
| 50 ‑ 59 | 4.10‑7.30 ммоль/л | |
| 60 ‑ 69 | 4.20‑7.40 ммоль/л |
Определение количества общего холестерина
в сыворотке крови методом Златкис‑Зака
Принцип
Свободный и эфирносвязанный холестерин окисляется хлорным железом в присутствии уксусной, серной и фосфорной кислот с образованием ненасыщенных продуктов, окрашенных в фиолето‑красный цвет.
Нормальные величины
| Сыворотка (указанный метод) | 3,1‑6,5 ммоль/л |
Определение содержания общего холестерина
ферментативным методом по набору «Новохол»
Принцип
Основан на использовании сопряженных ферментативных реакций, катализируемых: 1) холестеролэстеразой, катализируещей гидролиз эфиров холестерина до свободного холестерина; 2) холестеролоксидазой, катализирующей превращение холестерина в холестенон с образованием перекиси водорода; 3) пероксидазой, катализирующей в присутствии фенола окисление перекисью водорода 4‑аминоантипирина с образованием окрашенного продукта розово‑малинового цвета.
Нормальные величины
| Сыворотка (указанный метод) |
20‑29 лет | 3,70‑6,51 ммоль/л |
| 30‑39 лет | 4,25‑7,04 ммоль/л | |
| 40‑49 лет | 4,37‑7,70 ммоль/л | |
| старше 50 лет | 4,55‑8,24 ммоль/л | |
| Спинномозговая жидкость | 0‑0,013 ммоль/л | |
| Слюна | 0,065‑0,233 ммоль/л | |
| Желчь | печеночная | 2,1‑5,4 ммоль/л |
| пузырная | в среднем 11,1 ммоль/л | |
Влияющие факторы
Завышение результатов при колориметрических методах исследования происходит при высоком содержании в пробе билирубина, гемоглобина, витамина A; при ферментативном методе — оксикортикостероидов и применении антикоагулянтов (фторидов, оксалатов).
Клинико‑диагностическое значение
Сыворотка
Существенное повышение содержания холестерина отмечается при гиперлипопротеинемии IIa типа (семейная гиперхолестеринемия), IIb и III типа (полигенная гиперхолестеринемия, семейная комбинированная гиперлипидемия), умеренное повышение наблюдается при гиперлипопротеинемии I, IV, V типа, а также заболеваниях печени (внутри‑ и внепеченочный холестаз), заболеваниях почек, злокачественных опухолях поджелудочной железы, гипотиреозе, заболеваниях сердечно‑сосудистой системы, беременности, сахарном диабете.
Снижение выявляется при гипертиреозе, циррозе печени, злокачественных опухолях печени, гипопротеинемии и аb‑липопротеинемии.
Спинномозговая жидкость
Накопление холестерина выявляется при менингите, опухоли или абсцессе мозга, кровоизлияниях в мозг, при рассеяном склерозе.
Снижение значений обнаруживается при церебральной и кортикальной атрофии.
Определение концентрации свободного и
этерифицированного холестерина в сыворотке крови
Свободный холестерин способен образовывать с дигитонином, томатином, пиридинсульфатом труднорастворимые соединения. Чаще всего применяют водно‑спиртовый или изопропаноловый раствор дигитонина.
Принцип
Холестерин экстрагируют из сыворотки с помощью изопропилового спирта, экстракт делят на две части, в одной определяют содержание общего холестерина. В другой порции экстракта свободный холестерин осаждают дигитонином, супернатант отбрасывают, а осадок растворяют и определяют содержание свободного холестерина любым методом. Содержание этерифицированного холестерина рассчитывают как разницу между общим и свободным.
Нормальные величины
| Сыворотка | фракция этерифицированного холестерина составляет 60‑80% от общего |
Клинико‑диагностическое значение
Коэффициент этерификации холестерина является важной функциональной пробой печени. Снижение коэффициента пропорционально снижению функции печени: острый и обострения хронического гепатита, механическая желтуха, цирроз печени. Степень этерификации также зависит от активности сывороточного фермента лецитин-холестерин-ацил-трансферазы, поэтому хранение пробы при комнатной температуре может изменить соотношение между свободной и этерифицированной фракцией холестерина.
Определение содержания α‑холестерина
Принцип
Разделение α‑ и β‑липопротеинов основано на избирательной способности липопротеинов очень низкой и низкой плотности образовывать нерастворимые комплексы с гепарином в присутствии двухвалентных катионов Mn2+. Липопротеины высокой плотности при этом остаются в надосадке, где определяют содержание α‑холестерина любым способом.
Определение α‑холестерина используется для расчета индекса атерогенности:
Нормальные величины
| α‑Холестерин | ||
| Сыворотка | 0,9‑1,9 ммоль/л | |
| Индекс атерогенности | ||
| Сыворотка | новорожденные | < 1.0 |
| 20-30 лет | 2.0‑2.8 | |
| больше 30 лет | 3.0‑3.5 | |
Клинико‑диагностическое значение
Возрастание концентрации α‑холестерина клинически не значимо, наблюдается при доброкачественных состояниях. Снижение содержания α‑холестерина свидетельствует об угрозе атеросклероза.
Возрастание индекса атерогенности до 4 и более наблюдается при ишемической болезни сердца и атеросклерозе.
