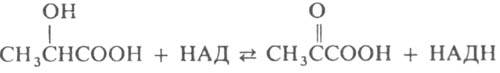3.6. Лактатдегидрогеназа (лдг)
Лактатдегидрогеназа (ЛДГ; L-лактат-НАД-оксидоредуктаза, КФ 1.1.1.27) — цинксодержаший фермент, катализирует обратимую реакцию восстановления пировиноградной кислоты в молочную кислоту при участии НАД-Н2.
Фермент в кристаллической форме был получен из мышцы сердца. Подобным же образом были получены кристаллические ферментные препараты из скелетных мышц и печени. При рН 7,0 равновесие реакции смещено в сторону образования лактата, в щелочной среде реакция проходит в обратном направлении. ЛДГ может также реагировать с НАДФ в качестве кофермента, но значительно медленнее, чем с НАД.
ЛДГ — тетрамер; два локуса генов кодируют синтез двух олигомеров — М- и Н-субъединиц. М-субъединица синтезируется главным образом в тканях с анаэробным метаболизмом, в то время как Н-субъединица присутствует в тканях с преобладанием аэробных процессов. Молекулярная масса каждой субъединицы составляет 35 кДа, каждого тетрамера — 140 кДа. Полипептидная цепь обеих субъединиц содержит 330 аминокислотных остатков; различия в их последовательности в субъединицах обнаружены на протяжении более чем 25% длины полипептидной цепи. В тетрамерной структуре ЛДГ субъединицы связаны силами ионных и водородных взаимодействий. На каждой субъединице расположен каталитический центр; диссоциация тетрамера на димеры или мономеры приводит к потере ферментативной активности.
В цитоплазме клеток и сыворотке крови ЛДГ имеет 5 изоферментов, обозначаемых в соответствии с их подвижностью к аноду в электрическом поле: ЛДГ1 (НННН), ЛДГ2 (НННМ), ЛДГ3, (ННММ), ЛДГ4 (НМММ) и ЛДГ5 (ММММ). ЛДГ, участвует в окислении лактата в пируват в тканях с аэробным типом метаболизма (миокард, мозг, почки, эритроциты, тромбоциты). ЛДГ5 оптимизирована природой для превращения пирувата в лактат в тканях с высоким уровнем гликолиза (скелетные мышцы, печень). Не все изоферменты ЛДГ гомогенны: при электрофоретическом разделении изоферментов ЛДГ сыворотки и эритроцитов в полиакриламидном геле обнаружено расщепление ЛДГ 3 на две полосы, которое позволяет предположить синтез двух форм ЛДГ3 в тканях. Наличие молекулярных структур двух форм, подтвержденное в реакции с антисывороткой, объясняют различием пространственного (цис и транс) расположения Н-субъединиц и М-субъединиц в тетрамере.
В тканях человека активность ЛДГ на 1 г сухой массы уменьшается в последовательности: почки — скелетная мышца – поджелудочная железа — селезенка — печень — плацента. Изоферменты ЛДГ, и ЛДГ2 преобладают в эритроцитах, лейкоцитах, миокарде, почках, ЛДГ4 и ЛДГ5 — в печени, скелетных мышцах, неопластических тканях, наиболее высокое содержание ЛДГ3 отмечают в лимфоидной ткани, тромбоцитах и опухолях.
Свойства изоферментов ЛДГ определены особенностями входящих в них субъединиц. Изоферментам ЛДГ присущи разные кинетические характеристики: рН, при котором они проявляют максимальную активность, сродство к субстратам и кофакторам.
Клиническое значение определения активности ЛДГ
Активность ЛДГ в сыворотке крови повышается при многих патологических состояниях, поэтому для дифференциальной диагностики заболеваний более целесообразно исследовать изменения спектра изоферментов ЛДГ. В настоящее время накоплено большое количество данных о распределении изоферментов ЛДГ в тканях и об изменении спектра изоферментов ЛДГ в сыворотке крови при различных заболеваниях. Изоферментный спектр скелетной мускулатуры показывает преобладание ЛДГ5. При мышечной дистрофии отмечены увеличение более подвижных изоферментов ЛДГ и снижение активности ЛДГ5, что характерно и для многих нейромышечных заболеваний. Причиной изменения спектра изоферментов может быть быстрое удаление малоподвижных изоферментов из циркуляции. Активность ЛДГ 5 в сыворотке крови — чувствительный индикатор гепатоцеллюлярного поражения, увеличение его активности обычно наблюдают при гепатите, гипоксии печени (включая застой крови в печени вследствие сердечной недостаточности), лекарственной интоксикации, циррозе, опухолях и травме. Активность ЛДГ в сыворотке крови не повышается при хронических заболеваниях почек и уремии, но иногда возрастает после гемодиализа или плазмафереза, что может быть объяснено удалением из крови ингибиторов (мочевина, оксалаты).
Общая активность ЛДГ при инфаркте миокарда наиболее значительно повышается в течение первых 2 сут после приступа стенокардии и до исходного уровня понижается медленно, в течение 14-16 дней, эпизодическое повышение ЛДГ можно отметить и в более поздние сроки.
Активность
ЛДГ подвержена гормональному влиянию.
Большие дозы тироксина снижали синтез
фермента, при этом в большей мере отмечено
ингибирование синтеза субъединицы М.
Норадреналин и адреналин вызывают
увеличение общей активности ЛДГ с
преобладанием активности ЛДГ
Спектр изоферментов ЛДГ может меняться при неопластических процессах. В таких случаях его трудно интерпретировать, так как источником изоферментов ЛДГ служит не только неопластическая ткань, но и ткани, разрушаемые метастазами. Однако изоферментный спектр транссудатов при опухолевом поражении сходен с таковым сыворотки крови, тогда как в воспалительных экссудатах преобладает активность ЛДГ1 и ЛДГ2. Для ЛДГ, как и для других ферментов, при опухолевом процессе характерен синтез изоферментов, свойственных эмбриональным тканям. Недифференцированные эмбриональные ткани имеют спектр изоферментов ЛДГ, в котором преобладают ЛДГ 2 и ЛДГ3, а также ЛДГ4. В злокачественных опухолях обнаружено три вида распределения изоферментов ЛДГ. Увеличение содержания ЛДГ4 и ЛДГ5 выявлено при опухолях предстательной железы, матки, молочных желез, желудка, толстой кишки, мочевого пузыря и некоторых типах опухолей мозга. У больных лейкозом, злокачественной лимфомой, нейробластомой, феохромоцитомой, а также при опухолях полости рта, раке бронхов и некоторых типах опухолей мозга увеличена активность ЛДГ2, ЛДГ3, ЛДГ4. Увеличение активности ЛДГ, отмечено в сыворотке крови больных с некоторыми типами опухолей мозга и разными типами опухолей половых органов.
Возможность повышения активности ЛДГ, при опухолевом процессе следует учитывать при диагностике инфаркта миокарда. Иногда при опухолях мозга, раке пишевода, нейробластоме отмечают необычную дополнительную полосу при ЭФ сыворотки крови и ткани опухоли. Определение спектра изоферментов ЛДГ в сыворотке крови при онкологических заболеваниях полезно не только для диагностики, но и для контроля эффективности лечения. Обнаружено, что нормализация спектра изоферментов ЛДГ коррелирует с успешностью ответа больного на лечение.
Наличие осложнений при инфаркте миокарда и сопутствующие заболевания могут изменить спектр ЛДГ и активность ЛДГ. Выявление спектра изоферментов, характерного для инфаркта миокарда, возможно при застое крови в печени и почках вследствие сердечной недостаточности, при ишемическом поражении некоторых органов из-за резкого снижения сердечного выброса. При эмболии легочной артерии, которую в ряде случаев приходится дифференцировать с инфарктом миокарда, увеличение в крови активности ЛДГ2 и ЛДГ3 может быть объяснено выходом ферментов из тромбоцитов, патологией печени, вызванной венозной гипертензией, анемией коркового слоя надпочечников и почек. Поскольку эти нарушения не всегда удается различить, изменение спектра изоферментов ЛДГ интерпретировать непросто.
В сыворотке крови тяжелобольных (как правило, в терминальном состоянии) методом ЭФ на ацетате целлюлозы выявляется дополнительная полоса, более близкая к катоду, чем ЛДГ5, названная ЛДГ6. Во всех наблюдениях в тканях печени, скелетных мышцах, почке, селезенке и надпочечниках также отмечено присутствие ЛДГ6; в ряде случаев появление этой фракции носило транзиторный характер, ЛДГ6 не обнаружена в тканях миокарда. Считают, что нет нозологической формы заболевания, для которой характерна ЛДГ6, но есть тяжелые клинические состояния, обусловливающие ее появление, к которым следует отнести выраженный ацидоз, гипотонию и сепсис.
ЛАКТАТДЕГИДРОГЕНАЗА — Большая Медицинская Энциклопедия
ЛАКТАТДЕГИДРОГЕНАЗА (L-лактат: НАД — оксидоредуктаза; КФ 1.1.1.27 и 28; ЛДГ) — фермент углеводного обмена, катализирующий одну из важнейших реакций анаэробного гликолиза — взаимопревращение пировиноградной и молочной к-т.
Активность этого фермента в сыворотке крови и относительное содержание его изоферментов являются важным биохимическим диагностическим тестом при ряде заболеваний.
Лактатдегидрогеназа обнаруживается во всех тканях животных и человека, особенно в сердечной и скелетных мышцах, эритроцитах, печени и почках. Локализована Лактатдегидрогеназа в цитоплазме.
В физиологических условиях равновесие реакции, катализируемой Лактатдегидрогеназой, смещено в сторону образования молочной к-ты (лактата). Коферментом Лактатдегидрогеназы является НАД (см. Никотинамидадениндинуклеотид).
Восстановление пирувата под действием Л. завершает внутренний окислительно-восстановительный цикл гликолиза (см.). Когда клетки мышц высших организмов в условиях большой мышечной нагрузки вынуждены функционировать в анаэробных условиях, из мышц в кровь поступает большое количество лактата. В печени этот лактат вновь превращается в глюкозу (см.). Утомление мышц частично обусловлено развитием ацидоза в мышцах, т. к. при гликолизе из каждой нейтральной молекулы глюкозы образуются две молекулы молочной к-ты (см. Лактат-ацидоз).
С точки зрения кинетики, реакции, катализируемые Л., представляют собой двухсубстратные реакции с упорядоченным связыванием субстратов. Первым с Л. связывается кофермент, продукты реакции диссоциируют последовательно. В реакции восстановления пирувата стадией, лимитирующей скорость реакции, является изомеризация тройного комплекса: Л.— НАД-H — пируват. В реакции окисления лактата такой лимитирующей стадией является диссоциация пирувата или НАД-h3. Помимо пирувата, Л. катализирует восстановление гомологичных ему альфа-кетокислот — альфа-кетомасляной, альфа-кетовалериановой и альфа-кетокапроновой. Л. неактивна при использовании в качестве субстратов щавелево-уксусной (оксалата) и альфа-кетоглутаровой к-т, а также бета- и δ-кетокислот, кетонов и ацетальдегида. Л. обладает строгой стереоспецифичностью: она катализирует окисление только L-молочной к-ты; при восстановлении же оптически неактивного пирувата также образуется только L-молочная к-та (см. Изомерия).
Активность Л. обычно определяют спектрофотометрическим методом, основанным на измерении поглощения НАД-Н2 при 340 нм.
Аминокислотный состав и первичная структура Л. различаются в зависимости от источника выделения фермента и его изоферментного состава (см. Изоферменты). Мол. вес (масса) Л. равен приблизительно 140 000. Молекула Л. представляет собой тетрамер, состоящий из одного или двух типов субъединиц. В каждой из них имеются остатки цистеина и гистидина, существенные для проявления ферментативной активности, блокирование которых приводит к инактивации фермента. Активный центр в молекуле Л., где происходит связывание кофермента и субстрата, представляет собой гидрофобную область протяженностью 1,4 нм, содержащую остатки аргинина, дикарбоновых к-т и гистидина.
Лактат и пируват в высоких концентрациях вызывают ингибирование Л. вследствие образования непродуктивных комплексов с ферментом.
Адениновые нуклеотиды, оксалат и оксамат обратимо и конкурентно ингибируют Л. Дезамино-НАД эффективно участвует в реакции, катализируемой Л.
Л. существует по меньшей мере в пяти различных молекулярных формах, т. е. фермент представлен пятью изоферментами, которые обозначают в порядке расположения их на электрофореграмме по направлению к аноду при щелочных значениях pH: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. В сердечной мышце и почках содержится гл. обр. ЛДГ1. В скелетных мышцах и в печени содержится в основном ЛДГ5. Катализируя одну и ту же реакцию, изоферменты Л. четко различаются по величинам констант Михаэлиса — Ментен (Км) для субстратов. Высказывалось предположение, что отдельные изоферменты предпочтительно катализируют прямую или обратную лактатдегидрогеназную реакцию.
Полипептидные цепи в молекулах изоферментов Л. могут быть двух различных типов, обозначаемых обычно М или Н. Установлено, что пять изоферментов Л. имеют следующий субъединичный состав: ЛДГ1—Н4, ЛДГ2-Н3М, ЛДГ3-Н2М2, ЛДГ4—h2M3 и ЛДГ5—М4. Изоферменты Л. типа М4 и НМ3 содержатся преимущественно в тех тканях, в которых энергия образуется за счет гликолиза, напр, в белых скелетных мышцах или в эмбриональных тканях. Изоферменты же типа Н3М и Н4 встречаются гл. обр. в тканях, для которых характерен аэробный или дыхательный метаболизм. Изоферменты Л. отличаются друг от друга способностью к инактивации высокими концентрациями пирувата. Более чувствителен по отношению к пирувату изофермент ЛДГ5, что объясняется самой высокой скоростью образования им тройного непродуктивного комплекса Л.— НАД-H — пируват и его стабильностью. В организме обычно синтезируются субъединицы Л. обоих типов, но в неодинаковом количестве для разных тканей, что обусловливает сборку тех или иных изоферментов Л., специфичных именно для той или иной ткани. Пептидные цепи двух типов субъединиц Л. кодируются двумя разными генами. Влияние мутаций на изофермеиты Л. зависит от того, происходят ли они в локусе, кодирующем биосинтез цепи М, или в локусе, определяющем биосинтез цепи Н. Так, мутация в локусе М. не влияет на свойства ЛДГ1, поскольку этот изофермент не содержит субъединиц М. Вместе с тем такая мутация в разной степени изменяет свойства ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5, содержащих соответственное количество субъединиц М. Аналогично мутация в локусе В не должна затрагивать ЛДГ5, в отличие от остальных четырех изоферментов Л.
У гетерозигот (см. Менделя законы) синтезируется очень сложный набор изоферментов Л. Так, у индивидуума, гетерозиготного по локусу М., но гомозиготного по нормальному аллелю локуса Н, могут синтезироваться 15 изоферментов Л., распределение которых будет иным, нежели у индивидуума, гетерозиготного по локусу Н, но гомозиготного по локусу М. Соотношение нормальных и вариантных изоферментов определяется соотношением нормальных и вариантных полипептидов, доступных для образования тетрамеров.
У людей найдено значительное число вариантов Л., различающихся по своему изоферментному спектру (качественно и количественно). Все они сравнительно редки и были обнаружены путем обычного электрофоретического исследования. Ни один из известных вариантов, по-видимому, не связан с какой-либо определенной клинически проявляющейся аномалией. В каждом случае наблюдается сложная, но совершенно определенная картина электрофоретического разделения.
Кроме локусов, кодирующих М- и Н-субъединицы Л., существует, по-видимому, третий локус, определяющий еще одну субъединицу. Наличие этой субъединицы приводит к появлению особого типа тетрамерного изофермента (соответствующую ему полосу на электрофореграмме называют Х-полосой), характерного для сперматозоидов человека и животных.
Клиническое значение определения активности лактатдегидрогеназы
Уже через несколько часов после начала острого инфаркта миокарда в сыворотке крови отмечают значительное повышение активности Л. Через 36—48 час. эта активность достигает своего максимума (нередко она в 10—15 раз превышает нормальную). Оптимальный период для определения активности Л. в сыворотке крови составляет 2—4 суток после начала инфаркта, т. к. в этот временной отрезок ценность этого биохим, теста наиболее велика. Так, напр., его диагностическая точность, по данным И. В. Мартынова, при трансмуральном инфаркте миокарда в этот отрезок времени равна 97 ± 1,7%.
Обычно активность Л. в сыворотке крови при инфаркте возвращается к норме на 10—12-й день после начала заболевания. Активность Л. в сыворотке крови при инфаркте миокарда остается повышенной дольше других ферментов (напр., аминотрансфераз).
Ценность определения активности Л. в сыворотке крови особенно велика в неясных случаях инфаркта миокарда (при нетипичной клин, и электрокардиографической картинах, в частности при длительных ангинозных приступах, сопровождающихся преходящей деформацией сегмента S T или зубца T без появления патол, зубца Q), а также для дифференциальной диагностики между инфарктом миокарда и расслаивающей аневризмой аорты, острым перикардитом и тромбозом легочной артерии. При всех этих заболеваниях повышение активности Л. в сыворотке крови не столь резкое, как при инфаркте миокарда.
Однако величина активности Л. не позволяет с уверенностью судить о размерах поражения сердечной мышцы и тем более прогнозировать исход заболевания.
У больных стенокардией повышения активности Л. в сыворотке крови не наблюдается. Это позволяет применять ЛДГ-тест как надежный критерий отсутствия поражения сердечной мышцы в пределах 2—3 суток после сердечного приступа.
Активность Л. в сыворотке крови повышается при паренхиматозном гепатите в первые дни желтушного периода. При легкой и среднетяжелой форме заболевания активность фермента довольно быстро возвращается к норме. При механической желтухе активность Л. в сыворотке крови остается в норме, лишь на поздних стадиях болезни она повышается вследствие вторичных повреждений паренхимы печени. При карциномах печени и метастазах рака в печень активность Л. в сыворотке крови также может увеличиваться; при этом концентрация пирувата в сыворотке крови повышается в 2—3 раза (норма 0,5—1,0 мг%). Однако отрицательный результат ЛДГ-теста в этом случае отнюдь не свидетельствует об отсутствии злокачественного поражения печени.
В стадии ремиссии хрон, гепатита активность Л. в сыворотке крови остается в пределах нормы или слегка повышается, при обострении процесса возрастает. В этом случае ЛДГ-тест может быть использован в качестве вспомогательного вместе с другими ферментными пробами.
Активность Л. в сыворотке крови возрастает также при прогрессирующей мышечной дистрофии, хрон, лимфогранулематозе, лейкозах, пернициозной анемии, острых и хрон, нефритах, при опухолях в мочевыводящих путях и других заболеваниях.
Более важное значение в диагностике по сравнению с определением общей активности сывороточной Л. имеет определение изоферментного состава Л. Обычно в сыворотке крови здоровых людей обнаруживаются все 5 фракций Л., активность которых распределяется следующим образом: ЛДГ2>ЛДГ1>ЛДГ3>ЛДГ4>ЛДГ5. При остром инфаркте миокарда изменяется соотношение между активностями ЛДГ1 и ЛДГ2 так, что активность ЛДГ1 становится равной активности ЛДГ2 или выше ее. Этот показатель имеет большое значение в поздней диагностике инфаркта миокарда. Кроме того в силу специфичности этого теста он может быть использован для дифференциальной диагностики.
При паренхиматозных повреждениях ткани печени (инфекционный гепатит), а также при некоторых заболеваниях мышц (прогрессирующая мышечная дистрофия) обнаруживают значительное повышение относительного содержания ЛДГ5, что также находит применение в энзимодиагностике этих заболеваний.
См. также Дегидрогеназы.
Библиография:
Ньюсхолм Э. и Старт К. Регуляция метаболизма, пер. с англ., с. 111, 291, М., 1977;
Северин С. Е. Гликолиз, в кн.: Хим. основы процессов жизнедеят., под ред. В. Н. Ореховича, с. 156, М., 1962; Харрис Г. Основы биохимической генетики человека, пер. с англ., с. 53, М., 1973; Holbro ok J. J. а. о. Lactate dehydrogenase, в кн.: Enzymes, ed. by P. D. Boyer, v. И, p. 191, N. Y.— L., 1975, bibliogr.
Г. Я. Видершайн.
Использование активности лактатдегидрогеназы в клинической диагностике
Одновременно в организме человека происходят миллионы различных химических взаимодействий. Какие-то химические реакции должны были бы длиться очень долго, а многие из них вообще не должны происходить. Протекают реакции благодаря участию в обмене веществ ферментов. Одним из них в организме человека является лактатдегидрогеназа.
Цель работы: обобщить сведения о функции ЛДГ и методах определения её активности.
Основная задача: подготовка к поиску новых ингибиторов ЛДГ.
Лактатдегидрогеназа (ЛДГ) — это фермент, катализирующий реакцию образования пировиноградной кислоты из молочной кислоты, а также обратную реакцию.
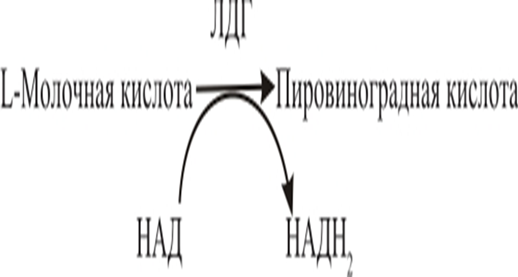
Рис. 1. Образование пировиноградной кислоты из молочной кислоты
Молекула ЛДГ представляет собой тетрамер, который состоит из 1 или 2 типов субъединиц, которые обозначаются как М(англ. Muscle) и Н(англ. Heart). Субъединицы различаются между собой по аминокислотному составу, иммунохимическим свойствам.
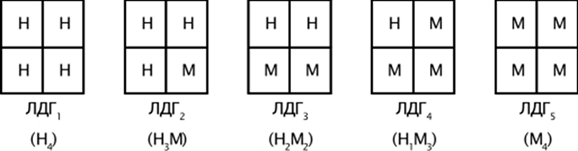
Рис. 2. Схема строения изоферментов ЛДГ
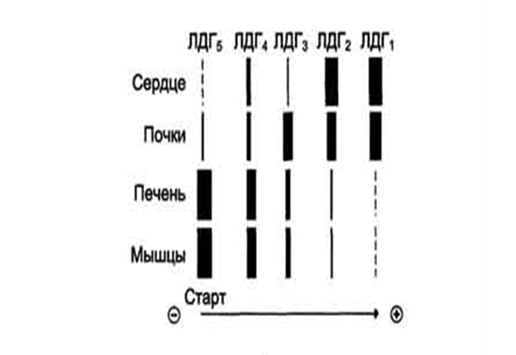
Рис. 3. Органоспецифичность ЛДГ
Наиболее точным, специфичным и быстрым методом определения активности ЛДГ является кинетический спектрофотометрический метод, который базируется на оптическом тесте Варбурга. Принцип метода основан на отличии спектров поглощения восстановленной (НАДН) и окисленной (НАД) форм никотинамидадениндинуклеотида. При 340 нм НАДН имеет максимальное поглощение, тогда как НАД не имеет поглощения при данной длине волны. Таким образом, при превращении НАДН в НАД происходит уменьшение оптической плотности реакционной смеси при 340 нм. [1]
Использование ЛДГ в клинической диагностике
Во время острого инфаркта миокарда сердечная мышца выделяет в кровь большое количество ферментов. Скорость выброса различных специфических ферментов неодинакова. Изменение во времени их уровня в крови имеет большую диагностическую ценность.
Увеличение активности ЛДГ можно наблюдать при заболеваниях печени, но степень ее повышения не столь высока по сравнению с аминотрансферазами.
Умеренное увеличение активности ЛДГ обнаружено в сыворотке крови пациентов с прогрессирующей мышечной дистрофией, особенно на ранних стадиях заболевания. Наблюдаемое увеличение обычно связано с изоферментом ЛДГ5, преобладающим в скелетной мышце.
Подготовка к поиску новых ингибиторов ЛДГ
Распад каждой молекулы глюкозы до пировиноградной кислоты требует восстановления двух молекул НАД до НАДН. Однако запас НАД в клетке ограничен, поэтому распад глюкозы в конечном итоге прекращается. Катаболизм глюкозы может продолжаться лишь при соответствующем окислении НАДН. Такая регенерация НАД возможна в результате лактатдегидрогеназной реакции — ферментативного превращения пировиноградной кислоты в молочную. На каждую образующуюся молекулу молочной кислоты приходится одна молекула НАД, что обеспечивает превращение еще одной половины молекулы глюкозы. Путь от глюкозы до молочной кислоты называют лактатным гликолизом; таким образом, в энергию без участия кислорода может быть превращено столько глюкозы, сколько потребуется. Еще в 1923 г. Варбург, анализируя поглощение кислорода и образование молочной кислоты в срезах солидных опухолей, обнаружил, что они поглощают меньше кислорода и образуют больше молочной кислоты, чем срезы нормальной ткани. В нормальной клетке активность ЛДГ стабильна в двух направлениях. В случае нарушений в дыхательной цепи (эффект Варбурга) равновесие смещается вправо. [2]
В результате нормальная клетка идёт по пути развития раковой. 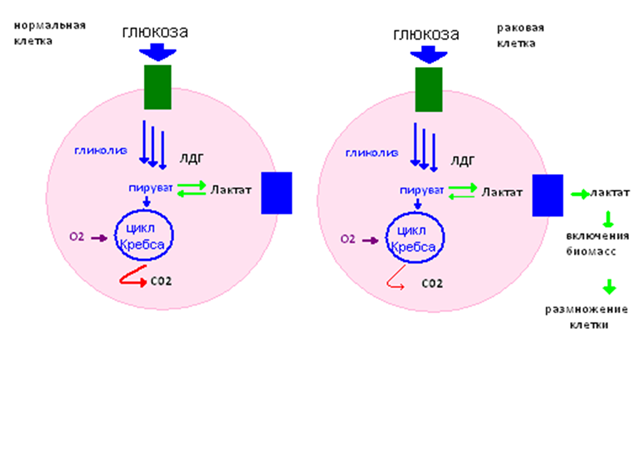 Рис. 4. Схема протекания процессов в нормальной и раковой клетках
Рис. 4. Схема протекания процессов в нормальной и раковой клетках
В настоящее время уже существуют ингибиторы ЛДГ, которые позволяют путь развития раковой клетки делать менее вероятным. Однако, основная задача в дальнейшей работе, проанализировав строение ЛДГ и механизмы связывания фермента с веществами, создать новые ингибиторы, которые могут быть более доступными.
Литература:
1. https://ru.wikipedia.org/wiki/Лактатдегидрогеназа
2. http://lekmed.ru/info/arhivy/rak-eksperimenty-i-gipotezy-38.html
Лактатдегидрогеназа — Большая советская энциклопедия
Лактатдегидрогена́за
Фермент класса оксидоредуктаз (См. Оксидоредуктазы); катализирует обратимое восстановление пировиноградной кислоты до L-молочной кислоты с потреблением в качестве кофермента восстановленного Никотинамидадениндинуклеотида (НАД․Н+Н+):

Л., выделенная в кристаллическом виде из мышечной ткани позвоночных, состоит из 4 полипептидных субъединиц (молекулярная масса тетрамера Л. 140000). Равновесие катализируемой Л. реакции сильно сдвинуто в сторону образования молочной кислоты. Реакция требует присутствия НАД․Н+Н+ и протекает в большинстве животных тканей в анаэробных условиях. Исключение составляют раковые клетки: в них образуется большое количество молочной кислоты в аэробных условиях. Известно 5 изоферментов (См. Изоферменты) Л., различающихся как по аминокислотному составу, так и по некоторым физическим, иммунологическим и каталитическим свойствам. Определение активности Л. в плазме крови имеет диагностическое значение. В молочнокислых бактериях обнаружена Л., катализирующая образование D-молочной кислоты с участием восстановленного НАД.
Ю. Н. Лейкин.
Источник: Большая советская энциклопедия на Gufo.me
Значения в других словарях
- лактатдегидрогеназа — сущ., кол-во синонимов: 1 фермент 253 Словарь синонимов русского языка
- Лактатдегидрогеназа — I Лактатдегидрогеназа (ЛДГ, лактат, НАД+ оксидоредуктаза, дегидрогеназа молочной кислоты) фермент углеводного обмена, катализирует важнейшую реакцию гликолиза — взаимопревращение пировиноградной и молочной кислот, т. Медицинская энциклопедия
- лактатдегидрогеназа — Фермент класса оксидоредуктаз; катализирует обратимую реакцию восстановления пировиноградной кислоты до молочной кислоты на последней стадии гликолиза. Биологический энциклопедический словарь
- ЛАКТАТДЕГИДРОГЕНАЗА — ЛАКТАТДЕГИДРОГЕНАЗА — фермент, катализирующий обратимое восстановление пировиноградной кислоты до молочной кислоты в процессе гликолиза. Определение лактатдегидрогеназы в сыворотке крови человека имеет диагностическое значение. Большой энциклопедический словарь

Лактатдегидрогеназа (ЛДГ) | Клинико-диагностические лаборатории «ОЛИМП»
Внутриклеточный фермент, основная функция которого заключается в осуществлении гликолиза, то есть «сжигании» глюкозы с выделением энергии.
Существует 5 видов ЛДГ, которые содержатся в определенных органах:
ЛДГ-1 – сердце и красные кровяные тельца (эритроциты)
ЛДГ-2 – ретикуло-эндотелиальная система (селезенка, лимфатические узлы)
ЛДГ-3 – легкие
ЛДГ-4 – почки, плацента, поджелудочная железа
ЛДГ-5 – печень и мышцы
При разрушении вышеперечисленных тканей, в кровь начинает поступать ЛДГ в большом количестве. Следовательно, данный анализ необходим врачам разных сфер деятельности.
При инфаркте миокарда – пик активности ЛДГ наблюдается на 3-4 день, и затем остается на одном уровне в течение 10 суток. Если у пациента был тяжелый приступ стенокардии (отличается от инфаркта тем, что нет гибели сердечной мышцы), то через несколько дней после приступа анализ покажет было ли разрушение сердечных клеток.
При эмболии легких (закупорка тромбом просвета кровеносного сосуда в легких) наблюдается триада лабораторных симптомов: повышение ЛДГ и билирубина при нормальном значении АСТ. Что помогает отличить эмболию от инфаркта миокарда.
При вирусном менингите (воспаление оболочек головного мозга) повышение ЛДГ носит негативный характер – свидетельствует о том, что у пациента развивается энцефалит (воспаление вещества мозга)
При заболеваниях мышц ЛДГ указывает на причину – повышается при гибели мышечных волокон и остается неизменной, если заболевание вызывают проблемы со стороны нервной системы.
Тяжелые формы гепатита (воспаление печени) характеризуются высокими и длительно неизменяющимися цифрами ЛДГ.
Лактатдегидрогеназа помогает в диагностике анемии (низкий уровень гемоглобина, содержащийся в эритроцитах). При гемолитической анемии, когда происходит разрушение эритроцитов и, как следствие, снижение гемоглобина, ЛДГ увеличивается.
ЛАКТАТДЕГИДРОГЕНАЗА — это… Что такое L-ЛАКТАТДЕГИДРОГЕНАЗА?
- L-ЛАКТАТДЕГИДРОГЕНАЗА
(L-лактат: НАД + оксидоредуктаза), фермент класса оксидоредуктаз, катализирующий на последней стадии гликолиза обратимую р-цию окисления L-молочной к-ты до пировиноградной:

В ур-нии НАД и НАДН — соотв. окисленная и восстановленная формы никотинамидадениндинуклеотида, к-рые выполняют ф-цию кофермента. Л. окисляет также нек-рые др. L-2-гидроксикарбоновые к-ты. Л. содержится во всех живых организмах, гл. обр. в цитоплазме клеток. Фермент животных — тетрамер, состоящий из одинаковых субъединиц (Н 4 или М 4) либо из их сочетаний (Н 3 М, Н 2 М 2, НМ 3). В тканях с аэробным обменом (сердце, печень) преобладает тетрамер Н 4, характеризующийся макс. электрофоретич. подвижностью среди всех изоферментных форм Л.; в скелетных мышцах — форма М 4, обладающая миним. подвижностью. Изофермент Н 4 предпочтительно катализирует окисление молочной к-ты в мышечной ткани сердца, а М 4 — восстановление пировиноградной к-ты в скелетных мышцах при низкой концентрации субстрата. У Л. из мышц (мол. м. 140 тыс.) оптим. каталитич. активность при рН 7,4-8,5; рI 4,5. В Л. имеется общий для мн. дегидрогеназ (катализируют окислит. — восстановит. р-ции с переносом водорода от одного соед. к другому) структурный фрагмент, связывающий НАД, к-рый состоит из 6 плотно упакованных параллельных b-цепей и неск. a-спиральных участков. Первичная структура определена для Л. из ряда источников (для Л. из акулы изучены структура активного центра и механизм каталитич. действия). Ингибиторы Л. — соед., реагирующие с группой SH, и гидроксиламин. Определение спектра изоферментного состава Л. в плазме крови используют для диагностики нек-рых болезней печени (напр., инфекц. гепатита) и сердца. Лит.:The enzymes, 3 ed., v. II, pt A, N.Y., 1975, p. 191-292. T. H. Дружинина.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
- ЛАКТАМЫ
- ЛАКТИДЫ
Смотреть что такое «L-ЛАКТАТДЕГИДРОГЕНАЗА» в других словарях:
Лактатдегидрогеназа — Идентификаторы 1.1.1.27 CAS number 9001 60 9 Базы ферментов IntEnz … Википедия
ЛАКТАТДЕГИДРОГЕНАЗА — фермент, катализирующий обратимое восстановление пировиноградной кислоты до молочной кислоты в процессе гликолиза. Определение лактатдегидрогеназы в сыворотке крови человека имеет диагностическое значение … Большой Энциклопедический словарь
ЛАКТАТДЕГИДРОГЕНАЗА — фермент класса оксидоредуктаз; катализирует обратимую реакцию восстановления пиро виноградной кислоты до молочной кислоты на последней стадии гликолиза. Л. состоит из 4 полипептидных субъединиц 2 типов (один тип субъединиц характерен для… … Биологический энциклопедический словарь
лактатдегидрогеназа — сущ., кол во синонимов: 1 • фермент (253) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
лактатдегидрогеназа — лактатдегидрогеназа … Орфографический словарь-справочник
лактатдегидрогеназа — Фермент, катализирующий обратимое восстановление пировиноградной кислоты до молочной кислоты [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN lactic dehydrogenase … Справочник технического переводчика
Лактатдегидрогеназа ЛДГ — Лактатдегидрогеназа, ЛДГ * лактатдэгідрагеназа, ЛДГ * lactate dehydrogenase or LDH … Генетика. Энциклопедический словарь
лактатдегидрогеназа — фермент, катализирующий обратимое восстановление пировиноградной кислоты до молочной кислоты в процессе гликолиза. Определение лактатдегидрогеназы в сыворотке крови человека имеет диагностическое значение. * * * ЛАКТАТДЕГИДРОГЕНАЗА… … Энциклопедический словарь
лактатдегидрогеназа — lactate dehydrogenase лактатдегидрогеназа [КФ 1.1.1.27]. Фермент класса оксидоредуктаз, катализирующий обратимое восстановление пировиноградной кислоты до молочной на последней стадии гликолиза; широко используется в качестве маркера в… … Молекулярная биология и генетика. Толковый словарь.
лактатдегидрогеназа — laktatdehidrogenazė statusas T sritis chemija apibrėžtis Fermentas, katalizuojantis pieno rūgšties oksidaciją. atitikmenys: angl. lactodehydrogenase rus. лактатдегидрогеназа … Chemijos terminų aiškinamasis žodynas
лактатдегидрогеназа — фермент из класса оксидоредуктаз (КФ 1.1.1.27 и 1.1.1.28), катализирующий взаимопревращение пировиноградной и молочной кислот; содержится во всех тканях человека, участвуя в процессах анаэробного гликолиза; повышенное содержание Л. в сыворотке… … Большой медицинский словарь
ЛДГ — лактатдегидрогеназа, характеристика фракций | Про Анализы
ЛДГ или лактатдегидрогеназа катализирует обратимое превращение молочной кислоты (лактата) в пировиноградную. У этого фермента выделено 5 фракций с одинаковым коферментом у всех. А для белковой части фракций ЛДГ доказано существование 4 полипептидных субъединиц одинакового размера, но двух разных типов, которые условно обозначены:
- Н-тип (от heart — сердце)
- М-тип (от muscle — мышцы).
Способ сочетания между собой белковых субъединиц в молекуле определяет тип изофермента и его физико-химические свойства:
- ЛДГ 1 — НННН
- ЛДГ 2 — НННМ
- ЛДГ 3 — ННММ
- ЛДГ 4 — НМММ
- ЛДГ 5 — ММММ
В сердечной мышце преобладает ЛДГ 1 и повышение ее активности в крови всегда соотносят с деструктивными процессами в миокарде — ЛДГ 1 очень показателен в диагностике инфаркта миокарда. ЛДГ 2 и, особенно, ЛДГ 3 преобладают в почках, легких. ЛДГ 4 и ЛДГ 5 — это изоферменты печени и скелетной мускулатуры.
Определяют изоферменты ЛДГ методом электрофореза в полиакриламидном геле, либо пробирочным методом, используя избирательное ингибирование отдельных фракций (тепловое, химическое).
Увеличивается активность лактатдегидрогеназы (ЛДГ) при инфаркте миокарда, некротических поражениях почек, гепатите, остром панкреатите, злокачественных новообразованиях, лейкозах, гемолитической и серповидноклеточной анемиях, инфекционном мононуклеозе, прогрессирующей мышечной дистрофии.
У больных инфарктом миокарда повышение активности ЛДГ отмечается через 12-24 часа от начала приступа. Максимальное увеличение активности фермента наступает через 48-72 часа. Снижаться активность начинает на 5-6 сутки. Нормализуется активность ЛДГ на 7-8 сутки.
Степень повышения активности ЛДГ пропорциональна тяжести поражения миокарда:
- при мелкоочаговом инфаркте активность ЛДГ увеличивается на треть,
- при крупноочаговом инфаркте — в 1,5-2 раза;
- при трансмуральном инфаркте — в 2,5-3 раза.
Повышение общей активности ЛДГ при инфаркте миокарда обусловлено увеличением активности ее изофермента ЛДГ 1. Вместе с тем, известны случаи, когда общая активность ЛДГ при инфаркте миокарда остается в пределах нормы или незначительно увеличивается за счет компенсаторного перераспределения активностей других ее изоферментов в ответ на увеличение активности ЛДГ 1. Поэтому наиболее показательными в диагностике инфаркта миокарда и другой патологии, являются методы, позволяющие определять активность отдельных изоферментов ЛДГ, к тому же обладающих органоспецефичностью.
Недостаточность кровообращения по малому кругу, тромбоз легочной артерии вызывает увеличение активности легочной фракции ЛДГ 3. При патологии печени увеличивается активность ЛДГ 4 и ЛДГ 5.
Нормальные пределы уровня ЛДГ в крови
0-450 Ед/л
Изменения уровня ЛДГ у крови — может происходить как в сторону повышения одной из фракций так и снижения.
Повышение ЛДГ
- инфаркт миокарда
- поражение печени
- лейкозы
- инфекционный мононуклеоз
- тромбоцитопении (снижение числа тромбоцитов крови)
- опухоли
- прогрессирующая мышечная дистрофия
Лактатдегидрогеназа фракция 1 — ЛДГ-1
Норма ЛДГ-1: 19—29%
Повышение ЛДГ-1
- инфаркт миокарда
Лактатдегидрогеназа фракция 2 — ЛДГ-2
Норма ЛДГ-2: 23-37%
Повышение ЛДГ-2
Лактатдегидрогеназа фракция 3 — ЛДГ-3
Норма ЛДГ-3: 17-25%
Повышение ЛДГ-3
- острые лейкозы
Лактатдегидрогеназа фракция 4 — ЛДГ-4
Норма ЛДГ-4: 8-17%
Повышение ЛДГ-4
Лактатдегидрогеназа фракция 5 — ЛДГ-5
Норма ЛДГ-5: 8-18%
Повышение ЛДГ-5
- острый гепатит
- цирроз печени
- поражение мышц