Кишечная палочка — Википедия
Кишечная палочка (лат. Escherichia coli) — вид грамотрицательных палочковидных бактерий, широко распространённых в нижней части кишечника теплокровных животных. Большинство штаммов E. coli являются безвредными, однако серотип O157:H7 может вызывать тяжёлые пищевые отравления у людей[1] и животных[2]. Безвредные штаммы являются частью нормальной флоры кишечника человека и животных. Кишечная палочка приносит пользу организму хозяина, например, синтезируя витамин K[3], а также предотвращая развитие патогенных микроорганизмов в кишечнике[4][5].
E. coli не всегда обитают только в желудочно-кишечном тракте, способность некоторое время выживать в окружающей среде делает их важным индикатором для исследования образцов на наличие фекальных загрязнений[6][7]. Бактерии легко могут быть выращены в лабораторных условиях, поэтому кишечная палочка играет важную роль в генетических исследованиях.
E. coli была описана немецким педиатром и бактериологом Теодором Эшерихом в 1885 году[6]. В настоящее время кишечную палочку относят к роду эшерихий (Escherichia), названному в честь Теодора Эшериха семейства энтеробактерий[8].
Штаммы
 Модель последовательного бинарного деления E. coli
Модель последовательного бинарного деления E. coliШтамм — это совокупность особей внутри вида, которая обладает свойствами, отличными от свойств других особей. Часто такие отличия могут быть обнаружены только на молекулярном уровне, однако имеют эффект на физиологию бактерии или жизненный цикл. Разные штаммы E. coli часто специфичны к определённым хозяевам, что делает возможным определение источника фекального заражения в образцах [6][7]. Например, если известно, какие штаммы E. coli представлены в образце воды, можно определить источник заражения, например, человек, другое млекопитающее или птица.
Новые штаммы E. coli появляются в результате мутаций и горизонтального переноса генов[9]. Некоторые штаммы вырабатывают особенности, губительные для организмов хозяина, такие вирулентные штаммы могут вызывать диарею, что неприятно в случае взрослых и может привести к летальному исходу у детей в развивающихся странах[10]. Более вирулентные штаммы, например, O157:H7 вызывают тяжёлые заболевания и даже приводят к смерти у пожилых людей, маленьких детей и лиц с ослабленным иммунитетом[10][11].
Биология и биохимия
E. coli — грамотрицательная бактерия, факультативный анаэроб, не образует эндоспор. Клетки палочковидные, со слегка закруглёнными концами, размером 0,4—0,8 × 1—3 мкм, объём клетки составляет около 0,6—0,7 мкм³
Оптимальный рост достигается культурами E. coli при температуре 37°C, некоторые штаммы могут делиться при температурах до 49°C[15]. Рост может стимулироваться аэробным или анаэробным дыханием, различными парами окислителей и восстановителей, в том числе, окислением пирувата, формиата, водорода, аминокислот, а также восстановлением кислорода, нитрата, диметилсульфоксида и триметиламин N-оксида[16].
Штаммы, имеющие жгутики, способны передвигаться. Жгутики расположены перитрихально [17]. На конце жгутика расположен белок FimH, который прикрепляется к молекулам сахаров на поверхности, а сам жгутик состоит из цепочки взаимосвязанных белковых сегментов, закрученных в форме тонкой длинной пружины и упруго вытягивающихся при воздействии силы[18][19].
Роль в нормальной микрофлоре
E. coli в норме заселяет кишечник новорождённого ребёнка в течение 40 часов после рождения, поступая с пищей или от лиц, контактирующих с ребёнком, и сохраняются на протяжении жизни на уровне 106—108 КОЕ/г содержимого толстой кишки. В ЖКТ кишечные палочки прилипают к слизистым оболочкам и являются основными представителями факультативных анаэробов у человека. Так как кишечные палочки не имеют бактериофагов, кодирующих факторы вирулетности, они являются комменсалами[20]. По другим данным, микроорганизмы (в том числе E. coli) начинают заселять человеческий организм ещё в утробе матери
Непатогенный штамм Escherichia coli Nissle 1917 известен как Mutaflor и используется в медицине в качестве пробиотика, в основном для лечения желудочно-кишечных заболеваний, в том числе у новорождённых[22][23].
Модельный организм
E. coli часто используют в качестве модельного организма в микробиологических исследованиях. Культивируемые штаммы, например, E. coli K12 хорошо приспособлены к росту в лабораторных условиях, и, в отличие от штаммов дикого типа, неспособны заселять кишечник. Многие лабораторные штаммы утеряли способность образовывать биологические плёнки[24][25]. Описанные особенности предохраняют штаммы дикого типа от антител и химических агентов, но требуют больших затрат вещества и энергии.
В 1946 году Джошуа Ледерберг и Эдуард Тейтем описали явление конъюгации бактерий, используя кишечную палочку в качестве модельного организма[26]. E. coli остаётся одной из наиболее востребованных бактерий при изучении конъюгации и в настоящее время. E. coli была важным компонентом первых экспериментов по генетике бактериофагов[27], ранние исследователи, например, Сеймор Бензер, использовали E. coli и фаг T4 для изучения структуры генов[28]. До исследований Бензера не было известно, имеет ген линейную или разветвлённую структуру.
Кишечная палочка E. coli была одним из первых организмов, чей геном был полностью секвенирован. Последовательность нуклеотидов в геноме штамма К12 E. coli была опубликована в журнале Science в 1997 году[29].
Долговременный эксперимент по эволюции E. coli был начат Ричардом Ленски в 1988 году и позволил непосредственно наблюдать эволюционные изменения в лабораторных условиях[30]. В данном эксперименте одна популяция E. coli получила возможность аэробно метаболизировать цитрат. Такая способность встречается у
Биотехнология
E. coli играет важную роль в современной промышленной микробиологии и биологической инженерии[31]. Работа Стенли Нормана Коэна и Герберта Бойера на E. coli с использованием плазмид и эндонуклеаз рестрикции для создания рекомбинантной ДНК находится у истоков современной биотехнологии[32].
Кишечную палочку считают универсальным организмом для синтеза чужеродных белков[33]. В E. coli исследователи вводят гены при помощи плазмид, что позволяет осуществлять биосинтез белков для промышленной ферментации. Также разработаны системы для синтеза в E. coli рекомбинантных белков. Одним из первых примеров использования технологии рекомбинантных ДНК является синтез аналога инсулина человека [34]. Модифицированные E. coli используют при разработке вакцин, синтеза иммобилизованных ферментов и решения других задач[33]. Однако в организме E. coli невозможно получать некоторые крупные белковые комплексы, содержащие дисульфидные связи, в частности, белки, для проявления биологической активности которых требуется посттрансляционная модификация[31].
Гены кишечной палочки также используются для генетической модификации растений, в частности из нее выделяют ген устойчивости к антибиотикам неомицину и канамицину.[35]
Патогенность
Непатогенные бактерии E. coli, в норме в больших количествах населяющие кишечник, могут, тем не менее, вызвать развитие патологии при попадании в другие органы или полости человеческого тела. Если бактерия попадает через отверстие в ЖКТ в брюшную полость, может возникнуть перитонит. Попав и размножившись во влагалище женщины, бактерия может вызвать или осложнить кольпит. Попадание бактерии в предстательную железу мужчины может быть патогенезом острого или хронического бактериального простатита. В таких случаях в лечение включается применение антибиотиков, проводимое таким образом, чтобы не подавлять нормальную микрофлору кишечника, иначе возможно развитие дисбактериоза.
E. coli очень чувствительна к таким антибиотикам, как стрептомицин или гентамицин. Однако E. coli может быстро приобретать лекарственную устойчивость[36].
Желудочно-кишечные инфекции
Вирулентные штаммы E. coli в норме отсутствуют в кишечнике, и заболевание наступает при заражении алиментарным путём. Передача патогенных E. coli часто происходит фекально-оральным путём[20][37][38]. Частые пути передачи могут быть вызваны: низкой гигиеной приготовления пищи[37], загрязнением продуктов навозом[39], поливом урожая загрязнённой водой или сточными водами [40], при выпасе диких свиней на пашнях[41], употреблением для питья воды, загрязнённой сточными водами[42].
Вирулентные штаммы E. coli могут вызывать гастроэнтериты, воспаления мочеполовой системы, а также менингит у новорождённых. В редких случаях вирулентные штаммы также вызывают гемолитический-уремический синдром, перитонит, мастит, сепсис и грамотрицательную пневмонию.
Низкотемпературная электронная микрофотография кластера E. coli. Увеличение в 10 000 раз. Индивидуальные бактерии представлены округлёнными цилиндрами.Некоторые штаммы E. coli, например, O157:H7, O121, O104:h5 и O104:h31, синтезируют потенциально смертельные токсины. Пищевые отравления, инфекционным агентом при которых являются вирулентные E. coli, обычно вызваны употреблением в пищу немытых овощей или непрожаренного мяса.
Первичными резервуарами E. coli O157:H7 является мясной и молочный скот[43]
В случае заболеваний кишечника у новорождённых, при болезни Крона и при неспецифическом язвенном колите обнаруживают повышенные уровни E. coli в слизистых ЖКТ[44]. Инвазивные штаммы E. coli обнаружены в воспалённых тканях, а количество бактерий в очагах воспаления коррелирует с тяжестью воспаления в кишечнике[45].
Менингит новорождённых
Один из серотипов Escherichia coli содержит антиген K1. Заселение кишечника новорождённого данным серотипом бактерий при попадании бактерий из влагалища матери может приводить к менингиту. В отсутствие IgM от матери, которые не способны проникать через гемато-плацентарный барьер, и потому, что организм распознаёт K1 как собственный антиген, данный серотип вызывает тяжёлые воспаления мозга.
Лечение фагами
Терапия бактериофагами для лечения патогенных бактерий была разработана более 80 лет назад в Советском Союзе, где использовалась для лечения диареи, вызванной E. coli[46]. В настоящее время фаговая терапия доступна лишь в Центре фаговой терапии в Грузии и в Польше[47].
Бактериофаг Т4 является хорошо изученным фагом, инфицирующим E. coli.
Вакцина
Исследователи разрабатывают эффективные вакцины для снижения количества случаев заражения патогенными штаммами E. coli по всему миру[48].
В апреле 2009 года исследователи Мичиганского университета заявили о том, что разработали вакцину для одного из штаммов E. coli. Подана заявка на патент[49].
См. также
Примечания
- ↑ Escherichia coli O157:H7. CDC Division of Bacterial and Mycotic Diseases. Проверено 25 января 2007. Архивировано 5 июля 2012 года.
- ↑ Vogt RL, Dippold L (2005). «Escherichia coli O157:H7 outbreak associated with consumption of ground beef, June-July 2002». Public Health Rep 120 (2): 174–8. PMID 15842119.
- ↑ Bentley R, Meganathan R (1 September 1982). «Biosynthesis of vitamin K (menaquinone) in bacteria». Microbiol. Rev. 46 (3): 241–80. PMID 6127606.
- ↑ Hudault S, Guignot J, Servin AL (July 2001). «Escherichia coli strains colonising the gastrointestinal tract protect germfree mice against Salmonella typhimurium infection». Gut 49 (1): 47–55. DOI:10.1136/gut.49.1.47. PMID 11413110.
- ↑ Reid G, Howard J, Gan BS (September 2001). «Can bacterial interference prevent infection?». Trends Microbiol. 9 (9): 424–8. DOI:10.1016/S0966-842X(01)02132-1. PMID 11553454.
- ↑ 1 2 3 Feng P, Weagant S, Grant, M. Enumeration of Escherichia coli and the Coliform Bacteria. Bacteriological Analytical Manual (8th ed.) (недоступная ссылка — история). FDA/Center for Food Safety & Applied Nutrition (1 сентября 2002). Проверено 25 января 2007. Архивировано 29 ноября 2001 года.
- ↑ 1 2 Thompson, Andrea. E. coli Thrives in Beach Sands, Live Science (4 июня 2007). Проверено 3 декабря 2007.
- ↑ Escherichia. Taxonomy Browser. NCBI. Проверено 30 ноября 2007.
- ↑ Lawrence, J.G. and Ochman, H. (1998) Molecular archaeology of the Escherichia coli genome Proc. Natl. Acad. Sci. USA 95:9413-9417 PMC21352
- ↑ 1 2 Nataro JP, Kaper JB (January 1998). «Diarrheagenic Escherichia coli». Clin. Microbiol. Rev. 11 (1): 142–201. PMID 9457432.
- ↑ Viljanen MK, Peltola T, Junnila SY, et al. (October 1990). «Outbreak of diarrhoea due to Escherichia coli O111:B4 in schoolchildren and adults: association of Vi antigen-like reactivity». Lancet 336 (8719): 831–4. DOI:10.1016/0140-6736(90)92337-H. PMID 1976876.
- ↑ Facts about E. coli: dimensions, as discussed in bacteria: Diversity of structure of bacteria: — Britannica Online Encyclopedia (недоступная ссылка)
- ↑ Kubitschek HE (1 January 1990). «Cell volume increase in Escherichia coli after shifts to richer media». J. Bacteriol. 172 (1): 94–101. PMID 2403552.
- ↑ Madigan MT, Martinko JM. Brock Biology of microorganisms. — 11th. — Pearson, 2006. — ISBN 0-13-196893-9.
- ↑ Fotadar U, Zaveloff P, Terracio L (2005). «Growth of Escherichia coli at elevated temperatures». J. Basic Microbiol. 45 (5): 403–4. DOI:10.1002/jobm.200410542. PMID 16187264.
- ↑ Ingledew WJ, Poole RK (1984). «The respiratory chains of Escherichia coli». Microbiol. Rev. 48 (3): 222–71. PMID 6387427.
- ↑ Darnton NC, Turner L, Rojevsky S, Berg HC, On torque and tumbling in swimming Escherichia coli. J Bacteriol. 2007 Mar;189(5):1756-64. Epub 2006 Dec 22.
- ↑ Жгутики кишечной палочки оказались пружинами с липучками
- ↑ Uncoiling Mechanics of Escherichia coli Type I Fimbriae Are Optimized for Catch Bonds (англ.)
- ↑ 1 2 Evans Jr., Doyle J.; Dolores G. Evans. Escherichia Coli. Medical Microbiology, 4th edition. The University of Texas Medical Branch at Galveston. Проверено 2 декабря 2007. Архивировано 2 ноября 2007 года.
- ↑ Учёные обнаружили бактерии в кишечнике нерождённых детей — МедНовости — MedPortal.ru
- ↑ Grozdanov L, Raasch C, Schulze J, Sonnenborn U, Gottschalk G, Hacker J, Dobrindt U (August 2004). «Analysis of the genome structure of the nonpathogenic probiotic Escherichia coli strain Nissle 1917.». J Bacteriol 186 (16): 5432–41. DOI:10.1128/JB.186.16.5432-5441.2004. PMID 15292145.
- ↑ Kamada N, Inoue N, Hisamatsu T, Okamoto S, Matsuoka K, Sato T, Chinen H, Hong KS, Yamada T, Suzuki Y, Suzuki T, Watanabe N, Tsuchimoto K, Hibi T (May 2005). «Nonpathogenic Escherichia coli strain Nissle1917 prevents murine acute and chronic colitis.». Inflamm Bowel Dis 11 (5): 455–63. DOI:10.1097/01.MIB.0000158158.55955.de. PMID 15867585.
- ↑ Fux CA, Shirtliff M, Stoodley P, Costerton JW (2005). «Can laboratory reference strains mirror «real-world» pathogenesis?». Trends Microbiol. 13 (2): 58–63. DOI:10.1016/j.tim.2004.11.001. PMID 15680764.
- ↑ Vidal O, Longin R, Prigent-Combaret C, Dorel C, Hooreman M, Lejeune P (1998). «Isolation of an Escherichia coli K-12 mutant strain able to form biofilms on inert surfaces: involvement of a new ompR allele that increases curli expression». J. Bacteriol. 180 (9): 2442–9. PMID 9573197.
- ↑ Lederberg, Joshua; E.L. Tatum (October 19 1946). «Gene recombination in E. coli» (PDF). Nature 158: 558. DOI:10.1038/158558a0. Source: National Library of Medicine — The Joshua Lederberg Papers
- ↑ The Phage Course — Origins (недоступная ссылка — история). Cold Spring Harbor Laboratory (2006). Проверено 3 декабря 2007. Архивировано 20 июля 2002 года.
- ↑ Benzer, Seymour (March 1961). «On the topography of the genetic fine structure». PNAS 47 (3): 403–15. DOI:10.1073/pnas.47.3.403.
- ↑ Frederick R. Blattner, Guy Plunkett III, Craig Bloch, Nicole Perna, Valerie Burland, Monica Riley, Julio Collado-Vides, Jeremy Glasner, Christopher Rode, George Mayhew, Jason Gregor, Nelson Davis, Heather Kirkpatrick, Michael Goeden, Debra Rose, Bob Mau, Ying Shao (September 5 1997). «The complete genome sequence of Escherichia coli K-12». Science 277 (5331): 1453–1462. DOI:10.1126/science.277.5331.1453.
- ↑ Bacteria make major evolutionary shift in the lab New Scientist
- ↑ 1 2 Lee SY (1996). «High cell-density culture of Escherichia coli». Trends Biotechnol. 14 (3): 98–105. DOI:10.1016/0167-7799(96)80930-9. PMID 8867291.
- ↑ Russo E (January 2003). «The birth of biotechnology». Nature 421 (6921): 456–7. DOI:10.1038/nj6921-456a. PMID 12540923.
- ↑ 1 2 Cornelis P (2000). «Expressing genes in different Escherichia coli compartments». Curr. Opin. Biotechnol. 11 (5): 450–4. DOI:10.1016/S0958-1669(00)00131-2. PMID 11024362.
- ↑ Tof, Ilanit Recombinant DNA Technology in the Synthesis of Human Insulin. Little Tree Pty. Ltd. (1994). Проверено 30 ноября 2007. Архивировано 5 июля 2012 года.
- ↑ Event Name: MON801 (MON80100)
- ↑ Gene Sequence Of Deadly E. Coli Reveals Surprisingly Dynamic Genome. Science Daily (25 января 2001). Проверено 8 февраля 2007. Архивировано 5 июля 2012 года.
- ↑ 1 2 Retail Establishments; Annex 3 — Hazard Analysis. Managing Food Safety: A Manual for the Voluntary Use of HACCP Principles for Operators of Food Service and Retail Establishments. U.S. Department of Health and Human Services Food and Drug Administration Center for Food Safety and Applied Nutrition (April 2006). Проверено 2 декабря 2007. Архивировано 7 июня 2007 года.
- ↑ Gehlbach, S.H.; J.N. MacCormack, B.M. Drake, W.V. Thompson (April 1973). «Spread of disease by fecal-oral route in day nurseries». Health Service Reports 88 (4): 320–322. PMID 4574421.
- ↑ Sabin Russell. Spinach E. coli linked to cattle; Manure on pasture had same strain as bacteria in outbreak, San Francisco Chronicle (October 13, 2006). Проверено 2 декабря 2007.
- ↑ Heaton JC, Jones K (March 2008). «Microbial contamination of fruit and vegetables and the behaviour of enteropathogens in the phyllosphere: a review». J. Appl. Microbiol. 104 (3): 613–26. DOI:10.1111/j.1365-2672.2007.03587.x. PMID 17927745.
- ↑ Thomas R. DeGregori. CGFI: Maddening Media Misinformation on Biotech and Industrial Agriculture (недоступная ссылка — история) (17 августа 2007). Проверено 8 декабря 2007. Архивировано 13 октября 2007 года.
- ↑ Chalmers, R.M.; H. Aird, F.J. Bolton (2000). «Waterborne Escherichia coli O157». Society for Applied Microbiology Symposium Series (29): 124S–132S. PMID 10880187.
- ↑ 1 2 Bach, S.J.; T.A. McAllister, D.M. Veira, V.P.J. Gannon, and R.A. Holley (2002). «Transmission and control of Escherichia coli O157:H7». Canadian Journal of Animal Science 82: 475–490. (недоступная ссылка)
- ↑ Rolhion N, Darfeuille-Michaud A (2007). «Adherent-invasive Escherichia coli in inflammatory bowel disease». Inflamm. Bowel Dis. 13 (10): 1277–83. DOI:10.1002/ibd.20176. PMID 17476674.
- ↑ Baumgart M, Dogan B, Rishniw M, et al. (2007). «Culture independent analysis of ileal mucosa reveals a selective increase in invasive Escherichia coli of novel phylogeny relative to depletion of Clostridiales in Crohn’s disease involving the ileum». ISME J 1 (5): 403–18. DOI:10.1038/ismej.2007.52. PMID 18043660.
- ↑ Therapeutic use of bacteriophages in bacterial infections (недоступная ссылка — история). Polish Academy of Sciences. Архивировано 8 февраля 2006 года.
- ↑ Medical conditions treated with phage therapy. Phage Therapy Center. Архивировано 5 июля 2012 года.
- ↑ Girard M, Steele D, Chaignat C, Kieny M (2006). «A review of vaccine research and development: human enteric infections». Vaccine 24 (15): 2732–50. DOI:10.1016/j.vaccine.2005.10.014. PMID 16483695.
- ↑ Researchers develop E. coli vaccine
Литература
Бактерии — Википедия
Бакте́рии (лат. Bacteria), от др.-греч. βακτήριον — «палочка») — домен прокариотических микроорганизмов. Бактерии обычно достигают нескольких микрометров в длину, их клетки могут иметь разнообразную форму: от шарообразной до палочковидной и спиралевидной. Бактерии — одна из первых форм жизни на Земле и встречаются почти во всех земных местообитаниях. Они населяют почву, пресные и морские водоёмы, кислые горячие источники, радиоактивные отходы[2] и глубинные слои земной коры. Бактерии часто являются симбионтами и паразитами растений и животных. Большинство бактерий к настоящему времени не описано, и представители лишь половины типов бактерий могут быть выращены в лаборатории[3]. Бактерии изучает наука бактериология — раздел микробиологии.
Один грамм почвы в среднем содержит 40 миллионов бактериальных клеток, а в миллилитре свежей воды можно найти миллион клеток бактерий. На Земле насчитывается около 5⋅1030 бактерий[4], и их биомасса превышает суммарную биомассу животных и растений[5]. Они играют важную роль в круговороте питательных веществ[en], например, именно бактерии осуществляют фиксацию атмосферного азота. Они также разлагают останки животных и растений посредством гниения[6]. Экстремофильные бактерии, обитающие рядом с холодными[en] и горячими гидротермальными источниками, вырабатывают энергию из нерастворимых соединений, таких как сероводород и метан. Предполагается, что бактерии живут и в Марианской впадине, имеющей глубину 11 километров[7][8]. Имеются сообщения о бактериях, обитающих в каменистых породах на 580 метров глубже морского дна на глубине 2,6 км около северо-востока США[7][9].
Человеческую микрофлору составляют 39 триллионов бактериальных клеток (само тело человека состоит из около 30 триллионов клеток)[10]. Наиболее многочисленна кишечная микрофлора, кожа также заселена многими бактериями[11]. Большинство бактерий, обитающих в человеческом теле, безвредны за счёт сдерживающего действия иммунной системы или приносят пользу (микрофлора человека). Ряд бактерий патогенны для человека. Такие инфекционные болезни, как холера, сифилис, сибирская язва, проказа и бубонная чума, вызываются бактериями. Наибольшее число смертей вызвано бактериальными респираторными инфекциями[en], и один лишь туберкулёз ежегодно убивает 2 миллиона человек (преимущественно в Африке южнее Сахары)[12]. В развитых странах антибиотики используются не только для лечения заболеваний человека, но и в животноводстве, из-за чего проблема устойчивости к антибиотикам становится всё более актуальной. В промышленности бактерии используют в очистке сточных вод, для ликвидации разливов нефти, при получении сыра и йогурта, восстановлении золота, палладия, меди и других металлов из руд[13], а также в биотехнологии, для получения антибиотиков и других соединений[14].
Первоначально бактерии поместили в царство растений в составе класса Schizomycetes. Сейчас известно, что бактерии, в отличие от растений и других эукариот, не имеют оформленного ядра и, как правило, мембранных органелл. Традиционно бактериями называли всех прокариот, однако в 1970-х годах было показано, что прокариоты представлены двумя независимыми доменами — бактериями и археями (эукариоты составляют третий домен)[15].
Слово «бактерия» происходит от лат. bacterium, производного от греч. βακτηρία, что означает «трость, палочка», так как первые описанные бактерии были палочковидными[16][17].
Предки современных бактерий были одноклеточными микроорганизмами, которые стали одной из первых форм жизни на Земле, появившись около 4 миллиардов лет назад. Почти три миллиарда лет вся жизнь на Земле была микроскопической[18][19]. Хотя для бактерий известны ископаемые останки (например, строматолиты), их морфология очень однообразна, что не позволяет идентифицировать отдельные виды. Однако для реконструкции филогении бактерий можно использовать последовательности генов, и именно с их помощью было показано, что бактерии отделились раньше архей и эукариот[20]. Ближайший общий предок бактерий и архей, вероятнее всего, был гипертермофилом, который жил 3—2,5 млрд лет назад[21][22].
Бактерии сыграли важнейшую роль в появлении эукариот. Считается, что эукариотическая клетка возникла, когда бактерии стали эндосимбионтами одноклеточных организмов, вероятно, близких к современным археям[23][24]. Иными словами, прото-эукариотическая клетка проглотила клетку α-протеобактерии, которая дала начало митохондриям и гидрогеносомам. На данный момент неизвестны эукариоты, лишённые и митохондрий, и гидрогеносом, хотя иногда эти органеллы сильно редуцированы. Впоследствии некоторые из эукариот, уже имеющих митохондрии, проглотили клетки цианобактерий, которые стали пластидами растений и водорослей[25][26].
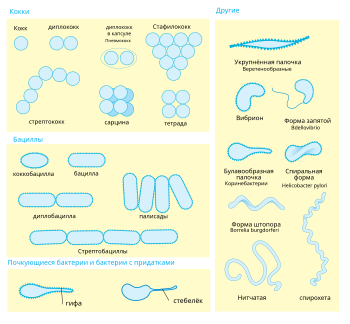 Различные морфотипы бактерий
Различные морфотипы бактерийБактериальные клетки имеют чрезвычайно разнообразную морфологию (то есть форму и размер). Как правило, бактериальные клетки в десять раз мельче эукариотических и достигают 0,5—5 мкм в длину. Однако есть и бактерии, видимые невооружённым глазом: так, Thiomargarita namibiensis достигает половины миллиметра в длину[27], а длина Epulopiscium fishelsoni может составлять 0,7 мм[28]. К числу самых мелких бактерий можно отнести представителей рода Mycoplasma, длина клеток которых не превышает 0,3 мкм, что сравнимо по размерам с вирионами некоторых вирусов[29]. Существуют ещё более мелкие бактерии (ультрамикробактерии[en]), однако они плохо изучены[30].
Большинство бактерий имеют шарообразную (кокки) или палочковидную (бациллы) форму[31]. Некоторые бактерии, называемые вибрионами[en], выглядят как слегка закрученные палочки или запятые; спириллы имеют спиральную форму, а спирохеты имеют длинные плотно закрученные клетки. Описаны и бактерии с другими необычными формами клеток, например, клетками в форме звезды[32]. Разнообразие форм бактериальных клеток обусловлено особенностями их клеточных стенок и цитоскелета. Форма бактериальной клетки обусловливает их способность поглощать питательные вещества, прикрепляться к поверхностям, плавать в жидкостях и ускользать от питающихся бактериями организмов[33].

Многие виды бактерий существуют в виде одиночных клеток, однако у некоторых видов клетки образуют характерные скопления: например, клетки Neisseria объединены в пары, у Streptococcus — в цепочки, у Staphylococcus — в скопления в виде грозди винограда. Некоторые бактерии могут формировать более сложные многоклеточные структуры. Так, Actinobacteria формируют длинные филаменты (внутриклеточные нитевидные образования), Myxococcales образуют плодовые тела, а Streptomyces образуют ветвящиеся нити[34]. Иногда такие сложные структуры появляются только при некоторых условиях. Например, при нехватке аминокислот клетки Myxococcales определяют расположение соседних клеток того же вида с помощью чувства кворума, движутся навстречу друг другу и формируют плодовые тела до 500 мкм длиной, состоящие из около 100 тысяч бактериальных клеток[35]. Бактериальные клетки в составе плодовых тел выполняют различные функции: десятая часть всех клеток мигрирует к верхней части плодового тела и превращается в особую покоящуюся форму, называемую миксоспорой, которая более устойчива к высыханию и другим неблагоприятным условиям внешней среды[36].
Бактерии часто прикрепляются к какой-либо поверхности и формируют плотные скопления, известные как биоплёнки, или более крупные скопления — бактериальные маты. Толщина биоплёнок и матов может составлять от нескольких микрометров до полуметра, в их состав могут входить бактерии разных видов, а также археи и протисты. В биоплёнках наблюдается сложное расположение клеток и внеклеточных компонентов, которые формируют вторичные структуры, известные как микроколонии, через которые проходит сеть каналов, обеспечивающая лучшую диффузию питательных веществ[37][38]. В таких местообитаниях, как почва и поверхность растений, большинство бактерий, прикреплённых к поверхностям, входят в состав биоплёнок[39]. Биоплёнки имеют важное значение для медицины, потому что они часто образуются при хронических бактериальных инфекциях или инфекциях, связанных с инородными имплантатами. Более того, бактерии в составе биоплёнок гораздо сложнее убить, чем отдельные бактериальные клетки[40].
 Строение клетки типичной грамположительной бактерии (обратите внимание на наличие только одной клеточной мембраны)
Строение клетки типичной грамположительной бактерии (обратите внимание на наличие только одной клеточной мембраны)Внутриклеточные структуры[править | править код]
Бактериальная клетка окружена мембраной, состоящей в основном из фосфолипидов. Мембрана окружает всё содержимое клетки и выступает в роли барьера для удержания в клетке питательных веществ, белков и других компонентов цитоплазмы[41]. В отличие от клеток эукариот, у бактерий, как правило, отсутствуют крупные мембранные органеллы, такие как ядро, митохондрии, хлоропласты[42]. Однако у некоторых бактерий имеются органеллы с белковой оболочкой, в которых протекают определённые метаболические процессы[43][44], например, карбоксисомы[45]. Кроме того, у бактерий имеется многокомпонентный цитоскелет, который контролирует локализацию нуклеиновых кислот и белков внутри клетки и управляет клеточным делением[46][47][48].
Многие важные биохимические реакции, такие как образование АТФ, происходят за счёт градиента концентрации определённых ионов по разные стороны мембраны, что создаёт разность потенциалов, как в батарейке. Поскольку у бактерий нет мембранных органелл, такие реакции (например, перенос электронов) протекают при участии мембраны бактериальной клетки, обращённой во внешнюю среду в случае грамположительных бактерий или в периплазматическое пространство в случае грамотрицательных бактерий[49]. Однако у многих фотосинтезирующих бактерий мембрана образует многочисленные складки, которые заполняют почти всё внутреннее пространство клетки[50]. На этих складках располагаются светопоглощающие комплексы, однако у некоторых бактерий, например, зелёных серных бактерий, светопоглощающие комплексы находятся внутри особых мембранных пузырьков — хлоросом[51].
У большинства бактерий нет ядра, окружённого мембранами, и их генетический материал, в большинстве случаев представленный единственной кольцевой молекулой ДНК[en], находится в цитоплазме в составе нуклеоида, имеющего неправильную форму[52]. Нуклеоид содержит не только геномную ДНК, но также взаимодействующие с ней белки и РНК. Как все живые организмы, бактерии имеют рибосомы, которые обеспечивают синтез белков, однако размеры и структура рибосом бактерий отличаются от таковой у рибосом архей и эукариот[53].
У некоторых бактерий в цитоплазме имеются гранулы, запасающие питательные вещества, такие как гликоген[54], полифосфат[55], сера[56] или полигидроксиалканоаты[57]. Ряд бактерий, например, фотосинтезирующие цианобактерии, имеют газовые вакуоли, с помощью которых они регулируют свою плавучесть, благодаря чему могут перемещаться между слоями воды с разным содержанием питательных веществ и уровнем освещённости[58].
Внеклеточные структуры[править | править код]
Поверх мембраны бактериальной клетки располагается клеточная стенка. Клеточная стенка бактерий состоит из пептидогликана, также известного как муреин, который состоит из полисахаридных цепочек, связанных пептидными линкерами из D-аминокислот[59]. По химическому составу бактериальная клеточная стенка отличается от клеточной стенки растений и грибов, у которых она состоит из целлюлозы и хитина соответственно[60]. Клеточная стенка архей также не содержит пептидогликана. Клеточная стенка жизненно необходима для многих видов бактерий, и некоторые антибиотики, такие как пенициллин, подавляют биосинтез пептидогликана и тем самым убивают бактерию[60].
В широком смысле по составу клеточной стенки бактерий принято делить на грамположительные и грамотрицательные. Название этих типов связано с их дифференциальной окраской по методу Грама, который долгое время используется для классификации бактерий[61]. У грамположительных бактерий имеется толстая клеточная стенка, состоящая из многих слоёв пептидогликана и тейхоевых кислот. У грамотрицательных бактерий, напротив, клеточная стенка значительно тоньше и включает всего лишь несколько слоёв пептидогликана, а поверх неё залегает вторая мембрана, содержащая липополисахариды и липопротеины. Большинство бактерий грамотрицательны, и только фирмикуты и актинобактерии грамположительны (ранее они были известны как грамположительные бактерии с низким GC-составом и грамположительные бактерии с высоким GC-составом соответственно)[62]. Различия между грамположительными и грамотрицательными бактериями могут обусловливать различную чувствительность к антибиотикам. Например, ванкомицин эффективен только против грамположительных бактерий и не действует на грамотрицательные бактерии[63]. У некоторых бактерий строение клеточной стенки не соответствует в строгом смысле ни грамположительному, ни грамотрицательному типу. Например, у микобактерий имеется толстый слой пептидогликана, как у грамположительных бактерий, который покрыт внешней мембраной, как у грамотрицательных бактерий[64].
У многих бактерий клетка покрыта так называемым S-слоем, состоящим из плотно уложенных молекул белков[65]. S-слой обеспечивает химическую и физическую защиту клетки и может выступать в роли макромолекулярного диффузионного барьера. Функции S-слоя разнообразны, но плохо изучены, однако известно, что у Campylobacter он выступает фактором вирулентности, а у Geobacillus stearothermophilus[en] он содержит поверхностные ферменты[66].
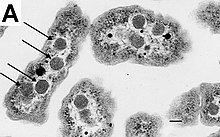
 Электронная микрофотография Helicobacter pylori, на клеточной поверхности располагается множество жгутиков
Электронная микрофотография Helicobacter pylori, на клеточной поверхности располагается множество жгутиковУ многих бактерий имеются жгутики, представляющие собой плотные белковые структуры около 20 нм в диаметре и до 20 мкм в длину. Они обеспечивают подвижность клеток и по строению и механизму работы не имеют ничего общего с эукариотическими жгутиками. Движение жгутиков бактерий происходит за счёт энергии, которая высвобождается при движении ионов по электрохимическому градиенту через клеточную мембрану[67].
Нередко клетки бактерий покрыты фимбриями, которые представляют собой белковые филаменты, достигающие 2—10 нм в диаметре и до нескольких мкм в длину. Они покрывают всю поверхность бактериальной клетки и в электронный микроскоп выглядят как волоски. Предполагается, что фимбрии участвуют в прикреплении клеток бактерий к различным поверхностям и друг к другу, а у многих патогенных бактерий они являются факторами вирулентности[68]. Пили — это клеточные белковые придатки, более толстые, чем фимбрии, которые обеспечивают перенос генетического материала от одной бактериальной клетки к другой в ходе конъюгации (половые пили)[69]. Кроме того, пили IV типа участвуют в движении[70].
Многие бактериальные клетки выделяют покрывающий их гликокаликс различной сложности строения: от тонкого неструктурированного слоя внеклеточных полимеров[en] до высоко структурированной капсулы. Гликокаликс может защищать бактерию от поглощения эукариотическими клетками, например, макрофагами, входящими в состав иммунной системы[71]. Он также может выступать в роли антигена, который используется для распознавания бактериальных клеток иммунной системой, а также участвовать в формировании биоплёнок и прикреплении бактериальных клеток к поверхностям[72].
Образование внеклеточных структур бактериальной клетки обеспечивается бактериальными системами секреции. Они транспортируют белки из цитоплазмы в периплазматическое пространство или во внешнюю среду. Известно несколько типов бактериальных систем секреции, кроме того, бактериальные системы секреции нередко выступают в роли факторов вирулентности[73].
Эндоспоры[править | править код]
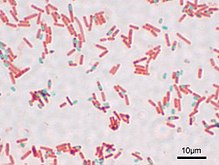 Окрашенный препарат Bacillus subtilis. Вегетативные клетки красные, споры зелёные.
Окрашенный препарат Bacillus subtilis. Вегетативные клетки красные, споры зелёные.Представители нескольких родов грамположительных бактерий, таких как Bacillus, Clostridium, Sporohalobacter[en], Anaerobacter[en] и Heliobacterium, образуют покоящиеся структуры, обладающие повышенной устойчивостью к неблагоприятным факторам внешней среды и называемые эндоспорами[74]. Эндоспоры образуются в цитоплазме клетки, и, как правило, в одной клетке может сформироваться только одна эндоспора. Каждая эндоспора содержит ДНК и рибосомы, окружённые поверхностным слоем цитоплазмы, поверх которого залегает плотная многослойная оболочка, состоящая из пептидогликана и разнообразных белков[75].
Внутри эндоспор не протекают метаболические процессы, и они могут выживать при сильнейших неблагоприятных физических и химических воздействиях, таких как интенсивное УФ-излучение, γ-излучение, детергенты, дезинфицирующие агенты, замораживание, давление и высыхание[en][76]. Эндоспоры могут сохранять жизнеспособность в течение миллионов лет[77][78], и с их помощью бактерии могут оставаться живыми даже в условиях вакуума и космического излучения[79]. Некоторые бактерии, формирующие эндоспоры, патогенны. Так, сибирская язва развивается после вдыхания спор грамположительной бактерии Bacillus anthracis, а попадание эндоспор Clostridium tetani в глубокие открытые раны может привести к столбняку[80].
У бактерий наблюдается колоссальное разнообразие видов метаболизма[81]. Традиционно таксономия бактерий строилась на основе их метаболических особенностей, однако она во многом не совпадает с современной классификацией, построенной на геномных последовательностях[82]. Бактерии делятся на три типа питания в зависимости от ключевых черт метаболизма: источника энергии, донора электронов и источника углерода[83].
Бактерии получают энергию двумя способами: поглощая свет в ходе фотосинтеза или окисляя химические соединения (хемосинтез)[84]. Хемотрофы используют в качестве источника энергии химические вещества, перенося электроны с имеющегося донора на конечный акцептор электронов в ходе окислительно-восстановительной реакции. Высвобождающаяся при этой реакции энергия далее используется для нужд метаболизма. В зависимости от того, какое вещество используется как донор электронов, хемотрофы подразделяются ещё на несколько групп. Бактерии, использующие неорганические вещества, такие как водород, угарный газ или аммиак, называются литотрофами, а бактерии, окисляющие органические соединения, называются органотрофами. Бактерий также классифицируют в зависимости от веществ, выступающих акцепторами электронов. У аэробов акцептором электронов выступает кислород, а анаэробы используют для этого другие соединения, такие как нитрат, сульфат и углекислый газ[84].
Многие бактерии удовлетворяют свои потребности в углероде за счёт органических соединений; такие бактерии называются гетеротрофами. Другие бактерии, например, цианобактерии и некоторые пурпурные бактерии, являются автотрофами, то есть получают углерод, фиксируя углекислый газ[85]. В некоторых условиях метанотрофные бактерии используют метан и как источник электронов, и как источник углерода[86].
| Тип питания | Источник энергии | Источник углерода | Примеры |
|---|---|---|---|
| Фототрофы | Солнечный свет | Органические вещества (фотогетеротрофы) или фиксированный углекислый газ (фотоавтотрофы) | Цианобактерии, зелёные серные бактерии, Chloroflexi[en], пурпурные бактерии |
| Литотрофы | Неорганические соединения | Органические вещества (литогетеротрофы) или фиксированный углекислый газ (литоавтотрофы) | Thermodesulfobacteria[en], Hydrogenophilaceae[en], Nitrospirae[en] |
| Органотрофы | Органические соединения | Органические вещества (хемогетеротрофы) или фиксированный углекислый газ (хемоавтотрофы) | Bacillus, Clostridium, Enterobacteriaceae |
Метаболизм бактерий имеет огромное значение для экологической стабильности и деятельности человека. Например, некоторые бактерии являются единственными фиксаторами атмосферного азота (с помощью фермента нитрогеназы)[87]. Другими важными для окружающей среды химическими процессами, осуществляемыми бактериями, являются денитрификация, восстановление сульфата и ацетогенез[88][89]. Метаболические процессы бактерий также могут служить источниками загрязнения. Так, сульфатредуцирующие бактерии образуют высокотоксичные соединения ртути (метил- и диметилртуть)[90]. Ряд анаэробных бактерий осуществляет брожение для получения энергии, и его побочные продукты (например, этанол при спиртовом брожении) попадают в окружающую среду. Факультативные анаэробы могут переключаться между получением энергии с помощью брожения и получением её с помощью дыхания с различными акцепторами электронов в зависимости от условий окружающей среды[91].
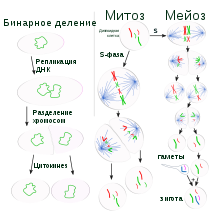 Многие бактерии размножаются бинарным делением (сравните с митозом и мейозом на этой схеме)
Многие бактерии размножаются бинарным делением (сравните с митозом и мейозом на этой схеме)В отличие от многоклеточных организмов, у одноклеточных организмов (и бактерий в том числе) рост, то есть увеличение клетки в размерах, и размножение путём деления клеток тесно связаны[92]. Бактериальные клетки достигают определённого размера и после этого делятся бинарным делением. В оптимальных условиях бактерии растут и делятся очень быстро, описан пример морской псевдомонады, популяция которой может удваиваться каждые 9,8 минуты[93]. При бинарном делении образуются две дочерние клетки, идентичные материнской. Некоторые бактерии, хотя и размножаются простым делением, образуют более сложные структуры, предназначенные для распространения дочерних клеток. Примером могут служить плодовые тела миксобактерий и воздушные гифы стрептомицетов. Некоторые бактерии способны к почкованию, когда дочерняя клетка образует вырост на материнской, который впоследствии отделяется и переходит к самостоятельной жизни[94].

В лаборатории бактерии растят на твёрдых или жидких средах. Твёрдые среды, такие как агар, используются для изоляции[en] чистых культур бактериальных штаммов. Жидкие среды используются, когда необходимо измерять скорость роста или получить большое количество клеток. При выращивании бактерий в жидкой среде с перемешиванием получаются однородные клеточные культуры, однако сложно заметить загрязнение другими бактериями. Для идентификации отдельных бактерий используются селективные среды, содержащие антибиотики, специфические питательные вещества или, наоборот, лишённые каких-то соединений[96].
Для большинства лабораторных методов выращивания бактерий необходимы большие количества питательных веществ, чтобы обеспечить быстрое получение больших объёмов клеток. Однако в естественных условиях питательные вещества ограничены, и бактерии не могут размножаться бесконечно. Из-за ограниченного количества питательных веществ в ходе эволюции появились различные стратегии роста. Некоторые виды растут чрезвычайно быстро, когда питательные вещества доступны, например, цианобактерии нередко вызывают цветение водоёмов, насыщенных органикой[97]. Другие организмы адаптированы к жёстким условиям окружающей среды, например, бактерии рода Streptomyces выделяют антибиотики, которые подавляют рост конкурирующих бактерий[98]. В природе многие виды бактерий живут сообществами (например, в виде биоплёнок), которые обеспечивают каждую клетку необходимым питанием и защищают от неблагоприятных условий[39]. Некоторые организмы и группы организмов растут только в составе сообществ и не могут быть выделены в чистую культуру[99].
Динамику роста бактериальной популяции можно подразделить на четыре фазы. Когда популяция бактерий попадает в среду, богатую питательными веществами, клетки начинают адаптироваться к новым условиям. Первая фаза роста называется лаг-фазой, это период медленного роста, когда клетки адаптируются к среде, богатой питательными веществами, и готовятся к быстрому росту. Во время лаг-фазы происходит интенсивный синтез белков[100]. За лаг-фазой следует логарифмическая, или экспоненциальная фаза, во время которой происходит быстрый экспоненциальный рост. Скорость, с которой клетки растут во время этой фазы, называют скоростью роста, а время, которое необходимо для удвоения клеточной популяции, называется временем генерации. В ходе лог-фазы питательные вещества потребляются с максимальной скоростью, до тех пор пока одно из необходимых соединений не кончится и не начнёт подавлять рост. Третья фаза роста называется стационарной, она начинается при нехватке питательных веществ для быстрого роста. Скорость метаболизма падает, и клетки начинают расщеплять белки, не являющиеся строго необходимыми. Во время стационарной фазы экспрессируются гены, белковые продукты которых участвуют в репарации ДНК, метаболизме антиоксидантов и транспорте питательных веществ[101]. Финальная фаза роста — фаза смерти, при которой запас питательных веществ исчерпывается и бактерии погибают[102].
У большинства бактерий геном представлен единственной кольцевой молекулой ДНК (её иногда называют хромосомой), а размер генома варьирует от 160 тысяч пар оснований (п. о.) у эндосимбиотической бактерии Carsonella ruddii[en][103] до примерно 13 миллионов п. о. у почвенной бактерии Sorangium cellulosum[en][104]. Впрочем, у ряда представителей родов Streptomyces и Borrelia геном представлен единственной линейной хромосомой[105][106], а у некоторых видов рода Vibrio имеется более одной хромосомы[107]. Многие бактерии также содержат плазмиды — маленькие внехромос
Enterobacterales — Википедия
Материал из Википедии — свободной энциклопедии
Enterobacterales (лат.) — большой порядок бактерий, включающий в себя такие известные патогены как: сальмонеллы, кишечная палочка, чумная палочка и т. д. До 2016 года употреблялось название «Enterobacteriales», но этот таксон был описан с нарушением норм Международного кодекса номенклатуры прокариот[en] в орфографии и у него отсутствовал типовой род, поэтому это название было заменено. При описании порядка изменили его классификацию, разделив семейство энтеробактерий (Enterobacteriaceae), единственное в порядке «Enterobacteriales», на 8 самостоятельных семейств.
Представители порядка — палочки длиной 1—5 мкм. Они грамотрицательны, факультативные анаэробы и ферментируют углеводы с образованием муравьиной кислоты и других конечных продуктов (так называемое формиатное брожение). Некоторые из них могут разлагать лактозу. Большинство имеет жгутики для передвижения. Не образуют спор.
Множество представителей порядка являются частью нормальной микрофлоры кишечника и могут быть найдены в кишечнике человека и других животных, тогда как остальные обитают в почве, воде или паразитируют на различных растениях и животных. Лучше всего изучена кишечная палочка — важнейший модельный организм, использующийся в генетике, молекулярной биологии из-за высокой изученности её генетики и биохимии.
На июнь 2019 года в порядок включают следующие семейства и роды[1]:
Род Calymmatobacterium Aragão and Vianna 1913 (Калимматобактерии[8]) систематики сводят в синонимы к роду Klebsiella[9], род Levinea Young et al. 1971 — к роду Citrobacter[10].
- ↑ Classification of domains and phyla — Hierarchical classification of prokaryotes (bacteria) : Version 2.2 : [англ.] // LPSN. — 2019. — 22 June.
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии, 2003, с. 43.
- ↑ 1 2 Атлас по медицинской микробиологии, вирусологии и иммунологии, 2003, с. 46.
- ↑ 1 2 3 Атлас по медицинской микробиологии, вирусологии и иммунологии, 2003, с. 47.
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии, 2003, с. 44.
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии, 2003, с. 45.
- ↑ 1 2 Атлас по медицинской микробиологии, вирусологии и иммунологии, 2003, с. 48.
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии, 2003, с. 55.
- ↑ Genus Calymmatobacterium : [англ.] // LPSN[en]. (Проверено 29 июня 2019).
- ↑ Genus Levinea : [англ.] // LPSN[en]. (Проверено 29 июня 2019).
- Атлас по медицинской микробиологии, вирусологии и иммунологии / Под ред. А. А. Воробьева, А. С. Быкова. — М.: Медицинское информационное агентство, 2003. — С. 236. — ISBN 5-89481-136-8.
- MacFaddin, Jean F. Biochemical Tests for Identification of Medical Bacteria. Williams & Wilkins, 1980, p. 441.
Колибактериоз — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 марта 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 марта 2019; проверки требует 1 правка.Колибактериоз или эшерихиоз — острая инфекционная болезнь молодняка всех видов сельскохозяйственных животных, вызываемая патогенной кишечной палочкой (Escherichia coli) и проявляющаяся главным образом диареей. Наносит значительный ущерб животноводству. Возникает при нарушении зоотехнических и ветеринарных правил содержания, кормления и ухода за животными. Источники возбудителя инфекции — больные, переболевшие животные, матери — носители патогенных кишечных палочек, инфицированные окружающие предметы. Диагноз ставят на основании эпизоотологических, клинических, патологоанатомических данных и результатов бактериологического исследования патологического материала[1].
Телята заражаются в первые 3–7 суток после рождения через инфицированные окружающие предметы, молозиво, молочную посуду, воздух, руки и спецодежду обслуживающего персонала, а также при контакте с крысами и домашними мышами из-за пониженной естественной резистентности организма новорожденных, нарушения зоотехнических и ветеринарно-санитарных правил содержания, кормления и ухода за матерями, новорожденными животными и молодняком в период его отъема от матерей[2].
Основной путь заражения – алиментарный, реже аэрогенный, возможен внутриутробный[2].
Слизистая кишечника здорового новорождённого препятствует проникновению вульгарной кишечной палочки, но если её защитная система нарушена, то бактерии начинают усиленно размножаться и внедряться в слизистую кишечника. Продукты жизнедеятельности кишечной палочки(эндотоксины) вызывают воспаление. При недостаточной активности защитных механизмов кишечной стенки и прежде всего фагоцитоза, эшерихии проникают в лимфатическую и кровеносную системы, вызывая при этом септический процесс. Начавшийся понос вызывает резкое обезвоживание тканей организма. Размножение в крови бактерий и наводнение организма токсическими продуктами их жизнедеятельности и тканевого распада угнетают деятельность центральной нервной системы, что даёт к концу заболевания картину тяжёлого коматозного состояния.[3]
Иммунная сыворотка, коли-фаг, гамма-глобулин, антибиотики и др.
Соблюдение правил содержания и кормления матерей в период сухостоя, гигиены родов, выпаивания молозива; секционное содержание новорождённых с поддержанием строгого изоляционно-дезинфекционного режима, вакцинация беременных животных[1].
- ↑ 1 2 Сельское хозяйство. Большой энциклопедический словарь. — М.: Большая Российская энциклопедия, 1998. — 656 с. — 100 000 экз. — ISBN 5-85270-263-3; 12.
- ↑ 1 2 Дорош М. Болезни крупного рогатого скота. — ISBN 5-9533-1681-x.
- ↑ Р.Ф.Сосов и др. Эпизоотология. — М.: Колос, 1969. — 400 с.
Эпидемия кишечной палочки в Европе (2011) — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 января 2020; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 января 2020; проверки требует 1 правка.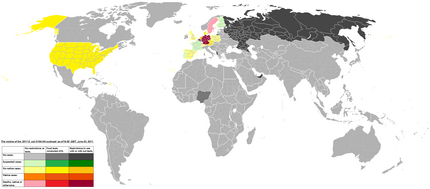 Карта заболеваний, вызванных штаммом Escherichia coli O104:h5 (на 3 июня 2011)
Карта заболеваний, вызванных штаммом Escherichia coli O104:h5 (на 3 июня 2011)Серый цвет: не обнаружено
Зелёный: подозрительные случаи
Жёлтый: угроза заражения
Оранжевый: есть заболевшие
Красные тона: есть смертельные случаи
Эпидемия заболевания, вызванная патогенным штаммом кишечной палочки — эпидемия в Европе (май-июнь 2011 года), вызванная штаммом e.coli O104:h5. Штамм O104:h5 привёл к многочисленным случаям гемолитико-уремического синдрома в Германии и других странах Европейского союза. С 30 мая 2011 года Россия ввела полный запрет на ввоз овощей из Испании и Германии[1]. 8 июня поступила информация, что Главный санитарный врач РФ Геннадий Онищенко приостановил ввоз на территорию РФ и оборот ягод, произведенных в странах ЕС после 15 апреля 2011 г.[2]. Под запрет попали земляника и клубника, клюква, черника, брусника и некоторые другие ягоды. Кишечная эпидемия вызвала «овощной психоз» в Европе. Из-за эпидемии потребление свежих овощей в Германии резко снизилось[3]. 22 июня эмбарго на ввоз в Россию овощей из Европы было снято.[4]
Число жертв энтерогеморрагической бактерии на 24 июня 2011 года составило 43 человек и около 4 тысяч зараженных[5]
Предполагаемый возбудитель — редко встречаемый, энтерогеморрагический штамм кишечной палочки Escherichia coli O104:h5.
Пострадавшие
| Страна | Количество заболевших | Количество умерших |
|---|---|---|
| Великобритания | 11[6] | нет летальных исходов |
| Германия | 520[7] | 42[5] |
| США | 4[8] | нет летальных исходов |
| Финляндия | 1[9] | нет летальных исходов |
| Словакия | 1[10] | нет летальных исходов |
| Швеция | нет данных | 1[5] |
| Франция | 2[11] | нет летальных исходов |
| Таиланд | нет данных | 1[12] |
Строение бактериальной клетки — Википедия
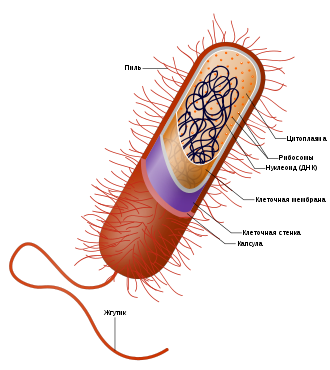 Схема строения бактериальной клетки
Схема строения бактериальной клеткиБактериа́льная кле́тка обычно устроена наиболее просто по сравнению с клетками других живых организмов. Бактериальные клетки часто окружает капсула, которая служит защитой от внешней среды. Для многих свободноживущих бактерий характерно наличие жгутиков для передвижения, а также ворсинок.
Для выведения веществ, в том числе факторов патогенности, в окружающую среду используются системы секреции. Клеточная стенка бактерий обычно содержит пептидогликан. По химическому составу клеточные мембраны бактерий гораздо разнообразнее мембран эукариотических клеток. В отличие от эукариот, бактерии не имеют ограниченного оболочкой ядра и, в большинстве случаев, каких-либо мембранных органелл. Вместе с тем у ряда бактерий имеются клеточные структуры, не имеющие аналогов в двух других доменах.
Геном бактерий состоит из суперскрученных кольцевых хромосом, связанных с гистонподобными белками, и меньших по размерам молекул ДНК — плазмид. Элементы цитоскелета играют важные роли в делении клеток, защите, поддержании формы и определении полярности у различных прокариот. Бактериальные рибосомы меньше рибосом эукариотического типа, но имеют сходный план строения.
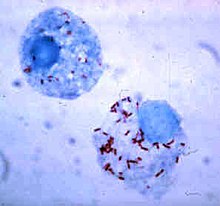 Риккетсии (красные точки) в клетках млекопитающего
Риккетсии (красные точки) в клетках млекопитающегоКак правило, размеры клеток бактерий находятся в пределах от 0,2 до 10 мкм. Существуют, однако, бактерии, видимые невооружённым глазом: клетки бактерии Epulopiscium fishelsoni, обитающей в кишечнике рыбы-хирурга, достигают до 600 мкм в длину и 100 мкм в диаметре, а клетки Thiomargarita namibiensis, населяющей прибрежные воды Намибии, достигает 400—750 мкм в диаметре[1].
Бактерий, клетки которых составляют менее 0,5 мкм в диаметре, называют нанобактериями, или ультрамикробактериями[en], они даже способны проходить через мембранные фильтры[en]. Среди ультрамикробактерий есть и свободноживущие виды, например, морская бактерия Sphingopyxis alaskensis, и непатогенные эндосимбионты, например, представители рода Holospora, размножающиеся в микро- или макронуклеусе инфузории-туфельки Paramecium caudatum. Многие ультрамикробактерии ведут паразитический образ жизни, в их числе микоплазмы, хламидии и риккетсии. Ультрамикробактерия Bdellovibrio bacteriovorus размножается в периплазматическом пространстве клеток других бактерий и питается продуктами лизиса хозяйской клетки, за что её часто относят к хищным бактериям[2].
 Различные морфотипы бактерий
Различные морфотипы бактерийФорма бактериальной клетки является диагностическим признаком и применяется в их классификации. Чаще всего бактериальные клетки имеют сферическую (кокки) или палочковидную (бациллы) формы, некоторые имеют форму, промежуточную между сферической и палочковидной, и называются коккобациллами. Многие бактерии имеют нитевидную или извитую форму — в виде запятой (вибрионы), спирали (спириллы[en]) или вытянутую, закрученную наподобие спирали ДНК[en] (спирохеты)[3].
Часто бактериальные клетки образуют устойчивые сочетания, такие как пары палочек (диплобациллы) или кокков (диплококки), цепочки палочек (стрептобациллы) или кокков (стрептококки), тетрады, пакеты из 4, 8 и более кокков (сарцины), гроздья (стафилококки). Некоторые бактерии образуют розетки, плоские таблички, сети, а также прямые или ветвящиеся трихомы — цепочки плотно примыкающих друг к другу клеток.
Известны бактерии с клетками весьма необычной формы (например, звёздчатые), некоторые бактерии (Corynebacterium[en]*, Mycobacterium, Nocardia[en]) меняют морфологию в течение жизненного цикла. Актинобактерии формируют мицелий, представители рода Hyphomicrobium образуют гифы с почками[4]. Клетки некоторых бактерий (например, Caulobacter) несут стебельки и прочие придатки[5].
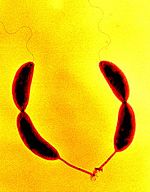 Две делящиеся клетки Caulobacter crescentus под микроскопом, виды стебельки на одном полюсе клеток и жгутики на противоположном
Две делящиеся клетки Caulobacter crescentus под микроскопом, виды стебельки на одном полюсе клеток и жгутики на противоположномВ отличие от многоклеточных организмов, у одноклеточных организмов (и бактерий в том числе) рост, то есть увеличение клетки в размерах, и размножение путём деления клеток тесно связаны[6]. Обычно бактериальные клетки делятся на две равноценные дочерние клетки. Сначала клетка удлиняется, в ней образуется поперечная перегородка. На завершающем этапе дочерние клетки расходятся. Отличительной чертой деления бактериальных клеток является непосредственное участие реплицированной ДНК в процессе деления[7]. В связи с тем, что в подавляющем большинстве случаев прокариотические клетки имеют клеточную стенку, бинарное деление сопровождается формированием септы — перегородки между дочерними клетками, которая затем расслаивается посередине. Процесс деления прокариотической клетки подробно изучен на примере E. coli[8].
В то же время есть примеры неравноценного деления. Например, у грамотрицательной бактерии Caulobacter crescentus[en] одна из дочерних клеток подвижная, у неё есть один жгутик для хемотаксиса. Вторая клетка остаётся прикреплённой к субстрату «стебельком». Подвижные клетки дифференцируются в клетки со стеблем после короткого периода свободного плавания. Репликация хромосом и деление клеток происходят только на стадии прикреплённой клетки[9].
В оптимальных условиях бактерии растут и делятся очень быстро, описан пример морской псевдомонады, популяция которой может удваиваться каждые 9,8 минуты[10].
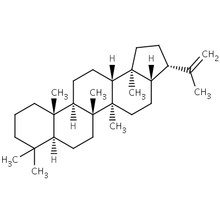 Структурная формула гопена — соединения группы гопаноидов
Структурная формула гопена — соединения группы гопаноидовКак любая живая клетка, бактериальная клетка окружена мембраной, которая представляет собой липидный бислой (её ещё называют цитоплазматической мембраной). Клеточная мембрана поддерживает осмотический баланс клетки, осуществляет разные виды транспорта, в том числе секрецию белков, задействована в образовании клеточной стенки и биосинтезе внеклеточных полимеров, а также получает регуляторные сигналы из внешней среды. Во многих случаях клеточная мембрана может участвовать в синтезе АТФ за счёт трансмембранного электрохимического градиента (протондвижущей силы). Мембрана бактериальной клетки участвует в репликации и разделении дочерних бактериальных хромосом при делении клетки, а также в передаче ДНК посредством трансдукции или конъюгации[11].
Помимо липидов, в состав бактериальных мембран входят различные белки. По химическому составу клеточные мембраны бактерий гораздо разнообразнее мембран эукариотических клеток. Мембранные липиды архей представлены ацил[en]— и алкилсодержащими глицеролипидами (в том числе фосфолипидами), а также полиизопреноидами. В отличие от эукариот, меняющих свойства липидного остова мембраны за счёт изменения соотношения между фосфолипидами и холестерином, бактерии изменяют свойства мембраны, варьируя жирные кислоты, входящие в состав липидов. Стероиды обнаруживаются в бактериальных мембранах чрезвычайно редко, и вместо стероидов мембраны содержат гопаноиды, представляющие собой пентациклические[en] углеводороды. Гопаноиды активно участвуют в регуляции физических свойств мембран бактериальных клеток[12].
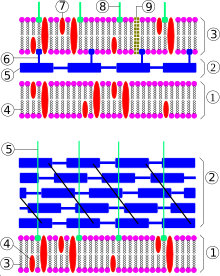 Схема строения клеточной стенки грамотрицательной (сверху) и грамположительной (снизу) бактерий. Сверху: 1 — клеточная мембрана, 2 — периплазматическое пространство, 3 — внешняя мембрана, 4 — фосфолипид, 5 — пептидогликан, 6 — липопротеин, 7 — белок, 8 — липополисахарид, 9 — порины. Снизу: 1 — клеточная мембрана, 2 — пептидогликан, 3 — фосфолипид, 4 — белок, 5 — липотейхоевая кислота
Схема строения клеточной стенки грамотрицательной (сверху) и грамположительной (снизу) бактерий. Сверху: 1 — клеточная мембрана, 2 — периплазматическое пространство, 3 — внешняя мембрана, 4 — фосфолипид, 5 — пептидогликан, 6 — липопротеин, 7 — белок, 8 — липополисахарид, 9 — порины. Снизу: 1 — клеточная мембрана, 2 — пептидогликан, 3 — фосфолипид, 4 — белок, 5 — липотейхоевая кислотаВ зависимости от типа строения клеточной стенки бактерии подразделяют на грамположительные и грамотрицательные (названия группам были даны вследствие их разного окрашивания по методу Грама). Большинство бактериальных клеток окружены жёсткой клеточной стенкой, состоящей из полимера пептидогликана, также известного как муреин. Пептидогликан состоит из полисахаридных цепей, скреплённых короткими пептидными сшивками. В большинстве случаев клеточная стенка жизненно необходима для бактерии, поэтому антибиотики, блокирующие её образование (формирование) (например, пенициллин), эффективны против самых разных бактерий. В старых культурах и при несбалансированном росте грамотрицательных бактерий появляются так называемые сферопласты — клетки, лишённые клеточной стенки или имеющие дефекты в ней. Однако, в отличие от протопластов, они взаимодействуют с бактериофагами, размножаются и при благоприятных условиях возвращаются в нормальное состояние. Сферопласты патогенных бактерий называются L-формами, которые получаются в лабораториях в отсутствие клеточной стенки только в изотонических растворах[13][14][15]. Некоторые бактерии, паразитирующие внутри эукариотических клеток, например, микоплазма, не имеют клеточной стенки[16].
Клеточная стенка механически стабилизирована и противостоит внутреннему давлению (тургорному давлению) бактериальной клетки, которое составляет от 2 до 25 атм[17]. Кроме того, она играет ключевую роль в поддержании формы бактериальной клетки[18]. Через слой пептидогликана, имеющий небольшие отверстия, могут проходить только относительно небольшие молекулы (массой до 50—60 кДа), причём размер проникающих молекул не зависит от толщины слоя пептидогликана. В связи с этим в тех случаях, когда через слой пептидогликана должны пройти большие молекулы, такие как белки жгутиков, пилей и ДНК при конъюгации, специфические гидролазы пептидогликана локально расширяют отверстия для их прохода[17].
Химическое строение[править | править код]
 Упрощённая схема строения пептидогликана
Упрощённая схема строения пептидогликанаГликановые цепи пептидогликана обычно состоят из повторяющегося дисахарида N-Ацетилглюкозамин-N-Ацетилмурамовой кислоты (NAG-NAM). В среднем нить образована 30 дисахаридами, но их количество может варьировать. К NAM присоединяется короткий пептид, состоящий из аминокислот D-глутаминовой кислоты, D-аланина и диаминопимелиновой кислоты (DAP) и синтезируемый вне рибосом. Аминогруппы DAP участвуют в образовании сшивок между полисахаридными цепями пептидогликана. При образовании сшивок последний D-аланин пептида высвобождается. У некоторых бактерий в пептидных мостиках присутствуют другие аминокислоты, а у грамположительных бактерий гликановые нити могут также соединяться с одним или несколькими остатками глицина в пептидных мостиках[19].
Грамположительные бактерии[править | править код]
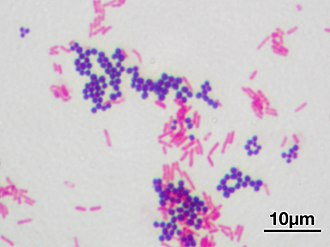 Окрашивание по Граму. Грамположительные кокки окрашены фиолетовым цветом, а грамотрицательные палочки — розовым
Окрашивание по Граму. Грамположительные кокки окрашены фиолетовым цветом, а грамотрицательные палочки — розовымУ грамположительных бактерий поверх мембраны есть (от 20 до 50 нм) оболочка из пептидогликана толщиной до 40 молекулярных слоёв[20]. Их положительная окраска по методу Грама связана с тем, что их толстая пептидогликановая клеточная стенка прочно связывает комплекс красителя генцианвиолета[en] с йодом, который не вымывается. Поэтому на препаратах грамположительные бактерии выглядят фиолетовыми (у грамотрицательных бактерий этот комплекс вымывается, и они приобретают цвет второго красителя, например сафранина)[21].
Кроме пептидогликана, в клеточной стенке грамположительных бактерий имеются тейхоевые кислоты, которые закрепляются на поверхности клетки, образуя связи с пептидогликаном. Липотейхоевые кислоты взаимодействуют с остатками жирных кислот клеточной мембраны. Тейхоевые и липотейхоевые кислоты представляют собой полианионы, состоящие из повторяющихся звеньев в виде фосфорилированных сахаров или остатков глицерина. Фосфатные группы в составе тейхоевых кислот могут быть заменены на глюкоуронат, в результате чего образуются тейхуроновые кислоты. Синтез тейхуроновых кислот запускается при фосфорном голодании. Блокировка синтеза тейхоевых кислот приводит к гибели бактерий, однако конкретные функции этих соединений точно не установлены[22]. Высказываются предположения, что они действуют наподобие пружин, делая возможным растяжение и сжатие клеточной стенки. Кроме того, за счёт своей полианионной природы тейхоевые кислоты прочно связывают ионы магния, поэтому могут выполнять в клетке роль ионообменника[23].
Поскольку у грамположительных бактерий слой пептидогликана не прикрыт сверху мембраной, перед ними стоит проблема удержания поверхностных белков. В ряде случаев поверхностные белки при помощи специальных ферментов пришиваются к фосфолипидам клеточной мембраны с образованием липопротеинов. Кроме того, поверхностные белки могут закрепляться на поверхности клетки за счёт связывания с пептидогликаном, которое обеспечивается ферментом сортазой[en]. Белки, предназначенные к связыванию с пептидогликаном, несут на N- и C-концах характерные последовательности, например, на N-конце находится сигнальный пептид, благодаря которому белок проходит через клеточную мембрану. Вблизи C-конца находится мотив, распознаваемый сортазой; в него вносится разрыв, после чего белок с отрезанным C-концевым фрагментом ковалентно пришивается к пептидогликану амидной связью[24].
У микобактерий, нокардий и коринебактерий 30 % вещества клеточной стенки составляют липиды, причём у некоторых микобактерий в ней также образованы воски. Такую обогащённую липидами клеточную стенку иногда называют микомембраной. Микомембрана защищает бактерий от неблагоприятных условий среды и антимикробных препаратов[25]. У бактерий родов Mycobacterium, Nocardia, Corynebacterium, Rhodococcus[en] и Caseobacter в клеточной стенке обнаруживаются миколовые кислоты. Помимо полисахаридов, у ряда патогенных грамположительных бактерий в клеточных стенках присутствуют белки, например, белок А у стафилококков, который служит важным антигеном. Кроме того, с клеточной стенкой временно, перед высвобождением в окружающую среду, связываются энтеротоксины[en][26].
Грамотрицательные бактерии[править | править код]
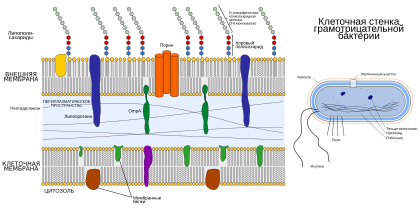 Подробная схема строения клеточной стенки грамотрицательных бактерий
Подробная схема строения клеточной стенки грамотрицательных бактерийУ грамотрицательных бактерий поверх клеточной мембраны тоже залегает слой пептидогликана, однако он значительно (почти в 40 раз[17]) тоньше, чем у грамположительных бактерий, и прикрыт сверху второй мембраной. Клеточная и наружная мембраны отличаются по химическому составу. Пространство между клеточной и наружной мембранами называется периплазматическим пространством (периплазмой)[27].
В периплазматическом пространстве находится много разнообразных белков: разрушающие биологические молекулы ферменты, транспортные белки, белки, участвующие в метаболизме, а также шапероны, которые регулируют пространственную структуру других белков, защищают их от протеолиза и нежелательных взаимодействий с другими белками. Например, в периплазме происходит образование дисульфидных мостиков и цис—транс-изомеризация пролина, которая является частью процесса созревания белка. Некоторые шапероны периплазмы участвуют в сборке ворсинок. Если под действием стрессовых условий в периплазме происходит агрегация[en] неуложенных белковых молекул, то активируется система Cpx. Она состоит из белка CpxA, заякоренного в клеточной мембране, и связанного с ним белка CpxP, который обращён в периплазму. CpxP взаимодействует с неуложенными белками и покидает CpxA, который при этом подвергается аутофосфорилированию[en] и далее переносит фосфатную группу на цитоплазматический белок CpxR. Фосфорилированный CpxR запускает экспрессию генов стрессового ответа[28]. По мере роста клетки в периплазматическом пространстве накапливаются продукты метаболизма пептидогликана, которые клетка использует повторно[29].
 Строение липополисахарида
Строение липополисахаридаНаружная мембрана состоит из двух асимметричных слоёв: внутренний слой, обращённый к клетке, состоит из фосфолипидов, а внешний — из липополисахаридов. Внутренний слой почти на 90 % состоит из фосфатидилэтаноламина[13]. Липополисахариды содержат О-полисахарид, коровый полисахарид и остаток липида А[en]. О-полисахарид, как правило, состоит из повторяющихся остатков галактозы, глюкозы, рамнозы и маннозы. Центральный (коровый) полисахарид состоит из N-ацетилглюкозамина, глюкозамина, фосфата, гептозы и кетодезоксиоктоната. Липополисахариды токсичны для животных и являются важнейшими антигенами, активирующими иммунную систему в ответ на бактериальное заражение[30]. Наружная мембрана связана со слоем пептидогликана при помощи липопротеинов, N-концы которых связаны с жирными кислотами и погружены во внешнюю мембрану, а C-концы связаны с пептидогликаном. Во внешней мембране имеются белки-порины[en], а также белки, связанные со сборкой поверхностных структур, конъюгацией и секрецией белковых молекул[31].
От наружной мембраны могут образовываться так называемые везикулы наружной мембраны, имеющие диаметр от 20 до 500 нм. В отпочковывании везикул принимает участие цитоскелет. Образование везикул может быть вызвано тем, что при росте клетки наружная мембрана увеличивается быстрее пептидогликанового слоя, а может вызываться особыми внешними условиями, например, у Porphyromonas gingivalis[en] образование везикул запускается нехваткой гемина[en]. Стенка везикул состоит из наружной мембраны, и при отпочковывании она может захватывать содержимое периплазмы. Так, у Pseudomonas aeruginosa везикулы наружной мембраны содержат периплазматические ферменты, в числе которых гемолизин, пептидогликан-гидролазы, протеазы, проэластазы, щелочная фосфатаза и фосфолипаза C, а также β-лактамаза, которая позволяет бактериям гидролизовать β-лактамные антибиотики и в периплазме, и во внешней среде. Везикулы наружной мембраны могут также служить для доставки ферментов и фрагмента наружной мембраны к клеткам-мишеням или в необходимый участок внешней среды[32].
В клетке грамотрицательной бактерии имеется от 200 до 400 зон слипания между наружной и клеточной мембранами, которые называют контактами Байера. В области контактов Байера в пептидогликановом слое имеется крупное отверстие, благодаря чему наружная и клеточная мембраны могут сблизиться вплотную. Адгезию мембран могут обеспечивать компоненты некоторых экспортных комплексов. Контакты Байера могут служить для выделения наружу различных молекул, например, субъединиц пилей, кроме того, к ним прикрепляются некоторые бактериофаги[33].
Из-за наличия дополнительного барьера проницаемости (наружной мембраны) для достижения необходимого эффекта грамотрицательные бактерии требуют больших концентраций антибиотиков, чем грамположительные бактерии. Наружная мембрана обеспечивает взаимодействия клеток друг с другом, с клетками организма-хозяина (при патогенезе) и с поверхностью субстрата. Она удерживает такие внешние структурные образования, как пили[29].
У цианобактерий поверх слоя пептидогликана располагается внешняя мембрана, однако с пептидогликаном ковалентно связаны полисахариды, из-за которых, судя по всему, цианобактерии окрашиваются по Граму положительно. Кроме того, наружная мембрана цианобактерий содержит каротиноиды[21].
Формирование клеточной стенки[править | править код]
Синтез пептидогликана протекает в несколько этапов. Дисахариды его гликановых цепей синтезируются в цитозоле, начиная с уридин-5-дифосфата[en]-NAM (УДФ-NAM). Синтез пептида начинается на NAM. Он формируется последовательно, присоединение каждой аминокислоты катализируется определённым ферментом. Наконец, пентапептид, связанный с УДФ-NAM, присоединяется к особому липиду клеточной мембраны — бактопренолу[en]. Далее к УДФ-NAM присоединяется NAG, УДФ высвобождается, и всё звено, включающее NAM, NAG и пептид, переворачивается и становится обращённым во внешнюю среду, а не в цитоплазму. Поперечные сшивки образуются с участием ферментов DD-транспептидаз[en] (которые ингибируются пенициллином), которые катализируют реакцию транспептидации, сопровождающуюся высвобождением остатка D-аланина. Образование гликановых цепей катализируют трансгликозилазы, кроме того, имеются бифункциональные ферменты, обладающие и трансгликозилазной, и транспептидазной активностями[19].
Согласно одной из предложенных моделей, при росте клетки в клеточную стенку сначала добавляются новые нити, и лишь потом происходит разрыв старых связей. У большинства бактерий в клеточной стенке находится множество ферментов автолиза, которые разрушают различные химические связи в пептидогликане[34].
Под системами секреции у бактерий понимают белковые комплексы, расположенные в клеточной мембране бактерий и служащие для выведения во внешнюю среду различных веществ. В частности, их используют патогенные бактерии для выделения факторов вирулентности[en] (преимущественно белковой природы). На основании состава, структура и действия системы секреции делят на несколько типов. Существует по меньшей мере шесть типов систем секреции, специфичных для грамотрицательных бактерий, четыре типа систем секреции уникальны для грамположительных бактерий, а два типа систем секреции имеются у обеих групп бактерий. Типы бактериальных систем секреции и их основные свойства приведены в таблице ниже[25].
| Система секреции | Сигнал секреции | Количество этапов секреции | Уложен ли субстрат | Количество мембран | Грам(+) или грам(-) |
|---|---|---|---|---|---|
| Sec | N-концевой | 1 | Нет | 1 | Обе группы |
| Tat | N-концевой | 1 | Да | 1 | Обе группы |
| I тип | C-концевой | 1 | Нет | 2 | Грам(-) |
| II тип | N-концевой | 2 | Да | 1 | Грам(-) |
| III тип | N-концевой | 1—2 | Нет | 2—3 | Грам(-) |
| IV тип | C-концевой | 1 | Нет | 2—3 | Грам(-) |
| V тип | N-концевой | 2 | Нет | 1 | Грам(-) |
| VI тип | Неизвестен | 1 | Неизвестно | 2—3 | Грам(-) |
| SecA2 | N-концевой | 1 | Нет | 1 | Грам(+) |
| Сортазы | N-концевой (Sec) C-концевой (cws) | 2 | Да | 1 | Грам(+) |
| Инжектосомы | N-концевой | 2 | Да | 1 | Грам(+) |
| VII тип | C-концевой | 1 | Да | 1—3 | Грам(+) |
Капсула[править | править код]
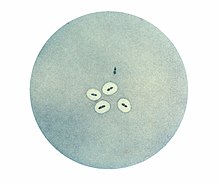 Клетки Streptococcus pneumoniae с капсулами, визуализированными при помощи Quellung-реакции. Обратите внимание, что две бактерии в верхней части фотографии не имеют капсулы
Клетки Streptococcus pneumoniae с капсулами, визуализированными при помощи Quellung-реакции. Обратите внимание, что две бактерии в верхней части фотографии не имеют капсулыУ многих бактерий поверх клеточной стенки или внешней мембраны залегает капсула, состоящая из экзополисахаридов[en]. Структурной основой капсулы служат линейные или разветвлённые полигликаны и олипептиды, состоящие из одинаковых или разных мономеров. У непатогенных бактерий капсулы служат для защиты высыхания, например, именно благодаря капсуле цианобактерии рода Nostoc могут расти в пустыне. У патогенных бактерий капсула резко увеличивает вирулентность, так как иммунная система плохо справляется с бактериями, покрытыми капсулой: они плохо связываются с антителами и не поддаются фагоцитированию[35].
S-слой[править | править код]
Поверхность некоторых бактерий (как грамположительных, так и грамотрицательных) покрыта S-слоем, состоящим из упорядоченно уложенных белковых субъединиц. У бактерий очень редки случаи, когда S-слой является единственной плотной оболочкой, обычно он сосуществует вместе с пептидогликановой клеточной стенкой. S-слой не играет формообразующей роли и часто утрачивается бактериями, растущими в лабораторных условиях. Сборка S-слоя начинается с того, что его белковые субъединицы секретируются в экзоплазматический компартмент, где они спонтанно агрегируют, связываясь друг с другом гидрофобными, водородными и электростатическими связями. S-слой обеспечивает механическую защиту бактериальной клетки, препятствует попаданию в клетку экзогенных молекул, взаимодействует с бактериофагами. У патогенных бактерий S-слой является важным фактором вирулентности[36].
Жгутик[править | править код]
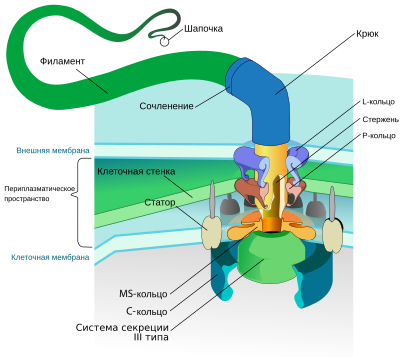 Схема строения бактериального жгутика
Схема строения бактериального жгутикаБольшинство бактерий подвижны, и их подвижность обеспечивается одним или нескольким жгутиками, которые представляют собой поверхностные белковые структуры. Расположение жгутиков на клетке может быть различным. У монотрихов имеется только один жгутик, у лофотрихов на одном из полюсов клетки находится пучок жгутиков, у амфитрихов на противоположных полюсах клетки находится по одному жгутику, а у перитрихов многочисленные жгутики разбросаны по всей поверхности клетки. Длина жгутика варьирует, но диаметр обычно составляет 20 нм[37].
Основание бактериального жгутика представлено базальным телом, состоящим из двух (у грамположительных) или четырёх (у грамотрицательных бактерий) белковых колец, стержня и моторных белков. От базального тела отходит крючок, переходящий в , который завершается «шапочкой». Филамент представляет собой жёсткий цилиндр, образованный белком флагеллином. В клеточной мембране находятся кольца M и S, которые часто рассматривают как единое целое. MS-кольцо окружено несколькими моторными белками, которые передают вращающий момент на филамент. У грамотрицательных бактерий, помимо колец M и S, есть ещё два кольца: P, залегающее в пептидогликановом слое, и L, находящееся во внешней мембране. Через все кольца проходит жёсткий стержень, передающий вращающий момент на филамент[38].
При сборке жгутика сначала в мембране клетки появляется MS-кольцо, к которому прикрепляются моторные белки, далее формируются P- и L-кольца (у грамотрицательных бактерий), крючок и филамент. В такой же последовательности запускается экспрессия генов, кодирующих белки соответствующей части жгутика[39]. Через полое внутреннее пространство базального тела новые флагеллиновые субъединицы поступают к вершине растущего жгутика, где самоорганизуются по спирали. Чтобы субъединицы флагеллина не уходили во внешнюю среду, конец растущего филамента прикрыт «шапочкой», которая не даёт им покинуть жгутик. В среднем зрелый филамент состоит из около 20 тысяч молекул флагеллина, а белки жгутика кодируются более чем 30 генами[40].
Вероятно, движущей силой вращения жгутика у бактерий является протонный градиент. Поток протонов, проходящий через кольца M и S или между базальным телом и клеточной мембраной, запускает вращение жгутика[41].
Движение клетки происходит за счёт вращения жгутика по часовой стрелке или против неё. У монотрихов клетка медленно вращается в направлении, противоположном вращению жгутика. Если жгутик вращается по часовой стрелке, то клетка движется жгутиком вперёд, а если против, то клетка выталкивается жгутиком вперёд (то есть движется жгутиком назад). Некоторые бактерии, имеющие единственный жгутик, вращают его только по часовой стрелке, и, чтобы сменить направление движения, им нужно остановиться и переориентироваться. У перитрихов жгутики вращаются против часовой стрелки, и, если нужно сменить направление движения, клетка останавливается и совершает кувырок[41].
У некоторых бактерий рода Vibrio (в частности, Vibrio parahaemolyticus[en][42]) и некоторых протеобактерий, таких как Aeromonas, имеются две различные жгутиковые системы, белковые компоненты которых кодируются различными наборами генов, а для вращения используются разные ионные градиенты. Полярные жгутики, относящиеся к первой жгутиковой системе, присутствуют постоянно и обеспечивают подвижность в потоке жидкости, а боковые жгутики, относящиеся ко второй жгутиковой системе, экспрессируются только тогда, когда сопротивление окружающей жидкости так велико, что полярные жгутики не могут вращаться. Благодаря этому бактерии могут скользить по различным поверхностям и в вязкой жидкости[43][44][45][46][47][48].
Пили[править | править код]
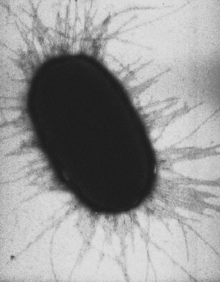 Клетки E. coli с многочисленными пилями
Клетки E. coli с многочисленными пилямиПили (также известны как фимбрии или ворсинки) — нитевидные белковые структуры, расположенные на поверхности клеток многих бактерий. Размер пилей варьирует от долей мкм до более чем 20 мкм в длину и 2—11 нм в диаметре. Пили участвуют в передаче генетического материала между бактериальными клетками (конъюгация), прикреплении бактерий к субстрату и другим клеткам, отвечают за адаптацию организмов, служат местами прикрепления многих бактериофагов. Структурно пили могут быть от тонких нитевидных образований до толстых палочкообразных структур с осевыми отверстиями. Пили состоят из одного или нескольких типов спирально уложенных белковых молекул, которые называют пилинами[en] или фимбринами[49]. В образовании пилей, помимо самих белков-пилинов, участвуют дополнительные белки, способствующие правильной сборке. У грамотрицательных бактерий они должны пройти через клеточную мембрану, периплазматическое пространство и наружную мембрану[50].
Прочие внеклеточные структуры[править | править код]
Иногда слизистая структура окружает не отдельную клетку, как в случае капсулы, а скопление клеток, и тогда покровную слизистую структуру называют чехлом. Чехлы могут покрывать не только вегетативные клетки, но и другие варианты дифференцированных клеток, например, покоящиеся структуры (цисты, эндоспоры, гетероцисты). Чехлы имеются, например, у
Обсуждение:Кишечная палочка — Википедия
Материал из Википедии — свободной энциклопедии
Ничего себе — фрагменты![править код]
Пока это скорее статья на иностранном языке с фрагментом русского… —A. C. Tatarinov 15:02, 27 ноября 2010 (UTC)
- Неужели фрагменты на английском языке мешают читать текст на русском? —Sirozha.ru 15:24, 27 ноября 2010 (UTC)
- Да, мешают. Вы же не первый год в википедии, неужели не понимаете, что так здесь не работают? Серебряный 01:06, 28 ноября 2010 (UTC)
- Здесь работают так, чтобы было удобно ВСЕМ. Мне удобно таким образом переводить статьи, в моем архиве порядка 100 длинных статей, переведенных именно таким образом. Частями, с установкой шаблона «перевожу». Это первый случай. Статью обычно перевожу сверху вниз. Закончился текст на русском языке — есть выбор — читать на английском или перейти на другую статью. Был только один случай за последний год, когда я оставил в тексте статьи непереведенный фрагмент. До конца ноября либо удалю непереведенный текст, либо переведу, можете не сомневаться. Пользы для проекта от такой работы больше чем вреда, в этом я не сомневаюсь —Sirozha.ru 05:06, 28 ноября 2010 (UTC)
- Здесь читают, а работают в личном пространстве или в инкубаторе (за исключением, если вы не можете одной правкой создать читаемый текст). Вы создаете существенные трудности для читателя. S.J. 06:55, 30 ноября 2010 (UTC)
- Вы откуда появились снова? Так мило попрощались с вами —Sirozha.ru 07:59, 30 ноября 2010 (UTC)
- Соскучился 🙂 как же я без такого милого общества. S.J. 08:05, 30 ноября 2010 (UTC)
- Зачем тогда было объявлять, что вы уходите и подпитывать пустые надежды? —Sirozha.ru 08:06, 30 ноября 2010 (UTC)
- Итак, я понимаю Вы отказываетесь работать как вам рекомендуют уже с десяток участников ? S.J. 08:07, 30 ноября 2010 (UTC)
- Я хочу попрощаться с вами на этой странице и навсегда. И обещаю больше не нарушать ВП:ЭП и ВП:НО в вашу сторону ни здесь, ни где-либо еще. Еще раз прощайте, ( скрыто) —Sirozha.ru 08:12, 30 ноября 2010 (UTC)
- Соскучился 🙂 как же я без такого милого общества. S.J. 08:05, 30 ноября 2010 (UTC)
- Вы откуда появились снова? Так мило попрощались с вами —Sirozha.ru 07:59, 30 ноября 2010 (UTC)
- Здесь читают, а работают в личном пространстве или в инкубаторе (за исключением, если вы не можете одной правкой создать читаемый текст). Вы создаете существенные трудности для читателя. S.J. 06:55, 30 ноября 2010 (UTC)
- Здесь работают так, чтобы было удобно ВСЕМ. Мне удобно таким образом переводить статьи, в моем архиве порядка 100 длинных статей, переведенных именно таким образом. Частями, с установкой шаблона «перевожу». Это первый случай. Статью обычно перевожу сверху вниз. Закончился текст на русском языке — есть выбор — читать на английском или перейти на другую статью. Был только один случай за последний год, когда я оставил в тексте статьи непереведенный фрагмент. До конца ноября либо удалю непереведенный текст, либо переведу, можете не сомневаться. Пользы для проекта от такой работы больше чем вреда, в этом я не сомневаюсь —Sirozha.ru 05:06, 28 ноября 2010 (UTC)
- Да, мешают. Вы же не первый год в википедии, неужели не понимаете, что так здесь не работают? Серебряный 01:06, 28 ноября 2010 (UTC)
- Перестаньте удалять обсуждение. Что написано пером … Если хотите принести мне извинения то можно просто словами. —S.J. 08:40, 30 ноября 2010 (UTC)
- Обсуждения не удаляются, а архивируются. Если в этом есть необходимость сделайте так как правильно. —S.J. 09:44, 30 ноября 2010 (UTC)
Коллеги, давайте уже прекратим войну правок в совершенно ненужном месте. Не очень понимаю, что вы тут хотите друг другу доказать, но это никого из вас не украшает. Дискуссия закрыта, поскольку более нерелевантна — статья допереведена, предупреждения за нарушения правил всем розданы. — Артём Коржиманов 09:47, 30 ноября 2010 (UTC)
- А зачем Вы восстановили подделку фразы ? S.J. 09:49, 30 ноября 2010 (UTC)
- Ответил на ваше странице обсуждения. Это не подделка подписи, это обращение к вам. подпись стоит после него через тире. — Артём Коржиманов 09:51, 30 ноября 2010 (UTC)
- Спасибо за помощь, Артём Коржиманов вот как раз пример того, что не является подделкой подписи, но — обращением —Sirozha.ru 10:30, 30 ноября 2010 (UTC)
- Ответил на ваше странице обсуждения. Это не подделка подписи, это обращение к вам. подпись стоит после него через тире. — Артём Коржиманов 09:51, 30 ноября 2010 (UTC)
Отклонение правки 17 апреля 2012[править код]
- Почему была отменена моя правка статьи? Вот статья на основании которой я сделал правку: http://medportal.ru/mednovosti/news/2012/04/12/bacterfetus/ — Эта реплика добавлена участником Niteo (о • в) 18:50, 17 апреля 2012 (UTC)
- Согласно ВП:ПРОВ информация в тексте статьи должна быть подтверждена ссылками на источники. Вы этого не сделали и в этот раз. Напрасно Sirozha.ru 02:19, 18 апреля 2012 (UTC)
- Источник, который содержит подобные выводы К тому же, Францино обнаружила, что у детей, мамы которых получили высшее образование, преобладают лактобактерии. У детей, мамы которых не учились в университетах, в составе микробиома доминирует кишечная палочка. — ахинея. По неизвестной мне причине авторитетному источнику Medical Microbiology, 4th edition вы противопоставляете информацию из околонаучного медицинского сайта, который пользуется переводами околонаучного журнала, не делая при этом ссылку на оригинальную работу. —Sirozha.ru 02:20, 18 апреля 2012 (UTC)
- Хорошо. Подождем до публикации в «более» научном издании…
