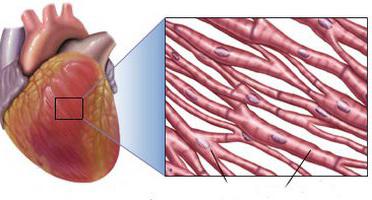
Клетки сердца
![]()
Что заставляет сердце сокращаться? Что определяет его ритм, и как этот ритм поддерживается всей мускулатурой сердца? Чему обязано сердце своей способностью пульсировать: свойствам каждой отдельной клетки или взаимодействию клеток? Чтобы ответить на все эти вопросы, мы, сотрудники медицинского центра Калифорнийского университета, разрабатываем новый метод изучения работы сердца. Мы обособляем элементы живой ткани сердечной мышцы и следим за поведением отдельных клеток.
Эксперимент начинается с обработки трипсином измельченной ткани сердца молодой крысы. Этот фермент разрушает протеин — белок, цементирующий клетки, причем подобная операция, очевидно, не нарушает целости самих клеток. Поместив затем выделенные таким образом клетки в центрифугу, мы получаем их суспензию в среде, содержащей сыворотку крови и другие необходимые питательные вещества.
Приблизительно через четыре часа клетки сердца начинают осаждаться на дно. После двух-трех дней инкубации (температура поддерживается 37° по Цельсию) в специальном сосуде (флаконе) видно, что клетки сердца коренным образом изменяются. Они вытягиваются, уплощаются и прикрепляются к стеклу флакона длинными отростками.
Когда мы в первый раз рассмотрели один из этих препаратов под микроскопом, перед нами открылась удивительная картина: некоторые из наших клеток пульсировали! Примерно одна из ста клеток ритмично сокращалась, причем каждая такая клетка имела свою особую частоту сокращений (от 10 до 150 раз в минуту). До этого проводились исследования, которые показали пульсацию изолированных клеток сердца эмбриона цыпленка. Нам впервые удалось обнаружить это явление на материале, полученном из сердца полностью развитых млекопитающих.
Это сразу же доказало, что биение сердца зарождается в биении единичной клетки, то есть для процесса пульсации не требуется ни множества клеток, ни нервных связей. Эти факторы регулируют работу сердца, но нет сомнения, что периодическое сокращение является внутренней функцией единичной клетки.
До последнего времени большинство специалистов отрицало даже существование в сердце отдельных клеток. Когда исследовали ткань сердца, то видели нечто, казавшееся пучками связанных между собой волокон, многочисленные ядра которых не разделялись клеточными оболочками. Поэтому считали, что сердце состоит, по существу, из одной крупной клетки с большим количеством ядер. Электронная микроскопия, однако, показывает, что в действительности ядро и окружающая их протоплазма в сердечномышечной ткани разделены перегородками, и сердце, таким образом, состоит из отдельных функционирующих клеток.
В первом из наших опытов мы дали нашему препарату возможность развиваться несколько недель и вели наблюдения. По мере того, как клетки поглощали питательные вещества, они росли и размножались. Их отростки удлинялись и вступали в контакт друг с другом. Чем больше клеток соединялось таким образом, тем большее их число начинало пульсировать. В конечном счете все клетки соединялись воедино и пульсировали, но пульсация каждой из них больше не была самостоятельной. После того как происходило окончательное объединение клеток, они пульсировали с одинаковой частотой и в унисон.
По мере дальнейшего размножения клеток сосуд все больше заполняется ими. Начинается новая фаза процесса. Среди клеток появляются совершенно определенные центры, вокруг которых радиально располагаются удлиненные клетки. Теперь стенки сосуда как бы покрыты розетками, и все эти розетки пульсируют в унисон. Следующая стадия — срастание клеток в перепончатый пласт, который весь вздымается и опускается, пульсируя уже как единый орган, а не как совокупность многих клеток. Розетки организуются в линии, как бы образуя длинные пульсирующие «горные хребты». Эти «хребты» часто утолщаются и частично отделяются от перепончатого пласта в виде волокон, и волокна тоже продолжают пульсировать.
Эти наблюдения наводят на мысль о том, что организация сердца взрослой особи частично является результатом деятельности самих клеток. А. А. Москона (университет Чикаго) получил аналогичные результаты, работая с тканями других органов. Он смешивал в одной чашке клетки печени эмбриона с клетками почек и замечал, что оба типа клеток вскоре разделялись, и каждая группа оформлялась таким образом, что напоминала строение родительских тканей.
Весь процесс объединения и определенной организации клеток сердца напоминает развитие слизистой плесени — особого организма, который проводит часть жизни в виде суспензии единичных клеток, а другую часть уже как многоклеточный организм. В конце первого периода, то есть когда каждая клетка еще живет самостоятельной жизнью, клетки слизистой плесени собираются и объединяются во взрослый организм. На этой стадии слизистая плесень поразительно похожа на собирающиеся воедино клетки сердца.
Проследив за тем, как распространялся процесс пульсации при объединении клеток, мы решили несколько изменить условия эксперимента. Была приготовлена культура, содержащая в восемь раз больше клеток на единицу объема, чем в первоначальном варианте. За один-два дня все клетки вступили в контакт друг с другом и начали пульсировать в унисон. В суспензии средней концентрации за то же время начали пульсировать 80 процентов клеток, которые образовали несколько отдельных групп. Причем каждая из этих групп пульсировала как единый орган, хотя и не в унисон с другими группами клеток.
Было похоже на то, что пульсация передается путем прямого контакта между клетками. Однако можно было также предполагать, что в питательной среде находится какой-то химический переносчик — раздражитель. Чтобы решить этот вопрос, мы разделили одну колонию синхронно пульсирующих клеток на две самостоятельные части. Обе они немедленно начали пульсировать с различной частотой, несмотря на то, что были помещены в одну и ту же среду. В другом эксперименте мы применили ацетилхолин (вещество, замедляющее работу сердца), обработав им лишь небольшую часть клеток целой колонии. Ацетилхолин подавил пульсацию всех клеток. Когда же мы подействовали ацетилхолином на клетки одной из частей разделенной колонии, он подавил пульсацию клеток только в этой части; вторая половина никак не реагировала на ацетилхолин до тех пор, пока не была перемешена питательная среда.
Опыты показали, что могут быть два типа изолированных сердечных клеток: 1) небольшое количество клеток, пульсирующих самопроизвольно (их мы назвали ведущими клетками — «лидерами») и 2) большинство клеток, названных нами «ведомыми», которые пульсируют, только находясь в контакте с одним из «лидеров». Обработка культуры метиленовой синькой помогла выделить эти группы вполне четко. Это, во-первых, длинные клетки неправильной формы, которые хорошо окрашивались в темно-синий цвет. Вероятно, это и есть клетки-«лидеры». И, во-вторых, клетки меньшего размера, округлой формы, очевидно, «ведомые» клетки. Окрашивались они очень слабо.
В сердце известны два основных типа клеток. Одни из них — клетки миокарда, мышечные клетки, составляют основу сердечной ткани. Другие порождают и рассылают импульсы, поддерживающие ритмичность пульсации сердца. Каждое сокращение, очевидно, начинается с импульса в синусном узле (узел в правом предсердии). Отсюда импульс распространяется на оба предсердия и достигает атриовентрикулярного узла. Затем следует дальше через сеть клеток, известных под названием волокон Пуркинье, к остальным клеткам сердца. Нам представляется возможным, что клетки-«лидеры» в наших культурах происходят из узловых тканей и волокон Пуркинье, а «ведомые» клетки — из тканей сердечной мышцы. Данные предварительных экспериментов подтвердили эту точку зрения: когда мы приготовили культуру части правого предсердия, включающей синусный узел, мы получили более высокий процент самопроизвольно пульсирующих клеток.
Затем мы поставили перед собой задачу выяснить, что определяет частоту пульсации в синхронной сети. Зависит ли частота от биений самой «быстрой» или самой «медленной» клетки-«лидера» в данной группе, или же здесь возникает какая-то средняя частота пульсации? Этот вопрос можно сразу решить, проведя серию микрофотографий при помощи видеокамеры, которая проследит частоту пульсаций отдельных клеток при их объединении в сеть клеток. Мы приступили к подбору необходимого оборудования.
А тем временем нам удалось получить некоторые данные не столь прямым методом. Известно, что частота пульсации сердечных клеток возрастает с повышением температуры. Использовав аппарат, который давал возможность установить температурный градиент в чашке с культурой, мы измерили частоту биений клеток вначале при температуре 25° по Цельсию, затем при 35°. После этого мы подогрели одну сторону чашки и понизили температуру другой ее стороны с тем, чтобы клетки находились в условиях разных температур — от 25 до 35°. Вся сеть пульсировала с той же частотой (или почти с такой же), которая наблюдалась при самой высокой температуре.
Но когда эта сеть была разделена на две части, на нагретой стороне сохранилась начальная высокая частота пульсации, а на охлажденной стороне частота упала. Другими словами, клетки на более холодной половине чашки сохраняли быстрый темп биений до тех пор, пока они были связаны с клетками, нагретыми до более высокой температуры. Однако когда охлажденные клетки были отделены, частота их биений сократилась до скорости, характерной для более низкой температуры. Это позволило нам сделать вывод, что общая для всей сети клеток частота определяется самой быстрой клеткой (или, может быть, группой клеток).
Опыты, проведенные над целым сердцем, подтверждают этот вывод. Разрушение синусного узла снижает частоту пульсации, и основная роль в определении скорости биения тогда принадлежит атриовентрикулярному узлу. Когда развивающееся сердце цыпленка разделяли на две части, то обе части пульсировали с разной частотой; когда обе части соединяли, то преобладала большая частота.
Короче говоря, общая частота пульсации определяется клеткой, обладающей наибольшей частотой, и именно потому, что она пульсирует быстрее всех других, И хотя все клетки в сети клеток пульсируют с одинаковой частотой, потенциально они сохраняют свои индивидуальные особенности.
Если приготовить культуру клеток сердца очень слабой концентрации, то в ней не образуются ни розетки, ни волокна, клетки продолжают пульсировать в одиночку до 40 дней. Первые несколько дней поведение каждой такой пульсирующей клетки во многом напоминает работу целого сердца. Но пульсирующая клетка гораздо более чувствительна, чем бьющееся сердце, и представляет собой как бы уменьшенную во много раз «модель» сердца, которую можно использовать во многих опытах, На клетках можно изучать действие лекарственных веществ. Так, например, ацетилхолин совершенно приостанавливает биение клетки на несколько минут. Биение возобновляется после нейтрализации действия ацетилхолина ферментом холинэстеразой. Если клетку предварительно обработать эзерином, то есть составом, нейтрализующим действие холинэстеразы, то эффект ацетилхолина сохраняется. Действие эзерина, в свою очередь, может быть сведено на нет строфантином.
Сердечномышечные клетки чрезвычайно чувствительны также к агентам, подавляющим некоторые стадии обмена веществ. Одним из таких агентов является динитрофенол, препятствующий синтезу аденозин-трифосфата (АТФ), который, как считают, дает энергию для процесса сокращения мышц. Мы обнаружили, что очень низкие концентрации динитрофенола задерживают пульсацию единичной клетки. Это тормозящее действие динитрофенола может быть уничтожено прибавлением АТФ. Напрашивается вывод, что для процесса пульсации необходим АТФ. При помощи соответствующих тормозящих агентов можно изучить и другие реакции, снабжающие энергией – клеточные процессы. Подобные исследования могут внести ясность в картину обмена веществ, лежащую в основе работы сердца.
Клеткам требуется меньше питательных веществ для того, чтобы они пульсировали, чем для одновременного роста и пульсации. Физиологический раствор, содержащий фракцию гликопротеина сыворотки крови, углекислоту и источник энергии в виде глюкозы или лактата (соли молочной кислоты), будет способствовать продолжению и сохранению процесса пульсации. Цельная сыворотка, аминокислоты и витамины способствуют росту клеток. Если концентрация культуры достаточно высока для образования из клеток волокнистых масс, то потребность их в питательных веществах снижается: они могут пульсировать безо всякого постороннего источника энергии (углекислоты и гликопротеина).
Гарри Игл (медицинский колледж имени Альберта Эйнштейна) обнаружил подобное явление и на других клетках млекопитающих. Разбавленные культуры требуют нескольких аминокислот, в то время как культуры повышенной концентрации прекрасно обходятся без этого. Независимо от того, какие могут быть сделаны выводы из этих открытий, уже сейчас одно представляется несомненным: потребность в питательных веществах неодинакова у единичной клетки и у целой ткани.
В основе описанных экспериментов лежит вопрос о взаимосвязи и взаимозависимости единичных клеток и родительской ткани. Нет сомнения, что изоляция клетки и помещение ее в чужеродную среду не могут не сказаться коренным образом на процессах, происходящих в этой клетке. Клетка некоторое время продолжает функционировать, потому что она сохраняет структуру и ферменты, синтезированные в нормальных условиях целого организма. Она, так сказать, пытается продолжать свою историю. Однако через некоторое время в этих клетках наступают изменения. Они теряют способность производить специфичные ферменты. Единичные клетки в разбавленных растворах пульсируют не более шести недель; в концентрированных культурах клетки, объединившиеся в синхронно пульсирующие совокупности, дегенерируют уже через две недели.
Такие эксперименты, мы надеемся, позволят решить один из наиболее важных вопросов биологии: как в развивающемся организме возникает специфика различных типов клеток.
Автор: Г. Иткиса, перевод с английского.
P. S. О чем еще говорят британские ученые: о том, что когда то благодаря научным исследованием клеток сердца, наша медицина дойдет до создания настоящих искусственных сердец, которые при нужде можно сдать в ремонт, какую-нибудь бытовую технику мы сдаем в ремонт компании rem-bot.ru.
Кардиомиоцит — Википедия
Материал из Википедии — свободной энциклопедии
Кардиомиоциты — мышечные клетки сердца.
Выделяют рабочие (сократительные), синусные (пейсмекерные), переходные, проводящие, секреторные кардиомиоциты. Рабочие кардиомиоциты составляют основную массу миокарда.
Миоциты желудочков млекопитающих относительно крупны — их диаметр составляет от 12 до 90 мкм, их форма приближается к цилиндрической. Корреляция размера кардиомиоцитов и массы тела животного отсутствует. Предсердные кардиомиоциты чаще всего отросчаты и, как правило, меньше желудочковых.
Кардиомиоциты имеют все органеллы общего характера, однако степень их развития различна.
- ядро, как правило светлое, характеризующееся наличием большого количества эухроматина. В миокарде взрослых млекопитающих преобладают двухъядерные кардиомиоциты, кроме человека, у которого количество двухъядерных миоцитов не превышает 10—13 %.
- Аппарат Гольджи. Зачастую представлен 3-4 цистернами и скоплением мелких пузырьков и везикул, обычно располагается возле полюсов ядра.
- Гранулярный эндоплазматический ретикулум развит слабо — иногда встречаются одиночные каналы.
- Митохондрии, из числа органелл общего характера достигающие наибольшего развития и занимающие значительный объём кардиомиоцитов желудочков сердца. Характерной особенностью именно митохондрий кардиомиоцитов является наличие специфический структур — межмитохондриальных контактов.
- Лизосомы, которые преимущественно находятся в околоядерной зоне.
До сих пор остаётся открытым вопрос, встречаются ли центриоли в клетках кардиомиоцитов.
К специализированным органеллам относят:
Потенциал действия рабочего кардиомиоцита[править | править код]

Потенциал действия рабочего кардиомиоцита развивается в ответ на электрическую стимуляцию (обычно со стороны соседних клеток за счет наличия плотных вставочных дисков, или нексусов).
Фаза быстрой деполяризации[править | править код]
Первой фазой (Фаза 0) потенциала действия рабочего кардиомиоцита является фаза быстрой деполяризации. Ионный ток через нексусы приводит к деполяризации мембраны рабочего кардиомиоцита до критического уровня деполяризации (примерно −60 мВ[1]). Это вызывает открытие быстрых потенциалзависимых натриевых каналов на мембране кардиомиоцита. Через эти каналы ионы натрия по концентрационному градиенту проходят через мембрану внутрь клетки, вызывая дальнейшую деполяризацию мембраны до уровня в +20 — +30 мВ[1][2]. Это значение может меняться в зависимости от концентрации ионов натрия в межклеточной жидкости. Нормальная концентрация натрия составляет приблизительно 140 мЭкв/л. При снижении этого показателя до, примерно, 20 мЭкв/л кардиомиоциты становятся невозбудимыми[3]. В результате деполяризации мембраны кардиомиоцита большинство натриевых каналов переходят в инактивированное состояние и ток Na
Фаза быстрой начальной реполяризации[править | править код]
Фаза быстрой начальной реполяризации (Фаза 1) обусловлена активацией быстрых потенциалзависимых калиевых каналов[5]. Ионы калия выходят через эти каналы из клетки, что приводит к реполяризации мембраны.
Фаза плато (медленной реполяризации)[править | править код]
Фаза плато (Фаза 2) развивается в результате уравновешивания выходящего тока ионов калия входящим током ионов кальция[6]. Кальций входит в клетку через потенциалзависимые кальциевые каналы. Их активация происходит в результате деполяризации мембраны во время фазы 0. В сердце обнаружены кальциевые каналы двух типов: L и T[7]. Кальциевые каналы T-типа активируются при заряде на мембране примерно в −50 мВ[4]. Их активация и инактивация происходит быстро. Кальциевые каналы L-типа активируются при мембранном потенциале в −20 мВ и остаются открытыми относительно продолжительное время (в среднем 200 мс) [6][4].
Выходящий ток калия во время фазы плато обеспечивается несколькими типами калиевых каналов[8].
ПО мере инактивации кальциевых каналов баланс между входящим током кальция и выходящим током калия нарушается, ток калия начинает доминировать и фаза плато завершается.
Фаза быстрой конечной реполяризации[править | править код]
Во время фазы быстрой конечной реполяризации (Фаза 3) выходящий ток калия возвращает мембранный потенциал рабочего кардиомиоцита к уровню мембранного потенциала покоя. В это время натриевые каналы начинают переходить из инактивированного в закрытое состояние, что позволяет рабочему кардиомиоциту возбуждаться в ответ на сверхпороговые раздражители. Такое состояние мембраны получило название — относительная рефрактерность[6].
Мембранный потенциал покоя[править | править код]
Восстановление мембранного потенциала покоя (Фаза 4) сопровождается работой Na+/K+-АТФ-азы которая удаляет из клетки ионы натрия, прошедшие внутрь во время фазы 0. Кроме того, происходит восстановление концентрации ионов кальция за счёт работы 3Na
- ↑ 1 2 3 Нормальная физиология человека / под ред. Б. И. Ткаченко. — 2-е изд. — М.: Медицина, 2005. — С. 115. — 928 с. — ISBN 5-225-04240-6.
- ↑ 1 2 Гайтон А. К., Холл Д. Э. Медицинская физиология = Textbook of Medical Physiology / под ред. В.И. Кобрина. — М.: Логосфера, 2008. — С. 113. — 1296 с. — ISBN 978-5-98657-013-6.
- ↑ Koeppen B. M., Stanton B. A. Berne & Levy Physiology. — 6th edition. — Philadelphia: Mosby/Elsevier, 2008. — С. 293. — 834 с. — ISBN 0323045820.
- ↑ 1 2 3 Jeanne M. Nerbonne, Robert S. Kass. Molecular Physiology of Cardiac Repolarization (англ.) // Physiological Reviews. — 2005-10-01. — Vol. 85, no. 4. — P. 1205—1253. — DOI:10.1152/physrev.00002.2005.
- ↑ Нормальная физиология человека / под ред. Б. И. Ткаченко. — 2-е изд. — М.: Медицина, 2005. — С. 116. — 928 с. — ISBN 5-225-04240-6.
- ↑ 1 2 3 Нормальная физиология человека / под ред. Б. И. Ткаченко. — 2-е изд. — М.: Медицина, 2005. — С. 117. — 928 с. — ISBN 5-225-04240-6.
- ↑ Koeppen B. M., Stanton B. A. Berne & Levy Physiology. — 6th edition. — Philadelphia: Mosby/Elsevier, 2008. — С. 295. — 834 с. — ISBN 0323045820.
- ↑ Koeppen B. M., Stanton B. A. Berne & Levy Physiology. — 6th edition. — Philadelphia: Mosby/Elsevier, 2008. — С. 297. — 834 с. — ISBN 0323045820.
- ↑ Koeppen B. M., Stanton B. A. Berne & Levy Physiology. — 6th edition. — Philadelphia: Mosby/Elsevier, 2008. — С. 299. — 834 с. — ISBN 0323045820.
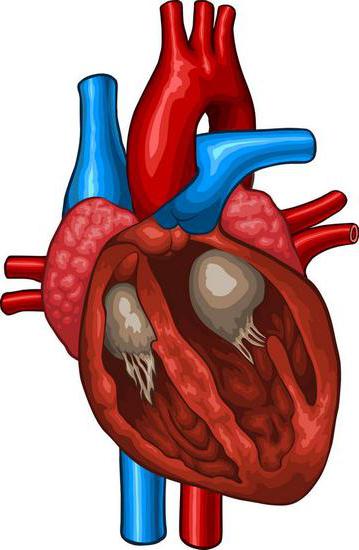
Строение сердца Эндокард
Внутренняя оболочка сердца, эндокард (endocardium), выстилает изнутри камеры сердца, папиллярные мышцы, сухожильные нити, а также клапаны сердца. Толщина эндокарда в различных участках неодинакова. Он толще в левых камерах сердца, особенно на межжелудочковой перегородке и у устья крупных артериальных стволов — аорты и легочной артерии, а на сухожильных нитях значительно тоньше.
В эндокарде различают 4 слоя: эндотелий, субендотелиальный слой, мышечно-эластический слой и наружный соединительнотканный слой.
Поверхность эндокарда выстлана эндотелием, лежащим на толстой базальной мембране
. За ним следует субэндотелиальный слой, образованный рыхлой волокнистой соединительной тканью. Глубже располагается мышечно-эластический слой, в котором эластические волокна переплетаются с гладкими мышечными клетками. Эластические волокна гораздо лучше выражены в эндокарде предсердий, чем в желудочках. Гладкие мышечные клетки сильнее всего развиты в эндокарде у места выхода аорты. Самый глубокий слой эндокарда — наружный соединительнотканный слой — лежит на границе с миокардом. Он состоит из соединительной ткани, содержащей толстые эластические, коллагеновые и ретикулярные волокна. Эти волокна непосредственно продолжаются в волокна соединительнотканных прослоек миокарда.Питание эндокарда осуществляется главным образом диффузно за счет крови, находящейся в камерах сердца.
Миокард
Средняя, мышечная оболочка сердца (myocardium) состоит из поперечнополосатых мышечных клеток — кардиомиоцитов
Различают кардиомиоциты трех типов:
сократительные, или рабочие, сердечные миоциты;
проводящие, или атипичные, сердечные миоциты, входящие в состав так называемой проводящей системы сердца;
секреторные, или эндокринные, кардиомиоциты.
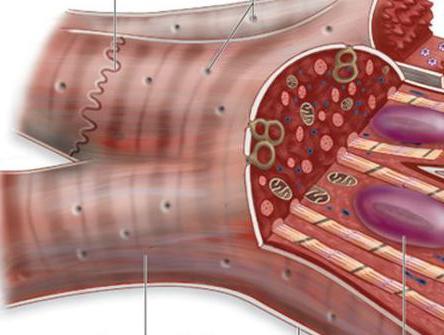
Сократительныекардиомиоциты образуют основную часть миокарда. Они содержат 1-2 ядра в центральной части клетки, а миофибриллы расположены по периферии. Места соединения кардиомиоцитов называются вставочные диски, в них обнаруживаются щелевые соединения (нексусы) и десмосомы. Форма клеток в желудочках — цилиндрическая, в предсердиях — неправильная, часто отросчатая.
Кардиомиоциты покрыты сарколеммой, состоящей из плазмолеммы и базальной мембраны, в которую вплетаются тонкие коллагеновые и эластические волокна, образующие «наружный скелет» кардиомиоцитов, — эндомизий. Базальная мембрана кардиомиоцитов содержит большое количество гликопротеинов, способных связывать ионы Са2+. Она принимает участие в перераспределении ионов Са2+ в цикле сокращение — расслабление. Базальная мембрана латеральных сторон кардиомиоцитовинвагинирует в канальцы Т-системы (чего не наблюдается в соматических мышечных волокнах).
Кардиомиоциты желудочков значительно интенсивнее пронизаны канальцами Т-системы, чем соматические мышечные волокна. Канальцы L-системы (латеральные расширения саркоплазматического ретикулума) и Т-системы образуют диады (1 каналец L-системы и 1 каналец Т-системы), реже триады (2 канальца L-системы, 1 каналец Т-системы). В центральной части миоцита расположено 1-2 крупных ядра овальной или удлиненной формы. Между миофибриллами располагаются многочисленные митохондрии и трубочки саркоплазматическогоретикулума.
В отличие от желудочковыхкардиомиоцитов предсердные миоциты чаще имеют отростчатую форму и меньшие размеры. В миоцитах предсердий меньше митохондрий, миофибрилл, саркоплазматической сети, а также слабо развита Т-система канальцев. В тех предсердных миоцитах, где нет Т-системы, на периферии клеток, под сарколеммой, располагаются многочисленные пиноцитозные пузырьки и кавеолы. Полагают, что эти пузырьки и кавеолы являются функциональными аналогами Т-канальцев.
Между кардиомиоцитами находится интерстициальная соединительная ткань, содержащая большое количество кровеносных и лимфатических капилляров. Каждый миоцит контактирует с 2-3 капиллярами.
Секреторные кардиомиоциты встречаются преимущественно в правом предсердии и ушках сердца. В цитоплазме этих клеток располагаются гранулы, содержащие пептидный гормон — предсердный натрийуретический фактор (ПНФ). При растяжении предсердий секрет поступает в кровь и воздействует на собирательные трубочки почки, клетки клубочковой зоны коры надпочечников, участвующие в регуляции объема внеклеточной жидкости и уровня артериального давления. ПНФ вызывает стимуляцию диуреза и натриуреза (в почках), расширение сосудов, угнетение секреции альдостерона и кортизола (в надпочечниках), снижение артериального давление. Секреция ПНФ резко усилена у больных с гипертонической болезнью.
Проводящие сердечные миоциты (myocyticonducenscardiacus), или атипичные кардиомиоциты, обеспечивают ритмичное координированное сокращение различных отделов сердца благодаря своей способности к генерации и быстрому проведению электрических импульсов. Совокупность атипичных кардиомиоцитов формирует так называемую проводящую систему сердца.
В состав проводящей системы входят:
синусно-предсердный, или синусный, узел;
предсердно-желудочковый узел;
предсердно-желудочковый пучок (пучок Гиса) и
его разветвления (волокна Пуркинье), передающие импульсы на сократительные мышечные клетки.
Различают три типа мышечных клеток, которые в разных соотношениях находятся в различных отделах этой системы.
Первый тип проводящихмиоцитов — это P-клетки, или пейсмейкерныемиоциты, — водители ритма. Они светлые, мелкие, отросчатые. Эти клетки встречаются синусном и предсердно-желудочковом узле и в межузловых путях. Они служат главным источником электрических импульсов, обеспечивающих ритмическое сокращение сердца. Высокое содержание свободного кальция в цитоплазме этих клеток при слабом развитии саркоплазматической сети обусловливает способность клеток синусного узла генерировать импульсы к сокращению. Поступлениенеобходимойэнергииобеспечиваетсяпреимущественнопроцессамианаэробногогликолиза.
Второй тип проводящихмиоцитов — это переходные клетки. Они составляют основную часть проводящей системы сердца. Это тонкие, вытянутые клетки, встречаются преимущественно в узлах (их периферической части), но проникают и в прилежащие участки предсердий. Функциональное значение переходных клеток состоит в передаче возбуждения от Р-клеток к клеткам пучка Гиса и рабочему миокарду.
Третий тип проводящихмиоцитов — это клетки Пуркинье, часто лежат пучками. Они светлее и шире сократительных кардиомиоцитов, содержат мало миофибрилл. Эти клетки преобладают в пучке Гиса и его ветвях. Отнихвозбуждениепередаетсянасократительныекардиомиоцитымиокардажелудочков.
Мышечные клетки проводящей системы в стволе и разветвлениях ножек ствола проводящей системы располагаются небольшими пучками, они окружены прослойками рыхлой волокнистой соединительной ткани. Ножки пучка разветвляются под эндокардом, а также в толще миокарда желудочков. Клетки проводящей системы разветвляются в миокарде и проникают в сосочковые мышцы. Это обусловливает натяжение сосочковыми мышцами створок клапанов (левого и правого) еще до того, как начнется сокращение миокарда желудочков.
Клетки Пуркинье — самые крупные не только в проводящей системе, но и во всем миокарде. В них много гликогена, редкая сеть миофибрилл, нет Т-трубочек. Клетки связаны между собой нексусами и десмосомами.
Проводящая система сердца — Википедия
| Проводящая система сердца | |
|---|---|
| лат. Systema conducens cordis | |
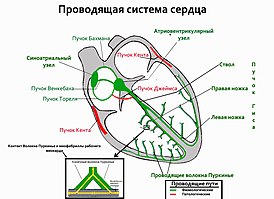 Элементы проводящей системы сердца | |
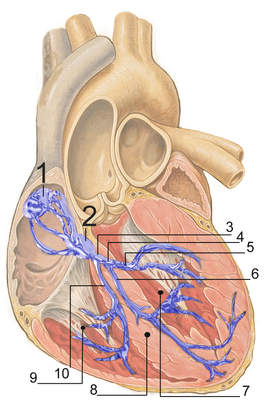 | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе |
Проводящая система сердца (ПСС) — комплекс анатомических образований сердца (узлов, пучков и волокон), состоящих из атипичных мышечных волокон (сердечные проводящие мышечные волокна) и обеспечивающих координированную работу разных отделов сердца (предсердий и желудочков), направленную на обеспечение нормальной сердечной деятельности.
ПСС состоит из двух взаимосвязанных частей: синоатриальной (синусно-предсердной) и атриовентрикулярной (предсердно-желудочковой).
К синоатриальной относят синоатриальный узел (узел Кис-Флака), три пучка межузлового быстрого проведения, связывающие синоатриальный узел с атриовентрикулярным и межпредсердный пучок быстрого проведения, связывающий синоатриальный узел с левым предсердием.
Атриовентрикулярная часть состоит из атриовентрикулярного узла (узел Ашоффа–Тавара), пучка Гиса (включает в себя общий ствол и три ветви: левая передняя, левая задняя и правая) и проводящих волокон Пуркинье.[B: 1]
Кровоснабжение[править | править код]
Иннервация[править | править код]
ПСС морфологически отличается как от мышечной, так и от нервной ткани, но находится в тесной связи и с миокардом, и с внутрисердечной нервной системой.[B: 2]
Атипичные мышечные волокна сердца — это специализированные проводящие кардиомиоциты, богато иннервированные, с небольшим количеством миофибрилл и обилием саркоплазмы.[B: 1]
Синусовый узел[править | править код]
Синусовый узел или синоатриальный узел (САУ) (лат. nódus sinuatriális), открытый в 1907 году Артуром Кейтом[en] и Мартином Флаком[en][2], расположен субэндокардиально в стенке правого предсердия латеральнее устья верхней полой вены, между отверстием верхней полой вены и правым ушком предсердия; отдаёт ветви к миокарду предсердий.[B: 1][B: 2]
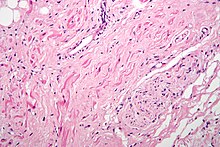 Микрофотография синусового узла. Мышечные волокна в узле напоминают миоциты сердца, однако они тоньше, имеют волнистую форму и менее интенсивно окрашиваются гематоксилин-эозином. На фотографии к узлу прилегает нервное волокно: синусовый узел взаимодействует с ответвлениями блуждающего нерва.
Микрофотография синусового узла. Мышечные волокна в узле напоминают миоциты сердца, однако они тоньше, имеют волнистую форму и менее интенсивно окрашиваются гематоксилин-эозином. На фотографии к узлу прилегает нервное волокно: синусовый узел взаимодействует с ответвлениями блуждающего нерва.Длина САУ ≈ 15 мм, ширина его ≈ 5 мм и толщина ≈ 2 мм. У 65% людей артерия узла берёт своё начало из правой венечной артерии, у остальных — из огибающей ветви левой венечной артерии. САУ богато иннервирован симпатическими и правым парасимпатическим нервами сердца, которые вызывают, соответственно, положительный и отрицательный хронотропные эффекты.[B: 2].
Клетки, составляющие синусовый узел, гистологически отличаются от клеток рабочего миокарда. Хорошим ориентиром служит выраженная a.nodalis (узловая артерия). Клетки синусового узла по размерам меньше клеток рабочего миокарда предсердия. Они группируются в виде пучков, при этом вся сеть клеток погружена в развитый матрикс. На границе синусового узла, обращенной к миокарду устья верхней полой вены, определяется переходная зона, которая может расцениваться как присутствие клеток рабочего миокарда предсердий в пределах синусового узла. Такие участки вклинения клеток предсердия в ткань узла чаще всего встречаются на границе узла и пограничного гребня (выступа стенки правого предсердия сердца, которым заканчиваются вверху гребенчатые мышцы).[B: 3]
Гистологически синусовый узел состоит из т.н. типичных клеток узла. Они располагаются беспорядочно, имеют веретенообразную форму, а иногда разветвления. Для этих клеток характерно слабое развитие сократительного аппарата, случайное распределение митохондрий. Саркоплазматический ретикулум развит хуже, чем в миокарде предсердий, а система T-трубочек отсутствует. Это отсутствие, правда, не является критерием, по которому выделяются «специализированные клетки»: часто система T-трубочек отсутствует и в рабочих кардиомиоцитах предсердия.
По краям синусового узла наблюдаются переходные клетки, отличающиеся от типичных лучшей ориентацией миофибрилл наряду с более высоким процентом межклеточных соединений — нексусов. Находимые ранее «вставочные светлые клетки», по последним данным, являются не более чем артефактом.
Согласно концепции, предложенной T.James и соавт. (1963-1985), связь синусового узла с АВ-узлом обеспечивается за счет наличия 3-х трактов: 1) короткий передний (пучок Бахмана), 2) средний (пучок Венкебаха) и 3) задний (пучок Тореля), более длинный. Обычно импульсы попадают в АВУ по короткому переднему и среднему трактам, на что расходуется 35-45 мсек. Скорость распространения возбуждения по предсердиям составляет 0,8—1,0 м/с. Описаны и другие проводящие тракты предсердий; к примеру, по данным B.Scherlag (1972), по нижнему межпредсердному тракту возбуждение проводится из передней части правого предсердия в нижнезаднюю часть левого предсердия. Считается, что в физиологических условиях эти пучки, а также пучок Тореля находятся в латентном состоянии.[B: 2]
Тем не менее, многими исследователями оспаривается существование каких-либо специализированных пучков между САУ и АВУ. Так, к примеру, в хорошо известной коллективной монографии[B: 3] сообщается следующее:
Полемика по вопросу об анатомическом субстрате для проведения импульсов между синусовым и атриовентрикулярным узлами ведётся уже сто лет, сколько насчитывает и сама история изучения проводящей системы. (…) По мнению Aschoff, Monckeberg и Koch, ткань между узлами является рабочим миокардом предсердий и не содержит гистологически различимых трактов. (…) На наш взгляд, в качестве трёх указанных выше специализированных путей James дал описание практически всего миокарда предсердной перегородки и пограничного гребня. (…) Насколько нам известно, никто до сих пор на основе морфологических наблюдений не доказал, что в межсердечной перегородке и пограничном гребне проходят узкие тракты, каким-либо образом сравнимые с атриовентрикулярным трактом и его ответвлениями.
Область атриовентрикулярного соединения[править | править код]
Предсердно-желудочковый узел (лат. nódus atrioventriculáris) лежит в толще передне-нижнего отдела основания правого предсердия и в межпредсердной перегородке. Длина его составляет 5-6 мм, ширина 2-3 мм. Кровоснабжается он одноименной артерией, которая в 80-90% случаев является ветвью правой коронарной артерии, а в остальных — ветвью левой огибающей артерии.[B: 2]
АВУ представляет собой ось проводящей ткани. Располагается на гребне входного и верхушечного трабекулярного компонентов мышечной части межжелудочковой перегородки. Архитектонику АВ-соединения удобнее рассматривать по восходящей — от желудочка к миокарду предсердий. Ветвящийся сегмент АВ-пучка расположен на гребне апикального трабекулярного компонента мышечной части межжелудочковой перегородки. Предсердный отрезок АВ-оси может быть разделен на компактную зону АВ-узла и переходную клеточную зону. Компактный участок узла по всей своей длине сохраняет тесную связь с фиброзным телом, которое образует его ложе. Он имеет два удлинения, проходящие вдоль фиброзного основания направо к трёхстворчатому клапану и налево — к митральному.
Переходная клеточная зона — это область, диффузно расположенная между сократительным миокардом и специализированными клетками компактной зоны АВ-узла. В большинстве случаев переходная зона более выражена сзади, между двумя удлинениями АВ-узла, но она также образует полуовальное покрытие тела узла.
С точки зрения гистологии, клетки предсердного компонента АВ-соединения мельче, чем клетки рабочего миокарда предсердий. Клетки переходной зоны имеют вытянутую форму и иногда разделены тяжами фиброзной ткани. В компактной зоне АВ-узла клетки расположены более тесно и часто организованы во взаимосвязанные пучки и завитки. Во многих случаях выявляется разделение компактной зоны на глубокий и поверхностный слои. Дополнительным покрытием служит слой переходных клеток, придающий узлу трехслойность. По мере перехода узла в проникающую часть пучка наблюдается увеличение размеров клеток, но в основном клеточная архитектоника сравнима с таковой в компактной зоне узла. Границу между АВ-узлом и проникающей частью одноименного пучка трудно определить под микроскопом, поэтому предпочтительней чисто анатомическое разделение в районе точки входа оси в фиброзное тело. Клетки, составляющие ветвящуюся часть пучка, по своим размерам напоминают клетки миокарда желудочков.
Коллагеновые волокна делят АВУ на кабельные структуры. Эти структуры создают анатомическую основу для продольной диссоциации проведения. Проведение возбуждения по АВУ возможно как в антероградном, так и в ретроградном направлениях. АВУ, как правило, оказывается функционально разделённым продольно на два проводящих канала (медленный α и быстрый β) — это создаёт условия для возникновения пароксизмальной узловой реципроктной тахикардии.
Продолжением АВУ является общий ствол пучка Гиса.
Пучок Гиса[править | править код]
Предсердно-желудочковый пучок (лат. fascículus atrioventriculális), или пучок Гиса, связывает миокард предсердий с миокардом желудочков. В мышечной части межжелудочковой перегородки этот пучок делится на правую и левую ножки (лат. crus déxtrum et crus sinístrum). Концевые разветвления волокон (волокна Пуркинье), на которые распадаются эти ножки, заканчиваются в миокарде желудочков.[B: 1]. Описан немецким кардиологом Вильгельмом Гисом[3].
Длина общего ствола пучка Гиса 8-18 мм в зависимости от размеров перепончатой части межжелудочковой перегородки, ширина около 2 мм. Ствол пучка Гиса состоит из двух сегментов — прободающего и ветвящегося. Прободающий сегмент проходит через фиброзный треугольник и доходит до мембранной части межжелудочковой перегородки. Ветвящийся сегмент начинается на уровне нижнего края фиброзной перегородки и делится на две ножки: правая направляется к правому желудочку, а левая — к левому, где распределяется на переднюю и заднюю ветви. Передняя ветвь левой ножки пучка Гиса разветвляется в передних отделах межжелудочковой перегородки, в передне-боковой стенке левого желудочка и в передней сосочковой мышце. Задняя ветвь обеспечивает проведение импульса по средним отделам межжелудочковой перегородки, по задне-верхушечным и нижним частям левого желудочка, а также по задней сосочковой мышце. Между ветвями левой ножки пучка Гиса существует сеть анастомозов, по которым импульс при блокаде одной из них попадает в блокированный области за 10-20 мсек. Скорость распространения возбуждения в общем стволе пучка Гиса составляет около 1,5 м/с, в разветвлениях ножек пучка Гиса и проксимальных отделах системы Пуркинье она достигает 3-4 м/с, а в терминальных отделах волокон Пуркинье снижается и в рабочем миокарде желудочков равняется примерно 1 м/с. [B: 2]
Прободающая часть ствола Гиса кровоснабжается из артерии АВУ; правая ножка и передняя ветвь левой ножки — от передней межжелудочковой венечной артерии; задняя ветвь левой ножки — от задней межжелудочковой венечной артерии.[B: 2]
Волокна Пуркинье[править | править код]
Бледные или набухшие клетки (так называемые клетки Пуркинье) редко встречаются в специализированной области атриовентрикулярного соединения у младенцев и детей младшего возраста.
Координируя сокращения предсердий и желудочков, ПСС обеспечивает ритмичную работу сердца, т.е нормальную сердечную деятельность. В частности, именно ПСС обеспечивает автоматизм сердца.
Функционально синусовый узел является водителем ритма первого порядка. В состоянии покоя в норме он генерирует 60-90 импульсов в минуту.[B: 2]
В АВ-соединении, главным образом в пограничных участках между АВУ и пучком Гиса, происходит значительная задержка волны возбуждения. Скорость проведения сердечного возбуждения замедляется до 0,02-0,05 м/с. Такая задержка возбуждения в АВУ обеспечивает возбуждение желудочков только после окончания полноценного сокращения предсердий. Таким образом, основными функциями АВУ являются: 1) антероградная задержка и фильтрация волн возбуждения от предсердий к желудочкам, обеспечивающие скоординированное сокращение предсердий и желудочков и 2) физиологическая защита желудочков от возбуждения в уязвимой фазе потенциала действия (с целью профилактики рециркуляторных желудочковых тахикардий). Клетки АВУ также способны брать на себя функции центра автоматизма второго порядка при угнетении функции САУ. Они обычно вырабатывают 40-60 импульсов в минуту. [B: 2] Патологии:
- Синдром слабости синусового узла.
- Патологические добавочные проводящие пути между предсердиями и желудочками.
- Блокада проведения.
Добавочные пучки между предсердиями и желудочками являются анатомическим субстратом для классического варианта предвозбуждения желудочков (синдром Вольфа-Паркинсона-Уайта)[B: 3].
- ↑ 1 2 3 4 Борзяк Э. И., Бочаров В. Я., Сапин М. Р. и др. Анатомия человека. В 2 томах / Под ред. акад. РАНМ, проф. М. Р. Сапина. — М.: Медицина, 1993. — Т. 2. — 560 с. — 40 000 экз. — ISBN 5-225-00879-8.
- ↑ 1 2 3 4 5 6 7 8 9 Анатомия и физиология проводящей системы сердца // Клиническая аритмология / Под ред. проф. А. В. Ардашева. — М.: МЕДПРАКТИКА-М, 2009. — С. 35—41. — 1220 с. — ISBN 978-5-98803-198-7.
- ↑ 1 2 3 Аритмии сердца. Механизмы. Диагностика. Лечение. В 3 томах / Пер. с англ./Под ред. В. Дж. Мандела. — М.: Медицина, 1996. — Т. 1. — 10 000 экз. — ISBN 0-397-50561-2.
- ↑ 1 2 Foundational Model of Anatomy
- ↑ Глязер Г. Исследователи человеческого тела. От Гиппократа до Павлова = Die Entdecker des Menschen. Von Hippokrates bis Pawlow / Пер. с нем. Ю. А. Федосюка. Под ред. Б. Д. Петрова. — М.: Государственное издательство медицинской литературы, 1956. — С. 200. — 7000 экз.
- ↑ Гаврилов Л. Ф. Гис Вильгельм (младший) // Большая Медицинская Энциклопедия / Главный редактор Б. В. Петровский. — М.
Ученые заявили, что биению сердца помогают клетки иммунной системы
Клетки иммунной системы должны бороться с болезнями. Но некоторые могут также играть повседневную роль, помогая сердечному ритму. Это неожиданное открытие — результат нового исследования.

Обычная функция макрофагов — защита от вредных бактерий, но…
Иммунные клетки представляют собой тип белых кровяных клеток, известных как макрофаги. Они обычно защищают организм от вторжения болезнетворных микробов. Но у мышей, как выяснило исследование, они также помогают проходить току электричества между сердечно-мышечными клетками.
Ритмический паттерн мышечных клеток известен как сердцебиение. Эти сокращения прокачивают кровь через сердце и по всему остальному телу. Макрофаги протискиваются между клетками сердечной мышцы. Там они «подключаются» к мышечным клеткам. Это помогает сердечным клеткам получать электрические сигналы, которые им необходимы, чтобы оставаться в ритме.
Матиас Нарендорф — клеточный биолог Гарвардской медицинской школы в Бостоне, штат Массачусетс и его команда — поделились этим новым открытием. Исследователи уже несколько лет знают, что макрофаги живут в здоровых тканях сердца. Но какую функцию они там выполняли, было загадкой.
Что делают макрофаги в сердце?
Нарендорф интересовался этими макрофагами в сердце. Поэтому он попытался выполнить МРТ на сердце мыши, которая была генетически спроектирована так, чтобы у нее не было макрофагов в сердце. Сканирование не увенчалось успехом. Сердцебиение животного было слишком медленным и нерегулярным для сканирования.
Эти симптомы указывают на то, что, вероятно, была проблема с сердцебиением, а точнее с атриовентрикулярным узлом. Это пучок мышечных волокон, который электрически соединяет верхнюю и нижнюю камеры сердца.
Людям с нарушениями узла может понадобиться кардиостимулятор, чтобы сердце билось так, как должно. У здоровых мышей исследователи обнаружили макрофаги, сконцентрированные в узле. Однако, что могли делать там макрофаги, было неясно.
Макрофаг «общается» с сердечно-мышечной клеткой электрически
Поэтому команда Нарендорфа изолировала один макрофаг сердца и проверила его. Он не показал электрической активности. В результате загадка осталась. Затем исследователи связали макрофаг с сердечно-мышечной клеткой. Они начали общаться электрически. Теперь ответ на загадку начал появляться. Электрические сообщения между ними стимулируют сокращение сердечно-мышечных клеток.
Ионы — это заряженные молекулы. И клетки сердечной мышцы имеют их дисбаланс. Во время отдыха вне клетки сердечной мышцы больше положительных ионов, чем внутри нее. Когда мышечная клетка получает электрический сигнал от соседней сердечной клетки, это распределение ионов переключается. Теперь внутри клетки больше положительных ионов, чем за ее пределами. Такой «переключатель» называется деполяризацией. Это краткое изменение заставляет клетку сокращаться, что посылает электрический сигнал, чтобы сообщить соседней мышечной клетке о деполяризации.
Ученые ранее думали, что сердечно-мышечные клетки могут делать этот ионный сдвиг самостоятельно. Но команда Нарендорфа обнаружила, что макрофаги тоже играют свою роль. Используя белок, макрофаги «зацепляются» за клетку сердечной мышцы, что позволяет им передавать положительные ионы и положительный электрический заряд. Это похоже на использование белка в качестве соединительного кабеля, чтобы дать мышечной клетке небольшой электрический старт. По словам Нарендорфа, это облегчает деполяризацию клеток сердца и вызывает сокращение сердца.
Фото: cdn.idntimes.com
Читайте также:
Сердце граждан — объект государственной значимости?
Сердечная мышца человека, ее особенности и функции :: SYL.ru
Сердце представляет собой полый орган. Его размер примерно с кулак человека. Сердечная мышца формирует стенки органа. В нем присутствует перегородка, разделяющая его на левую и правую половины. В каждой из них сеть желудочек и предсердие. Направление движения крови в органе контролируется посредством клапанов. Далее рассмотрим подробнее свойства сердечной мышцы.
Общие сведения
Сердечная мышца – миокард – составляет основную часть массы органа. Она состоит из трех типов ткани. В частности, выделяют: атипический миокард проводящей системы, волокна предсердия и желудочков. Размеренное и координированное сокращение сердечной мышцы обеспечивается проводящей системой.
Строение
Сердечная мышца отличается сетчатой структурой. Она формируется из волокон, переплетенных в сеть. Связи между волокнами устанавливаются за счет присутствия боковых перемычек. Таким образом, сеть представлена в виде узкопетлистого синцития. Между волокнами сердечной мышцы присутствует соединительная ткань. Она отличается рыхлой структурой. Кроме этого, волокна обвиты густой сетью капилляров.
Свойства сердечной мышцы
В структуре присутствуют вставочные диски, представленные в виде мембран, отделяющих клетки волокон друг от друга. Здесь следует отметить важные особенности сердечной мышцы. Отдельные кардиомиоциты, присутствующие в структуре в большом количестве, соединены друг с другом параллельно и последовательно. Клеточные мембраны сливаются так, что формируют щелевые контакты высокой проницаемости. Через них беспрепятственно диффундируют ионы. Таким образом, одна из особенностей миокарда состоит в наличии свободного перемещения ионов по внутриклеточной жидкости по ходу всего миокардиального волокна. Это обеспечивает беспрепятственное распределение потенциалов действия от одной клетки к другой сквозь вставочные диски. Из этого следует, что сердечная мышца – это функциональное объединение огромного количества клеток, имеющих тесную взаимосвязь друг с другом. Она настолько сильна, что при возбуждении только одной клетки провоцирует распространение потенциала на все остальные элементы.
Миокардиальные синцития
В сердце их два: предсердный и желудочковый. Все отделы сердца отделены друг от друга фиброзными перегородками с отверстиями, снабженными клапанами. Непосредственно через ткань стенок возбуждение от предсердия к желудочку перейти не может. Передача осуществляется посредством специального атриовентрикулярного пучка. Его диаметр – несколько миллиметров. Состоит пучок из волокон проводящей структуры органа. Присутствие в сердце двух синцитий способствует тому, что предсердия сокращаются раньше желудочков. Это, в свою очередь, имеет важнейшее значение для обеспечения эффективной насосной деятельности органа.
Болезни миокарда
Работа сердечной мышцы может нарушаться вследствие различных патологий. В зависимости от провоцирующего фактора, выделяют специфические и идиопатические кардиомиопатии. Болезни сердца могут быть также врожденными и приобретенными. Существует еще одна классификация, в соответствии с которой различают рестриктивную, дилатационную, конгестивную и гипертрофическую кардиомиопатии. Рассмотрим их вкратце.
Гипертрофическая кардиомиопатия
На сегодняшний день специалистами выявлены мутации генов, провоцирующие данную форму патологии. Для гипертрофической кардиомиопатии характерно утолщение миокарда и изменение его структуры. На фоне патологии мышечные волокна увеличиваются в размерах, «скручиваются», приобретая странные формы. Первые симптомы заболевания отмечаются в детском возрасте. Основными признаками гипертрофической кардиомиопатии считаются болезненность в груди и одышка. Также наблюдается неравномерность сердечного ритма, на ЭКГ обнаруживаются изменения в сердечной мышце.
Конгестивная форма
Это достаточно распространенный тип кардиомиопатии. Как правило, заболевание возникает у мужчин. Распознать патологию можно по признакам сердечной недостаточности и нарушениям в сердечном ритме. У некоторых пациентов отмечается кровохарканье. Патологию также сопровождает боль в районе сердца.
Дилатационная кардиомиопатия
Эта форма заболевания проявляется в виде резкого расширения во всех камерах сердца и сопровождается снижением сократительной способности левого желудочка. Как правило, дилатационная кардиомиопатия возникает в сочетании с гипертонической болезнью, ИБС, стенозом в аортальном отверстии.
Рестриктивная форма
Кардиомиопатия этого типа диагностируется крайне редко. Причиной патологии является воспалительный процесс в сердечной мышце и осложнения после вмешательства на клапанах. На фоне заболевания происходит перерождение миокарда и его оболочек в соединительную ткань, отмечается замедленное наполнение желудочков. У пациента отмечается одышка, быстрая утомляемость, пороки клапанов и сердечная недостаточность. Крайне опасной рестриктивная форма считается для детей.
Существуют различные способы это сделать. Мероприятия включают в себя коррекцию режима дня и питания, упражнения. В качестве профилактики после консультации с врачом можно начать принимать ряд препаратов. Кроме этого, есть и народные методы укрепления миокарда.
Физическая активность
Она должна быть умеренной. Физическая активность должна стать неотъемлемым элементом жизни любого человека. При этом нагрузка должна быть адекватной. Не стоит перегружать сердце и истощать организм. Оптимальным вариантом считаются спортивная ходьба, плавание, езда на велосипеде. Упражнения рекомендуется проводить на свежем воздухе.
Ходьба
Она превосходно подходит не только для укрепления сердца, но и для оздоровления всего организма. При ходьбе задействована практически вся мускулатура человека. При этом сердце дополнительно получает умеренную нагрузку. По возможности, особенно в молодом возрасте, стоит отказаться от лифта и преодолевать высоту пешком.
Образ жизни
Укрепление сердечной мышцы невозможно без корректировки режима дня. Для улучшения деятельности миокарда необходимо отказаться от курения, дестабилизирующего давление и провоцирующего сужение просвета в сосудах. Кардиологи также не рекомендуют увлекаться баней и сауной, поскольку пребывание в парной существенно увеличивает сердечные нагрузки. Необходимо также позаботиться и о нормальном сне. Спать следует ложиться вовремя и отдыхать достаточное количество часов.
Диета
Одним из важнейших мероприятий в вопросе укрепления миокарда считается рациональное питание. Следует ограничить количество соленой и жирной пищи. В продуктах должны присутствовать:
- Магний (бобовые, арбузы, орехи, гречка).
- Калий (какао, изюм, виноград, абрикосы, кабачки).
- Витамины Р и С (клубника, черная смородина, перец (сладкий), яблоки, апельсины).
- Йод (капуста, творог, свекла, морепродукты).
Негативное воздействие на деятельность миокарда оказывает холестерин в высоких концентрациях.

Психоэмоциональное состояние
Укрепление сердечной мышцы может осложняться различными неразрешенными проблемами личного либо рабочего характера. Они могут спровоцировать перепады давления и нарушения ритма. Следует по возможности избегать стрессовых ситуаций.
Препараты
Существует несколько средств, способствующих укреплению миокарда. К ним, в частности, относят такие препараты, как:
- «Рибоксин». Его действие направлено на стабилизацию ритма, усиление питания мышцы и коронарных сосудов.
- «Аспаркам». Этот препарат представляет собой магниево-калиевый комплекс. Благодаря приему средства нормализуется электролитный обмен, устраняются признаки аритмии.
- Родиола розовая. Это средство улучшает сократительную функцию миокарда. При приеме данного препарата следует соблюдать осторожность, поскольку он обладает способностью к возбуждению нервной системы.
Молекулярные посылки от лабораторных клеток помогут сердцу
С помощью регуляторных молекул из сердечных клеток, выращенных в лаборатории, можно восстановить работу сердца после инфаркта.
Клетки сердца, выращенные из стволовых клеток. (Фото: British Heart Foundation / Flickr.com) Внеклеточные пузырьки-везикулы. (Фото: Science)‹
›
Если бы наше сердце умело регенерировать, инфарктов можно было бы не бояться: пусть сколько-то клеток сердечной мышцы и погибло, на их место придут другие, и сердце будет работать, как работало.
Но, к сожалению, стволовые клетки, из которых получаются кардиомиоциты (то есть клетки сердечной мышцы), перестают делиться вскоре после рождения. И в случае инфаркта погибшие участки рубцуются – их заполняет соединительная ткань, которая вообще не может сокращаться. И сердце начинает работать хуже.
По всему миру исследователи ищут способы, с помощью которых сердце можно было бы восстановить. Кто-то пытается пробудить в самом сердце регенеративные способности – так, три года назад мы писали о том, что некоторые клетки сердечной мышцы все же сохраняют способность делиться, и, может быть, их можно как-то дополнительно простимулировать, чтобы они в случае инфаркта делились поактивнее.
Другой способ – взять стволовые клетки, в лаборатории вырастить из них кардиомиоциты в нужном количестве, и поставить эту заплатку на поврежденную мышцу. Но тут возникает проблема: готовые пересаженные клетки не могут синхронизироваться с остальной мышцей, и сердце начинает страдать от аритмии. Можно поступить иначе – поставить заплатку из самих стволовых клеток. Однако и тут все не очень хорошо: стволовые клетки, оказавшись на сердце, плохо превращаются в зрелые мышечные клетки и часто просто гибнут.
Впрочем, даже если все пересаженные стволовые клетки гибнут, польза от них все равно есть : было замечено, что больная сердечная мышца лучше себя чувствует после того, как на ней побывали стволовые клетки. Очевидно, они передавали какие-то молекулярные сигналы окружающим клеткам, помогая им справиться со стрессом. Исследователям из Колумбийского университета пришло в голову, что эти сигналы можно просто взять у лабораторных клеток и обработать ими сердечную мышцу.
И стволовые клетки, и кардиомиоциты (как и многие, многие другие) выделяют во внешнюю среду крохотные мембранные пузырьки-везикулы с разнообразными молекулами. Такие пузырьки – что-то вроде посылок с инструкциями, с их помощью клетки общаются и согласовывают свои действия. Например, одна клетка может послать другой клетке набор молекул, которые активируют у получателя те или иные гены. Что особенно важно, эти мембранные пузырьки сравнительно легко собирать с клеток, которые их выделяют.
Гордана Вуньяк-Новакович (Gordana Vunjak-Novakovic) и ее коллеги решили сравнить содержимое везикул, взятых у стволовых клеток, которым еще только предстоит превратиться в клетки сердечной мышцы, и других везикул, взятых у свежих кардиомиоцитов, которые только-только сформировались из стволовых клеток.
В статье в Nature Biomedical Engineering говорится, что в пузырьках, которые выделяли зрелые мышечные клетки, содержались регуляторные молекулы, стимулирующие рост сердечных мышечных волокон и кровеносных сосудов. (То есть эффект от пересадки стволовых клеток состоял в том, что они пытались превратиться в зрелые клетки сердечной мышцы, им это до конца не удавалось, они гибли, но успевали послать окружающим клеткам оздоровительные молекулярные посылки.)
Когда везикулы в составе специального гидрогеля накладывали на послеинфарктное сердце крыс, то в течение нескольких недель, пока пузырьки постепенно выходили из геля, сердце животных чувствовало себя все лучше: мышечные клетки переставали гибнуть после перенесенного стресса (то есть послеинфарктные повреждения не расширялись), аритмия постепенно слабела, а сама мышца начинала более эффективно качать кровь. По словам авторов работы, через месяц после лечения везикулами больное сердце работало почти как нормальное здоровое – регуляторные молекулы помогли скомпенсировать повреждения, связанные с инфарктом.
В дальнейшем исследователи хотят поточнее определить, на какой именно стадии развития, в какой именно момент превращения стволовых клеток в кардиомиоциты у них нужно брать лечебные везикулы – вполне может быть, что пузырьки, взятые на промежуточных стадиях, окажутся более эффективны. И не исключено, что в скором времени медики смогут пользоваться гелевыми «пластырями» с такими пузырьками, помогающими пациентам восстановиться после инфаркта.
