42.Опухоли системы крови. Современные принципы классификации. Варианты течения. Морфологические проявления острых лейкозов, осложнения, исходы, значение.
Системные – лейкозы (острые и хронические), регионарные (лимфомы)
Лейкозы – острые лейкозы (миелобластные и лимфобластные)
Острые миелобластные лейкозы : (От 10% и более бластных клеток, лейкемический провал, лейкемическая инфильтрация, синдромы анемический, тромбоцитопенический, кахектический, гиперпластический, инфекционный гнойно-некротическая ангина Венсана-Плаута-Симановского, геморрагический )
Миелобластные формы без дифференцировки
Миелобласты без созревания
Миелобласты с созреванием
Промиелоцитарные формы
Миеломоноцитарные формы
Монобластные формы
Эритроидные формы
Мегакариоцитарные формы
Острый лимфобластный лейкоз
Острый плазмобластный лейкоз
Хронические миелоцитарные лейкозы:
Хронический миелолейкоз
Хронический эритромиелоз
Болезнь Вакеза – красный лейкоз
Хронические лимфоцитарные лейкозы:
Хронический лимфолейкоз
Болезнь Сезари
Парапротеинемический лейкоз – миеломная болезнь
Макроглобулинемия Вальденстрейма
Болезнь тяжелых цепей Франклина
Хронические моноцитарные лейкозы:
Хронический моноцитарный лейкоз
Гистиоцитоз Х
Лифомы:
Лимфосаркомы (лимфоцитарная , пролимфоцитарная, лимфобластная, лимфоплазмоцитарная, лимфома Берккита)
Грибовидный микоз
Болезнь Сезари – регионарная форма
Ретикулосаркома
Лимфома Ходжкина или лимфогранулематоз
43.Хронические миелопролиферативные и лимфопролиферативные заболевания: классификация, этиология, морфологические проявления, исходы, значение.
Хронические миелоцитарные лейкозы (Пиоидный костный мозг , малокровие органов, спленомегалия, атрофия фолликулов , гепатомегалия, лейкозная инф печени, гемосидероз печени, лейкозные стазы и тромбы, нейролейкемия, инфаркты и геморрагии различных органов и тканей)
Хронический миелолейкоз
Хронический эритромиелоз
Болезнь Вакеза – красный лейкоз
Хронические лимфоцитарные лейкозы (Высокая лейкемия, тромбоцитопения, аутоиммунные поражения, участки желтого цвета костного мозга, огромные пакеты лимфоузлов, увеличены миндалины, спленомегалия, но меньше чем при миелоцитарных, гепатомегалия, нефромегалия с атрофией паренхимы, лейкозная инфильтрация)
Хронический лимфолейкоз
Болезнь Сезари
Парапротеинемический лейкоз – миеломная болезнь
Макроглобулинемия Вальденстрейма
Болезнь тяжелых цепей Франклина
Хронические моноцитарные лейкозы:
Хронический моноцитарный лейкоз
Гистиоцитоз Х
44.Регионарные опухоли кроветворной ткани (лимфомы) : классификация. Понятие «лейкемизация». Болезнь Ходжкина: этиология, клинико-морфологические формы, исходы, значение
Лифомы:
Лимфосаркомы (лимфоцитарная , пролимфоцитарная, лимфобластная, лимфоплазмоцитарная, лимфома Берккита)
Грибовидный микоз
Болезнь Сезари – регионарная форма
Ретикулосаркома
Лимфома Ходжкина или лимфогранулематоз
Хроническое , рецедивирующее, реже остро-протекающее неопластическое заболевание, при котором разрастание опухоли происходит преимущественно в лимфоузлах.
2 формы: изолированная и генерализованная. Чаще поражаются шейные лимфоузлы, узлы увеличиваются и спаеваются, лимфоузлы некротизируются и склерозируются. При генерализованной форме – «порфировая селезенка». В очагах первичной опухоли много пролиферирующих клеток, которые образуют узелки, которые подвергаются некрозу и склерозу. Характерны малые и большие клетки Ходжкина и клетки Березовского – Штенберга – Рид.
Варианты:
С преобладанием лимфоидной ткани
Узелковый склероз (разрастание фиброзной ткани в центре клетки БШР)
Смешанно – клетоный (гигантские клетки Ходжкина, БШР, участки лимфоидной ткани подвержены некрозу и фиброзу)
С вытеснением лимфоидной ткани чаще при ВИЧ-инфекции (диффузное разрастание соединительной ткани, клетки БШР, Ходжкина, склероза нет, саркома Ходжкина)
Общая характеристика лейкозов
В первую очередь для лейкозов характерна первичная пролиферация атипических клеток в костном мозге с угнетением нормальной кроветворной ткани.
Способность лейкозных клеток к инвазии и метастазированию приводит к последующей диссеминации в периферическую кровь, селезенку, лимфоузлы и другие органы.
Лейкозы часто, характеризуются лейкоцитозом, наличием незрелых и атипических клеток в периферической крови (но не при всех формах и не в 100% случаев).
Принципы классификации лейкозов
В основу классификации лейкозов положены следующие принципы:
степень дифференцировки (зрелости) лейкозных клеток
гисто-, цитогенез опухолевых клеток
количество бластных клеток в периферической крови
по степени дифференцировки (зрелости) лейкозных клеток различают:
– острые
– хронические лейкозы
Определяющим признаком является не скорость течения процесса, а субстрат опухоли (т.е. основная масса клеток составляющих опухоль). Если основная масса клеток представлена бластами, то это острый лейкоз. При хронических лейкозах основной массой опухолевых клеток являются зрелые и созревающие элементы.
по гистогенетической характеристике лейкозных клеток выделяют:
– неоплазмы из клеток лимфоидной линии
– неоплазмы из клеток миелоидной линии
по количеству лейкоцитов (Le) и бластных клеток в периферической крови:
– лейкемические: Le более (30 –50) ∙ 109 / л, большое количество бластных клеток
– сублейкемические: Le — (30 –50) ∙ 109 / л, большое количество бластных клеток
– алейкемические: Le в норме, отсутствие бластных клеток
– лейкопенические: Le менее 4∙109 / л, небольшое количество бластных клеток
Этиология лейкозов
Существует несколько теорий происхождения лейкозов.
Радиационная теория
Роль ионизирующей радиации в увеличении частоты хронического миелолейкоза, острого миелобластного лейкоза, лимфосарком и миеломной болезни была доказана при изучении последствий взрыва атомных бомб в Хиросиме и Нагасаки. Описано учащение случаев острых лейкозов среди больных эритремией после лечения их радиоактивным фосфором. В настоящее время установлено, что высокодозовая лучевая терапия онкологических больных в 5-10% случаев вызывает вторичное опухолевое заболевание, в том числе и острый лейкоз.
Теория химического лейкозогенеза
Экспериментально доказана возможность индуцирования лейкозов у животных введением канцерогенных веществ (диметилбензантрацен, метилхолантрен и др.). Также в эксперименте показана возможность стимуляции лейкозогенеза метаболитами триптофана и тирозина. Однако роль этих веществ в лейкозогенезе человека не доказана.
Накопленные данные, указывают на увеличение частоты острых миелолейкозов у людей, имеющих длительный профессиональный контакт с бензолом (шоферы, работники кожевенной и обувной промышленности и т.д.). Хроническое воздействие бензола также имеет место при длительном курении у активных и пассивных курильщиков.
Отмечается заметное увеличение частоты острого лейкоза у больных злокачественными новообразованиями, леченных такими алкилирующими цитостатическими препаратами, как циклосфосфан, хлорбутин, метотрексат и др. У пациентов с лимфомой Ходжкина получавших сочетание лучевой и химиотерапии вторичные лейкозы наблюдались в сотни раз чаще.
Вирусная теория
Несомненно, доказанным является вирусное происхождение лейкозов у многих видов животных: птиц, мышей, крыс, хомячков, кошек, крупного рогатого скота. К настоящему времени выделено и детально охарактеризовано несколько типов вирусов, вызывающих различные виды лейкозов у животных. Как правило, это РНК-содержащие вирусы, а также ДНК-содержащие вирусы, которые относятся к герпесвирусам.
У человека безусловно установленной считается вирусная природа и контагиозный характер Т-клеточного лимфолейкоза взрослых, который вызывается ретровирусом HLTV-1 (human T-leukemia virus-1) и передается половым путем, трансплацентарно и при переливании крови и ее производных. Роль вируса Эпштейн-Барр доказана в развитии лимфомы Беркитта, В-клеточного острого лимфобластного лейкоза, В-клеточных лимфом.
Генетическая теорияВероятность возникновения острого лейкоза у ближайших родственников пациента выше, чем в общей популяции. К возникновению лейкозов предрасполагают болезни, характеризующиеся спонтанными разрывами хромосом и нерасхождением соматических или половых хромосом (болезнь Дауна, анемия Фанкони, синдромы Кляйнфельтера, Тернера и др.).
Морфологическая классификация острого лимфобластного лейкоза (fab-классификация)
Морфологические признаки Лимфобластов | L1 | L2 | L3 |
Размеры клеток | Малые клетки однородные | Большие клетки неоднородные | Большие клетки однородные |
Размеры цитоплазмы | Цитоплазма скудная | Цитоплазма умеренно выраженная | Цитоплазма умеренно выраженная |
Базофилия цитоплазмы | Слабо выраженная | Слабо выраженная иногда умеренная | Выраженная |
Цитоплазматические вакуоли | Могут быть или отсутствуют | Могут быть или отсутствуют | Выражены значительно |
Ядерный хроматин | Нежная хроматиновая сеть или в виде глыбок | Нежная хроматиновая сеть | Нежная хроматиновая сеть |
Форма ядра | Правильная округлая, могут быть зазубрины | Правильная, могут быть зазубрины | Правильная округлая или овальная |
Ядрышко | Неотчетливое или не определяется | Одно или больше, большое выраженное | Одно или больше, большое выраженное |
Субпопуляции лимфобластов | 75% О- лимфобласты 25% Т — лимфобласты | 75% О- лимфобласты 25% Т — лимфобласты | В — лимфобласты |
Распределение больных по возрасту (%) — дети — взрослые | 5 31 | 14 60 | 1 9 |
Прогноз | Более благоприятный | Менее благоприятный | Прогноз очень плохой |
Цитохимические исследования, которые определяют с помощью цитохимического окрашивания принадлежность клеток к определенной линии дифференцировки. Наиболее характерные цитохимические показатели:
— определение миелопероксидазы. Принцип метода основан на том, что система перекись — пироксидаза гранул лейкоцитов способна окислять различные красители. Высокая активность миелопероксидазы проявляется в миелобластах, лимфобласты дают отрицательную реакцию;
— определение фосфолипидов основано на способности красителя судана черного растворяться в нейтральных жирах, фосфолипидах и окрашивать эти соединения. Для лимфобластов характерна отрицательная реакция на липиды, для миелобластов — положительная;
— содержание гликогена выявляется PAS-реакцией. В миелобластах гликоген диффузно распределен в цитоплазме, в лимфобластах гликоген выявляется в виде гранул.
При разных морфологических вариантах острого лимфобластного лейкоза цитохимические реакции могут оказаться очень вариабельными.
Иммунологическая классификация.Иммунологические варианты острого лимфобластного лейкоза выделяются с помощью моноклональных антител к дифференцировочным антигенам лимфоцитов и гемопоэтических клеток. Различают В-клеточные и Т-клеточные лимфолейкозы с подразделением на варианты внутри этих основных групп (табл. 15).
Специфические особенности наличия поверхностных и цитоплазматических антигенов Т- и В-лимфоцитов используются в качестве маркеров для идентификации и классификации происхождения и стадии дифференцировки лимфопролиферативных заболеваний. Использование панели моноклональных антител к кластерам дифференцировки и определение процентного соотношения их экспрессии в бластной популяции, позволяет указать, к какой Т- или В-линии относится лейкемический клон у данного больного. Разделение лимфобластов при ОЛЛ на гетерогенные группы соответственно стадиям созревания и иммунологическим поверхностным маркерам и в настоящее время остается важным прогностическим фактором.
Для ОЛЛ В-линии факторами определения тактики лечения являются возраст больного, инициальный лейкоцитоз и цитогенетические аномалии. Для Т-клеточного ОЛЛ нет признаков, влияющих на выбор терапии, он сам по себе является прогностически неблагоприятным и требует более интенсивного лечения. Как правило, для него характерны более старший возраст, наличие экстрамедулярного поражения и высокий лейкоцитоз.
Таблица 15
Иммунологическая классификация острого лимфобластного лейкоза
(Egil, 1995)
ОЛЛ В-линии Основной критерий: экспрессия CD79 в цитоплазме и/или CD22 и/или CD19 | |
В I Про-В-ОЛЛ | CD19+ и/или CD79+ и/или CD22+ В цитоплазме отсуствуют цепи На мембране отсутствует IgM |
В II Common ОЛЛ | CD10+ CD19+ и/или CD79+ и/или CD22+ В цитоплазме отсуствуют цепи На мембране отсутствует IgM |
В III Пре-В ОЛЛ | CD10+/- CD19+ и/или CD79+ и/или CD22+ выявляются + в цитоплазме |
В IV Зрелый В ОЛЛ | Мембранный IgM+ CD10+/- CD19+ и/или CD79+ и/или CD22+ |
ОЛЛ Т-линии Основной критерий: экспрессия цитоплазматического или мембранного CD3 | |
Т I Про-Т ОЛЛ | CD7+ CD3 в цитоплазме |
Т II Пре-Т ОЛЛ | CD7+ CD2+ и/или CD5+ и/или CD8+ на мембране несколько Т-антигенов но нет CD3 и CD1а CD3 в цитоплазме |
Т III Кортикальный ОЛЛ | CD1а+ CD3 в цитоплазме или на мембране |
Т IV Зрелый Т ОЛЛ | CD3 на мембране (и в цитоплазме) CD1а отсутствует |
У некоторых больных возможно присутствие на опухолевых клетках и Т- и В-клеточных маркеров одновременно (CD2+ и CD19+). Такие пациенты имеют хорошие прогностические показатели, выход в ремиссию и бессобытийную выживаемость. «Общий » антиген (CALLA, CD10+) экспрессируется на нормальных лимфоидных предшественниках и нейтрофилах. Наличие его на бластных клетках при ОЛЛ является относительно благоприятным признаком, особенно в случаях коэкспессии с CD19 и CD34 или у детей до года с лейкоцитозом менее 100000 /мкл. Отсутствие CD10 у детей до года часто ассоциируется с t[11q23]аномалией и плохим прогнозом. Некоторые авторы отмечают значениеCD45 — общего лейкоцитарного антигена. Последние исследования показали, что CD45 вовлечен в регуляцию клеточного роста и дифференцировки, В — клеточной активациии и апоптоза. Отсутствие его экспрессии на бластах больных ОЛЛ является прогностически благоприятным признаком.
Разделение ОЛЛ по клеточным линиям имеет и фармакологическое значение. Установлено, что лейкемические лимфобласты имеют повышенный уровень фермента дигидрофолатредуктазы, инактивирующего метотрексат в клетках, причем при Т-ОЛЛ это повышение значительно больше, чем при В-линейном. Как следствие этого в современных протоколах рекомендуется применение высокодозного метотрексата при Т-ОЛЛ, так как считается, что это может помочь преодолеть резистентность к нему.
Цитогенетические и молекулярно-генетические методыпозволяют оценить состояние хромосомного аппарата — количество хромосом и их структурные изменения (транслокации, инверсии, делеции). Наличие цитогенетических аномалий и ДНК-индекс (соотношение количества ДНК в лейкемических клетках и в клетках с нормальным диплоидным кариотипом) оказались значимым прогностическим фактором. Цитогенетическая аномалия (Ph-хромосома), характеризующаяся делецией или транслокацией 22q11, встречается у 5% детей, больных ОЛЛ, имеет плохой прогноз, выживаемость составляет 25-30% у детей. Чаще это дети старшего возраста, с гиперлейкоцитозом, ОЛЛ В-линейного фенотипа (CD10+, CD19+, CD34+). Выход в ремиссию может произойти, но затем возникает ранний рецидив. В плане лечения таких пациентов предпочтение отдается аллогенной ТКМ от совместимого родственного донора в первые 6 месяцев заболевания, что снижает риск токсической смерти и рецидива.
Еще одним известным неблагоприятным фактором является наличие транслокации t[1;19]. Она, как правило, встречается у детей старше 10 лет с В-линейным фенотипом (CD10+, CD19+, CD34+). Несмотря на интенсивную терапию выживаемость этих больных составляет около 40%.
У детей 1-го года жизни в 68-81% случаев выявляется транслокация t[4;11], что обуславливает плохой прогноз. ДНК-индекс выше 1,16 (более 50 хромосом в опухолевой клетке) встречается у 20% пациентов старше 1-го года независимо от инициального лейкоцитоза и возраста и ассоциируется с хорошим прогнозом. Предполагают, что при этом значительно больше клеток находится в S фазе, и они более чувствительны к цитостатическим препаратам. Еще одним благоприятным цитогенетическим признаком является наличие транслокации t[12;21], которая встречается у 25% детей, как правило, с common-вариантом ОЛЛ. Безрецидивная выживаемость таких пациентов может достигать 100%.
Общий анализ мочи —специфических особенностей нет, при поражении почек отмечаются протеинурия, микрогематурия, возможна цилиндрурия.
Биохимический анализ крови— возможно увеличение содержания ЛДГ, фибриногена, при поражении печени — гипербилирубинемия, повышение активности аланиновой аминотрансферазы, щелочной фосфатазы, снижение содержания альбумина; при поражении почек и развитии почечной недостаточности — повышение содержания мочевины и креатинина.
Рентгенография и томография легких —при наличии лейкозного пневмонита определяются усиленный легочный рисунок, мелко- и крупноочаговые тени по всей легочной ткани. С помощью этих методик также выявляются увеличенные лимфатические узлы средостения, поражение плевры, плевральный выпот.
Электрокардиография— при лейкемической инфильтрации миокарда обнаруживаются изменения миокарда и виде снижения амплитуды зубца Т в нескольких отведениях, чаще и грудных. В ряде случаев при выраженной инфильтрации миокарда возможно развитие атриовентрикулярной блокады различной степени.
Ультразвуковое исследование.Эхокардиография может выявить при тяжелом поражении миокарда расширение полостей сердца и снижение фракции выброса (признак уменьшения сократительной способности миокарда). Ультразвуковое исследование печени и селезенки выявляет увеличение этих органов, при лейкемической инфильтрации печени обнаруживаются мелкоочаговые изменения эхогенности, возможно обнаружение инфарктных очагов в селезенке. Ультразвуковое исследование почек может обнаружить двусторонние диффузные изменения эхоструктуры.
Радиоизотопное сканирование печени— в настоящее время применяется редко, выявляются увеличение печени, снижение поглощения радиофармпрепарата с диффузным неравномерным его накоплением.
Спинномозговая пункция— производится при наличии симптоматики поражения нервной системы. Характерные изменения цереброспинальной жидкости описаны выше. Исследования проводятся при уровне тромбоцитов не менее 30 000 /мкл. Для приготовления цитопрепарата необходимо 2 мл ликвора.
Обобщенные критерии диагностики ОЛЛ представлены в табл. 16.
Ремиссия острого лейкоза— это исчезновение патологических клинико-гематологических проявлений заболевания под влиянием полихимиотерапии, называемой терапией индукции (Л. И. Ковалева, 1990).
Таблица 16
классификация, клиника острого миелобластного лейкоза, диагностика, лечение.
Острый лейкоз — заболевание, в основе которого лежит образование клона злокачественных (бластных) клеток, имеющих общую клетку-предшественницу. Бласты инфильтрируют костный мозг, вытесняя постепенно нормальные гемопоэтические клетки, что приводит к резкому угнетению кроветворения. Для многих типов лейкозов характерна также бластная инфильтрация внутренних органов.
Острый лейкоз подразделяют на лимфобластный (ОЛЛ) и миелобластный (ОМЛ).
Классификация
Дифференциация различных форм острых лейкозов основывается главным образом на особенностях морфологической и цитохимической характеристики бластных клеток. В соответствии с данными литературы и рекомендациями ВОЗ среди острых лейкозов различают следующие основные формы.
Острый миелобластный
Острый миеломонобластный
Острый промиелоцитарный
Острый эритромиелоз, болезнь Ди Гульельмо
Острый мегакариобластный, включая вариант с миелофиброзом
Острый малопроцентный
Острый лимфобластный (преобладают незрелые, реже зрелые Т- и В-клеточные фенотипы)
Острый недифференцируемый
Эозинофильный, базофильный, плазмобластный острые лейкозы встречаются редко.
Иммунофенотипирование бластных клеток позволяет выделить субварианты острого лимфобластного лейкоза: пре-В-форма, пре-Т-форма, В-форма, Т-форма, ни Т- ни В-форма, ни Т- ни В-форма с Ph’-хромосомой. На основе уникального фенотипа, отличающегося от антигенного спектра зрелых лимфоцитов, проводится раннее распознавание прогрессирующей лейкозной популяции, когда это не представляется возможным с помощью морфологических методов исследований. При острых нелимфобластных лейкозах иммунофенотипирование бластных клеток оказалось менее информативным.
Клиника
Клинические проявления острых лейкозов складываются в основном из гиперпластического, геморрагического и язвенно-некротического синдромов.
Больные нередко обращаются к врачу по поводу быстрой утомляемости и снижения работоспособности. В гемограмме в этот период уже выявляется различное количество бластных клеток либо абсолютный лимфоцитоз. Общее число лейкоцитов бывает увеличено или уменьшено, имеется тенденция к анемии и тромбоцитопении, обычно не обнаруживают увеличения печени, селезенки, периферических лимфатических узлов. Иногда при первом обследовании изменения в гемограмме незначительны или вовсе отсутствуют, но имеется уже некоторое увеличение селезенки, периферических лимфатических узлов. В подобных случаях верификация диагноза основывается на данных миелограммы, в которой процент бластных форм бывает достаточно высоким, исключение составляют случаи так называемого малопроцентного острого лейкоза (менее 15—20% бластов).
Острый миелобластный лейкоз (ОМЛ). Ему присущи острое начало и быстрое развитие клинических симптомов. Часто отмечаются лихорадка, боли в костях. При глубокой гранулоцитопении возникают язвенно-некротические поражения слизистой оболочки полости рта, пищевода, кишечника, признаки общей интоксикации. Обычно увеличены в размерах селезенка, лимфатические узлы, печень. Присоединяются анемия, геморрагический тромбоцитопенический синдром, специфическая инфильтрация почек, матки, кожи.
Лейкозные миелобласты имеют различную величину (от 10 до 25 мк), правильную округлую форму или овальные очертания. Ядерно-цитоплазматическое соотношение низкое или среднее. Цитоплазма клеток серо-голубого цвета. В некоторых клетках она содержит азурофильную зернистость, встречается палочка Ауэра. Ядра клеток чаще имеют круглую форму. Структура ядерного хроматина нежная, в ядрах обнаруживают 1—4 ядрышка различной величины.
Для бластных клеток при ОМЛ характерно присутствие фосфолипидов, пероксидазы и хлорацетатэстеразы. У отдельных больных начальный этап заболевания характеризуется так называемой эритробластической фазой, когда в костном мозге обнаруживают большое количество эритробластов, содержащих два, три нередко перекрученных ядра. Эта фаза сменяется довольно быстро миелобластозом костного мозга.
Диагноз острого лейкоза устанавливают на основании клинической симптоматики, результатов исследования гемограммы и пунктата костного мозга, в котором, как правило, обнаруживают значительное количество бластных клеток. В дифференциации различных форм лейкозов важное значение имеет цитохимическая характеристика бластных клеток. Иммунологическая характеристика клеток позволяет дифференцировать Т- и В-формы, отличающиеся определенными клиническими особенностями. В случаях, когда бластные клетки в миелограмме составляют всего 10—20%, наличие в трепанобиоптате костного мозга пролифератов, состоящих из бластных клеток, подтверждает диагноз острого лейкоза.
Определенные трудности встречаются при проведении дифференциальной диагностики между острым миелобластным лейкозом и хроническим миелолейкозом в ранней фазе бластемии. Обнаружение Рh’-хромосомы в бластных клетках пунктата костного мозга свидетельствует в пользу хронического, миелолейкоза.
Острые лейкозы, протекающие с панцитопенией и отсутствием бластных клеток в периферической крови, следует дифференцировать от гипопластической (апластической) анемии и остеобластической формы рака, метастазирующего в костный мозг из желудка, молочной железы и других органов.
Иногда приходится проводить дифференциальную диагностику с инфекционным мононуклеозом, агранулоцитозом, протекающим с увеличением числа бластных клеток в пунктате костного мозга, лейкемоидными реакциями.
Лечение острых лейкозов
Для индукции клинико-гематологической ремиссии применяют 2—3 курса выбранной схемы полихимиотерапии.
При острых лейкозах с неблагоприятными прогностическими признаками (наличие анемии, тромбоцитопении, неадекватная профилактика нейролейкоза) назначают самые интенсивные программы лечения — 7 + 3, РОАП и др. . При опасности развития лейкостазов и при наличии их необходимо до химиотерапии произвести 2—3 операции бластафереза. У больных острым лимфобластным и недифференцируемым лейкозами, у которых отсутствуют неблагоприятные прогностические признаки, используют схемы ЦВАМП, ЦОАП и др., для усиления их эффективности возможно включение в эти схемы противоопухолевых антибиотиков антрациклинового ряда. При значительных опухолевых разрастаниях разовая доза циклофосфана в этих и других схемах может быть увеличена до 800—1000 мг (в частности, при внутриплевральном введении).
Оценка результатов лечения острых лейкозов основывается на комплексе клинических и морфологических данных (см. таблицу). Полихимиотерапия ОЛЛ и недифференцируемого острого лейкоза обеспечивает индукцию полной клинико-гематологической ремиссии у 75—80% взрослых больных.
Основное в лечении острых лейкозов — цитостатическая терапия, направленная на максимальное уничтожение опухолевых клеток. Современный этап химиотерапии отличается применением программ, составленных в зависимости от патоморфологических форм, особенностей течения заболевания. Эти программы позволили добиться ремиссии у 80-95% детей, 60-80% взрослых.
Разработка программ цитостатической терапии согласуется с данными клеточной кинетики при острых лейкозах. Известно, что пролиферирующие клетки проходят фазы митотического цикла: фаза митоза (М) самая короткая, характеризуется образование двух дочерних клеток, постмитотическая фаза (G1) отражает период стабилизации, отдыха, фаза синтеза (S) характеризуется синтезом, удвоением ДНК, премитотическая фаза G2), когда клетка готова к делению.
С позиций клеточной кинетики все химиопрепараты делятся на 2 группы.
Первая группа – это химические агенты, специфически действующие на клеточный цикл. Вторая группа – вещества, действие которых проявляется независимо от цикла (циклонеспецифичные).
При проведении терапии необходимо учитывать следующие принципиальные положения:
сочетание цитостатических препаратов оказывает большее цитостатическое действие, причем комбинировать необходимо препараты различной фазово- и циклоспецифичности с нециклоспецифическими средствами, чтобы охватить большее количество лейкозных клеток;
соблюдение цикличности и прерывистости в применении терапии;
длительность, упорность, достаточная активность терапии
В комбинированной цитостатической терапии различают следующие этапы:
индукция ремиссии
консолидация ремиссии
профилактика нейролейкемии
лечение в ремиссии
постиндукционная терапия
Индукция ремиссии заключается в проведении курсовой цитостатической терапии по эффективным программам. При условии развития ремиссии следующим этапом является консолидация (закрепление) ремиссии. Допустимо повторение индукционной терапии или проведение более агрессивных схем. Задачей лечения в период ремиссии является дальнейшая максимальная редукция бластных клеток. В этот период осуществляют непрерывную низкодозную поддерживающую терапию или периодические курсы реиндукции.
Международная классификация острых лейкозов (ФАБ).

Основной принцип— характеристика доминирующей популяции лейкемических клеток на основании морфоцитохимических критериев.
I.Острые нелимфобластные лейкозы
II.Острые лимфобластные лейкозы
III. Миелодиспластический синдром. Варианты I:
М1 – острый миелолейкоз без вызревания М2 – ОМЛ с вызреванием М3 – Острый промиелолейкоз
М4 – острый миеломонолейкоз М5 – острый монобластный лейкоз М6 – острый эритромиелоз
М7 – острый мегакариолейкоз (редкий( М0 – острый недифференцированноклеточный лейкоз. Варианты II: L1-, L2, L3

Современная диагностика острых лейкозов
Это определение направленности и степени дифференцировки лейкемических клеток
Морфологические исследования
крови и костного мозгаЦитохимические исследованияИммунофенотипированиеЦитогенетические исследования
Молекулярно-биологические
исследования

Обязательные цитохимические реакции в диагностике лейкозов
 Выявление миелопероксидазы (положительна в виде золотисто-желтых гранул в цитоплазме гранулоцитов, начиная с миелобластов и части моноцитов, отрицательна – у лимфоидных клеток)
Выявление миелопероксидазы (положительна в виде золотисто-желтых гранул в цитоплазме гранулоцитов, начиная с миелобластов и части моноцитов, отрицательна – у лимфоидных клеток)
 Реакция на липиды с черным суданом В (положительна – черные или серые гранулы в цитоплазме гранулоцитов и моноцитов, отрицательна – у лимфоидных клеток)
Реакция на липиды с черным суданом В (положительна – черные или серые гранулы в цитоплазме гранулоцитов и моноцитов, отрицательна – у лимфоидных клеток)
 Реакция на неспецифическую эстеразу (положительна в виде серовато-коричневых гранул в цитоплазме моноцитов, начиная с монобластов).
Реакция на неспецифическую эстеразу (положительна в виде серовато-коричневых гранул в цитоплазме моноцитов, начиная с монобластов).
 Реакция на гликоген с реактивом ШИФ (PAS, ШИК) (положительна – в виде диффузного малиново- сиреневого окрашивания в цитоплазме гранулоцитов и моноцитов, положительна в виде красновато- фиолетовых и синефиолетовых крупных гранул в цитоплазме лимфоцитов)
Реакция на гликоген с реактивом ШИФ (PAS, ШИК) (положительна – в виде диффузного малиново- сиреневого окрашивания в цитоплазме гранулоцитов и моноцитов, положительна в виде красновато- фиолетовых и синефиолетовых крупных гранул в цитоплазме лимфоцитов)

Особенности различных вариантов ОНЛЛ
М1 и М2 – наиболее частая форма у взрослых (60% от всех острых лейкозов взрослых). Бласты крупные и средние, ядерно:цитоплазматическое соотношение 1:1 (или высокое). Структура хроматина нежно-сетчатая, могут быть мелкие ядрышки, цитоплазма голубая без гранул (у М1) или с зернистостью и в 30% палочки Ауэра (у М2). При ОМЛ могут встречаться единичные созревающие гранулоциты (миело, метамиело), то есть нет абсолютного зияния (чаще при М2).
Цитохимия – пероксидаза+, липиды+, гликоген + в диффузной форме, эстераза-.
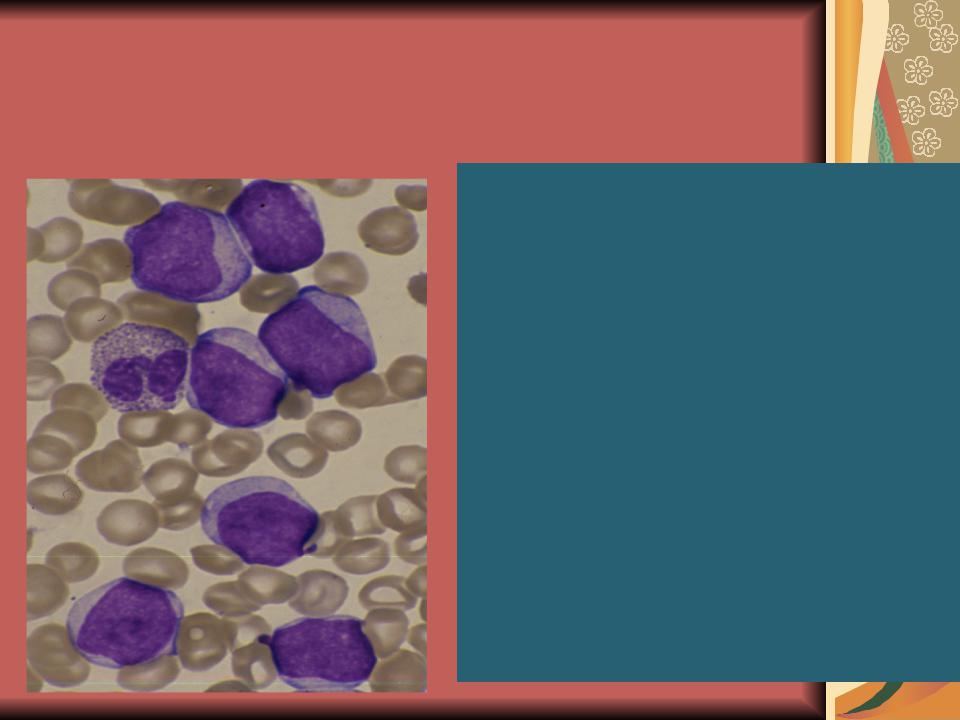
Острый миелолейкоз без вызревания (М1)
AML not otherwise categorized
AMLwithout maturation M1)
Immunophenotyping
Cytoplasmic antigen :cCD3,cCD79a () 
Surface antigen |
|
|
| cMPO |
| 18.7% |
| ||
|
|
|
|
|
|
|
|
| |
T cell associated | :CD2,3,4,5,7,8 | () |
|
|
| ||||
B cell associated | :CD10,19,20 | () |
|
|
| ||||
NK cell associated :CD16,56 |
| () |
|
|
| ||||
Myeloid associated : CD13 | 87.7% |
|
|
| |||||
|
|
|
|
|
|
|
| ||
|
| CD15 | 1.8% |
| |||||
|
| CD33 | 68.1% |
|
| ||||
(mono) :CD14 | 0.4% |
| |||||||
|
| CD64 | 0.8% |
| |||||
(megkryo) :CD41 | 0.8% |
|
| ||||||
(erythroid) :CD235a | 3.4% |
|
|
| |||||
Stem cell associated: CD34 | 91.7% |
|
|
| |||||
|
|
| CD117 | 72. | 9% | ||||
|
|
|
|
|
| ||||
Others | :HLADR | 91.6% |
| ||||||
|
|
| CD38 | 87.1% |
|
| |||
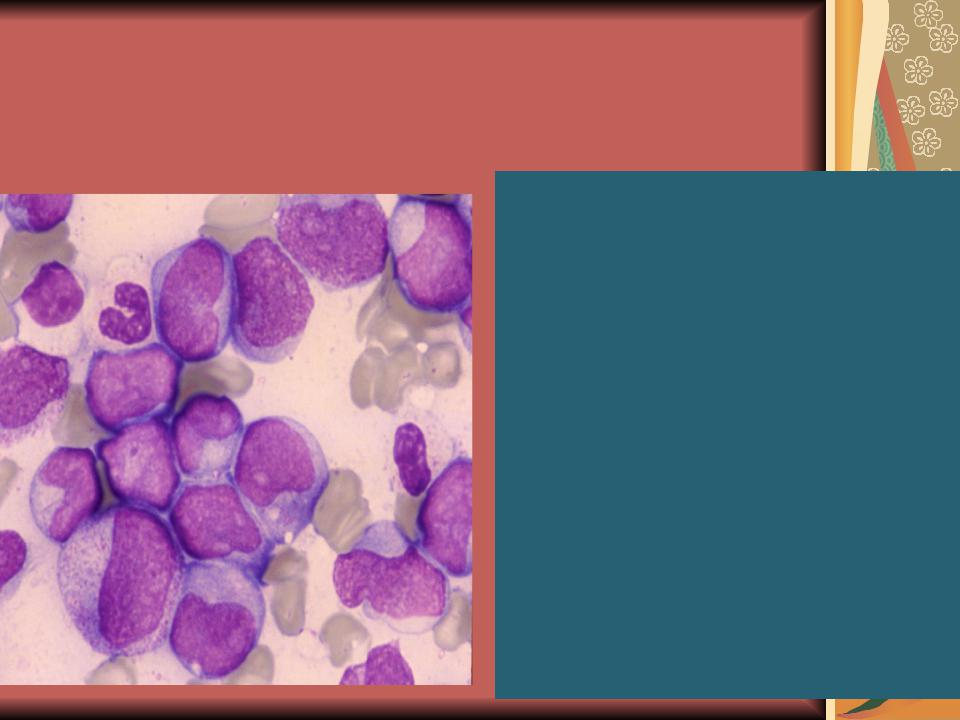
Острый миелолейкоз с вызреванием (М2)
AML not otherwise categorized
AML with maturation M2) | Immunophenotyping |
|
|
|
|
|
| ||||||
|
|
|
|
|
|
| |||||||
| Cytoplasmic antigen cCD3,cCD79a () | ||||||||||||
| Surface antigen |
|
| cMPO |
| 98.7% |
| ||||||
|
|
|
|
|
|
|
|
|
|
| |||
| T cell associated | :CD2,3,4,5,8 | () |
|
| ||||||||
| B cell associated | :CD10,19,20 | () |
|
| ||||||||
| NK cell associated | :CD16,56,57 | () |
|
| ||||||||
| Myeloid associated :CD13 | 86.9% |
|
| |||||||||
|
| CD15 |
|
|
|
|
|
|
|
|
|
| |
|
| 69.7% |
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
| CD33 |
| 81.5% | ||||
|
|
| (mono) :CD14 |
| 18.9% |
| |||||||
|
|
|
|
| CD64 |
| 38.4% |
| |||||
|
| (megkryo) :CD41 |
| 4.2% |
| ||||||||
|
| (erythroid) :CD235a |
| 2.4% |
| ||||||||
| Stem cell associated: CD34 | 50.1% |
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
| CD117 |
|
| 51.4% | ||||
|
|
|
|
|
|
|
|
|
| ||||
| Others |
|
| :HLADR |
|
| 92.5% |
| |||||
|
|
|
|
| CD38 |
| 88.6% |
| |||||

Особенности различных вариантов ОНЛЛ
М3 встречается в 3%. Клинические особенности – выраженная кровоточивость из-за развития ДВС, фибриноген ↓. Особенность морфологии
(используется для диагностики)– выраженный полиморфизм бластных клеток, гранулярность, атипия. Цитохимия как при М1 и М2. Цитогенетический маркер – транслокация 15 и 17 хромосом (онкоген PML/RaRa).
Специфична для М3 цитохимическая реакция на кислые сульфатированные мукополисахариды, однако для диагностики достаточно более простых методов.
М3 хорошо поддается лечению ретиноевой кислотой (индуцирует апоптоз). Описаны случаи выздоровления.

Острый промиелолейкоз (М3)
AML with recurrent genetic abnormalities
Acute promyelocytic leukemia
AML with t(15;17)(q22;q12)
Immunophenotyping
Cytoplasmic antigen cCD3,cCD79a (-)
(-)
Surface antigen | cMPO | 95.2% | |
|
|
| |
T cell associated | :CD2,3,4,5,7,8 | (-) | |
B cell associated | :CD10,19,20 | (-) | |
NK cell associated :CD16,56,57 | (-) | ||
Myeloid associated : CD13 | 95.9% | ||
| CD15 | 1.4% | |
| CD33 | 99.5% | |
(mono) :CD14 | 1.8% | ||
(megkryo) :CD41 | 0.3% | ||
(erythroid) :CD235a | 1.8% | ||
Stem cell associated:CD34 | 2.4% | ||
| CD117 | 60.1% | |
Others | :HLADR | 11.0% | |
| CD38 | 74.9% | |

Особенности различных вариантов ОНЛЛ
М4 – встречается в 20% острых лейкозов взрослых. По клинике мало отличается от других. Несколько чаще поражается печень, кожа. Могут быть беспричинные подъемы температуры. Бласты 2-х типов: 1) как при ОМЛ, 2) моноцитоподобные бласты. Цитохимия: пероксидаза и липиды +, гликонен+ диффузный, эстераза +.
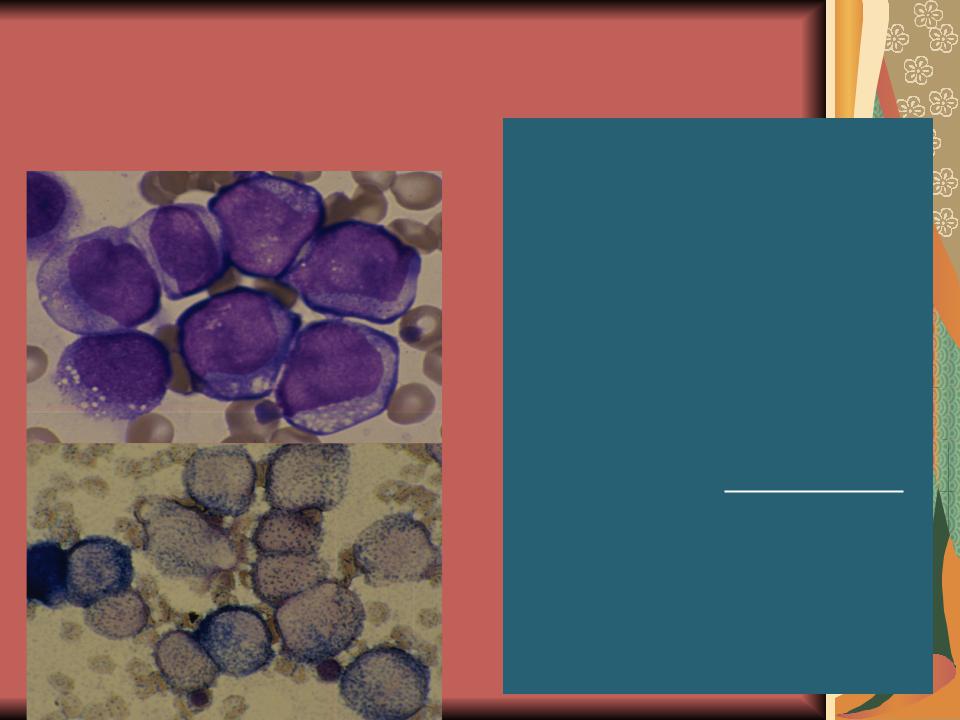
Острый миеломонобласный лейкоз (М4)
AML not otherwise categorized
Acute myelomonocytic leukemia(M4)
Immunophenotyping 
 Cytoplasmic antigen cCD3,cCD79a ()
Cytoplasmic antigen cCD3,cCD79a ()

cMPO 92.4%
Surface antigen |
|
|
|
|
|
|
T cell associated | :CD2,3,5,7,8 | () |
| |||
CD4 | 24.0% | |||||
B cell associated | :CD10,19,20 | () |
| |||
NK cell associated :CD16, 57 |
| () |
| |||
|
| CD56 62.1% | ||||
Myeloid associated : CD13 |
| 91.3% |
| |||
|
|
|
|
|
|
|
|
| CD15 |
| 9.6% |
| |
|
| CD33 |
| 84.6% |
| |
(mono) :CD14 |
| 2.4% | ||||
|
| CD64 |
| 32.9% |
| |
(megkryo) :CD41 |
| 0.9% |
| |||
(erythroid) :CD235a |
| 1.1% |
| |||
Stem cell associated: CD34 | 88.8% |
| ||||
|
|
| CD117 | 59.7% | ||
Others | :HLADR |
| 88.3 | |||
|
|
| CD38 |
| 94.0% |
|
Острые лейкозы.
Классификация.
Наиболее распространенной морфологической классификацией ОЛ остается предложенная франко-американо-британской группой в 1976 г. классификация FAB, пересмотренная и дополненная в 1991 г., согласно которой выделяют следующие формы ОЛ.
Острые лимфобластные лейкозы (ОЛЛ):
L1 (микролимфобластный вариант, ОЛЛ без созревания) является преобладающим у детей (70% случаев среди всех детских ОЛЛ). У взрослых на его долю приходится не более 20-25%.
L2 — ОЛЛ с созреванием, наиболее вариабелен, чаще встречается у взрослых (около 70% случаев среди всех ОЛЛ).
L3 — Беркиттоподобный лимфобластный лейкоз — достаточно редкий вариант ОЛЛ (менее 5% случаев).
Самым благоприятным в прогностическом отношении является L1 -ОЛЛ (наиболее высокие показатели частоты получаемых ремиссий и длительной безрецидивной выживаемости)
Острые нелимфобластные лейкозы (ОНЛЛ)
М0 — острый миелобластный недифференцированный лейкоз.
М1 — острый миелобластный лейкоз без созревания.
М2 — острый миелобластный лейкоз с созреванием.
МЗ — острый промиелоцитарный лейкоз.
М4 — острый миеломонобластный лейкоз.
М5 — острый монобластный лейкоз.
М6 — острый эритробластный лейкоз (эритромиелоз).
М7 — острый мегакариобластный лейкоз.
В 2001 г. международной группой экспертов была разработана новая классификация гематологических опухолей (ВОЗ, 2001), основой которой явилась классификация FAB (табл. 1). В классификации ВОЗ ОЛ характеризуются не только в соответствии с морфологическими и цитохимическими признаками бластных клеток, но и с учетом их генотипа, иммунофенотипа, связи с предшествующей химиорадиотерапией. В тех ситуациях, когда нет возможности проанализировать кариотип бластных клеток, единственный принцип классификации ОЛ — морфологический.
Клиническая классификация стадий острого лейкоза преследует сугубо тактические цели — терапевтическую тактику и прогноз:
1. Первый острый период (развернутая стадия болезни).
2. Полная (неполная) ремиссия.
3. Выздоровление
4. Рецидив (с указанием, первый или повторный).
5. Терминальная стадия.
Таблица 1
Классификация острых лейкозов (ВОЗ 2001 г.)
Острые миелоидные лейкозы ОМЛ с t (8;21)(q22;q22) ОМЛ с перестройками 11q23 ОМЛ — с мультилинейной дисплазией — с предшествующим миелодиспластическим синдромом — без предшествующего миелодиспластического синдрома ОМЛ с минимальной дифференцировкой ОМЛ без признаков вызревания ОМЛ с признаками вызревания ОМЛ с базофилией Промиелоцитарный лейкоз [ОМЛ с t(15;17)(q22;q11-12) и вариантами] Острый миеломоноцитарный лейкоз ОМЛ с inv(16)(p13;q22) или t(16;16)(p13;q22) и с патологической костномозговой эозинофилией Острый моноцитарный лейкоз ОМЛ с перестройками 11q23 Острый эритроидный лейкоз Острый мегакариоцитарный лейкоз Острый панмиелоз с миелофиброзом Миелодиспластические синдромы (МДС) рефрактерная анемия — с кольцевыми сидеробластами — без кольцевых сидеробластов рефрактерная цитопения (миелодиспластический синдром) — с мультилинейной дисплазией рефрактерная анемия (миелодиспластический синдром) — с избытком бластов Синдром 5q — Миелодиспластические синдромы, неклассифицируемые | M1 M2 М2Baso М3 М4 М4Ео М5а (недифференцированный) М5b (дифференцированный) М6 М7 |
Вторичные ОМЛ и миелодиспластический синдром, развившиеся после химиотерапии | M1 M2 M4 M5 M6 M7 |
Острые лимфобластные лейкозы В-лимфобластный лейкоз/лимфома из предшественниц В-клеток, варианты с — t(9;22)(q34;11), — t(1;19)(q23;13), — t(12;21)(p12;q22) — и с перестройками 11q23 Т–лимфобластный лейкоз / лимфома из клеток-предшественниц | L1 L2 |
