Изоферменты КК — Ферменты плазмы крови в диагностике — Клиническая химия в диагностике и лечении
В результате сочетаний белковых субъединиц М и В образуются 3 изофермента КК.
Преобладающим изоэнзимом мышц (скелетных и сердечной) является ММ, который можно обнаружить в плазме крови здорового человека.
Сердечная мышца содержит также MB изоэнзим, отсутствующий в плазме крови здорового человека. Обнаружение этого изоэнзима указывает на поражение миокарда. Возможности и ограничения определений КК-МВ рассмотрены на с. 384.
Изоэнзим ВВ содержится в тканях головного мозга и гладких мышцах желудочно-кишечного и полового трактов. Нарастание этого изоэнзима в плазме крови может происходить во время родов, а также после поражений головного мозга и в случаях злокачественных новообразований бронхов, предстательной и молочных желез. Диагностическая ценность определений содержания изоэнзима при этих заболеваниях не доказана. При злокачественных новообразованиях суммарная активность КК повышена не всегда.
сс-Амилаза (AM)
Фермент а-амилаза участвует в распаде крахмала пищевых продуктов или гликогена до мальтозы. а-Амилаза содержится в панкреатическом соке и в слюне, а также в печени, фаллопиевых трубах и мышцах. Фермент экскретируется с мочой. В плазму крови амилаза поступает в норме как из поджелудочной, так и из слюнных желез.
Результаты определений суммарной амилазной активности наиболее важны для диагностики острого панкреатита, во время которого величины активности этого фермента могут быть очень высокими. Умеренное нарастание активности, обнаруживаемое при многих патологических состояниях, диагностического значения не имеет.
«Клиническая химия в диагностике и лечении»,
Дж.Ф.Зилва, П.Р.Пэннелл
Кислую фосфатазу обнаруживают в предстательной железе, печени, эритроцитах, тромбоцитах и костной ткани. Результаты определений активности КФ используют преимущественно для диагностики карциномы предстательной железы. В норме КФ, секретируемая предстательной железой, поступает преимущественно в ее проток и лишь в очень небольшом количестве проникает в кровь. При карциноме предстательной железы, особенно если имеются метастазы, содержание КФ в плазме…
Опыт нашей работы, однако, свидетельствует о том, что в некоторых случаях после таких обследований уровень КФ все же в 2—3 раза превышает верхнюю границу нормы и затем понижается до фоновых значений только через несколько дней. На с. 499 мы приводим соответствующий пример и предлагаем процедуру отбора проб с учетом указанной возможности. Очевидно, простатэктомия приведет к…
Y -Глутамилтрансфераза (у-глутамилтранспептидаза) встречается преимущественно в печени, почках и поджелудочной железе. Повышение уровня ГГТ в плазме крови, однако, почти всегда связано с поражениями печени и возможно при следующих условиях: при заболеваниях печени, сопровождающихся холестазом. Обычно в этих случаях имеется параллелизм между нарастанием содержания ГГТ и ЩФ. При обтурационной желтухе беременных уровень ГГТ не нарастает; при…
Инфаркт миокарда Ферментами, исследования которых имеют наибольшую диагностическую ценность при инфаркте миокарда, являются ACT, ЛДГ (или ОВД) и КК. Выбор исследований зависит от того, сколько времени прошло после момента возникновения предполагаемого инфаркта. Таблица 29 дает представление о последовательности развивающихся явлений. В течение по меньшей мере 4 ч после инфаркта содержание всех ферментов может быть в…
После даже небольшого инфаркта миокарда обычно происходит некоторый отек печени, обусловленный правосторонней сердечной недостаточностью, и, следовательно, незначительное нарастание АЛТ. Обычно изучение этого явления не составляет диагностической проблемы, поскольку относительное нарастание ACT выражено в значительно большей степени, чем АЛТ, и содержание ОБД (ЛДГ) бесспорно повышено. При первичном нарушении функций печени, сердечной недостаточности с отеками, но без…
Ферменты – биологические катализаторы. Значение ферментов
Ферменты – это белковые молекулы, которые синтезируются живыми клетками. В каждой клетке насчитывается более сотни различных ферментов. Роль ферментов в клетке колоссальна. С их помощью химические реакции идут с высокой скоростью, при температуре, подходящей для данного организма.То есть ферменты – это биологические катализаторы, которые облегчают протекание химической реакции и за счет этого увеличивают её скорость. Как катализаторы они не изменяют направление реакции и не расходуются в процессе реакции.
Ферменты—биокатализаторы – вещества, увеличивающие скорость химических реакций.
Без ферментов все реакции в живых организмах протекали бы очень медленно и не могли бы поддерживать его жизнеспособность.
Наглядный пример работы ферментов – сладковатый вкус во рту, который появляется при пережевывании продуктов, содержащих крахмал (например, риса или картофеля). Появление сладкого вкуса связано с работой фермента амилазы, которая присутствует в слюне и расщепляет крахмал (рис. 1). Крахмал является полисахаридом, и сам по себе безвкусный, но продукты расщепления крахмала (моносахариды) с меньшей молекулярной массой (декстрины, мальтоза, глюкоза) сладкие на вкус.
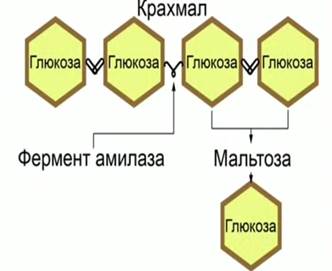
Рис. 1. Механизм действия амилазы
Все ферменты – глобулярные белки с третичной или четвертичной структурой. Ферменты могут быть простыми, состоящими только из белка, и сложными.
Сложные ферменты состоят из белковой и небелковой части (белковая часть – апофермент, а добавочная небелковая – кофермент). В качестве кофермента могут выступать витамины – E, K, B групп (рис. 2).
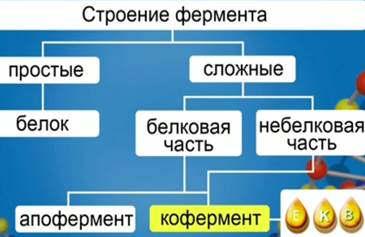
Рис. 2. Классификация ферментов по их составу
Фермент взаимодействует с субстратом, не всей молекулой, а отдельной её частью – т. н. активным центром.
Фермент взаимодействует с субстратом и образует короткоживущий фермент-субстратный комплекс. По завершении реакции, фермент-субстратный комплекс распадается на продукты и фермент. Фермент в итоге не изменяется: по окончании реакции он остается таким же, каким был до неё, и может теперь взаимодействовать с новой молекулой субстрата (рис. 3).
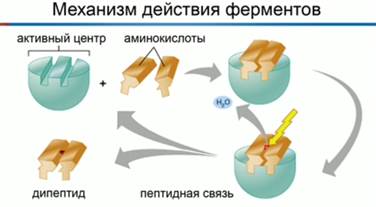
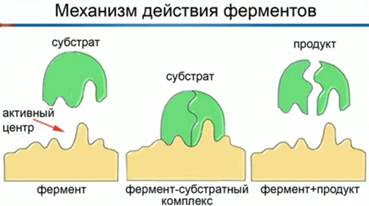
Рис. 3. Механизм взаимодействия фермента и субстрата
На рисунке 3 представлен механизм работы фермента, в частности, образования пептидной связи между молекулами аминокислот. Две аминокислоты взаимодействуют между собой в активном центре фермента, между ними образуется пептидная связь. Новое вещество (дипептид) покидает активный центр фермента, поскольку оно по своей структуре не соответствует этому центру.
Особенностью ферментов является то, что они обладают высокой специфичностью, т. е. могут ускорять только одну реакцию или реакции одного типа.
В 1890 году Э. Г. Фишер предположил, что эта специфичность обусловлена особой формой молекулы фермента, которая точно соответствует форме молекулы субстрата. Эта гипотеза получила название «ключа и замка», где ключ сравнивается с субстратом, а замок – с ферментом. Гипотеза гласит: субстрат подходит к ферменту, как ключ подходит к замку. Избирательность действия фермента связана со строением его активного центра (рис. 4).

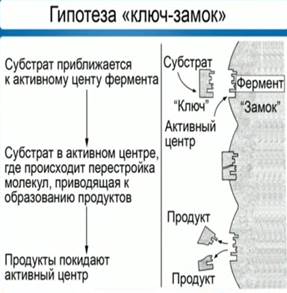
Рис. 4. Гипотеза взаимодействия фермента и субстрата по принципу ключ-замок Э. Г. Фишера
В первую очередь, на активность фермента влияет температура. С повышением температуры скорость химической реакции возрастает. Увеличивается скорость молекул, у них появляется больше шансов столкнуться друг с другом. Следовательно, увеличивается вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую активность фермента – оптимальная.
За пределами оптимальной температуры скорость реакции снижается вследствие денатурации белков. Когда температура снижается, скорость химической реакции тоже падает. В тот момент, когда температура достигает точки замерзания, фермент инактивируется, но при этом не денатурирует (см. видео).
В наше время для длительного хранения продуктов широко используют способ быстрого замораживания. Оно останавливает рост и развитие микроорганизмов, а также инактивирует ферменты, находящиеся внутри микроорганизмов, и предотвращает разложение продуктов питания.
Кроме этого, активность ферментов зависит ещё от pH среды (кислотности – то есть показателя концентрации ионов водорода).
В большинстве случаев, ферменты работают при нейтральном pH, т. е. при pH около 7. Но существуют ферменты, которые работают либо в кислой и сильнокислой, либо в щелочной и сильнощелочной среде. Например, один из таких ферментов – пепсин, он находится у нас с вами в желудке, работает в сильнокислой среде и расщепляет белки. Поскольку в желудке среда достаточно кислая, 1,5 – 2 pH, то этот фермент работает при сильнокислой среде.
Ферменты подвержены действию активаторов и ингибиторов. Некоторые ионы, например, ионы металлов Mg, Mn, Zn активируют ферменты. Другие же ионы (к ним относятся ионы тяжелых металлов, а именно Hg, Pb, Cd), наоборот, подавляют активность ферментов, денатурируют их белки.
В 1961 году была предложена систематическая классификация ферментов на 6 групп. Но названия ферментов оказались очень длинными и трудными в произношении, поэтому ферменты принято сейчас именовать с помощью рабочих названий. Рабочее название состоит из названия субстрата, на который действует фермент, и окончания «аза» (рис. 5). Например, если вещество — лактоза, то есть молочный сахар, то лактаза – это фермент который его преобразует. Если сахароза (обыкновенный сахар), то фермент, который его расщепляет, – сахараза. Соответственно, ферменты, которые расщепляют протеины, носят название протеиназы.
Ферменты применяются практически во всех областях человеческой деятельности, и такое широкое применение, в первую очередь, связано с тем, что они сохраняют свои уникальные свойства вне живых клеток.
Ферменты групп амилаз, протеаз и липаз применяются в медицине. Они расщепляют крахмал, белки и жиры. Все эти ферменты, как правило, входят в состав комбинированных препаратов, таких как фестал и панзинорм, и используются, в первую очередь, для лечения заболеваний желудочно-кишечного тракта (рис. 6).
Ферменты применяют для растворения тромбов в кровеносных сосудах, при лечении гнойных ран.
Особое место занимает энзимотерапия при лечении онкологических заболеваний.
Такие ферменты как амилаза расщепляют крахмал и поэтому широко используются в пищевой промышленности. В пищевой промышленности используется протеиназа, расщепляющая белки, и липазы, расщепляющие жиры. Ферменты амилазы используются в хлебопечении, виноделии и пивоварении (см. видео).
Протеазы используются для смягчения мяса и при изготовлении готовых каш.
Липазы используются в производстве сыра.
Ферменты широко используются в косметической промышленности, входят в состав кремов, некоторые ферменты входят в состав стиральных порошков.
Энзимопатология
Энзимопатология – область энзимологии, которая изучает связь между болезнью и недостаточным синтезом, или отсутствием синтеза какого-либо фермента.
Например, причиной наследственного заболевания – фенилкетонурии, которое сопровождается расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение фенилаланина в тирозин.
В результате в организме накапливаются токсические вещества. Новорожденный ребенок выглядит здоровым, а первые симптомы фенилкетонурии проявляются в возрасте от двух до шести месяцев. Это выраженная вялость, отсутствие интереса к окружающему миру, повышенная раздражительность, а также беспокойство и рвота.
Во втором полугодии жизни у ребенка выражено отставание в психическом развитии. Менее чем в 10% случаев – это слабая степень олигофрении, а у 60% развивается идиотия.
При своевременной диагностике патологических изменений можно избежать, если с момента рождения до наступления полового созревания ограничить поступление фенилаланина с пищей.
Стиральные порошки с ферментами
На этом уроке мы с вами выяснили, что ферменты используются в различных областях человеческой деятельности.
Они широко используются в пищевой промышленности, в медицине, в косметике и бытовой химии. Например, в стиральные порошки добавляют амилазу, которая расщепляет крахмал, протеазы, расщепляющие белки или белковые загрязнения, и липазы, очищающие ткани от жира и масла. Как правило, в состав стирального порошка входит комбинация этих ферментов, то есть ферментные препараты усиливают действие друг друга.
Сегодня наиболее изученными ферментами являются протеазы и амилазы. Липазы не всегда стабильны по качеству. Их разработкой занимаются только 10 лет, а амилаза и протеаза существуют на рынке уже более полувека. Сегодня эти две категории ферментов очень хорошо изучены и дают прекрасные результаты, чего пока что нельзя сказать о липазах. Липазы полностью справляются с загрязнениями только после двух-трех стирок, а протеазы и амилазы – за одну.
Ученые подсчитали, что добавление ферментов в стиральные порошки на 30-35% увеличивает моющую способность данного порошка.
Ферменты были открыты при изучении процессов брожения. Представления о том, что химические процессы внутри живых организмов протекают под действием каких-то особенных веществ, возникло более 200 лет назад. В XIX века Луи Пастер (рис. 7) доказал, что сбраживание дрожжами сахара в спирт катализируется веществами белковой природы. Пастер ошибочно считал, что ферменты неотделимы от живых клеток. Другой ученый, Эдуард Бухнер, доказал, что в водных экстрактах живых клеток находится набор ферментов, катализирующих превращение сахара в спирт. Именно его открытие дало начало новой науке – энзимологии.
Успехи энзимологии во второй половине XX века привели к тому, что в настоящее время выделено и очищено более 2000 ферментов, которые используются в различных отраслях человеческой деятельности.
Домашнее задание
1. Что такое фермент?
2. Как ферменты работают?
3. Как ферменты получают имена? Назовите известные вам группы ферментов.
4. Назовите ученых, которые внесли особый вклад в дело изучения ферментов.
5. К какому уровню организации можно отнести ферментативный катализ?
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Интернет-портал Biochemistry.ru (Источник).
2. Биология (Источник).
3. Интернет-портал Chem.msu.su (Источник).
4. YouTube (Источник).
5. Вкус жизни (Источник).
Список литературы
1. Каменский А. А., Криксунов Е. А., Пасечник В. В. Общая биология 10-11 класс Дрофа, 2005.
2. Биология. 10 класс. Общая биология. Базовый уровень / П. В. Ижевский, О. А. Корнилова, Т. Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
3. Беляев Д. К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
4. Биология 11 класс. Общая биология. Профильный уровень / В. Б. Захаров, С. Г. Мамонтов, Н. И. Сонин и др. – 5-е изд., стереотип. – Дрофа, 2010. – 388 с.
5. Агафонова И. Б., Захарова Е. Т., Сивоглазов В. И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Диагностические ферменты
Диагностические ферменты — это ферменты, которые используются для диагностики или прогнозирования. Ферменты, как и другие белки, синтезируются тканями тела для удовлетворения их метаболических потребностей. Они не всегда являются специфическими для той или иной ткани. Более одной ткани / органа может синтезировать один или больше ферментов.
Ферменты являются предпочтительными в диагностике из-за их субстратной специфичности и возможности количественного определения их активности в присутствии других белков.
Почему ферменты используются в медицинской диагностике?
Болезнь, как правило, приводит к умеренному или обширному повреждению ткани в зависимости от времени его начала и тяжести поражения. Такие состояния связаны с освобождением в кровь специфичных для пораженного органа или ткани ферментов, что сопровождается увеличением таких ферменты в биологических жидкостях. О количестве ферментов судят по их активности. В диагностике используют измерение ферментативной активности в сыворотке / плазме крови и других жидкостях тела.
Ферменты в диагностике заболеваний
1. Костные, аутоиммунные и воспалительные расстройства
Щелочная фосфатаза (ЩФ) как диагностический фермент
ЩФ катализирует гидролиз фосфатных групп у белков и нуклеотидов при щелочном рН.
У детей сывороточные уровни щелочной фосфатазы значительно выше, чем у взрослых и коррелирует с темпом роста костей. После 60 лет значения ЩФ немного выше у мужчин, чем у женщин. Содержание фермента увеличиваются в период полового созревания, беременности и в постменопаузе. Увеличение уровня сывороточной ЩФ указывает на повышение активности остеобластов как при наличии активного образования костной ткани, так как и в случае болезни Педжета или ревматоидного артрита. Другие патологические состояния, которые приводят к высокому уровню ЩФ, включают рахит, остеомаляцию, гипертиреоз и гиперпаратиреоз.
Низкая ЩФ встречается редко и вероятно, связана с генетическим пороком или дефицитом питания. Гипофосфатазия — редкое расстройство, характеризуется низким уровнем активности ЩФ сыворотки, что приводит к аномальному фосфорилированию метаболитов и изменению скелета.
Катепсин D как диагностический фермент
Повышенная концентрация лизосомального катепсина D ассоциируется с прогрессированием ревматоидного артрита.
Желатиназа В
Желатиназа В (матричная металлопротеиназа-9, 1MMP-9) представляет собой секретируемый фермент, который регулирует состав клеточного матрикса. Ее основной субстрат желатин (денатурированный коллаген). ММР-9 продуцируется некоторыми типами клеток, в том числе кератиноцитами, моноцитами, тканевыми макрофагами, полиморфно-ядерными лейкоцитами и различными злокачественными клетками. ММР-9, по-видимому, участвует в разнообразных патологических процессах, происходящих при аутоиммунных недугов. ММР-9 человека представляет собой фермент-маркер ревматоидного артрита. ММР-9 играет определенную роль в патогенезе системной волчанки и определение уровня активности ММР-9 в плазме / сыворотке крови пациентов может обеспечить важной информацией при мониторинге болезни.
Лейкоцитарная эстераза — диагностический фермент
Обнаружение лейкоцитарной эстеразы в синовиальной жидкости — чрезвычайно ценная информация для врача при диагностике инфекции околосуставной ткани. Тест-полоски для определения лейкоцитарной эстеразы дают возможность получить результат в режиме реального времени, они простые и недорогие, позволяют исключить или подтвердить инфекцию суставов.
Лизоцим — диагностический фермент
Лизоцим гидролизует гликозидные связи в клеточной стенке пептидогликанов. Сывороточные уровни лизоцима повышены у пациентов с ревматоидным артритом и отражают состояние системы моноциты — макрофаги.
Тартрат устойчивая кислая фосфатаза (TУКФ) — диагностический фермент
TУКФ — гликозилированный мономерный металлофермент млекопитающих с молекулярной массой приблизительно 35 кДа. Она отличается от других кислых фосфатаз устойчивостью к ингибированию тартратами (соли виноградной кислоты), молекулярной массой и фиолетовым цветом. TУКФ находится в остеокластах и освобождается в циркуляцию при резорбции кости. Значение TУКФ увеличивается при ревматоидном артрите, остеопорозе и нарушении метаболизма костей, что позволяет отнести его к группе диагностических ферментов поражения костной ткани.
2. Рак и диагностические ферменты
Кислая фосфатаза (КФ)
У человека охарактеризованы пять важных КФ: лизосомальная, простатическая, эритроцитарная, макрофагальная и остеокластическая, которые отличаются тканевым и хромосомным происхождением, молекулярным весом, аминокислотным составом, последовательностью аминокислот и устойчивостью к тартрату и фториду. Показатель КФ в предстательной железе мужчин в 100 раз выше, чем в любой другой ткани тела. При раке простаты определение активности ЩФ проводят с целью выяснения его метастазирование, мониторинга и прогноза. Анализ на КФ дополняют определением простатспецифического антигена (ПСА) При раке простаты значительно повышается простатическая ЩФ, особенно при его метастазировании в кости.
Щелочная фосфатаза (ЩФ)
Щелочная фосфатаза печени и кости по-разному гликозилированные формы одного генного продукта. Специфическая оценка этих форм отражает пораженный орган. Аномальная экспрессия генетически различных изоферментов ЩФ является ценным в мониторинге рака, особенно герминативных опухолей. Изофермент Ригана. Изофермент выделен из сыворотки больных с неоплазмой. Из-за сходства с плацентарным изоферментом, он упоминается как карциноплацентарный изофермента. Изофермент Ригана был выделен от больных раком легкого, раком молочной железы, раком яичников и раком толстой кишки. Нагао изофермента: вариант изофермента Ригана, который мигрирует на ацетатцеллюлозе в том же положении, что Риган. Он был выделен из метастатической карциномы плевральных поверхностей и аденокарциномы поджелудочной железы и желчных протоков. Изофермент Касахара, по-видимому, являются результатом повторного выражения гена эмбриональной кишечной щелочной фосфатазы.
Определение ЩФ костной ткани в сыворотке является полезным параметром для мониторинга изменений в образовании костной ткани, а также у пациентов с метастазами в кости — повышение этого изофермента.
Аланинтрансаминаза (АЛТ)
Повышенные уровни АЛТ связаны с высоким риском гепатоцеллюлярной карциномы
Катепсин D (КД)
Катепсина D (КD) представляет собой растворимую лизосомальную аспарагиновую эндопептидазу, синтезируемую в шероховатой эндоплазматической сети, как препрокатепсин D. После удаления сигнального пептида, 52 кДа, образуется прокатепсин D, который направляется во внутриклеточные везикулярные структуры (лизосомы, эндосомы, фагосомы). В перспективе полезно определение катепсина D в ткани молочной железы при прогнозировании риска раннего рецидива у женщин с раком молочной железы.
Цистеиновые катепсины (ЦК) как диагностические ферменты нео
ЦК известны как катепсины B, L и H. Распространяются повсеместно. Они катализируют гидролиз белков внутри лизосом. Усиленный синтез ЦК наблюдается при многих опухолях человека, включая рак молочной железы, яичников, шейки матки, легких, головного мозга, желудочно-кишечного тракта, головы, шеи и меланому. Концентрация катепсина В повышен при предраковых поражениях толстой кишки, щитовидной железы, мозга, печени, молочной железы, простаты. ЦК повышены при воспалительных процессах, таких миопатия, ревматоидный артрит и воспаления ЖКТ. Следовательно, ЦК играют потенциальную роль в качестве диагностических и прогностических маркеров рака, а также некоторых воспалительных состояниях.
Циклооксигеназа-2 (ЦОГ-2) диагностический фермент рака
ЦОГ-2 как диагностический фермент отсутствует в нормальных тканях.
Экспрессия ЦОГ-2 является ранним сигналом канцерогенеза и играет определенную роль в прогрессировании опухоли. Таким образом, СОХ-2 представляет собой молекулярную мишень для раннего выявления и профилактики различных раковых форм рака.
Глюкоза-6-фосфат-дегидрогеназы (Г6ФД)
Г6ФД является важным ферментом для поддержания целостности мембран. Избыточная экспрессия Г6ФД тесно связана с прогрессированием рака желудка и может рассматриваться как независимый предиктор прогноза при раке желудка.
Лейкоцитарная Г6ФД может служить диагностическим и прогностическим инструментом при остром нелимфоцитарном лейкозе и хроническом миелоидном лейкозе (ХМЛ). При этом при нелимфоцитарном лейкозе. Содержание Г6ФД значительно снижается, в то время как у всех пациентов с ХМЛ — повышается.
Лактатдегидрогеназа (ЛДГ)
При ведении онкологических больных важно раннее выявление развития рецидива после первичной терапии. ЛДГ является, пожалуй, наиболее распространенным диагностическим ферментом, используемым для прогнозирования. ЛДГ — ценный прогностический маркер рака яичка, лимфомы, лейкемии и рака толстой кишки. Уровень ЛДГ в опухолевой ткани при раке молочной железы наряду с маммографической характеристикой отражают агрессивность рака.
Тартрат устойчивая кислая фосфатаза (ТУКФ) — диагностический фермент метастазирования в кости
Метастазы рака в кости рассматриваются онкологами как его терминальная фаза. Биохимические маркеры костного метаболизма потенциально полезны для диагностики метастазов в кости и для мониторинга результатов лечения у онкологических больных. Тартратустойчивая кислая фосфатаза, изоформа 5b (ТУКФ 5b) является биохимическим маркером количества остеокластов и их активности. Мониторинг активности фермента — полезный маркер резорбции костной ткани, используемый в диагностике и лечении костной патологии, прогнозе различных онкологических патологиях с высоким уровнем метастазирования в кости, включая рак молочной железы, простаты, легких и множественную миелому.
Тимидинкиназы как диагностические ферменты при онкопатологии
Тимидинкиназы (TK) играют ключевую роль в синтезе ДНК. Известны два изофермента ТК: ТК1 и ТК2. ТК1 появляется в цитоплазме клеток во время деления, ТК2 содержится в митохондриях и не имеет отношения к делению клеток. Уровни ТК1 в сыворотке и опухолевых тканях полезны для скрининга и мониторинга злокачественных опухолей человека. концентрация ТК1 повышается в опухолевых тканях – карцинома пищевода, легких, молочной железы. Содержание ТК1 отражает эффективность противоопухолевой терапии, ремиссию и рецидив рака. Значеие ТК1 предсказывает риск развития неоплазии на ранней стадии. ТК1 — потенциальный маркер для мониторинга состояния пациента после операции по поводу рака или других видов рака.
3.Диабет тип 2 и диагностические ферменты
Щелочная фосфатаза (ЩФ)
Помимо обычных факторов риска, таких как возраст, и женский пол, повышенное содержание ЩФ может рассматриваться как фактор риска фиброза печени у пациентов с сахарным диабетом, неалкогольным стеатогепатитом (жировое перерождение и воспалительный процесс в печени).
4. Болезнь Гоше и диагностические ферменты
Кислая фосфатаза (КФ)
Повышенная КФ наблюдается в сыворотке крови и тканях пациента с болезнью Гоше, врожденными ошибками метаболизма цереброзидов.
Хитиназы
Иммунная система человека способна распознавать и разрушать хитин — важную составляющую клеточной стенки патогенных грибов. В плазме пациентов с болезнью Гоше хитиназа повышена в несколько сотен раз, кислая хитиназа используется в качестве биомаркера для диагностики болезни Гоше. Кроме того, хитиназа — перспективный маркер при лечении астмы и других аллергий.
Болезни печени и их диагностические ферменты
Аланинтрансаминаза (АЛТ)
Увеличение уровня АЛТ в сыворотке отражает тяжесть поражени печени, как правило, вирусный гепатит и токсический некроз печени. АЛТ — сывороточный маркер патологического состояния печени.
Щелочная фосфатаза (ЩФ)
Повышение уровня ЩФ в сыворотке указывает на повышение активности гепатоцитов при гепатобилиарной болезни. Более высокие уровни ЩФ в сыворотке наблюдаются как при блокаде желчных протоков, так и в случае обтурационной желтухи.
Аспартаттрансаминаза (АСТ)
АСТ значительно увеличивается в сыворотке (в 10-100 раз) при вирусном гепатите или токсическом некрозе гепатоцитов или клеток сердечной мышцы — кардиомиоцитов.
Гамма-глутамилтрансфераза (ГГТ)
Катализирует перенос аминокислот из одного пептида на другой. Этот фермент иногда называют «транспептидаза». Гепатобилиарная болезнь является преобладающим источником повышенной активности ГГТ в сыворотке крови. Увеличение фермента связано со всеми формами первичных и вторичных гепатобилиарных расстройств. Умеренное (от 2 до 5 раз) повышение при диффузном повреждении клеток печени при токсическом или инфекционном гепатите. При холестазе вследствие внутрипеченочной или внепеченочной обструкции желчных протоков повышение ГГТ в сыворотке от 5 до 30 раз выше нормы. При холестазе повышение ГГТ происходит раньше и сохраняется дольше, чем ЩФ.
Лактатдегидрогеназа (ЛДГ)
Изоферменты ЛДГ помогают диагностировать многие болезни При поражении печени повышается ЛДГ-5.
6.Инфаркт миокарда и диагностические ферменты
Креатинкиназа
КК-MB Боль в груди может быть следствием острой ЖК болезни или серьезной проблемы с сердцем. Поражение сердечной мышцы при инфаркте миокарда сопровождается освобождением в кровоток многих молекул, одни из которых креатинкиназа (КK). Сывороточные уровни КК значительно выше контроля у пациентов с острым инфарктом миокарда (ИМ). Известно три изофермента КК: MM, MB и ВВ. В то время как общая активность фермента рассматривается как неспецифическая, наличие КК-MB является наиболее специфическим, точным и экономически эффективным тестом обнаружения ИМ. По сравнению с другими тестами для диагностики ИМ, КК-МВ характеризуют раннее повышение в циркуляции, высокая чувствительность и специфичность. КК-МВ неизменно показывает быстрое увеличение в сыворотке крови в первые часы после приступа боли в грудной клетке. Использование КK-MB как маркера помогает диагностировать ИМ в течение 6 часов после появления симптомов и > 60% инфарктов обнаруживаемые в течение первого часа госпитализации в отделении интенсивной терапии сердца. Изофермент КК-MB значительно повышен в сыворотке уже в первый день после инфаркта. При определении КК-МВ предпочтение отдают ИФА анализу.
Гликогенфосфорилаза BB (ГФBB)
Гликоген фосфорилаза — фермент гликолиза, ответственный за мобилизацию гликогена. Среди трех изоферментов, а именно, гликогенфосфорилаза LL (ГФП) [печень], гликогенфосфорилаза ММ (ГФMM) [мышцы] и гликогенфосфорилазы BB (ГФBB) [мозг], изофермент ВВ является преобладающим изоферментом в миокарде. Быстрое повышение уровня в крови ГФ BB можно увидеть при ИМ и нестабильной стенокардии. ГФBB повышается в крови больного ИМ через 1- 4 часа после появления боли в грудной клетке.
Лактатдегидрогеназа (ЛДГ)
Увеличение общей активности ЛДГ в сыворотке крови может в результате повреждения сердечной мышцы, скелетных мышц, поджелудочной железы или печени. Для того чтобы дифференцировать поврежденные ткани, определяют уровни отдельных изоферментов ЛДГ. Значительное увеличение уровня ЛДГ-1 в сыворотке характерно для ИМ.
Желатиназы как диагностические ферменты
В качестве биомаркеров ранней стадии острого инфаркта миокарда предложены желатиназы А и В, значние которых отражает степень повреждения клеточной мембраны кардиомиоцитов.
Альфа-амилаза
Высокая амилаза слюны является независимым предиктором острого ИМ у пациентов отделения неотложной помощи с болью в грудной клетке.
7. Панкреатит и диагностические ферменты
Амилаза
В течение 24 часов с момента появления симптомов повышение уровня общей амилазы является чувствительным маркером острого панкреатита. В последующие дни госпитализации амилаза является наименее чувствительным из ферментативных тестов.
Липаза
Содержание липазы сыворотки может быть использовано в качестве диагностического инструмента для выявления таких состояний как острый панкреатит и травмы поджелудочной железы. Острый панкреатит обычно возникает в результате злоупотребления алкоголем или обструкции желчных протоков. Хотя в сыворотке крови повышен трипсин, сывороточные уровни липазы и амилазы до сих пор используются для подтверждения диагноза острого панкреатита
8. Стоматология и диагностические ферменты
Аспартаттрансаминаза (АСТ)
Периодонтит — одно из самых распространенных воспалительных поражений полости рта, характеризующееся прогрессирующей деструкцией альвеолярной кости и мягких тканей, окружающих зубы. В жидкости десневых бороздок наблюдается высокое содержание АСТ. Значение АСТ в жидкости десневой борозды значительно выше, чем в сыворотке крови. Предлагается использовать АСТ жидкости слюнных бороздок как маркер прогрессирования периодонтита.
9. Почечные расстройства и диагностические ферменты
Лизосомальные гликозидазы
Лизосомальные гликозидазы мочи, а именно N-ацетил-p-D-глюкозаминидаза [NAG] (p-гексозамин, инидаза), p-глюкуронидаза и p-галактозидаза имеют значение в ранней диагностике диабетической нефропатии, NAG самый полезный маркер. Повышение NAG в моче больных диабетом — биомаркер скрининга диабетической почечной дисфункции.
Лизоцим
Фермент осуществляет гидролиз гликозидных связей в пептидогликанах клеточной стенки некоторых микроорганизмов и поддерживает, таким образом, защиту хозяина. Концентрация лизоцима в моче — чувствительный индикатор повреждения почек. Она значительно выше у пациентов с хронической почечной недостаточностью, для количественного определения фермента используют высокоэффективную жидкостную хроматографию.
10. Шизофрения
Бутирилхолинэстераза (БХЭ) как диагностический фермент
Пациенты с шизофренией имеют более высокую БХЭ в плазме по сравнению с контролем. У пациентов с шизофренией БХЭ не связана с возрастом, алкогольным статусом и клиническими подтипами, не коррелирует с длительностью болезненного состояния. Увеличение активности БХЭ может быть связано с патофизиологией шизофрении.
Общая характеристика ферментов — мультимеров
Большинство ферментов представлено белками – мультимерами, т.е. построенными из субъединиц. Например, РНК-полимераза состоит из 6 протомеров, ДНК-полимераза – из 2 протомеров.
Способы компоновки протомеров в мультимерах разнообразны. Крайне важно, что фермент проявляет максимальную каталитическую активность именно в виде мультимера: диссоциация на протомеры резко снижает активность фермента. Не все ферменты-мультимеры построены исключительно из каталитически активных протомеров. Наряду с каталитическими в их составе отмечены регуляторные субъединицы.
Среди ферментов-мультимеров безусловно преобладают димеры и тетрамеры (их несколько сотен), в меньшей мере распространены гексамеры и октамеры (несколько десятков) и редко встречаются тримеры и пентамеры.
Среди ферментов – мультимеров выделяют изоферменты, мультиэнзимы или полиферментные комплексы и мембраносвязанные ферменты.
Изоферменты — это формы фермента, которые катализируют одну и ту же реакцию, но различаются по некоторым свойствам: аминокислотной последовательности, молекулярной массе, аминокислотному составу, составу субъединиц, электрофоретической подвижности и др.
Изоферменты являются продуктами экспрессии разных генов: гены могут быть в разных хромосомах (например, для амилазы слюны и амилазы панкреатической) или в одной хромосоме (например, для цитоплазматической и митохондриальной малатде-гидрогеназы).
Существуют различия в распределении изоферментов в разных тканях, в разных внутриклеточных компартментах, что отражает различия в метаболизме, например изоферменты могут иметь разное сродство к субстрату.
Один из основных механизмов образования изоферментов включает объединение разных субъединиц в разной комбинации при образовании активного олигомерного фермента.
Пример 1. Изоферменты креатинкиназы (КК) образуются при объединении 2 субъединиц в димерную молекулу.
Креатинкиназа катализирует обратимую реакцию образования и распада креатинфосфата — вещества, которое участвует в запасании энергии.
Фермент КК является димером, состоящим из 2 субъединиц. Субъединицы В (мозговая) и М (мышечная) закодированы в разных генах.
Фермент КК представлен 3 изоферментами, которые различаются по электрофоретической подвижности:
— ВВ (КК-1) — мозговой, максимальное продвижение к аноду;
— MB (КК-2) — сердечный, средняя подвижность;
— ММ (КК-3) — мышечный, самый медленный. Набор изоформ КК в разных тканях неодинаков:
— КК-1 присутствует в значительных количествах в мозге, простате, желудке, легких, плаценте, щитовидной железе.
— КК-2 находится в основном в сердечной мышце (25-46% от общей активности фермента в кардиомиоците), в скелетной мышце (5%).
— КК-3 присутствует в основном в клетках скелетных и сердечной мышц.
Мультиэнзим или полиферментный комплекс образован за счет нековалентных взаимодействий, в его состав входит несколько индивидуальных ферментов; обычно эти ферменты функционально взаимосвязаны. Этот комплекс ферментов работает подобно конвейеру, в котором продукт передается от фермента к ферменту.
Примером может служить мультиэнзим, ускоряющий реакцию окислительного декарбоксилирования пировиноградной кислоты. Этот полиферментный комплекс состоит из трех видов ферментов: пируватдекарбоксилазы (1), дигидролипоат-ацетилтрансферазы(2), дегидрогеназы дигидролипоевой кислоты (3).
Такой принцип повышает эффективность работы ферментов, так как снижает случайность в контакте реагирующих веществ с ферментом. Далее приводятся названия ферментов и характеристика катализируемых реакций.
В тех случаях, когда ансамбль ферментов обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном. Таковы метаболоны гликолиза, биосинтеза ряда аминокислот, цикла дикарбоновых и трикарбоновых кислот и др.
Особенность работы мультиэнзимных комплексов и метаболонов: эстафетная передача промежуточных продуктов реакции от одного компонента каталитической системы к другому без их высвобождения.
Многие ферменты и ферментные комплексы прочно связаны с мембранами клетки или её органоидов (митохондрий, лизосом, микросом и т.д.) и участвуют в активном транспорте веществ через мембраны.
Ацил-КоА-дегидрогеназы — Википедия
Ацил-КоА-дегидрогеназы, также ACADs (сокр. от англ. Acyl-CoA dehydrogenases, КФ 1.3.99.3) — группа ферментов из класса оксидоредуктаз, которые катализируют реакции переноса протона (дегидрогенизация) от субстрата — ацил-КоА жирной кислоты на электрон-переносящий флавопротеин (FAD), участвуют в процессе β-окисления. Результатом реакции является образование двойной связи расположенной между атомами С2 (α) и С3 (β) в молекуле тиоэфира субстрата (ацил-КоА)[1].
Флавопротеин в данном случае молекула FAD является простетической группой.
Ферменты катализируют реакции β-окисления жирных кислот, протекающие по следующей схеме:

или Ацил-КоА + FAD → транс-2,3-дегидроацил-КоА + FADH2
Образовавшийся продукт реакции тиоэфир ненасыщенной жирной кислоты (транс-Δ2-еноил-КоА) имеет двойную связь в транс-положении.
ACADs могут быть разделены на три группы в зависимости от их специфики для коротко-, средне- и длинноцепочечных ацил-КоА жирных кислот. Несмотря на различия длины цепей субстрата, все виды ACADs механистически подобны. Различия в ферментах происходит на основе расположения активного центра в аминокислотной последовательности[2].
Ферменты ACADs идентифицированы у многих животных (9 важнейших ферментов), а том числе нематод[3], а также у растений[4], грибов[5] и бактерий[6]. Пять из этих девяти ферментов участвуют в β-окислении жирных кислот (SCAD, MCAD, LCAD, VLCAD, и VLCAD2), а остальные четыре участвуют в метаболизме аминокислот с разветвлённой цепью (i3VD, i2VD, GD и iBD). Большинство ацил-КоА-дегидрогеназ являются α4-гомотетрамерами, а в двух случаях (для очень длинноцепочечных жирных кислотных субстратов) они являются α2-гомодимерами. Был обнаружен дополнительный класс ацил-КoA-дегидрогеназ, который катализирует реакции α,β-ненасыщенности с стероил-КoA-тиоэфирами в некоторых типах бактерий[7][8]. Было продемонстрировано, что этот класс ACAD образует гетеротетрамеры α2β2, а не обычный гомотетрамер α4, белковая архитектура, которая развилась для того, чтобы разместить гораздо больший стероил-КoA-субстрат[9][10].

Наиболее изученной структурой среди ферментов данной группы является структура Ацил-КоА-дегидрогеназы жирных кислот со средней цепью (MCAD, КФ 1.3.8.7). Она представлена в виде тетрамера, в каждой субъединице которой содержится по 400 аминокислотных остатков и 1 молекула FAD на один мономер. Тетрамер классифицируют как «димер димера», имеющий общий диаметр в 90 Å.
Простетическая группа — FAD связывается с тремя доменами мономера, где вносит существенный вклад в общую стабильность фермента. Ацил-КоА жирных кислот полностью связывается с каждым мономером фермента. Активный центр выровнен аминокислотными остатками F252, T255, V259, T96, T99, A100, L103, Y375, Y375 и E376.
MCAD может связываться с довольно широким спектром длины цепей субстратов — ацил-КоА жирных кислот, однако исследования показывают, что наиболее специфичной целью для связывания является октаноил-КоА (С8-КоА)[11].
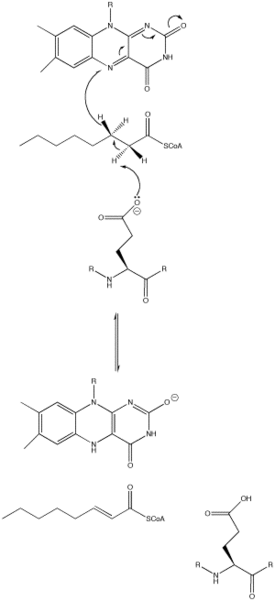 Общий механизм катализа ацил-КоА-дегидрогеназы.
Общий механизм катализа ацил-КоА-дегидрогеназы.Механизм катализа основывается на реакциях элиминирования E2 (отщепления) двух протонов от субстрата и, последующим их переносом на FAD. Отщепление протонов инициируется остатком глутамата, который, хоть и необходим для механизма протекания реакции, не сохраняется[1].
Остаток глутамата может появляться в самых различных местах в различных видах ацил-КоА-дегидрогеназ (например, для MCAD это Glu-376). Он депротонирует (отщепляет) про-R водород у атома углерода в положении α (C2) в молекуле ацил-КоА. Водородные связи карбонильного кислорода субстрата для обоих 2′-ОН групп рибитола в боковой цепи FAD и основной цепи N—H из ранее упомянутого остатка глутамата снижают рKа (константу кислотности) этого протона, что позволяет ему быстро быть удалённым с субстрата при помощи Glu-376[1].
По мере того как происходит депротонирование альфа-углерода (С2), про-R водород бета-углерода (С3) покидает молекулу субстрата и тот, уже как гидрид анион движется к FAD в согласованной стадии. Протон присоединяется к Re стороне FAD в положении N-5, при этом фермент удерживает FAD на месте посредством водородных связей с участком пиримидина и гидрофобных взаимодействий с диметилбензоловой частью. Субстрат теперь превращается в a,β-ненасыщенные тиоэфир[1].
Как только FAD принимает гидрид анион, атом карбонильного кислорода, прилегающий к атому азота в положении N-1 становится отрицательно заряженным. Эти электроны находятся в резонансе с N-1 атомом азота, которые распространяют и стабилизируют в результирующий отрицательный заряд. Заряд также стабилизируется водородной связью между атомами кислорода и азота и различными аминокислотными остатками активного центра фермента[1].
 Крупным планом показан участок активного центра ацил-КоА-дегидрогеназы со средней длиной цепи (MCAD). Молекула FAD связана. Субстрат начнёт связываться в пространстве между Glu-376 и FAD , когда произойдёт активация процесса β-окисления жирных кислот.
Крупным планом показан участок активного центра ацил-КоА-дегидрогеназы со средней длиной цепи (MCAD). Молекула FAD связана. Субстрат начнёт связываться в пространстве между Glu-376 и FAD , когда произойдёт активация процесса β-окисления жирных кислот.Дефицитные состояния, связанные с метаболическими нарушениями человека[править | править код]
Дефицитные состояния ацил-КоА-дегидрогеназ приводят к замедлению процессов β-окисления жирных кислот, тем самым показывая, метаболические нарушения. Наиболее частыми являются генетические нарушения такими, как дефицит ацил-КоА-дегидрогеназ жирных кислот со средней длиной цепи (MCADD, сокр. от англ. Medium-chain acyl-CoA dehydrogenase deficiencies) аутосомно-рецессивное заболевание, приводящее к летальным состояниям организма. Некоторые симптомы, характеризующие MCADD: приступы рвоты, гипогликемия и синдром внезапной младенческой смерти (развивается на фоне обильной утилизации глюкозы) и другие. Все эти симптомы непосредственно связаны с накоплением жирных кислот средней цепи (особенно каприловой) и их производных в крови и вторичным дефицитом карнитина. Это приводит к закислению и понижению pH крови и, как следствие, к ацидозу[1][12]. Большую опасность эти проявления MCADD представляют у новорождённых детей, среди них наблюдается самая высокая летальность (до 60%)[12].
Причиной МСАDD является мутация гена ACADM. Примерно в 90% случаев она проявляется в замене лизина в позиции 304 (Lys-304) на глутамат, тем самым лишает фермент нормального функционирования. Мутация выявляется у 1 из 20000 новорождённых каждый год. Так как MCADD относится к рецессивным мутациям, то часто родители детей, которые страдают от дефицита могут быть потом диагностированы как носители[13].
Молекулярные основы мутации[править | править код]
В организме человека наиболее распространённые естественные мутации в MCAD происходят по аминокислотному остатку лизина в позиции 304 (Lys-304). В результате точечных мутаций в боковой цепи происходит замена лизина на остаток глутамата. Lys-304, как правило, взаимодействует с окружающими аминокислотными остатками, образуя водородные связи с остатками Gln-342, Asp-300 и Asp-346. Когда происходит мутация и место лизина занимает глутамат, то он вызывает негативное проявление — дополнительный отрицательный заряд (вследствие наличия у последнего двух карбоксильных групп) внедряется на той стороне, где образуется водородная связь, разрушая её. Такое нарушение изменяет складчатую структуру фермента, в конечном счёте, ставя под угрозу его стабильность и подавляя его главную функцию — окисление жирных кислот. Эффективность мутировавшего белка примерно в 10 раз ниже, чем у нативного белка. Это приводит к симптомам MCADD[14].
- ↑ 1 2 3 4 5 6 Thorpe C., Kim J. J. Structure and mechanism of action of the acyl-CoA dehydrogenases (англ.) // The FASEB Journal (англ.)русск. : journal. — Federation of American Societies for Experimental Biology (англ.)русск., 1995. — June (vol. 9, no. 9). — P. 718—725. — PMID 7601336.
- ↑ Kim J. J., Wang M., Paschke R. Crystal structures of medium-chain acyl-CoA dehydrogenase from pig liver mitochondria with and without substrate (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1993. — August (vol. 90, no. 16). — P. 7523—7527. — DOI:10.1073/pnas.90.16.7523. — PMID 8356049.
- ↑ Komuniecki R., Fekete S., Thissen-Parra J. Purification and characterization of the 2‐methyl branched‐chain Acyl-CoA dehydrogenase, an enzyme involved in NADH-dependent enoyl-CoA reduction in anaerobic mitochondria of the nematode, Ascaris suum (англ.) // J Biol Chem : journal. — 1985. — Vol. 260. — P. 4770—4777. — PMID 3988734.
- ↑ Bode, K.; Hooks, M.A.; Couee, I. Identification, separation, and characterization of acyl-coenzyme A dehydrogenases involved in mitochondrial β-oxidation in higher plants (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 1999. — Vol. 119. — P. 1305—1314. — DOI:10.1104/pp.119.4.1305.
- ↑ Kionka, C.; Kunau, W.H. Inducible β-oxidation pathway in Neurospora crassa (англ.) // Journal of Bacteriology (англ.)русск. : journal. — 1985. — Vol. 161. — P. 153—157.
- ↑ Campbell, J.W.; Cronan, J.E. Jr. The enigmatic Escherichia coli fadE gene is yafH (англ.) // Journal of Bacteriology (англ.)русск. : journal. — 2002. — Vol. 184, no. 13. — P. 3759—3764. — DOI:10.1128/JB.184.13.3759-3764.2002.
- ↑ Thomas, S.T.; Sampson, N.S. Mycobacterium tuberculosis utilizes a unique heterotetrameric structure for dehydrogenation of the cholesterol side chain (англ.) // Biochemistry : journal. — 2013. — Vol. 52, no. 17. — P. 2895—2904. — DOI:10.1021/bi4002979. — PMID 23560677.
- ↑ Wipperman, M.F.; Yang, M.; Thomas, S.T.; Sampson, N.S. Shrinking the FadE Proteome of Mycobacterium tuberculosis: Insights into Cholesterol Metabolism through Identification of an α2β2 Heterotetrameric Acyl Coenzyme A Dehydrogenase Family (англ.) // Journal of Bacteriology (англ.)русск. : journal. — 2013. — Vol. 195, no. 19. — P. 4331—4341. — DOI:10.1128/JB.00502-13. — PMID 23836861.
- ↑ Voskuil, M.I. Mycobacterium tuberculosis Cholesterol Catabolism Requires a New Class of Acyl Coenzyme A Dehydrogenase (англ.) // Journal of Bacteriology (англ.)русск. : journal. — 2013. — Vol. 195, no. 19. — P. 4319—4321. — DOI:10.1128/JB.00867-13. — PMID 23893117.
- ↑ Wipperman, Matthew, F.; Thomas, Suzanne, T.; Sampson, Nicole, S. Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis (англ.) // Crit. Rev. Biochem. Mol. Biol. (англ.)русск. : journal. — 2014. — Vol. 49, no. 4. — P. 269—293. — DOI:10.3109/10409238.2014.895700. — PMID 24611808.
- ↑ Kieweg V., Kräutle F. G., Nandy A. et al. Biochemical characterization of purified, human recombinant Lys304→Glu medium-chain acyl-CoA dehydrogenase containing the common disease-causing mutation and comparison with the normal enzyme (англ.) // Eur. J. Biochem. (англ.)русск. : journal. — 1997. — June (vol. 246, no. 2). — P. 548—556. — DOI:10.1111/j.1432-1033.1997.00548.x. — PMID 9208949. Архивировано 5 января 2013 года.
- ↑ 1 2 Нельсон Д., Кокс М. Основы биохимии Ленинджера. — М.: БИНОМ, 2011. — Т. II.
- ↑ Touma E. H., Charpentier C. Medium chain acyl-CoA dehydrogenase deficiency (англ.) // Arch. Dis. Child. (англ.)русск. : journal. — 1992. — January (vol. 67, no. 1). — P. 142—145. — DOI:10.1136/adc.67.1.142. — PMID 1739332.
- ↑ Nasser I., Mohsen A. W., Jelesarov I., Vockley J., Macheroux P., Ghisla S. Thermal unfolding of medium-chain acyl-CoA dehydrogenase and iso(3)valeryl-CoA dehydrogenase: study of the effect of genetic defects on enzyme stability (англ.) // Biochim. Biophys. Acta (англ.)русск. : journal. — 2004. — September (vol. 1690, no. 1). — P. 22—32. — DOI:10.1016/j.bbadis.2004.04.008. — PMID 15337167.
НАДФ-зависимая декарбоксилирующая малатдегидрогеназа — Википедия
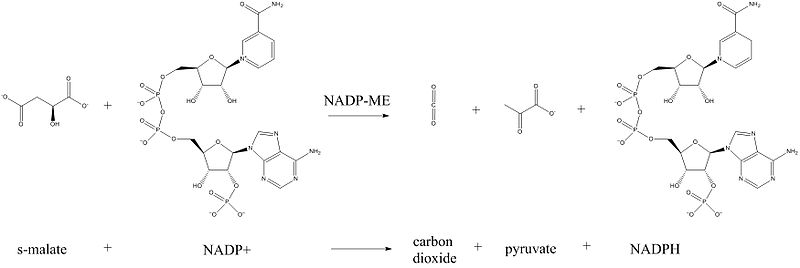
НАДФ-зависимая декарбоксилирующая малатдегидрогеназа или НАДФ-малик-энзим (НАДФ-МЭ) представляет собой фермент, катализирующий химическую реакцию в присутствии двухвалентных ионов металлов:
- (S)-малат + НАДФ+ -> пируват + CO2 + НАДФН
В качестве субстрата фермент использует (S)-малат и НАДФ+, при реакции образуются пируват, углекислый газ и НАДФН. В ходе реакции малат окисляется до пирувата и CO2, а НАДФ+ восстанавливается до НАДФН.
Фермент принадлежит к семейству оксидоредуктаз, а точнее, к ферментам, взаимодействующим с СН-OH группой донора, а в качестве акцептора использующих НАД+ или НАДФ+. Систематическое название этого фермента: (S)-малат: НАДФ+ оксидоредуктаза (оксалоацетат-декарбоксилаза). Малатдегидрогеназа участвует в метаболизме пирувата и связывании углерода. НАДФ-малик энзим является одним из трех ферментов декарбоксилирования, участвующих в концентрировании неорганического углерода у С4 и CAM-растений. Также к этому классу относятся НАД-малик-энзим и ФЕП-карбоксикиназа.[1][2] Хотя часто одна из трех фотосинтетических декарбоксилаз преобладает, также может встречаться одновременное включение активности всех трех ферментов[3].
 Кристаллическая структура гомолога — человеческого малик-энзима; выделенные остатки участвуют в связывании субстрата и катализе. Сайт II содержит GLGDLG мотив, сайт V содержит другой мотив — GXGXXG, выделенный остаток аргинина взаимодействует с НАДФ+ и малатом, а обозначенный лизин, возможно, составляет основу катализа. Идентификатор PDB файла для изображения — 2aw5.
Кристаллическая структура гомолога — человеческого малик-энзима; выделенные остатки участвуют в связывании субстрата и катализе. Сайт II содержит GLGDLG мотив, сайт V содержит другой мотив — GXGXXG, выделенный остаток аргинина взаимодействует с НАДФ+ и малатом, а обозначенный лизин, возможно, составляет основу катализа. Идентификатор PDB файла для изображения — 2aw5.На основе кристаллографических данных гомологичного НАДФ-зависимого малик-энзима млекопитающих, была разработана 3D модель НАДФ-МЭ участвующего в C4 пути в растениях для выявления основных остатков, обеспечивающих связывание субстрата при катализе. Участок связывания НАДФ+ включает в себя два богатых глицином мотива — GXGXXG, гидрофобный желобок с участием минимум шести аминокислотных остатков и отрицательно заряженный остаток на конце ß-нити.[4][5] Первичная последовательность первого мотива, 240GLGDLG245, является консенсусным маркером для связывания фосфата, что подтверждает участие НАДФ+ в связывании, другие глицин-богатые мотивы принимают классическую укладку Россмана — также являющуюся типичным маркером для связывания НАДФ кофактора.[6]
Полученные путем искусственного мутагенеза растения кукурузу с дефицитом функции НАДФ-МЭ подтвердждают предложенную молекулярно-биологическую модель. Замена валина глицином в любом месте мотива приводит к полной инактивации фермента. При этом спектральный анализ не показывает существенных отличий от формы дикого типа. Данные свидетельствуют о нарушениях в главном остатке, участвующем в связывании и катализе, а не во междоменном остатке, влияющем на конформационную стабильность. Важную роль играет остаток аргинина в положении 237, взаимодействуя с малатом и НАДФ+, он участвует в формировании электростатического взаимодействия с отрицательно заряженной карбоксильной группой кислоты и фосфатной группой нуклеотида. Не известно, играет ли данный остаток важную роль в субстрат-связывающих взаимодействиях или же определяет положение субстрата при катализе.[7] Предполагается, что остаток лизина в положении 255 выступает в качестве каталитического основания. Однако, необходимы дальнейшие исследования для точного установления его биохимической роли.
Если рассматривать этот класс ферментов в общем, то малик-энзимы найдены у многих эукариотических организмов (от грибов до млекопитающих). Показана локализация ферментов на субклеточном уровне. Малик энзим присутствует в цитозоле, митохондрия и хлоропластах. В частоности, у С4 растений НАДФ-МЭ локализован в хлоропластах клеток-обкладок проводящего пучка.
В ходе C4фотосинтеза — биохимического пути, возникшего для концентрирования CO2 в месте его фиксации РуБисКО — углекислый газ попадает в клетки мезофилла и образует оксалоацетат. Затем, происходит восстановление оксалоацетата до малата. Малат транспортируется в клетки обкладки, где подвергается декарбоксилированию при участии НАДФ-МЭ. Поскольку в одну клетку обкладки поступает малат от нескольких клеток мезофилла, то в результате происходит концентрирование углекислого газа в месте его фиксации РуБисКо.[8]
Роль НАДФ-MЭ в коцентрировании углекислого газа подтверждается исследованием, проведенным на трансгенных растениях. Трансгенные растения с частичной потерей функции НАДФ-MЭ (40% активности НАДФ-ME от активности у дикого типа) наблюдалось значительное снижение уровня фиксации CO2 даже при высоком межклеточном содержании углекислого газа. Это говорит о важном значении НАДФ-MЭ в регуляции потока углерода, направленного к циклу Кальвина.
Было показано, что экспрессия НАДФ-МЭ регулируется факторами абиотического стресса. Для CAM растений в условиях засухи характерно закрывание устьиц для избегания потери воды в результате испарения, которое приводит к голоданию по СО2. Этот процесс компенсируется за счёт того, что закрытие устьиц активирует трансляцию НАДФ-MЭ, что в свою очередь, во время коротких периодов поглощения СО2, увеличивает эффективность усвоения СО2,позволяя таким образом осуществлять фиксацию углерода.
В дополнение к длительному регулированию фермента посредством изменения экспрессии генов, существует кратковременное регулирование, которое может осуществляться за счёт аллостерических механизмов. Было показано, что для частичного ингибирования С4 НАДФ-МЭ субстратом, малат предположительно должен иметь два независимых сайта связывания: один в активном центре, а второй — аллостерический. Однако, ингибирующий эффект зависит от рН и проявляется лишь при рН = 7, но не 8. Наблюдение за изменением активности фермента в зависимости от изменения рН согласуются с гипотезой о том, что НАДФ-МЭ активен во время фотосинтеза: световые реакции приводят к повышению основности в строме хлоропласта — места локализации НАДФ-МЭ, что приводит к уменьшению ингибирующего влияния малата на НАДФ-МЭ, способствуя тем самым увеличению реакционной способности фермента. И наоборот, замедление световых реакций приводит к повышению кислотности среды в строме, вызывая ингибирование НАДФ-МЭ малатом. Необходимость регуляторного механизма объясняется тем, что для реакций цикла Кальвина требуются высокоэнергетические продукты световой фазы, НАДФН и АТФ, и,соответственно, процесс накопления СО2 без этих продуктов не является полезным.
Для этого белка можно использовать морфеиновую модель аллостерической регуляции.
НАДФ-малик энзим, как и все остальные С4 декарбоксилазы, не развился de novo с целью оказания помощи в фиксации СО2 РуБисКо. Наиболее вероятно, что НАДФ-МЭ был трансформирован из C3 вида в процессе фотосинтеза, но возможно также и более раннее происхождение из древнего цитозольного предка. В цитозоле, фермент существовал как ряд изоформ «домашнего хозяйства», предназначенных для выполнения различных функций, включая поддержание уровня малата во время гипоксии, удаление микроспор и защиту от патогенов. Относительно механизма эволюции, считается, что С4 функциональность была вызвана ошибкой внутри промоторных областей при дупликации гена, что привело к его гиперэкспрессии в кодирующей области в клетках обкладки, порождая неофункционализацию. Выбор в пользу сохранения функции фиксирования CО2, а также повышенной утилизации воды и азота при стрессовых условиях был обусловлен эволюционным давлением.
Установлено, что в ходе эволюции фермент приобрел несколько ключевых функциональных особенностей, в частности: увеличенную каталитическую активность, тетрамерную структуру и способность к pH-зависимому ингибированию собсвтенным субстратом — малатом [9]. Сайт-специфический мутагенез, вместе с разрешеним кристаллической структуры C4-НАДФ-МЭ из сорго и кукурузы позволил установить ряд аминоксилотных остатков, обеспечивающих эти функции:
- Q503, L544 и E339 увеличивают эффективность катализа;
- E339 обеспечивает pH-зависимое ингибирование малатом;
- F140 обеспечивает поддержание олигомерной структуры;
- N-конец участвует в тетрамеризации [9].
- ↑ Kanai, Ryuzi; Edwards, Gerald E. The Biochemistry of C4 Photosynthesis // C4 Plant Biology (неопр.) / Rowan F. Sage, Russell K. Monson. — Academic Press, 1999. — С. 49—87. — ISBN 978-0-08-052839-7.
- ↑ Christopher J.T., Holtum J. Patterns of Carbon Partitioning in Leaves of Crassulacean Acid Metabolism Species during Deacidification (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 1996. — September (vol. 112, no. 1). — P. 393—399. — DOI:10.1104/pp.112.1.393. — PMID 12226397.
- ↑ Furumoto T., Hata S., Izui K. cDNA cloning and characterization of maize phosphoenolpyruvate carboxykinase, a bundle sheath cell-specific enzyme (англ.) // Plant Molecular Biology : journal. — 1999. — October (vol. 41, no. 3). — P. 301—311. — DOI:10.1023/A:1006317120460. — PMID 10598098.
- ↑ Rossman, Michael G.; Liljas, Anders; Brändén, Carl-Ivar; Banaszak, Leonard J. Evolutionary and Structural Relationships among Dehydrogenases // The Enzymes (неопр.) / Boyer, Paul D.. — 1975. — Т. 11. — С. 61—102. — ISBN 978-0-12-122711-1. — DOI:10.1016/S1874-6047(08)60210-3.
- ↑ Bellamacina C.R. The nicotinamide dinucleotide binding motif: a comparison of nucleotide binding proteins (англ.) // The FASEB Journal (англ.)русск. : journal. — Federation of American Societies for Experimental Biology (англ.)русск., 1996. — September (vol. 10, no. 11). — P. 1257—1269. — PMID 8836039.
- ↑ Rothermel B.A., Nelson T. Primary structure of the maize NADP-dependent malic enzyme (англ.) // The Journal of Biological Chemistry : journal. — 1989. — November (vol. 264, no. 33). — P. 19587—19592. — PMID 2584183.
- ↑ Coleman, David E.; Rao, G. S. Jagannatha; Goldsmith, E. J.; Cook, Paul F.; Harris, Ben G. Crystal Structure of the Malic Enzyme from Ascaris suum Complexed with Nicotinamide Adenine Dinucleotide at 2.3 Å Resolution (англ.) // Biochemistry : journal. — 2002. — June (vol. 41, no. 22). — P. 6928—6938. — DOI:10.1021/bi0255120. — PMID 12033925.
- ↑ Edwards G.E., Franceschi V.R., Voznesenskaya E.V. Single-cell C(4) photosynthesis versus the dual-cell (Kranz) paradigm (англ.) // Annual Review of Plant Biology : journal. — 2004. — Vol. 55. — P. 173—196. — DOI:10.1146/annurev.arplant.55.031903.141725. — PMID 15377218.
- ↑ 1 2 Veronica G. Maurino, Martin J. Lercher, Maria F. Drincovich, Luitgard Nagel-Steger, Alejandro Buschiazzo. Molecular adaptations of NADP-malic enzyme for its function in C 4 photosynthesis in grasses (англ.) // Nature Plants. — 2019-06-24. — P. 1. — ISSN 2055-0278. — DOI:10.1038/s41477-019-0451-7.
