Лекции по Патологической Анатомии. Общий курс. М.А. Пальцев
Нарушения гемостаза. Комплекс механизмов, поддерживающий кровь в жидком состоянии, без ее свертывания в просвете сосуда или просачивания через сосудистую стенку, получил название гемостаза. Так как патологические состояния, связанные со свертыванием крови разбираются в следующей лекции, то здесь следует рассмотреть другие изменения, связанные с нарушениями гемостаза.
Кровотечением (геморрагией, от греч. haima — кровь и rhein — течь) называется выход крови за пределы сосудистого русла или сердца в окружающую среду (наружное кровотечение) или в полости тела, просвет полого органа (внутреннее кровотечение). Примерами наружного кровотечения являются метроррагия (маточное), мелена
(кишечное), а внутреннего — гемоперикард, гемоторакс, гемоперитонеум и гемартроз (в полость перикарда, плевры, брюшной полости или сустава соответственно).
В зависимости от источника кровотечения делятся на артериальные, венозные, артериально-венозные (смешанные), капиллярные, паренхиматозные (капиллярные из паренхиматозных органов) и сердечные.
Частным видом кровотечения является кровоизлияние, при котором кровь накапливается экстраваскулярно в тканях. Различают четыре его разновидности:
•гематома — кровоизлияние с нарушением целостности тканей и образованием полости;
•геморрагическое пропитывание (инфильтрация) — кровоизлияние с сохранением целости ткани;
•кровоподтек (синяк) — плоскостное кровоизлияние в коже, подкожной клетчатке, слизистых оболочках;
•петехии — точечные кровоизлияния в коже, слизистых и серозных
оболочках, внутренних органах.
Множественные петехиальные кровоизлияния, сливающиеся между собой в более крупные по размерам, называют геморрагической пурпурой, а кровоподтек до 2 см диаметром — экхимозом.
К механизмам развития как кровотечений, так и кровоизлияний относят:
•разрыв (haemorragia per rhexin), возникающий вследствие травм неизмененного сосуда или некроза (разрыв сердца при инфаркте миокарда), воспаления (сифилитический мезаортит с разрывом аорты), аневризмы пораженной сосудистой стенки;
•разъедание (haemorragia per diabrosin), или аррозивное кровотечение, развивающееся при разрушении сосудистой стенки воспа-
Венозное полнокровие печени и легких 1) морфогенез изменений печени 2) морфология изменений печени при хроническом венозном полнокровии 3) морфогенез изменений легких 4) морфология изменений легких при хроническом венозном полнокровии 5) исходы венозного полнокровия печени и легких
Нужна помощь в написании работы?
1) Морфогенез изменений в печени:
Хронический венозный застой, гипоксия → дистрофия и некроз в центре долек и компенсаторная пролиферация периферических гепатоцитов → пролиферация фибробластов адвентиции центральных вен, активация липоцитов синусоидов печени → разрастание соединительной ткани в синусоидов, появление непрерывной базальной мембраны (в норме нет) → капилляризация синусоидов → капиллярно-паренхиматозный блок → усугубление гипоксии → застойный фиброз (склероз) печени → застойный (мускатный) цирроз печени (диффузный склероз+перестройка и деформация за счет патологической регенерации гепатоцитов)
2) Печень
МаСк: увеличена, плотная, края загруглены, поверхность разреза пестрая, серо-желтая с темно-красным крапом, напоминает мускатный орех (бурая индурация печени). МиСк: центральные отделы долек полнокровные, гепатоциты разрушены, на периферии гепатоциты в состоянии жировой дистрофии.
МиСк: центральные отделы долек полнокровные, гепатоциты разрушены, на периферии гепатоциты в состоянии жировой дистрофии.
3) Морфогенез изменений в легких: застойное венозное полнокровие → легочная гипертензия → спазм мелких сосудов → гипертрофия мышечно-эластических структур мелких ветвей легочной вены и артерии с перестройкой сосудов по типу замыкающих артерий — адаптивная реакция на переполнение кровью → склероз сосудов, срыв адаптации → декомпенсация, переполнение капилляров кровью → нарастание гипоксии → повышение тканевой проницаемости, активация фибробластов→ диапедезные кровоизлияния, диффузный гемосидероз легких и пневмосклероз альвеолярных перегородок → капиллярно-паренхиматозный блок → застойный склероз легких
4) Легкие МаСк: увеличены, плотные, бурые (бурая индурация легких). МиСк: множественные диапедезные кровоизлияния, гемосидероз, склероз.
5) Исходы венозного полнокровия легких и печени: пневмосклероз легких, ДН и цирроз печени, печеночная недостаточность.
Поможем написать любую работу на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость Поделись с друзьямиСтраница не найдена — Саянский медицинский колледж
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.

- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).
- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.

- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.
- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.
- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
микро пат.ан. | DocumentSite.net: сайт обмен документами
Сердечно-сосудистая системаСмешанный тромб в сосуде Описание: просвет сосуда, стенка сосуда, лейкоциты, фибрин, гемолизированный эритроциты.
 Стадии тромбообразования: агглютинация тромбоцитов, коагуляция фибриногена, агглютинация эритроцитов, преципитация белков плазмы. Этиология: васкулиты, спазм сосудов, замедление кровотока, нарушение балланса свертывающих систем крови. Классификация: по строению: красный, белый, смешанный, гиалиновый. По отношению к просвету сосуда: пристеночный, обтурирующий. Исход: канализация с последующей васкуляризацией, асептический аутолиз тромба, обызвествление, тромбоэмболия, септическое расплавление тромба.
Стадии тромбообразования: агглютинация тромбоцитов, коагуляция фибриногена, агглютинация эритроцитов, преципитация белков плазмы. Этиология: васкулиты, спазм сосудов, замедление кровотока, нарушение балланса свертывающих систем крови. Классификация: по строению: красный, белый, смешанный, гиалиновый. По отношению к просвету сосуда: пристеночный, обтурирующий. Исход: канализация с последующей васкуляризацией, асептический аутолиз тромба, обызвествление, тромбоэмболия, септическое расплавление тромба. Сифилитический мезаортит Описание: лейкоцитарная инфильтрация, колонии микроорганизмов, разрастание соединительной ткани, клетки Пирагова-Лангханса, очаги некроза. В воспалительном инфильтрате имеются клетки: лимфоидгые , плазматические, Пирагова-Лангханса. Локализация: Восходящая часть аорты, дуга аорты, близ клапанов. Этиология: бледная трепонема. Классификация: приобретенный (первичный, вторичный, третичный), врожденный (сифилис мертворожденных недоношенных плодов, ранний врожденный, поздний врожденный (триада Гетчинсона: паренхиматозный кератит, глухота, бочкообразные зубы)).

Атеросклероз аорты Описание: клеточная инфильтрация, мышечная оболочка, отложение мирных кислот и холестерола. На рисунке здесь: фиброзная бляшка, суженный просвет, полнокровие сосудов, миокард: Этиология: обменные факторы, гормональные, сосудистые, нервный фактор, наследственные и этнические. Стадии: долипидная, липоидоз, липосклероз, атероматоз, изъязвления, атерокальциноз. Клинико-морфологические формы: атеросклероз аорты, венечных артерий, головного мозга, почечных артерий, артерий кишечника, артерий конечности. Осложнения: гангрена, кровоизлияние, ишемия органов, аневризма. Исход: ИБС.
Ожирение сердца Описание: прослойки жировой ткани, истонченные (атрофированные) мышечных волокон, соединительной ткани. Классификация стромально-сосудистых жировых дистрофий: нарушение обмена нейтральных жиров, нарушение обмена холестерина и его эфиров. Исход: ИБС, сердечная недостаточность, ИМ.
Инфаркт миокарда в стадии организации Описание: лейкоцитарная инфильтрация, обширные поля соединительной ткани, гипертрофированные мышечные волокна.
 Этиология: длительный спазм, тромбоз венечных артерий, перенапряжение миокарда в условиях атеросклеротической окклюзии этих артерий, факторы риска: курение, ГБ, гиперлипидемия, гиподинамия, ожирение. Классификация: по времени его возникновения (первичный, повторный, рецидивирующий), по локализации (верхушка, передняя и боковая стенки ЛЖ, передний отдел перегородки, другая классификация — на экзамене: субэндокардиальный, субэпикардиальный, интрамуральный, трансмуральный), по распространенности (обширный, мелкоочаговой, трансмуральный), по течению (некротический, рубцующийся). Стадии: некротическая, стадия рубцевания. Осложнений и причины смерти: миомаляция, острая аневризма сердца, пристеночные тромбы, перикардит. Смерть связано: с самим инфарктом, фибрилляция желудочков, разрыв сердца, тромбоэмболия в сосуды головного мозга, асистолия, кардиогенный шок, острая СН.
Этиология: длительный спазм, тромбоз венечных артерий, перенапряжение миокарда в условиях атеросклеротической окклюзии этих артерий, факторы риска: курение, ГБ, гиперлипидемия, гиподинамия, ожирение. Классификация: по времени его возникновения (первичный, повторный, рецидивирующий), по локализации (верхушка, передняя и боковая стенки ЛЖ, передний отдел перегородки, другая классификация — на экзамене: субэндокардиальный, субэпикардиальный, интрамуральный, трансмуральный), по распространенности (обширный, мелкоочаговой, трансмуральный), по течению (некротический, рубцующийся). Стадии: некротическая, стадия рубцевания. Осложнений и причины смерти: миомаляция, острая аневризма сердца, пристеночные тромбы, перикардит. Смерть связано: с самим инфарктом, фибрилляция желудочков, разрыв сердца, тромбоэмболия в сосуды головного мозга, асистолия, кардиогенный шок, острая СН. lkt
Дыхательная система
Бурая индурация легких и хроническое венозное полнокровие легких Описание: расширенные межальвеолярные сосуды, скопление сидерофагов, нагруженных гемосидерином), отечная жидкость в альвеолах, склероз и утолщение межальвеолярных перегородок. Этиология: патология сердца, ведущая хронической СН: ИМ + кардиосклероз = ИБС, ГБ, хронический миокардит, кардиомиопатии, митральные пороки сердца. Классификация венозного полнокровия: общее венозное полнокровие (острое и хроническое), местное венозное полнокровие. Морфогенез: застой в малом круге кровообращения — гипертензия — гипертрофия стенки сосудов — расширение сосудов — гипоксия ткани — диапедезные кровоизлияния — распад эритроцитов — образование сидеорофагов — гемосидероз — нарастание гипоксии — склероз сосудов — капиллярно-паренхиматозный блок пневмосклероз. Исход: пневмосклероз, правожелудочковая СН.
Этиология: патология сердца, ведущая хронической СН: ИМ + кардиосклероз = ИБС, ГБ, хронический миокардит, кардиомиопатии, митральные пороки сердца. Классификация венозного полнокровия: общее венозное полнокровие (острое и хроническое), местное венозное полнокровие. Морфогенез: застой в малом круге кровообращения — гипертензия — гипертрофия стенки сосудов — расширение сосудов — гипоксия ткани — диапедезные кровоизлияния — распад эритроцитов — образование сидеорофагов — гемосидероз — нарастание гипоксии — склероз сосудов — капиллярно-паренхиматозный блок пневмосклероз. Исход: пневмосклероз, правожелудочковая СН.
Жировая эмболия сосудов легкого Описание: в расширенных сосудах выявляется скопление жира. Этиология: разможжение подкожной жировой клетчатки, перелом или огнестрельные ранения трубчатых костей. Классификация эмболий: тромбоэмболия, воздушная, газовая, инородными телами, жировая, микробная, тканевая. Исход: омыление и рассасывание жиров, острая и легочная и сердечная пневмония, смерть. Осложнения: пневмония.
Осложнения: пневмония.
Крупозная пневмония Описание: утолщение межальвеолярных перегородок, склероз, экссудат и фибрин в просвете альвеол, колонии микроорганизмов. Этиология: пневмококк, диплобацилла Фридлендера. Классификация: центральная, мигрирующая, фриндлиндеровская. Стадии: прилива, красного и серого опеченения, разрешения. Возможно отсутствие стадии серого опеченения, прилива, стадия серого опеченения может предшествовать стадии красного опеченения. Исход: легочные осложнения: гангрена, абсцесс, карнификация, внелегочные осложнения: перитонит, перикардит, миокардит, гнойный артрит, гнойный менингит.
Пневмосклероз с бронхоэктазами Описание: просвет бронха расширен, лейкоцитарная инфильтрация, полнокровие сосудов, склероз легочной и перибронхиальной ткани. Классификация: врожденные и приобретенные бронхоэктазы. Этиология: хронический бронхит, эмфизема легких, бронхиальная астма, пороки и болезни сердца. Осложнения: гипертрофия ПЖ — легочное сердце, ПЖН, амилоидоз.
Бронхопневмония при гриппе Описание: геморрагический экссудат, белковые массы в просвете альвеол, лейкоцитарная инфильтрация, явления панбронхита. Этиология: РНК-содержащий вирус гриппа — одна из форм: А1, А2, В, С. Переносчики: домашние животные, грызуны, лошади, свиньи. Передача: воздушно-капельно, перорально Инкубационный период: до 2 суток Формы гриппа: легкая, средней тяжести, тяжелая. Осложнения: неврит, радикулит, миокардит, энцефалит, плеврит, медиастенит, серозный менингит, пиелонефрит, дистрофия и некроз почечных канальцев.
Этиология: РНК-содержащий вирус гриппа — одна из форм: А1, А2, В, С. Переносчики: домашние животные, грызуны, лошади, свиньи. Передача: воздушно-капельно, перорально Инкубационный период: до 2 суток Формы гриппа: легкая, средней тяжести, тяжелая. Осложнения: неврит, радикулит, миокардит, энцефалит, плеврит, медиастенит, серозный менингит, пиелонефрит, дистрофия и некроз почечных канальцев.
lkt
lkt
Желудочно-кишечный тракт
Хроническое венозное полнокровие печени — мускатная печень Описание: сосуды полнокровны, гепатоциты атрофичны, разрушены, пространство Диссе расширено, балочное строение сохранено, разрастание соединительной ткани, гепатоциты периферии долек гипертрофированы, разрушение начинается от центра. Этиология: сердечная недостаточность. Классификация венозного полнокровия: общее венозное полнокровие (острое и хроническое), местное венозное полнокровие. Исход: цирроз печени, асцит, пищеводные кровотечения, другие болезни ЖКТ.
Жировой гепатоз Описание: на периферии дольки большие скопление жира, в центре его концентрация ниже. Этиология: токсические воздействия, гипоксия (СН, ЛН, анемия), нарушение питания, эндокринно-метаболические нарушения. Классификация гепатозов: наследственные (в связи с: липоидозы, гликогенозы, пигментный гепатоз, гемохроматоз), приобретенные (острый — токсическая дистрофия печени и хронический — жировая дистрофия печени). Ожирение гепетоцитов: пылевидное, мелко- и крупноклеточное; диссеминированное, зональное, диффузное; перипортально, центролабулярно. Стадии: простое ожирение, ожирение в сочетании с деструкцией гепатоцитов и мезенхимально-клеточной реакцией, ожирение с начинающейся перестройкой дольковой структуры печени. Исход: образование жировых кист, цирроз печени, желтуха, асцит, СН.
Этиология: токсические воздействия, гипоксия (СН, ЛН, анемия), нарушение питания, эндокринно-метаболические нарушения. Классификация гепатозов: наследственные (в связи с: липоидозы, гликогенозы, пигментный гепатоз, гемохроматоз), приобретенные (острый — токсическая дистрофия печени и хронический — жировая дистрофия печени). Ожирение гепетоцитов: пылевидное, мелко- и крупноклеточное; диссеминированное, зональное, диффузное; перипортально, центролабулярно. Стадии: простое ожирение, ожирение в сочетании с деструкцией гепатоцитов и мезенхимально-клеточной реакцией, ожирение с начинающейся перестройкой дольковой структуры печени. Исход: образование жировых кист, цирроз печени, желтуха, асцит, СН.
Портальный цирроз печени Описание: разрастание соединительной ткани вдоль тракта, клеточная инфильтрация, узел-регенерат, вакуоли, очаги некроза. Этиология: алкоголизм, пищевой дисбаланс, хронический венозный застой в печени, инфекция — гепатит. Классификация: портальный, постнекротический, билиарный, смешанный. Осложнения: гепатоцеллюлярная недостаточность, желтуха, геморрагический синдром, асцит, спленомегалия, иммунокомплексный гломерулонефрит, тромбоз воротной вены, рак печени, печеночная кома.
Осложнения: гепатоцеллюлярная недостаточность, желтуха, геморрагический синдром, асцит, спленомегалия, иммунокомплексный гломерулонефрит, тромбоз воротной вены, рак печени, печеночная кома.
Туберкулезная гранулема в печени Описание и состав туберкулемы: творожистый некроз, лимфоциты, эпителиоидный клетки, лимфоциты, клетки Пирогова-Лангханса. Путь передачи туберкулеза: аэрогенный, контактный, алиментарный. Этиология: человеческая и бычья микобактерия. Классификация: первичный, гематогенный (генерализованый, с преимущественным поражением легких, с преимущественными внелегочными поражениями), вторичный (острый очаговый, фиброзно-очаговый, инфильтративный, туберкулема, казеозная пневмония, острый кавернозный туберкулез, фиброзно-кавернозный, цирротический). Исход: бугорки заживают или летальный исход. Осложнения туберкулеза: менингит, плеврит, перитонит, абсцессы и свщи мягких тканей, эмпиема плевры, пневмоторакс, амилоидоз. Смерть: Л-СН, кровотечения, амилоидоз, осложения послеоперационного периода.
Хроническая язва желудка в стадии обострения Описание: лейкоцитарно-некротический вал, фибриноидный некроз, воспалительная инфильтрация, грануляционная ткань, рубцовая ткань. Этиология: химические вещества, болезни ЦНС (гипоксия, кровоизлияния), заболевания легких, инфекция — коликобактерия палочка или кокки, эзофагогастроскопия — перенос инфекта, острая пища. Периоды: ремиссии, обострения. Осложнения: кровотечения, перфорация, пенитрация, малигнизация, комбинированные осложнения.
Флегманозный аппендицит Описание: мышечные элементы, просвет, адипоциты, соединительная ткань, воспалительная инфильтрация, мезентериолит. Этиология: дистрофия нервных сплетений, спазм мышечной оболочки, аутоинфекция. Формы: катаральный (острый), флегмонозный, гангренозный (первичный и вторичный), ложный. Классификация: острый и хронический. Осложнения: перфорация. Перитонит, эмпиема отростка, перитифлит, периаппендицит, пилефлебетический абсцесс в связи с пилефлебитом вследствие гнойного тромбофлебита сосудов брыжейки. Исход: водянка отростка при хрониечкой форме.
Исход: водянка отростка при хрониечкой форме.
Мозговидное набухание с некрозом пейеровых бляшек при брюшном тифе Описание: некроз, брюшнотифозные клетки, единичные лимфоциты, полнокровные сосуды. Этиология: брюшнотифозная палочка, способствующий фактор — длительная инсоляция. Передача: водный, алиментарный, парентерально. Инкубационный период: 10-14 дней. Стадии: мозговидного набухания, некроза, образование язв, чистых язв, заживления язв. Осложнения (смерть больных наступает из-за осложнений): макроперфорации, перитонит, кровоизлияния, пневмония, сепсис, гнойный остеомиелит, гнойный артрит, гнойный перихондрит гортани, что связано с развитием пролежней у входа в пищевод.
lkt
lkt
Органы кроветворения
Гиалиноз сосудов селезенки Описание: утолщенны стенки сосуда ивыявляется их склероз, соединительная ткань не имеет фибриллярной структуры. Этиология: тромбоз сосудов, гипертоническая болезнь, хроническая гипокися, воспаление, склероз, некроз. Виды гиалиноза: гиалиноз сосудов, гиалиноз соединительной ткани. Классификация гиалина сосудов по строению: простой, сложный, липогиалин. Механизм развития: декомпозиция, извращенный синтез, инфильтрация, трансформация. Исход: разрыхление и рассасывание, ослизнение гиалинизированной ткани, склероз селезенки.
Классификация гиалина сосудов по строению: простой, сложный, липогиалин. Механизм развития: декомпозиция, извращенный синтез, инфильтрация, трансформация. Исход: разрыхление и рассасывание, ослизнение гиалинизированной ткани, склероз селезенки.
Центральная нервная система
Кровоизлияние в головной мозг Описание: скопление эритроцитов вокруг сосуда, ткань головного мозга. Этиология: аррозивное кровотечение (воспаление, некроз сосуда, прорастание злокачественной опухоли — данные процессы крайне редко в головном мозге), кровотечение в связи с повышением проницаемости сосуда, или диапедезное кровоизлияние (гипоксия (тромбоз, атеросклероз, спазм), артериальная гипертензия, васкулиты, гемабластозы, анемии), разрыв сосуда (травма). Классификация: наружное (эпистаксис, гемотенез, гемоптоэ, мелена, метрорагия) и внутреннее (гемоторакс, гемоперикард, гемоперитонеум) кровотечение. Классификация расстройств кровообращение: транзиторная ишемия, инсульт. Классификация инсультов: геморрагический (представлен гематомой и геморрагическим пропитыванием, субарахноидальное кровоизлияние) и ишемический (ишемический, геморрагический, смешанный). Исход: рассасывание крови, образование кисты, инкапсуляция или прорастание гематомы соединительной тканью, присоединение инфекции, нагноение, летальный исход.
Исход: рассасывание крови, образование кисты, инкапсуляция или прорастание гематомы соединительной тканью, присоединение инфекции, нагноение, летальный исход.
Гнойный менингит Описание: лейкоцитарная инфильтрация, утолщена мягкая мозговая оболочка, вакуолизация нейронов головного мозга, полнокровие сосудов. Передача: через молоко матери, парентерально, воздушно-капельным путем. Этиология: менингококк, сепсис, пневмония, как осложнение инфекционных заболеваний. Формы менингококковой инфекции: назофарингиальная, менингиальная, менингококцемия. Локализация: передние и базальные отделы головного мозга, затылочная доля. Осложнения: гнойный артрит, иридоциклит, увеит, эпендимит, пиоцефалия гидроцефалия, дислокация ствола головного мозга, НП недостаточность, бактериальный шок, ОПН — некротический нефроз. Смерть: дислокация, общая церебральная кахексия, бактериальный шок, ОПН, септикопиемия.
Спинной мозг при полиомиелите Описание: полнокровие сосудов, периваскулярная клеточная инфильтрация, пролиферация глиальных клеток вокруг погибших нейронов, вакуолизация нейронов, кариолизис, разрушение отростков нейронов. Этиология: РНК-содержащий вирус. Формы: назофарингиальная, спинномозговая, бульбарная. Стадии: препаралитическая, паралитическая, восстановления, остаточные явления. Исход: образование кист, рубцов. Осложнения: атрофия скелетных и дыхательных мышц.
Этиология: РНК-содержащий вирус. Формы: назофарингиальная, спинномозговая, бульбарная. Стадии: препаралитическая, паралитическая, восстановления, остаточные явления. Исход: образование кист, рубцов. Осложнения: атрофия скелетных и дыхательных мышц.
Болезни крови
Атрофия слизистой оболочки при анемии Аддисона-Бирмера Описание: слизистая оболочка истончена, единичные железистые структуры, подслизистый слой инфильтрирован лимфоидными клетками. Этиология: наследственная неполноценность фундальных желез желудка, аутоиммунные процессы, недостаток витамина В12 в пище, резекция желудка, болезни печени, глистная инвазия. Осложнения: фуникулярный миелоз, атрофия слизистой, гемосидероз печени, гунтеровский глоссит, общий гемосидероз.
Мочеполовая система
Эмболический гнойный нефрит Описание: бактериальные эмболы, сосуды расширены и полнокровны. Этиология: гнойная инфекция, сопровождающаяся сепсисом. Классификация сепсиса: септицемия, септикопиемия, септический эндокардит, хроносепсис. Осложнения: тромбоэмболия, общая атрофия, эксикоз, пороки сердца.
Осложнения: тромбоэмболия, общая атрофия, эксикоз, пороки сердца.
Некротический нефроз Описание: некроз эпителия извитых канальцев, просвет сужен, ядро смещено к базолатеральной мембране. Этиология: интоксикация, инфекция, заболевание самих почек (амилоидоз, гломерулонефрит), эксикоз, синдром сдавления, массивные ожоги, обесхлоривание, заболевания печени. Стадии: начальная — шоковая, олигурическая, восстановления диуреза. Осложнения: сегментарный и тотальный некроз коркового вещества почек. Исход: уремия — смерть, выздоровление.
Аборт в соскобе Описание: децидуальная ткань, ворсины хориона. Классификация: ранний аборт — до 14 недель, поздний аборт — 14-28, преждевременные роды — 28-29. Естественный аборт, искусственный аборт. Осложнения: сепсис, инфекция половых путей, перитонит.
lkt
lkt
Опухоли
Фиброма Описание: пучки соединительной ткани, имеющие различную толщину и неправильный ход волокон, хорошо отграничена от окружающих тканей — имеет капсулу. Происхождение: соединительная ткань. Рост: экспансивный. Классификация: по консистенции: мягкая и плотная. Разновидности: десмоид, дерматофиброма (гистиоцитома).
Рост: экспансивный. Классификация: по консистенции: мягкая и плотная. Разновидности: десмоид, дерматофиброма (гистиоцитома).
Недифференцированная фибросаркома Описание: клетки эпителиоидного типа, круглые, веретенообразные, гигантские многоядерные. Все клетки различной величены. Локализация: бедро, плечо. Классификация: дифференцированная фибросаркома, недифференцированная фибросаркома. По строению: клеточно-волокнистая саркома, клеточная саркома, неклассифицируемая опухоль. Осложнения: метастазы, наиболее злокачественна клеточная саркома.
Плоскоклеточный рак с ороговением Описание: скопление опухолевых клеток, с ороговением в центре узла — раковая жемчужина. Классификация плоскоклеточного рака: с ороговением (ороговивающий) и без ороговения (неороговивающий). Локализация: кожа, слизистая пищевода, шейки матки, влагалище.
Аденокарцинома легких Описание: клетки различной формы и велечины, перстневидные клетки, образование железистых структур. Классификация: высоко-, умеренно-, низкодифференцированная формы. Осложнения: лимфогенные метастазы (лимфатические узлы, головной мозг, печень, кости — особенно позвоночник, НП. Гематогенные метастазы. Обтурационный ателектаз, некроз опухоли — кровотечение, нагноение, образование полостей. Смерть: от кахексии, вторичных легочных осложнений.
Осложнения: лимфогенные метастазы (лимфатические узлы, головной мозг, печень, кости — особенно позвоночник, НП. Гематогенные метастазы. Обтурационный ателектаз, некроз опухоли — кровотечение, нагноение, образование полостей. Смерть: от кахексии, вторичных легочных осложнений.
Аденокарцинома матки Описание: отсутствует базальная мембрана, выражен атипизм клеток, формируются железисто-подобные структуры, ядра темные — гиперхромированы, раковые клетки лишены микроворсинок. Классификация: умеренно-, высок-, низкодифференцированная формы. Осложнения: метастазы в лимфатические узлы таза, гематогенные — редко.
Печень при хроническом лимфолейкозе Описание: гепатоциты в состоянии белковой и жировой дистрофии, лимфоцитарная инфильтрация по ходу портальных трактов. Классификация хронических лейкозов лимфоцитарного происхождения: хронический лимфолейкоз с болезнью Сезари и парапротеинемические лейкозы.
Кавернозная гемангиома печени Описание: сосудистые крови, заполненные кровью, соединительнотканная капсула, ткань печени. Классификация: капиллярная гемангиома (кожа, слизистые, ЖКТ, печень), венозная, кавернозная (печень, кожа, губчатые кости, мышцы, ЖКТ, мозг), доброкачественная гемангиоперицитома (кожа, межмышечные прослойки конечностей), гломусная опухоль (кожа кистей рук и стоп).
Классификация: капиллярная гемангиома (кожа, слизистые, ЖКТ, печень), венозная, кавернозная (печень, кожа, губчатые кости, мышцы, ЖКТ, мозг), доброкачественная гемангиоперицитома (кожа, межмышечные прослойки конечностей), гломусная опухоль (кожа кистей рук и стоп).
Аденокарцинома желудка Описание: нормальные железы слизистой оболочки, железы опухоли, прорастающие стенку желудка, множественные митозы, перстневидные клетки. Классификация: тубулярная, папиллярная, муцинозная. Каждая из разновидностей делится на дифференцированную, малодифференцированную, и умеренно дифференцированную формы Осложнения: гематогенные, лимфогенные (ретроградный и ортоградный путь) метастазы. Клиника метастазов: вирховская железа, крукенберовский рак яичников, карциноматоз брюшины — вследствие имплантационный путь метастазирования канкрозный перитонит. Гематогенные метастазы — в печень, карциноматоз плевры и легких. Возможна: перфорация, кровотечение, перитуморозное воспаление, флегмона желудка, желтуха, асцит, паралитический илеус, стеноз привратника, плеврит, эмпиема плевры. Исход: кахексия, смерть.
Исход: кахексия, смерть.
Почечно-клеточный рак Описание: состоит из железисто-подобных структур, клеток различной величины и формы с темными ядрами и пенистой цитоплазмой, опухоль инкапсулирована. Классификация: светлоклеточный, зернисто-клеточный, железистый, саркомоподобный, смешанно-клеточный. Осложнения: метастазы в головной мозг, печень, контралатеральную почку, легкий.
Папиллома Описание: соединительно-тканный сосочек, покрытый многослойным плоским эпителием, полярность и комплексность расположения клеток сохранена. Локализация: полость рта, гортань, мочевой пузырь, кожа, мочеточник, истинные голосовые связки. Осложнения: кровотечение. Исход: рецидивирование после удаления, малигнизация, разрушение при легкой травме.
Тестовые задания на различение — Логика
1. Укажите двепричины общей артериальной гиперемии: а) воспаление, б) плетора, в) затруднение кровотока по магистральной артерии, г) эритремия, д) образование соустья между артерией и веной.
2. Укажите двепричины артериальной ангионевротической гиперемии: а) воспаление, б) уменьшение барометрического давления, в) раздражение сосудорасширяющих нервов, г) затруднение кровотока по магистральной артерии, д) паралич сосудосуживающих нервов.
3. Укажите артериальную гиперемию, которая сочетается с газовой эмболией: а) ангионевротическая, б) вакатная, в) постишемическая, г) коллатеральная, д) гиперемия при наличии артериовенозного шунта.
4. Укажите основную причину венозного полнокровия: а) уменьшение притока крови, б) затруднение оттока крови, в) усиление притока крови, г) увеличение оттока крови, д) остановка кровотока.
5. Укажите основной фактор морфогенеза изменений органов и тканей при остром венозном полнокровии: а) повышение рН тканевой среды, б) недостаток углекислоты, в) острая гипоксия ткани, г) снижение проницаемости сосудов микроциркуляторного русла, д) ослабление апоптоза.
6. Выберите триструктурных изменения при остром венозном полнокровии: а) некроз клеток паренхиматозных органов, б) стазы в капиллярах, в) диапедезные кровоизлияния, г) склероз стромы органов, д) атрофия органов, е) капиллярно-паренхиматозный блок.
7. Укажите причину острого венозного застоя преимущественно в системе малого круга кровообращения: а) инфаркт миокарда левого желудочка, б) декомпенсированный стеноз трёхстворчатого клапана, в) тромбоэмболия лёгочной артерии, г) сжатие устьев полых вен опухолью средостения, д) облитерирующий тромбоз печёночных вен.
8. Укажите причину острого венозного застоя преимущественно в системе большого круга кровообращения: а) тромбоэмболия лёгочной артерии, б) декомпенсированный митральный стеноз, в) декомпенсированный стеноз устья аорты, г) инфаркт миокарда левого желудочка, д) сдавление лёгочных вен опухолью средостения.
9. Выберите три процесса, являющихся непосредственным следствием повышения сосудистой проницаемости при остром и хроническом венозном полнокровии: а) некроз клеток паренхиматозных органов, б) склероз стромы органов, в) плазморрагия, г) отёк, д) расширение вен и капилляров, е) диапедезные кровоизлияния.
10. Выберите три характеристики капиллярно-паренхиматозного блока при хроническом венозном полнокровии: а) уменьшение числа функционирующих капилляров, б) накопление триглицеридов в клетках паренхимы, в) снижение сосудистой проницаемости, г) развитие острой ишемии тканей, д) преобразование истинных капилляров в ёмкостные, е) шунтирование артериальной крови в венозную систему.
11. Определите дваизменения органов, которые наблюдаются при хроническом венозном полнокровии: а) увеличение размеров, б) уменьшение размеров, в) дряблая консистенция, г) плотная консистенция, д) глинистый вид на разрезе.
12. Укажите два основных адаптивных процесса, которые развиваются в сосудистом русле лёгких при гипертензии малого круга кровообращения: а) рефлекторное расширение артериол и венул, б) рефлекторное сужение артериол и венул, в) гипертрофия мышечно-эластических структур мелких ветвей лёгочных артерий и вен, г) склероз стенок мелких ветвей лёгочных артерий и вен, д) переполнение кровью капилляров межальвеолярных перегородок.
13. Укажите причину бурого цвета лёгких при хроническом венозном полнокровии: а) миоэластофиброз сосудов мышечного типа, б) накопление гемосидерина, в) воспалительная гиперемия, г) капиллярно-паренхиматозный блок, д) пневмосклероз.
14. Укажите причину индурации лёгких при хроническом венозном полнокровии: а) накопление в альвеолах сидерофагов, б) разрастание соединительной ткани в межальвеолярных перегородках, в) организация фибрина в альвеолах, г) отложение в межальвеолярных перегородках угольных частиц, д) экстраваскулярный гемолиз.
15. Определите три характеристики «клеток сердечных пороков»: а) образуются при отёке лёгких, б) образуются при бурой индурации лёгких, в) не характерны для декомпенсированного митрального стеноза, г) обусловливают ржавый цвет мокроты, д) представлены разрушенными эритроцитами, е) представлены макрофагами, заполненными гемосидерином.
16. Назовите двасиндрома, для которых характерно развитие мускатной печени: а) синдром хронической сердечно-сосудистой недостаточности, б) синдром диссеминированного внутрисосудистого свёртывания, в) геморрагический синдром, г) синдром Криглера – Найяра, д) синдром Бадда – Киари.
17. Укажите три процесса, которые развиваются в печени при хроническом венозном полнокровии: а) гиперемия центральных вен, б) гиперемия сосудов портальных трактов, в) атрофия гепатоцитов в центре печёночных долек, г) гипертрофия гепатоцитов в центре печёночных долек, д) жировая дистрофия гепатоцитов в центре печёночных долек, е) жировая дистрофия гепатоцитов на периферии печёночных долек.
18. Укажите два вида гиперемии, которые развиваются в печени при хроническом венозном полнокровии: а) гиперемия центральных вен, б) гиперемия синусоидов в центре долек, в) гиперемия синусоидов на периферии долек, г) гиперемия ветвей воротной вены, д) гиперемия ветвей печёночной артерии.
19. Укажите двафактора, которыми обусловлен пёстрый вид печени при хроническом венозном полнокровии: а) гиперемия в центре печёночных долек, б) атрофия гепатоцитов в центре печёночных долек, в) жировая дистрофия гепатоцитов на периферии печёночных долек, г) разрастание соединительной ткани в центре печёночных долек, д) капиллярно-паренхиматозный блок.
20. Укажите заболевание, для которого характерен симптом «головы медузы»: а) ишемическая болезнь сердца, б) язвенная болезнь желудка, в) тромбоцитопеническая пурпура, г) кессонная болезнь, д) цирроз печени.
21. Укажите двепричины разрыва вен пищевода при портальной гипертензии: а) варикозное расширение вен круглой связки печени, б) варикозное расширение вен пищевода и кардиального отдела желудка, в) венозное полнокровие в системе верхней полой вены, г) венозное полнокровие в системе воротной вены, д) цианотическая индурация селезёнки.
22. Определите три верных утверждения в отношении аррозивного кровотечения: а) haemorrhagia per diapedesin, б) haemorrhagia per diabrosin, в) возникает в результате разрыва стенки сердца или сосуда, г) возникает в результате разъедания стенки сосуда, д) может развиваться в очагах гнойного воспаления, е) развивается в головном мозге при артериальной гипертензии.
23. Определите триверных утверждения в отношении гематомы: а) пример наружного кровотечения, б) пример внутреннего кровотечения, в) haemorrhagia per rhexin, г) haemorrhagia per diapedesin, д) сопровождается нарушением целостности ткани, е) не сопровождается образованием полости.
24. Определите три возможных исхода гематомы: а) образование «ржавой» кисты, б) васкуляризация, в) инкапсуляция, г) мелкоочаговый глиоз, д) нагноение, е) гангрена.
25. Выберите трипроцесса, характеризующих стаз крови: а) агглютинация эритроцитов,б) гемолиз эритроцитов, в) изменение реологических свойств крови, г) лейкодиапедез, д) остановка кровотока, е) свёртывание крови.
26. Выберите три процесса, способствующих развитию внутрикапиллярной агрегации эритроцитов при стазе: а) плазморрагия, б) некроз ткани, в) снижение грубодисперсных фракций белков крови, в) увеличение поверхностного потенциала эритроцитов, г) дисциркуляторные расстройства, д) нарушения иннервации микроциркуляторного русла.
27. Укажите двепричины образования тромбов в мелких сосудах при стазе: а) деформация стенок сосудов, б) нарушения осевого слоя кровотока, в) накопление активированных факторов коагуляции, г) подавление агрегации тромбоцитов, д) активация фибринолиза.
28. Определите триверных утверждения в отношении сладж-феномена: а) является разновидностью стаза, б) является разновидностью тромбоза, в) сладж-феномен всегда обратим, г) возникает исключительно в сосудах микроциркуляторного русла, д) основной признак – агрегация эритроцитов, лейкоцитов и тромбоцитов, е) развивается со снижения отрицательного заряда форменных элементов крови.
Схема 13. Морфогенез хронической сердечно-сосудистой недостаточности
в плевральной — гидроторакс, в полости перикарда — гидроперикард, в брюшной — асцит (обычно при наличии застойного мускатного фиброза печени).
Органы при хроническом венозном полнокровии увеличиваются в объеме, становятся синюшными вследствие повышенного содержания восстановленного гемоглобина, плотными из-за сопутствующего нарушения лимфообращения и отека, а позже в связи с разрастанием соединительной ткани.
Изменения в органах при хроническом венозном полнокровии, несмотря на ряд общих черт (застойная индурация), имеют ряд особенностей.
Кожа,особенно нижних конечностей, становится холодной и приобретает синюшную окраску (цианоз). Вены кожи и подкожной основы расширены, переполнены кровью; также расширены и переполнены лимфой лимфатические сосуды. Выражены отек дермы и подкожной основы, разрастание в коже соединительной ткани. В связи с венозным застоем, отеком и склерозом в коже легко возникают воспалительные процессы и изъязвления, которые длительное время не заживают.
В слизистых оболочкахвенозная гиперемия сопровождается цианозом, а также повышенной продукцией слизи с Развитием катарального воспаления (застойный катар).
Печеньпри хроническом венозном застое увеличена, плотная, ее края закруглены, поверхность разреза пестрая, серо-желтая с темно-красным крапом и напоминает мускатный орех, поэтому такую печень называют мускатной. При микроскопическом исследовании видно, что полнокровны лишь центральные отделы долек, где отмечаются кровоизлияния, дискомплексация печеночных балок и гибель гепатоцитов; эти отделы на разрезе печени выглядят темно-красными. На периферии долек гепатоциты находятся в состоянии жировой дистрофии, чем объясняется серо-желтый цвет печеночной ткани.
Хроническое венозное полнокровие печени сопровождается веноартериальной реакцией — гипертрофией мелких ветвей печеночных артерий, имеющих узкий просвет вследствие гипертрофии циркулярного и продольного внутреннего мышечных слоев. В дальнейшем стенки сосудов склерозируются.
Морфогенез изменений печени при длительном венозном застое сложен. Избирательное полнокровие центра долек обусловлено тем, что застой печени охватывает прежде всего печеночные вены, распространяясь на собирательные и центральные вены, а затем и на синусоиды. Последние расширяются, но только в центральных и средних отделах дольки, где встречают сопротивление со стороны впадающих в синусоиды капиллярных разветвлений печеночной артерии, давление в которых выше, чем в синусоидах. По мере нарастания полнокровия в центре долек появляются кровоизлияния, гепатоциты здесь подвергаются дистрофии, некрозу и атрофии. Гепатоциты периферии долек компенсаторно гипертрофируются и приобретают сходство с центролобулярными. Разрастание соединительной ткани в зоне кровоизлияний и гибели гепатоцитов связано с пролиферацией клеток синусоидов — липоцитов, которые могут выступать в роли фибробластов, а вблизи центральных и собирательных вен — с пролиферацией фибробластов адвентиции этих вен. В результате разрастания соединительной ткани в синусоидах появляется непрерывная базальная мембрана (в нормальной печени она отсутствует), т.е. происходит капилляризация синусоидов, возникает капиллярно-паренхиматозный блок, который, усугубляя гипоксию, ведет к прогрессированию атрофических и склеротических изменений в печени.
Последние расширяются, но только в центральных и средних отделах дольки, где встречают сопротивление со стороны впадающих в синусоиды капиллярных разветвлений печеночной артерии, давление в которых выше, чем в синусоидах. По мере нарастания полнокровия в центре долек появляются кровоизлияния, гепатоциты здесь подвергаются дистрофии, некрозу и атрофии. Гепатоциты периферии долек компенсаторно гипертрофируются и приобретают сходство с центролобулярными. Разрастание соединительной ткани в зоне кровоизлияний и гибели гепатоцитов связано с пролиферацией клеток синусоидов — липоцитов, которые могут выступать в роли фибробластов, а вблизи центральных и собирательных вен — с пролиферацией фибробластов адвентиции этих вен. В результате разрастания соединительной ткани в синусоидах появляется непрерывная базальная мембрана (в нормальной печени она отсутствует), т.е. происходит капилляризация синусоидов, возникает капиллярно-паренхиматозный блок, который, усугубляя гипоксию, ведет к прогрессированию атрофических и склеротических изменений в печени. Этому способствует также шунтирование крови, развивающееся при склерозе стенок и обтурации просветов многих центральных и собирательных вен, а также нарастающий застой лимфы. В финале развивается застойный фиброз (склероз) печени, который называют также мускатным, или кардиальным, поскольку развивается он при хронической сердечно-сосудистой недостаточности. При прогрессирующем разрастании соединительной ткани в редких случаях возникает перестройка и деформация органа — развивается застойный (мускатный) цирроз печени, который называют также сердечным.
Этому способствует также шунтирование крови, развивающееся при склерозе стенок и обтурации просветов многих центральных и собирательных вен, а также нарастающий застой лимфы. В финале развивается застойный фиброз (склероз) печени, который называют также мускатным, или кардиальным, поскольку развивается он при хронической сердечно-сосудистой недостаточности. При прогрессирующем разрастании соединительной ткани в редких случаях возникает перестройка и деформация органа — развивается застойный (мускатный) цирроз печени, который называют также сердечным.
Почкипри хроническом общем венозном застое становятся большими, плотными и цианотичными — цианотическая индурация почек. Особенно полнокровны вены мозгового вещества и юкстамедуллярной зоны. При хроническом венозном полнокровии почек рано набухает основное вещество мозгового слоя вследствие реакции полисахаридов, содержащихся здесь в большом количестве. Полнокровие почечных клубочков развивается позже, чем наступают изменения в мозговом веществе, так как вступает в силу веноартериальная реакция, сопровождающаяся при длительной гиперемии гипертрофией артерий коркового вещества. Лишь развитие склероза мышечной оболочки этих артерий сопровождается расширением их просвета и капилляров почечных клубочков. На этой стадии возможны огрубение базальной мембраны капилляров и их склероз, приводящие к умеренной протеинурии. На фоне венозного застоя развивается лимфо-стаз. В условиях нарастающей гипоксии возникает дистрофия нефроцитов главных отделов нефрона и склероз стромы, который, однако, не бывает резко выраженным. Снижение сердечного выброса (ударного объема) приводит к уменьшению почечного кровотока, к спазму сосудов коркового вещества, что, с одной стороны, стимулирует ренин-ангиотензиновую систему, а с другой, усиливает ишемические повреждения канальцевого эпителия.
Лишь развитие склероза мышечной оболочки этих артерий сопровождается расширением их просвета и капилляров почечных клубочков. На этой стадии возможны огрубение базальной мембраны капилляров и их склероз, приводящие к умеренной протеинурии. На фоне венозного застоя развивается лимфо-стаз. В условиях нарастающей гипоксии возникает дистрофия нефроцитов главных отделов нефрона и склероз стромы, который, однако, не бывает резко выраженным. Снижение сердечного выброса (ударного объема) приводит к уменьшению почечного кровотока, к спазму сосудов коркового вещества, что, с одной стороны, стимулирует ренин-ангиотензиновую систему, а с другой, усиливает ишемические повреждения канальцевого эпителия.
В селезенкехронический венозный застой также ведет к ее цианотической индурации. Селезенка увеличена, плотна, темно-вишневого цвета; отмечаются атрофия фолликулов и склероз пульпы. При хроническом венозном полнокровии в условиях портальной гипертензии (при развитии мускатного фиброза печени) масса селезенки может превышать 500 г (спленомегалия). До развития асцита, т.е. в стадии компенсации, строма пульпы аргирофильна, выражена гипертрофия мышечной оболочки селезеночных и трабекулярных артерий. В фазе декомпенсации отмечается фиброз стромы пульпы и стенок указанных сосудов, особенно кисточковых артерий, который следует дифференцировать от возрастного гиалиноза.
До развития асцита, т.е. в стадии компенсации, строма пульпы аргирофильна, выражена гипертрофия мышечной оболочки селезеночных и трабекулярных артерий. В фазе декомпенсации отмечается фиброз стромы пульпы и стенок указанных сосудов, особенно кисточковых артерий, который следует дифференцировать от возрастного гиалиноза.
В легкихпри хроническом венозном полнокровии развиваются два вида изменений — множественные диапедезные кровоизлияния, обусловливающие гемосидероз легких, и разрастание соединительной ткани, т.е. склероз. Легкие становятся большими, бурыми и плотными — бурая индурация (уплотнение) легких.
В морфогенезе бурого уплотнения легких основную роль играют застойное полнокровие и гипертензия в малом круге кровообращения. Бурая индурация легких развивается лишь в исходе сосудистой декомпенсации нарушенного оттока по легочным венам. Ей предшествует длительная стадия адаптивной перестройки мелких ветвей легочной артерии и вен, выражающаяся в картине посткапиллярной гипертензии в малом круге. При этом развивается резкая гипертрофия мышечной оболочки внутри-дольковых вен, просвет их суживается, что предохраняет капилляры легких от регургитации крови. Гипертрофия мелких ветвей легочной артерии достигает максимума лишь при давлении в системе легочной артерии, в 3 раза превышающем нормальное. В этот период происходит перестройка по типу замыкающих сосудов, что приводит к еще большему сужению просвета. Со временем адаптивные изменения сосудов легких сменяются склеротическими, развивается декомпенсация легочного кровообращения, капилляры межальвеолярных перегородок переполняются кровью. Нарастает гипоксия ткани, в связи с чем повышается сосудистая проницаемость, возникают множественные диапедезные кровоизлияния. В альвеолах, бронхах, межальвеолярных перегородках, лимфатических сосудах и узлах легких появляются скопления нагруженных гемосидерином клеток — сидеробластов и сидерофагов, и свободнолежащего гемосидерина. Возникает диффузный гемосидероз легких. Гемосидерин и белки плазмы «засоряют» строму и лимфатические дренажи легких, что ведет к резорбционной недостаточности их лимфатической системы, которая сменяется механической.
При этом развивается резкая гипертрофия мышечной оболочки внутри-дольковых вен, просвет их суживается, что предохраняет капилляры легких от регургитации крови. Гипертрофия мелких ветвей легочной артерии достигает максимума лишь при давлении в системе легочной артерии, в 3 раза превышающем нормальное. В этот период происходит перестройка по типу замыкающих сосудов, что приводит к еще большему сужению просвета. Со временем адаптивные изменения сосудов легких сменяются склеротическими, развивается декомпенсация легочного кровообращения, капилляры межальвеолярных перегородок переполняются кровью. Нарастает гипоксия ткани, в связи с чем повышается сосудистая проницаемость, возникают множественные диапедезные кровоизлияния. В альвеолах, бронхах, межальвеолярных перегородках, лимфатических сосудах и узлах легких появляются скопления нагруженных гемосидерином клеток — сидеробластов и сидерофагов, и свободнолежащего гемосидерина. Возникает диффузный гемосидероз легких. Гемосидерин и белки плазмы «засоряют» строму и лимфатические дренажи легких, что ведет к резорбционной недостаточности их лимфатической системы, которая сменяется механической. Склероз кровеносных сосудов и недостаточность лимфатической системы усиливают легочную гипоксию, которая становится причиной пролиферации фибробластов, утолщения межальвеолярных перегородок. Возникает капиллярно-паренхиматозный блок, замыкающий порочный круг в морфогенезе индурации легких, развивается застойный фиброз легких. Он более значителен в нижних отделах легких, где сильнее выражен венозный застой и больше скоплений кровяных пигментов (гемосидерина), фибрина. Пневмосклероз, как и гемосидероз, при буром уплотнении легких имеет каудоапикальное распространение и зависит от степени и длительности j венозного застоя в легких.
Склероз кровеносных сосудов и недостаточность лимфатической системы усиливают легочную гипоксию, которая становится причиной пролиферации фибробластов, утолщения межальвеолярных перегородок. Возникает капиллярно-паренхиматозный блок, замыкающий порочный круг в морфогенезе индурации легких, развивается застойный фиброз легких. Он более значителен в нижних отделах легких, где сильнее выражен венозный застой и больше скоплений кровяных пигментов (гемосидерина), фибрина. Пневмосклероз, как и гемосидероз, при буром уплотнении легких имеет каудоапикальное распространение и зависит от степени и длительности j венозного застоя в легких.
Лекция 11
Расстройства кровообращения. Гиперемия — полнокровие. Застой. Ишемия
- Подробности
Общие характеристики нарушений крообращения:
1) нарушения кровообращения нельзя рассматривать в отрыве от нарушений лимфообращения и состояния системы крови, так как структурно и функционально эти системы связаны
2) нарушения крово- и лимфообращения ведут к нарушению тканевого и клеточного метаболизма, а значит, повреждению структуры клетки, развитию дистрофии или некроза.
Расстройства крово- и лимфообращения возникают не только в результате нарушения работы кровеносной и лимфатической системы, но и нейрогуморальной регуляции работы сердца, структурного полома на любом уровне – сердце, кровеносные сосуды, микроциркуляторное русло, лимфатические сосуды, грудной проток. При расстройстве регуляции деятельности сердца, развитии в нем патологического процесса возникают общие, а при расстройстве регуляции функции сосудистого русла на том или ином участке, как и структурном поломе его, — местные нарушения крово- и лимфообращения.
1. Полнокровие (гиперемия). Артериальное полнокровие.
Повышенное кровенаполнение органа, ткани вследствие увеличенного притока артериальной крови. Может иметь :
а) общий характер, что наблюдается при:
— увеличении объема циркулирующей крови (плетора)
— увеличении числа эритроцитов. (эритремия)
В таких случаях отмечается окраска кожных покровов красного цвета, повышается АД
б) местный характер
Различают:
— физиологическую гиперемию
Возникает при действии адекватных доз физических и химических факторов, при чувстве стыда и гнева (рефлекторные гиперемии), при усилении функции органов (рабочая гиперемия).
— патологическую гиперемию
Исходя из особенностей этиологии и механизма развития, различают:
1) ангионевротическую гиперемиюНаблюдается как следствие раздражения сосудорасширяющих нервов или паралича сосудосуживающих нервов.
Кожа и слизистые становятся красными, припухшими, теплыми. Этот вид гиперемии может возникать н определенных участках тела при нарушении иннервации, на коже и слизистых при некоторых инфекциях, сопровождающимся поражением узлом симпатической нервной системы.
Обычно быстро проходит, не оставляет следов.
2) коллатеральную гиперемиюВозникает в связи с затруднением кровотока по магистральному артериальному стволу, закрытому тромбом или эмболом. Кровь устремляется по коллатеральным сосудам. Просвет рефлекторно расширяется, приток артериальной крови усиливается и ткань получается увеличенное количество крови.
Коллатеральная гиперемия является, по существу, компенсаторной, обеспечивая кровообращение при закрытии артериального ствола.
Развивается в тех случаях, когда фактор, ведущий к сдавлению артерии и малокровию (опухоль, скопление жидкости в полости, жгут), быстро устраняется. Сосуды ранее обескровленной ткани резко расширяются и переполняются кровью, что может привести не только к их разрыву и кровоизлиянию, но и к малокровию других органов, например, головного мозга, в связи с резким перераспределением крови.
4) вакатная гиперемияРазвивается в связи с уменьшением барометрического давления. Она может быть общей (например, у водолазов и кессонных рабочих при быстром подъеме из области повышенного давления).Возникающая при этом гиперемия сочетается с газовой эмболией, тромбозом сосудов и кровоизлияниями.
Местная вакатная гиперемия появляется на коже под действием, например, медицинских банок, создающих над определенным участком ее разреженное пространство.
5) воспалительная гиперемияПостоянный спутник воспаления и его обязательный компонент. Усиленный приток крови к воспаленному участку окрашивает его в красный цвет, он становится теплым на ощупь. Воспалительная гиперемия проходит вместе с окончанием воспаления.
Усиленный приток крови к воспаленному участку окрашивает его в красный цвет, он становится теплым на ощупь. Воспалительная гиперемия проходит вместе с окончанием воспаления.
Возникает в тех случаях, когда, например, при огнестрельном ранении или другой травме образуется свищ (соустье) между близлежащими артерией и веной, артериальная кровь потечет в вену.
2. Полнокровие (гиперемия). Венозное полнокровие.
Повышенное кровенаполнение органа или ткани в связи с уменьшением (затруднением) оттока крови, приток крови при этом не изменен или уменьшен.
Застой венозной крови (застойная гиперемия) приводит к расширению вен и капилляров, замедлению в них кровотока, с чем связано развитие гипоксии, повышение проницаемости базальных мембран капилляров.
1) общее венозное полнокровиеРазвивается при патологии сердца, ведущей к острой или хронической сердечно-сосудистой недостаточности. Оно может быть острым и хроническим.
Оно может быть острым и хроническим.
Является синдромом острой сердечной недостаточности. В результате гипоксического повреждения гистогематических барьеров, накопления продуктов нарушения тканевого обмена (ацидоз) и резкого повышения капиллярной проницаемости в тканях наблюдаются плазморрагия и отек, стазы в капиллярах, множественные диапедезные кровоизлияния, в паренхиматозных органах появляются дистрофические изменения. Структурно-функциональные особенности органа, в котором развивается ОВЗ, определяют преобладание отечно-плазморрагических, геморрагических либо дистрофических и некротических изменений.
Наиболее часто развивается при инфаркте миокарда левого желудочка.
б) хроническое венозное полнокровиеРазвивается при хронической сердечно-сосудистой недостаточности, осложняющей многие хронические заболевания сердца (пороки, ИБС, кардиомиопатии, хронический миокардит),правожелудочковой недостаточности кардиогенной природы, декомпенсированных пороках сердца, сжатии устьев полых вен опухолью средостения. ХВЗ приводит к тяжёлым изменениям органов и тканей. Длительно поддерживая состояние тканево гипоксии, оно определяет развитие не только плазморрагии, отека, стаза и кровоизлияний, дистрофии и некроза, но и атрофических и склеротических изменений (связаны с тем, что хроническая гипоксия стимулирует синтез коллагена фибробластами, в этом принимает участие HIF).
ХВЗ приводит к тяжёлым изменениям органов и тканей. Длительно поддерживая состояние тканево гипоксии, оно определяет развитие не только плазморрагии, отека, стаза и кровоизлияний, дистрофии и некроза, но и атрофических и склеротических изменений (связаны с тем, что хроническая гипоксия стимулирует синтез коллагена фибробластами, в этом принимает участие HIF).
Соединительная ткань вытесняет паренхиматозные элементы, развивается индурация (застойное уплотнение) органов и тканей.
Также происходит капиллярно-паренхиматозный блок в связи с утолщением базальных мембран эндотелия и эпителия ха счет повышенной продукции коллагена фибробластами, гладкими мышечными клетками и липофибробластами.
При хроническим венозное застое кожа, особенно нижних конечностей, становится холодной и приобретает синюшную окраску (цианоз). Вены кожи и подкожной клетчатки расширены, переполнены кровью, также расширены и переполнены лимфой лимфатические сосуды. Выражены отек дермы и подкожной клетчатки, разрастание в коже соединительной ткани.
Морфологически застойно-паренхиматозный блок характеризуется:
-уменьшение числа функционирующих капилляров в результате склероза, индуцированного гипоксией. При этом происходит магистрализация кровотока, что еще сильнее ухудшает кровоснабжение паренхимы, что способствует склерозу.
-истинные капилляры преобразуются в емкостные.
Бурая индурация печениБурая индурация печени – гемосидероз, венозный застой в печени + склероз
Печень увеличена, плотная, ее края закруглены, поверхность разреза пестрая, серо-желтая с темно-красным крапом и напоминает мускатный орех.
При микроскопии видно, что полнокровны лишь центральные отделы долек, где гепатоциты разрушены. Эти отделы выглядят темно-красными. На периферии долек клетки печени находятся в состоянии дистрофии, нередко жировой, чем объясняется серо-желтый цвет печеночной ткани.
Избирательное полнокровие центра долек связано с тем, что застой печени охватывает прежде всего печёночные вены, распространяясь на собирательные и центральные вены, а затем и на синусоиды. Последние расширяются, но только в центральных и средних отделах дольки, где встречают сопротивление со стороны впадающих в синусоиды капиллярных разветвлений печеночной артерии, давление в которых выше, чем в синусоидах.
Последние расширяются, но только в центральных и средних отделах дольки, где встречают сопротивление со стороны впадающих в синусоиды капиллярных разветвлений печеночной артерии, давление в которых выше, чем в синусоидах.
По мере нарастания полнокровия в центре долек появляются кровоизлияния, гепатоциты здесь подвергаются дистрофии, некрозу и атрофии. Гепатоциты периферии долек компенсаторно гипертрофируются и приобретают сходство с центролобулярными.
Разрастание соединительной ткани в зоне кровоизлияний и гибели гепатоцитов связано с пролиферацией клеткок синусоидов – адипоцитов, которые могут выступать в роли фибробластов, а вблизи центральных и собиратеьных вен – с пролиферацией фибробластов адвентиции этих вен. В результате разрастания соединительной ткани в синусоидах появляется непрерывная базальная мембрана (в нормальной печени она отсутствует, т. е. происходит капилляризация синусоидов, возникает капиллярно-паренхиматозный блок, который, усугубляя гипоксию, ведет к прогрессированию атрофических и склеротических изменений в печени.
Таким образом развивается застойный склероз печени.
При прогрессирующем склерозе появляются несовершенная регенерация гепатоцитов с образованием узлов-регенератов, перестройка и деформация органа. Развивается застойный (мускатный) цирроз печени, который также называют сердечным, так как он встречается при хронической сердечной недостаточности.
Бурая индурация легких
При хроническом венозном застое развиваются множественные кровоизлияния, обуславливающие гемосидероз легких, и разрастание соединительной ткани, склероз.
Легкие становятся большими, бурыми и плотными.
В морфогенезе основную роль играют застойное полнокровие и гипертензия в малом круге кровообращения, ведущие к гипоксии и повышению сосудистой проницаемости, отеку, диапедезным кровоизлияниям. Развитию этих изменений предшествует ряд адаптивны процессов в сосудистом русле легких. В ответ на гипертензию в малом круге кровообращения происходит гипертрофия мышечно-эластических структур мелких ветвей легочной вены и артерии с перестройкой сосудов по типу замыкающих артерий, что предохраняет капилляры легкого от резкого переполнения кровью.
Со временем адаптивные изменения сосудов легкого сменяются склеротическими, развиваются декомпенсация легочного кровообращения, переполнение капилляров межальвеолярных перегородок кровью.
Нарастает гипоксия ткани, повышается сосудистая проницаемости, возникают множественные диапедезные кровоизлияния,
В альвеолах, бронхах, межальвеолярных перегородках, лимфатических сосудах и узлах легких появляются скопления нагруженных гемосидеринов клеток – сидеробластов и сидерофагов и свободнолежащего гемосидерина.
Возникает диффузный гемосидероз. Гемосидерин и белки плазмы (фибрин) «засоряют» строму и лимфатические дренажи легких, что ведет к резорбционной недостаточности их лимфатической системы, которая сменяется механической, Склероз кровеносных сосудов и недостаточность лимфатической системы усиливают легочную гипоксию, которая становится причиной пролиферации фибробластов, утолщения межальвеолярных перегородок. Возникает капиллярно-паренхиматозный блок. Развивается застойный склероз легких (более значителен в нижних отделах легких, где сильнее выражен венозный застой и больше скоплений пигментов и фибрина).
Развивается застойный склероз легких (более значителен в нижних отделах легких, где сильнее выражен венозный застой и больше скоплений пигментов и фибрина).
Имеет каудоапикальное распространение и зависит от степени и длительности венозного застоя в легких.
Прогрессированию пневмосклероза при хроническом венозном застое способствует недостаточность лимфообращения, которая объясняется накоплением пигментов и белков плазмы крови вследствие повышения сосудистой проницаемости (резорбционная недостаточность), затем склерозом стромы (механическая недостаточность). Кроме того, склеротические процессы в легких стимулируют SH-ферритином, входящим в состав гемосидерина.
Цианотическая индурация почек
Почки становятся большими, плотными и цианотичными. Особенно полнокровны вены мозгового вещества и пограничной зоны. На фоне венозного застоя развивается лимфостаз. В условиях гипоксии возникают дистрофия нефроцитов главных отделов нефрона и склероз, который не очень сильно выражен.
Цианотическая индурация селезенки
Селезенка увеличена, плотная, темно-вишневого цвета. Отмечается атрофия фолликулов и склероз пульпы.
2) местное венозное полнокровиеНаблюдается при затруднении отток венозной крови от определенного органа или части тела в связи с закрытием просвета вены (тромбом, эмболом) или сдавливание ее извне.
Примеры:
а) венозное полнокровие ЖКТ развивается при тромбозе воротной вены
б) мускатная печень и мускатный цирроз встречаются не только при общем полнокровии, но и при воспалении печеночных вен и тромбозе их просветов (облитерирующий тромбофлебит печеночных вен), что характерно для синдром Бадда-Киари
в) цианотическая индурация почек может появляться вследствие тромбоза почечных вен.
Местное венозное полнокровие может возникнуть и в результате развития венозных коллатералей при затруднении или прекращении оттока крови по основным венозным коллатералям (например, портокавальные анастомозы при затруднении оттока крови по воротной вене). Переполненные кровью коллатеральные вены резко расширяются, а стенка их истончается, что может быть причиной кровотечений (например, из расширенных и истончённых вен пищевода при циррозе печени).
Переполненные кровью коллатеральные вены резко расширяются, а стенка их истончается, что может быть причиной кровотечений (например, из расширенных и истончённых вен пищевода при циррозе печени).
С венозным полнокровием связано возникновение не только плазмогеморрагическх, дистрофических, атрофических, склеротических изменений, но и венозных (застойных) инфарктов.
3. Малокровие (ишемия)
Малокровием называют уменьшенное кровенаполнение ткани, органа, части тела в результате недостаточного притока крови. В ткани при ишемии развивается не только гипоксия, но и дефицит метаболитов, используемых клеткой в процессе гликолиза, активизирующего в условиях снижения доставки кислорода, что объясняет ускоренное развитие повреждения.
По распространенности малокровие можно разделить на:
-общее (анемия)
Заболевание кроветворной системы и характеризуется недостаточным содержанием эритроцитов и гемоглобина.
-местное
Изменения ткани, возникающие при малокровии связаны с гипоксией или аноксией (кислородным голоданием). В зависимости от причины ишемии, момента внезапности ее возникновения, длительности гипоксии и степень чувствительности к ней ткани при ишемии возникают либо тонкие изменения на уровне ультраструктур, либо грубые деструктивные изменения, вплоть до инфаркта.
В зависимости от причины ишемии, момента внезапности ее возникновения, длительности гипоксии и степень чувствительности к ней ткани при ишемии возникают либо тонкие изменения на уровне ультраструктур, либо грубые деструктивные изменения, вплоть до инфаркта.
Также повреждения клеток наблюдаются при восстановлении притока крови – реперфузионный синдром, который включает в себя три компонента:
1) перегрузка кальцием
Реперфузия ишемизированных клеток, утративших способность к синтезу достаточного уровня АТФ, приводит к потере контроля над обменов ионов. Внутриклеточное увеличение содержание кальция запускает апоптоз или активирует ферменты, нарушающие клеточные мембранные структуры.
2) формирование активных форм кислорода
Ишемия индуцирует генерацию активных форм кислорода, таких как супероксид, пероксид, гидроксильный радикал. Свободные радикалы вызывают каскадный процесс повреждения клеточных мембран, протеинов и хромосом.
3) развитие воспаления
Также активные формы кислорода активируют воспалительный каскад.
При остром малокровии возникают дистрофические и некробиотические изменения. При этом происходит исчезновения из ткани гликогена, снижение активности окислительно-восстановительных ферментов и деструкция митохондрий. Острую ишемию стоит рассматривать как предынфарктное состояние. При длительном малокровии развиваются атрофия паренхиматозных элементов и склероз.
Окраска: для диагностики применяют различные соли тетразолия, теллурит калия, которые вне участков ишемии восстанавливаются и окрашивают ткань в серый ли черный цвет, а участки ишемии не окрашены.
В зависимости от причин и условий возникновения различают:
а) ангиоспастическое малокровиеВозникает вследствие спазма артерии в связи с действием каких-либо раздражителей. Например, болевое раздражение может вызывать спазм артерий и малокровие определенных участков тела. Ангиоспастическая ишемия появляется и при отрицательных эмоциональных аффектах («ангиоспазм неотреагированных эмоций), и при воздействиях низких температур.
Ангиоспастическая ишемия появляется и при отрицательных эмоциональных аффектах («ангиоспазм неотреагированных эмоций), и при воздействиях низких температур.
Ангиоспазм лежит в основе вено-артериального эффекта: при повышении венозного давления развивается спазм артериол.
б) обтурационное малокровиеРазвивается вследствие закрытия просвета артерии тромбом (нередко завершает ангиоспазм) или эмболом, в результате разрастания соединительной ткани в просвете артерии при воспалении ее стенки (облитерирующий эндартериит) сужение просвета артерии атеросклеротической бляшкой.
в) компрессионное малокровиеПоявляется при сдавлении артерии опухолью, выпотом, жгутом, лигатурой.
г) ишемия в результате перераспределения кровиНаблюдается в случаях гиперемии после анемии. Например, ишемия головного мозга при извлечении жидкости из брюшной полости, куда устремляется большая масса крови.
Малокровие вследствие спазма артерий обычно непродолжительно и не вызывает особых расстройств. Однако, при длительных спазмах возможно развитие дистрофии и инфаркта. Острое обтурационное малокровие особенно опасно, так как нередко ведет к инфаркту. Длительно существующее малокровие рано или поздно ведет к атрофии и склерозу.
Однако, при длительных спазмах возможно развитие дистрофии и инфаркта. Острое обтурационное малокровие особенно опасно, так как нередко ведет к инфаркту. Длительно существующее малокровие рано или поздно ведет к атрофии и склерозу.
Изоляция и канюляция церебральных паренхиматозных артериол
J Vis Exp. 2016; (111): 53835.
Пауло В. Пирес
1 Кафедра фармакологии Медицинского факультета Университета Невады
Фабрис Дабертран
2 Кафедра фармакологии Медицинского колледжа Вермонта
Скотт Эрли
1 Кафедра фармакологии Медицинского факультета Университета Невады
1 Кафедра фармакологии Медицинского факультета Университета Невады
2 Кафедра фармакологии Медицинского колледжа Университета Вермонта
Copyright © 2016, Журнал визуализированных экспериментов Эту статью цитировали в других статьях в PMC.Abstract
Внутримозговые паренхимные артериолы (ПА), которые включают паренхимальные артериолы, проникающие артериолы и прекапиллярные артериолы, представляют собой кровеносные сосуды с высоким сопротивлением, отходящие от пиальных артерий и артериол и ныряющие в паренхиму головного мозга. Отдельные PA перфузируют дискретную цилиндрическую территорию паренхимы и нейронов, содержащихся внутри. Эти артериолы играют центральную роль в регуляции мозгового кровотока как в глобальном (цереброваскулярная ауторегуляция), так и локально (функциональная гиперемия).ПА являются частью сосудисто-нервного узла, структуры, которая сопоставляет региональный кровоток с метаболической активностью в головном мозге, а также включает нейроны, интернейроны и астроциты. Перфузия через PA напрямую связана с активностью нейронов на этой конкретной территории, и увеличение нейронального метаболизма приводит к увеличению локальной перфузии, вызванной расширением питающей PA. Регуляция PA отличается от регуляции более хорошо охарактеризованных пиальных артерий. Вазоконстрикция, вызванная давлением, больше у ПА, и сосудорасширяющие механизмы различаются.Кроме того, ПА не получают внешней иннервации от периваскулярных нервов — иннервация является внутренней и косвенной по своей природе через контакт с концами астроцитов.
Отдельные PA перфузируют дискретную цилиндрическую территорию паренхимы и нейронов, содержащихся внутри. Эти артериолы играют центральную роль в регуляции мозгового кровотока как в глобальном (цереброваскулярная ауторегуляция), так и локально (функциональная гиперемия).ПА являются частью сосудисто-нервного узла, структуры, которая сопоставляет региональный кровоток с метаболической активностью в головном мозге, а также включает нейроны, интернейроны и астроциты. Перфузия через PA напрямую связана с активностью нейронов на этой конкретной территории, и увеличение нейронального метаболизма приводит к увеличению локальной перфузии, вызванной расширением питающей PA. Регуляция PA отличается от регуляции более хорошо охарактеризованных пиальных артерий. Вазоконстрикция, вызванная давлением, больше у ПА, и сосудорасширяющие механизмы различаются.Кроме того, ПА не получают внешней иннервации от периваскулярных нервов — иннервация является внутренней и косвенной по своей природе через контакт с концами астроцитов. Таким образом, данные о регуляции сократимости, накопленные в исследованиях с использованием пиальных артерий, не позволяют напрямую понять функцию PA. Кроме того, остается неясным, как патологические состояния, такие как гипертония и диабет, влияют на структуру и реактивность ПА. Этот пробел в знаниях отчасти является следствием технических трудностей, связанных с изоляцией и канюляцией ПА.В этой рукописи мы представляем протокол для изоляции и канюлирования PA грызунов. Кроме того, мы показываем примеры экспериментов, которые могут быть выполнены с этими артериолами, включая вызванное агонистом сужение и миогенную реактивность. Хотя основное внимание в этой рукописи уделяется канюляции ПА и миографии под давлением, изолированные ПА также могут быть использованы для биохимических, биофизических, молекулярных исследований и исследований изображений.
Таким образом, данные о регуляции сократимости, накопленные в исследованиях с использованием пиальных артерий, не позволяют напрямую понять функцию PA. Кроме того, остается неясным, как патологические состояния, такие как гипертония и диабет, влияют на структуру и реактивность ПА. Этот пробел в знаниях отчасти является следствием технических трудностей, связанных с изоляцией и канюляцией ПА.В этой рукописи мы представляем протокол для изоляции и канюлирования PA грызунов. Кроме того, мы показываем примеры экспериментов, которые могут быть выполнены с этими артериолами, включая вызванное агонистом сужение и миогенную реактивность. Хотя основное внимание в этой рукописи уделяется канюляции ПА и миографии под давлением, изолированные ПА также могут быть использованы для биохимических, биофизических, молекулярных исследований и исследований изображений.
Ключевые слова: Neuroscience, Issue 111, церебральные паренхимные артериолы, миография давления, миогенная реактивность, вызванное агонистами сужение, изоляция, канюляция сосудов
Введение
Церебральное кровообращение уникально организовано для поддержки метаболических потребностей центральных нейронов, клетки, которые имеют ограниченные запасы энергии и, следовательно, очень чувствительны к изменениям давления кислорода и поступления необходимых питательных веществ. Поскольку определенные субпопуляции нейронов становятся активными при выполнении определенных задач, сосудистая сеть способствует высокому локализованному увеличению перфузии для предотвращения локальной гипоксии и истощения питательных веществ 1 . Это форма функциональной гиперемии, известная как сосудисто-нервное соединение , и зависит от правильной работы сосудисто-нервной единицы, состоящей из активных нейронов, астроцитов и церебральных артерий 2 . Внутримозговые паренхимные артериолы, группа кровеносных сосудов, включающая паренхиматозные, проникающие и прекапиллярные артериолы, имеют центральное значение для этого ответа, и поэтому критически важно изучить их индивидуально, чтобы исследовать сосудисто-нервное соединение 3 .
Поскольку определенные субпопуляции нейронов становятся активными при выполнении определенных задач, сосудистая сеть способствует высокому локализованному увеличению перфузии для предотвращения локальной гипоксии и истощения питательных веществ 1 . Это форма функциональной гиперемии, известная как сосудисто-нервное соединение , и зависит от правильной работы сосудисто-нервной единицы, состоящей из активных нейронов, астроцитов и церебральных артерий 2 . Внутримозговые паренхимные артериолы, группа кровеносных сосудов, включающая паренхиматозные, проникающие и прекапиллярные артериолы, имеют центральное значение для этого ответа, и поэтому критически важно изучить их индивидуально, чтобы исследовать сосудисто-нервное соединение 3 .
Паренхиматозные артериолы — это небольшие (внутренний диаметр 20–70 мкм) кровеносные сосуды с высоким сопротивлением, которые перфузируют различные популяции нейронов в головном мозге. Отходя от пиальных артерий на поверхности, паренхимные артериолы проникают в паренхиму головного мозга под углом почти 90 ᵒ , питая подповерхностную микроциркуляцию ( Рисунок 1 ). Эти артериолы играют решающую роль в поддержании соответствующего перфузионного давления, поскольку они являются наиболее дистальными сосудами, содержащими гладкие мышцы и защищающими капилляры.В отличие от поверхностного пиального кровообращения, паренхимные артериолы не имеют коллатеральных ветвей и анастомозов и, следовательно, являются «узкими местами» мозгового кровообращения 4 . В результате дисфункция паренхиматозных артериол способствует развитию цереброваскулярных заболеваний, таких как сосудистые когнитивные нарушения и небольшие ишемические инсульты (также известные как тихие или лакунарные инсульты). Исследования показывают, что дисфункция паренхиматозных артериол может быть вызвана эссенциальной гипертензией 5 , хроническим стрессом 6 и является ранним событием в генетической модели болезни мелких сосудов у мышей 7 .Кроме того, экспериментально индуцированной окклюзии одиночных проникающих артериол у крыс достаточно, чтобы вызвать небольшие ишемические инсульты цилиндрической формы, подобные тем, которые наблюдаются у пожилых людей 8 .
Эти артериолы играют решающую роль в поддержании соответствующего перфузионного давления, поскольку они являются наиболее дистальными сосудами, содержащими гладкие мышцы и защищающими капилляры.В отличие от поверхностного пиального кровообращения, паренхимные артериолы не имеют коллатеральных ветвей и анастомозов и, следовательно, являются «узкими местами» мозгового кровообращения 4 . В результате дисфункция паренхиматозных артериол способствует развитию цереброваскулярных заболеваний, таких как сосудистые когнитивные нарушения и небольшие ишемические инсульты (также известные как тихие или лакунарные инсульты). Исследования показывают, что дисфункция паренхиматозных артериол может быть вызвана эссенциальной гипертензией 5 , хроническим стрессом 6 и является ранним событием в генетической модели болезни мелких сосудов у мышей 7 .Кроме того, экспериментально индуцированной окклюзии одиночных проникающих артериол у крыс достаточно, чтобы вызвать небольшие ишемические инсульты цилиндрической формы, подобные тем, которые наблюдаются у пожилых людей 8 .
Помимо этих анатомических различий, механизмы, регулирующие сократительную функцию, различаются между пиальными артериями и паренхиматозными артериолами. Миогенная вазоконстрикция больше в паренхиматозных артериолах 9 , возможно, из-за отсутствия внешней иннервации 10 , различных режимов механотрансдукции 11 и различий во внутриклеточном Ca 2+ , сигнализирующем 12,13 в гладких мышцах сосудов. клетки.Имеющиеся данные свидетельствуют о том, что эндотелий-зависимые вазодилататорные механизмы также различаются между этими сосудистыми сегментами, при этом паренхиматозные артерии в большей степени зависят от механизмов, включающих каналы K + , активированные Ca 2+ , и электротонную связь в стенке сосудов по сравнению с диффузионными факторами, такими как азотная кислота. оксид и простациклины 14 . Следовательно, данные, собранные в экспериментах с использованием пиальных артерий, не обязательно применимы к паренхиматозным артериолам, что оставляет пробел в наших знаниях о местном контроле перфузии головного мозга.
Несмотря на свою важность, паренхимные артериолы в значительной степени недостаточно изучены, в первую очередь из-за технических проблем с изоляцией и установкой для исследования ex vivo . В этой рукописи мы описываем методологию выделения и канюлирования церебральных паренхиматозных артериол, которые можно использовать для миографии под давлением или для выделения ткани для иммуномечения, электрофизиологии, молекулярной биологии и биохимического анализа.
Протокол
1. Подготовка канюли и камеры
Вставьте чистые капилляры из боросиликатного стекла (внешний диаметр: 1.2 мм; внутренний диаметр: 0,69 мм; Длиной 10 мм) в канавки съемника пипеток платиновой нитью (диаметр: 100 мкм).
Используя соответствующие настройки, потяните капилляр, чтобы создать канюлю с длинным и тонким наконечником (, рис. 2, ), используя съемник для микропипеток. Используемые настройки: Нагрев — 700, Тяга — 100, Скорость — 50, Время — 10.

Вставьте канюлю в держатель камеры миографа давления. Правильно выровняйте канюли.
Осторожно сломайте кончики канюль, используя щипцы под препаровальным микроскопом до желаемого диаметра. Здесь мы показываем канюлю с наконечником 10 мкм (, рис. 2, ).
Заполните обе канюли искусственной спинномозговой жидкостью (ACSF), содержащей 1,8 мМ Ca 2+ ; заполните камеру aCSF без Ca 2+ с добавлением 1% бычьего сывороточного альбумина (BSA) + 10 мкМ дилтиазема (все растворы должны быть приготовлены свежими до начала эксперимента).В зависимости от размера камеры варьируйте объем ACSF от 5 до 20 мл. Храните камеру при 4 C до начала канюляции. ПРИМЕЧАНИЕ. Дилтиазем — это обратимый потенциалзависимый ингибитор кальция L-типа, который вызывает расширение артериол, что облегчает канюляцию. лаборатории, одобренные комитетом по уходу за животными.Предпочтительно использование барбитуратов или диоксида углерода, поскольку другие широко используемые анестетики могут оказывать сосудорасширяющее действие на мозговое кровообращение 15 .
 Все процедуры с животными, показанные здесь, были одобрены Комитетом по уходу и использованию животных Медицинской школы Университета Невады и согласованы с «Руководящими принципами по уходу и использованию животных» Национального института здравоохранения.
Все процедуры с животными, показанные здесь, были одобрены Комитетом по уходу и использованию животных Медицинской школы Университета Невады и согласованы с «Руководящими принципами по уходу и использованию животных» Национального института здравоохранения.Эвтаназируйте животное, используя углекислый газ. Перед обезглавливанием убедитесь, что животное перестало дышать и не реагирует на щипки за лапы.
Обезглавьте животное острыми ножницами (мышь) или гильотиной (крыса). Снимите кожу с головы животного и разрежьте по средней линии черепного шва ножницами с тонкими кончиками. Используя тупой пинцет (мышь) или плоскогубцы, осторожно удалите кости черепа и обнажите головной мозг. Удалите мозг медленно и осторожно, чтобы не повредить поверхностные пиальные артерии. Поместите мозг в контейнер, наполненный 20 мл aCSF без Ca 2+ с добавлением 1% BSA на льду.
Заполните чашку для препарирования, содержащую подушку, ледяной Ca2 + -содержащей aCSF с добавлением 1% BSA и перенесите головной мозг вентральной поверхностью вверх в эту чашку ( Рисунок 2A ).
 Поместите блюдо под рассекающий микроскоп (, рис. 3A, ). Приколите мозг к подушечке иглами 27-го калибра. Будьте осторожны, не размещайте булавки рядом со средней мозговой артерией (СМА).
Поместите блюдо под рассекающий микроскоп (, рис. 3A, ). Приколите мозг к подушечке иглами 27-го калибра. Будьте осторожны, не размещайте булавки рядом со средней мозговой артерией (СМА).Определите местонахождение Уиллисова круга и ответвления MCA от него.Используя острые и выровненные пружинные ножницы Vannas, вырежьте небольшой прямоугольник вокруг MCA. Убедитесь, что прямоугольник составляет около 5 мм по всей длине MCA. Верхняя часть прямоугольника должна проходить за точкой разветвления от Уиллисовского круга (проксимальнее Уиллисовского круга, , рис. 2B, , стрелка).
С помощью пружинных ножниц Vannas сделайте поднутрение ткани примерно на 2–3 мм на глубину. ПРИМЕЧАНИЕ. Эта часть имеет решающее значение для хорошей изоляции паренхиматозных артериол, и может потребоваться несколько попыток, чтобы сделать это правильно.Если разрез сделать достаточно глубоким, изолированные паренхиматозные артериолы будут короткими; если разрез будет слишком глубоким, при удалении рассеченной ткани артериолы разорвутся в месте их разветвления.

Прикрепите самый дистальный конец среза мозга к чашке для препарирования так, чтобы MCA была направлена вверх (дистальнее от Виллисовского круга), используя булавки для насекомых. Сделайте неглубокий надрез, чтобы разрезать мягкую мозговую оболочку рядом со штифтом, стараясь не прорезать слишком глубоко в подлежащую кору головного мозга (иначе штифты не будут держаться).
Осторожно возьмитесь за мягкую подушечку с каждой стороны маленькими щипцами и начните отслаивать мягкую мозговую оболочку от коры. При необходимости удерживайте MCA, следя за тем, чтобы окружающая пиальная мембрана не была повреждена.
Продолжайте пилинг до тех пор, пока мягкая мозговая оболочка, содержащая MCA, не освободится от коры. Обратите внимание, что сопротивление отслаиванию будет увеличиваться ближе к кругу Виллиса. Будьте особенно осторожны на этом этапе, потому что в этой области будут находиться более длинные паренхиматозные артериолы.
Освободив мягкую мозговую оболочку, осторожно поместите ее поверх подушечки на чашке для препарирования так, чтобы поверхность, противоположная паренхиматозным артериолам, была обращена вниз ( Рисунок 2B, ).

С помощью пружинных ножниц Vannas вырежьте рассеченные артериолы, не выходящие за пределы СМА, убедившись, что концы сосуда срезаны тупо.
Собранные артериолы можно использовать для миографии под давлением, молекулярного анализа или выделения нативных гладкомышечных или эндотелиальных клеток.
3. Давление миография
Подготовьте нить заранее. Нарежьте темно-зеленую нейлоновую нить на кусочки по 5 мм и поместите на липкую сторону двустороннего скотча на чашке Петри.Под препарирующим микроскопом разделите каждый кусок на нити с помощью тонких пинцетов и слегка подготовьте простой узел с полусцепкой, пропустив один конец нити в другой.
Пинцетом снимите узел с двустороннего скотча, стараясь не захватывать его слишком сильно. Затяните нить в растворе ванны, наденьте узел на канюлю и затяните его на расстоянии от кончика канюли. Повторите этот процесс, чтобы на каждую канюлю наложили по 2 шва.
Нанесите на стеклянную микропипетку 10% раствор BSA, а затем смойте излишки aCSF без Ca 2+ с добавлением 1% BSA.

Наберите 50 мкл раствора в стеклянную микропипетку, вытяните паренхиматозную артериолу и перенесите в камеру миографии под давлением. Нажмите на поршень одним плавным движением, чтобы распределить паренхиматозную артериолу в камеру, чтобы предотвратить ее прилипание к внутренней камере стеклянной микропипетки.
Используя два сверхтонких пинцета, откройте просвет ЛА, стараясь касаться только самого конца сосуда.
С помощью щипцов, удерживающих края паренхиматозной артериолы, осторожно натяните сосуд на канюлю.Вытяните канюлю достаточно далеко, чтобы сосуд не оказался на очень сужающемся конце канюли (, рис. 3A, ).
Ослабьте 2 шва на канюле и затяните их на сосуде ( Рисунок 3B ). Немного разнесите швы на сосуде и потяните к оператору, затягивая его. Перед закрытием противоположного конца паренхиматозной артериолы убедитесь, что все ветви перевязаны.
Поверните камеру и закройте противоположный конец паренхиматозной артериолы как слепой мешок.
 Для этого откройте стяжки на противоположной канюле и проденьте ее на артериолу. Медленно затяните узел так, чтобы паренхиматозная артериола была привязана к стороне канюли. Избегайте продольного растяжения артериолы. ( Рисунок 3C ). ПРИМЕЧАНИЕ: Если целью исследования является перфузия лекарств через просвет, канюлируйте противоположный конец вместо того, чтобы привязывать паренхиматозную артериолу к стороне канюли. Убедитесь, что в канюлях нет кристаллов соли или внутренних отложений, которые блокируют внутрипросветный поток.Отрегулируйте скорость потока соответствующим образом, чтобы поддерживать напряжение сдвига на физиологическом уровне. Исследование Shih et al. показывает скорость потока внутри проникающих артериол у крыс 8 и может служить в качестве начального руководства для пилотных исследований.
Для этого откройте стяжки на противоположной канюле и проденьте ее на артериолу. Медленно затяните узел так, чтобы паренхиматозная артериола была привязана к стороне канюли. Избегайте продольного растяжения артериолы. ( Рисунок 3C ). ПРИМЕЧАНИЕ: Если целью исследования является перфузия лекарств через просвет, канюлируйте противоположный конец вместо того, чтобы привязывать паренхиматозную артериолу к стороне канюли. Убедитесь, что в канюлях нет кристаллов соли или внутренних отложений, которые блокируют внутрипросветный поток.Отрегулируйте скорость потока соответствующим образом, чтобы поддерживать напряжение сдвига на физиологическом уровне. Исследование Shih et al. показывает скорость потока внутри проникающих артериол у крыс 8 и может служить в качестве начального руководства для пилотных исследований.Осторожно перенесите камеру на предметный столик микроскопа, который будет использоваться для регистрации диаметра сосуда.
 Присоедините камеру к столику микроскопа, соединив температурный зонд, вход и выход для перфузии с соответствующими трубками.Поднимите в артериолу давление внутри просвета 40 мм рт. Ст. Для паренхиматозных артериол мыши или 50 мм рт. На рис. 4D. показан пример перистальтического насоса, соединенного с датчиком давления для создания давления в канюлированной артериоле.
Присоедините камеру к столику микроскопа, соединив температурный зонд, вход и выход для перфузии с соответствующими трубками.Поднимите в артериолу давление внутри просвета 40 мм рт. Ст. Для паренхиматозных артериол мыши или 50 мм рт. На рис. 4D. показан пример перистальтического насоса, соединенного с датчиком давления для создания давления в канюлированной артериоле.Включите систему, используемую для обнаружения изменений диаметра ( Рисунок 3E ).Отрегулируйте настройки микроскопа, такие как освещенность и контраст, чтобы добиться наилучшего возможного обнаружения. В идеале стенки артериолы должны быть темными, а просвет — полупрозрачным. Как только обнаружение будет подходящим, начните запись эксперимента.
Запустите систему суперфузии. Промойте канюлированную паренхимальную артериолу под давлением теплым (37 ° C) aCSF, содержащим 1,8 мМ Ca 2+ , в течение 15-20 минут при скорости потока 3-5 мл / мин.Этот aCSF не должен содержать Дилтиазем или BSA.
Замените обычный aCSF на 60 мМ KCl aCSF, чтобы оценить жизнеспособность препарата. На этом этапе ПА должны демонстрировать сужение на 10-20% до 60 мМ KCl. Если артериола не сужается до такой степени, удалите и канюлируйте другую артериолу.
Вымойте 60 мМ KCl с помощью обычного ACSF. Подождите, пока не сформируется спонтанный миогенный тонус, что может занять до одного часа. Если к тому времени артериола не имеет миогенного тонуса, замените ее другой артериолой.ПРИМЕЧАНИЕ. Миогенный тонус наблюдается как постепенное, а иногда и медленное уменьшение диаметра просвета сосуда без стимуляции сократительными агонистами или раствором с высоким содержанием KCl. Миогенный тонус рассчитывается по следующей формуле: (1 — (диаметр активного просвета / диаметр пассивного просвета)) x 100 5 . Подходящее количество миогенного тонуса может варьироваться в зависимости от лечения, штамма, вида, трансгенного происхождения, и т. Д. . В целом физиологический миогенный тонус колеблется от 15 до 30% 5 .
4. Пример экспериментов с миографией под давлением: сужение, вызванное агонистами, и миогенная реактивность
Приготовьте серию разведений выбранного агониста в aCSF с использованием подходящих концентраций. В данном примере использовали агонист рецептора тромбоксана A 2 U46619. Готовили основной раствор 1 мл U46619 с концентрацией 1 мМ. Перенесите 100 мкл 1 мМ раствора в новую пробирку, содержащую 900 мкл aCSF, чтобы сделать 10-кратное разведение препарата, в результате чего получится раствор, содержащий 100 мкМ U46619.Повторите этот процесс для 6 разведений, в диапазоне от 1 мМ до 100 нМ, чтобы подготовить кривую сужения зависимости от концентрации.
Добавьте весь объем раствора, содержащего агонист (1 мл для первой дозы, а затем 900 мкл для всех последующих доз), к 100 мл суперфузионного aCSF. Это приведет к дополнительному 100-кратному разведению агониста. Таким образом, конечные концентрации агониста в ванне колеблются от 10 мкМ до 10 мкМ. Дайте артериолам инкубироваться в течение ~ 10 мин при каждой концентрации, пока диаметр просвета не станет стабильным.
Вымойте агонист, переплавив PA с aCSF без каких-либо лекарств, пока диаметр PA не вернется к исходному значению. Инкубируйте паренхиматозную артериолу в aCSF без Ca 2+ (без BSA) с добавлением 10 мкМ дилтиазема + 2 мМ EGTA, чтобы вызвать максимальное расширение и зарегистрировать пассивный диаметр артериолы.
Удалите паренхиматозную артериолу из канюли, осторожно вытащив ее, удерживая за конец стяжки. Промойте камеру сосуда двойной деионизированной водой, чтобы удалить остатки и избыток агониста.Заполните камеру aCSF + BSA без Ca 2+ и канюлируйте другую артериолу. Не рекомендуется проводить более одного эксперимента на каждую артериолу.
Для проведения эксперимента по миогенной реактивности позвольте паренхимной артериоле уравновеситься при внутрипросветном давлении 40 мм рт.ст. до тех пор, пока не сформируется спонтанный миогенный тонус (описано выше). Уменьшите внутрипросветное давление до 5 мм рт.ст. и дайте ПА уравновеситься в течение ~ 5-10 мин, пока диаметр просвета не достигнет устойчивого состояния.Постепенно увеличивайте внутрипросветное давление, используя интервал выбора (например, от 5 до 140 мм рт. Ст. С шагом 20 мм рт. Ст.).
Не подвергайте артериолу воздействию внутрипросветного давления ниже 5 мм рт. Ст., Так как это может вызвать коллапс и повреждение эндотелия, что повлияет на результаты эксперимента.
В конце кривой давления выполните переливание паренхимальной артериолы aCSF без Ca 2+ (без BSA) с добавлением 10 мкМ дилтиазема + 2 мМ EGTA и повторите шаги давления, начиная с самого низкого давления.ПРИМЕЧАНИЕ: Это даст пассивные диаметры PA, которые необходимы для расчета% миогенного тонуса, определяемого формулой:% tone = (1 — (активный диаметр / пассивный диаметр)) x 100.
Репрезентативные результаты
Фигура 5A показывает типичное сокращение PA мыши до 60 мМ KCl aCSF для оценки целостности препарата. ПА должны сжиматься на 15–30% в присутствии 60 мМ KCl. Если сужение ниже 15%, выбросьте ЛА и канюлируйте другую, поскольку это говорит о том, что артериола была повреждена в процессе изоляции и канюляции.
На рис. 5B показано сужение PA в результате увеличения концентрации тромбоксана A 2 аналог U-46619 (от 10 мкМ до 1 мкМ) в ванне для суперфузии. Сужение наблюдали как уменьшение диаметра просвета после инкубации с каждой концентрацией. PA давали уравновеситься при каждой концентрации в течение 10 минут. Эти данные могут быть проанализированы и представлены как изменение диаметра (ΔDiameter) или как% вазоконстрикции по KCl, что нормализует изменение диаметра на максимальное сужение до 60 мМ KCl.
Рисунок 6 показывает репрезентативную трассировку диаметра просвета PA в эксперименте с миогенной реактивностью. Поэтапное увеличение внутрипросветного давления вызывает постепенное сужение PA в присутствии 1,8 мМ внеклеточного Ca 2+ ( Рисунок 6, , нижняя кривая). Инкубация того же PA с aCSF без Ca 2+ и с добавкой 10 мкМ дилтиазема + 2 мМ EGTA отменяет генерацию миогенного тонуса, а диаметр просвета PA увеличивается в соответствии с внутрипросветным давлением ( Рис. 5, , верхний график), который представляет собой диаметр пассивного просвета артериолы.
Рисунок 1: Схема паренхиматозных артериол. PA отходят от поверхностных пиальных артерий и проникают в нижележащую паренхиму головного мозга. Каждый PA перфузирует небольшую популяцию нейронов в пределах своей столбчатой территории (выделенные области). Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 2: Выделение церебральных PA мыши. A) Изображение головного мозга с вентральной поверхностью, обращенной вверх, показывающее Уиллисовский круг (стрелка 1) и отходящая от него MCA (стрелка 2).Б) Изображение MCA с подлежащей тканью головного мозга. Стрелка указывает на самый проксимальный участок СМА от Уиллисова круга. В) PA, отходящие от MCA (стрелки). Бар = 100 мкм. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 3: Канюляция изолированных PA мыши. A) Изображение ЛА канюлировано, но еще не наложено швы. На этом изображении показана длина PA, которая должна быть вставлена в канюлю до закрытия ее швами. B) Теперь PA закрывается на канюле двумя швами, чтобы гарантировать, что он не соскользнет с канюли после создания давления.C) Изображение канюлированного, находящегося под давлением PA мыши в экспериментальной конфигурации слепого мешка. Пруток = 50 мкм. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рис. 4: Оборудование, используемое в нашей лаборатории для экспериментов с PA. A) Диссекционный микроскоп с источником света. Б) Регулятор температуры. C) Перистальтический насос для переливания aCSF в ванне. D) Сервоуправление давлением, КИПиА. E) Анализатор размеров видео (внизу справа), монитор (вверху справа) и система обнаружения края видео, загруженная на портативный компьютер (слева).F) Камера малого сосуда (камера линейного выравнивания). Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рис. 5. Сужение PA из-за KCl-индуцированной деполяризации и тромбоксана A 2 Аналог U46619. A) Типичное сокращение PA мыши до 60 мМ KCl aCSF для оценки целостности препарата. ПА должны сжиматься на 15–30% в присутствии 60 мМ KCl. Б) вызванное U46619 сужение ПА; как видно на графике, U46619 вызывает зависящее от концентрации сужение PA, наблюдаемое как уменьшение диаметра просвета после инкубации с каждой концентрацией.Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 6: Миогенная реактивность ПА. Пошаговое увеличение внутрипросветного давления вызывает постепенное сужение PA в присутствии 1,8 мМ внеклеточного Ca 2+ (нижняя граница). Это вызванное давлением сужение характерно для резистентных артериол. Инкубация того же PA с aCSF без 1,8 мМ Ca 2+ и с добавлением 10 мкМ дилтиазема + 2 мМ EGTA отменяет генерацию миогенного тонуса, а диаметр просвета PA увеличивается в соответствии с внутрипросветным давлением (верхняя кривая), что является диаметр просвета пассивной артериолы.Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Церебральные паренхимные артериолы — это артериолы с высоким сопротивлением, с небольшим количеством анастомозов и ветвей, которые перфузируют различные популяции нейронов. Эти специализированные кровеносные сосуды являются центральными участниками цереброваскулярной ауторегуляции и нервно-сосудистого взаимодействия посредством опосредованной астроцитами вазодилатации 1 . Важность этих специализированных кровеносных сосудов при сосудистых заболеваниях головного мозга была известна примерно 50 лет назад, когда новаторская работа доктора Х.Миллер Фишер описал структурные изменения паренхиматозных артериол на территориях лакунарных инфарктов в головном мозге гипертоников post mortem 16 . Эти изменения в сочетании с функциональными нарушениями могут вызвать гипоперфузию глубокого белого вещества, что является основным фактором риска развития сосудистой деменции 17 . Паренхимные артериолы функционально отличаются от крупных внутричерепных и пиальных артерий, а также от поверхностных артериол, поэтому данные, накопленные с использованием этих членов цереброваскулярного дерева, не могут быть легко экстраполированы на паренхиматозную микроциркуляцию.Несмотря на их очевидную важность в поддержании надлежащего гомеостаза мозга, исследований, посвященных физиологии и функциональным реакциям этих артериол, было мало до последних лет, в первую очередь из-за технических трудностей, связанных с изоляцией и манипуляциями.
В данной рукописи мы описываем простой и воспроизводимый метод выделения и канюляции паренхиматозных артериол для исследований давлением миографии, молекулярного анализа или получения нативных гладкомышечных или эндотелиальных клеток.Кроме того, мы представляем данные об использовании этого метода для исследования миогенной регуляции, констрикторных и дилатационных механизмов в паренхиматозных артериолах. Мы наблюдаем, что эти сосуды являются миогенно активными, генерируя спонтанный миогенный тонус, когда внутрипросветное давление поддерживается на постоянном уровне, а также изменяют свой миогенный статус, сталкиваясь с изменениями внутрипросветного давления, феномен, хорошо описанный для резистентных артерий, называемый миогенная реактивность 18 . Миогенная реактивность является ключевым фактором в регулировании перфузионного давления в головном мозге, поддерживая его постоянным перед колебаниями системного артериального давления, тем самым предотвращая потерю перфузии при низком давлении или вазогенный отек при более высоком давлении 18 .Кроме того, мы показываем, что эти артериолы реагируют на вазоактивные вещества, такие как эндотелин-1, важный эндогенный вазоконстриктор, продуцируемый эндотелиальными клетками. Основное ограничение препарата, описанного здесь, состоит в том, что при выделении паренхиматозных артериол теряются жизненно важные компоненты нервно-сосудистой единицы, и невозможно изучить функциональные гиперемические реакции. Другие препараты, такие как срез головного мозга, поддерживают структуру неповрежденной нервно-сосудистой единицы и более подходят для изучения астроцитарного контроля диаметра церебральных артериол 19 .Однако при приготовлении среза головного мозга паренхиматозные артериолы не подвергаются давлению, и необходимо экзогенное введение рецептор-зависимых сосудосуживающих агентов для имитации базального тонуса с целью изучения сосудорасширяющих реакций. Миография давления и подготовка среза головного мозга должны рассматриваться как дополняющие друг друга для исследования церебральной микроциркуляции.
Описанный здесь протокол был адаптирован из препарата, впервые описанного Dacey и Duling в 1982 г. 20 , и изменен Coyne et al. 21 . Основное различие заключается в использованной технике канюляции: в то время как Dacey, Duling и Coyne et al. В модели использовались два разных набора пипеток, удерживающая внешняя пипетка и пипетка для внутрипросветной канюляции, мы использовали только внутрипросветную пипетку и вручную вводили PA в пипетку. Этот метод был недавно использован для проведения исследований на PA крыс после церебральной ишемии — реперфузионное повреждение 22 , PA у крыс с хронической гипертензией 5 , среди других.На мышах мы использовали этот метод для оценки сигналов Ca 2+ в гладкомышечных клетках PA под давлением в физиологических условиях и при ацидозе путем сочетания канюляции PA с лазерной сканирующей конфокальной микроскопией для оценки волн Ca 2+ и искр в гладкомышечных клетках 13 . Мы также протестировали несколько нейрососудистых связывающих агентов 3 и продемонстрировали, используя фармакологические инструменты в сочетании с записями мембранного потенциала, что церебросспецифическая регуляция потенциалзависимых калиевых каналов K V 1 вызывает каннелопатический дефект в генетических заболеваниях мелких сосудов. модель 7 .Эти примеры демонстрируют жизнеспособность этого препарата для ответа на различные исследовательские вопросы.
Важно подчеркнуть, что изоляция церебральных PA из ткани мозга является наиболее важным шагом, поскольку простота канюляции будет зависеть от количества и длины выделенных PA. Для оптимизации изоляции может потребоваться несколько попыток. Кроме того, кривая обучения канюлированию может быть долгой и утомительной, а исходные показатели успеха могут составлять всего 50%. Однако после освоения этого метода воспроизводимость и производительность становятся высокими, и за один день можно провести множество экспериментов.
Таким образом, в настоящей рукописи описывается метод выделения и канюляции церебральных паренхиматозных артериол. Такой препарат изолировал сосудистый компонент нервно-сосудистой единицы, поддерживая неповрежденные реакции артериол под давлением. Исследования с использованием изолированных ПА предоставят ценную информацию о паренхиматозном кровообращении головного мозга как при физиологических, так и при патологических состояниях.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Финансируется NHLBI R01HL091905 (SE), исследовательским грантом United Leukodystrophy Foundation CADASIL (FD) и AHA 15POST247200 (PWP).Авторы хотели бы поблагодарить Саманту П. Ахчай за предоставленное изображение на Рисунке 1 и доктора Джерри Эрреру, доктора философии, за критические комментарии к рукописи.
Ссылки
- Dunn KM, Nelson MT. Нейроваскулярная сигнализация в головном мозге и патологические последствия гипертонии. Am J Physiol Heart Circ Physiol. 2014; 306: ч2 – ч24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Иадекола С. Нейроваскулярная регуляция в нормальном мозге и при болезни Альцгеймера.Nat Rev Neurosci. 2004; 5: 347–360. [PubMed] [Google Scholar]
- Dabertrand F, et al. Простагландин E2, предполагаемый нейроваскулярный связывающий агент, происходящий из астроцитов, сужает, а не расширяет паренхиматозные артериолы. J Cereb Blood Flow Metab. 2013; 33: 479–482. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Nishimura N, Schaffer CB, Friedman B, Lyden PD, Kleinfeld D. Проникающие артериолы являются узким местом в перфузии неокортекса. Proc Natl Acad Sci U S. A. 2007; 104: 365–370.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pires PW, Jackson WF, Dorrance AM. Регуляция миогенного тонуса и структуры паренхиматозных артериол гипертонией и минералокортикоидным рецептором. Am J Physiol Heart Circ Physiol. 2015; 309: h227 – h236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Longden TA, Dabertrand F, Hill-Eubanks DC, Hammack SE, Nelson MT. Индуцированная стрессом передача сигналов глюкокортикоидов ремоделирует нервно-сосудистую связь через нарушение цереброваскулярной функции, внутренне выпрямляющей функцию K + -каналов.Proc Natl Acad Sci U S. A. 2014; 111: 7462–7467. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dabertrand F, et al. Подобный калиевой каналопатии дефект лежит в основе ранней стадии цереброваскулярной дисфункции в генетической модели болезни мелких сосудов. Proc Natl Acad Sci U S. A. 2015; 112: E796 – E805. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Shih AY, et al. Самый маленький инсульт: закупорка одного проникающего сосуда приводит к инфаркту и когнитивному дефициту. Природа нейробиологии. 2013; 16: 55–63.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cipolla MJ, et al. Повышенный вызванный давлением тонус паренхиматозных артериол крыс по сравнению со средними церебральными артериями: роль ионных каналов и чувствительность к кальцию. Журнал прикладной физиологии. 2014; 117: 53–59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Хамель Э. Периваскулярные нервы и регуляция цереброваскулярного тонуса. Журнал прикладной физиологии. 2006; 100: 1059–1064. [PubMed] [Google Scholar]
- Брайден Дж. Э., Ли Й., Таварес М. Дж.Пуринергические рецепторы регулируют миогенный тонус в паренхиматозных артериолах головного мозга. J Cereb Blood Flow Metab. 2013; 33: 293–299. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dabertrand F, Nelson MT, Brayden JE. Рецепторы рианодина, передача сигналов кальция и регуляция сосудистого тонуса в паренхиматозной микроциркуляции головного мозга. Микроциркуляция. 2013; 20: 307–316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dabertrand F, Nelson MT, Brayden JE. Ацидоз расширяет артериолы паренхимы головного мозга за счет преобразования кальциевых волн в искры для активации BK-каналов.Circ Res. 2012; 110: 285–294. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- You J, Johnson TD, Marrelli SP, Bryan RM, Jr. Функциональная гетерогенность эндотелиальных пуриноцепторов P2 в цереброваскулярном дереве крыс. Am J Physiol. 1999; 277: H893 – H900. [PubMed] [Google Scholar]
- Nagase K, Iida H, Dohi S. Влияние кетамина на изофлуран- и севофлуран-индуцированную вазодилатацию мозга у кроликов. J Neurosurg Anesthesiol. 2003. 15: 98–103. [PubMed] [Google Scholar]
- Фишер К.М.Артериальные поражения, лежащие в основе лакун. Acta Neuropathol. 1968; 12: 1–15. [PubMed] [Google Scholar]
- Brown WR, Moody DM, Thore CR, Anstrom JA, Challa VR. Микрососудистые изменения белой материи при деменции. J Neurol Sci. 2009. 283: 28–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pires PW, Dams Ramos CM, Matin N, Dorrance AM. Влияние гипертонии на мозговое кровообращение. Am J Physiol Heart Circ Physiol. 2013; 304: h2598 – h2614. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Филоса Дж. А., Бонев А. Д., Нельсон М. Т..Динамика кальция в корковых астроцитах и артериолах при нервно-сосудистом соединении. Circ Res. 2004; 95: e73 – e81. [PubMed] [Google Scholar]
- Dacey RG, Jr, Duling BR. Исследование внутримозговых артериол крыс: методы, морфология, реактивность. Am J Physiol. 1982; 243: H598 – H606. [PubMed] [Google Scholar]
- Койн Э. Ф., Нгаи А. С., Мено Дж. Р., Винн Х. Р.. Способы выделения и характеристики внутримозговых артериол у мышей C57 / BL6 дикого типа. J Neurosci Methods. 2002. 120: 145–153.[PubMed] [Google Scholar]
- Чиполла MJ, Smith J, Kohlmeyer MM, Godfrey JA. Каналы SKCa и IKCa, миогенный тонус и сосудорасширяющие реакции в средних церебральных артериях и паренхиматозных артериолах: эффект ишемии и реперфузии. Инсульт. 2009. 40: 1451–1457. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Микромеханика легочных альвеол: структура и функция сурфактанта и тканевых компонентов
Альберт Р.К. (2012) Роль индуцированной вентиляцией дисфункции сурфактанта и ателектаза в возникновении острого респираторный дистресс-синдром.Am J Respir Crit Care Med 185: 702–708
PubMed Google Scholar
Bachofen H, Schürch S (2001) Силы альвеолярной поверхности и архитектура легких. Comp Biochem Physiol A Mol Integr Physiol 129: 183–193
CAS PubMed Google Scholar
Bachofen H, Gehr P, Weibel ER (1979) Изменения механических свойств и морфологии иссеченных легких кроликов, промытых детергентом.J Appl Physiol 47: 1002–1010
CAS PubMed Google Scholar
Bachofen H, Schürch S, Urbinelli M, Weibel ER (1987) Отношения между альвеолярным поверхностным натяжением, площадью поверхности, объемом и давлением отдачи. J Appl Physiol 62: 1878–1887
CAS PubMed Google Scholar
Bastacky J, Lee CYC, Goerke J, Koushafar H, Yager D, Kenaga L, Speed TP, Chen Y, Clements JA (1995) Тонкий и непрерывный слой альвеолярной выстилки: низкотемпературная сканирующая электронная микроскопия легкого крысы .J Appl Physiol 79: 1615–1628
CAS PubMed Google Scholar
Бейтс Дж. Х., Ирвин К. Г. (2002) Зависимость от времени набора и прекращения набора в легких: теоретическая модель. J Appl Physiol 93: 705–713
PubMed Google Scholar
Bates JH, Davis GS, Majumdar A, Butnor KJ, Suki B (2007) Связь прогрессирования паренхиматозного заболевания с изменениями механической функции легких путем перколяции.Am J Respir Crit Care Med 176: 617–623
PubMed PubMed Central Google Scholar
Билек А.М., Ди К.С., Гавер Д.П. (2003) Механизмы повреждения эпителиальных клеток, вызванного поверхностным натяжением, в модели повторного открытия легочных дыхательных путей. J Appl Physiol 94: 770–783
PubMed Google Scholar
Burkhardt A (1989) Альвеолит и коллапс в патогенезе легочного фиброза.Am Rev Respir Dis 140: 513–524
CAS PubMed Google Scholar
Берроуз К.С., Иревани А., Канг В. (2018) Интегрированная механика легочной ткани по частям: вычислительное моделирование в масштабах биологии. Clin Biomech. https://doi.org/10.1016/j.clinbiomech.2018.01.002
Артикул Google Scholar
Carney DE, Bredenberg CE, Schiller HJ, Picone AL, McCann UG, Gatto LA, Bailey G, Fillinger M, Nieman GF (1999) Механизм изменения объема легких во время механической вентиляции.Am J Respir Crit Care Med 160: 1697–1702
PubMed Google Scholar
Chang S, Kwon N, Kim J, Kohmura Y, Ishikawa T., Rhee CK, Je JH, Tsuda A (2015) Синхротронная рентгеновская визуализация легочных альвеол при дыхании у живых интактных мышей. Научный представитель 5: 8760
CAS PubMed PubMed Central Google Scholar
Чу Е.К., Уайтхед Т., Слуцкий А.С. (2004) Влияние циклического открытия и закрытия при низко- и высокопроизводительной вентиляции на цитокины бронхоальвеолярного лаважа.Crit Care Med 32: 168–174
CAS PubMed Google Scholar
Cong X, Hubmayr RD, Li C, Zhao X (2017) Ранение и восстановление плазматической мембраны при легочных заболеваниях. Am J Physiol Lung Cell Mol Physiol 312: L371 – L391
PubMed PubMed Central Google Scholar
Costello ML, Mathieu-Costello O, West JB (1992) Стрессовое нарушение альвеолярных эпителиальных клеток, изученное с помощью сканирующей электронной микроскопии.Am Rev Respir Dis 145: 1446–1455
CAS PubMed Google Scholar
Crapo JD, Barry BE, Gehr P, Bachofen M, Weibel ER (1982) Число клеток и характеристики клеток нормального легкого человека. Am Rev Respir Dis 126: 332–337
CAS PubMed Google Scholar
Долинай Т., Хаймс Б.Е., Шумятчер М., Лоуренс Г.Г., Маргулис С.С. (2017) Интегрированная реакция на стресс опосредует повреждение эпителия при ИВЛ.Am J Respir Cell Mol Biol 57: 193–203
CAS PubMed PubMed Central Google Scholar
Dreyfuss D, Saumon G (1998) Повреждение легких, вызванное искусственной вентиляцией легких: уроки экспериментальных исследований. Am J Respir Crit Care Med 157: 294–323
CAS PubMed Google Scholar
Фредберг Дж. Дж., Камм Р. Д. (2006) Передача стресса в легких: пути от органа к молекуле.Annu Rev Physiol 68: 507–541
CAS PubMed Google Scholar
Fu Z, Costello ML, Tsukimoto K, Prediletto R, Elliott AR, Mathieu-Costello O, West JB (1992) Большой объем легких увеличивает стрессовую недостаточность в легочных капиллярах. J Appl Physiol 73: 123–133
CAS PubMed Google Scholar
Fung YC (1975) Делает ли легкое нестабильным по своей природе поверхностное натяжение? Circ Res 37: 497–502
CAS PubMed Google Scholar
Fung YC, Sobin SS (1969) Теория листового потока в альвеолах легких.J Appl Physiol 26: 472–488
CAS PubMed Google Scholar
Гатто Л.А., Флюк Р.Р. (2004) Альвеолярная механика в остро поврежденном легком: роль альвеолярной нестабильности в патогенезе повреждения легких, вызванного вентилятором. Respir Care 49: 1045–1055
PubMed Google Scholar
Гер П., Бахофен М., Вейбель Э. Р. (1978) Нормальное легкое человека: ультраструктура и морфометрическая оценка диффузионной способности.Respir Physiol 32: 121–140
CAS PubMed Google Scholar
Gil J, Weibel ER (1969) / 70) Улучшения в демонстрации выстилающего слоя альвеол легких с помощью электронной микроскопии. Respir Physiol 8: 13–36
CAS PubMed Google Scholar
Gil J, Weibel ER (1972) Морфологическое исследование гистерезиса давление-объем в легких крысы, зафиксированное перфузией сосудов.Respir Physiol 15: 190–213
CAS PubMed Google Scholar
Gil J, Bachofen H, Gehr P, Weibel ER (1979) Соотношение площади альвеолярного объема и площади поверхности в легких, заполненных воздухом и физиологическим раствором, зафиксировано с помощью перфузии сосудов. J Appl Physiol 47: 990–1001
CAS PubMed Google Scholar
Haefeli-Bleuer B, Weibel ER (1988) Морфометрия ацинуса легких человека.Anat Rec 220: 401–414
CAS PubMed Google Scholar
Хаджари А.Дж., Яблонский Д.А., Сукстанский А.Л., Куирк Д.Д., Конради М.С., Вудс Дж.С. (2012) Морфометрические изменения ацинуса легких человека во время инфляции. J Appl Physiol 112: 937–943
CAS PubMed Google Scholar
Hamlington KL, Smith BJ, Allen GB, Bates JH (2016) Прогнозирование повреждения легких, вызванного вентилятором, с использованием функции стоимости повреждения легких.J Appl Physiol 121: 106–114
PubMed PubMed Central Google Scholar
Hobi N, Ravasio A, Haller T (2012) Межфазный стресс влияет на передачу сигналов альвеолярных клеток типа II крысы и экспрессию генов. Am J Physiol Lung Cell Mol Physiol 303: L117 – L129
CAS PubMed PubMed Central Google Scholar
Hsia CCW, Hyde DM, Weibel ER (2016) Структура легких и внутренние проблемы газообмена.Compr Physiol 6: 827–895
PubMed PubMed Central Google Scholar
Ikegami M, Whitsett JA, Martis PC, Weaver TE (2005) Обратимость воспаления легких, вызванного дефицитом SP-B. Am J Physiol Lung Cell Mol Physiol 289: L962 – L970
CAS PubMed Google Scholar
Ingber DE (2003) Тенсегрити I. Структура клетки и биология иерархических систем.J Cell Sci 116: 1157–1173
CAS PubMed Google Scholar
Kapanci Y, Assimacopoulos A, Irle C, Zwahlen A, Gabbiani G (1974) «сократительные интерстициальные клетки» в легочных альвеолярных перегородках: возможный регулятор соотношения вентиляция / перфузия? J Cell Biol 60: 375–392
CAS PubMed PubMed Central Google Scholar
Kay SS, Bilek AM, Dee KC, Gaver DP (2004) Градиент давления, а не продолжительность воздействия, определяет степень повреждения эпителиальных клеток в модели повторного открытия легочных дыхательных путей.J Appl Physiol 97: 269–276
PubMed Google Scholar
Knudsen L, Weibel ER, Gundersen HJ, Weinstein FV, Ochs M (2010) Оценка характеристик размера воздушного пространства путем измерения пересечения (хорды): точный и эффективный стереологический подход. J Appl Physiol 108: 412–421
PubMed Google Scholar
Knudsen L, Ruppert C, Ochs M (2017) Ремоделирование ткани при легочном фиброзе.Cell Tissue Res 367: 607–626
CAS PubMed Google Scholar
Knudsen L, Lopez-Rodriguez E, Berndt L, Steffen L, Ruppert C, Bates JHT, Ochs M, Smith BJ (2018) Альвеолярная микромеханика при повреждении легких, вызванном блеомицином. Am J Respir Cell Mol Biol. https://doi.org/10.1165/rcmb.2018-0044OC
Артикул PubMed Google Scholar
Lopez-Rodriguez E, Boden C, Echaide M, Perez-Gil J, Kolb M, Gauldie J, Maus UA, Ochs M, Knudsen L (2016) Дисфункция поверхностно-активного вещества во время сверхэкспрессии TGF-β1 предшествует профибротическому ремоделированию легких в естественным образом.Am J Physiol Lung Cell Mol Physiol 310: L1260 – L1271
PubMed Google Scholar
Lopez-Rodriguez E, Gay-Jordi G, Mucci A, Lachmann N, Serrano-Mollar A (2017) Метаболизм сурфактанта в легких: в начале жизни, в начале болезни и мишень в клеточной терапии. Cell Tissue Res 367: 721–735
CAS PubMed Google Scholar
Loring SH, Topulos GP, Hubmayr RD (2016) Транспульмональное давление: важность точных определений и ограничивающих предположений.Am J Respir Crit Care Med 194: 1452–1457
PubMed Google Scholar
Lovric G, Vogiatzis Oikonomidis I, Mokso R, Stampanoni M, Roth-Kleiner M, Schittny JC (2017) Автоматизированный компьютерный количественный анализ интактных легких мыши в альвеолярном масштабе. PLoS One 12: e0183979
PubMed PubMed Central Google Scholar
Lutz D, Gazdhar A, Lopez-Rodriguez E, Ruppert C, Mahavadi P, Günther A, Klepetko W, Bates JH, Smith B, Geiser T, Ochs M, Knudsen L (2015) Деререкрутмент альвеолярного отростка и уплотнение коллапса как решающие механизмы повреждения легких и фиброза.Am J Respir Cell Mol Biol 52: 232–243
PubMed Google Scholar
Ма Б., Бейтс Дж. Х. (2012) Модели континуума и пружинной сети взаимосвязи дыхательных путей и паренхимы. J Appl Physiol 113: 124–129
PubMed PubMed Central Google Scholar
Ma B, Bates JH (2014) Механические взаимодействия между соседними дыхательными путями в легком. J Appl Physiol 116: 628–634
PubMed PubMed Central Google Scholar
Ma B, Breen B, Bates JH (2013a) Влияние паренхиматозной гетерогенности на взаимозависимость паренхиматозных путей и дыхательных путей.Respir Physiol Neurobiol 188: 94–101
PubMed PubMed Central Google Scholar
Ма Б., Сандерсон М., Бейтс Дж. Х. (2013b) Взаимозависимость дыхательных путей и паренхимы в срезе легкого. Respir Physiol Neurobiol 185: 211–216
PubMed Google Scholar
Ma B, Smith BJ, Bates JH (2015) Устойчивость к изменению формы альвеол ограничивает диапазон распространения силы в паренхиме легких.Respir Physiol Neurobiol 211: 22–28
PubMed PubMed Central Google Scholar
Mai C, Verleden SE, McDonough JE, Willems S, De Wever W, Coolen J, Dubbeldam A, Van Raemdonck DE, Verbeken EK, Verleden GM, Hogg JC, Vanaudenaerde BM, Wuyts WA, Verschakelen JA (2017) Характеристики тонкого среза идиопатического фиброза легких коррелировали с результатами микро-КТ и гистологического анализа. Радиология 283: 252–263
PubMed Google Scholar
Maina JN, West JB (2006) Тонкий и сильный! Биоинженерная дилемма в структурном и функциональном дизайне газового барьера.Physiol Rev 85: 811–844
Google Scholar
Макияма AM, Гибсон LJ, Харрис RS, Венегас JG (2014) Концентрация напряжений вокруг ателектатической области: модель конечных элементов. Respir Physiol Neurobiol 201: 101–110
CAS PubMed Google Scholar
Mascheroni D, Kolobow T, Fumagalli R, Moretti MP, Chen V, Buckhold D (1988) Острая дыхательная недостаточность после фармакологически индуцированной гипервентиляции: экспериментальное исследование на животных.Intensive Care Med 15: 8–14
CAS PubMed Google Scholar
Mead J, Takishima T, Leith D (1970) Распределение напряжения в легких: модель легочной эластичности. J Appl Physiol 28: 596–608
CAS PubMed Google Scholar
Mercer R, Crapo J (1990) Пространственное распределение волокон коллагена и эластина в легких. J Appl Physiol 69: 756–765
CAS PubMed Google Scholar
Mercer RR, Laco JM, Crapo JD (1987) Трехмерная реконструкция альвеол в легком крысы для соотношений давление-объем.J Appl Physiol 62: 1480–1487
CAS PubMed Google Scholar
Mertens M, Tabuchi A, Meissner S, Krueger A, Schirrmann K, Kertzscher U, Pries AR, Slutsky AS, Koch E, Kuebler WM (2009) Альвеолярная динамика при остром повреждении легких: гетерогенное растяжение, а не циклическое раскрытие и крах. Crit Care Med 37: 2604–2611
PubMed Google Scholar
Milos S, Khazaee R, McCaig LA, Nygard K, Gardiner RB, Zuo YY, Yamashita C, Veldhuizen R (2017) Влияние повреждения легких, вызванного вентиляцией, на структуру и функцию пластинчатых тел.Am J Physiol Lung Cell Mol Physiol 313: L524 – L533
PubMed Google Scholar
Mishima M, Hirai T, Itoh H, Nakano Y, Sakai H, Muro S, Nishimura K, Oku Y, Chin K, Ohi M, Nakamura T, Bates JH, Alencar AM, Suki B (1999) Сложность геометрия конечного воздушного пространства, оцениваемая с помощью компьютерной томографии легких у здоровых людей и пациентов с хронической обструктивной болезнью легких. Proc Natl Acad Sci USA 96: 8829–8834
CAS PubMed Google Scholar
Mondoñedo JR, Suki B (2017) Прогнозирование структурно-функциональных отношений и выживаемости после хирургического и бронхоскопического лечения эмфиземы легких для уменьшения объема легких.PLoS Comput Biol 13: e1005282
PubMed PubMed Central Google Scholar
Mouded M, Egea EE, Brown MJ, Hanlon SM, Houghton AM, Tsai LW, Ingenito EP, Shapiro SD (2009) Апоптоз эпителиальных клеток вызывает острое повреждение легких, маскирующееся под эмфизему. Am J Respir Cell Mol Biol 41: 407–414
CAS PubMed PubMed Central Google Scholar
Mühlfeld C, Weibel ER, Hahn U, Kummer W., Nyengaard JR, Ochs M (2010) Является ли длина подходящей оценкой для характеристики легочных альвеолярных капилляров? Критическая оценка в человеческом легком.Анат Рек. 293: 1270–1275
Google Scholar
Muscedere JG, Mullen JB, Gan K, Slutsky AS (1994) Приливная вентиляция при низком давлении в дыхательных путях может усилить повреждение легких. Am J Respir Crit Care Med 149: 1327–1334
CAS PubMed Google Scholar
Николас Т.Э. (1996) Легочный сурфактант: это не просто краска на стенке альвеол. Респирология 1: 247–257
CAS PubMed Google Scholar
Ниман Г.Ф., Гатто Л.А., Хабаши Н.М. (2015) Влияние механической вентиляции легких на патофизиологию прогрессирующего острого повреждения легких.J Appl Physiol 119: 1245–1261
CAS PubMed Google Scholar
Nonaka PN, Uriarte JJ, Campillo N, Melo E, Navajas D, Farré R, Oliveira LV (2014) Механические свойства легких мышей при децеллюляризации органов додецилсульфатом натрия. Respir Physiol Neurobiol 200: 1–5
CAS PubMed Google Scholar
Ochs M (2010) Чем ближе мы смотрим, тем больше видим? Количественный микроскопический анализ системы легочных сурфактантов.Cell Physiol Biochem 25: 27–40
CAS PubMed Google Scholar
Ochs M, Weibel ER (2015) Функциональная конструкция легкого человека для газообмена. В: Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (eds) Легочные болезни и расстройства Фишмана, 5-е изд. McGraw-Hill, New York, pp 20–62
Google Scholar
Ochs M, Nenadic I, Fehrenbach A, Albes J, Wahlers T, Richter J, Fehrenbach H (1999) Ультраструктурные изменения внутриальвеолярных подтипов сурфактантов после экспериментальной ишемии и реперфузии.Am J Respir Crit Care Med 160: 718–724
CAS PubMed Google Scholar
Ochs M, Knudsen L, Hegermann J, Wrede C, Grothausmann R, Mühlfeld C (2016) Использование электронных микроскопов для изучения легких. Histochem Cell Biol 146: 695–707
CAS PubMed Google Scholar
Оклер Р.А., Хубмайр Р.Д. (2008) Повреждение и восстановление клеток в легких, поврежденных вентилятором.Respir Physiol Neurobiol 163: 44–53
CAS PubMed PubMed Central Google Scholar
Oldmixon EH, Hoppin FG (1991) История складывания альвеолярной перегородки и инфляции легких. J Appl Physiol 71: 2369–2379
CAS PubMed Google Scholar
Olmeda B, Martinez-Calle M, Perez-Gil J (2017) Легочный метаболизм сурфактанта в альвеолярном воздушном пространстве: биогенез, внеклеточные превращения, рециклинг.Анн Анат 209: 78–92
PubMed Google Scholar
Павоне Л.А., Альберт С., Карни Д., Гатто Л.А., Холтер Дж. М., Ниман Г. Ф. (2007) Поврежденная механическая вентиляция в нормальном легком вызывает прогрессирующее патологическое изменение динамической альвеолярной механики. Crit Care 11: R64. https://doi.org/10.1186/cc5940 pii]
Статья PubMed PubMed Central Google Scholar
Perez-Gil J (2008) Структура легочных мембран и пленок сурфактанта: роль белков и липид-белковые взаимодействия.Biochim Biophys Acta 1778: 1676–1695
CAS PubMed Google Scholar
Perlman CE, Lederer DJ, Bhattacharya J (2011) Микромеханика альвеолярного отека. Am J Respir Cell Mol Biol 44: 34–39
CAS PubMed Google Scholar
Petroulia V, Funke M, Zumstein P, Berezowska S, Ebner L, Geiser T, Torbica N, Heverhagen J, Poellinger A (2018) Повышенная плотность компьютерной томографии выдоха выявляет возможные аномалии радиологически сохраненной паренхимы легких при идиопатическом легочном фиброзе .Invest Radiol 53: 45–51
PubMed Google Scholar
Possmayer F, Nag K, Rodriguez K, Qanbar R, Schürch S (2001) Поверхностная активность in vitro: роль сурфактантных белков. Comp Biochem Physiol A Mol Integr Physiol 129: 209–220
CAS PubMed Google Scholar
Ravasio A, Hobi N, Bertocchi C, Jesacher A, Dietl P, Haller T (2011) Межфазное зондирование клетками альвеолярного типа II: новая концепция в физиологии легких? Am J Physiol Lung Cell Mol Physiol 300: C1456 – C1465
CAS Google Scholar
Retamal J, Bergamini BC, Carvalho AR, Bozza FA, Borzone G, Borges JB, Larsson A, Hedenstierna G, Bugedo G, Bruhn A (2014) Недолевой ателектаз вызывает воспаление и структурное повреждение альвеол в окружающих здоровых ткани при ИВЛ.Crit Care 18: 505
PubMed PubMed Central Google Scholar
Роан Э., Уотерс К.М. (2011) Что мы знаем о механической деформации альвеол легких? Am J Physiol Lung Cell Mol Physiol 301: L625 – L635
CAS PubMed PubMed Central Google Scholar
Салазар Э., Ноулз Дж. Х. (1964) Анализ характеристик давления и объема легких. J Appl Physiol 19: 97–104
CAS PubMed Google Scholar
Schiller HJ, McCann UG, Carney DE, Gatto LA, Steinberg JM, Nieman GF (2001) Измененная альвеолярная механика в остро поврежденном легком.Crit Care Med 29: 1049–1055
CAS PubMed Google Scholar
Schirrmann K, Mertens M, Kertzscher U, Kuebler WM, Affeld K (2010) Теоретическое моделирование взаимодействия между альвеолами во время инфляции и дефляции в нормальных и больных легких. J Biomech 43: 1202–1207
PubMed Google Scholar
Seah AS, Grant KA, Aliyeva M, Allen GB, Bates JH (2011) Количественная оценка роли дыхательного объема и PEEP в патогенезе повреждения легких, вызванного вентилятором.Энн Биомед Энг 39: 1505–1516
PubMed Google Scholar
Sera T, Yokota H, Tanaka G, Uesugi K, Yagi N, Schroter RC (2013) Мышиная легочная ацинарная механика во время квазистатической инфляции с использованием компьютерной томографии с синхротронной рефракцией. J Appl Physiol 115: 219–228
PubMed Google Scholar
Sirianni FE, Chu FS, Walker DC (2003) Фибробласты альвеолярной стенки человека напрямую связывают эпителиальные клетки типа 2 с эндотелием капилляров.Am J Respir Crit Care Med 168: 1532–1537
PubMed Google Scholar
Smith BJ, Bates JHT (2013) Оценка прогрессирования вызванного вентилятором повреждения легких у мышей. IEEE Trans Biomed Eng 60: 3449–3457
PubMed PubMed Central Google Scholar
Смит Б.Дж., Грант К.А., Бейтс Дж.Х. (2013) Связь развития повреждений, вызванных вентилятором, с механической функцией легких.Энн Биомед Энг 41: 527–536
PubMed Google Scholar
Smith B, Lundblad L, Kollisch-Singule M, Satalin J, Nieman G, Habashi N, Bates J (2015) Прогнозирование реакции поврежденного легкого на профиль механического дыхания. J Appl Physiol 118: 932–940
PubMed PubMed Central Google Scholar
Smith BJ, Bartolak-Suki E, Suki B, Roy GS, Hamlington KL, Charlebois CM, Bates JHT (2017) Связь утечки, вызванной травмой аппарата ИВЛ через барьер между кровью и газом, с нарушениями функции легких мыши.Front Physiol 8: 466
PubMed PubMed Central Google Scholar
Steffen L, Ruppert C, Hoymann HG, Funke M, Ebener S, Kloth C, Mühlfeld C, Ochs M, Knudsen L, Lopez-Rodriguez E (2017) Заместительная терапия сурфактантами уменьшает острое повреждение легких и легкое, связанное с уплотнением коллапса ремоделирование в модели блеомицина. Am J Physiol Lung Cell Mol Physiol 313: L313 – L327
PubMed Google Scholar
Steinberg JM, Schiller HJ, Halter JM, Gatto LA, Lee HM, Pavone LA, Nieman GF (2004) Альвеолярная нестабильность вызывает раннее повреждение легких, вызванное вентилятором, независимо от нейтрофилов.Am J Respir Crit Care Med 169: 57–63
PubMed Google Scholar
Subramaniam K, Kumar H, Tawhai MH (2017) Доказательства возрастного увеличения воздушного пространства, способствующего потере упругого давления отдачи легочной ткани и увеличению модуля сдвига в пожилом возрасте. J Appl Physiol 123: 79–87
CAS PubMed Google Scholar
Suki B, Ito S, Stamenovic D, Lutchen KR, Ingenito EP (2005) Биомеханика паренхимы легких: критическая роль коллагена и механических сил.J Appl Physiol 98: 1892–1899
PubMed Google Scholar
Суки Б., Стаменович Д., Хубмайр Р. (2011) Механика паренхимы легких. Compr Physiol 1: 1317–1351
PubMed PubMed Central Google Scholar
Tabuchi A, Nickles HT, Kim M, Semple JW, Koch E, Brochard L, Slutsky AS, Pries AR, Kuebler WM (2016) Острое повреждение легких вызывает асинхронную альвеолярную вентиляцию, которую можно исправить с помощью отдельных вздохов.Am J Respir Crit Care Med 193: 396–406
PubMed Google Scholar
Тодд Н.В., Атамас С.П., Лузина И.Г., Галвин Дж.Р. (2015) Постоянный альвеолярный коллапс является преобладающим механизмом при идиопатическом фиброзе легких. Эксперт Rev Respir Med 9: 411–418
CAS PubMed Google Scholar
Toshima M, Ohtani Y, Ohtani O (2004) Трехмерная архитектура сетей эластиновых и коллагеновых волокон в легких человека и крысы.Arch Histol Cytol 67: 31–40
CAS PubMed Google Scholar
Таунсли М.И. (2012) Структура и состав легочных артерий, капилляров и вен. Compr Physiol 2: 675–709
PubMed PubMed Central Google Scholar
Tschumperlin DJ, Margulies SS (1999) Отношение площади поверхности альвеолярного эпителия к объему в изолированных легких крысы. J Appl Physiol 86: 2026–2033
CAS PubMed Google Scholar
Tschumperlin DJ, Oswari J, Margulies AS (2000) Повреждение альвеолярных эпителиальных клеток, вызванное деформацией.Влияние частоты, длительности и амплитуды. Am J Respir Crit Care Med 162: 357–362
CAS PubMed Google Scholar
Велдхуизен Р.А., Велк Б., Харботтл Р., Хирн С., Наг К., Петерсен Н., Поссмайер Ф. (2002) Механическая вентиляция изолированных легких крысы изменяет структуру и биофизические свойства сурфактанта. J Appl Physiol 92: 1169–1175
PubMed Google Scholar
Венегас Дж. Г., Харрис Р. С., Саймон Б. А. (1998) Исчерпывающее уравнение для кривой легочного давления-объема.J Appl Physiol 84: 389–395
CAS PubMed Google Scholar
Влахакис Н.Е., Хубмайр Р.Д. (2005) Недостаточность клеточного стресса в легких, поврежденных вентилятором. Am J Respir Crit Care Med 171: 1328–1342
PubMed PubMed Central Google Scholar
Vlahakis NE, Schroeder MA, Pagano RE, Hubmayr RD (2002) Роль вызванного деформацией переноса липидов в предотвращении стрессового отказа плазматической мембраны.Am J Respir Crit Care Med 166: 1282–1289
PubMed Google Scholar
Weibel ER (1963) Морфометрия легкого человека. Springer, Берлин
Google Scholar
Weibel ER (1973) Морфологические основы альвеолярно-капиллярного газообмена. Physiol Rev 53: 419–495
CAS PubMed PubMed Central Google Scholar
Weibel ER (1984) Путь кислорода.Структура и функции дыхательной системы млекопитающих. Издательство Гарвардского университета, Кембридж
Google Scholar
Weibel ER (2009) Что делает легкое хорошим? Swiss Med Wkly 139: 375–386
PubMed Google Scholar
Weibel ER (2017) Морфометрия легких: связь между структурой и функцией. Cell Tissue Res 367: 413–426
PubMed Google Scholar
Weibel ER, Bachofen H (1997) Волокнистый каркас паренхимы легких.В: Crystal RG, West JB, Weibel ER, Barnes PJ (eds) Легкие: научные основы, 2-е изд. Lippincott-Raven, New York, pp 1139–1146
Google Scholar
Weibel ER, Crystal RG (1997) Структурная организация легочного интерстиция. В: Crystal RG, West JB, Weibel ER, Barnes PJ (eds) Легкие: научные основы, 2-е изд. Lippincott-Raven, New York, pp 685–695
. Google Scholar
Weibel ER, Gil J (1968) Электронно-микроскопическая демонстрация внеклеточного дуплексного выстилающего слоя альвеол.Respir Physiol 4: 42–57
CAS PubMed Google Scholar
Weibel ER, Gil J (1977) Структурно-функциональные отношения на альвеолярном уровне. В: West JB (ed) Биоинженерные аспекты легких. Биология легких в здоровье и болезнях, том 3. Марсель Деккер, Нью-Йорк, стр. 1–81
Google Scholar
Weibel ER, Taylor CR, Hoppeler H (1991) Концепция симморфоза: проверяемая гипотеза взаимосвязи структура-функция.Proc Natl Acad Sci USA 88: 10357–10361
CAS PubMed Google Scholar
Weibel ER, Taylor CR, Hoppeler H (1992) Варианты функции и дизайна: тестирование симморфоза в дыхательной системе. Respir Physiol 87: 325–348
CAS PubMed Google Scholar
Weibel ER, Sapoval B, Filoche M (2005) Дизайн периферических дыхательных путей для эффективного газообмена.Respir Physiol Neurobiol 148: 3–21
PubMed Google Scholar
Wilson TA, Bachofen H (1982) Модель механической структуры альвеолярного протока. J Appl Physiol 52: 1064–1070
CAS PubMed Google Scholar
Wu Y, Kharge AB, Perlman CE (2014) Вентиляция легких повреждает области с дискретным альвеолярным затоплением в зависимости от поверхностного натяжения.J Appl Physiol 117: 788–796
PubMed PubMed Central Google Scholar
Юань Х., Кононов С., Кавальканте Ф.С., Лютчен К.Р., Ингенито Е.П., Суки Б. (2000) Влияние коллагеназы и эластазы на механические свойства полосок легочной ткани. J Appl Physiol 89: 3–14
CAS PubMed Google Scholar
(PDF) Ex vivo Подготовка гиппокампальных капилляров и паренхиматозных артериол под давлением для функционального исследования
Журнал визуализированных экспериментов www.jove.com
Авторское право © 2019 Журнал визуализированных экспериментов, декабрь 2019 г. | 154 | e60676 | Страница 6 из 7
является потенциальной мишенью и затрудняет интерпретацию, потому что несколько типов клеток подвергаются воздействию лекарств. Мы в первую очередь разработали наш подход ex vivo
для решения этих потенциальных проблем. В заключение, для полного изучения ННО следует использовать несколько подходов.
Таким образом, в настоящем отчете описан интактный препарат ex vivo из находящихся под давлением артериол и капилляров гиппокампа, который позволяет
проверить действие фармакологических и биологических агентов на функциональные параметры в дискретных положениях вдоль капиллярно-артериолного континуума
.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Жюля Морена за содержательные комментарии к рукописи. Это исследование финансировалось за счет наград некоммерческой организации CADASIL
Вместе мы имеем надежду, Центра женского здоровья и исследований и NHLBI R01HL136636 (FD).
Ссылки
1. Нисимура, Н., Шаффер, К. Б., Фридман, Б., Лайден, П. Д., Кляйнфельд, Д.Проникающие артериолы являются узким местом в перфузии неокортекса.
Труды Национальной академии наук Соединенных Штатов Америки. 104 (1), 365-370 (2007).
2. Shih, A. Y. et al. Надежные и хрупкие аспекты коркового кровотока по отношению к основной ангиоархитектуре. Микроциркуляция (Нью-Йорк,
Нью-Йорк: 1994). 22 (3), 204-218 (2015).
3. Чиполла, М. Дж., Смит, Дж., Кольмейер, М. М., Годфри, Дж. А. Каналы SKCa и IKCa, миогенный тон и сосудорасширяющие реакции в средней части
Церебральные артерии и паренхиматозные артериолы: эффект ишемии и реперфузии.Инсульт. 40 (4), 1451-1457 (2009).
4. Нисториак М.А. и др. Фундаментальное увеличение зависящего от давления сужения паренхиматозных артериол головного мозга у крыс с субарахноидальным кровоизлиянием
из-за деполяризации мембраны. AJP: Сердце и физиология кровообращения. 300 (3), H803-H812 (2011).
5. Дабертран, Ф., Нельсон, М. Т., Брайден, Дж. Э. Ацидоз расширяет паренхиматозные артериолы мозга путем преобразования кальциевых волн в искры, чтобы
активировали каналы ВК. Циркуляционные исследования.110 (2), 285-294 (2012).
6. Дабертран, Ф., Нельсон, М. Т., Брайден, Дж. Э. Рецепторы рианодина, передача сигналов кальция и регуляция сосудистого тонуса в паренхиматозной микроциркуляции головного мозга.
. Микроциркуляция (Нью-Йорк, Нью-Йорк: 1994). 20 (4), 307-316 (2013).
7. Cipolla, M. J. et al. Повышенный вызванный давлением тонус паренхиматозных артериол крыс по сравнению со средними церебральными артериями: роль ионных каналов и чувствительность к кальцию
. Журнал прикладной физиологии.117 (1), 53-59 (2014).
8. Де Силва, Т. М., Модрик, М. Л., Дабертран, Ф., Фарачи, Ф. М. Изменения церебральных артерий и паренхиматозных артериол с возрастом: роль
Rho-киназы 2 и влияние генетического фона. Гипертония. 71 (5), 921-927 (2018).
9. Shih, A. Y. et al. Самый маленький инсульт: закупорка одного проникающего сосуда приводит к инфаркту и когнитивному дефициту. Природа Неврологии. 16
(1), 55-63 (2013).
10. Koide, M. et al.Инь и янь KV-каналов при патологиях мелких сосудов головного мозга. Микроциркуляция (Нью-Йорк, Нью-Йорк: 1994). 25 (1), (2018).
11. Girouard, H. et al. Каналы Ca2 + и BK на конце стопы астроцитов определяют как расширение, так и сужение артериол. Труды Национальной
Академии наук Соединенных Штатов Америки. 107 (8), 3811-3816 (2010).
12. Dabertrand, F. et al. Простагландин E2, предполагаемый нейроваскулярный связывающий агент, происходящий из астроцитов, скорее сужает, чем расширяет
паренхиматозных артериол.Журнал мозгового кровотока и метаболизма. 33 (4), 479-482 (2013).
13. Longden, T.A., Dabertrand, F., Hill-Eubanks, D.C., Hammack, S.E., Nelson, M.T., индуцированные стрессом ремоделирования передачи сигналов глюкокортикоидами
нервно-сосудистая связь через нарушение цереброваскулярной внутренней ректификации функции канала K +. Труды Национальной академии
наук Соединенных Штатов Америки. 111 (20), 7462-7467 (2014).
14. Dabertrand, F. et al. Подобный калиевой каналопатии дефект лежит в основе ранней стадии цереброваскулярной дисфункции в генетической модели болезни мелких сосудов
.Труды Национальной академии наук Соединенных Штатов Америки. 112 (7), E796-805 (2015).
15. Пирес, П. В., Салливан, М. Н., Притчард, Х. А. Т., Робинсон, Дж. Дж., Эрли, С. Унитарные события притока Са2 + канала TRPV3 вызывают эндотелий-
-зависимое расширение церебральных паренхиматозных артериол. AJP: Сердце и физиология кровообращения. 309 (12), ч3031-2041 (2015).
16. Johnson, A.C., Cipolla, M.J. Измененная структура и функция гиппокампа артериолы в модели преэклампсии на крысах: потенциальная роль в нарушении гиперемии, вызванной приступами
.Журнал мозгового кровотока и метаболизма. 37 (8), 2857-2869 (2016).
17. Johnson, A.C., Miller, J.E., Cipolla, M.J. Нарушение памяти у крыс со спонтанной гипертензией связано с гипоперфузией гиппокампа
и сосудистой дисфункцией гиппокампа. Журнал мозгового кровотока и метаболизма. 271678X19848510 (2019 г.).
18. Ядекола, С. Нейроваскулярное подразделение, достигшее совершеннолетия: путь через нервно-сосудистую связь в здоровье и болезнях. Нейрон. 96 (1),
17-42 (2017).
19. Рой, С.С., Шеррингтон, С.С. О регулировании кровоснабжения мозга. Журнал физиологии. 11 (1-2), 85-158,17 (1890).
20. Longden, T. A. et al. Капиллярная чувствительность к K + инициирует ретроградную гиперполяризацию для увеличения местного церебрального кровотока. Природа Неврологии. 20
(5), 717-726 (2017).
21. Харраз, О. Ф., Лонгден, Т. А., Дабертран, Ф., Хилл-Юбэнкс, Д., Нельсон, М. Т. Эндотелиальная активность GqPCR контролирует капиллярную электрическую передачу сигналов
и кровоток в головном мозге через истощение PIP2.Труды Национальной академии наук Соединенных Штатов Америки. 115 (15),
E3569-E3577 (2018).
22. Харраз, О. Ф., Лонгден, Т. А., Хилл-Юбэнкс, Д., Нельсон, М. Т. Истощение PIP2 способствует активности канала TRPV4 в эндотелиальных клетках
капилляров головного мозга мыши. eLife. 7, 351 (2018).
23. Ходжкин, А. Л., Хаксли, А. Ф. Количественное описание мембранного тока и его применение к проводимости и возбуждению в нерве.
Журнал физиологии.117 (4), 500-544 (1952).
24. Ballanyi, K., Doutheil, J., Brockhaus, J. Мембранные потенциалы и микроокружение дорсальных клеток блуждающего нерва in vitro во время истощения энергии.
Журнал физиологии. 495 (Pt 3), 769-784 (1996).
Случай ранней диагностики гемангиоматоза легочных капилляров у рабочего при воздействии кремнезема | BMC Pulmonary Medicine
PCH / PVOD встречается редко. Это заболевание, которое наиболее сложно диагностировать и лечить, особенно ЛКГ, который встречается реже, чем ВОБЛ.На сегодняшний день зарегистрировано менее 100 случаев PCH [4]. Было высказано предположение, что распространенность ВОБЛ составляет от 0,3 до 1,4 случая на миллион человек [11]. Отличить PCH или PVOD от других причин легочной гипертензии может быть непросто для клиницистов, радиологов и патологов [6]. Кроме того, поскольку и PCH, и PVOD имеют схожие клинические, визуализационные и гемодинамические проявления с плохим прогнозом, дифференциальный клинический и патологический диагноз между ними должен проводиться опытными врачами.
Хотя схожие рентгенологические признаки являются общими для ПКГ и ВОБЛ, в первом случае наблюдаются базилярные ретикулонодулярные помутнения и большие помутнения из травяного покрова, но нечасто во втором [6, 12]. В текущем случае были обнаружены диффузно матовые стеклянные помутнения в обоих легких с крошечными узелками на КТГ грудной клетки. Интересно, что некоторые специфические особенности, такие как образование воздушных ловушек, кистозные поражения и очаговые бронхиолэктазы, также наблюдались во всех полях легких, что указывает на паттерн заболевания дыхательных путей, что является атипичным изображением на изображениях при PCH.Клинические характеристики, такие как молодая женщина и профессиональный анамнез, заставили наших врачей в первую очередь рассмотреть другие заболевания, включая профессиональные заболевания легких и интерстициальные заболевания легких. Однако у нее не было никаких симптомов или лабораторных данных, связанных с заболеванием соединительной ткани. У нее не было повышенного RVSP или рентгенологических свидетельств легочной гипертензии или сосудистого поражения PCH. Кроме того, патологическое исследование легочной ткани выявило диффузное утолщение альвеолярных стенок в результате заметной пролиферации капилляров и инфильтрации в соседние бронхи, что соответствует PCH.Гистопатологическим признаком PCH является атипичная пролиферация капиллярных каналов в стенках альвеол и междолевых перегородках, что согласуется с нашими данными [3]. В некоторых предыдущих сообщениях PCH сопровождается легочным фиброзом или эмфиземой, что вызывает атипичные рентгенологические данные, как в нашем случае [13, 14]. Они объяснили, что повторное альвеолярное кровотечение или воспаление при PCH может вызвать вторичный фиброз легких. В данном случае также был выявлен очаговый паренхиматозный фиброз с кальцификацией в гистологии.Однако не было массивного паренхиматозного или плеврального фиброза, с помощью которого мы можем исключить возможность силикоза или асбестоза. Это может сделать КТ-визуализацию сложной и необычной в сочетании с отсутствием легочной гипертензии. У нее не было клинических симптомов, указывающих на астму и аллергические заболевания. Кроме того, на основании лабораторных данных, таких как количество эозинофилов и аллерген-специфический тест на IgE, а также тест функции легких, не было никаких доказательств аллергического заболевания легких.
PCH обычно сопровождается легочной гипертензией, хотя их взаимосвязь еще не выяснена.В отчете Xie et al. [15], 78% из 64 случаев ЛКГ имели легочную гипертензию. Правдоподобным объяснением может быть неконтролируемое разрастание легочных капилляров, инфильтрирующих сосудистую, бронхиальную и интерстициальную структуру легких. Кроме того, эти пролиферирующие капилляры могут окружать и сдавливать стенки легочных венул и вен, вызывая фиброз интимы и вторичную веноокклюзию, тем самым увеличивая сопротивление легочных сосудов при PCH [16]. В данном случае гистология показала, что капилляры инфильтрированы в альвеолярную и бронхиальную стенки, но не в сосудистую стенку.Это могло способствовать поддержанию легочного кровотока на ранней стадии естественного течения болезни. Есть несколько случаев PCH без легочной гипертензии, для которых нет определенных доказательств периваскулярной или внутрисосудистой пролиферации капилляров [5].
Что касается профессионального анамнеза, пациент работал на заводе по производству ванн без надлежащей защиты органов дыхания. Она могла подвергнуться воздействию кремнезема или органического растворителя. Учитывая эту особую ситуацию и время появления одышки, мы напомнили нам об остром силикопротеинозе, одном из респираторных заболеваний, связанных с кремнеземом [17].Однако она не показала никаких типичных проявлений силикопротеиноза, таких как двустороннее заболевание воздушного пространства с консолидацией, обычно включающей задние части легких на КТ грудной клетки и положительный по Шиффу липопротеин, заполняющий воздушное пространство [18].
Montani et al. [10] сообщили, что воздействие органических растворителей на рабочем месте может представлять фактор риска ВОБЛ. Хотя основные причины факторов риска PCH еще не идентифицированы, PCH может развиваться вторично в легких с PVOD, заболеваниями соединительной ткани и хроническим пассивным застоем, основываясь на нескольких сообщениях о случаях [19].Принимая во внимание указанную выше связь между PCH и PVOD, профессиональное воздействие диоксида кремния или органического растворителя у текущего пациента могло повлиять на клиническое течение PCH, хотя неясно, может ли воздействие и в какой степени быть связано с развитием PCH.
Недавно сообщалось, что мутация EIF2AK4 является одной из причин аутосомно-рецессивного PCH как семейного, так и спорадического происхождения [9]. Экспрессия EIF2AK4 или ее отсутствие способствует регуляции ангиогенеза, влияя на пролиферацию эндотелия и устойчивость к апоптозу.В отчете Best et al. идентифицировали различные мутации, включая c.3766C> T и c.1153dupG, у двух пациентов с семейным PCH и c.1392delT, c.860-1G> A и c.3438C> T у двух пациентов из 10 спорадических пациентов с PCH [9 ]. Кроме того, мутации EIF2AK4 были обнаружены в случаях семейной и спорадической ВОБЛ, что свидетельствует о четкой связи между ПКГ и ВОБЛ [20]. Однако не следует ожидать, что мутация EIF2AK4 является причиной всех случаев PCH / PVOD.Согласно отчету Montani et al. [10], 20% случаев ВОБЛ имели мутации EIF2AK4 . Похоже, что наличие дополнительных факторов, таких как факторы окружающей среды и дополнительные генетические локусы, может изменить эффект мутации EIF2AK4 с потерей функции, давая фенотип, который может варьироваться от одного, преимущественно демонстрирующего особенности ВОБЛ, до фенотипа, который преимущественно проявляет особенности. ПЧ [6].
Мы испытали патологически диагностированный как PCH у молодой женщины с жалобами на прогрессирующую одышку, которая подвергалась воздействию профессионального кремнезема или органического растворителя без повышенного RVSP, но с уникальными рентгенологическими данными.Поскольку хирургическая биопсия часто невозможна из-за состояния пациента, раннее распознавание PCH должно основываться на клинических и рентгенологических характеристиках. Гистологическое подтверждение требуется пациентам с подозрением на профессиональное заболевание легких, если клинические и визуальные паттерны нетипичны.
Сосудистые мальформации головного мозга
УЧЕБНИКИ
Beers MH, Berkow R., eds. Руководство Merck, 17-е изд. Станция Уайтхаус, Нью-Джерси: Исследовательские лаборатории Мерк; 1999: 244–45; 1427; 1482.
Смит WS, Джонстон СК, Истон Дж. Цереброваскулярные заболевания. В: Kasper, DL, Fauci AS, Longo DL, et al. Ред. Принципы внутренней медицины Харрисона. 16-е изд. Компании McGraw-Hill. Нью-Йорк, штат Нью-Йорк; 2005: 2392-93.
Марчук Д.А., Берг Ю.Н. ENG и ALK1 и наследственная геморрагическая телеангиэктазия (синдром Ослера-Вебера-Ренду) и морфогенез сосудов. В: Эпштейн CJ, Erickson RP, Wynshaw-Boris, eds. Врожденные ошибки развития. 1-е изд. Издательство Оксфордского университета. Нью-Йорк, штат Нью-Йорк; 2004: 319-28.
Джонстон М.В. Синдромы острого инсульта. В: Behrman RE, Kliegman RM, Jenson HB. Ред. Учебник педиатрии Нельсона. 17-е изд. Elsevier Saunders. Филадельфия, Пенсильвания; 2005: 2036-37.
Соломон Р.А., Пайл-Спеллман Дж., Мор Дж. П. Сосудистые опухоли и пороки развития. В: Rowland LP. Эд. Неврология Мерритта. 10-е изд. Липпинкотт Уильямс и Уилкинс. Филадельфия, Пенсильвания. 2000: 367-71.
Guttmacher AE, McDonald JE. Наследственная геморрагическая телеангиэктазия. В: Справочник НОРД по редким заболеваниям.Липпинкотт Уильямс и Уилкинс. Филадельфия, Пенсильвания. 2003: 418.
ОБЗОР СТАТЬИ
Артериовенозная мальформация
Choi JH, Mohr JP. Артериовенозные мальформации головного мозга у взрослых. Lancet Neurol. 2005; 4: 299-308.
Хуссейн М.С., Куреши А.И., Кирмани Дж.Ф. и др. Новости эндоваскулярного лечения цереброваскулярных заболеваний. J Endovasc Ther. 2004; 11 Дополнение 2: II32-42.
Браун Р. Д. мл., Флемминг К. Д., Мейер Ф. Б. и др. Естественный анамнез, оценка и лечение внутричерепных сосудистых мальформаций.Mayo Clin Proc. 2005; 80: 269-81.
Шаубле Б., Кашино Г.Д., Поллок Б.Е. и др. Судорожные исходы после стереотаксической радиохирургии по поводу артериовенозных мальформаций головного мозга.
Ямада С., Брауэр Ф.С., Колохан А.Р. и др. Понятие об отделах артериовенозной мальформации и хирургическом лечении. Neurol Res. 2004; 26: 288-300.
Кавернозная аномалия
Raychaudhuri R, Batjer HH, Awad IA. Внутричерепная кавернозная гемангиома: практический обзор клинических и биологических аспектов.Surg Neurol. 2005; 63: 319-28.
Бирн СП. Цереброваскулярные мальформации. Eur Radiol. 2005; 15: 448-52.
Ясуи Т., Комияма М., Иваи Й и др. Кавернома ствола мозга, демонстрирующая резкое спонтанное уменьшение размера во время наблюдения: отчет о болезни и обзор литературы. Surg Neurol. 2005; 63: 170-73; обсуждение 173.
Баумгартнер Дж. Э., Атер Дж. Л., Ха С. С. и др. Патологически подтвержденные кавернозные ангиомы головного мозга после лучевой терапии опухолей головного мозга у детей.Педиатр Нейрохирург. 2003; 39: 201-07.
Чжоу Л.Ф., Мао Ю., Чен Л. Диагностика и хирургическое лечение гемангиом кавернозного синуса: опыт 20 случаев. Surg Neurol. 2003; 60: 31-36; обсуждение 36-37.
Венозные ангиомы
Биланюк Л.Т. Сосудистые поражения орбиты у детей. Neuroimaging Clin N Am. 2005; 15: 107-20.
Чиллер KG, Frieden IJ, Arbiser JL. Молекулярный патогенез сосудистых аномалий: классификация на три категории на основе клинических и биохимических характеристик.Lymphat Res Biol. 2003; 1: 267-81.
Метры DW. Возможные осложнения сегментарных гемангиом младенчества. Semin Cutan Med Surg. 2004; 23: 107-15.
Tille JC, Pepper MS. Наследственные сосудистые аномалии: новое понимание их патогенеза. Артериосклер Thromb Vasc Biol. 2004; 24: 1578-90.
Вена уродства Галена
Куби Н., Леви Б.И. Понимание ангиогенеза: ключ к пониманию сосудистых мальформаций. J Neuroradiol. 2004; 31: 365-68.
Грин А.К., Берроуз П.Е., Смит Л. и др.Периорбитальная лимфатическая мальформация: клиническое течение и лечение у 42 пациентов. Plast Reconstr Surg. 2005; 115: 22-30.
Гупта А.К., Варма ДР. Пороки развития вены Галена: обзор. Neurol India. 2004; 52: 43-53.
Пунт Дж. Хирургическое лечение инсульта у детей. Pediatr Radiol. 2004; 34: 16-23.
Телеангиэктазии
Фридом Р.М., Ю С.Дж., Перрин Д. Биологический «скраб» легочных артериовенозных мальформаций: соображения в условиях кавопульмональной хирургии.Кардиол Янг. 2004; 14: 417-37.
Вудс CG. Микроцефалия человека. Curr Opin Neurobiol. 2004; 14: 112-17.
Марчук Д.А., Сринивасан С., Сквайр Т.Л. и др. Сосудистый морфогенез: сказки о двух синдромах. Hum Mol Genet. 2003; 12 ТУ № 1: Р97-112.
Sabba C, Pasculli G, Cirulli A, et al. Наследственная геморрагическая телеангиэктазия (болезнь Ренду-Ослера-Вебера). Минерва Кардиоангиол. 2002; 50: 221-38.
Атаксия телеангиэктазии с сосудистыми аномалиями в паренхиме головного мозга: отчет о вскрытии трупа и обзор литературы.Pathol Int. 2001; 51: 271-76.
ИЗ ИНТЕРНЕТА
МакКусик В.А., изд. Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Кавернозные пороки развития головного мозга; СКК. Регистрационный номер; 116860: Дата последнего редактирования; 02.11.2005.
МакКусик В.А., изд. Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Телеангиэктазия, наследственная геморрагическая болезнь Ренду, Ослера и Вебера; HHT. Регистрационный номер; 187300: Дата последнего редактирования; 18.02.2005 ..
МакКусик В.А., изд.Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Артериовенозные мальформации головного мозга. Регистрационный номер; 108010: Дата последнего редактирования; 07.02.2000.
Вагнер АЛ. Головной мозг, венозные сосудистые мальформации. эмедицина. Последнее обновление: 21 августа 2002 г. 8pp.
www.emedicine.com/radio/topic104.htm
Истощение PIP2 способствует активности канала TRPV4 в эндотелиальных клетках капилляров головного мозга мышей
Ранее мы продемонстрировали, что увеличение [K + ] o , связанное с нейрональной активностью, изменяет церебральный кровоток на капиллярном уровне, показывая, что внеклеточный K + активирует капиллярный Kir2.1, запуская ретроградный электрический (гиперполяризационный) сигнал, который распространяется вверх по течению, расширяя питающие артериолы и усиливая кровоток в активной области (Longden et al., 2017). Мы также показали, что G q ПЦР-опосредованное истощение PIP 2 подавляет капиллярную электрическую передачу сигналов (Harraz et al., 2018), идентифицируя точку пересечения между электрической передачей сигналов и эндотелиальной активностью ПЦР G q . В настоящем исследовании мы показываем, что cECs экспрессируют каналы TRPV4, и демонстрируем, что эти каналы тонически подавляются базальными уровнями PIP 2 .Кроме того, мы показываем, что активация ПЦР G q снимает ингибирование канала TRPV4 за счет истощения PIP 2 . Эта парадигма представляет фосфоинозитид PIP 2 в качестве главного регулятора передачи сигналов TRPV4 и Kir2.1 в эндотелии капилляров и подчеркивает способность ПЦР-активности G q настраивать баланс этих модальностей передачи сигналов в пользу передачи сигналов TRPV4 (рис. ).
Репертуар функциональных ионных каналов в цИК головного мозга остается не полностью охарактеризованным, хотя некоторые молекулярные особенности недавно стали предметом внимания.Например, наши данные свидетельствуют о том, что внутренний выпрямительный канал Kir2.1 является основным типом каналов K + в ЦИК головного мозга (Longden et al., 2017), тогда как Ca 2+ -чувствительные каналы SK и IK, которые являются присутствуют в артериальных и артериолярных ЭК и играют важную роль в регуляции сосудистого тонуса (Ledoux et al., 2008; Sonkusare et al., 2012; Taylor et al., 2003), не экспрессируются в ЦИК головного мозга (Longden et al., 2017). Примечательно, что идентичность деполяризующих (Na + и / или Ca 2+ -проницаемых) каналов в cECs, которые, как мы предполагаем, должны присутствовать, чтобы позволить мембранному потенциалу сбросить для поддержки повторной работы нашего ранее описанного Kir2.1-зависимый механизм NVC, основанный на передаче электрических сигналов, не известен. Наша демонстрация того, что высокоселективный агонист TRPV4, GSK101, индуцировал токи в цИК головного мозга, которые были устранены TRPV4-специфическим антагонистом, HC-067047, и отсутствовали в цИК от мышей TRPV4 — / — , твердо подтверждают наличие этого не -селективный катионный канал в капиллярах. В артериальных и артериолярных ЭК приток Ca 2+ , опосредованный TRPV4-каналом, тесно связан с активацией чувствительных к Ca 2+ SK и IK-каналов и последующей гиперполяризацией мембранного потенциала (Sonkusare et al., 2012). Однако, поскольку у ЦИК отсутствуют функциональные Ca 2+ -активированные каналы K + (Longden et al., 2017), TRPV4-опосредованный приток Na + / Ca 2+ в эти клетки вместо этого приведет к мембране. потенциальная деполяризация (Behringer et al., 2017; Earley, Brayden, 2015). В совокупности эти наблюдения предполагают, что канал TRPV4 является основным деполяризующим элементом в цИК, хотя мы не можем исключить возможность того, что другие, еще не идентифицированные катионные каналы могут вносить вклад в деполяризацию мембраны, как предполагали более ранние исследования (Csanády and Adam-Vizi , 2004; Popp and Gögelein, 1992; Csanády and Adam-Vizi, 2003).Наши наблюдения также подчеркивают тот факт, что функциональная роль каналов TRPV4 критически зависит от экспрессии и функции ключевых ассоциированных белков.
Интересно и разительно контрастирует со случаем периферических артериальных ЭК (Sonkusare et al., 2014; Sonkusare et al., 2012), вероятность открытия капиллярных каналов TRPV4 в цИК была заметно низкой в базальных условиях и увеличивалась при диализе. вне внутриклеточного содержимого — первое звено в цепи, ведущей к нашему открытию, что каналы TRPV4 в цИК по своей природе ингибируются внутриклеточным АТФ.Хорошо известно, что липидкиназы, участвующие в синтезе PIP 2 , требуют для своей активности миллимолярного АТФ (Balla and Balla, 2006; Hilgemann, 1997; Knight and Shokat, 2005; Suer et al., 2001), и этого достаточно. продемонстрировали, что поддержание PIP 2 зависит от АТФ в нескольких типах клеток (Suh and Hille, 2008; Ye et al., 2018; Zakharian et al., 2011), включая цИК (Harraz et al., 2018). Три основных направления представленных здесь доказательств подтверждают вывод о том, что цитозольное АТФ-зависимое поддержание устойчивых базальных уровней PIP 2 подавляет активность канала TRPV4.Во-первых, миллимолярные концентрации гидролизуемого АТФ подавляли активность капиллярных каналов TRPV4. Во-вторых, включение аналогов PIP 2 в патч-пипетку подавляло токи TRPV4. В-третьих, удаление PIP 2 или ингибирование его синтеза отменяет опосредованное АТФ ингибирование. Примечательно, что PIP 2 , как сообщается, напрямую взаимодействует с разными остатками на N-конце TRPV4 в гетерологичных системах экспрессии (Garcia-Elias et al., 2013; Takahashi et al., 2014). Однако в этих исследованиях были сделаны противоречивые выводы, одно из которых предполагает, что прямое связывание PIP 2 с доменом анкиринового повтора канала TRPV4 ингибирует различные способы активации TRPV4 (Takahashi et al., 2014) и другие сообщения о том, что PIP 2 необходим для активации канала, вызванного нагреванием, гипотонией или эпоксиэйкозатриеновой кислотой (EET), путем облегчения структурных перестроек канала (Garcia-Elias et al., 2013). Эти несоответствия могут отражать различные эффекты PIP 2 на поведение канала через привязку к нескольким сайтам в канале. Интересно, что предполагаемый активатор эндогенного канала TRPV4 (Earley and Brayden, 2015; Watanabe et al., 2003) 11,12-эпоксиэйкозатриеновая кислота (11,12-EET, 1 мкМ) вызывал токи в ЦИК даже в отсутствие диализованного PIP 2 (рисунок 3 — приложение к рисунку 2).В любом случае, наши результаты являются первыми, в которых сообщается о опосредованном PIP 2 подавлении каналов TRPV4 в эндотелии и, в более широком смысле, в нативных клетках, и они согласуются с результатами Takahashi et al., 2014. Интересно, что недавнее исследование предоставило структурные доказательства того, что молекулы липидов прочно связаны с фильтром селективности поры канала TRPV4, хотя идентичность и функция этих липидов не были охарактеризованы (Deng et al., 2018).
Canonical G q ПЦР-сигнализация включает активацию PLC и последующее разбиение PIP 2 на DAG и IP 3 .Агонисты рецептора, которые активируют G q ПЦР, могут значительно снизить PIP 2 , способствуя его гидролизу со скоростями, которые превышают скорости повторного синтеза PIP 2 . Мы показываем здесь, что PGE 2 , который, как ранее предполагалось, действует как агент NVC посредством воздействия на G s -связанные рецепторы EP 2 / EP 4 в гладких мышцах артериол (Lacroix et al., 2015 ; Zonta et al., 2003), активирует каналы TRPV4 в цИК независимо от действия метаболитов PIP 2 , DAG и IP 3 , снимая опосредованное PIP 2 подавление (Рисунок 4, Рисунок 5).Напротив, мы недавно показали, что агонисты ПЦР G q оказывают противоположный эффект на капиллярные каналы Kir2.1, ингибируя их способность опосредовать передачу электрических сигналов от капилляров к артериолам (Harraz et al., 2018). В соответствии с этими предыдущими выводами и нашими текущими наблюдениями, одновременный мониторинг токов каналов TRPV4 и Kir2.1 подтвердил двунаправленные эффекты агонистов ПЦР G q на два канала (Рисунок 6). Эта двусторонняя модуляция (рис. 7) уникальна, поскольку показывает, что один сигнальный каскад ПЦР G q способен изменять баланс между электрическим Kir2.1 (ингибирование , ) и передача сигналов TRPV4 ( облегчение, ). Учитывая отсутствие Ca 2+ -активированных каналов K + в цИК, отмеченное выше, истощение PIP 2 , вызванное передачей сигналов ПЦР G q , вероятно, деполяризует цИК за счет одновременного растормаживания деполяризующих каналов TRPV4 (это исследование ) и дезактивацию гиперполяризующих каналов Kir2.1 (Harraz et al., 2018).
На основе наших прямых измерений тока Kir2.1 (Harraz et al., 2018; Longden et al., 2017) и известной зависимости от напряжения и K + каналов Kir2.1 (Longden and Nelson, 2015), мы оцениваем, что выходной ток через эти каналы при физиологических потенциалах мембраны (около -40 мВ ) и внешнего K + (3 мМ) составляет ~ 6 фА. Увеличение внешнего K + до 10 мМ увеличит ток Kir2 при этом напряжении до ~ 260 фА. Несмотря на кажущуюся незначительность, такие небольшие мембранные токи — именно то, что необходимо для обеспечения точности проводимости.Мы измерили устойчивую и глубокую гиперполяризацию около -25 мВ в гладких мышцах артериол в ответ на капиллярную стимуляцию 10 мМ K + (Longden et al., 2017). Наше компьютерное моделирование показывает, что стабильная гиперполяризация мембраны 25 мВ требует, чтобы внешний (гиперполяризационный) ток значительно превышал внутренний (деполяризующий) ток. Наша оценка базального, подавленного PIP 2 тока TRPV4 при -40 мВ составляет около -80 фА. G q Активация ПЦР увеличивает вероятность открытия в ~ 6 раз, производя ток (400–500 фА), достаточный для эффективного короткого замыкания индуцированной K + гиперполяризации и нарушения этого ключевого Kir2.Механизм NVC на основе 1. В заключение, низкий уровень активности канала TRPV4 согласуется с функциональной ролью капилляров.
Активация капилляров G q ПЦР также должна запускать сигналы Ca 2+ в цИК, предположительно через IP 3 -опосредованное высвобождение Ca 2+ из внутриклеточных хранилищ, а также растормаживание каналов TRPV4 (как описано здесь) и последующий приток Ca 2+ . Такие капиллярные сигналы Ca 2+ должны положительно влиять на гемодинамику — и, таким образом, на функциональную гиперемию — обеспечивая правдоподобное объяснение роли агонистов ПЦР G q в процессе NVC, предположительно через зависимую от Ca 2+ активацию азотной кислоты. оксидсинтаза (NOS) и последующее высвобождение сосудорасширяющего средства NO (Förstermann et al., 1991; Марциано и др., 2017). Капиллярная передача сигналов Ca 2+ может также служить совершенно другой цели при функциональной гиперемии: поскольку локальные сигналы Ca 2+ представляют сайты истощения PIP 2 (через передачу сигналов ПЦР G q ) и, таким образом, деполяризации мембранного потенциала ( через растормаживание TRPV4 и деактивацию Kir2.1) они могут мешать прохождению электрических сигналов, генерируемых дальше по сосудистому дереву. Соответственно, эти сигналы могут представлять собой «знаки остановки» или «лежачие полицейские», которые играют роль в перенаправлении гиперполяризующих (вазодилататорных) сигналов от определенных областей мозга в дополнение к их роли в сбросе мембранного потенциала капилляров, о чем говорилось выше.
Учитывая роль PIP 2 в отрицательной регуляции каналов TRPV4, чрезвычайно низкая базальная активность TRPV4 и пониженная чувствительность к GSK101 в цИК (рис. 1) по сравнению с ЭК брыжеечной артерии (Sonkusare et al., 2012) предполагают различия в PIP. 2 «уставка» в этих двух сосудистых ложах. Это предположение имеет важное физиологическое значение для передачи электрических сигналов в головном мозге. Наши данные показывают, что уровни PIP 2 в цИК головного мозга достаточны для насыщения Kir2.1 (Harraz et al., 2018) и настраивают токи в каналах TRPV4 до уровней, которые предотвращают несоответствующую деполяризацию мембранного потенциала (Рисунок 3). В отсутствие подавления PIP 2 опосредованных каналом TRPV4 внутренних токов маловероятно, что увеличенные наружные токи K + через каналы Kir2.1 в ответ на повышенные K + будут достаточными, чтобы вызвать гиперполяризацию мембранного потенциала. Механистическая основа явно более высокого заданного значения PIP 2 в ЦИК головного мозга в настоящее время неизвестна, но может включать более низкую конститутивную активность ПЦР G q , более низкие уровни микросреды G q агонистов ПЦР и / или снижение G q Экспрессия ПЦР — и, таким образом, уменьшение распада PIP 2 .Наряду с этим недавний анализ одноклеточной транскриптомики показал, что уровни транскрипта Gα q ( Gnaq ) в эндотелии мозга мыши снижены по сравнению с таковыми в периферических легочных ЭК (Vanlandewijck et al., 2018). В качестве альтернативы, различия в заданном значении могут указывать на более устойчивый синтез PIP 2 в капиллярах мозга, предположение, которое подтверждается более высоким содержанием митохондрий — и, следовательно, синтезом АТФ — в высокоактивных ЦИК мозга по сравнению с другими ЭК (Oldendorf and Браун, 1975; Oldendorf et al., 1977).
В заключение, это исследование предоставляет убедительные доказательства того, что капилляры головного мозга экспрессируют каналы TRPV4, а также показывает, что активность этих каналов физиологически подавляется базальными уровнями PIP 2 . Это вводит PIP 2 и его модуляцию агонистами ПЦР G q в качестве основных регуляторов передачи сигналов в капиллярах головного мозга. При поддержании на достаточном уровне PIP 2 подавляет каналы TRPV4 и поддерживает передачу электрических сигналов от капилляров к артериолам, но в ответ на активацию ПЦР G q уровни PIP 2 снижаются, усиливая передачу сигналов TRPV4 и подавляя ретроградную передачу электрических сигналов. через Kir2.1 канал. Таким образом, ПЦР Capillary G q можно рассматривать как молекулярные переключатели, которые определяют модальность передачи сигналов в микрососудистой сети головного мозга.
Симптоматическая неразорвавшаяся капиллярная телеангиэктазия ствола головного мозга: отчет о трех случаях и обзор литературы
Капиллярные телеангиэктазии состоят из нерегулярных скоплений расширенных капилляров, смешанных с нормальной паренхимой головного мозга, и чаще всего располагаются в мостах1. Случайное открытие при аутопсии у людей без явных неврологических проявлений, капиллярные телеангиэктазии ствола головного мозга традиционно считались доброкачественными бессимптомными сосудистыми аномалиями.1-3 Из-за чрезвычайно медленного кровотока их демонстрация in vivo невозможна с помощью артериографии, но может быть получена с помощью МРТ.2 Мы сообщаем о трех пациентах с симптоматической телеангиэктазией капилляров ствола головного мозга, не связанной с разрывом сосудов.
Отчеты о случаях
КОРПУС 1
28-летняя женщина обратилась с жалобой на шум в ушах в левом ухе, который разбудил ее однажды ночью. Тиннитус, который она описала как рев фургона, повторился в течение следующих месяцев с менструальным обострением.Неврологическое обследование показало легкую слабость правой руки и ноги с диффузным повышением глубоких сухожильных рефлексов. Слух у нее был нормальный. Обычные лабораторные анализы крови, поиск антител к ДНК, анти-ANA и анти-ENA, а также результаты исследований свертывания крови были ничем не примечательными. Соматосенсорные вызванные потенциалы показали увеличение латентности и снижение амплитуды волн N20 и P39 справа. Слуховые вызванные потенциалы ствола головного мозга показали длительное латентное время между волнами I-V слева. МРТ головного мозга на 0.5 T показал пятнистую гиперинтенсивность овальной формы в плотности протонов и T2-взвешенные изображения в левой парамедианной области в понтомезэнцефалическом соединении (рис. 1). Других аномалий головного мозга замечено не было. Область изменения сигнала увеличилась после внутривенного введения контраста (рис. 1). Через 2 недели она была обследована на системе 1,5 Т с использованием градиентного эхо-сигнала T2 *, который показал пониженную интенсивность поражения ствола головного мозга (рис. 1). Тиннитус, неврологические данные и результаты МРТ не изменились через 5 лет.
фигура 1Пациент 1.Неразрывшаяся капиллярная телеангиэктазия ствола головного мозга. (A) Осевое T2-взвешенное (TR 4000 мс, TE 85 мс, длина эхо-последовательности 12) изображение турбо спинового эха демонстрирует пятнистую гиперинтенсивность (стрелка) в левом парамедианном понтомезэнцефалическом соединении. (B) Область показывает усиление контраста на осевом T1-взвешенном (TR 400 мс, TE 20 мс) спин-эхо-изображении после внутривенного введения Gd-DTPA. (C) Низкая интенсивность сигнала видна в той же области на осевом T2 * взвешенном (TR 600 мс, TE 25 мс, угол поворота 20) градиентном эхо-изображении.
КОРПУС 2
Женщина 30 лет без анамнеза обратилась с жалобами на пароксизмальные движения левой губы, которые внезапно появились через 4 недели после рождения первого ребенка. Непроизвольные движения спонтанно исчезли через 5 часов, но повторились дважды на следующей неделе. Неврологическое обследование и ЭЭГ в норме. Обычные лабораторные анализы крови, поиск антител к ДНК, анти-ANA и анти-ENA, а также результаты исследований свертывания крови были ничем не примечательными. Моторные, соматосенсорные и слуховые вызванные потенциалы ствола мозга были в норме.МРТ при 1,5 тесла показала очаговую пятнистую область гиперинтенсивности на Т2-взвешенных изображениях в нижней правой части моста, которая усилилась после введения внутривенного контраста. Других аномалий головного мозга не обнаружено. Через шесть месяцев симптомы не вернулись, неврологическое обследование было отрицательным, результаты МРТ не изменились; Последовательность, взвешенная с градиентным эхо-сигналом T2 * при 1,5 Тл, показала гипоинтенсивность поражения моста.
ДЕЛО 3
Мужчина 36 лет поступил с параличом правого глаза Белла.Неврологическое обследование показало полный паралич правого лицевого нерва. Стандартные лабораторные анализы крови и спинномозговой жидкости без особенностей. Его лечили преднизоном, и паралич лицевого нерва почти выздоровел за несколько дней. МРТ черепа при 0,5 Тл показала две маленькие точки с повышенной интенсивностью на изображениях, взвешенных по протонной плотности, которые усилились после внутривенного введения контраста в левой парамедианной центральной части базисного моста. Других аномалий головного мозга не обнаружено. МРТ головного мозга через 1,5 Тл через 1 месяц показала пониженную интенсивность точек в последовательностях, взвешенных по градиентному эхо-сигналу Т2 *.
Обсуждение
Капиллярные телеангиэктазии имеют характерные особенности МРТ, которые позволяют обнаруживать и дифференцировать их in vivo от других заболеваний ствола головного мозга, включая рассеянный склероз, инфаркт и новообразования.2 Эти особенности отражают чрезвычайно медленный кровоток в сосудах и нормальность смешанной паренхимы мозга. Соответственно, сосуды выглядят как изоинтенсивные или гипоинтенсивные области по сравнению с нормальной паренхимой головного мозга на изображениях не усиленного спинового эхо, взвешенных по Т1, и как изоинтенсивные или гиперинтенсивные области на изображениях с плотностью протонов и Т2-взвешенных спиновых эхо-изображениях и изображениях с быстрым спин-эхом.Прежде всего, они проявляют гипоинтенсивность на Т2 * -взвешенных градиентных эхо-изображениях, особенно если они получены на системах МРТ с высоким полем (≥1,0 Тл). Этот внешний вид отражает более высокую чувствительность последовательностей градиентного эха к высокому содержанию дезоксигемоглобина в застойной крови в аномальных сосудах, что определяет сокращение времени релаксации Т2 крови и снижение сигнала. 3 Обычно сосуды расширяются после введения контраста, создавая сетку из усиленных структур на фоне неусиленной паренхимы головного мозга.Стабильность характеристик МРТ с течением времени является важным ключом к различению капиллярной телеангиэктазии от кровотечения, при котором сложные паттерны интенсивности сигнала развиваются упорядоченным образом.4 Иногда капиллярные телеангиэктазии связаны с венозными аномалиями.
Частота телеангиэктазий капилляров ствола головного мозга неизвестна. В 1968 году Маккормик и др. 5 сообщили о 27 патологически подтвержденных случаях телеангиэктазии моста в серии из 164 сосудистых мальформаций задней черепной ямки.Совсем недавно Барр и др. 3 и Ли и др. 2 описаны клинические особенности и особенности МРТ 12 и 15 случаев телеангиэктазии моста. За 5 лет мы обнаружили, в дополнение к трем пациентам с симптомами, описанным здесь, еще два случая капиллярной телеангиэктазии ствола головного мозга, продемонстрированные МРТ, в которых не было обнаружено клинических аналогов. Один пациент был обследован на гипофизарную аменорею, другой — на головную боль.
В обзоре английской литературы мы обнаружили 20 случаев неразорвавшейся капиллярной телеангиэктазии ствола головного мозга с преходящими или постоянными симптомами, сопоставимыми с локализацией поражения, продемонстрированной патологией, КТ или МРТ.1-3 6-9 Расположение и проявление симптомов в этих 20 случаях вместе с нашими тремя случаями суммированы в таблице 1. Возраст проявления варьировал от 15 месяцев до 71 года, но преимущественно в третьем и четвертом десятилетии. Симптомы включали головокружение или диплопию у пяти из 20 (25%) пациентов, потерю слуха, головокружение, фокальную слабость или атаксию у четырех (20%), шум в ушах или нарушения речи у трех (15%), гиперрефлексию, монокулярный птоз и парестезии по одному экземпляру 1-3. 6-9
Таблица 1Пациенты с симптомами неразорвавшейся капиллярной телеангиэктазии ствола головного мозга
У трех наших пациентов расположение поражения соответствовало клиническим характеристикам.В случае 1 мальформация затрагивает акустический путь (латеральный лемниск), что, возможно, объясняет шум в ушах и длительную межволновую задержку I-V слуховых вызванных потенциалов ствола головного мозга с одной и той же стороны. Вовлечение правого кортикоядерного пучка может объяснить аномальное движение губ в нашем случае 2. В случае 3 поражение левого кортикоядерного тракта объясняет паралич Белла.
По нашим данным и в ранее описанных случаях, 1-3 6–9 симптомов, связанных с телеангиэктазией капилляров ствола головного мозга, имели преходящее или прерывистое течение, напоминающее преходящие ишемические атаки или воспалительные заболевания.
Патофизиология, лежащая в основе преходящих или прерывистых симптомов у пациентов с капиллярной телеангиэктазией, не установлена. Примечательно, что у двух наших пациенток симптомы развивались или обострялись во время менструального цикла или после беременности. При некоторых пороках развития сосудов, таких как ангиома глазницы, стероидные рецепторы присутствуют как в мышечных, так и в эндотелиальных клетках. 11 Мы утверждаем, что стимуляция стероидных рецепторов, экспрессируемых эндотелиальными клетками при телеангиэктазии, может быть пусковым моментом неврологических симптомов через вазомоторный или гемодинамический механизмы.
Сложная проблема, связанная с частотой и естественным течением телеангиэктазии стволовых капилляров ствола головного мозга, связана с возможностью того, что эти сосудистые аномалии резко проявляются в результате разрыва сосуда без какой-либо возможности документировать естественную сосудистую деформацию, которая компенсируется кровотечением.12 Частота геморрагических осложнений капиллярных телеангиэктазий неизвестно. Хотя в литературе описаны случаи внутрипаренхиматозных или субарахноидальных кровоизлияний из-за разрыва капиллярных телеангиэктазий, 12-15 геморрагических осложнений не возникали, ни у 27 пациентов МРТ документально подтвержденная телеангиэктазия ствола головного мозга в течение периода от 1 месяца до 4 лет. , 2 3 ни у наших пациентов.Кроме того, ни один из 27 случаев телеангиэктазии капилляров моста, описанных McCormick et al 5 были связаны со значительным кровотечением.
Знание особенностей МРТ капиллярной телеангиэктазии может помочь в определении реальной частоты и клинических коррелятов этой сосудистой мальформации.


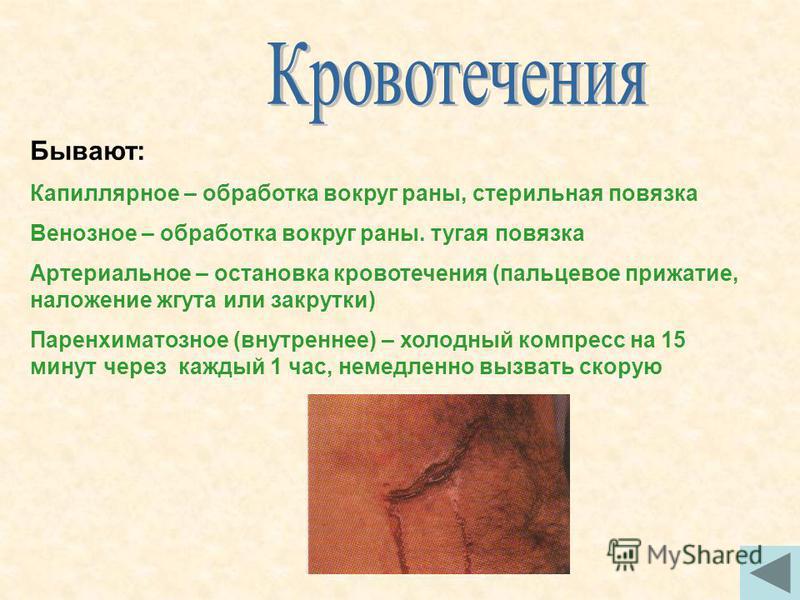

 Все процедуры с животными, показанные здесь, были одобрены Комитетом по уходу и использованию животных Медицинской школы Университета Невады и согласованы с «Руководящими принципами по уходу и использованию животных» Национального института здравоохранения.
Все процедуры с животными, показанные здесь, были одобрены Комитетом по уходу и использованию животных Медицинской школы Университета Невады и согласованы с «Руководящими принципами по уходу и использованию животных» Национального института здравоохранения. Поместите блюдо под рассекающий микроскоп (, рис. 3A, ). Приколите мозг к подушечке иглами 27-го калибра. Будьте осторожны, не размещайте булавки рядом со средней мозговой артерией (СМА).
Поместите блюдо под рассекающий микроскоп (, рис. 3A, ). Приколите мозг к подушечке иглами 27-го калибра. Будьте осторожны, не размещайте булавки рядом со средней мозговой артерией (СМА).


 Для этого откройте стяжки на противоположной канюле и проденьте ее на артериолу. Медленно затяните узел так, чтобы паренхиматозная артериола была привязана к стороне канюли. Избегайте продольного растяжения артериолы. ( Рисунок 3C ). ПРИМЕЧАНИЕ: Если целью исследования является перфузия лекарств через просвет, канюлируйте противоположный конец вместо того, чтобы привязывать паренхиматозную артериолу к стороне канюли. Убедитесь, что в канюлях нет кристаллов соли или внутренних отложений, которые блокируют внутрипросветный поток.Отрегулируйте скорость потока соответствующим образом, чтобы поддерживать напряжение сдвига на физиологическом уровне. Исследование Shih et al. показывает скорость потока внутри проникающих артериол у крыс 8 и может служить в качестве начального руководства для пилотных исследований.
Для этого откройте стяжки на противоположной канюле и проденьте ее на артериолу. Медленно затяните узел так, чтобы паренхиматозная артериола была привязана к стороне канюли. Избегайте продольного растяжения артериолы. ( Рисунок 3C ). ПРИМЕЧАНИЕ: Если целью исследования является перфузия лекарств через просвет, канюлируйте противоположный конец вместо того, чтобы привязывать паренхиматозную артериолу к стороне канюли. Убедитесь, что в канюлях нет кристаллов соли или внутренних отложений, которые блокируют внутрипросветный поток.Отрегулируйте скорость потока соответствующим образом, чтобы поддерживать напряжение сдвига на физиологическом уровне. Исследование Shih et al. показывает скорость потока внутри проникающих артериол у крыс 8 и может служить в качестве начального руководства для пилотных исследований. Присоедините камеру к столику микроскопа, соединив температурный зонд, вход и выход для перфузии с соответствующими трубками.Поднимите в артериолу давление внутри просвета 40 мм рт. Ст. Для паренхиматозных артериол мыши или 50 мм рт. На рис. 4D. показан пример перистальтического насоса, соединенного с датчиком давления для создания давления в канюлированной артериоле.
Присоедините камеру к столику микроскопа, соединив температурный зонд, вход и выход для перфузии с соответствующими трубками.Поднимите в артериолу давление внутри просвета 40 мм рт. Ст. Для паренхиматозных артериол мыши или 50 мм рт. На рис. 4D. показан пример перистальтического насоса, соединенного с датчиком давления для создания давления в канюлированной артериоле.