Изофермент лдг-1 в сыворотке
Активность ЛДГ-1 в норме составляет 15—25 % общей активности ЛДГ.
Изоферменты ЛДГ содержатся в тканях в строго определенном процентном соотношении, т.е. каждая ткань, в том числе и кровь, имеет характерный, только ей свойственный спектр изоферментов ЛДГ. При ряде патологических состояний, когда в том или ином органе увеличивается проницаемость клеточных мембран и происходит повреждение тканей, изоферменты ЛДГ в избыточном количестве поступают в кровь. Поскольку активность изоферментов в тканях в несколько сот раз превышает активность их в сыворотке крови, спектр изоферментов ЛДГ в ней становится похожим на спектр изоферментов ЛДГ в пораженном органе. В норме в сыворотке крови имеется следующее соотношение изоферментов: ЛДГ1 — 15-25 % общей активности ЛДГ, ЛДГ2 — 30-40 %, ЛДГЗ — 20-25 %, ЛДГ4 — 10-15 %, ЛДГ5 — 5-15 % [Комаров Ф.И. и др., 1981].
Определение активности ЛДП используется в клинической практике главным образом в диагностике инфаркта миокарда.
У больных с острым инфарктом миокарда в сыворотке крови резко повышается активность ЛДП и отчасти ЛДГ2. Динамика начала подъема активности ЛДП совпадает с таковой для общей ЛДГ, однако продолжительность повышения активности ЛДП более длительная — 10—12 сут.
При стенокардии активность ЛДП не изменяется. Поэтому при неясной клинической симптоматике и нормальной общей активности ЛДГ повышение активности ЛДП указывает на мелкие некротические очаги в миокарде.
При заболеваниях печени возрастает активность ЛДГ5 и ЛДГ4 и уменьшается активность ЛДП и ЛДГ2.
У больных с прогрессирующей мышечной дистрофией (миопатией) в крови повышается уровень изоферментов ЛДП, ЛДГ2, ЛДГЗ и снижается — ЛДГ4, ЛДГ5. Степень снижения ЛДГ4 и ЛДГ5 при миопатии коррелирует с тяжестью заболевания.
У больных острыми лейкозами отмечается отчетливое повышение активности изоферментов ЛДГ2 и ЛДГЗ. При опухолевых заболеваниях соотношение ЛДГ5/ЛДП всегда выше 1. Опухолевые ткани отличаются значительной активностью изоферментов ЛДГЗ, ЛДГ4, ЛДГ5 [Комаров Ф.И. и др., 1981].
190
Маркеры повреждения мозговой ткани Белок s-100 в сыворотке
Содержание белка S-100 в сыворотке крови в норме менее 0,2 мкг/л; в СМЖ — менее 5 мкг/л.
S-100
является специфическим белком
астроцитарной глии, способным связывать
кальций,
с мол. массой 21 000 Да. Белок впервые был
идентифицирован в 1965 г. B.W.
Moore
и получил
свое название благодаря растворимости
в 100 % сульфате аммония. Он состоит из
двух
субъединиц — а и p.
S-100
(Pβ)
присутствует в высоких концентрациях
в глиальных и шванновских клетках
(леммоцитах), S-100
(оф) — в глиальных клетках, S-100
(аа) — в поперечнополосатых
мышцах, печени и почках. Белок
метаболизируется почками, его время
биологической полужизни составляет 2
ч. Астроглиальные клетки — это наиболее
многочисленные
клетки в мозговой ткани. Они образуют
трехмерную сеть, которая является
опорным каркасом
для нейронов. Коммерчески доступные
наборы позволяют определять формы белка
S-100
(рр) и S-100
(оф), т.е. пригодны для диагностики
поражения мозговой ткани. В
последние годы определение этого белка
все более активно используется в клинике
в качестве
маркера повреждения мозговой ткани при
нарушениях мозгового кровообращения.
У больных с кровоизлиянием в мозг пик
концентрации S-100
в сыворотке крови и СМЖ наблюдается
уже в первые сутки заболевания, при
ишемическом инсульте этот пик приходится
на
3-й сутки [Kim
J.S.
et
al.,
1996]. Уровень повышения концентрации
коррелирует с объемом
поражения мозга. Так, К. Fassbender
и соавт. (1997) отмечают, что уровень S-100
в сыворотке
крови у больных ишемическим инсультом
при объеме поражения мозга более 5 см
Белок S-100 высвобождается в кровь у пациентов, оперированных в условиях искусственного кровообращения. Пик концентрации приходится на окончание экстракорпоральной циркуляции и затем уменьшается в неосложненных случаях. У пациентов с мозговыми осложнениями выход белка продолжается и в послеоперационном периоде. Уровень S-100 более 0,5 мкг/л через 2 дня после операции на сердце указывает на наличие у пациента неврологических осложнений [Johnsson P., 1996].
Повышение белка S-100 в сыворотке крови и СМЖ при нарушениях мозгового кровообращения обусловлено активацией микроглии. Е. Postler и соавт. (1997) показали, что в ранней фазе церебрального инфаркта микроглиальные клетки в периинфарктной зоне экспрес-сируют белки семейства S-100 и активно пролиферируют, причем белки экспрессируются не более чем 3 дня после инфаркта. Это говорит о том, что активация постоянной популяции микроглии является ранним ответом мозговой ткани на ишемию и может быть использована как ранний маркер ее повреждения.
Изофермент лдг-1 в сыворотке
Активность ЛДГ-1 в норме составляет 15—25 % общей активности ЛДГ.
Изоферменты ЛДГ содержатся в тканях в строго определенном процентном соотношении, т.е. каждая ткань, в том числе и кровь, имеет характерный, только ей свойственный спектр изоферментов ЛДГ. При ряде патологических состояний, когда в том или ином органе увеличивается проницаемость клеточных мембран и происходит повреждение тканей, изоферменты ЛДГ в избыточном количестве поступают в кровь. Поскольку активность изоферментов в тканях в несколько сот раз превышает активность их в сыворотке крови, спектр изоферментов ЛДГ в ней становится похожим на спектр изоферментов ЛДГ в пораженном органе. В норме в сыворотке крови имеется следующее соотношение изоферментов: ЛДГ1 — 15-25 % общей активности ЛДГ, ЛДГ2 — 30-40 %, ЛДГЗ — 20-25 %, ЛДГ4 — 10-15 %, ЛДГ5 — 5-15 % [Комаров Ф.И. и др., 1981].
Определение активности ЛДП используется в клинической практике главным образом в диагностике инфаркта миокарда.
У больных с острым инфарктом миокарда в сыворотке крови резко повышается активность ЛДП и отчасти ЛДГ2. Динамика начала подъема активности ЛДП совпадает с таковой для общей ЛДГ, однако продолжительность повышения активности ЛДП более длительная — 10—12 сут.
При стенокардии активность ЛДП не изменяется. Поэтому при неясной клинической симптоматике и нормальной общей активности ЛДГ повышение активности ЛДП указывает на мелкие некротические очаги в миокарде.
При заболеваниях печени возрастает активность ЛДГ5 и ЛДГ4 и уменьшается активность ЛДП и ЛДГ2.
У больных с прогрессирующей мышечной дистрофией (миопатией) в крови повышается уровень изоферментов ЛДП, ЛДГ2, ЛДГЗ и снижается — ЛДГ4, ЛДГ5. Степень снижения ЛДГ4 и ЛДГ5 при миопатии коррелирует с тяжестью заболевания.
У больных острыми лейкозами отмечается отчетливое повышение активности изоферментов ЛДГ2 и ЛДГЗ. При опухолевых заболеваниях соотношение ЛДГ5/ЛДП всегда выше 1. Опухолевые ткани отличаются значительной активностью изоферментов ЛДГЗ, ЛДГ4, ЛДГ5 [Комаров Ф.И. и др., 1981].
190
Маркеры повреждения мозговой ткани Белок s-100 в сыворотке
Содержание белка S-100 в сыворотке крови в норме менее 0,2 мкг/л; в СМЖ — менее 5 мкг/л.
S-100
является специфическим белком
астроцитарной глии, способным связывать
кальций,
с мол. массой 21 000 Да. Белок впервые был
идентифицирован в 1965 г. B.W.
Moore
и получил
свое название благодаря растворимости
в 100 % сульфате аммония. Он состоит из
двух
субъединиц — а и p.
S-100
(Pβ)
присутствует в высоких концентрациях
в глиальных и шванновских клетках
(леммоцитах), S-100
(оф) — в глиальных клетках, S-100
(аа) — в поперечнополосатых
мышцах, печени и почках. Белок
метаболизируется почками, его время
биологической полужизни составляет 2
ч. Астроглиальные клетки — это наиболее
многочисленные
клетки в мозговой ткани. Они образуют
трехмерную сеть, которая является
опорным каркасом
для нейронов. Коммерчески доступные
наборы позволяют определять формы белка
S-100
(рр) и S-100
(оф), т.е. пригодны для диагностики
поражения мозговой ткани. В
последние годы определение этого белка
все более активно используется в клинике
в качестве
маркера повреждения мозговой ткани при
нарушениях мозгового кровообращения.
У больных с кровоизлиянием в мозг пик
концентрации S-100
в сыворотке крови и СМЖ наблюдается
уже в первые сутки заболевания, при
ишемическом инсульте этот пик приходится
на
3-й сутки [Kim
J.S.
et
al.,
1996]. Уровень повышения концентрации
коррелирует с объемом
поражения мозга. Так, К. Fassbender
и соавт. (1997) отмечают, что уровень S-100
в сыворотке
крови у больных ишемическим инсультом
при объеме поражения мозга более 5 см
Белок S-100 высвобождается в кровь у пациентов, оперированных в условиях искусственного кровообращения. Пик концентрации приходится на окончание экстракорпоральной циркуляции и затем уменьшается в неосложненных случаях. У пациентов с мозговыми осложнениями выход белка продолжается и в послеоперационном периоде. Уровень S-100 более 0,5 мкг/л через 2 дня после операции на сердце указывает на наличие у пациента неврологических осложнений [Johnsson P., 1996].
Повышение белка S-100 в сыворотке крови и СМЖ при нарушениях мозгового кровообращения обусловлено активацией микроглии. Е. Postler и соавт. (1997) показали, что в ранней фазе церебрального инфаркта микроглиальные клетки в периинфарктной зоне экспрес-сируют белки семейства S-100 и активно пролиферируют, причем белки экспрессируются не более чем 3 дня после инфаркта. Это говорит о том, что активация постоянной популяции микроглии является ранним ответом мозговой ткани на ишемию и может быть использована как ранний маркер ее повреждения.
происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой — изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний. Изоформы лактатдегидрогеназы. Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты).
Лактатдегидрогеназа — олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle — мышца) и Н (от англ, heart — сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 — в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы
ЛДГ отличаются электрофоретической
подвижностью, что позволяет устанавливать
тканевую принадлежность изоформ ЛДГ.
Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) — в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
Изоформы лактатдегидрогеназы. А — строение различных изоформ ЛДГ; Б — распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В — содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы — слева и фотометрическое сканирование — справа).
2. Необратимые ингибиторы ферментов как
лекарственные препараты
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, — широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой Nh3-группе одной из субъединиц циклооксигеназы (см. схему ниже).
Это вызывает снижение образования продуктов реакции простагландинов (см. раздел 8), которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
13. Изоферменты. Особенности строения и функционирования (рассмотреть на примере лдг). Значение определения изоферментного спектра ферментов в диагностике заболеваний.
) Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты.
Лактатдегидрогеназа — олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle — мышца) и Н (от англ, heart — сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 — в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ
Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) — в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
14. Аллостерическая регуляция. Ингибирование по принципу обратной связи.
АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ
(от алло и греч. stereos — пространственный), контроль за скоростью протекания отдельных метаболич. процессов в организме за счёт изменения активности регуляторных (аллостерических) ферментов. Направлена на наиболее экономичное использование материальных и энергетич. ресурсов клетки. Аллостерич. фер менты обладают четвертичной структурой (состоят из неск. полипептидных пеней) и помимо активного центра имеют обособленные «аллостерические» центры (один или неск.) на поверхности своих молекул. К этим центрам присоединяются специфич. регуляторы, т. н. эффекторы, изменяющие активность фермента, а следовательно, и всего метаболич. процесса в целом. В качестве эффекторов часто выступают нуклеотиды (напр., аденило-вая к-та, АТФ и т. п.), аминокислоты (в реакциях биосинтеза др. аминокислот) и др. А. р. анаболич. (биосинтетических) Путей осуществляется в осн. по принципу обратной связи, когда конечный продукт биосинтетич. цепи подавляет действие фермента, катализирующего начальную стадию всего процесса (т. н. ретроингибированне). В катаболич. путях, обеспечивающих клетку энергией, активность первого фермента контролируется соединениями, к-рые показывают уровень эпергетич. состояния клетки в каждый данный момент, напр. фосфатами и аде-ниловыми нуклеотидами. Для нек-рых метаболич. путей известна ситуация, когда первый метаболит в цепи после-доват. реакций активирует фермент, катализирующий последнюю стадию, обеспечивая т. н. активацию предшественником.
1)Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
Билет 1.
Мультиферментный комплекс — это комплекс, в котором принимают участие несколько ферментов, при этом продукт предшествующей реакции является субстратом следующей реакции.
Пример:
— дыхательная цепь;
— гликолиз;
— пируватдегидрогеназы;
— синтетаза жирных кислот.
Изоферменты— множественные молекулярные формы данной особи, катализирующие одну и туже реакцию, но отличающиеся друг от друга по физическим и химическим свойствам и разделяющиеся с помощью физико-химических методов.
Примером фермента, имеющего изоферменты, является гексокиназа, имеющая четыре изотипа, обозначаемых римскими цифрами от I до IV. При этом гексокиназа IV, экспрессируется почти исключительно впечении обладает особыми физиологическими свойствами. Ещё одним примером фермента, имеющего изоферменты, являетсяамилаза— панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Третий пример фермента,креатинфосфокиназа— изотип этого фермента, экспрессируемый всердце, отличается от креатинфосфокиназы скелетных мышц
Энзимодиагностика— определение активности фермента.
Изоферменты ЛДГ органоспецифичны
ЛДГ5 —характерен для ткани, в которой анаэробные процессы.
ЛДГ1— для ткани, в которой аэробные процессы.
В инфаркте миокарда кровь из сердца выходит с ЛДГ1, при заболеваниях печени — ЛДГ4 , ЛДГ5, при патологиях лёгких ЛДГ3.
АСТ — имеет двойную локализацию (митохондрии и цитоплазма)
АЛТ — локализуется только в цитоплазме.
Активность АЛТ увеличивается при заболеваниях печени. Активность АСТ увеличивается при инфаркте миокарда.
Коэфициент Де Ритиса <1 при патологиях печени – АСТ/АЛТ = 1,75
Активность щелочной фосфатазыувеличивается при рахите, механической желтухе и патологии костной ткани.
Активность кислой фосфатазыувеличивается при раке простаты.
Активность амилазыувеличивается при патологии слюнных желез и остром панкреатите.
Также при остом панкреатите Увеличена активность:амилаза крови и мочи, липаза, фосфолипаза, трипсин, химотрипсин.
А при гепатите Увеличена активность:АЛТ, АСТ, ЛДГ4,5, сорбитолдегидрогеназа.
Коэффициент де Ритиса <1
Лечение ферментами
Заместительная терапия
Пепсин — при недостаточной активности пепсина в желудке, при нарушении переваривания белков, синтеза и секреции пепсина
Патогенетическая терапия
Трипсин, химотрипсин— при лечении гнойных ран (в хирургии и стоматологии), способен расщеплять пептидные связи в белках
ДНКаза — используется в лечении вирусных кератитов, гнойных бронхитов
Фибринолизин, стрептокиназа— способны растворять нити фибрина (ликвидация тромбов)
Липаза, гиалуронидаза-используются для лечения спаечной болезни, рубцов
Лизилоксидаза, аспарагиназа— лечение опухолей
2) Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жк с нечетным количеством углеродных атомов и ненасыщенных жк.
Окисление жирных кислот (β-окисление)
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2и воды. Этот путь называетсяβ-окисление.
Включает 4 этапа — первая стадия дегидрирования, стадия гидратации, вторая стадия дегидрирования, тиолазная реакция.

Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие изкрови или появляющиеся прилиполизе собственных внутриклеточных ТАГ.
Расчет энергетического баланса β-окисления линолиевой кислоты.
так как число атомов углерода равно 18, то количество молекул ацетил-S-КоАравно 9. Значит при его окислении в ЦТК образуется 9×12=108 молекул АТФ.
исходя из формулы (n/2 — 1) число циклов β-окисления равно 8. При расчете получаем 8×5=40 молекул АТФ.
в кислоте имеются 2 двойные связи. Следовательно, в двух циклах β-окисления не образуется 2 молекулы ФАДН2, что равноценно потере 4 молекул АТФ.
на активацию жирной кислоты тратятся 2 макроэргические связи.
таким образом, энергетический выход 108 + 40 — 4 — 2 =142 молекулы АТФ.
Окисление жирных кислот с нечетным числом углеродных атомов
Жирные кислоты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой образуется пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и образованию сукцинил-SКоА. В этих реакциях участвуютбиотинивитамин В12.
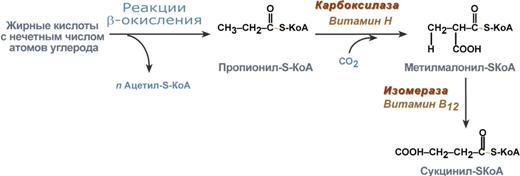
Последние реакции окисления жирных кислот с нечетным числом атомов углерода
Окисление ненасыщенных жирных кислот
При окислении ненасыщенных жирных кислот возникает потребность клетки в дополнительных ферментах изомеразах. Эти изомеразы перемещают двойные связи в жирнокислотных остатках из γ—в β—положение и переводят природные двойные связи изцис— втранс-положение.
Таким образом, уже имеющаяся двойная связь готовится к β-окислению и пропускается первая реакция цикла, в которой участвует ФАД.
