Анализ крови на ионизированный кальций
Ионизированный кальций (Са2+) – биологически активная форма кальция. Ионизированный кальций играет ключевую роль в регуляции внутриклеточных процессов. Является антагонистом магния. Уровень ионизированного кальция может существенно меняться при изменениях кислотно-основного состояния крови: при алкалозе – снижается, при ацидозе – повышается.
Данный тест играет значимую роль у беременных, при симптомах гиперпаратиреоза (также у детей, рожденных матерями с признаками гиперпаратиреоза), при почечной или печеночной недостаточности, после переливания компонентов крови.
Ионизированный Ca не связан с белками. Он выполняет такие функции, как формирование основы костной ткани, участие в мышечных сокращениях, процессе свертывания крови. Макроэлемент входит в состав костной ткани и зубов.
Ионизированный макроэлемент составляет около половины от его общего количества.
Определения количества общего Ca во многих случаях достаточно, чтобы оценить обмен кальция. Этот показатель отражает уровень свободного Ca, так как количество свободной и связанной фракций в большинстве случаев сбалансировано. Иногда баланс нарушается, и общий Ca не может служить достоверным показателем обмена этого макроэлемента. В таких ситуациях рекомендуется провести анализ крови на ионизированный кальций. Значительные колебания его уровня чреваты нарушением сердечного ритма (тахикардией либо брадикардией), нарушениям ясности сознания, спазмами мышц. В некоторых случаях такие колебания могут стать причиной комы.
Этот показатель отражает уровень свободного Ca, так как количество свободной и связанной фракций в большинстве случаев сбалансировано. Иногда баланс нарушается, и общий Ca не может служить достоверным показателем обмена этого макроэлемента. В таких ситуациях рекомендуется провести анализ крови на ионизированный кальций. Значительные колебания его уровня чреваты нарушением сердечного ритма (тахикардией либо брадикардией), нарушениям ясности сознания, спазмами мышц. В некоторых случаях такие колебания могут стать причиной комы.
Изменения показателей в течение суток являются нормой. Максимальная концентрация макроэлемента наблюдается в конце дня, а утром она снижена. Количество Ca может отклоняться от нормы у женщин, которые используют оральные либо инъекционные контрацептивы. У пожилых людей его количество значительно снижено. Прием ряда препаратов может оказывать значительное влияние на результаты теста. Важно поставить в известность врача, который будет оценивать результаты анализа, о приеме любых препаратов.
Кальций ионизированный
Именно уровень ионизированного кальция в крови регулируется ПТГ, кальцитонином, активной формой витамина D3, продукция которых зависит от концентрации кальция в крови. Снижение концентрации свободных ионов кальция приводит к повышению нейромышечной возбудимости и появлению синдрома тетании, вызывает судороги, бронхоспазм и ларингоспазм, удлинение интервала Q–Т на электрокардиограмме. Концентрация ионизированного кальция меняется в течение суток: максимальная концентрация в 20 ч, минимальная в 2–4 ч ночи. Уровень свободного кальция в крови зависит от концентрации в крови магния, существенно меняется при нарушениях КОР: алкалоз увеличивает связывание и снижает концентрацию, тогда как ацидоз, напротив, снижает связывание и увеличивает концентрацию ионизированного кальция в крови.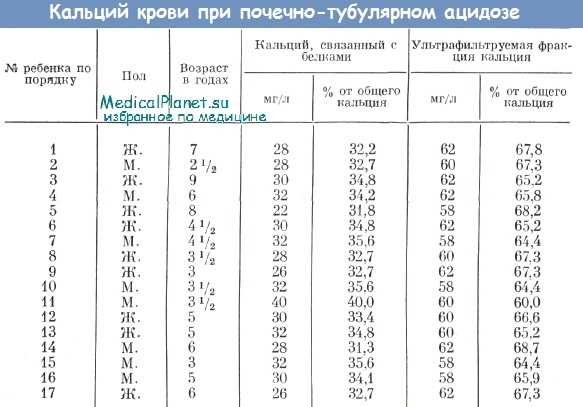
Показания к исследованию.
- Гипер- и гипокальциемия, особенно в сочетании с диспротеинемией;
- состояние после переливаний цитратной крови, введения гепарина;
- обширные травмы, хирургическое вмешательство, сепсис, ожоги;
- хроническая почечная недостаточность;
- нефротический синдром;
- мальабсорбция;
- множественная миелома;
- нарушения КОР.
Особенности взятия и хранения образца. Сыворотка или плазма (гепарин), тщательно и быстро отделенные от клеточных элементов крови. Проба крови должна быть взята в анаэробных условиях. Не использовать в качестве антикоагулянтов оксалат, цитрат или ЭДТА. Образцы хранить в тщательно закупоренной посуде.
Метод исследования. Определение концентрации ионизированного кальция в крови в настоящее время проводят преимущественно ионоселективным методом.
Повышенные значения.
- первичный гиперпаратиреоз, псевдогиперпаратиреоз;
- гипервитаминоз D3;
- злокачественные новообразования, метастазы в костную ткань, заболевания крови;
- ацидоз;
- прием тиазидных диуретиков, андрогенов, препаратов лития.
Пониженные значения.
- первичный гипопаратиреоз, псевдогипопаратиреоз;
- гиповитаминоз витамина D3;
- хронические заболевания почек, почечная недостаточность;
- тяжелые поражения скелетных мышц, состояние после обширных травм, хирургических вмешательств, ожогов;
- сепсис;
- острый панкреатит;
- гипомагниемия, гиперфосфатемия;
- алкалоз.
Кальций ионизированный (свободный кальций) — цена анализа в Днипро в ИНВИТРО
Исследуемый материал Плазма (гепарин)
Метод определения
Ионселективные электроды.
Ионизированный кальций представляет собой кальций, свободно циркулирующий в крови, он не связан с белками. Это дало ему еще одно название — свободный кальций.
Для оценки кальциевого обмена часто бывает достаточно общего показателя, который отразит количество свободного кальция в крови.
Когда необходимо сдать анализ
Анализ на ионизированный кальций в крови дает возможность оценивать кальциевый обмен. Сдать анализ следует в случае:
- лечения после реанимации, ожогов, обширной травмы, хирургической операции;
- диагностики гиперфункции паращитовидной железы, онкологических заболеваний;
- проведения процедуры гемодиализа;
- назначения и приема лекарственный средств: гепарин, магнезия, бикарбонаты, препараты кальция.
Норма ионизированного кальция
В норме ионизирующий кальций в крови в разных лабораториях может незначительно отличаться. Уровень ионов кальция обуславливается возрастом человека.
У детей до 16 лет показатель кальция в ионизированной форме по сравнению с взрослыми несколько повышен.
Если у ребенка кальций ниже нормы, то могут наступить неприятные последствия – судороги, спонтанные переломы, задержка развития нервной и костной систем.
У взрослых содержание кальция снижается, у женщин на показатели влияет беременность, контрацепция, лактация.
У мужчин, женщин после 50-ти лет постепенно уменьшается объем костей. Потери кальция становятся причиной его неправильного распределения в организме. Если уровень кальция понижен, происходит нарушение обмена костных клеток, в результате развивается остеопороз, который проявляет себя болью в суставах, сутулой осанкой, деформацией позвоночника.
Пониженный уровень ионизированного кальция
Что делать, когда расшифровка биохимического анализа крови покажет низкий уровень данного минерала? Прежде всего, ввести в свой рацион молочные продукты, включая твердый сыр, творог, молоко.
Причины повышенного уровня ионизированного кальция
Что показывает уровень кальция выше нормы? Это может быть результатом приема некоторых лекарств, а также свидетельствовать о таких расстройствах, как гипертиреоз, злокачественные новообразования и пр. В данном случае рекомендуется сделать дополнительные анализы, чтобы врач смог определиться с вопросом, как снизить этот показатель.
Анализ крови на ионизированный кальций вы можете сделать в лаборатории ИНВИТРО по сравнительно невысокой стоимости. Здесь же вам проведут дополнительные исследования в случае необходимости. Лаборатория имеет отличные отзывы, что доказывается отличным обслуживанием и приемлемыми ценами.
Литература
Jacobs D., DeMott W., Oxley D. Laboratory test handbook, Lexi-comp. 2004, pp. 328 — 329.Нарушение метаболизма кальция: описание болезни, причины, симптомы, стоимость лечения в Москве
Нарушение метаболизма кальция вследствие отклонений в функциональности эндокринных желез моет привести к серьезным осложнениям. Кальция является минералом, необходимым организму для формирования и сохранения полноценного состояния костной ткани. В организме этот минерала содержится в количестве 1,5 кг.
Кальция является минералом, необходимым организму для формирования и сохранения полноценного состояния костной ткани. В организме этот минерала содержится в количестве 1,5 кг.
Кальций поступает в организм с продуктами питания, а так же вырабатывается паращитовидными железами. Эндокринная система регулирует обменные процессы между кальцием и фосфором. При гормональном дефиците происходит повышение фосфатов в крови с сопутствующим снижением показателей уровня кальция. Нарушение функций железы моет привести и к обратному процессу, когда показатели кальция увеличены. Оба вида отклонений не считаются нормой и вызывают развитие патологических процессов.
Характерные особенности
В организме человека нарушение кальциевого метаболизма провоцирует развитие различных заболеваний. Кальций считается важным элементом в процессе регулирования нервной возбудимости мышечных тканей, процессе гемостаза, в стабилизации клеточной ткани мембран, в трансдукции внутриклеточного сигнала.
В медицине выделяют две формы нарушения минерального метаболизма в эндокринной системе:
Второй тип заболевания опаснее и требует более сложного лечения. В большинстве случаев, если патология запущена, врачи прибегают к хирургическому вмешательству.
Для того чтобы понять, что могло спровоцировать изменение в выработке паращитовидными железами кальция в кровь, как бороться с этим нарушением и какие могут быть последствия, следует рассматривать каждую патологию отдельно.
Причины гипокальциемии
Эндокринные органы чувствительны к воздействию на них, поэтому кальциевый метаболизм может нарушаться по разным причинам.
Понижение содержания Ca в плазме может произойти по следующим причинам:
-
травматизация шеи с кровотечением;
-
осложнение после проведенные операции на щитовидной железе;
-
воспалительные процессы;
-
ионизирующее излучение;
-
метастазирование в эндокринных органах;
-
недостаточность надпочечников;
-
аутоиммунные заболевания;
-
болезни системного типа.

Выявление причин считается основой лечения, поскольку при продолжении влияния негативных факторов терапия окажется не эффективной.
Причины гиперкальциемии
Избыточное количество Ca в плазме может быть спровоцировано несколькими факторами. Не редко, нарушение кальциевого метаболизма возникает по причине развития злокачественных образований или доброкачественных опухолей.
У 80% больных гиперкальциемия развивается из-за нарушений, возникающих в результате формирования на гипофизе аденомы солитарной. Аденома в свою очередь образуется по причине стрессов, пониженного давления, приема гормонов и др.
В 12% случаев причиной становится первичная форма гиперплазии. У 2% пациентов диагностируется рак железы паращитовидной. Около 6 % больных имеют множественную аденому.
К причинам так же можно отнести:
-
дефицит в рационе продуктов, содержащих кальций;
-
нарушение мальабсорбционных функций кишечника;
-
почечная недостаточность в хронической форме.

Лечение в данном случае предполагает устранение причины. Если после этого показатели не изменяются, проводится направленная терапия, или даже хирургическое вмешательство.
Немного подробнее о симптоматике
Клиническая картина в обоих случаях — выраженная. Основной областью поражения становится костная система, которая содержит более 90% кальция от общего его содержания в организме.
Симптоматика гиперкальциемии, относительно костной ткани:
-
псевдо- и простая форма подагры;
-
деформация;
-
болевые ощущения;
-
мышечная слабость и атрофия;
-
переломы даже при простых ушибах;
-
кистозные образования костей.
При тяжелой стадии возникает ощущение «мурашек», онемение и жжение на отдельных участках тела, может наблюдаться временная парализация тазовых мышц.
Гипокальциемия характеризуется судорожными приступами, которые могут затрагивать не только конечности, но и мышцы грудной клетки. Опасность предоставляет гипокальциемический криз, который вызывает серьезные осложнения.
Гиперкальциемический криз
Редким, но опасным осложнением является гиперкальциемический криз. В остром состоянии у больного нарушается работа всей нервной системы и ускоряется свертываемость крови. Повышенная густота крови, предполагает повышенные риски для жизни больного, поскольку это может привести к формированию тромбов или полной остановке сердечной мышцы.
Криз гиперкальциемический имеет симптоматику:
-
сохранение температуры более 40°C;
-
внутренние кровотечения;
-
признаки лихорадки;
-
сильный зуд кожи.
Нарушения ЦНС приводят и к возникновению психоза, а в дальнейшем шока. Состояние больного приводит к тому, что он не понимает того, что происходит. Если медицинская помощь не оказывается своевременно, начинается паралич органов дыхания с последующей остановкой сердца и летальным исходом.
Состояние больного приводит к тому, что он не понимает того, что происходит. Если медицинская помощь не оказывается своевременно, начинается паралич органов дыхания с последующей остановкой сердца и летальным исходом.
Гипокальциемический криз
Обострение при кальциевом дефиците характеризуется снижением минеральных веществ в плазме менее 2,25 ммоль/л. Криз гипокальциемический так же опасен.
Приступ может наступить внезапно, но, как правило, ему предшествует ряд симптомов:
-
ощущение «мурашек»;
-
чувство покалывания по всему телу;
-
конечности и часть лица немеют;
-
сильная слабость мышц;
-
внезапные мышечные боли;
-
депрессивное состояние;
-
изменение цвета кожного покрова.

Постепенно потерю чувствительности и другие признаки сменяют подергивания мышц. Первоначально больной ощущает лишь легкие и единичные спазмы, но достаточно быстро состояние переходит в припадки сильных судорог.
Тонус мышц выражается характерными проявлениями:
Опасность возникает, когда спазмы затрагивают мышечные ткани внутренних органов: почечные/печеночные колики, ларингоспазм или бронхоспазм. Нарушение дыхания может спровоцировать асфиксию.
Больной в момент криза ощущает нестерпимые боли, от которых теряет сознание и способность разумно воспринимать происходящее.
Диагностика
Нарушение метаболизма кальция определяется путем лабораторных анализов. Для определения причины патологии требуются более обширные исследования, поэтому специалисты назначают аппаратные исследования. Дополнительно может быть проведена дифференциальная диагностика.
Методы обследования:
-
анализ мочи (общий) — при повышенных показателях Ca в биоматериале будет присутствовать минерал и щелочная реакция будет выраженной;
-
анализ крови (биохимический) — в плазме выявляется значительное превышение/понижение ионизированного, а так же общего кальция;
-
ультразвуковое исследование — обследуется вся эндокринная система на наличие новообразований, увеличение тканей и другие отклонения;
-
рентгенография — используется для обследования костей с целью определения возможного развития остеопороза, переломов, кистозных образований и других патологических процессов;
-
денситометрия — применяется для точного определения плотности тканей костей;
-
рентгенография (с контрастным веществом) — помогает выявлению язвенного поражения ЖКТ и паратиреоаденому в загрудинном пространстве;
-
компьютерная — томография — исследуется мочевыделительная система и почки на наличие камней;
-
магниторезонансная томография — позволяет получить максимально точные данные об опухолевых образованиях желез щитовидки;
-
спинтиграфия — исследование с применением радиоактивных изотопов, с помощью которого удается визуализировать исследуемую область.

Диагностика позволяет получить максимальное количество информации для выявления провоцирующих факторов, особенностей заболевания и возможных осложнений. Лечение может начинаться только после получения результатов обследования.
Последствия
Дефицит или превышение нормы содержания кальция в плазме, несомненно, приводит к различным отклонениям. Следует отметить, что избыток минерала так же опасен, как и недостаток, если его запустить. Лечить заболевание нужно вне зависимости от его типа.
При нарушении минерального метаболизма по причине патологии эндокринной системы имеются значительные шансы на полное выздоровление. Но гипокалиемия требует не однократного, а курсового лечения, включающего систематические обследования, прием препаратов и диспансерного наблюдения.
Если в течение долгого времени патология не была диагностирована, а действия по ее устранению не были предприняты, могут наблюдаться последствия:
-
серьезные нарушения сна;
-
снижение интеллектуальных способностей;
-
гиперпигментация на кожном покрове;
-
расслоение ногтевых пластин;
-
алопеция.

Заболевание опасно развитием серьезных осложнений. Если у больного значительный недостаток Ca, то у него случаются тяжелейшие приступы судорог, которые могут повлечь атрофию тканей, паралич, потерю зрения и смерти из-за удушья.
Гиперкальциемия приводит к разрушению костной ткани, снижению ее плотности и, как следствие, деформации и разрушению. При гипокальциемии могут разрушаться зубы, эмаль частично отсутствует. Данный вид заболевания часто возникает у детей в возрасте до 5 лет.
Гипопаратиреоз в детском и подростковом возрасте | #06/18
Часть 1
Гипопаратиреоз (гипоПТ) — это эндокринное заболевание, характеризующееся недостаточным синтезом, секрецией или периферическим действием паратиреоидного гормона (ПТГ). Следствием гипоПТ является нарушение фосфорно-кальциевого обмена. Гипокальциемия — основной признак этого заболевания, однако причины ее могут быть разные.
Кальций (Са) играет важную роль в функционировании любой клетки и в обменных процессах организма в целом. Он участвует в мышечном сокращении, является посредником при передаче сигналов между клетками, изменяет проницаемость мембран клеток.
Основным депо Са в организме считается костная ткань (около 99%). Приблизительно 1% его находится в виде лабильных фосфатных солей, которые могут легко растворяться и изменять концентрацию Сa в плазме крови.
Биологически активной (примерно 50%) является фракция свободного (ионизированного) кальция (Са2+), остальной Са связан с белками плазмы крови, цитратами, фосфатами, которые влияют на плотность кости. Щелочная среда увеличивает связь Са с альбумином, уменьшая пул ионизирующей фракции.
Фосфор в организме человека содержится в кристалличеcкой форме в костной ткани (85%), в межклеточной жидкости в форме неорганического фосфата и в мягких тканях в виде сложных фосфорных эфиров.
Вместе с кальцием фосфор составляет основу костной ткани. Фосфаты участвуют в переносе энергии в виде макроэргических связей (ТФ, АДФ, креатинфосфат и т. д.), входят в состав буферных систем плазмы и тканевой жидкости. Фосфорная кислота влияет на процессы гликолиза, глюконеогенеза, обмена жиров.
Фосфаты участвуют в переносе энергии в виде макроэргических связей (ТФ, АДФ, креатинфосфат и т. д.), входят в состав буферных систем плазмы и тканевой жидкости. Фосфорная кислота влияет на процессы гликолиза, глюконеогенеза, обмена жиров.
Кроме ионов Са для сопряженных процессов возбуждения и сокращения необходим и циклический нуклеотид-аденозин 3–5 монофосфат (цАМФ). Он является вторичным мессенджером в процессе сокращения. Са и цАМФ связаны друг с другом. Са регулирует скорость синтеза и распад цАМФ, в то же время последний контролирует вход в клетку ионов Са и таким образом является регулятором цикла сокращения и расслабления мышцы [1].
Анатомия и физиология паращитовидных желез
Паращитовидные железы (ПЩЖ) закладываются у зародыша на 5-й неделе внутриутробного развития из 3–4 пар жаберных карманов глоточной кишки. В дальнейшем эти выступы отшнуровываются с образованием 4 отдельных околощитовидных желез. Дополнительные ПЩЖ встречаются в ткани щитовидной и вилочковой желез, в переднем и заднем средостении, в перикарде, позади пищевода, в области бифуркации общей сонной артерии.
Каждая ПЩЖ окружена соединительнотканной капсулой. Паренхима железы представлена трабекулами и скоплениями между ними эндокринных клеток — паратироцитов.
ПТГ синтезируется в главных ацидофильных клетках. Ген, кодирующий синтез ПТГ, локализуется на 11-й хромосоме (11р15). В регуляции экспрессии гена ПТГ принимает участие витамин D (1,25(ОН)2D3), который, как и кальций, может действовать независимо друг от друга.
Сначала синтезируется препрогормон, насчитывающий 115 аминокислотных остатков. Далее от него отщепляется сигнальный петид, содержащий 25 аминокислотных остатков, и образуется прогормон, который перемещается в аппарат Гольджи. В нем происходит превращение его в зрелый гормон, складирующийся в секреторных гранулах.
В крови ПТГ циркулирует в трех основных формах: интактный паратгормон с молекулярной массой 9500, биологически активный карбоксильный фрагмент с молекулярной массой 7000–7500, биологически активный фрагмент с молекулярной массой 4000. Образование фрагментов происходит в печени и почках. Интактный гормон в дальнейшем распадается на короткие звенья, которые связываются с рецепторами на клетках-мишенях [1].
Образование фрагментов происходит в печени и почках. Интактный гормон в дальнейшем распадается на короткие звенья, которые связываются с рецепторами на клетках-мишенях [1].
Регуляция секреции ПТГ происходит с помощью кальций-чувствительных рецепторов (СаSR) на поверхности паратиреоидных клеток и носит пульсирующий характер: в течение короткого времени через ионизированный Са, а при длительной стимуляции совместно с витамином D. Секреция ПТГ максимальна при низком уровне Са2+, повышение последнего подавляет ее [2]. Время биологической полужизни ПТГ в организме около 18 мин. ПТГ полностью инактивируется в течение нескольких часов в купферовских клетках печени и в почках. В ПЩЖ вырабатывается также хромографин.
При рождении ПЩЖ хорошо развиты, функционально активны, но при достаточном транспланцетарном транспорте кальция секреция ПТГ понижена. Увеличение концентраций ПТГ в сыворотке крови новорожденного в ранний адаптационный период происходит одновременно со снижением концентрации Са. Нормальный или повышенный уровень ПТГ у здоровых новорожденных устанавливается через 2–3 дня [3].
Нормальный или повышенный уровень ПТГ у здоровых новорожденных устанавливается через 2–3 дня [3].
Органами-мишенями для ПТГ являются кости и почки. В них располагаются кальций-чувствительные рецепторы, воздействуя на которые ПТГ активирует аденилатциклазу. Она влияет на АТФ, превращая его в циклический аденозинмонофосфат (цАМФ), который в свою очередь мобилизует ионы кальция из внутриклеточных запасов.
ПТГ контролирует концентрацию циркулирующих в крови двухвалентных катионов, в основном Mg2+ и Са2+, а также содержание цАМФ в клетках ПЩЖ.
Магний участвует, в частности, в активации митохондриальной АТР-синтетазы, регулирует активность некоторых ионных каналов и, обладая свойством образовывать устойчивые трехкомпонентные комплексы с нуклеотидами, участвует в процессах синтеза нуклеиновых кислот, транскрипции и трансляции [4].
Введение в организм больших количеств магния значительно снижает секрецию ПТГ, что используется в клинике при гиперпаратиреозе.
Основная функция ПТГ заключается в поддержании постоянного уровня ионизированного Са в крови, которую он выполняет, влияя на костную ткань, почки и опосредованно через витамин D на кишечник.
В костях ПТГ активирует резорбтивные процессы. В костной ткани содержится три вида клеток: остеоциты, остеобласты (молодые клетки, создающие костную ткань) и остеокласты (разрушают костную ткань). В костной ткани рецепторы к ПТГ располагаются только на остеоцитах и остеобластах. При связывании ПТГ с остеобластами они начинают усиленно синтезировать инсулиноподобный фактор роста 1 (ИФР1) и различные цитокины. Эти вещества влияют на остеокласты, стимулируя их метаболическую активность.
Остеокласты синтезируют протеиназы, такие как щелочная фосфатаза и коллагеназа, которые влияют на распад костного матрикса. В результате мобилизуются Са и фосфаты во внеклеточную жидкость. С этим его действием связано повышение содержания кальция в крови. Воздействие ПТГ на костную ткань происходит только в присутствии витамина D3 (холекальциферола).
В почках ПТГ, как и витамин D, усиливает реабсорбцию Са в дистальных отделах канальцев, тем самым снижая его выведение с мочой и повышая его уровень в крови. Механизм действия ПТГ на фосфаты в почечных канальцах прямо противоположен влиянию витамина D. Первый подавляет реабсорбцию фосфата в нефронах, напротив, витамин D усиливает его реабсорбцию [3]. Фосфатурический эффект паратгормона препятствует отложению фосфата кальция в мягких тканях.
Витамин D действует в кишечнике, увеличивая выработку кальцийсвязывающего белка, необходимого для транспорта экзогенного Са через клеточную мембрану слизистой оболочки кишечника.
Синтез активной формы витамина D3 (1α,25(ОН)2D3 — D-гормона — кальцитриола) происходит при участии фермента 1a-гидроксилазы в проксимальных отделах почечных канальцев под контролем ПТГ. В синтезе этого ключевого фермента необходимы также половые, тиреоидные, соматотропный гормоны, пролактин, кальцитонин.
Основная физиологическая функция витамина D (его активных метаболитов) в организме — регуляция и поддержание на необходимом уровне фосфорно-кальциевого гомеостаза, обеспечение минерализации костей. В костях 1α,25(ОН)2D3 связывается с рецепторами на остеобластах, повышая экспрессию активатора ядерного фактора RANKL. Это ускоряет созревание преостеокластов и их превращение в зрелые остеокласты [5].
В костях 1α,25(ОН)2D3 связывается с рецепторами на остеобластах, повышая экспрессию активатора ядерного фактора RANKL. Это ускоряет созревание преостеокластов и их превращение в зрелые остеокласты [5].
В костной ткани кальциферол мобилизует кальций и использует его для процессов минерализации вновь образовавшейся кости. Наряду с этим он влияет на синтез коллагена, участвующего в образовании матрикса костной ткани. Механизм всасывания кальция в кишечнике связан с синтезом энтероцитами кальцийсвязывающего белка (СаСБ), одна молекула которого транспортирует 4 атома кальция. В норме человек потребляет около 1 грамма Са в сутки. От 25% до 50% кальция всасывается при участии кальциферола.
Итак, в плазму крови кальций поступает из кишечника, всасываясь из воды, пищи или путем резорбции костной ткани. Уровень кальция в сыворотке имеет большое значение для большого количества физиологических процессов, поскольку даже небольшие отклонения влияют на различные клеточные функции. Уровень кальция в сыворотке обычно поддерживается в очень узком диапазоне.
Уровень кальция в сыворотке обычно поддерживается в очень узком диапазоне.
Патогенез
Абсолютный или относительный недостаток ПТГ ведет к падению активности остеокластов, снижению резорбции костной ткани и, соответственно, поступлению кальция из кости в кровь. В почках из-за недостатка ПТГ уменьшается синтез активного витамина D, нарастает реабсорбция фосфатов, сокращается всасывание Са, в результате чего развивается гиперфосфатемия и гипокальциемия.
Отрицательный кальциевый и положительный фосфорный баланс нарушают электролитное равновесие, изменяются соотношения кальций/фосфор и натрий/калий. Это ведет к универсальному нарушению проницаемости клеточных мембран, в частности, в нервных клетках, к изменению процессов поляризации в области синапсов.
Возникающее в результате этого повышение нервно-мышечной возбудимости и общей вегетативной реактивности приводит к повышению судорожной готовности и тетаническим кризам. В генезе тетании значительная роль принадлежит также нарушению метаболизма магния и развитию гипомагнезиемии, снижающих синтез ПТГ..jpg) Это облегчает проникновение ионов натрия в клетку и выход из клетки ионов калия, что тоже способствует повышению нервно-мышечной возбудимости. Такое же действие оказывает и возникающий при этом сдвиг кислотно-основного состояния в сторону алкалоза [6].
Это облегчает проникновение ионов натрия в клетку и выход из клетки ионов калия, что тоже способствует повышению нервно-мышечной возбудимости. Такое же действие оказывает и возникающий при этом сдвиг кислотно-основного состояния в сторону алкалоза [6].
Нозологические формы
Тетания новорожденных
Тетания новорожденных встречается относительно часто. Сопровождается гипокальциемией и нередко гипофосфатемией. Возможно, что этиологическим фактором в патогенезе неонатальной гипокальциемии является резистентность органов-мишеней к паратгормону и транзиторный гипоПТ. В крови здоровых новорожденных концентрация паратгормона или очень низка или не определяется совсем, и только на 4-е сутки после рождения начинается параллельное увеличение в крови содержания ПТГ, связанного и ионизированного кальция. В период новорожденности резервы ПЩЖ у детей снижены. Однако уменьшение концентрации кальция в крови не всегда сопровождается повышением функции ПЩЖ, что свидетельствует об участии дополнительных неизвестных факторов в генезе неонатальной гипокальциемии.
У новорожденных гипокальциемия может проявляться плохим набором веса и обильными срыгиваниями, генерализованными судорогами, острой сердечно-сосудистой недостаточностью [7].
Семейный изолированный гипопаратиреоз
Врожденный изолированный гипопаратиреоз чаще всего обусловлен наследственными нарушениями синтеза паратиреоидного гормона. Выделяют два типа заболевания: гипопаратиреоз инфантильный Х-сцепленный (ген картирован на Xq26-q27) и семейный гипопаратиреоз с аутосомно-доминантным типом наследования (ген картирован на коротком плече 11-й хромосомы) [8]. Зависимые от пола формы заболевания имеют благоприятный прогноз. У детей этой группы обнаруживают гипоплазию или эктопию ПЩЖ, гипоплазию или отсутствие вилочковой железы.
У детей с врожденной недостаточностью ПЩЖ содержание кальция в крови снижено, нарушен рост костей, зубов и волос, наблюдаются длительные сокращения мышечных групп (предплечья, грудной клетки, глотки и др.).
Семейная гиперкальциурическая гипокальциемия
Семейная гиперкальциурическая гипокальциемия — эта аутосомно-доминантная гипокальциемия вызвана активирующей мутацией гена 3q13.3-q21, кодирующей кальцийчувствительный рецептор. Из-за активирующей мутации чувствительность CaSR высокая, что по типу обратной связи приводит к подавлению секреции ПТГ и состоянию гипокальциемии. Однако ПЩЖ у этих пациентов функционируют нормально, хотя заболевание протекает с клиникой гипоПТ.
Особое внимание следует уделять пациентам с этой формой заболевания, поскольку они имеют аномально высокую почечную экскрецию кальция в ответ на лечение добавками кальция, что приводит к высокому риску развития почечной кальцификации и почечной недостаточности [9].
Идиопатический, или аутоиммунный, гипоПТ
Идиопатический, или аутоиммунный, гипоПТ может быть как изолированный, так и быть частью множественной аутоиммунной эндокринопатии.
При изолированном аутоантитела направлены к рецепторам кальция на мембранах клеток ПЩЖ, а именно к связанному с ними цензору, белку G120 кДа, который улавливает самое минимальное снижение уровня кальция в сыворотке крови. Так как антитела связаны с белком G120 Кда, последний не стимулирует в нужной степени секрецию ПТГ, уровень его в сыворотке крови низкий, вследствие чего развивается гипокальциемия [10]. Синдром идиопатического аутоиммунного гипоПТ относится к числу редких форм эндокринопатий, однако случаи его развития в детском возрасте могут встретится.
Аутоиммунный полигландулярный синдром 1-го типа
Аутоиммунный полигландулярный синдром 1-го типа (АПС-1) — моногенное заболевание с аутосомно-рецессивным типом наследования, реже встречаются спорадические случаи. В основе синдрома лежит мутация структуры гена аутоиммунного регулятора (AIRE).
Ген расположен на хромосоме 21q22.3, состоит из 14 экзонов и преимущественно экспрессируется в тимусе. В настоящее время установлено более 50 мутаций данного гена. Самыми распространенными являются R257X, 109del13, R139X. Эти мутации затрагивают области гена, которые ответственны за формирование ДНК-связывающих доменов [11].
Ассоциация АПС-1 с галотипами HLA отсутствует. Пик манифестации приходится на 12 лет. Характерными признаками АПС-1 являются слизисто-кожный кандидоз, первичная хроническая надпочечниковая недостаточность и гипоПТ.
Комбинация симптомов, сроки проявления и степень их выраженности при АПС-1 у детей значительно варьируют. В большинстве случаев дебют заболевания сопровождается развитием кожно-слизистого кандидоза в первые 10 лет жизни, чаще сразу после рождения ребенка. При этом отмечается поражение слизистых ротовой полости, гениталий, кожи, ногтей. Реже в процесс вовлекается желудочно-кишечный тракт, дыхательные и мочевыводящие пути [8].
На фоне кандидоза у 84% пациентов диагностируют гипоПТ, который обычно развивается в первую декаду жизни ребенка. Клинические проявления гипоПТ разнообразны: от характерных парестезий и мышечных судорог до развития приступов, сходных с эпилепсией. Первичный гипокортицизм длительное время протекает в латентной форме и манифестирует у большинства пациентов в течение второго десятилетия жизни острой надпочечниковой недостаточностью.
Клинические фенотипы при данном синдроме гетерогенны и не исчерпываются этими симптомами. Классической триаде заболевания могут сопутствовать первичный гипогонадизм, первичный гипотиреоз на фоне аутоиммунного тироидита, сахарный диабет 1 типа [12].
Среди неэндокринных заболеваний при АПС-1 выявляются алопеция, витилиго, пернициозная анемия, синдром мальабсорбции, аутоиммунный гепатит, аномалия зубной эмали, эктодермальная дисплазия, изолированный дефицит IgA, бронхиальная астма, гломерулонефрит. Появление вышеуказанных клинических компонентов этого синдрома может растягиваться на многие годы, что затрудняет диагностику. Ранняя постановка АПС-1 возможна в случаях длительного кандидоза и моноэндокринной паталогии при исследовании гена AIRE [10].
Яртрогенный гипопаратиреоз
Яртрогенный гипоПТ является наиболее частой причиной постхирургического гипоПТ (2–10%), который развивается в связи с повреждением ПЩЖ при операциях на шее в первые сутки. Согласно данным Garrhyetal, гипоПТ в 38% случаях были связаны с тотальной тиреоидэктомией, в 9% — с частичной тиреоидэктомией, в 21% — с паратиреоидэктомией и в 5% — с другими операциями на шее. Риск развития гипоПТ после операции на шее во многом зависит от опыта хирурга [13]. У большинства пациентов развивался транзиторный гипоПТ. Функция ПЩЖ у них полностью восстанавливалась через 6 месяцев. У 15–25% развивался хронический гипоПТ [14].
Инфильтративно-дистрофический гипоПТ
Инфильтративно-дистрофический гипоПТ связан с отложением в тканях железы различных веществ при системных заболеваниях.
Гемохроматоз — наследственное заболевание, характеризующееся нарушением обмена железа в организме, нарушенной регуляцией всасывания железа в кишечнике, повышенным его содержанием в сыворотке крови и накоплением в тканях и органах.
Талассемия — это гетерогенная группа нарушений, являющихся результатом снижения или отсутствия продукции нормальных цепей глобина. В результате происходит усиленный распад гемоглобина и избыточное образование пигмента гемосидерина и отложение его в тканях железы.
Болезнь Вильсона–Коновалова — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях.
Радиационный гипопаратиреоз
Радиационный гипопаратиреоз возникает вследствие лучевого повреждения ПЩЖ при дистанционном облучении органов головы и шеи, а также эндогенном облучении при лечении диффузного токсического зоба или рака щитовидной железы радиоактивным йодом.
Синдром Ди Джорджи
Синдром Ди Джорджи — генетическое заболевание, обусловленное нарушением эмбрионального развития третьего и четвертого фарингеальных мешков.
Встречаемость синдрома Ди Джорджи составляет 1:3000–20 000. Такое значительное расхождение данных обусловлено тем, что достоверная и четкая граница между этим заболеванием и велокардиофациальным синдромом до сих пор не установлена. Отличием болезни Ди Джорджи являются грубые иммунологические нарушения, которые слабо выражены при велокардиофациальном синдроме.
Генетическая природа синдрома Ди Джорджи заключается в повреждении центральной части длинного плеча 22-й хромосомы (22q22.3), где предположительно располагаются гены, кодирующие процессы эмбриогенеза. Одним из этих генов является TBX1, который производит белок T-box. Доказательством взаимосвязи синдрома Ди Джорджи и TBX1 является тот факт, что незначительный процент больных не имеет выраженных повреждений 22-й хромосомы, а присутствуют только мутации в этом гене [15].
Многие проявления синдрома Ди Джорджи определяются сразу после рождения ребенка. Чаще всего первыми обнаруживаются аномалии развития лица — расщепление мягкого и твердого неба, иногда в сочетании с «заячьей губой», прогнатия нижней челюсти. Дети с синдромом Ди Джорджи чаще низкорослые, имеют короткий нос с широкой переносицей, деформированные или недоразвитые хрящи ушных раковин, гипертелоризм. При относительно легком течении заболевания все вышеперечисленные симптомы могут быть выражены довольно слабо, даже расщепление твердого неба может возникать только в задней его части и выявляться лишь при тщательном осмотре оториноларинголога.
Результатом гипоплазии ПЩЖ является дефицит ПТГ и персистирующая гипокальциемия, вследствие чего развивается судорожный синдром, который может проявиться уже в первые часы жизни (неонатальная тетания). Эта патология сочетается с самыми разнообразными дефектами сердечно-сосудистой системы — тетрада Фалло, дефект межжелудочковой перегородки, незаращение артериального протока и другие.
Синдром характеризуется полным или частичным недоразвитием вилочковой железы, где формируется клеточный иммунитет. В крови определяется лимфоцитопения. Дефицит Т-лимфоцитов проявляется склонностью к вирусным, грибковым и бактериальным инфекциям, которые нередко принимают затяжное и тяжелое течение.
Синдром Бараката
Синдром Бараката, или синдром HDR (hypoparathyroidism, deafness, renaldisease).
Это редкое генетическое заболевание, связанное с дефектом гена GATA3 (10p15). Ген кодирует белок, отвечающий за развитие ПЩЖ, внутреннего уха, почек [16]. Гипокальциемические афебрильные судороги и тетания могут проявиться после рождения или в любом возрасте. ПЩЖ представляют собой небольшие эндокринные образования, содержание ПТГ резко снижено или не определяется. У пациентов определяется гипокальциемия, непроизвольное сокращение мышц (тетания) или судороги в грудном возрасте. Двусторонняя нейросенсорная тугоухость может варьировать от легкой до глубокой. Среди почечных аномалий встречаются дисплазия, гипоплазия, аплазия, глюкокортикоид-резистентный нефротический синдром (почечная недостаточность, приводящая к потере большого количества белка в моче).
Синдром Кенни–Каффи
Синдром Кенни–Каффи относится к орфанным заболеваниям, известным как «акроцефалополисиндактилии» (ACPS). Наследуется по аутосомно-доминантному типу. В основе синдрома лежат мутации гена TBCE (1q43–44), вызывающие изменения структуры клеток. Пациенты рождаются с внутриутробной задержкой развития. Врожденные аномалия затрагивают несколько систем организма. Клинически это проявляется пропорциональной карликовостью, маленьким лицом и выпуклым лбом, акроцефалией (высокий конический череп вследствие преждевременного заращения черепных швов), синдактилиями или полидактилиями.
Другие симптомы включат в себя аномалии органа зрения, приступы тетании, связанные с гипоПТ. Костные полости и каналы всех костей сужены (медуллярный стеноз) при нормальном или утолщенном корковом веществе. В анализе крови выявляют гипокальциемию и гиперфосфатемию [17].
Синдром Кенни–Каффи типа 2
Синдром Кенни–Каффи типа 2 (KCS2) является чрезвычайно редкой патологией скелета, вызванной мутацией в гене FAM111A, с аутосомно-доминантным типом наследования.
Дети рождаются малорослые и с низкой массой тела. Голова гидроцефальной формы, лоб выпуклый, микрофтальмия. Характерным является утолщение трубчатых костей и остеосклероз.
Гипокальцимические судороги могут выявляться уже в периоде новорожденности, которые связаны с гипоПТ [18].
Синдром Саньяда–Сакати
Синдром Саньяда–Сакати (синдром HRD, hypoparathyroidism/retardation/dysmorphism) известен также как акроцефалополисиндактилия III типа. Этот синдром вызван дефектом гена 1q.42-q.43. Хотя синдром Саньяда–Сакати имеет один и тот же локус с аутосомно-рецессивной формой синдрома Кенни–Каффи, пациенты при последнем отличаются нормальным интеллектом и скелетными особенностями.
Синдром характеризуется внутриутробной задержкой роста, микроцефалией. Лицо вытянутое, узкое, глаза глубоко посажены, нос клювовидный, уши большие и висящие, губы тонкие, переносица плоская, микрогнатия, длинный фильтр. Задержка умственного развития легкая или умеренно выражена.
Кроме того, при синдроме Саньяда–Сакати нарушается развитие костной системы: деформации рук и ног, короткие пальцы (брахидактилия), полидактилия, слаборазвитость костей голени и аномалии бедренных костей. Дети рождаются с врожденными пороками сердца и глаз. У некоторых выявляли дефекты формирования сосудов (извилистость сосудов сетчатки, верхней брыжеечной артерии), помутнение роговицы.
Врожденный гипоПТ проявляется рано тетанией или повышенной судорожной готовностью. Пациенты значительно отстают в росте [19].
Окончание статьи читайте в следующем номере
В. В. Смирнов1, доктор медицинских наук, профессор
П. Н. Владимирова
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
1 Контактная информация: [email protected]
Гипопаратиреоз в детском и подростковом возрасте (часть 1) В. В. Смирнов, П. Н. Владимирова
Для цитирования: Лечащий врач № 6/2018; Номера страниц в выпуске: 49-53
Теги: щитовидная железа, эндокринные заболевания, органы-мишени, кальций
Что такое аденома паращитовидной железы?
Сегодня мы задаем вопросы заведующей отделением радиоизотопной диагностики Екатерине Игоревне Денисенко-Канкия.
ЧТО ТАКОЕ ПАРАЩИТОВИДНАЯ ЖЕЛЕЗА?
Паращитовидные железы расположены на шее, рядом с щитовидной железой. У большинства людей четыре паращитовидных железы овальной формы размером с горошину. Работа паращитовидной железы заключается в выработке гормона паращитовидной железы, который помогает регулировать использование кальция в организме. Кальций необходим клеткам во многих частях вашего тела: в мозге, сердце, нервах, костях и пищеварительной системе. Гормон паращитовидной железы забирает кальций из кости, где он хранится, и выпускает его в кровоток. «Связь» между паращитовидными железами и кровотоком помогает поддерживать нормальный уровень кальция.
ЧТО ТАКОЕ АДЕНОМА ПАРАЩИТОВИДНОЙ ЖЕЛЕЗЫ?
Иногда доброкачественные новообразования, называемые аденомами, появляются на одной или нескольких паращитовидных железах человека. Аденомы заставляют паращитовидную железу вырабатывать больше паратиреоидного гормона, чем нужно организму, и это состояние называется первичным гиперпаратиреозом. Слишком много паратиреоидного гормона нарушает нормальный баланс кальция в организме, что увеличивает количество кальция в кровотоке. Подобное, но менее распространенное заболевание, называемое вторичным гиперпаратиреозом, может возникать у людей с хронической почечной недостаточностью. У женщин вероятность развития аденомы паращитовидных желез в два раза выше, чем у мужчин, и часто после менопаузы.
ПРИ КАКИХ СИМПТОМАХ МОЖНО ЗАПОДОЗРИТЬ АДЕНОМУ ПАРАЩИТОВИДНОЙ ЖЕЛЕЗЫ?
- Усталость.
- Ухудшение памяти и концентрации внимания.
- Депрессия, раздражительность или спутанность сознания.
- Камни в почках.
- Боль в костях и суставах, остеопороз неясной этиологии.
- Боль в животе.
- Общие боли без очевидной причины.
КАК ДИАГНОСТИРУЮТ АДЕНОМУ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ?
Аденомы паращитовидных желез чаще всего обнаруживаются, когда при обычном анализе крови уровень кальция выше нормы, особенно у людей без симптомов. Затем врачи подтверждают диагноз первичного гиперпаратиреоза с помощью теста, который показывает, что уровень паратиреоидного гормона в крови выше нормы. Важно понимать, что первичное заболевание околощитовидной железы диагностируется только на основании уровня кальция и гормона околощитовидной железы.
ПОЧЕМУ СЦИНТИГРАФИЯ И КАК ЭТО РАБОТАЕТ?
Когда паращитовидная железа вырабатывает паратиреоидный гормон (паратгормон или ПТГ), она использует большое количество энергии. Часть клетки, которая вырабатывает энергию, называется митохондрия, а ядерный материал препарата (РФП), который вводят пациенту притягивается к активно работающим митохондриям. Чем он активнее, тем больше вероятность, того, что РФП прикрепится к нему. Таким образом, в ситуации, когда уровни ПТГ высокий, при сканировании можно легко найти аномальную железу.
Данный метод диагностики высокочувствителен при высоком уровне ПТГ. Обнаруживает паращитовидные железы, которые прячутся за голосовым связками, трахеей, ключицей, в верхней части шеи или в грудной клетке (эктопия).
КАК ПРОВОДИТСЯ СЦИНТИГРАФИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ?
Перед сцинтиграфией паращитовидных желез, лечащий врач проконсультирует и проинформирует Вас, о преимуществах и рисках исследования. Он также спросит, есть ли у вас какие-либо ранее существовавшие заболевания или какие лекарства Вы принимаете. Потому что лекарства применяемы при патологии щитовидной железы и йодсодержащие препараты могут повлиять на результаты исследования, например, препятствуя проникновению радиофармпрепарата в ткань щитовидной железы, то есть блокируя ее и соответственно деформируя результаты исследования. Поэтому перед проведением исследования может потребоваться отменить прием этих препаратов.
Сцинтиграфия паращитовидной железы проводится в положении лежа. Обследование совершенно безболезненно. Продолжительность исследования до 3,5 часов.
ЕСТЬ ЛИ ПОБОЧНЫЕ ЭФФЕКТЫ И ПРОТИВОПОКАЗАНИЯ?
РФП вводимый пациенту для исследования переносятся очень хорошо. Из литературы и нашего опыта не известно о побочных эффектах. Доза ионизирующего излучения очень мала и сопоставима со стандартным рентгеновским излучением.
Во время беременности и кормления грудью сцинтиграфия не проводится. Если грудное вскармливание необходимо, то его следует прекратить.
цена на диагностику костной ткани в СМ-Клиника
С возрастом или из-за определенных нарушений организм может хуже усваивать кальций. Это приводит к повышенной ломкости костей. Если процесс не выявить вовремя и не назначить лечение, болезнь прогрессирует. Она проявляется болями в позвоночнике и частыми переломами. Перелом шейки бедра часто ведет к инвалидности, а его осложнения становятся причиной смерти. Для ранней диагностики и коррекции патологии костной ткани назначают денситометрию.
Денситометрия — это неинвазивный метод оценки минеральной плотности костей. С её помощью можно измерить количество кальция в костной ткани, который является основным элементом кости. Исследование позволяет вовремя выявить нарушения и провести лечение, предотвратив тяжёлые дегенеративные изменения (остеопороз).
Денситометрия бывает нескольких видов. В медицинском центре «СМ-Клиника» исследование проводится с помощью компьютерного томографа. В ходе КТ-денситометрии делают замеры плотности костей на уровне шейки бедра, грудного и поясничного отделов позвоночника.
Преимущества остеоденситометрии
- Безопасность для пациента за счет минимальной дозы ионизирующего излучения.
- Высокая чувствительность – способность выявлять патологии на ранней стадии, когда они эффективно лечатся.
- Безболезненность – наркоз не нужен.
- Процедура длится около 30 минут, результат можно получить на следующий день (12-24 часа после обследования).
Показания и противопоказания
Денситометрия показана в следующих случаях:
- частые переломы;
- регулярные боли в спине;
- нарушения метаболизма, связанные с выводом кальция и фосфора;
- гормональные изменения;
- патологии эндокринной системы.
Также исследование назначают в ходе лечения остеопороза.
Ежегодно процедура рекомендована представителям групп риска:
- женщинам в постменопаузе, не принимающим эстрогены, с ростом выше 1,8 м и весом менее 60 кг;
- пациентам с личной либо семейной предрасположенностью к переломам шейки бедра;
- курящим женщинам;
- больным ревматоидным артритом, хроническими патологиями печени, почек, щитовидной железы, диабетом, синдромом Кушинга;
- на постоянной основе принимающим гормоны, барбитураты и противосудорожные препараты;
- пациентам с высоким показателем ДПИД в моче;
- после переломов.
Пожилым людям денситометрию назначают при уменьшении роста на 2 см и больше, а также повторно при пограничных результатах первичного обследования.
В зрелом возрасте (после 45-50 лет) врачи медицинского центра «СМ-Клиника» рекомендуют проходить денситометрию раз в 2 года, чтобы своевременно выявить проблемы и скорректировать их.
Главное противопоказание к проведению КТ-денситометрии — индивидуальная непереносимость йода (его раствор применяется в качестве контрастирующего вещества).
Исследование придётся отложить, если пациентка беременна. Есть ограничения по весу пациента: наш аппарат рассчитан на вес до 120 кг. Также КТ не проводится детям младше 6 лет.
Как проводится денситометрия
КТ-денситометрия — это абсолютно безопасная и безболезненная процедура, требующая минимальной подготовки: за сутки до исследования необходимо прекратить приём биодобавок с кальцием и кальцийсодержащие продукты (например, творог).
В ходе процедуры пациент находится на комфортной кушетке. Продолжительность сеанса зависит от области исследования, но в среднем занимает 10-30 минут. Во время исследования необходимо сохранять полную неподвижность, так как от этого зависит чёткость получаемых изображений.
Оценка и выдача результатов, дальнейшая лечебная тактика
Сканирование позволяет измерить номинальную плотность костей. Показатель сравнивают с двумя нормами:
- для здоровых молодых людей того же пола (эталон) – Т-показатель;
- для здоровых людей той же возрастной группы и пола – Z-показатель.
Референсные значения для интерпретации T-показателя:
- -1 и выше – нормальная плотность костной ткани;
- от -1 до -2,4 – сниженная;
- -2,5 и ниже – остеопороз.
Z-показатель в норме – положительный, при остеопорозе – отрицательный.
По Т-показателю врач оценивает риск переломов и необходимость их профилактики. Отклонение от нормы – показание назначить лечение, чтобы повысить плотность костной ткани. Отклонения от нормы Z-показателя – показание для дополнительного обследования. Пациента направляют на рентгенографию, биохимический анализ, опционально – на биопсию кости.
Результаты КТ-денситометрии записываются на диск и описываются в заключении рентгенолога. На руки они выдаются в течение часа после процедуры.
На основании полученных данных врач «СМ-Клиника» даст рекомендации по дальнейшим обследованиям, назначит схему лечения. Узнать все подробности и записаться на денситометрию вы можете по телефону или оставив заявку на сайте.
Концентрация ионизированного кальция в цельной крови и сыворотке у диализных пациентов
Korean J Intern Med. 2014 Март; 29 (2): 226–230.
, , , , иСеок Хуэй Канг
Отделение нефрологии, Отделение внутренней медицины, Медицинский центр Университета Йоннам, Тэгу, Корея.
Kyu Hyang Cho
Отделение нефрологии, Отделение внутренней медицины, Медицинский центр Университета Йоннам, Тэгу, Корея.
Джонг Вон Парк
Отделение нефрологии, Отделение внутренней медицины, Медицинский центр Университета Йунгнам, Тэгу, Корея.
Kyung Woo Yoon
Отделение нефрологии, Отделение внутренней медицины, Медицинский центр Университета Йоннам, Тэгу, Корея.
Jun Young Do
Отделение нефрологии, Отделение внутренней медицины, Медицинский центр Университета Йунгнам, Тэгу, Корея.
Отделение нефрологии, Отделение внутренней медицины, Медицинский центр Университета Йунгнам, Тэгу, Корея.
Автор, ответственный за переписку. Переписка с Чон Ён До, доктором медицины, отделение нефрологии, отделение внутренней медицины, Медицинский центр Университета Йоннам, 170 Хёнчунг-ро, Намгу, Тэгу 705-717, Корея. Тел .: + 82-53-680-3844, Факс: + 82-53-654-8386, rk.ca.uy.dem@odyjПолучено 13 сентября 2012 г .; Пересмотрено 16 октября 2012 г .; Принято 7 декабря 2012 г.
Авторские права © Корейская ассоциация внутренних болезней, 2014 г.Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http: // creativecommons.org / licenses / by-nc / 3.0 /), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях в PMC.Abstract
Предпосылки / цели
Целью данного исследования является определение разницы в содержании ионизированного кальция между гепаринизированной цельной кровью и сывороткой.
Методы
Мы набрали 107 пациентов на поддерживающем гемодиализе (HD) из нашего госпитального отделения HD.Клинические и лабораторные данные включали ионизированный кальций в сыворотке и цельной крови (эталонное значение от 4,07 до 5,17 мг / дл).
Результаты
Уровень ионизированного кальция в сыворотке был выше, чем в цельной крови ( p <0,001). Анализ Бланда-Альтмана показал, что разница для ионизированного кальция составила 0,5027. Для разницы нестандартный β был -0,4389 ( p <0,001), а точка пересечения - 2,2418 ( p <0,001). Наблюдалась значительная разница в распределении категорий уровня ионизированного кальция между двумя методами (κ, 0.279; p <0,001).
Выводы
Это исследование демонстрирует, что ионизированный кальций цельной крови недооценен по сравнению с ионизированным кальцием сыворотки. Положительная разница увеличивается по мере уменьшения содержания ионизированного кальция в цельной крови. Следовательно, значительная гипокальциемия в ионизированном кальции цельной крови должна быть подтверждена с помощью ионизированного кальция в сыворотке крови.
Ключевые слова: Почечный диализ, гепарин, гипокальциемия
ВВЕДЕНИЕ
Хроническая болезнь почек — минеральная болезнь костей — широко известное осложнение у диализных пациентов [1-3].Правильный уровень кальция и фосфора связан со снижением кальцификации сосудов, заболеваемости и смертности у диализных пациентов [1-4]. Общий кальций делится на ионизированный (свободный кальций) и связанный кальций (комплексно связанный кальций). В клинических руководящих принципах Инициативы по качеству результатов лечения заболеваний почек Национального фонда почек рекомендуется, чтобы общий кальций сыворотки с поправкой на альбумин находился в пределах нормального диапазона для лаборатории (справочное значение в нашем центре от 8,6 до 10,6 мг / дл) [1].Однако стандартизированной формулы исправленного кальция не существует. Хотя согласно рекомендациям по заболеванию почек: улучшение глобальных результатов ионизированный кальций не является экономически эффективным, специфичность для ионизированного кальция выше, чем для общего кальция или скорректированного общего кальция [5,6]. Ионизированный кальций фактически измеряется во многих центрах для выявления аномалий кальция. Ионизированный кальций можно измерить с помощью цельной крови или сыворотки. На него могут влиять pH, фосфат, лактат и антикоагулянты.Антикоагулянтный гепарин связан, в частности, с более низким уровнем ионизированного кальция в цельной крови, чем в сыворотке [7,8]. Целью этого исследования было оценить разницу в уровне ионизированного кальция между гепаринизированной цельной кровью и сывороткой и определить, полезен ли гепаринизированный кальций цельной крови для диагностики аномалий кальция.
МЕТОДЫ
Мы включили 107 пациентов на поддерживающем гемодиализе (HD) в наше больничное отделение HD. Это исследование было проведено в полном соответствии с измененной Хельсинкской декларацией после одобрения Институционального наблюдательного совета больницы Йунгнамского университета (YUH-12-0401-O52).Все 107 субъектов, включенных в это исследование, дали письменное информированное согласие на участие в этом исследовании.
Все пациенты проходили диализ два или три раза в неделю (от 3,5 до 4,5 часов за сеанс) с использованием диализаторов из полых волокон. Стандартный кровоток составлял от 250 до 300 мл / мин, а поток диализата составлял 500 мл / мин. Клинические и лабораторные данные, собранные во время отбора проб, включали возраст, пол, заболевание, лежащее в основе терминальной стадии почечной недостаточности, продолжительность ГД, общий кальций (референсный диапазон от 8,6 до 10,6 мг / дл), скорректированный общий кальций (мг / дл), фосфор. (мг / дл), использование кальцийсодержащего фосфатсвязывающего агента, высокочувствительный С-реактивный белок (hs-CRP; мг / дл), сывороточный альбумин (г / дл), лактат (ммоль / л), pH, бикарбонат (ммоль) / Л) и ионизированный кальций в сыворотке и цельной крови (референсный диапазон 4.07 до 5,17 мг / дл). Эти лабораторные параметры были измерены в одном и том же заборе крови.
Образцы крови были взяты у пациентов, не принимающих голодание, перед первым сеансом HD за неделю. Для определения уровней ионизированного кальция в сыворотке использовали негепаринизированные сухие пробирки Vacutainer. Уровни ионизированного кальция в цельной крови определяли с помощью 3-миллилитровых шприцев, покрытых натриевым гепарином. Ионизированный кальций обнаруживали двумя методами с помощью анализатора ABL800 (Radiometer, Копенгаген, Дания). Образцы сыворотки хранили при 4 ℃ сразу после отбора и отделяли от клеток в течение 1 часа.Ионизированный кальций в цельной крови измеряли в течение 15 минут после отбора пробы. Уровни сывороточного альбумина и CRP измеряли с помощью автоматического химического анализатора Olympus AU4500 (Olympus, Токио, Япония) (бромкрезоловый зеленый для альбумина). Скорректированный уровень кальция в сыворотке рассчитывали по формуле Пейна: скорректированный кальций (мг / дл) = общий кальций (мг / дл) + 0,8 × [4 — альбумин (г / дл)] [1].
Данные представлены в виде чисел (%) для категориальных переменных и медиан и межквартильного размаха (25% перцентиль; 75% перцентиль) для непрерывных переменных.Различия в общем содержании кальция и скорректированном общем содержании кальция сравнивали с использованием знакового рангового критерия Вилкоксона. Для оценки силы связи между парами переменных использовался корреляционный анализ Пирсона. Категориальные переменные сравнивали с использованием критерия хи-квадрат Пирсона или точного критерия Фишера с критериями κ. Эти анализы были выполнены с использованием SPSS версии 19 (IBM Co., Армонк, Нью-Йорк, США). Графики Бланда-Альтмана использовались для визуальной оценки различий между двумя методами [9,10]. Различия отображаются в зависимости от средних значений двух методов.Горизонтальные линии указывают среднюю разницу и ± 1,96 × стандартное отклонение. Это полезно для определения размера или тенденции различий. Различия рассчитывались следующим образом: ионизированный кальций в сыворотке ионизированный кальций в цельной крови. Этот анализ был выполнен с использованием MedCalc версии 11.6.1.0 (MedCalc Software, Мариакерк, Бельгия). Уровень статистической значимости был установлен на уровне p <0,05.
РЕЗУЛЬТАТЫ
В этом исследовании приняли участие сто семь пациентов с HD ().Средняя продолжительность HD составила 23 месяца (8; 55). Эти 54,2% участников исследования были мужчинами. PH составлял 7,36 (7,33; 7,38), нескорректированный уровень общего кальция составлял 8,3 мг / дл (8,0; 8,8), а скорректированный уровень общего кальция составлял 8,28 (7,86; 9,02). Уровень ионизированного кальция составлял 3,76 мг / дл (3,41; 4,01) в цельной крови и 4,15 мг / дл (3,89; 4,47) в сыворотке. Уровень ионизированного кальция был выше в сыворотке, чем в цельной крови ( p <0,001). Ионизированный кальций в сыворотке коррелировал с ионизированным кальцием цельной крови, общим кальцием и скорректированным общим кальцием ( r = 0.464 для ионизированного кальция цельной крови, r = 0,803 для общего кальция и r = 0,789 для скорректированного общего кальция; p <0,001 для всех трех переменных) (). Не было значимой корреляции с использованием фосфора, кальцийсодержащего фосфатного связующего, hs-CRP, лактата, pH или бикарбоната ().
Таблица 1
Характеристики пациентов (n = 107)
Таблица 2
Связь между ионизированным кальцием в сыворотке и другими переменными
Анализ Бланда-Альтмана показал, что разница для ионизированного кальция была 0.5027 (95% доверительный интервал [ДИ] от 0,3990 до 0,6064). У большинства пациентов ионизированный кальций в сыворотке ионизированного кальция в цельной крови находился в пределах ± 1,96 стандартного отклонения от 0,5027 (). Для разницы нестандартизованный β составлял -0,4389 (95% ДИ, от -0,6648 до -0,2131; p <0,001), а точка пересечения составляла 2,2418 (95% ДИ, от 1,3417 до 3,1419; p <0,001). Между двумя методами наблюдалась значительная разница в распределении категорий в соответствии с уровнем ионизированного кальция (κ = 0.279, p <0,001) (). При измерении ионизированного кальция в цельной крови 43 пациента с нормокальциемией (67,2%) были ошибочно отнесены к гипокальциемии. Двое пациентов с гиперкальциемией (66,6%) были неправильно отнесены к нормокальциемии или гипокальциемии. Кроме того, среди 64 пациентов с нормокальциемией пациенты, ошибочно отнесенные к гипокальциемии, имели более высокие уровни ионизированного кальция в цельной крови, чем скорректированные уровни общего кальция.
График Бланда-Альтмана, показывающий пределы соответствия между уровнями ионизированного кальция в сыворотке и цельной крови.Разница 0,5027 (95% доверительный интервал от 0,3990 до 0,6064). Са, кальций; S, сыворотка; WB, цельная кровь; SD, стандартное отклонение.
Таблица 3
Состояние кальция согласно кальциевому методу
ОБСУЖДЕНИЕ
Результаты настоящего исследования показывают, что уровень ионизированного кальция в цельной крови, определенный с помощью шприцев, покрытых гепарином, показывает разницу 0,5 мг / дл по сравнению с ионизированным. кальций в сыворотке. Разница увеличивалась по мере снижения уровня ионизированного кальция в цельной крови.
Ионизированный кальций можно измерить в цельной крови или сыворотке. Институт клинических лабораторных стандартов (CLSI) предполагает, что оба метода приемлемы [7]. Измерение ионизированного кальция в сыворотке имеет недостатки, связанные с задержкой анализа и клеточного метаболизма во время центрифугирования. Измерение ионизированного кальция с использованием цельной крови имеет преимущества быстрых результатов, минимизации клеточного метаболизма и одновременного измерения калия. И хотя для этого требуется гепаринизация цельной крови, центрифугирование крови для выделения сыворотки не требуется.Гепарин связывает значительные количества ионизированного кальция и снижает уровень ионизированного кальция [8]. CLSI рекомендует, чтобы концентрация гепарина натрия была ниже 10 МЕ / мл и чтобы концентрация гепарина после титрования кальцием не превышала 70 МЕ / мл [7].
Анализ Bland-Altman показал, что среднее значение ионизированного кальция в сыворотке и ионизированного кальция цельной крови составляло 0,5 мг / дл, и что уравнение регрессии для разницы между двумя методами было следующим: разница = 2,2418 — 0.4389 × [среднее содержание ионизированного кальция в сыворотке и цельной крови (мг / дл)]. Это уравнение показывает, что разница между двумя методами увеличивается по мере снижения уровня ионизированного кальция. Доля ионизированного кальция, связанного с гепарином, увеличивается по мере снижения уровня ионизированного кальция. Если средний уровень ионизированного кальция в цельной крови и сыворотке составляет 5,108 мг / дл, разница будет примерно 0. Следовательно, если гиперкальциемия определяется как> 5,17 мг / дл, большинство уровней ионизированного кальция в цельной крови у пациентов без гиперкальциемии будут занижены. уровень ионизированного кальция в сыворотке.
Когда ионизированный кальций сыворотки был определен как эталон, не было значительных различий в распределении пациентов с гипокальциемией. Более половины всех пациентов с нормокальциемией (67,2%) были ошибочно отнесены к гипокальциемии на основании ионизированного кальция в цельной крови. Для классификации по уровню ионизированного кальция согласие между двумя измерениями составило только 27,9%. Этот результат предполагает, что ионизированный кальций следует измерять с использованием сыворотки у пациентов с подозрением на гипокальциемию.Кроме того, диагноз гипокальциемии на основе ионизированного кальция в цельной крови должен подтверждаться одновременным измерением ионизированного кальция в сыворотке крови.
У трех пациентов была гиперкальциемия. Многие пациенты необходимы для оценки различий в уровнях ионизированного кальция между цельной кровью и сывороткой у пациентов с гиперкальциемией. Однако, поскольку различия уменьшаются с увеличением уровня ионизированного кальция в цельной крови, количество случаев гиперкальциемии, определяемое измерением цельной крови, не может быть изменено.Среди пациентов с нормокальциемией частота ошибочной отнесения к гипокальциемии составила 43,8% для скорректированного кальция. Скорректированный кальций не может заменять ионизированный кальций в сыворотке крови.
Уровень pH связан с уровнем ионизированного кальция [7,11-13]. Изменения pH в цельной крови и сыворотке связаны с потерей CO2 и образованием молочной кислоты соответственно [7,8,11-13]. Чтобы свести к минимуму эффект потери CO 2 , ионизированный кальций цельной крови измеряли в течение 15 минут после отбора пробы. Чтобы свести к минимуму контакт с эритроцитами, образцы сывороточного ионизированного кальция следует центрифугировать в течение 1 часа после отбора и хранить при 4 ℃.В настоящем исследовании все значения pH были в пределах 0,15 единиц (7,36 ± 0,04), и изменение pH не коррелировало с ионизированным кальцием. Узкий интервал pH в нашей когорте может объяснить очевидное отсутствие связи между ионизированным кальцием и pH.
В заключение, это исследование демонстрирует, что уровень ионизированного кальция в цельной крови недооценен по сравнению с уровнем ионизированного кальция в сыворотке. Разница между измерениями увеличивается с уменьшением уровня ионизированного кальция в цельной крови.Следовательно, ионизированный кальций следует измерять в сыворотке крови. Значительную гипокальциемию в цельной крови следует подтверждать измерением ионизированного кальция в сыворотке.
ОСНОВНОЕ СООБЩЕНИЕ
1. Значительную гипокальциемию в цельной крови следует подтверждать измерением ионизированного кальция в сыворотке крови.
Сноски
Это исследование было поддержано грантом Daewoong Pharm. Co., Ltd., Республика Корея.
Ссылки
1. Национальный фонд почек. K / DOQI. Руководство по клинической практике костного метаболизма и заболеваний при хронической болезни почек.Am J Kidney Dis. 2003; 42 (4 доп. 3): S1 – S201. [PubMed] [Google Scholar] 2. Блок Г.А., Классен П.С., Лазарус Дж. М., Офстун Н., Лоури Е. Г., Чертов Г. М.. Минеральный обмен, смертность и заболеваемость при поддерживающем гемодиализе. J Am Soc Nephrol. 2004. 15: 2208–2218. [PubMed] [Google Scholar] 3. Янг EW, Альберт JM, Satayathum S и др. Предикторы и последствия измененного минерального метаболизма: исследование результатов диализа и моделей практики. Kidney Int. 2005. 67: 1179–1187. [PubMed] [Google Scholar] 4. An WS, Ким SE, Ким KH, Bae HR, Rha SH.Связь между соотношением окисленных ЛПНП и ЛПНП, ЛПВП и кальцификацией сосудов стоп у пациентов, находящихся на гемодиализе. J Korean Med Sci. 2009; 24 (Дополнение): S115 – S120. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Заболевание почек: улучшение глобальных результатов (KDIGO) Рабочая группа CKD-MBD. Руководство KDIGO по клинической практике по диагностике, оценке, профилактике и лечению хронической болезни почек — минеральных и костных заболеваний (CKD-MBD) Kidney Int Suppl. 2009; (113): S1 – S130. [PubMed] [Google Scholar] 6. Гаучи С., Моранн О., Фукери Б. и др.Подводные камни измерения общего содержания кальция в крови у пациентов с ХБП. J Am Soc Nephrol. 2008; 19: 1592–1598. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Sachs C, Rabouine P, Chaneac M, Kindermans C, Dechaux M. Оценка in vitro пробоотборника гепаринизированной крови для измерения ионизированного кальция. Энн Клин Биохим. 1991. 28 (Pt 3): 240–244. [PubMed] [Google Scholar] 8. Д’Орацио П., Тоффалетти Дж. Г., Вандруп Дж. Национальный комитет по клиническим лабораторным стандартам. Определение ионизированного кальция: переменные до сбора, выбор, сбор и обращение с образцом: утвержденное руководство.2-е изд. Уэйн: Национальный комитет по клиническим лабораторным стандартам; 2001. [Google Scholar] 9. Бланд Дж. М., Альтман Д. Г.. Статистические методы оценки соответствия между двумя методами клинических измерений. Ланцет. 1986; 1: 307–310. [PubMed] [Google Scholar] 10. Бланд Дж. М., Альтман Д. Г.. Сравнение методов измерения: почему отображение разницы по сравнению со стандартным методом вводит в заблуждение. Ланцет. 1995; 346: 1085–1087. [PubMed] [Google Scholar] 11. Маклин ФК, Гастингс Б.А. Состояние кальция в жидкостях организма: I.условия, влияющие на ионизацию кальция. J Biol Chem. 1935; 108: 285–321. [Google Scholar] 12. Хинкль Дж. Э., Куперман Л. Х. Уровень ионизированного кальция в сыворотке изменяется после переливания цитратной крови у анестезированного человека. Br J Anaesth. 1971; 43: 1108–1112. [PubMed] [Google Scholar] 13. Тоде Дж., Фог-Андерсен Н., Уимберли П.Д., Моллер Соренсен А., Сиггаард-Андерсен О. Связь между pH и ионизированным кальцием in vitro и in vivo у человека. Scand J Clin Lab Invest Suppl. 1983; 165: 79–82. [PubMed] [Google Scholar]Практический подход к гиперкальциемии
МЭРИ Ф.КАРРОЛЛ, доктор медицины, Восточный медицинский центр Нью-Мексико, Розуэлл, Нью-Мексико.
ДЭВИД С. ШЕЙД, доктор медицины, Школа медицины Университета Нью-Мексико и Центр медицинских наук, Альбукерке, Нью-Мексико
Am Fam Physician. 2003 1 мая; 67 (9): 1959-1966.
Гиперкальциемия — это заболевание, с которым обычно сталкиваются врачи первичного звена. У бессимптомных пациентов диагноз часто ставится случайно. Клинические проявления влияют на нервно-мышечную, желудочно-кишечную, почечную, скелетную и сердечно-сосудистую системы.Наиболее частыми причинами гиперкальциемии являются первичный гиперпаратиреоз и злокачественные новообразования. Некоторыми другими важными причинами гиперкальциемии являются лекарственные препараты и семейная гипокальциурическая гиперкальциемия. Первоначальное диагностическое обследование должно включать определение уровня интактного гормона паращитовидной железы, а прием любых лекарств, которые могут быть причиной заболевания, следует прекратить. Гормон паращитовидной железы подавляется при гиперкальциемии, связанной со злокачественными новообразованиями, и повышается при первичном гиперпаратиреозе. Перед рассмотрением операции на паращитовидных железах важно исключить другие причины, и пациентов следует направлять на паратиреоидэктомию только в том случае, если они соответствуют определенным критериям.Многие пациенты с первичным гиперпаратиреозом имеют доброкачественное течение и не нуждаются в хирургическом вмешательстве. Гиперкальциемический криз — это чрезвычайная ситуация, угрожающая жизни. Агрессивная внутривенная регидратация является основой лечения тяжелой гиперкальциемии, а антирезорбтивные средства, такие как кальцитонин и бисфосфонаты, часто могут облегчить клинические проявления гиперкальциемических расстройств.
Гиперкальциемия — это заболевание, с которым обычно сталкиваются врачи первичного звена. Примерно один из 500 пациентов, проходящих лечение в клинике общей медицины, имеет недиагностированный первичный гиперпаратиреоз, ведущую причину гиперкальциемии.1–4 Диагноз гиперкальциемии чаще всего ставится случайно, когда в образцах крови обнаруживается высокий уровень кальция. Основные проблемы в лечении гиперкальциемии — отличить первичный гиперпаратиреоз от состояний, которые не поддаются паратиреоидэктомии, и знать, когда уместно направить пациента на операцию. Очень важно, чтобы врачи знали, как оценивать и оптимально вести пациентов с гиперкальциемией, потому что лечение и прогноз зависят от основного заболевания.
Патофизиология гиперкальциемии
Скелет содержит 98 процентов общего кальция в организме; оставшиеся 2 процента циркулируют по всему телу. Половина циркулирующего кальция — свободный (ионизированный) кальций, единственная форма, которая имеет физиологические эффекты. Остальное связано с альбумином, глобулином и другими неорганическими молекулами. Низкий уровень альбумина может повлиять на общий уровень кальция в сыворотке. Прямое измерение уровня свободного кальция более удобно и точно, но для расчета скорректированного общего уровня кальция в сыворотке можно использовать следующую формулу:
Скорректированный кальций = (4.0 г на дл — [плазменный альбумин]) 3 0,8 + [сывороточный кальций] Паратироидный гормон (ПТГ), 1,25-дигидроксивитамин D 3 (кальцитриол) и кальцитонин контролируют гомеостаз кальция в организме (таблица 1). Повышенная резорбция костей, повышенное всасывание кальция в желудочно-кишечном тракте и снижение выведения кальция через почки вызывают гиперкальциемию. Нормальный уровень кальция в сыворотке составляет от 8 до 10 мг на дл (от 2,0 до 2,5 ммоль на л, рис. 1), хотя точный диапазон может варьироваться в зависимости от лаборатории. Нормальный уровень ионизированного кальция составляет от 4 до 5.6 мг на дл (от 1 до 1,4 ммоль на л). Гиперкальциемия считается легкой, если общий уровень кальция в сыворотке составляет от 10,5 до 12 мг на дл (2,63 и 3 ммоль на л) .5 Уровни выше 14 мг на дл (3,5 ммоль на л) могут быть опасными для жизни.
ПТГ — это гормон из 84 аминокислот, продуцируемый четырьмя паращитовидными железами размером с горошину, расположенными позади щитовидной железы. В ответ на низкий уровень кальция в сыворотке крови ПТГ повышает уровень кальция за счет ускорения резорбции остеокластической кости и увеличения резорбции кальция почечными канальцами.Он также увеличивает уровень кальцитриола, что косвенно повышает уровень кальция в сыворотке крови. ПТГ вызывает потерю фосфатов через почки. Таким образом, у пациентов с гиперкальциемией, опосредованной ПТГ, уровни фосфатов в сыворотке обычно низкие.
Посмотреть / распечатать таблицу
ТАБЛИЦА 1Действия гормонов, участвующих в гомеостазе кальция
| Гормон | Влияние на кости | Влияние на кишечник | Влияние на почки |
Действия гормонов, участвующих в гомеостазе кальция
Витамин D — стероидный гормон, который получается с пищей или вырабатывается солнечным светом на предшественниках витамина D кожа.Кальцитриол, активная форма витамина D, образуется в результате последовательного гидроксилирования предшественника холекальциферола сначала в печени (25-гидроксилирование), затем в почках (1-гидроксилирование). Достаточное количество витамина D необходимо для образования костей. Однако главной целью витамина D является кишечник, где он увеличивает усвоение кальция и фосфата. Таким образом, при гиперкальциемии, опосредованной витамином D, уровни фосфатов в сыворотке обычно высоки. Посмотреть / распечатать рисунок Спектр гиперкальциемииРИСУНОК 1. Спектр гиперкальциемии, определяемый уровнями общего и ионизированного кальция в сыворотке. Спектр гиперкальциемииРИСУНОК 1. Спектр гиперкальциемии, определяемый уровнями общего и ионизированного кальция в сыворотке. Кальцитонин — гормон из 32 аминокислот, продуцируемый парафолликулярными С-клетками щитовидной железы. Кальцитонин является слабым ингибитором активации остеокластов и противодействует воздействию ПТГ на почки, тем самым способствуя выведению кальция и фосфата.Уровень кальцитонина может быть повышен у беременных и у пациентов с медуллярной карциномой щитовидной железы. Однако прямых клинических последствий нет, и уровень кальция в сыворотке обычно в норме. ПТГ-родственный пептид (PTHrP) является основным медиатором гиперкальциемии, связанной с солидными опухолями. 6 PTHrP гомологичен PTH по аминоконцу, области, которая включает рецептор-связывающий домен. PTHrP связывает рецептор PTH и имитирует биологическое воздействие PTH на кости и почки. Клинические проявления гиперкальциемииОптимальная концентрация ионизированного кальция в сыворотке крови необходима для нормального функционирования клеток. Гиперкальциемия приводит к гиперполяризации клеточных мембран. Пациенты с уровнем кальция от 10,5 до 12 мг на дл могут протекать бессимптомно.7 Когда уровень кальция в сыворотке поднимается выше этой стадии, становятся очевидными мультисистемные проявления (таблица 2). Эта совокупность симптомов привела к мнемоническому «Камни, кости, брюшные стоны и психические стоны», которые используются для напоминания о признаках и симптомах гиперкальциемии, особенно в результате первичного гиперпаратиреоза. Нервно-мышечные эффекты включают нарушение концентрации внимания, спутанность сознания, кальцификацию роговицы, утомляемость и мышечную слабость.8 Среди желудочно-кишечных проявлений — тошнота, боль в животе, анорексия, запор и, в редких случаях, язвенная болезнь или панкреатит. Наиболее важными почечными эффектами являются полидипсия и полиурия в результате нефрогенного несахарного диабета и нефролитиаз в результате гиперкальциурии. Другие почечные эффекты включают обезвоживание и нефрокальциноз. Сердечно-сосудистые эффекты включают гипертензию, кальцификацию сосудов и укороченный интервал QT на электрокардиограмме.Сердечные аритмии встречаются редко. Боль в костях может возникать у пациентов с гиперпаратиреозом или злокачественными новообразованиями. Остеопороз кортикальной кости, такой как запястье, в основном связан с первичным гиперпаратиреозом.9 Избыток ПТГ также может привести к поднадкостничной резорбции, что приводит к кистозному остеиту с кистами и коричневыми опухолями длинных костей. Дифференциальный диагноз гиперкальциемииПервичный гиперпаратиреоз и злокачественные новообразования составляют более 90 процентов случаев гиперкальциемии.Эти состояния необходимо дифференцировать на ранней стадии, чтобы обеспечить пациенту оптимальное лечение и точный прогноз. Гуморальная гиперкальциемия злокачественной опухоли подразумевает очень ограниченную продолжительность жизни — часто всего несколько недель. С другой стороны, первичный гиперпаратиреоз имеет относительно доброкачественное течение. Причины гиперкальциемии можно разделить на семь категорий: гиперпаратиреоз, причины, связанные с витамином D, злокачественные новообразования, лекарства, другие эндокринные нарушения, генетические нарушения и разные причины (Таблица 3).Оценка пациента с гиперкальциемией (рисунок 2) должна включать тщательный сбор анамнеза и физикальное обследование с акцентом на клинические проявления гиперкальциемии, факторы риска злокачественных новообразований, лекарственные препараты, вызывающие заболевание, и семейный анамнез состояний, связанных с гиперкальциемией (например, камней в почках). Посмотреть / распечатать таблицу ТАБЛИЦА 2Клинические проявления гиперкальциемии
Клинические проявления гиперкальциемии
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|





