Гемолиз, хилез и иктеричность. Зачем пересдавать анализ крови
Почему не получился анализ и нужен повторный забор крови?
Ваш питомец чувствует себя не хорошо, и вы пошли с ним на прием к ветеринарному врачу. У питомца взяли кровь на исследование. Однако, из лаборатории пришел запрос на повторный забор материала (крови) по причине гемолиза или хилеза. Давайте кратко попробуем разобраться, зачем так необходим повторный забор крови.
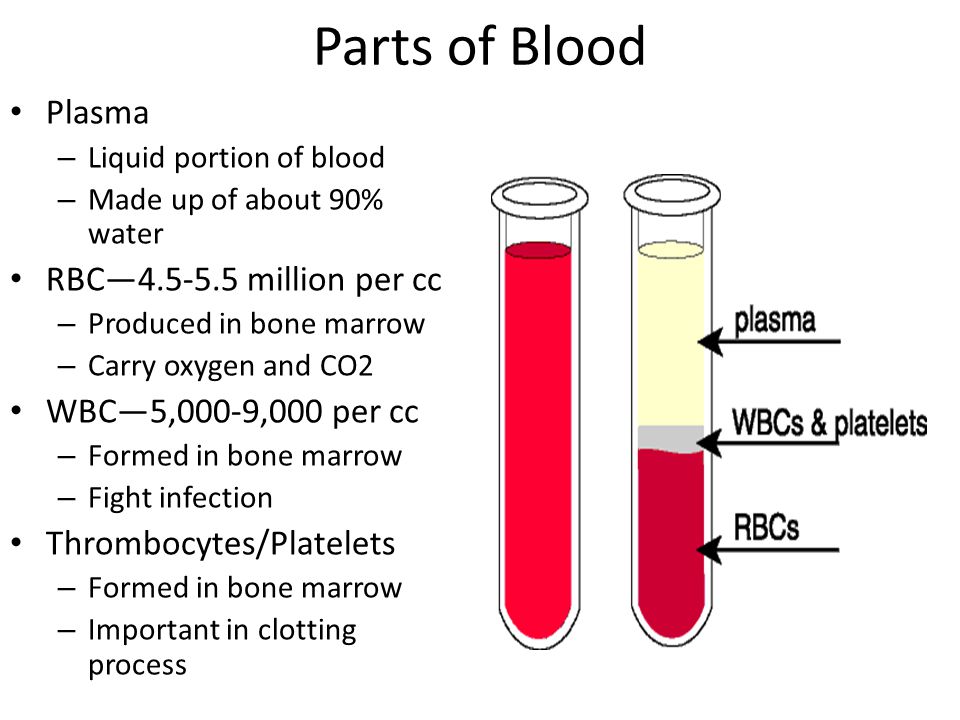
Кровь животных имеет красный цвет, так как в ней циркулирует большое количество красных клеток крови – эритроцитов. Клетки не вечны и завершает жизненный цикл эритроцитов физиологический гемолиз. В результате освобождается гемоглобин, который в последующем идет на синтез новых эритроцитов.
1 — норма и иктеричность; 2 — норма и хилез; 3 — норма и гемолиз
Что такое гемолиз?
При определенных патологиях (болезнях) происходит патологический гемолиз. То есть клетки разрушаются гораздо быстрее, чем нужно. Такие процессы происходят при инфекционных заболеваниях, отравлениях растительными или синтетическими ядами, гемолитических анемиях, аутоиммунных заболеваниях, после переливания неподходящей донорской крови. Крайне редко гемолиз может возникать по причине нарушения преаналитического этапа забора крови.
Отличительным признаком гемолиза является прозрачная сыворотка красного цвета после центрифугирования крови. Эта окраска сыворотки ведет к искажению истинных значений биохимических показателей. Поэтому лаборант просит повторить отбор материала. Чтобы удостоверится в истинном патологическом гемолизе у животного.
Что такое хилез/липемия?
Такую пометку делают на бланках результатов
Хилез – это физическое помутнение сыворотки из-за присутствия большого количества жиров (триглицеридов и хиломикронов).
С такой ситуацией можно столкнутся, если кровь взяли у животного после кормления, либо питомец принимает курс специфичных лекарственных препаратов. Во всех других случаях стойкий хилез указывает на нарушение обмена веществ у питомца, в том числе возможны эндокринологические проблемы.
Что такое иктеричность?
Так же в бланках результатов анализов можно встретить в комментариях термин «иктеричность».
Этот термин обозначает окраску сыворотки или плазмы крови от ярко желтого до оранжевого цвета. Такое изменение характерно для тяжелых болезней животных и не требует повторного взятия крови.
Лаборатория стремится сделать анализы максимально качественно, чтобы лечащий ветеринарный врач смог быстро и качественно помочь вашим питомцам! Вышеописанные патологии зачастую не дадут корректного результата. Именно поэтому приходит просьба о повторном заборе крови.
Здоровья вам и вашим питомцам!
Отделение хирургии МВЦ «ПиК»
Хилез | Кружок Эсмарха
Бывают ситуации, когда при сдаче крови из вены для определения биохимических анализов, мы видим оставленную лаборантом надпись «Хилез!». Что такое хилез?
Это лабораторное понятие, которое обозначает лишь то, что визуально сыворотка крови, сданная человеком, хилезная или «молочная».
Это происходит в тех случаях, когда кровь сдается не натощак, а после еды (часто у грудных детей, у лиц, которые вынуждены сдавать кровь, выезжая для этого в другой город). При этом в сыворотке крови начинают преобладать жировые микрочастицы, которые и обусловливают ее цвет. В результате после того, как кровь подвергнется центрифугированию, будет получена белая густая сметанообразная жидкость. Понятно, что делать анализ такого субстрата и определять содержание биохимических показателей невозможно.
Может возникнуть вопрос, а каким все-таки образом прием пищи будет влиять на лабораторные данные (в частности печеночные ферменты, трансаминазы)? Точного ответа на этот вопрос нет: может повлиять, а может и не повлиять.
Следует отдельно сказать об определении содержания в крови гормонов, позволяющих оценить функцию щитовидной железы: ТТГ, Т3; а так же половых гормонов. На их определение в сыворотке крови прием пищи никакого влияния не оказывает. Разумеется, если блюда, которые были съедены незадолго до взятия крови на анализ, не содержали наряду с прочим ткани щитовидных и половых желез (что в нашей действительности встречается не так уж и редко).
Итак, из всего вышеизложенного следует сделать один вывод:
если Вы видите на результате Вашего биохимического анализа надпись «ХИЛЕЗ», значит всё, что Вам нужно сделать, это строго натощак пересдать кровь.
В ряде случаев даже рекомендуют несколько дней до проведения анализа пить минеральную воду, придерживаясь диеты, исключающей животные жиры, алкоголь, а так же консервированную продукцию.
Влияние сыворотки крови больного острым панкреатитом на свободнорадикальные процессы эритроцитов здоровых людей и больных острым панкреатитом Текст научной статьи по специальности «Фундаментальная медицина»
© Коллектив авторов, 2007 УДК: б1б.37 — 002:б1б.127
ВЛИЯНИЕ СЫВОРОТКИ КРОВИ БОЛЬНОГО ОСТРЫМ ПАНКРЕАТИТОМ НА СВОБОДНОРАДИКАЛЬНЫЕ ПРОЦЕССЫ ЭРИТРОЦИТОВ ЗДОРОВЫХ ЛЮДЕЙ И БОЛЬНЫХ ОСТРЫМ ПАНКРЕАТИТОМ
П.С. Филипенко, Г.С. Ивченко, Г.В. Потапов Ставропольская государственная медицинская академия
Острый панкреатит (ОП) сопровождается повышенным «уклонением» ферментов из поджелудочной железы в кровь и снижением активности основного ингибитора сериновых протеиназ a1 — антитрипсина [10]. Вследствие этого сыворотка крови становится токсичной для форменных элементов крови, в том числе эритроцитов.
Материал и методы. Использовали кровь 21 здорового донора (контрольная группа) и 93 больных ОП. Исследовали отмытые 0,9% раствором NaCl эритроциты и очищенные мембраны эритроцитов. Активацию ПОЛ вызывали инкубацией эритроцитов и мембран эритроцитов здоровых людей с 0,5 мл плазмы крови больного ОП (диастаза 2480 ед.). Плазму с образцами эритроцитов инкубировали 30 мин. при 37°С. Мембраны выделяли методом дифференцированного центрифугирования при 35 000 g. Липиды экстрагировали смесью гексан-изопропанол (2:1) [7] с добавлением в экстрагируемую смесь 102М ионола для предотвращения спонтанной индукции ПОЛ. Содержание диеновой конъюгации (ДК) определяли по методу И.А. Волчегорского и соавт. (1989) [2], малонового диальдегида (МДА) по методу И.Д. Стальной [б]. Активность каталазы (КА) определяли кинетически по поглощению Н2О2 в УФ-об-ласти [4], активность глюкозо-б-фосфатдегндрогеназы (Г-б-ФДГ), глутатионредуктазы (ГР), глутатионперок-сидазы (ГП) по Ф.Е. Путилиной (1982) [5]. Результаты
исследования обработаны методом корреляционного и вариационного анализа при р не < 95%.
Результаты и обсуждение. В остром периоде ОП в эритроцитах наблюдалось увеличение ДК и статистически незначимое повышение МДА. Это могло быть связано либо с меньшим накоплением МДА в эритроцитах или с утилизацией первичных продуктов ПОЛ на стадии зарождения цепей. Высказанное предположение подтверждено обратной корреляцией между названными показателями (г = 0,817, р<0,01).
Это могло быть связано либо с меньшим накоплением МДА в эритроцитах или с утилизацией первичных продуктов ПОЛ на стадии зарождения цепей. Высказанное предположение подтверждено обратной корреляцией между названными показателями (г = 0,817, р<0,01).
Изменение системы, сопряженной с окислением восстановленного глутатиона, сопровождалось торможением активности Г-6-ФДГ и ростом ГР и ГП. Максимальное увеличение активности среди исследованных ферментов отмечено для каталазы (4,6 раза). Ее активность при ОП прямо коррелировала с изменениями ДК (г = 0,876), МДА (г = 0,942), ГП (г = 0,976), ГР (г = 0,891) и обратное Г-6-ФДГ (г = 0,831). Аналогичное повышение активности КА, ГР, ГП, СОД отмечено при инкубации изолированных альвеолярных макрофагов, отмытых эритроцитов в атмосфере 95% кислорода под обычным давлением. Активация антиокислительных ферментов в этом случае является первой реакцией организма на увеличение интенсивности ПОЛ [1]. Наиболее чувствительным индикатором процесса следует считать КА [3].
Известно, что большая часть антиокислительных ферментов локализована в растворимой фазе клетки, в то время как процесс ПОЛ затрагивает в основном структурированные липиды мембранных образований [8]. Представлялось целесообразным выяснить возможность участия ферментов в регуляции ПОЛ на мембране эритроцитов. Работая с очищенными мембранами эритроцитов, мы обнаружили, что в некоторых образцах мембран больных ОП, в отличие от интакт-ных эритроцитов, имело место достоверное накопление МДА после их контакта с плазмой крови больного ОП. Мы предположили, что определенное значение в торможении пероксидации могла иметь КА, поскольку активность фермента, связанного с мембраной, изменялась в широких пределах — от 6,50 до 75,78 ммоль Н2О2
МЕДИЦИНСКИЙ ВЕСТНИК СЕВЕРНОГО КАВКАЗА, № 1, 2007
на мг белка за 1 минуту.
В то же время в интактных эритроцитах активность КА не изменилась в широких пределах после контакта с плазмой крови больного ОП. Наличие двух максимумов активности КА со средними значениями 74,121±4,276 и 17,715±0,972 мкмоль Н2О2 на мг белка в мембранах послужило основанием для выделения двух типов мембран: с высоким (тип I) и низким (тип II) значением активности КА. Мембраны I типа были у 39 больных, а II типа у 54 больных. Активность Г-6-ФДГ в мембранах I типа была на 21 % ниже (р<0,05), а в мембранах II типа на 19% выше (р<0,018), чем в интактных мембранах эритроцитов. При изучении активности ГП, ГР отмечена более высокая активность ферментов в мембранах II типа, чем первого (р<0,01). Таким образом, мембраны эритроцитов отличались не только по активности КА, но и по скорости включения антиокислительных ферментов в процесс детоксикации органических продуктов ПОЛ.
Изучение природы связи КА и других антиокислительных ферментов с мембраной эритроцитов показало, что при выделении ферментов количество отмывок не влияет на активность КА, Г-6-ФДГ, ГП, ГР. Мы предположили, что на активность ферментов, возможно, оказывает влияние их физико-химическое взаимодействие с мембраной, обусловленное глубиной погружения гидрофобной части фермента в липидный бислой. После обработки мембран 0,6 М раствором ионного детергента КО связанной с мембраной активности КА оставалось всего 10% от ее первоначальной величины (р<0,01), ГП- 100%, ГР-80% (р<0,05), Г-6-ФДГ-7% (р<0,01). Экстракция же связанных с мембраной ферментов 1% тритоном Х-100 приводила к солюбилизации 90% ферментов. Учитывая то обстоятельство, что КО солюбилизирует поверхностно расположенные и удерживаемые на мембране за счет ионных взаимодействий белки, а тритон Х-100 модифицирует липидный бислой мембраны и вычленяет значительно больше, чем КО, гидрофобных белков из липидов, можно предположить, что КА и Г-6-ФДГ, в отличие от ГР и ГП, относятся к периферическим белкам эритроцитарной мембраны. Ферменты сорбируются и удерживаются на ней с помощью ионных взаимодействий; активность же ферментов определяется, вероятно, особенностями мембраны. Выводы
Ферменты сорбируются и удерживаются на ней с помощью ионных взаимодействий; активность же ферментов определяется, вероятно, особенностями мембраны. Выводы
1. В эритроцитах здоровых людей в присутствии плазмы крови больного ОП процесс ПОЛ обрывается на стадии зарождения цепей (ДК), а у больных острым панкреатитом принимает цепной свободнорадикальный характер с образованием МДА.
2. На уровне эритроцитарных мембран происходит более существенная активация процесса ПОЛ, степень которого зависит от структуры мембраны и первоначальной активности, связанных с мембраной ферментов.
3. КА и Г-6-ФДГ связаны с мембранами эритроцитов лабильно, а ГП и ГР более жестко.
4. В мембранах с высокой активностью КА анти-окислительный процесс осуществляет каталазная реакция. В мембранах с низкой каталазной активностью это происходит за счет ферментов окислительно-восстановительного перехода глутатиона.
5. Низкая активность ГП при высокой активности КА служит показателем резистентности эритроцитов к повреждающему действию плазмы крови больного ОП,
в то время как низкая активность при высокой ГП указывает на низкую резистентность мембран к переокис-лению.
Литература
1. Арчаков, А.И. Модификация белков активным кислородом и их распад / А.И. Арчаков, Н.М. Мохосев // Биохимия. — 1989. — Т. 54, вып. 2. — С. 179-186.
2. Волчегорский, И.Н. Сопоставление различных подходов к опредлению продуктов перекисного окисления липидов в гептан-пропропанольных экстрактах крови // Вопр. мед. химии. — 1989. — № 1. — С. 127-131.
3. Ивченко, Г.С. Зависимость изменения активности свободнорадикальных процессов от сроков развития острого панкреатита: Дис. … к-та мед. наук / Г.С. Ивченко. — Ставрополь, 2006. — 135 с.
Ивченко, Г.С. Зависимость изменения активности свободнорадикальных процессов от сроков развития острого панкреатита: Дис. … к-та мед. наук / Г.С. Ивченко. — Ставрополь, 2006. — 135 с.
4. Метод определения активности каталазы / М.А. Королюк, Л.И. Иванова, И.Г. Майорова и др. // Лаб. дело. — 1988.
— № 1. — С. 16-19.
5. Путилина Ф.Е. // Методы биохимических исследований / под ред. М.П. Прохоровой. Л., 1982. — С. 181 — 183.
6. Стальная, И.Д. // Современные методы в биохимии / под ред. В.Н. Орехович. — М., 1977. — С. 63-64.
7. Таранова, Н.П. Микрометод определения общих липидов в лимфоцитах и другом биологическом материале / Н.П. Таранова, Л.В. Говорова // Вопр. мед. химии. — 1987. — №2.
— с. 132-136.
8. Филипенко, П.С. Механизмы повреждения и защиты поджелудочной железы при остром панкреатите : Дис. … д-ра мед. наук / П.С. Филипенко. — Ставрополь, 1996. — 335 с.
9. Esierhauer, H. Chemistry and biochemistry of 4-hydroxynon-enal, malonaldehyde and related aldehydes / H. Esierhauer, R.J. Schaur, H. Zollner // Free Radic. Biol. Med. — 1991.
— Vol. 11. — P. 81-128.
10. Wefers, H. Oxidation of glutathione by the superoxide radical to the disulfide and the sulfonate yielding singlete oxygen / H. Wefers, H. Sies // Eur. J. Biochem. — 1983. — Vol. 137, № l-2. — P. 29-36.
ВЛИЯНИЕ СЫВОРОТКИ КРОВИ БОЛЬНОГО ОСТРЫМ ПАНКРЕАТИТОМ НА СВОБОДНОРАДИКАЛЬНЫЕ ПРОЦЕССЫ ЭРИТРОЦИТОВ ЗДОРОВЫХ ЛЮДЕЙ И БОЛЬНЫХ ОСТРЫМ ПАНКРЕАТИТОМ
П. С.ФИЛИПЕНКО, Г. С. ИВЧЕНКО, Г.В. ПОТАПОВ
С.ФИЛИПЕНКО, Г. С. ИВЧЕНКО, Г.В. ПОТАПОВ
Исследованы продукты перекисного окисления липидов (диеновая конъюгация ненасыщенных жирных кислот и малоновый диальдегид) и ферменты антиокислительной системы (каталаза, глутатионпероксидаза, глутатионредуктаза и глюкозо-6-фосфатде-гидрогеназа) в отмытых 0,9% раствором ШС1 эритроцитах и эрит-роцитарных мембранах 21 донора и 93 больных ОП. Установлено, что в эритроцитах в присутствии плазмы крови больного острым панкреатитом активизируются процессы перекисного окисления липидов, возрастает активность антиокисли-тельных ферментов. На уровне мембран происходит более существенная активация процесса, степень которой зависит от структуры мембраны и первоначальной активности, связанных с мембраной ферментов. Каталаза и глюкозо-6-фосфатдегидрогеназа связаны с мембраной эритроцитов лабильно, а глутатионпероксидаза и глутатионредук-таза более жестко.
Ключевые слова: острый панкреатит, свободнорадикальные процессы, антиокислительные ферменты
EFFECT OF BLOOD SERUM IN ACUTE PANCREATITIS UPON THE FREE RADICAL PROCESSES I N RED CELLS OF HEALTHY VOLUNTEERS AND PATIENTS
FILIPENKO P.S., IVCHENKO G.S., POTAPOV G.V.
Lipid peroxidation products (diene conjugation of nonsaturated fat acids and malonic dialdehyde) and enzymes of antioxidizing system (catalase, glutathione peroxidase, glutathione reductase and glucose 6-phosphate dehydrogenase) were studied in swept by 0,9 % NaCl solution red cells and erythrocytic membranes of 21 donors and 93 patients with acute pancreatitis (AP). Lipid peroxidation processes and antioxidizing enzymes in blood cells were evidently activated by plasma of acute pancreatitis patients. More essential activation of the above process was observed in cell’s membranes and depended on the membrane structure and initial activity of the membrane-bound enzymes. Cata-lase and glucose 6-phosphate dehydrogenase binding with erythrocytic membranes was labile, while glutathione peroxidase connection with glutathione reductase was more stable.
Cata-lase and glucose 6-phosphate dehydrogenase binding with erythrocytic membranes was labile, while glutathione peroxidase connection with glutathione reductase was more stable.
Key words: an acute pancreatitis, free radical processes, anti-oxidizing enzymes
Важная информация | ГБУ НО «Облветлаборатория»
Презентация к семинару по теме: «Отбор проб и пробоподготовка пищевой продукции». Презентация №1
Презентации к семинару по теме: «Правила приобретения, использования и утилизирования прекурсоров». Химреактивы , Прекурсоры
Презентации к семинару по теме: «Особенности отбора и доставки проб в лабораторию для исследования на АЧС. Правила техники безопасности и биобезопасности». , Презентация №2
Презентации к семинару по теме: «Отбор проб патматериала. Правила отбора, упаковки и доставки проб в лабораторию. Законодательная база. Сопроводительная документация. Типичные ошибки». Презентация №1 , Презентация №2
Презентация по теме: «Клинический анализ крови». Презентация Клинический анализ крови
Для владельцев домашних животных.
Облветлаборатория проводит исследования снятых с животных и людей клещей на наличие инфекционного начала клещевого энцефалита, пироплазмоза, боррелиоза и бартонеллеза.
Клещевые инфекции животных.
Основную опасность укуса клеща представляют инфекционные заболевания, для которых насекомые являются переносчиками в эндемических районах.
Часто владельцы питомцев не знают о существовании многих болезней, которые передаются вместе с укусом клеща.
Что переносят клещи?
Род Ixodes — переносчики боррелиоза, или болезни Лайма, клещевого энцефалита а также — бабезиоза (пироплазмоза) и бартонеллеза;
Род Haemaphisalis — переносят боррелиоз, бабезиоз, ряд риккетсиоозов;
Род Rhipicephalus — переносчики ряда риккетсиозов и пироплазмоза собак и других животных.
О чем нужно помнить?
Заражение собак трансмиссивными болезнями возможно даже в крупных городах;Многие инфекционные заболевания собак, переданные с укусом клеща, опасны для человека;После укуса и заражения у животного не всегда могут проявляться клинические признаки болезни. Субклиническое — скрытое течение патологии обуславливает носительство и является источником заражения человека;При отсутствии корректного и своевременного лечения собаки к основному течению болезни присоединяются, как правило, коинфекции — дополнительные инфекционные заболевания;Укус клеща у собаки помимо симптомов основного заболевания может вызвать признаки кожных заболеваний, аллергический эффект, оказать токсичное воздействие на нервную систему.В связи с опасностью и сложностью многих патологий, в том числе и для хозяев животных, необходима ранняя и точная диагностика инфекционных заболеваний.
Для своевременного выявления заболевания вашего питомца необходимо сдать клеща на исследование (методом ПЦР) на наличие возбудителя.
Руководителям сельхозпредприятий.
Облветлаборатория разрабатывает для предприятий-производителей сырого молока и сырого мяса программу производственного контроля, основанную на принципах ХАССП.
Определение сухого молока в продуктах питания методом иммуноферментного анализа.
«Молоко, — писал академик И.П. Павлов, — это изумительная пища, приготовленная самой природой».
В состав молока входят свыше 100 ценнейших компонентов: белки, жиры, углеводы, минеральные соли, витамины, ферменты. Молоко является основой для производства множества полезных, питательных кисломолочных продуктов для взрослых, а особенно для детей.
В связи с повышением внимания населения к здоровому питанию и к качеству продуктов встает вопрос об использовании максимально натурального и высококачественного сырья в пищевых технологиях.
Качество многих продуктов, в том числе и молочных, в последнее время значительно снизилось благодаря недобросовестности некоторых производителей, поэтому возникла необходимость в выявлении некоторых фальсификаций, в частности в молочном производстве.
Например, для определения количественного выявления содержания восстановленного молока в пищевых продуктах, применяются наборы реагентов для определения сухого молока в продуктах питания методом иммуноферментного анализа. Метод позволяет определять минимальную достоверно определяемую концентрацию антигена сухого молока в пробе на уровне 0,025 Ед/мл.
Это соответствует: 0,025% примеси восстановленного молока в натуральном; 0,85% сухого молока на общий белок пробы.
Положительная особенность данного метода в том, что содержание антигена-мишени не влияют технологические процессы, которым подвергается сырье, а также тип продукта (свежее молоко, кисломолочные изделия, сыры и пр.). Наличие антигена связано только с присутствием его в начальном сырье. При этом длительность исследования составляет 2часа 30минут.
Вниманию предприятий, осуществляющих производство и реализацию пищевой продукции.
Облветлаборатория проводит гистологическое исследование пищевой продукции.
Об отборе проб
Точный результат лабораторных исследований во многом зависит от самих хозяйств, в частности от сроков отбора, условий транспортировки, а также качества биоматериала.
Пат. материал.
Отбор проб производит ветспециалист. Важно отобрать биоматериал в соответствии с предполагаемым заболеванием, т.е. из тех органов, в которых наиболее сильно выражены патологоанатомические изменения. Образцы на исследование доставляют в опечатанном виде нарочным, в возможно кратчайший срок, не позднее 24 часов с момента отбора. Пробу необходимо упаковать во влаго-непроницаемую тару. Транспортировка пат. материала производится при температуре от 2 до 8 С (в термосе со льдом).
Для исследования пат. материала методами ИФА, РИФ, РГА необходимо отобрать пат. материал в период проявления клинических признаков или не позже 2-3 часов после гибели животного. Допускается хранение патологического материала при температуре +4-60С 2 суток, при температуре -30 ºС — не более 10 дней.
При подозрении на отравление в лабораторию отправляют материал от павших животных. Взятый материал должен быть отправлен в лабораторию немедленно с нарочным.
Для биохимических исследований следует направлять органы и ткани не отпавших животных, а специально выборочно убитых (в крайнем случае, павших в присутствии ветеринарного врача и в тотчас разделанных) животных.
Патологический материал при подозрении на инфекционные заболевания отбирают не позднее 2 часов после гибели, убоя животного или аборта и направляют в лабораторию в герметичной упаковке. При невозможности скорой доставки пат. материал хранят в холодильнике при 4-6°С не более 6 часов или консервируют 30%-ным стерильным водным раствором глицерина. Трупы мелких животных направляют целыми в непроницаемой таре (целлофане, полиэтиленовой пленке, пластиковой ёмкости).
Кровь.
Для проведения серологических лабораторных исследований необходимо отобрать сыворотку крови в объеме: от животных — 1-3 мл, от птиц- не менее 0,5 мл. Допускается однократное замораживание сыворотки крови.
Для исследования биоматериала методом ПЦР сыворотки крови доставляют в лабораторию в замороженном состоянии в сумке-холодильнике, либо в термоконтейнере с заложенными хладоэлементами без замораживания в течение 24-48 часов.
Отбор проб крови для гематологического исследования проводят стерильными иглами в подготовленные пробирки, используют свежий антикоагулянт (трилон «Б»). Так же можно использовать пробирки произведенные фабричным способом. Во время отбора проб крови животных не кормят, уборку помещений не проводят. Стабилизированную кровь до исследования хранят в холодильнике при температуре 2-4 С и исследуют не позднее, чем через 36 часов с момента взятия. Пробы крови нельзя замораживать, нельзя встряхивать (при транспортировке), нельзя долго хранить.
Для биохимического анализа пробы крови берут у животных перед кормлением или через 5-6 часов после кормления в сухие подготовленные для анализа пробирки. В лабораторию доставляют сыворотку в день взятия крови. Объем доставленной сыворотки должен составлять не менее 6 мл. Промежуток времени между взятием крови и началом исследования должен быть не более 5 часов. Гемолизированная, замороженная и хилезная сыворотка к исследованию не принимаются.
В лабораторию доставляют сыворотку в день взятия крови. Объем доставленной сыворотки должен составлять не менее 6 мл. Промежуток времени между взятием крови и началом исследования должен быть не более 5 часов. Гемолизированная, замороженная и хилезная сыворотка к исследованию не принимаются.
Для проведения серологических исследований кровь берут утром до кормления животных (у жвачных в любое время) в количестве не менее 5-7 мл. Пробы направляют для исследования в лабораторию в свежем или консервированном виде (сыворотку собак через 3-4 часа и повторно через 10-12 часов). Неконсервированные сыворотки пригодны для исследования в течение 6 суток со дня взятия крови при условии хранения их при 4-80С. Сыворотки консервированные фенолом или борной кислотой, пригодны для исследования в течение 30 суток, замороженные сыворотки – в течении 3 суток после однократного оттаивания. В случае доставки крови без сыворотки ее нельзя консервировать или замораживать.Кровь от абортировавших животных должна доставляться дважды- непосредственно сразу после аборта и через 14-21 день с настоящего момента крововзятия.
На лептоспироз пробы крови берутся не ранее чем через 5-7 суток после проявления клинических признаков болезни или не ранее чем через 90 суток после вакцинации крупного рогатого скота, для свиней после вакцинации через 60 суток и других видов животных, а также не ранее, чем через 10-12 дней после проведенного лечения.
Общее правило для всех исследований крови: мутные, проросшие, гемолизированные сыворотки исследованию не подлежат.
Фекалии.
Пробы фекалий для исследования на вирусные заболевания помещают в пенициллиновые флаконы, закрывают резиновыми пробками. Смывы со слизистых оболочек берут стерильными тампонами во флаконы с 1-2 мл физ.раствора.
Пробы фекалий для паразитологического исследования массой 10 г от крупного рогатого скота, лошадей, собак фекалии берут индивидуально. Для исследования овец, оленей, свиней, кроликов и пушных зверей взятый материал регистрируют в соответствии с группой (отарой) животных или станком и клеткой, в которых содержатся животные. Обследуют 10% поголовья животных хозяйства, фермы, отары. Пробы помета от птиц для исследования берут от 5% поголовья. Доставлять пробы фекалий следует в стеклянных банках, целлофановых мешочках, в плотной оберточной или пергаментной бумаге и в прочих упаковках. Доставляют пробы в лабораторию в день их взятия.
Обследуют 10% поголовья животных хозяйства, фермы, отары. Пробы помета от птиц для исследования берут от 5% поголовья. Доставлять пробы фекалий следует в стеклянных банках, целлофановых мешочках, в плотной оберточной или пергаментной бумаге и в прочих упаковках. Доставляют пробы в лабораторию в день их взятия.
Фекалии, гной, слизь, экссудат, молоко, желчь, кровь, мочу на исключение бактериальных инфекций направляют в стерильных пробирках, флаконах, хорошо закрытых стерильными резиновыми пробками, в объёме не менее 5 мл. Весь материал доставляется в лабораторию в сумке – холодильнике с хладагентами.
Моча.
Пробы мочи для ПЦР-диагностики нужно доставлять в тот же день.
Для биохимического исследования следует брать первую утреннюю порцию мочи. У животных с выделениями из половых органов мочу для исследования берут непосредственно из мочевого пузыря при помощи катетера. Мочу для исследования нужно как можно быстрее отправить в лабораторию. Сосуд с мочой тщательно закрывают во избежание попадания в нее микроорганизмов, которые могут вызвать разложение мочевины и распад форменных элементов. В теплое или жаркое время года к моче во избежание брожения прибавляют крупинку тимола или хлороформную воду из расчета 20-30 мл на 1мл мочи.
Для исследования молока на бруцеллез в кольцевой реакции пробу (10-15 мл) цельного свежего молока берут из одного удоя от коровы в стерильную пробирку. Пробы молока на рынках берут из каждой отдельной посуды (бидон, фляга и прочее) после тщательного его перемешивания. Пробирки нумеруют и составляют опись проб.
При направлении молока на исследование в лабораторию каждую пробу консервируют добавлением одной капли 10%-ного формалина на 5-10 мл молока. Консервированное молоко пригодно для исследования в течении 2-3 суток. Перед исследованием его необходимо перемешать для равномерного распределения сливок. При массовом исследовании молока постановку КР следует проводить на ферме в специально отведенном помещении.
Не разрешается исследовать в КР молоко от коров, страдающих маститом или болезнями, сопровождающимися повышением температуры тела, а также молоко животных в первые 2 недели после родов.
Пищевые продукты.
Средняя проба различных продуктов отбирается и транспортируется в соответствии с ГОСТами.
ГОСТ 31904-2012 — Продукты пищевые. Методы отбора проб для микробиологических испытаний
ГОСТ Р 50396.0-92 — Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям.
ГОСТ 31467-2012 — Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Методы отбора проб и подготовка их к испытаниям.
ГОСТ 20235.0-74 — Мясо кроликов. Методы отбора образцов. Органолептические методы определения свежести.
ГОСТ 7269-79 — Мясо. Методы отбора образцов и органолептические методы определения свежести.
ГОСТ Р 51447-99 — Мясо и мясные продукты. Методы отбора проб.
ГОСТ Р ИСО 707-2010 — Молоко и молочные продукты. Руководство по отбору проб.
ГОСТ 3622-68 — Молоко и молочные продукты. Отбор проб и подготовка их к испытанию. (прекращено действие ГОСТ в части сыров и плавленых сыров, заменен на ГОСТ 55063-2012, прекращено действие в части коровьего масла заменен на ГОСТ Р 55361-2012)
ГОСТ 32901-2014 — Молоко и молочная продукция. Методы микробиологического анализа.
ГОСТ 5904-82 — Изделия кондитерские. Правила приемки, методы отбора и подготовки проб.
ГОСТ 31339-2006 — Рыба, нерыбные объекты и продукция из них. Правила приемки и методы отбора проб.
ГОСТ 31720-2012 — Пищевые продукты переработки яиц сельскохозяйственной птицы. Методы отбора проб и органолептического анализа.
ГОСТ 31942-2012 — Вода. Отбор проб для микробиологического анализа.
ГОСТ Р 56237-2014 — Вода питьевая .Отбор проб на станциях водоподготовки и в трубопроводных распределительных системах.
Корма и кормовые добавки.
Средняя проба по своему составу должна отображать средний состав кормов направляемых для исследования в соответствии с требованиями ГОСТов.
ГОСТ Р ИСО 6497-2011 — Корма для животных. Отбор проб.
ГОСТ 13586.3-83 — Зерно. Правила приемки и методы отбора проб. (с 01.07.2016 действует ГОСТ 13586.3-2015)
ГОСТ Р ИСО 6497-2011 — Корма для животных .Отбор проб.
Отбор жидких кормов (Барда, пивная дробина, масла и др.) проводят после тщательного их перемешивания в чистую стеклянную или пластиковую тару не менее 1 килограмма.
С4 компонент комплемента | Лека-Фарм
С4 – это компонент классического пути активации комплемента (взаимодействия компонентов комплемента с комплексом антиген-антитело), имеющий важное значение в развитии аутоиммунных заболеваний.
Синонимы русские
Бета1-Е-глобулин.
Синонимы английские
Beta1-E-globulin.
Метод исследования
Иммуноферментный анализ (ИФА).
Единицы измерения
Г/л (грамм на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов до анализа, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут перед сдачей крови.
Общая информация об исследовании
Система комплемента – это каскад из 20 белков – ферментов плазмы крови, обеспечивающих иммунную реакцию в ответ на взаимодействие антигена с антителом. Эта система отвечает за фагоцитоз, разрушение чужеродных бактерий и поддерживает различные воспалительные реакции. Активация каскада комплемента может осуществляться классическим путем, при котором стимулирующим фактором является взаимодействие антигена с антителом, или альтернативным путем, когда в роли этих факторов выступают полисахариды, эндотоксины или иммуноглобулины. Независимо от исходного стимулирующего фактора, конечным продуктом активации системы комплемента является сложный белок, способный разрушать мембраны клеток, содержащих чужеродные антигены. Девять главных компонентов комплемента обозначены как С1-С9. Для выявления нарушений в системе комплемента и оценки ее функциональной целостности обычно проводится определение двух компонентов – С3 и С4.
Девять главных компонентов комплемента обозначены как С1-С9. Для выявления нарушений в системе комплемента и оценки ее функциональной целостности обычно проводится определение двух компонентов – С3 и С4.
С4-компонент комплемента синтезируется преимущественно в печени, легких и костях и активируется только по классическому пути. Он участвует в обеспечении фагоцитоза, нейтрализации вирусов и увеличивает проницаемость сосудистой стенки. Его содержание уменьшается при активном потреблении вследствие активации по классическому пути, при этом может снижаться устойчивость к инфекционным заболеваниям. Кроме того, дефицит С4-компонента связан с предрасположенностью к системной красной волчанке. При иммунокомплексных заболеваниях С4 адсорбируется на иммунных комплексах, а его уровень в крови снижается.
Для чего используется исследование?
- Для диагностики и мониторинга аутоиммунных (иммунокомплексных) заболеваний.
- Для контроля за эффективностью терапии вышеназванных заболеваний.
- Чтобы выявить предрасположенность к системной красной волчанке.
- ЧТобы оценить иммунный статус при инфекционных заболеваниях.
Когда назначается исследование?
- При аутоиммунных нарушениях.
- При повторных бактериальных инфекциях.
- При злокачественных новообразованиях.
- При подозрении на системную красную волчанку.
- При рецидивирующих тяжелых инфекциях.
Что означают результаты?
Референсные значения: 0,1 — 0,4 г/л.
Снижение С4-компонента наряду со снижением С3-компонента свидетельствует об активации классического пути (что может наблюдаться, например, при вирусном гепатите, начале формирования иммунных комплексов). Снижение в плазме крови С4 при нормальном уровне С3 указывает на дефицит С4 (как при врожденном ангионевротическом отеке и при некоторых формах системной красной волчанки).
Причины повышения уровня С4:
злокачественные новообразования, саркомы, лимфомы;
рак;
хроническая крапивница;
дерматомиозит;
ювенильный ревматоидный артрит; ревматоидный спондилит.
Причины снижения уровня С4:
врожденная недостаточность С4;
хронический бронхит;
курение;
криоглобулинемия;
пурпура Шейнляйн – Геноха;
хронический активный гепатит;
болезни иммунных комплексов;
системная красная волчанка, волчаночный нефрит;
отторжение почечного трансплантата;
подострый бактериальный эндокардит;
гломерулонефрит;
наследственный ангионевротический отек;
лечение цитостатиками и иммунодепрессантами.
Что может влиять на результат?
Большой период от взятия крови до выполнения исследования (более 2 часов), разрушение эритроцитов в пробе крови, хилезная сыворотка (слишком густая кровь).
Также рекомендуется
Кто назначает исследование?
Иммунолог, ревматолог, терапевт.
Услуги по взятию (сбору) биоматериала
Венозная кровь
Срок выполнения
До 12:00 следующего дня. В случае сдачи анализов до 12:00 результат можно получить по электронной почте до 24:00 этого же дня
Методы
Иммунонефелометрический анализ
Подготовка к исследованию
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Тип биоматериала и способы взятия
|
Тип |
На дому |
В Центре |
Самостоятельно |
|
Венозная кровь |
да |
да |
На дому: возможно взятие биоматериала сотрудником мобильной службы.
В Диагностическом центре: взятие, либо самостоятельный сбор биоматериала осуществляется в Диагностическом центре.
Самостоятельно: сбор биоматериала осуществляется самим пациентом (моча, кал, мокрота и т.п.). Другой вариант – образцы биоматериала предоставляет пациенту врач (например, операционный материал, ликвор, биоптаты и т.п.). После получения образцов пациент может как самостоятельно доставить их в Диагностический центр, так и вызвать мобильную службу на дом для передачи их в лабораторию.
Литература
- Назаренко Г. И. Клиническая оценка результатов лабораторных исследований / Г. И. Назаренко, А. А. Кишкун — М. : Медицина, 2006. – 543 с.
- Кишкун А. А. Иммунологические и серологические исследования в клинической практике / А. А. Кишкун. – М. : «Медицинское информационное агентство», 2006. – 536 с.
- Клиническая оценка лабораторных тестов : пер. с англ. / Под ред. Н. У. Тица. – М. : Медицина, 1986. – 480 с.
- Wallach J. B. Interpretation of diagnostic tests / J.B. Wallach. – 7 ed. – Lippincott Williams & Wilkins, 2000. – 1027 pp.
- Chernecky C. C. Laboratory tests and diagnostic procedures / C. C. Chernecky, B. J. Berger; 5th ed. – Saunder Elsevier, 2008. – 1232 pp.
- Wilson D. D. McGraw-Hill Manual of laboratory & diagnostic tests / D. D. Wilson ; 1 ed. – McGraw-Hill Professional, 2007. – 608 pp.
Кемерово | Хилез крови у кошки
03.08.2017 г. в отдел химико-токсикологический была направлена проба сыворотки крови для полного биохимического анализа. Визуально сыворотка взятой на анализ крови определялась как молочная или, другими словами, хилезная. В отличие от нормальной сыворотки, которая прозрачная и имеет желтоватый оттенок, хилезная сыворотка мутная и как будто содержит молочные примеси, а после процедуры центрифугирования стала полностью белой и по консистенции сходной со сметаной.
Термин «хилез крови» относится к категории лабораторных понятий. Сам по себе хилез не является заболеванием, а лишь свидетельствует о том, что в крови пациента при проведении биохимического анализа были обнаружены отдельные «ненужные» элементы.
Хилез – это состояние, характеризующееся повышением уровня содержащихся в крови триглицеридов – нейтральных жиров (или липидов крови). Хилез, а точнее триглицеридемия вторичного типа развивается в результате сахарного диабета, гипотиреоза, ожирения, а также вследствие почечной недостаточности. Также возникновению хилеза способствует прием отдельных препаратов, среди которых диуретики, эстрогенсодержащие медикаменты, кортикостероиды, бета-блокаторы и т.п.
Кроме того, к причинам хилеза относятся:
Также причиной хилеза может быть наличие большого количества различных примесей в лимфе крови, обусловленное нарушением деятельности лимфатической системы в целом.
Сыворотка была признана непригодной для проведения анализа, так как наличие в составе крови жировых частиц не позволяет осуществить точную, качественную диагностику и правильно оценить состояние организма пациента. Владельцу животного было рекомендовано доставить животное для повторного забора крови.
Автор Отдел химико-токсикологический Данный материал опубликован на сайте BezFormata 11 января 2019 года,ниже указана дата, когда материал был опубликован на сайте первоисточника!
Что такое жирная кровь и почему это плохо
Нередко, получив анализ крови из лаборатории, можно увидеть загадочную и пугающую надпись «хилез» или «хилезная сыворотка». Термин этот используют в основном врачи-лаборанты и означает он лишь то, что в крови присутствует большое количество жира, которого в норме быть не должно. Проведение анализа такой крови зачастую не возможно, так как во время разделения ее на составляющие, кровь превращается в сливкообразную массу.
Термин этот используют в основном врачи-лаборанты и означает он лишь то, что в крови присутствует большое количество жира, которого в норме быть не должно. Проведение анализа такой крови зачастую не возможно, так как во время разделения ее на составляющие, кровь превращается в сливкообразную массу.
Практикующие врачи заменяют термин хилезной крови понятием гиперлипидемии (повышенное содержание липидов в крови). Основной липид на который обращают внимание – это холестерин. Особенно часто с этим сталкиваются кардиологи и неврологи. Ни для кого не секрет, что повышенный уровень холестерина приводит к развитию атеросклероза. А у пациентов, страдающих этим недугом, повышенный риск развития ишемической болезнь сердца и инсульта.
Почему кровь становиться жирной
На первом месте причин появления хилезной крови стоит неправильная сдача анализа. Всем известно, что кровь необходимо сдавать натощак, а накануне не рекомендуется употреблять жирную пищу и алкоголь. После еды происходит временное повышение уровня жиров и глюкозы в крови, а после употребления алкоголя повышаются печеночные ферменты. Длительность периода, в течение которого кровь будет жирной, определяется индивидуальными особенностями организма и качеством съеденной пищи.
Еще одной из причин хилезной крови бывает нарушение обмена веществ. Часто у всех членов семьи отмечается повышенный уровень холестерина. Это связано не только с особенностями питания, но и с наследственным фактором (наследственная гиперхолестеринемия).
Некоторые заболевания печени также могут привести к появлению жирной крови. Процесс этот усугубляется на фоне неправильного питания.
Как бороться с хилезной кровью
Если в анализе написали хилез, то откажитесь от еды хотя бы за 12 часов до сдачи крови.
Накануне не допускайте погрешностей в диете. Если же в повторном анализе вновь обнаружили жирную кровь, значит дело тут не во временном повышении уровня холестерина, а в постоянном.
Это состояние очень опасно, потому что холестерин как мусор забивает сосуды и препятствует нормальному кровоснабжению органов и тканей. Повышенный уровень холестерина является фактором риска развития многих тяжелых заболеваний.
Существует несколько способов снижения уровня холестерина.
- Соблюдение диеты,
- Использование народных методов,
- Лекарственные препараты.
1.Соблюдение диеты.
Перечень продуктов, употребление которых следует свести к минимуму не так велик:
- Жирное мясо;
- Сладости;
- Яйца;
- Жирное молоко и сливочное масло;
- Алкоголь.
Что можно есть в неограниченных количествах:
- Рыбу;
- Овощи и фрукты;
- Злаки;
- Бобовые.
Следует помнить, что ежедневное употребление рыбы не только приводит к снижению уровня вредного холестерина, но и повышению уровня полезного холестерина, что очень благотворным образом сказывается на состоянии сосудов.
2.Народные методы борьбы с жирной кровью.
К наиболее распространенным народным методам снижения холестерина крови относятся:
- льняное и оливковое масло,
- ячмень и рисовые отруби,
- масло сорного лимона,
- активированный уголь,
- чеснок.
Вот один из рецептов для борьбы с жирной кровью: 100 г семян укропа, 200 г липового меда, 2 столовые ложки корня валерианы смешивают и помещают в термос с 2 литрами воды. Настаивают в течение 24 часов. Принимать по 1 столовой ложке за полчаса до еды.
3. Лекарственные препараты для снижения холестерина.
Основные точки приложения лекарственной гиполипидемической (направленной на снижение уровня холестерина) терапии это:
- Уменьшение всасывания холестерина из желудочно-кишечного тракта;
- Уменьшение синтеза холестерина клетками организма;
- Повышение выведения холестерина;
- Антиоксидантные препараты;
- Применение гормональной терапии у женщин в менопаузе.

К веществам, замедляющим всасывание холестерина из кишечника, относят Эзетрол. Он избирательно действует на транспортер холестерина из кишечника в кровь, тем самым нарушая всасывание.
Широко распространенные статины (Симвастатин, Аторвастатин) нарушают начальный этап синтеза холестерина в печени. Этот класс препаратов является наиболее эффективным и может снижать уровень холестерина до 40%.
Популярная никотиновая кислота оказывает противоатеросклеротическое действие лишь в больших дозах (1.5-3 г в сутки). Она уменьшает образование жирных кислот и липопротеидов низкой плотности (вредного холестерина).
Для повышения выведения холестерина из организма применяют секвестранты желчных кислот. Наиболее известным представителем этого класса является Колестирамин, представляющий собой анионную смолу. Она связывает желчные кислоты в кишечнике, тем самым нарушая их всасывание. При этом в печени образуется больше желчных кислот из холестерина, а содержание его в крови снижается.
Фибраты также ускоряют метаболизм холестерина и снижают его концентрацию в крови.
Антиоксиданты непосредственно на уровень холестерина в крови не влияют, но они препятствуют окислению жиров и предотвращают отложение холестерина в стенках сосудов
Несмотря на разнообразия лекарственных препаратов, наиболее эффективным классом являются статины. Совместное их применение с фибратами уменьшает уровень холестерина крови на 50%.
Хилезная кровь или попросту жирная обусловлена большим содержанием липидов в плазме. Такая кровь не только затрудняет лабораторную диагностику, но и является опасным для человека. Холестерин, содержащийся в больших количествах, в буквальном смысле забивает сосуды и препятствует нормальному кровоснабжению основных органов и тканей. Развивающийся на этом фоне атеросклероз приводит к развитию инфарктов, инсультов и гангрены.
Получив в анализе крови хилез, необходимо разобраться, временное это повышение жиров или постоянное. Для этого нужно пересдать анализ по всем правилам (не есть в течение 12 часов перед сдачей крови и придерживаться диеты накануне). Если в повторном анализе также выявлена хилезная кровь, то холестерин повышен постоянно. Такое состояние требует вмешательства со стороны врача. Лечение повышенного уровня холестерина комплексное и назначается терапевтом или кардиологом. Для профилактики жирной крови используйте специальную диету и народные методы.
Для этого нужно пересдать анализ по всем правилам (не есть в течение 12 часов перед сдачей крови и придерживаться диеты накануне). Если в повторном анализе также выявлена хилезная кровь, то холестерин повышен постоянно. Такое состояние требует вмешательства со стороны врача. Лечение повышенного уровня холестерина комплексное и назначается терапевтом или кардиологом. Для профилактики жирной крови используйте специальную диету и народные методы.
Хилоторакс (Материалы)
Грудная полость полностью выстлана серозной оболочкой, известной как плевра. Плевра делится на висцеральную плевру, которая покрывает легкие, и париетальную плевру, которая покрывает оставшуюся грудную полость. Плевра состоит из одного слоя мезотелиальных клеток, поддерживаемых тонкой сетью эластичной соединительной ткани. Висцеральная и париетальная плевры содержат богатую капиллярную сеть, исходящую от легочного и системного кровообращения соответственно.Кроме того, париетальная плевра содержит богатую лимфатическую сеть, отвечающую за лимфодренаж плевральной полости. В нормальных условиях плевральная полость представляет собой лишь потенциальную полость. Висцеральная и париетальная плевра разделены тонким слоем плевральной жидкости, средний объем которой составляет 2,4 мл у собаки массой 10 кг. Жидкостное соединение между грудной стенкой и легкими обеспечивает мгновенную передачу изменений объема грудной клетки в легкие, при этом обеспечивая скольжение между плевральными поверхностями с низким коэффициентом трения.
Поскольку высокая проницаемость плевры приводит к тому, что плевральное пространство непрерывно с интерстициальной жидкостью грудной стенки, динамика образования и абсорбции плевральной жидкости контролируется силами Старлинга. Поскольку гидростатическое давление в системных капиллярах, снабжающих париетальную плевру, составляет 30 см водяного столба, а гидростатическое давление легочных капилляров, снабжающих висцеральную плевру, составляет примерно 11 см водяного столба, одна теория предполагает, что плевральная жидкость формируется париетальной плеврой и абсорбируется. висцеральной плеврой в физиологических условиях.Более свежие данные свидетельствуют о том, что плевральная жидкость фильтруется через париетальную плевру и выводится через париетальные лимфатические сосуды.
Анатомия грудного протокаХилоторакс возникает, когда хилоз из цистерны хили-торакальной системы протоков получает доступ к плевральной полости. У собаки хвостовой грудной проток проходит дорсально и справа от аорты, латеральнее межреберных артерий и вентрально по отношению к непарной вене. Проток пересекает левую сторону аорты вентрально к телу пятого грудного позвонка и продолжается краниовентрально через левую сторону пищевода, опустошаясь на стыке левой яремной вены и краниальной полой вены.Хотя это описание грудного протока считается «нормальным», некоторые собаки демонстрируют этот образец без каких-либо изменений. Вариации включали множественные коллатерали каудальной и средней частей протока, а также системы двойных протоков. У кошек каудальный грудной проток обычно проходит дорсально и слева от аорты.
ЭтиологияЭтиология хилоторакса у собак и кошек недостаточно изучена. Заболеваемость хилотораксом у афганцев чрезвычайно высока, но неизвестно, является ли эта предрасположенность наследственной.Травма — часто упоминаемая причина хилоторакса у собак и кошек. Разрыв грудного протока может быть результатом тупых или проникающих ранений, травматической диафрагмальной грыжи, торакальной хирургии или эпизодов сильного кашля или рвоты. Недавние данные свидетельствуют о том, что травматический разрыв грудного протока может быть нечастой причиной хилоторакса у животных. Роль, которую играет обструкция грудного протока в развитии хилоторакса, неясна. Сама по себе экспериментальная обструкция грудного протока редко приводит к хилотораксу, но перевязка краниальной полой вены вызывает лимфангиэктазию грудного протока и высокую частоту (> 50%) хилоторакса у собак и кошек.Предполагается, что лимфангиэктазия может привести к экстравазации хилуса через стенку лимфатического сосуда. Злокачественные новообразования или тромбоз, которые закупоривают краниальную полую вену, могут вызвать хилоторакс с помощью такого механизма. Повышение системного венозного давления вследствие застойной сердечной недостаточности, вероятно, объясняет, почему хилоторакс возникает при кардиомиопатии, дисплазии трикуспидального клапана и сердечном черве. Лимфангиэктазия неизвестного происхождения была продемонстрирована у собак и кошек со спонтанным хилотораксом.
Ослабление, связанное с хилотораксом, вызвано, в основном, потерей хилуса из организма после проведения плеврального дренажа.Потери воды и электролита может быть достаточно, чтобы вызвать обезвоживание и нарушение электролитного баланса. Потеря липидов и белков может привести к белково-калорийной недостаточности и гипопротеинемии. Недоедание усугубляется потерей жирорастворимых витаминов. Иммунокомпетентность нарушается из-за потери антител, лимфопении и недоедания.
ДиагнозДиагностика хилоторакса основана на распознавании характерных клинических и рентгенографических данных плеврального выпота и на выявлении хилуса при анализе жидкости.Хилезные выпоты обычно непрозрачны и имеют цвет от молочно-белого до желтого цвета. Чили сохраняет свой молочный вид при стоянии и может образовывать кремообразный верхний слой. Физико-химические свойства хилезных выпотов аналогичны обструктивным транссудатам, поскольку лимфа составляет большую часть хилуса грудного протока. Общий белок колеблется от 3 до 5 г / дл. Цитологическое исследование выявляет преобладание мелких и крупных лимфоцитов. Хронический хилезный выпот покажет увеличение количества нейтрофилов, макрофагов и мезотелиальных клеток.Общее количество клеток обычно не превышает 20 X 103 клеток / мкл. Хиломикроны внутри выпота подтверждают его хилезную природу. Хиломикроны можно визуализировать на прямых мазках или с помощью суправитальных пятен, таких как Судан III или IV. Наличие хиломикронов наиболее надежно подтверждается определением уровней триглицеридов в сыворотке и жидкости. Хилезные жидкости обычно показывают уровни триглицеридов, которые в 12-100 раз превышают уровни, измеренные в сыворотке. Уровни холестерина в хилезных выпотах не повышаются при сравнении значений со значениями сыворотки.У животных с анорексией и хилезным выпотом может значительно снизиться уровень хиломикронов. Плевральную жидкость таких животных легко принять за модифицированный транссудат или обструктивный выпот. Для демонстрации хилезной природы плеврального выпота у этих животных часто необходимо кормление жирной пищей. .Эти излияния называются псевдохилезными излияниями. Псевдохилезные выпоты будут с низким содержанием триглицеридов и могут иметь высокий уровень холестерина.
После диагностики хилоторакса необходимо попытаться определить его причину. Следует расспросить владельцев о возможности недавней травмы. Рентгенограммы грудной клетки, сделанные после полного дренирования плевры, должны быть оценены на предмет наличия новообразований, особенно в краниальном средостении. Также можно провести эхокардиографию и ультразвуковое исследование средостения.Животных с хилотораксом следует обследовать на дирофиляриоз, используя методы определения концентрации микрофилярий или тесты на определение антигена взрослых в сыворотке крови, или и то, и другое. Цитологическое исследование хилезного выпота на наличие опухолевых клеток помогает исключить новообразование. Часто причина хилоторакса не обнаруживается, и врачу остается диагноз идиопатический хилоторакс. Прямая лимфангиография может предоставить информацию об этиологии идиопатического хилоторакса (то есть разрыв в сравнении с лимфангиэктазией), но в целом представляет академический интерес только потому, что обычно не меняет терапевтический план.
ЛечениеЛечение хилоторакса может быть медикаментозным или хирургическим. Медицинское лечение направлено на дренирование плевральной полости и уменьшение образования хилуса. Плевральный дренаж показан для облегчения респираторного дистресса и может быть прерывистым или непрерывным. Диеты с низким содержанием жира снижают содержание триглицеридов в хилсе, но нет никаких доказательств того, что объем хилуса уменьшается аналогичным образом. Животные с хилотораксом должны получать активную питательную поддержку и получать жирорастворимые витамины.
Хирургическое лечение хилоторакса включает перевязку каудального грудного протока. Обоснование перевязки грудного протока основано на формировании лимфатических анастомозов, которые отводят хилезный поток от системы грудного протока. Абсолютных показаний к хирургическому вмешательству у животных не установлено. Предлагаются следующие показания к операции: 1) отсутствие значительного уменьшения оттока хилуса после 5-10 дней лечения, 2) потеря хилуса, превышающая 20 мл / кг / день в течение пяти дней, или 3) белок- калорийность питания и гипопротеинемия.Трансторакальная перевязка грудного протока выполняется у собаки правой девятой или десятой межреберной торакотомией. Неспособность перевязать все коллатеральные ветви каудального грудного протока считается наиболее частой причиной хирургической неудачи. По этой причине рекомендуется перевязка всех структур каудального средостения дорсальнее аорты. Интраоперационная лимфангиограмма, выполняемая для обеспечения полной перевязки грудного протока, была рекомендована, однако этот подход значительно увеличивает время операции и требует оборудования для проведения интраоперационных рентгенограмм.Успешность хирургического лечения одного хилоторакса обычно составляет менее 60%. Комбинированный механический плевродез плевры и лигирование грудного протока, выполняемые с помощью срединной стернотомии, в настоящее время проходят клиническую оценку и показывают первые перспективы улучшения успеха операции.
Несмотря на энергичные попытки медикаментозного и хирургического лечения, значительное количество животных с хилотораксом не реагирует на терапию. Плевроперитонеальное шунтирование и химический плевродез рекомендуются как паллиативные методы лечения рефрактерного хилоторакса.Хронический хилоторакс может вызвать констриктивный плеврит, который может потребовать декортикации.
Хилезный выпот у кошки
Спросите себя:1. Какой биохимический тест поможет отличить хилус от гнойного материала?
2. Какие условия могут вызывать хилезный выпот?
3. Какие еще испытания могут потребоваться?
4. Что может помешать рефрактометрическому измерению концентрации белка в жидкости?
Рисунок 3.Прямой мазок жидкости. Тонкая слабая липидная вакуолизация (вызванная высоким содержанием триглицеридов) в фоновом режиме теряется во время центрифугирования. (Исходное увеличение 1000 ¥)
Диагноз : Хилезный выпот, вторичный по отношению к левостороннему пороку сердца
Нейтрофилия и лимфопения соответствовали реакции на стресс (кортикостероиды). Накопление жидкости, богатой лимфоцитами, в плевральной полости также могло способствовать лимфопении. В одном исследовании лимфопения была наиболее частой аномалией, отмеченной при обычном клиническом анализе крови у кошек с хилезным выпотом. 1 У этого пациента микроскопические и биохимические характеристики жидкости больше соответствовали хилусу, чем гнойному материалу, несмотря на присутствие воспалительных клеток. Хилезные выпоты часто имеют воспалительный компонент. Сам по себе хилус может быть раздражителем, а количество нейтрофилов и макрофагов имеет тенденцию увеличиваться с хроническим течением выпота и (возможно) с увеличением частоты плевроцентеза. 2 Концентрация триглицеридов в плевральной жидкости значительно выше, чем в парном образце сыворотки или плазмы, убедительно подтверждает диагноз хилезного выпота. 3
Статья по теме: Торакоцентез
Дополнительные результаты
ЭКГ выявила выраженную гипертрофию левого желудочка и серьезную дилатацию левого предсердия, наиболее характерную для гипертрофической кардиомиопатии; Также были отмечены предсердные преждевременные комплексы, предполагающие, что хилезный выпот был проявлением левосторонней застойной сердечной недостаточности. У кошек может развиться плевральный выпот при левосторонней и правосторонней сердечной недостаточности, так как висцеральные плевральные лимфатические сосуды попадают в легочное венозное кровообращение. 4 При левосторонней сердечной недостаточности высокое давление в легочной венозной системе может ограничивать нормальный отток лимфатических сосудов из грудной клетки.
Хилезные выпоты
Пищевые липиды переупаковываются кишечным эпителием или эпителием в хиломикроны, богатые триглицеридами. Их большой размер предотвращает локальное поглощение капиллярами, и вместо этого богатые липидами структуры попадают в лимфатическую систему. Лимфа, обогащенная хиломикронами, в конечном итоге попадает в грудной проток, который анастомозирует с венозной системой через лимфатически-венозные соединения краниальнее сердца. 5 Высокое содержание хиломикронов придает жидкости характерный непрозрачный молочно-белый вид, хотя сопутствующее кровоизлияние может привести к выпоту с розовым оттенком (Рис. 2) ; гипорексия или анорексия могут привести к менее непрозрачной жидкости с более низким содержанием триглицеридов. Обильное содержание липидов в хилезных выпотах может мешать преломлению света, часто делая рефрактометрическую оценку содержания белка ложно завышенной. 6
Большинство случаев заболевания кошек являются идиопатическими. 1 Когда причину можно определить, это обычно прямое нарушение или вмешательство в работу грудного протока или повышение местного венозного давления, нарушающее адекватный лимфодренаж или отток. Сообщается, что вызванные травмой разрыв грудного протока и новообразования средостения (например, лимфома, тимома, гранулема) вызывают хилезный выпот. 7-10 Кроме того, с хилезными выпотами связаны сердечные заболевания, дирофиляриоз, перекрут доли легкого и тромбоз или перевязка краниальной полой вены. 11-16
Вы ответили?
1. Сравнение концентрации триглицеридов в жидкости и сыворотке или плазме
2. Травма грудного протока, болезнь сердца (левосторонняя или правосторонняя), другие причины повышения лимфатического давления или проницаемости; однако причину выявлять редко.
3. Эхокардиограмма, ЭКГ, посев и проверка чувствительности жидкости и тестирование сердечного червя.
4. Высокое содержание липидов в жидкости
СОФИ А. ДЖЕСТИ, DVM, DACVIM (кардиология, крупные животные), является доцент кардиологии Университета Теннесси.Она получила стипендию по кардиологии и ультразвуковой диагностике крупных животных и ординатуру по внутренней медицине крупных животных в Центре Нью-Болтона Пенсильванского университета, а затем получила ординатуру по кардиологии и стипендию по регенеративной медицине в Корнельском университете, где получила степень доктора медицины и медицины.
ДЖЕННИФЕР Л. СКРАГГС, доктор медицинских наук, доктор философии, ординатор по клинической патологии в Университете Теннесси и майор армии США. Она получила степень доктора неврологии в Университете Вандербильта и степень доктора медицины в Университете Теннесси.
Хилоторакс и выпот холестерина — Консультант по пульмонологии
Хилоторакс и выпот холестерина (также известный как хилиформный выпот или псевдохилоторакс) представляют собой богатые липидами плевральные выпоты. Содержание липидов состоит из хиломикронов / триглицеридов (ТГ) в хилотораксе и холестерина в излияниях холестерина. В обоих случаях плевральная жидкость часто имеет опалесцирующий или молочный оттенок из-за высокой концентрации жира (рис. 1).
Хилоторакс подразумевает утечку хилуса, вызванную нарушением или блокадой грудного протока или его притоков.Выпоты холестерина не связаны с лимфатическими сосудами, а связаны с длительными плевральными выпотами с утолщенными плевральными оболочками или без них.
Хилоторакс составляет от 2% до 3% всех плевральных выпотов, в то время как излияния холестерина — редкое состояние, зарегистрировано менее двухсот случаев.
Таблица I.
| Этиология | Заболеваемость | Комментарии |
|---|---|---|
| Хирургический | ~ 40% | Операции по пластике врожденных пороков сердца и диафрагмальной грыжи у детей, эзофагэктомия, резекция легкого или средостения, аортокоронарное шунтирование, радикальное расслоение шеи и пластика нисходящей аневризмы грудной аорты у взрослых |
| Опухоли | ~ 30% | Лимфома (70%), метастатическая карцинома |
| Разное | ~ 20% | Цирроз, врожденные или приобретенные лимфатические нарушения (например,g., LAM, синдром желтого ногтя), синдром верхней полой вены, тромбоз безымянной или левой подключичной вены, проникающая и тупая травма, лекарственные препараты (дазатиниб), лучевое поражение |
| Идиопатический | ~ 10% | Включает врожденный хилоторакс. У взрослых исключите скрытое новообразование или тривиальную травму (кашель, икоту, чихание, растяжку при зевании и роды), прежде чем рассматривать хилоторакс как идиопатический |
Наиболее распространенной этиологией излияния холестерина является туберкулез (42%), особенно в контексте предшествующей терапии коллапса и остаточных изливов после противотуберкулезной терапии.Вторая по частоте причина — хронический ревматоидный плеврит (32%). Редкие причины включают парагонимоз, синдром желтого ногтя и ятрогенные (например, операция коронарного шунтирования). Причина неизвестна примерно в 15% случаев.
Вы уверены, что у вашего пациента хилоторакс или выпот холестерина? Что вы должны ожидать найти?
Рассмотрите возможность хилоторакса у пациентов с плевральным выпотом при следующих обстоятельствах:
Жидкость молочно-белого цвета отсасывается.
Существуют предрасполагающие факторы (например, недавняя кардиоторакальная операция, подозрение на лимфому, цирроз печени и ЛАМ).
В послеоперационном периоде происходит непрерывный дренаж плевральной жидкости через дренажную трубку (> 400 мл / сут).
Причина постоянного или рецидивирующего излияния неизвестна.
Пациенты с хилотораксом могут проявлять одышку (> 50%) и / или непродуктивный кашель (<10%), или отсутствие респираторных симптомов (37%), когда выпоты небольшие или умеренные.Начало симптомов может быть острым / подострым при послеоперационном хилотораксе или постепенным при нетравматическом хилотораксе.
Учитывая невоспалительную природу хилуса, плевритической боли в груди или лихорадки ожидать не следует, за исключением лимфомы (лихорадка является симптомом категории «В»). Отсутствие молочного цвета наблюдается у половины пациентов, особенно если они голодают (например, в послеоперационный период) или недоедают.
Анатомические причины объясняют преимущественную латерализацию хилоторакса в зависимости от уровня повреждения или обструкции грудного протока: если проток поврежден ниже пятого или шестого грудного позвонка, выпот будет правосторонним, что является наиболее частой ситуацией.Повреждение выше этого уровня приводит к левому хилотораксу, тогда как двусторонний хилоторакс (20%) возникает в результате разрыва на уровне пятого грудного позвонка или трансдиафрагмального движения хилезного асцита. Однако следует отметить, что анатомическое строение грудного протока типично только для 40–60% пациентов, и существует несколько вариаций.
Рассматривайте выпот холестерина, когда у пациента нет симптомов (1/3) или симптоматический с односторонним (88%), хроническим плевральным выпотом (> 5 лет в 90% случаев) неизвестной этиологии, или когда у пациента есть захват легких или локализованные выпоты независимо от того, утолщены ли плевральные поверхности или нет.Действительно, утолщение плевры отсутствует в 20% случаев.
Осторожно: существуют другие заболевания, которые могут имитировать хилоторакс или излияние холестерина:
Млечная жидкость может быть вызвана хилотораксом, излитием холестерина, эмпиемой или экстравазацией липидсодержащего парентерального питания из центральной линии, которая случайно попала в плевральную полость. Кроме того, дифференциальная диагностика хилоторакса не беловатого цвета включает и другие типы послеоперационных излишеств.
Дифференцировать излияния холестерина от хронической туберкулезной эмпиемы, последняя из которых характеризуется хронической активной микобактериальной инфекцией плевральной полости; толстая кальцинированная плевральная корка и утолщение ребер, окружающие локализованную плевральную жидкость, и гнойную жидкость, мазок которой дает положительный результат на кислотоустойчивые бациллы.
Как и / или почему у пациента развился хилоторакс или излияние холестерина?
Повреждение грудного протока или его непроходимость, ведущая к утечке хилуса в плевральную полость, может быть результатом:
случайное повреждение при кардиоторакальной операции
лимфаденопатия средостения, препятствующая оттоку лимфы от структур грудной клетки
Инвазия грудного протока лимфоматозными или карциноматозными клетками
большая или легкая травма
спонтанный (болезнь Бехчета) или связанный с катетером тромбоз, или внешнее сжатие (субтернальный зоб) магистральных вен
Разрастание аномальных гладкомышечных клеток вокруг лимфатических сосудов (LAM)
— лекарственное заболевание лимфатической сети.Антилейкемический агент дазатиниб ингибирует бета-рецептор тромбоцитарного фактора роста, который участвует в лимфангиогенезе. Примерно у 30% пациентов, принимающих дазатиниб, появляются плевральные выпоты, связанные с лекарственными препаратами, хотя они редко бывают хилезными.
В случаях цирроза хилоторакс, по-видимому, вызывается трансдиафрагмальным перемещением хилезного асцита в плевральную полость. Считается, что происхождение липидов в излияниях холестерина является результатом дегенерирующих красных и белых кровяных телец в плевральной жидкости и захваченного холестерина, который меняет свои липопротеин-связывающие характеристики из-за местного метаболизма.
Какие люди подвержены наибольшему риску развития хилоторакса или выпота холестерина?
Распространенность хилоторакса зависит от сопутствующих заболеваний:
Врожденная операция на сердце: 9%
Врожденная герниопластика диафрагмальной грыжи: 6%
Эзофагэктомия: менее 4%
Резекция легкого с диссекцией грудных средостенных лимфатических узлов: 1,4%
Восстановление аневризмы нисходящей грудной аорты: 0.4%
Лимфопролиферативные заболевания: 2,5%
Цирроз: 5%
Синдром верхней полой вены: 5%
ЛАМ: 15% (сложная форма туберозного склероза) или 20% (спорадическая форма)
Врожденный (т.е. нетравматический хилезный выпот, обнаруженный антенатально или в течение 28 дней после рождения): 1 из 10 000–24 000 живорождений
Факторы, предрасполагающие к развитию излияния холестерина, включают остаточный туберкулезный плеврит, хронический ревматоидный плеврит и защемление легких.
Какие лабораторные исследования следует заказать для постановки диагноза и как интерпретировать результаты?
Желтоватый или серозно-кровавый вид жидкости встречается даже чаще, чем типичный молочный вид. Более того, излияния холестерина имеют молочный цвет только в 40% случаев и часто имеют матовый или коричневый оттенок.
Аспирируйте плевральную жидкость для измерения:
Получите сыворотку одновременно для определения уровней белка, ЛДГ, глюкозы, холестерина и ТГ.
Характеристики плевральной жидкости при хилотораксе следующие:
Экссудат в 85% случаев. В двух третях этих случаев выпот классифицируется как экссудат по белку, но не по критерию концентрации ЛДГ (экссудат, противоречащий белку).
Транссудат в 15% случаев, что должно вызывать подозрение на цирроз печени и, реже, на сердечную недостаточность или нефротический синдром.
Лимфоциты преобладают в 80% случаев, хотя нейтрофильные жидкости не редкость в послеоперационном периоде.
концентрация ТГ превышает 110 мг / дл более чем в 85% случаев; уровень менее 50 мг / дл решительно свидетельствует против этого диагноза, поскольку этот уровень встречается менее чем в 3% случаев.
Наличие хиломикронов позволяет поставить точный диагноз. Их следует измерять только при промежуточных значениях ТГ (50-110 мг / дл).
Если анализ липопротеинов недоступен и есть сомнения в диагнозе, прием пищи с высоким содержанием жиров приведет к резкому изменению внешнего вида и содержания ТГ в плевральной жидкости.
Плевральная жидкость в выпоте холестерина представляет собой экссудат, часто с преобладанием лимфоцитов (60%), который характеризуется: соотношением холестерин / ТГ более 1 (97%)
кристаллов холестерина на поляризованной микроскопии (патогномонично, но не является обязательным) (90%)
уровень холестерина более 200 мг / дл (75%)
отсутствие хиломикронов
При излияниях холестерина жидкость следует направлять на измерение аденозиндезаминазы и посевы микобактерий, причем последние дают положительный результат только в одной трети случаев туберкулеза, когда используются классические твердые среды.
Какие визуализационные исследования будут полезны при постановке или исключении диагноза хилоторакса или выпота холестерина?
Рентген грудной клетки подтверждает наличие плеврального выпота. При хилотораксе неясного происхождения КТ грудной клетки и брюшной полости может выявить лимфаденопатию, тромбоз или компрессию магистральных вен и / или кистозные изменения паренхимы, указывающие на ЛАМ.
При излияниях холестерина КТ грудной клетки может продемонстрировать утолщенные или кальцинированные плевральные поверхности, локализованный скопление жидкости и / или наличие уровня жир-жидкость или жир-кальций.
У пациентов, у которых планируется восстановление грудного протока или перевязка, для определения места утечки может потребоваться МРТ-лимфодуктография без контрастного усиления или интранодальная лимфангиография (при которой доступ к паховым лимфатическим узлам осуществляется под контролем УЗИ и, впоследствии, с применением масляного контрастного вещества. агент вводится) в качестве предпочтительных методов визуализации. Менее часто используемые методы включают лимфосцинтиграфию после перорального приема 123 I-меченой бета-метил-йодофенилпентадекановой кислоты или внутрикожную инъекцию 99m Tc-меченного альбумина или коллоидной серы в тыльную сторону стопы или кисти; или педальная лимфангиография с использованием липиодола.
Какие неинвазивные диагностические исследования легких будут полезны для постановки или исключения диагноза хилоторакса или выпота холестерина?
См. Исследования изображений.
Какие диагностические процедуры будут полезны при постановке или исключении диагноза хилоторакса или выпота холестерина?
Диагноз хилоторакса и выпота холестерина основывается на анализе плевральной жидкости (см. Выше).
После центрифугирования плевральной жидкости супернатант непрозрачен при хилотораксе и излияниях холестерина и прозрачен при эмпиеме (молочность вызвана взвешенными лейкоцитами и остатками).Добавление 2 мл этилового эфира устранит молочность при хилотораксе, но не при излиянии холестерина.
Соотношение глюкозы в плевральной жидкости и сыворотке может помочь дифференцировать хилоторакс (соотношение <1) от внесосудистой миграции центрального венозного катетера у пациентов, получающих полное парентеральное питание (соотношение> 1).
Биопсия плевры или плевроскопия под контролем КТ могут потребоваться для диагностики хилоторакса, связанного со злокачественными новообразованиями, если цитологический и / или проточный цитометрический анализ плевральной жидкости не дает результатов.
Какие патологические / цитологические / генетические исследования помогут поставить или исключить диагноз хилоторакса или выпота холестерина?
Никакие патологические / цитологические / генетические исследования не помогли бы поставить или исключить диагноз хилоторакса или выпота холестерина.
Если вы решите, что у пациента хилоторакс или выпот холестерина, как следует вести себя с пациентом?
Управленческие решения по поводу хилоторакса зависят от первопричины, размера выпота и тяжести симптомов, скорости образования или повторного накопления жидкости и местного опыта.При лечении хилоторакса переходите от консервативных мер к более инвазивным методам лечения.
Стратегии лечения делятся на три категории:
Лечение основного заболевания — химиотерапия, с лучевой терапией или без лучевой терапии лимфом и метастатических опухолей; диуретики или парацентез большого объема и / или TIPS при цирротическом асците; и временное прекращение приема или снижение дозы дазатиниба наряду с терапевтическим плевроцентезом, когда в результате этого возникают умеренные или большие излияния (могут потребоваться кортикостероиды и / или диуретики).Ингибитор mTOR силоримус (от 1 до 5 мг / сут) может уменьшить размер трудноизлечимых хилезных выпотов у пациентов с ЛАМ, хотя ответ может занять несколько месяцев, и излияния могут возобновиться после прекращения лечения.
Консервативное лечение — терапевтический торакоцентез или дренаж через грудную трубку для облегчения симптомов (рис. 2), период полного парентерального питания или диета с низким содержанием жиров с добавлением пероральных среднецепочечных триглицеридов для уменьшения потока хилуса в грудном протоке и октреотида ( сандостатин), 50-100 мкг / 8 ч подкожно для уменьшения продукции хилуса в кишечнике.По некоторым данным, этилефрин (симпатомиметический препарат, вызывающий сокращение гладкой мускулатуры грудного протока), изолированно или в сочетании с октеотридом, может способствовать разрешению хилоторакса.
Рисунок 2.
Лечебный торакоцентез у больного хилотораксом
Хирургические и / или паллиативные варианты следует рассматривать, если консервативные меры в течение двухнедельного периода не увенчались успехом, имеются серьезные проблемы с питанием или метаболизмом или средняя суточная потеря хилуса превышает 1 к 1.5 л на 5-7 дней.
При хилотораксах с высоким выходом (> 1 л / день) методы лечения включают визуализацию грудного протока под рентгеноскопией с помощью интранодальной лимфангиографии или чрескожного КТ-контроля доступа к цистерне хили и инъекции водорастворимого йодного контраста с последующей катетеризацией и эмболизацией грудного протока множественными рентгеноконтрастными микроватками и / или жидкими эмболическими агентами (например, N-бутилцианоакрилатным клеем). Сама по себе обычная лимфангиография может уменьшить или вылечить утечку хилуса у некоторых пациентов.
Лечение хилоторакса с высокой производительностью может также включать торакальную хирургию с помощью видео (VATS или торакотомию) для хирургического восстановления лимфатического разрыва и / или лигирования грудного протока. Крем для полости рта вводится за 24 часа до процедуры, чтобы облегчить определение места утечки. Если утечку невозможно идентифицировать, следует провести массовую перевязку всех тканей перед пищеводом и между аортой и непарной веной. ВАТС позволяет проводить одновременный плевродез с нанесением талька.
При хронических хилотораксах с низким выходом или хилотораксах, вызванных злокачественными новообразованиями, для контроля плеврального выпота может потребоваться прикроватный плевродез с использованием доксициклина или талька, или постоянный катетер (PleurX), или плевроперитонеальное шунтирование, если плевродез или застряло легкое. PleurX также можно рассматривать как терапию первого выбора вместо химического плевродеза.
Лечение излияния холестерина включает лечение основного заболевания, терапевтический торацентез для облегчения симптомов (пациент может испытывать боль за грудиной после аспирации большого объема из-за повышения отрицательного плеврального давления (захват легкого)) и плевродез и / или декортикацию. при повторяющихся симптоматических излияниях.Медикаментозное лечение решает почти 80% случаев.
Каков прогноз для пациентов с рекомендованным лечением?
При хилотораксе консервативные методы лечения успешны около 40%. В остальных случаях требуется хирургическое или паллиативное вмешательство.
Нетравматический хилоторакс, по-видимому, хуже реагирует на консервативные и хирургические меры, чем травматический хилоторакс. Его прогноз определяется основной этиологией.
Перевязка грудного протока при сильнодействующем или рецидивирующем хилотораксе травматического происхождения успешна почти в 95% случаев.
Смертность после хилоторакса после эзофагэктомии с высоким выходом составляет от 10% до 15% при ранней повторной операции и более 50% при консервативных мерах.
В большинстве случаев излияния холестерина протекают доброкачественно.
Какие еще соображения существуют для пациентов с хилотораксом или выпотом холестерина?
Липопротеиновый анализ плевральной жидкости для выявления хиломикронов выполняется редко.
Некоторые хилотораксы, скорее всего, не диагностируются из-за их немолочного цвета.
У голодных или истощенных пациентов использование критериев триглицеридов может упустить из виду диагноз хилоторакса.
Перед постановкой диагноза идиопатический хилоторакс исключите лимфому.
Длительное дренирование хилоторакса может привести к нарушению питания, иммуносупрессии и серьезным электролитным нарушениям (гипонатриемия и гипокальциемия).
Профилактическая перевязка грудного протока во время эзофагэктомии по поводу рака является эффективной профилактической мерой для снижения частоты послеоперационного хилоторакса.Лучше всего проводить его путем точной идентификации протока, а не путем перевязки масс.
Стойкий хилоторакс с высокой производительностью требует определенного вмешательства, при этом эмболизация грудного протока является хорошо переносимым и эффективным лечением. Стандартная процедура состоит из лимфангиографии и трансабдоминального доступа к грудному протоку с последующей эмболизацией.
Интранодальная лимфангиография — это возможный метод затемнения лимфатической системы с целью эмболизации грудного протока.
Активный туберкулез следует исключить у всех пациентов с излияниями холестерина.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Milking the System: диетическая терапия после нефрэктомии. Хилезный асцит
Browse NL, Wilson NM, Russo F, Al-Hassan H, et al. Этиология и лечение хилезного асцита. Br J Surg . 1992; 97: 1145–1150.
Артикул Google Scholar
Уильямс Р.А., Ветто Дж., Хинонес-Балдрих В., Бонгард Ф.С. и др. Хилезный асцит после операции на брюшной аорте. Энн Васк Сург . 1991; 5: 247–252.
Артикул CAS PubMed Google Scholar
Балсара К.П., Дубаш К. Хилезный асцит после шунта Уоррена. Индийский J Гастроэнтерол . 1987; 6: 243.
CAS PubMed Google Scholar
Бхат А.Л., Лоури Г.Л. Хилезная травма после операции на переднем отделе позвоночника. Eur Spine J . 1997. 6: 270–272.
Артикул CAS PubMed PubMed Central Google Scholar
Комб Дж., Буньет Дж. М., Дуг С., Бернард И. и др.Хилоторакс и хилезный асцит после операции по поводу воспалительной аневризмы аорты. Отчет о болезни с обзором литературы. Дж Мал Васк . 1992; 17: 151–156.
CAS PubMed Google Scholar
Баниэль Дж., Фостер Р.С., Роуленд Р.Г., Байрле Р. и др. Лечение хилезного асцита после диссекции забрюшинных лимфатических узлов при раке яичек. Дж Урол . 1993; 150: 1422–1424.
Артикул CAS PubMed Google Scholar
Bower TC, Nagorney DM, Cherry KJ, Toomey BJ и др. Замена нижней полой вены при злокачественных новообразованиях: обновленная информация. J Vasc Surg . 2000. 31: 270–281.
Артикул CAS PubMed Google Scholar
Парашер В.К., Мерони Э., Пинелли П. Анатомия грудного протока: эндосонографическое исследование. Гастроинтест Эндоск . 1995; 42: 188–189.
Артикул CAS PubMed Google Scholar
Зильверсмит БД. Состав и структура лимфохиломикронов собаки, крысы и человека. Дж. Клин Инвест . 1965; 44: 1610–1622.
Артикул CAS PubMed PubMed Central Google Scholar
Пабст Т.С. 3-й, Макинтайр К.Э. мл., Шиллинг Д.Д., Хантер Г.С. и др. Лечение хилоперитонеума после операций на брюшной аорте. Am J Surg . 1993; 166: 194–199.
Артикул PubMed Google Scholar
Аблан CJ, Littooy FN, Freeark RJ. Послеоперационный хилезный асцит: диагностика и лечение. Отчет о серии и обзор литературы. Arch Surg . 1990; 125: 270–273.
Артикул CAS PubMed Google Scholar
Ватанабе А.Т., Джеффри РБ. КТ-диагностика травматического разрыва цистерны хили. J Comput Assist Tomogr . 1987. 11: 175–176.
Артикул CAS PubMed Google Scholar
Паттен Р.М., Калкинс С.М., Мур Э. Изолированный травматический разрыв хиловой цистерны: КТ-диагностика. J Comput Assist Tomogr . 1999; 23: 701–702.
Артикул CAS PubMed Google Scholar
Коное С., Такахаши И., Каванака Х., Окадоме К. и др. Комбинация предоперационной лимфангиографии с использованием липиодола и интраоперационной лимфангиографии с использованием Evans Blue облегчает точную идентификацию послеоперационных хилезных свищей. Хирургия Сегодня . 1993; 23: 929–931.
Артикул CAS PubMed Google Scholar
Hill H, Srinivasa RN, Gemmete JJ, Hage A, et al. Эндолимфатическое этиодированное масло, интранодальная лимфангиография и эмболизация цианоакрилатным клеем для лечения послеоперационной лимфатической утечки после роботизированной лапароскопической резекции таза. J Endourol Case Rep . 2018; 4: 66–71.
Артикул PubMed PubMed Central Google Scholar
Гермази А., Брис П., Хеннекен С., Сарфати Э. Лимфография: старая техника сохраняет свою полезность. РадиоГрафика . 2003. 23: 1541–1558.
Артикул PubMed Google Scholar
Моро К., Кояма Ю., Косуги С., Исикава Т. и др. Состав с низким содержанием жира, содержащий элементарные вещества, эффективен для послеоперационного восстановления и потенциально полезен для предотвращения утечки хилуса во время послеоперационного раннего энтерального питания после эзофагэктомии. Clin Nutr . 2016; 35: 1423–1428.
Артикул CAS PubMed Google Scholar
Leibvitch I, Mor Y, Golomb J, Ramon J. Диагностика и лечение послеоперационного хилезного асцита. Дж Урол . 2002. 167: 449–457.
Артикул Google Scholar
Ulibarri JI, Sanz Y, Fuentes C, Mancha A, et al. Уменьшение лимфоррагии из-за разрыва грудного протока соматостатином. Ланцет . 1990; 336: 258.
Артикул CAS PubMed Google Scholar
Негоро Х., Ока Х., Кавакита М. Два случая хилоретроперитонеума после ретроперитонеоскопической нефроуретерэктомии. Инт Дж. Урол . 2006. 13: 487–489.
Артикул PubMed Google Scholar
Aalami OO, Allen DB, Organ CH. Хилезный асцит: коллективный обзор. Хирургия . 2000; 128: 761–778.
Артикул CAS PubMed Google Scholar
Симаджири Х., Эги Х., Ямамото М., Кочи М. и др. Лапароскопическое лечение рефрактерного хилезного асцита с использованием флуоресцентной навигации с индоцианиновым зеленым: клинический случай. Int J Surg Case Rep . 2018; 49: 149–152.
Артикул PubMed PubMed Central Google Scholar
Ярмохаммади Х., Броуди Л.А., Эринджери Дж. П., Кови А.М. и др. Терапевтическое применение чрескожного перитонеовенозного (Денверского) шунта при лечении хилезного асцита у онкологических больных. J Vasc Interv Radiol . 2016; 27: 665–673.
Артикул PubMed PubMed Central Google Scholar
Хилезный асцит Артикул
Непрерывное образование
Хилезный асцит (ХА) определяется как имеющая молочный оттенок, богатая триглицеридами перитонеальная жидкость в брюшной полости.Он характеризуется накоплением истинного хилуса из грудной или кишечной лимфы. Это необычное клиническое состояние, о котором впервые сообщили в 1912 году. Обычно это происходит из-за травмы и разрыва лимфатических сосудов из-за непроходимости и повышения перитонеального лимфатического давления. КА богат питательными веществами и иммуноглобулинами, которые становятся биологически недоступными после накопления в брюшной полости. Это может привести к обезвоживанию, нарушению баланса электролитов, недоеданию и подавлению иммунной системы.Эта деятельность предоставляет информацию, необходимую для быстрой диагностики и лечения, гарантированного межпрофессиональной командой.
Целей:
- Определите этиологию хилезного асцита.
- Обрисуйте соответствующую оценку хилезного асцита.
- Просмотрите доступные варианты лечения хилезного асцита.
- Опишите стратегии межпрофессиональной команды для улучшения координации помощи и коммуникации для продвижения хилезного асцита и улучшения результатов.
Введение
Хилезный асцит (ХА) определяется как имеющая молочный оттенок, богатая триглицеридами перитонеальная жидкость в брюшной полости. Это необычное клиническое состояние, о котором впервые сообщили в 1912 году. Оно характеризуется накоплением истинного хилуса из грудной или кишечной лимфы.[1] Описаны различные этиологии, и обычно это происходит из-за травмы, разрыва лимфатических сосудов, вызванных обструкцией, или повышения перитонеального лимфатического давления. КА богат питательными веществами и иммуноглобулинами, которые становятся биологически недоступными после накопления в брюшной полости. Это может привести к обезвоживанию, нарушению баланса электролитов, недоеданию и подавлению иммунной системы. Это может быть связано с высоким уровнем смертности, который может достигать от 40% до 70%, в зависимости от основной этиологии.Следовательно, необходимы своевременная диагностика и лечение. [2]
Этиология
Этиология хилезного асцита может быть классифицирована следующим образом: [3]
- Травматический или нетравматический.
- Воспалительный
- Послеоперационный
- Злокачественное
- Инфекционный
- Врожденный или приобретенный
- Портальные и непортальные, определяемые наличием или отсутствием заболеваний, влияющих на давление в портальной системе
В западных странах злокачественные новообразования брюшной полости и цирроз считаются основными причинами CA.В развивающихся и восточных странах большинство из них является вторичным по отношению к инфекциям, таким как туберкулез и филяриатоз. [3] [4] [5] Однако обзор 190 пациентов с КА выявил в общей сложности 41 различную этиологию. Наиболее частой причиной были лимфатические аномалии (32%), которые чаще встречаются в педиатрической популяции. На втором месте по частоте встречались злокачественные заболевания (7%). Цирроз и микобактериальные инфекции были определены как причины КА в 11% и 10% случаев соответственно [6].
Эпидемиология
В 1992 году крупная университетская больница оценила заболеваемость хилезным асцитом примерно в 1 на 20 000 случаев госпитализации в течение 20 лет.Однако частота CA, вероятно, увеличилась из-за улучшения ухода и лечения больных раком и увеличения их выживаемости. КА — это патологическое состояние, связанное с высоким уровнем смертности в зависимости от основной этиологии (от 40% до 70%). [1] [3] [7]
Патофизиология
Патофизиология хилезного асцита варьируется в зависимости от этиологии. Это можно разделить на три механизма: [3]
1) Приобретенные лимфатические нарушения
Приобретенные лимфатические нарушения могут быть травматическими или вторичными по отношению к хирургическим процедурам.Это вызывает расширение забрюшинных лимфатических сосудов с оттоком лимфы в брюшную полость через свищ между лимфатической системой и забрюшинным пространством. Расширение также может быть результатом увеличения производства лимфы и повышенного давления в печеночных венах, которые наблюдаются в случаях портальной гипертензии (HTN), вторичной по отношению к циррозу и констриктивному перикардиту.
2) Фиброз лимфатической системы
Это чаще всего наблюдается при злокачественных новообразованиях, затрудняющих лимфатический поток из кишечника в цистерну хили, с утечкой из расширенных суберозных лимфатических сосудов в брюшную полость и фиброзе лимфатических узлов.
3) Врожденные причины
Врожденные аномалии, такие как врожденная лимфангиэктазия, вызывают экссудацию лимфы в брюшную полость, вызывающую КА [8].
Гистопатология
Основная причина хилезного асцита — нарушение лимфотока. Лимфа в основном происходит из кишечника и печени, а также из других органов брюшной полости. Длинноцепочечные триглицериды (ТГ) в пище абсорбируются в виде хиломикронов в лимфатической системе после преобразования в моноглицериды и ЖК в тонком кишечнике.Это связано с молочным видом лимфы из-за высокого содержания триглицеридов [9].
В случае КА, вызванного портальной гипертензией, происходит нарушение эндотелия из-за высокого лимфатического давления, что приводит к расширению лимфатических каналов, что приводит к их разрыву и образованию КА. При непортальной этиологии лимфатический материал фильтруется в виде экссудата в брюшину через свищ, который образуется забрюшинно из-за врожденных или приобретенных мегалифатических сосудов. Со временем отложение коллагена в базальной мембране (БМ) лимфатических каналов происходит из-за повышенного лимфатического давления, что приводит к снижению абсорбционной способности слизистой оболочки кишечника.Это может привести к энтеропатии с потерей белка, проявляющейся недостаточной абсорбцией, недоеданием и стеатореей. [10] [11]
Историческая и физическая
Обследование пациента с асцитом должно начинаться с тщательного сбора анамнеза и физического обследования. Подробный анамнез должен описывать имеющиеся симптомы и включать прошлый медицинский анамнез (например, злокачественные новообразования, заболевания печени или почек и справки о любой недавней травме), семейный анамнез, хирургический анамнез, анамнез путешествий и социальный анамнез.[6]
Пациенты с хилезным асцитом обычно жалуются на безболезненное прогрессирующее вздутие живота, которое может длиться от нескольких недель до месяцев. Это наиболее частый симптом у 81% пациентов. Менее распространенные симптомы среди пациентов с хилезным асцитом включают боль или перитонит у 11%, диарею, дисфагию (как сообщалось при атравматических причинах, вызванных зобом или параэзофагеальной грыжей, сдавливающей грудной проток и приводящей к образованию хилоторакса и ХА), периферических отеков. , прибавка в весе и одышка, вызванные повышенным давлением в животе.[12] Другие менее специфические симптомы включают потерю аппетита, усталость, тошноту, увеличение лимфатических узлов, чувство полноты, лихорадку и ночную потливость.
При физикальном осмотре обнаружен вздутие живота, которое может напрягаться при пальпации. Также можно увидеть классические признаки асцита, такие как тупое переключение передач и дрожание при передаче (жидкая волна). Хирургические рубцы, обнаруженные при осмотре, могут свидетельствовать о травматической этиологии. Видны увеличенные лимфатические узлы. Следует оценить другие общие результаты обследования, выявленные при злокачественных новообразованиях, заболеваниях почек или печени.Например, пациенты с циррозом печени могут иметь характерные признаки физического осмотра, такие как кахексия, желтуха, временное истощение, ладонная эритема, паучьи ангиомы на груди и животе, гинекомастия, снижение шума дыхания и тупость при перкуссии грудной клетки на фоне плеврального выпота, напряжение живот при асците, головке медузы, спутанности сознания и дезориентации (печеночная энцефалопатия) при декомпенсированном заболевании. [6]
Другие результаты физикального обследования могут быть связаны с определенными синдромами, такими как синдром желтого ногтя или синдром Клиппеля-Тренауне.
Оценка
Для диагностики и оценки хилезного асцита необходимо сдать анализ крови и асцитической жидкости. Требуются стандартные анализы крови, которые включают полный анализ крови, базовую метаболическую панель, липидный профиль, функциональные пробы печени, общий белок, альбумин, лактатдегидрогеназу (ЛДГ), амилазу и липазу. [8]
Следующие тесты рассматриваются в каждом конкретном случае и в зависимости от клинической картины:
Парацентез брюшной полости необходим для диагностики CA.CA подозревают, когда асцит имеет молочный цвет. Должен быть получен уровень триглицеридов в асцитической жидкости, а концентрация более 200 мг / дл подтверждает диагноз. Жировые глобулы и лейкоциты с преобладанием лимфоцитов показаны после окрашивания Суданом III и микроскопического исследования. При подозрении на туберкулез следует провести мазок на кислотоустойчивые бациллы, посев и провести полимеразную цепную реакцию (ПЦР). Аденозиндезаминаза считается как чувствительным (93%), так и специфическим (94%) диагностическим тестом для диагностики туберкулеза брюшины, но в некоторых случаях может потребоваться биопсия брюшины.
Электрофорез липопротеинов считается золотым стандартом в диагностике ХА путем определения хиломикронов. Повышенный уровень триглицеридов в асцитической жидкости — лучший параметр для диагностики СА. С чувствительностью и специфичностью до 95% недавнее исследование предложило точку отсечения триглицеридов от 187 мг / дл (2,13 ммоль / л) или диапазон от 148 до 246 мг / дл (от 1,69 до 2,80 ммоль / л) до установить CA. [13]
Цитология и биопсия брюшины являются важными диагностическими инструментами при исследовании CA.[14] [15]
Компьютерная томография (CT ) брюшной полости полезна для диагностики новообразований в брюшной полости и лимфатических узлов в некоторых случаях CA. Уровень жировой жидкости является патогномоничным признаком хилезного асцита на компьютерной томографии, которую можно продемонстрировать, поместив пациента в положение лежа на спине на некоторое время перед тем, как сделать снимок. Поскольку удельный вес липидов меньше, чем у воды, это приводит к образованию уровня жировой жидкости, что также можно увидеть при ультразвуковом исследовании.[16] [17]
Лимфангиография считается золотым стандартом диагностики ХА в случаях лимфатической обструкции. Лимфангиография и лимфосцинтиграфия эффективны при отборе пациентов для операции, оценке эффектов результатов лечения, обнаружении аномалий в забрюшинных узлах, в дополнение к обнаружению утечек, свищей и проницаемости грудного протока [1].
Другие тесты: CA-125 может быть особенно повышен у пациентов с циррозом печени и хилезным асцитом.
Лечение / менеджмент
Возможности лечения хилезного асцита ограничены. Поэтому устранение первопричины и применение консервативных мер для улучшения комфорта пациента, уменьшения рецидивов и оптимизации результатов являются краеугольными камнями в лечении хилезного асцита.
Диета
Рекомендуется специальная диета с низким содержанием жиров, в основном с ТГ со средней длиной цепи и высоким содержанием белка.Триглицериды со средней длиной цепи защищают лимфатическую систему благодаря абсорбции энтероцитами и транспортируются непосредственно в печень в виде свободных жирных кислот и глицерина. Если этих диетических изменений недостаточно, следует рассмотреть возможность отдыха кишечника и парентерального питания. Такой подход помогает уменьшить лимфатический поток и обходит кишечник. Следует рассмотреть возможность консультации по питанию, чтобы помочь контролировать полное парентеральное питание и выбрать идеальный состав липидов. [1] [14] [15]
Лечебная терапия
Медикаментозная терапия включает различные лекарства, которые могут помочь уменьшить накопление СА:
- Орлистат снижает доступность ЖК и их абсорбцию, обратимо ингибируя высвобождение липазы из желудка и поджелудочной железы.
- Соматостатин и синтетический аналог октреотида использовались для лечения CA. Точный механизм действия полностью не изучен. Он может снизить портальное давление (подавляя внутреннюю вазодилатацию), перистальтику, кишечное всасывание жиров, концентрацию триглицеридов в грудном протоке и лимфоток в основных каналах. Путь введения и период полувыведения соматостатина и октреотида различаются. Соматостатины вводятся внутривенно и имеют период полувыведения от 1 до 3 минут, а октреотид вводится подкожно и имеет период полувыведения около 2 часов.[18] Октреотид успешно применялся у пациентов с СА, вторичным по отношению к панкреатиту, посттрансплантации печени, злокачественным новообразованиям, тромбозу воротной вены и идиопатическим причинам, улучшая их качество жизни.
- Этилефрин (агонист адренорецепторов) используется для лечения постуральной гипотензии из-за его симпатомиметического эффекта. Он также использовался у тех, кто подвергся эзофагэктомии и у которых развился КА из-за повреждения грудного протока. он уменьшает отток хилуса за счет сокращения гладких мышц грудного протока.[19] [20]
Терапевтические вмешательства
- Лимфангиография с эмболизацией может использоваться при лечении CA канд. Это достигается путем чрескожного введения клея в лимфатический узел. [21]
- Абдоминальный парацентез может быть подходящим временным вариантом. Это может быть осложнено дисбалансом электролитов, недоеданием и инфекцией из-за повторяющегося дренирования. Пациентам с циррозом печени рекомендуется заместительная терапия альбумином, в зависимости от объема.Парацентез следует использовать в сочетании с другими консервативными методами лечения из-за снижения эффективности при использовании отдельно [17].
- Сообщается, что трансъюгулярный внутрипеченочный портосистемный шунт (TIPS) является успешным средством лечения пациентов с циррозом печени, которые не реагируют на консервативные меры [22].
- Перитонеовенозные шунты (шунты LeVeen или Denver): могут быть рассмотрены у пациентов, которые не реагируют на медикаментозное лечение или не могут перенести операцию. Шунт возвращает хилезную жидкость в кровь и тем самым снова достигает гемостаза.С этими шунтами могут быть связаны серьезные осложнения, такие как электролитные нарушения, септический шок, непроходимость тонкой кишки, диссеминированное внутрисосудистое свертывание (ДВС) и воздушная эмболия. Кроме того, это может быть осложнено окклюзией шунта из-за повышенной вязкости хилуса. [23]
Хирургическая терапия
Хирургические вмешательства могут быть полезными, если все консервативные меры не помогают при лечении CA. Это следует учитывать, если CA возникла в результате врожденной причины, хирургического вмешательства или злокачественного новообразования.Лапаротомия обычно выполняется, чтобы установить шунт, закрыть свищ или удалить злокачественное новообразование. [22]
Дифференциальная диагностика
Хилезный асцит встречается редко. Дифференциальный диагноз может включать: [24]
- Послеоперационный: нарушение лимфатической системы из-за операции
- Травма
- Лимфома или лейкемия (ХЛЛ)
- Солидные злокачественные новообразования
- Саркомы (саркома Капоши)
- Нейроэндокринные опухоли
- Инфекции (микобактериальные инфекции и филяриатоз)
- Аутоиммунные заболевания (например, СКВ или саркоидоз).
- Панкреатит
- Синдром верхней полой вены
- Цирроз.
- Врожденные аномалии лимфатической системы (первичная кишечная лимфангиэктазия или болезнь Вальдмана, синдром желтого ногтя, синдром Клиппеля-Тренауне)
Прогноз
Прогноз у пациентов с хилезным асцитом зависит от основной этиологии. CA может быть связана с высоким уровнем смертности, который может достигать от 40% до 70%.Это может быть очень болезненным. [3] [7] Прогноз в нехирургических случаях CA хуже, чем в хирургических [19]. Хотя злокачественные новообразования считаются важной причиной CA, сообщалось, что они связаны с улучшением выживаемости при лечении, особенно у пациентов с лимфомами, благодаря недавнему введению более эффективных режимов химиотерапии и моноклональных антител. До появления этих новых протоколов в химиотерапии, CA, которая возникала одновременно с лимфомами, обычно приводила к плохому прогнозу с трехмесячной смертностью в 90%.[25]
Осложнения
Хилезный асцит содержит питательные вещества и иммуноглобулины, которые истощаются из-за их накопления в брюшной полости, что приводит к потере жидкости, нарушению питания, электролитным нарушениям и подавлению иммунитета. Следовательно, необходима адекватная диагностика и лечение. [2] Со временем отложение коллагена в базальной мембране лимфатических каналов происходит из-за повышенного лимфатического давления, что приводит к снижению абсорбционной способности слизистой оболочки кишечника.Это может привести к энтеропатии с потерей белка. [8]
Сдерживание и обучение пациентов
Обучение пациентов считается одним из краеугольных камней в ведении случаев хилезного асцита и лежащих в его основе причин. Пациенты должны осознавать важность изменения диеты как основного и начального шага в управлении ХА. Для симптоматического лечения хилезного асцита рекомендуется диета с высоким содержанием белка и низким содержанием жира и среднецепочечных триглицеридов (МСТ).MCT содержатся в пальмовом и кокосовом масле, жирном молоке, сыре и масле, которые содержат каприновую и лауриновую кислоты. Следует избегать других масел и жиров, включая орехи, красное мясо, рыбу, оливковое масло и авокадо, поскольку они содержат (LCT). [26] МСТ иногда считаются неприятными на вкус и могут вызывать вздутие живота, что может привести к плохому соблюдению диеты, связанной с тошнотой и рвотой. Поэтому пациентов следует предупреждать о вышеупомянутых побочных эффектах. [27] Кроме того, пациенты с СА из-за цирроза должны быть осведомлены о соблюдении диеты с низким содержанием натрия в дополнение к использованию диуретиков.[1]
Жемчуг и другие выпуски
Обычно диапазон общего белка составляет от (2,5 до 7,0 г / дл) и может варьироваться в зависимости от основной причины. Например, при циррозе печени уровень общего белка ниже 2,5 г / дл. Для диагностики портальной гипертензии в условиях заболевания печени (SAAG) может использоваться, что означает градиент сывороточного к асцитному альбумину. [14] Наличие SAAG менее 1,1 г / дл исключает портальную гипертензию и предполагает другие причины.С другой стороны, пациенты с СА из-за цирроза будут иметь SAAG выше 1,1 г / дл. Интересно, что уровень СА-125 повышен у пациентов с СА из-за цирроза [28] [29] [30].
Улучшение результатов команды здравоохранения
Улучшение результатов при хилезном асците зависит от первопричины. Например, внедрение более совершенных и новых протоколов химиотерапии, включая, помимо прочего, ритуксимаб и моноклональные антитела, привело к улучшению показателей выживаемости и разрешения симптомов, особенно при лимфомах.[25] Кроме того, обеспечение прочных взаимоотношений между пациентом и врачом, безусловно, приведет к лучшему соблюдению диетических мер, необходимых для лечения хилезного асцита.
Жидкость брюшной полости | eClinpath
Жидкость обычно нельзя аспирировать из брюшной полости мелких животных (собак, кошек), но небольшие количества могут собираться из брюшной полости крупных животных (лошадей, жвачных, верблюдовых). Таким образом, интерпретация результатов перитонеальной жидкости включает понятие «нормальных значений» для последних видов, тогда как любая скопившаяся брюшная жидкость является ненормальной для мелких животных (т.е.е. нет нормалей). Независимо от вида, применяются одни и те же механизмы накопления жидкости, то есть транссудация, разрыв / утечка сосуда / внутренних органов, экссудация и неоплазия.
Транссудативный выпот
В брюшной полости развивается транссудативный выпот из-за изменений гидродинамического давления плазмы (например, венозная гипертензия) или изменений онкотического давления плазмы (например, гипоальбуминемия). Оба механизма могут действовать у одного пациента. Брюшная жидкость у мелких животных подразделяется на транссудаты с низким (с низким содержанием белка) и с высоким содержанием белка (с высоким содержанием белка), что помогает определить механизм выпота и, возможно, его первопричину.
Транссудаты с низким содержанием белка (также называемые «чистыми» транссудатами)
Обычно они вызваны пресинусоидальной гипертензией, то есть гипертонией, возникающей между портальной триадой в печени и кишечном тракте. Это связано с тем, что лимфатическая жидкость, стекающая из кишечника в синусоиды печени, содержит мало белка. Тяжелая гипоальбуминемия (<1,0–1,5 г / дл) также может привести к низкому содержанию протеина в транссудате, но самой по себе гипоальбуминемии недостаточно, чтобы вызвать значительную транссудацию.Это связано с тем, что глобулины также оказывают онкотическое давление, а компенсаторное увеличение лимфатического дренажа снижает накопление жидкости. Следовательно, обычно наблюдаются сопутствующие изменения гидродинамического давления (например, портальная гипертензия), приводящие к излиянию у животных с гипоальбуминемией (т.е. действует более одного механизма).
Цитологические характеристики транссудата с низким содержанием белка у мелких животных:
- Число ядерных клеток : <1500 / мкл (чистые) или <5000 / мкл (бедные белком)
- Количество эритроцитов (эритроцитов) : варьируется, но обычно <5000 / мкл, если нет загрязнения крови.
- Общий белок (по рефрактометру): <2,5 г / дл
- Цитологические признаки : Смесь невырожденных нейтрофилов и макрофагов (примерно 50:50, но может варьироваться от 20:80 до 80:20) с низким количеством мелких лимфоцитов и мезотелиальных клеток. Можно увидеть реактивные лимфоциты или плазматические клетки. Обычно в только что собранном и приготовленном образце наблюдается минимальная эритрофагия (указывающая на кровоизлияние или экстравазацию эритроцитов в брюшную полость).
Некоторые причины транссудата с низким содержанием белка:
- Портальная (пресинусоидальная) гипертензия, вызванная заболеванием печени : Это наиболее частая причина как у собак, так и у кошек, e.грамм. цирроз печени, портосистемные шунты или сосудистые аномалии.
- Нефропатия с потерей белка : В этих условиях жидкость напоминает «воду». При нефропатии с потерей белка гломерулярная болезнь приводит к потере большого количества альбумина с мочой (снижение онкотического давления плазмы) и задержке натрия в почках (повышение гидродинамического давления плазмы).
Транссудаты с высоким содержанием белка (также называемые «модифицированные» транссудаты)
Высокобелковые транссудаты развиваются из-за повышенного гидродинамического давления плазмы (обычно из-за венозного застоя) в печени, где синусоиды печени более проницаемы для белка и указывают на синусоидальную или постсинусоидальную гипертензию (т.е. давление, возникающее в печени или проксимальнее центральной вены печени).
Цитологические характеристики транссудата с высоким содержанием белка у мелких животных:
- Количество ядерных клеток : <5000 / мкл
- Количество эритроцитов (эритроцитов) : варьируется, но обычно <50,000 / мкл
- Общий белок (по рефрактометру):> 2,5 г / дл (и обычно <5,0 г / дл)
- Цитологические признаки : Смесь невырожденных нейтрофилов и макрофагов (примерно 50:50, но может варьироваться от 20:80 до 70:30) с низким количеством мелких лимфоцитов и мезотелиальных клеток.Можно увидеть реактивные лимфоциты или плазматические клетки. Обычно наблюдается эритрофагия и гемосидерофаги (что указывает на кровоизлияние или экстравазацию эритроцитов в брюшную полость). Таким образом, цитологические характеристики аналогичны транссудату с низким содержанием белка, хотя количество эритроцитов часто выше при наличии признаков эритрофагии.
Перитонеальный выпот транссудата с высоким содержанием белка
Некоторые причины транссудата с высоким содержанием белка:
- Постсинусоидальная гипертензия
- Застойная сердечная недостаточность у собак : Снижение сердечного выброса может привести к венозному застою во многих органах, включая печень и легкие.
- Тромбоз хвостовой полой вены
- Новообразование : отшелушивающее или не отшелушивающее
- Синусоидальная гипертензия
- Заболевание печени : Заболевания печени, поражающие синусоиды или центральную вену, могут вызывать утечку жидкости с высоким содержанием белка в брюшную полость, например хронический активный гепатит.
- Другие причины повышения венозного давления : Новообразования и перекрут органов брюшной полости.
Обратите внимание, что в выпотах может присутствовать воспалительный компонент с повышенной проницаемостью сосудов без хемотаксиса, который в основном вызван транссудативными механизмами. Это можно увидеть у животных с серозным воспалением. Последнее подозревается в случаях, когда количество ядерных клеток приближается к верхнему пределу (3-5000 / мкл) у мелких животных или в сомнительном диапазоне у лошадей (5-10 000 / мкл), с высокой долей нейтрофилов (> 60-70 %) и, возможно, свидетельство гибели клеток (крупные индивидуализированные апоптотические клетки) или других аномалий (чрезмерная лейкофагия, остатки некротических клеток в макрофагах).
Хилезные выпоты
Хилезный или богатый лимфоцитами выпот обычно является вариантом транссудативного выпота и возникает из-за утечки лимфы в брюшную полость. Хилезные выпоты обычно богаты хиломикронами, которые состоят в основном из пищевых триглицеридов и абсорбируются в лимфатических сосудах кишечника, а затем выводятся в грудной проток. Эти хиломикроны придают жидкости характерный белый и непрозрачный вид. В этих жидкостях преобладают мелкие лимфоциты.В отличие от хилезных выпотов из грудной клетки, хилезный асцит встречается относительно редко. У некоторых пациентов жидкость может быть богатой лимфоцитами, но не иметь хилуса (хиломикронов). Это может быть связано с отсутствием аппетита или анорексией у пораженных пациентов или с утечкой лимфы, которая специально не дренирует кишечник. Мы также наблюдали, как тонкоклеточная лимфома кишечника вырабатывает (неопластический) выпот, богатый лимфоцитами, вероятно, из-за сопутствующей лимфангиэктазии или лимфатической обструкции, но это довольно редко.
Хилоабдомен
Цитологические характеристики хилезного выпота у мелких животных:
- Общий вид: Мутный, опалесцирующий, может образовывать жировой слой с менее плотным накоплением (особенно при охлаждении) хиломикронов. Непрозрачность не осаждается при центрифугировании (супернатант остается липемическим).
- Количество ядерных клеток : варьируется, но обычно> 3000 / мкл
- Количество эритроцитов (эритроцитов) : переменное.
- Общий белок (по рефрактометру): переменная. Может быть неточным из-за липемии, мешающей измерению.
- Цитологические признаки : Характерна высокая доля малых лимфоцитов, наряду с другими клетками полостной жидкости (невырожденные нейтрофилы, макрофаги). И макрофаги, и нейтрофилы могут иметь четкие цитоплазматические вакуоли с дискретными краями, что указывает на поглощение липидов. Может наблюдаться небольшое количество крупных лимфоцитов и плазматических клеток или реактивных лимфоцитов.Хилоз вызывает раздражение, поэтому возможно одновременное нейтрофильное или смешанное нейтрофильное гистиоцитарное воспаление, которое может даже доминировать, приводя к количеству ядерных клеток> 5000 / мкл.
- Подтверждение : Чтобы подтвердить диагноз хилезного выпота, триглицериды могут быть измерены в жидкости и сыворотке, и их содержание будет выше в жидкости (обычно более чем в 2 раза выше, чем в сыворотке). Хилезный выпот также можно подтвердить, если соотношение холестерин: триглицериды в жидкости <1. На самом деле в подавляющем большинстве хилезных выпотов концентрация триглицеридов> 100 мг / дл, поэтому измерение концентрации триглицеридов в сыворотке также может не потребоваться.В Корнельском университете мы редко получаем запросы на определение холестерина с жидкостью, потому что псевдохилезные выпоты (из-за повышенного уровня холестерина) у животных довольно редки. Обратите внимание: концентрация триглицеридов (или соотношение с сывороткой) может быть бесполезной для подтверждения диагноза у животных, которые не ели (жидкость от животных с анорексией также может быть не очень хилезной).
Причины хилезного асцита встречаются редко и включают:
- Лимфатическая непроходимость , эл.грамм. опухоль в мезентериальном лимфатическом узле, перекрут брыжейки, спайки.
- Лимфангиэктазия , например кишечное заболевание, например лимфома.
Экссудативный выпот
Экссудаты развиваются, когда медиаторы воспаления вызывают повышенную проницаемость сосудов, что делает возможным экссудацию белков и экстравазацию воспалительных клеток (чаще всего нейтрофилов). Эти медиаторы также вызывают расширение сосудов, что может усугубить излияние за счет увеличения притока крови к капиллярам в этой области.Экссудаты могут быть вызваны как инфекционными (бактериальные, вирусные, грибковые и др.), Так и неинфекционными (инородное тело, некроз с опухолью, мочеполовой оболочкой, желчью) причинами. В некоторых случаях экссудация может происходить в отсутствие хемотаксиса, что приводит к высокому содержанию белка, но нормальному количеству клеток. Это типично для инфекционного перитонита кошек, при котором васкулит и выработка вазоактивных медиаторов инфицированными моноцитами способствует экссудативному излиянию без существенного хемотаксиса нейтрофилов. Например, Takano et al (2011) показали, что инфекция FIP в моноцитах или альвеолярных макрофагах индуцирует продукцию мРНК и секрецию фактора роста эндотелия сосудов по сравнению с ложно-инфицированными клетками и инфицированными вирусом супернатантами культуры моноцитов, повышая проницаемость в культивируемых эндотелиальных клетках кошачьих.Однако было неясно, были ли слои эндотелиальных клеток сливными, и исследователи не показали, что изменения проницаемости были вызваны VEGF с блокирующими антителами или другими ингибирующими подходами. В других случаях может иметь место хемотаксис нейтрофилов без проницаемости сосудов, что приводит к высокому количеству нейтрофилов, но нормальному белку. Оба варианта являются вариантами экссудативных излишеств.
Цитологические характеристики экссудативного выпота у мелких животных:
- Количество ядерных клеток :> 5000 / мкл
- Количество эритроцитов (эритроцитов) : варьируется в зависимости от сопутствующего кровотечения или заражения крови.
- Общий белок (по рефрактометру): обычно> 2,5 г / дл, но может быть <2,5 г / дл
- Цитологические признаки : Может варьироваться в зависимости от побуждающей причины. Могут преобладать нейтрофилы (> 80-85%), что указывает на гнойное воспаление, или воспаление может быть смешанным (нейтрофилы и макрофаги), например инфекционный перитонит кошек. Нейтрофилы могут быть дегенерированными, особенно с бактериальными причинами. Полумесяцы протеина могут быть видны, когда протеин достаточно высок.Следует провести поиск причины воспаления, например, инфекционные агенты, желчь, лежащие в основе новообразования. В Корнельском университете мы регулярно выполняем окрашивание по Граму экссудативных выпотов. Что касается других выпотов, наблюдается небольшое количество тучных клеток, эозинофилов и реактивных лимфоцитов или плазматических клеток. Обратите внимание, что есть некоторые излияния, богатые эозинофилами. Мы всегда рассматриваем лежащие в основе тучноклеточные опухоли или лимфому, а также мигрирующих паразитов и некоторые инфекционные агенты (например, определенные грибы), но эозинофилы не являются специфичными в отношении причины выпота.
Это включает широкий спектр излияний, включая кровотечение, разрыв желчных протоков, мочеиспускательный канал и разрыв или утечку желудочно-кишечного тракта.
Геморрагический выпот
В Корнельском университете мы оставляем за собой термин «геморрагический выпот» для случаев, когда кровотечение считается основной причиной выпота (например, гемостатическое расстройство, травматическая гемангиосаркома) по сравнению с кровотечением, сопровождающим или осложняющим выпот из другие причины.При геморрагических излияниях PCV изотической жидкости обычно поддается измерению (> 1%) с количеством эритроцитов в миллионах / мкл. Всякий раз, когда в выпоте есть эритроциты, мы пытаемся отличить их от загрязнения крови во время сбора или от истинного кровоизлияния в полость. Есть несколько способов попытаться провести это различие:
- Во время сбора образца : Если жидкость меняет цвет с красного на прозрачный или с прозрачного на красный во время сбора, это означает, что кровь присутствует в результате контаминации, когда игла проходит через сосуд.Если весь образец при отборе имеет однородный красный или коричневый цвет, это свидетельствует о реальном кровоизлиянии in vivo. Эта информация очевидна для клинического патологоанатома только в том случае, если она указана в форме запроса.
- Сбор в пробирку с антикоагулянтом, отличную от — (красный верх) : Если жидкость кровоточит, может быть полезным сбор жидкости в пробирку без антикоагулянта. Жидкость будет свертываться при загрязнении крови или непреднамеренной аспирации селезенки. Жидкость не должна свертываться с геморрагическим выпотом (постулируемые механизмы см. Ниже).
- Во время цитологического исследования мазка : Здесь мы ищем следующее:
- Тромбоциты : Во время кровоизлияния в полость тела тромбоциты активируются и потребляются, поэтому может присутствовать небольшое количество тромбоцитов. Если в мазке присутствуют тромбоциты, это означает, что есть заражение крови или острое или продолжающееся кровотечение, поэтому отсутствие тромбоцитов более полезно, чем их присутствие.
- Свидетельства фагоцитоза и разрушения эритроцитов в макрофагах — эритрофаги, гемосидерофаги, кристаллы гематоидина: довольно быстро после начала кровотечения (возможно, в течение нескольких часов в некоторых случаях) макрофаги начнут фагоцитировать свободные эритроциты.Однако это также может происходить как артефакт in vitro, если образец находится в пробирке в течение нескольких часов перед изготовлением слайдов (например, образец отправляется в лабораторию на ночь). Мы наблюдали, что эритрофагия in vitro может возникнуть в течение 2 часов после сбора образца (и может возникнуть быстрее, если макрофаги уже «активированы» in vivo). Таким образом, эритрофагия более уместна в свежеприготовленном мазке жидкости и менее убедительна в мазке, сделанном из скопившейся жидкости. После эритрофагии макрофагам требуется время (вероятно, по крайней мере, день или два), чтобы расщепить эритроциты на гемосидерин или гематоидин (форма билирубина, образующаяся в среде с низким содержанием кислорода).Таким образом, если в мазке присутствует гемосидерин или гематоидин, это указывает на кровотечение некоторой продолжительности (и подтверждает кровоизлияние in vivo или экстравазацию эритроцитов даже в хранящемся образце). Если кровотечение продолжается, будут видны эритрофаги и, возможно, тромбоциты.
Отсутствие свертывания крови при сборе геморрагического выпота в пробирку с красным верхом — хорошо известное явление. Исследование 1983 года, в котором радиоактивно меченый фибриноген вводили собакам с 10 мл / кг крови через бедренную вену в перитонеальный шунт, показало, что фибриноген быстро расщеплялся до продуктов распада фибрина (огена) в течение 1 часа инфузии без сшивки. формируемые продукты.Расщепление фибриногена полностью ингибировалось гепарином, что позволяет предположить, что тромбин активируется, и кровь быстро сгущается после введения в полость, но затем быстро лизируется. Введение фибринолитического ингибитора, ε-аминокапроновой кислоты, вызывало свертывание крови, что позволяет предположить, что фибринолиз является основной причиной отсутствия свертывания геморрагического выпота (Moore et al., 1983). Мезотелиальные клетки собак действительно демонстрируют фибринолитическую активность in vitro (Louagie et al 1986). Культивируемые мезотелиальные клетки человека экспрессируют тканевой активатор плазминогена (будет стимулировать фибринолиз) и ингибитор активатора плазминогена-1 (будет ингибировать фибринолиз), поэтому баланс этих двух медиаторов будет определять, является ли мезотелий профибринолитическим или антифибринолитическим (стимулирующим спайки) (van Hinsbergh et al. 1990).Также могут быть региональные различия в фибринолитической активности мезотелия (Merto et al 1980).
Желчь «Белая»
Разрыв / утечка желчи
Вытекание желчи в брюшную полость может происходить при травме, разрыве мукоцеле (у собак), обструктивных поражениях (например, желчекаменной болезни) и воспалении или новообразовании в желчевыводящей системе или печени. Материал, напоминающий желчь, также можно увидеть в выпотах, вызванных разрывом или утечкой двенадцатиперстной кишки. Сама желчная жидкость ответственна за лишь небольшое количество образующегося в результате излияния, причем излияние в основном вызвано последующей воспалительной реакцией, которую вызывает желчь (в конце концов, это эмульгирующий агент).Желчь может быть распознана как желто-коричневый материал, либо свободный, либо внутри макрофагов (желчь в макрофагах может быть трудно отличить от гемосидерина), либо как «белая» желчь, которая характеризуется скоплениями или полосами слизи (небольшие количества которой трудно отделить). отличить от фибрина) (Owens et al 2003). В большинстве случаев разрыв желчных путей может быть подтвержден путем измерения билирубина в жидкости, который будет выше, чем билирубин в сыворотке (обычно в 2 раза или более выше), однако мы наблюдали случаи разрыва мукоцеле, состоящих из белой желчи, при которых общий концентрация билирубина ниже, чем в сыворотке крови.
Мочеиспускательный канал
Подтекание мочи в брюшную полость может произойти при травме, тяжелом воспалении, неоплазии или непроходимости (мочекаменной болезни) мочевыводящих путей (мочевого пузыря или мочеточников). Если разрыв большой, жидкость будет очень похожа на мочу (с довольно низким количеством клеток и общим белком) сразу после разрыва. Однако, как и при разрыве желчевыводящих путей, свободная моча затем вызывает воспалительную реакцию, вызывающую экссудативный выпот. Точно так же небольшое поражение, позволяющее мочи просачиваться в брюшную полость, вызывает стерильный перитонит (если нет сопутствующей инфекции мочевыводящих путей).Уроперитонеум может быть подтвержден путем сравнения уровней креатинина в жидкости и сыворотке (обычно в жидкости более чем в 2 раза выше, чем в сыворотке). Хотя концентрация азота мочевины также может быть изначально высокой, мочевина представляет собой небольшую молекулу с высокой способностью к диффузии, поэтому она быстро уравновешивается с мочевиной сыворотки, что делает ее менее полезной, чем креатинин, для подтверждения уроперитонеума.
GI разрыв / утечка
Это может произойти при травмах, обструктивных, воспалительных или удушающих поражениях, новообразованиях или инородном теле.Подобно разрыву желчевыводящих путей и уроперитонеума, большая часть выпота вызвана возникающим в результате воспалением и экссудацией, при этом бактериальная флора помогает вызвать воспалительную реакцию. Наличие смешанной популяции бактерий в нейтрофилах (включая виды, обычно встречающиеся в кишечном тракте, такие как Enterococcus или Peptostreptococcus ) или пищевого материала в цитологическом мазке может помочь подтвердить разрыв. Однако случайный забор кишечного содержимого во время сбора жидкости (энтероцентез) можно спутать с разрывом желудочно-кишечного тракта.При энтероцентезе мы не ожидаем увидеть воспалительную реакцию или наличие внутриклеточных бактерий, а также клеток полости перитонеальной жидкости. Это имитирует образцы, взятые сразу после разрыва желудочно-кишечного тракта (особенно если выделяется большое количество жидкости желудочно-кишечного тракта), цитологические результаты могут быть неотличимы от результатов энтероцентеза, поскольку не было достаточно времени для воспалительной реакции. В этих случаях можно клинически заподозрить разрыв желудочно-кишечного тракта из-за быстрого ухудшения состояния пациента, что требует немедленного хирургического вмешательства или повторной пробы через несколько часов в зависимости от клинической тяжести заболевания пациента.Это показывает, что цитологические результаты никогда не следует интерпретировать изолированно, а всегда в контексте пациента.
Новообразования
Некоторые неопластические процессы могут приводить к увеличению объема жидкости в полости тела из-за множества механизмов (с одной опухолью может работать более одного механизма):
- Компрессия лимфатических сосудов опухолью : Хилезный или богатый лимфоцитами выпот, например тимома, лимфома тимуса
- Венозное сжатие, вызывающее повышенное гидростатическое давление : Транссудативный выпот
- Эрозия кровеносных сосудов / инвазия или разрыв сосудистой опухоли : Геморрагический выпот, e.грамм. гемангиосаркома
- Продукция цитокинов или вазоактивных медиаторов опухолевыми клетками, увеличивающая проницаемость сосудов : Экссудативный выпот
- Воспаление : Экссудативный выпот
Мезотелиальный против карциномы
Не все типы опухолей расслаиваются с образованием выпота, поэтому опухолевые клетки могут или не могут быть идентифицированы в жидкости. Следовательно, основная неоплазия редко когда-либо может быть исключена как причина выпота. Лимфома и карцинома с большей вероятностью выделяют диагностические клетки в полостную жидкость, чем саркомы (например,грамм. гемангиосаркома). Лимфома обычно отшелушивает большое количество клеток в жидкость. Неопластические клетки могут быть легко идентифицированы, если они большие, однако, если лимфома состоит из мелких клеток или отслаивает только небольшое количество клеток, диагностика может быть более сложной и ее легко можно пропустить без более сложных диагностических процедур, например клональность тестирования. Карциномы могут быть идентифицированы в жидкостях, когда есть скопления прикрепленных клеток (некоторые клетки могут быть индивидуализированы), демонстрируя цитологические критерии злокачественности, например.грамм. анизоцитоз, анизокариоз, множественные причудливые ядрышки, митотические фигуры и т. д. Однако может быть очень трудно отличить клетки карциномы от неопухолевых реактивных мезотелиальных клеток (поскольку все эти клетки часто находятся в кластерах) и невозможно отличить от мезотелиомы , но, к счастью, последние встречаются редко.
Ссылки по теме
- Сводная таблица и алгоритм диагностики выпотов.