ФАРМАТЕКА » Синдром Гудпасчера: патогенез, диагностика, лечение
1. Мухин Н.А. Синдром Гудпасчера. В кн. Нефрология (руководство для врачей). М., 2000.
2. Bosch X, Font J. The pulmonary-renal syndrome: a poorly understood clinicopathologic condition. Lupus 1999;8:258–62.
3. Алмазов В.А., Журавлев В.А., Наймарк Д.А., Петров М.Н. Капиллярит с преимущественным поражением сосудов почек и легких (синдром Goodpasture) // Клин. мед. 1972. № 10. С. 140–45.
4. Uezu Y, Kiyatake I, Tokuyama K. A case of Goodpasture’s syndrome with massive pulmonary hemorrhage ameliorated by cyclophosphamide pulse therapy. Nippon Jinzo Gakkai Shi 1999;41:499–504.
5. Daly C, Conlon PJ, Medwar W, Walshe JJ. Characteristics and outcome of anti-glomerular basement membrane disease: a single-center experience. Ren Fail 1996;18:105–12.
6. Shah MK, Hugghins SY. Characteristics and outcomes of patients with Goodpasture’s syndrome. South Med J 2002;95:1411–18.
7. Hirayama K, Yamagata K, Kobayashi M, Koyama A. Anti-glomerular basement membrane antibody disease in Japan: part of the nationwide rapidly progressive glomerulonephritis survey in Japan. Clin Exp Nephrol 2008;12(5):339–47.
8. von Vigier RO, Trummler SA, Laux-End R, et al. Pulmonary renal syndrome in childhood: a report of twenty-one cases and a review of the literature. Pediatr Pulmonol 2000;29:382–88.
9. Bergs L. Goodpasture syndrome. Crit Care Nurs 2005;25:50–8.
10. Hammerschmidt DE. Ernest Goodpasture and glomerulonephritis. J Lab Clin Med 2002;139:324.
11. Murphy TE. A case report of Goodpasture syndrome is described and discussed in terms of insurability. J Insur Med 2000;32:189–90.
12. Jung C, Karpouzas G, Stringer WW. Dyspnea, hemoptysis, and perihilar infiltrates in a 35-yearold man. Chest 2005;127:1437–41.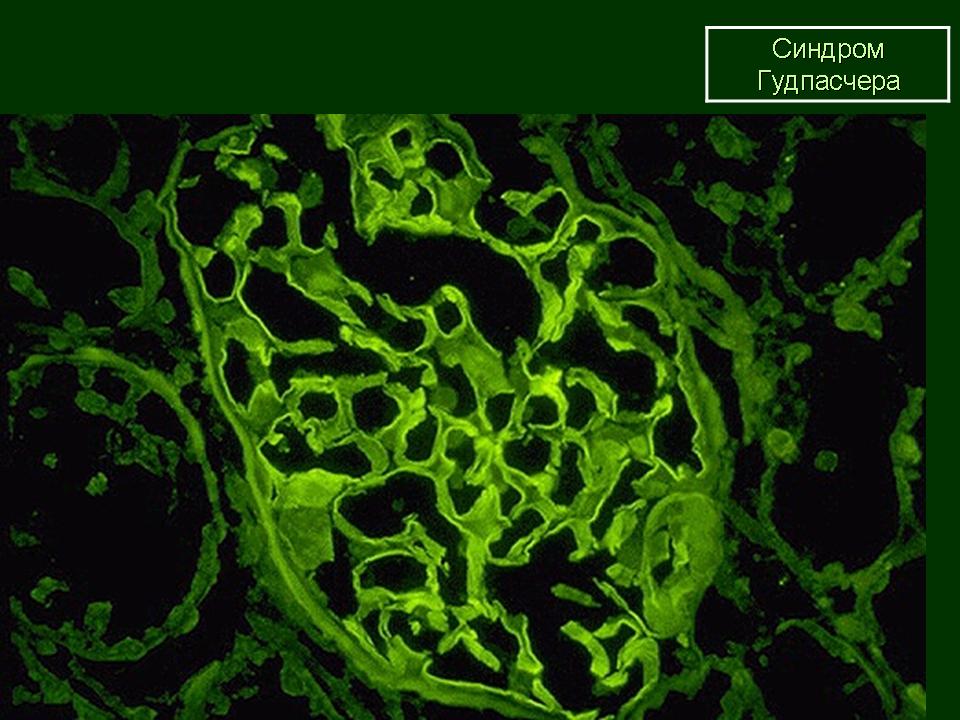
13. Calderon EJ, Wichmann I, Varela JM, et al. Presence of glomerular basement membrane (GBM) antibodies in HIV-patients with Pneumocystis carinii pneumonia. Clin Exp Immunol 1997;107:448–50.
14. Tsagalis GC, Margelos V, Nikolopoulou N, Hadjiconstantinou VE. Fluctuating levels of antiGBM antibodies following a fungal infection in a patient with secondary amyloidosis. Clin Nephrol 2003;59:150–52.
15. Lucas Guillen E, Martinez Ruiz A, Alegria Fernandez M, Martinez Losa A. Goodpasture syndrome: re-exacerbations associated with intercurrent infections. Rev Clin Esp 1995;195:761–64.
16. Turner-Warwick M. Adverse reactions affecting the lung: possible association with D-penicillamine. J Rheumatol 1981;7:166–68.
17. Stetter M, Schmidl M, Krapf R. Azathioprine hypersensitivity mimicking Goodpasture’s syndrome. Am J Kidney Dis 1994;23:874–77.
18. Shah MK. Outcomes in patients with Goodpasture’s syndrome and hydrocarbon exposure. Ren Fail 2002;24:545–55.
19. Sirvent AE, Enriquez R, Andrada E, et al. Goodpasture’s syndrome in a patient using cocaine – a case report and review of the literature. Clin Nephrol 2007;68(3):182–85.
20. Kalluri R, Petrides S, Wilson CB, et al. Antialpha 1 (IV) collagen autoantibodies associated with lung adenocarcinoma presenting as the Goodpasture syndrome. Ann Intern Med 1996;124:651–53.
21. Au WY, Tang SC, Chan KW, et al. Pulmonary renal syndrome and thrombotic thrombocytopenic purpura in a patient with giant cavernous hemangioma of the leg. Arch Intern Med 2002;162:221–22.
22. Persson U, Hertz JM, Carlsson M, et al. Patients with Goodpasture’s disease have two normal COL4A3 alleles encoding the NC1 domain of the type IV collagen alpha 3 chain. Nephrol Dial. Transplant 2004;19:2030–35.
23. Ball JA, Young KR. Pulmonary manifestations of Goodpasture’s syndrome. Antiglomerular basement membrane disease and related disorders. Clin Chest Med 1998;19:777–91.
Clin Chest Med 1998;19:777–91.
24. Rutgers A, Meyers KE, Canziani G, et al. High affinity of anti-GBM antibodies from Goodpasture and transplanted Alport patients to alpha 3 (IV) NC1 collagen. Kidney Int 2000;58:115–22.
25. Hudson BG, Tryggvason K, Sundaramoorthy M, Neilson EG. Alport’s syndrome, Goodpasture’s syndrome, and type IV collagen. N Engl J Med 2003;348:2543–56.
26. Hellmark T, Segelmark M, Unger C, et al. Identification of a clinically relevant immunodominant region of collagen IV in Goodpasture disease. Kidney Int 1999;55:936–44.
27. Gunnarsson A, Hellmark T, Wieslander J. Molecular properties of the Goodpasture epitope. J Biol Chem 2000;275:30844–48.
28. Wu J, Borillo J, Glass WF, et al. T-cell epitope of alpha3 chain of type IV collagen induces severe glomerulonephritis. Kidney Int 2003;64(4):1292–301.
29. Zou J, Henderson L, Thomas V, et al. Presentation of the Goodpasture autoantigen requires proteolytic unlocking steps that destroy prominent T cell epitopes. J Am Soc Nephrol 2007;18(3):771–79.
30. Zhao J, et al. Levels of epitope-specific autoantibodies correlate with renal damage in anti-GBM disease. Nephrol Dial Transplant 2009;24(6):1838–44.
31. Zhao J, Yan Y, Cui Z, et al. The immunoglobulin G subclass distribution of anti-GBM autoantibodies against rH alpha 3 (IV) NC1 is associated with disease severity. Hum Immunol 2009;70(6):425–29.
32. Chikamitsu H. Experimentelle studien uber immunocytotoxische glomerulonephritis. Folia Endocrin Japan 1940;40:85.
33. Reynolds J, Moss J, Duda MA, et al. The evolution of crescentic nephritis and alveolar haemorrhage following induction of autoimmunity to glomerular basement membrane in an experimental model of Goodpasture’s disease. J Pathol 2003;200:118–29.
34. Borza DB. Autoepitopes and alloepitopes of type IV collagen: role in the molecular pathogenesis of anti-GBM antibody glomerulonephritis. Nephron Exp Nephrol 2007;106:37–43.
Nephron Exp Nephrol 2007;106:37–43.
35. Salama AD, Chaudhry AN, Ryan JJ, et al. In Goodpasture’s disease, CD4(+) T cells escape thymic deletion and are reactive with the autoantigen alpha3 (IV) NC1. J Am Soc Nephrol 2001;12:1908–15.
36. Dean EG, Wilson GR, Li M, et al. Experimental autoimmune Goodpasture’s disease: a pathogenetic role for both effector cells and antibody in injury. Kidney Int 2005;67:566–75.
37. Okada H, Moriwaki K, Kalluri R, et al. Inhibition of monocyte chemoattractant protein-1 expression in tubular epithelium attenuates tubulointerstitial alteration in rat Goodpasture syndrome. Kidney Int 2000;57:927–36.
38. Kuroda T, Yoshida Y, Kamiie J, et al. Expression of MMP-9 in mesangial cells and its changes in anti-GBM glomerulonephritis in WKY rats. Clin Exp Nephrol 2004;8(3):206–15.
39. Collard HR, Schwarz MI. Diffuse alveolar hemorrhage. Clin Chest Med 2004;25:583–92.
40. Jung C, Karpouzas G, Stringer WW. Dyspnea, hemoptysis, and perihilar infiltrates in a 35-yearold man. Chest 2005;127:1437–41.
41. Ball JA, Young KR. Pulmonary manifestations of Goodpasture’s syndrome. Antiglomerular basement membrane disease and related disorders. Clin Chest Med 1998;19:777–91.
42. Salama AD, Levy JB, Lightstone L, Pusey CD. Goodpasture’s disease. Lancet 2001; 358:917–20.
43. Sethi S, Lewin M, Lopez L, Lager D. Linear antiglomerular basement membrane IgG but no glomerular disease: Goodpasture’s syndrome restricted to the lung. Nephrol Dial Transplant 2007;22(4):1233–35.
44. Sengul E, Eyileten T, Ozcan A, et al. Antiglomerular basement membrane disease with nephrotic proteinuria. Clin Nephrol 2009;72(2):157–59.
45. Gallagher H, Kwan JT, Jayne DR. Pulmonary renal syndrome: a 4-year, single-center experience. Am J Kidney Dis 2002;39:42–7.
46. Kalluri R. Goodpasture syndrome. Kidney Int 1999;55:1120–22.
47. Zhao M, Ding J, Liu Y, et al. A clinical and pathological analysis of 41 patients with antiglomerular basement membrane antibody related diseases. Zhonghua Nei Ke Za Zhi 2001;40:316–20.
48. Vuckovic B, Ilic T, Mitic I, et al. Goodpasture’s syndrome – case report. Med Pregl 2004; 57:391–95.
49. Sharma S. Bilateral serous retinal detachments associated with Goodpasture’s syndrome. Can J Ophthalmol 1998;33:226–27.
50. Chak M, Stanford MR, Poon W, et al. Uveitis initiating an autoimmune reaction resulting in Goodpasture’s syndrome in a Chinese man. Br J Ophthalmol 2002;86:1188–90.
51. Blanco Filho F, Ernesto LC, Rosa MA, et al. Rapidly progressive antineutrophil cytoplasm antibodies associated with pulmonary-renal syndrome in a 10-year-old girl. Sao Paulo Med J 2001;119:29–32.
52. Verburgh CA, Bruijn JA, Daha MR, van Es LA. Sequential development of anti-GBM nephritis and ANCA-associated Pauci-immune glomerulonephritis. Am J Kidney Dis 1999;34:344–48.
53. Kalluri R, Meyers K, Mogyorosi A, et al. Goodpasture syndrome involving overlap with Wegener’s granulomatosis and anti-glomerular basement membrane disease. J Am Soc Nephrol 1997;8:1795–800.
54. Serratrice J, Chiche L, Dussol B, et al. Sequential development of perinuclear ANCA-associated vasculitis and anti-glomerular basement membrane glomerulonephritis. Am. J. Kidney Dis 2004;43:e26-e30.
55. Henderson RD, Saltissi D, Pender MP. Goodpasture’s syndrome associated with multiple sclerosis. Acta Neurol Scand 1998; 98:134–35.
56. Carreras L, Poveda R, Bas J, et al. Goodpasture syndrome during the course of a SchonleinHenoch purpura. Am J Kidney Dis 2002;39:E21.
57. Drube S, Maurin N, Sieberth HG. Coincidence of myasthenia gravis and antiglomerular basement membrane glomerulonephritis: a combination of two antibody-mediated autoimmune diseases on day 15. Nephrol Dial Transplant 1997;12:1478–80.
Nephrol Dial Transplant 1997;12:1478–80.
58. Nakamura T, Suzuki Y, Koide H. Granulocyte and monocyte adsorption apheresis in a patient with antiglomerular basement membrane glomerulonephritis and active ulcerative colitis. Am J Med Sci 2003;325:296–98.
59. Komatsu T, Utsunomiya K, Oyaizu T. Goodpasture’s syndrome associated with primary biliary cirrhosis. Intern Med 1998;37:611–13.
60. Kielstein JT, Helmchen U, Netzer KO, et al. Conversion of Goodpasture‘s syndrome into membranous glomerulonephritis. Nephrol Dial Transplant 2001;16:2082–85.
61. Thitiarchakul S, Lal SM, Luger A, Ross G. Goodpasture’s syndrome superimposed on membranous nephropathy. A case report. Int J Artif Organs 1995;18:763–65.
62. Hecht N, Omoloja A, Witte D, et al. Evolution of antiglomerular basement membrane glomerulonephritis into membranous glomerulonephritis. Pediatr Nephrol 2008;23(3):477–80.
63. Gartenschlager M, Lenci G, Schinzel H, et al. Goodpasture syndrome: treatment initiation with plasmapheresis before histologic diagnostic verification. Pneumologie 1996;50:764–68.
64. Laczika K, Knapp S, Derfler K, et al. Immunoadsorption in Goodpasture’s syndrome. Am J Kidney Dis 2000;36:392–25.
65. Baumgartner I, Gmur J, Fontana A, et al. Recovery from life threatening pulmonary hemorrhage in Goodpasture’s syndrome after plasmapheresis and subsequent pulse dose cyclosphosphamide. Clin Nephrol 1995;43:68–70.
66. Garcia-Canton C, Toledo A, Palomar R, et al. Goodpasture’s syndrome treated with mycofenolat mofetil. Nephrol Dial Transplant 2000;15:920–22.
67. Takeda S, Takahashi M, Sado Y, et al. Prevention of glomerular crescent formation in glomerulonephritis by mycophenolate mofetil in rats. Nephrol Dial Transplant 2004;19(9):2228–36.
68. Asgeirsdóttir SA, Zwiers PJ, Morselt HW, et al. Inhibition of proinflammatory genes in antiGBM glomerulonephritis by targeted dexamethasoneloaded AbEsel liposomes. Am J Physiol Renal Physiol 2008;294(3):554–61.
Am J Physiol Renal Physiol 2008;294(3):554–61.
69. Garcia GE, Truong LD, Li P, et al. Inhibition of CXCL16 attenuates inflammatory and progressive phases of anti-glomerular basement membrane antibody-associated glomerulonephritis. Am J Pathol 2007;170(5):1485–96.
70. Huang L, Garcia G, Lou Y, et al. Antiinflammatory and renal protective actions of stanniocalcin-1 in a model of anti-glomerular basement membrane glomerulonephritis. Am J Pathol 2009;174(4):1368–78.
71. Leh S, Vaagnes O, Margolin SB, et al. Pirfenidone and candesartan ameliorate morphological damage in mild chronic anti-GBM nephritis in rats. Nephrol Dial Transplant 2005; 20(1):71–82.
72. Netzer KO, Merkel F, Weber M. Goodpasture syndrome and end-stage renal failure – to transplant or not to transplant? Nephrol Dial Transplant 1998;13:1346–48.
73. Miyazato M, Koyama Y, Miyazato T, et al. Cadaveric renal transplantation for Goodpasture’s syndrome: a case report. Hinyokika Kiyo 2001;47:493–95.
74. Hibbs AM, Bznik-Cizman B, Guttenberg M, et al. Ulcerative colitis in a renal transplant patient with previous Goodpasture disease. Pediatr Nephrol 2001;16:543–46.
75. Khandelwal M, McCormick BB, Lajoie G, et al. Recurrence of anti-GBM disease 8 years after renal transplantation. Nephrol Dial Transplant 2004;19(2):491–94.
76. Sauter M, Schmid H, Anders HJ, et al. Loss of a renal graft due to recurrence of anti-GBM disease despite rituximab therapy. Clin Transplant 2009;23(1):132–36.
77. Saurina A, Arrizabalaga P, Rodriguez R, et al. Anti-glomerular basement membrane antibody mediated disease: revision of 32 cases and followup at one year of the diagnosis. Nefrologia 2003;23:415–22.
78. Segelmark M, Hellmark T, Wieslander J. The prognostic significance in Goodpasture’s disease of specificity, titre and affinity of anti-glomerularbasement-membrane antibodies. Nephron Clin Pract 2003;94:59–68.
Nephron Clin Pract 2003;94:59–68.
79. Schindler R, Kahl A, Lobeck H, et al. Complete recovery of renal function in a dialysis-dependent patient with Goodpasture syndrome. Nephrol Dial Transplant 1998;13:462–66.
80. Schmidt RH, Sieh S, Rohl D, et al. Spontaneous remission of Goodpasture syndrome in a 21-year-old patient. Dtsch Med Wochenschr 1999;124:1201–03.
81. Levy JB, Turner AN, Rees AJ, Pusey CD. Longterm outcome of anti-glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression. Ann Intern Med 2001;134:1033–42.
82. Merkel F, Pullig O, Marx M, et al. Course and prognosis of anti-basement membrane antibody (anti-BM-Ab)-mediated disease: report of 35 cases. Nephrol Dial Transplant 1994;9:372–76.
83. Cui Z, Zhao MH, Xin G, Wang HY. Characteristics and prognosis of Chinese patients with antiglomerular basement membrane disease. Nephron Clin Pract 2005;99:49–55.
СИНДРОМ ГУДПАСЧЕРА (случай из клинической практики) Текст научной статьи по специальности «Клиническая медицина»
Проблемы здоровья и экологии
150
3. Методика парентерального введения озоно-кислородной смеси расширяет возможности лечения пациентов с ИБС со стабильной стенокардией (ФК I и II), в том числе с высоким риском осложнений и при наличии сопутствующих заболеваний.
4. ОЗТ является высокоэффективным и перспективным природным немедикаментозным методом восстановительного лечения пациентов с ИБС в санатории.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Манак, Н. А. Современные взгляды на профилактику ишемической болезни сердца / Н. А. Манак // Мед. новости. — 2003. — № 5. — С. 15-20.
2.
3. Гуревич, Г. Л. Применение озона в медицинской практике / Г. Л. Гуревич, А. Л. Працкевич // Рецепт. — 2002. — № 5 (25). — С. 91-93.
4. Ковальчук, Л. С. Озонотерапия при ишемической болезни сердца / Л. С. Ковальчук // Проблемы здоровья и экологии. — 2005. — № 4 (6). — С. 63-65.
5. Altman, N. Oxygen healing therapies: for optimum healing and vitality / N. Altman // Vermont: Healing Arts Press Rochester. — 1994. — 200 p.
6. Катюхин, В. Н. Возможности озонотерапии ишемиче-
ской болезни сердца в современной кардиологической клинике / В. Н. Катюхин, М. С. Упорова, А. А. Андрущенко // Новые Санкт-Петербургские врачебные ведомости: Всероссийскийжурнал врача общей практики. — 2006. — № 2. — С. 81-83.
7. Ковальчук, Л. С. Озонотерапия на санаторном этапе реабилитации больных ишемической болезнью сердца пожилого возраста / Л. С. Ковальчук // Мед. панорама. — 2007. — № 1 (69). — С. 3-5.
8. Interval and continuous training in cardiovascular rehabilitation / L. Mifkova [et al.] // Vnitr. Lek. — 2006. — Vol. 52. — P. 44-50.
9. Wolf, H. H. Das Medizinisch Ozon / H. H. Wolf. — 1988. — 270 p.
Поступила 10.01.2012
СЛУЧАЙ ИЗ КЛИНИЧЕСКОЙ ПРАКТИКИ
СИНДРОМ ГУДПАСЧЕРА (случай из клинической практики)
И. ase from clinical practice)
ase from clinical practice)
I. F. Shaliga, L. A. Martemianova, O. V. Kanaplianik Gomel State Medical University
Presented a case of rare pathology Goodpasture’s syndrome in a younger patient with a clinical diagnosis polysegmentary bronchopneumonia, chronic glomerulonephritis, chronic sepsis, after clinical and morphological analysis of the case exposed the diagnosis of hemorrhagic pneumo-renal syndrome.
Discussed the morphological changes in organs and their relationship to clinical and laboratory and instrumental methods. Show in a concrete example low verification of lifetime diagnostic of this disease.
Key words: Goodpasture’s syndrome, historical aspects, clinical, laboratory and morphological diagnostic methods.
Введение
Синдром Гудпасчера (СГ) — редкое заболевание аутоиммунной природы, сопровождающееся системным капилляритом с преимущественным поражением легких и почек
по типу геморрагических пневмонита и гломе-рулонефрита. В основе заболевания лежит аутоиммунная реакция с выработкой организмом аутоантител, главным образом, к базальным мембранам клубочковых капилляров почек и
Проблемы здоровья и экологии
151
 ). При вирусной, бактериальной инфекции возможно наличие общих антигенов как в базальных мембранах клубочковых и легочных капилляров, так и в клеточных структурах бактерий, что приводит к выработке в организме перекрестно реагирующих антител [1].
). При вирусной, бактериальной инфекции возможно наличие общих антигенов как в базальных мембранах клубочковых и легочных капилляров, так и в клеточных структурах бактерий, что приводит к выработке в организме перекрестно реагирующих антител [1].В настоящее время основной теорией патогенеза СГ, как и других диффузных болезней соединительной ткани, является аутоиммунная, суть которой заключается в стимуляции выработки антител к структурным элементам (антигенам) базальных мембран легочных альвеол и почечных клубочков. Это подкрепляется данными иммунофлюоресцентного и электронно-микроскопического исследования с выявлением патогномоничного для данного заболевания линейного характера отложения иммунных депозитов на базальных мембранах капилляров легких и в почечных клубочках. Для СГ характерно также повышение в крови больных титра антител к гломерулярной базальной мембране [1, 2].
В мировой литературе описано 280 наблюдений, в российских и белорусских источниках — 21 случай этого заболевания (у 8 женщин и 13 мужчин) [3].
В большинстве случаев заболевание развивается внезапно после острой респираторной вирусной инфекции и проявляется симптомами поражения легких: кровохарканием или легочным кровотечением, одышкой, кашлем, болью в грудной клетке. Эти признаки возникают на фоне общей слабости, повышенной температуры, снижения массы тела. На рентгенограммах легких видны характерные двусторонние рыхлые инфильтраты, распространяющиеся из прикорневых отделов к периферии, преимущественно в нижних долях или прикорневой и срединной локализации, которые имеют преходящий характер и могут исчезать спонтанно. В редких случаях они могут сливаться или развиваются с одной стороны. Диффузное затемнение в легких отмечается во время легочного кровотечения и связано с интраальвеолярной геморрагией. В мокроте присутствуют макрофаги, содержащие гемо-
сидерин. Развивается железодефицитная анемия, связанная с легочным кровотечением. При анализе мочи выявляются выраженные в той или иной степени протеинурия, гематурия, пиурия и цилиндрурия, реже — азотемия, во многих случаях — прогрессирующая почечная недостаточность на фоне олигурии и даже анурии [2]. При гистологическом исследовании в легких выявляются внутриальвеолярные кровоизлияния, макрофаги, содержащие гемосидерин, утолщения альвеолярных перегородок; в почках обнаруживается очаговый гломерулит или распространенный гломерулонефрит [3, 4].
Развивается железодефицитная анемия, связанная с легочным кровотечением. При анализе мочи выявляются выраженные в той или иной степени протеинурия, гематурия, пиурия и цилиндрурия, реже — азотемия, во многих случаях — прогрессирующая почечная недостаточность на фоне олигурии и даже анурии [2]. При гистологическом исследовании в легких выявляются внутриальвеолярные кровоизлияния, макрофаги, содержащие гемосидерин, утолщения альвеолярных перегородок; в почках обнаруживается очаговый гломерулит или распространенный гломерулонефрит [3, 4].
При осмотре больного отмечают резкую бледность кожных покровов без признаков цианоза. При аускультации в легких выслушиваются сухие и влажные (особенно в период легочного кровотечения) хрипы на фоне жесткого дыхания, преимущественно в прикорневой зоне. При перкуссии легочный звук не изменен. Пульс частый, обычно малого наполнения, мягкий. Артериальное давление у большинства больных в пределах нормы. Печень и селезенка не пальпируются. В редких случаях могут отмечаться геморрагические изменения кожи и слизистых оболочек, гепатомегалия, признаки сердечной декомпенсации, перикардиты, как исключение — спленомегалия. Указанный порядок возникновения симптомов при СГ является классическим.
Ряд авторов описывают менее типичные варианты болезни, когда вышеперечисленные признаки могут отсутствовать, на первое место в начале заболевания выходят нехарактерные симптомы: повышение температуры, артралгия, диспептические явления и др. Постановка диагноза в таких случаях весьма затруднительна.
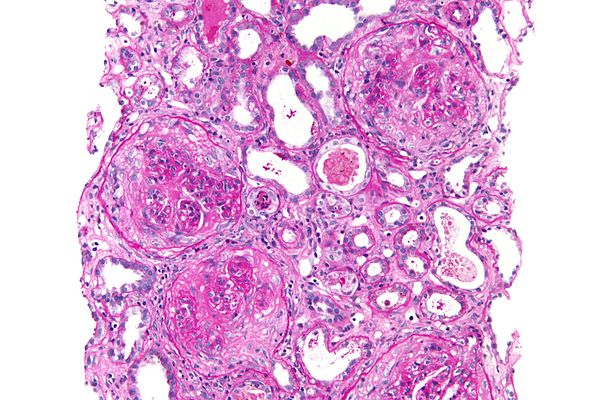
При гистологическом исследовании обнаруживают преимущественно поражение клубочков, соответствующее сегментарному очаговому пролиферативно-мембранозному, пролиферативному (чаще экстракапиллярному) или некротизирующему гломерулонефриту с реактивным разрастанием на месте погибших неф-ронов соединительной ткани с развитием склероза почечных клубочков.
При быстром развитии СГ, когда патологический процесс в легких характеризуется массивностью поражения, обнаруживаются преимущественно свежие изменения в виде
Проблемы здоровья и экологии
152
мелких и обширных кровоизлияний, изолированных или сливающихся пневмонических фокусов и полостей распада. Проявления гемосидероза и пневмосклероза у таких больных выражены слабо. Если же легочная патология прогрессирует медленно, на первое место выступает очаговый или диффузный гемосидероз и фиброз ткани органа.
При электронно-микроскопическом и иммунофлюоресцентном исследовании в качестве характерных признаков СГ описывают утолщение и гомогенизацию базальных мембран, пролиферацию и отек эндотелиальных клеток, линейные депозиты, состоящие из иммуноглобулинов класса G и M, C3-, С4-фракций комплемента, которые при СГ располагаются внутри базальных мембран, а не субэпителиально или субэндотелиально, как при системной красной волчанке и постстрептококковом гломерулонефрите.
Степень тяжести поражения легких и почек у больных на разных этапах заболевания различна. В одних случаях преобладает патология почек, в других — поражение легких, в третьих — легочные и почечные изменения одинаково тяжелы. Превалирующая в начале болезни легочная патология может затем смениться более серьезными нарушениями со стороны почек, и наоборот.
Заподозрить СГ можно при детальной оценке клинической картины заболевания: сочетание легочных геморрагий с быстропрогрессирующим гломерулонефритом при отсутствии признаков системного васкулита. Диагноз становится более достоверным, если наряду с характерными клиническими признаками при иммунофлюоресцентном исследовании биоптата почечной ткани на базальных мембранах клубочков выявляются линейные депозиты, включающие иммуноглобулины класса G или М и СЗ-фракцию комплемента. Доказательством аутоиммунного генеза служит обнаружение циркулирующих и фиксированных антител к базальным мембранам почек, перекрестно реагирующих с антигенами базальных мембран легких. Обязательным для подтверждения диагноза является обнаружение в крови антител к клубочковым базальным мембранам [5, 6].
Во всех случаях легочных кровотечений, причину которых установить не удается, следует предполагать СГ, даже если симптомы поражения почек еще отсутствуют. СГ необходимо дифференцировать с гломерулонефри-том, особенно в тех случаях, когда последний в результате уремии может осложняться легочными кровотечениями; с идиопатическим гемосидерозом легких; системной красной волчанкой; болезнью Шенлейна-Геноха; узелковым периартериитом; гранулематозом Веге-
нера; синдромом Черджа-Стросса; криоглобу-линемией; микроскопическим полиангиитом. Иногда это заболевание приходится дифференцировать с милиарным туберкулезом легких, вирусной пневмонией, лептоспирозом, первичными или метастатическими опухолями с поражением почек и легких и т. д.
Прогноз обычно неблагоприятный — смерть наступает в ближайшие 6-12 месяцев от начала болезни при явлениях легочно-сердечной или почечной недостаточности.
В связи с редкостью патологии каждый случай синдрома Гудпасчера представляет большой теоретический и практический интерес.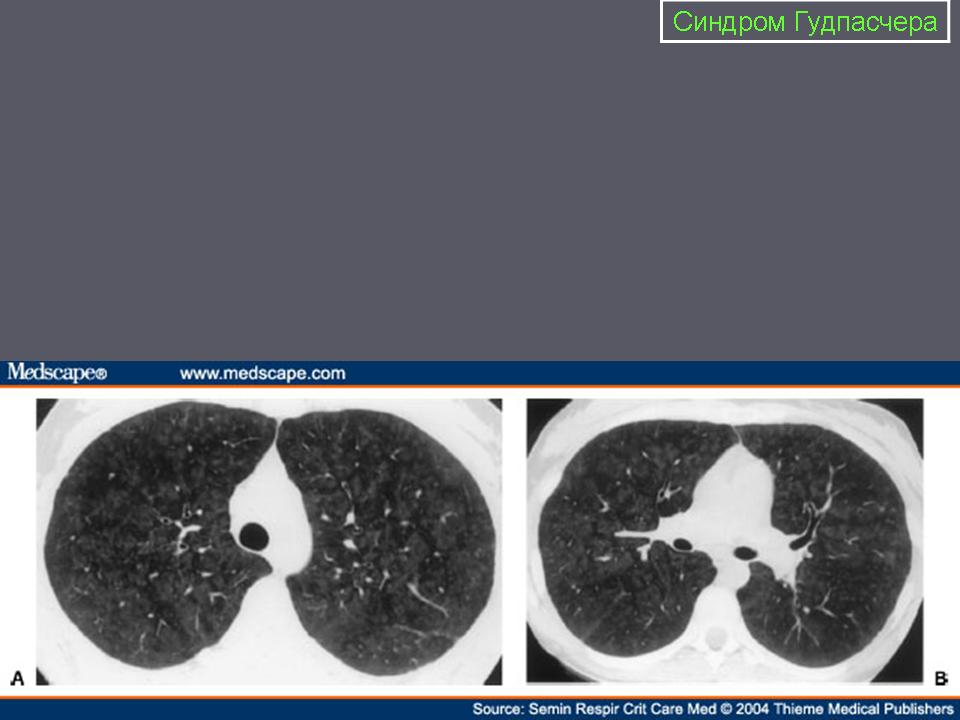 Приводим собственное наблюдение случая синдрома Гудпасчера, который был клинически расценен как полисегментарная бронхопневмония, хронический гломерулонефрит, хрониосепсис.
Приводим собственное наблюдение случая синдрома Гудпасчера, который был клинически расценен как полисегментарная бронхопневмония, хронический гломерулонефрит, хрониосепсис.
Материалы и методы
Данные аутопсии. Для гистологического исследования материал фиксировался в 10% растворе формалина с последующей заливкой в парафин по стандартной методике. Гистологические срезы толщиной 4-5 мкм окрашивались гематоксилином и эозином, пикрофукси-ном по Ван-Гизону, по Циль-Нильсену.
Результаты исследования
Больная Б., 30 лет, в 1992 г. перенесла перелом голени, осложнившийся нагноением раны. Данное состояние протекало с периодическими подъемами температуры до 38 °С. В 1992 г. выставлен и верифицирован данными клинико-лабораторных исследований диагноз: «Хрониосепсис». При дальнейшем обследовании добавлен диагноз: «Хронический гломе-рулонефрит». Больная неоднократно находилась на стационарном лечении с вышеуказанными диагнозами. С декабря 1995 г. состояние больной ухудшилось, при поступлении предъявляла жалобы на резкую слабость, повышение температуры тела до 38 °С, боль в горле, нарастающую одышку, кашель со слизистой, ржавого цвета мокротой. При госпитализации на основании клинико-рентгенологических данных выставлен диагноз: «Двусторонняя септическая пневмония». Несмотря на проводимую противовоспалительную терапию, нарастала интоксикация, одышка до 40 дыханий в минуту. При объективном исследовании: дыхание жесткое, в нижних отделах прослушивались мелкопузырчатые влажные хрипы, появилось кровохарканье, пульс ритмичный, участился до 128 уд./мин, тоны сердца ослаблены. Рентгенологически: справа в верхнее-средних отделах участок выраженной инфильтрации, мелкофокусные очаговые тени сливного характера. Анализ мокроты: цвет — красновато-коричневый, вязкая, микобактерии люминесцентным методом не
Проблемы здоровья и экологии
153
обнаружены. При окраске по Граму: в частых полях зрения грамположительные диплококки, в капсулах — пневмококки. Анализ крови: эритроциты — 2,1*1012/л, гемоглобин — 72 г/л, скорость оседания эритроцитов — 75 мм/ч, лейкоциты — 3,4*109/л, цветной показатель — 1,1. В крови повышенное содержание иммунных комплексов (до 117 усл. ед.), гамма-глобулинов. В моче обнаруживался белок до 2,7 г/л, гематурия (до 30 эритроцитов в поле зрения). Несмотря на проводимое лечение, при явлениях интоксикации и дыхательной недостаточности больная умерла.
При окраске по Граму: в частых полях зрения грамположительные диплококки, в капсулах — пневмококки. Анализ крови: эритроциты — 2,1*1012/л, гемоглобин — 72 г/л, скорость оседания эритроцитов — 75 мм/ч, лейкоциты — 3,4*109/л, цветной показатель — 1,1. В крови повышенное содержание иммунных комплексов (до 117 усл. ед.), гамма-глобулинов. В моче обнаруживался белок до 2,7 г/л, гематурия (до 30 эритроцитов в поле зрения). Несмотря на проводимое лечение, при явлениях интоксикации и дыхательной недостаточности больная умерла.
Данные патологоанатомического исследования
Труп женщины молодого возраста, пониженного питания. При осмотре кожных покровов на переднее-боковой поверхности правой голени определяются старые посттравматические рубцы с изъязвленными краями. В сердечной сумке 50 мл прозрачной соломенного цвета жидкости, в плевральных полостях около 100 мл аналогичного содержимого. Легкие значительно увеличены в объеме, мясистые на ощупь. Масса правого легкого: 1580 г; левого: 1270 г. На висцеральном и париетальном плевральных листках нитевидные фибринозные наложения. Под плеврой множественные кровоизлияния. На разрезе ткань во всех отделах легких серо-красного цвета с кровоизлияниями, зернистая, с поверхности при надавливании стекает пенистая кровянистая жидкость. В просветах бронхов умеренное количество вязкой тягучей мокроты «ржавого» цвета. Сердце размерами 11×9*6 см, в его полостях
Рисунок 1 — Гистологическая картина в легком при синдроме Гудпасчера.
Окраска: гематоксилином и эозином. Увеличение: 200*
Сердце — межмышечный отек. Селезенка с явлениями капиллярита с очагами некроза, лимфоретикулярной гиперплазией с редукцией
темно-красная жидкая кровь. Миокард дряблый, тусклый, толщина стенки левого желудочка — 1,4 см, правого — 0,4 см. Печень — 28*20*15*9 см, коричнево-желтого цвета, тусклая, дряблая. Почки: правая — 13*6*5,5 см, масса — 210 г, левая — 12*7*5,5 см, вес — 220 г, фиброзная капсула снимается легко, поверхность — мелкозернистая. Корковый слой широкий, желтовато-серый, тусклый, с мелкоточечными кровоизлияниями, мозговой — серокрасный, граница между слоями четкая. Слизистая оболочка мочевых путей обычная. Селезенка — 13*8*4 см, масса — 190 г, на разрезе серокрасная, пульпа дает обильный соскоб.
Миокард дряблый, тусклый, толщина стенки левого желудочка — 1,4 см, правого — 0,4 см. Печень — 28*20*15*9 см, коричнево-желтого цвета, тусклая, дряблая. Почки: правая — 13*6*5,5 см, масса — 210 г, левая — 12*7*5,5 см, вес — 220 г, фиброзная капсула снимается легко, поверхность — мелкозернистая. Корковый слой широкий, желтовато-серый, тусклый, с мелкоточечными кровоизлияниями, мозговой — серокрасный, граница между слоями четкая. Слизистая оболочка мочевых путей обычная. Селезенка — 13*8*4 см, масса — 190 г, на разрезе серокрасная, пульпа дает обильный соскоб.
При гистологическом исследовании в легких выявлены следующие изменения: в просветах альвеол большое количество эритроцитов, обилие гемосидерофагов; определяются очаги некрозов, отдельные фокусы сливной гнойно-некротической пневмонии. Альвеолярные перегородки резко утолщены, склеро-зированы, с незначительной лимфоидной инфильтрацией. Капилляры с резко утолщенными стенками, эндотелий их набухший, просвет не определяется. В просветах бронхов эритроциты, гемосидерофаги (рисунок 1).
В клубочках почек при гистологическом исследовании картина экстра- и интракапи-лярного гломерулонефрита. В части их преобладают явления склероза и гиалиноза разной степени. Вокруг некоторых гиалинизирован-ных клубочков и артериол инфильтраты из лимфоидных, плазматических клеток и гистиоцитов. Дистрофия эпителия канальцев вплоть до некроза (рисунок 2).
Рисунок 2 — Экстракапиллярный гломерулонефрит при синдроме Гудпасчера.
Окраска: ШИК реакция. Увеличение: 1000*
лимфатических фолликулов. В печени отмечалось полнокровие сосудов, паренхиматозная белковая и жировая дистрофия гепатоцитов.
Проблемы здоровья и экологии
154
Заключение
На основании вышеизложенных данных аутопсии с последующим микроскопическим исследованием гистологических препаратов органов и тканей больной был выставлен следующий патологоанатомический диагноз: «Синдром Гуд-пасчера (геморрагический пневмо-ренальный синдром): двусторонняя геморрагическая пневмония с распространенным альвеолитом; гемосидероз легких вследствие диффузного капилярита; интерстициальный фиброз; пролиферативный гломерулонефрит. Гипохромная анемия. Двусторонний гидроторакс. Паренхиматозная дистрофия миокарда, печени. Гиперплазия селезенки. Застойное полнокровие внутренних органов». Смерть больной наступила в результате острой почечной и легочно-сердечной недостаточности.
Гипохромная анемия. Двусторонний гидроторакс. Паренхиматозная дистрофия миокарда, печени. Гиперплазия селезенки. Застойное полнокровие внутренних органов». Смерть больной наступила в результате острой почечной и легочно-сердечной недостаточности.
Таким образом, приведенный случай указывает на сложность диагностики СГ, требующего тщательной дифференциации с ря-
дом других заболеваний, сопровождающихся геморрагическим легочно-почечным синдромом. Вовремя начатое адекватное лечение значительно улучшает прогноз пациентов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Ярыгин, Н. Е. Системные аллергические васкулиты / Н. Е. Ярыгин, В. А. Насонова, Р. Н. Потехина. — М.: Медицина, 1980. — 328 с.
2. Справочник по нефрологии / Под ред. И. Е.Тареевой, Н. А. Мухина. — М.: Медицина, 1986. — 432 с.
3. Козырь, В. И. Синдром Гудпасчера и ошибки в диагностике / В. И. Козырь // Клиническая медицина. — 1987. — № 10. — С. 136-138.
4. Синдром Гудпасчера как причина легочных геморрагий / А. Г. Киргинцев [и др.] // Проблемы туберкулеза. — 2000. — № 1. — С. 43-45.
5. Мостовой, Ю. М. Синдром Гудпасчера / Ю. М. Мостовой, А. В. Демчук // Здоров’я Украши. — 2008. — № 3/1. — С. 56-57.
6. Богомолов, Д. В. Врачебная ошибка. Нераспознанный в клинике синдром Гудпасчера (наблюдение из практики) / Д. В. Богомолов, И. А. Пешкова, А. Б. Шорников // Биомедицинский журнал Медлайн.Ру. — 2003. — Т. 4. — С. 41.
Поступила 05.03.2012
Лечение синдрома Гудпасчера в Израиле
Лечение синдрома Гудпасчера в Израиле проводят высококвалифицированные специалисты, каждый из которых прошел длительное обучение и прекрасно знаком со всеми тонкостями диагностики и терапии данного аутоиммунного заболевания. Принимая во внимание агрессивный характер синдрома и тяжесть причиняемых им последствий, израильские специалисты проводят обследование в сжатые сроки и начинают лечение пациента уже через три-четыре дня после обращения в клинику.
Принимая во внимание агрессивный характер синдрома и тяжесть причиняемых им последствий, израильские специалисты проводят обследование в сжатые сроки и начинают лечение пациента уже через три-четыре дня после обращения в клинику.
Врачи центра Топ Ассута используют для терапии синдрома такие высокоэффективные методики, как медикаментозное лечение иммуносупрессантами, моноклональными антителами, плазмаферез на современном оборудовании. Благодаря применению комплексного подхода, нашим специалистам за короткий срок удается обеспечивать высокие показатели излечения.
Методы лечения синдрома Гудпасчера в Израиле
Данный синдром является достаточно редким аутоиммунным заболеванием, при котором антитела разрушают ткани легких и почек, что приводит к возникновению кровотечений. Синдром может развиваться чрезвычайно быстро и приводить к тяжелым поражениям почек и легких, поэтому лечение следует начинать как можно раньше. Методы лечения синдрома Гудпасчера в Израиле включают такие эффективные мероприятия, как терапия цитостатиками и кортикостероидными препаратами, моноклональными антителами, плазмаферез.
Для предотвращения формирования новых патологических антител применяется иммуносупрессивная терапия с использованием алкилирующих цитостатиков и кортикостероидов. Также определенные успехи наблюдаются при назначении иммуносупрессантов из группы ингибиторов биосинтеза пурина (последний необходим для продукции ДНК и РНК, в частности ДНК и РНК лейкоцитов).
Новым методом терапии данного синдрома является применение моноклональных антител. Действие препаратов основано на способности избирательно присоединяться к белкам CD20, которыми богата поверхность В-лимфоцитов, и угнетать таким образом их активность. Использование данных средств позволяет полностью обновить популяцию лимфоцитов и остановить разрушительное воздействие антител на ткани легких.
Плазмаферез – это процедура, при которой кровь пациента очищается от компонентов, провоцирующих патологический процесс (они содержатся в плазме). Плазмаферез абсолютно безопасен и позволяет быстро удалить циркулирующие в кровеносной системе антитела.
Плазмаферез абсолютно безопасен и позволяет быстро удалить циркулирующие в кровеносной системе антитела.
Лечение синдрома Гудпасчера без операции в Израиле весьма эффективно — согласно накопленной статистике, пятилетняя выживаемость пациентов после пройденной терапии составляет 80% и выше. Прекрасное свидетельство того, каким результативным является лечение синдрома Гудпасчера в Израиле, — отзывы людей, которые уже избавились от недуга.
Получить цены
Диагностика синдрома Гудпасчера в Израиле
Всестороннее обследование в клинике Топ Ассута проводится в кратчайшие сроки (не более 3-4 дней) и выполняется с помощью ультраточной, инновационной аппаратуры.
Первый день — встреча с врачом
Начинаются диагностические мероприятия, как правило, в первый же день пребывания пациента в стране. Совместно с личным куратором он едет в клинику Топ Ассута на первичный осмотр, который проводит ведущий специалист.
Второй день — исследования
Еще один день отводится на проведение диагностических мероприятий.
- Физикальный осмотр с исследованием клинических проявлений синдрома.
- Лабораторные анализы мочи, крови и мокроты.
- Иммунологическое исследование.
- Тесты на антитела (особенно цитоплазматические антинейтрофильные антитела).
- Рентгенографическое исследование.
- Ультразвуковое исследование почек.
- Спирография.
- Биопсия почек с последующим анализом тканей и другие.
Третий день — коллегиальное решение
Заканчивает диагностическую программу медицинский консилиум — комиссия, которую собирает лечащий врач. Специалисты анализируют результаты исследований и выбирают наиболее подходящий метод терапии.
Лечение синдрома Гудпасчера в Израиле — стоимость
Если перечислять все преимущества, которыми отличается лечение синдрома Гудпасчера в Израиле, цены следует упомянуть не в последнюю очередь. При сопоставлении сумм в прайсах тут можно сэкономить не менее 35-45% средств по сравнению с больницами Великобритании, Швейцарии, Австрии, Канады, США или Германии. Высокая доступность медицинских услуг — одна из характерных черт системы здравоохранения Израиля.
Высокая доступность медицинских услуг — одна из характерных черт системы здравоохранения Израиля.
Преимущества Топ Ассута
- Специалисты клиники обладают колоссальным опытом в терапии аутоиммунных заболеваний. Многие наши врачи без преувеличения являются экспертами мирового уровня, к мнению которых прислушиваются медики из разных стран.
- Заболевание отличается нетривиальной диагностикой, требует от специалиста не только большого опыта, но и владения современными методами проведения исследований. Врачи для выявления данного синдрома применяют самые эффективные способы — лабораторные анализы, ультразвуковое и рентгенографическое исследования, биопсию и др. Диагностика синдрома Гудпасчера в Израиле выполняется в течение трех-четырех дней.
- Терапия проводится с применением современных установок для плазмафереза, эффективных и безопасных иммуномодулирующих препаратов и моноклональных антител.
- Пациенты, которые проходят лечение в стационаре, проживают в комфортных одно- и двухместных палатах, оснащенных всем необходимым.
- Решить любые возникающие вопросы пациентам помогает персональный куратор-переводчик.
- 5
- 4
- 3
- 2
- 1
Синдром Гудпасчера
Синдром Гудпасчера — системный капиллярит с преимущественным поражением альвеол легких и базальных мембран гломерулярного аппарата почек по типу геморрагических пневмонита и гломерулонефрита. Заболевают чаще мужчины в возрасте 20-30 лет (зафиксировано заболевание и в более раннем возрасте — 16 лет).
Есть теория о наследственности болезни.
Этиология и патогенез
Факторы возникновения заболевания неизвестны, однако отмечается связь с вирусной и бактериальной инфекцией, переохлаждением, приёмом лекарственных препаратов (пенициллинамин и карбимазол). Первое описания болезни сделал американский врач и патофизиолог Э.У.Гудпасчер (E. W.Goodpasture) (1886–1960) во время эпидемии гриппа в 1919 году у 18-летнего юноши, у которого через месяц после перенесённого гриппа развились поражение почек в виде нефрита и пневмония, сопровождавшаяся кровохарканьем. Обсуждается аутоиммунный механизм развития, поскольку обнаружены циркулирующие и фиксированные антитела к базальным мембранам почек, перекрестно реагирующие с антигенами базальных мембран лёгких.
W.Goodpasture) (1886–1960) во время эпидемии гриппа в 1919 году у 18-летнего юноши, у которого через месяц после перенесённого гриппа развились поражение почек в виде нефрита и пневмония, сопровождавшаяся кровохарканьем. Обсуждается аутоиммунный механизм развития, поскольку обнаружены циркулирующие и фиксированные антитела к базальным мембранам почек, перекрестно реагирующие с антигенами базальных мембран лёгких.
Клиника
Выделяют три варианта течения синдрома Гудпасчера:
- Злокачественный вариант характеризуется рецидивирующей геморрагической пневмонией и быстро прогрессирующим гломерулонефритом.
- С более медленным развитием изменений в почках и лёгких.
- С преобладанием прогрессирующего гломерулонефрита и быстрым развитием почечной недостаточности.
Начало острое с высокой лихорадкой, кровохарканьем или легочным кровотечением, одышкой. При прослушивании отмечается обилие звонких влажных хрипов в средних и нижних отделах лёгких, рентгенологически — множественные очаговые или сливные затемнения в обоих легочных полях. Тяжелый, прогрессирующий гломерулонефрит развивается почти одновременно, быстро приводя к почечной недостаточности. Повторные кровохарканье и потеря крови с мочой ведут, как правило, к анемии, усугубляющейся при почечной недостаточности. При лабораторном исследовании: анемия, увеличение количества лейкоцитов в крови и повышенная СОЭ. Характерным иммунологическим признаком болезни является наличие антител к базальным мембранам почки. Прогноз обычно неблагоприятен — смерть наступает в течение 12 месяцев от начала болезни при явлениях лёгочно-сердечной или почечной недостаточности. Также имели место случаи с быстрым прогрессированием заболевания. Стадии от лихорадки до предсмертного состояния проходили в течение недели.
При замедлении или улучшении состояния пациента следует терапия Метилпреднизолоном 12мг/сут. И дальнейшее наблюдение в нефроцентре или у врача нефролога, по месту жительства.
Лечение
Своевременная диагностика и ликвидация причинного фактора(рибавирин)Кортикостероиды в больших дозах (Бетаметазон до 100 мг/сут) в сочетании с цитостатическими препаратами (азатиоприн по 150—200 мг/сут) при условии рано начатого лечения могут замедлить прогрессирование. При анемии: препараты эритропоэтина, колонио-стимулирующие факторы. Описано успешное применение плазмафереза в сочетании с иммуносупрессивной терапией.
Антитела к базальной мембране клубочков почек IgG (анти-БМК, Glomerular Basement Membrane IgG antibody, anti-GBM)
Метод определения Иммуноанализ (ELISA)
Исследуемый материал Сыворотка крови
Тест, использующийся в диагностике синдрома Гудпасчера.
Болезни, ассоциированные с этим видом антител, являются редко встречающимися аутоиммунными заболеваниями, при которых иммунитет направлен против нормальных компонентов базальной мембраны клубочков почек и альвеолярного эпителия. Основной антигенной мишенью для антител данного типа являются альфа-3 цепи NC1 домена коллагена IV типа, присутствующего в почках, лёгких, хрусталике, мозге и яичках, но, очевидно, более доступного на уровне клубочков почек вследствие уникальных особенностей их строения.
Легочные проявления заболевания могут быть ассоциированы с воздействием факторов, нарушающих целостность альвеолярного эпителия (курение, воздействие других вдыхаемых токсических веществ, респираторные инфекции). В результате стимуляции под действием антител местного иммунопатологического процесса развиваются клинические проявления, включающие патологию почек, вплоть до быстро прогрессирующего гломерулонефрита, лёгочные кровотечения, признаки системной патологии.
Сочетание гломерулонефрита и геморрагического альвеолита (почечно-лёгочный синдром) носит наименование синдрома Гудпасчера. Заболевание несёт признаки генетической предрасположенности, частота данной патологии выше среди мужчин. Раннее обследование является крайне важным для назначения адекватного лечения и прогноза заболевания. Выявление антител к базальной мембране является диагностическим и позволяет дифференцировать ассоциированную с ними патологию от других причин легочных кровотечений и гломерулонефрита.
В трети случаев у пациентов выявляются также антитела к цитоплазме нейтрофилов (ANCA, тест № 970).
Заболевание несёт признаки генетической предрасположенности, частота данной патологии выше среди мужчин. Раннее обследование является крайне важным для назначения адекватного лечения и прогноза заболевания. Выявление антител к базальной мембране является диагностическим и позволяет дифференцировать ассоциированную с ними патологию от других причин легочных кровотечений и гломерулонефрита.
В трети случаев у пациентов выявляются также антитела к цитоплазме нейтрофилов (ANCA, тест № 970).
ИЦ РИОР
Синдром Гудпасчера (СГ) – аутоиммунное заболевание, проявляющееся клиникой быстро прогрессирующего гломерулонефрита и поражением легких (геморрагическим пульмонитом) с рецидивами легочного кровотечения (кровохарканья). Описан впервые патологом Э. Гудпасчером в 1919 г., наблюдавшим случай летального исхода у юноши 18 лет через 6 недель после гриппа и проявлявшегося двусторонними легочными инфильтратами, рецидивами кровохарканья, анемией, диффузным некрозом альвеол и пролиферативным нефритом. СГ болеют чаще мужчины в возрасте до 40 лет и люди старше 60 лет (как мужчины, так и женщины). СГ относится к редким заболеваниям, его частота у взрослых колеблется от 0,5 до 1 на 1 млн в год, у детей заболевание наблюдается еще реже [8], хотя И.А.Зборовская склонна связывать редкость данной патологии с трудностью диагностики (2013). В мировой литературе описано 280, а в отечественной медицине – 21 случай этого заболевания (8 у женщин и 13 у мужчин) [5].
У большинства больных заболеванию предшествует вирусная инфекция (ОРВИ), генетическая предрасположенность (HLA DRW2). Α3-цепь коллагена ІV типа является основной мишенью антител к базальной мембране клубочков почек. Поэтому возможны мутации в кодирующем ее гене (антигены НLA класса DR: HLA-DR15HLA-DR4. HLA-DRB1-15) [4, 11, 12, 14]. Обсуждается роль бактерий как пускового фактора СГ [2, 11]. Это связано с наличием общих антигенов на базальных мембранах капилляров клубочков, альвеол легких и на клеточных структурах бактерий.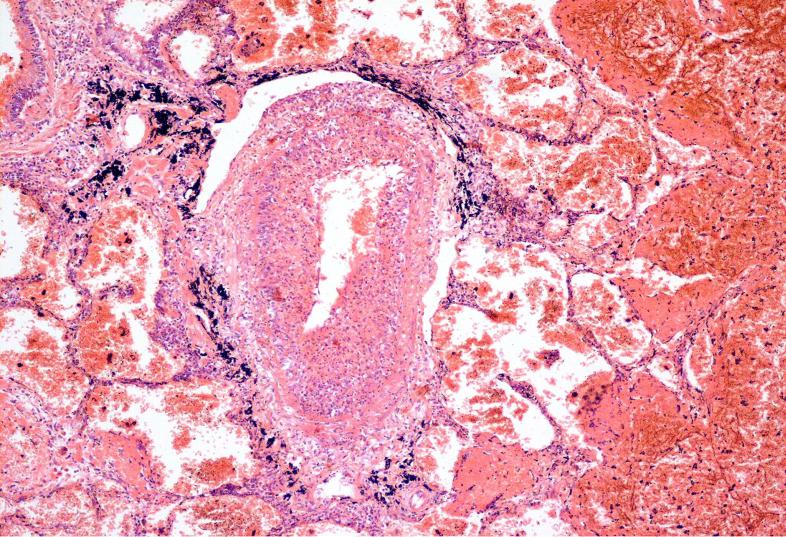 При попадании патогенного микроорганизма в организм человека на него вырабатываются перекрестно реагирующие антитела, повреждающие не только инфекционный агент, но и собственные структуры организма. При этом происходит повреждение базальных мембран альвеол и клубочков почек, что обусловлено их структурной связанностью с α3-цепями коллагена, облегчающими доступ антител извне [13, 15]. Развивается иммуно-воспалительное поражение капилляров почек и легких, протекающее с развитием гломерулонефрита и геморрагического пульмонита. В качестве триггеров могут выступать термические (переохлаждение), химические (углеводороды, бензин, кокаин, пары лаков, органические растворители), лекарственные вещества, некоторые медицинские манипуляции (ударно-волновая литотрипсия) [11]. Ревматологи относят СГ к системным васкулитам и обозначают как «геморрагический легочно-почечный синдром», «геморрагическая пневмония с гломерулонефритом», «идиопатический гемосидероз легких с нефритом» [9], системный васкулит или капиллярит [3].
При попадании патогенного микроорганизма в организм человека на него вырабатываются перекрестно реагирующие антитела, повреждающие не только инфекционный агент, но и собственные структуры организма. При этом происходит повреждение базальных мембран альвеол и клубочков почек, что обусловлено их структурной связанностью с α3-цепями коллагена, облегчающими доступ антител извне [13, 15]. Развивается иммуно-воспалительное поражение капилляров почек и легких, протекающее с развитием гломерулонефрита и геморрагического пульмонита. В качестве триггеров могут выступать термические (переохлаждение), химические (углеводороды, бензин, кокаин, пары лаков, органические растворители), лекарственные вещества, некоторые медицинские манипуляции (ударно-волновая литотрипсия) [11]. Ревматологи относят СГ к системным васкулитам и обозначают как «геморрагический легочно-почечный синдром», «геморрагическая пневмония с гломерулонефритом», «идиопатический гемосидероз легких с нефритом» [9], системный васкулит или капиллярит [3].
Аутоиммунная теория СГ подтверждается результатами иммунофлюоресцентного и электронно-микроскопического исследования, выявляющими линейный характер отложений депозитов на базальных мембранах легких и клубочков почек. Для этого заболевания характерно повышение в крови больных титра антител к базальной мембране клубочков почек [5, 6]. Поражение почек при СГ морфологически представлено картиной фокального некротизирующего гломерулонефрита, переходящего в диффузный нефрит и быстро приводящего к терминальной почечной недостаточности [11]. Поражение легких проявляется воспалением венул, артериол и капилляров с выраженными явлениями деструкции (кровотечения) и пролиферации [11]. Наряду с легочными кровотечениями возможно поражение легких по типу фиброзирующего альвеолита, интерстициальной пневмонии с фиброзом, что ведёт к тяжелой дыхательной недостаточности.
Клиника СГ разнообразна. Часто поражение почек и легких происходит одновременно, но преобладает тяжесть поражения легких, и тогда первыми симптомами болезни являются кашель и кровохарканье (встречается в 70% случаев) [7]. Выраженность кровохарканья не коррелирует с тяжестью кровотечения: наряду с проникновением крови в альвеолы происходит кровоизлияние в интерстициальную ткань легких. Развивается дыхательная недостаточность с одышкой, диффузным цианозом и нарушением сознания вследствие гипоксемии. Повторяющиеся легочные кровопотери приводят к развитию анемии, которая является довольно ранним признаком СГ. Аускультативными феноменами в этот период являются крепитация в базальных отделах, а по мере нарастания альвеолярного кровотечения – и в верхних отделах легких. Могут выслушиваться влажные хрипы, дыхание с бронхиальным оттенком [7]. Рентгенологические признаки СГ представлены двусторонними симметричными очаговыми тенями или обширными инфильтратами в базальных и центральных отделах легких, имеющими преходящий характер и спонтанно исчезающими в течение 48 часов. При присоединении отека легких или вторичной бактериальной пневмонии данные изменения сохраняются значительное время [7, 8].
Выраженность кровохарканья не коррелирует с тяжестью кровотечения: наряду с проникновением крови в альвеолы происходит кровоизлияние в интерстициальную ткань легких. Развивается дыхательная недостаточность с одышкой, диффузным цианозом и нарушением сознания вследствие гипоксемии. Повторяющиеся легочные кровопотери приводят к развитию анемии, которая является довольно ранним признаком СГ. Аускультативными феноменами в этот период являются крепитация в базальных отделах, а по мере нарастания альвеолярного кровотечения – и в верхних отделах легких. Могут выслушиваться влажные хрипы, дыхание с бронхиальным оттенком [7]. Рентгенологические признаки СГ представлены двусторонними симметричными очаговыми тенями или обширными инфильтратами в базальных и центральных отделах легких, имеющими преходящий характер и спонтанно исчезающими в течение 48 часов. При присоединении отека легких или вторичной бактериальной пневмонии данные изменения сохраняются значительное время [7, 8].
Поражение почек проявляется обычно через несколько недель после поражения легких. Но может иметь и изолированный характер. Быстро нарастают признаки почечной недостаточности: повышаются показатели креатинина, мочевины крови до терминальных цифр, микро- или макрогематурия, умеренная протеинурия, олигурия, иногда анурия. Артериальное давление может оставаться в пределах нормы, но при присоединении терминальной почечной недостаточности наблюдается артериальная гипертензия [11]. В редких случаях происходит потеря слуха на одно ухо и значительное быстрое снижение зрения [6, 16]. И.А.Зборовская (2013) считает, что течение СГ очень вариабельно и выделяет 3 варианта течения данного заболевания:
- Первый вариант характеризуется рецидивирующей геморрагической пневмонией и признаками диффузного гломерулонефрита. Диагностика основывается на сочетании симптомов кровохарканья или легочного кровотечения с протеинурией и гематурией, при этом у половины больных выявляется и цилиндрурия. Отеки и артериальная гипертензия обычно отсутствуют.
 Заболевание прогрессирует быстро. Больные погибают от почечной, реже, дыхательной, недостаточности.
Заболевание прогрессирует быстро. Больные погибают от почечной, реже, дыхательной, недостаточности. - Второй вариант характеризуется медленным прогрессирующим течением с изменениями в легких и почках. Степень выраженности легочных симптомов варьирует у одного и того же больного – от минимальных до очень выраженных. Патология почек обычно регистрируется в более поздние сроки и проявляется небольшой протеинурией и скудным мочевым осадком. В последующем развивается картина диффузного гломерулонефрита с почечной недостаточностью.
- Третий вариант СГ от начала до конца протекает с преобладанием в клинической картине диффузного гломерулонефрита. Патология легких может выявляться лишь в финале заболевания, и не всегда имеются симптомы кровохарканья или легочного кровотечения.
В клиническом анализе крови имеются признаки железодефицитной анемии (снижение уровня гемоглобина, количества эритроцитов, гипохромия, анизоцитоз, пойкилоцитоз), могут быть лейкоцитоз и значительное ускорение СОЭ [7]. В общем анализе мочи обнаруживается белок более 1 г/л, эритроциты, цилиндры гиалиновые, зернистые, эритроцитарные, иногда выявляется пиурия. По мере прогрессирования почечной недостаточности снижаются удельный вес мочи и скорость клубочковой фильтрации. При биохимических исследованиях крови отмечается повышение креатинина и мочевины, мочевой кислоты, калия, снижение сывороточного железа, может быть артериальная гипоксемия. При исследовании мокроты обнаруживаются эритроциты, сидерофаги [7, 10]. Иммунологические исследования методом ИФА выявляют антитела к базальным мембранам более чем у 95% пациентов [14]. При электронно-микроскопическом исследовании биоптатов почек выявляются утолщение и гомогенизация базальных мембран, пролиферация и отек эндотелия, линейные депозиты, располагающиеся внутри базальных мембран [7, 8]. Таким образом, постановка диагноза СГ опирается на сочетание основных проявлений болезни в виде патологии легких и почек, неуклонного прогрессирования с развитием дыхательной и почечной недостаточности, специфической рентгенологической картины, обнаружении антител к базальной мембране капилляров почечных клубочков и легочных альвеол, наличии линейных депозитов JgG и C3-компонента на базальных мембранах клубочков и альвеол и отсутствии других системных проявлений [2, 6].
Дифференциальный диагноз СГ необходимо проводить с заболеваниями, при которых наблюдается легочно-почечный синдром. Это АНЦА-ассоциированные васкулиты, системная красная волчанка, болезнь Шенлейн-Геноха, криоглобулинемический васкулит, ревматоидный васкулит, постстрептококковый гломерулонефрит. Основным диагностическим тестом, позволяющим верифицировать отдельное аутоиммунное заболевание в группе причин легочно-почечного синдрома, является определение специфических аутоантител [8]. Кроме этого необходимо исключить синдром Черджа-Стросса, первичные или метастатические опухоли легких, тромбоэмболию легочной артерии, саркоидоз, уремическое легкое, нарушение гемостаза, баротравму, некоторые инфекции [17].
Диагноз СГ всегда свидетельствует о тяжелом состоянии пациента и необходимости неотложного назначения активной терапии иммуносупрессантами. В былые годы СГ считали фатальным заболеванием, в настоящее время прогноз улучшился в связи с разработкой новых схем лечения [12]. Лечение СГ заключается в применении цитостатиков и глюкокортикоидов в больших дозах в сочетании с сеансами плазмафереза [11]. При возникновении легочных кровотечений проводятся трансфузии свежезамороженной плазмы. При высоких показателях креатинина крови (более 600 мкмоль/л) – гемодиализ. Без активной иммуносупрессивной терапии смертность при СГ очень высока. Применение агрессивной иммунодепрессивной терапии в остром периоде болезни позволило снизить смертность до 10-40%. Таким образом, СГ остается прогностически неблагоприятным заболеванием [10].
По мнению И.Р. Балдановой и соавт. [1] сообщение о каждом случае СГ представляет научный интерес. По ее данным, СГ наиболее часто встречается у мужчин в возрасте 17-40 лет и крайне редко – у пожилых людей. В 75% случаев легочные симптомы предшествуют почечным. Но описаны больные, у которых явления со стороны почек присутствуют с самого начала, поэтому им ставится диагноз гломерулонефрита.
Подобную ситуацию довелось наблюдать автору статьи в 2016 г.
Пациент К., 65 лет, поступил в терапевтическое отделение 21.03. 2016 г. с жалобами на сухой кашель, одышку при умеренной физической нагрузке, повышение температуры до 38,2°С, недомогание, общую слабость. Ухудшение самочувствия в течение 5 дней. Из анамнеза известно, что в 2014 г. после ОРВИ был выставлен диагноз: Хронический нефритический синдром, гематурическая форма. Заболевание протекало с артериальной гипертензией (максимальные цифры артериального давления достигали 220/100 мм рт. ст.), общими отеками и эпизодами макрогематурии.
При поступлении состояние средней тяжести. Умеренно выраженные симметричные отеки стоп, голеней и рук, пастозность и бледность лица. Границы сердца смещены во все стороны на 1,5-2 см. Тоны сердца приглушены, выслушивается короткий систолический шум с эпицентром на аорте. ЧСС 68 в мин. Пульс ритмичный, напряженный. АД 200/100 мм рт. ст. Дыхание жесткое, хрипов нет. ЧДД 23 в мин. Живот несколько увеличен в объеме за счет жировой клетчатки, мягкий, безболезненный. Печень выступает из-под реберной дуги на 2 см, безболезненная при пальпации, размеры ее по Курлову 11×10×9 см. Почки не пальпируются. Симптом поколачивания слабо положителен с обеих сторон.
Проведено обследование. В клиническом анализе крови гемоглобин 74 г/л, эритроцитов 2,86×1012/л, лейкоцитов 14,3×109/л, палочкоядерных нейтрофилов 17%, сегментоядерных – 71%, эозинофилов 0%, моноцитов 4%, лимфоцитов 8%. СОЭ 60 мм/час.
Общий анализ мочи: цвет кровянистый, относительная плотность 1020, белок 11,7 г/л, лейкоциты 25-30 в поле зрения, эритроциты свежие и измененные в большом количестве, цилиндры зернистые 0-1 в поле зрения. Проба Реберга: клубочковая фильтрация 7,6 мл в минуту, канальцевая реабсорбция – 95,6%.
При биохимических исследованиях: общий белок 57 г/л, СРБ – отрицателен, АлАТ 23,3 UE, АсАТ 42,2 UE, креатинин 484 мкмоль/л, мочевина 28,8 ммоль/л, глюкоза 6,34 млмоль/л. Мочевая кислота 741 мкмоль/л.
Мочевая кислота 741 мкмоль/л.
Инструментальное исследование:
Рентгеноскопия органов грудной клетки: легочные поля неравномерно прозрачны за счет наличия в S6и S10 справа неоднородного затемнения с нечеткими неровными контурами. Заключение: правосторонняя сегментарная пневмония (S6, S10).
УЗИ органов брюшной полости: диффузные изменения паренхимы печени по типу жирового гепатоза, умеренная гепатомегалия. Увеличение размеров обеих почек (11,5×6,5см.), диффузные изменения паренхимы, конкремент левой почки размером 1,0 см.
Выставлен клинический диагноз: Внебольничная пневмония с локализацией в S6и S10 справа, средней степени тяжести. Сопутствующее заболевание: хронический гломерулонефрит, смешанная форма. ХБП ІV стадия. Вторичная подагра.
Назначено лечение: дженем 0,5 на физ. растворе 2 раза в сутки, дексазон 8/мг в сутки, декстразон, декстполиглюкин 500 мл, глюкоза с калием и магнием внутривенно капельно, альбумин, нитроглицерин, АЦЦ, ортофен, увлажненный кислород, клофелин, эналаприл.
На третьи сутки пребывания в стационаре у больного при кашле стала выделяться мокрота, окрашенная алой кровью. В экстренном порядке проведена бронхоскопия. После эвакуации содержимого установлено, что из бронхов 6 и 10 сегментов справа поступает кровь. Все доступные осмотру бронхи свободно проходимы.
Больной переведен в отделение реанимации, где проводилась гемостатическая терапия (эритромасса, свежезамороженная плазма), сеансы плазмафереза, продолжено ведение антибактериальных препаратов, гипотензивных средств, мочегонных и солевых и коллоидных растворов. С 25.03.2016 г. состояние больного несколько улучшилось: прекратилось кровохарканье, уменьшились кашель, отеки и одышка, нормализовалась температура тела. Артериальное давление снизилось до 130/80–150/85 мм рт. ст. Но с 7. 04.2016 г. состояние вновь ухудшилось: возобновились кашель с кровянистой мокротой и одышка, увеличились отеки, стали нарастать тахикардия и артериальная гипертония (пульс 100–108 в мин., АД 190/120–210/120 мм рт. ст.). Прогрессировала легочно-сердечная недостаточность, в результате которой 12.04.2016 г. в 14.50. наступила смерть. Реанимационные мероприятия (непрямой массаж сердца, управляемое дыхание, внутривенное введение атропина, дексазона, бикарбоната натрия и внутрисердечное введение адреналина) не оказали эффекта.
04.2016 г. состояние вновь ухудшилось: возобновились кашель с кровянистой мокротой и одышка, увеличились отеки, стали нарастать тахикардия и артериальная гипертония (пульс 100–108 в мин., АД 190/120–210/120 мм рт. ст.). Прогрессировала легочно-сердечная недостаточность, в результате которой 12.04.2016 г. в 14.50. наступила смерть. Реанимационные мероприятия (непрямой массаж сердца, управляемое дыхание, внутривенное введение атропина, дексазона, бикарбоната натрия и внутрисердечное введение адреналина) не оказали эффекта.
Направлен на вскрытие с диагнозом:
- Внебольничная бактериальная пневмония сегментарная справа (S6,10), тяжелое течение.
- Синдром Гудпасчера?
Фоновое заболевание: Нефротический синдром неуточненный, обострение. Ренальная почечная недостаточность, прогрессирование (артериальная гипертония, азотемия, гипопротеинемия, периферические отеки).
Осложнения: Острое легочное паренхиматозное кровотечение. Острый отек легких. Прогрессирующая легочно-сердечная недостаточность.
Сопутствующие заболевания: Хронический гепатит. Мочекаменная болезнь. Конкремент левой почки. Вторичный хронический пиелонефрит. Вторичная подагра.
Результаты патологоанатомического исследования.
Уремический запах от трупа. Малокровие внутренних органов, жидкость в плевральных полостях справа – 1000 мл, слева – 1200мл, жидкость в перикарде 70 мл. Множественные паренхиматозные кровоизлияния различной давности в легких, гемосидероз, в межальвеолярных перегородках явления капиллярита. Участки некротизирующего альвеолита. Отек легких и головного мозга, бурая индурация и отек легких, мускатная печень с центролобулярными некрозами. Венозное полнокровие и дистрофия почек, конкременты левой почки, вторичный хронический пиелонефрит. Атеросклероз коронарных сосудов (стеноз последних до 30%), мелкоочаговый кардиосклероз.
Морфологическое исследование: в почках явления пролиферативного гломерулонефрита с разрастанием на месте погибших нефронов соединительной ткани и развитием склероза почечных клубочков, местами – некроз сосудистых петель, разрывы базальных мембран.
Патологоанатомический диагноз:
Основное заболевание: Синдром Гудпасчера: множественные паренхиматозные кровоизлияния в легких, отек легких, нефротический синдром (артериальная гипертония, азотемия, гипопротеинемия, анемия).
Осложнения основного заболевания: Застойное венозное полнокровие внутренних органов: бурая индурация и отек легких, мускатная печень с центролобулярными некрозами, венозное полнокровие и дистрофия почек.
Сопутствующие заболевания: Атеросклеротическая болезнь сердца, атеросклероз коронарных артерий, мелкоочаговый кардиосклероз. Мочекаменная болезнь. Конкременты левой почки. Вторичный хронический пиелонефрит. Вторичная подагра (мочевая кислота 741 мкмоль/л.).
Эпикриз: Имеет место совпадение клинического и патологоанатомического диагнозов.
Приведенное клиническое наблюдение свидетельствует о том, что постановка диагноза СГ сложна: приходится опираться на сочетание легочного и почечного синдромов, неуклонное прогрессирование болезни с развитием дыхательной и почечной недостаточности, быстро исчезающие инфильтраты в легких при рентгенологическом исследовании, при возможности – на иммунологического исследования (обнаружение антител к базальным мембранам капилляров почечных клубочков и легочных альвеол), при электронной микроскопии пунктатов – наличие линейных депозитов на базальных мембранах капилляров клубочков почек и альвеол. Очень важным дифференциальным признаком является отсутствие других системных проявлений, характерных для гранулематоза Вегенера, болезни Шенлейн-Геноха, системной красной волчанки и др. Описанное наблюдение имеет свои особенности. Это третий, наиболее редкий, вариант СГ по И.А.Зборовской [3]. Его отличало весьма продолжительное течение (около трех лет с момента заболевания), пожилой возраст пациента, дебют – с поражения почек и присоединение легочного синдрома только в исходе болезни.
НЕОБЫЧНОЕ ТЕЧЕНИЕ СИНДРОМА ГУДПАСЧЕРА У ПОЖИЛОГО ПАЦИЕНТА (СЛУЧАЙ ИЗ ПРАКТИКИ) | Круглякова
1. Балданова И.Р., Зубкова Л.Л., Борхонова И.В., Эрдынеева Э.Б. Клинико-анатомическое наблюдение редких случаев из практики // Вестник Бурятского государственного университета. 2010. №12. С.119-123.
Балданова И.Р., Зубкова Л.Л., Борхонова И.В., Эрдынеева Э.Б. Клинико-анатомическое наблюдение редких случаев из практики // Вестник Бурятского государственного университета. 2010. №12. С.119-123.
2. Дудов Т.Р., Бородина Л.В., Ягода А.В., Корой П.В. Синдром Гудпасчера // Вестник молодого ученого. 2017. №4(19). С.17-24.
3. Зборовская И.А. Синдром Гудпасчера: URL: http://visualrheumatology.ru/sindrom-gudpaschera.hml
4. Казаков С.П., Моруга Р.А. Синдром Гудпасчера: алгоритм лабораторной диагностики. URL: https://internist.ru/video/detail/26317/
5. Мостовой Ю.М., Демчук А.В. Гудпасчера синдром. URL: https://radiomed.ru/publications/sindrom-gudpaschera-sindrom
6. Мухин Н.А. Синдром Гудпасчера: патогенез, диагностика, лечение // Фарматека. 2011. №18. С.8-14.
7. Нефрология. Клинические рекомендации / под ред. Е.М.Шилова, А.В.Смирнова, Н.Л.Козловской. М.: ГЭОТАР-Медиа, 2016. С.227-234.
8. Овсянников Д.Ю., Волков М.Ю., Гитинов Ш.А., Глазырина А.А., Рогаткин П.С., Горбунов А.В., Марченков Я.В., Колтунов И.Е. Синдром Гудпасчера в детском возрасте: обзор литературы и клиническое наблюдение // Трудный пациент. 2015. Т.13, №8-9. С.45-48.
9. Синдром Гудпасчера: URL: http://www.krasotaimedicina.ru/diseases/rheumatology/goodpasture-syndrome
10. Шалыга И.Ф., Мартемьянова Л.А., Конопляник О. В. Синдром Гудпасчера (случай из клинической практики) // Проблемы здоровья и экологии. 2012. №1(31). С.150-154.
В. Синдром Гудпасчера (случай из клинической практики) // Проблемы здоровья и экологии. 2012. №1(31). С.150-154.
11. Шилов Е.М., Козловская Н.Л., Коротчаева Ю.В. Клинические рекомендации по диагностике и лечению быстропрогрессирующего гломерулонефрита (экстракапиллярного гломерулонефрита с полулуниями) // Нефрология. 2015. T.19, №6. С.73-82.
12. Bayat A., Kamperis K., Herlin T. Characteristics and outcome of Goodpasture’s disease in children // Clin. Rheumatol. 2012. Vol.31, №12. P.1745-1751. doi: https://doi.org/10.1007/s10067-012-2062-9
13. Cui Z., Zhao M.H. Advances in human antiglomerular basement membrane disease // Nat. Ren. Nephr. 2011. Vol.7, №12. Р.697-705. doi: 10.1038/nrneph.2011.89
14. Greco A., Rizzo M.I., De Virgilio A., Gallo A., Fusconi M., Pagliuca G., Martellucci S., Turchetta R., Longo L., De Vincentiis M. Goodpasture’s syndrome: A clinical update // Autoimmun. Rev. 2014. Vol.14, №3. Р.246-253. doi: 10.1016/j.autrev.2014.11.006
15. Ohlsson S., Herlitz H., Lundberg S., Selga D., Mölne J., Wieslander J., Segelmark M. Circulating anti-glomerular basement membrane antibodies with predominance of subclass igg4 and falce-negative immunoassay test results in anti-glomerular basement membrane disease // Am. J. Kidney Dis. 2014. Vol.63, №2. Р.289-293. doi: 10.1053/j.ajkd.2013.08.032
16. Touzot V., Poisson J., Faguer S., Ribes D., Cohen P., Geffray L., Anguel N., François H., Karras A., Cacoub P., Durrbach A. Rituximab in anti-GBM disease: a retrospective study of 8 patients // J. Autoimmun. 2015. Vol.60. Р.74-79. doi: 10.1016/j.jaut.2015.04.003
2015. Vol.60. Р.74-79. doi: 10.1016/j.jaut.2015.04.003
17. West S.C., Arulkumaran N., Ind P.W., Pusey C.D. Pulmonary-renal syndrome: a life threatening but treatable condition // Postgrad. Med. J. 2013. Vоl.89, №1051. Р.274-283. doi: 10.1136/postgradmedj-2012-131416
Синдром Гудпасчера | Johns Hopkins Medicine
Что такое синдром Гудпасчера?
Синдром Гудпасчера — это группа острых заболеваний, поражающих легкие и почки. Это связано с аутоиммунным заболеванием. Обычно иммунная система вырабатывает антитела для борьбы с микробами. Но при синдроме Гудпасчера иммунная система по ошибке вырабатывает антитела, которые атакуют легкие и почки. Это состояние может быстро прогрессировать до воспаления почек (гломерулонефрит) и почечной недостаточности.Это может привести к летальному исходу, если быстро не диагностировать и не лечить.
Это заболевание чаще всего встречается у людей в возрасте от 20 до 30 или старше 60 лет. Чаще встречается у мужчин. В некоторых случаях может возникнуть легкое кровотечение. В большинстве случаев это заболевание не вызывает длительного поражения легких. Но повреждение почек может длиться долго. При отказе почек может потребоваться трансплантация почки или диализ.
Что вызывает синдром Гудпасчера?
Медицинские эксперты не уверены, что вызывает это заболевание.Он может передаваться в семьях, поэтому генетика может играть роль. Или заболевание может возникнуть из-за сочетания других факторов. К ним относятся воздействие определенных химических веществ, таких как химические чистящие средства или паракват, убивающий сорняки. Вирусные инфекции, курение или лекарства также могут иметь значение.
Каковы симптомы синдрома Гудпасчера?
Это наиболее распространенные симптомы синдрома Гудпасчера:
- Недостаток энергии или легкая утомляемость (утомляемость)
- Тошнота
- Проблемы с дыханием
- Бледная кожа
По мере прогрессирования состояния могут возникать другие симптомы, в том числе:
- При кашле с кровью
- Чувство жжения при мочеиспускании
Со временем могут появиться симптомы поражения почек, в том числе:
- Небольшое количество крови в моче (гематурия)
- Белок в моче (протеинурия)
Симптомы синдрома Гудпасчера могут быть похожи на другие заболевания или проблемы со здоровьем. Всегда обращайтесь к своему врачу за диагнозом.
Всегда обращайтесь к своему врачу за диагнозом.
Как диагностируется синдром Гудпасчера?
Ваш лечащий врач изучит вашу историю болезни и проведет медицинский осмотр. Другие тесты включают:
- Анализы крови. Эти тесты предназначены для выявления высокого уровня в крови продуктов жизнедеятельности, которые обычно выводятся почками с мочой. Циркулирующие антитела также обнаруживаются с помощью анализов крови.
- Анализы мочи. Белок может быть обнаружен в моче вместе с эритроцитами и лейкоцитами, а также группами клеток и клеточным материалом, слипшимися (зернистые цилиндры).
- Биопсия почки. Тест, при котором образцы ткани берутся и проверяются под микроскопом.
- Рентген грудной клетки. Это ищет изменения в легких.
Как лечить синдром Гудпасчера?
Ваш лечащий врач подберет для вас лучшее лечение на основе:
- Сколько вам лет
- Общее состояние вашего здоровья и история болезни
- Как вы больны
- Насколько хорошо вы справляетесь с определенными лекарствами, процедурами или терапией
- Ожидаемый срок действия состояния
- Ваше мнение или предпочтение
Лечение может включать:
- Иммунодепрессанты. Эти лекарства не дают вашей иммунной системе вырабатывать антитела. Они также могут повысить риск заражения. Так что вам также могут назначить антибиотики.
- Кортикостероиды. Используется для уменьшения воспаления и повреждения тканей, что помогает контролировать кровотечение в легких.
- Плазмаферез. Это процесс, при котором плазма крови удаляется, очищается от вредных антител, а затем возвращается в ваше тело. Обычно его назначают вместе со стероидами.
Каковы осложнения синдрома Гудпасчера?
Даже при правильном лечении могут развиться осложнения. Ваша функция почек может ухудшиться до почечной недостаточности. Это может потребовать лечения, например диализа или даже пересадки почки.
Ваша функция почек может ухудшиться до почечной недостаточности. Это может потребовать лечения, например диализа или даже пересадки почки.
Когда мне следует позвонить своему врачу?
Если ваши симптомы ухудшатся или у вас появятся новые симптомы, сообщите об этом своему врачу.Основные сведения о синдроме Гудпасчера
- Синдром Гудпасчера — редкое заболевание, при котором организм по ошибке вырабатывает антитела, которые атакуют легкие и почки.
- Чаще всего встречается у людей в возрасте от 20 до 30 лет и старше 60 лет. Чаще встречается у мужчин.
- Это может быть смертельным, если быстро не диагностировать и не лечить.
- При отказе почек может потребоваться диализ или трансплантация почки.
- Лечение направлено на уменьшение выраженности симптомов и предотвращение разрушения вашей иммунной системой ткани почек и легких.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения лечащего врача вашего ребенка:
- Знайте причину визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
- Узнайте, почему прописано новое лекарство или лечение и как они помогут вашему ребенку. Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить состояние вашего ребенка другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
- Если вашему ребенку назначен повторный прием, запишите дату, время и цель этого визита.
- Узнайте, как можно связаться с лечащим врачом вашего ребенка в нерабочее время.
 Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Синдром Гудпасчера: основы практики, история вопроса, патофизиология
Автор
Пранай Катурия, доктор медицины, FACP, FASN, FNKF Профессор медицины, директор отделения нефрологии и гипертонии, программный директор стипендии нефрологии, Школа общественной медицины Университета Оклахомы
Пранай Катурия, доктор медицины, FACP, FASN, FNKF является членом следующих медицинских обществ: Американского колледжа врачей — Американского общества внутренней медицины, Американской кардиологической ассоциации, Американского общества гипертонии, Американского общества нефрологов, Национального фонда почек
Раскрытие информации: не подлежит разглашению.
Соавтор (ы)
Prateek Sanghera, MD Parkland Memorial Hospital
Prateek Sanghera, MD является членом следующих медицинских обществ: Американского колледжа врачей, Американского общества нефрологов
Раскрытие: Ничего не разглашать.
Фрейзер Т. Стивенсон, доктор медицины Адъюнкт-профессор клинической медицины и директор по развитию образования Медицинской школы Дэвиса Калифорнийского университета
Раскрытие информации: не подлежит разглашению.
Сат Шарма, доктор медицины, FRCPC Профессор и руководитель отделения легочной медицины, отделение внутренней медицины, Медицинский факультет Университета Манитобы; Директор отделения респираторной медицины, больница общего профиля Св. Бонифация, Канада
Сат Шарма, доктор медицины, FRCPC является членом следующих медицинских обществ: Американской академии медицины сна, Американского колледжа грудных врачей, Американского колледжа врачей-Американского общества внутренних болезней. Медицина, Американское торакальное общество, Канадская медицинская ассоциация, Королевский колледж врачей и хирургов Канады, Королевское медицинское общество, Общество реаниматологии, Всемирная медицинская ассоциация
Раскрытие информации: не раскрывать.
Главный редактор
Ветихи Батуман, доктор медицины, FASN Хубервальд, профессор медицины, отделение нефрологии и гипертонии, временный председатель, кафедра медицины Деминга, медицинский факультет Тулейнского университета
Вечихи Батуман, доктор медицины, FASN является членом следующих медицинских обществ: Американский колледж врачей, Американское общество гипертонии, Американское общество нефрологов, Международное общество нефрологов, Южное общество клинических исследований
Раскрытие информации: раскрывать нечего.
Благодарности
Элеонора Ледерер, доктор медицины Профессор медицины, руководитель нефрологического отделения, директор программы обучения нефрологии, директор клиники метаболических камней, Программа лечения заболеваний почек, Медицинская школа Университета Луисвилля; Консультант, Госпиталь по делам ветеранов Луисвилля
Элеонора Ледерер, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской федерации медицинских исследований, Американского общества биохимии и молекулярной биологии, Американского общества исследований костей и минералов, Американского общества нефрологов, Американского общества. Общество трансплантологии, Международное общество нефрологов, Медицинская ассоциация Кентукки, Национальный фонд почек и Phi Beta Kappa
Раскрытие информации: Грант Департамента по делам ветеранов / исследовательские фонды Исследования
Джеймс У. Лор, доктор медицины Профессор кафедры внутренней медицины отделения нефрологии, директор программы стипендий, Школа медицины и биомедицинских наук Университета штата Буффало Нью-Йорка
webmd.com»> Джеймс Лор, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Американской кардиологической ассоциации, Американского общества нефрологов и Центрального общества клинических исследованийРаскрытие: Genzyme Honoraria Говорит и преподает
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Мауро Веррелли, доктор медицины, FRCP (C), FACP Доцент, кафедра медицины, отделение нефрологии, Университет Манитобы, Канада
Мауро Веррелли, доктор медицины, FRCP (C), FACP является членом следующих медицинских обществ: Американского колледжа врачей — Американского общества внутренней медицины, Американского общества нефрологов, Канадской медицинской ассоциации и Королевского колледжа врачей и хирургов Канады.
Раскрытие: Ничего не нужно раскрывать.
Синдром Гудпасчера | Национальный фонд почек
Синдром Гудпасчера — необычное аутоиммунное заболевание, поражающее как почки, так и легкие. Аутоиммунное заболевание означает, что иммунная система, которая обычно защищает организм от инфекции, по ошибке атакует здоровые части тела.
Что вызывает болезнь?
Иммунная система организма вырабатывает антитела — белки, которые помогают бороться с инфекциями. Однако при синдроме Гудпасчера организм вырабатывает антитела, которые атакуют и повреждают слизистую оболочку легких и почек.В результате, если у вас есть это заболевание, вы можете начать испытывать усталость, слабость и потерю аппетита. Однако болезнь может быстро прогрессировать, и у вас может появиться кровотечение из легких и кровохарканье. Это также может привести к воспалению почек (гломерулонефриту). Неизвестно, почему ваши антитела начинают атаковать ваши собственные легкие и почки. Факторы, которые могут вызвать заболевание, включают подверженность вирусным инфекциям легких, курение и вдыхание паров органических растворителей.
Однако болезнь может быстро прогрессировать, и у вас может появиться кровотечение из легких и кровохарканье. Это также может привести к воспалению почек (гломерулонефриту). Неизвестно, почему ваши антитела начинают атаковать ваши собственные легкие и почки. Факторы, которые могут вызвать заболевание, включают подверженность вирусным инфекциям легких, курение и вдыхание паров органических растворителей.
Эта проблема чаще всего встречается у людей в возрасте от 20 до 30 или старше 60 лет.Это не заразно и чаще встречается у мужчин и кавказцев. Иногда эти симптомы возникают в результате других заболеваний, таких как красная волчанка или гранулематоз Вегенера.
Какие проблемы могут возникнуть?
Синдром Гудпасчера может вызвать опасное для жизни кровотечение в легких, но обычно не вызывает долговременного повреждения в этой области. Однако вред, нанесенный вашим почкам, может привести к почечной недостаточности. Вам может потребоваться диализ или пересадка почки.Если ваша функция почек нарушена, вы можете:
- бледность и усталость (анемия)
- В моче есть кровь или белок
- страдает от болей в спине ниже ребер
- Чаще ходите в туалет, особенно ночью
- жжение или затруднение при мочеиспускании
- есть отеки кистей и стоп
- испытывает высокое кровяное давление.
- тошнота и рвота
Как диагностируется заболевание?
Существует специальный анализ крови, который может показать, есть ли у вас вредные антитела, атакующие ваши легкие и почки.
Врач также может проверить вашу кровь и мочу, чтобы узнать, есть ли у вас заболевание почек. Анализ мочи может проверить количество белка, крови и других факторов, указывающих на повреждение почек. Анализ крови на креатинин сыворотки можно использовать для расчета скорости клубочковой фильтрации (СКФ), которая показывает, насколько хорошо ваши почки фильтруют отходы из крови.
Ваш врач может также выполнить биопсию почки, чтобы проверить, не повреждена ли ткань почек антителами.
Ваши легкие также могут быть проверены на наличие повреждений с помощью рентгена грудной клетки и биопсии легких.
Какие методы лечения доступны?
Ранняя диагностика и лечение — лучший способ предотвратить повреждение почек. Ваш врач может прописать вам лекарства, которые помогут замедлить работу иммунной системы и предотвратить выработку вредных антител. Вам также могут назначить лекарства для контроля накопления жидкости или высокого кровяного давления. Врач может посоветовать вам пройти специальный процесс фильтрации крови (плазмаферез) для удаления вредных антител.
Чего я могу ожидать в долгосрочной перспективе? Пройдет ли когда-нибудь болезнь?
Обычно ваше тело вырабатывает антитела в течение короткого времени, от нескольких недель до двух лет.Как только это прекратится, у вас больше не должно быть проблем с легкими. Однако ваши почки могут быть слегка или сильно повреждены. Пятилетняя выживаемость составляет 80%. Менее 30% людей нуждаются в длительном диализе.
Нужно ли мне соблюдать особую диету?
Иногда вас просят изменить свой рацион из-за высокого кровяного давления или снижения функции почек. Например, вам может потребоваться контролировать потребление соли, жидкости и белка. Ваш врач, диетолог или другой член вашей медицинской бригады могут помочь вам понять эти изменения.
Чем еще я могу помочь себе?
Очень важно не курить и избегать вторичного дыма. Другие меры, которые могут помочь вам сохранить здоровье, — это упражнения и снижение стресса.
Что произойдет, если у меня откажутся почки?
К сожалению, к тому моменту, когда вы обратитесь к врачу, ваши почки уже могут быть повреждены. Если повреждение серьезное, вам может потребоваться диализ или пересадка почки. Прежде чем вы сможете сделать пересадку, ваш врач убедится, что вредные антитела отсутствуют в вашем организме.Лекарства, принимаемые при трансплантации, также помогают предотвратить выработку иммунной системой вредных антител.
Проводятся ли исследования синдрома Гудпасчера?
Да. В настоящее время существует большой интерес к изучению причин появления вредных антител. Эта работа может привести к появлению новых лекарств, которые будут более полезными.
Проводятся исследования для выявления важных генетических факторов, вызывающих заболевание. Кроме того, исследователи ищут более эффективные способы лечения кровотечения из пораженных легких.
Дата пересмотра: июль 2009 г.
См. Также в этом руководстве от А до Я:
Если вам нужна дополнительная информация, свяжитесь с нами.
© 2015 Национальный фонд почек. Все права защищены. Этот материал не является медицинским советом. Он предназначен только для информационных целей. Проконсультируйтесь с врачом для получения конкретных рекомендаций по лечению.
Гудпастур и его синдром | ACP Госпиталист
Спросите любого студента-медика, какое заболевание поражает легкие и почки, и он или она скорее всего ответит на синдром Гудпасчера.Мы столкнулись со случаем этого увлекательного болезнь в нашей службе внутренней медицины в последнее время.
Синдром Гудпасчера — редкое заболевание, характеризующееся аутоиммунным повреждением легкие и почки, поражая примерно 1 из 1 000 000 во всем мире. Признак синдрома Гудпасчера — это высокий уровень циркулирующих аутоантител IgG к альфа-3 цепь коллагена типа IV, вызывающая реакцию гиперчувствительности 2 типа, которая приводит к повреждению клубочков и альвеол.
Точный стимул для выработки антител не совсем понятен, но в настоящее время
считали, что временное увеличение циркулирующих антител против GBM может произойти после
острая вирусная инфекция. Пристрастие к тканям почек и легких связано с
ограниченное распределение цепи альфа-3, обнаруженное только в альвеолярном и клубочковом основании
мембраны (анти-ГБМ). Обычно для описания синдрома используют синдром Гудпасчера.
поражения легких и почек, в то время как болезнь Гудпасчера используется для описания
только заболевание почек, опосредованное антителами к ГБМ.
Обычно для описания синдрома используют синдром Гудпасчера.
поражения легких и почек, в то время как болезнь Гудпасчера используется для описания
только заболевание почек, опосредованное антителами к ГБМ.
Классическая клиническая картина синдрома Гудпасчера — молодой человек или мужчина среднего возраста. женщина, не имеющая в анамнезе заболеваний легких или почечной дисфункции, которая замечает резкое начало кровохарканья, кашля, одышки, периферических отеков, темной мочи и олигурия.Биопсия почки — современный золотой стандарт диагностики — выявляет серповидный гломерулонефрит, воспаление и разрыв основания клубочков мембрана. Иммунофлуоресцентные окраски (см. Рисунок) показывают практически патогномоничное обнаружение линейного отложения антител IgG вдоль базальная мембрана клубочков. Лабораторные исследования пораженных пациентов показывают высокий уровень циркулирующих антител IgG или IgM к базальной мембране клубочков а также повышенный креатинин как маркер почечной дисфункции.Анализ мочи показывает протеинурия и нефритический осадок, характеризующийся дисморфическими эритроцитами, лейкоцитами, и эритроциты и зернистые цилиндры.
Пациенты с поражением легких обычно имеют легочные инфильтраты на груди.
Рентгеновские лучи и повышенная способность рассеивать окись углерода за счет гемоглобина в
альвеолы. У некоторых пациентов также могут быть признаки железодефицитной анемии, если легочная
кровотечение было активным достаточно долго, чтобы вызвать значительную кровопотерю.Пациенты могут
или может не иметь антител к цитоплазме нейтрофилов (ANCA), но статус ANCA должен
быть исследованным, чтобы исключить дополнительные васкулиты или системное воспаление, которые
может изменить решения о лечении.
Первым пациентом, который позже был назван синдромом Гудпастура, был молодой моряк. обнаружено повреждение легких и почек после острого вирусного заболевания.Этот случай был описан в рукописи доктора Эрнеста Уильяма Гудпастюра 1919 года, в которой подробно описывается значение легочные поражения у пациентов, инфицированных вирусом всемирной эпидемии гриппа времени. Доктор Гудпастур также известен своей работой в области репликации вирусов. Он был первый человек, описавший метод выращивания вирусов в оплодотворенных куриных яйцах, возможность производства различных штаммов вирусов для тестирования.Эта техника используется сегодня для крупномасштабного производства вирусных вакцин, таких как вакцины против сезонного вируса и h2N1. вариант вируса гриппа.
Наиболее важные факторы, влияющие на прогноз для пациентов с синдромом Гудпасчера
своевременная диагностика и начало лечения. Лечение преследует две основные цели: удаление
существующих антител против GBM и предотвращение воспаления, вызывающего почки и
альвеолярное повреждение.Поскольку создание антител против GBM является временным, успешным
возможно удаление коротким (14-дневным) курсом ежедневного плазмафереза.
Иммуносупрессия с помощью перорального приема высоких доз преднизона, а также циклофосфамида
стать стандартным лечением. Уровни антител против GBM контролируются каждые две недели.
для отслеживания прогрессирования или ремиссии заболевания и индивидуального дозирования. В общем, лечение
длится от шести до девяти месяцев или до тех пор, пока не исчезнут антитела против GBM.
Прогноз пациента сильно зависит от уровня креатинина в плазме крови при поступлении. и ее потребности в гемодиализе. Исследования показывают, что пациенты с креатинином менее 5,7 мг / дл и отсутствие необходимости в диализе в течение 72 часов с момента обращения выживаемость пациентов 100% и выживаемость почек 95% в первый год при диализе пациенты с креатинином выше 5.7 мг / дл имеют гораздо худшие результаты — 65% пациентов выживаемость и выживаемость почек 8% в первый год.
Г-н Эман учится на четвертом курсе медицинского факультета Медицинской школы Майо в Рочестере, Миннесота.
Синдром Гудпасчера — обзор
Синдром Гудпасчера
Синдром Гудпасчера (GS) — это аутоиммунное заболевание, поражающее легкие и почки.Это вызвано циркулирующими антителами против базальной мембраны клубочков (анти-GBM), которые связываются с базальной мембраной сосудов в легких и почках, что приводит к аутоиммунной реакции. Конечным результатом является быстро прогрессирующий гломерулонефрит, который часто сопровождается васкулитом и легочным кровотечением. Заболеваемость составляет примерно 1 на 100 000 населения, причем оба пола страдают одинаково. Считается, что генетические факторы увеличивают вероятность развития GS, хотя факторы окружающей среды, такие как курение, инфекция, травма при вдыхании, перегрузка объемом и воздействие высоких концентраций кислорода (O 2 ), увеличивают риск легочного кровотечения. 38, 39 Генетический компонент GS плохо определен. Тем не менее, HLA-DR2 чаще встречается (88%) у пациентов с анти-GBM заболеванием по сравнению с контрольной группой (30%). Также наблюдается повышенная заболеваемость близнецами, братьями, сестрами и двоюродными братьями людей с ГС. Наследование определенных аллельных вариантов тяжелой цепи иммуноглобулина также увеличивает восприимчивость к заболеванию, вызывающему анти-GBM. 39 Болезнь развивается драматично, с внезапным кровохарканьем, одышкой и почечной недостаточностью (вставка 4-11).Частью проявления также может быть впервые возникшая гипертензия. Биопсия почек необходима для постановки диагноза и отличия GS от коллагеновых сосудистых заболеваний, таких как WG.
Наследование определенных аллельных вариантов тяжелой цепи иммуноглобулина также увеличивает восприимчивость к заболеванию, вызывающему анти-GBM. 39 Болезнь развивается драматично, с внезапным кровохарканьем, одышкой и почечной недостаточностью (вставка 4-11).Частью проявления также может быть впервые возникшая гипертензия. Биопсия почек необходима для постановки диагноза и отличия GS от коллагеновых сосудистых заболеваний, таких как WG.
Из-за внезапного начала и серьезности заболевания для первоначального лечения часто требуется гемодиализ и искусственная вентиляция легких. Если пациент GS выживает в острой фазе, высокие дозы кортикостероидов и циклофосфамида вызывают иммуносупрессию, а плазмаферез используется для удаления антител против GBM и комплемента.Терапия обычно длится от 3 до 6 месяцев, с исчезновением симптомов в течение первых 2 месяцев. Терминальная стадия почечной недостаточности является частым осложнением ГС, и может потребоваться трансплантация почки. Ранняя диагностика и лечение тесно связаны с лучшими результатами.
По возможности, операцию следует отложить до начала лечения и разрешения легочного поражения. По всей вероятности, некоторая почечная недостаточность, если не недостаточность, все же будет присутствовать. Предоперационная оценка должна включать определение АМК / креатинина и анализ мочи для оценки функции почек.Симптомы пациента и его медицинское состояние во время операции будут определять степень легочного обследования. Это может включать рентгенограмму грудной клетки, анализ артериального давления крови, спирометрию и диффузионную способность для количественной оценки степени и значимости легочного кровотечения. 40 Если легочное поражение продолжается, часто наблюдаются гипоксемия и рестриктивный дефект спирометрии. Рентгенограмма грудной клетки у типичного пациента показывает диффузные двусторонние альвеолярные инфильтраты из легочного кровотечения. Микроцитарная анемия из-за продолжающегося кровотечения также типична.
Оксигенация — это основная проблема анестезиологического обеспечения пациентов с активным ГС. При продолжающемся альвеолярном кровотечении у пациентов не только будет нарушен газообмен на альвеолярном уровне, но и, скорее всего, будет развиваться анемия. Это будет способствовать снижению доставки O 2 в ткани. Воздействие на легкие повышенного давления O 2 и высокого давления в дыхательных путях может усугубить альвеолярное кровотечение. Этих стрессов, наряду с чрезмерно агрессивной жидкостной реанимацией, следует избегать у всех пациентов с GS, чтобы свести к минимуму риск дальнейшего повреждения легких, опосредованного анти-GBM.Внутриартериальный катетер показан при лечении пациентов с более чем легкой формой заболевания. Для основных процедур у пациентов со значительной легочной недостаточностью установка PAC или TEE может быть полезна для проведения реанимационных мероприятий и управления гемодинамикой. При выборе анестетиков и других лекарств следует учитывать функцию почек и избегать применения любых потенциально нефротоксичных препаратов. Дозировку лекарств, которые зависят от почечной экскреции, следует изменять в зависимости от клиренса креатинина пациента (см. Вставку 4-10).
Отчет о болезни и обзор литературы
Мы сообщаем о случае синдрома Гудпасчера после хронического низкого уровня и острого высокого уровня воздействия кристаллического кремнезема. В отделение неотложной помощи поступил 38-летний плиточник с одышкой и дыхательной недостаточностью. Он сообщил, что его симптомы развились на предыдущей неделе после вдыхания большого количества пыли во время сухой шлифовки и подметания продукта на основе диоксида кремния, используемого для заполнения трещин в цементном полу. В последующие дни его легочная функция ухудшилась, и у него развилась острая почечная недостаточность.Тесты на антитела к базальной мембране клубочков были положительными, а биопсия почек выявила глобальный гломерулонефрит. Ему поставили диагноз синдром Гудпасчера и лечили стероидами, плазмаферезом и гемодиализом. Этот человек страдал астмой в детстве и давным-давно употреблял сигареты за одну пачку. Он пользовался напольным покрытием в течение семи лет до провокационного мероприятия, однако на предыдущих работах использовались значительно меньшие количества. Сообщалось о синдроме Гудпасчера и других аутоиммунных заболеваниях, связанных с воздействием кремнезема.Острое начало после воздействия высокого уровня кремнезема у этого ранее здорового человека предполагает, что клиницисты должны исследовать воздействие кремнезема как причинный фактор в случаях синдрома Гудпасчера.
1. Введение
Синдром Гудпасчера — редкое аутоиммунное заболевание, характеризующееся легочным кровотечением и гломерулонефритом. Клинические признаки синдрома Гудпасчера включают быстро прогрессирующую почечную недостаточность, а рентгенограммы грудной клетки показывают локализованное или диффузное затенение альвеол.Биопсия почек необходима для подтверждения диагноза и выявления серповидного гломерулонефрита и фибриноидного некроза. Кроме того, диагностические критерии включают наличие положительных антител против базальной мембраны клубочков (GBM). Лечение синдрома Гудпасчера включает стероиды, гемодиализ и плазмаферез. Прогрессирование болезни можно остановить с помощью медицинского вмешательства; однако поражение почек и легких может быть необратимым.
Кремнезем, также известный как диоксид кремния, представляет собой соединение, обычно встречающееся в природе и широко используемое.Диоксид кремния является основным компонентом многих продуктов, включая стекло, бетон, керамику, пищевые добавки, изоляцию, бетонные конструкции, литье, пескоструйную очистку и краску, и многие другие. Многие рабочие в США подвергаются риску профессионального воздействия вдыхаемого кристаллического кремнезема, особенно при работе в таких отраслях, как строительство, абразивно-струйная очистка, литейные работы, резка камня, бурение горных пород, работы в карьерах и туннелирования. Воздействие вдыхаемого кристаллического кремнезема на рабочем месте связано с развитием силикоза — прогрессирующего фиброза легких.Также известно, что эти воздействия вызывают аутоиммунные заболевания, такие как склеродермия, ревматоидный артрит и гломерулонефрит [1]. Кристаллический кремнезем классифицируется Международным агентством по изучению рака как канцероген Группы 1. Мы описываем здесь 38-летнего мужчину, у которого развился синдром Гудпасчера после хронического воздействия кристаллического кремнезема на низком и остром высоком уровне.
2. Описание клинического случая
Мужчина 38 лет поступил в отделение неотложной помощи с жалобами на кашель, одышку и кровянистую мокроту.Отвечая на вопрос, он заявил, что начал чувствовать себя плохо примерно неделю назад после того, как вдохнул большое количество пыли во время работы плиточником. Он сообщил, что потратил трехдневный период (8–10 дней до презентации), шлифуя и подметая смесь для ремонта полов, использовавшуюся для заполнения трещин в цементном полу. Он использовал этот же материал во многих небольших работах, но в этой работе использовалось гораздо больше материала для ремонта, чем он использовал ранее. Он подвергался воздействию облаков видимой пыли во время смешивания, шлифования и подметания материала.Соединение содержало от 1% до 5% кристаллического кварцевого кремнезема. Также было отмечено, что продукт был сильно щелочным (pH = 12). Он испытывал раздражение слизистой оболочки во время работы, и ему приходилось выходить на улицу еще 3–4 раза каждый рабочий день, чтобы выплюнуть пыль и «отдышаться». Каждую ночь после работы он чувствовал себя плохо. После третьего дня воздействия он почувствовал себя настолько плохо, что не вернулся к работе. В течение следующих выходных его симптомы переросли в озноб и лихорадку, и он подумал, что у него грипп. Он пошел в клинику, где ему дали антибиотики и ингалятор.В тот вечер его легочные проблемы обострились, что побудило его обратиться в отделение неотложной помощи, откуда он был помещен в больницу.
Пациент сообщил в анамнезе о детской астме и далекой истории употребления сигарет в течение одной пачки в год. Медицинский осмотр при поступлении показал диффузные двухсторонние хрипы и хрипы на выдохе во всех полях легких. После двух обработок распыленным альбутеролом и Атровентом газы крови пациента показали pH 7,45, PCO2 36 и PO2 56 в комнатном воздухе.Химическая панель, уровни КФК и тропонина были нормальными. Количество лейкоцитов составило 17,7 тыс. / Куб. Мм, гемоглобин 15 г / дл, гематокрит 42%. Рентген грудной клетки выявил аномалии в легких, указывающие на диффузный интерстициальный узор. Серийные тесты на КУБ и посев мокроты были отрицательными на микобактерии, пневмоцисты и стрептококки пневмонии.
Через два дня после поступления у пациента усилилась гипоксия, ему интубировали и подключили аппарат искусственной вентиляции легких. Волоконно-оптическая бронхоскопия показала кровянистые выделения, а жидкость БАЛ не показала твердых частиц или признаков бактериальной инфекции.Чреспищеводная эхокардиограмма показала нормальную функцию ЛЖ, ФВ 65%, отсутствие значительных клапанных аномалий и незначительный перикардиальный выпот. Он не реагировал на пероральные антибиотики и не добился прогресса в прекращении вентиляции легких, а скорее перешел в тяжелый респираторный ацидоз с артериальным pH <7,13 и pCO2> 100 мм рт.ст. через неделю после обращения. Впоследствии он перестал отвечать, и у него развилась олигурия и азотемия. Анализ мочи через неделю после поступления показал гематурию и легкую протеинурию, соответствующие гломерулонефриту, а также мутные коричневые цилиндры, характерные для острого некроза канальцев.В это время пациент дал положительный результат на антитела против GBM (базальная мембрана клубочков), и у него был диагностирован синдром Гудпасчера. Это было подтверждено биопсией почек, которая продемонстрировала глобальный гломерулосклероз, очаговую гематурию и линейные реакции иммунофлуоресценции (IgG, IgM, C3) на базальных мембранах клубочков. Биопсия открытого легкого выявила мультифокальный интерстициальный фиброз, диффузные интерстициальные PMN (полиморфноядерные нейтрофилы), внутрисосудистые тромбы и признаки внутриальвеолярного повреждения; совокупность симптомов, соответствующих синдрому Гудпасчера.Поляризующие частицы не наблюдались, но иммунофлуоресцентные исследования выявили линейную альвеолярную перегородку IgG- и C3-иммунореактивность. Окрашивание биопсии легкого также окончательно исключило грибковую, бактериальную, пневмоцистную и вирусную этиологию.
Затем пациенту была проведена непрерывная гемофильтрация и диализ, двухнедельный плазмаферез и иммунодепрессанты, включая цитоксан и преднизон. В течение трехмесячной госпитализации у пациента возникли осложнения, включая сепсис и кровоизлияние в мозг, но функция почек начала улучшаться, и он был постепенно отлучен от вентиляции.Тесты, проведенные в течение четвертой недели его госпитализации, дали отрицательный результат на антитела против GBM. При выписке пациент находился амбулаторно и мог самостоятельно дышать, но имел стойкие когнитивные и двигательные нарушения. Рентгенограмма грудной клетки в это время показала стойкий бибазилярный ателектаз и интерстициальный отек легких. Последующее амбулаторное исследование функции легких показало, что значения FEV-1 и FEV-1: FVC значительно ниже прогнозируемых, что согласуется с симптомами, о которых сообщает пациент, и картиной обструкции.Ежеквартальное наблюдение не показало рецидивов синдрома Гудпасчера, и пациент прекратил прием иммунодепрессантов через несколько месяцев после первой госпитализации. Однако пациенту потребовалось эпизодическое лечение рецидивирующей одышки и кровохарканья в течение трех лет после начала его заболевания и лечения из-за длительного обструктивного поражения легких.
3. Обсуждение
Синдром Гудпасчера был впервые описан Эрнестом Гудпастуром в 1919 году и позже назван в его честь в 1958 году [2].Это заболевание характеризуется легочным кровотечением и гломерулонефритом и опосредуется аутоантителами, направленными против базальной мембраны в почечных клубочках и альвеолах легких. Этиология синдрома Гудпасчера до сих пор неизвестна; однако о развитии заболевания после воздействия кристаллического кремнезема сообщалось по крайней мере в трех клинических случаях [3–5]. Другие воздействия также были вовлечены в качестве причинных факторов, включая углеводороды [6, 7], употребление кокаина [8], пыль твердых металлов [9] и D -пеницилламин [10].Обстоятельства нашего случая, когда плиточник с небольшой историей употребления табака, предполагают вдыхание кремнезема как существенный фактор, хотя некоторое воздействие углеводородов не является редкостью среди рабочих, занятых на строительных работах.
Этот пациент начал свою 9-летнюю карьеру в области настила полов в качестве помощника, а затем был повышен до механика пола. В его обязанности входило смешивание и нанесение состава, выравнивание и шлифовка пола, подметание лишней пыли и мусора, а также физическая укладка плитки или коврового покрытия.Никакое защитное оборудование никогда не использовалось, включая респираторы или перчатки. Он сообщает, что использовал соединение регулярно в течение семи лет, предшествовавших его госпитализации. Подробности других химических воздействий во время его карьеры плиточника неизвестны. До работы в производстве напольных покрытий пациент недолгое время работал водителем в магазине кормов, в полиграфической компании и в стекольной компании. Он также проработал семь лет в компании по борьбе с вредителями, где, по его словам, использовал защитное снаряжение, включая перчатки и респиратор, во время работы.
Информация, полученная по этому случаю, указывает на интенсивное острое воздействие вдыхаемого кремнезема до начала заболевания. На его последней работе не было промышленного гигиениста для измерения уровня воздуха во время шлифовки и подметания, однако пациент сообщает, что постоянно присутствовали большие облака пыли в каждый из трех рабочих дней и что количество продукта для ямочного ремонта пола был намного лучше, чем когда-либо ранее. Точное количество пластыря, использованного на этом сайте, неизвестно; тем не менее, рекордные счета за эту работу составили более 10 000 фунтов стерлингов.Вполне вероятно, что корпус нанес, отшлифовал и очистил большую часть, если не все, продукта за три дня его работы. Он использовал небольшой вентилятор для сушки каждого приложения, но не использовались средства пылеудаления, инженерные средства управления или другие средства управления вентиляцией. При содержании кристаллического кремнезема от 1% до 5% эти факторы указывают на максимальный потенциал вдыхания большого количества кремнеземсодержащей пыли до появления симптомов, что предположительно намного превышает рекомендуемые профессиональные ограничения (Таблица 1).
| |||||||||||||||||
Кристаллический кремнезем распознается как пневмотоксин и нефротоксин, и, как сообщается, вызывает множественные аутоиммунные заболевания [1]. Таким образом, наш случай выявил серьезную токсичность для органов-мишеней для легких, почек и других систем органов-мишеней, что согласуется с описанными в литературе.
Множество эпидемиологических исследований связывают воздействие кремнезема с различными известными аутоиммунными заболеваниями [13–20].Часто регистрируемые заболевания включают склеродермию, системную красную волчанку, ревматоидный артрит, аутоиммунную гемолитическую анемию и саркоидоз [1]. Несколько исследований рабочих, подвергшихся воздействию кремнезема, показали повышенную частоту некоторых распространенных аутоиммунных заболеваний, указывая на то, что исследования, изучающие частоту только одного заболевания, могут недооценивать риски, связанные с воздействием кремнезема [21, 22].
В соответствии с его корреляцией с аутоиммунными эффектами, эпидемиологические данные указывают на то, что кремнезем является причиной почечной недостаточности [18, 23, 24].Когортное исследование 4626 рабочих, подвергшихся воздействию кремнезема, показало сравнительно высокие показатели смертности от острых почечных заболеваний, хронических заболеваний почек и артритов. Было отмечено превышение частоты терминальной стадии почечной недостаточности, которая была самой высокой для гломерулонефрита. Они обнаружили рост заболеваемости терминальной почечной недостаточностью с увеличением кумулятивного воздействия [25]. В другом исследовании изучалась частота заболеваний почек в отдаленных районах добычи полезных ископаемых в Соединенном Королевстве по сравнению с областями клинической практики, не связанных с горнодобывающей промышленностью.Статистический анализ подтвердил значительный рост заболеваний почек, особенно гломерулонефрита, в районе добычи полезных ископаемых. Авторы предполагают, что это превышение связано с высоким содержанием кремнезема, присущим добыче плавикового шпата. Из шести рабочих, длительное время подвергавшихся воздействию кремнезема, у пяти был гломерулонефрит, подтвержденный биопсией, а у другого были признаки и симптомы, совместимые с хроническим гломерулонефритом [26]. Эти результаты согласуются с другими исследованиями, которые показывают повышенный риск между воздействием кремнезема и гломерулонефритом [14, 27, 28].
В отчетах о клинических случаях также описывается острое начало легочного, почечного и аутоиммунного заболевания после воздействия кремнезема, с подробным описанием клинических проявлений, аналогичных описанию нашего случая [29–33]. В одной серии случаев представлены четыре пациента, у которых у всех развилась быстро прогрессирующая почечная недостаточность после воздействия высокоинтенсивной пыли кремнезема. Гистологические данные в каждом случае показали гиперцеллюлярность клубочков и склероз, серповидные образования, интерстициальные клеточные инфильтраты и некроз канальцев. Циркулирующие иммунные комплексы присутствовали у трех пациентов, а электронная микроскопия показала электронно-плотные отложения базальной мембраны клубочков у всех пациентов.Кроме того, все четыре случая имели респираторное заболевание [34].
Одновременное наличие легочной и почечной недостаточности после воздействия кремнезема не ограничивается синдромом Гудпасчера. В исследовании «случай-контроль» профессиональные истории 16 пациентов с четким диагнозом гранулематоза Вегенера с поражением почек сравнивались с историями 32 пациентов из контрольной группы. Гранулематоз Вегенера — это системный васкулит с аутоиммунными и почечными проявлениями, подобными болезни Гудпасчера.В пяти случаях сообщалось о воздействии кремнеземной пыли, приводящей к отношению шансов 5,0 (95% ДИ 1,4–11,6) для этого аутоиммунного заболевания по сравнению с контрольной группой, не подвергавшейся воздействию, а в семи случаях, сообщающих о воздействии любых кремнийсодержащих соединений, отношение шансов составляло 6,5 (95 % ДИ 1,3–13,5). Сообщаемое воздействие свинца, кадмия, хрома, сварочного дыма и углеводородов не было связано со значительным повышением риска гранулематоза Вегенера [35].
В литературе нам доступны три клинических случая (четыре случая), в которых хроническое воздействие кремнезема напрямую связано с развитием синдрома Гудпасчера.Стратта и др. В публикации 2001 года предложили несколько причин, по которым в литературе имеется мало исследований и примеров синдрома Гудпасчера, связанного с кристаллическим кремнеземом. Указанные причины включают ограниченное количество записей о пациентах с острыми симптомами, ведущими к смерти, отсутствие клинических данных по почкам от облученных работников, отсутствие правильного диагноза в больницах и медицинских учреждениях, проводящих диализ, и относительно низкая частота перекрестных ссылок на профессиональные факторы [36].
В одном отчете описывается 46-летний рабочий литейного производства с историей интенсивного воздействия вдыхаемого кристаллического кремнезема, который был госпитализирован с одышкой, гематурией, протеинурией, тяжелым ограничительным нарушением функции легких и быстро снижающейся функцией почек. Иммунологические тесты и биопсия дали положительные результаты на антитела к GBM и слабый иммунный серповидный гломерулонефрит, ему поставили диагноз синдром Гудпастура и лечили гемодиализом и плазмаферезом.Обследование на рабочем месте показало, что уровень воздействия вдыхаемого кристаллического кремнезема превышает предел воздействия, TLV-TWA 0,0106 мг / м 3 , который был откалиброван для сверхурочной работы. Авторы приходят к выводу, что на основании его клинической картины и обследования на предмет промышленной гигиены синдром Гудпасчера был вызван длительным воздействием кремнезема [3].
В другом отчете рассказывается о 48-летнем мужчине, который в анамнезе подвергался воздействию кремнезема и свинца, проработав минимум четыре года маляром по глазурованной плитке на фабрике по производству керамической плитки.Характеристика кремнезема в отчете отсутствует. Этот конкретный случай осложнился обширным воздействием свинца и перенесенным острым отравлением свинцом [4]. В другом отчете о болезни кристаллический кремнезем был связан с развитием синдрома Гудпасчера у двух горняков, страдающих пневмокониозом [5]. Уровни воздействия не описаны ни в одном из отчетов, хотя в трудовой книжке указано хроническое воздействие на протяжении ряда лет.
Хотя исследования предполагают причинную связь между кремнеземом и аутоиммунным заболеванием, клеточный механизм неизвестен.Одна из теорий состоит в том, что когда вдыхаемые частицы кремнезема инкапсулируются макрофагами, образуются фиброгенные белки и факторы роста, и в конечном итоге активируется иммунная система [37–39]. Сообщалось, что вдыхание больших доз кремнезема увеличивает мобилизацию из легких в другие органы, включая почки [40]. Таким образом, можно предположить, что, как только кремнезем попадает в другие органы, иммунная система ошибочно повреждает нормальные ткани этих органов. В некоторых сообщениях предполагается, что кремнезем может вызывать мультисистемные заболевания как за счет активации иммунной системы, так и за счет прямого токсического воздействия на ткани [34].Кроме того, недавние литературные исследования показывают, что кремнезем обладает адъювантным действием и неспецифически усиливает иммунный ответ, тем самым провоцируя ряд систематических аутоиммунных заболеваний [15, 17]. В отчете Брауна и др. За 2005 год. фокусируется на потенциальных механизмах, с помощью которых кремнезем может приводить к развитию и прогрессированию аутоиммунного заболевания [13].
Точно так же не установлен патогенез гломерулонефрита и других почечных эффектов у рабочих, подвергшихся воздействию кремнезема. В то время как в некоторых отчетах о случаях заболевания приводятся доказательства иммунологического повреждения в результате образования иммунных комплексов, другие указывают на прямой токсический эффект кремнезема [23, 41–43].Также было высказано предположение, что, поскольку повреждение легких обнаруживается при нескольких заболеваниях почек, таких как синдром Гудпасчера и гранулематоз Вегенера, легочные инсульты могут играть роль в развитии некоторых хронических заболеваний почек [44].
Мы предполагаем, что сильнощелочная природа продукта привела к раздражающему и разъедающему действию на слизистые оболочки верхних дыхательных путей при вдыхании. В результате повреждения слизистой оболочки наш случай, вероятно, увеличил бы уязвимость к кремнезему, увеличив его абсорбцию в легкие или подслизистую ткань.
Учитывая установленный риск для здоровья, связанный с кремнеземной пылью, и временность прогрессирования заболевания, мы заключаем, что наш случай синдрома Гудпасчера был вызван интенсивным воздействием щелочной кремнеземной пыли. Этот пациент был здоров до острого контакта и не имел в анамнезе легочных, почечных или аутоиммунных заболеваний. Вероятно, что высокая доза вдыхаемой пыли кремнезема вызвала у него острую дыхательную недостаточность и инициировала прогрессирование аутоиммунного заболевания, которое в конечном итоге привело к почечной недостаточности.После того, как он выздоровел после этого события, у него больше не было рецидивов болезни, что позволяет предположить, что провоцирующее событие было разрешено. Несколько последующих анализов крови на антитела к базальной мембране клубочков дали отрицательный результат.
Предыдущие исследования были сосредоточены на хроническом, а не на остром профессиональном воздействии кремнезема; однако данные свидетельствуют о том, что интенсивность воздействия, а не продолжительность, по-видимому, важна для выборочного возникновения аутоиммунных расстройств [45]. Характеристики воздействий во время его карьеры неадекватны, однако этот пациент сообщает о том, что в течение семи лет, предшествовавших его заключительной работе, он неоднократно подвергал полы шлифованием и подметал полы.Неизвестно, применялись ли адекватные меры контроля воздействия во время предыдущих работ. Однако мы знаем, что защитное оборудование, такое как респираторы, не использовалось, и мы можем ожидать, что имело место хроническое воздействие вдыхаемого кремнезема. Однако опыт нашего случая может быть в некоторой степени уникальным, поскольку мы считаем, что это первый зарегистрированный случай, в котором имело место острое воздействие высокой интенсивности, непосредственно предшествовавшее развитию синдрома Гудпасчера.
Строительные рабочие сталкиваются с повышенным риском заболеваний, связанных с диоксидом кремния, из-за их воздействия при использовании, смешивании, резке, шлифовании и шлифовке бетона и / или составов на основе диоксида кремния.За последние десятилетия такие методы, как пылеподавление и более широкое использование респираторов, несколько снизили риски для здоровья рабочих-строителей; тем не менее, как показывает наш случай, воздействие диоксида кремния остается повсеместной опасностью и важной причиной заболеваний у людей, подвергшихся его воздействию. Этот отчет дополняет совокупность доказательств, подтверждающих, что воздействие диоксида кремния является причинным фактором в случаях синдрома Гудпасчера.
Конкурирующие интересы
Первоначальное финансирование этой клинической оценки было предоставлено юридической фирмой, представляющей пациента.Юридическая фирма не занималась анализом данных, интерпретацией данных или написанием отчета. Соответствующий автор имел полный доступ ко всем данным в исследовании и нес окончательную ответственность за решение представить рукопись для публикации.
Вклад авторов
Дж. Дальгрен опросил пациента с помощью Т. Пекхэма. Дж. Дальгрен, Т. Пекхэм и М. Варденбург проанализировали и интерпретировали медицинские данные пациента и данные о воздействии, касающиеся диагноза синдрома Гудпасчера.Дж. Дальгрен, Т. Пекхэм и М. Варденбург рассмотрели и обобщили соответствующую литературу и внесли большой вклад в написание рукописи. Все авторы прочитали и одобрили окончательную рукопись.
Благодарность
Авторы благодарят Марию Домингес, Алекса Ли, Элизабет Чой и Джейсона Кляйна за их комментарии и помощь в редактировании рукописи.
| 1 | Восприимчивость к заболеванию антигломерулярной базальной мембраны и синдрому Гудпасчера связана с генами MHC класса II и возникновением Т-клеточного иммунитета у мышей. 57 61 | Каллури Р. … Нейлсон Э. Г. | 9410904 | 1997 |
| 2 | Молекулярное клонирование человеческого антигена Goodpasture показывает, что это альфа-3 цепь коллагена IV типа. 61 57 | Тернер Н … Пьюзи, компакт-диск | 1737849 | 1992 |
| 3 | Доминирующая защита от HLA-связанного аутоиммунитета с помощью антиген-специфических регуляторных Т-клеток. 57 | Ooi JD … Китчинг AR | 28467828 | 2017 |
| 4 | Молекулярная архитектура аутоантигена Goodpasture при нефрите против GBM. 57 | Педченко В … Хадсон Б.Г. | 20660402 | 2010 |
| 5 | Синдром Альпорта, синдром Гудпасчера и коллаген IV типа. 57 | Hudson BG … Neilson EG | 12815141 | 2003 |
| 6 | Синдром Гудпастура у близнецов. 57 | Симонсен Х … Лейдфогед Дж. | 7158437 | 1982 |
| 7 | Синдром Гудпасчера у однояйцевых близнецов. 57 | D’Apice AJ … Sands JM | 563692 | 1978 |
| 8 | Синдром Гудпастура: семейное происхождение. 57 | Госсейн В.В. … Джейнс А.В. | 5017886 | 1972 |
| 9 | Антинейтрофильные цитоплазматические аутоантитела со специфичностью миелопероксидазы у пациента с заболеванием антигломерулярной базальной мембраны. 61 54 | Wanten GJ … Assmann KJ | 7651563 | 1995 |
| 10 | Прогностическое значение антинейтрофильных цитоплазматических аутоантител со специфичностью миелопероксидазы при заболевании антигломерулярной базальной мембраны. 61 54 | Bosch X … Вернуть L | 1657470 | 1991 |
| 11 | Клинико-патологические характеристики и предикторы неблагоприятного исхода при болезни антигломерулярной базальной мембраны — пятнадцатилетний опыт работы в одном центре. 61 | Захир З … Джайн М | 33334228 | 2021 |
| 12 | Клинико-иммунологические особенности постэкстракорпоральной ударно-волновой литотрипсии антигломерулярной базальной мембраны. 61 | Ван Б … Чжао М | 33435789 | 2021 |
| 13 | Атипичное заболевание антигломерулярной базальной мембраны с отрицательными антителами к GBM и положительными ANCA: отчет о клиническом случае. 61 | Го Н … Фу П | 33546629 | 2021 |
| 14 | Последовательное возникновение микроскопического полиангиита и заболевания антигломерулярной базальной мембраны у пациента с мелкоклеточным раком легкого: клинический случай. 61 | Хаяси Й … Фукуи М | 33517889 | 2021 |
| 15 | Идиопатический легочный гемосидероз: современный обзор. 61 | Saha BK | 33246295 | 2021 |
| 16 | Атипичное заболевание антигломерулярной базальной мембраны, осложненное чувствительным к метициллину Staphylococcus aureus, быстро прогрессирующим гломерулонефритом, связанным с инфекцией: отчет о клиническом случае и обзор литературы. 61 | Ямасита Т … Кобаяши Х | 33460013 | 2021 |
| 17 | Сложное лечение рака: взгляд иммунонефролога. 61 | Феноглио Р … Sciascia S | 33326976 | 2021 |
| 18 | Антигломерулярная болезнь базальной мембраны: чему мы научились? 61 | Ахтар М…Асим М | 329 | |
| 2021 | ||||
| 19 | Плазмаферез с двойной фильтрацией — 10-летний опыт работы в педиатрии как альтернатива плазмаферезу. 61 | Максимальный AP… Хуссейн Ф | 32919882 | 2020 |
| 20 | Неотложная гипертоническая болезнь и судороги у 30-летнего мужчины с заболеванием антигломерулярной базальной мембраны. 61 | Маскола М…Obligado S | 33363926 | 2020 |
| 21 | Отдаленные результаты у реципиентов почечного трансплантата с терминальной стадией заболевания почек из-за болезни антигломерулярной базальной мембраны. 61 | Сингх Т…Panzer SE | 33259076 | 2020 |
| 22 | Антигломерулярная болезнь базальной мембраны как потенциальное осложнение COVID-19: отчет о болезни и обзор литературы. 61 | Наххаль С…Ajami Z | 33489507 | 2020 |
| 23 | Имлифидаза: первое одобрение. 61 | Аль-Салама ZT | 33058042 | 2020 |
| 24 | Пациент с COVID-19 и заболеванием базальной мембраны клубочков. 61 | Koc NS … Erdem Y | 33139077 | 2020 |
| 25 | Распространенность и иммунологические особенности антител к базальной мембране клубочков у пациентов с ВИЧ. 61 | Ван WJ … Ying S | 33032537 | 2020 |
| 26 | Синдром Гудпасчера, проявляющийся в виде протеинурии нефротического диапазона с серонегативностью антител к базальной мембране клубочков: отчет о клиническом случае. 61 | Чжун Цз … Цинь В | 32991448 | 2020 |
| 27 | Заболевание базальной мембраны клубочков во время пандемии COVID-19. 61 | Prendecki M … McAdoo SP | 32599088 | 2020 |
| 28 | Заболевание антигломерулярной базальной мембраны, осложненное синдромом задней обратимой энцефалопатии и подкорковым кровоизлиянием в мозг: отчет о клиническом случае и обзор литературы. 61 | Цунэёси С … Китазоно Т | 32277358 | 2020 |
| 29 | Почечная выживаемость у детей с гломерулонефритом с полумесяцами: когортное исследование Консорциума исследований детской нефрологии. 61 | Малиаккал Дж.Г. … Вендерфер С.Е. | 32722612 | 2020 |
| 30 | Редкий случай синдрома Гудпасчера, сопровождающегося кровотечением из поражения тощей кишки Дьелафоя. 61 | Кавабата Х … Шикано Т | 31786734 | 2020 |
| 31 | [Преимущество обнаружения тел Хауэлла-Джолли: обнаружение приобретенного гипоспленизма у пациента с синдромом Гудпасчера]. 61 | Леру Т … Боби В | 32319948 | 2020 |
| 32 | Заболевание базальной мембраны клубочков, ассоциированное с лейкоцитарным антигеном, у братьев и сестер. 61 | Дуркан МЭ … Андертон Дж. Г. | 32296530 | 2020 |
| 33 | Антигломерулярная болезнь базальной мембраны: клинико-морфологическое исследование 16 случаев. 61 | Вавилапалли С … Раджу СБ | 32317520 | 2020 |
| 34 | Гломерулонефрит с положительными антителами к базальной мембране клубочков после лечения алемтузумабом. 61 | Белый E … O’Riordan S | 32815683 | 2020 |
| 35 | Тяжелая инфекция при заболевании антигломерулярной базальной мембраны: ретроспективное многоцентровое французское исследование. 61 | Кайяр П. Титека-Бопорт Д. | 32143501 | 2020 |
| 36 | Атипичное антигломерулярное заболевание базальной мембраны с диффузным серповидным мембранопролиферативным гломерулонефритом: отчет о болезни и обзор литературы. 61 | Эльширбены М … Фитури О | 323 | 2020 |
| 37 | Клинико-патологические особенности и исход атипичного антигломерулярного заболевания базальной мембраны в большой единичной когорте. 61 | Шен ЧР … Чжао М.Х. | 33013861 | 2020 |
| 38 | Необычное проявление редкого заболевания: случай заболевания антигломерулярной базальной мембраны без поражения почек. 61 | Полман Дж … Тати В | 33294356 | 2020 |
| 39 | [Обзор болезни антигломерулярной базальной мембраны или синдрома Гудпасчера]. 61 | Маркес С. Саадун Д. | 31776042 | 2020 |
| 40 | Синдром Гудпасчера и кровотечение после биопсии почек: отчет о клиническом случае. 61 | Ли ВЛ … Луан СД | 32047792 | 2020 |
| 41 | Новая мышиная модель заболевания против GBM проливает свет на материнский перенос аллоантител при гломерулярном заболевании. 61 | Виварелли М … Эмма Ф | 31759484 | 2019 |
| 42 | Материнский аллоиммунный IgG вызывает заболевание антигломерулярной базальной мембраны у перинатальных трансгенных мышей, экспрессирующих человеческий ламинин α5. 61 | Абрахамсон Д.Р. … Борза Д.Б. | 31530475 | 2019 |
| 43 | Атипичное заболевание антигломерулярной базальной мембраны, проявляющееся макроскопической гематурией, болью в пояснице и острым повреждением почек после интенсивных упражнений. 61 | Le Flecher A … Vacher Coponat H | 31807293 | 2019 |
| 44 | Странные комбинации — сосуществование болезни антигломерулярной базальной мембраны и синдрома Шегрена. 61 | Ахмед А. Робертс ISD | 31170292 | 2019 |
| 45 | Заболевание антигломерулярной базальной мембраны: обновленная информация о подгруппах, патогенезе и методах лечения. 61 | Segelmark M … Hellmark T | 30371823 | 2019 |
| 46 | Разлагающий IgG фермент Streptococcus pyogenes вызывает быстрое выведение антител против базальной мембраны клубочков у пациентов с рефрактерным заболеванием базальной мембраны клубочков. 61 | Совери И … Сегельмарк М | 31563334 | 2019 |
| 47 | Идеи при заболевании антигломерулярной базальной мембраны: это новое решение? 61 | Рафат К…Luque Y | 31648697 | 2019 |
| 48 | Плазмаферез при заболевании антигломерулярной базальной мембраны. 61 | Прендецкий М…Пусей С | 31703956 | 2019 |
| 49 | Андрогенная депривация при раке простаты и риск аутоиммунных заболеваний. 61 | Лю JM…Hsu RJ | 30692587 | 2019 |
| 50 | Рецидивирующее заболевание против ГБМ с Т-клеточной крупнозернистой лимфоцитарной лейкемией: отчет о клиническом случае. |

 Заболевание прогрессирует быстро. Больные погибают от почечной, реже, дыхательной, недостаточности.
Заболевание прогрессирует быстро. Больные погибают от почечной, реже, дыхательной, недостаточности. Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.