причины, симптомы, лечение и диагностика
Гипопластическая анемия – гематологическое заболевание, вызванное угнетением деятельности костного мозга. В результате нарушений гемопоэза происходит снижение продукции форменных элементов крови, однако может возникать недостаточность исключительно эритроцитарного ростка. Заболевание наносит значительный вред организму, так как в патологический процесс вовлекается большинство внутренних органов и систем, провоцируя появления опасных осложнений. Пациенту необходимо знать, какие причины вызывают нарушение кроветворной функции и по каким признакам можно заподозрить начало болезни.
Общая характеристика недуга
Гипопластические анемии характеризуются дисфункцией костного мозга, в результате чего нарушаются процессы его самовосстановления, что приводит к повреждению ростков кроветворения. Сниженное содержание тромбоцитов, лейкоцитов, эритроцитов сопровождается нарушением их созревания на различных этапах формирования.
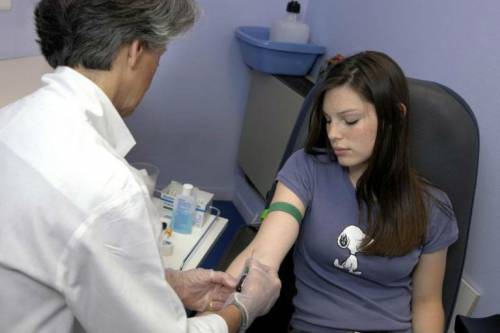
Заболеванию подвержены лица молодого возраста, преимущественно женщины и подростки
Характерным признаком патологии является полное истощение костного мозга на последних стадиях, а также выраженное нарушение его функций.
Симптоматика проявляется выраженной анемией, тромбоцитопенией, лейкопенией. При отсутствии лечения патология быстро прогрессирует, что может привести к летальному исходу.
Классификация патологии
В зависимости от причины возникновения различают следующие виды гипопластической анемии:
- Врожденная. Формируется на фоне генетической мутации ДНК вследствие нарушений внутриутробного развития плода под действием провоцирующих факторов. Аномалии способствует генетическая предрасположенность, когда подобным заболеваниям страдают близкие родственники.
- Приобретенная. Может сформироваться в разном возрасте под действием вредных факторов, вызывающих угнетение кроветворной функции.

По этиологическим признакам существует идеопатическая форма, когда причина развития остается невыясненной, а также миелотоксическая, формирование которой происходит из-за действия токсических веществ.
В зависимости от локализации повреждений в кроветворной системе выделяют:
- Эритроцитопению (угнетение выработки эритроцитов).
- Тромбоцитопению (снижение продукции эритроцитов одновременно с тромбоцитами).
- Панцитопению (дисфункцию всех ростков кроветворения).
Причины развития
Гипопластическая анемия может быть обусловлена негативным действием различных факторов, их совокупность способствует не только развитию болезни, но и приводит к усугублению течения патологического процесса.
Очень часто данный вид анемии возникает вследствие токсического действия некоторых медикаментов, способных спровоцировать нарушения в костном мозге с дальнейшей дисфункцией ростков кроветворения. Ее формирование не зависит от дозировки медикаментов и от длительности терапевтического курса.
К препаратам, способным вызвать нарушения в системе кроветворения, относят:
- сульфаниламиды,
- антибиотики,
- антигистаминные,
- тетрациклины.

Очень часто недуг определяют у лиц, длительно принимающих Левомицетин
Нарушение гемопоэза наблюдается после курса химиотерапии, так как токсическое действие препаратов разрушает не только патологические образования, но и здоровые клетки и ткани.
Причинами расстройства кроветворной функции также являются аутоиммунные болезни, при которых иммунный механизм направлен на угнетение не только патогенных микроорганизмов, но и на собственное повреждение элементов костного мозга.
Таким образом, различают три группы основных причин, вызывающих нарушение кроветворной функции костного мозга:
- Наследственная. Передача генетически модифицированных генов, проявляющаяся хромосомными аномалиями.
- Основная. Токсическое воздействие химиопрепаратов, радиационное излучение, отравление мышьяком и бензолом.
- Редкая. Формируется на фоне приема некоторых медикаментов, при инфицировании грибком.
Факторы, провоцирующие развитие заболевания:
- гепатит вирусного происхождения;
- вирус герпеса;
- цитомегаловирусная инфекция;
- ВИЧ-инфекция.
Ионизирующее излучение, применяющееся в ходе рентгенологического исследования, играет важную роль в механизме формирования анемии. Чаще всего данная патология встречается у работников рентгенологических кабинетов, а также у пациентов, прошедших курс радиоволновой терапии.
Механизм развития
Механизм развития гипопластической анемии связан с действием провоцирующих факторов на систему кроветворения. Патологические изменения приводят к замедлению процесса размножения форменных элементов до их полного исчезновения.
Прогрессирование патологического процесса приводит к замещению тканей костного мозга жировыми клетками
При данном типе анемии наблюдается нарушение обмена железа в результате усиленного разрушения эритроцитов и изменения порфиринового обмена. Далее происходит снижение утилизации железа и его отложение в тканях и органах, что приводит к возникновению вторичного гемохроматоза.
В формировании недуга выделяют несколько механизмов:
- поражение стволовых клеток костного мозга;
- нарушение клеточного и гуморального механизма;
- дисфункция элементов стромы костного мозга;
- недостаток факторов, стимулирующих процесс кроветворения.
Кроме этого, механизм возникновения патологии может быть связан с образованием антител, действующих на выработку форменных элементов крови в костном мозге.
Симптомы
Течение болезни от начала первых признаков до выраженных симптомов протекает незаметно, поэтому больные подвергаются наблюдению специалистов на поздней стадии. Однако возможно и острое развитие патологии, когда наблюдаются интенсивные геморрагические проявления, мышечная слабость и костные боли. Все клинические проявления обусловлены угнетением системы кроветворения, а также дефицитом поступления кислорода к органам и тканям. Выраженность симптоматики зависит от степени патологического процесса и формы течения анемии.
Начальные признаки недуга своевременно не выявляются, так как организм пациента способен адаптироваться к первостепенным патологическим изменениям
Появление характерных симптомов зависит от длительности течения патологии:
- Острая фаза (протекает до 1 месяца).
- Подострая фаза (продолжительность составляет от 1 до 6 месяцев).
- Хроническая стадия (сохраняется больше 6 месяцев).
В большинстве случаев гипопластические анемии проявляются подострым или хроническим течением с частыми периодами обострения, сменяющимися ремиссией на фоне комплексного лечения. Несмотря на период ремиссии, в периферической крови сохраняются выраженные нарушения функции кроветворения, что свидетельствует о медленном восстановлении физиологических процессов.
Развитие анемичного синдрома вызывает появление характерных симптомов:
- выраженное чувство усталости;
- головная боль, головокружение;
- расстройства сна;
- периодические боли за грудиной;
- отсутствие аппетита;
- резкое снижение веса;
- сухость и бледность слизистых оболочек;
- бледность кожных покровов;
- сниженное артериальное давление;
- обморочные состояния;
- обильные менструальные кровотечения.

Заболевание сопровождается частыми кровотечениями из десен, носовых ходов, пищеварительного тракта
Снижение уровня лейкоцитов в кровотоке повышает восприимчивость организма больного к инфекционным и воспалительным заболеваниям, что проявляется частыми ангинами, пневмониями.
Появление сопутствующего гемолитического синдрома провоцирует окрашивание кожных покровов в желтушный оттенок, а также появление геморрагических высыпаний в виде кровоточащих точек. В местах введения инъекций появляются гематомы. Сыпь геморрагического характера размещается в области нижних конечностей, живота и лица. Наблюдаются кровоизлияния в слизистых оболочках рта, губ, глаз.
На фоне заболевания развиваются нарушения со стороны внутренних органов и систем:
- Бронхо-легочная система. В анамнезе частые пневмонии, бронхиты, отдышка при незначительных физических нагрузках.
- Сердечно-сосудистая система. Перебои в работе миокарда, тахикардия, головокружение, болезненность в грудной клетке.
- Пищеварительная система. Могут образовываться эрозии на слизистой оболочке желудка, кишечника.
Тяжелая форма патологии имеет неблагоприятный прогноз, в большинстве случаев заканчиваясь летальным исходом. Смерть наступает в течение 3-х – 4-х месяцев. Причиной смерти являются осложнения, связанные с острым течением пневмонии, сердечной недостаточностью, кровоизлияниями в головной мозг.
Особенности течения патологии при беременности
Сочетание беременности с гипоапластической анемией встречается довольно редко. В случае возникновения патологии прогноз для беременной неблагоприятный, поскольку в большинстве случаев он заканчивается летальным исходом.
Особенно неблагоприятное течение имеет анемия, сформировавшаяся в период вынашивания ребенка. Как правило, она выявляется во втором триместре, сопровождаясь стремительным ухудшением гематологических показателей и присоединением инфекционных заболеваний. Прерывание течения беременности не останавливает развитие патологических процессов в организме. Лечебные мероприятия не приносят результатов.

При наличии адаптационных механизмов в организме женщины к нарушению гомепоэза возможно сохранение беременности
Беременность, которая образовалась на фоне гипопластической анемии, вызывает ее обострение. В данном случае необходимо срочное диагностирование нарушенного кроветворения с дальнейшим прерыванием беременности на раннем сроке и удалением селезенки.
Выявление анемии на позднем сроке беременности требует индивидуального подхода в вопросах родоразрешения. Оно может быть произведено как путем кесарева сечения, так и с сохранением беременности до начала самопроизвольного выкидыша.
Описаны случаи благоприятного исхода родоразрешения, однако у ребенка диагностировалась железодефицитная анемия на протяжении нескольких месяцев.
Диагностические показатели
Для подтверждения диагноза «гипопластической анемии» пациенту необходимо пройти множество исследований, которые смогут подтвердить наличие нарушения процесса кроветворения. Отличительной чертой данного вида анемии является то, что селезенка и лимфатические узлы не увеличиваются.
Лабораторная и инструментальная диагностика определяют следующие изменения:
- Клинический анализ крови (сниженный уровень красных тел, гемоглобина, лейкоцитопения).
- Биохимия крови (повышенная концентрация сывороточного железа, повышение насыщаемости железа трансферином).
- Миелограмма (уменьшение клеточных элементов эритроцитов, гранулоцитов, дисплазия ростков гомепоэза).
Основы лечения
Лечение заболевания является сложным и длительным процессом, включающим следующие принципы:
- Ограничение больного от контактов с прямым источником инфекции.
- Устранение первопричины патологии.
- Переливание компонентов крови.
- Удаление селезенки.
- Введение специфических иммуноглобулинов.
- Трансплантация костного мозга.
Медикаментозная терапия
В ходе лечения широко применяют консервативные методы лечения, которые позволяют уменьшить проявления недуга и подготовить организм к пересадке костного мозга.
Консервативные методы лечения предназначены для уменьшения выраженности гемолитического синдрома
В комплексном лечении болезни используют группы лекарственных средств:
- Глюкокортикостероиды. Назначаются в качестве заместительной терапии у больных со сниженной функцией надпочечников. Позволяют устранить кровоточивость и проявления гемолитического синдрома.
- Иммуносупрессоры. Позволяют устранить патологический процесс, сформировавшийся в результате аутоиммунных заболеваний.
- Анаболитические стероиды. Способствуют стимуляции продукции форменных элементов крови.
- Гормональные средства. Стимуляция ростков кроветворения.
- Витаминные комплексы. Инъекции витамина В, никотиновой и фолиевой кислоты применяют для регуляции стимулирования эритропоэза, а также для подготовки больного к пересадке костного мозга.
Главную роль в комплексном лечении патологии играет переливание компонентов крови, для гемотрансфузий используют свежестабилизированную или катионовую кровь, поскольку она обладает высокими качественными характеристиками. Однако продолжительное переливание крови может вызвать появление антител к лейкоцитам и тромбоцитам.
Инвазивные методы лечения
Отсутствие терапевтического эффекта от медикаментозного лечения служит показанием к проведению оперативных методик:
- Спленэктомия. Удаление селезенки позволяет ликвидировать оказываемое торможение на процессы кроветворения, вследствие чего наблюдается улучшение активности ростков гомепоэза.
- Миелотрансплантация. Трансплантация костного мозга проводится в разовой дозировке, лечебное действие обусловлено гуморальной стимуляцией клеток. Побочным эффектом операции является гибель трансплантата и прогрессирование болезни на фоне вторичного иммунологического нарушения.
Удаление селезенки проводится в том случае, если трансплантация костного мозга не дала необходимых результатов.
Гипопластическая анемия является тяжелым недугом, однако при своевременной диагностике и выборе оптимальной схемы лечения возможно замедлить прогрессирование патологического процесса и снизить риск развития осложнений. Благодаря комплексным подходам в терапии, можно достичь длительного периода ремиссии и снизить показатели смертности. На данный момент разрабатываются новые методы в лечении, способные создать благоприятный прогноз у пациентов с тяжелой формой болезни.
Апластическая анемия — Википедия
Апласти́ческая анеми́я — заболевание кроветворной системы, характеризуется угнетением кроветворной функции костного мозга и проявляется недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, синонимы: апластическая анемия, арегенераторная анемия, геморрагическая алейкия, миелопарез, миелофтиз, панмиелофтиз, прогрессирующая гипоцитемия
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21-летней женщины. Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжёлых расстройств гемопоэза. Без лечения больные тяжёлыми формами апластической анемии погибают в течение нескольких месяцев. При своевременном адекватном лечении прогноз достаточно хороший. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения. Современная медицина относит апластическую анемию к арегенераторному виду анемий (гипо-, апластические анемии)[4].
Причинами апластической анемии могут быть:
- Химические вещества (мышьяк, ароматические углеводороды, в частности бензол, соли тяжёлых металлов).
- Ионизирующее излучение (см. Мария Склодовская-Кюри)
- Лекарственные препараты (НПВС, цитостатики, мерказолил, анальгин, левомицетин).
- Инфекционные агенты (вирусы, м/о).
- Аутоиммунные процессы (СКВ, синдром Шегрена).
Апластическая анемия может развиться при воздействии ряда миелотоксических факторов: ионизирующего излучения, химических веществ — бензола, солей золота, мышьяка; лекарственных средств — хлорамфеникола (левомицетина), фенилбутазона (бутадион), хлорпромазина (аминазин), мепробамата, дилантина, антиметаболитов (6-меркаптопурина, метотрексата), алкилирующих (циклофосфана, хлорбутина) и некоторых других средств. Миелотоксический эффект от воздействия одних факторов (ионизирующее излучение, антиметаболиты) возникает всегда при достаточно большой дозе, других — проявляется индивидуально. Причина индивидуальной чувствительности, в частности к некоторым лекарственным средствам не всегда ясна, но может быть связана с генетическими дефектами кроветворных клеток. Это относится, например, к хлорамфениколу и фенилбутазону, которые вызывают супрессию (в зависимости от дозы) эритропоэза с частотой соответственно 1:24000 и 1:40000 лиц, их принимающих. Наследственный характер индивидуальной чувствительности эритропоэтических клеток к данным лекарственным веществам подтверждается развитием аплазии костного мозга у разных членов одной семьи и у однояйцевых близнецов. В других случаях вероятна связь индуцированного лекарственными веществами угнетения кроветворения с иммунными механизмами появлением антител к эритроцитарным предшественникам. Описаны случаи возникновения апластической анемии после острого вирусного гепатита (возможно, вследствие способности вируса гепатита изменять кариотип клеток, что было прослежено на культуре лейкоцитов), перенесенной инфекции вирусом Эпштейна — Барр, парвовирусом.
Существует и наследственная форма апластической анемии — анемия Фанкони.
Более чем у половины больных не удается выявить какие-либо причинные факторы — это так называемая идиопатическая апластическая анемия. Механизмы, лежащие в основе идиопатической формы анемии, неясны. Возможен аутоиммунный механизм, связанный с воздействием на клетки костного мозга аутоантител при участии иммунных лимфоцитов. Показано, что лимфоциты (Т-супрессоры) больных тормозят образование эритроцитных колоний костного мозга донора и могут нарушать дифференциацию и пролиферацию гематопоэтических предшественников.
Предполагают также, что основой апластической анемии может быть поражение (внутренний дефект) стволовой клетки, о чём свидетельствует восстановление кроветворения у больных после трансплантации им аллогенного костного мозга, содержащего нормальные стволовые клетки. Существуют экспериментальные данные, свидетельствующие о значении для развития апластического процесса и нарушений микроокружения — первичного дефекта стромальных клеток костного мозга. Однако суть этих клеточных дефектов остается неясной, так же как и их первичность. Возможно, что при разных формах апластической анемии патогенетические механизмы неодинаковы.
- Анемический синдром (головокружение, снижение работоспособности, утомляемость, бледность кожных покровов и слизистых, сердцебиение, непереносимость длительных физических нагрузок и т. д.)
- Геморрагический синдром (кровоточивость, склонность к диапедезам, геморрагии)
- Инфекционные осложнения.
Картина периферической крови представлена трицитопенией. Снижение гемоглобина значительно и может достигать критического уровня 20 — 30 г/л. Цветовой показатель обычно равен единице, но в ряде случаев может быть гиперхромия и макроцитоз эритроцитов. Количество ретикулоцитов резко снижено. Характерна выраженная лейкопения (агранулоцитоз). Абсолютное содержание лимфоцитов не изменено или снижено. Количество тромбоцитов всегда снижено, в некоторых случаях не удается обнаружить их вообще. В большинстве случаев увеличивается СОЭ (до 40 — 60 мм/час).
Клиническая картина заболевания позволяет сформировать первичное представление о патологии системы крови. Отправной точкой диагностического поиска является клиническое исследование крови с подсчетом количества ретикулоцитов и тромбоцитов. Выявление би- или трицитопении при исследовании периферической крови служит основанием для выполнения морфологического исследования костного мозга.
Диагноз АА устанавливают на основании типичной гистологической картины костного мозга, получаемого методом трепанобиопсии гребня подвздошной кости. Для получения качественного (информативного) биоптата используются трепаны, выпускаемые промышленным способом (Sherwood medical).
При гистологическом исследовании костного мозга обнаруживается большое количество жировой ткани, содержание которой может достигать 90 %. Среди доминирующей жировой ткани встречаются стромальные и лимфоидные элементы. Гематогенные клетки представлены крайне скудно: в небольшом количестве встречаются эритроидные и гранулоцитарные предшественники. Мегакариоциты отсутствуют.
Лечение апластической анемии представляет собой очень сложную задачу.
- Лечение с глюкокортикоидами эффективно, если болезнь обусловлена аутоиммунными механизмами, появлением антител против клеток крови.
- Лечение анаболическими препаратами стимулируют кроветворение.
- Лечение андрогенами обладает анаболическим эффектом и стимулируют эритропоэз.
- Лечение цитостатиками (иммунодепресантами) — назначается лишь при отсутствии эффекта от других методов лечение у больных с аутоиммунной формой, в том числе при парциальной красноклеточной аплазии.
- Спленэктомия
- Лечение антилимфоцитарным глобулином рекомендуется при отсутствии эффекта от спленэктомии и других методов лечения.
- Лечение циклоспорином. Циклоспорин А (сандиммун) обладает иммунодепрессантным эффектом, селективно ингибирует транскрипцию гена интерлейкина-2 в Т-лимфоцитах, подавляет продукцию Гамма интерферона и альфа фактора некроза опухоли.
- Трансплантация костного мозга.
Основным и единственным патогенетическим методом лечения апластической анемии, позволяющим рассчитывать на спасение жизни больного, является трансплантация костного мозга от совместимого донора. При невозможности подобрать донора проводится паллиативная терапия. В качестве базисного препарата используется иммунодепрессант циклоспорин А. У больных нетяжёлой апластической анемией использование данного препарата позволяет рассчитывать в ряде случаев на успех. Кроме того использование циклоспорина А целесообразно и с тех позиций, что глюкокортикоиды, андрогены и антилимфоцитарный глобулин способны улучшить состояние гемопоэза у больных нетяжёлой апластической анемией, но, однако, при этом следует принимать во внимание повышенный риск развития в последующем клональных заболеваний костного мозга. Применение циклоспорина А сводит такой риск к минимуму. Следует также отметить, что у части больных нетяжёлой апластической анемией, преодолевших 6-месячный порог выживаемости, может наступить спонтанное улучшение даже если им не проводилось никакой иммуносупрессивной терапии. Эффект от иммуносупрессивной терапии у больных тяжёлой и крайне тяжелой апластической анемией сомнителен.
- Лечение колониестимулирующими факторами или миелоидными факторами роста — эти гликопротеиды, стимулирующие пролиферацию и дифференциацию клеток-предшественниц гемопоэза различных типов.
- Трансфузии эритроцитов; показания: выраженная анемия, гипоксия мозга, гемодинамические нарушения.
Все больные апластической анемией нуждаются в заместительной трансфузионной терапии эритроцитарной и/или тромбоцитарной массой. Объём трансфузионной терапии определяется показателями периферической крови и клиническими проявлениями заболевания. Кроме того, проводится антибактериальная и микостатическая терапия с целью профилактики или лечения инфекционных осложнений.
Ремиссию удаётся получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых. Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезёнки и хотя бы небольшой, но чёткий эффект от кортикостероидных гормонов. В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
Апластическая анемия — причины, симптомы, диагностика и лечение
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
Общие сведения
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда — только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.

Апластическая анемия
Причины
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой — главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается — такие случаи относят к идиопатической форме.
Патогенез
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Классификация
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
Осложнения
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Диагностика
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследование пунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
Гипопластическая анемия
Гипопластическая анемия (греческий hypo- + plasis формирование, образование; анемия; синонимы: апластическая анемия, арегенераторная анемия, геморрагическая алейкия, миелопарез, миелофтиз, панмиелофтиз, прогрессирующая гипоцитемия) — заболевание системы крови, характеризующееся угнетением кроветворной функции костного мозга и проявляющееся недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, эритробластофтиз).
Классификация
Различают врождённые (конституциональные) и приобретённые формы Гипопластическая анемия. Врождённые Гипопластическая анемия встречаются сравнительно редко. В зависимости от характера угнетения кроветворения выделяют формы с поражением всех трёх ростков (истинная Гипопластическая анемия) или только эритропоэза (парциальная Гипопластическая анемия). Иногда выделяют Гипопластическая анемия с гемолитическим компонентом, но некоторые авторы считают, что она представляет собой гипопластическую стадию пароксизмальной ночной гемоглобинурии (смотри полный свод знаний Гемолитическая анемия).
Этиология Гипоплазия кроветворения может быть обусловлена воздействием разнообразных внешних факторов, которые принято делить на две группы: 1) факторы с облигатным миелотоксическим эффектом, пропорциональным величине дозы, — ионизирующая радиация, бензол и его производные (развивается бензольная анемия), противоопухолевые препараты (хлорэтиламины; фосфорамиды; антиметаболиты — антагонисты фолиевой к-ты, аналоги пуринов, пиримидинов и другие; антимитотические средства — колхицин, алкалоиды барвинка; антибиотики — брунеомицин, рубомицин, адриамицин, карминомицин), неорганические соединения мышьяка, эстрогены и другие; 2) факторы с факультативным миелотоксическим эффектом, обнаруживаемым лишь в единичных случаях — антибактериальные, противосудорожные, антитиреоидные, антигистаминные препараты, транквилизаторы (развивается апластическая постмедикаментозная анемия), инсектициды и другие; прямой связи развития Гипопластическая анемия с дозой и длительностью применения препарата в этих случаях не отмечается. |
Ко второй группе должны быть отнесены сравнительно редкие случаи развития Гипопластическая анемия при туберкулёзе, беременности. Гипопластическая анемия, связанная с приёмом в пищу перезимовавшего зерна (смотри полный свод знаний Алейкия алиментарно-токсическая), практически не встречается.
Из факторов с факультативным миелотоксическим эффектом наиболее опасен антибиотик левомицетин (хлорамфеникол). По данным Валлерштейна с сотрудники (R. О. Wallerstein, 1969), у лиц, принимающих левомицетин (смотри полный свод знаний), возможность заболеть Гипопластическая анемия в 13 раз выше, чем у населения в целом. Реже описывают Гипопластическая анемия в связи с приёмом органических соединений мышьяка (мафарсен и другие), противомалярийных препаратов, производных гидантоина, фенилбутазона, солей золота.
Гипопластическую анемию, вызванную воздействием различных внешних факторов, называют миелотоксической анемией. Примерно в 50% случаев Гипопластическая анемия выявить причину заболевания не удаётся — так называемый идиопатическая форма.
Этиология конституциональной Гипопластическая анемия (синдрома, или анемии, Фанкони, парциальной Гипопластическая анемия Джозефса — Даймонда — Блекфена и семейной Гипопластическая анемия Эстрена — Дамешека) связана скорее всего с наследованием гена от одного из родителей по рецессивному типу. При цитогенетическом исследовании Блум (G. Е. Bloom) с сотрудники (1966) обнаружили у больных разнообразные хромосомные аберрации в кроветворных клетках. Описаны случаи заболевания детей, родившихся от межродственных браков. Некоторые авторы отмечают сходство синдрома Фанкони с эмбриопатией (смотри полный свод знаний), вызванной талидомидом (смотри полный свод знаний).
причины, диагностика, симптомы и лечение
Диагноз «гипопластическая анемия» – это анемическое состояние, которое относится к целой группе заболеваний кровеносной системы. Это патологическое нарушение, которое характеризуется истощением костного мозга. В своем большинстве гипопластическая анемия достаточно трудно поддается лечению, в особенности это касается запущенных случаев.
Гипопластическая и апластическая анемии
Гипопластическая и апластическая анемии сходны тем, что патологический процесс связан с недостаточностью костного мозга, которая обусловлена нарушениями пролиферации и дифференциации некоторых элементов клеток. При гипопластической анемии наблюдается понижение кровообразовательной функции костного мозга, которое происходит в результате критического недостатка определенных веществ, необходимых для процесса кроветворения.
Апластическая анемия характеризуется значительным истощением и критической недостаточностью кроветворной функции. Причиной для появление этой разновидности анемии может послужить негативное воздействие на организм человека ионизирующего излучения или радиации в больших дозах, отравление бензолом, соединением свинца, ртути или в результате других серьезных интоксикаций.
Гипопластическая анемия у детей
Признаки прогрессирование гипопластической анемии у детей возникают достаточно поздно, чаще всего это происходит в возрасте от 4 до 12 лет. Однако их проявление немного заметнее, чем у взрослых – это обусловлено ускоренным развитием детского организма. У детей с этой формой анемии встречаются множественные пороки развития сердечной мышцы, почек, костной системы. Дети старшего возраста обращаются с жалобами на боли в области сердца, ощущают «замирание».

Симптомы
Прогрессирование гипопластической анемии отличается тем, что происходит утрата способности вещества в костном мозге восстанавливаться – это происходит по причине поражения всех трех ростков кроветворения. Происходит изменения в картине крови: снижается уровень гемоглобина, тромбоцитов и эритроцитов.
Симптомы гипопластической анемии развиваются практически незаметно, с течением длительного промежутка времени. Такое течение патологического процесса свойственно для нормохромного типа анемического расстройства. Первые признаки имеет настолько размытые характеристики, что определить наличие анемии на первой стадии практически не представляется возможным.
Прогрессирование гипопластической анемии проходит с появлением слабости в мышцах и теле, отсутствия аппетита, частых головокружений, снижения работоспособности, головной боли, нарушения сна, учащенного сердечного ритма. У пациентов появляются и внешние проявления: бледный оттенок кожных покровов. Затем у больных проявляется геморрагический синдром:
- Беспричинное появление частых кровотечений из носа.
- Появление синяков на коже (при надавливании).
- Кровотечения из десен.
- У женщин появляются обильные и длительные менструации.
В том случае, когда происходит длительное прогрессирование гипопластической анемии или массивное повреждение тромбоцитов, у пациента могут появиться опасные осложнения: внутреннее кровотечение, инфаркт головного мозга. Итоге затянувшегося патологического процесса – летальный исход больного.
Причины
Выделяют несколько главных причин гипопластической анемии:
- Наследственность обеспечивает передачу генов от родителей, которые обуславливают возникновение анемического расстройства, когда происходят хромосомные нарушения.
- Основными факторами, которые провоцируют прогрессирование заболевания являются различные негативные радиационные излучения и радиации, патогенное влияние медикаментозных препаратов, интоксикация химическими соединениями, аутоиммунные причины.
- К редким причинам относят случаи гипопластической анемии из-за приема лекарственных препаратов, которые оказывают гемотоксическое действие.

Диагностика
Проводится множество обследований при диагностике гипопластической анемии: анализ крови демонстрирует значительное снижение гемоглобина, уровень тромбоцитов и красных кровяных телец также понижен. Затем ставится диагноз на основании клинических проявлений, исследований крови и состояния костного мозга.
Проводится УЗИ лимфатических узлов и печени – если они не увеличены, тогда диагностируется гипопластическая анемия. Для приобретенной формы этого заболевания будет характерно нормоцитарное течение. Также перед постановкой диагноза пациент проходит необходимое обследование, которое исключит возможность дефицитных анемий, поскольку существует схожесть признаков.
Лечение
Гипопластическая анемия – это неизлечимая патология, однако при правильно подобранной лечебной тактике и соблюдении всех необходимых рекомендаций лечащего врача вполне возможно полностью остановить процесс развития этого заболевания. Помимо всего прочего, при адекватном лечении гипопластической анемии можно предупредить появление опасных осложнений. Только выявив нарушение процесса кроветворения, а также проведя правильное лечение, можно в значительной степени улучшить качество жизни пациента.
Лечебная терапия проводится в гематологическом отделении. Все процедуры проводятся исходя из тяжести, причин и степени выраженности заболевания. Лечение проводится консервативными или оперативными методами. Пациентам назначаются глюкокортикостероидные, анаболические и гормональные препараты. Для молодых пациентов трансплантация мозга остается перспективным решением.
что это такое, анапластическая, симптомы, лечение
Гипопластическая анемия — это заболевание кровеносной системы, сопровождающееся потерей костным веществом способности к восстановлению собственных клеток в связи с поражением кроветворных ростков. В данном случае состав крови изменяется — наблюдается снижение уровня гемоглобина, лейкоцитов, тромбоцитов, эритроцитов. В структуре костного мозга активно снижается количество кроветворных ростков. Патологическое состояние характерно для людей средней и старшей возрастной группы.
Причины
Негативное действие провоцирующих факторов обуславливает формирование патологии кровеносной системы, а совокупность таких приводит к ускоренному развитию и усугублению течения болезни.
Одной из ведущих причин появления патологии является действие токсических медицинских препаратов. Антибиотики, тетрациклины, сульфаниламиды, антигистаминные, химиотерапевтические провоцируют изменения в функционировании костного мозга, нарушая процесс кроветворения.
Кроветворная функция может нарушаться в результате аутоиммунных заболеваний, в ходе которых защитные механизмы организма угнетают патогенные клетки и структуры костного мозга. Так, специалисты выделяют следующие группы причин, приводящих к развитию болезни крови:
- редкая, проявляющаяся грибковым заражением или действием лекарственных средств;
- наследственная, связанная с хромосомными аномалиями;
- основная, характеризующаяся токсическим воздействием химических веществ.
Также спровоцировать развитие анемии может ВИЧ, герпес, гепатит. Излучение, использующееся в рентгеновском обследовании и лечении, провоцирует формирование заболевания у медицинских работников и пациентов.
Классификация
Существует несколько оснований для классификации анапластической анемии. В зависимости от причин заболевания выделяют следующие виды патологии:
- миелотоксическая, вызванная действием таких факторов, как интоксикация лекарственными и химическими веществами, радиационное облучение, вирусные и эндокринные патологии, беременность, туберкулез;
- идиопатическая форма устанавливается при невозможности определить первопричину заболевания.
Основываясь на периоде течения болезни, доктора выделяют острую анемию, продолжающуюся до 30 дней, подострую форму, длительность которой не превышает 6 месяцев, и хроническое заболевание, длящееся свыше полугода.
По степени тяжести и уровню поражения функций костного мозга выявляются следующие формы анемии:
- умеренная, характеризующаяся избирательным повреждением кроветворных веществ при сохраняющемся формировании полноценных клеток крови;
- тяжелая, при которой атрофируется большая часть костного мозга с последующим его замещением жировыми клетками;
- крайне тяжелая, сопровождающаяся полным замещением клеток костного мозга жировой тканью.
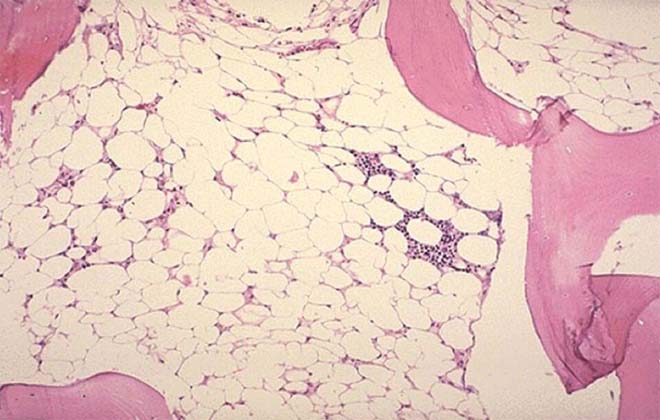
Основываясь на степени вовлечения в патологический процесс ростков крови специалисты выделяют парциальный тип, для которого характерно уменьшение эритроцитного состава, эритроцито-, тромбоцитопения, связанная с нарушением формирования двух компонентов крови — тромбоцитов и эритроцитов. Третьим типом является истинная анемия гипопластическая, при которой сокращается выработка всех компонентов крови.
Ведущей классификацией является деление анемии на врожденную и приобретенную.
Приобретенные формы
К данным формам болезни относят следующие состояния:
- истинная патология, в половине случаев которой не выявляется истинных причин развития заболевания;
- парциальная красноклеточная аплазия обусловлена аутоиммунным действием, угнетающим красные кровяные клетки, а также развитием опухоли вилочковой железы;
- патология с гемолитическим компонентом сопровождается разрушением эритроцитов.
Перечисленные состояния формируются у людей различных возрастных групп под действием негативных факторов, провоцирующих угнетение функции кроветворения.
Врожденные и наследственные формы
В данную категорию гипопластических анемий специалисты включают следующие заболевания:
- конституциональная анемия Фанкони — проявляется в период от 4 до 10 лет, сопровождается аномальным развитием внутренних органов;
- заболевание Джозефа-Даймонда-Блекфена — выявляется начиная с четырехмесячного возраста, в некоторых случаях диагностируется дефектное развитие органов;
- болезнь Эстрена-Дамешека — нарушение кроветворной функции, не сопровождающееся формированием дефектов.
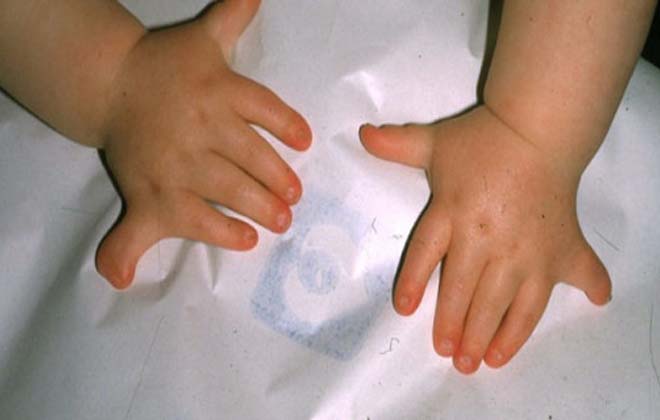
Такие заболевания обусловлены генетической мутацией, сбоем в процессе внутриутробного развития, наследственной предрасположенностью.
Симптомы и диагностика
Для гипопластической анемии характерно постепенное нарастание симптомов. Острое течение болезни отмечается в редких случаях. К ранним проявлениям симптоматики патологии относятся следующие признаки:
- мышечная слабость;
- снижение двигательной активности;
- одышка;
- головокружение;
- головная боль.
По мере ухудшения состояния у больного отмечаются такие признаки: бледность поверхности кожи и слизистых, частые кровоизлияния и кровотечения. На поздних стадиях заболевания формируются неврологические нарушения, вызванные кровоизлияниями в головной мозг.
При постановке диагноза у людей, страдающих апластической анемией, доктора применяют следующие диагностические методы:
- уточнение симптоматической картины;
- общий анализ крови и мочи;
- исследование каловых масс на наличие скрытой крови;
- биохимический анализ;
- иммунологическое тестирование;
- электрокардиограмму;
- ультразвуковое обследование брюшной полости.
Лечение
Терапия апластической патологии занимает длительный период и является сложным процессом, включающим:
- устранение причины болезни;
- ограничение контактов с источниками инфекции;
- переливание крови;
- инъекции иммуноглобулинов;
- пересадку костного мозга.
Медикаментозное лечение предназначено для уменьшения симптоматических проявлений и подготовки организма к оперативному вмешательству. С этими целями используются глюкокортикостероиды, анаболики, иммуносупрессоры, гормональные и витаминные препараты.
Хирургическое вмешательство применяется при неэффективности медикаментозного воздействия. Трансплантация костного мозга выполняется для нормализации кроветворной функции. В случае отсутствия необходимого результата осуществляется удаление селезенки. Такая мера позволяет стимулировать процесс кроветворения.
Вконтакте
Google+
Одноклассники
Гипопластическая анемия
Этиология:
1. Радиация.
2. Цитостатическая терапия.
3. Медикаменты: антитиреоидные препараты (мерказолил), метилтиоурацил, амидопирин, противотуберкулезные препараты, левомицетин.
4. Анемия Фанкони — врожденная недостаточность развития костного мозга.
5. Миксидема.
б. Тимома.
Патогенез
1. Страдает стволовая клетка костного мозга — цитостатическая миелотоксическая гипоплазия.
2. Появление антител — аутоиммунный механизм.
3. Т-лимфоциты могут уничтожать собственные клетки костного мозга.
4. Дефекты стромы костного мозга.
Страдают следующие ростки: гранулоцитарный, эритроцитарный, тромбоцитарный.
Клиника
1. Анемия может быть очень тяжелой. Гемоглобин может падать до 15 ЕД, бледность, слабость, одышка, утомляемость, тахикардия. Может появиться функциональный систолический шум (анемический). Анемия чаще гипохромная.
2. Геморрагический диатез: вследствие тромбоцитопении проявляется кровотечениями (носовыми, полостными, в местах инъекций).
3. Присоединение инфекции: некротическая ангина, нередко именно с нее начинается заболевание. Стоматит.
Заболевание неуклонно прогрессирует, прогноз крайне неблагоприятный.
Дифференциальный диагноз
Проводится с заболеваниями, протекающими с панцитопенией:
Острый лейкоз, в крови есть бластные клетки: много бластных форм в костном мозге: увеличение печени, селезенки, лимфоузлов; при анемии костный мозг, наоборот, бедный клеточными элементами, пустой. В срезах костного мозга увеличено содержание жировой ткани. В норме — 50% жировых клеток.
Лечение
Госпитализация в специализированное учреждение. Больного помещают в палату с повышенным давлением атмосферного воздуха с целью изоляции его от инфекции. Активнейшая антибактериальная терапия, когда количество лейкоцитов периферической крови снижается до 1000 в мкл. В этом случае опасна даже сырая пища, необходимо давать вареную.
Цепорин и др.антибиотики.
Специфическая терапия: пересадка костного мозга, но это чревато большими иммунологическими конфликтами, с реакциями по типу:
а) трансплантат против хозяина,
б) хозяин против трансплантата.
Поэтому перед пересадкой костного мозга больные получают анти-Т-лимфоцитарный глобулин, а также циклофосфан и глюкокоротикоиды.
Цитостатики дают только в тех случаях, когда уверены, что гипоплазия связана с действием Т-лимфоцитов: циклофосфан, имуран, 6 меркаптопурин.
5. анаболические стероиды: ретаболил 1,0 в/м 1 раз в неделю, курс до 6 месяцев, так как эффект развивается медленно. Механизм действия:
а) стимулирует гемопоэз,
б) действует на макрофагов через повышение выработки колонийстимулирующего фактора.
6) соли лития также усиливают выработку макрофагами КСФ — карбонат лития 0,3 * 3 раза.
7) Витамины В6, В12.
8) Переливание крови, лейкоцитарной взвеси.
9) Иногда прибегают к спленэктомии.
Агранулоцитоз
Изолированное поражение гранулоцитопоэза, резкое снижение или полное отсутствие в периферической крови нейтрофильных лейкоцитов. Случаи заболевания увеличиваются с каждым годом.
Этиология
1. Медикаменты: цитостатики, амидопирин, фенацетин, антитиреоидные препараты, сульфаниламидные препараты, противодиабетические пероральные средства, противоревматические средства, резохин, делагил, хлорахин.
2. Лучевая энергия, в том числе и при лучевой болезни.
3. Органические растворители (бензол и др.).
4. Как казуистика: алиментарный фактор — несвежее проросшее зерно.
5. В некоторых случаях прослеживается связь с вирусными заболеваниями, тяжелыми стрептококковыми инфекциями.
6. Иногда есть связь с наследственностью.
По патогенезу агранулоцитоз бывает аутоиммуный и миелотоксический.
Аутоиммуный агранулоцитоз. Благодаря аутоиммуным реакциям повышается чувствительность нейтрофилов к некоторым препаратам, повреждаются клетки, в них образуются антигены или гаптены — активируется иммунная система, начинают вырабатываться антитела. Образуются комплексы АГ+АТ+комплемент —> лизис клетки, клетки агглютинируются между собой, секвестрируются в селезенке и остаются там. Стволовые клетки страдают меньше, чем периферические. Процесс развивается бурно, но характерно и быстрое обратное развитие. Миелотоксический агранулоцитоз. Фактор действует на стволовые клетки-предшественники гранулоцитопоэза. Прежде всего пустеет костный мозг, исчезают гранулоциты, затем процесс переходит и на периферическую кровь. Развивается более медленно, но выход больных из этого состояния затруднен.
Клиника
Острое начало, подъем температуры. Появляются язвенно-некротические изменения, связанные с дефектом нейтрофилов. Язвенно-некротическая ангина, могут быть язвы на языке, губах и других отделах ротовой полости. При тифозной форме поражение пейеровых бляшек кишечника. Может быть некроз слизистой пищевода и даже кожи, особенно на фоне приема лекарств. Тяжелый сепсис, чаще кокковый, с высокой лихорадкой и сильной интоксикацией. В анализе крови резкая агранулоцитопения (нейтропения), в пунктате костного мозга бледность гранулоцитарного ростка, при аутоиммуной форме повышено количество антител к гранулоцитам. Колонийобразующая способность клеток не изменена или повышена при аутоиммуной форме и снижена при миелотоксической.
Дифференциальный диагноз
1. Острый лейкоз. Характерно наличие бластных клеток в крови и костном мозге, может быть анемия и тромбоцитопения, увеличение лимфоузлов, селезенки, печени.
2. Гипопластическая анемия, поражение и других ростков, а не только гранулоцитарного.
3. Инфекционный мононуклеоз. Также часто начинается с язвенно-некротической ангины, характерно наличие в крови мононуклеаров. Обязательно увеличение лимфоузлов, реже селезенки. Реакция Пауля-Бучаля — выявляет антитела к эритроцитам барана.
Лечение
Больные помещаются в специальные отделения с боксированными палатами с целью максимально снизить возможность инфекции. В палате желательны бактерицидные лампы, вентиляция. Минимальный контакт с посетителями.
1) Массивная антибактериальная терапия: антибиотики, лучше в/в в больших дозах и широкого спектра действия — цефалоспорины, пенициллины и др. Так как инфекция может проникать и из кишечника, с целью предупреждения дают антибиотики внутрь, из тех, которые плохо всасываются в кишечнике — мономицин.
2) Антигрибковые препараты: леворин.
3) Дезинтоксикационная терапия.
4) Витамины: С, фолиевая кислота, витамины группы В.
5) Заместительная терапия: переливание больших количеств лейкоцитов, переливание свежей крови, которая оказывает благоприятное действие на гранулоцитопоэз.
6) Стимуляторы кроветворения: хлористый литий, вернокислый литий, углекислый литий — их по 0,3 * 3 раза в день.
7) Ретаболил 1,0 * 1 раз в неделю в/м, действует на стволовые клетки, усиливает выделение КСФ.
8) Препараты, действующие на иммунологические механизмы: преднизолон 40-50 мг./сут в/в, но нужна большая осторожность.
9) Иммуномодуляторы: декарис — стимулирует то, что угнетено и угнетает то, что увеличено. Применять по 150 мг/сут.
10) Лейкоген, пентоксил — но эффект слабый.
11) Перевод на перентральное питание.
