Гиперплазия эндометрия — симптомы и лечение, причины, диагностика, профилактика
Внутренняя оболочка матки у женщины репродуктивного возраста подвержена изменениям под действием половых гормонов – эстрогенов. При их чрезмерной стимуляции возникает гиперплазия эндометрия – его избыточное разрастание, увеличение толщины и изменение клеток. Это состояние является доброкачественным, но в некоторых случаях может привести к раку матки. Заболевание чаще встречается у женщин с нарушениями менструального цикла, а также в постменопаузальном периоде.
Гиперплазия эндометрия: причины и классификация
Основной причиной заболевания является нарушение баланса между двумя половыми гормонами – эстрогеном и прогестероном. Активная эстрогенная стимуляция при недостатке гестагенов приводит к разрастанию клеток эндометрия, как это происходит в первую фазу менструального цикла, но к более выраженному.
Факторы, способные вызвать гормональный дисбаланс:
- синдром поликистозных яичников;
- состояние постменопаузы;
- избыточный вес.
Другие причины гиперплазии эндометрия:
- эндокринные заболевания – диабет, ожирение;
- заболевания яичников;
- прием тамоксифена по поводу рака молочной железы.
В России часто используется такая классификация заболевания:
- эндометриальные полипы;
- простая железистая гиперплазия эндометрия;
- железистокистозная очаговая гиперплазия эндометрия;
- диффузная железистокистозная гиперплазия эндометрия;
- атипическая гиперплазия эндометрия (аденоматоз), очаговая или диффузная, в том числе аденоматозные полипы.
Согласно ВОЗ, различают 2 основных вида этой патологии – без атипии и атипическую. Каждый из них может быть простым и сложным. Клетки, образующие железы эндометрия, претерпевают изменения разной степени выраженности – от незначительных до предраковых.
Эндометрий при железистой гиперплазии разрастается, но его клетки не подвергаются изменениям. Кистозная перестройка – формирование из некоторых желез округлых образований (кист). Это наименее опасная из всех форм заболевания, она хорошо поддается гормональной терапии.
Простая атипичная гиперплазия эндометрия сопровождается изменением свойств клеток на отдельном участке. Она поддается гормональной терапии и имеет низкий риск озлокачествления. Сложная форма этой разновидности патологии – наиболее опасная и часто трансформируется в рак эндометрия. Лечение нередко состоит в удалении матки.
Гиперплазия эндометрия – симптомы
Наиболее частые признаки гиперплазии эндометрия связаны с изменениями менструального цикла. Они могут наблюдаться ежедневно или в определенные фазы цикла, их выраженность тоже может быть разной.
Основные симптомы гиперплазии эндометрия:
- нерегулярные менструации;
- угревая сыпь на коже;
- сухость во влагалище;
- кровянистые выделения между менструациями;
- боль во время полового акта;
- приливы жара;
- отсутствие менструации;
- учащенное сердцебиение, утомляемость;
- нестабильность настроения;
- усиление роста волос на теле;
- слишком обильные или длительные менструации;
- боль в нижней части живота.
При появлении таких симптомов необходимо обратиться к гинекологу. Специалисты клиники на Барклая, расположенной в Москве, окажут таким пациенткам квалифицированную помощь в диагностике и лечении этого серьезного заболевания.
Диагностика и лечение гиперплазии эндометрия
Главная задача диагностики заболевания – подтвердить утолщение эндометрия и наличие в нем измененных клеток. Это может быть сделано на УЗИ и путем взятия биопсии.
Материал для микроскопического исследования может быть получен в ходе диагностического выскабливания полости матки.
Для выяснения толщины эндометрия применяется УЗИ. Большей информативностью обладает трансвагинальный метод, когда датчик вводится во влагалище. Врач оценивает эхопризнаки заболевания, в том числе и с точки зрения возможного развития рака.
Лечение железистой гиперплазии эндометрия и простой формы атипической гиперплазии проводится с помощью гормональных препаратов. Обычно это средства на основе гестагенов, которые принимают внутрь, или регулярно в форме инъекций, либо путем введения внутриматочной гормональной спирали. Во время такого курса беременность невозможна.
Применяются и другие группы лекарств – антигонадотропные препараты и агонисты гонадотропин-рилизинг гормона.
Также врачи используют кюретаж стенок матки для удаления разросшихся тканей. Лечение гиперплазии эндометрия без выскабливания возможно при легких формах заболевания и включает абляцию (удаление) эндометрия путем диатермокоагуляции или лазерного воздействия.
В тяжелых случаях, не поддающихся медикаментозному лечению, при постоянных кровотечениях, рецидивирующей гиперплазии или при комплексной атипичной форме патологии может быть рекомендовано хирургическое лечение гиперплазии эндометрия – удаление матки.
Удаление полиповидных образований производится с помощью гистероскопии.
Профилактика гиперплазии эндометрия
Для снижения риска этой патологии необходимо:
- в перименопаузальном периоде назначать женщинам эстрогены только в комбинации с гестагенными препаратами;
- при нерегулярных менструациях по назначению врача использовать оральные контрацептивы, нормализующие цикл;
- поддерживать нормальный вес.

Лечение в клинике на Барклая
Терапия гиперплазии эндометрия довольно сложна и зависит от возраста пациентки, тяжести заболевания, выраженности его признаков, возможности принимать препараты, их переносимости и многих других факторов. Такая женщина нуждается в регулярном наблюдении и лечении у гинеколога.
Клиника на Барклая предлагает:
- консультации и лечение у квалифицированных врачей;
- тщательное диагностическое обследование;
- динамическое наблюдение и оценку эффективности лечения;
- подбор наиболее современного и эффективного гормонального препарата;
- психологический комфорт для пациенток, внимательное отношение всего персонала;
- доступные цены на услуги.
Запишитесь на прием к гинекологу по телефону клиники. Помните, что при правильном лечении все пациентки с гиперплазией эндометрия избегают злокачественной трансформации этого заболевания.
Клиника Ито
Первичный гиперпаратиреоз
Что такое первичный гиперпаратиреоз?
Первичный гиперпаратиреоз представляет собой состояние, при котором паратиреоидный гормон выделяется в избыточных количествах из-за отклонений в самих паращитовидных железах. Паратиреоидный гормон, также как и другие гормоны, необходим организму, но избыточная выработка гормона оказывает пагубный эффект.
Поскольку при первичном гиперпаратиреозе паратиреоидный гормон выделяется в избыточных количествах из-за патологического состояния паращитовидных желез, включая аденому, рак и другие опухоли, а также гиперплазию, а уровень кальция в крови аномально повышается, это может вызвать разнообразные симптомы. Гиперпаратиреоз диагностируется приблизительно у 1 из 4000 – 5000 человек, при этом, на рак паращитовидной железы приходится около 1- 5 % всех случаев, поэтому можно сказать, что он ассоциируется с раком крайне редко.
 д. Заболевание, вызванное отклонениями в самих паращитовидных железах, называется «первичным» гиперпаратиреозом, заболевание, вызванное другими причинами, — «вторичным» гиперпаратиреозом.
д. Заболевание, вызванное отклонениями в самих паращитовидных железах, называется «первичным» гиперпаратиреозом, заболевание, вызванное другими причинами, — «вторичным» гиперпаратиреозом.Симптомы
Существует 3 типичных симптома:
(1)Отклонения в костях (кости становится хрупкими и подверженными переломам. В тяжелых случаях может наблюдаться уменьшение роста)
(2)Мочевые камни: (камни в почках)
(3)Гиперкальциемия (головная боль, жажда, изжога, тошнота, потеря аппетита, запоры и другие расстройства ЖКТ, раздражительность, утомляемость, снижение мышечного тонуса и т.д.)
В последнее время растет число примеров случайного обнаружения гиперкальциемии при диспансеризации и т.д. еще до проявления типичных симптомов.
При этой болезни несколько повышенный уровень кальция в крови, особенно на начальной стадии заболевания, часто не вызывает никаких явных симптомов. Однако при значительном повышении уровня кальция в крови вышеприведенные симптомы могут усугубляться.
Рак паращитовидной железы часто вызывает избыточно высокий уровень кальция, поэтому 3 вышеприведенных симптома отчетливо проявляются.
Обследование
Поскольку это редкое заболевание, такие симптомы как вялость и т.д. могут оцениваться как психологические, оставляя проблему нераспознанной в течение длительного времени. Эти симптомы, конечно, могут также вызываться другими причинами, и наличие таких симптомов не обязательно означает, что человек страдает данным заболеванием. Однако поскольку в последнее время в большинстве больниц можно провести анализ на уровень кальция и паратиреоидного гормона в крови, болезнь стала диагностироваться более эффективно.
(1)Обследования для диагностирования заболевания: анализ крови/ анализ мочи
Повышенный уровень кальция (Ca) в сыворотке крови, повышение уровня паратиреоидных гормонов (i-PTH, общий PTH), изменение в уровне кальция (Ca) в моче и т. д
д
(2)Обследования для определения расположения опухолей в паращитовидных железах
Ультразвуковое исследование (УЗИ), радиоизотопное обследование (сцинтиграфия паращитовидных желез (МИБИ-сцинтиграфия)), КТ шейного отдела и т.д.
Рак паращитовидной железы трудно диагностировать перед лечением. Диагноз приходится ставить после комплексной оценки всех симптомов, результатов указанных выше обследований и результатов гистопатологического исследования после хирургической операции.
Лечение
Показанием к лечению является точное диагностирование гиперкальциемии, повышенного уровня паратиреоидного гормона и подтверждение наличия гипертрофированного участка паращитовидных желез в результате обследований. Существуют такие методы лечения как чрескожные инъекции этанола (ЧИЭ) и медикаментозная терапия, но основным методом лечения является удаление пораженного участка паращитовидной железы. (На конференции NIH* была провозглашена концепция бессимптомного гиперпаратиреоза, и при выполнении условий возможен выбор наблюдения за состоянием пациента).
※Национальный институт здравоохранения
| Метод проведения операции (тип операции) | |
| Аденома | Удаление гипертрофированных паращитовидных желез |
| Гиперплазия | Тотальная резекция паращитовидных желез с последующей аутологической трансплантацией (в предплечье и т.д.) |
| Рак | Частичная резекция щитовидной железы, включая лимфатические узлы |
Повседневная жизнь
В случае чрезвычайно высокого уровня кальция в крови и наличия ярко выраженных симптомов требуется срочная госпитализация. Кроме того, при хрупкости костей необходимо соблюдать постельный режим.
Кроме того, при хрупкости костей необходимо соблюдать постельный режим.
При этом неотложное лечение может не требоваться, если у пациента наблюдается лишь небольшое повышение уровня кальция в крови и отсутствуют явные симптомы. Человек может поддерживать обычный образ жизни, а также продолжать работу до определения даты госпитализации.
Пациенты могут употреблять обычную пищу. При отсутствии соответствующих указаний врача, нет необходимости ограничивать себя в богатой кальцием пище, такой как молоко или мелкая рыба.
МРТ почек и надпочечников с контрастом: исследование и диагностика
Почки — это парный паренхиматозный орган, выполняющий множества функций, одна из основных — выделительная. Надпочечники также являются парным органом, выполняющие эндокринную функцию.
МРТ почек проводят как дополнительный уточняющий метод обследования, после проведенного ранее УЗИ и/или КТ. МРТ является информативным методом обследования мягких тканей, потому он хорошо подходит для поиска новообразований почек и надпочечников.
При проведении МРТ почек оценивают расположение, размеры и контуры почек, толщину паренхимы, дифференциацию мозгового и коркового вещества, однородность структуры, чашечно-лоханочную систему, крупные почечные сосуды, верхние отделы мочеточника. Также проводят обязательный анализ размеров, контуров и структуры надпочечников.
Перед началом исследования с пациента снимают все объекты с содержанием металла (украшения, часы, пластиковые карты, слуховые аппараты, съемные зубные протезы, очки, пирсинг и т.д.).
Исследование проводят в неподвижном состоянии на пустой желудок, последний прием пищи за 5-6 часов до процедуры для исключения артефактов (искажения изображения) от наполненного желудка и кишечника. Также за несколько дней рекомендуется исключить продукты, способствующие газообразованию (грубая клетчатка, кисломолочные продукты, газированные напитки и т.д.). За полчаса до исследования — 2 таблетки спазмолитических препаратов (при отсутствии противопоказаний!).
Исследование по времени занимает 30-60 минут. Важно пациенту знать, что во время сканирования необходимо задерживать дыхание на короткое время.
Во время исследования пациенту могут предложить введение контрастного вещества для диагностики и дифференциации новообразований, выделительной функции почек.
При предъявлении пациентами жалоб на боли в области поясницы, почечные колики, отеки, повышение артериального давление, головной боли, изменение анализов на гормоны могут назначить МРТ почек и надпочечников. Изменения структуры почек, которые могут выявить:
- Новообразование почек и надпочечников, с уточнения распространения за капсулу почек,
- Доброкачественные образования почек (кисты, ангиомиолипомы, липомы),
- Определить класс кистозных образований по Figo,
- Доброкачественные образования надпочечников (узловая гиперплазия, аденома и тд),
- Воспалительные изменения почек (пиелонефрит, абсцессы и тд),
- Травма почек (гематомы интрапаренхиматозные и субкапсулярные),
- Гидронефроз (расширение чашечно-лоханочной системы), камни в просвете мочеточников, перегиб пиелоуретрального сегмента,
- Ишемические изменения в почках (инфаркт).
Имеются противопоказания к прохождению МРТ:
- установленный кардиостимулятор (изменения магнитного поля могут имитировать сердечный ритм),
- ферромагнитые или электронные имплантаты среднего уха ,
- большие металлические имплантаты, ферромагнитные осколки, металлические штифты, винты, пластины,
- ферромагнитные аппараты Илизарова,
- кохлеарные имплантаты,
- инсулиновые насосы,
- нервные стимуляторы,
- неферромагнитные имплантаты внутреннего уха,
- протезы клапанов сердца,
- некоторые кровоостанавливающие клипсы,
- первый триместр беременности (на данный момент собрано недостаточное количество доказательств отсутствия тератогенного эффекта магнитного поля, однако метод предпочтительнее рентгенографии и компьютерной томографии),
- клаустрофобия (панические приступы во время нахождения в тоннеле аппарата могут не позволить провести исследование).

При широком выборе видов диагностики необходимо учитывать показания, противопоказания и преимущества каждого метода.
Преимущества УЗИ: первичный скрининговый метод обследования, доступная стоимость; выявление камней; при проведении ультразвуковой доплерографии имеется возможность оценить состояние кровообращения в почках и надпочечниках; возможность за одно исследование оценить состояние мочевого пузыря.
Преимущества МРТ: обладает большей информативностью в диагностики опухолей и ее детализации. МРТ проводят при неэффективности данных УЗИ и КТ, при противопоказании к проведению КТ, экскреторной урографии.
Цены на МРТ почек
| Наименование услуги | Цена, руб |
|---|---|
| МРТ мягких тканей конечностей (одна область) | 5250 |
| МРТ мягких тканей конечностей (одна область) с контрастом | 9450 |
| МРТ органов забрюшинного пространства (почки, надпочечники) | 4720 |
| МРТ органов забрюшинного пространства (почки, надпочечники) с контрастом | 9970 |
Доброкачественная гиперплазия предстательной железы (простаты) (ДГП)
Доброкачественная гиперплазия простаты (ДГП) — наиболее частое урологическое заболевание мужчин старшего и пожилого возраста. Высокая социальная значимость и актуальность заболевания подчеркивается демографическими исследованиями ВОЗ, свидетельствующими о прогрессирующем увеличении населения планеты за счет лиц старше 60 лет, темпы которого опережают рост населения в целом.Сущностью заболевания является увеличение предстательной железы в объеме за счет гиперпластического процесса в эпителии простатических парауретральных желез. Если в норме объем предстательной железы составляет 20 – 28 куб. см., то при доброкачественной гиперплазии он увеличивается до 35 – 70 куб. см. и более. Описаны случаи, когда объем простаты при этом заболевании достигал 300 – 320 куб. см. Находясь у основания мочевого пузыря с проходящим через нее начальным отделом мочеиспускательного канала, увеличенная в объеме простата приводит к сдавлению мочеиспускательного канала. В результате развиваются основные симптомы заболевания. При отсутствии необходимого лечения, эти симптомы прогрессируют и развиваются такие осложнения, как острая и хроническая задержка мочи, декомпенсация функции мочевого пузыря, гидронефротическая трансформация почек с развитием почечной недостаточности, камни почек и мочевого пузыря, восходящая инфекция органов мочевой системы.
см. Находясь у основания мочевого пузыря с проходящим через нее начальным отделом мочеиспускательного канала, увеличенная в объеме простата приводит к сдавлению мочеиспускательного канала. В результате развиваются основные симптомы заболевания. При отсутствии необходимого лечения, эти симптомы прогрессируют и развиваются такие осложнения, как острая и хроническая задержка мочи, декомпенсация функции мочевого пузыря, гидронефротическая трансформация почек с развитием почечной недостаточности, камни почек и мочевого пузыря, восходящая инфекция органов мочевой системы.
Распространенность. Многолетние исследования отечественных и зарубежных авторов сходятся в том, что большинство мужчин старше 50 лет имеют те или иные симптомы, обусловленные Доброкачественной гиперплазией простаты (ДГП). (Barry M.J., Fowler F.J., Oleary M.P. et al.1993) По оценке О.Л. Тиктинского с соавт. (1995), среди всех заболеваний, которыми страдают мужчины старше 50 лет, на доброкачественную гиперплазию простаты приходится 36%. При этом, если после 50 лет около 25% мужчин имеют симптомы Доброкачественной гиперплазии простаты (ДГП), то в возрасте 60-69 лет проявления этого заболевания испытывают уже 43% мужчин .(Garraway, W., Collins, G., and Lee, R.,1999). В последние десятилетия отмечается тенденция к росту заболевания во всем мире. В настоящее время в США 30% мужчин в возрасте 40 лет имеют шанс подвергнуться оперативному лечению по поводу Доброкачественной гиперплазии простаты (ДГП). (Glynne R.J., Campion E.W. at al,1995) Двадцать пять лет назад такие шансы были лишь у 10% мужчин того же возраста. Lytton B, Emery J M, Harvard B M. 1968). По данным Н.А. Лопаткина (1999), эпидемиологические исследования в нашей стране выявили нарастание частоты ДГП с 11,3% в возрасте 40-49 лет до 81,4% в возрасте 80 лет. До 30% мужчин сорокалетнего возраста, доживающих до 80 лет, оперируются по поводу ДГП. Средняя обращаемость по поводу ДГП в России составляет 113-125 человек на 100.000 мужского населения, в Ростове процент такой же. В США общие расходы здравоохранения на лечение пациентов с ДГП составляют не менее 5 миллиардов долларов ежегодно (Geller J, Kirschenbaum A, et al.,1995).
В США общие расходы здравоохранения на лечение пациентов с ДГП составляют не менее 5 миллиардов долларов ежегодно (Geller J, Kirschenbaum A, et al.,1995).
Симптомы.
Основными симптомами доброкачественной гиперплазии простаты являются затруднение при мочеиспускании, вялая струя мочи, учащение мочеиспускания, дисфункция органов мочевой системы (Lepor, 1993). На начальных стадиях заболевания первыми симптомами могут быть императивные позывы к мочеиспусканию, небольшая задержка перед началом мочеиспускания или необходимость один — два раза за ночь посетить туалет. Как правило, сочетаясь с хроническим простатитом, доброкачественная гиперплазия может проявляться и отчетливыми симптомами последнего — болевыми ощущениями внизу живота, в промежности, в области крестца, иногда тянущими болями в мошонке. Часть больных отмечает ослабление или резкое угнетение половой функции. В развитии симптомов ведущую роль играют два фактора: статический – увеличение простаты в объеме и механическое сдавление мочеиспускательного канала, и динамический, обусловленный сокращением гладкой мускулатуры простаты. Развитие заболевания может приводить к ситуации, когда больной перестает самостоятельно мочиться – возникает острая задержка мочеиспускания (ОЗМ) или хроническая задержка мочеиспускания, когда при переполненном мочевом пузыре, моча непроизвольно, по каплям, выделяется из мочеиспускательного канала (парадоксальная ишурия). Хроническая декомпенсация функции мочевого пузыря сопровождается повышенной нагрузкой на функцию почек, их структурными изменениями с развитием почечной недостаточности, нарастанием слабости, утомляемости, отеков, нарушением функции печени и сердечно-сосудистой системы, падением иммунитета. Явления венозного застоя и расширение вен мочевого пузыря могут сопровождаться периодической примесью крови к моче и приводить к развитию мочепузырного кровотечения. Примесь крови к моче может быть также признаком образования камней мочевого пузыря на фоне декомпенсации функции последнего. При этом больные часто жалуются на выраженные боли в области мочевого пузыря и частые, непрекращающиеся позывы на мочеиспускание. При отсутствии правильного лечения, симптомы доброкачественной гиперплазии простаты могут сделать жизнь больного очень мучительной, а осложнения этого заболевания – поставить жизнь под угрозу.
При этом больные часто жалуются на выраженные боли в области мочевого пузыря и частые, непрекращающиеся позывы на мочеиспускание. При отсутствии правильного лечения, симптомы доброкачественной гиперплазии простаты могут сделать жизнь больного очень мучительной, а осложнения этого заболевания – поставить жизнь под угрозу.
Патогенез.
Развитие доброкачественной гиперплазии простаты обусловлено взаимодействием нескольких факторов, связанных с возрастными изменениями мужского организма. Еще в 1959 г. А.Я. Пытель писал, что это «не есть заболевание только мочевой и половой системы, а представляет собой весьма сложное заболевание всего организма, где имеют место глубокие нарушения обмена веществ и расстройства корреляций между разными органами и системами». Теперь, спустя полвека, эти слова полностью подтвердились. Исследованиями последнего времени установлено, что одной из ведущих причин развития доброкачественной гиперплазии простаты (ДГП) являются возрастные изменения гормонального баланса мужского организма, включающие взаимодействие стероидных гормонов, прежде всего, андрогенов и эстрогенов с различными факторами роста самой предстательной железы (De Miguel M.P; Royuela M, et al. 1999). Андрогены, а именно 5--дигидротестостерон (ДГТ) — метаболит тестостерона, присутствующий в простате, способствует пролиферации, то есть размножению, клеток эпителия при нарушении взаимодействия последнего со стромой, что сопровождается дисбалансом между программируемой гибелью и пролиферацией клеток. При этом стромальную гиперплазию вызывают эстрогены, точнее эстрадиол, который оказывает синергический эффект с дигидротестостероном. Установлено, что уровень андрогенов определяет увеличение объема простаты за счет гиперплазии эпителия, в то время как мышечное сокращение ее гладкой мускулатуры вызывает норадреналин, действуя через -1-адренергические рецепторы (Mackenzie, J.F., Daly, et al. 1999). Поэтому степень выраженности симптомов при Доброкачественной гиперплазии простаты (ДГП) лишь частично связана с объемом простаты (Garraway, W. , Collins, G., et al. 1991). При этом эстрогены поддерживают увеличение простаты, обусловленное андрогенами, и сокращение гладкой мускулатуры, обусловленное норадреналином.
, Collins, G., et al. 1991). При этом эстрогены поддерживают увеличение простаты, обусловленное андрогенами, и сокращение гладкой мускулатуры, обусловленное норадреналином.
Немаловажную роль в развитии ДГП исследователи отводят нарушению ферментного состава ткани железы и наличии хронического воспалительного процесса – простатита. Лечение воспаления проходит очень сложно. Исследованиями показано, что ДГП почти в 100% случаев сочетается с хроническим простатитом. (Ю.В. Кудрявцев, Л.М. Романова, 1998; Bedalov G, Vuckovic I, et al. 1994; Mohanty N.K, Jolly BB, 1996; Bradley R. Hennenfent, Antonio Novak Feliciano, 2000). По данным J. Nickel (1997), хронический простатит обнаруживается более, чем в 99% образцов ткани при резекции простаты в связи с доброкачественной гиперплазией простатой (ДГП). Некоторые исследователи считают, что ДГП является прямым следствием предшествующего хронического простатита (Brad Hennenfent, 1999). Имеются и экспериментальные модели развития ДГП вследствие воспалительных изменений в простате (Oded J. Kessler et al., 1998).
Помимо указанных факторов, имеются исследования, посвященные роли иммунной системы в патогенезе ДГП, в частности, роли цитокинов в пролиферации простатического эпителия (Санамянц В.А., Евстропов В.М. 2002, Санамянц В.А. Красулин В.В., 2006). Иммунная система в первую очередь ответственна за структурный гомеостаз органов и тканей. Возрастные изменения иммунной системы, как правило, являются ключевыми в развитии гиперпластических процессов различной локализации. Установлено, что важную роль в развитии гиперпластических и онкологических процессов в возрасте 55-65 лет играет снижение активности естественных киллеров (NК) и способности лейкоцитов к продукции - и -интерферонов (В.П. Кузнецов с соавт., 2000). У лиц пожилого возраста не только уменьшается количество Т-лимфоцитов, но и снижается их функция, в частности, выработка интерлейкина-2 (IL-2) Тх-клетками (В.В. Смирнов с соавт., 1999). При этом интерферон (прежде всего, -интерферон) активирует макрофаги и естественные киллеры (NK), которые затем синтезируют -интерферон и интерлейкины (IL) — 1,2,4,6 (Matsuyama T. , Kimura Т, et al., 1993). Участие системы интерферонов (ИФН-системы) в поддержании структурного гомеостаза обусловлено антигенами, подключающими эту систему к активной функциональной деятельности (Thiele J, Wickenhauser C. et al., 1998). Интерфероны резко усиливают экспрессию клеточных рецепторов к цитокинам и обусловливают быструю индукцию генов раннего ответа («immediatly early» генов) (Kimura, T., Kadokawa, Y. et al., 1996). Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки — они кодируют белки, регулирующие репликацию ДНК. Поэтому важнейшим свойством ИФН-системы является выраженное ингибирование пролиферативных процессов (Lothar Rink 1993; Janis Kuby, 1997).
, Kimura Т, et al., 1993). Участие системы интерферонов (ИФН-системы) в поддержании структурного гомеостаза обусловлено антигенами, подключающими эту систему к активной функциональной деятельности (Thiele J, Wickenhauser C. et al., 1998). Интерфероны резко усиливают экспрессию клеточных рецепторов к цитокинам и обусловливают быструю индукцию генов раннего ответа («immediatly early» генов) (Kimura, T., Kadokawa, Y. et al., 1996). Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки — они кодируют белки, регулирующие репликацию ДНК. Поэтому важнейшим свойством ИФН-системы является выраженное ингибирование пролиферативных процессов (Lothar Rink 1993; Janis Kuby, 1997).
Диагностика.
Основанием для установления диагноза «доброкачественная гиперплазия простаты» являются данные жалоб пациента, тщательный сбор анамнеза, оценка мочеиспускания по международной шкале IPSS, оценка качества жизни по шкале QOL, пальцевое ректальное исследование предстательной железы. Из лабораторных исследований проводятся анализы мочи, общие и биохимические показатели крови, исследование PSA – антигена общего и свободного; по показаниям – почечные и печеночные пробы. Для оценки сопутствующего хронического простатита проводится исследование секрета предстательной железы, микроскопия мазков из мочеиспускательного канала, ПЦР-исследования, бактериологические посевы. Данные ультразвукового исследования (УЗИ или ТРУЗИ простаты) позволяют выявить размеры, объем, ультразвуковую структуру органа, наличие в структуре очагов гиперплазии, их объем и локализацию, а также рубцовых изменений, кист и других патологических образований. Ультразвуковое исследование почек проводится для оценки их морфологических изменений, наличия расширения полостных систем, патологических образований, камней; исследовании мочевого пузыря дает возможность определить его объем, толщину стенок, наличие или отсутствие остаточной мочи. Для оценки функции мочевого пузыря проводится компьютерная урофлоуметрия (УФМ), которая дает показатели максимального и среднего потока мочи, время мочеиспускания и пр. При том, что диагностика Доброкачественной гиперплазии простаты (ДГП), как правило, не вызывает затруднений, это заболевание в обязательном порядке необходимо дифференцировать от рака предстательной железы и от гранулематозных форм хронического простатита. При подозрении на рак предстательной железы больному проводится компьютерная томография органов малого таза, ЯМР – исследования и многофокусная трансректальная биопсия простаты.
При том, что диагностика Доброкачественной гиперплазии простаты (ДГП), как правило, не вызывает затруднений, это заболевание в обязательном порядке необходимо дифференцировать от рака предстательной железы и от гранулематозных форм хронического простатита. При подозрении на рак предстательной железы больному проводится компьютерная томография органов малого таза, ЯМР – исследования и многофокусная трансректальная биопсия простаты.
Лечение.
До 80-х годов ХХ века доброкачественная гиперплазия простаты (ДГП) имела лишь один надежный способ лечения, а именно, открытые операции – чрезпузырная и позадилонная аденомэктомия. На фоне общего старения населения, значительной послеоперационной смертности (2 – 3%) и большого числа послеоперационных осложнений (до 12 – 23%), в последние два десятилетия произошли коренные изменения концепции лечения ДГП в рамках совещаний, организованных Международным консультативным комитетом по урологическим заболеваниям под эгидой ВОЗ. Произошло смещение акцента с открытых хирургических способов лечения к широкому спектру менее инвазивных методов — трансуретральной резекции простаты (ТУР), лазерной абляции, электровапоризации (ЭВП), трансуретральной игольчатой абляции и другим методам.
Тем не менее, «золотым стандартом» современного лечения Доброкачественной гиперплазии простаты (ДГП) является трансуретральная резекция простаты (ТУР). Сегодня это одна из самых распространенных эндоскопических операций, при которой участки ткани гиперплазированной железы удаляются токами высокой частоты с использованием специального эндоскопического инструментария — резектоскопа, введенного в просвет мочеиспускательного канала. Вместе с тем, оценка результатов ТУР свидетельствует, что и этот метод почти у 18% пациентов имеет осложнения – кровотечения во время операции и после нее, так называемый ТУР-синдром, рецидивы заболевания, неудержание и недержание мочи, рубцовые изменения и стриктуры мочеиспускательного канала, ослабление эрекций, при этом ретроградная эякуляция после ТУР наблюдается у 24 – 78% оперированных больных (С. В. Павлов, 1998). Рядом исследований продемонстрировано, что эффективность оперативного лечения ДГП не превышает 75%. От 20 до 30% мужчин после операции не удовлетворены ее результатами и не отмечают существенного уменьшения симптомов нарушения мочеиспускания и улучшения качества жизни (Севрюков Ф, А., 1999; Mebust WK, Holtgrewe HL, et al. 1999).
В. Павлов, 1998). Рядом исследований продемонстрировано, что эффективность оперативного лечения ДГП не превышает 75%. От 20 до 30% мужчин после операции не удовлетворены ее результатами и не отмечают существенного уменьшения симптомов нарушения мочеиспускания и улучшения качества жизни (Севрюков Ф, А., 1999; Mebust WK, Holtgrewe HL, et al. 1999).
Определенная роль в безоперационном лечении доброкачественной гиперплазии простаты (ДГП) до последнего времени отводилась методам гипертермии (нагрев простаты до 43 градусов) и термотерапии (нагрев до 44 – 51 градусов) простаты при помощи микроволнового СВЧ – излучения. Эти методы стали активно внедряться в практику с начала 1990-х годов. При этом последующие исследования выявили их недостаточную эффективность, находящуюся в границах 14 – 40%, при таких, достаточно частых осложнениях термотерапии, как поздние кровотечения. В настоящее время гипертермия и термотерапия простаты в лечении ДГП имеют ограниченное применение.
В то же время, экспериментальные и клинические исследования, базирующиеся на современных концепциях патогенеза этого заболевания, открыли путь безоперационному медикаментозному лечению ДГП, сформулировав основные принципы этого лечения — (А) подавление андрогенов, (Б) блокада -1-адренорецепторов и (В) подавление эстрогенов. Эти принципы сегодня активно развиваются; при том, что они еще далеки от совершенства, их внедрение в практику привело к тому, что уже сегодня подвергаются операции лишь 30 – 35% пациентов с диагнозом ДГП.
Медикаментозный метод подавления андрогенов обусловлен тем, что самым активным андрогеном простаты является дигидротестостерон (ДГТ), который синтезируется простатой из тестостерона при участии фермента 5--редуктазы. Подавление этого фермента финастеридом, который содержится в препаратах «Проскар», «Финаст» и пр., тормозит развитие Доброкачественной гиперплазии простаты (ДГП). Установлено, что при длительном применении (2,5 – 4 года) финастерид способен приводить к уменьшению объема простаты у 40-48% пациентов в среднем на 14% от ее первоначального объема.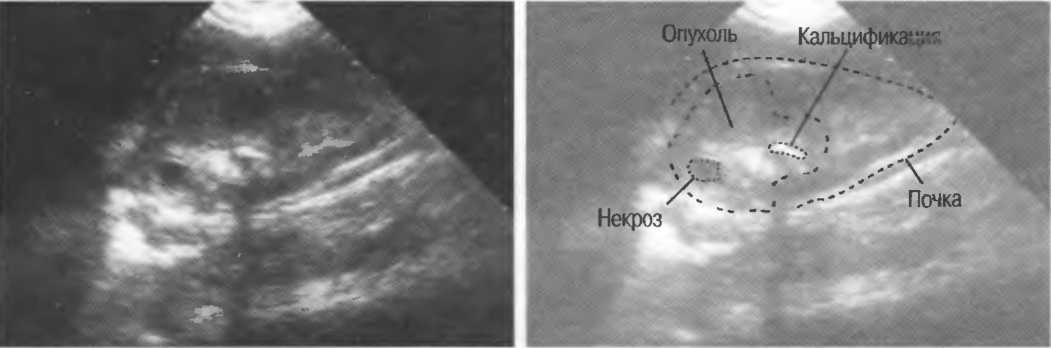 При этом, заметный лечебный эффект финастерид оказывает тогда, когда объем простаты превышает 40 мл. (Boyle et al., 1996). Однако, в связи с тем, что 5--редуктаза присутствует не только в простате, но и в эпидидимисе и семенных пузырьках, побочные действия финастерида, среди прочих, включают эректильную и эякуляторную дисфункции, что нередко побуждает пациентов к отказу от лечения.
При этом, заметный лечебный эффект финастерид оказывает тогда, когда объем простаты превышает 40 мл. (Boyle et al., 1996). Однако, в связи с тем, что 5--редуктаза присутствует не только в простате, но и в эпидидимисе и семенных пузырьках, побочные действия финастерида, среди прочих, включают эректильную и эякуляторную дисфункции, что нередко побуждает пациентов к отказу от лечения.
Медикаментозный метод блокады -1-адренорецепторов обоснован тем, что рецепторы норадреналин-зависимого сокращения гладкой мускулатуры простаты принадлежат к подтипу -1 (Graham el al., 1996). В связи с этим подавление функции -1-адренорецепторов с помощью -1-блокаторов, к которым относятся Празозин, Альфузозин, Доксазозин (Кардура), Тамсулозин (Омник) и пр., приводит к ослаблению симптомов Доброкачественной гиперплазии простаты (ДГП), причем терапевтический эффект -1-блокаторов коррелирует с количеством гладкой мускулатуры в простате (Shapiro el al., 1992). Так как -1-адренорецепторы находится не только в простате, но и в сосудах, их подавление, как правило, приводит к понижению сосудистого тонуса. Как следствие, лечение -блокаторами часто (<20%) приводит к таким явлениям, как снижение кровяного давления, головокружение, атаксия и обмороки (Eri and Tvetter, 1995). Единственный препарат, который практически не вызывает этих осложнений – тамсулозин (Омник). Это обусловлено тем, что в отличие от -1-адреноцепторов сосудов, рецепторы простаты принадлежат подтипу -1А, на которые Тамсулозин действует избирательно, являясь единственным высокоспецифичным простатоселективным -1А-адреноблокатором.
Медикаментозный метод подавления эстрогенов основан на том, что эстрогены у мужчин синтезируются из андрогенов при участии фермента ароматазы. В течение ряда лет медикаментозное лечение ДГП включало препараты-ингибиторы ароматазы, например, атаместан. Однако, как показали исследования, эффективность такого лечения невелика – снижение уровня эстрогенов применением атаместана неизменно сопровождается увеличением выработки андрогенов (Gindell et al. , 1995). Поэтому альтернативным методом снижения уровня эстрогенов стал метод, направленный на усиление их естественной экскреции, что достигается использованием Мепартрицина. Мепартрицин связывает эстрогены, находящиеся в кишечнике, блокируя их проникновение в систему внутрипеченочной циркуляции крови. Как следствие, применение Мепартрицина снижает уровень эстрогенов в плазме (Lotti et al., 1988) и ослабляет симптомы ДГП.
, 1995). Поэтому альтернативным методом снижения уровня эстрогенов стал метод, направленный на усиление их естественной экскреции, что достигается использованием Мепартрицина. Мепартрицин связывает эстрогены, находящиеся в кишечнике, блокируя их проникновение в систему внутрипеченочной циркуляции крови. Как следствие, применение Мепартрицина снижает уровень эстрогенов в плазме (Lotti et al., 1988) и ослабляет симптомы ДГП.
Определенную роль в лечении доброкачественной гиперплазии простаты (ДГП) имеют и растительные препараты (фитопрепараты), содержащие вытяжки карликовой пальмы Serenoa repens (Пермиксон, Простаплант, Простамол) и африканской грушиygeum africanum (Таденан). Исследованиями показано, что применение этих препаратов способно не только ослаблять симптоматику ДГП, но частично тормозить развитие гиперпластического процесса в простате (Е.Б. Мазо, М.Н. Белковская, 2001).
В дополнение к изложенным методам лечения, МКЦ «Ваш Докторъ» использует собственные уникальные разработки лечения доброкачественной гиперплазии простаты (ДГП), активно воздействуя на ликвидацию воспалительного процесса в простате, являющегося патогенетическим фактором развития заболевания и используя защищенный Государственным патентом метод локальной иммунотерапии простаты, в короткий срок приводящий к уменьшению объема железы и подавляющий в ней гиперпластические и пролиферативные процессы.
| Выпуск | Название | |
| № 2 (2013) | НОВЫЙ ПОДХОД К ОЦЕНКЕ МУЖСКОЙ СЕКСУАЛЬНОСТИ ПРИ СИМПТОМНОЙ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРОСТАТЫ (РОСТОВСКАЯ АНКЕТА) | Аннотация PDF (Rus) похожие документы |
| А. Ю. Киреев | ||
| «… основных клинических проявлений доброкачественной гиперплазии предстательной железы, а также позволяет …» | ||
| Том 8, № 4 (2020) | Опыт использования технологии MOSES при эндоскопическом лечении гиперплазии предстательной железы | Аннотация PDF (Rus) похожие документы |
| К. С. Пешехонов, О. О. Бурлака, Е. С. Шпиленя, Б. К. Комяков | ||
| № 2 (2013) | ВЛИЯЕТ ЛИ ГИПОГОНАДИЗМ НА РЕЗУЛЬТАТЫ ТРАНСУРЕТРАЛЬНОЙ РЕЗЕКЦИИ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ? | Аннотация PDF (Rus) похожие документы |
| А. В. Сигаев, В. В. Митусов, А. Ю. Киреев, М. И. Коган | ||
| «… доброкачественной гиперплазией предстательной железы (ДГПЖ) остается неизученным. В исследование включены 98 …» | ||
| № 3 (2013) | ПРИМЕНЕНИЕ ОРИГИНАЛЬНЫХ АЛЬФА-1-АДРЕНОБЛОКАТОРОВ И ИХ ГЕНЕРИКОВ В КЛИНИЧЕСКОЙ УРОЛОГИЧЕСКОЙ ПРАКТИКЕ | Аннотация PDF (Rus) похожие документы |
| В. В. Борисов | ||
| «… генериков, а также вопросам выбора препарата для лечения доброкачественной гиперплазии предстательной железы …» | ||
| № 1 (2016) | ЛАПАРОСКОПИЧЕСКАЯ АДЕНОМЭКТОМИЯ (ПРЕДВАРИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ) | Аннотация PDF (Rus) похожие документы |
| А. Ю. Сероухов, Е. А. Пронкин, К. И. Глинин, И. Э. Мамаев | ||
| «… Инфравезикальная обструкция, обусловленная доброкачественной гиперплазией предстательной железы …» | ||
| Том 8, № 1 (2020) | Сравнительный анализ резекционной и энуклеационных методик эндоскопического лечения гиперплазии предстательной железы у пациентов пожилого возраста | Аннотация PDF (Rus) похожие документы |
| К. С. Пешехонов, Е. С. Шпиленя, Б. К. Комяков, О. О. Бурлака, М. С. Саргсян | ||
| № 1 (2013) | МИКРОБНАЯ КОНТАМИНАЦИЯ ТКАНИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ ПРИ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ И РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | Аннотация PDF (Rus) похожие документы |
| Ю. Л. Набока, М. Б. Чибичян, А. В. Ильяш | ||
| «… отношении, как при раке, так и при доброкачественной гиперплазии предстательной железы, превалируют …» | ||
| № 3 (2014) | ОБЗОР НОВЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ЕВРОПЕЙСКОЙ АССОЦИАЦИИ УРОЛОГОВ ПО ЛЕЧЕНИЮ И ВЕДЕНИЮ БОЛЬНЫХ С НЕНЕЙРОГЕННЫМИ СИМПТОМАМИ НИЖНИХ МОЧЕВЫХ ПУТЕЙ (СНМП И C ДОБРОКАЧЕСТВЕННОЙ ПРОСТАТИЧЕСКОЙ ОБСТРУКЦИЕЙ) | Аннотация PDF (Rus) похожие документы |
| К. Л. Локшин | ||
| Том 5, № 2 (2017) | ОЦЕНКА КОПУЛЯТИВНОЙ ФУНКЦИИ У ПАЦИЕНТОВ, ПОДВЕРГНУВШИХСЯ ТРАНСУРЕТРАЛЬНЫМ И ЭНДОВИДЕОХИРУРГИЧЕСКИМ ВМЕШАТЕЛЬСТВАМ ПО ПОВОДУ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | Аннотация PDF (Rus) похожие документы |
| С. В. Попов, И. Н. Орлов, Т. М. Топузов, Е. А. Гринь, П. С. Кызласов | ||
| «… — хирургических (ЭВХ) методов оперативного лечения доброкачественной гиперплазии предстательной железы (ДГПЖ) на …» | ||
| Том 9, № 1 (2021) | Оценка эффективности баллонной дилатации рубцового сужения шейки мочевого пузыря после трансуретральных вмешательств на предстательной железе (предварительные результаты) | Аннотация PDF (Rus) похожие документы |
| Ш. А. Аббосов, Д. А. Охоботов, Н. И. Сорокин, А. Б. Шомаруфов, Б. М. Шапаров, Я. С. Наджимитдинов, Ш. Т. Мухтаров, Ф. А. Акилов, А. А. Камалов | ||
| Том 7, № 2 (2019) | Ренин-ангиотензиновая и калликреин-кининовая системы простаты: роль в патогенезе гиперплазии простаты | Аннотация PDF (Rus) похожие документы |
| М. Б. Чибичян, Е. А. Черногубова, А. В. Аветян | ||
| «… Актуальность. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является наиболее …» | ||
| Том 7, № 2 (2019) | Современные возможности хирургического лечения гиперплазии предстательной железы | Аннотация PDF (Rus) похожие документы |
| В. В. Красулин, В. П. Глухов, К. С. Васильев | ||
| «… Актуальность. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из самых …» | ||
| 1 — 12 из 12 результатов | ||
Чрескожная пункционная нефростомия — ЧПНС
При наличии препятствий для оттока мочи из почек выполняется чрескожная пункционная нефростомия. Суть операции заключается в установке нефростомы (дренажа) в полость почки, по которому моча поступает во внешние системы сбора. Основными показаниями к проведению чрескожной пункционной нефростомии являются: мочекаменная болезнь (камни почек, мочеточника), опухоли почек и мочеточника, простаты, доброкачественная гиперплазия предстательной железы (аденома простаты), забрюшинный фиброз (болезнь Ормонда), стриктуры мочеточников и т.д. Процедура также проводится при прорастании или сдавлении мочеточников опухолями других органов, лимфомах, лимфоаденопатиях и др. Кроме того, чрескожная пункционная нефростомия является обязательным первым этапом при проведении биопсии чашечно-лоханочной системы почки.
Чрескожная пункционнаянефростомия проводитсяв специально оборудованной операционной врачами-урологами или радиологами. Обязательным условием является рентгенологический и ультразвуковой мониторинг всех этапов процедуры. Длительность проведения ЧПНС обычно не превышает 20-30 минут.
Этапы выполнения
Этапы выполнения чрескожной пункционной нефростомии
Поскольку пункционная игла вводится в поясничную область, то производится укладка пациента на живот или в небольшую косую позицию. После местного обезболивания (лидокаин, новокаин) в кожу поясничной области, под контролем рентгена и ультразвука, вводится игла с мандреном. После проникновения иглы в почечную лоханку, через нее вводится контрастное вещество, позволяющее оценить точность введения и внутреннее строение почки. Затем игла заменяется на проводник и извлекается. С помощью пластиковых и металлических дилятаторов производится постепенное расширение нефростомического канала до нужного размера.
После этого в почку вводят специальный нефростомический катетер (дренаж), а проводник удаляют. Катетер подсоединяется к внешней системе сбора мочи, куда и осуществляется ее отток из данной почки. После окончания чрескожной пункционной нефростомии обязательно проводится контроль артериального давления и других показателей гемодинамики. При их нормальных значениях пациент может быть активизирован. Срок, на который устанавливается нефростома, зависит от показаний, выраженности патологических изменений и тактики дальнейшего лечения. В любом случае, пациент должен избегать ситуаций, при которых возможно выпадение дренажа.
Типы нефростомических катетеров.
Окончательный вид после установки нефростомы.
Потенциальные осложнения
Процедура, как правило, легко переносится пациентами. В первые сутки после операции могут наблюдаться умеренные боли, небольшое количество крови в моче, которые проходят самостоятельно. Более редкими осложнениями являются инфекционные (до 21%), засорение, пережатие или смещение нефростомы (не более 12%). Крайне редко возникают кровотечения, требующие переливания крови (2,8%) или хирургического вмешательства (1%). Мочевые затеки отмечались менее чем у 2% пациентов после ЧПНС. Не более чем в 1% случаев наблюдалось ранение легочной плевры. Возможно также возникновение аллергических реакций, связанных с индивидуальной непереносимостью йодсодержащих контрастных веществ.
Гидронефроз в Сочи — клиника УРО-ПРО — лечение урологических заболеваний
Гидронефроз – это патология, для которой характерно прогрессивное расширение полостной системы и чашек почки. Причиной этому является нарушение циркуляции мочи и повышенное давление в почках. Данное заболевание может привести к ухудшению функционирования почки. Чаще всего встречается у женщин в возрасте от 25 до 35 лет.
Симптомы
У данной болезни нет характерной симптоматики. Выявить ее можно лишь при инфицировании, получении травмы или в случае пальпации в области почек. Однако при гидронефрозе существуют следующие расстройства:
- ноющая боль в области поясницы;
- наличие опухоли в подреберье;
- ощущение коликов в почке;
- приступы тошноты и рвоты;
- вздутие живота;
- высокое артериального давления;
- скудное количество мочи во время обострения и увеличение ее количества после него;
- при инфицированном гидронефрозе возможна высокая температура;
- на запущенных стадиях острая боль отсутствует.
В большинстве случаев единственным показателем является наличие крови в моче, которое наблюдается в основном на ранних стадиях. При поражении обоих почек может резвиться почечная недостаточность.
Причины заболевания
Причины развития данной аномалии могут быть как врожденными, так и приобретёнными.
Врожденные причины:
- дистенезия мочевыводящих путей;
- неправильная локализация почечной артерии, которая сдавливает уретру;
- стриктура уретры;
- ретрокавальное расположение уретры;
- уретероцеле;
- непроходимость нижних мочевыводящих путей.
Приобретенные причины:
- стеноз лоханочно-мочеточникового сегмента;
- стриктура уретры;
- добавочная почечная артерия;
- высокое отхождение мочеточника;
- мочекаменная болезнь;
- опухоль почки, лоханки, уретры, простаты;
- доброкачественная гиперплазия простаты;
- беременность;
- повреждение мочевыводящих путей и прочее.
Постоянное откладывание лечения может привести к почечной недостаточности, которая несет опасность для жизни.
Осложнения
При регулярном откладывании лечения гидронефроз может вызывать серьезные осложнения, такие как:
- пиелонефрит;
- мочекаменная болезнь;
- сепсис, вплоть до летального исхода;
- уменьшение размеров почки, приводящее к ее гибели.
Лечение
Выбор лечения зависит от причин заболевания. Существует консервативное лечение, однако оно малоэффективно и чаще всего направлено на снятие воспалительного процесса, нормализацию давления и снятие признаков почечной недостаточности.
При нормальном функционировании почки проводится пластическая операция, но, если орган утратил свою работоспособность, его приходится удалить.
Гиперплазия почек: Биоинформатика заболеваний: Novus Biologicals
Разместите свое изображение, связанное с болезнями, чтобы оно было размещено!Социальные сети
Разместите свой аккаунт в Твиттере, связанный с гиперплазией почек, чтобы быть отмеченным!Блоги
| Разместите свой блог о Гиперплазии почек, чтобы его разместили! |
События
| Разместите свое мероприятие о Гиперплазии почек, чтобы быть популярным! |
Видео
Разместите свое видео о гиперплазии почек, чтобы его отметили!Благотворительность
Примите участие в благотворительной акции «Гиперплазия почек», чтобы ее представили!
Исследование гиперплазии почек было связано с гиперплазией, заболеваниями почек, гемолитической желтухой, трансформацией клеток, новообразованиями, карциномой печени.Исследование гиперплазии почек было упомянуто в исследовательских публикациях, которые можно найти с помощью нашего инструмента биоинформатики ниже. Исследованные пути, связанные с гиперплазией почек, включают регенерацию, регенерацию печени, акклиматизацию к холоду, апоптотический процесс. Эти пути дополняют наш каталог исследовательских реагентов для изучения гиперплазии почек, включая антитела и наборы для ELISA против SERPINA1, H6PD.Инструмент биоинформатики почек для гиперплазии почек
Laverne — это удобный инструмент биоинформатики, помогающий облегчить научное исследование родственных генов, болезней и путей на основе совместного цитирования.Узнайте больше о гиперплазии почек ниже! Для получения дополнительной информации о том, как использовать Laverne, прочтите Руководство.Лучшие исследовательские реактивы
У нас есть 193 продукта для исследования гиперплазии почек, которые могут быть применены к проточной цитометрии, вестерн-блоттингу, иммуноцитохимии / иммунофлюоресценции, иммуногистохимии из нашего каталога антител и наборов для ELISA. NBP1- Кролик Поликлональный
Виды Человек
Приложения WB, ICC / IF, IHC
| 8 Публикаций | Добавить в корзину |
Мышь Monoclonal
Виды Человек, обезьяна, примат
Приложения WB, Flow, ICC / IF
Родственные гены
Гиперплазия почек была исследована против:Связанные пути
Гиперплазия почек связана с:Связанные заболевания
Гиперплазия почек изучалась в отношении таких заболеваний, как:Альтернативные названия
Гиперплазия почек также известна как гиперплазия почек.Цилостазол ослабляет гиперплазию интимы на мышиной модели хронической болезни почек
Abstract
Гиперплазия интимы (ГИ) является частой причиной васкулопатии из-за прямого эндотелиального повреждения (например, пост-коронарной реваскуляризации) или косвенного повреждения (например, хронической болезни почек или ХБП). Хотя было продемонстрировано ослабление ИГ, вызванного коронарной реваскуляризацией (ИГ, индуцированного прямым сосудистым повреждением), цилостазолом, ингибитором фосфодиэстеразы III, было продемонстрировано, наше понимание влияния на ХБП-индуцированный ИГ (ИГ, индуцированное непрямым сосудистым повреждением) ) ограничено.Здесь мы проверили, ослабляет ли цилостазол индуцированный ХБП IH на мышиной модели ишемически-реперфузионного повреждения с односторонней нефрэктомией (Chr I / R), нормотензивной модели ХБП без протеинурии. Цилостазол (50 мг / кг / день) или плацебо вводили перорально один раз в день через 1 неделю после нефрэктомии. Через 20 недель цилостазол значительно ослабил ИГ аорты, что продемонстрировано уменьшением на 34% общей площади интимы с 50% и 47% уменьшением соотношений площадь внутренней оболочки / площадь средней оболочки и площадь внутренней оболочки / (tunica intima + tunica media площадь) соответственно.Диаметр аорты и функция почек не менялись под действием цилостазола. Интересно, что цилостазол уменьшал miR-221, но усиливал miR-143 и miR-145 либо в in vitro, , либо в ткани аорты, а также ослаблял несколько провоспалительных медиаторов, включая асимметричный диметиларгинин, высокочувствительный С-реактивный белок, сосудистый фактор роста эндотелия в аорте и провоспалительные цитокины сыворотки (IL-6 и TNF-α). Мы продемонстрировали доказательство концепции эффективности цилостазола в ослаблении ИГ на мышиной модели Chr I / R, модели ХБП с преимущественно индуцированным непрямым сосудистым повреждением ИГ.Эти соображения требуют дальнейшего изучения для разработки новой стратегии первичной профилактики ИГ, связанной с ХБП.
Цитирование: Chancharoenthana W, Leelahavanichkul A, Taratummarat S, Wongphom J, Tiranathanagul K, Eiam-Ong S (2017) Цилостазол ослабляет гиперплазию интимы на мышиной модели хронической болезни почек. PLoS ONE 12 (12): e0187872. https://doi.org/10.1371/journal.pone.0187872
Редактор: Джун Ю, Медицинский факультет Университета Темпл, США
Поступила: 19 февраля 2017 г .; Одобрена: 29 октября 2017 г .; Опубликован: 5 декабря 2017 г.
Авторские права: © 2017 Chancharoenthana et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Эта работа была поддержана исследовательским грантом Ratchadapiseksomphot (RA57 / 055) медицинского факультета Университета Чулалонгкорн.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Гиперплазия интимы (ГИ) — это васкулопатия, характеризующаяся дифференцировкой любых клеток, которые образуют многослойный компартмент в внутренней оболочке кровеносных сосудов. IH отвечает за сосудистые осложнения при нескольких хронических заболеваниях, включая ишемическую болезнь сердца (CAD), заболевание периферических артерий (PAD) и хроническое заболевание почек (CKD) [1–3].Прямое эндотелиальное повреждение является наиболее важным фактором, индуцирующим ИГ при ИБС и ЗПА [3]. С другой стороны, как прямое сосудистое повреждение (гипертензия), так и непрямое сосудистое повреждение (уремия, анемия и хроническое воспалительное состояние) ответственны за ИГ при ХБП [1, 4]. Поскольку большинство исследований ИГ на животных проводилось в экспериментах на модели нефрэктомии 5/6 или модели с хронической гломерулопатией с гипертензией и тяжелой протеинурией, на ИГ у этих мышей влияла не только ХБП, но и связанный с гипертензией прямой эндотелий. травма, повреждение.Чтобы увидеть, существует ли ИГ ХБП, вызванная непрямым сосудистым повреждением, без гипертензии, необходима другая модель ХБП. Интересно, что модель ХБП с преобладающим тубулоинтерстициальным повреждением, меньшей альбуминурией и гипертензией развивается при ишемии-реперфузионном повреждении с односторонней нефрэктомией (Chr I / R) [5]. Следовательно, мы исследуем ИГ, вызванное непрямым сосудистым повреждением, на этой модели.
Кроме того, предыдущие исследования продемонстрировали, что за ИГ ответственны несколько молекул, включая фактор роста эндотелия сосудов (VEGF), фактор роста тромбоцитов (PDGF) [6-8], асимметричный диметиларгинин (ADMA) [9] и несколько микроРНК. (miRs) [10–12].MiR представляют собой небольшие некодирующие РНК длиной 18–22 нуклеотида, которые регулируют посттранскрипционную экспрессию генов. Появляется все больше свидетельств того, что miR активно участвует в воспалительных процессах и прогрессировании сосудистого ИГ [13, 14]. Связь между miRs и тяжестью IH подразумевает возрастающую роль miRs для мониторинга IH. В целом miR-143, miR-145 и miR-221 синтезируются и секретируются эндотелиальными клетками (ECs) через внеклеточные везикулы, чтобы регулировать функции гладкомышечных клеток сосудов (VSMC) [10].Сверхэкспрессия Mir-221 усиливает IH в модели баллонного повреждения сонной артерии крысы [11], тогда как miR-143 и miR-145 снижают тяжесть IH в модели баллонного повреждения сонной артерии крысы [12].
Таким образом, терапевтическая стратегия с множественными эффектами может быть более подходящим лечением IH. Действительно, цилостазол, ингибитор фосфодиэстеразы (PDE) III, ослабляет IH, вызванное прямым сосудистым повреждением, посредством множества механизмов, включая вазодилатацию и антитромбоцитарное действие [15], противовоспалительное действие и уменьшение взаимодействия тромбоцитов с лейкоцитами [16] и ингибирование сосудистой пролиферации [17, 18] за счет активации факторов роста гепатоцитов и усиления онкогена p53 [19–21].Более того, цилостазол может модулировать факторы роста сосудов и молекулы окислительного стресса, такие как VEGF [7], PDGF [8] и оксиды азота (NO) [22]. Тем не менее, данные о влиянии цилостазола на ГГ, вызванное непрямым сосудистым повреждением, все еще ограничены. Поэтому мы провели эксперименты для определения терапевтических эффектов цилостазола на ИГ, вызванное непрямым сосудистым повреждением, на мышиной модели Chr I / R.
Материалы и методы
Животная модель
Тридцать 6-недельных мышей-самцов CD-1 массой 34 ± 3 г были получены из Национального центра лабораторных животных, Накхонпатхом, Таиланд.Уход за животными соответствовал критериям Национального института здоровья в отношении использования и лечения лабораторных животных. Протокол эксперимента был одобрен Комитетом по уходу и использованию животных медицинского факультета Университета Чулалонгкорн (№ 008/2556). Мышей разделили по одному животному в клетке и содержали в условиях 20–24 ° C и влажности 40–70% с 12-часовым циклом свет-темнота. Еда и вода давались ad libitum .
Хроническая болезнь почек, вызванная ишемическим реперфузионным повреждением (Chr I / R), модель
Процедура выполнялась в 2 этапа под изофлурановой анестезией, как описано ранее, с некоторыми изменениями [5].Вкратце, в первую неделю (неделя-1) левый почечный пучок зажимался через разрезы на левом боку атравматическим сосудистым зажимом, и разрезы послойно закрывались нейлоном 2–0. Затем мышам давали проснуться в боксе. Впоследствии процедура была повторена для удаления зажимов после общего времени ишемии 50 мин. Через неделю (неделя 0) была выполнена правая нефрэктомия через разрезы на правом боку (рис. 1А). В группе ложнооперированных мышей на неделе-1 были выполнены имитационные операции на левой почке с последующей нефрэктомией на правой почке.Температура тела во время всех операций, включая анестезию, разрез / зажим и наложение швов, поддерживалась установкой температуры нагревательной пластины (Kleintier-OP-Tisch, Medax GmbH, Германия) на 37 ° C, чтобы избежать влияния температуры на ишемическую реперфузию. (I / R) травма [23]. Через одну неделю после нефрэктомии (неделя 1) мышей Chr I / R были рандомизированы для введения либо цилостазола (Pletaal ® , PM129023, Otsuka, Tokushima, Japan) в дозе 50 мг / кг / доза, либо контрольной группы плацебо (обратный объем физиологического раствора) через ежедневный желудочный зонд в 08:00 до эвтаназии через 20 недель после нефрэктомии (20-я неделя).
В течение периода последующего наблюдения за мышами ежедневно наблюдали на предмет клинических признаков, включая состояние тела, состояние кожи, расчетную гидратацию, цвет слизистых оболочек, частоту сердечных сокращений и ритм, частоту дыхания, признаки диареи, а также количество и внешний вид мочи. и кал в клетке. Четыре мыши умерли на 15-й и 16-й неделе после рандомизации без предшествующих признаков и симптомов. Таким образом, для анализа было доступно 10 мышей в каждой группе (рис. 1B). Вес тела контролировали дважды в неделю.Кровь брали через хвостовую вену через 1, 4, 12, 16 и 20 недель после нефрэктомии. Образцы сыворотки немедленно центрифугировали при 8000 g в течение 10 минут при 4 ° C и хранили при -80 ° C до использования. Точечные пробы мочи собирали каждую неделю в течение 4 недель подряд, затем каждые 4 недели и хранили при -80 ° C.
Все мыши были умерщвлены посредством сердечной пункции под изофлурановой анестезией, а внутренние органы (сердце, легкие и почки) были сохранены в 10% формалине с нейтральным буфером для гистологического исследования.Несмотря на защитный эффект изофлурана [24] и многократного воздействия изофлурана, фиброз почек был продемонстрирован на модели мышей Chr I / R как у мышей, получавших плацебо, так и у мышей, получавших цилостазол. Удалена аорта от дуги аорты до бифуркации подвздошной кости. Проксимальная треть дуги аорты была сохранена в 10% нейтральном забуференном формалине, а дистальные две трети были сохранены в RNAlater (ThermoFisher Scientific, Уолтем, Массачусетс, США) и хранились при -80 ° C для исследования miR.
Измерение систолического артериального давления
Для измерения систолического артериального давления (САД) использовалась плетизмография хвостовой манжеты (IITC Life Scientific Instruments, Woodland Hills, Калифорния, США), как ранее описано в другом месте [25].САД измеряли до пережатия левого почечного пучка на 1-й неделе, а затем снова через 4, 12 и 20 недель после правой нефрэктомии. Измерения САД в периоперационном периоде не проводились из-за смешивающей переменной периоперационного стресса. Измерения САД проводили несколько раз перед началом эксперимента, чтобы подготовить мышей к процедуре. Измерения САД были получены после того, как мыши ознакомились с процессом. Средние значения трех измерений САД в каждый момент времени с 10-минутным интервалом отдыха между измерениями были использованы для представления данных.
Гистология и оценка гломерулярных и интерстициальных повреждений
Срезы почек (толщиной 3 мкм) окрашивали гематоксилином и эозином (H&E), реагентом Шиффа периодической кислоты (PAS) и трихромным красителем Массона. Травмы клубочков слепо оценивали 3 патологоанатома. Для оценки повреждения клубочков были исследованы 50 случайно выбранных клубочков на каждом слайде срезов, окрашенных PAS, и площадь склероза в каждом клубочке оценивалась полуколичественным методом балльной оценки: склеротическая площадь 0% = нормальные клубочки; склеротическая зона до 25% = минимальный склероз; склеротическая область от 25 до 50% = умеренный склероз; склеротическая область от 50 до 75% = склероз средней степени тяжести; и склеротическая область от 75 до 100% = тяжелый склероз.Количественный анализ интерстициальных компартментов, занятых фиброзной тканью, определяли по относительному интерстициальному объему общего интерстиция на каждом слайде срезов, окрашенных трихромом Массона. Для количественного определения объема почечной коры использовался стандартный метод подсчета точек [26]. Область коры анализировали поэтапно как серию последовательных полей. Для каждого поля отслеживалась интересующая область, которая включала корковые канальцы и интерстициальное пространство. Одно исследование с подсчетом баллов оценивало только интерстиций и основывалось на 1200 баллах для каждой почки.Гломерулы, кровеносные сосуды большого или среднего размера и костномозговая ткань были исключены. Относительный объем интерстициального пространства оценивался как процент пораженной почечной паренхимы к общей площади поверхности коркового слоя, взятой из пробы. Для всех параметров использовались средние значения трех последовательных измерений.
Гистология и оценка гиперплазии интимы
Поперечные срезы сосудов аорты (толщиной 3 мкм) окрашивали H&E и PAS, затем количественно анализировали в десяти срезах на мышь, начиная с области левого желудочка размером 2 размером 5 мкм.Чтобы минимизировать погрешность измерения, для всех параметров использовались средние значения трех последовательных измерений. Толщина аорты измерялась двумя патологами с использованием слепых экспериментальных данных с использованием программного обеспечения Image-Pro® Premier 9.1 (Media Cybernetics Manufacturing, PA, США). Наконец, были взяты средние значения оценок двух патологов. Внутренняя оболочка представляет собой область внутри внутренней эластичной пластинки, а толщина средней оболочки представляет собой область, разграниченную между внутренней и внешней эластичной пластинами.Для определения IH использовали соотношение tunica intima / tunica media (I: M) и соотношение tunica intima / (tunica intima + tunica media) (I: I + M).
Анализ крови и мочи
Азот мочевины крови (BUN), креатинин сыворотки (SCr) и креатинин мочи (UCr) определяли с помощью колориметрического анализа (QuantiChrom Ureas and Creatinine kit, Bioassay, Hayward, CA, USA). Точечный белок мочи измеряли с помощью анализа Брэдфорда (Bio-rad, Геркулес, Калифорния, США), а протеинурию представляли по соотношению точечного белка мочи к креатинину мочи (UPCR; точечный белок мочи / креатинин мочи), что эквивалентно 24-часовой протеинурии исследование на животных [5].Гематокрит (Hct) оценивали с помощью метода микрогематокрита и счетчика Коултера (Hitachi 917, IN, США). Анализы ELISA использовали для измерения ADMA (Enzo Life Sciences Inc., Нью-Йорк, США), PDGF (Boster Biological Technology Co., Ltd., Калифорния, США), VEGF (Abcam, MA, США) и высокой чувствительности C-реактивного белок (hs-CRP) (Biocompare, Калифорния, США). Воспалительные цитокины, в том числе интерлейкин (IL-6) и фактор некроза опухоли (TNF-α), измеряли с помощью мультиплексной технологии на основе Luminex Map с использованием панели MILLIPLEX MAP Mouse Cytokine Magnetic Bead Panel (Millipore, Billerica, MA, USA) на планшете Инструмент Luminex согласно методике производителя.Мы измерили ADMA, PDGF, VEGF, hs-CRP, IL-6, TNF-α и miR (miR-143, miR-145, miR-221) через 4, 12, 16 и 20 недель после нефрэктомии.
Экспрессия микроРНК,
in vitroПервичные эндотелиальные клетки пупочной вены человека (HUVEC: ATCC ® PCS-100-010 TM ) использовали для тестирования эффектов цилостазола на экспрессию miR. HUVEC (100000 клеток / лунку) помещали в 24-луночные планшеты и инкубировали в течение 24 часов при 37 ° C в условиях атмосферы 5% CO 2 .Затем клетки обрабатывали 3, 10 или 30 мкМ цилостазола, который растворяли в диметилсульфоксиде (ДМСО) в течение 24 часов. Для контрольной группы HUVEC культивировали в основной среде эндотелиальных клеток (EBM-2) (Lonza, Walkersville, MD, USA), полной среде, содержащей 5% ДМСО. После этого miR экстрагировали с помощью miRNeasy (Qiagen, Hilden, Германия). Количественное определение miR-143, miR-145, miR-221 и RNU44 измеряли с использованием зондов Taqman и ПЦР в реальном времени (Applied Biosystems ™ 7500). RNU44 использовался в качестве гена домашнего хозяйства.Списки праймеров (Invitrogen Life Technologies) были продемонстрированы следующим образом: праймер RNU44 (ID001094):
5’CCTGGATGATGATAGCAAATGCTGACTGAACATGAAGGTCTTAATTAGCTCTAACTGACT 3′ , праймера микроРНК-145а (ID002278): 5′ GUCCAGUUUUCCCAGGAAUCCCU 3′ , праймера микроРНК-143 (ID002249): 5′ UGAGAUGAAGCACUGUAGCUC 3′ , праймера микроРНК-221 (ID002096): 5′ ACCUGGCAUACAAUGUAGAUUU 3′ . Выражения были определены с помощью CT, и кратное изменение экспрессии было рассчитано, как ранее описано в другом месте [27].
Выделение и количественное определение РНК
Протокол этого исследования соответствует предыдущей публикации [28].Вкратце, образцы помещали в TRIzol (Invitrogen, Carlsbad, CA, USA), полностью гомогенизировали и центрифугировали при 10 000 g в течение 15 мин при 4 ° C. Далее в супернатант помещали 1 мкл гликогена и 250 мкл хлороформа. Затем образцы снова центрифугировали при 10 000 g в течение 20 минут при 4 ° C, и супернатант переносили в 1 мл 70% этанола и помещали в колонку RNeasy. Общую РНК оценивали с помощью набора miRNA easy (Qiagen, Валенсия, Калифорния, США) для экстракции. Образцы снова смешивали с денатурирующим буфером в соответствии с протоколами производителей.Как квалификацию, так и количественную оценку miR проводили с помощью спектрометра NanoDrop ND-1000 (NanoDrop Technologies, Уилмингтон, Делавэр, США).
Обратная транскрипция, ПЦР в реальном времени и построение графической тепловой карты
зондов Taqman для каждого гена и мастер-микса Taqman использовали для количественной оценки синтетических спайков miR и клеточных miR в анализах ПЦР в реальном времени в соответствии с протоколами производителя. Отдельные анализы ПЦР в реальном времени выполняли в реакционном объеме 20 мкл на системе ABI 7500 для ПЦР в реальном времени (Applied Biosystems, Уолтем, Массачусетс, США) на основе стандартного режима запуска 7500.Метод ΔΔCt использовали для расчета относительной экспрессии (кратного изменения) между группами образцов. Экспрессию RNU6B использовали для нормализации сывороточного miR [28]. Для лучшей демонстрации miR из ткани аорты у отдельных мышей было выполнено построение графической тепловой карты всех значений ΔCt RT-qPCR с использованием метода Варда.
Статистический анализ
Все экспериментальные данные выражены как среднее ± стандартная ошибка (SEM). Дисперсионный анализ (ANOVA) с последующей апостериорной поправкой Бонферрони использовался для анализа более чем двух групп.Двусторонний дисперсионный анализ ANOVA с повторным измерением использовался, когда оценивались две или более временных точек. Корреляции между переменными были проанализированы с использованием корреляционного анализа Пирсона, значения p- менее 0,05 считались статистически значимыми. Статистические расчеты были выполнены с использованием SPSS для Windows 15.0 (SPSS для Windows; Чикаго, Иллинойс) и GraphPad Prism 6.0 (GraphPad Software, Ла-Холла, Калифорния, США).
Результаты
Клинические проявления хронической болезни почек при ишемически-реперфузионном поражении у мышей с хронической болезнью почек, вызванной односторонней нефрэктомией (Chr I / R)
Клинические проявления ХБП, включая массу тела (BW), систолическое артериальное давление (SBP), протеинурию, Hct и объем мочи, были исследованы на мышах Chr I / R.Неспособность развиваться ХБП была продемонстрирована с неизменной массой тела в течение первых 8 недель после нефрэктомии у мышей Chr I / R. Напротив, на фиктивных мышах было продемонстрировано значительное увеличение веса. Через 20 недель наблюдалось снижение BW на 6% от исходного уровня у мышей Chr I / R, но на 38% увеличение BW от исходного уровня у фиктивных мышей (рис. 2A). Кроме того, настоящая модель мышей Chr I / R не продемонстрировала значительных изменений в измерениях САД (рис. 2B).
Рис. 2. Клинические и лабораторные проявления ишемико-реперфузионного повреждения при односторонней нефрэктомии (Chr I / R) на мышиной модели.
(a) Масса тела (BW), (b) систолическое артериальное давление (САД), (c) креатинин сыворотки (Cr) и (d) изменение гематокрита (Hct) мнимого Оперированные (n = 6), плацебо (PB) (n = 10) и получавшие цилостазол мыши (CZ) (n = 10 / группа) в течение периода исследования были продемонстрированы в продольной оценке. (e) Была показана количественная протеинурия, определенная с помощью соотношения белка креатинина в моче (UPCR) мышей Chr I / R через 1 неделю (время рандомизации) и через 20 недель после нефрэктомии.* p <0,05 по сравнению с исходным уровнем в той же группе; # p <0,05, ## p <0,01 по сравнению с исходным уровнем у ложно оперированных мышей на неделе-1; $ p <0,05.
https://doi.org/10.1371/journal.pone.0187872.g002
Что касается функции почек, то уровень азота мочевого пузыря и SCr увеличился уже через 2 недели после нефрэктомии у мышей, получавших цилостазол и получавших плацебо. Исходно, за 1 неделю до выполнения травмы I / R левой почки (неделя-1), АМК и SCr были 14 ± 2 и 0.3 ± 0,1 мг / дл у мышей, получавших цилостазол, и 13 ± 6 и 0,2 ± 0,1 мг / дл у мышей, получавших плацебо, соответственно. Через 20 недель после нефрэктомии уровень АМК и SCr увеличился до 83 ± 5 и 1,2 ± 0,5 мг / дл у мышей, получавших цилостазол, и до 88 ± 6 и 1,2 ± 0,3 мг / дл у мышей, получавших плацебо, соответственно (рис. 2C). . Этот результат согласуется с идеей, что у мышей Chr I / R была постепенная анемия, что определялось снижением Hct от исходного уровня (с 50 ± 7% до 45 ± 6%) через 12 недель после нефрэктомии. В конечном итоге, Hct через 20 недель после нефрэктомии составил 37 ± 2% (рис. 2D).Несмотря на прогрессирующее ухудшение функции почек, протеинурия не различалась между ложнооперированными, получавшими плацебо и цилостазолом мышей через 20 недель (рис. 2E), что позволяет предположить, что модель ХБП с преобладающим тубулоинтерстициальным повреждением была подтверждена патологией почек (рис. 3A). . Однако через 20 недель мыши, получавшие цилостазол, продемонстрировали более низкий относительный объем интерстициального пространства, чем мыши, получавшие плацебо ( p <0,05), как определено с помощью гистопатологического анализа (рис. 3B).
Рис 3.Оценка почечной патологии через 20 недель после нефрэктомии ишемически-реперфузионного повреждения на мышиной модели с односторонней нефрэктомией (Chr I / R).
(a) Были продемонстрированы репрезентативные цифры окрашивания почечной коры с помощью Periodic Acid-Schiff (PAS) и трихрома Массона среди ложнооперированных мышей, мышей, получавших плацебо (PB) и цилостазол (CZ). (b) Гломерулосклероз, процент гломерулярной области, которая была склеротической, определенная на срезах, окрашенных PAS (левая панель), и относительный объем интерстициального пространства, процент от общей площади поверхности отобранной кортикальной области в срезах, окрашенных трихромом Массона который занят интерстициальным пространством (см. метод), (правая панель) от Chr I / R у ложнооперированных (n = 6), плацебо (PB) (n = 10) и мышей, получавших цилостазол (CZ) (n = 10).* p <0,05, # p <0,0001. Масштабная линейка = 200 мкм.
https://doi.org/10.1371/journal.pone.0187872.g003
Кроме того, у мышей Chr I / R был выявлен диурез. Объем мочи составил 9 ± 3 мл / день через 20 недель после нефрэктомии. Несмотря на диурез у мышей Chr I / R, 35% (7/20) этих мышей показали явный отек легких при макроскопическом исследовании. Среднее соотношение влажная масса легких / масса тела (LW / BW) у мышей Chr I / R составляло 10,4 ± 3,9 мг / г по сравнению с 3,3 ± 0,1 мг / г у фиктивных мышей ( p <0.01).
Цилостазол улучшает гиперплазию интимы сосудов через 20 недель после ишемического реперфузионного повреждения у мышей с хронической болезнью почек, вызванной односторонней нефрэктомией (Chr I / R)
МышиChr I / R продемонстрировали положительную корреляцию между тяжестью IH аорты и относительным объемом интерстициального пространства (r 2 = 0,74, p = 0,01), а также BUN (r 2 = 0,67, p = 0,004). , но слабая корреляция между тяжестью IH и SCr (r 2 = 0.12, p <0,001), как показано на фиг. S1. Интересно, что мыши, получавшие цилостазол, показали более низкую тяжесть IH (фиг. 4A). Через 20 недель после нефрэктомии ИГ у мышей, получавших цилостазол, и мышей, получавших плацебо, составляла 99,704 ± 22,310 и 150,556 ± 5,669 мкм 2 ( p <0,01), соответственно (таблица S1). Эти данные согласуются с более низким соотношением I: M на 50% и соотношением I: I + M на 46%. Напротив, диаметр аорты в группе, получавшей цилостазол, не отличался от диаметра аорты в группе, получавшей плацебо (рис. 4B-4E).
Рис. 4. Патология аорты через 20 недель после нефрэктомии, вызванная ишемически-реперфузионным повреждением с односторонней нефрэктомией (Chr I / R), модель мыши.
(a) Были продемонстрированы репрезентативные цифры аорты по окрашиванию H&E ложнооперированных мышей, мышей, получавших плацебо (PB) и цилостазол (CZ), через 20 недель после нефрэктомии. Полуколичественный анализ, касающийся: (b) средней площади IH области, (c) отношения площади внутренней оболочки к площади медиальной оболочки, (d) отношения площади внутренней оболочки / (оболочки область интимы + область средней оболочки) и (e) диаметр аорты у ложнооперированных (n = 6), плацебо (PB) (n = 10) и получавших цилостазол мышей (CZ) (n = 10). .* p <0,01, # p <0,0001.
https://doi.org/10.1371/journal.pone.0187872.g004
Влияние цилостазола на miR ткани аорты, цитокины, связанные с гладкомышечными клетками сосудов (VSMC), и воспалительные цитокины через 20 недель после ишемического реперфузионного повреждения у мышей с односторонней нефрэктомией, вызванной хронической болезнью почек (Chr I / R)
Повышенная экспрессия miR-143 и miR-145 в ткани аорты была продемонстрирована у мышей, получавших цилостазол, по сравнению с контрольной группой плацебо.Напротив, miR-221 обнаруживает значительно сниженную экспрессию в группе, получавшей цилостазол (фиг. 5). Чтобы подтвердить связь между цилостазолом и экспрессией miR, был проведен тест in vitro на HUVEC. Как показано на фиг. 6, цилостазол значительно усиливал экспрессию как miR-143, так и miR-145, но снижал экспрессию miR-221 по сравнению с контрольной группой.
Рис. 5. Анализ микроРНК в ткани аорты через 20 недель после нефрэктомии ишемического реперфузионного повреждения на модели мыши с односторонней нефрэктомией (Chr I / R).
(a) МикроРНК в ткани аорты от ложнооперированных (n = 6), плацебо (PB) (n = 10) и получавших цилостазол мышей (CZ) (n = 10) через 20 недель после нефрэктомии были показаны. Для нормализации использовался RNU48 (см. Метод). (b) Была продемонстрирована графическая тепловая карта. Более высокие и более низкие значения ΔCt были окрашены в красный и синий цвета соответственно; * p <0,05, ** p <0,01.
https://doi.org/10.1371/journal.pone.0187872.g005
Рис. 6. Влияние различных концентраций цилостазола на экспрессию микроРНК (miR) эндотелиальных клеток пупочной вены человека (HUVEC).
HUVEC инкубировали с 3, 10, 30 мкМ цилостазола в течение 24 часов. Количество экспрессий представлено как процент экспрессии, определяемый ΔΔCT и кратным изменением экспрессии относительно контроля. Данные представлены как среднее значение ± стандартная ошибка. * p <0,05, ** p <0,01 и # p <0.001 указывают на значимость относительно контроля. Размер выборки (n) = 3 для каждой группы из 3 независимых повторов. Ctrl, контрольная (DMSO в EBM-2) группа; CZ, группа, получавшая цилостазол.
https://doi.org/10.1371/journal.pone.0187872.g006
Из-за влияния цитокинов, связанных с VSMC, и провоспалительных процессов на патогенез IH, мы измерили VEGF, PDGF, hs-CRP, IL-6. , и TNF-α. По сравнению с мышами, получавшими плацебо, у мышей, получавших цилостазол, были значительно более низкие уровни сывороточного VEGF, hs-CRP, IL-6 и TNF-α, но не сывороточного PDGF.Кроме того, сывороточный ADMA, суррогатный маркер сосудорасширяющего эффекта, был значительно ниже у мышей, получавших цилостазол, по сравнению с группой плацебо (рис. 7). Несмотря на эффективность цилостазола через 20 недель в отношении ослабления IH у мышей Chr I / R, функция почек, определяемая с помощью BUN и SCr, не различалась между группами цилостазола и плацебо (данные не показаны).
Рис. 7. Концентрация нескольких медиаторов в сыворотке через 20 недель после нефрэктомии ишемического реперфузионного повреждения на модели мыши с односторонней нефрэктомией (Chr I / R).
(a) асимметричный диметиларгинин (ADMA), (b) C-реактивный белок высокой чувствительности (hs-CRP), (c) фактор роста тромбоцитов (PDGF), (d) сосудистый фактор роста эндотелия (VEGF), (e), интерлейкин (IL) -6 и (f), фактор некроза опухоли альфа (TNF-α) при ложной операции (n = 6), плацебо (PB) (n = 10) и мышей, получавших цилостазол (CZ) (n = 10), через 20 недель после нефрэктомии. * p <0.05, ** p <0,01, # p <0,001, ## p <0,0001.
https://doi.org/10.1371/journal.pone.0187872.g007
Поскольку ХБП увеличивает количество провоспалительных медиаторов [29, 30], и сообщалось о связи между PDGF и VEGF с miR в патогенезе IH [12, 31 , 32], мы оценили концентрацию в сыворотке крови с течением времени, чтобы определить каскад этих медиаторов у мышей Chr I / R. Мы обнаружили, что сывороточный miR-221 был самым ранним детектируемым биомаркером среди этих молекул (обнаруживался у 5 мышей (50%) через 12 недель после правой нефрэктомии).Впоследствии другие молекулы, включая VEGF, miR-143 и miR-145, были обнаружены через 16 недель (S2 фиг.). Затем через 20 недель после правой нефрэктомии были продемонстрированы другие биомаркеры сыворотки, включая ADMA, PDGF и воспалительные цитокины (IL-6, TNF- и hs-CRP) (данные не показаны). Кроме того, увеличение экспрессии VEGF, hs-CRP, IL-6 и TNF-α у мышей Chr I / R было обращено у животных, получавших цилостазол. Интересно, что положительная корреляция была продемонстрирована между VEGF и miR-221, тогда как отрицательная корреляция была отмечена между ADMA и miR-221.Между другими параметрами корреляции не наблюдалось (рис. 8).
Рис. 8. Корреляционный анализ между микроРНК (miR) в ткани аорты и другими параметрами сыворотки.
Корреляция между асимметричным диметиларгинином ( ADMA) и miR-143 (a) , miR-145, (b) miR-221 (c) ; между фактором роста эндотелия сосудов (VEGF) и этими miR (d-f) и между фактором роста тромбоцитов (PDGF) и этими miR (g-i) .
https://doi.org/10.1371/journal.pone.0187872.g008
Обсуждение
Мы впервые продемонстрировали, что цилостазол ослабляет индуцированный ХБП аортальный ГГ при ХБП на мышиной модели Chr I / R. Цилостазол модулировал несколько ответов miR, включая снижение VEGF и ADMA. Кроме того, цилостазол также индуцировал противовоспалительные эффекты, о чем свидетельствует ослабление действия нескольких провоспалительных медиаторов (IL-6, TNF-α и hs-CRP). Эти вклады подтверждают полезность цилостазола в качестве дополнительной стратегии для предотвращения ХБП-индуцированного ИГ.
Артериальная гиперплазия интимы и характеристики Chr I / R модели
Несмотря на разнообразие IH от различных заболеваний, патогенез IH можно объяснить через процессы прямого и непрямого эндотелиального повреждения [33, 34], которые для CKD являются гипертензией и метаболическими последствиями, соответственно. Поскольку ИГ, вызванная прямым сосудистым повреждением, хорошо известна, мы стремились исследовать преимущественно непрямое влияние ХБП на прогрессирование ИГ, связанное с повреждением сосудов. Преобладающее тубулоинтерстициальное повреждение с другими последствиями, связанными с ХБП, но с легкой протеинурией, было продемонстрировано в Chr I / R в нашем исследовании, что подтверждает предыдущие исследования [5].Интересно, что хотя защитное действие изофлурана на повреждение I / R было продемонстрировано [24], у мышей, получавших как плацебо, так и цилостазол, развились характеристики ХБП под его влиянием. Из-за минимального высокого кровяного давления в этой модели, IH, возможно, в основном был вызван непрямым эндотелиальным повреждением. Действительно, IH аорты для Chr I / R было продемонстрировано с увеличением на 30% толщины внутренней оболочки всех мышей через 20 недель после нефрэктомии. Таким образом, мышиная модель Chr I / R может быть одной из наиболее подходящих моделей ХЗП для исследования ИГ, вызванного непрямым эндотелиальным повреждением.Интересно, что медиальная кальцификация на этой модели мышей с ХЗП не была заметной. Мы предполагаем, что кальцифилаксия в этой модели не такая серьезная, как у пациентов с ХБП. Это означает, что влияние на кальцифилаксию кальция, витамина D и / или диеты у пациентов с ХБП и в других моделях in vivo и [35].
Цилостазол ослабляет IH, связанное с хроническим заболеванием почек, по крайней мере частично, за счет противовоспалительного действия и модуляции miRs
Защитное действие цилостазола на ИГ, связанное с ХЗП, было продемонстрировано уменьшением общей площади внутренней оболочки оболочки, наблюдаемым в более низком соотношении I: M и I: I + M у мышей, получавших цилостазол, по сравнению с группой плацебо.Более низкое соотношение I: M означает, что цилостазол был нацелен на интиму, тогда как более низкое соотношение I: I + M поддерживало эффективность цилостазола в слое интимы. Хотя ослабление ИГ, вызванного прямым эндотелиальным повреждением, цилостазолом было продемонстрировано ранее [36–38], это исследование впервые показывает преимущества на модели ХБП с преимущественно непрямым ИГ, вызванным повреждением сосудов. Наши результаты показывают, что цилостазол может способствовать защите сосудов преимущественно за счет противовоспалительного действия (ослабление hs-CRP, IL-6 и TNF-α) (рис. 7B, 7E и 7F).Возможно, противовоспалительные эффекты были важны для улучшения ИГ, вызванного непрямым сосудистым повреждением, в то время как сосудорасширяющие эффекты были важны для ослабления ИГ, вызванного прямым сосудистым повреждением [39–41].
Хотя цилостазол теоретически индуцирует VEGF, у обработанных цилостазолом Chr I / R уровень VEGF был ниже [7, 42]. Действительно, VEGF парадоксальным образом влияет на эндотелий. VEGF был индуцирован провоспалительными реакциями, но важен для процесса заживления эндотелия [43].Таким образом, анти-VEGF полезен в качестве противовоспалительного препарата при провоспалительных состояниях, но нарушает процессы заживления ран в модели хронического повреждения [44, 45]. VEGF-индуцированная пролиферация эндотелия может ухудшить IH. Более низкий уровень VEGF у мышей, получавших цилостазол, демонстрирует более выраженные противовоспалительные эффекты по сравнению с индукцией пролиферации эндотелия, что благоприятно для ослабления IH.
С другой стороны, циркулирующий ADMA, уремический токсин с эндогенным ингибирующим действием NOS и вызывающий провоспалительные реакции [46], также значительно снижался при лечении цилостазолом.Как наблюдалось на модели кролика, ADMA ингибировал NO, что приводило к относительной вазоконстрикции, увеличению адгезии лейкоцитов и тромбоцитов и усилению IH [47]. Таким образом, снижение ADMA после лечения цилостазолом также может быть полезным. Однако цилостазол не ослаблял PDGF, важный активатор IH, несмотря на активацию VSMCs [48] в модели Chr I / R.
Более того, недавно была продемонстрирована ассоциация между miRs, регуляцией VSMC и образованием IH [10, 12]. Мыши с дефицитом гена miR-143 и / или miR-145 показали выраженный IH [49]; блокирование miR-145 заметно ингибирует IH [12]; нокдаун miR-221 также ингибировал IH [11].Мы предположили, что цилостазол может также опосредовать IH через miRs, и исследовали экспрессию этих miR в аорте мышей Chr I / R. В самом деле, мы обнаружили, что цилостазол ингибирует тканевые miR-221, но способствует тканевым miR-143 и miR-145 в аорте и роль miRs в патогенезе IH [50]. Кроме того, повышенная экспрессия miR-143 и miR-145 наряду со сниженной экспрессией miR-221 после лечения цилостазолом также была продемонстрирована в экспериментах HUVEC.
Наши данные подтверждают предыдущие исследования важности miR-221 [11], но демонстрируют противоположное направление miR-143 и miR-145 в ассоциации с тяжестью IH [10, 12, 49].Эти данные свидетельствуют о разнообразии патогенеза ИГ в разных моделях. Несмотря на эти данные, самая ранняя временная точка активации miR цилостазолом по отношению к супрессии IH не была определена в нашем исследовании. Т.о., хотя активация miR, по-видимому, является последующим событием, связанным с ингибированием IH [10], связь между этими 3 мишенями miR в CKD-связанных IH после Chr I / R требует дальнейшего изучения.
Тем не менее, корреляционный анализ продемонстрировал тенденции ассоциации miR-221 с VEGF и ADMA в положительном и отрицательном направлении, соответственно.Цилостазол снижает miR-221 вместе с VEGF. Поскольку miR-221 индуцирует IH за счет увеличения VEGF за счет активации передачи сигналов Vegfc / Vegfr-3 [51], возможно, что цилостазол может ослаблять VEGF за счет снижения miR-221. Мы обнаружили, что miR-221 имеет раннее начало, концентрация которого снижается по сравнению с VEGF, а miR-221 также имеет более высокий процент снижения от исходного уровня, чем VEGF, через 16 недель после нефрэктомии (93,5% и 71,6%, соответственно, p <0,05). С другой стороны, цилостазол ослаблял как miR-221, так и ADMA, но между этими параметрами наблюдалась обратная тенденция.Это означает, что и miR-221, и ADMA могут участвовать в регуляции VSMC; однако miR-221 не может быть дифференциально экспрессируемой miR для ADMA. Хотя все больше доказательств раскрывает эффекты miR221 и ADMA на ранний ответ эндотелиальных клеток-предшественников [52, 53], их роль в VSMCs малоизвестна и является плодотворной темой для будущих исследований.
В заключение, мы продемонстрировали доказательство эффективности цилостазола в ослаблении ИГ на мышиной модели Chr I / R, модели ХБП с преимущественно индуцированным непрямым сосудистым повреждением ИГ.Эти соображения требуют дальнейшего изучения для разработки новой стратегии первичной профилактики ИГ, связанной с ХБП. Идентификация тканевых miR-221, ADMA и воспалительных цитокинов также может быть интересным суррогатным биомаркером для демонстрации перехода биохимических изменений в значительные патологические дефекты. Эти данные могут открыть новые возможности для управления повреждением сосудов от ИГ.
Вспомогательная информация
S2 Рис. Процент мышей с положительными сывороточными miR, факторами роста и воспалительными цитокинами после ишемически-реперфузионного повреждения модели на мышах с односторонней нефрэктомией (Chr I / R) (n = 10).
Сыворотка miR-221 была продемонстрирована у 5 мышей (50%) через 12 недель после правой нефрэктомии. Впоследствии VEGF, miR-143 и miR-145 были обнаружены через 16 недель использования модели у 9 (90%), 7 (70%) и 7 (70%) мышей соответственно. miR, miRNA; VEGF, фактор роста эндотелия сосудов.
https://doi.org/10.1371/journal.pone.0187872.s002
(TIF)
Ссылки
- 1. Читалия Н., Росс Л., Кришнамурти М., Капустин А., Шанахан С.М., Каски Дж. К. и др.Неоинтимальная гиперплазия и кальцификация артерий среднего размера у взрослых пациентов с хронической болезнью почек. Semin Dial 2015; 28: E35–40. pmid: 25488635
- 2. Кокубо Т., Исикава Н., Учида Х., Часнофф С.Е., Се Х, Мэтью С. и др. ХБП ускоряет развитие неоинтимальной гиперплазии при артериовенозных свищах. J Am Soc Nephrol 2009; 20: 1236–1245. pmid: 19423694
- 3. Хайнен Ю., Стегеманн Э., Сансоне Р., Бенеденс К., Вагстафф Р., Бальцер Дж. И др. Локальная связь между эндотелиальной дисфункцией и гиперплазией интимы: актуальность при заболевании периферических артерий.J Am Heart Assoc 2015; 4 (2): e001472. pmid: 25648609
- 4. Вассе Х., Хуанг Р., Накви Н., Смит Э., Ван Д., Хусейн А. Воспаление, окисление и венозная неоинтимальная гиперплазия предшествуют повреждению сосудов в результате создания АВФ у пациентов с ХБП. Журнал Vasc Access 2012; 13: 168–174. pmid: 22020525
- 5. Лилахаваничкул А., Ян К., Ху Х, Эйснер С., Хуанг И, Чен Р. и др. Ангиотензин II преодолевает штамм-зависимую резистентность быстрого прогрессирования ХБП в новой модели мышей с остаточной почкой.Kidney Int 2010; 78: 1136–1153. pmid: 20736988
- 6. Ценг К.Н., Чанг Ю.Т., Ленгквист М., Кронквист М., Хедин Ю., Эрикссон Э. Адгезия тромбоцитов к эндотелию на ранней стадии после трансплантации вены опосредует рекрутирование лейкоцитов и гиперплазию интимы на мышиной модели. Тромб Хемост 2015; 113: 813–825. pmid: 25518998
- 7. Biscetti F, Pecorini G, Straface G, Arena V, Stigliano E, Rutella S и др. Цилостазол способствует ангиогенезу после периферической ишемии посредством VEGF-зависимого механизма.Int J Cardiol 2013; 167: 910–916. pmid: 22473072
- 8. Ямамото К., Онода К., Савада Й., Фудзинага К., Иманака-Йошида К. и др. При местном применении цилостазол подавляет неоинтимальную гиперплазию и утолщение медиальной части в модели венозного трансплантата. Ann Thorac Cardiovasc Surg 2007; 13: 322–330. pmid: 17954989
- 9. Ravani P, Tripepi G, Malberti F, Testa S, Mallamaci F, Zoccali C. Асимметричный диметиларгинин предсказывает прогрессирование до диализа и смерти у пациентов с хроническим заболеванием почек: подход к моделированию конкурирующих рисков.J Am Soc Nephrol 2005; 16: 2449–2455. pmid: 15944335
- 10. Джи Р, Ченг И, Юэ Дж, Ян Дж, Лю Х, Чен Х и др. Сигнатура экспрессии микроРНК и антисмысловое истощение выявляют важную роль микроРНК в формировании сосудистых неоинтимальных повреждений. Circ Res 2007; 100: 1579–1588. pmid: 17478730
- 11. Лю X, Cheng Y, Zhang S, Lin Y, Yang J, Zhang C. Необходимая роль miR-221 и miR-222 в пролиферации гладкомышечных клеток сосудов и неоинтимальной гиперплазии.Circ Res 2009; 104: 476–487. pmid: 19150885
- 12. Cheng Y, Liu X, Yang J, Lin Y, Xu DZ, Lu Q и др. MicroRNA-145, новый фенотипический маркер и модулятор гладкомышечных клеток, контролирует образование сосудистых неоинтимальных повреждений. Circ Res 2009; 105: 158–166. pmid: 19542014
- 13. Song Z, Li G. Роль специфических микроРНК в регуляции дифференцировки гладкомышечных клеток сосудов и реакции на повреждение. J. Cardiovasc Transl Res. 2010; 3: 246–250. pmid: 20543900
- 14.Chen LJ, Lim SH, Yeh YT, Lien SC, Chiu JJ. Роль микроРНК при атеросклерозе и рестенозе. Журнал биомедицинских наук 2012; 19: 79. pmid: 22931291
- 15. Цучикане Э., Фукухара А., Кобаяши Т., Кирино М., Ямасаки К., Кобаяши Т. и др. Влияние цилостазола на рестеноз после чрескожной коронарной баллонной ангиопластики. Тираж 1999 г .; 100: 21–26. pmid: 10393676
- 16. Иноуэ Т., Учида Т., Сакума М., Имото Ю., Озеки Ю., Хикичи Ю. и др. Цилостазол ингибирует интегрин лейкоцитов Mac-1, что приводит к потенциальному снижению рестеноза после имплантации коронарного стента.Дж. Ам Колл Кардиол 2004; 44: 1408–1414. pmid: 15464320
- 17. Танака Т., Исикава Т., Хагивара М., Онода К., Ито Н., Хидака Х. Эффекты цилостазола, селективного ингибитора фосфодиэстеразы цАМФ на сокращение гладких мышц сосудов. Фармакология 1988; 36: 313–320. pmid: 2841693
- 18. Камиширадо Х., Иноуэ Т., Мидзогути К., Учида Т., Наката Т., Сакума М. и др. Рандомизированное сравнение цилостазола и тиклопидина гидрохлорида для антитромбоцитарной терапии после имплантации коронарного стента для предотвращения позднего рестеноза.Am Heart J 2002; 144: 303–308. pmid: 12177649
- 19. Аоки М., Моришита Р., Мацусита Х., Хаяши С., Накагами Х., Ямамото К. и др. Ингибирование гена-супрессора опухолей р53 приводит к росту гладкомышечных клеток сосудов аорты человека. Возможная роль p53 в регуляции роста гладкомышечных клеток сосудов. Гипертония 1999; 34: 192–200. pmid: 10454440
- 20. Iida O, Yokoi H, Soga Y, Inoue N, Suzuki K, Yokoi Y и др. и от имени следователей STOP-IC.Цилостазол снижает ангиографический рестеноз после эндоваскулярной терапии бедренно-подколенных поражений в исследовании «Достаточное лечение периферического вмешательства с помощью цилостазола». Циркуляция 2013; 127: 2307–2315. pmid: 23652861
- 21. Исии Х., Кумада Й., Торияма Т., Аояма Т., Такахаши Х., Ямада С. и др. Цилостазол улучшает долгосрочную проходимость после чрескожной транслюминальной ангиопластики у гемодиализных пациентов с заболеванием периферических артерий. Clin J Am Soc Nephrol 2008; 3: 1034–1040.pmid: 18322041
- 22. Хори А., Шибата Р., Морисаки К., Мурохара Т., Комори К. Цилостазол стимулирует реваскуляризацию в ответ на ишемию через eNOS-зависимый механизм. Eur J Vasc Endovasc Surg 2012; 43: 62–65. pmid: 21852163
- 23. Маршнер Я.А., Шефер Х., Холдерид А, Андерс Х.-Дж. Оптимизация операций на мышах с онлайн-мониторингом ректальной температуры и предоперационной подачей тепла. Влияние на постишемическое острое повреждение почек. PLoS ONE 2016; 11 (2): e0149489.pmid: 268
- 24. Ли Х.Т., Ким М., Ким М., Ким Н.Л., Биллингс Ф.Т., Д’Агати В.Д. и др. Изофлуран защищает от ишемии почек и реперфузионного повреждения и модулирует инфильтрацию лейкоцитов у мышей. Am J Physiol Renal Physiol 2007; 293: F713 – F722. pmid: 17596528
- 25. Сеуджанге Ю., Лилахаваничкул А., Исаракун В., Хосук В., Мипул А., Phamonleatmongkol П. и др. Водные экстракты Hibiscus sabdariffa Linnaeus уменьшают прогрессирование почечного повреждения у крыс с нефрэктомией 5/6. (-delta CT) метод количественного анализа данных полимеразной цепной реакции в реальном времени. Биостат Биоинформа Биомат 2013; 3: 71–85. pmid: 25558171
- 28. Лилахаваничкул А., Сомпарн П., Панич Т., Чанчароентана В., Вонгпхом Дж., Писиткун Т. и др. Сывороточная miRNA-122 при остром повреждении печени, вызванном повреждением почек и сепсисом, на моделях мышей CD-1. Hepatol Res 2015; 45: 1341–1352. pmid: 25655304
- 29. Knight EL, Rimm EB, Pai JK, Rexrode KM, Cannuscio CC, Manson JE и др.Дисфункция почек, воспаление и коронарные события: проспективное исследование. J Am Soc Nephrol 2004; 15: 1897–903. pmid: 15213279
- 30. Grenda R, Wühl E, Litwin M, Janas R, Sladowska J, Arbeiter K и др. Экскреция с мочой эндотелина-1 (ЕТ-1), трансформирующего фактора роста-бета1 (TGF-beta1) и фактора роста эндотелия сосудов (VEGF165) при хронических заболеваниях почек у детей: результаты исследования ESCAPE. Трансплантат Nephrol Dial 2007; 22: 3487–94. pmid: 179
- 31.Малабанан К.П., Канеллакис П., Бобик А., Хачигян Л.М. Активация фактора транскрипции-4, индуцированная фактором роста фибробластов-2, регулирует транскрипцию фактора роста эндотелия А сосудов в гладкомышечных клетках сосудов и опосредует утолщение интимы в артериях крысы после баллонного повреждения. Circ Res 2008; 103: 378–387. pmid: 18617696
- 32. Quintavalle M, Elia L, Condorelli G, Courtneidge SA. МикроРНК контроль образования подосом в гладкомышечных клетках сосудов in vivo и in vitro.J Cell Biol 2010; 189: 13–22. pmid: 20351064
- 33. Цю Дж., Чжэн Ю., Ху Дж., Ляо Д., Грегерсен Х., Дэн Х и др. Биомеханическая регуляция функций гладкомышечных клеток сосудов: от in vitro к пониманию in vivo. Интерфейс JR Soc 2014; 11: 20130852. pmid: 24152813
- 34.
Чен К., Хьюз Дж. Д., Маттар С. Г., Ку Д. Н., Ламсден А.Б. Изучение динамики гиперплазии интимы эндартерэктомированной артерии собаки. J Surg Res 1997; 67: 106–112. pmid:
91 - 35.Роджерс М., Гетч С., Айкава Е. Медиальная кальцификация и кальцификация интимы при хронической болезни почек: подчеркивая вклад. J Am Heart Assoc 2013; 2: e000481 pmid: 24060959
- 36. Аоки М., Моришита Р., Хаяси С., Джо Н, Мацумото К., Накамура Т. и др. Ингибирование образования неоинтимы после баллонного повреждения цилостазолом, сопровождающееся улучшением эндотелиальной дисфункции и индукцией фактора роста гепатоцитов на модели диабета у крыс. Диабетология 2001; 44: 1034–1042.pmid: 11484082
- 37. Накамура Т., Хучи Х, Минами А., Сакамото С., Цучия К., Нива И. и др. Эндотелий-зависимое расслабление цилостазолом, ингибитором фосфодиэстеразы III, на грудной аорте крысы. Life Sci 2001; 69: 1709–1715. pmid: 11665832
- 38. Цучикане Э, Катох О, Сумицудзи С., Фукухара А., Фунамото М., Оцудзи С. и др. Влияние цилостазола на пролиферацию интимы после направленной коронарной атерэктомии. Am Heart J 1998; 135: 495–502. pmid: 9506336
- 39.Yang J, Cheng Y, Ji R, Zhang C. Новая модель воспалительного образования неоинтимы показывает потенциальную роль миелопероксидазы в неоинтимальной гиперплазии. Am J Physiol Heart Circ Physiol 2006; 291 (6): h4087–93. pmid: 16844918
- 40. Baldus S, Rudolph V, Roiss M, Ito WD, Rudolph TK, Eiserich JP, et al. Гепарины увеличивают биодоступность эндотелиального оксида азота за счет высвобождения миелопероксидазы, иммобилизованной на сосудах. Циркуляция 2006 г .; 113: 1871–1878. pmid: 16606792
- 41.Фишер Дж. У., Хокинс С., Клоуз А. В.. Фармакологическое ингибирование синтаз оксида азота и циклооксигеназ усиливает гиперплазию интимы в поврежденных баллоном сонных артериях крыс. J Vasc Surg 2004; 40: 115–122. pmid: 15218471
- 42. Banai S, Jaklitsch MT, Shou M, Lazarous DF, Scheinowitz M, Biro S и др. Ангиогенно-индуцированное усиление коллатерального кровотока к ишемическому миокарду за счет фактора роста эндотелия сосудов у собак. Тираж 1994; 89: 2183–2189. pmid: 7514110
- 43.Феррара Н. Роль фактора роста эндотелия сосудов в регуляции ангиогенеза. Kidney Int 1999; 56: 794–814. pmid: 10469350
- 44. Jeong SJ, Han SH, Kim CO, Choi JY, Kim JM. Антитела против фактора роста эндотелия сосудов ослабляют воспаление и снижают смертность в экспериментальной модели тяжелого сепсиса. Реанимация 2013; 17: R97. pmid: 23710641
- 45. Chancharoenthana W, Tiranathanagul K, Srisawat N, Susantitaphong P, Leelahavanichkul A, Praditpornsilpa K, et al.Повышенный фактор роста эндотелия сосудов и клиренс провоспалительных цитокинов с гемодиафильтрацией в режиме онлайн на высокопроизводительном гемодиализе у пациентов с острым повреждением почек, связанным с сепсисом. Ther Apher Dial 2013; 17: 557–563. pmid: 24107284
- 46. van der Zwan LP, Scheffer PG, Dekker JM, Stehouwer CD, Heine RJ, Teerlink T. Системное воспаление связано с низким уровнем аргинина и высоким уровнем ADMA в плазме, что приводит к неблагоприятному соотношению субстрат-ингибитор NOS: исследование Hoorn.Clin Sci (Лондон) 2011; 121: 71–78.
- 47. Масуда Х., Гото М., Тамаоки С., Адзума Х. Ускоренная гиперплазия интимы и увеличение количества эндогенных ингибиторов синтеза NO у кроликов с гипергликемией, вызванной аллоксаном. Br J Pharmacol 1999; 126: 211–218. pmid: 10051138
- 48. Chen Z, Lee FY, Bhalla KN, Wu J. Сильное ингибирование индуцированного фактором роста тромбоцитов ответа в гладкомышечных клетках сосудов с помощью BMS-354825 (дазатиниб). Mol Pharmacol 2006; 69: 1527–1533.pmid: 16436588
- 49. Бетгер Т., Битц Н., Костин С., Шнайдер Дж., Крюгер М., Хайн Л. и др. Приобретение сократительного фенотипа гладкомышечными клетками артерий мышей зависит от кластера генов Mir143 / 145. Дж. Клин Инвест 2009; 119: 2634–2647. pmid: 196
- 50. Фарх К.К.-Х, Гримсон А., Ян С., Льюис Б.П., Джонстон В.К., Лим Л.П. и др. Широкое влияние микроРНК млекопитающих на репрессию и эволюцию мРНК. Наука 2005; 310: 1817–1821. pmid: 16308420
- 51.Dang LTH, Lawson ND, Fish J.E. МикроРНК контролирует сигнальный выход фактора роста эндотелия сосудов во время развития сосудов. Артериосклер Thromb Vasc Biol 2013; 33: 193–200. pmid: 23325476
- 52. Минами Ю., Сато М., Маэсава К., Такахаши Ю., Табучи Т., Ито Т. и др. Влияние аторвастатина на экспрессию микроРНК221 / 222 в эндотелиальных клетках-предшественниках, полученных от пациентов с ишемической болезнью сердца. Eur J Clin Invest 2009; 39: 359–367. pmid: 19371267
- 53.Fleissner F, Jazbutyte V, Fiedler J, Gupta SK, Yin X, Xu Q и др. Асимметричный диметиларгинин нарушает функцию ангиогенных клеток-предшественников у пациентов с ишемической болезнью сердца через механизм, зависимый от микроРНК-21. Circ Res 2010; 107: 138–143. pmid: 20489163
Почечная недостаточность вследствие доброкачественной гиперплазии предстательной железы
Случай
Мужчина 65 лет был направлен в урологию с 5-летней историей прогрессирующей частоты мочеиспускания, ночного мочеиспускания и трудностей с инициированием струи, которые значительно ухудшились за последний месяц.В 1990-х его отцу была сделана операция ТУРП (трансуретральная резекция простаты), в результате которой на всю оставшуюся жизнь он получил «ужасное недержание мочи и импотенцию». Из-за опыта его отца пациент неохотно обращался за помощью по поводу своих собственных симптомов, чтобы ему не потребовалось хирургическое вмешательство и не развились аналогичные осложнения.
Во время своего первого визита в кабинет уролога пациента осмотрел ассистент врача, который спросил о предыдущих результатах исследования простатического специфического антигена (ПСА). По словам пациента, когда он ответил, что никогда не проходил тестирование на ПСА, его ругали за то, что он не прошел то, что, по словам помощника врача, было важным и важным тестом.Пациент, который был ученым-исследователем, объяснил, что он изучил литературу и самые последние рекомендации, в которых говорилось, что риски тестирования перевешивают его преимущества. Пациент чувствовал, что фельдшер не подозревал об этих противоречиях, а также пренебрежительно отнесся к его выбору.
Позже во время визита сканирование мочевого пузыря в офисе показало 999 мл, верхний предел обнаружения для аппарата. Последующее сканирование после мочеиспускания составило 500 мл. Несмотря на выраженное пациентом мнение о тестировании PSA, помощник врача приступил к выполнению лабораторных работ, включая тест PSA, назначил цистоскопию и призвал пациента самостоятельно катетеризоваться, если его симптомы ухудшатся (без каких-либо инструкций или демонстраций).Из-за этого негативного взаимодействия и, как следствие, недоверия к провайдеру, пациент решил не продолжать лабораторные работы и отменил запланированную цистоскопию, так как он чувствовал, что никто не объяснил ему адекватно, зачем она нужна. Фельдшер уролога также прописал тамсулозин (альфа-адреноблокатор), но пациент быстро прекратил прием препарата после того, как почувствовал сильное головокружение.
Через десять недель после первого визита в кабинет уролога пациент начал постепенно чувствовать «одурманение, головную боль и головокружение», но без резких изменений мочевых симптомов.Он посетил практикующую медсестру в кабинете своего лечащего врача, которая почувствовала, что он выглядит очень больным, и обнаружила, что его кровяное давление опасно повышено (230/170 мм рт. Ст.). Она направила его в ближайшее отделение неотложной помощи, где его креатинин был значительно повышен до 14,9 мг / дл (нормальный диапазон 0,6–1,2 мг / дл). Был введен мочевой катетер, сразу слито 2 л мочи.
Он был госпитализирован на следующие 6 дней, в течение которых его функция почек постепенно улучшилась.Его креатинин снизился до 4,3 мг / дл. Он был выписан домой с постоянным мочевым катетером и повторным приемом в том же кабинете уролога, куда он впервые обратился.
На этом контрольном приеме ему сказали, что он «готов к операции» — несмотря на его опасения относительно возможного неблагоприятного исхода на основании опыта его отца — и сказали, что отделение свяжется с вами, чтобы назначить ТУРП. Однако ему так и не перезвонили, и, решив, что он больше не будет иметь ничего общего с этим кабинетом урологии, он вместо этого связался с урологом в другой больнице.Несколько месяцев спустя пациенту без осложнений была проведена ТУРП, и в конечном итоге ему удалось удалить катетер с восстановлением нормального мочеиспускания. Его функция почек также постепенно улучшалась; однако через год он оставался ненормальным с креатинином 2,0 мг / дл.
Майкл Дж. Барри, доктор медицины, и Марк Б. Гарник, доктор медицины
Симптомы нижних мочевыводящих путей (СНМП) из-за доброкачественной гиперплазии предстательной железы (ДГПЖ) встречаются более чем у половины мужчин старше 50. Эти СНМП включают те, которые испытывал этот пациент: медленно прогрессирующая частота мочеиспускания, никтурия ( симптомов накопления , которые могут также включают позывы к мочеиспусканию) и трудности с началом мочеиспускания ( — симптомы мочеиспускания, — симптомы, которые также могут включать слабую струю, прерывистость и неполное опорожнение).(1) Эти симптомы были хроническими, но у этого пациента резко ухудшились за последний месяц. Более серьезные осложнения ДГП включают острую задержку мочи и, в обсуждаемом случае, обструктивную уропатию с почечной недостаточностью из-за обструкции выходного отверстия мочевого пузыря. Мужчины с острой или хронической задержкой мочи обычно имеют признаки декомпенсации мочевого пузыря, включая большой остаточный объем мочевого пузыря, который также может предрасполагать к инфекции и камням в мочевом пузыре.
Почечная недостаточность из-за обструктивной уропатии встречается нечасто.В рандомизированном исследовании по делам ветеранов трансуретральной простатэктомии (ТУРП) и бдительного ожидания мужчины с умеренными симптомами, связанными с ДГПЖ, были рандомизированы даже с остаточными объемами после мочеиспускания до 350 мл. За более чем 3 года наблюдения у 3/280 мужчин развилась почечная декомпенсация в группе хирургического вмешательства, по сравнению с 1/276 в группе бдительного ожидания. (2) В другом исследовании более 3000 мужчин были рандомизированы для приема альфа-адреноблокаторов. ингибитор 5-альфа-редуктазы (5-ARI), комбинированная терапия или плацебо.После 4,5 лет последующего наблюдения ни у одного мужчины в какой-либо группе исследования не развилось почечной недостаточности, связанной с ДГПЖ. (3) С учетом этих данных, руководство Американской урологической ассоциации (AUA) по лечению состояний ДГПЖ: «Обычное измерение сыворотки крови». Уровни креатинина не указаны при первоначальной оценке мужчин с СНМП, вторичными по отношению к ДГП ». (4)
Тем не менее, как показывает этот случай, разумно поддерживать высокий индекс подозрения на хроническую задержку мочи и почечную недостаточность. История резкого ухудшения симптомов нетипична для аденомы простаты и должна вызывать подозрение, что у пациента может наблюдаться задержка мочи.Обнаружение остаточного объема после мочеиспускания в 500 мл также было красным флагом, который должен был вызвать измерение креатинина.
Вместо того, чтобы отреагировать на проблему, которая привела пациента, клиницист отругал его за то, что он не прошел тест на ПСА, рекомендовал самокатетеризацию мочи без инструкции и прописал альфа-блокатор без каких-либо рекомендаций относительно потенциальных побочных эффектов. Возможно, пациент назначил тест на креатинин, но не сделал его из-за сопутствующего нежелательного теста на ПСА.Повторная проверка остаточного объема после мочеиспускания после пробного приема альфа-блокатора была бы разумной и более важной, чем цистоскопия. Хотя результаты цистоскопии могут помочь в планировании операции, они не являются надежными предикторами обструкции и, как правило, не рекомендуются, когда первоначальная оценка предполагает обструкцию выходного отверстия мочевого пузыря. (1) Самокатетеризация является вариантом лечения хронической задержки мочи, но обычно после дополнительной оценки Так было здесь, и только при тщательном обучении.
Какие еще оценки могли быть полезны на начальном этапе? Оценка симптомов AUA может помочь объективно количественно оценить симптомы и послужить основой для оценки будущего ухудшения или улучшения. (5) Пальцевое ректальное исследование могло продемонстрировать симметрично увеличенную твердую (как кончик носа) простату, что помогло подтвердить диагноз. аденомы простаты, но также асимметрия, уплотнение или узловатость, которые могут указывать на рак простаты в качестве другого возможного диагноза. Анализ мочи был бы полезен для оценки наличия инфекции или гематурии.(1,4)
Поскольку этого пациента осматривали в урологическом кабинете, был доступен сканер мочевого пузыря для неинвазивного измерения остаточного объема мочевого пузыря. Дополнительным тестом, который можно было бы сделать в этой обстановке, была бы скорость потока мочи; пиковая скорость потока мочи более 15 мл / сек снижает вероятность обструкции выходного отверстия мочевого пузыря. Перед хирургическим вмешательством одновременное измерение давления в мочевом пузыре и потока мочи (уродинамическое исследование) является золотым стандартом для документирования обструкции, но, как правило, это не выполняется при первом посещении.
Для терапевта, не имеющего доступа к сканеру мочевого пузыря, более обременительным методом является заказ трансабдоминального УЗИ с оценкой объема мочевого пузыря до и после мочеиспускания. Ультразвук также может оценить гидронефроз и более объективно оценить размер простаты.
Несмотря на то, что доступны другие медицинские варианты (6,7), решение о назначении альфа-блокаторов при СНМП, связанных с ДГПЖ, было разумным, хотя и с лучшим объяснением ожидаемых терапевтических и потенциальных побочных эффектов.У мужчин с увеличенной простатой сочетание альфа-адреноблокатора с 5-ARI связано с большим улучшением симптомов и снижением риска прогрессирования до острой ретенции или хирургического вмешательства. Однако 5-ОРИ действуют медленнее по сравнению с альфа-адреноблокаторами и, вероятно, не повлияли бы на краткосрочное прогрессирование пациента до хронической ретенции.
В этой клинической ситуации часто назначают анализ ПСА, но его нельзя проводить без обсуждения рисков и преимуществ с пациентом. Во-первых, хотя ДГПЖ и рак простаты могут сосуществовать, типичные симптомы СНМП не увеличивают вероятность рака простаты у мужчины.(8) Рекомендации AUA и Целевой группы профилактических служб США по раннему выявлению рака простаты рекомендуют единый подход к принятию решений по скринингу на ПСА для мужчин в возрасте 55–69 лет (9,10), и этот мужчина явно не был склонен. Уровни специфического антигена простаты также могут быть полезны при лечении ДГПЖ; ПСА может дать приблизительную оценку размера простаты (11), и мужчины с более высоким уровнем ПСА получают больше пользы от 5-ОРИ. (12) Более того, уровни ПСА снижаются примерно на 50% при 5-ОРИ и последующем повышении у приверженцев. Пациент может предупредить о прогрессировании рака.Однако, если для лечения аденомы простаты проводится анализ ПСА и результат повышается, мужчину могут заставить сделать нежелательную биопсию из-за опасений по поводу рака простаты.
В течение следующих 10 недель пациент, не доверявший врачу, с которым он встретился, отменил свое наблюдение с последующей прогрессирующей хронической задержкой мочи, обструктивной уропатией с почечной недостаточностью и опасной для жизни гипертонией. Его мочевой пузырь сильно расширился, и после катетеризации из него было истощено 2 литра. Хотя его функция почек частично восстановилась после ТУРП, повреждение мочевого пузыря и почек не может быть полностью обратимым.
В дополнение к уже упомянутым ошибкам в общении и обучении, беспокойство пациента по поводу плохого исхода его отца после ТУРП можно было бы лучше решить. Эректильная дисфункция и недержание мочи возникают редко после ТУРП, в то время как ретроградная эякуляция является обычным явлением, и даже возможно, что пациент неправильно понял фактическое состояние или процедуру, которую перенес его отец. В настоящее время доступно множество новых хирургических вариантов для лечения СНМП, связанных с ДГПЖ, если лекарства не работают (13), что дает пациентам гораздо больше возможностей, чем было доступно в 1990-х годах.Общий процесс принятия решений между врачом и пациентом может начаться на диагностической фазе, когда мужчина поступает с СНМП, и продолжаться после установления диагноза и рассмотрения вариантов лечения. В руководстве AUA по аденоме простаты подчеркивается важность совместного принятия решений и акцент на том, как симптомы влияют на пациентов, как на важные подходы к оптимальному ведению. (4)
Очков на дом
- Базовое обследование пожилого мужчины с симптомами нижних мочевыводящих путей, предположительно вызванными доброкачественной гиперплазией предстательной железы, должно включать оценку симптомов Американской урологической ассоциации, пальцевое ректальное исследование и анализ мочи.
- Мужчинам с быстро ухудшающимися симптомами нижних мочевых путей, связанными с доброкачественной гиперплазией предстательной железы, следует измерить креатинин, чтобы исключить почечную недостаточность из-за обструкции выходного отверстия мочевого пузыря. Кроме того, следует измерить остаточный объем мочевого пузыря с помощью сканера мочевого пузыря или трансабдоминального УЗИ. Значительные остаточные объемы после мочеиспускания (> 350 мл или около того) должны быть подтверждены, и настоятельно рекомендуется проконсультироваться с урологом.
- Как и в случае с большинством медицинских проблем, шаги по диагностике и лечению состояния следует тщательно обсудить с пациентом.
Майкл Дж. Барри, доктор медицины
Директор и профессор медицины
Программа принятия обоснованных медицинских решений
Отделение общей внутренней медицины
Больница общего профиля Массачусетса
Гарвардская медицинская школа
Бостон, Массачусетс, СШАМарк Б. Гарник, доктор медицины
Клинический профессор медицины братьев Горман
Отделение гематологии и онкологии
Медицинский центр Бет Исраэль Дьяконесса
Гарвардская медицинская школа
Бостон, МассачусетсВыражение признательности: Этот случай был разработан в сотрудничестве с Сетью обучения первичной медицинской помощи по диагностическим ошибкам (PRIDE).
Список литературы
1. Абрамс П., Чаппл С., Хури С., Рорборн С., де ла Розетт Дж. Оценка и лечение симптомов нижних мочевыводящих путей у пожилых мужчин. J Urol. 2013; 189 (приложение 1): S93-S101. [перейти в PubMed]
2. Уоссон Дж. Х., Реда Д. Д., Брускевиц Р. К., Элинсон Дж., Келлер А. М., Хендерсон В. Г.; Совместная исследовательская группа по делам ветеранов по трансуретральной резекции простаты. Сравнение трансуретральной хирургии с осторожным ожиданием умеренных симптомов доброкачественной гиперплазии простаты.N Engl J Med. 1995; 332: 75-79. [перейти в PubMed]
3. МакКоннелл Дж. Д., Рорборн К. Г., Баутиста О. М. и др .; Исследовательская группа по медицинской терапии простатических симптомов (MTOPS). Долгосрочное влияние доксазозина, финастерида и комбинированной терапии на клиническое прогрессирование доброкачественной гиперплазии простаты. N Engl J Med. 2003; 349: 2387-2398. [перейти в PubMed]
4. McVary KT, Roehrborn CG, Avins AL, et al. Обновление руководства AUA по лечению доброкачественной гиперплазии простаты. J Urol. 2011; 185: 1793-1803.[перейти в PubMed]
5. Барри М.Дж., Фаулер Ф.Дж. II, О’Лири М.П. и др. Индекс симптомов доброкачественной гиперплазии предстательной железы, разработанный Американской урологической ассоциацией. J Urol. 1992; 148: 1549-1557. [перейти в PubMed]
6. Ким Э. Х., Ларсон Дж. А., Андриоле Г. Л.. Лечение доброкачественной гиперплазии простаты. Ann Rev Med. 2016; 67: 137-151. [перейти в PubMed]
7. Brasure M, MacDonald R, Dahm P, et al. Новые лекарства от симптомов нижних мочевыводящих путей, приписываемых доброкачественной гиперплазии предстательной железы: обзор.Роквилл, Мэриленд: Агентство по исследованиям и качеству здравоохранения; Май 2016. Отчет № 16-EHC024-EF. [Доступно по адресу]
8. Шенк Дж. М., Кристал А. Р., Арнольд К. Б. и др. Ассоциация симптоматической доброкачественной гиперплазии предстательной железы и рака простаты: результаты исследования профилактики рака простаты. Am J Epidemiol. 2011; 173: 1419-1428. [перейти в PubMed]
9. Картер Х. Б., Альбертсен П. К., Барри М. Дж. И др. Раннее выявление рака простаты: рекомендации AUA. J Urol. 2013; 190: 419-426. [перейти в PubMed]
10.Гроссман Д.К., Карри С.Дж., Оуэнс Д.К. и др .; Целевая группа по профилактическим услугам США. Скрининг на рак простаты: рекомендация Целевой группы по профилактическим службам США. ДЖАМА. 2018; 319: 1901-1913. [перейти в PubMed]
11. Roehrborn CG, Boyle P, Gould AL, Waldstreicher J. Сывороточный простатоспецифический антиген как предиктор объема простаты у мужчин с доброкачественной гиперплазией простаты. Урология. 1999; 53: 581-589. [перейти в PubMed]
12. Рорборн К.Г., МакКоннелл Д.Д., Либер М. и др. Концентрация простатспецифического антигена в сыворотке крови является мощным предиктором острой задержки мочи и необходимости хирургического вмешательства у мужчин с клинической доброкачественной гиперплазией предстательной железы.PLESS Study Group. Урология. 1999; 53: 473-480. [перейти в PubMed]
13. Foster HE, Barry MJ, Dahm P, et al. Хирургическое лечение симптомов нижних мочевыводящих путей, связанных с доброкачественной гиперплазией простаты: Руководство AUA. J Urol. 2018; 200: 612-619. [перейти в PubMed]
Вызванная амлодипином гиперплазия десен у молодых мужчин с хронической болезнью почек 5 стадии
Гиперплазия десен — редкое явление в клинической практике. Тем не менее, когда это происходит, это открытие имеет большую ценность, поскольку оно может привести к определенному клиническому диагнозу.В данном случае речь идет о 19-летнем мужчине, который был направлен для дальнейшего лечения хронической болезни почек 5 стадии. При обследовании у него была обнаружена гиперплазия десен. Его обследовали на предмет наличия обратимых причин заболевания почек, и, поскольку ничего не было обнаружено, была рекомендована заместительная почечная терапия. Он принимал амлодипин для контроля артериального давления. Поскольку предполагалось, что это является причиной гиперплазии десен, это было остановлено и заменено комбинацией бета-адреноблокаторов и празозина. Через шесть месяцев у него было полное исчезновение гиперплазии десен.Амлодипин как причина гиперплазии десен встречается редко. Однако очень важно помнить о таком возможном побочном эффекте этого обычно назначаемого гипотензивного препарата.
1. Введение
Гиперплазия десны — это физическое проявление, которое редко встречается в клинической практике. Однако, как только это подтверждается, это важный признак, поскольку он может дать ключ к правильному диагнозу пациента. На протяжении многих лет в литературе сообщалось о различных причинах гиперплазии десен.Распространенными причинами гиперплазии десен являются лекарственные препараты, неходжкинская лимфома, острый моноцитарный лейкоз, гранулематозные заболевания и хронические инфекции пародонта [1]. Этот список можно еще больше сузить с помощью целенаправленного анамнеза и физического осмотра. Если установлена точная этиология, часто можно избежать биопсии, и можно начать лечение, просто избегая этиологического агента. В этом контексте было бы полезно знать все причины гиперплазии десен, как известные, так и неясные.Здесь мы описываем редкий случай пациента с вызванной амлодипином гиперплазией десен на фоне хронической болезни почек 5 стадии.
2. Описание клинического случая
Мальчик 19 лет поступил с ночным кашлем и двусторонним отеком нижних конечностей продолжительностью 3 месяца. Жалоб на пенистую мочу, снижение диуреза, гематурию не было. Его обследовали на предмет этих жалоб в его родном городе, и ему поставили диагноз: гипертония и хроническая болезнь почек 5 стадии.У него не было никаких зависимостей, аллергии или значительного семейного анамнеза заболевания почек. Ему начали давать 10 мг амлодипина, и он был направлен в нашу больницу для дальнейшего обследования и лечения. После начала приема амлодипина пациент заметил безболезненный, постепенно прогрессирующий и нерегулярный отек десен с несколькими эпизодами кровотечения при чистке зубов. Когда он обратился к нам, он в общей сложности принимал амлодипин в течение трех месяцев.
При обращении в амбулаторное отделение у него было артериальное давление 180/100 мм рт. Ст. В обеих верхних конечностях.Его частота сердечных сокращений составляла 84 удара / мин, частота дыхания — 18 вдохов / мин, а сатурация артериальной крови кислородом комнатного воздуха составляла 98%. Он был без лихорадки. У него был отмечен точечный отек педалей обеих нижних конечностей до середины икры. При интраоральном осмотре было обнаружено массивное безболезненное увеличение десны, охватывающее обе дуги, захватывающее буккальное, небное и лингвальное вестибулярное пространство (рис. 1). Десна была бледно-розовой, плотной консистенции, не болезненной при пальпации. Других положительных результатов проверки других систем не было.
Был обследован на предмет излечимых причин хронического заболевания почек. Причины гиперплазии десен, которые считались причинами, включали хронический пародонтит, лекарственные препараты (блокаторы кальциевых каналов, такие как амлодипин и нифедипин; циклоспорин и противосудорожные препараты, такие как фенитоин), острый моноцитарный лейкоз и неходжкинскую лимфому.
Первоначальные исследования крови пациента показали анемию (Таблица 1). Его креатинин был повышен, а ультразвуковое сканирование показало двустороннее сморщивание почек с изменениями паренхимы почек 3 степени.Общая продолжительность его заболевания почек не была известна. Биопсия почки не могла быть выполнена из-за небольшого размера и плохой кортико-медуллярной дифференцировки. Следовательно, невозможно было провести полную оценку причины его заболевания почек.
Исследования Результат (нормальный диапазон) Гемоглобин (г / л) 90 (140–175) Всего × 10 9 / л) 6 (4.5–11.0) Количество тромбоцитов (× 10 9 / л) 154 (150–350) Серология на ВИЧ, HBV, HCV Отрицательный Креатинин сыворотки ( μ моль / л) 666,5 (62–106) Скорость оседания эритроцитов (СОЭ) (мм / час) 22 (0–20) Натрий сыворотки (ммоль / л) 138 ( 135–145) Калий в сыворотке (ммоль / л) 5.2 (3,5–5) Бикарбонат сыворотки (ммоль / л) 16 (22–29) Мочевая кислота сыворотки (мг / дл) 5,8 (4–7) Сыворотка кальций (мг / дл) 7,81 (8,3–10,4) Фосфор сыворотки (мг / дл) 5 (2,5–4,6) Гормон паращитовидной железы сыворотки (пг / мл) 1305,3 (8 –74) c-ANCA (антинейтрофильные цитоплазматические антитела) Отрицательный p-ANCA (антинейтрофильные цитоплазматические антитела) Отрицательный Тиреотропный гормон µмл (ТТГ) ) 2.6 Общий комплемент сыворотки Нормальный Содержание белка в суточной моче (г) 3,3 (50–150 мг) Количество лейкоцитов в крови в норме , а это исключало какие-либо дискразии крови. Его кровь не обнаружила взрывов. Лимфаденопатии у него не было. Установлен диагноз: хроническая болезнь почек 5 стадии неясной этиологии и вторичная гипертензия. Был поставлен предварительный диагноз гиперплазии десен, вызванной амлодипином.Из-за четкой временной ассоциации было решено оценить реакцию на отмену амлодипина, прежде чем приступить к дальнейшей оценке.
Пациенту рекомендовано соблюдать почечную диету с низким содержанием соли. Амлодипин был отменен, и ему дали комбинацию атенолола и празозина для контроля артериального давления. Он также начал принимать фебуксостат, торсемид, добавки кальция и витамина D, фосфатсвязывающие средства, добавки железа и эритропоэтин. Была объяснена необходимость заместительной почечной терапии, и ему было назначено создание АВ (артериовенозной) фистулы.Ему также объяснили возможность пересадки почки.
При контрольном обследовании через шесть месяцев у пациента было полное исчезновение гиперплазии десен. Была проведена оценка причинно-следственной связи ВОЗ-UMC, и случай попал в категорию «вероятный / вероятный». Доказательство «определенной» причинности потребовало бы повторной проверки препарата, что было бы неэтично. Таким образом, это было сочтено достаточным доказательством того, что причиной гиперплазии десен является амлодипин. Хроническое заболевание почек лечилось с медицинской точки зрения, и ему было запланировано создание атриовентрикулярного свища для начала поддерживающего гемодиализа.
3. Обсуждение
Амлодипин — дигидропиридиновый блокатор кальциевых каналов, который обычно назначают в качестве гипотензивного препарата. Общие побочные эффекты амлодипина включают головную боль, головокружение и сердцебиение. Гиперплазия десен — редкий побочный эффект этого препарата. Распространенность гиперплазии десен, вызванной амлодипином, была оценена Йоргенсеном в 1997 году как 3,3% для пациентов в Соединенных Штатах Америки, в то время как исследование, проведенное в Индии в 2014 году Tejnaniet al.пришли к аналогичному количеству 3,4% [2, 3]. Это говорит о том, что распространенность гиперплазии десен, вызванной амлодипином, одинакова в популяциях разных рас и географических регионов и остается стабильной с течением времени. Другими причинами гиперплазии десен являются лекарственные препараты (другие блокаторы кальциевых каналов, такие как нифедипин; циклоспорин и противосудорожные средства, такие как фенитоин), неходжкинская лимфома, острый моноцитарный лейкоз, гранулематозные заболевания (саркоидоз и болезнь Крона), гранулематоз с хроническими инфекциями полиангиита, пиогенная гранулема, доброкачественные новообразования, такие как фиброма или папиллома, злокачественные новообразования, такие как карцинома или злокачественная меланома, синдромальные причины (синдром Резерфорда, кросс-синдром, синдром Рамона и синдром Лабанда), беременность и идиопатическая гиперплазия десен [4].
Было известно, что блокаторы кальциевых каналов, такие как нифедипин, могут вызывать гиперплазию десен. Когда на рынке появился амлодипин, поступали аналогичные сообщения о гиперплазии десен и при применении этого препарата. Об этом впервые сообщили в 1993 г. Ellis et al. [5]. С тех пор поступали различные сообщения о подобных случаях. Видно, что он в три раза чаще встречается у мужчин, чем у женщин [6]. Сообщается, что амлодипин также вызывает гиперплазию твердого неба [7].
Точный механизм гиперплазии десен, вызванной амлодипином, не известен. Были предложены различные механизмы. К ним относятся недостаточная активность коллагеназы из-за снижения поглощения фолиевой кислоты, увеличение адренокортикотропного гормона (АКТГ) из-за блокировки синтеза альдостерона, увеличение фактора роста кератиноцитов, воспаление из-за концентрации лекарства в щелях и бактериальных бляшках, а также активация трансформирующего фактора роста-бета [8–10]. Другие факторы, такие как гигиена полости рта, дефицит питательных веществ, сопутствующие заболевания, такие как почечная недостаточность (наблюдаемая у нашего пациента) и мужской пол, также могут способствовать гиперплазии десен [6].Это также может быть предвзятым наблюдением, поскольку большая часть пациентов с хроническим заболеванием почек получает терапию амлодипином в качестве гипотензивного средства.
Замена амлодипина другим гипотензивным средством остается основой лечения. У нашего пациента гиперплазия десен полностью исчезла в течение шести месяцев после прекращения приема препарата. Также сообщалось о регрессе в течение трех месяцев после прекращения приема препарата [11]. Это говорит о том, что гиперплазия десен, вызванная амлодипином, обратима при прекращении приема одного препарата.Однако некоторые рекомендуют хирургическое вмешательство для лучшего эстетического результата. Может быть выполнена гингивэктомия или хирургия пародонтального лоскута. Поддержание хорошей гигиены полости рта и регулярная чистка зубов также имеют первостепенное значение. Таким образом, амлодипин является потенциально обратимой причиной гиперплазии десен, и это необходимо учитывать при оценке пациентов с чрезмерным разрастанием десен.
Этическое разрешение
Работа соответствует этическим нормам и требованиям местного законодательства.
Согласие
Информированное подписанное согласие было получено от пациента.
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов относительно публикации этой статьи.
Благодарности
Авторы хотели бы поблагодарить профессора Варгезе Джона за рецензирование рукописи.
Инфекция почек (пиелонефрит); Симптомы, лечение, профилактика
Обзор
Что такое инфекция почек (пиелонефрит)?
Инфекция мочевыводящих путей может поражать нижние пути, особенно мочевой пузырь (цистит), простату (простатит) или верхние пути и почки (пиелонефрит).Обычно это бактериальная инфекция. Заболевание встречается примерно у трех-семи из каждых 10 000 человек в Соединенных Штатах. Возникновение у беременных составляет около 2 процентов. Это легко поддается лечению, если диагностировано на ранней стадии.
Бактерия кишечной палочки (кишечная палочка) вызывает около 90 процентов инфекций почек. Бактерии мигрируют из половых органов через уретру (трубку, по которой моча выводится из организма) в мочевой пузырь и вверх по трубкам (мочеточникам), соединяющим мочевой пузырь с почками.
Некоторые бактерии, например, стафилококковые инфекции, могут попадать в почки с кровотоком.
Симптомы и причины
Каковы причины инфекций почек (пиелонефрита)?
Обычно бактерии выводятся с потоком мочи.Однако несколько проблем могут увеличить риск почечной инфекции. Эти проблемы могут включать:
- Структурные аномалии (стриктуры, стенты, камни, хирургическое вмешательство), блокирующие отток мочи.
- Увеличенная предстательная железа (доброкачественная гиперплазия предстательной железы), сдавливающая уретру.
- Обратный поток (рефлюкс) мочи из мочевого пузыря в почки.
- Если ваша иммунная система затронута (низкое количество лейкоцитов, прием некоторых лекарств, ВИЧ, рак, трансплантация органов).
- Беременность, во время которой увеличивающаяся матка может сдавливать мочеточники и уменьшать отток мочи, позволяя бактериям мигрировать в почки.
- Неконтролируемый сахарный диабет.
Каковы симптомы почечной инфекции?
Ряд симптомов может указывать вашему врачу на то, что у вас может быть инфекция почек. Чем серьезнее симптомы, тем больше вероятность заражения почки. Симптомы почечной инфекции включают:
- Внезапное начало озноба
- Температура выше 100 градусов по Фаренгейту
- Боль в паху, пояснице или боку
- Тошнота
- Рвота
- Спазм мышц живота
Более общие симптомы инфекции верхних почек включают:
- Покрасневшая или покрасневшая кожа
- Болезненное мочеиспускание
- Учащенное мочеиспускание
- Непродуктивные попытки мочеиспускания, несмотря на чувство крайней необходимости
- Общие недомогания
- Мутная моча
- Моча ненормального цвета
- Кровь в моче
- Моча с неприятным запахом
Если у вас возникнут какие-либо из этих внезапных симптомов, обратитесь за медицинской помощью.
Диагностика и тесты
Как диагностируется инфекция почек (пиелонефрит)?
Два общих лабораторных теста выполняются для диагностики почечных инфекций (пиелонефрита). Образец мочи исследуется под микроскопом, чтобы определить, присутствуют ли белые и / или эритроциты.Мочу также отправляют в лабораторию, чтобы проверить, не растут ли бактерии в посеве мочи. Если человек очень болен, ему также могут быть отправлены посевы крови. Штамм культивируемых бактерий будет определять тип терапии, используемой в вашем лечении.
Пиелонефрит часто можно лечить без рентгеновских исследований, если только ваш врач не подозревает, что это может быть дополнительная проблема. КТ-сканирование дает изображения структур и органов, и это сканирование обычно выполняется без контраста (красителя). Иногда для оценки может быть достаточно УЗИ почек.
Ведение и лечение
Как лечат инфекции почек (пиелонефрит)?
Врач лечит болезнь на основании своего осмотра. Он или она может начать стандартное лечение пациента курсом антибиотиков до того, как станут доступны результаты лабораторных анализов.Лекарство может измениться после того, как лабораторные тесты выявят точный штамм бактерий.
При эффективном лечении пациент должен чувствовать себя лучше через два-три дня. В противном случае ваш лечащий врач начнет искать дополнительные проблемы. Большинство курсов лечения антибиотиками длится 14 дней, и важно, чтобы пациенты принимали таблетки в соответствии с рекомендациями в течение полных 14 дней, даже если симптомы могут исчезнуть через несколько дней. Исчезновение симптомов не означает, что все бактерии погибают.Некоторые могут остаться, и инфекция может появиться снова.
Есть также опасения, что у оставшихся бактерий может развиться устойчивость к лекарству. По какой-то причине мужчинам сложнее лечить заболевание, и им, возможно, придется принимать лекарства до шести недель. Пациенты с тяжелым заболеванием, у которых наблюдается сильная тошнота и рвота, высокая температура, сильная боль и признаки обезвоживания, могут быть госпитализированы на несколько дней, пока антибиотики вводятся внутривенно.Образцы мочи берутся примерно через шесть недель после лечения и исследуются, чтобы гарантировать искоренение бактериальной инфекции.
Профилактика
Можно ли предотвратить инфекцию почек (пиелонефрит)?
Инфекции почек можно предотвратить, не допуская попадания бактерий в мочевыводящие пути и мочевой пузырь.Инфекции почек часто начинаются с инфекции нижних отделов мочевого пузыря. Предотвращая эти инфекции, вы можете предотвратить инфекции почек.
Есть несколько способов избежать заражения и сохранить здоровье почек. Эти советы могут включать:
- Гидратация: важно пить достаточное количество жидкости (не только воды) каждый день, но нет конкретных рекомендаций, применимых к каждому пациенту. Количество может измениться, если у вас есть определенные заболевания или вы живете в особенно жарком климате.Поговорите со своим врачом о рекомендуемом количестве воды, которое вам нужно каждый день.
- Полностью помочитесь: когда вам нужно помочиться, полностью опорожните мочевой пузырь. Удерживание в моче может быть вредным и способствовать росту бактерий. Мочеиспускание каждые несколько часов может помочь вывести из организма любые бактерии и защитить его от инфекции.
- Мочеиспускание после полового акта: Мочеиспускание после полового акта помогает удалить любые бактерии, которые могли попасть в организм. И мужчины, и женщины должны делать это для предотвращения инфекций.
- Соблюдайте правила гигиены. Поддержание чистоты помогает защитить свое тело от инфекций. После дефекации протрите его спереди назад, чтобы отогнать бактерии от уретры (отверстия в теле). Это особенно важно для женщин.
Перспективы / Прогноз
Каковы прогнозы при инфекциях почек (пиелонефрите)?
При лечении прогноз почечных инфекций (пиелонефрита) очень положительный.Жизненно важно принимать все прописанные вам лекарства от инфекции. Вы можете почувствовать себя лучше вскоре после начала лечения, но при этом вам все равно нужно будет пройти весь прописанный курс лечения.
ДГПН Почечная недостаточность: подвержен ли я риску?
Примерно половина всех мужчин с аденомой простаты испытывают симптомы. Состояние может вызвать серьезные осложнения, в том числе почечную недостаточность.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) поражает более 50 процентов мужчин старше 60 лет и более 80 процентов мужчин старше 80 лет.
Эта статья отвечает на многие часто задаваемые вопросы, касающиеся почечной недостаточности при ДГПЖ.
ДГП относится к увеличенной простате, не вызванной раком.
Простата — это железа размером с грецкий орех, расположенная между мочевым пузырем и половым членом. Уретра, трубка, по которой моча транспортируется из мочевого пузыря к половому члену, проходит через середину простаты.
Простата отвечает за выработку щелочной жидкости, которая защищает сперму после эякуляции.
Эта железа увеличивается в размере вдвое во время полового созревания и продолжает расти в течение взрослого периода, но гораздо медленнее.Если простата становится слишком большой, она может давить на уретру и мешать оттоку мочи.
Почечная недостаточность, обычно известная как почечная недостаточность, возникает, когда почки больше не могут выводить отходы из кровотока.
ДГПЖ может препятствовать оттоку мочи, что может способствовать почечной недостаточности.
Другие причины почечной недостаточности включают:
Существует пять стадий почечной недостаточности. Человеку с терминальной почечной недостаточностью требуется продолжение диализа или трансплантация.Диализ включает в себя искусственную фильтрацию крови для удаления продуктов жизнедеятельности.
Уретра, по которой моча выводится из организма, проходит через простату. Когда простата увеличивается из-за аденомы простаты, она может сдавливать уретру и мешать оттоку мочи.
Когда моча не выводится из организма, это может привести к почечной недостаточности.
Увеличенная простата может вызвать:
- затруднение мочеиспускания
- низкий поток мочи
- неспособность полностью опорожнить мочевой пузырь
- неспособность мочеиспускания
Другие состояния, которые могут повлиять на отток мочи, включают:
ДГПЖ редко приводит к почечной недостаточности.Однако тяжелые случаи ДГПЖ могут вызывать другие осложнения, такие как повреждение мочевого пузыря, инфекция и повреждение почек. Очень важно как можно скорее сообщить врачу о симптомах мочеиспускания.
Поделиться на Pinterest Симптомы аденомы простаты могут включать учащенное мочеиспускание, напряжение при мочеиспускании и неспособность к мочеиспусканию.Люди с аденомой простаты замечают изменения в привычках мочеиспускания. Они часто жалуются, что просыпаются за ночь более одного раза, чтобы помочиться. Этот симптом называется никтурией.
Другие симптомы ДГПЖ включают:
- позывы к мочеиспусканию
- учащенное мочеиспускание
- ощущение, что мочевой пузырь всегда полон, даже после мочеиспускания
- слабый поток мочи
- напряжение при мочеиспускании
- невозможность мочеиспускания
- затрудненное начало мочеиспускания
- капающая моча
У некоторых могут быть дополнительные признаки и симптомы, такие как:
- кровь в моче
- инфекция мочевыводящих путей
- полная невозможность мочеиспускания, для которой требуется катетер
Симптомы варьируются от легких до тяжелых, и их тяжесть может не зависеть от размера простаты.
Симптомы аденомы простаты могут со временем ухудшиться, но они могут стабилизироваться или даже улучшиться.
Когда ДГПЖ вызывает почечную недостаточность, у людей возникают некоторые из описанных выше мочевых симптомов.
Они также могут заметить некоторые из следующих признаков почечной недостаточности:
- боль в груди
- усталость
- тошнота
- опухоль в лодыжках, ступнях и ногах
- одышка
- снижение диуреза
На более поздних стадиях почечной недостаточности симптомы могут быть опасными для жизни.К ним относятся:
У некоторых людей с признаками и симптомами аденомы простаты может быть другое заболевание, например:
- инфекция мочевыводящих путей
- мочевой пузырь или камни в почках
- простатит, воспаление простаты
- сужение уретры, которая называется стриктура уретры
- рубцевание мочевого пузыря, вызванное хирургическим вмешательством
- нервные проблемы в мочевом пузыре
- рак простаты
- рак мочевого пузыря
.
При изменении привычек мочеиспускания человек должен обратиться за медицинской помощью. Врач может проверить размер простаты через прямую кишку.
Человек, который не может мочиться или замечает кровь в моче, должен немедленно обратиться за медицинской помощью.
Люди с диагнозом ДГПЖ должны проходить регулярные осмотры. Отслеживание размера простаты и сообщение о любых новых симптомах может снизить риск осложнений.
Чтобы предотвратить повреждение почек, люди с аденомой простаты должны следовать плану лечения, разработанному их врачом.
Это может включать прием лекарств и изменение образа жизни. Тяжелые случаи аденомы простаты можно лечить с помощью малоинвазивных или открытых операций.
Раннее устранение симптомов аденомы простаты улучшит качество жизни человека и предотвратит почечную недостаточность. Важно регулярно проверять размер простаты и сообщать врачу о любых новых симптомах.
Поделиться в PinterestИзменение образа жизни, например ограничение употребления алкоголя, может помочь в лечении незначительных симптомов.Лекарства от аденомы простаты могут расслабить мышцы или предотвратить выработку гормонов, вызывающих рост простаты.
Если лекарства не работают, врач может порекомендовать удалить часть простаты с помощью хирургического вмешательства или лазерной терапии. Лечение не всегда необходимо, особенно если симптомы отсутствуют или они легкие.
Незначительные симптомы можно лечить с помощью изменения образа жизни, включая тренировку мочевого пузыря, физические упражнения и ограничение потребления кофеина и алкоголя.
Выбор лечения будет зависеть от состояния здоровья человека, симптомов и размера простаты.
Когда у человека почечная недостаточность, необходимы другие методы лечения для лечения таких осложнений, как высокое кровяное давление и задержка жидкости.Человеку с терминальной почечной недостаточностью потребуется трансплантация почки или диализ.
У большинства людей с аденомой простаты не разовьется почечная недостаточность, особенно если они сразу сообщают о симптомах.
Симптомы аденомы простаты обычно улучшаются при лечении. Человеку может потребоваться постоянный прием лекарств или повторное лечение, чтобы симптомы не вернулись или не ухудшились.
У людей с почечной недостаточностью лечение направлено на замедление поражения почек. На завершающих стадиях заболевания человеку потребуется регулярный диализ или пересадка почки.
Доброкачественное заболевание предстательной железы | Национальный фонд почек
Предстательная железа размером с грецкий орех расположена под мочевым пузырем, органом, хранящим мочу. У мужчин предстательная железа является частью репродуктивной системы. Работа предстательной железы — производить жидкость для спермы, которая используется для переноса сперматозоидов во время эякуляции.
Почему предстательная железа вызывает проблемы?
Если предстательная железа увеличивается, это может препятствовать оттоку мочи.Простата обвивает уретру — трубку, по которой моча проходит от мочевого пузыря к кончику полового члена. По мере увеличения простаты это вызывает постепенное сжатие части уретры, которая проходит через нее, что может вызвать затруднение мочеиспускания. Увеличение предстательной железы называется доброкачественной гиперплазией предстательной железы или ДГПЖ.
Насколько распространены проблемы с простатой?
Более половины мужчин старше 60 лет имеют увеличенную простату. С возрастом у мужчин увеличивается вероятность увеличения простаты.К 80 годам около 80 процентов имеют увеличенную предстательную железу. Только около половины этих мужчин имеют какие-либо симптомы, связанные с простатой.
Каковы симптомы проблемы с простатой?
Наиболее частые симптомы проблемы с простатой:
- слабая струя мочи
- ощущение невозможности полностью опорожнить мочевой пузырь
- Проблемы с началом мочеиспускания
- частое мочеиспускание или ощущение того, что нужно немедленно уйти
- необходимость часто вставать ночью, чтобы помочиться
- остановка и запуск струи мочи.
Как диагностируется проблема простаты?
Проблема простаты чаще всего диагностируется из-за симптомов, которые она вызывает. Ваш врач также проведет физическое обследование, которое называется пальцевым ректальным исследованием или DRE. Другие тесты могут быть выполнены для измерения потока мочи, которые могут помочь врачу определить, насколько простата блокирует поток мочи.
Означает ли увеличение простаты рак?
Большинство мужчин с проблемами простаты не болеют раком.Рак возникает в предстательной железе и чаще встречается у мужчин. Вашему врачу важно проверить вашу предстательную железу на предмет увеличения или отклонений, особенно с возрастом. Кроме того, теперь существует анализ крови, называемый ПСА, или тест на специфический антиген простаты, который измеряет содержание вещества, которое увеличивается в крови при распространении рака простаты. Американская урологическая ассоциация (AUA) рекомендует ежегодное обследование простаты всем мужчинам старше 50 лет. Однако мужчины с повышенным риском развития рака простаты, такие как афроамериканцы и мужчины с семейным анамнезом этого заболевания, являются рекомендуется начинать ежегодные обследования простаты в возрасте 40 лет.Другие тесты, такие как ультразвук, также могут дать информацию о предстательной железе.
Когда нужно лечение простаты?
ДГПЖ требует лечения только в том случае, если симптомы достаточно серьезны, чтобы причинять боль пациенту, если функция мочевыводящих путей серьезно нарушена или если есть другие осложнения, такие как кровотечение, инфекции почек или повреждение почек. Увеличенная простата сама по себе не является достаточной причиной для лечения.
Какие методы лечения используются при увеличении простаты?
Существует ряд методов лечения увеличенной простаты, вызывающей проблемы с мочеиспусканием.
- Лекарство: В настоящее время используются два типа лекарств для лечения увеличения простаты. Лекарство, которое обычно используется при высоком кровяном давлении (альфа-блокаторы), помогает расслабить мышечную ткань простаты, частично снимая блокировку. Второй тип применяемых лекарств уменьшает увеличенную простату, блокируя действие на простату мужского гормона тестостерона. Эти лекарства полезны некоторым мужчинам с увеличенной простатой.
- Операция: В настоящее время это наиболее широко распространенный метод лечения увеличенной простаты при тяжелых симптомах.В основном операция удаляет часть увеличенной ткани, чтобы облегчить симптомы. Также выполняются более ограниченные виды хирургических вмешательств, при которых простаты просто разрезаются, а не удаляются ткани.
- Новые методы лечения: Высокий уровень электрического тока может использоваться для разрушения увеличенной ткани простаты. Термическая терапия использует микроволновую или радиочастотную энергию для уменьшения размера железы. Сообщалось, что в некоторых случаях травяные экстракты, такие как пальметто, помогают уменьшить симптомы.Эти новые методы лечения все еще оцениваются врачами, и долгосрочные риски и преимущества еще не известны. Ваш врач посоветует вам, какое лечение лучше всего подходит для вас.


