9. Количественное определение пировиноградной кислоты (пвк) в моче
В норме в плазме крови 90-170 мкмоль/л ПВК, с мочой за сутки её выделяется до 200 мг.
Принцип метода: ПВК с 2,4-динитрофинилгидразином образует окрашенное соединение 2,4-динитрофинилгидразонпируват, которое экстрагируют из реактивной смеси толуолом и в щелочной среде со спиртовым раствором щёлочи регистрируется на ФЭК красно-оранжевое окрашивание — интенсивность которого прямо пропорциональна величинам ПВК.
Увеличение концентрации ПВК в крови (до 570 мкмоль/л) наблюдается при мышечной работе, гиповитаминозе витамина В1, сахарном диабете, заболеваниях печени, токсикозе беременности, болезнях сердца. Все факторы, вызывающие накопление ПВК в тканях (столбняк, гепатит, гипоксия, опухоли), приводят к росту её уровня в крови и, следовательно, в моче.
10. Количественное определение белков в плазме крови
Принцип метода: Их общее количество можно определить с помощью метода, в основе которого лежит биуретовая реакция, т.е. способность пептидов образовывать с сульфатом меди в щелочной среде комплексное соединение красно-фиолетового цвета. Интенсивность окраски прямо пропорциональна концентрации протеинов в растворе и измеряется фотоэлектроколориметром.
Развитие гиперпротеинемии возможно при ревматизме, воспалительно-инфекционных заболеваниях за счёт роста вклада γ-глобулинов. Гипопротеинемия регистрируется при алиментарной дистрофии, нефритах, раковых заболеваниях, болезнях печени.
11. Количественное определение мочевины в крови
В норме 46 – 60% остаточного азота у здоровых людей приходится на долю мочевины, поэтому в настоящее время проводят определение именно этого компонента. В норме содержание мочевины в сыворотке крови составляет 2,5 – 8,3 ммоль/л. Увеличение ее концентрации в крови (гиперкарбамидемия) регистрируется при почечной патологии. При тяжелых заболеваниях печени, острых отравлениях лекарствами концентрация мочевины снижается. Методы определения содержания мочевины подразделяют на две основные группы: ферментативные (уреазные) и неферментативные. Первые являются более точными и специфичными.
Метод основан на способности уреазы гидролизовать мочевину с образованием аммиака, по уровню которого можно судить о концентрации мочевины в крови или других биологических жидкостях.
С О(NН2)2 + Н2О
уреаза NН3 + СО2
О(NН2)2 + Н2О
уреаза NН3 + СО2
мочевина
Для установления содержания аммиака может быть применена реакция взаимодействия его с салицилатом натрия и гипохлоридом натрия в присутствии нитропруссида натрия, в результате которой образуется окрашенный продукт (зеленого цвета), интенсивность окраски которого пропорциональна концентрации мочевины в пробе.
Реактивы:
Реагент 1 – раствор уреазы (40 ед. акт/мл)
Реагент 2 – раствор салицилата натрия (1,4 моль/л) и нитропруссида натрия (0,2 моль/л)
Реагент 3 – растволр гипохлорита натрия (75 ммоль/л) и гидроокиси натрия (0,56 моль/л)
Принцип метода: К 0,5 мл реагента № 1 добавляют 0,01 мл сыворотки крови, выдерживают 5 минут при 37 и приливают по 2 мл реагентов 2 и 3. Через 5 минут измеряют оптическую плотность растворов опытной и калибровочной проб против контроля при 640 нМ. Расчет производят по формуле: Соп=Еоп/Ест*Сст, где – Сст – концентрация стандартного раствора мочевины; Еоп – оптическая плотность опытного раствора; Ест – оптическая плотность стандартного раствора мочевины.
При ряде патологических состояний этот показатель увеличивается (гиперазотемия).
Ретенционная гиперазотемия развивается в результате недостаточного выделения с мочой азотсодержащих продуктов при нормальном поступлении их в кровь (в основном за счёт мочевины при ослаблении экскреторной функции почек или при тяжёлой недостаточности кровообращения, и препятствии оттоку крови). Продукционная гиперазотемия наблюдается при избыточном выходе из тканей в кровь азотсодержащих продуктов (при усиленном распаде тканевых белков, при ранениях, ожогах, кахексии, заболеваниях печени, экссудативном диатезе у детей и т.д.).
Так как мочевина вносит основной вклад в состав небелкового азота, то в клинике часто используют различные способы ее определения в сыворотке крови. В основе одного из них лежит способность этого соединения образовывать с диацетилмонооксимом в кислой среде в присутствии тиосемикарбазида и солей железа окрашенные вещества, интенсивность пигментации которых пропорциональна содержанию карбамида в сыворотке крови (в норме
12. Методы исследования белков (хроматография, электрофорез, гель-фильтрация, рентгеноструктурный анализ и др.)
Работы, которые нужно проделать практически:
— гипераммониемии — Биохимия
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость.
Гипотезы токсичности аммиака
Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Аммиак вызывает защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы.
Наследственные и приобретенные формы гипераммониемий
Приобретенные формы
Приобретенная (вторичная) гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений.
Например, на фоне избыточного содержания белка в пище или при кишечном кровотечении (появление белка в нижних отделах кишечника) микрофлора кишечника активно продуцирует аммиак, который способен переходить в кровь воротной системы. Если у больного имеется сопутствующий цирроз печени (при котором развиваются коллатерали между воротной веной и большим кругом кровообращения), то развивается гипераммониемия.
Вирусные инфекции могут приводить к снижению синтеза ферментов орнитинового цикла и, в результате, к гипераммониемии.
Наследственные формы
Наследственные формы гипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния.
Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание сцеплено с Х-хромосомой, встречается с частотой от 1:14000 до 1:50000 (по разным данным). У матери также может наблюдаться гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения).
Лабораторным критерием гипераммониемий является накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче.
Основа лечения гипераммониемий сводится к ограничению белка в диете, уже это позволяет предотвратить многие нарушения мозговой деятельности.
Также используют глутамат (связывающий аммиак) и фенилацетат, образующий с глутамином водорастворимый комплекс, который выводится с мочой. Учитывая, что часть аммиака способна вступать в синтез глицина, также используют бензойную кислоту, образующую с глицином гиппуровую кислоту, которая также выводится с мочой.
Биохимические признаки сд
Гипергликемия. В норме содержание глюкозы в крови довольно стабильно (натощак в пределах 3,5 — 5,5 ммоль/л). Источником эндогенной глюкозы служат гликогенолиз и глюконеогенез, происходящие в печени, откуда глюкоза, предварительно лишившись с помощью глюкозо-6-фосфатазы кислотного остатка, способна преодолеть мембрану и попасть в общий кровоток. Дефицит инсулина вызывает угнетение активности гексокиназы, ферментов гликолиза, гликогеногенеза, пентозофосфатного пути (ПФП), сопровождается усилением секреции контринсулярных гормонов, стимулирующих глюконеогенез, гликогенолиз — в целом все перечисленное провоцирует гипергликемию (схема 1).
Гиперлактацидемия. В норме величины молочной кислоты в
крови не превышают 2,2 ммоль/л. Она
образуется в клетках только из ПВК,
источниками последней служат гликогенолиз
и последующий гликолиз. Обычно последний
процесс происходит в аэробных условиях
и заканчивается образованием ПВК,
которая или вступает в окислительное
декарбоксилирование, или преобразуется
в оксалоацетат (ОА) (схема 1). Оба продукта
ОА и ацетиКоА, конденсируясь, запускают
цикл трикарбоновых кислот (ЦТК). При СД
фосфорилирование пируваткарбоксилазы,
вызванное избыточной секрецией
контринсулярных гормонов, обусловливает
угнетение использования ПВК в синтезе
ОА. Гликозилированный гемоглобин (Hb)
(см. ниже) — приводит к развитию гипоксии,
что провоцирует подавление аэробных
процессов (ЦТК, окислительного
декарбоксилирования ПВК). Указанные
моменты сопровождаются накоплением
восстановленного НАД
Гликозилирование биополимеров (полисахаридов, полипептидов). При хронической гипергликемии изменяется соотношение глюкозы клетки и глюкозы крови в пользу последней, поэтому данный моносахарид преодолевает мембрану клетки-мишени путем облегченной диффузии. Но для того, чтобы он мог быть использован для нужд клетки, его необходимо фосфорилировать. Активность мембранной гексокиназы из-за недостаточности инсулина угнетена, а активность цитоплазматического варианта этого фермента невелика, что не позволяет всей глюкозе использоваться обычным путем. Она начинает преобразовываться инсулин-независимыми способами. Часть ее в начале восстанавливается в сорбит, который потом может окислиться во фруктозу. Появление и накопление этих веществ (глюкозы, сорбита, фруктозы) в необычных количествах грозит патологическим ростом осмотического давления. Но главная опасность в способности глюкозы реагировать с ОН-, NH2-группами белков, полисахаридов даже в отсутствии ферментов (реакция называется гликозилированием), что приводит к нарушению конфигурации их молекул, к изменению свойств.
В эритроцитах здорового человека может находиться до 6% гликозилированного Hb (HbAic), у больных СД его количество увеличено. Он обладает повышенным сродством к кислороду и обусловливает развитие гипоксии в различных тканях.
Гликозилирование альбуминов и глобулинов характеризуется повреждением их транспортной функции (перенос Fe, Cu, билирубина). Подобная модификация коллагена нарушает функции всех видов соединительных тканей (мелких и крупных сосудов — ангиопатии, сосудистых клубочков почек — нефропатии, хрящевой ткани — парадонтоз, артриты и артрозы). Гликозилирование ЛПНП снижает их сродство к рецепторам фибробластов, отвечающих за их катаболизм. Накопление ЛПНП грозит не только развитием атеросклероза. Их мицеллы, агрегируя на эритроциты, увеличивают толщину их плазмолемм, уменьшают тем самым скорость диффузии кислорода, способствуют гипоксии. Гликозилирование кристаллина и глюкозаминогликанов хрусталика повреждает его прозрачность (провоцирование катаракты). Подобная реакция с белками миелиновой оболочки нарушает функционирование нервных волокон (нейропатии). При взаимодействии фибрина с глюкозой замедляется скорость его деградации. Даже сам инсулин тоже гликозилируется, естественно, также меняются его свойства.
Увеличение уровня высших жирных кислот (ВЖК) в крови. Этот симптом обусловлен дефицитом инсулина, поэтому нарушается транспорт ВЖК в клетки-мишени. Мало того, параллельная гиперсекреция контринсулярных гормонов, обладающих липолитическим действием (адреналин, тироидные гормоны, СТГ) (схема 2) — увеличивает в крови концентрацию свободных жирных кислот.
Изменение массы тела. Если дефицит инсулина носит первичный характер, следовательно заторможен синтез липидов, угнетена диффузия ВЖК в липоциты, угнетенно окислительное декарбоксилирование ПВК и ПФП (поставщики ацетил-КоА и восстановленного НАДФ+ соответственно) — основные участники биосинтеза ВЖК. Если при этом регистрируется гиперсекреция контринсулярных гормонов, то еще усиливается и липолиз. Такой вариант диабета встречается чаще у детей и юношества (диабет худых). ИНСД развивается обычно в зрелом возрасте, его провоцирует переедание, панкреатит, усиленная выработка контринсулярных гормонов, стрессы — результатом чего служит гипергликемия, индуцирующая повышенную секрецию инсулина, который обеспечивает преобразование избыточной глюкозы в нейтральный жир (ожирение). Однако такая работа поджелудочной железы в форсированном режиме быстро истощает ее, что и заканчивается развитием СД, но на фоне ожирения.
Гиперкетонемия. В крови здорового человека регистрируется ацетоуксусная и β-оксимасляная кислоты — продукты альдольной конденсации ацетил-КоА. При СД скорость этой реакции возрастает, т.к. нарушено взаимодействие ацетил-КоА с ОА для своевременного запуска ЦТК. Это обусловлено нарушением стехиометрии ацетил-КоА и ОА, т.к. угнетено преобразование ПВК в ОА (схема 1) из-за подавления активности пируваткарбоксилазы (см. выше — гиперсекрецию контринсулярных гормонов). Мало того, в развитии гиперкетонемии свой вклад вносит усиление использования с энергетической целью аминокислот (т.к. снижена скорость гликолиза и сопряженных с ним аэробных процессов катаболизма), а метаболитами распада кетогенных аминокислот (валина, лейцина, изолейцина, фенилаланина, тирозина) являются кетоновые тела. Чтобы предотвратить высокую гиперкетонемию, организм используя особенности строения и свойств ацетоацетата, декарбоксилирует последний. Образовавшиеся при этом СО2 и ацетон легко выделяются через легкие.
Гиперхолестеринемия. Обычно у больных СД уровень холестерина в крови превышает 6 ммоль/л. Это объясняется тем, что образовавшийся в печени цитрат из ацетил-КоА и ОА по большей своей части не способен распадаться в ЦТК из-за гипоксии. Поэтому, выходя из митохондрий, он в цитоплазме расщепляется на свои исходные соединения. Цитоплазматический ацетил-КоА (схема 1) может служить субстратом в синтезе или ВЖК, или холестерина. Но, чтобы индуцировать образование ВЖК, требуется получить малонил-КоА путем карбоксилирования ацетил-КоА. Как отмечено выше, фермент этой реакции угнетается контринсулярными гормонами, и весь вышедший из митохондрий ацетил-КоА направляется на синтез холестерина.
Гипертриацилглицеролемия. Наблюдающаяся у больных СД повышенная концентрация ВЖК в крови (см. выше) способствует их проникновению в цитоплазму гепатоцитов. Но использования ВЖК с энергетической целью не растет, т.к. они не могут преодолеть мембрану митохондрий (из-за дефицита инсулина нарушена работа переносчика — карнитиновой системы). И накапливаясь в цитоплазме клеток, жирные кислоты используются в липогенезе (жировое перерождение печени), включаются в ЛПОНП и выделяются в кровь.
Дислипопротеидемия. Все выше перечисленные сдвиги в липидном метаболизме (усиленный синтез холестерина, гликозилирование ЛП) способствуют накоплению ЛПОН, ЛПНП с одновременным снижением значений ЛПВП.
Нарушение перекисного гомеостаза. Как известно, гипоксия, характерная для СД, служит одним из индукторов ПОЛ. Мало того из-за угнетения ПФП снижается восстановление НАДФ+, так необходимого в качестве компонента антирадикальной защиты.
Гиперазотемия. Традиционно этим термином обозначают сумму величин низкомолекулярных азотсодержащих соединений (мочевину, аминокислоты, мочевую кислоту, креатин, креатинин и др.). Гипераминоацидемия при СД обусловлена: 1) нарушением проницаемости мембран для аминокислот; 2) замедлением использования аминокислот в биосинтезе белков, т.к. снижена скорость ПФП — источника рибозо-5-фосфата — облигатного компонента мононуклеотидов — участников синтеза РНК — матрицы в синтезе протеинов (схема 1). Оба (1,2) повреждения обусловлены дефицитом инсулина. А многие контринсулярные гормоны в избытке обладают катаболическим эффектом (табл. 2), т.е. активируют протеолиз, что также обеспечивает гипераминоацидемию.
Кроме того, нарушение использования глюкозы с энергетической целью при СД за счет действия тех же контринсулярных гормонов вызывает усиление глюконеогенеза (схема 2), в первую очередь, из аминокислот и ускорение распада кетогенных аминокислот с образованием кетоновых тел — неплохих источников энергии. Одним из конечных продуктов обоих преобразований будет аммиак, обезвреживаемый путем синтеза мочевины. Следовательно, при СД в крови регистрируется повышенный уровень этого вещества (гиперкарбамидемия).
Снижение защитных сил. Вследствие дефицита инсулина замедлена скорость синтеза белков (см. выше), в том числе иммуноглобулинов. Мало того часть, из них после гликозилирования (см. выше) теряет свои свойства, отсюда объяснимо развитие у больных гнойничковых заболеваний, фурункулеза и т.д.
Повышение осмотического давления крови из-за накопления различных низкомолекулярных соединений (глюкозы, амино-, кетокислот, лактата, ПВК и т.д.).
Дегидротация (обезвоживание) тканей, вследствие повышения осмотического давления крови.
Ацидоз, из-за накопления кислых продуктов (ацетоацетата, β-оксибутирата, лактата, пирувата и т.д.).
Различные — урии. Глюкозурия, кетонурия, аминоацидурия, лактатацидурия и т.д. — из-за превышения их величинами почечного порога.
Повышение удельной плотности мочи, из-за развития различных — урий.
Полиурия. а) Для выведения различных веществ требуется дополнительное количество воды;
б) из-за полидипсии.
Полидипсия. Повышена жажда из-за увеличения осмотического давления в плазме крови и из-за повышенных потерь воды с мочой.
Полифагия. Один из первых и главных симптомов СД. Из-за дефицита инсулина повреждена проницаемость мембран для глюкозы, аминокислот, ВЖК, т.е. кровь «сытая», а клетки «голодные».
Подобные сдвиги в метаболизме грозят развитием самых различных осложнений (острых и хронических).
Наиболее серьезные острые осложнения:
Диабетический кетоацидоз
Диабетический лактацидоз
Гиперосмолярная бескетонная кома
Гипогликемическая кома.
Главными звеньями диабетического кетоацидоза являются гипергликемия (больше 10 ммоль/л), отсюда глюкозурия, гиперосмолярность плазмы, гиперкетонемия, последний симптом обусловливает метаболический ацидоз (снижение содержания бикарбонатов плазмы крови). Поэтому в почках — задержка Н+, что усугубляет ацидоз, возбуждает дыхательный центр, углубляется и урежается дыхание — дыхание Куссмауля, выводится СО2, что уменьшает выраженность ацидоза, но при этом усиливается дефицит бикарбонатов. Классический признак при этом — запах ацетона изо рта. Кетоацидоз провоцируется пищей, богатой жирами, и тормозится в присутствии углеводов.
В основе диабетического лактацидоза лежит развитие высокой гиперлактацидемии (см. выше), чему способствуют тканевая гипоксия и нарушение кислотно-щелочного состояния.
Гиперосмолярная безкетонная кома чаще встречается у больных среднего и пожилого возраста. Для нее характерна высокая гипергликемия (более 55 ммоль/л), естественно, отсюда резкий подъем осмолярности плазмы крови, появление глюкозы в моче, что обусловливает осмотический диурез (потерю воды и электролитов). В отличие от первого осложнения у подобных больных не регистрируются гиперкетонемия и кетонурия.
Гипогликемическая кома развивается при хронической передозировки инсулина, пропуске или задержке приема пищи, при длительной физической нагрузке в сочетании с беременностью.
Среди хронических осложнений выделяют, в первую очередь, сосудистые (микро- и макроангиопатии). Чаще поражаются сосудистая оболочка глаз, клубочки в нефроне, сосуды головного мозга, миокарда, периферических нервов, нижних конечностей (механизм см. выше). Свой вклад в развитие макроангиопатий вносит прогрессирование при СД атеросклеротического процесса (см. выше).
Гиперлипидемия — Википедия
Материал из Википедии — свободной энциклопедии
Гиперлипидемия (гиперлипопротеинемия, дислипидемия) — аномально повышенный уровень липидов и/или липопротеинов в крови человека. Нарушение обмена липидов и липопротеинов встречается довольно часто в общей популяции. Гиперлипидемия является важным фактором риска развития сердечно-сосудистых заболеваний в основном в связи со значительным влиянием холестерина на развитие атеросклероза. Кроме этого, некоторые гиперлипидемии влияют на развитие острого панкреатита.
Классификация липидных нарушений, основанная на изменении профиля липопротеинов плазмы при их электрофоретическом разделении или ультрацентрифугировании, была разработана Дональдом Фредриксоном в 1965[2]. Классификация Фредриксона принята Всемирной организацией здравоохранения в качестве международной стандартной номенклатуры гиперлипидемий. Однако, она не учитывает уровень ЛПВП, который является важным фактором, снижающим риск атеросклероза, а также роль генов, вызывающих липидные нарушения. Данная система остаётся самой распространённой классификацией.
Гиперлипопротеинемия I типа[править | править код]
Редкий тип гиперлипидемии, который развивается при недостаточности ЛПЛ или дефекте в белке-активаторе ЛПЛ — апоС2. Проявляется в повышенном уровне хиломикрон, классе липопротеинов, переносящих липиды от кишечника в печень. Частота встречаемости в общей популяции — 0,1 %.
Гиперлипопротеинемия II типа[править | править код]
Наиболее частая гиперлипидемия. Характеризуется повышением холестерина ЛПНП. Подразделяется на типы IIa и IIb в зависимости от отсутствия или наличия высоких триглицеридов.
Тип IIa[править | править код]
Эта гиперлипидемия может быть спорадической (в результате неправильного питания), полигенной или наследственной. Наследственная гиперлипопротеинемия IIа типа развивается в результате мутации гена ЛПНП-рецептора (0.2 % популяции) или гена апоВ (0.2 % популяции). Семейная или наследственная форма проявляется ксантомами и ранним развитием сердечно-сосудистых заболеваний.
Тип IIb[править | править код]
Этот подтип гиперлипидемии сопровождается повышенной концентрацией триглицеридов в крови в составе ЛПОНП. Высокий уровень ЛПОНП возникает из-за усиленного образования главного компонента ЛПОНП — триглицеридов, а также ацетил-кофермента А и апоВ-100. Более редкой причиной этого нарушения может быть замедленный клиренс (удаление) ЛПНП. Частота встречаемости этого типа в популяции — 10 %. К этому подтипу относятся также наследственная комбинированная гиперлипопротеинемия и вторичная комбинированная гиперлипопротеинемия (как правило при метаболическом синдроме).
Лечение этой гиперлипидемии включает изменение питания как основной компонент терапии. Многим больным требуется назначение статинов для снижения риска сердечно-сосудистых заболеваний. В случае сильного подъёма триглицеридов часто назначаются фибраты. Комбинированное назначение статинов и фибратов высокоэффективно, но имеет побочные эффекты, такие как риск миопатии, и должно быть под постоянным контролем врача. Используются также другие лекарственные препараты (никотиновая кислота и др.) и растительные жиры (ω3-жирные кислоты).[3]
Гиперлипопротеинемия III типа[править | править код]
Эта форма гиперлипидемии проявляется увеличением хиломикрон и ЛППП, поэтому называется ещё дис-бета-липопротеинения. Наиболее частая причина — гомозиготность по одной из изоформ апоЕ — E2/E2, которая характеризуется нарушением связывания с ЛПНП-рецептором. Встречаемость в общей популяции — 0,02 %.
Гиперлипопротеинемия IV типа[править | править код]
Этот подтип гиперлипидемии характерен повышенной концентрацией триглицеридов, поэтому также называется гипертриглицеридемией. Частота встречаемости в общей популяции — 1 %.
Гиперлипопротеинемия V типа[править | править код]
Этот тип гиперлипидемии во многом похож на I тип, но проявляется не только высокими хиломикронами, но и ЛПОНП.
Другие редкие формы дислипидемий, не входящие в принятую классификацию:
- Гипо-альфа-липопротеинемия
- Гипо-бета-липопротеинемия (0.01-0.1 %)
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Frederickson DS, Lee RS. A system for phenotyping hyperlipidemia. Circulation 1965;31:321-7. PMID 14262568.
- ↑ Thompson GR. Management of dyslipidaemia. Heart 2004;90:949-55. PMID 15253984.
что это такое, как лечить, классификация и симптомы
Гиперлипидемия — это обобщенное наименование группы заболеваний, суть у которых примерно одна: рост концентрации определенных жиров (не только холестерина, это следствие, а не причина, частный случай) в кровеносном русле.
Насчитывается несколько типов расстройства, каждое провоцируется отдельной группой липидов, определяет формирование того или иного осложнения.
В любом случае, требуется лечение. Чем быстрее, тем лучше. Потому как без коррекции под контролем эндокринолога не миновать атеросклероза, нарушений работы печени, поджелудочной железы, вероятны критические дисфункции сердца.
Проблема состоит в том, что на ранних стадиях расстройство можно обнаружить исключительно лабораторными методами и то не всегда. Стандартное исследование предполагает оценку только холестерина, этого недостаточно.
Все становится понятно к тому моменту, когда расстройство в самом разгаре. Начинаются структурные изменения. От времени начала терапии зависит прогноз.
Механизм развития
Основу патологического процесса составляет нарушение обмена веществ. Если не вдаваться в подробности, отклонение прогрессирует постепенно и заключается в невозможности нормального депонирования жиров.
Они запасаются в неестественно больших количествах, проникают в кровеносное русло, зацепляются за артерии, закупоривают их, формируют атеросклеротические бляшки.
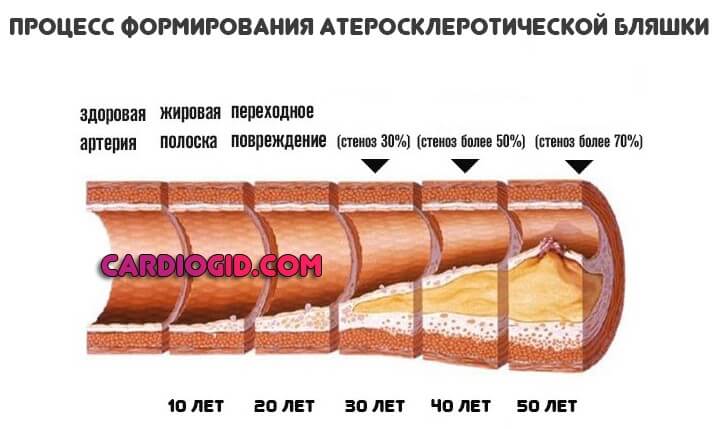
Для переработки такого количества липидов особенно напряженно функционируют печень, поджелудочная железа, что приводит к быстрому развитию воспалительных, дегенеративных процессов в этих органах.
Гиперлипидемия начинается спонтанно, часто расстройство манифестирует в пубертатный период, когда как раз стартуют изменения гормонального фона.
Момент особенно неблагоприятен, в течение всего созревания нужно регулярно проходить профилактические осмотры под контролем эндокринолога как минимум.
Мужчины в период пубертата подвержены развитию обменного нарушения реже, чем женщины. При приближении к возрастной группе 30+ ситуация диаметрально противоположная, сглаживается она по пришествии климакса.
Огромная роль в развитии гиперлипидемии отведена наследственному фактору. Согласно профильным исследованиям, пациенты, у которых хотя бы один родитель имеет проблемы обменного характера, вероятность формирования гиперлипидемии составляет порядка 30%. Два — более 60%.
При этом в расчет нужно брать также предков по восходящей линии живших еще ранее: дедушек, бабушек. Но столь глубокая оценка возможна не всегда.
Отклонения существуют годами незамеченными, не во всех случаях прогрессируют в принципе.
Но если имеет место движение, динамика, она не остановится, пока существует провоцирующий фактор. Когда таковыми выступают наследственность, генетика, рассчитывать на спонтанное восстановление и тем более регресс отклонения не приходится. Необходима диагностика и лечение.
Внимание:Единственный способ обнаружить нарушение своевременно — регулярно проводить лабораторные тесты с расширенной картиной по липидным соединениям.
Классификация
Подразделение патологического процесса проводится по ключевому основанию — тип липида, провоцирующего нарушение (классификация гиперлипидемии по Фредриксону).
Также косвенно учитывается осложнение, которое развивается по мере движения болезни вперед.
Тип 1
Встречается крайне редко. Среди всех прочих разновидностей обнаружить его вероятность ниже всего.
Сопровождается ростом концентрации особых транспортных веществ, переносящих жиры (хиломикронов). Есть четкая связь между определенными биохимическими процессами и развитием подобного явления.
Основное осложнение, с которым встречаются пациенты с гиперлипидемией 1 типа — панкреатит. Воспалительное поражение поджелудочной железы.
Есть и абсолютно обусловленные генетикой разновидности патологического процесса. Она складываются в результате мутаций.
При этом не долю наследственных форм приходится менее процента от общего числа случаев. Примерно 0.5%. Это так называемый тип гиперлипидемии IIa. Сопровождается ростом концентрации ЛПНП (липопротеинов низкой плотности).
Другое название вещества — плохой холестерин, согласно устоявшемуся мнению, он считается наиболее атерогенным. Вызывает отложение на стенках сосудов и развитие бляшек, недостаточного кровообращения.
Подавляющее большинство ситуаций сопряжено с алиментарным фактором — неправильным питанием.
Преимущественно обуславливает развитие атеросклероза по всему организму, поражаются крупные сосуды: нижние конечности, сердце (аорту), головной мозг

Тип IIb
Обнаруживается чуть реже. Если в первом случае наблюдается отклонение в выработке одного фактора, регулирующего концентрацию жирных веществ (апо B или кофермента А), в данном случае изменена выработка сразу двух соединений плюс ко всему растет количество триглицеридов.
В системе они могут быть классифицированы как ЛПОНП. Липопротеины очень низкой плотности. Гиперлипидемия 2 а типа встречается у 7% населения, что довольно много и обуславливает в основном коронарную недостаточность, повышает риски инфаркта.
Признаки предынфарктного состояния описаны здесь.
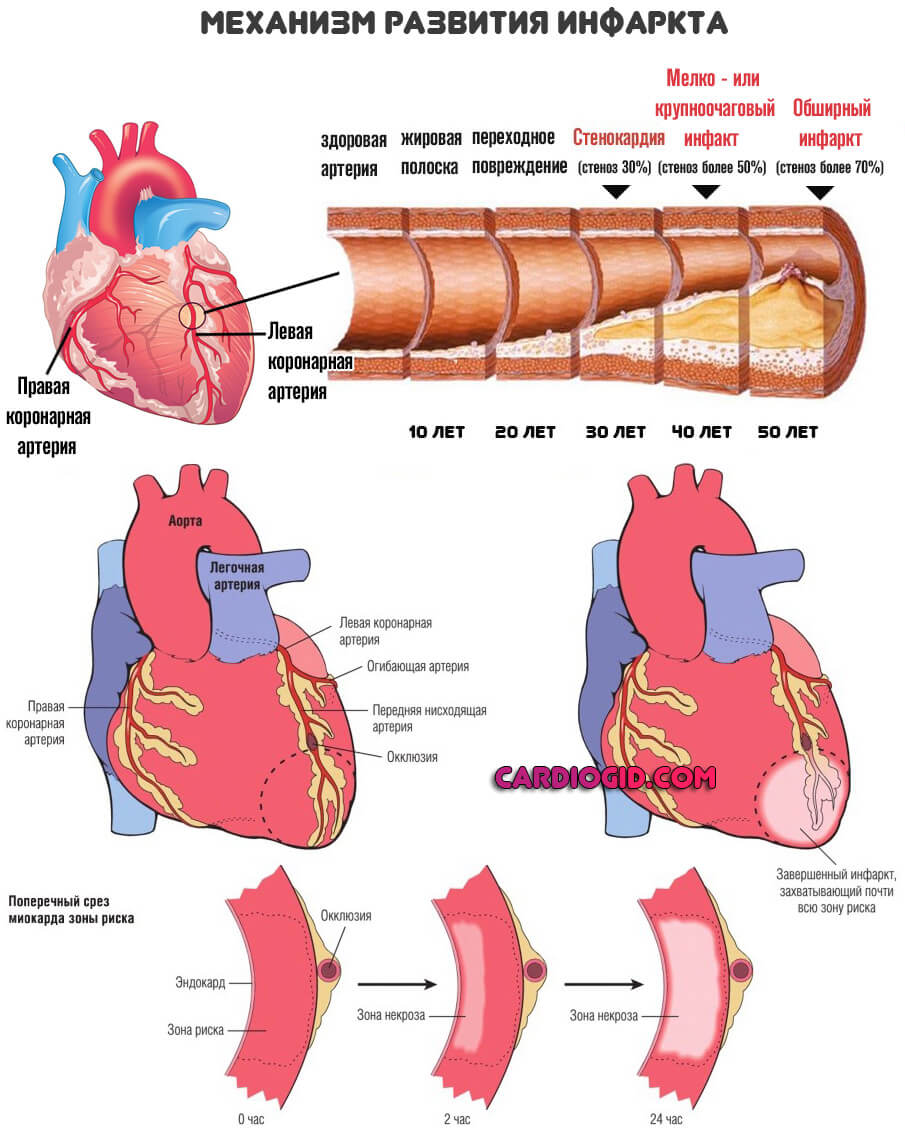
Однако возможны и прочие нарушения, вроде ИБС, проблем с питанием головного мозга (ишемией), что приводит к инсульту.

Тип III
Встречается исключительно редко, намного меньше десятой доли процента. В пересчете на население планеты выходит порядка полутора миллионов человек.
Патология имеет чисто наследственное происхождение, обуславливается нарушением синтеза особого вещества, которое называется апо Е.
Этот белок играет одну из ключевых ролей в обменных процессах с участием холестерина, потому расстройства всегда тяжелые. Вроде атеросклероза сосудов нижних конечностей, стенокардии, ишемической болезни сердца.

Для этой формы типично спонтанное длительное развитие и сравнительно ранняя манифестация спустя несколько лет от начала заболевания.
Триггером, тем фактором, который станет виновником расстройства и запустит изменения, может оказаться гормональный сбой, ожирение, пубертат, беременность. И еще множество моментов.
Оценка таковых — задача эпидемиологии как науки, зная особенности и механизмы можно разработать пути профилактики. Пока однозначного ответа, как предотвратить болезнь, нет.
IV тип
Встречается в 1% случаев. Сопровождается усилением выработки триглицеридов, липопротеинов очень низкой плотности.
Для гипертриглицеридемии типично незначительное повышение уровня холестерина, но не всегда. Стремительный рост концентрации жирных веществ обнаруживается позднее, по мере прогрессирования отклонения.
Подобная патология повышает риск сахарного диабета, гипертонической болезни, вызывает дальнейшее увеличение массы тела.
V тип
Еще одна наследственная форма расстройства. Напоминает самый первый названный вид, с той разницей, что растет концентрация не только хиломикронов, но и липопротеинов очень низкой плотности.
Чаще всего нарушение провоцирует тяжелые формы воспаления поджелудочной железы — панкреатита.
Точный механизм манифестации расстройства не ясен. Предполагается, что толчком к развитию становится несбалансированное питание.
Внимание:При всех этих заболеваниях сам холестерин может быть в норме или совсем незначительно повышен.
Хотя он и является одним из ключевых веществ в деле развития негативных последствий гиперлипидемии, основу, фундаментальный механизм болезни составляют специальные белки и вещества, названные выше, которые участвуют в транспортировке холестерина.
Есть и другой способ классифицировать гиперлипидемию. Исходя из ее происхождения, называют две крупных группы нарушений:
- Заболевание уточненного генеза. Причина очевидна или хотя бы есть возможность оценить природу отклонения, выставить точный диагноз в результате диагностики. Большая часть проблем относится именно к этому виду. Хотя для полного обследования может потребоваться не один месяц динамического лабораторного наблюдения.
- Гиперлипидемия неуточненная. Выявить точный фактор развития патологического процесса невозможно. Однако с этого зачастую начинается диагностика. До момента выставления диагноза может пройти довольно много времени. Не всегда получается определиться с происхождением обменного нарушения.
Обе классификации активно используются врачами. Первая играет ключевую роль в назначении специального терапевтического курса.
Симптомы
Клиники как таковой повышение концентрации жиров в крови не имеет ровно до того момента, как начинается спровоцированное нарушением заболевание.
Вариантов тут может быть множество: от стенокардии или аритмии, до сахарного диабета, панкреатита и, наиболее часто, атеросклероза сосудов нижних конечностей, головного мозга, кардиальных структур (коронарных артерий).
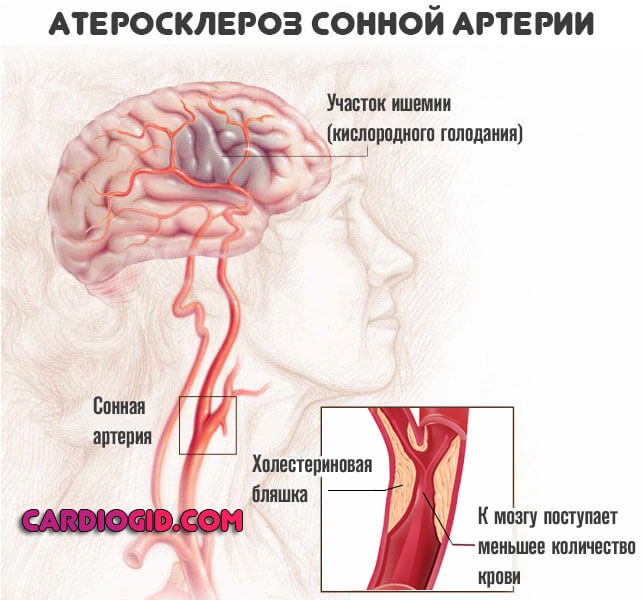
Выделить единый комплекс признаков невозможно, потому как форм и последствий течения обменного отклонения слишком много. Говоря строго, это не симптомы гиперлипидемии, речь о клинике тех осложнений, которые она спровоцировала.
На развитие патологического процесса порой уходит не год и даже не один их десяток. Зависит от запаса прочности организма, сопротивляемости и способности к саморегуляции.
Мужчины подвержены заболеванию больше женщин, потому как у последних роль расщепителя жиров и регулятора обменных процессов играет эстроген, который в организме представителя сильного пола имеет ничтожную концентрацию.
Причины
Перечень таковых огромен. Стоит назвать лишь некоторые:
- Сахарный диабет.
- Гипертоническая болезнь или симптоматический рост уровня давления до стабильно высоких отметок.
- Ожирение. Изменение массы тела, нескорректированное.
Парадоксально, но триада этих отклонений может быть причиной гиперлипидемии и следствием ее течения, в качестве осложнения. Связи нужно «распутывать» вместе с врачом.
- Патологии почек. Недостаточность в любой фазе. Особенно в декомпенсации.
- Наследственный фактор. Определенную роль играет во всех пяти формах заболевания. Ключевым фундаментальным виновником вступает в двух случаях. В рамках диагностики обязательно проводится оценка семейного анамнеза.
- Патологии печени, поджелудочной железы. Воспалительного, дегенеративного характера.
- Беременность, особенно тяжелая, поздняя, многоплодовая.
- Пубертатный период с нестабильностью гормонального фона.
- Гипотиреоз. Снижение концентрации специфических веществ щитовидной железы: Т3, Т4, ТТГ (формально он относится к соединениям, синтезируемым гипофизом).
- Бесконтрольный прием оральных контрацептивов. Убивают нормальный фон специфических веществ женской репродуктивной системы. Не рекомендуются к применению даже по совету врача и с его согласия, последствия непредсказуемы. Это не только проблемы с уровнем липидов, но и бесплодие, падение полового влечения. Расстройства со стороны почек, печени, сердечнососудистой системы.
- Курение, потребление спиртного. Тем более наркотических веществ. Это крайне опасно. Вредные привычки тормозят обменные процессы. Даже после отказа организму потребуется время, чтобы перестроиться на адекватный, физиологичный лад.
- Расстройства со стороны гипофиза.
Огромную роль играет неправильное питание с избытков фаст-фуда, соли, жирного, жареного.
Диагностика
Обследование проводится под контролем как минимум эндокринолога. При необходимости привлекаются и прочие специалисты.
Мероприятия по выявлению примерно одинаковы всегда:
- Устный опрос больного. Есть ли жалобы, если да — когда они возникли и так по цепи. Чтобы составить полную клиническую картину. Но, как было сказано, в начальной стадии и даже при длительном течении в большинстве случаев, проявлений нет никаких.
- Сбор анамнеза. Привычки, характер питания, профессиональная активность, семейная история болезней.
- Исследование крови на вещества липидного профиля. Направлено на подробное описание концентрации различных структур: липопротеинов низкой, высокой плотности, холестерина, определяется атерогенный индекс. Рекомендуется проводить это исследование регулярно, пациентам с текущий гиперлипидемией — раз в полгода. В рамках профилактического скрининга — в 12 месяцев или чуть реже.
- Это основные методы диагностики собственно нарушения. Что касается выявления осложнений этой проблемы:
- УЗДГ сосудов нижних конечностей, шеи, оценка коронарных артерий, в том числе методом ЭХО.
- Ангиография при необходимости.
- МРТ или КТ по потребности.
Вероятно назначение прочих исследований.
Лечение
Терапия зависит от формы патологического процесса. Исходя из вида гиперлипидемии, назначается определенная схема.
Тип 1
Требует диеты, это основной метод восстановления. Строгих правил нет. Достаточно разнообразить рацион, включить в него больше свежих и термически обработанных овощей, фруктов, доля растительных компонентов в меню — не менее 50%. Лучше довести ее до 60%.
Обязателен белок, вегетарианский рацион возможен, но при желании. В качестве мяса нужно потреблять куриную грудку, индейку. В разумных количествах возможно использование в готовке телятины без жира.
Исключаются жареные, копченые блюда, соленья и маринады с большой осторожностью. Сладостей меньше, разве что варенье собственного приготовления без сахара.
Соль ограничивается. Не более 5-7 граммов в день, потому ни о каких консервах, полуфабрикатах речь также не идет.
Продолжительность такой диеты — от 3 до 12 месяцев. Возможно, к ней нужно будет возвращаться регулярно или же перейти на новый рацион.
Тип 2а
Лечится с применением статинов. Они выводят избыток липидов из организма. В качестве вариантов — Аторвастатин, Аторис и аналогичные. Также назначают средства на основе никотиновой кислоты.

Тип 2b
Предполагает применение тех же препаратов плюс подключение еще одной группы — фибратов. Устраняющих избыточный синтез условно вредных веществ. В качестве основного наименования назначается Гемфиброзил.

Тип 3
Использование статинов и никотиновой кислоты возможно, но клиническая практика говорит о минимальной эффективности в таком случае.
Показано использование фибратов. Уже названного препарата. Длительность лечения значительная, порядка нескольких месяцев до достижения стойкого результата.
Тип 4
Необходимо использовать никотиновую кислоту.
При последней, 5 форме патологического процесса помимо нее применяется еще и Гемфиброзил. Или его аналоги из группы фибратов.
Внимание:Все названные схемы лечения очень примерные. Есть огромное количество препаратов, торговых наименований. Эффективное сочетание назначает только специалист.
В оперативном лечении гиперлипидемии смысла нет. Речь о фундаментальном расстройстве.
Клиники предлагают инновационные, не апробированные до конца методики, вроде гравитационной очистки крови, но эффективность такого пути туманна. Пока больше вопросов, чем ответов.
Хирургическое вмешательство требуется при развитии осложнений. Вроде критического сужения сосудов нижних конечностей, закупорки артерий сердца, кальцификации бляшки, когда образование из холестерина становится жестким, как камень.


Лечить гиперлипидемию нужно под контролем эндокринолога. Имеет смысл и при прочих формах процесса кроме первой придерживаться диеты, отказаться от курения, спиртного, тем более наркотических веществ.
Если нарушение стало вторичным, то есть обусловлено прочими диагнозами, нужно устранить первопричину и только потом бороться с последствиями.
Прогноз
При раннем обнаружении благоприятный. Заболевание годами протекает без выраженной клиники, пока не провоцирует критические нарушения. Даже в этом случае шансы на восстановление хорошие.
Главное не медлить с терапией и придерживаться всех рекомендаций лечащего специалиста.
Возможные последствия
Таковых несколько:
- Коронарная недостаточность. Скудное питание сердца по одноименным артериям. Часто заканчивается инфарктом, со всеми вытекающими последствиями.
- Инсульт. Острое нарушение трофики тканей головного мозга.
- Атеросклероз сосудов мозга и ног.
- Сосудистая деменция.
- Острый панкреатит, воспаление поджелудочной железы с отмиранием ее клеток.
- Проблемы с печенью, почками.
Гиперлипидемия — сложный системный процесс. Обращаться нужно к врачу-эндокринологу. Без лечения почти всегда нарушение движется вперед, с разной скоростью.
Чем это закончится — представить нетрудно, список чуть выше красноречиво говорит о возможных последствиях. При ответственном же подходе есть все шансы на восстановление.
Список литературы использованной при подготовке статьи:
- Рекомендации Европейского общества кардиологов (ЕОК) и Европейского общества атеросклероза (ЕОА) по лечению дислипидемий.
РОССИЙСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ СЕМЕЙНОЙ ГИПЕРХОЛЕСТЕРИНЕМИИ. Ежов М.В., Сергиенко И.В., Рожкова Т.А., Кухарчук В.В., Коновалов Г.А., Мешков А.Н., Ершова А.И., Гуревич В.С., Константинов В.О., Соколов А.А., Щербакова М.Ю., Леонтьева И.В., Бажан С.С., Воевода М.И., Шапошник И.И.
Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. V пересмотр. В.В. Кухарчук, Г.А.Коновалов, А.В. Сусеков, И.В. Сергиенко, А.Е. Семенова, Н.Б.
Горнякова, Е.Ю. Соловьева, М.Ю. Зубарева- Институт клинической кардиологии им. А.Л. Мясникова РКНПК МЗ РФ. Гиперлипидемия — современное состояние проблемы и методы ее медикаментозной коррекции. Автор: Сусеков А.В.
2.2.1.4. Судьба продуктов распада аминокислот
В отличие от углеводов и нейтральных жиров, при катаболизме которых образуются лишь СО2 и Н2О, при распаде аминокислот конечным продуктом, кроме вышеназванных веществ, является аммиак. Учитывая его вероятные токсические эффекты, следует остановиться на способах обезвреживания.
Пути обезвреживания NН3
Свободный аммиак токсичен. Во-первых, он обладает хорошей растворимостью в воде, что сопровождается следующей реакцией:

Ее продукт — сильная щелочь, что грозит развитием алкалоза. Во-вторых, нарушается ЦТК, так как его метаболит – α-кетоглутарат – используется клеткой для нейтрализации гидроксида аммония. Образующаяся и накапливающаяся при этом глутаминовая кислота повреждает баланс аминокислот, в ЦНС ее гиперпродукция провоцирует декарбоксилирование, т.е. генез ГАМК, отсюда изменяется равновесие среди тормозных и возбуждающих медиаторов.
Клинически накопление аммония (гипераммониемия) проявляется рвотой, судорогами, спутанностью и помутнением сознания, вплоть до комы. Поэтому в клетках существуют следующие механизмы, предотвращающие развитие этого явления:
1) Восстановительное аминирование:






2) Во многих тканях (головном мозгу, печени, почках, мышцах) обезвреживание осуществляется путем синтеза глутамина (реже аспарагина) — нейтрального нетоксического вещества, способного диффундировать через мембраны (одна из форм транспорта NН3).

Амидная группа глутамина часто используется в реакциях аминирования (в получении глюкозамина, галактозамина, заменимых аминокислот и т.д.)
3) Работа внутри- и внеклеточных буферных систем; с помощью которых нейтрализуется NН4ОН до солей аммония.
Продукты обезвреживания аммиака (глн, асн, соли аммония) кровотоком доставляются в гепатоциты, где и происходит окончательная инактивация данного соединения:
4) Синтез мочевины.
Мочевина – полный амид угольной кислоты, значит субстратами в ее образовании служат различные формы углекислоты (НСО3– или карбоксибиотин) и аммиака (амидная группа глутамина или соль аммония): Первая реакция:

протекает в митохондриях, здесь карбамоилфосфат взаимодействует с орнитином, служащим своеобразным катализатором, вследствие чего данный процесс известен как орнитиновый цикл синтеза мочевины:

образовавшийся при этом цитруллин, выходя из митохондрий изомеризуется в енольную форму:

С
аргининосукцинат

 помощью специфической лигазы —
аргининосукцинатсинтазы взаимодействует
с аспарагиновой кислотой:
помощью специфической лигазы —
аргининосукцинатсинтазы взаимодействует
с аспарагиновой кислотой: 

Аргининосукцинат из-за наличия сильно поляризованных связей довольно легко разрушается с помощью аргининосукцинатлиазы:

П родукт
данной реакции фумарат обычно отправляется
в митохондрии, где включается в ЦТК, а
аргинин гидролизуется до мочевины и
орнитина.
родукт
данной реакции фумарат обычно отправляется
в митохондрии, где включается в ЦТК, а
аргинин гидролизуется до мочевины и
орнитина.

Последний вновь связывается с молекулой карбамоилфосфата, начиная новый цикл.
Суммарно:

Подводя итог, следует заметить, что в целом мочевина собирает все атомы азота аминокислот: ее одна аминогруппа взята из аспартата, который может получиться путем переаминирования оксалоацетата с любой аминокислотой, другая же аминогруппа является производной аммиака, высвободившегося с помощью дезаминирования.
Двухколесный велосипед Кребса – так называют исследователи два цикла, описанные Г. Кребсом из–за их тесной связи между собой (Схема 2.2.1.4.1).
Цикл трикарбоновых кислот, тесно сопряженный с биологическим окислением и окислительным фосфорилированием, не только является поставщиком ОА для переаминирования в аспартат, но и дает СО2, НОН, АТФ для запуска и течения орнитинового цикла, одним из продуктов которого и является фумарат, служащий метаболитом ЦТК.
Нормальное течение синтеза мочевины обеспечивает:
1. окончательное обезвреживание аммиака;
2. избавление организма от NH3 и CO2;
3. баланс рН, поддерживая гомеостаз бикарбонатной буферной системы.
Для контроля нормального течения метаболизма азотсодержащих соединений, и в основном, процессов обезвреживания аммиака в клинике

Схема 2.2.1.4.1. Взаимосвязь между ЦТК с орнитиновым циклом.
служит определение в крови следующего показателя — остаточного азота (Rest W) – т.е. оценивается суммарное содержание низкомолекулярных азотистых веществ, которые остаются фильтрате после осаждения белков. В их общем количестве около половины приходится на мочевину, 25% составляет доля аминокислот, величины креатина укладываются в 5%, ураты в 4% и т. д.
В норме значения остаточного азота колеблются в пределах 14–25 ммоль/л, у новорожденных они выше (42–71 ммоль/л). При различных патологических состояниях регистрируется гиперазотемия. В зависимости от механизмов возникновения выделяют продукционную и ретенционную гиперазотемии. Первый вариант может быть спровоцирован систематическим избыточным поступлением пищевых белков (у «мясоедов»), усиленный деструкцией тканей, сопровождающейся ускоренным распадом белков (при опухолях, лейкозах, ожоговой болезни и т.д.). Основной причиной ретенционной гиперазотемии служат обычно болезни почек при нарушении их выделительной способности, что обуславливает избыточное накопление в плазме крови мочевины. Кроме того, рост величин остаточного азота может наблюдаться при сердечно–сосудистой декомпенсации, при непроходимости кишечника (усилено всасывание продуктов гниения), сахарном диабете и т.д.
В последние годы стали проводить количественное определение отдельных компонентов остаточного азота – аминокислот (например, гипер-аминоацидемия при усиленном гидролизе тканевых белков распадающихся тканей) и мочевины (гиперкарбамидемия при болезнях почек). Гипокарбамидемия встречается довольно редко, обычно это следствие мутаций ферментов – участников орнитинового цикла (см. «Патохимия наследственных болезней» С. 57).
Что такое гипоальбуминемия и как ее лечить — Рамблер/доктор
Гипоальбуминемия — состояние, характеризующееся низким уровнем альбумина в крови. Альбумин — это белок крови, который составляет основную часть плазмы крови. Плазма — это жидкая часть крови, которая содержит белки и клетки крови.
Альбумин играет важную роль в организме человека, включая поддержание давления в кровеносных сосудах и транспортировку веществ, таких как гормоны и лекарственные препараты. Когда уровень альбумина снижается, кровь не может эффективно транспортировать необходимые вещества.
Гипоальбуминемия — причины
Низкий уровень альбумина зависит от многих причин.
Уровень альбумина ниже 3,4 грамм в децилитре (г/дл) считается низким. Определение причины гипоальбуминемии необходимо для эффективного лечения.
Некоторые из наиболее распространенных причин:
Печеночная недостаточность
Печень продуцирует альбумин, поэтому анализ крови на уровень альбумина зачастую является частью проверки функционирования печени. Многие заболевания могут вызвать печеночную недостаточность, включая цирроз, рак печени, гепатит, алкогольная болезнь печени и неалкогольная жировая болезнь печени.
Сердечная недостаточность
У некоторых людей с острой сердечной недостаточностью наблюдается снижение уровня альбумина, хотя причина этого явления не вполне понятна.
Заболевания почек
Проблемы с почками могут увеличить количество белка в моче. Это может привести к гипоальбуминемии.
Энтеропатия с потерей белка (ЭПБ)
Некоторые заболевания желудочно-кишечного тракта, включая целиакию и воспалительные заболевания кишечника, могут привести к тому, что пищеварительная система теряет много белка. Это может привести к снижению уровня альбумина в крови.
Недоедание
У человека может развиться гипоальбуминемия, когда он не получает достаточно питательных веществ.
Кроме этого, у людей может развиться гипоальбуминемия в результате серьезного ожога, инфекции крови, называемой сепсисом, аллергических реакций, волчанки, гипотиреоза или диабета.
Каковы симптомы низкого альбумина?
Желтушность и сухость кожных покровов, истончение волос являются потенциальными симптомами гипоальбуминемии. Некоторые симптомы гипоальбуминемии:
избыток белка в моче;
задержка жидкости, что вызывает отеки, особенно ног или рук;
признаки желтухи, включая желтую кожу или глаза;
чувства слабости или истощения;
учащенное сердцебиение;
рвота, диарея и тошнота;
изменения аппетита;
истончение волос;
очень сухая и зудящая кожа.
Гипоальбуминемия — лечение
Самым лучшим методом лечения гипоальбуминемии является устранение первопричины. Некоторым людям могут понадобиться препараты для повышения уровня альбумина. Это может быть альбумин, который вводят внутривенно.
Лечение может включать:
препараты от высокого артериального давления у людей с заболеваниями почек или сердечной недостаточностью;
изменения образа жизни, в частности отказ от алкоголя при заболевании печени;
препараты от хронических желудочно-кишечных заболеваний;
антибиотики, если у человека гипоальбуминемия вызвана после перенесенного тяжелого ожога;
диетические изменения.
Людям с гипоальбуминемией, вследствие органной недостаточности, может потребоваться пересадка органа. Люди с заболеванием почек могут нуждаться в диализе, поскольку они ждут трансплантации почки. Людям с гипоальбуминемией может потребоваться госпитализация и наблюдение до тех пор, пока уровень альбумина не повысится.
Какие продукты повышают альбумин?
Альбумин присутствует во многих продуктах животного происхождения. Они включают:
говядину;
молоко;
творог;
рыбу;
яйца;
йогурт.
Некоторые пищевые добавки и заменители мяса могут также содержать альбумин.
Люди, которые потребляют достаточное количество белка, как правило, получают достаточное количество альбумина. Большинству людей требуется минимум 0,8 грамма белка на килограмм массы тела в день.
Гипоальбуминемия — осложнения
Гипоальбуминемия может усугубить последствия других заболеваний. У людей с хронической обструктивной болезнью легких (ХОБЛ) и гипоальбуминемией чаще наблюдается дыхательная недостаточность. Другие осложнения гипоальбуминемии:
накопление жидкости, в том числе в плевральной и брюшной полостях;
пневмония;
повреждение мышц.
Низкий альбумин говорит о том, что у человека могут быть определенные проблемы со здоровьем, но сам по себе он не дает информации о причине. Люди с низким уровнем альбумина должны обратиться к врачу, чтобы узнать причину.
