Гемоглобин — Википедия. Что такое Гемоглобин
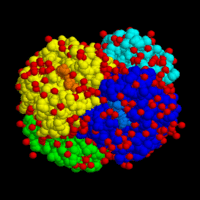 Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета  Структура гемоглобина человека. Железосодержащие гем-группы показаны зеленым. Красным и синим показаны альфа- и бета- субъединицы.
Структура гемоглобина человека. Железосодержащие гем-группы показаны зеленым. Красным и синим показаны альфа- и бета- субъединицы.Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа.
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[3].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности [4].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[5]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как
Строение
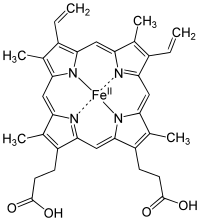
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология
 Изменение состояний окси- и дезоксигемоглобина
Изменение состояний окси- и дезоксигемоглобинаВ отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[6].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
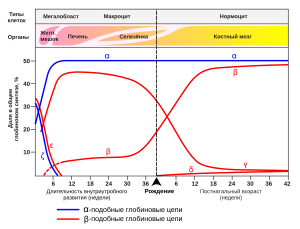 Экспрессия генов гемоглобина до и после рождения.
Экспрессия генов гемоглобина до и после рождения.Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[7]
Гемоглобин при заболеваниях крови
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии. Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также
Примечания
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology. — 12th ed. — Philadelphia, Pa. : Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6.
- Levitt, M & C Chothia (1976), «Structural patterns in globular proteins», Nature. doi 10.1038/261552a0.
Значение слова ГЕМОГЛОБИН. Что такое ГЕМОГЛОБИН?
Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях. Молекулярная масса гемоглобина человека — около 66,8 кДа.Большой вклад в исследование структуры и функционирование гемоглобина внёс Макс Перуц, получивший за это в 1962 году Нобелевскую премию.
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови.
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате уровень гемоглобина несколько понижается (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности.
Главная функция гемоглобина состоит в переносе кислорода. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Гемоглобин А — это… Что такое Гемоглобин А?
Гемоглоби́н A, или ΗbA — нормальный гемоглобин взрослого человека.
Этот белок представляет собой тетрамер, состоящий из двух пар полипептидных цепей — мономеров: двух мономеров α-цепей и двух мономеров β-цепей (так называемый гемоглобин A, или гемоглобин α2β2), или двух мономеров α и двух мономеров δ (гемоглобин Α2, или гемоглобин α2δ2).
- Гемоглобин A — HbA (α2β2)
- Гемоглобин A2 — HbA2 (α2δ2)
В эритроцитах здорового взрослого человека гемоглобин А (α2β2) является основным вариантом гемоглобина и составляет в норме почти 97 % общего гемоглобина эритроцитов. Оставшиеся около 3 % приходятся на гемоглобин Α2 (α2δ2). Количество этой формы гемоглобина увеличивается у больных β-талассемией.
Гемоглобин A (англ. Adult — взрослый) относится к сложным белкам — хромопротеидам. Он состоит из белковой и небелковой частей. Белковая часть представлена четырьмя полипептидными цепями, которые попарно одинаковы: 2α и 2β цепи. В связи с тем, что цепи гемоглобина A неодинаковы, он относится к гетеротетрамерным молекулам. Каждая полипептидная цепь связана с небелковой частью, которую представляет гем. Комплекс гема с α- или β-полипептидной цепью представляет субъединицу или протомер. Таким образом, вся молекула гемоглобина состоит из 4-х субъединиц или протомеров, образуя олигомер.
В структуре HbA находится 574 аминокислоты. Полипептидные цепи гемоглобина на 80 % спирализованы, обозначаются спирали буквами латинского алфавита от A до H. Неспиральные участки обозначаются двумя буквами латинского алфавита, между спиралями которых они находятся. Это необходимо для обозначения молекулярных замещений, приводящих к синтезу аномальных гемоглобинов.
См. также
Гемоглобин E
Гемоглобин F
Гемоглобин: определение, показатели и нормализация
Содержание этой статьи:
Одно из самых часто используемых исследований крови человека – анализ на гемоглобин. Медработники проводят этот анализ для осуществления контроля за здоровьем больных, а также для определения множества болезней. Наиболее частым является определение уровня гемоглобина в крови при её общем анализе.
Красные кровяные тельца являются основным составляющим элементом клеток крови. Гемоглобин, как известно, содержится в красных кровяных тельцах, представляет собой уникальный белок. По сути это пигмент красного цвета, содержащий атомы железа. В результате соединения кислорода, поступающего в кровь, с молекулами гемоглобина, кровь и обретает красный цвет.
Общеизвестно, что этот белок очень важен для жизнедеятельности организма человека. Ведь его способность образовывать непрочные соединения с кислородом сложно переоценить. Благодаря ей, гемоглобин отвечает за беспрерывное перенесение кислорода к каждому органу и системе человеческого организма.
При прохождении воздуха через лёгкие, молекулы кислорода отсоединяются и создают нестойкую связь с ферментом. Далее, при перемещении крови по организму этот белок осуществляет разнесение кислорода по всему организму, к каждой его клетке.
После доставки молекулы кислорода к клетке, фермент присоединяет к себе молекулу окиси углерода, которая содержится в клетках после сжигания питания. Далее, клетка осуществляет перенесение окиси углерода обратно в лёгкие, где они выводится наружу. Таким образом, процесс длится бесконечно. Как видим, это вещество выполняет дыхательную функцию организма.
Основные формы гемоглобина
Чистый белок ещё именуется основным. Когда к белку (глобину) присоединяется глюкоза, получается гликированный (гликолизированный гемоглобин). Он возрастает в случаях пресыщения крови глюкозой. Такие состояния характерны для сахарного диабета. Потому Всемирная организация здравоохранения рекомендовала анализ на гликированный гемоглобин как самый достоверный метод определения сахарного диабета. Те, кто страдает данным недугом, должны сдавать подобный анализ раз в квартал, а возможно и чаще.
Существует ещё одна форма, которую имеет данный фермент, — фетальный гемоглобин. Он имеет иные свойства в виду несколько другого строения. Фетальный гемоглобин – это фермент, характерный для новорождённых. В крови малышей среднее содержание гемоглобина этой формы достигает 80%. По достижении первого года жизни этот белок разрушается. Происходит его почти полная замена взрослой формой белкового соединения. Если же у взрослых обнаруживается фетальный гемоглобин, то это является признаком нарушений и болезней.
Нормы содержания гемоглобина
Как уже упоминалось выше, определение содержания этого белка в составе крови является одним из самых важных и распространённых анализов. Такое исследование необходимо сдавать натощак. Ответ с анализом готов практически сразу. Среднее содержание гемоглобина на протяжении суток немного изменяется.
У мужчин среднее содержание гемоглобина составляет около 135–160 грамм на литр крови. У женщин же эти показатели варьируются в пределах 120–140 грамм на литр.
Если говорить о гликированном гемоглобине, то в норме его содержание лежит в пределах 4–5%. Это значит, что по сравнению с уровнем свободного гемоглобина, гликированный составляет до 5%. Наибольшее значение содержания гемоглобина наблюдается с утра. После еды же на протяжении пары-тройки часов его показатели падают до минимума. Особенно это заметно после приёма жидкой еды. Необходимо отметить, что белок у взрослых людей находится в большей концентрации, нежели у детей. Кроме того, у мужчин, гемоглобин в крови находится в большей концентрации, нежели у женщин, что подтверждают вышеприведённые цифры. Также фермент несколько зависит от возраста человека. Необходимо отметить, что гликированный гемоглобин может и не иметь прямой зависимости от того, какое содержание в крови демонстрирует прямой белок.
Отметим, что проверяют показатели этого белка путём использования специального набора реагентов (обязательно натощак). Такое средство именуется Гемоглобин Агат.
Определение содержания фетального гемоглобина в крови взрослых пациентов (также делается натощак) даёт возможность диагностировать заболевания крови. Кроме того, гемоглобин повышается при онкологии. Потому увеличение его концентрации выше 1% может дать ответ об онкологической патологии.
Заболевания, сопровождающиеся повышением гемоглобина
В повышенной концентрации фермент может указывать на определённые заболевания:
- Сгущение крови.
- Непроходимость кишечника.
- Возрастание числа эритроцитов в крови – эритроцитоз.
- Ожоги.
- Врождённый порок сердца.
- Сердечно-лёгочная недостаточность.
Если наблюдается повышенный гликолизированный белок, то это может сигнализировать о наличии дефицита железа, а также сахарного диабета.
Стоит отметить, что возрастание уровня гемоглобина является следствием физических нагрузок на организм. У пилотов и альпинистов гемоглобин повышается после нахождения на высоте. Также высокий уровень белка – это норма для людей, живущих в высокогорье. Более высокое содержание гемоглобина вполне может возникать даже после обычной прогулки на свежем воздухе.
Анемия, её причины и следствия
Состояние, когда в крови падает гемоглобин, именуется анемией. Она является следствием болезней крови с разрушением эритроцитов, сильных кровотечений. Также низкий уровень фермента демонстрируется в результате переливаний крови. Влияет на него и алкоголь. Уровень гемоглобина стремительно падает и от недостатка железа, витаминов В12, а также фолиевой кислоты. Они способствуют синтезу гемоглобина. Также это нарушение нормы является следствием хронических болезней, таких как талассемия.
Гликированный гемоглобин понижается при гемолитической анемии, гипогликемии, переливаниях крови, а также кровотечениях.
Будущим мамам на заметку
У беременных также очень часто снижается уровень этого белка. Это является свидетельством нехватки железа у беременной. Ведь потребность в этом микроэлементе при вынашивании ребёнка возрастает. Медицина рекомендует беременным следить за данным показателем. Ответ на вопрос о снижении фермента у беременных кроется в том, что обычному человеку для жизнедеятельности нужно до 10–15 мг железа в сутки, а беременной – до 18 мг. Пониженный гемоглобин способен вызвать досрочные роды либо задержку развития ребёнка.
Продукты, способствующие повышению гемоглобина
- Зелень: репчатый лук, молодая ботва репы, горчица, листья обычного одуванчика, кресс-салат, петрушка, шпинат.
- Овощи: тыква, свёкла, молодая печёная картошка, помидоры.
- Крупы и каша: гречневая, чечевица, фасоль, рожь, толокно, горох.
- Мясо: говядина, сердце, почки, печень, язык, белое мясо курицы.
- Ягоды: клюква и чёрная смородина в свежем либо замороженном виде.
- Соки: морковный, свекольный, гранатовый, некоторые виды яблочного сока.
- Других продукты: чёрная или красная икра, грецкие орехи, яичный желток, морепродукты, чёрный шоколад, алкоголь в виде красного вина, гематоген, сушёные грибы, сухофрукты.
Необходимо отметить, что железо хорошо усваивается только при определённых условиях. Для более эффективного усваивания нужно употреблять пищу, которая богата витамином С. Так, овощной либо фруктовый сок положительно влияет на усваивание железа. Чай или кофе наоборот замедляет усвоение железа организмом. Чем же их заменить? Ответ — зелёным чаем либо соками.
При беременности не следует есть печень для поднятия уровня гемоглобина. Ведь в ней в высоких концентрациях присутствуют витамины А и D. А каждый из них при избыточном употреблении негативно влияет на организм.
Гранатовый сок является чрезвычайно эффективным средством увеличения содержания фермента. Однако у него есть побочное действие – вероятность возникновения запоров.
В любом случае необходимо ограничить алкоголь.
Рецепты средств для повышения гемоглобина
Существует множество рецептов, содержащих доступные вещества, повышающие содержание этого белка. Все их следует принимать системно, чтобы обеспечивать поддержку организма. Не забудьте только о чувстве меры и помните, что превышение разумного количества пусть даже и полезной пищи вместо благотворного эффекта приведёт только к расстройству желудочно-кишечного тракта. Итак:
- Перемолоть по стакану гречневой крупы и грецких орехов, в смесь добавить стакан мёда и тщательно перемешать. Ежедневно есть по столовой ложке, желательно натощак.
- Перемолоть и перемешать курагу, грецкие орехи, изюм и мёд в одинаковых пропорциях. Употреблять от 1 до 3 столовых ложек в сутки. Этот рецепт ещё и наполнит организм витаминами.
Ответы@Mail.Ru: Что такое Гемоглобин?
в крови что то
Красная составляющая крови!
Белок крови млекопитающих, который содержится внутри эритроцита и обеспечивает перенос кислорода в органы.
Сложный белок в эритроцитах (клетках крови) , который переносит кислород и углекислый газ.
Гемоглоби́н (от др. -греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок животных и человека, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях [1]. Главная функция гемоглобина состоит в переносе дыхательных газов. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови прочнее, чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия) . В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел −120, верхний предел −180 г/л) , у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови. [1] Метгемоглобин — производное гемоглобина, в котором железо окислено (трехвалентно) . Метгемоглобин не способен переносить кислород. Образуется в организме при некоторых видах отравлений. [2]
Что такое гемоглобин? Большинство клеток нашей крови представляют собой красные кровяные тельца. Миллионы и миллионы красных кровяных клеток циркулируют по кровеносным сосудам. Красные кровяные тельца содержат белковое вещество, называемое гемоглобином. Гемоглобин — красный пигмент, содержащий атомы железа. Наша кровь по цвету красная, потому что в нее входят соединения гемоглобина с кислородом. Гемоглобин выполняет для тела более важную функцию, чем просто окрашивание крови в красный цвет. Он обладает способностью к образованию непрочного соединения с кислородом. Благодаря этой способности красные кровяные тельца могут разносить кислород по всему телу. Кислород входит в состав воздуха, проходящего через легкие, и гемоглобин подхватывает молекулы кислорода. Продолжая свое путешествие по кровеносным сосудам, красные тельца разносят кислород по всем клеткам тела. Когда молекула кислорода доставлена в клетку человеческого тела, гемоглобин забирает из нее молекулу окиси углерода, образовавшуюся там в процессе сжигания этой клеткой питания. Затем красное кровяное тельце, нагруженное молекулой окиси углерода, возвращается в легкие, где происходит обмен: окись углерода отсоединяется и выводится из организма вместе с выдыхаемым воздухом, а новая молекула кислорода подхватывается взамен ее. Затем красное кровяное тельце продолжает свой путь, чтобы доставить этот кислород в соответствующую клетку. Вот почему очень важно, чтобы наша пища содержала железо. Оно стимулирует производство красных кровяных телец и увеличивает содержание в них гемоглобина. Что такое гемоглобин (Hb, Hemoglobin)? Гемоглобин – это дыхательный пигмент крови, который содержится в эритроцитах и участвует в транспортировке кислорода и углекислоты, регуляции кислотно-основного состояния. Состоит гемоглобин из двух частей белковой и железосодержащей. У мужчин содержание гемоглобина несколько выше, чем у женщин. У детей до года имеется физиологическое снижение показателей гемоглобина. Физиологические формы гемоглобина: O оксигемоглобин (HbО2) — соединение гемоглобина с кислородом — образуется, преимущественно, в артериальной крови и придает ей алый цвет; O восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям; O карбоксигемоглобин (HbCO2) — соединение гемоглобина с углекислым газом — образуется, преимущественно, в венозной крови, которая вследствие этого приобретает темно-вишневый цвет. Когда концентрация гемоглобина может увеличиваться? При заболеваниях и состояниях: ° ведущих к сгущению крови (ожоги, упорная рвота, кишечная непроходимость, дегидротация или длительное обезвоживание) ; ° сопровождающихся увеличением количества эритроцитов – первичные и вторичные эритроцитозы (горная болезнь, хроническое обструктивное заболевание легких, поражение кровеносных сосудов легких, злостное курение табака, наследственные гемоглобинопатии с повышенным сродством гемоглобина к кислороду и дефиците 2,3-дифосфоглицерата в эритроцитах, врожденные «синие» пороки сердца, поликистоз почек, гидронефроз, стеноз почечных артерий в результате локальной ишемии почек, аденокарцинома почек, гемангиобластома мозжечка, синдром Гиппеля-Линдау, гематома, миома матки, миксома предсердий, опухолевые заболевания желез внутренней секреции и др.) ; ° физиологические состояния (у жителей высокогорья, летчиков, альпинистов, после повышенной физической нагрузки, длительного стресса) . Когда концентрация гемоглобина может уменьшаться? ° При анемии различной этиологии (постгеморрагическая острая при острой кровопотере; железодифицитная при хронических кровопотерях, после резекции или с тяжелым поражением тонкого кишечника; наследственные, связанные с нарушением синтеза порфиринов; гемолитические анемии связанные с усиленным разрушением эритроцитов; апластичекие анемии связанные с токсическим воздействием некоторых медикаментов, химических веществ, идиопатическая, п
Гемоглобин- белок крови
Какая-то хрень в крови
