Как поднять гемоглобин после химиотерапии
Химиотерапия направленно подавляет клетки с повышенной митотической активностью (интенсивно делящиеся). Это основной принцип цитостатической терапии, поскольку опухоль активно растет, а остальные клетки обновляются медленно. Но кроветворные клетки тоже делятся со значительной скоростью и поэтому угнетаются химиотерапией. Одно из побочных проявлений лекарственного лечения опухолей заключается в развитии панцитопении — уменьшении числа форменных элементов крови (эритроцитов в том числе). Низкий гемоглобин при раке отражает общее угнетение кроветворения.
Принцип лучевого лечения тоже основан на повреждении клеток, находящихся в процессе деления. Угнетение красного гемопоэза ведет к эритроцитопении, анемии и низкому гемоглобину. Критически низкий гемоглобин наблюдают при повторных курсах лучевой терапии в сочетании с цитостатиками. Кроме этого, показатели красной крови склонны к снижению из-за опухолевых кровотечений, токсического гемолиза и угнетения выработки эритропоэтина. Онкологи постоянно мониторят картину красной крови и назначают лечение при ее ухудшении.
Повысить гемоглобин после химиотерапии — значит повысить шансы больного в борьбе с раком. Его уровень оказывает прямое влияние на выживаемость при онкологии вследствие 3-х групп причин:
- кислородное голодание опухоли снижает эффект лучевой и химиотерапии;
- гипоксия тканей снижает все показатели качества жизни пациента;
- анемия сокращает число курсов лечения вследствие невозможности их перенести.
Как поднять гемоглобин после химиотерапии?
Рациональная, согласованная с онкологом диета должна исключить недостаток пищевых факторов синтеза гемоглобина (железа, цианкобаломина, кислоты фолиевой и др.). Необходимо учесть, что, во-первых, сверхвысокое поступление факторов его синтеза с пищей не купирует гипогемоглобинемию, а во-вторых, большое количество витаминов способно стимулировать рак.
Гемотрансфузия и/или переливание эритроцитарной массы применяются широко и эффективно. Они незаменимы при тяжелых, нарастающих анемиях. Наиболее оправданы гемотрансфузии непосредственно перед курсом лечения или сразу после него, поскольку они быстро поднимают гемоглобин и улучшают состояние пациента. Это недорогие и эффективные процедуры. К сожалению, онкологические анемии могут длиться годами, и частые гемотрансфузии постепенно сенсибилизируют организм, вызывая аллергические реакции на переливание крови.
Эритропоэтины незаменимы в терапии онкологических анемий, безопасно и эффективно повышая показатели красной крови. Они стимулируют рост эритроцитов, что при наличии достаточного количества выше перечисленных факторов синтеза гемоглобина, повышает его уровень. Однако клинический эффект развивается не сразу, и поэтому их назначают при первых признаках анемии. В РФ доступны «Неорекормон», «Эпрекс» и другие средства.
Продолжается поиск колониестимулирующих факторов эритроцитов, которые выявлены и успешно применяются для лечения лейкопении. Сообщается о стимулирующем влиянии на рост эритроцитов терапии иммуноглобулином.
Как повысить гемоглобин?
Такой вопрос часто задают пациенты, но ответить на него однозначно не возможно. Нужно знать причину, почему отмечается снижение гемоглобина. При уменьшении общего количества гемоглобина, чаще всего проявляющееся уменьшением его концентрации в единице объема крови, мы говорим о наличии у человека анемии, точнее малокровия.
Основной причиной понижения уровня гемоглобина является дефицит железа, который может возникнуть при снижении его общего содержания в организме. Причинами дефицита железа, в свою очередь, могут быть:
- недостаточное получение его с пищей;
- нарушение всасывания железа;
- кровопотери.
Недостаточное содержание железа в рационе обычно бывает связано с преобладанием в нем растительной пищи. Так, алиментарная недостаточность железа нередко наблюдается среди вегетарианцев. Это обстоятельство дополнительно отягощается недостаточностью витамина В12, содержащегося в животных продуктах.
Так, алиментарная недостаточность железа нередко наблюдается среди вегетарианцев. Это обстоятельство дополнительно отягощается недостаточностью витамина В12, содержащегося в животных продуктах.
Железодефицитная анемия развивается при нарушении всасывания железа в кишечнике. К такому состоянию могут привести различные патологические изменения двенадцатиперстной кишки и верхних отделов тонкой кишки. Нарушение всасывания железа может возникать после операций на желудке и двенадцатиперстной кишке, удалении части тонкой кишки. В то же время, если при поражениях желудочно-кишечного тракта не страдают желудок и верхний отдел тонкого кишечника, всасывание железа обычно не нарушается. Косвенными причинами нарушения всасывания железа могут стать хронический панкреатит, атрофический гастрит. Всасывание железа может снижаться из-за избыточного содержания в пище ингибиторов всасывания железа – кальций, фосфаты, оксалаты и др.
Наиболее частой причиной железодефицитной анемии являются кровопотери, особенно длительные, постоянные, хотя и незначительные. Организм теряет больше железа, чем получает из пищи. Если при кровотечениях из носа, маточных кровотечениях к врачу обращаются до развития тяжелых анемий, то желудочно-кишечные кровотечения могут оставаться долго незамеченными и анемия более тяжелая. Причинами таких кровопотерь могут быть эрозии и язвы желудка, эрозии пищевода, варикозное расширение вен пищевода и кардиального отдела желудка, опухоли желудка и кишечника, а так же опухоли других локализаций.
Встречаются анемии, связанные с дефицитом в организме витамина В12 или (и) фолиевой кислоты. Дефицит витамина В12 в организме может наступить в результате нарушения его всасывания:
- недостаточная секреция хлористоводородной кислоты, пепсина и внутреннего фактора: из-за атрофии слизистой желудка, оперативного удаления части желудка, токсического воздействия на слизистую оболочку желудка, например алкоголя;
- поражение тонкой кишки при таких заболеваниях: тяжелый хронический энтерит, дивертикулез, опухоли, спру, целиакия, удаление части тощей кишки;
- конкурентное поглощение большого количества витамина В12: при инвазии широким лентецом, дисбактериозе кишечника, синдроме слепой кишки (после операции на кишечнике и погрешностях в наложении анастомозов).

Снижение концентрации гемоглобина может быть вызвано преждевременной гибелью эритроцитов, увеличением скорости разрушения эритроцитов. Такое состояние наблюдается при некоторых иммунных нарушениях (ревматойдный артрит, красная волчанка и др.), длительных инфекционных заболеваниях (гепатиты, пневмонии, туберкулез, хронический пиелонефрит и другие), в результате воздействия лекарств и химических веществ окислительного действия, ядов (укусы змей, пауков, пчел), термических поражений, инфекционных факторов, и др.
Коррекцию уровня гемоглобина проводят с учетом причины развития анемии. Важной задачей лечения является устранение основного заболевания. Поэтому при определении в крови низкого гемоглобина необходимо пройти целый ряд обследований, чтобы выяснить какая именно это анемия (железодефицитная, В12-дефицитная, связанная с дефицитом фолиевой кислоты, гемолитическая и др.). Далее необходим тщательный диагностический поиск причин малокровия: фиброгастродуоденоскопия, рентгенологическое исследование желудочно-кишечного тракта, УЗИ, обследование кишечника, анализ кала на кровь и яйца гельминтов.
Лечение хронической железодефицитной анемии у людей должно быть консилиумным. Под этим мы понимаем участие в диагностике и лечении различных специалистов в зависимости от причин, вызвавших железодефицитную анемию (хирург, терапевт, проктолог, эндоскопист, диетолог, уролог и другие). Только такой подход предполагает поиск и устранение причины заболевания. Прежде всего, это касается кровопотерь. Противоанемическая терапия при не устранённых, даже необильных кровопотерях не дает стойкого эффекта.
В лечении анемии важная роль отводится питанию. Чтобы повысить уровень гемоглобина, рекомендуется употреблять в пищу печень, почки, сердце, белое мясо курицы. Из круп отдайте предпочтение гречке, фасоли, чечевице, гороху и другим бобовым. Среди овощей лучше всего есть томаты, молодой картофель, лук, тыкву, салат. Полезна любая зелень (петрушка, одуванчик, шпинат, укроп). Богатые железом фрукты: лучше зеленые сорта яблок, бананы, гранат, абрикосы, персики, сливы, хурма и айва. Обязательно нужно пить соки: гранатовый, свекольный, морковный. Полезно также есть морепродукты, орехи (особенно грецкие), сухофрукты, шоколад (черный).
Богатые железом фрукты: лучше зеленые сорта яблок, бананы, гранат, абрикосы, персики, сливы, хурма и айва. Обязательно нужно пить соки: гранатовый, свекольный, морковный. Полезно также есть морепродукты, орехи (особенно грецкие), сухофрукты, шоколад (черный).
Конечно, лечение анемии всегда включает назначение лекарственных препаратов. Невозможно устранить железодефицитную анемию без препаратов железа, лишь диетой, включающей много железа. Всасывание железа из пищи ограничено, его максимум 2,5мг/сут. Из лекарственных препаратов железа его всасывается в 15-20 раз больше. Тем не менее, пища должна быть полноценной, содержать достаточное количество хорошо всасываемого железа и белка. Лучше препараты железа принимать совместно с аскорбиновой кислотой. Последняя улучшает всасывание железа в кишечнике. Поскольку пища значительно снижает всасывание неорганического железа, более эффективным оказывается прием таблеток перед едой. В виде инъекций препараты железа вводят лишь при наличии специальных показаний. Необходимо помнить, что необоснованное применение препаратов железа способно вызвать тяжелые побочные эффекты. Даже относительно небольшая передозировка может проявляться тошнотой, рвотой, диареей, болью в животе, понижением артериального давления, общей слабостью и другими неприятными симптомами.
Для профилактики анемии, связанной с недостаточностью витамина В12 или фолиевой кислоты, важно своевременно выявлять и лечить хронические заболевания желудочно-кишечного тракта. Лечение В12-дефицитной анемии предполагает устранение вызвавших ее причин: при глистной инвазии необходимым условием излечения является дегельминтизация, при изменении кишечной флоры и диарее применяются ферментные и закрепляющие средства, диетическое питание. Ну, а основное лечение – инъекции витамина В12. Как правило, спустя несколько дней после начала курса инъекций удается заметно повысить уровень гемоглобина в крови.
И так, в этой статье разобраны только некоторые анемии, на самом деле их значительно больше. Каждый случай пониженного гемоглобина в крови предполагает проведение тщательного обследования. Проблем с повышением гемоглобина не возникает, если точно установлена причина анемии. Правда некоторые анемии требуют довольно длительного курса лечения, а иногда и проведение курсов профилактического лечения. Так что, если у вас понижен гемоглобин, обратите внимание на свое питание и быстрее к врачу для проведения полного обследования.
Каждый случай пониженного гемоглобина в крови предполагает проведение тщательного обследования. Проблем с повышением гемоглобина не возникает, если точно установлена причина анемии. Правда некоторые анемии требуют довольно длительного курса лечения, а иногда и проведение курсов профилактического лечения. Так что, если у вас понижен гемоглобин, обратите внимание на свое питание и быстрее к врачу для проведения полного обследования.
Токарева Ирина Викторовна руководитель Городского гериатрического центра
Анемия при химиотерапии лечение, симптомы, причины. Как лечить анемию (малокровие) после химиотерапии
Анемия является одним из распространенных побочных эффектов в период проведения и после курса химиотерапии. При анемии отмечается аномально низкий уровень гемоглобина и эритроцитов. При слишком низком уровне эритроцитов возникает проблема недостаточной доставки кислорода к частям тела, что создает серьезные проблемы для их полноценного функционирования.
Важно учитывать – злокачественные клетки не способны жить в среде с достаточным поступлением кислорода. Следовательно, при анемии улучшаются условия для дальнейшего роста раковых клеток, учитывая сокращение общего количества поступающего кислорода.
У людей с анемией после химиотерапии возникает ощущение слабости и усталости, что может кардинально сказаться на качестве жизни. Проблема требует грамотного и внимательного лечения, с которым готовы помочь опытные врачи онкологи клиники «Витамед».
Причины анемии после химиотерапии
Выработка эритроцитов происходит в костном мозге. Гормон эритропоэтин, который вырабатывают почки, сообщает организму о необходимости выработки большего количества эритроцитов. Следствием рака и его лечения может стать анемия по причине нескольких обстоятельств:
- Действие определенных лекарств может спровоцировать появление повреждений костного мозга, не позволяя ему вырабатывать достаточно эритроцитов.
- Некоторые типы рака, которые сказываются на состоянии костного мозга, либо метастазирующие в кости, могут привести к вытеснению нормальных клеток костного мозга.

- Возможно травмирование почек под действием определенных химиотерапевтических препаратов, с ухудшением выработки эритропоэтина.
- Следствием лучевой терапии на больших участках могут стать повреждения костного мозга.
- Из-за рвоты, тошноты, потери аппетита может развиваться проблема недостатка необходимых питательных компонентов, которые требуются для соответствующей выработки эритроцитов.
- Кровотечение из-за опухоли либо оперативного вмешательства, может стать причиной анемии.
Признаки и симптомы анемии при химиотерапии
Основные признаки проблемы представлены мышечной слабостью, ощущением экстремальной слабости, излишней усталости, головными болями, бессонницей, проблемам и с сохранением тепла, бледностью, головокружениями и даже обмороком.
Диагностика анемии при химиотерапии
Диагностика проблемы предполагает анализ крови для определения процента либо количества эритроцитов, с определением уровня гемоглобина. При определенных видах рака пациентам может назначаться регулярный анализ крови для предотвращения возникновения и прогрессирования анемии и прочих болезней крови.
Лечение анемии после химиотерапии в клинике «Витамед»
Лечение анемии представляет собой обязательное условие при онкологических болезнях, являясь важным условием успешной симптоматической терапии, с индивидуальным планированием подходящего курса, с учетом степени анемии и прочих индивидуальных показаний. В практике специалистов клиники «Витамед» предусмотрена работа лишь с препаратами нового поколения, обеспечивая высокую переносимость организма с минимальными побочными эффектами для пациентов.
Гораздо легче и дешевле лечить анемию средней степени по сравнению с тяжелой. Поэтому не стоит откладывать лечение до момента, когда анемия уже станет угрозой для жизни, с необходимостью экстренного и затратного лечения. Опыт подтверждает, что самостоятельно, без помощи компетентных специалистов, решить проблему не удается.
Если возникают симптомы анемии, может потребоваться переливание крови с эритроцитами. Для лечения некоторых пациентов подходят препараты эпоэтина-альфа либо дарбэпоэтина-альфа. Данные препараты представляют собой формы эритропоэтина, произведенные в лабораторных условиях, с выдачей управляющих сигналов для костного мозга для повышения уровня выработки эритроцитов. Если причиной анемии стал недостаток питательных компонентов, может назначаться железо в таблетках. Также следует продумать подходящую диету и терапию для преодоления возникших проблем побочных эффектов при онкологических заболеваниях и химиотерапии.
9-20
Первичный приемОнкологАкушер — гинекологМаммологКардиологМассажистПроктологФлебологХирургУЗИ
Медики рассказали, как быстро поднять уровень гемоглобина
Причиной проблемы с гемоглобином может быть продолжительное кровотечение, неполноценное питание, недостаток витаминов В12 и В 6.
Гемоглобин входит в состав красных кровяных телец, которые переносят кислород по всему организму, и убирает углекислый газ. У крови красный цвет именно из-за соединения гемоглобина и кислорода.
Если гемоглобина в крови недостаточно, то организм не получает достаточно кислорода. Нарушается питание и правильная работа всех клеток организма.
Причиной проблемы с гемоглобином может быть продолжительное кровотечение, неполноценное питание, недостаток витаминов В12 и В 6.
Уровень гемоглобина проверяется простым анализом крови. Нормальный уровень гемоглобина для взрослых мужчин от 135 до 160 г/л, и от 120 до 140 г/л для взрослых женщин. Снижения гемоглобина является нормальным для женщин, которые беременны или имеют тяжелые менструальные кровотечения. Когда гемоглобин низкий из-за аномалии или заболевания, это называется анемией.
Анемия
Анемия особенно опасна для детей: проблемы с иммунитетом и правильным физическим и умственным развитием. Возможно развитие такого серьезного заболевания как серповидноклеточная анемия. Поэтому за уровнем гемоглобина особенно важно следить беременным и кормящим женщинам.
Поэтому за уровнем гемоглобина особенно важно следить беременным и кормящим женщинам.
Симптомами анемии могут стать бледность, сухость и ломкость волос и ногтей, повышенная утомляемость, частое сердцебиение и нарушения дыхания.
Причинами анемии могут стать сильные кровотечения, например, во время операции или огнестрельного ранения. Анемия также может быть вызвана некоторыми раковыми заболеваниями, такими как лейкемия, лимфома или множественная миелома. Анемия может быть побочным эффектом химиотерапии. Также анемия может быть вызвана дефицитом питательных веществ, железа, фолиевой кислоты (витамин В 12) и витамина В 6.
Для того чтобы повысить гемоглобин нужно вести здоровый образ жизни: чаще бывать на свежем воздухе, заниматься физкультурой, спать как минимум шесть часов в день и правильно питаться.
Самая распространенная причина анемии — дефицит железа, важного минерала для того, чтобы костный мозг вырабатывал гемоглобин.
В случаях сильной анемии врач может выписать специальные железосодержащие препараты. Они не очень хорошо усваиваются организмом, поэтому их лучше принимать во время еды. Намного лучше усваивается железо, которое содержится в натуральных продуктах питания.
Железо бывает двух видов: гемовое и негемовое. Гемовое железо усваивается организмом намного лучше. В то время как негемовое железо почти не усваивается организмом — помочь может только лимонная кислота и витамин С. Окисленное негемовое железо значительно повышается уровень его усваивания. Для полноценного питания нужно каждый день есть железосодержащие продукты, сочетая их между собой и продуктами, богатыми витамином С.
Продукты, содержащие гемовое железо
говядина,
тунец,
свинина,
курица,
палтус,
баранина,
креветки,
моллюски,
морские гребешки.
Продукты содержащие негемовое железо
свёкла,
тыква,
спаржа,
орехи,
бобы (соя, фасоль, чечевица и нут),
картофель,
шпинат,
зеленый горошек,
авокадо,
изюм,
сушеные абрикосы,
финики,
цельнозерновой хлеб,
цельнозерновые макароны,
цельнозерновая крупа.
Вместе с группой продуктов, содержащих негемовое железо, нужно употреблять в пищу продукты, богатые витамином С. Эти продукты помогут железу усвоиться организмом:
цитрусовые,
киви,
папайя,
клубника,
черная смородина,
дыня,
брокколи,
томаты,
свежий сладкий и острый перец,
гуава,
салат-латук.
Помимо продуктов, помогающих усвоению железа, есть продукты, мешающие железу усваиваться организмом.
Что нужно исключить
Для поднятия уровня гемоглобина из питания нужно исключить, или принимать отдельно от железосодержащих продуктов:
кофеиносодержащие напитки,
молочные продукты,
алкоголь,
продукты богатые клетчаткой.
препараты кальция, соды.
Поднять уровень гемоглобина помогут отвары:
корня щавеля курчавого,
кассии грандис,
крапивы,
базилика,
розмарина,
тимьяна,
шалфея.
Эти травы можно настаивать, добавлять в салаты, супы и гарниры. Они отлично помогают повысить уровень гемоглобина естественным путем.
Также поднять уровень железа в крови помогут черная патока и жидкий хлорофилл (Е140).
Витамин В 12
Помимо железа и витамина С, для поднятия уровня гемоглобина врачи рекомендуют принимать витамин В 12, который содержится в:
печени,
яйцах,
зеленых овощах,
бобовых.
Домашние рецепты для поднятия гемоглобина
— одну чайную ложку кориандра смешать с чайной ложкой меда. Использовать как заправку для салата, или использовать в качестве маринада и соуса к мясу или курице.
— замочить семена черного кунжута в теплой воде на полчаса. Раздавить их и пропустить через сито или фильтр. Смешать стакан молока, неочищенного пальмового сахара или кленового сиропа и добавить получившуюся кунжутную пасту. Пить ежедневно в течение минимум двух недель.
— замочить семь орехов миндаля на ночь в теплой воде. Измельчить их в пасту. Добавить немного меда для сладости. Такую пасту можно использовать для тостов или крекеров из цельного зерна.
Важно помнить, что перед тем как резко изменить режим питания и образ жизни вообще, нужна консультация с лечащим врачом.
При использовании рекомендаций для поднятия гемоглобина следует помнить об умеренности, так как повышенный уровень гемоглобина также вреден для здоровья, как и пониженный.
Симптомы повышенного гемоглобина
нарушение работы кишечника,
потеря аппетита,
проблемы со зрением,
утомляемость, и другие симптомы, схожие с пониженным уровнем гемоглобина.
Для контроля уровня гемоглобина, после изменения образа жизни через месяц нужно провести повторный анализ крови.
Гемоглобин и его функции в организме человека
Гемоглобин – это сложный белок, который состоит из простого белка глобина и железосодержащей группы гема. Гемоглобин содержится в красных клетках крови эритроцитах и выполняет функцию доставки кислорода от легких к тканям, а затем – углекислоты к легким. Железо, из которого образуется гемм, поступает в организм с животными белками.
В норме в крови мужчин содержится больше гемоглобина, чем в крови женщин (135-160 г/л против 120-140). Особенностью гемоглобина является то, что его способность присоединять углекислый газ во много раз сильнее, чем способность присоединять кислород. Именно это свойство делает особо опасным угарный газ: даже при незначительной его концентрации в воздухе большая часть гемоглобина крови связывается не с кислородом, а с угарным газом, образуя соединение, не способное присоединять кислород.
Чем грозит низкое содержание гемоглобина в крови
Если количество гемоглобина становится ниже нормы, то органы и ткани начинают страдать от нехватки кислорода. В первую очередь страдают ткани, которые более всего нуждаются в кислороде – это ткань головного мозга и почек.
Снижение гемоглобина ниже нормы называется железодефицитной анемией. Причина такого состояния обычно кроется в регулярных кровопотерях (например, при язвенной болезни желудка или двенадцатиперстной кишки с частыми незначительными кровотечениями, раке желудка, нарушениях менструального цикла и так далее). Раньше причиной такой анемии являлись многочисленные ранения с обильными кровотечениями.
Раньше причиной такой анемии являлись многочисленные ранения с обильными кровотечениями.
Так как железо в геме образуется из животного белка, нехватка последнего (например, при вегетарианском питании) также может стать причиной железодефицитной анемии. Наконец, причиной анемии может стать нарушение всасывания железа в кишечнике (например, после операций по удалению части желудка или кишечника) или нарушение образования белка, входящего в состав гемоглобина (при наследственных заболеваниях).
Признаками железодефицитной анемии являются слабость, недомогание, снижение трудоспособности и работы головного мозга (ухудшение памяти, мыслительных способностей), сухость кожи, выпадение волос, расслоение ногтей, частые обмороки.
Как повысить гемоглобин – уроки народной мудрости
С древних времен железодефицитные анемии принято было лечить ржавчиной, которую собирали с ржавых железных поверхностей. Эти «хитрости» особенно хорошо знали воины, которые всегда имели для этих целей специальные ржавые мечи. Не менее чем мужчины, страдали женщины: многочисленные роды обычно сопровождались кровотечениями, а девушки часто страдали нарушениями менструального цикла, сопровождавшимися кровотечениями. Вода с ржавчиной помогала и в этом случае.
Только в XIX веке врачи смогли объяснить причину, по которой ржавчина помогала лечить анемию: было установлено, что железо входит в состав крови и именное его дефицит является причиной этого заболевания.
Правильное питание при низком гемоглобине
Раньше считали, что железо в любом виде способствует поднятию гемоглобина. Так, дефицит железа принято было лечить с помощью таких богатых им продуктов, как яблоки и гречка. Но в дальнейшем, было установлено, что железо, содержащееся в растительных продуктах, в организме человека усваивается в незначительных количествах. А для построения гемоглобина организму необходимы животные белки, в состав которых входит железо, которое прекрасно усваивается организмом.
Поэтому для того, чтобы повысить гемоглобин, человек должен употреблять пищу, богатую мясом (в том числе печенью, почками), рыбой (в том числе рыбной икрой), молочными продуктами, яйцами.
Но одни эти продукты могут нарушить процесс пищеварения, поэтому рацион должен обязательно содержать сложные углеводы овощей и злаков (каши из цельных круп).
Но если гемоглобин очень низкий в течение достаточно длительного времени (то есть уже сформировалось заболевание), то одной диеты для его восстановления может быть мало, требуется и медикаментозное лечение.
Медикаментозное лечение при низком гемоглобине
Сегодня выпускается много препаратов железа, способных хорошо всасываться в желудочно-кишечном тракте и служить источником восстановления гемоглобина. Особенностью лекарств, содержащих железо и предназначенных для приема внутрь, является то, что они раздражают желудочно-кишечный тракт, вызывая такие неприятные ощущения, как тошнота, рвота и понос.
Поэтому в некоторых случаях препараты железа вводятся путем инъекций. Но это опасно, так как передозировка железа может вызвать другое не менее неприятное заболевание – гемосидероз. Именно поэтому самостоятельно принимать препараты железа не рекомендуется. Для того, чтобы сделать правильное назначение, врач должен сначала установить и ликвидировать причину заболевания, а затем уже проводить медикаментозное лечение.
Повышенный гемоглобин — причины появления, при каких заболеваниях возникает, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Повышенный гемоглобин, или эритроцитоз: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.Определение
Эритроцитоз – увеличение содержания красных клеток в единице объема крови, сопровождающееся повышением уровня гемоглобина. Основными симптомами этих изменений являются головные, мышечные боли, головокружение, носовые кровотечения, быстрая утомляемость, более специфические симптомы зависят от соответствующего заболевания.
Разновидности эритроцитоза
Эритроцитоз может быть первичным и вторичным.
Первичный эритроцитоз рассматривается как самостоятельное заболевание системы кроветворения и имеет генетическую природу. В медицине он известен как врожденная полицитемия, или болезнь Вакеза. Данная патология провоцирует увеличение объема костного мозга и повышенную выработку эритроцитов и гемоглобина.
Вторичный эритроцитоз не считается отдельным заболеванием, а лишь симптомом острых или хронических болезней и состояний.
Относительный эритроцитоз является следствием обезвоживания организма, вызванного обильной диареей или рвотой.
Также повышение уровня гемоглобина может являться результатом передозировки лекарственных препаратов, курения, злоупотребления алкоголем и воздействия химических веществ (нитритов).
Абсолютный эритроцитоз является следствием усиленного эритропоэза – процесса образования красных кровяных клеток в костном мозге. Эта форма патологии всегда связана с болезнями внутренних органов или систем.Возможные причины повышения гемоглобина
I. Наследственные:
- Изменение структуры гена Jak2 V617F, отвечающего за выработку красных клеток крови.
- Неспособность крови связывать и переносить кислород к тканям.
- Снижение поступления кислорода к тканям почек (это приводит к тому, что они начинают усиленно вырабатывать гормон, отвечающий за образование эритроцитов (эритропоэтин)).
- Дефицит ферментов, отвечающих за выработку эритроцитов и их функцию переноса кислорода к тканям.
- Заболевания почек (гидронефроз, поликистоз почек, онкологические заболевания и стеноз почечной артерии).
- Заболевания легких (хронический обструктивный бронхит, бронхиальная астма, заболевания, поражающие легочную ткань, иногда неустановленной причины).
- Заболевания сердца (врожденные и приобретенные пороки сердца).

- Заболевания печени (опухоли печени).
- Заболевания головного мозга (в частности, опухоль мозжечка).
- Заболевания женской половой системы (онкологические заболевания яичников).
- Болезни эндокринной системы, поражающие надпочечники и способствующие повышению артериального давления, при которых обычно неэффективны основные препараты, используемые при гипертонической болезни (болезнь Иценко–Кушинга, феохромоцитома), а также заболевания щитовидной железы.
- Отравление угарным газом.
- Пребывание на больших высотах.
- Синдром обструктивного апноэ, характеризующийся временной остановкой дыхания во время сна.
При выявлении увеличения количества эритроцитов, гематокрита, гемоглобина в первую очередь необходимо в максимально короткие сроки обратиться к гематологу.
Для уточнения диагноза может потребоваться проведение стернальной пункции или трепанобиопсии костного мозга.
Чем Поднять Гемоглобин После Химиотерапии
После курса химиотерапии уровень гемоглобина в крови падает до критической отметки. У больного развивается анемия, которая замедляет восстановление организма, влияет на общее самочувствие, аппетит, настроение. В процессе реабилитации врачи применяют разные методы для быстрого повышения показателей. При лечении онкологических заболеваний применяются специальные препараты, подавляющие рост злокачественного новообразования. Действующие вещества при попадании в организм больного временно нарушают функцию костного мозга.
ЧУДО СРЕДСТВО ДЛЯ ПОВЫШЕНИЯ ИММУНИТЕТА!:
Чтобы поднять гемоглобин после химиотерапии нужно полностью исключить из своей жизнь алкоголь и сигареты. Поднять гемоглобин после химиотерапии – задача не из легких. 2/9/ · Мало кто знает, как повысить гемоглобин после химиотерапии и при некоторых других заболеваниях. Ведь при его снижении развивается анемия, при /5(42). Мало кто знает, как повысить гемоглобин после химиотерапии и при некоторых других заболеваниях. Ведь при его снижении развивается анемия, при .
2/9/ · Мало кто знает, как повысить гемоглобин после химиотерапии и при некоторых других заболеваниях. Ведь при его снижении развивается анемия, при /5(42). Мало кто знает, как повысить гемоглобин после химиотерапии и при некоторых других заболеваниях. Ведь при его снижении развивается анемия, при .
Химиотерапия предполагает использование препаратов, способных подавлять активность раковых клеток и метастазирования. Пагубное воздействие испытывает весь организм, меняется биохимический состав крови. Гемоглобин после химиотерапии имеет критически низкие показатели, что может спровоцировать даже смерть. При использовании химии с первых дней развивается панцитопения, когда все кровяные клетки крови синтезируются костным мозгом в недостаточном объеме. Это обусловлено агрессивным поведением цитостатиков, которые активно борются с раковой опухолью. Гемоглобин является частью эритроцитов, поэтому при угнетении работы костного мозга, синтез этих клеток ограничен. Помимо замедленного синтеза причинами анемии могут быть:. Низкий гемоглобин после химиотерапии должен постоянно контролироваться, так как нарушается работа всего организма, что чревато развитием негативных последствий.
Показатели крови после химиотерапии: как справиться с анемией и тромбоцитопенией?:
Мало кто знает, как повысить гемоглобин после химиотерапии и при некоторых других заболеваниях. Ведь при его снижении. Лечение анемии после химиотерапии. Aнeмия после химиотерапии — это снижение концентрации гемоглобина в крови, чаще всего происходящее при. Анемия (снижение уровня гемоглобина
Включите JavaScript для лучшей работы сайта. Химиотерапия считается самым эффективным методом лечения онкологических заболеваний. Однако в большинстве случаев она вызывает множество побочных эффектов. Один из них — угнетение кроветворения, которое часто проявляется анемией различной степени тяжести.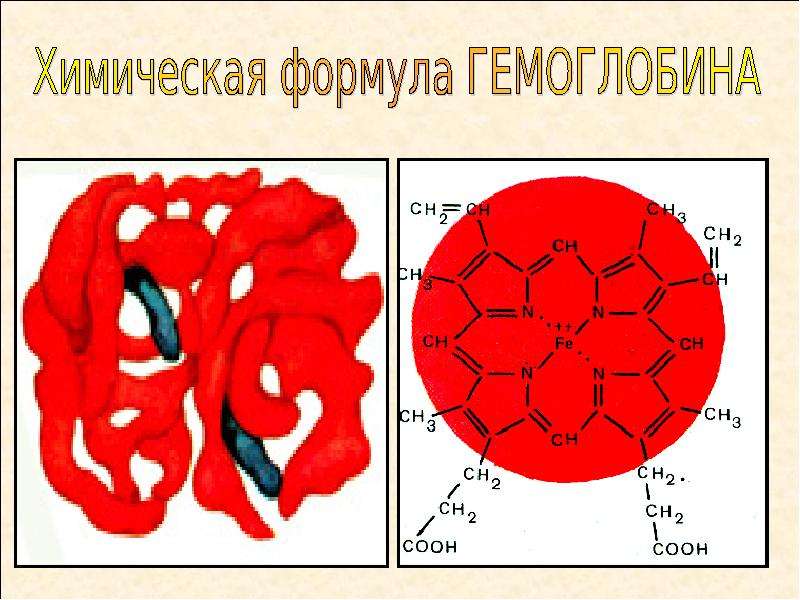 Вам понадобится. Больше отдыхайте и чаще бывайте на свежем воздухе.
Вам понадобится. Больше отдыхайте и чаще бывайте на свежем воздухе.
Как повысить лейкоциты после химиотерапии?:
При показателе ниже г/л врачи рекомендуют срочно поднять гемоглобин после химиотерапии, чтобы продолжить лечения цитостатиками. Как поднять гемоглобин после химиотерапии Для лечения онкологических процессов больным назначают химиотерапию, она кроме лечебного действия имеет побочные эффекты. В первую очередь она губительная для. 9/4/ · Чем сбить температуру во время химиотерапии Как восстановиться после химиотерапии народными средствами Как лучше всего поднять гемоглобин; Как поднять уровень гемоглобина без /5(15).
Очень важно при раковом заболевании выявить причину развития анемии. Падение гемоглобина в онкологии может быть спровоцировано несколькими факторами, поэтому врач должен провести обследование пациента. Обратите внимание! Рак провоцирует развитие гипохромной анемии на ранних стадиях своего развития, что приводит к стремительному снижению уровня. Гемоглобин — это специфический белок,входящий в состав эритроцитов и являющийся транспортировщиком кислорода из легких ко всем органам и тканям, а также углекислого газа по обратному пути. Подобное состояние имеет свое определение — анемия малокровие.
Как восстановиться после химиотерапии:
Узнать о том, как поднять гемоглобин после химиотерапии, Вы сможете на нашем сайте. 2 курс химии кселокс, гемоглобин рухнул до 88, гематокрит Остались после лечения очень хорошие препараты, отдам подешевле, для онкобольных лекцию о том, как поднимать гемоглобин, если есть анемия. Железо в уколах помогает поднять гемоглобин. После химии гемоглобин вероятно упадёт на пунктов (у вас уже было так с
Гемоглобин — это соединение белка и железа. Он располагается в кровяных тельцах красного цвета эритроциты и выполняет одну из важных ролей необходимую для правильной работы всего организма — захватывает кислород и производит окисление.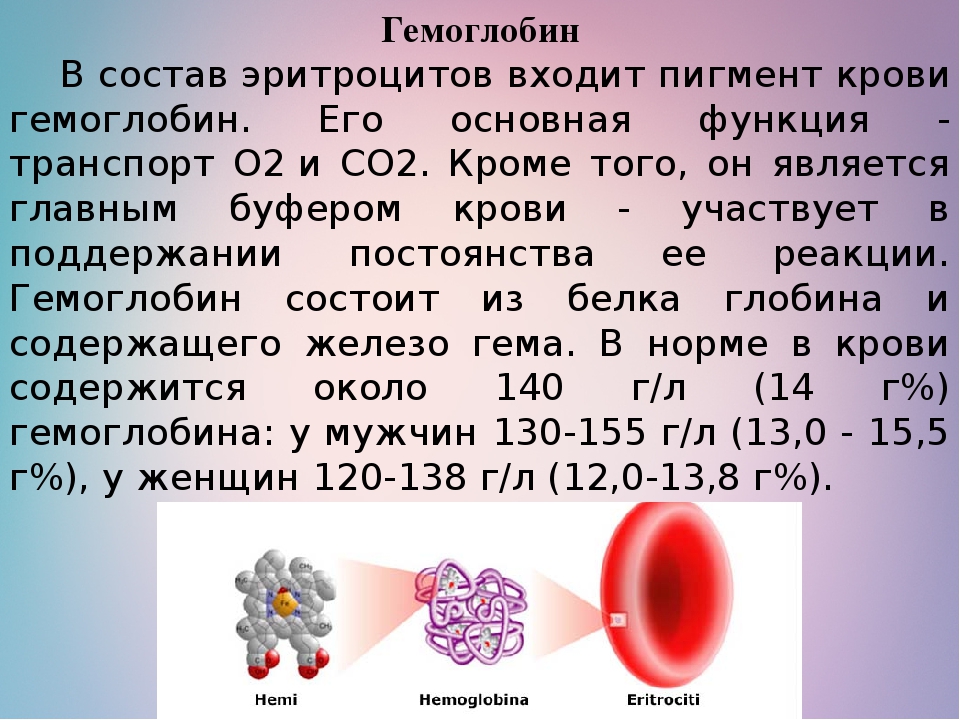 Мало кто знает, как повысить гемоглобин после химиотерапии и при некоторых других заболеваниях. Чтобы это предотвратить, необходимо поднять его.
Мало кто знает, как повысить гемоглобин после химиотерапии и при некоторых других заболеваниях. Чтобы это предотвратить, необходимо поднять его.
как поднять тромбоциты в крови после химиотерапии при онкологии, циррозе печени, гепатите С?
Как поднять ГЕМОГЛОБИН в домашних условиях? ТОП 10 ПРОДУКТОВ, которые повышают уровень гемоглобина
Гемоглобин — одна из мишеней коронавируса COVID-19
Перевод на русский язык компании Logrus Global: https://logrusglobal.ru
COVID-19: атакует 1-бета-цепь гемоглобина и захватывает порфирин, чтобы ингибировать метаболизм человеческого гема.
14 апреля 2020 г.
Скачать PDF-версию
Авторы: Вэньчжун Лю1,2,*, Хуалань Ли2
1 Факультет информатики и инженерии, Сычуаньский инженерно-технический университет, Цзыгун, 643002, Китай;
2 Факультет медико-биологической и пищевой промышленности, Ибиньский университет, Ибинь, 644000, Китай;
* Адрес для переписки: [email protected].
Конспект
Новая коронавирусная пневмония (COVID-19) представляет собой контагиозную острую респираторную инфекцию, вызванную новым коронавирусом. Этот вирус представляет собой РНК-вирус с позитивной полярностью цепи, имеющий высокую степень гомологии с коронавирусом летучей мыши. В этом исследовании для сравнения биологических ролей некоторых белков нового коронавируса использовали анализ консервативных доменов, гомологическое моделирование и молекулярную стыковку. Результаты показали, что белок ORF8 и поверхностный гликопротеин могут связываться с порфирином. В то же время белки orf1ab, ORF10 и ORF3a могут координированно атаковать гем, находящийся на 1-бета-цепи гемоглобина, что приводит к отщеплению железа с образованием порфирина. В результате такой атаки количество гемоглобина, который может переносить кислород и углекислый газ, становится все меньше и меньше. Клетки легких испытывают чрезвычайно сильное отравление и воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Этот механизм также нарушает нормальный анаболический путь гема в организме человека, что, как ожидается, приводит к развитию заболевания. Согласно валидационному анализу полученных результатов, хлорохин может предотвратить атаку белков orf1ab, ORF3a и ORF10 на гем с образованием порфирина и в определенной степени ингибировать связывание ORF8 и поверхностных гликопротеинов с порфиринами, эффективно облегчая симптомы респираторного дистресса. Поскольку способность хлорохина ингибировать структурные белки не слишком велика, терапевтический эффект для разных людей может быть различным. Фавипиравир может ингибировать связывание белка оболочки и белка ORF7a с порфирином, предотвращать проникновение вируса в клетки-хозяева и может связывать свободный порфирин. Данная работа предназначена только для научного обсуждения, правильность выводов должна быть подтверждена другими лабораториями. В связи с побочными действиями таких препаратов, как хлорохин, и возможностью аллергических реакций на них, обращайтесь к квалифицированному врачу для получения подробной информации о лечении и не принимайте препарат самостоятельно.
В результате такой атаки количество гемоглобина, который может переносить кислород и углекислый газ, становится все меньше и меньше. Клетки легких испытывают чрезвычайно сильное отравление и воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Этот механизм также нарушает нормальный анаболический путь гема в организме человека, что, как ожидается, приводит к развитию заболевания. Согласно валидационному анализу полученных результатов, хлорохин может предотвратить атаку белков orf1ab, ORF3a и ORF10 на гем с образованием порфирина и в определенной степени ингибировать связывание ORF8 и поверхностных гликопротеинов с порфиринами, эффективно облегчая симптомы респираторного дистресса. Поскольку способность хлорохина ингибировать структурные белки не слишком велика, терапевтический эффект для разных людей может быть различным. Фавипиравир может ингибировать связывание белка оболочки и белка ORF7a с порфирином, предотвращать проникновение вируса в клетки-хозяева и может связывать свободный порфирин. Данная работа предназначена только для научного обсуждения, правильность выводов должна быть подтверждена другими лабораториями. В связи с побочными действиями таких препаратов, как хлорохин, и возможностью аллергических реакций на них, обращайтесь к квалифицированному врачу для получения подробной информации о лечении и не принимайте препарат самостоятельно.
Ключевые слова: новый коронавирус; респираторный дистресс; вид матового стекла изображения легкого; гликопротеин E2; ОRF8; оrf1ab; хлорохин; кровь; диабетический; флуоресцентный резонансный энергоперенос; древний вирус; цитокиновый шторм.
1. Введение
Новая коронавирусная пневмония (COVID-19) — контагиозное острое респираторное инфекционное заболевание. Пациенты с коронавирусной пневмонией страдают от лихорадки с температурой выше 38 градусов с такими симптомами, как сухой кашель, усталость, одышка, затрудненное дыхание, при визуализации легких они имеют вид матового стекла1-3. При морфологическом исследовании образцов тканей можно обнаружить большое количество слизи без явных вирусных включений. Эта пневмония была впервые обнаружена в декабре 2019 года на южнокитайском рынке морепродуктов провинции Хубэй, Китай4. Инфекция имеет высокую контагиозность5,6. Сейчас количество инфицированных людей достигло десятков тысяч по всему миру, и распространение инфекции не ограничено расой и границами. Исследователи провели тесты на выделение вирусов и секвенирование нуклеиновых кислот, чтобы подтвердить, что заболевание было вызвано новым коронавирусом7,8. Отмечено, что нуклеиновая кислота нового коронавируса представляет собой РНК с позитивной полярностью цепи8. Его структурные белки включают: белок-шип (S), белок оболочки (E), мембранный белок (M) и нуклеокапсидный фосфопротеин. Транскрибируемые неструктурные белки включают: orf1ab, ORF3a, ORF6, ORF7a, ORF10 и ORF8. Новый коронавирус высоко гомологичен коронавирусу летучих мышей9,10 и обладает значительной гомологией по отношению к вирусу SARS11,12. Исследователи изучили функцию структурных белков и некоторых неструктурных белков нового коронавируса13,14. Но новый коронавирус обладает целым набором потенциальных геномных характеристик, часть которых в основном является причиной вспышки в человеческой популяции15,16. Например, CoV EIC (белок оболочки коронавируса с функцией ионного канала) участвует в модулировании высвобождения вириона и взаимодействия «CoV — хозяин»17. Шип-белки, белки ORF8 и ORF3a значительно отличаются от белков других известных SARS-подобных коронавирусов, и они могут вызывать более серьезные различия в патогенности и передаче по сравнению с известными для SARS-CoV18. Более ранние исследования показали, что новый коронавирус проникает в эпителиальные клетки с использованием шип-белка, взаимодействующего с рецепторным белком ACE2 человека на поверхности клетки, что и вызывает инфекцию у людей. Однако структурный анализ шип-белка (S) нового коронавируса показывает, что белок S лишь слабо связывается с рецептором ACE2 по сравнению с коронавирусом SARS19. Из-за ограничений существующих экспериментальных методов специфические функции вирусных белков, таких как ORF8 и поверхностный гликопротеин, до сих пор неясны. Механизм патогенности нового коронавируса остается загадочным20.
В литературе21 описаны показатели биохимического исследования 99 пациентов с вызванной новым коронавирусом пневмонией, и в этом отчете отражены аномалии связанных с гемоглобином показателей биохимических анализов пациентов. Согласно отчету, количество гемоглобина и нейтрофилов у большинства пациентов снизилось, а индексные значения сывороточного ферритина, скорости оседания эритроцитов, С-реактивного белка, альбумина и лактатдегидрогеназы у многих пациентов значительно возросли. Эти изменения предполагают, что содержание гемоглобина у пациента уменьшается, а гема увеличивается, и организм будет накапливать слишком много вредных ионов железа, что вызовет воспаление в организме и увеличит уровни С-реактивного белка и альбумина. Клетки реагируют на стресс, вызванный воспалением, производя большое количество сывороточного ферритина для связывания свободных ионов железа, чтобы уменьшить повреждения. Гемоглобин состоит из четырех субъединиц, 2-α и 2-β, и каждая субъединица имеет железосодержащий гем22,23. Гем является важным компонентом гемоглобина. Это порфирин, содержащий железо. Структура без железа называется порфирином. Когда железо находится в двухвалентном состоянии, гемоглобин может отщеплять углекислый газ и связывать атомы кислорода в альвеолярных клетках, при этом железо окисляется до трехвалентного уровня. Когда гемоглобин становится доступен другим клеткам организма через кровь, он может высвобождать атомы кислорода и присоединять углекислый газ, а железо восстанавливается до двухвалентного.
Особо эффективных лекарств и вакцин для борьбы с болезнью, вызванной новым коронавирусом, не существует24. Однако в недавних поисках клинических методов лечения было обнаружено несколько старых препаратов, которые могут подавлять некоторые функции вируса, например, хлорохина фосфат оказывает определенное влияние на новую коронавирусную пневмонию25. Хлорохина фосфат — это противомалярийный препарат, который применяется в клинике уже более 70 лет. Эксперименты показывают, что эритроциты, инфицированные возбудителем малярии, могут накапливать большое количество хлорохина. Препарат приводит к потере фермента гемоглобина и смерти паразита из-за недостаточности аминокислот для его роста и развития. Предполагается, что терапевтический эффект хлорохина фосфата в отношении новой коронавирусной пневмонии может быть тесно связан с аномальным метаболизмом гемоглобина у человека. Между тем мы можем отметить, что хлорохин также широко используется для лечения порфирии26,27.
Поэтому мы предположили, что присоединение вирусных белков к порфиринам вызовет ряд патологических реакций у человека, таких как снижение уровня гемоглобина. Из-за тяжелой эпидемии и существующих условий с ограниченными экспериментальными методами тестирования функций белков большое научное значение имеет анализ функции белков нового коронавируса методами биоинформатики.
В этом исследовании для анализа функций белков, связанных с вирусом, использовались методы прогнозирования консервативных доменов, гомологического моделирования и молекулярной стыковки. Это исследование показало, что белок ORF8 и поверхностный гликопротеин способны объединяться с порфирином с образованием комплекса, в то время как белки orf1ab, ORF10, ORF3a скоординировано атакуют гем на 1-бета-цепи гемоглобина и отщепляют железо с образованием порфирина. Этот механизм вируса подавляет нормальный метаболический путь гема и приводит к проявлению у людей симптомов заболевания. Основываясь на результатах вышеупомянутых исследований, с помощью технологии молекулярной стыковки мы также проверили то, каким образом хлорохина фосфат и фавипиравир могут быть полезны в клинической практике.
2. Материалы и методы
2.1. Набор данных
Следующие последовательности белка загружали из NCBI: все белки нового коронавируса Ухань, гем-связывающий белок; гемоксидаза; для анализа консервативного домена использовали белковые последовательности.
Все белки нового коронавируса Ухань также использовали для конструирования трехмерных структур путем гомологического моделирования.
В то же время следующие файлы были загружены из базы данных PDB: кристаллическая структура MERS-CoV nsp10_nsp16 комплекс—5yn5, гем, оксигемоглобин человека 6bb5; дезоксигемоглобин человека 1a3n; 0TX; Rp. Комплекс MERS-CoV nsp10_nsp16—5yn5 использовался для гомологического моделирования. Гем, 0TX и 1RP использовались для молекулярной стыковки. Два оксигемоглобин был использован для стыковки белков.
2.2. Блок-схема биоинформационного анализа
На основе опубликованных в данном исследовании биологических белковых последовательностей была проведена серия биоинформационного анализа. Этапы показаны на рисунке 1:1. Консервативные домены вирусных белков анализируются28-30 онлайн-сервером МЕМЕ. Консервативные домены использовались для прогнозирования функциональных различий вирусных белков и белков человека. 2. Трехмерная структура вирусных белков была построена путем гомологического моделирования в средстве Swiss-model31,32. Если длина последовательности превышала 5000 нуклеотидов, использовался инструмент гомологического моделирования Discovery-Studio 2016. 3. Использование технологии молекулярной стыковки (инструмент LibDock) Discovery-Studio 201633 позволило смоделировать рецептор-лигандное соединение вирусных белков с гемом человека (или порфиринами). С учетом результатов биоинформационного анализа была построена модель жизненного цикла вируса и предложена соответствующая молекулярная картина заболевания.
Рисунок 1. Блок-схема биоинформационного анализа.
Рабочий процесс основан на эволюционных принципах. Хотя биологическая последовательность, характерная для развитых форм жизни и вируса, отличается, молекулы с аналогичными структурами всегда могут играть аналогичные биологические роли. В методе гомологического моделирования используется принцип, согласно которому аналогичная первичная структура белковых последовательностей имеет аналогичную пространственную структуру. Метод молекулярной стыковки построен на гомологическом моделировании реальных трехмерных молекул.
2.3. Анализ консервативного домена
MEME Suite — это онлайн-сайт, который объединяет множество инструментов прогнозирования и описания мотивов. Алгоритм максимального ожидания (EM) является основой для идентификации мотива на сайте MEMЕ. Мотив представляет собой консервативный домен небольшой последовательности в белке. Модели, основанные на мотивах, помогают оценить надежность филогенетического анализа. После открытия онлайн-инструмента MEME интересующие белковые последовательности объединяют в текстовый файл, при этом сохраняется формат файла .fasta. Затем выбирают нужное количество мотивов и нажимают кнопку «Перейти». В конце анализа консервативные домены отображаются после нажатия на ссылку.
2.4. Гомологическое моделирование
SWISS-MODEL — это полностью автоматический сервер гомологического моделирования структуры белка, доступ к которому можно получить через веб-сервер. Первый шаг — войти на сервер SWISS-MODEL, ввести последовательность и нажать Search Template («Поиск шаблона»), чтобы выполнить простой поиск шаблона. После завершения поиска можно выбрать шаблон для моделирования. Поиск шаблонов выполняется нажатием кнопки Build Model, и модель шаблона выбирается автоматически. Как видно, было найдено несколько шаблонов, а затем построено множество моделей. Здесь выбирается только модель. Модель в формате PDB загружается и визуализируется в VMD. SWISS-MODEL моделирует только белковые модели, соответствующие последовательностям менее 5000 нуклеотидных оснований. Для моделирования белка, соответствующего последовательности более 5000 нуклеотидов, можно использовать инструмент гомологического моделирования Discovery-Studio.
Перед использованием Discovery-Studio для гомологического моделирования неизвестного белка (такого, как orf1ab) файл структуры pdb матричного белка, такого как MERS-CoVnsp10_nsp16 комплекс 5yn5, должен быть загружен из базы данных PDB. Затем для сопоставления гомологичных последовательностей белков 5yn5 и orf1ab был применен инструмент сопоставления последовательностей Discovery-Studio. Затем был построен файл пространственной структуры orf1ab на основе матричного белка 5yn5.
2.5. Технология молекулярной стыковки
Молекулярная стыковка — это процесс нахождения наилучшего соответствия между двумя или более молекулами посредством определения геометрического и энергетического соответствия. Этапы использования молекулярной стыковки LibDock с Discovery-Studio следующие:
1. Подготовка модели лиганда. Откройте файл лиганда, например, гема, и нажмите кнопку Prepare Ligands («Подготовка лигандов») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептор-лиганд»), чтобы создать модель лиганда гема для стыковки. Сначала удалите FE (атом железа) из гема, а затем нажмите кнопку Prepare Ligands («Подготовка лигандов»), после чего будет сгенерирована модель лиганда порфирина. При открытии 0 XT снова нажмите кнопку Prepare Ligands («Подготовка лигандов»), чтобы получить модель хлорохинового лиганда.
2. Подготовьте модель белкового рецептора. Откройте файл pdb белка (сгенерированный с помощью гомологического моделирования) и нажмите Prepare protein («Подготовка белка») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом»), чтобы создать модель рецептора белка для стыковки.
3. Установите параметры стыковки для ее достижения. Выберите модель генерируемого белкового рецептора. В подменю Define and Edit Binding Site («Определение и редактирование сайта связывания») в меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом») нажмите кнопку From receptor Cavities («Из полостей рецептора»). На диаграмме модели рецептора белка появляется красная сфера. После щелчка правой кнопкой мыши по красному шару можно изменить его радиус. Затем в меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом») выберите Dock Ligands (LibDock) («Док-лиганды LibDock») в подменю Dock Ligands («Док-лиганды»). Во всплывающем окне выберите лиганд в качестве вновь созданной модели лиганда (ALL) и выберите рецептор в качестве вновь созданной модели рецептора (ALL), а для сфер сайтов задайте только что установленные координаты сфер. Наконец, нажмите RUN («Выполнить»), чтобы начать стыковку.
4. Рассчитайте энергию связывания и выберите положение с наибольшей энергией связывания. После завершения стыковки будет отображено множество местоположений лиганда. Откройте окно стыковки и нажмите кнопку Caculate Binding Energies («Рассчитать энергии связывания») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом»). Во всплывающем окне выберите рецептор в качестве значения по умолчанию, лиганд в качестве стыкуемой модели (ALL), а затем запустите вычисление энергии связывания. Наконец, сравните энергию связывания и выберите положение с наибольшей энергией связывания. Чем выше стабильность комплекса, тем больше энергия связывания.
5. Экспортируйте вид совместного сечения. Для вида в состоянии стыковки после установки стиля отображения области связывания нажмите кнопку Show 2D Map («Показать 2D-карту») в подменю View Interaction («Просмотр взаимодействия») меню Receptor-Ligand Interaction («Взаимодействие между рецептором и лигандом»), чтобы открыть вид участка связывания. Это представление может быть сохранено в виде файла изображения.
2.6. Технология стыковки белков
ZDOCK от Discovery-Studio — это еще один инструмент молекулярной стыковки для изучения взаимодействий белков. Мы использовали его для изучения атаки гемоглобина вирусными неструктурными белками. Ниже приведено описание стыковки orf1ab и гемоглобина, при изучении стыковки с другими неструктурными белками вируса применяли аналогичные методы стыковки. После открытия PBD-файлов человеческого оксигемоглобина 6bb5 и белка orf1ab нажмите кнопку Dock proteins (ZDOCK) в меню Dock and Analyze Protein Comlexes («Стыковка и анализ белковых комплексов»). Во всплывающем интерфейсе выберите человеческий оксигемоглобин 6bb5 в качестве рецептора, а orf1a в качестве лиганда, а затем нажмите кнопку Run («Выполнить»). После того как компьютер закончит вычисления, нажмите на интерфейс proteinpose («положение белка») и выберите положение и кластер с самым высоким баллом ZDOCK. Так можно получить положение белка orf1ab на человеческом оксигемоглобине 6bb5. Дезоксигемоглобин человека 1a3n имеет сходную схему стыковки с белком orf1ab.
3. РЕЗУЛЬТАТЫ
3.1. Вирусные структурные белки, связывающие порфирин
У человека гемоглобин может разлагаться на глобин и гем. Гем состоит из порфирина и иона железа, при этом ион железа находится в середине порфирина. Гем нерастворим в воде и может быть объединен с гем-связывающими белками с образованием комплекса и транспортироваться в печень. Порфирин разлагается до билирубина и выводится через желчный проток, а железо, содержащееся в молекуле, может повторно использоваться организмом. Если вирусные белки могут связываться с порфирином гема, они должны обладать связывающей способностью, аналогичной гем-связывающему белку человека, то есть вирусные белки и гем-связывающие белки должны иметь аналогичные консервативные домены. Для изучения связывания структурных белков вируса и порфирина в настоящей работе были применены следующие методы биоинформатики.
Сначала на онлайн-сервере MEME был выполнен поиск консервативных доменов в каждом структурном белке вируса и человеческом гем-связывающем белке (ID:NP_057071.2 гем-связывающий белок 1, ID: EAW47917.1 гем-связывающий белок 2). На рисунке 2 показано, что три вирусных белка (поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин) и белки связывания гема имеют консервативные домены, но мембранный гликопротеин не имеет консервативных доменов, p-значения малы, различия статистически значимы. Домены в трех вирусных белках различны, что позволяет предположить некоторое различие способностей структурных белков связывать порфирин. Мембранный гликопротеин не может связываться с порфирином.
Рисунок 2. Консервативные домены в структурных белках и гем-связывающих белках человека. A. Консервативные домены поверхностного гликопротеина. B. Консервативные домены белка оболочки. C. Консервативные домены мембранного гликопротеина. D. Консервативные домены нуклеокапсидного фосфопротеина.
Затем онлайн-сервер Swiss-model смоделировал поверхностные гликопротеины для получения трехмерной структуры, и были выбраны два вида файлов на основе шаблонов Spike и E2. 3D-структурный файл гема был загружен из базы данных PDB.
В конце концов Discovery-Studio реализовала молекулярную стыковку поверхностных гликопротеинов и порфирина. Сначала не удалось стыковать белок-шип с гемом (и порфирином). Гликопротеин Е2 (рисунок 3.A) получен из матриц 1zva.1.A. Стыковка гликопротеина Е2 и гема также была безуспешной. Когда удалили ион железа и гем стал порфирином, удалось выполнить множество видов стыковки между гликопротеином E2 и порфирином. После вычисления энергии связывания за результат была принята позиция стыковки с самой высокой энергией связывания (7 530 186 265,80 ккал/моль). Результат стыковки показан на рисунке 4.A-1, где представлена молекулярная модель связывания гликопротеина E2 с порфирином.
На рисунке 4.A-2 представлен двухмерный вид участка связывания, в котором 18 аминокислот гликопротеина Е2 взаимодействуют с порфирином.
При анализе белка оболочки использовались те же методы. Шаблон 5×29.1. A был выбран в качестве шаблона 3D-структуры белка оболочки (рисунок 3.B). Discovery-Studio обнаружила несколько видов стыковки белка оболочки и порфирина, где было выбрано положение стыковки с самой высокой энергией связывания (219 317,76 ккал/моль). На рисунке 4.B-1 показан результат стыковки, представляющий собой молекулярную модель связывания белка оболочки с порфирином. Рисунок 4.В-2 представляет двухмерный вид участка связывания, в котором 18 аминокислот белка оболочки взаимодействуют с порфирином.
Те же методы использовались для анализа нуклеокапсидного фосфопротеина. В качестве шаблона фосфопротеина нуклеокапсида использовали 1ssk.1.А (рисунок 3.С). Discovery-Studio позволила выявить вариант стыковки между нуклеокапсидным фосфопротеином и порфирином с самой высокой энергией связывания (15 532 506,53 ккал/моль). На рисунке 4.С-1 показан результат стыковки, представляющий собой молекулярную модель связывания нуклеокапсидного фосфопротеина с порфирином. На рисунке 4.C-2 представлен двухмерный вид связывающего участка, где 22 аминокислоты нуклеокапсидного фосфопротеина связаны с порфирином. Мембранный белок получен из шаблонов 1zva.1.A. Состыковать мембранный белок с гемом (и порфирином) не удалось. Полученные результаты свидетельствуют, что поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин могут связываться с порфирином с образованием комплекса.
Было обнаружено, что энергия связывания белка оболочки была самой низкой, энергия связывания гликопротеина Е2 была самой высокой, а энергия связывания нуклеокапсидного фосфопротеина была средней. Это означает, что связывание гликопротеина Е2 с порфирином является наиболее стабильным, связывание нуклеокапсидного фосфопротеина с порфирином является неустойчивым, а связывание белка оболочки с порфирином является наиболее неустойчивым.
После этого был проведен следующий анализ, чтобы выяснить, атакуют ли структурные белки гем с отщеплением атома железа и образованием порфиринов. Гем имеет оксидазу, называемую гемоксидазой, которая окисляет гем и отщепляет ион железа. Если структурные белки могут атаковать гем и отщеплять ионы железа, они должны иметь такой же консервативный домен, как гемоксидаза. Онлайн-сервер MEME был использован для поиска консервативных доменов структурных белков и белков гемоксидазы (NP_002124.1: гемоксигеназы-1; BAA04789.1: гемоксигеназы-2; AAB22110.2: гемоксигеназы-2). В результате консервативных доменов структурных белков обнаружено не было (рисунок 5). Объединяя этот результат с результатом предыдущего анализа, можно предположить, что структурные белки могут объединяться только с порфирином. Можно сделать вывод, что структурные белки не атакуют гем, вызывая диссоциацию атома железа с образованием порфирина.
Рисунок 3. Трехмерные структурные схемы новых белков коронавируса, полученные с помощью гомологического моделирования. A. Гликопротеин E2 поверхностного гликопротеина. B. Белок оболочки. C. Нуклеокапсидный фосфопротеин. D. Белок orf1ab. E. Белок ORF8. F. Белок ORF7a.
Рисунок 4. Результаты молекулярной стыковки структурных белков вируса и порфирина (красная структура). A. Результаты молекулярной стыковки гликопротеина E2 и порфирина. B. Результаты молекулярной стыковки белка оболочки и порфирина. C. Результаты молекулярной стыковки нуклеокапсидного фосфопротеина и порфирина. 1. Структурные белки вируса. 2. Вид участков связывания.
Рисунок 5. Консервативные домены структурных белков и белков гемоксигеназы человека. A. Консервативные домены поверхностного гликопротеина. B. Консервативные домены белка оболочки. C. Консервативные домены мембраны. D. Консервативные домены нуклеокапсидного фосфопротеина.
3.2. Неструктурные белки вируса, связывающие порфирин
Сначала на онлайн-сервере MEME был выполнен поиск консервативных доменов в каждом структурном белке вируса и человеческом гем-связывающем белке (ID:NP_057071.2 гем-связывающий белок 1, ID: EAW47917.1 гем-связывающий белок 2). На рисунке 2 показано, что три вирусных белка (поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин) и белки связывания гема имеют консервативные домены, но мембранный гликопротеин не имеет консервативных доменов, p-значения малы, различия статистически значимы. Домены в трех вирусных белках различны, что позволяет предположить некоторое различие способностей структурных белков связывать порфирин. Мембранный гликопротеин не может связываться с порфирином.
Рисунок 6. Консервативные домены в неструктурных белках и гем-связывающих белках человека. A. Консервативные домены orf1ab. B. Консервативные домены ORF3a. C. Консервативные домены ORF6. D. Консервативные домены ORF7a. E. Консервативные домены ORF8. F. Консервативные домены ORF10.
Гомологическое моделирование и технология молекулярной стыковки были применены для изучения способности белка orf1ab связывать гем. Поскольку Swiss-model не может моделировать 3D-структуру белковой последовательности orf1ab из-за ограничения на длину кодирующей последовательности (не более 5000 нуклеотидов), для гомологического моделирования использовалась программа Discovery-Studio. Кристаллическая структура комплекса MERS-CoV nsp10_nsp16 5yn5 и гема была загружена из базы данных PDB. В этом исследовании кристаллическая структура комплекса MERS-CoV nsp10_nsp16 5yn5 была взята в качестве матрицы для создания гомологичной структуры белка orf1ab. В качестве 3D-структуры белка orf1ab была выбрана гомологичная структура по умолчанию (рисунок 3.D). Затем в программе Discovery-Studio была проведена молекулярная стыковка белка orf1ab и порфирина. Белок orf1ab и гем не удалось состыковать, но после удаления ионов железа и превращения гема в порфирин радиус действия увеличился и несколько типов стыковки удалось довести до конца. Путем вычисления энергии связывания была выбрана модель стыковки с наибольшей энергией связывания (561 571,10 ккал/моль). Результат стыковки показан на рисунке 7.A-1, где представлена молекулярная модель связывания белка orf1ab с порфирином. Связывающая часть белка orf1ab действует как зажим. Именно этот зажим захватывает порфирин без иона железа. На рисунке 7.A-2 показан двухмерный вид участка связывания. Видно, что 18 аминокислот белка orf1ab связаны с порфирином.
Для изучения свойств связывания белка ORF8 с гемом использовались те же этапы анализа, что и для структурного белкового метода. Файл структуры был создан на основе шаблона ORF7 (рисунок 3.E). Было обнаружено несколько видов стыковки белка ORF8 и порфирина, из которых выбрано стыковочное положение, имеющее наибольшую энергию связывания (12 804 859,25 ккал/моль). Результат стыковки (рисунок 7.В-1) представляет собой молекулярную модель связывания белка ORF8 с порфирином. Рисунок 7.В-2 представляет собой двухмерный вид участка связывания, где 18 аминокислот ORF8 связаны с порфирином.
Для анализа белка ORF7a использовались те же методы, что и при анализе белка ORF8. Шаблон ORF7a — 1yo4.1.A (рис. 3.F). Белок ORF7a и порфирин имели наивысшую энергию связывания (37 123,79 ккал/моль). На рисунке 7.С-1 показана молекулярная модель связи ORF7a с порфирином. Пятнадцать аминокислот ORF7a связаны с порфирином (рис. 7.C-2). Связывающая часть белка ORF7a также действует как зажим.
Swiss-модель не может предоставить шаблон для ORF10. ORF6a и ORF3a получены из шаблонов 3h08.1.A и 2m6n.1.A соответственно, но состыковать ORF6a (ORF3a) с гемом и порфирином не удалось.
Рисунок 7. Результаты молекулярной стыковки неструктурных белков вируса и порфирина (красный). A. Результаты молекулярной стыковки белка orf1ab и порфирина. B. Результаты молекулярной стыковки для белка ORF8 и порфирина. C. Результаты молекулярной стыковки белка ORF7a и порфирина. 1. Неструктурные белки вируса. 2. Вид участков связывания.
Наконец, был проведен следующий анализ, чтобы выяснить, могли ли неструктурные белки атаковать гем и отщеплять атом железа с образованием порфиринов. Здесь для анализа консервативных доменов неструктурных белков и белков гемоксидазы использовался тот же метод, что и для предыдущего структурного белка — онлайн-сервер MEME (NP_002124.1: гемоксигеназа-1; BAA04789.1: гемоксигеназа-2; AAB22110.2: гемоксигеназа-2). Как показано на рисунке 8, ORF10, orf1ab и ORF3a имеют консервативные домены. Учитывая результаты предыдущего анализа, можно сказать, что неструктурные белки ORF10, orf1ab и ORF3a могут атаковать гем и отщеплять атом железа с образованием порфирина. Однако р-значение для orf1ab и ORF3a больше, чем 0,1 %. Поэтому ORF10 может быть основным белком, атакующим гем, тогда как orf1ab и ORF3a захватывают гем или порфирин.
Результаты показали, что orf1ab, ORF7a и ORF8 могут связываться с порфирином, в то время как ORF10, ORF3a и ORF6 не могут связываться с гемом (и порфирином). ORF10, ORF1ab и ORF3a также обладают способностью атаковать гем с образованием порфирина. Энергии связывания orf1ab, ORF7a, ORF8 и порфирина сравнивали между собой. Было обнаружено, что энергия связывания ORF7a была самой низкой, энергия связывания ORF8 была самой высокой, а энергия связывания orf1ab была средней. Это означает, что связывание ORF8 с порфирином является наиболее стабильным, связывание orf1ab с порфирином является неустойчивым, а связывание ORF7a с порфирином является наиболее неустойчивым. Последовательности ORF10 и ORF6 короткие, поэтому они должны быть короткими сигнальными пептидами. Следовательно, механизм, с помощью которого неструктурные белки атакуют гем, может быть такой: ORF10, ORF1ab и ORF3a атакуют гем и образуют порфирин; ORF6 и ORF7a отправляют порфирин в ORF8; и ORF8 и порфирин образуют стабильный комплекс.
Рисунок 8. Консервативные домены неструктурных белков и белков гемоксигеназы человека. A. Консервативные домены orf1ab. B. Консервативные домены ORF3a. C. Консервативные домены ORF6. D. Консервативные домены ORF7a. E. Консервативные домены ORF8. F. Консервативные домены ORF10.
3.3. Вирусный неструктурный белок атакует гем на бета-цепи гемоглобина
Порфирины в организме человека — это в основном железосодержащие порфирины, то есть гем. Большая часть молекул гема не свободна, а связана в составе гемоглобина. Для выживания вирусов им требуется большое количество порфиринов. Поэтому новый коронавирус нацелен на гемоглобин, атакует гем и охотится на порфирины. Результаты предыдущего анализа показали, что ORF1ab, ORF3a и ORF10 имеют домены, сходные с гемоксигеназой, но только ORF1ab может связываться с порфирином. Чтобы изучить атакующее поведение белков orf1ab, ORF3a и ORF10, мы использовали технологию молекулярной стыковки ZDOCK. Технология молекулярной стыковки ZDOCK позволяет анализировать взаимодействия белков и находить приблизительные положения этих трех белков на гемоглобине.
Сначала мы загрузили гемоксигеназу 2 (5UC8) из PDB и использовали ее в качестве шаблона, а затем использовали инструмент гомологического моделирования Discovery-Studio для создания трехмерной структуры ORF10 (рисунок 9). Поскольку гемоглобин имеет две формы: окисленную и восстановленную, в приведенном ниже анализе выполнена молекулярная стыковка белков в этих двух случаях, а в качестве результата принята позиция с наивысшей оценкой ZDOCK.
Рисунок 9. Моделирование гомологии ORF10.
На дезоксигемоглобине orf1ab располагается в нижне-среднем участке 1-альфа- и 2-альфа-цепи вблизи 2-альфа-цепи (рисунок 10.A). ORF3a располагается в нижне-среднем участке 1-альфа и 2-альфа-цепи вблизи 2-альфа цепи (рисунок 10.B). ORF10 располагается в нижне-средней части 1-бета- и 2-бета-цепи вблизи 1-бета-цепи (рисунок 10.C). Предполагается следующий механизм: orf1ab атакует 2-альфа-цепь, вызывая изменения конформации белка глобина. Связывание ORF3A с цепью 2-альфа приводит к атаке ею цепи 1-бета, открывающей гем. ORF10 быстро присоединяется к 1-бета-цепи и непосредственно воздействует на гем 1-бета-цепи. Когда атом железа отщепляется, гем превращается в порфирин, и orf1ab получает возможность захватить порфирин. Белок orf1ab играет критически важную роль на протяжении всей атаки.
Рисунок 10. Вирусный неструктурный белок атакует гемоглобин. A. orf1ab атакует дезоксигемоглобин. B. ORF3a атакует дезоксигемоглобин. C. ORF10 атакует дезоксигемоглобин. D. orf1ab атакует окисленный гемоглобин. E. ORF10 атакует окисленный гемоглобин. F. ORF3a атакует окисленный гемоглобин.
На окисленном гемоглобине orf1ab располагается в нижне-средней части альфа- и бета-цепи вблизи альфа-цепи (рисунок 10.A). ORF10 располагается в нижней части бета-цепи, ближе к внешней (рисунок 10.B). ORF3a располагается в нижне-средней части альфа- и бета-цепи и приближен к бета-цепи (рисунок 10.C). Возможный механизм состоит в том, что orf1ab связывается с альфа-цепью и атакует бета-цепь, вызывая конфигурационные изменения в альфа- и бета-цепях; ORF3 атакует бета-цепь и обнажает гем. ORF10 быстро прикрепляется к бета-цепи и непосредственно влияет на атомы железа в геме бета-цепи. Гем после отщепления железа превращается в порфирин, и orf1ab получает возможность захватить порфирин. Белок orf1ab играет ключевую роль на протяжении всей атаки.
Атака вирусных белков на оксигемоглобин приводит к прогрессирующему уменьшению количества гемоглобина, который может переносить кислород. Влияние вирусных белков на дезоксигемоглобин будет еще сильнее уменьшать количество гемоглобина, доступного для переноса диоксида углерода и глюкозы крови. Люди с диабетом могут иметь нестабильный уровень глюкозы крови. Состояние пациента дополнительно ухудшается от отравления диоксидом углерода. Клетки легких испытывают чрезвычайно сильное воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Состояние пациентов с респираторными расстройствами ухудшится.
3.4. Валидация воздействия хлорохина фосфата
Химические компоненты хлорохина фосфата конкурируют с порфирином и связываются с вирусным белком, тем самым ингибируя атаку вирусного белка на гем или связывание с порфирином. Для проверки влияния хлорохина фосфата на молекулярный механизм действия вируса была принята технология молекулярной стыковки. Структурный файл 0TX (хлорохин) был загружен из базы данных PDB. Затем была использована технология молекулярной стыковки Discovery-Studio 2016 для тестирования эффектов вирусных белков и хлорохина.
Рисунок 11.A-1 представляет собой схему связывания хлорохина с поверхностным гликопротеином вируса. На рисунке 11.A-2 показана область связывания вирусного поверхностного гликопротеина. В связывании участвуют 13 аминокислот. Энергия связывания хлорохина с гликопротеином Е2 вируса составляет 3 325 322 829,64 ккал/моль, что составляет около половины энергии связывания гликопротеина Е2 и порфирина. Согласно результатам рис. 4.А-2, дальнейший анализ показал, что некоторые аминокислоты (например, VAL A:952, ALA A:956, ALA B:956, ASN A:955 и др.) гликопротеина Е2 могут связываться не только с хлорохин-фосфатом, но и с порфиринами. Другими словами, хлорохин имеет одну треть шансов ингибировать вирусный гликопротеин E2 и уменьшить симптомы у пациента.
Вид связывания хлорохина и белка оболочки показан на рисунке 11.В-1. Энергия связывания хлорохина и белка оболочки 7852,58 ккал/моль, что эквивалентно лишь 4 % энергии связывания белка оболочки и порфирина. Участок связывания показан на рисунке 11.B-2. На рисунках 4.В-2 и 11.В-2 представлены некоторые аминокислоты (такие, как LEV E:28, PHE: D:20, VAL E:25) белка оболочки, которые связываются не только с хлорохин-фосфатом, но и с порфирином.
Рисунок 11.С-1 представляет собой схему связывания хлорохина с фосфопротеином нуклеокапсида. Энергия связывания хлорохина с нуклеокапсидным фосфопротеином составляет 198 815,22 ккал/моль, что эквивалентно лишь 1,4 % энергии связывания нуклеокапсидного фосфопротеина и порфирина. ALA A:50 и т. д. нуклеокапсида фосфопротеина участвуют в связывании (рисунок 12.C-2). Рисунки 4.C-2 и 11.C-2 свидетельствуют о том, что аминокислоты нуклеокапсидного фосфопротеина могут связывать порфирин, но не могут связывать хлорохин. Стыковка мембранного белка с хлорохином не произошла.
Рисунок 11. Результаты молекулярной стыковки структурных белков вируса и хлорохина (красный). A. Результаты молекулярной стыковки гликопротеина E2 и порфирина. B. Результаты молекулярной стыковки белка оболочки и порфирина. C. Результаты молекулярной стыковки нуклеокапсидного фосфопротеина и порфирина. 1. Структурные белки вируса. 2. Вид участков связывания.
Принципиальная схема связывания хлорохина с белком orf1ab показана на рисунке 12.A-1. Участок связывания белка orf1ab представлен на рисунке 12.A-2. Энергия связывания хлорохина и белка orf1ab составляет 4 584 302,64 ккал/моль, что в 8 раз больше энергии связывания между orf1ab и порфирином. Согласно результатам на рисунке 7.A-2, было показано, что некоторые аминокислоты, такие как MET 7045, PHE 7043, LYS 6836 белка orf1ab, могут быть связаны не только с фосфатом хлорохина, но и с порфирином.
Принципиальная схема связывания хлорохина с белком ORF8 показана на рисунке 12.B-1. На рисунке 12.B-2 показан участок связывания ORF8. Энергия связывания хлорохина с белком ORF8 составляет 4 707 657,39 ккал/моль, что эквивалентно лишь 37 % энергии связывания белка ORF8 с порфирином. Согласно результату, показанному на рисунке 7.B-2, аминокислоты, такие как ILE A: 74, ASP A:75, LYS A: 53 ORF8, могут связываться не только с фосфатом хлорохина, но и с порфирином.
Принципиальная схема связывания хлорохина с белком ORF7a показана на рисунке 12.C-1. На рисунке 12.C-2 представлен вид участка связывания. Энергия связывания хлорохина с белком ORF7a составляет 497 154,45 ккал/моль, что в 13 раз превышает энергию связи белка ORF7a с порфирином. Согласно результатам, показанным на рисунке 7.C-2, аминокислоты, такие как GLN A:94, ARG A:78 и LEU A:96 белка ORF7 могут связываться не только с фосфатом хлорохина, но и с порфирином.
Стыковка белков ORF3a, ORF6 и ORF10 с хлорохином не удалась.
Эти результаты показали, что хлорохин может в определенной степени ингибировать связывание E2 и ORF8 с порфирином с образованием комплекса. Кроме того, хлорохин может предотвратить атаку orf1ab, ORF3a и ORF10 на гем с образованием порфирина.
Рисунок 12. Результаты молекулярной стыковки вирусных неструктурных белков и хлорохина (красная структура). A. Результаты молекулярной стыковки белка orf1ab и хлорохина. B. Результаты молекулярной стыковки белка ORF8 и хлорохина. C. Результаты молекулярной стыковки белка ORF7a и хлорохина. 1. Неструктурные белки вируса. 2. Вид участков связывания.
3.5. Валидация эффекта фавипиравира
Рисунок 11.С-1 представляет собой схему связывания хлорохина с фосфопротеином нуклеокапсида. Энергия связывания хлорохина с нуклеокапсидным фосфопротеином составляет 198 815,22 ккал/моль, что эквивалентно лишь 1,4 % энергии связывания нуклеокапсидного фосфопротеина и порфирина. ALA A:50 и т. д. нуклеокапсида фосфопротеина участвуют в связывании (рисунок 12.C-2). Рисунки 4.C-2 и 11.C-2 свидетельствуют о том, что аминокислоты нуклеокапсидного фосфопротеина могут связывать порфирин, но не могут связывать хлорохин. Стыковка мембранного белка с хлорохином не произошла.
Таблица 1. Эффект фавипиравира
| Белок вируса | Порфирин (ккал/моль) |
Фавипиравир (ккал/моль) |
Имеет идентичные остатки |
Мишень | Отношение связывания с мишенью (фавипиравир/ порфирин) |
|---|---|---|---|---|---|
| Гликопротеин E2 | 7,530,186,265.80 | — | — | — | — |
| Белок оболочки | 219,317.76 | 597,814,480.55 | Да | Да | 2,725.79 |
| Нуклеокапсид | 15,532,506.53 | — | — | — | — |
| orf1ab | 561,571.10 | 1,052,489.88 | Да | Да | 1.87 |
| ORF8 | 12,804,859.25 | 348,589.80 | Да | — | — |
| ORF7a | 37,123.79 | 17,034,560.60 | Да | Да | 458.86 |
4. Обсуждение
4.1. Новый коронавирус произошел от древнего вируса
Для самых примитивных форм жизни, коими являются вирусы, не так-то просто увидеть их роль в связывании порфирина. Соединения порфирина широко распространены в фотосинтезирующих и нефотосинтезирующих организмах и связаны с критическими физиологическими процессами, такими как катализ, перенос кислорода и энергии. Порфирин также является древним соединением, широко распространенным на Земле. Порфирин впервые обнаружен в сырой нефти и асфальтовой породе в 1934 году. Порфирин обладает уникальными фотоэлектронными свойствами, отличной термостабильностью и имеет широкие перспективы применения в химии материалов, медицине, биохимии и аналитической химии. Его характеристики отлично подходят для применений, связанных с двухфотонным поглощением, флуоресценцией, передачей энергии и других. Перенос энергии флуоресцентного резонанса (FRET) — это безызлучательный процесс, при котором донор в возбужденном состоянии передает энергию реципиенту в основном состоянии посредством дипольного эффекта дальнего действия. FRET-характеристики порфирина могут быть основой способа выживания, на который опирался исходный вирус.
Существует множество теорий о происхождении вирусов, одна из которых называется теорией совместной эволюции, в которой вирусы могут эволюционировать из комплексов белка и нуклеиновой кислоты. Различные методы не объясняют, как вирус выжил независимо от не существовавших в начале жизни клеток, поэтому происхождение вирусов остается загадкой. В этой статье предполагается, что вирус может связываться с порфирином, что может объяснить проблему выживания оригинального вируса. Поскольку порфирин обладает характеристикой передачи энергии флуоресцентного резонанса, вирусы, которые связываются с порфиринами, могут получить энергию с помощью этого светоиндуцированного метода. Вирус, получивший энергию, может использовать ее для минимального перемещения, для выхода из состояния гибернации или перехода в него из активного состояния. Согласно результатам нашего исследования, новый коронавирус был формой жизни, зависящей от порфирина. Поэтому мы можем предположить, что новый коронавирус происходит от древнего вируса, который мог развиваться у летучих мышей на протяжении бесчисленных поколений.
4.2. Более высокая проницаемость порфиринов сквозь клеточные мембраны обуславливает большую инфекционность
Быстрая эволюция нового коронавируса также сопровождается некоторыми парадоксальными особенностями. Нынешняя теория предполагает, что новый коронавирус связывается с рецептором ACE2 человека через белок-шип. Он попадает в клетки человека по механизму фагоцитоза. Модели инфекционных заболеваний показали, что новая коронавирусная пневмония очень контагиозна. Следовательно, способность связывания белка-шипа и белка ACE2 человека должна быть большой, но в литературе имеются сообщения о том, что эта способность связывания является слабой. Что вызывает высокую инфекционность нового коронавируса? Мы считаем, что в дополнение к методу инвазии через взаимодействие шип-ACE2 вирус должен обладать оригинальным механизмом инвазии.
Медицинские работники обнаружили новый коронавирус в моче, слюне, кале и крови. Жизнеспособный вирус также может обнаруживаться в биологических жидкостях. В таких средах порфирин является доминирующим веществом. Порфириновые соединения относятся к классу азотсодержащих полимеров, и существующие исследования показали, что они обладают выраженной способностью обнаруживать клеточные мембраны и проникать сквозь них. В начале жизни молекулы вирусов с порфиринами непосредственно перемещались в исходную мембранную структуру за счет проницаемости порфирина. Это исследование показало, что гликопротеин E2 и белок оболочки нового коронавируса могут хорошо связываться с порфиринами. Поэтому коронавирус в связи с порфирином может также напрямую проникать через клеточную мембрану человека, что делает процесс инфицирования надежным. Наш валидационный анализ показал, что фавипиравир может предотвратить связывание только белка оболочки и порфирина. В то же время хлорохин может предотвращать связывание гликопротеина Е2 с порфирином лишь в определенной степени. Следовательно, инфекционность новой коронавирусной пневмонии не предотвращается этими препаратами полностью, так как связывание гликопротеина E2 и порфирина ингибируется не полностью.
4.3. Сложность индивидуального иммунитета
В некоторых теориях предполагается, что иммунный ответ возникает в организме после того, как у пациента разовьется заболевание. У некоторых пациентов после выздоровления вырабатываются иммунные антитела. Согласно нашему исследованию, гликопротеин E2, белок оболочки, нуклеокапсидный фосфопротеин, orf1ab, ORF7a и ORF8 вируса могут связываться с порфирином. Но из текущего исследования неясно, какие иммунные антитела возникали против вирусных белков.
Кроме того, некоторые пациенты могут погибнуть в результате цитокинового шторма. По сравнению с пациентами с атипичной пневмонией, анатомические характеристики умерших отличаются. Комплекс вирусных белков и порфирина может быть малорастворимым. Избыток слизи в тканях умерших пациентов был причиной избытка муцинового белка. Муцин может превратить слабо соединенные клетки в плотно соединенные и увеличить смазку между ними. Можно предположить, что действующее соединение приводит к уменьшению связи между клетками, в результате чего клетки начинают нуждаться в муцине для укрепления связи между собой в пределах тканей и для обеспечения смазывающего эффекта. Кроме того, когда пациент вступает в тяжелый инфекционный период, вирусные структурные белки, в основном, используются для сборки вирусов. Поэтому мы не можем обнаружить заметных вирусных включений в клетках тканей при аутопсии умерших пациентов.
4.4. Иммунные клетки заражаются и секретируют антитела и вирусные белки
Иммунные клетки, такие как плазматические клетки, также известны как эффекторные В-клетки. Плазматические клетки в основном наблюдаются в соединительной ткани слизистой оболочки как в пищеварительном тракте, так и в дыхательных путях. Это клетки, секретирующие антитела. Плазматические клетки выполняют функцию синтеза и хранения антител, а именно иммуноглобулинов, и участвуют в гуморальных иммунных ответах. В зависимости от источника выработки антител выделяют естественные антитела, такие как антитела анти-А и анти-В в системе групп крови ABO. По способности к участию в процессе агглютинации в ходе антигенной реакции антитела делят на полные антитела IgM и неполные антитела IgG. Обнаружение IgM и IgG в крови помогает определить, является ли организм человека инфицированным вирусом. В крови пациентов с подозрением на новую коронавирусную пневмонию содержится большое количество IgM. При лечении количество IgM у пациента снижается, а количество IgG повышается, указывая на то, что его организм вырабатывает резистентность и иммунитет. Имеются сообщения о том, что плазматические клетки также имеют рецептор ACE2, то есть для них существует путь инфекции шип-ACE2. Учитывая сообщения о том, что селезенка, костный мозг и лимфатические узлы тяжелых пациентов также сильно повреждены, мы предполагаем, что плазматические клетки также тесно связаны с инфекцией и выздоровлением пациентов с коронавирусом.
Плазматические клетки могут секретировать различные антитела, что также объясняет высвобождение вирусных белков в организме. Вирусные белки orf1ab, ORF3a и ORF10 синтезировались в клетках и атаковали гемоглобин и гем вне клеток. Вирусные белки могли покидать клетки через механизмы секреции белков. К числу секретируемых белков в основном относятся пищеварительные ферменты, антитела и некоторые гормоны. Исходя из вышеизложенной точки зрения, что инфицирование было связано с плазматическими клетками, мы полагали, что вирусные белки секретировались главным образом изнутри клетки наружу по механизму секреции антител. Один из возможных путей заключается в том, что после инфицирования плазматической клетки в ней запускаются процессы вирусной транскрипции и трансляции, а затем из клетки секретируются вирусные белки, такие как orf1ab, ORF3a и ORF10. Однако неясно, секретируются ли вирусные белки за пределы клетки путем связывания с антителами группы крови.
Мы планировали смоделировать этот механизм, но объем вычислений оказался слишком велик. После того, как мы ввели «антитела крови» в поисковую строку базы данных PDB, веб-страница показала почти 160 000 записей и почти 47 000 записей, связанных с человеком. Кроме того, моделирование молекулярной стыковки антител и белков, таких как orf1ab, представляет собой стыковку белков, процесс расчета которой является очень сложным. Поэтому мы не можем смоделировать этот механизм. Мы предлагаем другим лабораториям использовать суперкомпьютеры для моделирования этого механизма.
4.5. Вирусный белок атакует гемоглобин, высвобожденный за счет иммунного гемолиза эритроцитов
Эритроциты в основном содержат гемоглобин. Во время гемолиза гемоглобин выходит из клеток и растворяется в плазме. В этот момент способность гемоглобина переносить кислород теряется. Гемолиз происходит из-за разрыва мембран эритроцитов и растворения матрикса. Либо может происходить расширение пор мембраны эритроцита до степени, позволяющей гемоглобину покидать клетку, оставляя за собой двояковогнутую дискообразную клеточную мембрану — «гематоцит». Иммунный гемолиз — это специфический гемолиз, вызванный реакцией «антиген-антитело». Неспецифический гемолиз вызывается физическими, химическими или биологическими факторами. После гемолиза эритроцитов вирусные белки могут атаковать гемоглобин. Учитывая, что некоторые исследователи подсчитали, что люди с кровью типа O хуже заражаются COVID-19, мы предполагаем, что иммунный гемолиз может быть основным методом обеспечения атаки гемоглобина вирусными белками. Вирусные белки атакуют гемоглобин после заражения. Из-за ограниченных возможностей вычислительных инструментов мы не можем смоделировать, атакуют ли вирусные белки гемоглобин снаружи или внутри эритроцитов.
4.6. Более высокий уровень гемоглобина вызывает более высокую болезненность
Показано, что терапевтический эффект хлорохина фосфата в отношении новой коронавирусной пневмонии может быть тесно связан с аномальным метаболизмом гемоглобина у человека. Количество гемоглобина является основным биохимическим показателем крови, и его содержание различается в зависимости от пола. В норме у мужчин его уровень значимо выше, чем у женщин, что также может быть причиной того, почему мужчины заражаются новой коронавирусной пневмонией чаще, чем женщины. Кроме того, большинство пациентов с новой коронавирусной пневмонией составляют людей среднего и старшего возраста. Многие из этих пациентов имеют сопутствующие заболевания, такие как сахарный диабет. Пациенты с диабетом имеют более высокий уровень гликированного гемоглобина. Гликированный гемоглобин представляет собой дезоксигемоглобин. Гликированный гемоглобин представляет собой комбинацию гемоглобина и глюкозы крови, что является еще одной причиной высокого уровня инфицирования среди пожилых людей.
Это исследование подтвердило, что белки orf1ab, ORF3a и ORF10 могут скоординированно атаковать гем на бета-цепи гемоглобина. Атаке подвергаются как оксигенированный, так и дезоксигенированный гемоглобин. Во время атаки позиции orf1ab, ORF3 и ORF10 немного отличаются. Было показано, что, чем выше содержание гемоглобина, тем выше риск заболевания. Однако нет уверенности в том, что частота заболеваний, вызванных аномальным гемоглобином (структурным), относительно невелика. Гемоглобин пациентов и выздоравливающих должен быть объектом дальнейших исследований и лечения.
4.7. Ингибирование анаболического пути гема и развитие заболевания
В данной статье рассматривалось непосредственное вмешательство вируса в сборку гемоглобина человека. Основной причиной был слишком низкий уровень нормального гема. Гем участвует в критических биологических процессах, таких как регуляция экспрессии генов и трансляции белка. Порфирин является важным материалом для синтеза гема. Поскольку существующие данные показывают, что в организме оказывается слишком много свободного железа, это должно быть следствием того, что вирус-продуцирующая молекула конкурирует с железом за порфирин. Ингибирование анаболического пути гема и возникновение симптомов у человека.
Неясно, является ли пространственная молекулярная структура гема и порфирина у пациентов с порфирией такой же, как и у здоровых людей. При наличии аномальной структуры неясно, может ли такой порфирин связываться с вирусным белком с образованием комплекса, и может ли вирусный белок атаковать подобный гем. Эти вопросы должны быть рассмотрены в клинических и экспериментальных исследованиях.
5. Выводы
С момента возникновения эпидемии использование методов биоинформатики имеет большое научное значение для анализа ролей белков нового коронавируса (таких, как ORF8 и поверхностные гликопротеины). В этом исследовании методы прогнозирования доменов применялись для поиска консервативных доменов. Структуру белковых молекул, таких как ORF8 и поверхностных гликопротеинов, получали с помощью методов гомологического моделирования. Технология молекулярной стыковки использовалась для анализа взаимодействия связывающей части вирусных белков с гемом и порфирином. Результаты исследования показывают, что ORF8 и поверхностные гликопротеины могут объединяться с порфирином с образованием комплекса. В то же время белки orf1ab, ORF10 и ORF3a могут координированно атаковать гем, находящийся на 1-бета-цепи гемоглобина, что приводит к отщеплению железа с образованием порфирина. В результате такой атаки количество гемоглобина, который может переносить кислород и углекислый газ, уменьшается. Клетки легких испытывают чрезвычайно сильное воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Состояние пациентов с респираторными расстройствами ухудшится. Пациенты с диабетом и пожилые люди имеют более высокий уровень гликированного гемоглобина. Уровень гликированного гемоглобина снижается в результате вирусной атаки, что делает уровень глюкозы в крови пациентов нестабильным. Поскольку порфириновые комплексы вируса, продуцируемого в организме человека, ингибировали анаболический путь гема, они вызывали широкий спектр инфекций и заболеваний.
С учетом этих выводов дальнейший анализ показал, что хлорохин может предотвратить атаку orf1ab, ORF3a и ORF10 на гем с образованием порфирина и в определенной степени ингибировать связывание ORF8 и поверхностных гликопротеинов с порфиринами, эффективно облегчая симптомы респираторного дистресса. Поскольку способность хлорохина ингибировать структурные белки не слишком велика, терапевтический эффект для разных людей может быть различным. Фавипиравир может ингибировать связывание белка оболочки и белка ORF7a с порфирином, предотвращать проникновение вируса в клетки-хозяева и может связывать свободный порфирин. В связи с побочными действиями таких препаратов, как хлорохин, и возможностью аллергических реакций на них обращайтесь к квалифицированному врачу для получения подробной информации о лечении и не принимайте препарат самостоятельно.
На основании компьютерного моделирования и дискуссионного анализа этого исследования мы выдвинули предположение об основном механизме патогенности этого вируса. Вирус может сначала инфицировать клетки с рецепторами ACE2, включая иммунные клетки. Иммунные клетки производят антитела и вирусные белки. Антитела действуют на эритроциты, вызывая иммунный гемолиз. Гемоглобин высвобождается и подвергается атаке. Вирус захватывает порфирин и ингибирует метаболизм гема. Поэтому мы считаем, что поражение организма человека вирусом носит системный характер, а не ограничивается дыхательной системой.
Данная работа предназначена только для научного обсуждения, правильность выводов должна быть подтверждена другими лабораториями. Мы с нетерпением ожидаем сообщений от лабораторий, которые смогут доказать, является ли эта теория неправильной или правильной из следующих экспериментов: 1) используйте рентгеноструктурный анализ для определения структуры гемоглобина у тяжелобольных пациентов, чтобы выяснить, есть ли какие-либо отклонения; 2) в эксперименте с вирусами должны быть показаны следующие этапы: вирусные белки могут связывать порфирин; вирусные белки могут атаковать гем; вирусные белки могут атаковать гемоглобин в крови.
Заявления/h5>
Согласие этического комитета и согласие на участие
Согласие на публикацию
Доступность данных и материалов
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Финансирование
Эта работа финансировалась за счет гранта Фонда естественных наук для проекта по внедрению талантов Сычуанского университета науки и техники (номер награды 2018RCL20, грантополучатель WZL).
Вклад авторов
Финансирование получил WZL. Дизайн, анализ, написание: WZL. Курирование данных, проверка рукописи: HLL. Все авторы прочитали и согласились с опубликованной версией рукописи.
Благодарности
Об авторах
1 Факультет информатики и инженерии, Сычуаньский инженерно-технический университет, Цзыгун, 643002, Китай;
2 Факультет медико-биологических наук и технологии пищевых продуктов, Ибиньский университет, Ибинь, 644000, Китай.
Список литературы
- Дяо, K., Хань, P., Пан, T., Ли, И. и Ян, Ц. Характерные особенности визуализации HRCT в репрезентативных случаях завозной инфекции новой коронавирусной пневмонии 2019 г. (Diao, K., Han, P., Pang, T., Li, Y. & Yang, Z. HRCT Imaging Features in Representative Imported Cases of 2019 Novel Coronavirus Pneumonia). Precision Clinical Medicine (2020).
- Чан, Д. и др., Эпидемиологические и клинические характеристики новой коронавирусной инфекции на примере 13 пациентов за пределами Уханя. Китай (Chang, D. et al. Epidemiologic and clinical characteristics of novel coronavirus infections involving 13 patients outside Wuhan, China). JAMA (2020).
- Хуан С. и др. Клинические характеристики пациентов, инфицированных новым коронавирусом 2019 в Ухане, Китай (Huang, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China). The Lancet (2020).
- Ли, С., Цай, Цз., Ван, С. и Ли, Ю. Возможность крупномасштабного переноса инфекции 2019 nCov от человека к человеку в первом поколении (Li, X., Zai, J., Wang, X. & Li, Y. Potential of large ‘first generation’human‐to‐human transmission of2019‐nCoV). Journal of Medical Virology (2020).
- Ван, Д. и др., Клинические характеристики 138 госпитализированных пациентов с вирусной пневмонией, вызванной новым коронавирусом 2019, Ухань, Китай (Wang, D. et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China). Jama (2020).
- Ли, Ц. и др. Ранняя динамика передачи пневмонии, вызванной новой коронавирусной инфекцией, в Ухане, Китай (Li, Q. et al. Early transmission dynamics in Wuhan, China, of novel coronavirus–infected pneumonia). New England Journal of Medicine (2020).
- Чжу, Н. и др. Новый коронавирус, выделенный у пациентов с пневмонией в Китае в 2019 г. (Zhu, N. et al. A novel coronavirus from patients with pneumonia in China, 2019). New England Journal of Medicine (2020).
- Ву, Ф. и др. Новый коронавирус, ассоциируемый с респираторными заболеваниями людей в Китае (Wu, F. et al. A novel coronavirus associated with human respiratory disease in China). Nature, 1-8 (2020).
- Лу, Х., Страттон, С. У. и Тан, И. В. Вспышка пневмонии неизвестной этиологии в Ухане, Китай: загадка и чудо (Lu, H., Stratton, C. W. & Tang, Y. W. Outbreak of Pneumonia of Unknown Etiology in Wuhan China: the Mystery and the Miracle). Journal of Medical Virology.
- Чу, Н. и др. Исследовательская группа по новому китайскому коронавирусу. Новый коронавирус, выделенный у пациентов с пневмонией в Китае (Zhu, N. et al. China Novel Coronavirus Investigating and Research Team. A novel coronavirus from patients with pneumonia in China, 2019). N Engl J Med (2020).
- Лу, Р. и др. Геномная характеристика и эпидемиология нового коронавируса 2019: заключения по поводу происхождения вируса и связывания его с рецепторами (Lu, R. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding). The Lancet (2020).
- Ван, М. и др. Прецизионно-медицинский подход в отношении лечения коронавирусной уханьской пневмонии (Wang, M. et al. A precision medicine approach to managing Wuhan Coronavirus pneumonia). Precision Clinical Medicine (2020).
- Шехер, С. Р., Пекош, А. в сборнике «Молекулярная биология коронавируса SARS» (Schaecher, S. R. & Pekosz, A. in Molecular Biology of the SARS-Coronavirus) 153-166 (Springer, 2010).
- МакБрайд, Р. и Филдинг, Б. Ч. Роль вспомогательных белков вируса тяжелого острого респираторного синдрома (ТОРС) в патогенезе вируса (McBride, R. & Fielding, B. C. The role of severe acute respiratory syndrome (SARS)-coronavirus accessory proteins in virus pathogenesis). Viruses 4, 2902-2923 (2012).
- Ву, А. и др. Состав и дивергенция генома нового коронавируса (2019-nCoV) родом из Китая (Wu, A. et al. Genome Composition and Divergence of the Novel Coronavirus (2019-nCoV) Originating in China). Cell Host & Microbe (2020).
- Параскевис, Д. и др. Полногеномный эволюционный анализ нового коронавируса (2019-nCoV) позволяет отклонить гипотезу о его появлении в результате недавнего события рекомбинации (Paraskevis, D. et al. Full-genome evolutionary analysis of the novel corona virus (2019-nCoV) rejects the hypothesis of emergence as a result of a recent recombination event). Infection, Genetics and Evolution, 104212 (2020).
- Ли, С. и др. Регуляция отклика на стресс со стороны эндоплазматического ретикулума активностью ионных каналов, образуемых белком оболочки коронавируса, вызывающего инфекционный бронхит, модуляцией выброса вирионов, влиянием на апоптоз, репликативную способность и патогенез (Li, S. et al. Regulation of the ER Stress Response by the Ion Channel Activity of the Infectious Bronchitis Coronavirus Envelope Protein Modulates Virion Release, Apoptosis, and Pathogenesis). Frontiers in Microbiology 10, 3022 (2020).
- То, К.-К. В. и др. Постоянное выявление нового коронавируса 2019 в слюне (To, K. K.-W. et al. Consistent detection of 2019 novel coronavirus in saliva). Clinical Infectious Diseases (2020).
- Дон, Н. и др. Анализ моделей генома и белковой структуры отображает происхождение и патогенность вируса 2019-nCoV, нового коронавируса, вызвавшего вспышку пневмонии в Ухане, Китай (Dong, N. Et al Genomic and protein structure modelling analysis depicts the origin and pathogenicity of 2019-nCoV, a novel coronavirus which caused a pneumonia outbreak in Wuhan, China). F1000Research 9, 121 (2020).
- Роте, К. и др. Передача инфекции 2019-nCoV при контакте с бессимптомным носителем в Германии (Rothe, C. et al. Transmission of 2019-nCoV infection from an asymptomatic contact in Germany). New England Journal of Medicine (2020).
- Чен, Н. и др., Эпидемиологические и клинические характеристики 99 случаев пневмонии, вызванной новым коронавирусом 2019 года в Ухане, Китай: дескриптивное исследование (Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study). The Lancet (2020).
- Дас, Р. и Шарма, П., в сборнике «Клиническая молекулярная медицина» (Das, R. & Sharma, P. in Clinical Molecular Medicine) 327-339 (Elsevier, 2020).
- Казазян-мл., Х. Х. и Вудхэд, А. П. Синтез гемоглобина А в развивающемся плоде (Kazazian Jr, H. H. & Woodhead, A. P. Hemoglobin A synthesis in the developing fetus). New England Journal of Medicine 289, 58-62 (1973).
- Лю, Дж. и др. Общие и отличающиеся аспекты патологии и патогенеза новых патогенных для человека коронавирусных инфекций SARS‐CoV, MERS‐CoV и 2019‐nCoV. (Liu, J. et al. Overlapping and discrete aspects of the pathology and pathogenesis of the emerging human pathogenic coronaviruses SARS‐CoV, MERS‐CoV, and 2019‐nCoV). Journal of Medical Virology (2020).
- Ван, М. и др. Ремдесивир и хлорохин эффективно ингибируют недавно появившийся коронавирус (2019-n-CoV) in vitro (Wang, M. et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro). Cell Research, 1-3 (2020).
- Бернардо-Сейсдедос, Г., Джил, Д., Блуэн, Ж-М., Ришар, Э. и Милле, О. Заболевания белкового гомеостаза (Bernardo-Seisdedos, G., Gil, D., Blouin, J.-M., Richard, E. & Millet, O. in Protein Homeostasis Diseases) 389-413 (Elsevier, 2020).
- Ламеда, И. Л. и Кох, Т. Р в сборнике «Заболевания печени» (Lameda, I. L. P. & Koch, T. R. in Liver Diseases) 107-116 (Springer, 2020).
- Бэйли, Т. Л., Джонсон, Дж., Грант, К. Э., Нобл, У. С. Программа МЕМЕ SUITE (Bailey, T. L., Johnson, J., Grant, C. E. & Noble, W. S. The MEME suite). Nucleic acids research 43, W39-W49 (2015).
- Бэйли, Т. Л. и др. ПРОГРАММА МЕМЕ SUITE: средство поиска известных мотивов и открытия новых (Bailey, T. L. et al. MEME SUITE: tools for motif discovery and searching). Nucleic acids research 37, W202-W208 (2009).
- Бэйли, Т. Л., Уильямс, Н., Мислех, С. и Ли, У. У. МЕМЕ: обнаружение и анализ мотивов с последовательностях ДНК и белков (Bailey, T. L., Williams, N., Misleh, C. & Li, W. W. MEME: discovering and analyzing DNA and protein sequence motifs). Nucleic acids research 34, W369-W373 (2006).
- Шведе, Т., Копп, Й., Гуэ, Н. и Петиш, М. SWISS-MODEL: автоматизированный сервер гомологического моделирования белков (Schwede, T., Kopp, J., Guex, N. & Peitsch, M. C. SWISS-MODEL: an automated protein homology-modeling server). Nucleic acids research 31, 3381-3385 (2003).
- Бьязини, М. и др. SWISS-MODEL: моделирование третичной и четвертичной структуры белков и использованием эволюционной информации (Biasini, M. et al. SWISS-MODEL: modelling protein tertiary and quaternary structure using evolutionary information). Nucleic acids research 42, W252-W258 (2014).
- Studio, D. Discovery Studio. Accelrys [2.1] (2008).
Низкое содержание эритроцитов (анемия)
Что такое анемия?
Когда у вас недостаточно здоровых эритроцитов, у вас заболевание, называемое анемией. Это означает, что в вашей крови уровень гемоглобина (Hgb) ниже нормы уровней . Гемоглобин — это часть красных кровяных телец (эритроцитов), которая переносит кислород ко всем клеткам вашего тела. Анемия — частый побочный эффект у онкологических больных.
Что вызывает анемию?
Есть много разных причин, по которым у человека, страдающего раком, может быть анемия.Некоторые частые причины:
- Сам рак
- Лечение рака, например лучевая или химиотерапия
- Кровопотеря (это может быть кровотечение из опухоли, кровотечение из раковых клеток, попадающих в кровеносные сосуды, или кровотечение, вызванное другими состояниями, такими как обильная менструация или кровотечение из язвы желудка)
- Отсутствие в рационе определенных витаминов или минералов из-за недостаточного питания
- Низкий уровень железа в крови
- Серьезные проблемы с органами (включая тяжелые заболевания сердца, легких, почек или печени)
- Эритроциты (эритроциты) разрушаются организмом прежде, чем они заменяются.
- Тело, производящее меньше эритроцитов
- Хроническая болезнь почек
- Наличие таких состояний, как серповидноклеточная анемия или талассемия (наследственные нарушения эритроцитов)
- Сочетание любого из этих факторов
Некоторые факторы риска могут повысить вероятность анемии у больного раком.К ним относятся:
- Некоторые химиотерапевтические препараты, например химиотерапия на основе платины (это определенная группа химиопрепаратов)
- Определенные типы опухолей (например, опухоли легких или яичников)
- У вас низкий уровень гемоглобина до рака
Симптомы анемии
Анемия часто начинается медленно, поэтому сначала вы можете не заметить симптомы. По мере снижения уровня гемоглобина у вас могут появиться один или несколько из следующих симптомов:
- Учащенное сердцебиение
- Частота дыхания
- Одышка (затрудненное дыхание)
- Проблемы с дыханием при ходьбе, подъеме по лестнице или даже при разговоре (при физических нагрузках)
- Головокружение или дурноту
- Боль в груди
- Отек рук и / или ног
- Цвет кожи, ногтевого ложа, рта и десен более бледный, чем обычно
- Сильная усталость (утомляемость)
Анемия может варьироваться от легкой до опасной для жизни, в зависимости от уровня гемоглобина и симптомов, которые вы испытываете.Некоторые из этих симптомов более серьезны, чем другие. Врач объяснит вам уровень гемоглобина и степень тяжести анемии.
Если у вас есть какие-либо из этих симптомов, немедленно сообщите об этом своему врачу или медсестре. Если вы не можете сразу связаться со своей онкологической бригадой, вам может потребоваться немедленная помощь в отделении неотложной помощи.
Сообщите своей бригаде по лечению рака, если у вас есть другие проблемы со здоровьем, например, болезни сердца или легких, поскольку это может усугубить симптомы анемии.Во время лечения важно следить за анемией и ее симптомами. Сообщите своей онкологической бригаде, если у вас есть какие-либо из описанных здесь симптомов. Не забудьте упомянуть, как симптомы влияют на вашу повседневную жизнь. Это поможет вам получить необходимое лечение, когда оно вам понадобится.
Тесты на причины анемии
Полный анализ крови (CBC) — это анализ крови, который измеряет уровень гемоглобина и другие характеристики эритроцитов (например, их размер).Этот тест не только показывает, есть ли у вас анемия, но также может помочь вашему врачу выяснить, что может быть ее причиной.
Вам также могут потребоваться другие тесты, чтобы помочь определить причину этого. Сюда могут входить:
- Биохимические анализы крови для проверки функций органов и уровня витаминов и минералов
- Анализ крови называется ретикулоцитов количество (Ретикулоциты — это очень молодые эритроциты, только что высвободившиеся из костного мозга, поэтому этот тест показывает, сколько новых эритроцитов вырабатывает ваше тело.)
- Исследование костного мозга , чтобы убедиться, что ваш костный мозг работает должным образом
- Анализы крови для определения уровня железа , витамина B12 и фолиевой кислоты
- Анализ стула (кал) на наличие крови (так называемый анализ кала на скрытую кровь или FOBT )
Ваш врач или медсестра могут использовать результаты этих тестов, а также вашу медицинскую информацию и медицинский осмотр, чтобы понять, что может быть причиной вашей анемии.Иногда не удается найти никакой другой причины, кроме «анемии хронического заболевания». Этот тип анемии часто встречается у людей с хроническими проблемами, такими как застойная сердечная недостаточность, воспалительные заболевания или рак.
Проблемы, которые может вызвать анемия
Первое, что нужно знать врачу, — это степень тяжести вашей анемии. Анемия может повлиять на качество вашей жизни, и было установлено, что она сокращает выживаемость у людей, больных раком. Это может вызвать сильную усталость, потому что клетки вашего тела не получают достаточно кислорода.В некоторых случаях недостаток кислорода может быть достаточно серьезным, чтобы угрожать вашей жизни. Анемия также может заставить ваше сердце работать тяжелее. Так что, если у вас уже есть проблема с сердцем, анемия может усугубить ситуацию. Анемия также может затруднить нормальное дыхание, что затрудняет выполнение ваших обычных дел.
Тяжелая анемия может означать, что вам придется отложить лечение рака или снизить дозу лечения. Это также может привести к тому, что некоторые методы лечения рака не будут работать должным образом.
Ваша команда по лечению рака может попытаться определить ваш риск серьезных проблем, связанных с анемией, на основе любых симптомов, которые у вас есть, и вашего уровня гемоглобина.Если у вас нет симптомов, они попытаются выяснить, насколько высока вероятность их появления в ближайшем будущем. Это будет основано на ряде вещей, в том числе:
- Ваш уровень гемоглобина и другие лабораторные результаты
- Тип лечения рака, который вы получали в прошлом
- Вероятность того, что любое лечение, которое вы сейчас проходите, может усугубить анемию
- Есть ли у вас проблемы с легкими, сердцем или кровеносными сосудами (кровообращением)
- Ваш возраст
Если вам кажется, что у вас нет проблем с анемией, ваша команда по лечению рака будет внимательно следить за уровнем гемоглобина и спрашивать о симптомах каждый раз, когда вы посещаете офис.
Лечение анемии
Анемию у онкологических больных обычно лечат в зависимости от причины. Иногда лечение анемии откладывает лечение рака до восстановления красных кровяных телец. При лечении анемии преследуются 2 основные цели:
.- Лечить причину анемии
- Повысить уровень гемоглобина, чтобы облегчить симптомы
Наиболее распространенные методы лечения анемии у онкологических больных включают:
- Железная терапия
- Переливание эритроцитов, широко известное как переливание крови
- Средства, стимулирующие эритропоэз (ЭСС)
- Лекарственные препараты прочие
Ваш врач изучит результаты ваших анализов, симптомы, длительность этих симптомов, тип рака, лечение рака и другие факторы.Поговорите со своей командой по лечению рака о том, какое лечение вам подходит. Как и в случае с любой другой медицинской проблемой, ожидаемая польза от лечения всегда должна перевешивать возможные риски.
Железная терапия
Если у вас низкий уровень железа, ваш врач может дополнить их таблетками железа или железом, вводимым через вены (вливание железа). Настои железа несут в себе риск аллергической реакции. Ваш врач обсудит с вами, какая форма железа лучше всего подходит для вашей ситуации. Ваш врач может также попросить вас есть больше продуктов, богатых железом.В пище содержится два типа железа: гемовое и негемовое.
Гемовое железо содержится в продуктах животного происхождения. Гемовое железо легче усваивается организмом, чем негемовое железо. Примеры продуктов, содержащих гемовое железо:
- Красное мясо
- Жирная рыба
- Курица и индейка
Негемовое железо содержится в продуктах растительного происхождения. Примеры продуктов, содержащих большое количество негемового железа, включают:
- Темно-зеленые листовые овощи, такие как шпинат, капуста, листовая капуста или мангольд
- Фасоль и чечевица
- Тофу
- Крупы обогащенные
- Сухофрукты, такие как изюм, абрикосы и персики
- Обогащенные макаронные изделия и рис.
Негемовое железо лучше всего усваивается организмом, когда его едят одновременно с фруктами и овощами с высоким содержанием витамина С. Примеры продуктов с высоким содержанием витамина С включают
- Цитрусовые
- Помидоры
- Темно-зеленые листовые овощи
- Ягоды.
Переливание крови для лечения анемии
Переливание клеток крови — это безопасный и распространенный способ лечения анемии у онкологических больных. Это может помочь пациенту почувствовать себя лучше и помочь кислороду добраться до жизненно важных органов.Хотя переливание крови может очень быстро облегчить симптомы, иногда облегчение временное, в зависимости от причины анемии.
Потребность в переливании крови зависит от тяжести симптомов и уровня гемоглобина. Переливание крови может быть выполнено, если уровень гемоглобина достигает определенного значения или если ваши симптомы слишком беспокоят.
Переливание крови требует тщательного сопоставления сданной крови с кровью реципиента. Продукты крови проверяются, чтобы убедиться, что они безопасны и принадлежат к той же группе крови, что и получатель.Но переливание крови также сопряжено с определенными рисками
- Реакция на переливание : Это происходит, когда иммунная система пациента атакует белки чужеродных клеток крови. Часто это выглядит как аллергическая реакция. Большинство этих реакций незначительны и поддаются лечению, но иногда они могут быть более серьезными.
- Повреждение легких, связанное с переливанием крови : Это один из наиболее серьезных рисков. Это может вызвать проблемы с дыханием и потребовать лечения в больнице.
- Контакт с определенными микробами, такими как вирус гепатита B или C : Тщательный анализ крови и скрининг, которые используются сегодня, значительно снизили риск инфекций.
- Перегрузка кровообращения, связанная с переливанием крови (TACO): Это может произойти, если кровь подается слишком быстро, чтобы сердце могло с ней справиться.
- Перегрузка железом : Люди, которым делают много переливаний крови, могут в конечном итоге получить слишком много железа, и тогда потребуется лечение.
Средства, стимулирующие эритропоэз (ЭСС)
Еще один способ лечения анемии у некоторых пациентов — это использование лекарств, которые заставляют организм вырабатывать больше красных кровяных телец. ЭСС работают как гормон (называемый эритропоэтин ), вырабатываемый почками, чтобы помочь организму вырабатывать собственные новые эритроциты. Если один из этих препаратов рекомендован, ваш лечащий врач расскажет вам о рисках и преимуществах этого препарата. Эти препараты могут вызывать очень серьезные побочные эффекты.Тем не менее, они могут помочь пациентам, получающим химиотерапию, иметь более высокий уровень гемоглобина и им нужно реже переливать кровь. Это может привести к постепенному уменьшению симптомов, связанных с анемией.
ЭСС даются в виде уколов под кожу, и время, которое проходит до начала работы, может быть разным для разных пациентов. Поговорите со своим врачом о рисках и преимуществах ESA, которые вы будете получать.
Другие препараты для лечения анемии
В зависимости от типа анемии, анемию также можно лечить с помощью добавок витамина B12 или фолиевой кислоты.
Поговорите со своим врачом о том, какой у вас тип анемии, о рекомендуемом лечении, а также о рисках и преимуществах лечения.
Лечение анемии в домашних условиях
На что обращать внимание
- Новая или усиливающаяся усталость, затрудняющая выполнение обычных дел
- Боль в груди или одышка во время активности
- Кожа, ногтевые ложа или десны более бледные, чем обычно
- Головокружение
- Слабость
- Ярко-красный, темно-красный или черный табурет
- Рвота темно-коричневая или ярко-красная
(Последние 2 признака кровотечения, которое может быть причиной анемии.)
Что может делать пациент
- Баланс отдыха и деятельности. Выполняйте только те действия, которые вы можете терпеть
- Записывайте свои симптомы, в какое время они возникают и что делает их хуже или лучше, и обсудите это со своим лечащим врачом на приеме.
- Сообщите своей онкологической бригаде, если вы не можете передвигаться так хорошо, как обычно.
- Планируйте важные дела, когда у вас больше всего энергии.
- Придерживайтесь сбалансированной диеты, включающей белок (например, рыбу, мясо, яйца, сыр, молоко, орехи, горох и бобы).Постарайтесь включить в свой рацион продукты, богатые железом
- Выпивайте от 8 до 10 стаканов (8 унций) воды в день, если лечащая бригада не даст вам других указаний. Можно пить другие жидкости вместо воды — только не пиво, вино или другие алкогольные напитки. Посоветуйтесь со своим врачом, чтобы узнать, какое количество жидкости для вас безопасно.
Что могут делать лица, осуществляющие уход
- Запланируйте друзей и членов семьи, чтобы они готовили еду, убирались в доме, работали во дворе или выполняли поручения для пациента.Вы можете использовать веб-сайты, которые помогают организовать эти вещи, или попросить кого-нибудь разобраться в этом за вас.
- Следите за замешательством, обмороком или головокружением.
Позвоните в бригаду по лечению рака, если пациент
- Боли в груди
- Имеет одышку в покое
- Ощущение головокружения или обморока
- Запутывается или не может сосредоточиться
- Не может встать с постели более 24 часов
- Кровь в стуле
- Имеет темно-коричневую или ярко-красную рвоту
Диффузия гемоглобина и динамика захвата кислорода эритроцитами
Броуновская диффузия в сравнении с аномальной
С помощью NSE мы измеряем промежуточную функцию рассеяния I ( q , t ). {- iq \ mathrm {.{2} \).
При увеличении концентрации макромолекул необходимо учитывать взаимодействие между ними и нельзя пренебрегать членами i ≠ j в уравнении 1, структурный фактор белок-белок, отличный от 1, появляется в интенсивности рассеяния раствора. Однако в диапазоне волновых векторов \ (qR \ gg 1 \), где R — радиус белка, получается S ( q ) ~ 1, членами уравнения 1 можно пренебречь. ; в этом диапазоне волновых векторов измеряется само промежуточная функция рассеяния I с ( q , t ) концентрированного белкового раствора.{\ beta}} $$
(4)
, чтобы различать одно экспоненциальное затухание или растянутую экспоненту промежуточной функции рассеяния (мы используем β , а не α , как это обычно встречается в литературе 32 , но имеет то же значение). Мы четко проверили, что \ (\ beta \ simeq 1 \) для диапазона интересующего волнового вектора (см. SI), который подчеркивает одно экспоненциальное затухание I ( q , t ).{2} т}
$ (5)
D ( q ) называется кажущимся коэффициентом диффузии. Итак, во второй серии уточнений мы подогнали формулу 5 к экспериментальным данным и извлекли D ( q , c п. ) для каждого раствора гемоглобина в разной концентрации. Промежуточная функция рассеяния, измеренная на растворах гемоглобина с помощью спинового эха нейтронов вместе с подгонками, изображена на рисунках 1 и 2 для двух концентраций белка c п. = 105 г . л −1 и c п. = 327 г . л -1 . Для наглядности по всем измеренным значениям нанесено только ограниченное количество спектров. При увеличении концентрации из-за уменьшения диффузии (т.е. увеличения времени релаксации) нам пришлось увеличить диапазон измеряемых волновых векторов, чтобы получить более быстрое уменьшение I ( q , t ).Для обоих рисунков ясно, что есть небольшое отклонение от единственного экспоненциального затухания для наименьшего измеренного q (наибольшего времени релаксации). Результаты, полученные для D ( q , c п. ) изображены на рис.3 для трех концентраций: c п. = 105 г . л -1 , с п. = 210 г . л −1 и c п. = 327 г . л -1 .
Рис. 1Промежуточная функция рассеяния, измеренная на спектрометре нейтронного спинового эха SNS, в диапазоне волнового вектора q = 0,069 Å −1 до q = 0,125 Å −1 , на растворе гемоглобина c п. = 105 г . л -1 . Показаны 22 спектра из 60, измеренных при 4 различных углах рассеяния.
Рис. 2Промежуточная функция рассеяния, измеренная на спектрометре нейтронного спинового эха SNS, в диапазоне волнового вектора от q = 0,069 Å −1 до q = 0,25 Å −1 , на растворе гемоглобина c п. = 327 г . л -1 .
Рисунок 3Зависимость волнового вектора кажущегося коэффициента диффузии D (q), измеренного NSE, для трех растворов с концентрацией c п. = 105 г . л -1 , с п. = 210 г . л −1 и c п. = 330 г . л -1 . Значение, полученное для q → 0, является коэффициентом взаимной или коллективной диффузии, тогда как значение плато соответствует долгосрочному коэффициенту самодиффузии при данной концентрации D с ( с п. ) (см. Текст).
Поскольку измеряется когерентное рассеяние нейтронов при очень малом волновом векторе, D ( q , c п. ) представляет собой коллективный коэффициент диффузии в пределах q → 0, таким образом, аналогичный коэффициенту, измеренному с помощью фотонной корреляционной спектроскопии (PCS). Этот коэффициент коллективной диффузии был измерен в растворах гемоглобина и очень медленно изменяется с концентрацией 34, 35 .К сожалению, невозможно сравнить измерения диффузии Hb в эритроцитах с помощью PCS с результатами NSE, поскольку в спектрах светорассеяния преобладают флуктуации мембраны 36 . {2} \) (см. Формулу 5).Значение, полученное при высоком q (значении плато), соответствует диапазону волнового вектора, в котором структурный фактор белок-белок равен \ (S (q) \ simeq 1 \). Как упоминалось ранее, этот диапазон q соответствует некогерентному приближению когерентного рассеяния, а кажущийся коэффициент диффузии соответствует самодиффузии \ ({D} _ {s} ({c} _ {p}) = {\ mathrm {lim}} _ {q \ mathrm {.} R \ gg 1} \, D (q, {c} _ {p}) \). Ранее было показано, что это соответствует коэффициенту долгой самодиффузии 28, 37 .Изменение коэффициента самодиффузии для растворов гемоглобина с различной концентрацией, измеренное с помощью спинового эха нейтронов при T = 20 ° C, показано на рис. 4. Для сравнения экспериментальные результаты, полученные разными методами, показаны вместе после масштабирования до T = 20 ° C согласно соотношению Стокса-Эйнштейна (см. Выше). Поразительно, что наблюдается сильный разброс точек, полученных разными авторами и разной экспериментальной техникой.
Рисунок 4Экспериментальные результаты изменения коэффициента самодиффузии в растворе, полученные разными методами, большой полный красный кружок в данном исследовании, от Moll 17 зеленый и красный кресты 17 , Gross 21 синий ромб , Риверос и др. . 20 черный крест, Эверхарт и Джонсон 25 синий треугольник, Келлер и др. . т c = 37 ° C до T c = 20 ° C пустой черный алмаз, T c = 20 ° C пустой красный алмаз, Спаан и др. . 23 полный зеленый бриллиант, Адамс и Фатт 18 полный голубой круг и Bouwer et al . 22 пустой синий кружок. И коэффициент самодиффузии, измеренный непосредственно в эритроцитах с помощью ЯМР, полный черный кружок 26 , полный зеленый кружок 27 и NSE в эритроцитах полный черный квадрат 28 .
В случае белка в эритроцитах и в растворах, где концентрация гемоглобина почти постоянна, за исключением небольших колебаний, для оценки транспортных свойств необходимо использовать коэффициент самодиффузии в течение длительного времени.Сильная деформация эритроцитов, вероятно, приведет к более актуальной коллективной диффузии белка. Однако мы решили пренебречь этим эффектом и предположить, что коэффициент транспортной диффузии в эритроцитах соответствует коэффициенту самодиффузии, который доступен NSE при более высоких волновых векторах 38, 39 .
Аналитическое описание концентрационной зависимости коэффициента диффузии
Вязкость концентрированного белкового раствора обычно описывается с помощью уравнения, полученного по Муни 40 , которое является расширением до конечной концентрации формулы Эйнштейна для бесконечного разбавления раствора жесткой сферической формы. частицы:
$$ \ eta = {\ eta} _ {0} \, exp \, (\ frac {\ nu {\ rm {\ Phi}}} {1-k {\ rm {\ Phi}}} ) $$
(6)
η 0 — вязкость растворителя, Φ — объемная доля белка, а k — постоянная величина, коэффициент самонасыщения.Фактор ν определяется выражением \ (\ nu \ eta = {\ mathrm {lim}} _ {{\ rm {\ Phi}} \ to 0} \, \ frac {\ eta — {\ eta} _ { 0}} {{\ eta} _ {0}} \), это обобщенное уравнение Эйнштейна \ (\ eta \ simeq {\ eta} _ {0} \ mathrm {(1} +2.5 \ varphi) \), он был установлен Муни равным ν = 2,5, чтобы соответствовать формуле Эйнштейна, но может превышать это значение для несферических частиц. Сложность применения этой формулы к растворам белка состоит в том, чтобы оценить Φ, поскольку она соответствует гидродинамической объемной доле, которая включает водную оболочку гидратации, которая движется вместе с ядром белка, что трудно определить.Росс и Минтон 41 преодолевают эту трудность, модифицируя уравнение Муни. Они ввели характеристическую вязкость раствора [ η ], величину, измеренную для разбавленного раствора макромолекулы, который содержит информацию о форме макромолекул, которая определяется как:
$$ [\ eta] = \ mathop {\ mathrm {lim}} \ limits_ {c \ to 0} \ frac {\ eta — {\ eta} _ {0}} {c {\ eta} _ {0}} $$
(7)
[ η ] знаком молекулярным биофизикам и может быть измерен для белковых растворов 42 .Наконец, Росс и Минтон вывели модифицированную формулу Муни, в которой объемная доля белка заменена его концентрацией:
$$ \ eta = {\ eta} _ {0} \, exp \, (\ frac {[\ eta] {c} _ {p}} {1- (k / \ nu) {c} _ {p} [\ eta]}) $$
(8)
На рис. 5 приведены аппроксимации по формуле, аналогичной 8, ( D ~ 1/ η ) результатов коэффициента диффузии, полученного с помощью спектроскопии NSE во время этого измерения, мы также нанесли результаты, полученные в RBC. тем же методом 28 и ЯМР 27 .Обратите внимание, что, принимая D с ( с п. ) · η ( с п. ) = cste , мы предполагаем справедливость обобщенного уравнения Стокса-Эйнштейна, как это обычно предполагается при проверке в переполненных белковых решениях 43 (критическое обсуждение справедливости обобщенного соотношения Стокса-Эйнштейна см.44). Все результаты скорректированы для вязкости D . 2 0 до H 2 0 и масштабируется до температуры T c = 37 ° C, используя процедуру, описанную ранее. Значения, извлеченные из процедуры подбора, представляют собой коэффициент диффузии гемоглобина при бесконечном разбавлении при T = 37 ° C: D с (0) = 10.1 ± 0,5 10 −7 см 2 . с −1 , характеристическая вязкость [ η ] = 2,94 ± 0,79 10 −3 л . г −1 и отношение k / ν = 0,52 ± 0,29.
Рисунок 5Коэффициент самодиффузии D с ( с п. ), измеренные с помощью спектроскопии NSE (красные кружки) и уточнения с использованием модифицированной формулы Муни, приведенной Россом и Минтоном 41 (красная линия), и эмпирической формулы, используемой Боувером и др. .{- \ frac {{c} _ {p}} {{c} _ {2}}}) $$
(9)
Результаты уточнений также представлены на рис. 5, полученные нами для коэффициента диффузии при нулевой концентрации D с (0) = 10,2 ± 0,6 10 −7 см 2 . с −1 , а для концентрации c 1 и c 2 соответственно c 1 = 404 ± 43 г .{-1} \) и существенно отличаются только выше. Оба они относительно точно совпадают с экспериментальными результатами.
Высокое содержание гемоглобина: причины, лечение
Обзор
Почему важен гемоглобин A1c.Что такое высокий уровень гемоглобина?
Гемоглобин — это белок красных кровяных телец, который помогает крови переносить кислород по всему телу.(Гемоглобин содержит железо, которое придает крови красный цвет.) Подсчет гемоглобина — это косвенное измерение количества красных кровяных телец в вашем теле. Когда уровень гемоглобина выше нормы, это может быть признаком проблемы со здоровьем.
Нормальный уровень гемоглобина составляет от 14 до 17 г / дл (граммов на децилитр) для мужчин и от 12 до 15 г / дл для женщин. Уровни гемоглобина зависят от многих факторов, включая возраст, расу, пол и общее состояние здоровья человека.
Гемоглобин обычно измеряется как часть общего анализа крови (стандартный анализ крови) вместе с гематокритом (процентное содержание эритроцитов в крови), чтобы помочь диагностировать заболевания и узнать больше о здоровье человека. .
Симптомы и причины
Что может вызвать повышенный уровень гемоглобина?
Многие факторы могут влиять на уровень гемоглобина. Иногда высокий уровень гемоглобина является результатом образа жизни или побочного эффекта приема лекарств.
Заболевания, которые могут вызвать высокий уровень гемоглобина, включают:
- Истинная полицитемия (костный мозг производит слишком много красных кровяных телец)
- Заболевания легких, такие как ХОБЛ, эмфизема или фиброз легких (на легочной ткани появляются рубцы)
- Порок сердца, особенно врожденный порок сердца (с ним рождается ребенок)
- Опухоли почек
- Обезвоживание (от диареи или недостатка жидкости)
- Гипоксия (низкий уровень кислорода в крови)
- Воздействие окиси углерода (обычно связанное с курением)
Факторы образа жизни, которые могут вызвать высокий уровень гемоглобина, включают:
- Курение сигарет
- Жизнь на большой высоте
- Прием препаратов, улучшающих работоспособность, таких как анаболические стероиды (например, синтетический тестостерон) или эритропоэтин
Диагностика и тесты
Чего я могу ожидать, когда мой врач обнаружит высокий уровень гемоглобина?
Врачи обычно обнаруживают высокий уровень гемоглобина при проведении тестов на другое заболевание.Ваш врач может провести дополнительные тесты, чтобы определить причину повышенного уровня гемоглобина. Эти тесты могут искать условия, которые заставляют ваше тело вырабатывать слишком много красных кровяных телец, или нарушения, ограничивающие поступление кислорода.
Ведение и лечение
Как лечить высокий уровень гемоглобина?
Если заболевание вызывает высокий уровень гемоглобина, ваш врач может порекомендовать процедуру или лекарство для его снижения.
Во время процедуры, называемой флеботомией, медицинский работник вводит иглу в вашу вену и сливает кровь через трубку в мешок или контейнер. Возможно, вам потребуется повторять эту процедуру до тех пор, пока уровень гемоглобина не станет близким к норме.
Как справиться с анемией во время химиотерапии
Анемия из-за химиотерапии — это не то, о чем мы слышим так часто, как, скажем, облысение, но это очень распространенный побочный эффект химиотерапии, который недостаточно лечится.Анемия может привести к усталости и головокружению, а также к другим симптомам, но, к счастью, ее относительно легко диагностировать с помощью общего анализа крови. В тяжелых случаях варианты лечения могут включать переливание крови, добавки железа или лекарства для стимуляции производства клеток крови. Тем не менее, с анемией, связанной с химиотерапией, часто можно справиться с помощью консервативных мер, чтобы справиться с симптомами. Узнайте об анемии во время химиотерапии и о том, что вы можете сделать, чтобы уменьшить ее влияние на вашу жизнь.
Purestock / Getty ImagesОбзор
Анемия, также известная как «кровь с низким содержанием железа» или «кровь с низким содержанием железа», определяется как уменьшение количества эритроцитов (эритроцитов) или гемоглобина. Это приводит к снижению способности крови переносить кислород к тканям тела.
Анемия обычно определяется как уровень гемоглобина менее 13,5 г / 100 мл у мужчин и менее 12 г / 100 мл у женщин.
Заболеваемость
Анемия во время химиотерапии чрезвычайно распространена, и одно исследование показало, что 89.5% людей с солидными опухолями, получавших химиотерапию, в той или иной степени страдали анемией. К счастью, подавляющее большинство этих людей страдали анемией от легкой до умеренной.
Удар
В дополнение к очевидному факту, что анемия может усугубить усталость, которая уже характерна для рака, анемия может негативно повлиять на лечение рака и другими способами. Было обнаружено, что умеренная или тяжелая анемия из-за химиотерапии может привести к отсрочке последующих сеансов химиотерапии или необходимости снижения дозы (что, в свою очередь, может привести к снижению эффективности).Взаимодействие с другими людьми
Симптомы
Симптомы, которые могут возникнуть при анемии, включают:
Это может способствовать усталости и вызвать ряд других симптомов, которые могут повлиять на качество вашей жизни.
- Усталость
- Недостаток энергии
- Головокружение или головокружение, особенно при быстром вставании или стоянии
- Одышка
- Головные боли
- Бледный вид
- Учащенное сердцебиение или учащенное сердцебиение
- Боль в груди
Причины
Есть несколько причин анемии во время лечения рака, в том числе:
- Лекарства для химиотерапии —Химиотерапия атакует быстро делящиеся клетки, включая клетки, которые в конечном итоге образуют эритроциты.Это также может вызвать язвы во рту, изменение вкуса или тошноту, что может снизить потребление питательных веществ, необходимых для образования красных кровяных телец.
- Кровотечение —Потеря крови из-за операции или кашля с кровью (кровохарканье) может вызвать анемию.
- Сам рак — Анемия может возникать при многих хронических заболеваниях либо в результате самой болезни, либо из-за недостаточности питательных веществ в результате болезни или лечения.
- Почечная недостаточность — Это чаще встречается у пожилых пациентов и является возможным результатом обезвоживания и самого рака.
Диагностика
Ваш врач назначит общий анализ крови (CBC) до и после химиотерапии, чтобы оценить количество красных кровяных телец, а также гемоглобин. Общий анализ крови также включает информацию (называемую индексами эритроцитов) об эритроцитах в вашей крови, такую как размер (MCV), количество гемоглобина (MCHC) и различные размеры (RDW). Эти тесты могут помочь определить вашу анемию.
Важно отметить, что помимо химиотерапии существует множество типов анемии и множество причин.Иногда требуется дальнейшее тестирование, чтобы определить точные причины. Например, комбинированная анемия (такая как сочетание подавления костного мозга, связанного с химиотерапией, плюс дефицит витамина B12) может быть не очевидна только на основании общего анализа крови. Дальнейшее тестирование может включать:
- Мазок периферической крови для определения морфологии: в мазке крови клетки крови исследуются под микроскопом, а не только с помощью автоматизированной машины, и обнаруживаются такие изменения, как фрагментация эритроцитов и т. Д.можно увидеть.
- Подсчет ретикулоцитов: этот тест проверяет зрелость ваших эритроцитов и может помочь ответить на вопрос о том, вызвана ли ваша анемия недостатком производства эритроцитов или чем-то еще (например, кровотечением или нарушением кровообращения).
Лечение
В большинстве случаев с легкой анемией можно справиться, просто немного изменив свой образ жизни и дождавшись, пока ваше тело вырабатывает больше эритроцитов. Недостаточный отдых, быстрое вставание или употребление напитков с кофеином или алкоголем могут ухудшить ваши симптомы.
В других случаях, особенно если у вас очень низкий уровень эритроцитов или вы испытываете симптомы, врач может порекомендовать лечение. Варианты лечения включают:
Переливания
Самый быстрый способ увеличить количество красных кровяных телец — переливание крови. Побочные эффекты могут включать жар, озноб и небольшой риск возникновения реакции на переливание крови или заражения инфекционным заболеванием, таким как гепатит.
Добавки железа
Могут быть рекомендованы пероральные или внутривенные добавки железа.Железо принимать внутрь проще всего, но оно может вызвать дискомфорт в желудке. Обычные побочные эффекты внутривенного введения железа — это временное ощущение приливы крови, металлический привкус, головные боли и боли в суставах или мышцах через несколько дней после лечения. Иногда инъекции железа могут вызывать серьезные аллергические реакции.
Лекарства, стимулирующие образование красных кровяных телец
Иногда используются лекарства (часто вместе с внутривенным введением железа), чтобы стимулировать выработку эритроцитов в организме.В настоящее время существует много споров об этом лечении, и ваш онколог обсудит преимущества и возможные риски, если это будет рекомендовано. Эти лекарства включают Прокрит или Эпоген (эпоэтин альфа) и Аранесп (Дарбэпоэтин альфа).
Копинг
Лучший способ справиться с анемией — позволить себе переносить ее легче, чем обычно, до тех пор, пока ваше тело не сможет наверстать упущенное и вырабатывать больше красных кровяных телец. Хорошая новость заключается в том, что анемия является одной из причин усталости, которую очень легко лечить, и обычно она начинает улучшаться через несколько недель после завершения химиотерапии.
Пока вы страдаете анемией, попробуйте:
- Высыпайтесь и вздремните, когда это необходимо.
- Встаньте медленно, особенно если вы сидите или лежите в течение длительного периода времени.
- Пейте много воды.
- Избегайте кофеина, табака и алкоголя.
- Обратитесь за помощью.
Когда звонить врачу
Сообщите своему врачу, если вы испытываете какие-либо симптомы, которые могут быть вызваны анемией.Между посещениями звоните, если вы заметили ухудшение любого из этих симптомов, особенно если у вас усилилась одышка, у вас учащается пульс, вы чувствуете усталость, несмотря на отдых, или если вы чувствуете головокружение или дезориентацию.
для любимых
Как отмечалось выше, один из лучших способов справиться с анемией во время химиотерапии — это обратиться за помощью. Тем не менее, многие люди, живущие с раком, не решаются обратиться за помощью. Они боятся оказаться обузой или потерять чувство независимости.Как друг или член семьи вы можете помочь, зная об этом, и будучи готовым вмешаться, даже если ваш любимый не просит.
Анемия у собак — Владельцы собак
Заболевание или отказ костного мозга по любой причине может привести к нерегенеративной анемии и снижению количества всех типов клеток крови — красных, белых и тромбоцитов. При широко распространенном поражении костного мозга сначала поражаются лейкоциты, затем тромбоциты и, наконец, эритроциты.
Апластическая анемия (анемия, при которой снижается способность костного мозга генерировать все клетки крови) у собак.В большинстве случаев причина неизвестна, но некоторые из них вызваны инфекциями, лекарственной терапией, токсинами или общим облучением организма. Иммунная система также может быть вовлечена в развитие этого заболевания. Заболевание диагностируется путем взятия пробы костного мозга. Чтобы вылечить это состояние, необходимо определить и устранить первопричину. Также может потребоваться поддерживающая терапия, такая как антибиотики и переливание крови, а также лекарства, подавляющие иммунную систему. Препараты, стимулирующие костный мозг, можно использовать до его выздоровления.Если болезнь не имеет известной причины или восстановление костного мозга маловероятно (например, отравление фенилбутазоном у собак), трансплантация костного мозга может помочь при наличии подходящего донора. Однако трансплантация костного мозга доступна не во всех регионах.
При аплазии чистых эритроцитов затрагиваются только эритроциты или элементы, вырабатывающие эритроциты. Он характеризуется нерегенеративной анемией с серьезным снижением количества элементов, вырабатывающих эритроциты в костном мозге.Сообщалось о собаках. Случаи, связанные с иммунитетом, часто поддаются лечению, подавляющему иммунную систему. Поддерживающее лечение, такое как переливание крови, может быть показано в тяжелых случаях. Сообщалось, что синтетический гормон, который стимулирует производство клеток крови, вызывает у некоторых собак чистую аплазию эритроцитов. Прекращение лечения гормонами может в конечном итоге привести к выздоровлению у некоторых животных.
Первичные лейкозы — это тип рака, при котором аномальные белые кровяные тельца заменяют нормальные кровяные тельца.Это приводит к анемии и недостатку нормальных лейкоцитов и тромбоцитов. Первичные лейкозы редки, но они были зарегистрированы у собак. Лейкозы могут развиваться в костном мозге или лимфатической системе и классифицируются как острые (внезапные и часто тяжелые) или хронические (длительные, с менее серьезными признаками). Острые лейкозы, при которых костный мозг заполнен незрелыми клетками крови, обычно плохо поддаются химиотерапии. У животных, которые действительно реагируют, время ремиссии обычно короткое.При остром лимфобластном лейкозе у собак степень ответа на химиотерапию для наиболее распространенного типа острого лейкоза составляет около 30%, при этом около половины собак выживают не менее 4 месяцев. Другие типы острого лейкоза встречаются реже и еще менее поддаются лечению. Хронические лейкозы, при которых значительно увеличивается продукция одной линии клеток крови, с меньшей вероятностью вызывают анемию и более поддаются лечению.
Миелодисплазия (также называемая миелодиспластическим синдромом) — это заболевание костного мозга, при котором нарушается рост и созревание кроветворных клеток в костном мозге.Это приводит к нерегенеративной анемии или нехватке лейкоцитов или тромбоцитов. Это считается прелейкемическим синдромом (возникает до того, как лейкоз полностью разовьется). Миелодисплазия встречается у собак, кошек и людей. Заболевание может возникать в результате мутации стволовых клеток или быть вызвано опухолями других органов или лекарственной терапией. Некоторые собаки реагируют на лечение синтетическими гормонами и стероидами. Поддерживающая терапия с переливанием крови может быть полезной. Показатели выживаемости различаются, поскольку миелодисплазия может прогрессировать до лейкемии.Многие животные с этим заболеванием усыпляются или умирают от инфекции, кровотечения или анемии.
Миелофиброз вызывает недостаточность костного мозга после того, как нормальные элементы костного мозга заменяются фиброзной (рубцовой) тканью. Это может быть начальное заболевание или возникать в результате рака, иммуноопосредованной гемолитической анемии (см. Анемия у собак: иммуноопосредованная гемолитическая анемия), облучения всего тела или наследственной анемии. Диагноз можно установить с помощью биопсии костного мозга — процедуры, требующей анестезии.Лечение зависит от первопричины, но обычно включает подавление иммунной системы. Поскольку подавление иммунной системы увеличивает вероятность заражения вашего питомца другими болезнями, внимательно следуйте рекомендациям ветеринара по контролю воздействия болезнетворных агентов.
Химия гемоглобина и миоглобина
Химия гемоглобина и миоглобинаХимия Гемоглобин и миоглобин
В тот или иной момент каждый испытал сиюминутную ощущение необходимости остановиться, «отдышаться», до тех пор, пока достаточное количество O 2 не будет поглощено легкими и транспортируется через кровоток.Представьте себе, какой была бы жизнь как если бы нам приходилось полагаться только на наши легкие и воду в наших кровь для транспортировки кислорода через наши тела.
O 2 только незначительно растворим (<0,0001 M ) в плазме крови при физиологическом pH. Если бы нам пришлось полагаться на кислород, растворенный в крови, как наш источник кислорода, мы бы получить примерно 1% кислорода, к которому мы привыкли. (Подумайте, какой была бы жизнь, если бы количество кислорода вы полученный был эквивалентен только одному дыханию каждые 5 минут, вместо этого одного вдоха каждые 3 с.) Эволюция форм жизни даже в сложный, как дождевой червь, потребовал разработки механизма для активного переноса кислорода по системе. Наш кровоток содержит около 150 г / л белка, известного как гемоглобин (Hb), который настолько эффективен как переносчик кислорода, что концентрация O 2 в кровотоке достигает 0,01 M такая же концентрация, как у воздуха. Однажды Комплекс Hb-O 2 достигает ткани, потребляющей кислород, молекулы O 2 переносятся на другой белок миоглобин (Мб) который переносит кислород через мышечную ткань.
Сайт, в котором кислород связывается как с гемоглобином, так и с миоглобин — это гем , показанный на рисунке ниже.
В центре гема находится атом Fe (II). Четыре из шести координационные центры вокруг этого атома заняты азотом атомы из планарного кольца порфирина . Пятый координационный сайт занят атомом азота гистидинового боковая цепь одной из аминокислот в белке.Последний координационный сайт доступен для связывания молекулы O 2 . Таким образом, гем является переносящей кислород частью молекулы гемоглобина и миоглобина. Возникает вопрос: Какова функция глобулярного белка или «глобиновая» часть этих молекул?
Структура миоглобина позволяет предположить, что переносящие кислород гемовая группа похоронена внутри белковой части этой молекулы, который предотвращает слишком близкое сближение пар группы гемов.Это важно, потому что эти белки должны связывать O 2 обратимо, и гем Fe (II) сам по себе этого сделать не может. Когда нет глобина для защиты гема, он реагирует с кислородом, чтобы образуют окисленный атом Fe (III) вместо Fe (II) -O 2 сложный.
Гемоглобин состоит из четырех белковых цепей, каждая примерно размер молекулы миоглобина, которая складывается, чтобы дать структуру, которая очень похож на миоглобин. Таким образом, гемоглобин имеет четыре отдельные гемовые группы, которые могут связывать молекулу O 2 .Хотя расстояние между атомами железа соседних гемов в гемоглобине очень большой между 250 и 370 нм акт связывания O 2 молекула одного из четырех гемов в гемоглобине приводит к значительное увеличение сродства к связыванию O 2 при другие рубцы.
Это кооперативное взаимодействие между разные сайты связывания делают гемоглобин необычайно хорошим кислород-транспортный белок, потому что он позволяет молекуле собирать как можно больше кислорода после того, как парциальное давление этого газ достигает определенного порогового уровня, а затем выделяется как как можно больше кислорода при парциальном давлении O 2 значительно ниже этого порогового уровня.Козы слишком далеко друг от друга, чтобы взаимодействовать напрямую. Но происходящие изменения в структуре глобина, окружающего гем, когда он захватывает молекулу O 2 передаются механически к другим глобинам в этом белке. Эти изменения несут в себе сигнал, который способствует усилению или потере O 2 молекула другими гемами.
Рисунки структур белков часто передают впечатление неподвижной жесткой конструкции, в которой боковые цепи отдельных аминокислотных остатков заблокированы в своих положениях.Нет ничего более далекого от правды. Происходящие изменения в структуре гемоглобина при связывании кислорода с гемами находятся настолько большие, что кристаллы дезоксигенированного гемоглобина разбиваются при подвергается воздействию кислорода. Еще одно свидетельство гибкости белки можно получить, отметив, что в кристаллические структуры миоглобина и гемоглобина, по которым O 2 молекула может путешествовать, чтобы достичь гемовой группы. Тот факт, что эти белки обратимо связывают кислород, предполагает, что они должны подвергаться простые изменения их экстерьера изменения которые получили название дыхательных движений . которые открываются, а затем закрываются по дороге, по которой проходит O 2 Молекула путешествует, когда входит в белок. Компьютер моделирование движения внутри белков предполагает, что внутренняя часть белка обладает значительной «текучестью», с группами, перемещающимися внутри белка на целых 20 нм.
Глюкоза и гемоглобин A1c | Лаборатория медицины
Обзор глюкозы и гемоглобина A
1cГлюкоза, моносахарид, является основным источником энергии для человеческого тела.Он используется печенью и другими клетками для получения энергии или хранится в виде гликогена для дальнейшего использования. Уровень глюкозы в кровотоке регулируется 2 гормонами поджелудочной железы, инсулином и глюкагоном. Инсулин высвобождается при повышении уровня глюкозы. Инсулин действует, увеличивая гликогенез, липогенез и гликолиз, вызывая снижение уровня глюкозы в кровотоке. Глюкагон высвобождается при падении уровня глюкозы, в результате чего печень выделяет хранящуюся глюкозу (гликоген) в кровоток (гликогенолиз), тем самым повышая уровень глюкозы в кровотоке.
Гемоглобин A 1c (HbA 1c ), также называемый гликозилированным гемоглобином, представляет собой соединение гемоглобина, вырабатываемое при взаимодействии глюкозы с аминогруппой молекулы гемоглобина с образованием кетоамина. Молекула глюкозы присоединена к одному или обоим N-концевым валинам β-полипептидных цепей нормального взрослого гемоглобина. 1 Образование HbA 1c пропорционально концентрации глюкозы в крови. Поскольку средняя продолжительность жизни красных кровяных телец составляет приблизительно 120 дней, уровень гликозилированного гемоглобина отражает средний уровень глюкозы в крови в течение предыдущих 2–3 месяцев.
Клиническая значимость
Тест на глюкозу используется для определения наличия у человека гипергликемии или гипогликемии. Высокий уровень глюкозы натощак (≥126 мг / дл) и / или высокий уровень HbA 1c (> 6,5%) могут указывать на то, что у человека сахарный диабет.
HbA 1c — надежный метод долгосрочного контроля сахарного диабета; он определяет средний уровень глюкозы в крови человека в течение примерно 3 месяцев.Нормальные значения колеблются от 4,0% до 6,0%. Результаты исследования 2 показали сильную линейную зависимость между средним уровнем глюкозы в крови и уровнями HbA 1c . Текущие руководящие принципы Американской ассоциации сахарного диабета рекомендуют проводить тест HbA 1c не реже двух раз в год для пациентов, которые достигают целей лечения и которые имеют стабильный гликемический контроль, или ежеквартально для пациентов, у которых изменился терапевтический режим или которые не достигают гликемических целей.Использование тестирования на HbA 1c в месте оказания медицинской помощи позволяет принимать более своевременные решения об изменении терапии, и было показано, что 2 приводит к более жесткому гликемическому контролю. Было показано, что уровень HbA 1c менее 7% снижает микрососудистые, ретинопатические и невропатические осложнения сахарного диабета.
Расчетное среднее значение глюкозы (eAG) можно рассчитать из сообщенного значения A 1C с использованием уравнения eAG мг / дл = 28,7 × A 1C — 46. 3 Однако эту информацию следует использовать осторожно, потому что результаты другого исследования 4 показали, что соотношение между средним уровнем глюкозы в плазме и HbA 1c может существенно различаться в зависимости от гликемического контроля исследуемой популяции и эритроцитов. продолжительность жизни. 4 Если продолжительность жизни эритроцитов уменьшается из-за другого болезненного состояния, такого как гемоглобинопатия, гемоглобин имеет меньше времени для гликозилирования; в результате уровень гликозилированного гемоглобина будет ниже.HbA 1c , полученный у пациентов с гемоглобиновой серповидно-клеточной болезнью (HbSS), гемоглобином C (HbC) и серповидно-гемоглобиновой C (HbSC) болезнью, следует интерпретировать с осторожностью. Используя два из следующих результатов тестов в последующие дни, можно поставить диагноз сахарного диабета: уровень гемоглобина A1c более 6,5%, уровень глюкозы в плазме натощак 126 мг / дл или выше, результаты перорального теста на толерантность к глюкозе (OGTT). при уровне 200 мг / дл или выше через 2 часа после нагрузки (нагрузка 75 г глюкозы) или симптомах сахарного диабета плюс случайный уровень глюкозы в плазме 200 мг / дл или выше.
Требования к образцам
В зависимости от метода измерения глюкозы можно проводить в сыворотке или плазме, собранной с использованием гепарина, этилендиаминтетрауксусной кислоты (ЭДТА), фторида, оксалата или цитрата. Концентрация глюкозы в цельной крови примерно на 11% ниже, чем в плазме. Для получения точного результата измерения уровня глюкозы крови натощак пациенту следует голодать в течение 8–10 часов перед забором крови и сдавать анализ утром. Значения глюкозы в плазме натощак (ГПН) демонстрируют суточные колебания, при этом среднее значение ГПН утром выше, чем днем 5 ; сахарный диабет у пациентов, обследованных во второй половине дня, может быть пропущен из-за этого разброса.Также могут быть проанализированы моча, спинномозговая и серозная жидкости.
Отделение сыворотки или плазмы от клеток должно быть выполнено в течение 1 часа, чтобы предотвратить значительную потерю глюкозы клеточной фракцией. Фторид натрия с оксалатом (пробирки с серым верхом) часто используют в качестве антикоагулянта и консерванта при тестировании глюкозы, особенно если анализ задерживается. Однако, хотя фторид ингибирует гликолитические ферменты и поддерживает долгосрочную стабильность глюкозы, темпы снижения уровня глюкозы в первый час после сбора образца в пробирках с фторидом и без него практически идентичны.Поэтому плазму следует как можно скорее отделить от клеток.
Для измерения HbA 1c требуется образец цельной крови с ЭДТА. Для этого теста не требуется статус пациента натощак.
Методы определения глюкозы
Наиболее распространенные методы анализа глюкозы в лаборатории используют фермент глюкозооксидазу или гексокиназу. Глюкозооксидаза — наиболее специфичный фермент; он реагирует только с β-d-глюкозой. Этот фермент превращает β-d-глюкозу в глюконовую кислоту; кислород потребляется и образуется перекись водорода (H 2 O 2 ).За реакцией можно следить полярографически, измеряя скорость исчезновения кислорода с помощью кислородного электрода или потребляя H 2 O 2 в побочной реакции.
Количество присутствующей глюкозы также можно определить спектрофотометрически путем измерения изменения поглощения окисленного хромогена, которое пропорционально количеству глюкозы, присутствующей в образце. Два обычно используемых хромогена — это 3-метил-2-бензотиазолинон гидразин и N, N-диметиланилин.В пероксидазной реакции (рис. 1) ложное снижение уровня глюкозы может быть вызвано повышенным уровнем мочевой кислоты, билирубина и аскорбиновой кислоты. Эти вещества окисляются пероксидазой и уменьшают количество окисляемого хромогена. Уровень кислородного истощения измеряется и пропорционален количеству присутствующей глюкозы. Спектрофотометрическое измерение окисленного хромогена пропорционально количеству присутствующей глюкозы. Сильные окисляющие вещества, такие как отбеливатель, могут вызвать ложно завышенные значения.Если используется прямое измерение кислорода методом полярографии, этих помех можно избежать.
Рисунок 1
Рисунок 1
Гексокиназный метод (Рисунок 2), общепринятый в качестве предпочтительного эталонного метода, считается более точным, чем методы глюкозооксидазы. Эта реакция использует глюкозо-6-фосфатдегидрогеназу и дает очень специфические результаты. Фермент гексокиназа в присутствии острой тромбоцитопенической пурпуры (АТФ) превращает глюкозу в глюкозо-6-фосфат.Глюкозо-6-фосфат и кофактор никотинамидадениндинуклеотидфосфат, окисленная форма (NADP + ), превращаются в 6-фосфоглюконат и никотинамидадениндинуклеотидфосфат, восстановленную форму (NADPH), посредством глюкозодезогенат-6-фосфата. НАДФН имеет сильный максимум поглощения при 340 нм. Скорость появления НАДФН можно контролировать спектрофотометрически, и она пропорциональна количеству глюкозы, присутствующей в образце. Общий гемолиз и чрезмерно повышенный уровень билирубина могут вызвать ложное снижение результатов.Однако на этот метод не влияет уровень аскорбиновой кислоты или мочевой кислоты.
Рисунок 2
Рисунок 2
В методах измерения уровня глюкозы на месте можно также использовать глюкозодегидрогеназу (Рисунок 3). Некоторые субстраты, используемые в этой реакции, включают никотинамид-адениндинуклеотид (NAD), флавина-адениндинуклеотид (FAD) и пирролохинолихинон (PQQ). Мальтоза (содержится в растворе для перитонеального диализа с икодекстрином) мешает типу теста PQQ, если специально не модифицирована для устранения этого вмешательства. 6,7 Неспецифические методы измерения глюкозы (рис. 4) по-прежнему используются в отделении анализа мочи лаборатории, в первую очередь, для обнаружения восстанавливающих веществ, отличных от глюкозы.
Рисунок 3
Метод глюкозодегидрогеназы.
Рисунок 3
Метод глюкозодегидрогеназы.
Рисунок 4
Рисунок 4
Гликозилированный гемоглобин / гемоглобин A
1c Методы тестирования Общее определение и метод определения HbA 1c были разработаны Международной федерацией клинической химии и лабораторной медицины (IFCC).IFCC определяет HbA 1c как гемоглобин, который необратимо гликируется на одном или обоих N-концевых валинах β-цепей. Используя высокоэффективную жидкостную хроматографию / масс-спектрометрию с электрораспылением (HPLC-ESI / MS) или HPLC / капиллярный электрофорез (HPLC-CE), эти методы используются для стандартизации анализов A 1c . 8 Результаты испытаний этого метода представлены в единицах Système Internationale (SI) (ммоль HbA 1c / моль HbA 0 ). В США метод ВЭЖХ по контролю за сахарным диабетом и его осложнениям (DCCT) используется в качестве основного эталонного метода, а HbA 1c указывается как процент от общего гемоглобина.Единицы СИ можно преобразовать в процентные единицы с помощью следующего основного уравнения IFCC – Национальной программы стандартизации гликогемоглобина (IFCC-NGSP): 9 :% = [0,09148 × значение SI] +2,152
Перед анализом HbA 1c , a гемолизат должен быть подготовлен. Два возможных метода, используемых для измерения HbA 1c , включают методы, основанные на разнице зарядов между гликозилированным и негликозилированным гемоглобином (катионообменная хроматография, электрофорез и изоэлектрическое фокусирование) и структурные характеристики гликогрупп на гемоглобин (аффинная хроматография и иммуноанализ).
Катионообменная хроматография использует отрицательно заряженные молекулы гемоглобина для прикрепления к положительно заряженному слою смолы. В этом методе, который зависит от температуры и подвержен гемоглобинопатиям, гликозилированный гемоглобин элюируется из слоя смолы с использованием буфера с определенным pH, чтобы отрицательно заряжать молекулы гемоглобина и элюировать их сначала из колонки.
Метод аффинной хроматографии, который предпочитает большинство лаборантов, использует группу боронатной смолы для присоединения гликозилированного гемоглобина, который затем селективно элюируется из слоя смолы с использованием буфера.Этот метод не зависит от температуры и не зависит от гемоглобина плода (гемоглобин F), гемоглобина с серповидно-клеточными признаками (гемоглобин S) или гемоглобина C.
Анализ HbA 1c в месте оказания помощи основан на латексе. метод ингибирования иммуноагглютинации. В этом методе измеряется концентрация HbA 1c и концентрация общего гемоглобина; соотношение указано в процентах от HbA 1c . Поскольку гликированный гемоглобин F не измеряется с помощью этого метода, очень высокие уровни гемоглобина F (> 10%) приведут к тому, что уровень HbA 1c будет ниже, чем ожидалось, поскольку большая часть гликированного гемоглобина будет находиться в форме гликированного гемоглобина. гемоглобин F.Кроме того, методы ВЭЖХ и электрофореза можно использовать для разделения различных форм гемоглобина на A 1a , A 1b и A 1c .
Диагностика и лечение сахарного диабета может быть сложной задачей. Однако измерение глюкозы и гемоглобина A 1c помогает врачам определить, есть ли у пациента сахарный диабет или, у уже диагностированных пациентов, находится ли их сахарный диабет под контролем. Целью лечения таких пациентов является поддержание уровня глюкозы в крови в пределах недиабетического диапазона или около него с минимальным количеством колебаний.Концентрации глюкозы в сыворотке или плазме могут быть измерены лабораториями в дополнение к самостоятельному мониторингу пациентом концентраций глюкозы в цельной крови. За долгосрочным регулированием уровня глюкозы в крови можно следить, измеряя уровень гликозилированного гемоглобина.
Сокращения
HbA1c
eAG
расчетное среднее значение глюкозы
HbSS
HbC
HbSC
серповидно-клеточный гемоглобин C
- Тест на глюкозу
ЭДТА
этилендиаминтетрауксусная кислота
FPG
H 2 O 2
АТФ
острая тромбоцитопеническая пурпура
ADAD- оксид ADAD
- диноспоринфосфат
НАДФН
никотинамидадениндинуклеотидфосфат
NAD
никотинамид-адениндинуклеотид
FAD
флавин-аденин-динуклеотид 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 рацион клинической химии и лабораторной медицины
HPLC
высокоэффективная жидкостная хроматография, HPLC-ESI / MS, HPLC / электрораспылительная масс-спектрометрия
HPLC-CE
HPLC / капиллярный электрофорез
- 9
- 9
DCCT
Контроль сахарного диабета и исследование его осложнений
NGSP
Национальная программа стандартизации гликогемоглобина
гемоглобин F
Контрольный гемоглобин
9
гемоглобин69
гемоглобин69
гемоглобин 1
.
Еще один шаг к стандартизации методов измерения гемоглобина A 1c
.ClinChem
.1997
;43
(10
):1811
—1813
,2Американская ассоциация сахарного диабета
.Стандарты медицинской помощи при сахарном диабете — 2012
.Помощь при сахарном диабете
.2012
;35
(Доп.1
):S11
—S63
.3для A 1 c-производной средней глюкозы (ADAG) Исследовательская группа
.Преобразование анализа A 1C в расчетные средние значения глюкозы
.Помощь при сахарном диабете
.2008
;31
:1473
—1478
,4.
Вариабельность отношения между средним уровнем глюкозы в плазме и HbA 1 c: Значение для оценки гликемического контроля
.ClinChem
.2007
;53
:897
–901
,5.
Суточные колебания уровня глюкозы в плазме натощак: значение для диагностики сахарного диабета у пациентов, обследованных во второй половине дня
.JAMA
.2000
;284
:3157
—3159
,6Напоминания FDA о ложно завышенных значениях уровня глюкозы в результате использования несоответствующего метода анализа
.Веб-сайт Управления по контролю за продуктами и лекарствами США (FDA)
. . По состоянию на 5 декабря 2013 г. 7Бренды и список производителей глюкометров для конкретных стран
.Веб-сайт корпорации Baxter Healthcare
. . Доступ 5 декабря 2013 г. 8и другие.
Международная федерация клинической химии и лабораторной медицины (IFCC)
.

