Строение и состав гемоглобина — структура гема и глобина, молекулярный вес и формула
Гемоглобин (Hb) — это сложный железосодержащий белок, который находится в эритроцитах. Именно он является основной составляющей эритроцитов и придает им характерный красный цвет. Это один из важнейших компонентов крови, так как основной функцией гемоглобина является перенос кислорода из альвеол легких к клеткам всего организма, а также углекислого газа в обратном направлении (к легким).
В одном эритроците содержится приблизительно 400 000 000 молекул гемоглобина.
Формула молекулы гемоглобина — С2954Н4516N780O806S12Fe4.
Молекулярная масса гемоглобина — 66 800 г/моль (66,8 кДа).
Строение гемоглобина
Строение гемоглобина в эритроците человекаСтроение молекулы гемоглобина простое — в ее состав входит всего 2 компонента:
- Гем
- Глобин
Гем
Гем — это природный пигмент, в состав которого входит соединение порфирина с железом. Общая доля гема в структуре гемоглобина составляет всего 4%. Железо, входящее в гем гемоглобина, имеет валентность Fe2+.
Общая формула гема — C34H32O4N4.
Молекулярная масса гема — 616,5 г/моль.
Наличие в крови сильных окислителей (свободных радикалов) приводит к окислению двухвалентного железа до трехвалентного (Fe3+). Гем в этом случае превращается в гематин, а сам гемоглобин в метгемоглобин. Только двухвалентное железо способно присоединять кислород и транспортировать его от альвеол легких до тканей организма, поэтому окисление железа в составе гема и образование метгемоглобина очень негативно сказывается на способности эритроцитов транспортировать кислород, что приводит к гипоксии.
Антиоксиданты (витамины С, А, Е, селен и др.) препятствуют образованию метгемоглобина за счет инактивации свободных радикалов. А вот уже образовавшийся гематин перевести обратно в гем могут только специальные ферменты — НАДН- и НАДФН-метгемоглобинредуктаза. Именно эти ферменты восстанавливают Fe3+ в составе метгемоглобина до Fe2+ гемоглобина.
Глобин
Глобин — это альбуминовый белок, который составляет 96% массы гемоглобина и состоит из 4 цепей — 2 α и 2 β .
Строение белка глобина — альфа- и бета-цепиКаждая альфа-цепь глобина состоит из 141 аминокислоты, бета-цепь — из 146 аминокислот. Всего в молекуле гемоглобина присутствует 574 аминокислотных остатка.
Глобин человека, в отличие от глобина животных не содержит в своем составе аминокислот лейцин и цистин.
Молекулярный вес глобина составляет 64 400 г/моль (64,4 кДа).
Альфа- и бета-цепи глобина образуют 4 гидрофобным кармана, в которых располагается 4 гема. Именно гидрофобный карман белка глобина позволяет железу гема присоединять кислород не окисляясь, т.е. без перехода в Fe3+. Особое значение в формировании гидрофобного кармана играют 3 аминокислотных остатка: проксимальный гистидин, дистальный гистидин и валин.
Поделиться в социальных сетях
Гемоглобін — Вікіпедія
 Структура гемоглобіну людини. Субодиниці α та β забарвлено червоним та синім, а залізовмісні гемові групи — зеленим.
Структура гемоглобіну людини. Субодиниці α та β забарвлено червоним та синім, а залізовмісні гемові групи — зеленим.Гемоглобі́н (від грец. haima — кров і лат. globus — куля) — складний залізовмісний білок еритроцитів тварин і людини, здатний оборотно зв’язуватися з киснем, забезпечуючи його перенесення до тканин.
Головна функція гемоглобіну полягає в транспорті дихальних газів. У капілярах легенів в умовах надлишку кисню останній з’єднується з гемоглобіном. Потоком крові еритроцити, що містять молекули гемоглобіну із зв’язаним киснем, доставляються до органів і тканин, де кисню мало; тут необхідний для протікання окислювальних процесів кисень звільняється із зв’язку з гемоглобіном. Крім того, гемоглобін здатний зв’язувати в тканинах невелику кількість діоксиду вуглецю (CO 2) і звільняти його у легенях. Монооксид вуглецю (CO) зв’язується з гемоглобіном крові міцніше, ніж кисень, необоротно утворюючи карбоксигемоглобін.Сполуки гемоглобіну з нітратами називаються метгемоглобіном (metHb, від мета. і гемоглобін, інакше геміглобін або феррігемоглобін). Таким чином, блокується процеси транспортування кисню. У метгемоглобіні залізо гема знаходиться в комплексі або в тривалентному стані. Метгемоглобін також утворюється в значних кількостях в результаті спадкового захворювання метгемоглобінемії.
В медицині використовують скорочене позначення даного показника — Hb (латинські літери). Нормальним вмістом гемоглобіну в крові людини вважається: у чоловіків 130—170 г/л, у жінок 120—150 г/л; у дітей — 120—140 г/л.
Емпірична хімічна формула найбільш поширеного людського гемоглобіну C2952H4664N812

Гемоглобін є складним білком класу хромопротеїнів, тобто таких, що містять простетичну групу, якою виступає особлива пігментна група, що містить хімічний елемент залізо, — гем. Гемоглобін є тетрамером, тобто складається з чотирьох субодиниць. У дорослої людини вони представлені поліпептидними ланцюгами α1, α2, β1 і β2. Субодиниці сполучені одна з одною за принципом ізологічного тетраедра. Основний внесок до взаємодії субодиниць вносять гідрофобні взаємодії. І α, і β-ланцюги відносяться до α містять в своїй структурі виключно α-спіралі. Кожен ланцюг містить вісім спіральних ділянок, що позначаються буквами A-H (від N-кінцю).
Гем є комплексом протопорфірину IX, що відноситься до класу порфіринових сполук, з атомом заліза(II). Ця простетична група нековалентно зв’язується з гідрофобною западиною молекул гемоглобіну і міоглобіну. Залізо(II) характеризується октаедричною координацією, тобто зв’язується з шістьма лігандами. Чотири з них представлені атомами азоту порфіринового кільця, що лежать в одній площині. Дві інших координаційних позиції лежать на осі, перпендикулярній площині порфірину. Одна з них зайнята азотом залишку гістидіну в 93 положенні поліпептидного ланцюга (ділянка F). Молекула кисню, що зв’язується гемоглобіном, координується до заліза зі зворотного боку і виявляється поміщеною між атомом заліза і азотом ще одного залишку гістидіну, розташованого в 64 положенні ланцюга (ділянка E). Всього в гемоглобіні чотири ділянки зв’язування кисню (один гем на кожну субодиницю), тобто одночасно може бути зв’язано чотири молекули кисню на комплекс гемоглобіну.
Гемоглобін є одним з основних білків, якими харчуються плазмодії малярії, і в ендемічних щодо малярії районах земної кулі вельми поширені спадкові аномалії будови гемоглобіну, що ускладнюють малярійним плазмодіям живлення цим білком і проникнення до еритроцитів. Зокрема, до таких аномалій, що мають еволюційно-пристосовне значення, відноситься серповидно-клітинна анемія. Проте, на жаль, ці аномалії, як і аномалії будови гемоглобіну, що не мають явно пристосовного значення, супроводжуються порушенням функції транспорту кисню гемоглобіном, зниженням стійкості еритроцитів до руйнування, анемією та іншими негативними наслідками. Аномалії будови гемоглобіну називаються гемоглобінопатіями.
Гемоглобін високо токсичний при попаданні значної його кількості з еритроцитів в плазму крові (що відбувається при масивному внутрішньосудинному гемолізі, геморагічному шоці, гемолітичних анеміях, переливанні несумісної крові та інших патологічних станах). Токсичність гемоглобіну, що знаходиться поза еритроцитами, у вільному стані в плазмі крові, виявляється тканинною гіпоксією — погіршенням кисневого постачання тканин, перевантаженням організму продуктами руйнування гемоглобіну — залізом, білірубіном, порфіринами з розвитком жовтяниці або гострою порфірії, закупоркою ниркових канальців крупними молекулами гемоглобіну з розвитком некрозу ниркових канальців і гострої ниркової недостатності.
Зважаючи на гаптоглобін, що специфічно зв’язує вільний глобін і глобін у складі гемоглобіну. Комплекс гаптоглобіна і глобіну (або гемоглобіну) потім захоплюється селезінкою і макрофагами тканинної ретікуло-ендотеліальної системи і знешкоджується.
Іншою частиною гемоглобінознешкоджуючої системи є білок гемопексин, що специфічно зв’язує вільний гем і гем у складі гемоглобіну. Комплекс гему (або гемоглобіну) і гемопексину потім захоплюється печінкою, гем відщеплюється і використовується для синтезу білірубіну та інших жовчних пігментів, або випускається в рециркуляцію в комплексі з трансферином для повторного використання кістковим мозком в процесі еритропоезу.
Гемоглобин. НАГЛЯДНАЯ БИОХИМИЯ. Ян Кольман, Клаус-Генрих Рем, Юрген Вирт
Гемоглобин
А. Структура
гемоглобина
Гемоглобин взрослого организма
(HbA, см. ниже) является тетрамером, состоящим из двух α- и двух
β-субьединиц с молекулярными массами примерно 16 кДа. α- и β-цепи отличаются
аминокислотной последовательностью, но имеют сходную конформацию. Примерно 80%
аминокислотных остатков глобина образуют α-спирали, обозначенные буквами
А-Н (см. схему). Каждая субъединица несет группу гема (формулу см. на рис.
197) с ионом двухвалентного железа в центре. При связывании
O2 с атомом железа в геме (оксигенация Hb) и отщеплении
O2 (дезоксигенация) степень окисления атома железа не
меняется. Окисление Fe2+ до Fe3+ в геме носит случайный
характер. Окисленная форма гемоглобина, метгемоглобин, не способна
переносить O2. Доля метгемоглобина поддерживается ферментами на
низком уровне и составляет поэтому обычно только 1-2%.
Четыре из шести координационных связей
атома железа в гемоглобине заняты атомами азота пиррольных колец, пятая —
остатком гистидина глобина (проксимальный остаток гистидина), а шестая —
молекулой кислорода в оксигемоглобине и, соответственно, Н
Б. Аллостерические эффекты в
гемоглобине
Аналогично аспартат-карбамоилтрансферазе
(см. с. 118) Hb может находиться в двух состояниях (конформациях):
обозначаемых как Т- и R-формы соответственно. Т-Форма (напряженная от
англ. tense) обладает существенно более низким сродством к O2
по сравнению с R-формой (на схеме справа). Связывание O2 с одной из
субъединиц Т-формы приводит к локальным конформационным изменениям, которые
ослабляют связь между субъединицами. С возрастанием парциального давления
O2 увеличивается доля молекул Hb в высокоаффинной R-форме (от англ.
relaxed). Благодаря кооперативным взаимодействиям между субъединицами с
ростом концентрации кислорода повышается сродство Hb к O2, в
результате чего кривая насыщения имеет сигмоидальный вид (см. с
276).
На равновесие между Т- и R-формами
влияют различные аллостерические эффекторы, регулирующие связывание
O2гемоглобином (желтые стрелки). К наиболее важным эффекторам
относятся CO2, Н+ и 2,3-дифосфоглицерат [ДФГ (BPG)]
(см. с. 276).
Дополнительная
информация
Hb взрослого организма состоит, как
упомянуто выше, из двух α- и двух β-цепей (α2β2). Наряду с
этой основной формой (HbA1) в крови присутствуют
незначительные количества второй формы с более высоким сродством к
O2, у второй β-цепи заменены δ-цепя-ми (HbA2,
α2δ2). Две другие формы Hb встречаются только в
эмбриональном периоде развития. В первые три месяца образуются эмбриональные
гемоглобины состава ξ2ε2 и α2γ2.
Затем вплоть до рождения доминирует фетальный гемоглобин (HbF,
α2δ2), который постепенно заменяется на первом месяце
жизни на HbА. Эмбриональный и фетальный гемоглобины обладают более высоким
сродством к О2 по сравнению с HbА, так как они должны переносить
кислород из системы материнского кровообращения.
Гемоглобин — Википедия
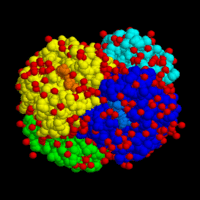 Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета  Структура гемоглобина человека. Железосодержащие гем-группы показаны зеленым. Красным и синим показаны альфа- и бета- субъединицы.
Структура гемоглобина человека. Железосодержащие гем-группы показаны зеленым. Красным и синим показаны альфа- и бета- субъединицы.Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа.
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[2].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[3].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[4].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[5]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение
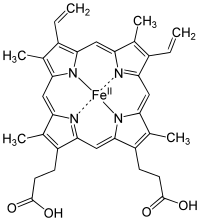
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология
 Изменение состояний окси- и дезоксигемоглобина
Изменение состояний окси- и дезоксигемоглобинаВ отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[6].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
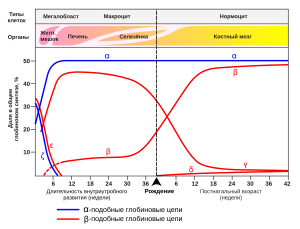 Экспрессия генов гемоглобина до и после рождения.
Экспрессия генов гемоглобина до и после рождения.Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[7]
Гемоглобин при заболеваниях крови
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии. Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также
Примечания
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology. — 12th ed. — Philadelphia, Pa. : Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6.
- Levitt, M & C Chothia (1976), «Structural patterns in globular proteins», Nature. doi 10.1038/261552a0.
Карбоксигемоглобин — Википедия
Материал из Википедии — свободной энциклопедии
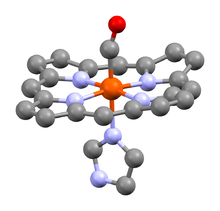 Единица гема человеческого карбоксигемоглобина, показан карбонил лиганд.[1]
Единица гема человеческого карбоксигемоглобина, показан карбонил лиганд.[1]Карбоксигемоглобин (HbCO) — прочное соединение гемоглобина и угарного газа. Избыток карбоксигемоглобина в крови приводит к кислородному голоданию, головокружению, тошноте, рвоте или даже смерти, так как угарный газ, связанный с гемоглобином, лишает его возможности присоединять к себе кислород.
Карбоксигемоглобин искусственно разрушается медицинским путём, а также карбоксигемоглобин диссоциирует на угарный газ и гемоглобин естественным путём, период полураспада — 4-6 часов. Это возможно, если его содержание в крови мало, и жизнедеятельность организма не нарушается.
Карбоксигемоглобин, HbCO, продукт присоединения CO (углерода окись, угарный газ) к гемоглобину (Hb). Растворы карбоксигемоглобина ярко-красного цвета, их спектр поглощения характеризуется максимумами при длине волны 570 и 539 нм. (Для измерения содержания в крови используются специальные неинвазивные CO-оксиметры[2].)
Расщепление карбоксигемоглобина на Hb и CO происходит в 10 тысяч раз медленнее, чем расщепление оксигемоглобина на Hb и O2. Поэтому при наличии во вдыхаемом воздухе CO кислород постепенно вытесняется из гемоглобина. Уже при концентрации 0,1 % CO в воздухе больше половины Hb крови превращается в карбоксигемоглобин; в результате нарушается перенос кислорода от лёгких к тканям и развивается так называемое угарное отравление, химическое соединение, образующееся при взаимодействии окиси углерода с красящим пигментом крови гемоглобином.
Карбоксигемоглобин образуется очень быстро, поскольку способность присоединяться к гемоглобину у угарного газа примерно в 200 раз выше, чем у кислорода. Карбоксигемоглобин не способен переносить кислород к тканям организма, поэтому при отравлении окисью углерода у человека может быстро наступить смерть. В больших количествах карбоксигемоглобин образуется при отравлении окисью углерода, а в небольших всегда присутствует в крови всех курильщиков и жителей огромных городов.
Какая эмпирическая формула молекулы гемоглобина?
Ну, формулу тебе кто-то врятли напишет, белок как никак. Молекула гемоглобина состоит из четырёх полипептидных цепей, каждая из которых нековалентно связана с ферропротопорфирином (гем) , который, собственно и ответственен за перенос кислорода. Лучше скачай какую-нибудь книжку по микробиологии или биохимии, там точно всё есть. Добавлено: «Вот она: C3032h5816O872N780S8Fe4″ а <a rel=»nofollow» href=»http://en.wikipedia.org/wiki/Hemoglobin» target=»_blank» >вот здесь</a> приводят C2952h5664N812O832S8Fe4 и где правда? =) только это называется не эмперическая, я брутто-формула, хотя может итак можно…
Fe4Hb что-так, но на самом деле формула офигенная должна быть: белок глобин и 4 железа
Насчет эмпирической формулы ты загнула! Ее что, потрогать и понюхать можно? А химическая тебя не устраивает в учебнике биологии?
