Определение HER2 статуса опухоли методом иммунофлуоресцентной гибридизации in situ (FISH) (Determination of HER2 Status of Tumor, Fluorescence In Situ Hybridization)
Метод определения флуоресцентная гибридизация in situ.
Исследуемый материал Смотрите в описании
Доступен выезд на дом
Исследование применяется для подбора индивидуальной адъювантной химиотерапии при раке молочной железы или при раке желудка.
Рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний у женщин. Клетки опухолей молочной железы могут содержать различные типы рецепторов, которые чувствительны к определенным веществам (гормонам или другим биологически активным молекулам).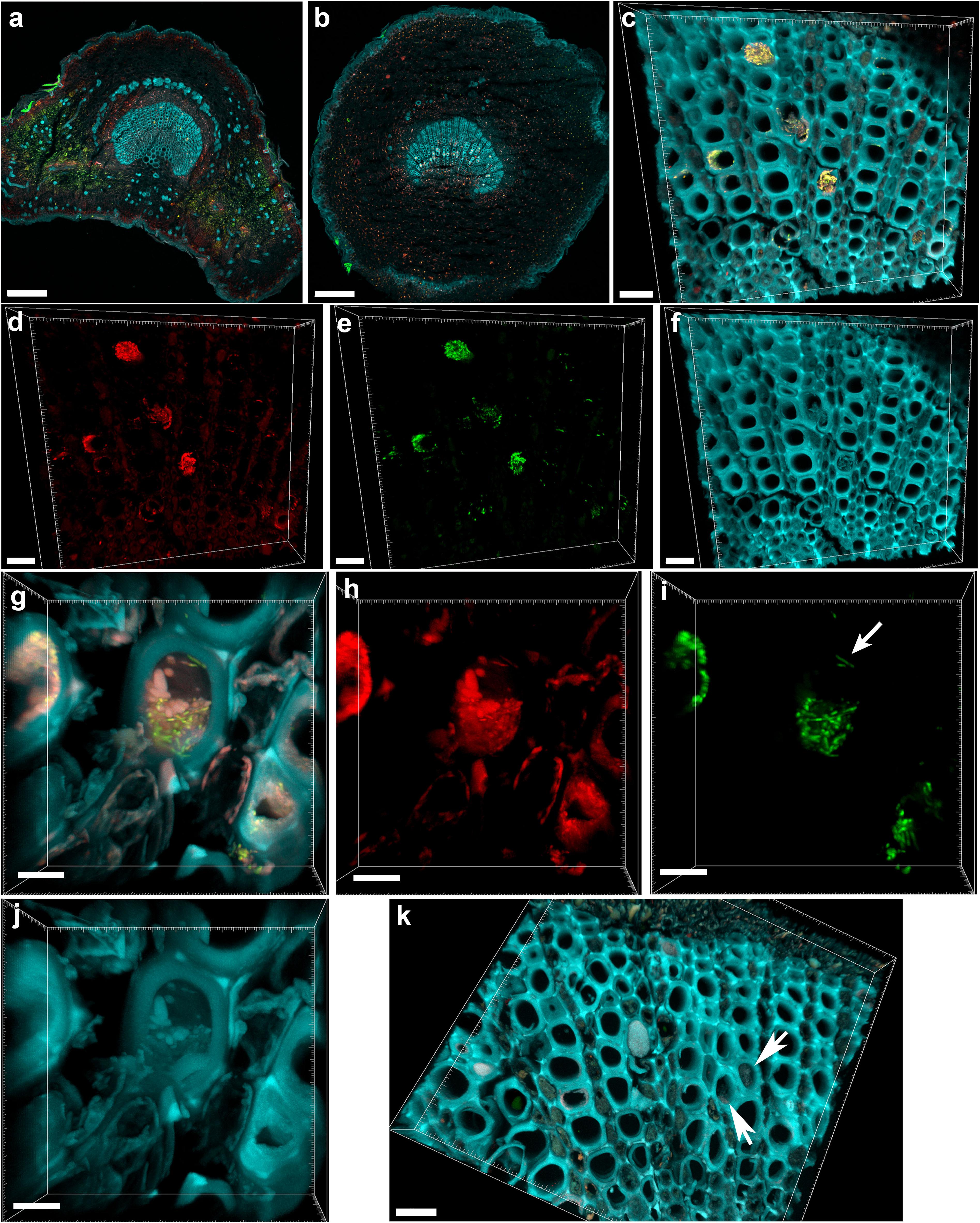
HER2 – это рецептор, который присутствует в тканях и в норме, участвуя в регуляции деления и дифференцировки клеток. Его избыток на поверхности опухолевых клеток (гиперэкспрессия) предопределяет быстрый неконтролируемый рост новообразования, высокий риск метастазирования и низкую эффективность некоторых видов лечения. Гиперэкспрессия HER2 при некоторых подтипах РМЖ ведет к усилению пролиферации и ангиогенеза, а также к нарушению регуляции апоптоза (генетически запрограммированного самоуничтожения клеток). В настоящее время имеются препараты, мишенью которых является рецептор HER2. Это, в частности, герцептин (трастузумаб), представляющий собой моноклональные антитела против HER2/neu рецепторов.
Амплификация и гиперэкспрессия онкогена HER2 (ЕrbB-2) являются относительно специфическими событиями для карциномы молочной железы и практически не встречаются в опухолях других локализаций. Рак желудка (РЖ) – одно из немногих исключений: активация HER2 отмечается примерно в 10-15% случаев злокачественных новообразований этого органа и коррелирует с агрессивным течением заболевания. При HER2-положительном раке молочной железы на поверхности опухолевых клеток может присутствовать избыток HER2-рецепторов (что обозначается как положительный HER2-статус, или положительный герцепт-статус). Это явление наблюдается у 15-20% женщин, страдающих РМЖ. Оценка HER2-статуса важна для определения тактики лечения.
Основные стандартизованные методы выявления гиперэкспрессии HER2/neu и/или амплификации гена HER2/neu – иммуногистохимический (ИГХ) метод и флуоресцентная гибридизация in situ (FISH). Оба исследования проводятся на гистологических препаратах (срезах материала опухоли, залитого в парафин) с использованием поликлональных антител (ИГХ), флуоресцентных зондов (FISH) и разных систем визуализации.
При оценке результатов ИГХ-реакции учитывается экспрессия только в инвазивном компоненте опухоли. Оценка результатов реакции проводится с помощью балльной шкалы: 0, 1+, 2+, 3+, разработанной производителем теста и получившей одобрение экспертов. Герцепт-статус, оцененный как 0 и 1+, следует считать негативным – гиперэкспрессия белка отсутствует, что соотносится с отсутствием амплификации его гена. Герцепт-статус, оцененный как 3+, является позитивным, т. е. гиперэкспрессия белка присутствует, что соотносится с наличием амплификации гена. Герцепт-статус 2+ считается неопределенным, т. е. по экспрессии белка, определенной на основании иммуногистохимической реакции, нельзя уверенно судить об амплификации гена, поэтому требуется исследование, прямо выявляющее наличие или отсутствие амплификации. FISH-метод применяют на срезах с того же образца (блока), на котором проводилось иммуногистохимическое исследование. При FISH-гибридизации оценку наличия амплификации гена HER2 проводят путем подсчета соотношения красных флуоресцентных (соответствующих помеченным генам HER2) и зеленых флуоресцентных сигналов, которыми помечен центромерный участок 17-й хромосомы.
Материал для исследования: парафиновый блок с биоптатом опухоли.
Внимание! ОБЯЗАТЕЛЬНО:
- предметное стекло с ИГХ-окрашиванием с антителами к HER2/neu
- направление от врача или выписка с результатами гистологического и ИГХ-исследования с антителами к Her-2/neu
Литература
- Завалишина Л.Э., Франк Г.А. Морфологическое исследование HER2 статуса. Методика и атлас. — М.: Изд. «Media Medica». 2006:98.
- Злокачественные заболевания в России в 2011 году (заболеваемость и смертность). Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. — М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России. 2013:289.
- Онкология. Клинические рекомендации. Ассоциация онкологов России. Под ред.
 В.И. Чиссова, С.Л. Дарьяловой. — М.: Изд. «ГЭОТАР-Медиа». 2008:702.
В.И. Чиссова, С.Л. Дарьяловой. — М.: Изд. «ГЭОТАР-Медиа». 2008:702. - Bang Y.J., Van Cutsem E., Feyereislova A., Chung H.C., Shen L., Sawaki A. et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376:687-697.
- Dabbs D.J. Diagnostic Immunohistochemistry: Theranostic and Genomic Applications. Elsevier, 4-th Edition. 2013:960.
- Ferlay J., Shin H.R., Bray F., Forman D., Mathers C., Parkin D.M. GLOBOCAN 2008, Cancer Incidence and Mortality Worldwide: IARC Cancer Base № 10. Lyon, France: International Agency for Research on Cancer; 2010. Available from: http://globocan.iarc.fr.
- Goldhirsch A., Glick J.H., Gelber R.D., Coates A.S., Thurlimann В., Senn H.J. Meeting Highlights: International Expert Consensus on the Primary Therapy of Early Breast Cancer 2005.

- Kurman R.J., Carcangiu M.L., Herrington C.S., Young R.H. WHO Classification of Tumours of the Female Reproductive Organs. WHO Press, 4-th Edition. 2014;4:316.
- NordiQC. http://www.nordiqc.org.
- Park D.I., Yun J.W., Park J.H. et al. Her2/neu amplification is an independent prognostic factor in gastric cancer. Digestive Diseases and Sciences. 2006;51(8):1371-1379.
- Slamon D. et al. Adjuvant Trastuzumab in HER2-Positive Breast Cancer. The New England Journal of Medicine. 2011;365:1273-1283.
Анализ fish при раке молочной железы- что это такое, показания к проведению
Анализ FISH при раке молочной железы
Онкология молочной железы – раковое заболевание, встречающееся у женщин наиболее часто. Проблема сложна и совершенно не случайно приковывает к себе ученых и врачей всего мира, которые разрабатывают и на практике осуществляют новые диагностические процедуры.
Сегодня диагностические методы значительно изменились в сторону усовершенствования. Среди новейших эффективных методов диагностики в настоящее время выделяют FISH, или флуоресцентная гибридизация in situ.
Зачем используется
Медицинская практика показывает, что онкология молочной железы имеет, как правило, различный гормональный статус. Его различие крайне важно для определения тактики лечения.
Один из биологических маркеров опухоли – рецептор HER2-neu, отвечающий за рост и деление клеток.
Данный ген, кодирующий одноименный белок HER2-neu, «виновен» в образовании примерно трети случаев заболевания онкологией молочной железы.
Увеличение экспрессии приводит к бесконтрольному делению клеток, но хуже всего то, что образовавшаяся при этом опухоль очень агрессивна.
Моноклональное антитело, позволяющее затормозить и даже заблокировать белок HER2-neu, снизив агрессивность заболевания, разработано учеными и применяется на практике в ведущих онкологических центрах.
Но проблема остается: чтобы применение препарата дало желаемый эффект, нужно с точностью определить, что в конкретном случае у пациента именно повышенная экспрессия белка HER2-neu в опухолевой ткани.
Решение данной проблемы – тест FISH.
Преимущества
Тест более эффективен в сравнении с иными методами диагностической цитогенетики. Преимущества его подтверждены исследованиями и медицинской практикой.
Пожалуй, главное преимущество FISH в том, что данное исследование можно применять не только к метафазным ядрам, но и к клеткам неделящимся, то есть интерфазным.
В силу этой особенности тест становится более точным и информативным в плане определения хромосомных изменений в тканях, имеющих низкую пролиферативную активность, например, опухолях значительных размеров.
Для FISH-тестирования можно использовать биоматериалы самые разные:
- Мазки;
- Аспираты тонкоугольной аспирационной биопсии;
- Аспираты костного мозга;
- Биоптаты;
- Гистологические блоки.
Последнее очень важно, ведь благодаря этой уникальной возможности тестирование может быть проведено даже с использованием препаратов повторных, полученных ранее при проведении биопсии.
Еще одно преимущество FISH-теста – возможность обнаружить хромосомные аномалии (микроделеции), не выявленные с помощью кариотипирования или ПЦР.
Как диагностический метод исследование играет важную роль в различении раковых заболеваний – миелолейкоза, промиелоцитарного лейкоза и других.
Если новообразование крупное, тест применим не только для определения онкологии молочной железы, но и мочевого пузыря, толстой кишки и т.д.
В большинстве случаев FISH-тестирование используют в комплексе с иными методами молекулярной и цитогенетической диагностики. Для более точного результата необходимо учесть и дополнительные данные, лабораторные и инструментальные.
Для более точного результата необходимо учесть и дополнительные данные, лабораторные и инструментальные.
Когда назначается FISH
Есть несколько способов определения статуса HER2-neu в патогенных клетках. Наиболее дешевый и простой в применении – иммуногистохимическое исследование. Но случается, что и оно не срабатывает и точного ответа врач не получает.
Анализируя результаты исследования на статус HER2-neu, специалист-онколог опирается за следующую систему:
- 0-1+. Это означает отрицательный результат;
- 2+. Нет определения статуса;
- 3+. Позитивный статус.
Здесь на помощь и приходит FISH-тест, потому что именно его проводят в случае, когда статус не определен, нет достоверной картины экспрессии гена, что, в свою очередь, означает вероятность неправильного выбора лечебной методики.
Несмотря на успехи современной онкологии, сегодня в арсенале врача нет FISH-тестов, которые бы помогли определить первоначальные стадии заболевания. Анализ FISH при раке молочной железы применяют в отношении пациентов, у которых злокачественное новообразование уже диагностировано, удалено и которым необходимо дальнейшее лечение.
Анализ FISH при раке молочной железы применяют в отношении пациентов, у которых злокачественное новообразование уже диагностировано, удалено и которым необходимо дальнейшее лечение.
Подготовка и проведение тестирования
Первый этап подготовки к проведению теста – взятие образцов патогенных клеток.
В большинстве случаев это происходит, когда пациентка уже прошла диагностическое исследование, включая биопсию. Иногда требуется повторное ее проведение.
Этап следующий – исследование иммуногистохимическое.
Как уже было отмечено выше, его плюсами являются простота и экономичность. К тому же это исследование помогает с высокой точностью определить в молочной железе статус HER2-neu.
При результате иммуногистохимии 2+, материал отправляется на FISH-тест.
Таким образом, FISH проводят на материале молочной железы, использованном при исследовании иммуногистохимическом.
В FISH-тесте используют ДНК-зонды, помеченными для визуализации специальными красителями, которые направлены на определенные мишени в патогенной клетке.
Специалиста-онколога интересует 17-я хромосома, где располагается ген, кодирующий белок HER2-neu.
Результатами теста FISH являются количество хромосом, а также количество копий гена в патогенных клетках. Это дает возможность врачу оценить процесс и сделать заключение.
Иначе говоря, FISH позволяет очень точно определить HER2-статус опухоли и на основании этого подобрать соответствующее лечение.
Плюсы и минусы
Главный плюс FISH-теста – высокая точность.
Лечение с применением препарата Герцептина (Трастузумаба), назначенным по результатам теста, значительно снижает вероятность рецидива (до 50%) и показатель смертности (30%).
Среди плюсов FISH-тестирования:
- Высокая чувствительность;
- Специфичность;
- И главное – короткий срок выполнения.

Среди ограничений выделим:
- Дорогостоящее оборудование;
- Дорогие расходные материалы;
- Высокая стоимость исследования.
FISH-тест применяют в крупных онкологических центрах в ситуациях специфических. Не всем он показан, но помогает в выборе лечебной методики и улучшает прогноз при опухоли молочной железы.
Врачи клиники интегративной онкологии Onco.Rehab проводят диагностические мероприятия и необходимые анализы для выявления раковых заболеваний, их особенностей, степени развития для назначения оптимальной методики лечения.
FISH тест
FISH тест – это относительно новый метод, позволяющий определять расположение генетического материала в клетке вплоть до отдельных генов и генных сегментов. С помощью данного обследования можно выявлять генетические отклонения, вызвавшие раковое заболевание. Благодаря этому FISH тест является быстрым и высокоточным методом выявления определенных типов опухолей.
Одна из главных особенностей данного теста в том, что он может применяться к неделящимся клеткам. За счет этого такое исследование является одним из самых точных методов для выявления хромосомных аномалий в тканях с низкой пролиферативной активностью.
В каких случаях может быть назначен FISH тест?
Как правило, данное исследование назначается в таких случаях:
- Для подтверждения ранее поставленного диагноза, в том числе для дифференциальной диагностики. Метод ценится в первую очередь за свою высокую точность.
- Если у пациента выявлена солидная опухоль или рак крови. Зачастую бывает непросто выбрать один из множества методов лечения. Но FISH тест позволяет определить хромосомный состав опухолевого клона. Благодаря этому лечащий врач может назначить оптимальную персонализированную тактику лечения.
Данное исследование предоставляет врачу всю необходимую информацию об опухоли. Это позволяет дать примерный прогноз течения заболевания, а также определиться с необходимостью проведения химиотерапии.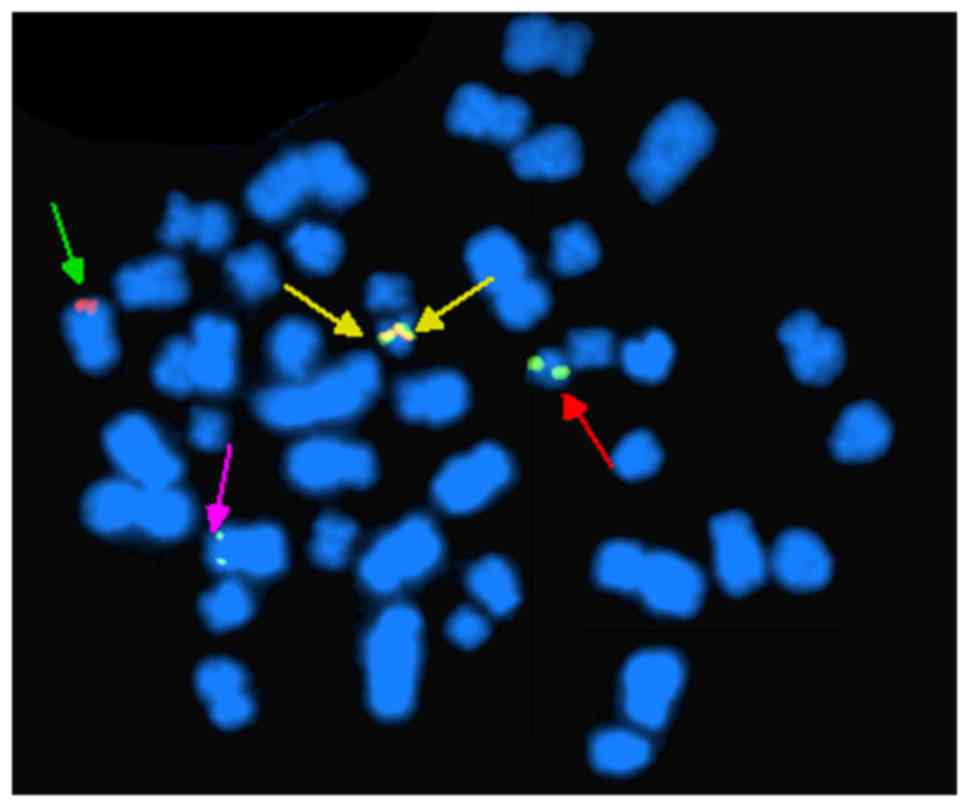
Например, если у пациента рак груди, то FISH тест пораженных тканей, полученный при биопсии, помогает определить наличие или отсутствие в клетках копий гена Her2. Если копия этого гена есть в крови, то врач назначает пациенту препараты, подавляющие способность рецепторов Her2 принимать сигналы. Именно такие сигналы используются для стимулирования роста раковых клеток.
Проведение FISH-теста в клинике Tel Aviv Medical Clinic
Tel Aviv Medical Clinic – это одно из ведущих медицинских учреждений Израиля. В клинике находится современное отделение генетики, оснащенное новейшим оборудованием. В отделении работают высококвалифицированные специалисты с многолетним опытом и мировым именем. Все это позволяет нам проводить любые генетические исследования, в том числе FISH тест.
| 42.1 | Стандартное цитогенетическое исследование клеток костного мозга, лимфатических узлов, ткани опухоли (кариотипирование) | 6 000 р. | |
| 42.2 | Флуорисцентная in situ гибридизация (FISH) на суспензии клеток, отпечатках или мазках (1 ДНК-зонд) | 5 000 р. | |
| 42.6 | Конституциональный кариотип. Определение хромосомных перестроек в ФГА стимулированных лимфоцитах крови методом G-дифференциального окрашивания | 6 000 р. | |
| 42.7 | ДЭБ-тест (Анемия Фанкони) | 7 500 р. | |
| 42.8 | Флуоресцентная in situ гибридизация (FISH) на парафиновых срезах (1 ДНК-зонд) | 7 700 р. | |
| 42.1.1 | Кариотип клеток крови/костного мозга/другое | 6 000 р. | |
| 42.1.2 | Кариотип клеток крови/костного мозга/другое | 6 000 р. | |
| 42.1.3 | Кариотипирование клеток костного мозга | 6 000 р. | |
| 42.17 | Определение химерного транскрипта методом ПЦР (1 исследование)* | 3 600 р. | |
42. 18 18 | Определение химерного транскрипта методом ПЦР (2 исследования — первая точка определения МОБ)* | 7 200 р. | |
| 42.19 | Отсутствие результата цитогенетического исследования костного мозга (включая культивирование) при отсутствии делящихся клеток | 3 000 р. | |
| 42.2.1 | FISH Другой ДНК-зонд | 5 000 р. | |
| 42.22 | Определение мутаций методом секвенирования по Сенгеру (1 фрагмент)* | 4 000 р. | |
| 42.2.2 | FISH t(9;22)(q34;q11)/ BCR-ABL1 | 5 000 р. | |
| 42.23 | Определение мутаций методом фрагментного анализа (1 фрагмент) | 4 000 р. | |
| 42.2.3 | FISH t(4;11)(q21;q23)/ KMT2A(MLL)-AFF1(AF4) | 5 000 р. | |
| 42.24 | Определение делеций/амплификаций методом MLPA* | 11 000 р. | |
| 42.2.4 | FISH t(12;21)(p13;q22) /ETV6-RUNX1 | 5 000 р. | |
| 42.25 | Выделение ДНК/РНК из клеток костного мозга/крови (включая выделение мононуклеаров) | 1 200 р. | |
| 42.2.5 | FISH KMT2A (MLL) | 5 000 р. | |
| 42.26 | Выделение ДНК/РНК из парафиновых срезов | 2 000 р. | |
| 42.2.6 | FISH t(10;11)(p12;q23)/ KMT2A(MLL)-MLLT10(AF10) | 5 000 р. | |
| 42.2.7 | FISH t(9;11)(p22;q23)/ KMT2A(MLL)-MLLT3(AF9) | 5 000 р. | |
| 42.2.8 | FISH t(11;19)(q23;p13.1)/ KMT2A(MLL)-ELL или KMT2A(MLL)-MLLT1(ENL) | 5 000 р. | |
| 42.30 | Определение мутаций при миелоидных опухолях методом секвенирования «нового поколения» (NGS) (в т.ч. «Миелоидная панель») | 80 000 р. | |
| 42.31 | Выделение ДНК для NGS | 1 300 р. | |
| 42.32 | Невключение зонда в клеточный материал (отсутствие результата при FISH -исследовании, невалидный результат) | 5 500 р. | |
| 42.7.1 | ДЭБ-тест (Анемия Фанкони) | 7 500 р. | |
| 42.8.1 | FISH ГИСТО t(8;14)(q24;q32)/ CMYC-IGH | 7 700 р. | |
| 42.8.2 | FISH ГИСТО t(2;8)(p12;q24)/ CMYC-IGK | 7 700 р. | |
| 42.8.3 | FISH ГИСТО t(8;22)(q24;q11)/ CMYC-IGL | 7 700 р. | |
| 42.8.4 | FISH ГИСТО CMYC | 7 700 р. | |
| 42.8.5 | FISH ГИСТО IGH | 7 700 р. | |
| 42.8.6 | FISH ГИСТО BCL2 | 7 700 р. | |
| 42.8.7 | FISH ГИСТО BCL6 | 7 700 р. | |
| 42.8.8 | FISH ГИСТО IRF4 | 7 700 р. | |
| 42.8.9 | FISH ГИСТО Делеция 17р (ТР53) | 7 700 р. | |
| 42.1.10 | Кариотип клеток крови/костного мозга/другое | 6 000 р. | |
| 42.17.1 | ПЦР ДИАГН/МОБ ПОВТОР ETV6-RUNX1/t(12;21)(p13;q22) | 3 600 р. | |
| 42.17.2 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-MLLT10(AF10)/t(10;11)(p12;q23) | 3 600 р. | |
| 42.17.3 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-AFF1(AF4)/t(4;11)(q21;q23) | 3 600 р. | |
| 42.17.4 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-MLLT3(AF9)/t(9;11)(p22;q23) | 3 600 р. | |
| 42.17.5 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-ELL/t(11;19)(q23;p13.1) | 3 600 р. | |
| 42.17.6 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-MLLT1(ENL)/t(11;19)(q23;p13.3) | 3 600 р. | |
| 42.17.7 | ПЦР ДИАГН/МОБ ПОВТОР PICALM-MLLT10(AF10)/t(10;11)(p12;q21-22) | 3 600 р. | |
| 42.17.8 | ПЦР ДИАГН/МОБ ПОВТОР SIL/TAL(1р32) | 3 600 р. | |
| 42.17.9 | ПЦР ДИАГН/МОБ ПОВТОР TCF3(E2A)-PBX1/t(1;19)(q23;p13) | 3 600 р. | |
| 42.18.1 | ETV6-RUNX1/t(12;21)(p13;q22) | 7 200 р. | |
| 42.18.2 | KMT2A(MLL)-MLLT10(AF10)/t(10;11)(p12;q23) | 7 200 р. | |
| 42.18.3 | KMT2A(MLL)-AFF1(AF4)/t(4;11)(q21;q23) | 7 200 р. | |
| 42.18.4 | ПЦР МОБ ПЕРВ KMT2A(MLL)-MLLT3(AF9)/t(9;11)(p22;q23) | 7 200 р. | |
| 42.18.5 | ПЦР МОБ ПЕРВ KMT2A(MLL)-ELL/t(11;19)(q23;p13.1) | 7 200 р. | |
| 42.18.6 | ПЦР МОБ ПЕРВ KMT2A(MLL)-MLLT1(ENL)/t(11;19)(q23;p13.3) | 7 200 р. | |
| 42.18.7 | ПЦР МОБ ПЕРВ PICALM-MLLT10(AF10)/t(10;11)(p12;q21-22) | 7 200 р. | |
| 42.18.8 | ПЦР МОБ ПЕРВ SIL/TAL(1р32) | 7 200 р. | |
| 42.18.9 | ПЦР МОБ ПЕРВ TCF3-PBX1/t(1;19)(q23;p13) | 7 200 р. | |
| 42.2.10 | FISH t(6;11)(q27;q23)/ KMT2A(MLL)-AFDN(AF6) | 5 000 р. | |
| 42.2.11 | FISH t(10;11)(p12;q21-22)/ PICALM-MLLT10(AF10) | 5 000 р. | |
| 42.2.12 | FISH E2A(TCF3) (t(17;19)(q22;p13/t(1;19)(q23;p13) | 5 000 р. | |
| 42.2.13 | FISH t(1;19)(q23;p13)/ E2A(TCF3)-PBX1 | 5 000 р. | |
| 42.2.14 | FISH Подтверждение гиподиплоидного кариотипа 7/8 | 5 000 р. | |
| 42.2.15 | FISH Делеция 17р (ТР53) | 5 000 р. | |
| 42.2.16 | FISH Подтверждение гипердиплоидного кариотипа 4/10/17 | 5 000 р. | |
| 42.2.17 | FISH t(8;14)(q24;q32)/ CMYC-IGH | 5 000 р. | |
| 42.2.18 | FISH t(2;8)(p12;q24)/ CMYC-IGK | 5 000 р. | |
| 42.2.19 | FISH t(8;22)(q24;q11)/ CMYC-IGL | 5 000 р. | |
| 42.2.20 | FISH CMYC | 5 000 р. | |
| 42.22.1 | МУТАЦИИ KIT ex8-11,17 | 20 000 р. | |
| 42.2.21 | FISH IGH | 5 000 р. | |
| 42.22.2 | МУТАЦИИ NPM1 ex12 | 4 000 р. | |
| 42.2.22 | FISH ZNF384 | 5 000 р. | |
| 42.2.23 | FISH ETV6 | 5 000 р. | |
| 42.22.3 | МУТАЦИИ FLT3 ex20 | 4 000 р. | |
| 42.22.4 | МУТАЦИИ ASLX1 ex12 | 24 000 р. | |
| 42.2.24 | FISH CRLF2 | 5 000 р. | |
| 42.22.5 | МУТАЦИИ DNMT3A ex 2-23 | 56 000 р. | |
| 42.2.25 | FISH PDGFRB | 5 000 р. | |
| 42.2.26 | FISH ABL1 | 5 000 р. | |
| 42.22.6 | МУТАЦИИ EZh3 ex14 | 4 000 р. | |
| 42.22.7 | МУТАЦИИ FBWX7 ex9,10 | 8 000 р. | |
| 42.2.27 | FISH ABL2 | 5 000 р. | |
| 42.22.8 | МУТАЦИИ IDh2 ex4 | 4 000 р. | |
| 42.2.28 | FISH JAK2 | 5 000 р. | |
| 42.22.9 | МУТАЦИИ IDh3 ex4 | 4 000 р. | |
| 42.2.29 | FISH EPOR | 5 000 р. | |
| 42.2.30 | FISH PAX5 | 5 000 р. | |
| 42.2.32 | FISH P2RY8 | 5 000 р. | |
| 42.23.2 | МУТАЦИИ ФА FLT3- ITD ex14-15 | 4 000 р. | |
| 42.2.33 | FISH CSF1R | 5 000 р. | |
| 42.23.3 | МУТАЦИИ ФА Другие гены (фрагментный анализ) | 4 000 р. | |
| 42.2.34 | FISH CREBBP | 5 000 р. | |
| 42.2.35 | FISH SIL/TAL(1р32) | 5 000 р. | |
| 42.2.36 | FISH TLX3/5q35 rear | 5 000 р. | |
| 42.2.37 | FISH TAL1 | 5 000 р. | |
| 42.2.38 | FISH TLX1 | 5 000 р. | |
| 42.2.39 | FISH TCRA | 5 000 р. | |
| 42.2.40 | FISH TCRB | 5 000 р. | |
| 42.2.41 | FISH Определение половых хромосом (XY) | 5 000 р. | |
| 42.24.1 | MLPA IKZF1(7p12.2), PAX5 (9p13.2), six probes for ETV6 (12p13.2), RB1 (13q14.2),BTG1 (12q21.33), EBF1 (5q33.3), CDKN2A-CDKN2B (9p21.3), Xp22.33 region (PAR1 region; SHOX area, CRLF2, CSF2RA, IL3RA and P2RY8 genes), At Yp11.31 (ZFY), 9p24.1 (JAK2) | 11 000 р. | |
| 42.24.2 | MLPA IKZF1,ERG, CDKN2A/2B, 14q32.33 | 11 000 р. | |
| 42.24.3 | MLPA STIL-TAL1 (1p33), LEF1 (4q25), CASP8AP2 (6q15), MYB (6q23), EZh3 (7q36) MLLT3+MTAP+CDKN2A/B (9p21), NUP214-ABL1 (9q34), PTEN (10q23), LMO1 (11p15), LMO2 (11p13), NF1+SUZ12 (17q11), PTPN2 (18p11), PHF6 (Xq26) | 11 000 р. | |
| 42.2.51 | FISH t(16;21)(p11;q22)/FUS-ERG | 5 000 р. | |
| 42.2.52 | FISH t(8;21)(q22;q22)/ RUNX1-RUNX1T1(ETO) | 5 000 р. | |
| 42.2.53 | FISH inv(16)(p16q22)/ t(16;16)(p13;q22)/ CBFβ-MYh21 | 5 000 р. | |
| 42.2.54 | FISH t(1;22)(p13;q13)/ OTT-MAL | 5 000 р. | |
| 42.2.55 | FISH t(15;17)(q24;q21)/ PML-RARa | 5 000 р. | |
| 42.2.57 | FISH t(6;9)(p23;q34.1)/ DEK-NUP214 | 5 000 р. | |
| 42.2.58 | FISH inv(3)(q21.3q26.2)/t(3;3)(q21.3;q26.2) | 5 000 р. | |
| 42.2.59 | FISH t(7;12)(q36;p13)/MNX1-ETV6 | 5 000 р. | |
| 42.2.60 | FISH NUP98 | 5 000 р. | |
| 42.2.61 | FISH RARa | 5 000 р. | |
| 42.2.62 | FISH Делеция 5q/ моносомия 5 | 5 000 р. | |
| 42.2.63 | FISH Моносомия 7/делеция 7q | 5 000 р. | |
| 42.2.64 | FISH Трисомия 8 | 5 000 р. | |
| 42.2.66 | FISH t(3;21) MECOM/RUNX1 | 5 000 р. | |
| 42.2.71 | FISH Делеция (20q) | 5 000 р. | |
| 42.2.77 | FISH PDGFRA | 5 000 р. | |
| 42.2.80 | FISH FGFR1 | 5 000 р. | |
| 42.2.82 | FISH Делеция участка 22q11.2 | 5 000 р. | |
| 42.2.88 | FISH BCL2 | 5 000 р. | |
| 42.2.89 | FISH BCL6 | 5 000 р. | |
| 42.2.90 | FISH IRF4 | 5 000 р. | |
| 42.2.91 | FISH Делеция 17р (ТР53) | 5 000 р. | |
| 42.2.92 | FISH t(11;14)(q13;q24)/ CCND1(BCL1)-IGH | 5 000 р. | |
| 42.2.93 | FISH t(14;18)(q32;q21)/ IGH-BCL2 | 5 000 р. | |
| 42.2.94 | FISH t(14;18)(q32;q21)/IGH-MALT1 | 5 000 р. | |
| 42.2.95 | FISH TCRB(7q34) | 5 000 р. | |
| 42.2.96 | FISH TCRalpha/delta | 5 000 р. | |
| 42.2.98 | FISH трисомия 12 | 5 000 р. | |
| 42.2.99 | FISH del13q14, del13q34 | 5 000 р. | |
| 42.30.1 | МУТАЦИИ NGS набор Human Myeloid Neoplasms Panel, № DHS-003Z (Qiagen), включающего 141 ген (ABL1, ADA, ANKRD26, ASXL1, ASXL2, ATM, ATRX, BCL6, BCOR, BCORL1, BCR, BIRC3, BLM, BRAF, BRCA1, BRCA2, C17orf97, CALR, CARD11, CBL, CBLB, CBLC | 80 000 р. | |
| 42.30.2 | МУТАЦИИ NGS набор Human Myeloid Neoplasms Panel, № DHS-003Z (Qiagen), включающего 141 ген (ABL1, ADA, ANKRD26, ASXL1, ASXL2, ATM, ATRX, BCL6, BCOR, BCORL1, BCR, BIRC3, BLM, BRAF, BRCA1, BRCA2, C17orf97, CALR, CARD11, CBL, CBLB, CBLC, CDKN2A, CEBPA | 80 000 р. | |
| 42.30.3 | МУТАЦИИ NGS набор Human Myeloid Neoplasms Panel, № DHS-003Z (Qiagen), включающего 141 ген (ABL1, ADA, ANKRD26, ASXL1, ASXL2, ATM, ATRX, BCL6, BCOR, BCORL1, BCR, BIRC3, BLM, BRAF, BRCA1, BRCA2, C17orf97, CALR, CARD11, CBL, CBLB, CBLC, CDKN2A, CEBPA | 80 000 р. | |
| 42.8.10 | FISH ГИСТО t(11;14)(q13;q24)/ CCND1(BCL1)-IGH | 7 700 р. | |
| 42.8.11 | FISH ГИСТО t(14;18)(q32;q21)/ IGH-BCL2 | 7 700 р. | |
| 42.8.12 | FISH ГИСТО t(14;18)(q32;q21)/IGH-MALT1 | 7 700 р. | |
| 42.8.13 | FISH ГИСТО TCRB(7q34) | 7 700 р. | |
| 42.8.14 | FISH ГИСТО TCRalpha/delta | 7 700 р. | |
| 42.8.15 | FISH ГИСТО NMYC | 7 700 р. | |
| 42.8.16 | FISH ГИСТО del(1p36) | 7 700 р. | |
| 42.8.17 | FISH ГИСТО del(11q23) | 7 700 р. | |
| 42.8.18 | FISH ГИСТО C-MYC | 7 700 р. | |
| 42.8.19 | FISH ГИСТО N-MYC | 7 700 р. | |
| 42.8.20 | FISH ГИСТО SMARCB1 | 7 700 р. | |
| 42.8.21 | FISH ГИСТО FOXO1 | 7 700 р. | |
| 42.8.22 | FISH ГИСТО EWSR1 | 7 700 р. | |
| 42.8.23 | FISH ГИСТО EWSR/ERG | 7 700 р. | |
| 42.8.24 | FISH ГИСТО FLI1/EWSR | 7 700 р. | |
| 42.8.25 | FISH ГИСТО FUS | 7 700 р. | |
| 42.8.26 | FISH ГИСТО CIC | 7 700 р. | |
| 42.8.27 | FISH ГИСТО ETV6 | 7 700 р. | |
| 42.8.28 | FISH ГИСТО DDI3A | 7 700 р. | |
| 42.8.29 | FISH ГИСТО SSI18 (SYT) | 7 700 р. | |
| 42.8.30 | FISH ГИСТО ALK | 7 700 р. | |
| 42.8.31 | FISH ГИСТО MDM2 (12q15) | 7 700 р. | |
| 42.8.32 | FISH ГИСТО PDGFRB | 7 700 р. | |
| 42.8.33 | FISH ГИСТО Другой ДНК зонд | 7 700 р. | |
| 42.17.10 | ПЦР ДИАГН/МОБ ПОВТОР TLX3/5q35 rear | 3 600 р. | |
| 42.17.11 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-AFDN(AF6)/t(6;11)(q27;q23) | 3 600 р. | |
| 42.17.12 | ПЦР ДИАГН/МОБ ПОВТОР BCR-ABL1/ t(9;22)(q34;q11) | 3 600 р. | |
| 42.17.13 | ПЦР ДИАГН/МОБ ПОВТОР Определение химерного транскрипта методом ПЦР генов, не указанных в перечне приложения к прейскуранту №4 (1 исследование) | 3 600 р. | |
| 42.17.14 | ПЦР ДИАГН/МОБ ПОВТОР RUNX1-RUNX1T1(ETO)/t(8;21)(q22;q22) | 3 600 р. | |
| 42.17.15 | ПЦР ДИАГН/МОБ ПОВТОР CBFβ-MYh21/inv(16)(p16q22)/t(16;16)(p13;q22) | 3 600 р. | |
| 42.17.17 | ПЦР ДИАГН/МОБ ПОВТОР FUS-ERG/t(16;21)(p11;q22) | 3 600 р. | |
| 42.17.23 | ПЦР ДИАГН/МОБ ПОВТОР OTT-MAL/t(1;22)(p13;q13) | 3 600 р. | |
| 42.17.25 | ПЦР ДИАГН/МОБ ПОВТОР PML-RARa/t(15;17)(q24;q21) | 3 600 р. | |
| 42.17.27 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-EPS15(AF1p)/t(1;11)(p32;q23) | 3 600 р. | |
| 42.17.28 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-MLLT6(AF17)/t(11;17)(q23;q12-21) | 3 600 р. | |
| 42.17.29 | ПЦР ДИАГН/МОБ ПОВТОР KMT2A(MLL)-NEBL/t(10;11)(p12;q23) | 3 600 р. | |
| 42.17.30 | ПЦР ДИАГН/МОБ ПОВТОР NPM1-RARa/t(5;17)(q35;q21) | 3 600 р. | |
| 42.17.32 | ПЦР ДИАГН/МОБ ПОВТОР Определение химерного транскрипта методом ПЦР генов, не указанных в перечне приложения к прейскуранту №4 (1 исследование) | 3 600 р. | |
| 42.18.10 | ПЦР МОБ ПЕРВ TLX3/5q35 rear | 7 200 р. | |
| 42.18.11 | ПЦР МОБ ПЕРВ KMT2A(MLL)-AFDN(AF6)/t(6;11)(q27;q23) | 7 200 р. | |
| 42.18.12 | ПЦР МОБ ПЕРВ BCR-ABL1/ t(9;22)(q34;q11) | 7 200 р. | |
| 42.18.13 | ПЦР МОБ ПЕРВ Определение химерного транскрипта методом ПЦР генов, не указанных в перечне приложения к прейскуранту №4 (1 исследование) | 7 200 р. | |
| 42.18.14 | ПЦР МОБ ПЕРВ RUNX1-RUNX1T1(ETO)/t(8;21)(q22;q22) | 7 200 р. | |
| 42.18.15 | ПЦР МОБ ПЕРВ CBFβ-MYh21/inv(16)(p16q22)/t(16;16)(p13;q22) | 7 200 р. | |
| 42.18.17 | ПЦР МОБ ПЕРВ FUS-ERG/t(16;21)(p11;q22) | 7 200 р. | |
| 42.18.23 | ПЦР МОБ ПЕРВ OTT-MAL/t(1;22)(p13;q13) | 7 200 р. | |
| 42.18.25 | ПЦР МОБ ПЕРВ PML-RARa/t(15;17)(q24;q21) | 7 200 р. | |
| 42.18.27 | ПЦР МОБ ПЕРВ KMT2A(MLL)-EPS15(AF1p)/t(1;11)(p32;q23) | 7 200 р. | |
| 42.18.28 | ПЦР МОБ ПЕРВ KMT2A(MLL)-MLLT6(AF17)/t(11;17)(q23;q12-21) | 7 200 р. | |
| 42.18.29 | ПЦР МОБ ПЕРВ KMT2A(MLL)-NEBL/t(10;11)(p12;q23) | 7 200 р. | |
| 42.18.30 | ПЦР МОБ ПЕРВ NPM1-RARa/t(5;17)(q35;q21) | 7 200 р. | |
| 42.18.32 | ПЦР МОБ ПЕРВ Определение химерного транскрипта методом ПЦР генов, не указанных в перечне приложения к прейскуранту №4 (1 исследование) | 7 200 р. | |
| 42.2.100 | FISH del11q23 (ATM) | 5 000 р. | |
| 42.2.101 | FISH t(14;16)(q32;q23)/IGH-MAF1 | 5 000 р. | |
| 42.2.102 | FISH t(11;14)(q13;q32)/IGH-MYEOV | 5 000 р. | |
| 42.2.103 | FISH t(14;20)(q32;q12)/ IGH-MAFB | 5 000 р. | |
| 42.2.104 | FISH t(6;14)(p21;q32)/IGH-CCND3 | 5 000 р. | |
| 42.2.105 | FISH t(4;14)(p16;q32)/IgH-FGFR3 | 5 000 р. | |
| 42.2.107 | FISH 1p32/1q21 амплификация | 5 000 р. | |
| 42.2.108 | FISH del(1p36) | 5 000 р. | |
| 42.2.109 | FISH ГИСТО FISH del(11q23) | 5 000 р. | |
| 42.2.110 | FISH NMYC | 5 000 р. | |
| 42.22.10 | МУТАЦИИ NOTCH ex26,27,34 | 20 000 р. | |
| 42.22.11 | МУТАЦИИ PTEN ex7 | 4 000 р. | |
| 42.22.12 | МУТАЦИИ TET2 ex3-11 | 60 000 р. | |
| 42.22.14 | МУТАЦИИ RUNX1 ex5-9 | 32 000 р. | |
| 42.22.15 | МУТАЦИИ GATA2 ex2-6 | 20 000 р. | |
| 42.22.16 | МУТАЦИИ TP53 ex2-11 | 28 000 р. | |
| 42.22.17 | МУТАЦИИ GATA1 ex2 СЭНГЕР + ФА | 8 000 р. | |
| 42.22.18 | МУТАЦИИ Другие гены/Валидация найденных при ВПС перестроек (секвенирование по Сэнгеру) | 4 000 р. | |
| 42.22.28 | МУТАЦИИ NRAS ex2,3 | 8 000 р. | |
| 42.22.29 | МУТАЦИИ KRAS ex2,3 | 8 000 р. | |
| 42.22.30 | МУТАЦИИ CBL ex7,8,9 | 12 000 р. | |
| 42.22.31 | МУТАЦИИ PTPN11 ex3,13 | 8 000 р. | |
| 42.22.32 | МУТАЦИИ Прочие гены, не указанные в перечне | 4 000 р. | |
| 42.22.35 | МУТАЦИИ JAK2 ex 12 | 4 000 р. | |
| 42.22.36 | МУТАЦИИ JAK2 ex 14 (V617F) | 4 000 р. | |
| 42.22.37 | МУТАЦИИ MPL ex10 | 4 000 р. | |
| 42.22.38 | МУТАЦИИ CALR СЭНГЕР + ФА | 8 000 р. |
ДИАГНОСТИКА РЕЦИДИВОВ РАКА МОЧЕВОГО ПУЗЫРЯ С ПОМОЩЬЮ FISH-МЕТОДА, ОСУЩЕСТВЛЯЕМОГО НА КЛЕТКАХ ОСАДКА МОЧИ | Воробцова
1. Parekh D.J., Bochner B.H., Dalbagni G. Superficial and muscle-invasive bladder cancer: principles of management for outcomes assessment. J Clin Oncol 2006;24:5519–27.
2. D.A. Levy. Surveillance for Recurrent Bladder Cancer. eMedicine 2008. http:// emedicine.medscape.com/article/458825-overview
3. Hall M.C., Chang S.S., Dalbagni G. et al. Guideline for the management of nonmuscle invasive bladder cancer (stages Ta, T1, and Tis). J Urol 2007;178(6):2314–30.
4. Halling K.C., King W., Sokolova I.A. et al. A comparison of BTA stat, hemoglobin dipstick, telomerase and Vysis UroVysion assays for the detection of urothelial carcinoma in urine. J Urol 2002;167(5):2001–6.
5. Sokolova I.A., Halling K.C., Jenkins R.B. et al. The development of a multitarget, multicolor fluorescence in situ hybridization assay for the detection of urothelial carcinoma in urine. J Mol Diagn 2000;(3):116–23.
6. Слозина Н.М., Никифоров А.М., Неронов а Е.Г. и др. Молекулярно-цитогенетическая диагностика рака мочевого пузыря. Онкология 2007;8:268–82.
7. Воробцова И.Е., Васильева З.Ж., Школьник М.И. и др. Применение метода флуоресцентной гибридизации in situ на клетках осадка мочи для диагностики рака мочевого пузыря и его рецидивов. Онкоурология 2011;1:73–8.
8. Kipp B.R., Karnes R.J., Brankley S.M. et al. Monitoring intravesical therapy for superficial bladder cancer using fluorescence in situ hybridization. J Urol 2005;173:401–4.
9. Воробцова И.Е., Васильева З.Ж. Способ диагностики переходно-клеточного рака мочевого пузыря. Патент РФ №2456607 от 20.07.2012.
10. Halling K.С., King W., Sokolova I.A. et al. A comparison of cytology and fluorescence in situ hybridization for the detection of urothelial carcinoma. J Urol 2000;164(5):1768–75.
11. Башкатов С.В., Севанькаев А.В., Карякин О.Б. и др. Флуоресцентная гибридизация in situ: практическое применение в онкоурологии. Онкоурология 2008;3:9–15.
12. Schrag D., Hsieh L.J., Rabbani F. et al. Adherence to surveillance among patients with superficial bladder cancer. J Natl Cancer Inst 2003;95(8):588–97.
13. Halling K.С. Vysys UroVysion for the detection of urothelial carcinoma. Expert Rev Mol Diagn 2003:3(4):507–19.
14. Yoder B.J., Skacel M., Hedgepeth R. et al. Reflex UroVysion testing of bladder cancer surveillance patients with equivocal or negative urine cytology: a prospective study with focus on the natural history of anticipatory positive findings. Am J Clin Pathol 2007;127:295–301.
15. Sokolova I.A., Halling K.C., Jenkins R.B. et al. The development of a multitarget, multicolor fluorescence in situ hybridization assay for the detection of urothelial carcinoma in urine. J Mol Diagn 2000;2(3):116–23.
16. Kipp B.R., Tanasescu M., Else T.A. et al. Quantitative fluorescence in situ hybridization and its ability to predict bladder cancer recurrence and progression to muscle-invasive bladder cancer. J Molec Diagn 2009;2;148–54.
FISH-анализ в онкологии в Москве, анализ-FISH при раке молочной железы в «Евроонко»
Рак молочной железы является самым частым онкологическим заболеванием у женщин. Поэтому данной проблеме уделяется очень много внимания со стороны врачей и ученых. На сегодняшний день методы диагностики рака молочной железы существенно изменились и усовершенствовались. Одним из таких методов является флуоресцентная гибридизация in situ или FISH (фиш).
Зачем нужен FISH-анализ?
Рак молочной железы может иметь различный гормональный статус, который очень важно определить для подбора дальнейшего лечения. Выделяют несколько биологических маркеров опухоли, одним из которых является рецептор HER2-neu. Он отвечает за рост и деление клеток.
Примерно в 25-30% случаев рака молочной железы отмечается увеличение экспрессии данного гена, который кодирует одноименный белок HER2-neu. В связи с этим, клетки начинают бесконтрольно делиться, а сама опухоль становится агрессивной и характеризуется неблагоприятным прогнозом. Зная эту особенность, ученые смогли разработать специальный лекарственный препарат. Это моноклональное антитело, которое позволяет «заблокировать» белок HER2-neu и снизить агрессивность рака молочной железы. Однако для того, чтобы этот препарат оказался эффективным, необходимо точно определить, что у конкретного пациента имеется повышенная экспрессия белка HER2-neu в опухолевой ткани. Эту задачу как раз и призван решить фиш тест.
Когда назначается FISH тест
Определить статус HER2-neu в клетках рака молочной железы можно разными способами. Наиболее простым и дешевым является иммуногистохимическое исследование. Однако в части случаев оно не дает точного ответа. При анализе результатов, врач определяет статус HER2-neu в баллах или плюсах (+).
- 0-1+ — результат негативный.
- 2+ — статус не определен.
- 3+ — статус позитивный.
Флуоресцентная гибридизация in situ назначается при неопределенном результате иммуногистохимического исследования (2+). В этом случае нельзя достоверно оценить экспрессию гена, следовательно, нельзя быть уверенным, что пациенту поможет соответствующее лечение.
На сегодняшний день не существует FISH-тестов, позволяющих проводить раннюю диагностику рака молочной железы. Это исследование показано тем женщинам, у которых уже опухоль выявлена, удалена и которым требуется подобрать лечение.
Подготовка к тесту и алгоритм его проведения
Для того чтобы провести исследование по методу FISH, необходимо получить образец опухолевых клеток. Как правило, к тому моменту, когда женщине назначается данный анализ, она уже прошла все необходимые диагностические процедуры, в том числе биопсию. Однако в некоторых случаях требуется повторное проведение биопсии молочной железы, о чем врач предупредит заранее.
На следующем этапе обязательно проводится иммуногистохимическое исследование. Во-первых, оно более дешевое и простое, во-вторых, оно тоже с большой точностью может помочь определить статус HER2-neu в молочной железе. Если результат иммуногистохимии оценивается в 2+, то материал отправляется на FISH исследование.
Тест проводится на таком же материале молочной железы, который использовался при проведении иммуногистохимии. Метод FISH подразумевает использование ДНК-зондов, которые связываются с определенными мишенями в клетке. Для того чтобы зонд можно было визуализировать, его помечают специальными флуоресцентными красителями.
При оценке статуса HER2-neu интерес представляет 17 хромосома, на которой расположен ген, который кодирует данный белок. В процессе проведения флуоресцентной гибридизации in situ можно оценивать как количество хромосом, так и количество копий гена в клетках рака молочной железы. Для этого ткань проходит пробоподготовку и помечается ДНК-зондом, после чего врач оценивает срез под флуоресцентным микроскопом и дает свое заключение.
Достоинства и недостатки FISH теста
В настоящее время метод FISH позволяет с высокой точностью определить HER2-статус опухоли молочной железы и подобрать необходимое лечение. Такая необходимость возникла с разработкой лекарственного препарата Трастузумаб (Герцептин). Согласно исследованиям, при назначении его на ранних стадиях рака молочной железы удается снизить вероятность рецидива заболевания на 50%, а показатели смертности — на 30%, что является очень хорошим результатом.
Препарат оказывает действие только на те клетки рака молочной железы, которые отличаются высокой гиперэкспрессией HER2-neu. В остальных случаях Герцептин будет неэффективен. Среди других достоинств, которыми обладает тест FISH, можно отметить относительно быстрые сроки выполнения анализа (около 2-3 дней), высокую чувствительность и специфичность.
Для проведения FISH теста требуется дорогостоящее оборудование (флуоресцентный микроскоп) и расходные материалы, поэтому его пока предлагают лишь крупные клиники и диагностические центры. Кроме того, стоимость самого исследования также является высокой, но при этом полностью оправдывает себя.
Тест FISH — это один из методов современной диагностики рака молочной железы, который применяется только в специфических ситуациях. Несмотря на высокую точность, его не требуется назначать всем пациентам подряд, но при наличии показаний, этот метод может существенно помочь в выборе метода лечения и улучшить прогноз при раке молочной железы.
Стоимость
Из прайса вы сможете узнать стоимость услуг в клиниках «Евроонко»:
FISH-диагностика | Клиника «Надия»
Предимплантационная диагностика
Предимплантационная генетическая диагностика, сравнительная геномная гибридизация, 24 хромосомы, количество эмбрионов не больше 8-ми
57 300,00
Предимплантационная генетическая диагностика, сравнительная геномная гибридизация, 24 хромосомы, количество эмбрионов не больше 8-ми, без биопсии бластоцисты/бластомера
54 400,00
Предимплантационная генетическая диагностика: сравнительная геномная гибридизация, 24 хромосомы, за каждый дополнительный эмбрион свыше 8-ми
8 000,00
Предимплантационная генетическая диагностика методом ПЦР (I ст. сложности)
11 200,00
Предимплантационная генетическая диагностика методом ПЦР (ІI ст. сложности)
22 400,00
Предимплантационная генетическая диагностика методом ПЦР (ІII ст. сложности)
33 600,00
Предимплантационный генетический скрининг по 5 хромосомам (13, 18, 21, X, Y): биопсия бластомера, PGD
19 410,00
Предимплантационный генетический скрининг по 5 хромосомам (13, 18, 21, X, Y), без биопсии бластоцисты/бластомера, до 5 образцов включительно
6 900,00
Предимплантационный генетический скрининг по 5 хромосомам (13, 18, 21, X, Y), без биопсии бластоцисты/бластомера, до 10 образцов включительно
13 800,00
Предимплантационный генетический скрининг по 9 хромосомам (13, 15, 16, 17, 18, 21, 22, X, Y), без биопсии бластоцисты/бластомера, до 5 образцов включительно
9 700,00
Предимплантационный генетический скрининг по 9 хромосомам (13, 15, 16, 17, 18, 21, 22, X, Y), без биопсии бластоцисты/бластомера, до 10 образцов включительно
19 400,00
Предимплантационный генетический скрининг по 8 хромосомам (13, 15, 16, 18, 21, 22, X, Y), без биопсии бластоцисты/бластомера, до 10 образцов включительно
19 000,00
Предимплантационный генетический скрининг по 8 хромосомам (13, 15, 16, 18, 21, 22, X, Y), без биопсии бластоцисты/бластомера, до 5 образцов включительно
9 500,00
FISH Test (флуоресцентная гибридизация in situ)
Leer esta página en español
Флуоресцентная гибридизация in situ (FISH) — это тест, который «отображает» генетический материал в клетках человека. Этот тест можно использовать для визуализации определенных генов или их частей. FISH-тестирование проводится на ткани рака груди, удаленной во время биопсии, чтобы увидеть, есть ли в клетках дополнительные копии гена HER2 . Чем больше копий гена HER2 присутствует, тем больше рецепторов HER2 имеют клетки.Эти рецепторы HER2 получают сигналы, которые стимулируют рост клеток рака груди.
Результаты теста FISH покажут вам, что рак является либо «положительным», либо «отрицательным» (результат иногда обозначается как «ноль») для HER2.
Как правило, тест FISH не так широко доступен, как другой метод тестирования HER2, называемый иммуно-гистохимией или IHC. Однако FISH считается более точным. Во многих случаях лаборатория сначала проводит тест IHC, заказывая FISH только в том случае, если результаты IHC не ясно показывают, являются ли клетки HER2-положительными или отрицательными.
Исследования показали, что некоторые результаты тестов HER2 могут быть неверными. Вероятно, это связано с тем, что в разных лабораториях действуют разные правила классификации положительного и отрицательного статуса HER2. Каждый патологоанатом также может использовать несколько разные критерии, чтобы решить, являются ли результаты положительными или отрицательными. В большинстве случаев это происходит, когда результаты теста находятся на грани, то есть они не являются строго HER2-положительными или HER2-отрицательными.
В других случаях ткань из одной области рака молочной железы может тестировать HER2-положительный результат, а ткань из другой области рака может тестировать HER2-отрицательный результат.
Неточные результаты теста HER2 могут привести к тому, что женщинам с диагнозом «рак груди» будет оказана не самая лучшая медицинская помощь. Если рак груди полностью или частично является HER2-положительным, но результаты анализов классифицируют его как HER2-отрицательный, врачи вряд ли порекомендуют лекарства, которые работают против HER2-положительного рака груди, даже если женщина потенциально может получить пользу от этих лекарств. . Если рак молочной железы HER2-отрицательный, но результаты анализов классифицируют его как HER2-положительный, врачи могут порекомендовать лечение против HER2, даже если женщина вряд ли получит какие-либо преимущества и подвергается риску приема лекарств.
Есть шесть лекарств, которые работают против HER2-положительного рака молочной железы:
Если ваши результаты теста HER2 HER2-отрицательные, вы можете спросить своего врача о том, насколько он уверен в лаборатории, которая проводила тестирование HER2, и если другой тест HER2 может иметь смысл в вашей уникальной ситуации.
Если ваши результаты теста HER2 пограничные, вы можете спросить своего врача, проверяли ли результаты более одного патологоанатома. Если результаты теста HER2 не были просмотрены более чем одним патологоанатомом, вы можете спросить, можно ли проверить результаты еще раз.
FISH лучше всего проводить на тканях, консервированных в воске или химикатах, а не на свежих или замороженных тканях.
Эта статья была полезной? Да / Нет Эта статья была полезной?
Последнее изменение 21 января 2020 г., 10:51
FISH-тестов и диагностики рака
Гибридизация флуоресценции in situ (FISH) — это один из нескольких методов, используемых для поиска ДНК ваших клеток на предмет наличия или отсутствия определенных генов или частей генов.Взаимодействие с другими людьми
Элиф Байрактар / Getty ImagesМногие различные типы рака связаны с известными генетическими аномалиями. Говоря о генетике, мы говорим не только о наследственности. В течение жизни клетки могут совершать ошибки, когда делятся и растут. В этих клетках могут накапливаться мутации ДНК, связанные с раком.
Как это работает
FISH — это метод, который использует флуоресцентные зонды для обнаружения определенных генов или частей генов (последовательностей ДНК). Персонал лабораторий медицинского центра и онкологи используют FISH для оценки пациентов, у которых может быть рак, а иногда и для наблюдения за пациентом, у которого уже был диагностирован рак и который лечился.Взаимодействие с другими людьми
FISH может быть проведен с использованием различных типов образцов в зависимости от местоположения и типа подозреваемого рака: опухолевые клетки, полученные из периферической крови, из биопсии костного мозга или из биопсии лимфатических узлов, и фиксированной формалином ткани, залитой парафином (это относится к образец ткани, который обрабатывается в лаборатории и заливается воском, делая его более жестким, чтобы его можно было разрезать на тонкие срезы и установить для просмотра под микроскопом).
Что означают буквы
Буква «H» в FISH означает гибридизацию.При молекулярной гибридизации меченая последовательность ДНК или РНК используется в качестве зонда — если хотите, визуализируйте красный кубик Lego. Зонд используется для поиска аналога кубика Lego или последовательности ДНК в биологическом образце.
ДНК в вашем образце похожа на груды кирпичей Lego, и большинство кирпичей в этих кучах не соответствуют нашему красному зонду. И все ваши кирпичи аккуратно организованы в 23 пары кирпичей — каждая куча более или менее представляет собой одну из ваших парных гомологичных хромосом. В отличие от кубиков Lego, наш красный зонд Lego похож на сильный магнит и находит подходящую деталь, не разбирая груды.
«F» относится к флуоресценции. Наш красный зонд может потеряться в грудах кирпичей, поэтому он помечен цветным флуоресцентным красителем, чтобы он светился. Когда он находит совпадение среди 23 парных стопок, флуоресцентная метка показывает его местоположение. Итак, теперь вы можете увидеть, как исследователи и врачи могут использовать FISH, чтобы помочь определить, где (в какой куче или в какой хромосоме) расположен конкретный ген для данного человека.
Буквы «I» и «S» означают in situ .Это относится к тому факту, что наш красный кирпичик Lego ищет совпадение в образце, который вы дали .
FISH и специфические виды рака крови
FISH и другие процедуры гибридизации in situ используются для диагностики различных хромосомных аномалий — изменений генетического материала, изменений в хромосомах, включая следующие:
- Удаление: отсутствует часть хромосомы
- Транслокация: часть одной хромосомы отрывается и прикрепляется к другой хромосоме
- Инверсия: часть хромосомы отрывается и вставляется обратно, но в обратном порядке
- Дупликация: часть хромосомы присутствует в слишком большом количестве копий внутри клетки
Каждый тип рака может иметь свой собственный набор хромосомных изменений и соответствующих зондов.FISH не только помогает идентифицировать начальные генетические изменения в процессе заболевания, например, рак, но также может использоваться для мониторинга реакции на терапию и ремиссии заболевания.
Генетические изменения, обнаруженные FISH, иногда предлагают дополнительную информацию о том, как человек может вести себя при раке, на основе того, что наблюдалось в прошлом у людей с таким же видом рака и аналогичными генетическими изменениями. Иногда FISH используется после того, как диагноз уже был поставлен, чтобы собрать дополнительную информацию, которая может помочь предсказать исход пациента или наилучшее лечение.
FISH может идентифицировать хромосомные аномалии при лейкозах, в том числе при хроническом лимфолейкозе (CLL). При хроническом лимфолейкозе / малой лимфоцитарной лимфоме FISH позволяет пациентам определить их прогностическую категорию: хороший, средний или плохой. При остром лимфобластном лейкозе (ОЛЛ) генетика лейкозных клеток может сказать вам об уровне риска рака и помочь в принятии терапевтических решений.
Панели FISH также доступны для лимфомы, множественной миеломы, пролиферативных нарушений плазматических клеток и миелодиспластического синдрома.В случае лимфомы из мантийных клеток, например, существует транслокация , которую FISH может обнаружить, называемая GH / CCND1 t (11; 14), которая часто связана с этой лимфомой.
Почему РЫБА?
Преимущество FISH заключается в том, что его не нужно проводить на активно делящихся клетках. Цитогенетическое тестирование обычно занимает около трех недель, потому что раковые клетки должны расти в лабораторных чашках в течение примерно 2 недель, прежде чем их можно будет проверить. Напротив, результаты FISH обычно доступны в лаборатории в течение нескольких дней.Взаимодействие с другими людьми
FISH тестирование | Тесты и сканы
FISH означает флуоресцентную гибридизацию in situ. Это тест, который ищет изменения генов в клетках. Гены состоят из ДНК. Они контролируют все, что делает клетка, в том числе, когда она растет и воспроизводится. Тесты FISH ищут определенные гены или части генов.
Раковые клетки могут образоваться из изменений генов:
- производят определенные белки
- производят гораздо больше белка, чем обычно
- прекращают производство определенного белка
Если происходит изменение гена, клетка может производить слишком много белка или недостаточно.Это может заставить раковые клетки расти и воспроизводиться больше, чем обычно.
Лечение рака
В настоящее время существуют методы лечения рака, нацеленные на определенные белки. Выявление, есть ли у вашего рака определенные изменения в его генетической структуре, может помочь вашему врачу узнать, подойдет ли вам то или иное лечение.
Некоторые виды рака груди производят слишком много белка HER2 из-за изменения гена, называемого HER2 / neu. Врачи используют тест FISH для измерения количества гена HER2 / neu в каждой раковой клетке.
Если результат теста FISH окажется явно положительным на HER2, гораздо более вероятно, что препарат под названием трастузумаб (Герцептин) подействует. Трастузумаб нацелен на белок HER2.
Как проводится тестирование FISH?
FISH-тестирование проводится патологом. Патолог — это эксперт, который смотрит и идентифицирует клетки.
Для проведения теста FISH патологу нужна кровь или ткань вашего рака. Это может быть биопсия, образец крови или время операции по удалению рака.
В лаборатории патолог прикрепляет краситель и ультрафиолет, чтобы найти и подсчитать изменения генов.
Как доступно тестирование FISH?
FISH-тесты используются только при нескольких видах рака, включая:
- рак груди
- хронический лимфолейкоз (ХМЛ)
- острый лимфобластный лейкоз (ALL)
- рак простаты
- рак легкого
- меланома рак кожи
- саркома овец
- множественная миелома
Он также используется при множественной миеломе
такие состояния, как синдром Прад Вилли и специфические инфекции.
Врачи и исследователи каждый день узнают все больше о генетических изменениях, влияющих на рост рака. Тесты FISH — важная часть поиска более конкретной информации о различных типах рака. Они могут помочь врачам решить, какое лечение вам нужно, и проверить, насколько эффективно лечение.
РЫБЫ | NeoGenomics
Полный набор панелей и датчиков для гематологических заболеваний и солидных опухолей
Флуоресцентная гибридизация in situ (FISH) может помочь идентифицировать тонкие или субмикроскопические структурные перестройки, вариантные хромосомы и низкочастотные аномалии, которые трудно обнаружить с помощью классической цитогенетики .FISH включает в себя три технологии — цитогенетику, гибридизацию ДНК и флуоресцентную микроскопию — чтобы обеспечить уникальную информативную комбинацию разрешения и ширины. FISH также называют молекулярной цитогенетикой.
NeoGenomics предоставляет высококачественные FISH-тесты уже более десяти лет. Мы предоставляем нашим клиентам полное меню панелей и датчиков с гибкими возможностями заказа, чтобы обеспечить быстрое и экономичное определение характеристик солидных опухолей, лейкозов, лимфом и миелоидных заболеваний.В середине 2000-х мы впервые начали тестирование FISH только для технических целей и с тех пор выполнили более 100 000 дел, связанных только с техническими решениями, с нашими клиентами.
Основные моменты нашей программы FISH
- Широта библиотеки гематологических датчиков HemeFISH ® известна во всей отрасли
- Комплексное меню солидных опухолей позволяет своевременно принимать клинические решения
- Доступны только технические параметры FISH для> 95% зондов, чтобы обеспечить обслуживание на местном уровне и помочь контролировать расходы за счет высоко индивидуализированного выбора зондов
- Интерактивные вебинары и обучающая библиотека по запросу NeoUniversity ™ расширяет техническое и клиническое понимание результатов глобальными и технически ориентированными клиентами
- FISH улучшает профилирование множественной опухоли в наших профилях рака NeoTYPE ® (с глобальными и техническими опциями FISH)
- Панели расширенной AML, MDS и плазматической миеломы соответствуют новейшим руководящим принципам для повышения уверенности в диагностике пациента и прогнозе , и лечение (SWOG / ECOG, IPSS-R и IMWG соответственно)
- 9010 9 Обогащение плазматических клеток выполняется автоматически без дополнительной оплаты и улучшает возможности диагностики пациентов с MM / MGUS
Информация об образцах и их заказе
Требования к образцам
Допустимые типы образцов зависят от теста, поэтому, пожалуйста, проверьте детали для интересующего теста .FISH-тестирование NeoGenomics обычно проводится на следующих образцах:
- Аспират костного мозга: Пробирка с натриевым гепарином на 1-2 мл. Допускается пробирка с ЭДТА
- Периферическая кровь: Пробирка с гепарином натрия 2–5 мл. Подходит трубка с EDTA
- Парафиновый блок: Блок FFPE (добавьте слайд H&E в кружке только для технических специалистов)
- Обрезанные слайды: Неокрашенные слайды с размером 4-5 микрон плюс слайд H&E (слайд H&E обведен только для технических специалистов)
Варианты заказа
FISH-тесты можно заказать как панели для конкретных заболеваний, а наборы датчиков внутри панелей можно заказать индивидуально для обнаружения единичных отклонений.Зонды доступны на глобальной и технической основе, за очень немногими глобальными исключениями, указанными в подробном онлайн-описании этого теста.
Подробнее
См. Полный список тестов FISH с распечатываемыми описаниями и требованиями к образцам.
Подпишитесь на нашу рассылку, чтобы получать уведомления о новых тестах по электронной почте.
Что такое тест FISH при множественной миеломе?
Генетика миеломы — важная часть мозаики миеломы.Если мы знаем, какой у нас тип миеломы, мы можем увидеть, существуют ли схемы получаемого лечения и его результаты. Самый распространенный генетический тест называется FISH-тестом.
Флуоресцентный тест гибридизации in situ (FISH) отображает генетический материал клетки. В нем используются специальные флуоресцентные красители, которые прикрепляются только к определенным участкам хромосом. FISH может обнаружить большинство хромосомных изменений (таких как делеции или транслокации), которые можно увидеть под микроскопом в стандартных цитогенетических тестах, а также некоторые изменения, которые слишком малы, чтобы их можно было увидеть при обычном цитогенетическом тестировании.Он может обнаруживать генетические аномалии — особенно рак. Он используется для диагностики определенных типов рака и может отчасти предсказать исход пациента и его восприимчивость к химиотерапевтическому лечению.
Изменения в генах раковых клеток могут сделать клетку:
- производят определенные белки
- производят больше нормального количества белка
- полностью прекратить производство белка
Тест FISH проводится на основе образца биопсии костного мозга и помогает исследователям и врачам лучше узнать, что такое ваш рак и как его лучше лечить.Тест FISH следует проводить только на отобранных клетках CD138. Многие эксперты по миеломе, такие как Сагар Лониал, доктор медицинских наук из Университета Эмори, отметили, насколько поразительно обычным является то, что тест проводится неправильно на всем образце. Если тест проводится на всем образце, результаты будут не такими точными.
Важная вещь, которую нужно знать о тесте FISH, — это то, что вы получаете то, на что тестируете. Другими словами, ваш врач должен будет запросить, чтобы панель множественной миеломы сравнивала с образцом. Если панель не проверяет общие генетические особенности миеломы, такие как транслокация 11; 14, усиление 1q или делеция 17p, конечно, результаты не покажут правильных результатов.
Этот тест следует проводить при постановке диагноза и при рецидиве болезни, поддающейся измерению. Ваши генетические результаты могут быть добавлены в ваш профиль с помощью нового инструмента под названием HealthTree, который поможет пациентам с миеломой находить схемы лечения и результаты, основанные на генетике миеломы. Создайте профиль HealthTree, и если вам нужна помощь в чтении результатов теста, вы можете загрузить распечатку, и мы поможем ввести информацию для вас.
Тест FISH является наиболее доступным тестом в большинстве центров, и его можно провести недорого.Его следует использовать для всех пациентов с миеломой, поэтому спросите своего врача, подходит ли вам этот тест.
СЛЕДУЕТ ПРОВОДИТЬ ТЕСТ РЫБ ВСЕМ ПАЦИЕНТАМ С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ?
Med Sci (Турция). Авторская рукопись; доступно в PMC 2014 13 января.
Опубликовано в окончательной редакции как:
PMCID: PMC3888953
EMSID: EMS37905
Zeki Akca
Отделение радиационной онкологии, Государственная больница Мерсина, Мерсин, Турция. мок.liamtoh @ ackaikez
Контактная информация автора, ответственного за переписку: Хасан Мутлу, доктор медицинских наук, отделение медицинской онкологии, Образовательная и исследовательская больница Кайсери, Кайсери, 38010, Турция. Тел .: +3207313 moc.liamg@ultumnasahrotkod Окончательная отредактированная версия этой статьи издателем доступна в Med Sci (Турция). См. Другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Определение рецептора CerbB2 очень важно для прогноза и лечения рака груди.Два наиболее используемых метода определения рецептора CerbB2 — это иммуногистохимия и методы FISH. Метод FISH рекомендуется для группы пациентов с иммуногистохимическим анализом CerbB2 (++). Следовательно, даже несмотря на то, что пациенты с иммуногистохимически CerbB2 (++) находятся в одной группе, тест FISH делит результаты на две отдельные группы. В нашем исследовании сравнивали эти две группы по продолжительности рецидивов. В это исследование были включены 85 пациентов из исследовательской и учебной больницы Кайсери в Кайсери, университетской больницы Кайсери Эрджиес и государственной больницы Мерсина.У пациентов была определена продолжительность рецидивов, а затем проведено статистическое сравнение. Когда сравнивали среднюю выживаемость без заболевания для групп FISH (+) и FISH (-), средняя DFS составляла 46 ± 5 и 73 ± 8 месяцев. Тем не менее, медиана DFS составила 38 ± 9 месяцев для группы с положительным результатом исследования FISH. Для группы FISH (-) медиана PFS не была достигнута. Иммуногистохимически пациенты с раком молочной железы CerbB2 (++) считаются находящимися в одной группе, однако на самом деле у них разные прогностические особенности. Точно так же, когда иммуногистохимические тесты и тесты FISH сравниваются на положительность CerbB2, получаются разные результаты.Вследствие этого будут изменены альтернативы терапии. Таким образом, мы делаем вывод, что тест FISH следует проводить всем пациентам.
Ключевые слова: Рак молочной железы, FISH, Cerb B2 (++), HER 2, Иммуногистохимическое окрашивание CerbB2
Введение
В контексте генетических исследований рака груди молекулярная классификация стала главной темой разговоров и опухоли молочной железы подразделяются на молекулярные подтипы: люминальные A и B (недавно добавлена третья группа в виде группы C), HER-2 Like, Basal Like и неклассифицированные [1].Известно, что усиление и сверхэкспрессия онкогена HER-2 является важным прогностическим фактором рака груди [2]. В исследованиях было показано, что группы HER2 Like и Basal Like имеют худший прогноз, чем другие группы [3,4].
Онкоген HER-2, также известный как CerbB2, является членом семейства рецепторов эпидермального фактора роста (EGFR) [5-7]. Он расположен на хромосоме 17q21 и играет роль в росте, дифференцировке, адгезии и подвижности клеток, передаче сигналов [8]. Выражение в раке груди придает опухоли агрессивные характеристики.
Важность онкогена HER 2 упомянута выше, и определение рецептора HER 2 у пациентов с раком груди является очень важной вехой для определения прогноза и методов лечения. Опухоли с положительным результатом на CerbB2 имели плохой прогноз. Однако введение противоопухолевых агентов, которые нацелены на этот рецептор и путь, изменило плохой прогноз для этой группы опухолей в качестве адъюванта или метастатического контекста [9-12].
Для определения рецептора HER 2 было протестировано несколько методов.Однако два из них используются более широко во всем мире: методы иммуногистохимического окрашивания и флуоресцентной гибридизации in situ (FISH) [13-14]. Баллы по иммуногистохимическому методу и их значения представлены на странице.
Таблица 1
Оценка HER-2 (система Ньюкасла) для иммуногистохимического окрашивания
| Оценка для отчета | Белок HER-2 Сверхэкспрессия | Оценка окрашивания Образец | Окрашивание не наблюдается или окрашивание мембраны наблюдается в <10% опухолевых клеток |
|---|---|---|---|
| 1+ | Отрицательный | Слабое / едва заметное окрашивание мембраны обнаруживается в> 10% опухоли клетки.Клетки демонстрируют неполное окрашивание мембраны | |
| 2+ | Слабо положительный | От слабого до среднего полное окрашивание мембраны наблюдается в> 10% опухолевых клеток | |
| 3+ | Сильно положительный | Полное окрашивание Окрашивание мембраны наблюдается в> 10% опухолевых клеток |
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило несколько тестов для этих методов.Некоторые из них — это Hercep Test (Dako Cytomation, Carpinteria, CA) и Pathway (Ventana Medical System, Inc, Tucson, AZ) для иммуногистохимического метода, PathVysion (Vysis Inc, Downers Grove, IL), Inform (Ventana Medical Systems Inc) и Dako HER2 FISH PharmDx тесты по методу FISH. Однако до сих пор нет единого мнения о том, какой метод является наиболее предсказуемым и полезным (13). Признанный в литературе и практике метод FISH считался золотым стандартом для иммуногистохимических опухолей CerbB2 (++) [13-19].
Опухоли груди делятся на 4 группы в соответствии с оценкой рецептора CerbB2: 0 (отрицательный), 1 (+), 2 (+) и 3 (+). Практически прогностические признаки считаются одинаковыми для каждой группы. Опухоли CerbB2 (++) делятся на 2 группы по FISH, и поэтому прогноз для этих подгрупп необходимо пересмотреть (FISH (+) и FISH (-)).
Целью нашего исследования является сравнение групп FISH (+) и FISH (-), определенных с помощью теста FISH, с точки зрения продолжительности рецидивов в группе пациентов с неметастатическим раком молочной железы CerbB2 (++).
Материалы и методы
В это исследование были включены 85 пациентов из исследовательской и учебной больницы Кайсери в Кайсери, университетской больницы Кайсери Эрджиес и государственной больницы Мерсина. Эти пациенты находились в адъювантном контексте во время диагностики, и их результаты по CerbB2 оказались иммуногистохимическими (++). У пациентов оценивали время до рецидивов. Их вводили в статистическое программное обеспечение SPSS 16.0 и использовали метод Каплана Мейера.
Результаты
Всего было оценено 85 пациентов.Количество случаев FISH (+) составило 37, а случаев FISH (-) — 48.
Прогностические факторы пациентов были представлены на. При статистической оценке не было обнаружено статистически значимых различий в возрасте, стадии, статусе менопаузы, статусе ER и PR, степени и режимах адъювантной химиотерапии между группами. Эта оценка представлена на сайте.
Таблица 2
Характеристики групп.
| Параметр | FISH (+) (n: 37) | FISH (-) (n: 48) |
|---|---|---|
| Возраст | 48 ± 13 (Среднее) | 47 ± 10 (Среднее) |
| (n,%) | (n,%) | |
| Этап | ||
| 1 этап | 1 (2,7%) | 7 (14,6%) |
| 2 этап | 11 (29,7%) | 18 (37,5%) |
| 3 этап | 25 (67,6%) | 23 (47,9%) |
| климактерический статус | ||
| В пременопаузе | 16 (43,2%) | 27 (56,2%) |
| Перименопаузальный | 5 (13,6%) | 4 (8,3%) |
| Постменопаузальный | 16 (43,2%) | 17 (35,4%) |
| ER Статус | ||
| ER (+) | 17 (46%) | 30 (62,5%) |
| ER (-) | 20 (54%) | 18 (37,5%) |
| PR Статус | ||
| ПР (+) | 20 (46%) | 35 (72,9%) |
| ПР (-) | 17 (54%) | 13 (27,1%) |
| Класс | ||
| 1 класс | 2 (5,4%) | 2 (4,2%) |
| 2 класс | 18 (48,6%) | 26 (54,2%) |
| 3 класс | 12 (32,4%) | 15 (31,2%) |
| Неизвестно | 5 (13,5%) | 5 (10,4%) |
| Адъювант CT | ||
| Нет | 3 (8,1%) | 2 (4,2%) |
| На основе антрациклина | 6 (16,2%) | 19 (39,6%) |
| Антрациклин + таксан на основе | 28 (75,7%) | 27 (56,2%) |
| Адъюван Герцептин | 20 (54%) | 0 |
Таблица 3
| Параметр | FISH (+) vs FISH (-) значение p |
|---|---|
| Возраст | 0.651 |
| Этап | 0,085 |
| Менопаузальный статус | 0,459 |
| ER | 0,128 |
| PR | 0,071 |
| Класс | 0,915 |
| Адъювант CT | 0,059 |
При анализе выживаемости без признаков заболевания средняя DFS составила 46 ± 5 и 73 ± 8 месяцев для групп FISH (+) и FISH (-).Тем не менее, медиана DFS составила 38 ± 9 месяцев для группы с положительным результатом исследования FISH. Для группы FISH (-) медиана DFS не обнаружена. В этом сравнении не было обнаружено значительных различий между двумя группами с точки зрения ВБП. Однако наблюдалась тенденция в пользу отрицательной группы FISH. Кривая DFS была представлена в.
Кривая выживаемости без заболеваний по группам FISH
Заключение
Показатель положительности FISH рассчитывался в соответствии с категорией иммуногистохимических показателей в нескольких исследованиях (24–29).Процент положительных результатов FISH (медиана) составил 3,5 для IHC (0), 5,9 для IHC (1+), 17,6 для IHC (2+) и 83,5 для IHC (3+) [26]. Процент положительных результатов FISH для случаев IHC (2+) составил 16,9%, 6,7%, 92,3%, 25,7% и 16,9% в исследованиях [20-25]. В нашем исследовании процент положительных случаев FISH составил 43,5%.
Наиболее важной причиной использования FISH в случаях IHC (2+) рецептора Cerb B2 является определение прогноза и изменение методов лечения. Как известно, в случаях с Cerb B2 (3+) трастузумаб эффективен на стадии адъюванта или метастазирования, а режимы на основе лапатиниба — на стадии метастазирования.Однако случаи Cerb B2 (2+) и Cerb B2 (3+) были определены как отдельные группы при оценке IHC. Итак, следует ли рассматривать все случаи Cerb B2 (2+) как подходящие для «лечения рецепторами HER2»? У случаев CerB B2 IHC (2+), даже если они являются FISH (+), ответ на антирецепторное лечение как в случаях IHC (3+).
В конце нашего исследования DFS была рассчитана как среднее и медианное значение для групп FISH (+) и FISH (-). При анализе выживаемости без прогрессирования среднее значение DFS составило 46 ± 5 и 73 ± 8 месяцев для групп FISH (+) и FISH (-).Тем не менее, медиана DFS составила 38 ± 9 месяцев для группы с положительным результатом исследования FISH. Для группы FISH (-) медиана ВБП не обнаружена.
Согласно этому анализу, даже если случаи относятся к IHC (2+), то есть в одной группе, они прогностически делятся на 2 группы, и эти две группы определяются с помощью теста FISH. Между группами не было обнаружено значительных различий в возрасте, стадии, статусе менопаузы, статусе рецепторов ER и PR, степени и режимах адъювантной химиотерапии. Это открытие предполагает, что наиболее важным и единственным фактором в формировании двух отдельных групп является результат FISH.
В исследовании HERA случаи CerbB2 (2+) FISH (+) оценивались в двух группах. Адъювантное лечение герцептином значительно улучшило локальные случаи CerbB2 (2+) FISH (+), но не центральные случаи CerbB2 (2+) FISH (+). Не было обнаружено существенной разницы в комбинации двух групп [9]. Опять же, для случаев CerbB2 (2+) FISH (+) в адъювантных исследованиях значительная разница была обнаружена для DFS в исследовании NSABP B31 и не была обнаружена в исследовании NCCTG N9831 [10-11].
В заключение, только ИГХ недостаточно, чтобы показать статус рецептора Cerb B2.Несмотря на то, что эти случаи относятся к IHC (2+) согласно шкале IHC, то есть с одним и тем же рисунком окрашивания, они имеют разный прогноз.
Процент положительных результатов FISH варьировался от 0% до 20% для случаев Cerb B2 IHC (0+) и от 3,1% до 50,0% для Cerb B2 IHC (1+) в исследованиях [20-25,27] . Процент негативности FISH варьировался от 6,2% до 23,5% для случаев Cerb B2 IHC (3+) [20-25,27]. Поэтому мы считаем, что прямой FISH-тест подходит для всех случаев рака груди при оценке статуса рецептора Cerb B2.Однако это может быть дорогостоящим, учитывая, что 6,3–23,5% случаев ИГХ CerbB2 (3+) не будут использовать антирецепторные методы лечения (такие как трастузумаб, лапатиниб) в адъювантной и метастатической стадиях, определенно это будет рентабельным.
Информация для авторов
Хасан Мутлу, Образовательная и исследовательская больница Кайсери, Кайсери, 38010, Турция. moc.liamg@ultumnasahrotkod.
Халит Караджа, Университет Эрджиес, Кайсери, Турция. moc.liamtoh@acartilah.
Зеки Акча, отделение радиационной онкологии, Государственная больница Мерсина, Мерсин, Турция.moc.liamtoh@ackaikez.
Ясемин Алтунер Торун, Образовательная и исследовательская больница Кайсери, Кайсери, 38010, Турция moc.oohay@renutlanimesay.
Ссылки
1. Kattan MW. Оценка предсказательного вклада нового маркера. Clin Cancer Res. 2004. 10 (3): 822–824. [PubMed] [Google Scholar] 2. Чибон Ф., Де Маскарель I, Сиранковский Г. и др. Прогнозирование статуса гена HER-2 при инвазивном раке груди HER-2 2+: исследование 108 случаев, сравнивающее рекомендации ASCO / CAP и FDA. Современная патология.2009. 22 (3): 403–409. [PubMed] [Google Scholar] 3. Voduc KD, Cheang MC, Tyldesley S, et al. Подтипы рака груди и риск местного и регионального рецидива. J Clin Oncol. 28: 1684. [PubMed] [Google Scholar] 4. Кэри Л.А., Перу С.М., Ливаси К.А. и др. Раса, подтипы рака груди и выживаемость в исследовании рака груди в Каролине. ДЖАМА. 2010; 295: 2492. [PubMed] [Google Scholar] 4. Кэри Л.А., Перу С.М., Ливаси К.А. и др. Раса, подтипы рака груди и выживаемость в исследовании рака груди в Каролине. ДЖАМА.2006; 295: 2492. [PubMed] [Google Scholar] 5. Дирмейер С., Хорват Дж., Кнючел-Кларк Р. и др. Коэкспрессия рецептора эпидермального фактора роста модулирует восприимчивость к герцептину в клетках рака молочной железы, сверхэкспрессирующих HER-2 / neu, посредством специфического взаимодействия и активации рецептора erbB. Exp Cell Res. 2005. 304 (2): 604–619. [PubMed] [Google Scholar] 6. Moulder SL, Yakes FM, Muthuswamy SK, Bıanco R, Sımpson JF, Arteaga CL. Ингибитор тирозинкиназы рецептора эпидермального фактора роста (HER1) ZD1839 (Iressa) ингибирует клетки рака молочной железы, сверхэкспрессирующие HER2 / neu (erbB2), in vitro и in vivo.Cancer Res. 2001. 61 (24): 8887–8895. [PubMed] [Google Scholar] 7. Feng SM, Sartor CI, Hunter D, ZHOU H, YANG X, CASKEY LS, DY R, MURAOKA-COOK RS, EARP HS., 3rd Цитоплазматический домен HER4, но не его С-конец, ингибирует пролиферацию клеток молочной железы. Мол Эндокринол. 2007. 21 (8): 1861–1876. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Чжан Д., Сальто-Теллез М., До Э. Оценка статуса онкогена HER-2 / neu в опухолях молочной железы на тканевых микроматрицах. Hum Pathol. 2003. 34 (4): 362–368. [PubMed] [Google Scholar] 9.Metro G, Mottolese M, Fabi A и др. HER-2-положительный метастатический рак молочной железы: трастузумаб и другие. Эксперт Opin Pharmacother. Октябрь 2008 г .; 9 (15): 2583–601. Рассмотрение. [PubMed] [Google Scholar] 10. Доусетт М., Проктер М., Маккаскилл-Стивенс В. и др. Безрецидивная выживаемость в зависимости от степени амплификации HER2 для пациентов, получавших адъювантную химиотерапию с использованием трастузумаба в течение 1 года или без него: исследование HERA. J Clin Oncol. 20 июня 2009 г.; 27 (18): 2962–9. Epub, 13 апреля. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11.Пайк С., Ким С., Чжон Дж. И др. Польза от адъювантного трастузумаба может не ограничиваться пациентами с IHC 3+ и / или FISH-положительными опухолями: результаты центрального тестирования NSABP B-31. J Clin Oncol. 2007; 25: 5с. [Google Scholar] 12. Perez EA, Romond EH, Suman VJ, et al. Обновленные результаты комбинированного анализа адъювантной химиотерапии NCCTG N9831 и NSABP B-31 с / без трастузумаба у пациентов с HER2-положительным раком молочной железы. J Clin Oncol. 2007; 25: 6с. [Google Scholar] 13. Лер Х.А., Якобс Т.В., Языджи Х. и др.Количественная оценка статуса HER-2 / neu при раке молочной железы с помощью флуоресцентной гибридизации in situ и иммуногистохимии с анализом изображений. Am J Clin Pathol. 2001. 115 (6): 814–822. [PubMed] [Google Scholar] 14. Уокер Р.А. Иммуногистохимические маркеры как инструменты прогнозирования рака груди. J Clin Pathol. 2008. 61 (6): 689–696. [PubMed] [Google Scholar] 15. Хоанг М.П., Сахин А.А., Ордонез Н.Г. и др. Амплификация гена HER-2 / neu по сравнению со сверхэкспрессией белка HER-2 / neu и воспроизводимость между наблюдателями при инвазивной карциноме молочной железы.Am J Clin Pathol. 2000; 113: 852–859. [PubMed] [Google Scholar] 16. Винсент-Саломон А., МакГроган Дж., Кутюрье Дж. И др. Калибровка иммуногистохимии для оценки HER2 при раке груди: результаты французского многоцентрового исследования GEFPICS. Гистопатология. 2003. 42: 337–347. [PubMed] [Google Scholar] 17. Цуда Х. Тестовое обновление HER-2 (c-erbB-2): текущее состояние и проблемы. Рак молочной железы. 2006; 13: 236–248. [PubMed] [Google Scholar] 18. Зауэр Т., Видсванг Дж., Буджема Дж. И др. Оценка сверхэкспрессии HER-2 / neu и / или амплификации гена в карциномах молочной железы: должна ли гибридизация in situ быть методом выбора? APMI.2003. 111: 444–450. [PubMed] [Google Scholar] 19. Левский Ю.М., Певица Р.Х. Флуоресцентная гибридизация in situ: прошлое, настоящее и будущее. J Cell Sci. 2003; 116: 2833–2838. [PubMed] [Google Scholar] 20. Редди Дж. К., Рейманн Дж. Д., Андерсон С. М. и др. Согласованность результатов тестирования HER2 в центральной и местной лаборатории по результатам клинического исследования на уровне сообщества. Clin рака груди. 2006. 7: 153–157. [PubMed] [Google Scholar] 21. Саез А., Андреу Ф.Дж., Сегуи М.А. и др. Амплификация гена HER-2 путем хромогенной гибридизации in situ (CISH) по сравнению с флуоресцентной гибридизацией in situ (FISH) при раке груди — исследование двухсот случаев.Грудь. 2006; 15: 519–527. [PubMed] [Google Scholar] 22. Эйнсворт Р., Бартлетт Дж. М., Гоинг Дж. Дж. И др. ИГХ для Her2 с антителом CBE356 является более точным предиктором амплификации гена Her2 с помощью FISH, чем HercepTest при карциноме молочной железы. J ClinPathol. 2005. 58: 1086–1090. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Прати Р., Apple SK, He J и др. Гистопатологические характеристики, позволяющие прогнозировать амплификацию HER-2 / neu при раке груди. Грудь J. 2005; 11: 433–439. [PubMed] [Google Scholar] 24. Press MF, Sauter G, Bernstein L, et al.Диагностическая оценка HER-2 как молекулярной мишени: оценка точности и воспроизводимости лабораторных исследований в крупных проспективных рандомизированных клинических испытаниях. Clin Cancer Res. 2005; 11: 6598–6607. [PubMed] [Google Scholar] 25. Уиллмор С., Холден Дж. А., Лейфилд Л. Дж.. Корреляция амплификации гена HER2 с иммуногистохимией при раке молочной железы, как определено с помощью нового анализа моноплексной полимеразной цепной реакции. Appl Immunohistochem Mol Morphol. 2005. 13: 333–341. [PubMed] [Google Scholar] 26.Куадрос М., Вильегас Р. Систематический обзор тестирования на рак груди HER2. Appl Immunohistochem Mol Morphol. 2009 Янв; 17 (1): 1–7. Рассмотрение. [PubMed] [Google Scholar] 27. Уиллмор С., Холден Дж. А., Лейфилд Л. Дж.. Корреляция амплификации гена HER2 с иммуногистохимией при раке молочной железы, как определено с помощью нового анализа моноплексной полимеразной цепной реакции. Appl Immunohistochem Mol Morphol. 2005. 13: 333–341. [PubMed] [Google Scholar]FISH — ПАНЕЛИ * — Отделение патологии и лабораторной медицины
Флуоресцентная гибридизация in situ — панель AML / MDS
Обзор теста
Код (а) CPT
88237-52, 88271 × 3, 88275, 88291
Методология
Культура / гибридизация / микроскопия / интерпретация
Требования к образцам
Костный мозг и / или лейкозная кровь
Емкость: Гепарин натрия (зеленая верхняя пробирка)
Оптимальное количество: 2-3 мл
Минимальное количество: 1-2 мл
Хранение: комнатная температура
Стабильность при комнатной температуре: 8 часов, затем охладить
Транспортировка: Избегать замерзания или нагрева выше 35 o C
Срок выполнения
Заключительный отчет за 5 дней для 90% случаев
Детали теста
Клиническая значимость
Флуоресцентная гибридизация in situ (FISH) — это чувствительный метод обнаружения небольших геномных изменений, связанных с различными гематологическими злокачественными новообразованиями и солидными опухолями.У технологии FISH есть несколько преимуществ по сравнению с обычным хромосомным анализом, и такие преимущества включают способность технологии FISH обнаруживать геномные аномалии в нежизнеспособных и неделящихся тканях, быстрое время обработки и повышенное разрешение. Однако технология FISH дополняет рутинный анализ хромосом и не может заменить рутинный анализ хромосом для диагностики рака.
Клиническая информация
Острый миелолейкоз / миелодиспластический синдром — это группа гетерогенных гематологических состояний с характерными хромосомными аномалиями, ведущими к специфическим перестройкам генов.Около половины пациентов с ОМЛ / МДС могут иметь хромосомные аномалии, которые можно классифицировать как первичные и вторичные или связанные с лечением. Известно, что хромосомные аномалии коррелируют с прогнозом и ответом на лечение. Хотя большинство таких аномалий можно обнаружить с помощью обычного хромосомного анализа, межфазный FISH-анализ из-за его высокой чувствительности может обнаруживать клоны низкого уровня, таким образом идентифицируя прогностически и терапевтически важные генетические аномалии.
Методы
Образцы обычно культивируют в течение 24 часов перед гибридизацией с зондами. После гибридизации и пост-гибридизационной промывки предметные стекла анализируют под флуоресцентным микроскопом, оборудованным эпифлуоресценцией и соответствующими наборами фильтров. Анализ и подсчет очков осуществляются двумя сертифицированными технологами вслепую. Результаты проверяются как руководителем лаборатории, так и директором. Панель AML / MDS FISH включает следующие зонды.
| делеция 5q / моносомия 5 | TAS2R1 / EGR1 | Cytocell (номер по каталогу LPH024) |
| Делеция / моносомия 7q 7 | RELN / TES | Cytocell (номер по каталогу LPH025) |
| т (8; 21) | ETO / AML1 (RUNX1 / RUNX1T1) | Cytocell (номер по каталогу LPH026) |
| Перегруппировка 11q | MLL | Cytocell (номер по каталогу LPH013) |
| т (15; 17) | PML / RARA | Cytocell (номер по каталогу LPH023) |
| инв. (16) | MYh21 / CBFB | Cytocell (номер по каталогу LPH022) |
| делеция 17p | р53 | Cytocell (номер по каталогу LPH017) |
| делеция 20q / моносомия 20 | MYBL2 / PTPRT | Cytocell (номер по каталогу LPH020) |
Интерпретация результатов
Морфологическая интерпретация и сопоставление результатов по всем случаям проводится сертифицированным докторантом (директором лаборатории).Окончательный отчет содержит подробное описание результатов. Если аномалии присутствуют, они объясняются в параграфе, который помогает уточнить и сопоставить хромосомные данные с фенотипом. Ссылки включены в отчет, чтобы помочь лечащему врачу с интерпретацией, в том числе книги или журналы, содержащие соответствующую информацию. При необходимости даются рекомендации относительно любых дополнительных испытаний.
Флуоресцентная гибридизация in situ — ALL Panel
Обзор теста
Код (а) CPT
88237-52, 88271 × 3, 88275, 88291
Методология
Культура / гибридизация / микроскопия / интерпретация
Требования к образцам
Костный мозг и / или лейкозная кровь
Емкость: Гепарин натрия (зеленая верхняя пробирка)
Оптимальное количество: 2-3 мл
Минимальное количество: 1-2 мл
Хранение: комнатная температура
Стабильность при комнатной температуре: 8 часов, затем охладить
Транспортировка: Избегать замерзания или нагрева выше 35 o C
Детали теста
Клиническая значимость
Флуоресцентная гибридизация in situ (FISH) — это чувствительный метод обнаружения небольших геномных изменений, связанных с различными гематологическими злокачественными новообразованиями и солидными опухолями.У технологии FISH есть несколько преимуществ по сравнению с обычным хромосомным анализом, и такие преимущества включают способность технологии FISH обнаруживать геномные аномалии в нежизнеспособных и неделящихся тканях, быстрое время обработки и повышенное разрешение. Однако технология FISH дополняет рутинный анализ хромосом и не может заменить рутинный анализ хромосом для диагностики рака.
Клиническая информация
Острый лимфобластный / лимфоцитарный лейкоз (ОЛЛ) является наиболее частым гематологическим злокачественным новообразованием, наблюдаемым у детей.У пациентов с ОЛЛ наблюдается большое количество специфических хромосомных аномалий и / или генных перестроек, при этом частота таких аномалий колеблется от 65-85% для взрослых и 60-70% для детей. Обнаружение этих аномалий имеет жизненно важное значение для стратификации пациентов по различным лечебным группам, и теперь обязательно проведение хромосомных и FISH-исследований, особенно у детей, для включения в протоколы лечения детской онкологической группы (COG). Хотя большинство таких аномалий можно обнаружить с помощью обычного хромосомного анализа, межфазный FISH-анализ из-за его высокой чувствительности может обнаруживать клоны низкого уровня, таким образом идентифицируя прогностически и терапевтически важные генетические аномалии.
Методы
Образцы обычно культивируют в течение 24 часов перед гибридизацией с зондами. После гибридизации и пост-гибридизационной промывки предметные стекла анализируют под флуоресцентным микроскопом, оборудованным эпифлуоресценцией и соответствующими наборами фильтров. Анализ и подсчет очков осуществляются двумя сертифицированными технологами вслепую. Результаты проверяются как руководителем лаборатории, так и директором. Панель ВСЕ РЫБЫ включает следующие зонды.
| Перегруппировка 8q | cMYC | Cytocell (номер по каталогу LPH010) |
| делеция 9p | п16 / D9Z3 | Cytocell (номер по каталогу LPH009) |
| гипердиплоидия — chr. 4 | FIP1L1 / CHIC2 / PDGFRA | Cytocell (номер по каталогу LPH032) |
| гипердиплоидия — chrs. 10 и 17 | D10Z1 / D17Z1 | Cytocell (номер по каталогу LPE010G / LPE017R) |
| т (12; 21) | ETV6 / AML1 | Cytocell (номер по каталогу LPH012) |
| Перегруппировка 11q | MLL | Cytocell (номер по каталогу LPH013) |
| т (9; 22) | ABL1 / BCR | Cytocell (номер по каталогу LPH038) |
| Перегруппировка 14q | IGH | Cytocell (номер по каталогу LPH014) |
Интерпретация результатов
Морфологическая интерпретация и сопоставление результатов по всем случаям проводится сертифицированным докторантом (директором лаборатории).Окончательный отчет содержит подробное описание результатов. Если аномалии присутствуют, они объясняются в параграфе, который помогает уточнить и сопоставить хромосомные данные с фенотипом. Ссылки включены в отчет, чтобы помочь лечащему врачу с интерпретацией, в том числе книги или журналы, содержащие соответствующую информацию. При необходимости даются рекомендации относительно любых дополнительных испытаний.
Флуоресцентная гибридизация in situ — панель множественной миеломы
Обзор теста
Код (а) CPT
88237-52, 88271 × 3, 88275, 88291
Методология
Выделение плазматических клеток / Культура / Гибридизация / Микроскопия / Интерпретация
Требования к образцам
Костный мозг и / или лейкозная кровь
Емкость: Гепарин натрия (зеленая верхняя пробирка)
Оптимальное количество: 2-3 мл
Минимальное количество: 1-2 мл
Хранение: комнатная температура
Стабильность при комнатной температуре: 8 часов, затем охладить
Транспортировка: Избегать замерзания или нагрева выше 35 o C
Детали теста
Клиническая значимость
Флуоресцентная гибридизация in situ (FISH) — это чувствительный метод обнаружения небольших геномных изменений, связанных с различными гематологическими злокачественными новообразованиями и солидными опухолями.У технологии FISH есть несколько преимуществ по сравнению с обычным хромосомным анализом, и такие преимущества включают способность технологии FISH обнаруживать геномные аномалии в нежизнеспособных и неделящихся тканях, быстрое время обработки и повышенное разрешение. Однако технология FISH дополняет рутинный анализ хромосом и не может заменить рутинный анализ хромосом для диагностики рака.
Клиническая информация
Расстройства плазматических клеток представляют собой генетически разнообразную группу заболеваний, возникающих в результате злокачественной пролиферации моноклональной популяции плазматических клеток.В эту группу входят моноклональная гаммопатия неопределенного значения (MGUS), плазменная цитома, тлеющая миелома и плазматическая клеточная миелома или множественная миелома. Геномные аномалии являются важными прогностическими факторами миеломы. Обычный хромосомный анализ часто ограничивает и неэффективен для обнаружения этих геномных аномалий, поскольку имеется ограниченная инфильтрация плазматических клеток в костный мозг, а также из-за медленной пролиферации плазматических клеток. Исследования показали, что обогащение плазматических клеток наиболее эффективно при обнаружении этих прогностически значимых геномных аномалий.Наша лаборатория обладает уникальными знаниями в области выделения плазматических клеток и использования отрицательной фракции для рутинного хромосомного анализа для выявления аномалий, не связанных с плазматическими клетками. Фактически, мы являемся первой лабораторией, которая со значительным успехом разработала протокол, использующий отрицательную фракцию для анализа хромосом.
Методы
Плазматические клетки выделяют с использованием метода магнитного разделения антител против CD134. Выделенные плазматические клетки собирают и гибридизируют с зондами.После гибридизации и пост-гибридизационной промывки предметные стекла анализируют под флуоресцентным микроскопом, оборудованным эпифлуоресценцией и соответствующими наборами фильтров. Анализ и подсчет очков осуществляются двумя сертифицированными технологами вслепую. Результаты проверяются как руководителем лаборатории, так и директором. Панель множественной миеломы включает следующие зонды.
| делеция 11q | D11Z1 / Банкомат | Cytocell (номер по каталогу LPH011) |
| делеция 17p | р53 | Cytocell (номер по каталогу LPH017) |
| делеция 13q | РБ1 / CTB-163C9 | Cytocell (номер в каталоге LPS011) |
| т (11; 14) | CCND1 / IGH | Cytocell (номер по каталогу LPH021) |
| т (4; 14) | FGFR3 / IGH | Cytocell (номер по каталогу LPH030) |
| т (14; 16) | IGH / MAF | Cytocell (номер по каталогу LPH029) |
| гипердиплоидия | Банкомат / MAF / FGFR3 |
Интерпретация результатов
Морфологическая интерпретация и сопоставление результатов по всем случаям проводится сертифицированным докторантом (директором лаборатории).Окончательный отчет содержит подробное описание результатов. Если аномалии присутствуют, они объясняются в параграфе, который помогает уточнить и сопоставить хромосомные данные с фенотипом. Ссылки включены в отчет, чтобы помочь лечащему врачу с интерпретацией, в том числе книги или журналы, содержащие соответствующую информацию. При необходимости даются рекомендации относительно любых дополнительных испытаний.
Флуоресцентная гибридизация in situ — панель CLL
Обзор теста
Код (а) CPT
88237-52, 88271 × 3, 88275, 88291
Методология
Культура / гибридизация / микроскопия / интерпретация
Требования к образцам
Костный мозг и / или лейкозная кровь
Емкость: Гепарин натрия (зеленая верхняя пробирка)
Оптимальное количество: 2-3 мл
Минимальное количество: 1-2 мл
Хранение: комнатная температура
Стабильность при комнатной температуре: 8 часов, затем охладить
Транспортировка: Избегать замерзания или нагрева выше 35 o C
Детали теста
Клиническая значимость
Флуоресцентная гибридизация in situ (FISH) — это чувствительный метод обнаружения небольших геномных изменений, связанных с различными гематологическими злокачественными новообразованиями и солидными опухолями.У технологии FISH есть несколько преимуществ по сравнению с обычным хромосомным анализом, и такие преимущества включают способность технологии FISH обнаруживать геномные аномалии в нежизнеспособных и неделящихся тканях, быстрое время обработки и повышенное разрешение. Однако технология FISH дополняет рутинный анализ хромосом и не может заменить рутинный анализ хромосом для диагностики рака.
Клиническая информация
Хронический лимфоцитарный лейкоз (ХЛЛ) — это лейкоз малых зрелых B-клеток, который в основном поражает взрослых в возрасте 65 лет и старше.ХЛЛ является наиболее распространенным лимфоидным злокачественным новообразованием, на которое приходится около 11% всех гематологических злокачественных новообразований и 25% всех лейкозов. До 50% пациентов с ХЛЛ могут иметь клональные цитогенетические аномалии, выявленные при рутинном анализе хромосом. Однако клоны CLL (лимфоциты) не делятся в культуре и устойчивы к митогенам, что затрудняет рутинный цитогенетический анализ. С другой стороны, FISH очень чувствителен к обнаружению геномных изменений, которые имеют важное прогностическое значение при ХЛЛ.
Методы
Образцы обычно культивируют в течение 24 часов перед гибридизацией с зондами. После гибридизации и пост-гибридизационной промывки предметные стекла анализируют под флуоресцентным микроскопом, оборудованным эпифлуоресценцией и соответствующими наборами фильтров. Анализ и подсчет очков осуществляются двумя сертифицированными технологами вслепую. Результаты проверяются как руководителем лаборатории, так и директором. Панель CLL включает следующие датчики.
| делеция 6q | D6Z1 / MYB | Cytocell (номер по каталогу LPH016) |
| трисомия 12 | D12Z1 | Cytocell (номер по каталогу LPE012R) |
| делеция 11q | D11Z1 / Банкомат | Cytocell (номер по каталогу LPH011) |
| т (14; 18) | IGH / BCL2 | Cytocell (номер по каталогу LPH018) |
| Перегруппировка 14q | IGH | Cytocell (номер по каталогу LPH014) |
| делеция 17p | р53 | Cytocell (номер по каталогу LPH017) |
| т (11; 14) | CCND1 / IGH | Cytocell (номер по каталогу LPH021) |
| делеция 13q | РБ1 / CTB-163C9 | Cytocell (номер в каталоге LPS011) |
Интерпретация результатов
Морфологическая интерпретация и сопоставление результатов по всем случаям проводится сертифицированным докторантом (директором лаборатории).

 В.И. Чиссова, С.Л. Дарьяловой. — М.: Изд. «ГЭОТАР-Медиа». 2008:702.
В.И. Чиссова, С.Л. Дарьяловой. — М.: Изд. «ГЭОТАР-Медиа». 2008:702.
