Инфаркт
Инфаркт — очаг некроза, развившегося вследствие нарушения кровообращения.Инфаркт называют также циркуляторным, или ангиогенным некрозом.
Термин «инфаркт» (от лат. нафаршировать) был предложен Вирховым для формы некроза, при которой омертвевший участок ткани пропитывается кровью.
Размеры и морфологические особенности инфаркта определяются калибром обтурированного сосуда, наличием других нарушений кровообращения, на фоне которых он развивается.
При магистральном типе ветвления артерии инфаркт по своим очертаниям напоминает конус, узкая часть которого (вершина) обращена к воротам органа, а основание ориентировано на периферию, к зоне терминального разветвления внутриорганных артерий. Инфаркты такой формы обычно выявляют в селезенке, почке, легких.
В органах с преобладанием рассеянного типа ветвления артерии, например в головном мозгу, кишечнике, сердце, кровоснабжаемая ею территория не образует конусовидных контуров и инфаркты не имеют определенной формы.
Виды инфаркта
Зона инфаркта может занимать весь орган или большую его часть (тотальный и субтотальный инфаркт) или выявляться только под микроскопом (микроинфаркт).По макроскопическим признакам различают 3 вида инфаркта: белый, белый с геморрагическим венчиком и красный.
Белый (ишемический) инфаркт формируется при непроходимости магистрального артериального ствола и запустевании всего сосудистого русла в его бассейне вследствие недостаточного развития сосудистых анастомозов и коллатералей. Чаще всего выявляют в селезенке, иногда в головном мозгу, печени.
Зона некроза хорошо видна при макроскопическом обследовании примерно через 24 ч после нарушения кровоснабжения. Под микроскопом ткань уплотнена, бледно-желтой окраски, структура ткани неразличима, а образующие ее элементы сливаются в гомогенную массу. По периферии зона инфаркта ограничивается воспалительным демаркационным валом.
Белый инфаркт с геморрагическим венчиком выглядит как участок белесовато-желтого цвета, окруженный темно-красной зоной кровоизлияний. Такой инфаркт развивается в случаях, когда компенсаторному включению коллатералей и реактивной артериальной гиперемии сосудов периферической зоны предшествует ангиоспазм, сменяющийся паралитическим расширением.
В результате резкое полнокровие сосудов сопровождается явлениями стаза крови и диапедезными кровоизлияниями в некротизированную ткань.
Белый инфаркт с геморрагическим венчиком развивается в сердце, селезенке, иногда в почках.
Красный (геморрагический) инфаркт обычно выявляют в легких, что связано с особенностями их кровоснабжения.
Иногда геморрагический инфаркт возникает на фоне выраженной гиперемии и в других органах: кишечнике, головном мозгу, почках. При красном инфаркте зона ишемии пропитывается кровью, при обретает темно-красный цвет и четкие границы.
Этот эффект возникает, если вслед за закупоркой артерии периферические сосуды омертвевшей ткани переполняются кровью, поступившей по коллатералям. При венозном застое ретроградное поступление крови из вен в зону ишемии также ведет к пропитыванию некротизированной ткани кровью.
Геморрагический инфаркт может развиваться также в результате выраженного венозного застоя при быстром прекращении оттока крови по крупным венозным стволам или одновременном выключении из кровотока большого количества мелких вен. Венозные застойные инфаркты выявляют в селезенке при тромбозе вены, отводящей от нее кровь, в головном мозгу — при нарушении проходимости синусов твердой мозговой оболочки или яремных вен, в сердце — при обтурации венечного синуса тромботическими массами, в тканях нижних конечностей — при перевязке бедренной вены.
Микроскопически в очаге геморрагического инфаркта отмечают массы гемолизированных эритроцитов, инфильтрирующих некротизированную ткань.
Общие закономерности формирования и заживления инфаркта
Стадия ишемии и некроза
Развитию инфаркта предшествует ишемия. Первые сдвиги, обусловленные нарушением кровоснабжения, определяются угнетением тканевого дыхания, компенсаторной активацией анаэробного гликолиза, быстрым накоплением метаболитов в клетках в токсических концентрациях.Недостаточное воспроизводство энергии и гистотоксический эффект ишемии нарушают электролитный гомеостаз клеток и подавляют пластические процессы, что приводит к прогрессирующей диссоциации цитомембран, закислению внутриклеточной среды, денатурации белков, гибели и разрушению клеток.
Электронно-микроскопически при ишемизации выявляют внутриклеточный отек или, напротив, дегидратацию цитоплазматического матрикса. Органеллы клеток набухают, их мембраны подвергаются гомогенизации и фрагментации, гранулы лабильного гликогена исчезают, отмечают накопление липидов в виде капель вследствие их высвобождения из диссоциирующих фосфолипидов цитомембран и нарушения липидного обмена.
В лизосомах накапливаются продукты внутриклеточного распада.
Происходят перераспределение, конденсация либо вымывание ядерного хроматина и разрушение ядрышек, расплавление цитоплазматических рибосом и органелл немембранной структуры. Гистохимически и биохимически в ишемизированной ткани определяется снижение уровня макроэргических фосфатов, активности окислительно-восстановительных ферментов, накопление недоокисленных метаболитов, нарушение обмена электролитов, уменьшение содержания гликогена, РНК и ДНК, а со временем — накопление продуктов распада стромальных структур.
На некротической стадии инфаркта при микроскопическом исследовании ядра клеток не окрашиваются, все структурные элементы ткани сливаются в однородную массу.
Стадия репаративных изменений наступает вслед за формированием некроза.
По периферии инфаркта всегда существует зона дистрофических изменений и реактивного воспаления — так называемый демаркационный вал. Микроскопически воспалительная реакция отмечается уже через несколько часов, а максимум ее развития приходится на 3-и–5-е сутки.
Воспаление в зоне демаркационного вала сопровождается выходом форменных элементов крови из капилляров. Некротические массы постепенно частично расплавляются под действием протеолитических ферментов, выходящих из нейтрофильных лейкоцитов, частично подвергаются фагоцитозу или резорбируются лимфатической сетью и выводятся по ее сосудам.
Организация зоны некроза — замещение некротических масс соединительной тканью, которая врастает со стороны демаркационного вала и к 7–10-м суткам трансформируется в грануляционную (юную) соединительную ткань, а со временем созревает в рубцовую.
Особенности развития инфаркта в различных органах
Морфология инфаркта во многом зависит от органной архитектоники сосудистой системы
В клинической практике наиболее часто отмечают инфаркт сердца (миокарда), головного мозга, кишечника, легких, почек и селезенки.Время, необходимое для развития инфаркта в различных органах, неодинаково и зависит от функциональных энергозатрат и филогенетически сложившегося метаболизма, что определяет потребность ткани в обеспечении кислородом.
Для развития ИМ достаточно полного прекращения его кровоснабжения на 20–25 мин, однако ишемия длительностью 5 мин уже ведет к гибели отдельных мышечных клеток.
В реальной жизни формирование инфаркта сердечной мышцы требует несколько большего промежутка времени, так как в зоне ишемии всегда частично сохраняется кровоток по сосудистым анастомозам и коллатералям. Он недостаточен для того, чтобы полностью предотвратить некроз, но несколько увеличивает срок его развития и ограничивает размеры.
Инфаркт обычно локализуется в ЛЖ, чаще всего в передней стенке.
По типу это белый инфаркт с геморрагическим венчиком, имеющий неправильную форму.
В зависимости от объема и локализации пораженной ткани миокарда различают мелко- и крупноочаговый, субэпикардиальный, интрамуральный, субэндокардиальный и трансмуральный ИМ, охватывающий все слои сердечной стенки.
В зоне перехода инфаркта на эпикард или эндокард развивается реактивное вос паление, в первом случае приводящее к фиброзному перикардиту (выпот в полость перикарда плазмы крови, обогащенной фибрином, и образование фиб ринозных наслоений на эпикарде), во втором — к тромбоэндокардиту (пристеночный тромбоз соответственно зоне инфаркта).
Формирование ИМ начинается с ишемической стадии.
Наряду с прогрессирующим нарушением метаболизма и дезинтеграцией клеточных мембран отмечают фрагментацию, растяжение и дезинтеграцию миофибрилл кардиомиоцитов. В результате снижается активность внутриклеточных энзимов, изменяется характер окрашивания клеток при использовании основных или кислотных гистологических красителей, нарушается способность клеток к лучепреломлению в поляризованном свете и люминесцентно-микроскопические свойства.
Эти явления используются для ранней диагностики метаболических и ишемических повреждений сердца. Гистологические признаки гибели клеток — сморщивание, набухание и разрушение клеточного ядра, исчезновение продольной и поперечной исчерченности, гомогенизирование саркоплазмы выявляют через 12 ч (рис. 2.1).

Рис. 2.1. Острый ИМ
Параллельно с деструктивными изменениями рабочих клеток миокарда происходит сосудистотканевая реакция, характеризующаяся спазмированием и паретической дилатацией интрамуральных артерий и артериол, плазматическим пропитыванием и повышением проницаемости их стенок, а также нарушением микроциркуляции с внутрисосудистой агрегацией эритроцитов, отеком интерстиция.При развитии некроза кровоток в некротической зоне прекращается, а в периинфарктной увеличивается.
Наряду с диапедезными кровоизлияниями в ней происходит экстравазация лейкоцитов и формируется лейкоцитарный вал.
В толще некротической зоны вокруг сохранившихся сосудов иногда выявляют островки жизнеспособной ткани, по периферии которых отмечают такие же явления, как и в окружающей инфаркт зоне.
В течение первых 18–24 ч от начала патологического процесса миокард в бассейне пораженной артерии отличается бледностью на фоне подчеркнуто неравномерного кровенаполнения остальной ткани.
В конце 1-х суток участок некроза становится различимым макроскопически.
В связи с непрерывной деятельностью сердца, высокой активностью ферментов, выделяющихся из лейкоцитов, на 3-и–5-е сутки начинается размягчение (миомаляция) погибшей ткани. Постепенное рассасывание (резорбция) некротизированной массы осуществляется при активном участии микрофагальных клеток, которые появляются на 4-й день кнаружи от лейкоцитарного вала.
Фибропластическая реакция интерстиция также возникает на 4–5-е сутки, а первые волокнистые элементы новообразованной соединительной ткани в зоне инфаркта появляются еще через 3 сут.
В течение последующей недели зона некроза представлена распадающимися мышечными волокнами, пропитана отечной жидкостью и инфильтрирована распадающимися лейкоцитами. По ее периферии и вокруг периваскулярных островков сохранившегося миокарда происходит новообразование соединительной ткани.
Процесс организации продолжается 2–2,5 мес. В дальнейшем соединительная ткань, образовавшаяся на месте некротических масс, уплотняется, ее сосуды запустевают и облитерируются, на месте некроза образуется рубец (рис. 2.2).

Рис. 2.2. Постинфарктный кардиосклероз
Проводящая система сердца более устойчива к гипоксии по сравнению с рабочим миокардом и способна дольше сохраняться в зонах ишемии, что важно для восстановления ритмичной работы сердца после экстренной инвазивной антиишемической терапии.В почках обычно развивается белый инфаркт с геморрагическим венчиком.
Вследствие хорошего развития сосудистых анастомозов и коллатералей инфаркт возникает только при нарушениях проходимости сосудов больше го калибра, чем дольковая артерия. Характерное расположение инфаркта — передняя латеральная поверхность органа, так как в этой зоне почечные артерии ветвятся не по магистральному, а по рассеянному типу, при котором межсосудистые коллатерали выражены значительно слабее.
Обычно инфаркт почки напоминает по форме конус, обращенный основанием к капсуле, верхушкой к почечной лоханке.
Однако иногда процесс ограничивается только корой, не затрагивая пирамидки, и поражение приближается по форме к квадрату.
Инфаркт почки часто сопровождается гематурией вследствие попадания крови в мочевые канальцы при разрыве мелких сосудов. Ишемическая стадия инфаркта почек развивается по общим закономерностям.
Некроз всех структур почечной паренхимы наступает через 24 ч, однако повреждение эпителия почечных канальцев возникает значительно раньше.
Так, уже через 6 ч отмечается гибель эпителия извитых, а через 12 ч — прямых канальцев нефрона.
К этому же времени по периферии инфаркта развивается реактивное воспаление, достигающее своего максимума примерно к 3-му дню процесса.
Формирование демаркационной зоны сопровождается нарушениями кровотока в микрососудах, явлениями отека, плазморрагиями и диапедезными кровоизлияния ми, активной миграцией лейкоцитов. Это приводит спустя сутки к образованию периферической геморрагической зоны инфаркта и лейкоцитарного вала.
Примерно с этого же времени появляются макрофаги и начинается процесс резорбции некротических масс.
На 7-е сутки деструктивнорезорбтивные процессы сочетаются с отчетливо выраженными явлениями организации, которая через несколько недель завершается образованием плотного соединительно-тканного рубца, реже — кисты.
В селезенке обычный морфологический тип инфаркта — белый (ишемический).
В условиях выраженного венозного застоя инфаркт селезенки может быть геморрагическим, приобретающим в течение нескольких суток серую или белую окраску. Ишемический инфаркт селезенки конической формы, бледно-желтой окраски. На поверхности капсулы органа в области широкой части этого конуса, а также на границе зоны инфаркта развиваются реактивное воспаление, процессы лизиса, резорбции и организации некротических масс.
Непосредственно в зоне некроза вначале разрушается красная пульпа, затем фолликулы и трабекулы.
Организация инфаркта осуществляется по общим закономерностям. Созревание постинфарктного рубца сопровождается де формированием селезенки.
Инфаркт головного мозга в 85–90% случаев является белым, в остальных — красным или смешанного характера.
Белый инфаркт может поражать любые отделы мозга. Первоначально это нечетко отграниченный участок дряблой или крошащейся консистенции, красновато-серого цвета, со стертым естественным рисунком базальных узлов или коры головного мозга.
Геморрагические инфаркты в виде небольших очагов красного цвета локализуются преимущественно в пределах скоплений серого вещества, чаще всего в коре. Смешанные инфаркты состоят из белых и красных участков, причем последние располагаются в сером веществе.
Топография различных морфологических типов инфарктов мозга предопределена особенностями кровоснабжения его различных областей.
Наиболее часто они возни кают в бассейне средней мозговой артерии, реже — позвоночных и базиллярных артерий.
Геморрагические инфаркты формируются в хорошо васкуляризированных зонах — скоплениях серого вещества или в коре головного мозга.
Развитие инфаркта головного мозга включает ишемическую и некротическую стадии.
Ишемическая стадия характеризуется дистрофическими изменениями нервной ткани, кровоизлияниями и деструкцией клеточных мембран с необратимой дезорганизацией обменных процессов и электролитного гомеостаза нервных клеток. При микроскопическом исследовании отмечают лизис глыбок базофильного вещества, просветление цитоплазмы, гиперхроматоз и деформацию ядра.
В результате нервные клетки и их ядра приобретают угловатую форму, а цитоплазма гомогенизируется, утрачивает базофильные включения и просветляется. Нарушение циркуляции крови в микрососудах сочетается с перицеллюлярным отеком — появлением светлого промежутка между капиллярной стенкой или телом нейрона и окружающей тканью.
Вокруг капилляров отмечают отек и набухание отростков окружающих их глиальных клеток.
Некротическая стадия инфаркта — стадия нарастающего аутолиза ишемизированной ткани мозга. Гибели нейронов предшествует их резкое просветление либо уплотнение и превращение в пикноморфные (уплотненные дегидратированные) клетки, а затем и в гомогенную бесструктурную массу.
Вместе с нейроцитами в деструктивные изменения вовлекаются и клетки глии.
Из мелких сосудов происходят диапедезные кровоизлияния, небольшие и единичные в очагах белого инфаркта, множественные и сливающиеся между собой при геморрагическом инфаркте.
К началу 2-х суток начинается резорбция некротизированной нервной ткани.
На границе с очагом ишемического поражения скапливаются лейкоциты.
Вместе с ними в зону некроза внедряются многочисленные активированные астроциты и появляются зернистые шары с липидными включениями. Часть астроцитов утрачивает цитоплазматические отростки, в их цитоплазме выявляют многочисленные фибриллы, приобретающие способность к образованию волокнистых структур.
Вокруг очага некроза начинается новообразование сосудов, капилляров и сосудистых петель.
В организации некротических масс участвуют как глиальные, так и соединительнотканные клетки — фибробласты.
Однако в конечной стадии процесса при небольших размерах инфаркта продукты мезодермальной пролиферации полностью вытесняются глиоволокнистыми структурами, образующими рубец. В крупных очагах срединная зона организовавшегося инфаркта остается соединительнотканной, а в центре сформировавшегося рубца образуется одна или несколько полостей, снаружи окруженных разрастаниями глии.
Инфаркт легких, как правило, имеет геморрагический характер, причиной чего являются двойное кровоснабжение легких и венозный застой.
Кровь попадает в легкие как по бронхиальным артериям, входящим в систему большого круга кровообращения, так и по артериям малого круга кровообращения. Между ЛА и бронхиальными артериями существуют многочисленные анастомозы, которые имеют строение артерий замыкающего типа и в обычных условиях не функционируют.
При обтурации достаточно крупной ветви ЛА в ее бассейн под большим давлением устремляется кровь из бронхиальных артерий по рефлекторно открывшимся анастомозам.
Переполняющиеся кровью легочные капилляры резко дилатируются, их стенки разрываются, кровьизливается в интерстиций альвеолярных перегородок и в полости альвеол, имбибируя соответствующий учас ток ткани. Благодаря автономному артериальному кровоснабжению бронхи в зоне инфаркта сохраняют жизнеспособность.
Нередко геморрагический инфаркт в легком развивается на фоне хронической венозной гиперемии, так как повышение давления в крупных венах способствует ретроградному поступлению крови в зону инфаркта. Инфаркт чаще всего развивается в периферических зонах средних и мелких отделов легких. При этом макроскопически выявляют очаги более плотной консистенции, чем окружающая ткань, конусовидной формы, основанием обращенные к плевре, которая покрывается фибринозным налетом и гиперемируется вследствие реактивного воспаления.
На разрезе некротизированная ткань темно-красного цвета, слегка зернистая, выбухает над поверхностью. В 1-е сутки в зоне инфаркта микроскопически определяются отек и кровоизлияния в виде скоплений частично гемолизированных эритроцитов в интерстициальной ткани, в просветах альвеол и мелких бронхов, что сопровождается кровохар каньем.
Затем присоединяются признаки некроза стенок альвеол, накапливаются сидерофаги. На 3-и–4-е сутки инфаркт представляет собой гомогенизированную массу из разрушившихся эритроцитов, на фоне которых видны следы некротизированных альвеолярных перегородок.
Расплавление некротизированной ткани и излившейся крови, их резорбция и организация начинаются с периферии и из сохранившихся периваскулярных и перибронхиальных зон.
Через 2–8 мес на месте инфаркта остается рубец или киста.
Белый инфаркт в легком выявляют редко.
Возникает при нарушении кровотока в бронхиальных артериях на фоне затруднения капиллярного кровотока, например вследствие сдавления внутриальвеолярным экссудатом или при уплотнении (гепатизации) легочной ткани, обусловленного пневмонией. В кишечнике инфаркт развивается по типу геморрагического.
Наиболее характерная локализация — бассейн верхней брыжеечной артерии, которая в связи с большой протяженностью чаще подвергается обструкции. Макроскопически инфаркт кишки имеет вид темно-красного участка, который достаточно ясно отграничен от непораженного кишечника.
Серозная оболочка в области инфаркта кишки становится тусклой, на ней появляются фибринозные наложения.
Стенка кишки утолщена, слизистая оболочка синюшная.
Некротические и реактивные изменения в ишемизированном сегменте кишечника развиваются быстро.
Через 15–20 мин после прекращения кровоснабжения в его стенке выявляют выраженные микроциркуляторные нарушения: тотальный отек ткани, замедление и прекращение движения крови в резко полнокровных капиллярах и венулах, множественные кровоизлияния.
Через 30 мин в отечной строме слизистой оболочки кишки появляются лейкоциты, лимфоциты, развивается макрофагальная реакция.
В течение 1–1,5 ч стенка кишки подвергается некрозу, который начинается с изъязвления ее слизистой оболочки. В сетчатке глаза инфаркт имеет характер белого, который в условиях венозного застоя трансформируется в геморрагический. Участок пораженной ткани в виде конуса обращен вершиной к зрительному диску, обычно локализуется в височном сегменте. Микроскопически выявляют деструкцию внутренних слоев сетчатки, ганглиозных клеток и нервных волокон на фоне нарушения микроциркуляции, отека и кровоизлияний.
Очень редко отмечают инфаркты в печени, мышцах, костях. Последствия инфаркта чрезвычайно существенны для организма.
Так, поражение при ИМ >30% ткани ЛЖ сопровождается развитием ОСН с остановкой сердца.
Повреждение проводящей системы сердца при формировании некроза влечет тяжелые нарушения ритма.
При обширном трансмуральном инфаркте иногда происходит взбухание некротизированного участка сердечной стенки и его истончение — развивается острая аневризма сердца. В некоторых случаях десинхронизация процессов миомаляции, резорбции некротических масс и организации зоны инфаркта приводит к разрыву аневризмы, заполнению полости перикарда кровью с летальным исходом.
В результате ИМ могут возникать разрывы межжелудочковой перегородки, отрыв папиллярных мышц, что также ведет к серьезным последствиям.
В более отдаленные сроки обширная рубцовая зона, изменяя геометрию сокращения сердца и внутрисердечную гемодинамику, способствует развитию ХСН и общей венозной гиперемии.
Инфаркт головного мозга сопровождается его отеком, расстройством микроциркуляции и метаболическими нарушениями как в непосредственной близости от очага поражения, так и в отдаленных участках.
Исход инфаркта определяется его размерами, локализацией и темпами развития патологического процесса.
Смерть таких больных может быть обусловлена как самим очагом поражения в головном мозгу, так и причинами, непосредственно с ним не связанными.
Нередко при медленном формировании инфаркта больные погибают не от деструктивных изменений, затрагивающих жизненно важные центры головного мозга, а вследствие СН, пневмонии и другой присоединившейся патологии, осложнившей течение инфаркта.
Серьезным осложнением инфаркта головного мозга является кровоизлияние в размягченную ткань.
Как и отек мозга, так и увеличение его объема вследствие восстановления кровотока по сосудам в зоне ишемии могут вызывать дислокацию и ущемление ствола мозга.
При благоприятном исходе на месте инфаркта формируется рубец или киста с более или менее значительными нарушениями функции ЦНС.
Инфаркт кишечника требует обязательного хирургического вмешательства, так как конечной фазой его развития является гангрена с прободением кишечной стенки.
Попадание содержимого кишечника в брюшную полость влечет за собой развитие перитонита. Причиной перитонита может стать также инфаркт селезенки, обычно заканчивающийся формированием грубого рубца, деформирующего орган. Инфаркт легкого обычно не несет непосредственной угрозы жизни больному.
Однако его течение может осложниться пост инфарктной пневмонией, нагноением и распространением воспалительного процесса на плевру с развитием пневмоторакса и гангрены легкого. Одной из наиболее характерных причин нагноения инфаркта является попадание в сосуд гнойного эмбола.
Это вызывает гнойное расплавление ткани легкого и образование абсцесса на месте инфаркта.
При инфаркте почек, обычно заживающем посредством рубцевания соответствующего участка, угрожающие жизни осложнения возникают при нагноении либо при обширных поражениях, особенно при симметричных некрозах коркового слоя, следствием которых может быть ОПН.
А.С. Гавриш «Нарушение кровообращения»
Опубликовал Константин Моканов
Красный и белый инфаркт
Расстройства кровообращения
Транспортно-обменную функцию, направленную на поддержание гомеостаза, в различных органах и тканях выполняют системы крово- и лимфообращения, тесно связанные между собой. Их состояние во многом зависит от показателей осмотического и онкотического давления, водно-электролитного баланса, уровня гормонов
(прежде всего ренин-ангиотензин-альдостероновой системы), влияющих на сосудистое русло. Поэтому любое их нарушение влечет за собой изменения метаболизма и различные повреждения клеток и тканей. Так, например, возрастание гидростатического давления, снижение онкотического давления плазмы, нарушение лимфооттока
при целом ряде патологических состояний, особенно сопровождающихся задержкой натрия и воды, приводят к формированию отека Среди расстройств кровообращения выделяют нарушения кровенаполнения и гемостаза.
Нарушения кровенаполнения заключаются в артериальном или венозном полнокровии (гиперемии) и отражают патологическое увеличение объема циркулирующей крови в пораженной системе органов, органе, ткани. Кроме того, выделяют артериальное малокровие, рассматриваемое в следующей лекции.
Инфаркт (от лат. infarcire — начинять, набивать) — очаг некроза в ткани или органе, возникающий вследствие прекращения или значительного снижения артериального притока, реже — венозного оттока.
Инфаркт — это сосудистый (дисциркуляторный) некроз. Причинами инфаркта являются тромбоз, эмболия, длительный спазм артерии или функциональное перенапряжение органа в условиях недостаточного кровоснабжения (последнее наблюдается только при инфаркте миокарда).
Форма инфаркта зависит от особенностей строения сосудистой системы того или иного органа, наличия анастомозов, коллатерального кровоснабжения (ангиоархитектоники). Так, в органах с магистральным расположением сосудов возникают треугольные (конусовидные, клиновидные) инфаркты, тогда как при рассыпном или смешанном типе ветвления сосудов наблюдается неправильная форма инфаркта. По внешнему виду выделяют белый и красный инфаркты.
Белый (ишемический, бескровный) инфаркт возникает вследствие поражения соответствующей артерии. Такие инфаркты встречаются в селезенке, головном мозге, сердце, почках и представляют собой в большинстве случаев коагуляционный или реже колликвационный (в головном мозге) некроз. Примерно через 24 ч от начала развития инфаркта зона некроза становится хорошо видимой, четко контрастирует своим бледно-желтым или бледно-коричневым цветом с зоной сохранной ткани. Между ними располагается демаркационная зона, представленная воспалительной лейкоцитарной и макрофагальной инфильтрацией и гиперемированными сосудами с диапедезом форменных элементов крови вплоть до формирования мелких кровоизлияний. В миокарде и почках вследствие большого количества сосудистых коллатералей и анастомозов демаркационная зона занимает значительную площадь. В связи с этим инфаркт этих органов называют ишемическим с геморрагическим венчиком.
Красный (геморрагический) инфаркт развивается при закупорке артерий и (реже) вен и обычно встречается в легких, кишечнике, яичниках, головном мозге. Большое значение в генезе красного инфаркта имеет смешанный тип кровоснабжения, а также наличие венозного застоя. Так, например, обтурация тромбоэмболом или тромбом ветви легочной артерии вызывает поступление по анастомозам крови в зону пониженного давления из системы бронхиальных артерий с последующим разрывом капилляров межальвеолярных перегородок. В очень редких случаях блокирования этих анастомозов (возможно при наличии пневмонии той же локализации) в легком может развиться и белый инфаркт. Также исключительно редко при тромбозе селезеночной вены образуется не белый, а красный (венозный) инфаркт селезенки. Зона некроза пропитывается кровью, придающей пораженным тканям темно-красный или черный цвет. Демаркационная зона при этом инфаркте не выражена, так как занимает небольшую площадь.
В течение нескольких дней сегментоядерные нейтрофилы и макрофаги частично резорбируют некротизированную ткань. На 7—10-й день отмечается врастание из демаркационной зоны грануляционной ткани, постепенно занимающей всю зону некроза. Происходит организация инфаркта, его рубцевание. Возможен и другой благоприятный исход — образование на месте некроза кисты (полости, иногда заполненной жидкостью), что часто наблюдается в головном мозге.
При небольших размерах ишемического инсульта (инфаркта мозга) возможно замещение его глиальной тканью с формированием глиального рубца. К неблагоприятным исходам инфаркта относится его нагноение.
Белый инфаркт и красный инфаркт
Инфаркт (лат. infarctus, от infarcire набивать, наполнять) — участок органа или ткани, подвергшийся некрозу вследствие прекращения его кровоснабжения. В связи с этим инфаркт называют также сосудистым, или ишемическим, некрозом. Непосредственными причинами развития инфаркта являются длительный спазм, тромбоз или эмболия артерии, а также функциональное напряжение органа в условиях его недостаточного кровоснабжения. Большое влияние на возникновение инфаркта оказывает недостаточность анастомозов и коллатералей, которая зависит от степени поражения стенок артерий и сужения их просветов, степени нарушения кровообращения и уровня обтурации (закупорки) артерии тромбом или эмболом. Поэтому инфаркт обычно развивается при заболеваниях, характеризующихся тяжёлыми изменениями артерий и общими расстройствами кровообращения (атеросклероз, гипертоническая болезнь, ревматизм, пороки сердца, затяжной септический эндокардит).
Возникают белый (ишемический) инфаркт, красный (геморрагический) инфаркт и белый инфаркт с геморрагическим ободком. Инфаркт любого типа может быть либо конической, либо неправильной формы. Коническую форму имеет обычно инфаркт, развивающийся в бассейне артерий с магистральным типом ветвления, неправильную — с рассыпным типом.
Белый инфаркт возникает в результате запустевания сосудистого русла в его зоне при непроходимости магистрального артериального ствола и недостаточной функции коллатералей. Особенно часто встречается в селезёнке, реже в почках. Сформированный белый инфаркт определяется макроскопически примерно через 1 сутки. Микроскопически в зоне инфаркта обнаруживается некроз, чаще коагуляционного, реже колликвационного типа. По периферии зона некроза отграничена воспалительным демаркационным валом.
При красном инфаркте зона некроза пропитана кровью тёмно-красного цвета. Этот тип инфаркта отмечается чаще в лёгких, головном мозге, кишечнике. Развитию красного инфаркта способствуют венозный застой и двойное кровоснабжение органа (из сосудов разных сосудистых систем). При венозном застое ретроградное проникновение крови из вен ведёт к излиянию крови в некротизированный участок. При значительной степени выраженности венозный застой может сам по себе вызвать геморрагический инфаркт. Особой формой геморрагического инфаркта является венозный инфаркт, причиной которого служит окклюзия вен в результате тромбоза или других патологических процессов. Двойное кровоснабжение (например, лёгких, печени) способствует тому, что в бассейн сосуда с нарушенной проходимостью через анастомозы проникает кровь из другой системы кровоснабжения, пропитывая некротизированную ткань.
Белый инфаркт с геморрагическим ободком развивается в тех случаях, когда в ходе формирования ишемического некроза происходит запоздалое включение коллатералей и сосудов краевой зоны инфаркта после их длительного спазма. При этом сосуды краевой зоны паралитически расширены, в них отмечаются резкое полнокровие и стаз, излияние крови в некротизированную ткань. Таким образом, этот тип инфаркта представляет собой комбинацию красного и белого инфаркта: центр его образован инфаркт белого типа, периферия — инфаркта красного типа. Такой инфаркт часто встречается в сердце и почках.
Осложнения. Из многочисленных осложнений назовём основные: нарушение ритма сердца, сердечная недостаточность, размягчение мозга.
Транспортно-обменную функцию, направленную на поддержание гомеостаза, в различных органах и тканях выполняют системы крово- и лимфообращения, тесно связанные между собой. Их состояние во многом зависит от показателей осмотического и онкотического давления, водно-электролитного баланса, уровня гормонов
(прежде всего ренин-ангиотензин-альдостероновой системы), влияющих на сосудистое русло. Поэтому любое их нарушение влечет за собой изменения метаболизма и различные повреждения клеток и тканей. Так, например, возрастание гидростатического давления, снижение онкотического давления плазмы, нарушение лимфооттока
при целом ряде патологических состояний, особенно сопровождающихся задержкой натрия и воды, приводят к формированию отека Среди расстройств кровообращения выделяют нарушения кровенаполнения и гемостаза.
Нарушения кровенаполнения заключаются в артериальном или венозном полнокровии (гиперемии) и отражают патологическое увеличение объема циркулирующей крови в пораженной системе органов, органе, ткани. Кроме того, выделяют артериальное малокровие, рассматриваемое в следующей лекции.
Инфаркт (от лат. infarcire — начинять, набивать) — очаг некроза в ткани или органе, возникающий вследствие прекращения или значительного снижения артериального притока, реже — венозного оттока.
Инфаркт — это сосудистый (дисциркуляторный) некроз. Причинами инфаркта являются тромбоз, эмболия, длительный спазм артерии или функциональное перенапряжение органа в условиях недостаточного кровоснабжения (последнее наблюдается только при инфаркте миокарда).
Форма инфаркта зависит от особенностей строения сосудистой системы того или иного органа, наличия анастомозов, коллатерального кровоснабжения (ангиоархитектоники). Так, в органах с магистральным расположением сосудов возникают треугольные (конусовидные, клиновидные) инфаркты, тогда как при рассыпном или смешанном типе ветвления сосудов наблюдается неправильная форма инфаркта. По внешнему виду выделяют белый и красный инфаркты.
Белый (ишемический, бескровный) инфаркт возникает вследствие поражения соответствующей артерии. Такие инфаркты встречаются в селезенке, головном мозге, сердце, почках и представляют собой в большинстве случаев коагуляционный или реже колликвационный (в головном мозге) некроз. Примерно через 24 ч от начала развития инфаркта зона некроза становится хорошо видимой, четко контрастирует своим бледно-желтым или бледно-коричневым цветом с зоной сохранной ткани. Между ними располагается демаркационная зона, представленная воспалительной лейкоцитарной и макрофагальной инфильтрацией и гиперемированными сосудами с диапедезом форменных элементов крови вплоть до формирования мелких кровоизлияний. В миокарде и почках вследствие большого количества сосудистых коллатералей и анастомозов демаркационная зона занимает значительную площадь. В связи с этим инфаркт этих органов называют ишемическим с геморрагическим венчиком.
Красный (геморрагический) инфаркт развивается при закупорке артерий и (реже) вен и обычно встречается в легких, кишечнике, яичниках, головном мозге. Большое значение в генезе красного инфаркта имеет смешанный тип кровоснабжения, а также наличие венозного застоя. Так, например, обтурация тромбоэмболом или тромбом ветви легочной артерии вызывает поступление по анастомозам крови в зону пониженного давления из системы бронхиальных артерий с последующим разрывом капилляров межальвеолярных перегородок. В очень редких случаях блокирования этих анастомозов (возможно при наличии пневмонии той же локализации) в легком может развиться и белый инфаркт. Также исключительно редко при тромбозе селезеночной вены образуется не белый, а красный (венозный) инфаркт селезенки. Зона некроза пропитывается кровью, придающей пораженным тканям темно-красный или черный цвет. Демаркационная зона при этом инфаркте не выражена, так как занимает небольшую площадь.
В течение нескольких дней сегментоядерные нейтрофилы и макрофаги частично резорбируют некротизированную ткань. На 7—10-й день отмечается врастание из демаркационной зоны грануляционной ткани, постепенно занимающей всю зону некроза. Происходит организация инфаркта, его рубцевание. Возможен и другой благоприятный исход — образование на месте некроза кисты (полости, иногда заполненной жидкостью), что часто наблюдается в головном мозге.
При небольших размерах ишемического инсульта (инфаркта мозга) возможно замещение его глиальной тканью с формированием глиального рубца. К неблагоприятным исходам инфаркта относится его нагноение.
Инфаркт (от лат. infarcire — начинять, набивать) — это мертвый участок органа или ткани, выключенный из кровообращения в результате внезапного прекращения кровотока (ишемии). Инфаркт — разновидность сосудистого (ишемического) коагуляционного либо колликвационного некроза.
Некрозу подвергаются как паренхиматозные клетки, так и интерстициальная ткань. Наиболее часто инфаркт возникает при тромбозе или эмболии, спазме, сдавлении артериальных сосудов. Очень редко причиной инфаркта может быть нарушение венозного оттока.
Причины развития инфаркта:
— острая ишемия, обусловленная длительным спазмом, тромбозом или эмболией, сдавлением артерии;
— функциональное напряжение органа в условиях недостаточного его кровоснабжения. Огромное значение для возникновения инфаркта имеет недостаточность анастомозов и коллатералей, которая зависит от степени поражения стенок артерий и сужения их просветов (атеросклероз, облитерирующий эндар- териит), от степени нарушения кровообращения (например, венозного застоя) и от уровня выключения артерии тромбом или эмболом.
Поэтому инфаркты возникают обычно при тех заболеваниях, для которых характерны тяжелые изменения стенок артерий и общие расстройства кровообращения. Это:
— бактериальный (инфекционный) эндокардит.
C недостаточностью анастомозов и коллатералей связано развитие венозных инфарктов при тромбозе вен в условиях застойного полнокровия.
Макроскопическая картина инфарктов. Форма, величина, цвет и консистенция инфаркта могут быть различными.
Форма инфаркта. Обычно инфаркты имеют клиновидную форму. При этом заостренная часть клина обращена к воротам органа, а широкая часть выходит на периферию, например, под капсулу органа, под брюшину (инфаркты селезенки), под плевру (инфаркты легких) и т. д. Характерная форма инфарктов в почках, селезенке, легких определяется характером ангиоархитектоники этих органов — магистральным (симметричным дихотомическим) типом ветвления артерий. Реже инфаркты имеют неправильную форму. Такие инфаркты встречаются в сердце, мозге, кишечнике, поскольку в этих органах преобладает не магистральный, а рассыпной или смешанный тип ветвления артерий.
Величина инфарктов. Инфаркт может охватывать большую часть или весь орган (субтотальный или тотальный инфаркт) или обнаруживаться лишь под микроскопом (.микроинфаркт).
Цвет и консистенция инфарктов. Если инфаркт развивается по типу коагуляционного некроза, то ткань в области омертвения уплотняется, становится суховатой, бело-желтого цвета (инфаркт миокарда, почек, селезенки). Если инфаркт образуется по типу колликвационного некроза, то мертвая ткань размягчается и разжижается (инфаркт мозга или очаг серого размягчения).
B зависимости от механизма развития и внешнего вида различают:
* белый (ишемический) инфаркт;
* красный (геморрагический) инфаркт;
* белый инфаркт с геморрагическим венчиком.
Белый (ишемический) инфаркт возникает в результате полного прекращения притока артериальной крови в органах, например, в сердце, почках, селезенке, головном мозге выше вилли- зиева круга. Обычно он возникает в участках с одной системой притока крови (магистральным типом ветвления артерий), в которых коллатеральное кровообращение развито слабо. Благодаря ненарушенному венозному оттоку из ишемизированной ткани и вследствие спазма дистального участка артерий после прекращения кровотока наблюдается бледность этих инфарктов. Белый (ишемический) инфаркт представляет собой участок, четко отграниченный от окружающих тканей, бело-желтого цвета, бесструктурный.
Белый инфаркт с геморрагическим венчиком представлен участком бело-желтого цвета, но этот участок окружен зоной кровоизлияний. Она образуется в результате того, что спазм сосудов ло периферии инфаркта сменяется паретическим их расширением и развитием кровоизлияний. Такой инфаркт может возникать в почках, миокарде.
Красный (геморрагический) инфаркт характеризуется тем, что участок омертвения пропитан кровью, он темно-красный и хорошо отграничен. Инфаркт становится красным из-за выхода в зоне инфаркта крови из некротизированных сосудов микроциркуляторного русла. Для развития красного инфаркта имеют значение особенности ангиоархитектоники органа — две и более системы притока крови, развитость коллатералей: влегких — наличие анастомозов между бронхиальной и легочной артериями, в кишечнике — обилие анастомозов между ветвями брыжеечных артерий, в головном мозге в области виллизиева круга анастомозы между внутренними сонными и ветвями базилярной артерий.
Редко геморрагический инфаркт встречается в почках и сердце. Необходимым условием для такого геморрагического пропитывания является венозный застой.
Венозный инфаркт возникает при окклюзии всей венозной дренажной системы ткани (например, тромбоз верхнего сагиттального синуса, тромбоз почечной вены, тромбоз верхней брыжеечной вены). При этом возникают тяжелый отек, застой, кровоизлияния и прогрессивное увеличение гидростатического давления в тканях. При сильном увеличении гидростатического давления затрудняется приток артериальной крови в ткань, что ведет к ишемии и инфаркту. Венозные инфаркты всегда геморрагические.
Особые типы венозного инфаркта возникают при ущемлении (например, при ущемлении грыжи в грыжевых воротах приводит к инфаркту содержимого грыжевого мешка) и перекручивании вен (например, перекрут семенного канатика приводит к геморрагическому инфаркту яичка).
Различают асептический и септический инфаркты. Большинство инфарктов внутренних органов, не соприкасающихся с внешней средой, являются асептическими. Септические инфаркты возникают при попадании вторичной бактериальной инфекции в некротизированные ткани. Септические инфаркты возникают при:
1) наличии микроорганизмов в обтурирующем тромбе или эмболе, например, в эмболах при бактериальном (септическом) эндокардите;
2) развитии инфаркта в ткани (например, в кишечнике), в которой в норме присутствует бактериальная флора.
Септические инфаркты характеризуются острым гнойным воспалением, которое часто приводит к образованию абсцесса на месте зоны инфаркта. Наличие предсуществующей бактериальной флоры в органах, контактирующих с внешней средой, может обусловить трансформацию развивающихся в них инфарктов в гангрену (например, в кишечнике, легких).
Микроскопически мертвый участок отличается потерей структуры, контуров клеток и исчезновением ядер.
Наибольшее клиническое значение имеют инфаркты сердца (миокарда), головного мозга, кишечника, легких, почек, селезенки.
B сердце инфаркт обычно белый с геморрагическим венчиком, имеет неправильную форму, встречается чаще в левом желудочке и межжелудочковой перегородке, крайне редко — в правом желудочке и предсердиях. Омертвение может локализоваться под эндокардом (субэндокардиалъный инфаркт), эпикардом (субэпи- кардиалъный инфаркт), втолще миокарда (интрамуральный) или охватывать всю толщу миокарда (трансмуральный инфаркт). B области инфаркта на эндокарде нередко образуются тромботические, а на перикарде — фибринозные наложения, что связано с развитием реактивного воспаления вокруг участков некроза. Чаще всего инфаркт миокарда встречается на фоне атеросклероза и гипертонической болезни с присоединением спазма или тромбоза артерий, являясь острой формой ишемической болезни сердца.
B головном M03te выше виллизиева круга возникает белый инфаркт, который быстро размягчается (очаг серого размягчения мозга). Если инфаркт образуется на фоне значительных расстройств кровообращения, венозного застоя, то очаг омертвения мозга пропитывается кровью и становится красным (очаг красного размягчения мозга). B области стволамозга, ниже вшлизиева круга также развивается красный инфаркт. Инфаркт локализуется обычно в подкорковых узлах, разрушая проводящие пути мозга, что проявляется параличами. Инфаркт мозга, как и инфаркт миокарда, чаще всего встречается на фоне атеросклероза и гипертонической болезни и является одним из проявлений цереброваскулярных заболеваний.
Влегких в подавляющем большинстве случаев образуется геморрагический инфаркт. Причиной его чаще служит тромбоэмболия, реже — тромбоз при васкулите. Участок инфаркта хорошо отграничен, имеет форму конуса, основание которого обращено к плевре. Омертвевшая ткань плотна, зерниста, темно-красного цвета. Геморрагический инфаркт легких обычно возникает на фоне венозного застоя, причем развитие его в значительной мере определяется особенностями ангиоархитектоники легких, наличием анастомозов между системами легочной и бронхиальных артерий. B условиях застойного полнокровия и закрытия просвета ветви легочной артерии в область омертвения ткани легкого из бронхиальной артерии поступает кровь, которая разрывает капилляры и изливается в просвет альвеол.
Инфаркт белый с геморрагическим венчиком это
Форма, величина, цвет и консистенция инфаркта могут быть разными. Форма инфаркта. Обычно инфаркты имеют клиновидную форму. При этом заостренная часть клина обращена к воротам органа, а широкая часть выходит на
периферию, например, капсулу органа, под брюшину (инфаркты селезенки), под плевру (инфаркты легких). Характерная форма инфарктов в почках, селезенке, легких определяется характером ангиоархитектоники этих органов — магистральным (симметричным дихотомическим) типом ветвления артерий. Реже инфаркты имеют неправильную форму. Такие инфаркты встречаются в сердце, мозге, кишечнике, поскольку в этих органах преобладает не магистральный, а рассыпной или смешанный тип ветвления артерий.
Величина инфарктов. Инфаркт может охватывать большую часть или весь орган (субтотальный или тотальный инфаркт) или проявляться лишь под микроскопом (микроинфаркт).
Цвет и консистенция инфарктов. Если инфаркт развивается по типу коагуляционного некроза, то ткань в области омертвения уплотняется, становится суховатой, бело-желтого цвета (инфаркт миокарда, почек, селезенки). Если инфаркт образуется по типу колликвационного некроза, то мертвая ткань размягчается и разжижается (инфаркт мозга или очаг серого размягчения).
В зависимости от механизма развития и внешнего вида различают:
— Белый (ишемический) инфаркт;
— Красный (геморрагический) инфаркт;
— Белый инфаркт с геморрагическим венчиком.
Белый (ишемический) инфаркт возникает в результате полного прекращения притока артериальной крови в органах, например, в сердце, почках, селезенке, головном мозге выше виллизиева круга. В основном он возникает в участках с одной системой притока крови (магистральным типом ветвления артерий), в которых коллатеральное кровообращение развит слабо. Благодаря ненарушенном венозного оттока из ишемизированной ткани и вследствие спазма дистального участка артерий после прекращения кровотока наблюдается бледность этих инфарктов. Белый (ишемический) инфаркт — это участок, четко отделена от окружающих тканей, бело-желтого цвета, бесструктурная.
Белый инфаркт с геморрагическим венчиком — это участок бело-желтого цвета, но ограничена зоной кровоизлияний. Она образуется в результате того, что спазм сосудов по периферии инфаркта меняется паретичную их расширением и развитием кровоизлияний. Такой инфаркт может возникать в почках, миокарде.
Красный (геморрагический) инфаркт характеризуется тем, что участок омертвения просякаегься кровью, она темно-красная и хорошо отграничен. Инфаркт становится красным вследствие выхода в зоне инфаркта крови из некротизированных сосудов микроциркуляторного русла. Для развития красного инфаркта имеют значение особенности ангиоархитектоники органа — две и более системы притока крови, развитие коллатералей: в легких — наличие анастомозов между бронхиальной и легочной артериями, в кишечнике — достаточно анастомозов между ветвями брыжеечных артерий, в головном мозге в области виллизиева круга — анастомозы между внутренними сонными и ветвями базилярной артерий. Красные инфаркты могут также возникать в ткани при растворении или фрагментации (распаде) обтурирующему тромба, восстанавливает артериальный кровоток в зоне инфаркта.
Геморрагический инфаркт редко встречается в почках и сердце. Необходимым условием для такого геморрагического пропитывания является венозный застой.
Венозный инфаркт возникает при окклюзии всей венозной дренажной системы ткани (например, тромбоз верхнего сагиттального синуса, тромбоз почечной вены, тромбоз верхней брыжеечной вены). При этом возникают тяжелый отек, застой, кровоизлияния и прогрессивное увеличение гидростатического давления в тканях. При сильном увеличении гидростатического давления затрудняется приток артериальной крови в ткань, что приводит к ишемии и инфаркта. Венозные инфаркты всегда геморрагические.
Особые типы венозного инфаркта возникают при ущемлении (например, при ущемлении грыжи в килових воротах приводит к инфаркту содержания килового мешка) и искажении вен (например, перекрут семенного канатика приводит к геморрагического инфаркта яичка).
Различают асептический и септический инфаркты. Большинство инфарктов внутренних органов, которые не соприкасаются с внешней средой, является асептическими. Септические инфаркты возникают при попадании вторичной бактериальной инфекции в некротизированные ткани. Септические инфаркты возникают при: 1) наличии микроорганизмов в обтурованому тромбе или эмболии, например, в эмболах при бактериальном (септическом) эндокардите, 2) развития инфаркта в ткани (например, в кишечнике), в которой в норме присутствует бактериальная флора. Септические инфаркты характеризуются острым гнойным воспалением, которое часто приводит к образованию абсцесса на месте зоны инфаркта. Наличие бактериальной флоры в органах, которые контактируют с внешней средой, может обусловить трансформацию инфарктов, развивающихся в них, в гангрену (например, в кишечнике, легких).
Микроскопически мертвый участок отличается потерей структуры, контуров клеток и исчезновением ядер. Наибольшее клиническое значение имеют инфаркты сердца (миокарда), головного мозга, кишечника, легких, почек, селезенки.
В сердце инфаркт обычно белый с геморрагическим венчиком, имеет неправильную форму, встречается чаще в левом желудочке и межжелудочковой перегородке, крайне редко — в правом желудочке и предсердиях. Омертвения может локализоваться под эндокардом (субэндокардиальный инфаркт), эпикардом (субэпикардиальный инфаркт), в толще миокарда (интрамуральный) или охватывать всю толщину миокарда (трансмуральный инфаркт). В области инфаркта на эндокарде нередко образуются тромботические, а на перикарде — фибринозные наложения, что связано с развитием реактивного воспаления вокруг участки некроза. Чаще всего инфаркт миокарда встречается на фоне атеросклероза и гипертонической болезни с присоединением спазма или тромбоза артерий, являясь острой формой ишемической болезни сердца.
В головном мозге выше виллизиева круга возникает белый инфаркт, быстро размягчается (очаг серого размягчения мозга). Если инфаркт образуется на фоне значительных расстройств кровообращения, венозного застоя, то ячейка омертвения мозга просякаеться кровью и становится красным (очаг красного размягчения мозга). В области ствола мозга, ниже виллизиева круга также развивается красный инфаркт. Инфаркт локализуется обычно в подкорковых узлах, разрушая проводящие пути мозга, что проявляется параличами. Инфаркт мозга, как и инфаркт миокарда, чаще всего встречается на фоне атеросклероза и гипертонической болезни и является одним из проявлений цереброваскулярных заболеваний.
В легких в большинстве случаев образуется геморрагический инфаркт. Причиной его чаще служит тромбоэмболия, реже — тромбоз при васкулите. Участок инфаркта хорошо отграничен, имеет форму конуса, основание которого обращена к плевры. На плевре в области инфаркта появляются наложения фибрина (реактивный плеврит). В острие конуса, обращенного к корню легкого, нередко оказывается тромб или эмбол в ветке легочной артерии. Мертвое ткань плотная, зернистая, темно-красного цвета. Геморрагический инфаркт легких обычно возникает на фоне венозного застоя, причем развитие его в значительной степени определяется особенностями ангиоархитектоники легких, наличием анастомозов между системами легочной и бронхиальных артерий. В условиях застойного полнокровия и закрытия просвета ветви легочной артерии в область омертвения ткани легкого с бронхиальной артерии поступает кровь, которая разрывает капилляры и изливается в просвет альвеол. Вокруг инфаркта нередко развивается воспаление легочной ткани (периинфарктна пневмония). Массивный геморрагический инфаркт легкого может быть причиной надпеченочной желтухи. Белый инфаркт в легких — исключительная редкость. Возникает он при склерозе и облитерации просвета бронхиальных артерий.
В почках инфаркт, как правило, белый с геморрагическим венчиком, конусообразная участок некроза охватывает или корковое вещество, или всю толщину паренхимы. При закрытии основного артериального ствола развивается, тотальный или субтотальный инфаркт почки. Своеобразной разновидностью инфарктов являются симметричные некрозы коры почек, которые приводят к развитию острой почечной недостаточности. Развитие ишемических инфарктов почек связан в основном с тромбоэмболией, реже — с тромбозом ветвей почечной артерии при ревматизме, бактериальном эндокардите, гипертонической болезни, ишемической болезни сердца. Редко при тромбозе почечных вен возникает венозный инфаркт почек.
В селезенке встречаются белые инфаркты, нередко с реактивным фибринозным воспалением капсулы и последующим образованием спаек с диафрагмой, париетальным листком брюшины, петлями кишки. Ишемические инфаркты селезенки связаны с тромбозом и эмболией. При тромбозе селезеночной вены иногда, очень редко, образуются венозные инфаркты.
В кишке инфаркты геморрагические и всегда подвергаются септический распад, что приводит к прорыв стенки кишки и развитию перитонита. Причиной, чаще, служит заворот, инвагинация кишки, ущемленная грыжа, реже-атеросклероз с присоединением тромбоза.
Читайте также:
- Адаптационно-метаболические механизмы гипербарической оксигенации при патологии (шок, инфаркт миокарда, ишемия головного мозга, токсические гепатиты)
- ИНФАРКТ МИОКАРДА
- Инфаркт миокарда
- Инфаркт миокарда — это некроз определенного участка сердечной мышцы, который развивается в связи с резким и продолжительным уменьшением коронарного кровотока.
- Инфаркт миокарда- это некроз определенного участка сердечной мышцы, который развивается в связи с резким и продолжительным уменьшением коронарного кровотока. 1 страница
- Инфаркт миокарда- это некроз определенного участка сердечной мышцы, который развивается в связи с резким и продолжительным уменьшением коронарного кровотока. 2 страница
- Инфаркт миокарда- это некроз определенного участка сердечной мышцы, который развивается в связи с резким и продолжительным уменьшением коронарного кровотока. 3 страница
- Какие зоны выделяют в миокарде при инфаркте?
- Клинические подходы при оценке состояния больных после инфаркта миокарда
- МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ КАРДИОМИОЦИТОВ ПРИ ИНФАРКТЕ МИОКАРДА
- Острый инфаркт миокарда
МОРФОЛОГИЯ ИШЕМИИ
Развивающиеся в тканях изменения связаны с продолжительностью и тяжестью ишемии, чувствительностью органов к недостатку кислорода, наличием коллатеральных сосудов. Наиболее чувствительными к артериальному малокровию являются головной мозг, почки, миокард, в меньшей степени — лёгкие и печень, а соединительная, костная и хрящевая ткани отличаются максимальной устойчивостью к недостатку кислорода.
Основой ишемии является гипоксия, механизмы повреждающего действия которой описаны в главе 1. При острой ишемии развиваются дистрофические и некротические изменения, а при хронической — преимущественно атрофические и склеротические. Для степени повреждения тканей большое значение имеет функциональное состояние органа в момент развития гипоксии, определяющее интенсивность обменных процессов в нем и потребность в кислороде. Например, при гипотермии эти показатели снижаются, что используется во время операций на сердце в условиях искусственного кровообращения. При хроническом малокровии успевает сформироваться коллатеральное кровообращение, снижающее кислородную недостаточность.
Инфаркт (от лат. infarcire — начинять, набивать) — очаг некроза в ткани или органе, возникающий вследствие острого прекращения или значительного снижения артериального притока, реже — венозного оттока. Инфаркт — сосудистый (дисциркуляторный) некроз. Причинами инфаркта являются: тромбоз, эмболия, длительный спазм артерий.
Форма инфаркта зависит от особенностей строения сосудистой системы органа, наличия анастомозов, коллатерального кровоснабжения (ангиоархитектоники), может быть треугольная и неправильная.
● В органах с магистральным расположением сосудов возникает инфаркт треугольной (конусовидной, клиновидной) формы.
● При рассыпном или смешанном типе ветвления сосудов образуется инфаркт неправильной формы.
По внешнему виду выделяют белый и красный инфаркты.
● Белый (ишемический, бескровный) инфаркт. Возникает вследствие прекращения кровотока в питающей артерии или её ветви. Такие инфаркты встречаются в селезёнке (рис. 3-10), головном мозге, сердце, почках и представляют собой в большинстве случаев коагуляционный или реже колликвационный (в головном мозге) некроз. Примерно через 24 ч от начала развития инфаркта зона некроза становится хорошо видимой, бледно-желтоватого или бледно-коричневатого цвета, отличаясь от зоны сохранившейся ткани. Между ними располагается демаркационная зона, представленная воспалительной лейкоцитарной и макрофагальной инфильтрацией и гиперемированными сосудами с диапедезом форменных элементов крови вплоть до формирования мелких кровоизлияний. В миокарде (рис. 3-11) и почках вследствие большого количества сосудистых коллатералей и анастомозов демаркационная зона занимает значительную площадь и имеет красно-бурый цвет. Поэтому такие инфаркты называют ишемическими с геморрагическим венчиком.
Рис. 3-10. Белый (ишемический) инфаркт селезёнки.
Рис. 3-11. Инфаркт миокарда. Окраска гематоксилином и эозином (x150).
● Красный (геморрагический) инфаркт развивается при закупорке артерий, реже вен и обычно наблюдается в лёгких (рис. 3-12), кишечнике, яичниках, головном мозге. Большое значение в генезе красного инфаркта имеет двойной тип кровоснабжения, а также наличие венозного застоя. Например, при обтурации тромбоэмболом или тромбом ветви лёгочной артерии в ней падает кровяное давление, что вызывает резкое поступление по анастомозам крови в зону пониженного давления из системы бронхиальных артерий. При этом разрываются капилляры межальвеолярных перегородок. Исключительно редко при тромбозе селезёночной вены образуется не белый, а красный (венозный) инфаркт селезёнки. Зона некроза пропитывается кровью, придающей пораженным тканям тёмно-красный или чёрный цвет. Демаркационная зона при этом инфаркте не выражена, так как занимает небольшую площадь.
Рис. 3-12. Красный (геморрагический) инфаркт лёгкого.
Исходы инфаркта. В течение нескольких дней сегментоядерные нейтрофилы и макрофаги частично резорбируют некротизированную ткань органа. На 7–10 день отмечается врастание из демаркационной зоны грануляционной ткани, постепенно занимающей всю зону некроза. Происходит организация инфаркта, его рубцевание. Возможен и другой благоприятный исход — образование на месте некроза кисты (полости, иногда заполненной жидкостью), что часто наблюдается в головном мозге. При небольших размерах ишемического инфаркта мозга возможно замещение его глиальной тканью с формированием глиального рубца. Неблагоприятным исходам инфаркта является его нагноение.
| ГЛАВА 04. ВОСПАЛЕНИЕ | печать |
| вернуться к списку статей | поставить закладку |
Воспаление — биологический и основной общепатологический процесс. Он имеет защитно-приспособительную функцию, направленную на ликвидацию повреждающего агента и восстановление повреждённой ткани. Несомненно, воспаление существует столь же долго, как и жизнь на Земле. Принято считать, что история учения о воспалении началась с Гиппократа (460–377 гг. до н.э.), хотя, несомненно, и ранее люди знали об этом процессе. Римский учёный А. Цельс (25 г. до н.э.–50 г. н.э.) выделил основные внешние симптомы воспаления: красноту (rubor), опухоль (tumor), жар (calor) и боль (dolor). Позже К. Гален прибавил ещё один признак — нарушение функции (functio laesa). Однако механизмы развития этих симптомов и других, более тонких процессов, определяющих суть воспаления, не изучены окончательно до настоящего времени.
В настоящее время большинство специалистов считает, что воспаление — возникшая в ходе эволюции сложная местная реакция организма на повреждение. Она проявляется характерными изменениями микроциркуляции и мезенхимы и на определённом этапе развития вызывает включение комплексных регулирующих систем. Значение воспаления для организма неоднозначно. Хотя защитно-приспособительный характер воспаления не вызывает сомнений, многие считают эту реакцию несовершенной, так как воспаление может привести к смерти больного. Воспаление как приспособительная реакция совершенно, прежде всего, по отношению к человеку как биологическому виду. В результате воспаления популяция приобретает новые свойства, помогающие приспособиться к условиям окружающей среды, например, сформировать врождённый и приобретённый иммунитет. Однако у конкретного человека воспалительная реакция нередко имеет черты болезни, так как его индивидуальные компенсаторные возможности по различным причинам (возраст, другие болезни, сниженная реактивность и т.п.) недостаточны. Именно эти индивидуальные особенности человека при конкретной болезни способствуют его смерти. Однако из-за особенностей отдельных пациентов сама воспалительная реакция не теряет своего совершенства. Кроме того, видовые реакции всегда преобладают над индивидуальными, так как для природы важно сохранение вида, а человек изначально смертен, поэтому его смерть не имеет существенного значения для биологического вида и природы в целом (И.В. Давыдовский). Из этого следует, что воспаление — совершенная защитно-приспособительная реакция, направленная на сохранение жизни человека.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
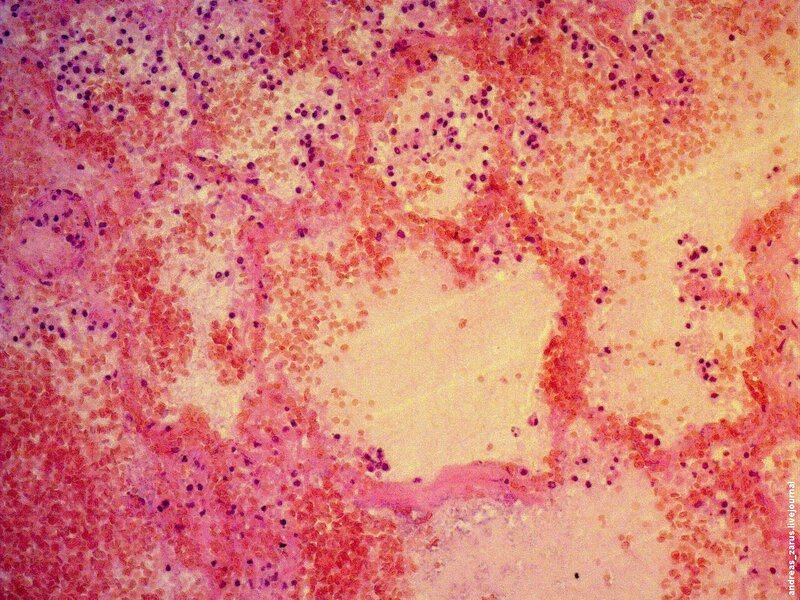

Рис 1. На микрофотограмме представлен полный инфаркт легкого. Заметны некротизированные альвеолярные перегородки, со следами резко выраженного полнокровия сосудов микроциркуляторного русла. В просветах альвеол содержатся эритроциты, макрофаги и отечная жидкость.
Источниками тромбоэмболов чаще всего являются глубокие вены нижних конечностей, особенно при наличии заболеваний вен нижних конечностей. В клинических условиях инфаркты легкого редко можно диагностировать с большой уверенностью, гораздо чаще это происходит при патологоанатомическом вскрытии. Гистологически выделяют два типа инфаркта легкого. Неполный инфаркт: обычно множественные очаги, темно красного или красно-коричневого цвета с формой, приближающейся к треугольной с вершиной, обращенной к окклюдированной артерии, а основанием к плевре и располагающиеся преимущественно в периферических отделах нижних долей.
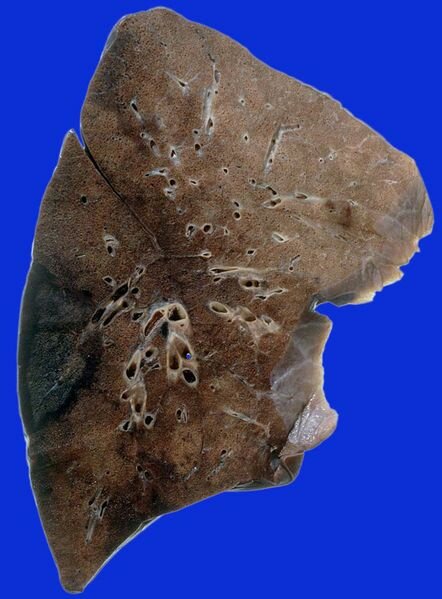

Рис 2. Инфаркт легкого представлен участком ткани буро черного цвета с формой приближающейся на разрезе к треугольной (препарат фиксирован) в просвете ветвей легочной артерии у вершины инфаркта обращенной в сторону ворот легкого заметны тромбоэмболы. Источник: alf3.urz.unibas.ch
Легочная ткань в бассейне окклюдированной артерии демонстрирует резко выраженное полнокровие капиллярного русла и внутриальвеолярные кровоизлияния. В случае неполного инфаркта содержимое альвеол эвакуируется в течение нескольких дней, и легкое возвращается к своей функции в полном объеме. При рентгенологическом исследовании грудной клетки в таких случаях выявляется преходящее инфильтративное снижение прозрачности, разрешающееся в течении 2—4 дней без формирования рубца.
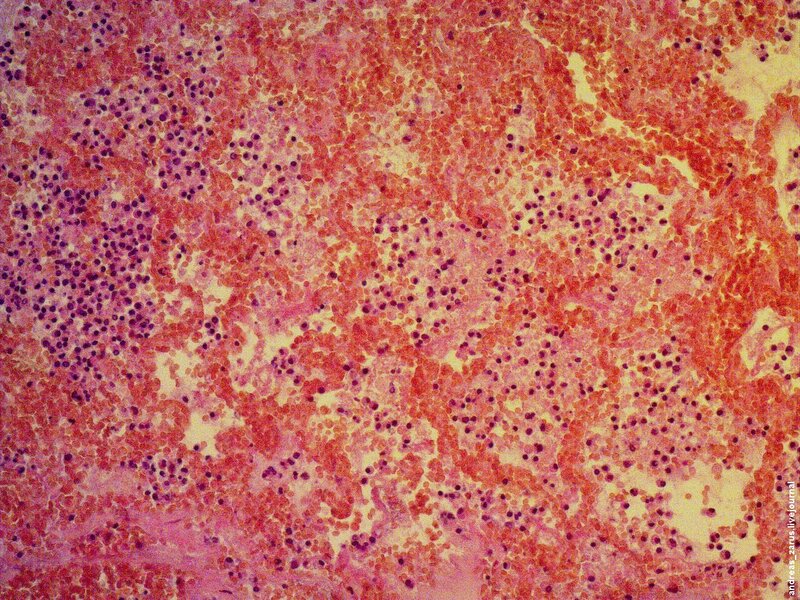

Рис 3. На микрофотограмме представлен полный инфаркт легкого. Заметны некротизированные альвеолярные перегородки, со следами резко выраженного полнокровия сосудов микроциркуляторного русла. В просветах альвеол содержатся эритроциты и макрофаги.
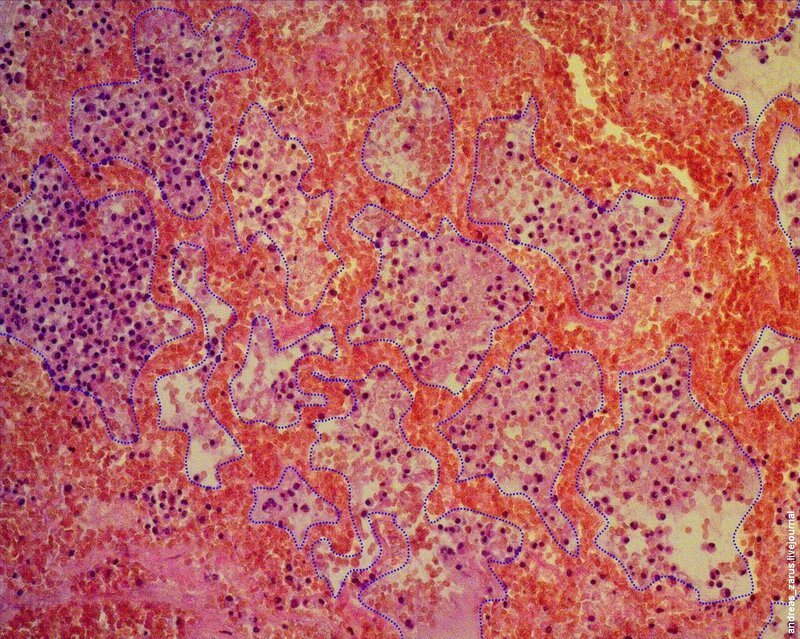

Рис 4. На микрофотограмме приблизительно прорисованы контуры просветов альвеол.
В случае полного инфаркта это обычно несколько очагов в каждом легком, часто развиваются на границах двух и более плевральных поверхностей, например в реберно-диафрагмальных углах, по переднему или заднему легочному краю, прилежащему к средостению или по краям средней доли.
Длинная ось инфаркта всегда параллельна наиболее длинной плевральной поверхности вовлеченной в процесс. Чаще всего очаги инфарктов расположены в нижних долях. Участок инфаркта макроскопически представлен плотной, тусклой темно-красной, тканью, с четкими границами, с фибринозными наложениями на плевре в участке соответствующей инфаркту, с нередко выявляющимся небольшим плевральным выпотом.
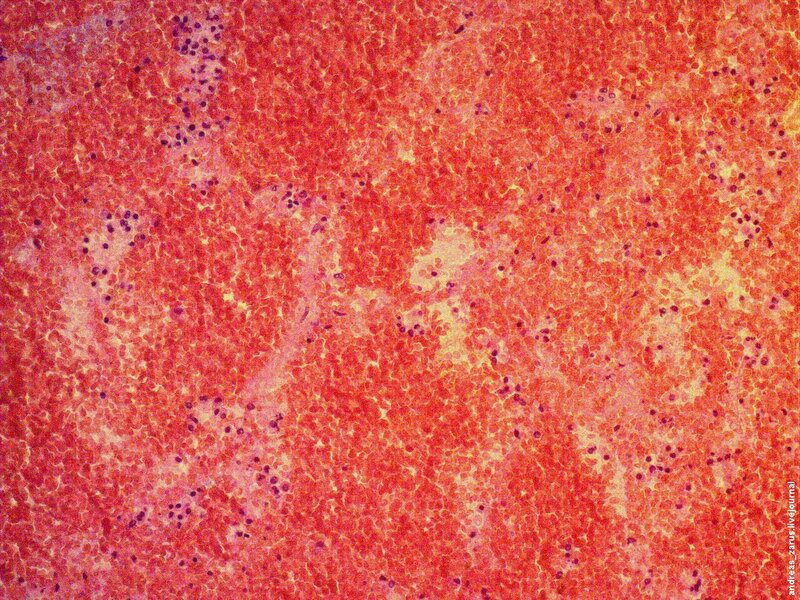

Рис 6. На микрофотограмме представлен полный инфаркт легкого. Заметны некротизированные альвеолярные перегородки. Просветы альвеол резко расширены, выполнены преимущественно эритроцитами.
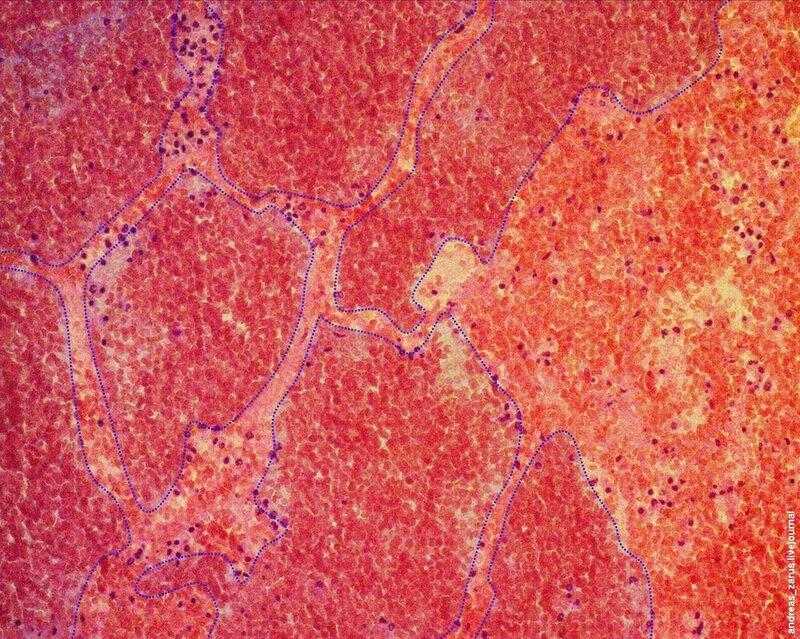

Рис 7. На микрофотограмме приблизительно прорисованы контуры просветов альвеол.
В первый и возможно второй день при гистологическом исследовании, определенных признаков разрушения альвеолярных стенок не выявляется, отмечается резко выраженное полнокровие сосудов микроциркуляторного русла и диапедез эритроцитов.
После второго дня явно выявляемый некроз альвеолярных стенок с признаками гемолиза эритроцитов находящихся в просветах альвеол, при наличии нагруженных зернами гемосидерина макрофагов.
Процессы организации обычно начинаются со второй недели, продолжительность организации зависит от размеров инфаркта и может длиться от недель, до месяцев. Грануляционная ткань появляется у границ инфаркта и постепенно продвигается вглубь инфаркта. Изредка, организующаяся ткань легкого может подвергаться распаду с образованием полости, которая может осложниться образованием бронхоплеврального свища или пневмоторакса. Тромбоэмболы могут подвергаться как полному лизису, так и организации в течении около восьми недель с образованием фиксированных к стенке артерий фиброзных полосок, с незначительным сужением просвета.
Reference:
«Thurlbeck’s Pathology of the Lung» William M. Thurlbeck,Andrew Churg.
Инфаркт
Инфаркт — очаг некроза, развившегося вследствие нарушения кровообращения.Инфаркт называют также циркуляторным, или ангиогенным некрозом.
Термин «инфаркт» (от лат. нафаршировать) был предложен Вирховым для формы некроза, при которой омертвевший участок ткани пропитывается кровью.
Размеры и морфологические особенности инфаркта определяются калибром обтурированного сосуда, наличием других нарушений кровообращения, на фоне которых он развивается.
При магистральном типе ветвления артерии инфаркт по своим очертаниям напоминает конус, узкая часть которого (вершина) обращена к воротам органа, а основание ориентировано на периферию, к зоне терминального разветвления внутриорганных артерий. Инфаркты такой формы обычно выявляют в селезенке, почке, легких.
В органах с преобладанием рассеянного типа ветвления артерии, например в головном мозгу, кишечнике, сердце, кровоснабжаемая ею территория не образует конусовидных контуров и инфаркты не имеют определенной формы.
Виды инфаркта
Зона инфаркта может занимать весь орган или большую его часть (тотальный и субтотальный инфаркт) или выявляться только под микроскопом (микроинфаркт).По макроскопическим признакам различают 3 вида инфаркта: белый, белый с геморрагическим венчиком и красный.
Белый (ишемический) инфаркт формируется при непроходимости магистрального артериального ствола и запустевании всего сосудистого русла в его бассейне вследствие недостаточного развития сосудистых анастомозов и коллатералей. Чаще всего выявляют в селезенке, иногда в головном мозгу, печени.
Зона некроза хорошо видна при макроскопическом обследовании примерно через 24 ч после нарушения кровоснабжения. Под микроскопом ткань уплотнена, бледно-желтой окраски, структура ткани неразличима, а образующие ее элементы сливаются в гомогенную массу. По периферии зона инфаркта ограничивается воспалительным демаркационным валом.
Белый инфаркт с геморрагическим венчиком выглядит как участок белесовато-желтого цвета, окруженный темно-красной зоной кровоизлияний. Такой инфаркт развивается в случаях, когда компенсаторному включению коллатералей и реактивной артериальной гиперемии сосудов периферической зоны предшествует ангиоспазм, сменяющийся паралитическим расширением.
В результате резкое полнокровие сосудов сопровождается явлениями стаза крови и диапедезными кровоизлияниями в некротизированную ткань.
Белый инфаркт с геморрагическим венчиком развивается в сердце, селезенке, иногда в почках.
Красный (геморрагический) инфаркт обычно выявляют в легких, что связано с особенностями их кровоснабжения.
Иногда геморрагический инфаркт возникает на фоне выраженной гиперемии и в других органах: кишечнике, головном мозгу, почках. При красном инфаркте зона ишемии пропитывается кровью, при обретает темно-красный цвет и четкие границы.
Этот эффект возникает, если вслед за закупоркой артерии периферические сосуды омертвевшей ткани переполняются кровью, поступившей по коллатералям. При венозном застое ретроградное поступление крови из вен в зону ишемии также ведет к пропитыванию некротизированной ткани кровью.
Геморрагический инфаркт может развиваться также в результате выраженного венозного застоя при быстром прекращении оттока крови по крупным венозным стволам или одновременном выключении из кровотока большого количества мелких вен. Венозные застойные инфаркты выявляют в селезенке при тромбозе вены, отводящей от нее кровь, в головном мозгу — при нарушении проходимости синусов твердой мозговой оболочки или яремных вен, в сердце — при обтурации венечного синуса тромботическими массами, в тканях нижних конечностей — при перевязке бедренной вены.
Микроскопически в очаге геморрагического инфаркта отмечают массы гемолизированных эритроцитов, инфильтрирующих некротизированную ткань.
Общие закономерности формирования и заживления инфаркта
Стадия ишемии и некроза
Развитию инфаркта предшествует ишемия. Первые сдвиги, обусловленные нарушением кровоснабжения, определяются угнетением тканевого дыхания, компенсаторной активацией анаэробного гликолиза, быстрым накоплением метаболитов в клетках в токсических концентрациях.Недостаточное воспроизводство энергии и гистотоксический эффект ишемии нарушают электролитный гомеостаз клеток и подавляют пластические процессы, что приводит к прогрессирующей диссоциации цитомембран, закислению внутриклеточной среды, денатурации белков, гибели и разрушению клеток.
Электронно-микроскопически при ишемизации выявляют внутриклеточный отек или, напротив, дегидратацию цитоплазматического матрикса. Органеллы клеток набухают, их мембраны подвергаются гомогенизации и фрагментации, гранулы лабильного гликогена исчезают, отмечают накопление липидов в виде капель вследствие их высвобождения из диссоциирующих фосфолипидов цитомембран и нарушения липидного обмена.
В лизосомах накапливаются продукты внутриклеточного распада.
Происходят перераспределение, конденсация либо вымывание ядерного хроматина и разрушение ядрышек, расплавление цитоплазматических рибосом и органелл немембранной структуры. Гистохимически и биохимически в ишемизированной ткани определяется снижение уровня макроэргических фосфатов, активности окислительно-восстановительных ферментов, накопление недоокисленных метаболитов, нарушение обмена электролитов, уменьшение содержания гликогена, РНК и ДНК, а со временем — накопление продуктов распада стромальных структур.
На некротической стадии инфаркта при микроскопическом исследовании ядра клеток не окрашиваются, все структурные элементы ткани сливаются в однородную массу.
Стадия репаративных изменений наступает вслед за формированием некроза.
По периферии инфаркта всегда существует зона дистрофических изменений и реактивного воспаления — так называемый демаркационный вал. Микроскопически воспалительная реакция отмечается уже через несколько часов, а максимум ее развития приходится на 3-и–5-е сутки.
Воспаление в зоне демаркационного вала сопровождается выходом форменных элементов крови из капилляров. Некротические массы постепенно частично расплавляются под действием протеолитических ферментов, выходящих из нейтрофильных лейкоцитов, частично подвергаются фагоцитозу или резорбируются лимфатической сетью и выводятся по ее сосудам.
Организация зоны некроза — замещение некротических масс соединительной тканью, которая врастает со стороны демаркационного вала и к 7–10-м суткам трансформируется в грануляционную (юную) соединительную ткань, а со временем созревает в рубцовую.
Особенности развития инфаркта в различных органах
Морфология инфаркта во многом зависит от органной архитектоники сосудистой системы
В клинической практике наиболее часто отмечают инфаркт сердца (миокарда), головного мозга, кишечника, легких, почек и селезенки.Время, необходимое для развития инфаркта в различных органах, неодинаково и зависит от функциональных энергозатрат и филогенетически сложившегося метаболизма, что определяет потребность ткани в обеспечении кислородом.
Для развития ИМ достаточно полного прекращения его кровоснабжения на 20–25 мин, однако ишемия длительностью 5 мин уже ведет к гибели отдельных мышечных клеток.
В реальной жизни формирование инфаркта сердечной мышцы требует несколько большего промежутка времени, так как в зоне ишемии всегда частично сохраняется кровоток по сосудистым анастомозам и коллатералям. Он недостаточен для того, чтобы полностью предотвратить некроз, но несколько увеличивает срок его развития и ограничивает размеры.
Инфаркт обычно локализуется в ЛЖ, чаще всего в передней стенке.
По типу это белый инфаркт с геморрагическим венчиком, имеющий неправильную форму.
В зависимости от объема и локализации пораженной ткани миокарда различают мелко- и крупноочаговый, субэпикардиальный, интрамуральный, субэндокардиальный и трансмуральный ИМ, охватывающий все слои сердечной стенки.
В зоне перехода инфаркта на эпикард или эндокард развивается реактивное вос паление, в первом случае приводящее к фиброзному перикардиту (выпот в полость перикарда плазмы крови, обогащенной фибрином, и образование фиб ринозных наслоений на эпикарде), во втором — к тромбоэндокардиту (пристеночный тромбоз соответственно зоне инфаркта).
Формирование ИМ начинается с ишемической стадии.
Наряду с прогрессирующим нарушением метаболизма и дезинтеграцией клеточных мембран отмечают фрагментацию, растяжение и дезинтеграцию миофибрилл кардиомиоцитов. В результате снижается активность внутриклеточных энзимов, изменяется характер окрашивания клеток при использовании основных или кислотных гистологических красителей, нарушается способность клеток к лучепреломлению в поляризованном свете и люминесцентно-микроскопические свойства.
Эти явления используются для ранней диагностики метаболических и ишемических повреждений сердца. Гистологические признаки гибели клеток — сморщивание, набухание и разрушение клеточного ядра, исчезновение продольной и поперечной исчерченности, гомогенизирование саркоплазмы выявляют через 12 ч (рис. 2.1).

Рис. 2.1. Острый ИМ
Параллельно с деструктивными изменениями рабочих клеток миокарда происходит сосудистотканевая реакция, характеризующаяся спазмированием и паретической дилатацией интрамуральных артерий и артериол, плазматическим пропитыванием и повышением проницаемости их стенок, а также нарушением микроциркуляции с внутрисосудистой агрегацией эритроцитов, отеком интерстиция.При развитии некроза кровоток в некротической зоне прекращается, а в периинфарктной увеличивается.
Наряду с диапедезными кровоизлияниями в ней происходит экстравазация лейкоцитов и формируется лейкоцитарный вал.
В толще некротической зоны вокруг сохранившихся сосудов иногда выявляют островки жизнеспособной ткани, по периферии которых отмечают такие же явления, как и в окружающей инфаркт зоне.
В течение первых 18–24 ч от начала патологического процесса миокард в бассейне пораженной артерии отличается бледностью на фоне подчеркнуто неравномерного кровенаполнения остальной ткани.
В конце 1-х суток участок некроза становится различимым макроскопически.
В связи с непрерывной деятельностью сердца, высокой активностью ферментов, выделяющихся из лейкоцитов, на 3-и–5-е сутки начинается размягчение (миомаляция) погибшей ткани. Постепенное рассасывание (резорбция) некротизированной массы осуществляется при активном участии микрофагальных клеток, которые появляются на 4-й день кнаружи от лейкоцитарного вала.
Фибропластическая реакция интерстиция также возникает на 4–5-е сутки, а первые волокнистые элементы новообразованной соединительной ткани в зоне инфаркта появляются еще через 3 сут.
В течение последующей недели зона некроза представлена распадающимися мышечными волокнами, пропитана отечной жидкостью и инфильтрирована распадающимися лейкоцитами. По ее периферии и вокруг периваскулярных островков сохранившегося миокарда происходит новообразование соединительной ткани.
Процесс организации продолжается 2–2,5 мес. В дальнейшем соединительная ткань, образовавшаяся на месте некротических масс, уплотняется, ее сосуды запустевают и облитерируются, на месте некроза образуется рубец (рис. 2.2).

Рис. 2.2. Постинфарктный кардиосклероз
Проводящая система сердца более устойчива к гипоксии по сравнению с рабочим миокардом и способна дольше сохраняться в зонах ишемии, что важно для восстановления ритмичной работы сердца после экстренной инвазивной антиишемической терапии.В почках обычно развивается белый инфаркт с геморрагическим венчиком.
Вследствие хорошего развития сосудистых анастомозов и коллатералей инфаркт возникает только при нарушениях проходимости сосудов больше го калибра, чем дольковая артерия. Характерное расположение инфаркта — передняя латеральная поверхность органа, так как в этой зоне почечные артерии ветвятся не по магистральному, а по рассеянному типу, при котором межсосудистые коллатерали выражены значительно слабее.
Обычно инфаркт почки напоминает по форме конус, обращенный основанием к капсуле, верхушкой к почечной лоханке.
Однако иногда процесс ограничивается только корой, не затрагивая пирамидки, и поражение приближается по форме к квадрату.
Инфаркт почки часто сопровождается гематурией вследствие попадания крови в мочевые канальцы при разрыве мелких сосудов. Ишемическая стадия инфаркта почек развивается по общим закономерностям.
Некроз всех структур почечной паренхимы наступает через 24 ч, однако повреждение эпителия почечных канальцев возникает значительно раньше.
Так, уже через 6 ч отмечается гибель эпителия извитых, а через 12 ч — прямых канальцев нефрона.
К этому же времени по периферии инфаркта развивается реактивное воспаление, достигающее своего максимума примерно к 3-му дню процесса.
Формирование демаркационной зоны сопровождается нарушениями кровотока в микрососудах, явлениями отека, плазморрагиями и диапедезными кровоизлияния ми, активной миграцией лейкоцитов. Это приводит спустя сутки к образованию периферической геморрагической зоны инфаркта и лейкоцитарного вала.
Примерно с этого же времени появляются макрофаги и начинается процесс резорбции некротических масс.
На 7-е сутки деструктивнорезорбтивные процессы сочетаются с отчетливо выраженными явлениями организации, которая через несколько недель завершается образованием плотного соединительно-тканного рубца, реже — кисты.
В селезенке обычный морфологический тип инфаркта — белый (ишемический).
В условиях выраженного венозного застоя инфаркт селезенки может быть геморрагическим, приобретающим в течение нескольких суток серую или белую окраску. Ишемический инфаркт селезенки конической формы, бледно-желтой окраски. На поверхности капсулы органа в области широкой части этого конуса, а также на границе зоны инфаркта развиваются реактивное воспаление, процессы лизиса, резорбции и организации некротических масс.
Непосредственно в зоне некроза вначале разрушается красная пульпа, затем фолликулы и трабекулы.
Организация инфаркта осуществляется по общим закономерностям. Созревание постинфарктного рубца сопровождается де формированием селезенки.
Инфаркт головного мозга в 85–90% случаев является белым, в остальных — красным или смешанного характера.
Белый инфаркт может поражать любые отделы мозга. Первоначально это нечетко отграниченный участок дряблой или крошащейся консистенции, красновато-серого цвета, со стертым естественным рисунком базальных узлов или коры головного мозга.
Геморрагические инфаркты в виде небольших очагов красного цвета локализуются преимущественно в пределах скоплений серого вещества, чаще всего в коре. Смешанные инфаркты состоят из белых и красных участков, причем последние располагаются в сером веществе.
Топография различных морфологических типов инфарктов мозга предопределена особенностями кровоснабжения его различных областей.
Наиболее часто они возни кают в бассейне средней мозговой артерии, реже — позвоночных и базиллярных артерий.
Геморрагические инфаркты формируются в хорошо васкуляризированных зонах — скоплениях серого вещества или в коре головного мозга.
Развитие инфаркта головного мозга включает ишемическую и некротическую стадии.
Ишемическая стадия характеризуется дистрофическими изменениями нервной ткани, кровоизлияниями и деструкцией клеточных мембран с необратимой дезорганизацией обменных процессов и электролитного гомеостаза нервных клеток. При микроскопическом исследовании отмечают лизис глыбок базофильного вещества, просветление цитоплазмы, гиперхроматоз и деформацию ядра.
В результате нервные клетки и их ядра приобретают угловатую форму, а цитоплазма гомогенизируется, утрачивает базофильные включения и просветляется. Нарушение циркуляции крови в микрососудах сочетается с перицеллюлярным отеком — появлением светлого промежутка между капиллярной стенкой или телом нейрона и окружающей тканью.
Вокруг капилляров отмечают отек и набухание отростков окружающих их глиальных клеток.
Некротическая стадия инфаркта — стадия нарастающего аутолиза ишемизированной ткани мозга. Гибели нейронов предшествует их резкое просветление либо уплотнение и превращение в пикноморфные (уплотненные дегидратированные) клетки, а затем и в гомогенную бесструктурную массу.
Вместе с нейроцитами в деструктивные изменения вовлекаются и клетки глии.
Из мелких сосудов происходят диапедезные кровоизлияния, небольшие и единичные в очагах белого инфаркта, множественные и сливающиеся между собой при геморрагическом инфаркте.
К началу 2-х суток начинается резорбция некротизированной нервной ткани.
На границе с очагом ишемического поражения скапливаются лейкоциты.
Вместе с ними в зону некроза внедряются многочисленные активированные астроциты и появляются зернистые шары с липидными включениями. Часть астроцитов утрачивает цитоплазматические отростки, в их цитоплазме выявляют многочисленные фибриллы, приобретающие способность к образованию волокнистых структур.
Вокруг очага некроза начинается новообразование сосудов, капилляров и сосудистых петель.
В организации некротических масс участвуют как глиальные, так и соединительнотканные клетки — фибробласты.
Однако в конечной стадии процесса при небольших размерах инфаркта продукты мезодермальной пролиферации полностью вытесняются глиоволокнистыми структурами, образующими рубец. В крупных очагах срединная зона организовавшегося инфаркта остается соединительнотканной, а в центре сформировавшегося рубца образуется одна или несколько полостей, снаружи окруженных разрастаниями глии.
Инфаркт легких, как правило, имеет геморрагический характер, причиной чего являются двойное кровоснабжение легких и венозный застой.
Кровь попадает в легкие как по бронхиальным артериям, входящим в систему большого круга кровообращения, так и по артериям малого круга кровообращения. Между ЛА и бронхиальными артериями существуют многочисленные анастомозы, которые имеют строение артерий замыкающего типа и в обычных условиях не функционируют.
При обтурации достаточно крупной ветви ЛА в ее бассейн под большим давлением устремляется кровь из бронхиальных артерий по рефлекторно открывшимся анастомозам.
Переполняющиеся кровью легочные капилляры резко дилатируются, их стенки разрываются, кровьизливается в интерстиций альвеолярных перегородок и в полости альвеол, имбибируя соответствующий учас ток ткани. Благодаря автономному артериальному кровоснабжению бронхи в зоне инфаркта сохраняют жизнеспособность.
Нередко геморрагический инфаркт в легком развивается на фоне хронической венозной гиперемии, так как повышение давления в крупных венах способствует ретроградному поступлению крови в зону инфаркта. Инфаркт чаще всего развивается в периферических зонах средних и мелких отделов легких. При этом макроскопически выявляют очаги более плотной консистенции, чем окружающая ткань, конусовидной формы, основанием обращенные к плевре, которая покрывается фибринозным налетом и гиперемируется вследствие реактивного воспаления.
На разрезе некротизированная ткань темно-красного цвета, слегка зернистая, выбухает над поверхностью. В 1-е сутки в зоне инфаркта микроскопически определяются отек и кровоизлияния в виде скоплений частично гемолизированных эритроцитов в интерстициальной ткани, в просветах альвеол и мелких бронхов, что сопровождается кровохар каньем.
Затем присоединяются признаки некроза стенок альвеол, накапливаются сидерофаги. На 3-и–4-е сутки инфаркт представляет собой гомогенизированную массу из разрушившихся эритроцитов, на фоне которых видны следы некротизированных альвеолярных перегородок.
Расплавление некротизированной ткани и излившейся крови, их резорбция и организация начинаются с периферии и из сохранившихся периваскулярных и перибронхиальных зон.
Через 2–8 мес на месте инфаркта остается рубец или киста.
Белый инфаркт в легком выявляют редко.
Возникает при нарушении кровотока в бронхиальных артериях на фоне затруднения капиллярного кровотока, например вследствие сдавления внутриальвеолярным экссудатом или при уплотнении (гепатизации) легочной ткани, обусловленного пневмонией. В кишечнике инфаркт развивается по типу геморрагического.
Наиболее характерная локализация — бассейн верхней брыжеечной артерии, которая в связи с большой протяженностью чаще подвергается обструкции. Макроскопически инфаркт кишки имеет вид темно-красного участка, который достаточно ясно отграничен от непораженного кишечника.
Серозная оболочка в области инфаркта кишки становится тусклой, на ней появляются фибринозные наложения.
Стенка кишки утолщена, слизистая оболочка синюшная.
Некротические и реактивные изменения в ишемизированном сегменте кишечника развиваются быстро.
Через 15–20 мин после прекращения кровоснабжения в его стенке выявляют выраженные микроциркуляторные нарушения: тотальный отек ткани, замедление и прекращение движения крови в резко полнокровных капиллярах и венулах, множественные кровоизлияния.
Через 30 мин в отечной строме слизистой оболочки кишки появляются лейкоциты, лимфоциты, развивается макрофагальная реакция.
В течение 1–1,5 ч стенка кишки подвергается некрозу, который начинается с изъязвления ее слизистой оболочки. В сетчатке глаза инфаркт имеет характер белого, который в условиях венозного застоя трансформируется в геморрагический. Участок пораженной ткани в виде конуса обращен вершиной к зрительному диску, обычно локализуется в височном сегменте. Микроскопически выявляют деструкцию внутренних слоев сетчатки, ганглиозных клеток и нервных волокон на фоне нарушения микроциркуляции, отека и кровоизлияний.
Очень редко отмечают инфаркты в печени, мышцах, костях. Последствия инфаркта чрезвычайно существенны для организма.
Так, поражение при ИМ >30% ткани ЛЖ сопровождается развитием ОСН с остановкой сердца.
Повреждение проводящей системы сердца при формировании некроза влечет тяжелые нарушения ритма.
При обширном трансмуральном инфаркте иногда происходит взбухание некротизированного участка сердечной стенки и его истончение — развивается острая аневризма сердца. В некоторых случаях десинхронизация процессов миомаляции, резорбции некротических масс и организации зоны инфаркта приводит к разрыву аневризмы, заполнению полости перикарда кровью с летальным исходом.
В результате ИМ могут возникать разрывы межжелудочковой перегородки, отрыв папиллярных мышц, что также ведет к серьезным последствиям.
В более отдаленные сроки обширная рубцовая зона, изменяя геометрию сокращения сердца и внутрисердечную гемодинамику, способствует развитию ХСН и общей венозной гиперемии.
Инфаркт головного мозга сопровождается его отеком, расстройством микроциркуляции и метаболическими нарушениями как в непосредственной близости от очага поражения, так и в отдаленных участках.
Исход инфаркта определяется его размерами, локализацией и темпами развития патологического процесса.
Смерть таких больных может быть обусловлена как самим очагом поражения в головном мозгу, так и причинами, непосредственно с ним не связанными.
Нередко при медленном формировании инфаркта больные погибают не от деструктивных изменений, затрагивающих жизненно важные центры головного мозга, а вследствие СН, пневмонии и другой присоединившейся патологии, осложнившей течение инфаркта.
Серьезным осложнением инфаркта головного мозга является кровоизлияние в размягченную ткань.
Как и отек мозга, так и увеличение его объема вследствие восстановления кровотока по сосудам в зоне ишемии могут вызывать дислокацию и ущемление ствола мозга.
При благоприятном исходе на месте инфаркта формируется рубец или киста с более или менее значительными нарушениями функции ЦНС.
Инфаркт кишечника требует обязательного хирургического вмешательства, так как конечной фазой его развития является гангрена с прободением кишечной стенки.
Попадание содержимого кишечника в брюшную полость влечет за собой развитие перитонита. Причиной перитонита может стать также инфаркт селезенки, обычно заканчивающийся формированием грубого рубца, деформирующего орган. Инфаркт легкого обычно не несет непосредственной угрозы жизни больному.
Однако его течение может осложниться пост инфарктной пневмонией, нагноением и распространением воспалительного процесса на плевру с развитием пневмоторакса и гангрены легкого. Одной из наиболее характерных причин нагноения инфаркта является попадание в сосуд гнойного эмбола.
Это вызывает гнойное расплавление ткани легкого и образование абсцесса на месте инфаркта.
При инфаркте почек, обычно заживающем посредством рубцевания соответствующего участка, угрожающие жизни осложнения возникают при нагноении либо при обширных поражениях, особенно при симметричных некрозах коркового слоя, следствием которых может быть ОПН.
А.С. Гавриш «Нарушение кровообращения»
Опубликовал Константин Моканов
Красный и белый инфаркт — My Life
Общие закономерности формирования и заживления инфаркта
Развитию инфаркта предшествует ишемия. Первые сдвиги, обусловленные нарушением кровоснабжения, определяются угнетением тканевого дыхания, компенсаторной активацией анаэробного гликолиза, быстрым накоплением метаболитов в клетках в токсических концентрациях.
Недостаточное воспроизводство энергии и гистотоксический эффект ишемии нарушают электролитный гомеостаз клеток и подавляют пластические процессы, что приводит к прогрессирующей диссоциации цитомембран, закислению внутриклеточной среды, денатурации белков, гибели и разрушению клеток.
Электронно-микроскопически при ишемизации выявляют внутриклеточный отек или, напротив, дегидратацию цитоплазматического матрикса. Органеллы клеток набухают, их мембраны подвергаются гомогенизации и фрагментации, гранулы лабильного гликогена исчезают, отмечают накопление липидов в виде капель вследствие их высвобождения из диссоциирующих фосфолипидов цитомембран и нарушения липидного обмена.
В лизосомах накапливаются продукты внутриклеточного распада.
Происходят перераспределение, конденсация либо вымывание ядерного хроматина и разрушение ядрышек, расплавление цитоплазматических рибосом и органелл немембранной структуры. Гистохимически и биохимически в ишемизированной ткани определяется снижение уровня макроэргических фосфатов, активности окислительно-восстановительных ферментов, накопление недоокисленных метаболитов, нарушение обмена электролитов, уменьшение содержания гликогена, РНК и ДНК, а со временем — накопление продуктов распада стромальных структур.
На некротической стадии инфаркта при микроскопическом исследовании ядра клеток не окрашиваются, все структурные элементы ткани сливаются в однородную массу.
Стадия репаративных изменений наступает вслед за формированием некроза.
По периферии инфаркта всегда существует зона дистрофических изменений и реактивного воспаления — так называемый демаркационный вал. Микроскопически воспалительная реакция отмечается уже через несколько часов, а максимум ее развития приходится на 3-и–5-е сутки.
Воспаление в зоне демаркационного вала сопровождается выходом форменных элементов крови из капилляров. Некротические массы постепенно частично расплавляются под действием протеолитических ферментов, выходящих из нейтрофильных лейкоцитов, частично подвергаются фагоцитозу или резорбируются лимфатической сетью и выводятся по ее сосудам.
Организация зоны некроза — замещение некротических масс соединительной тканью, которая врастает со стороны демаркационного вала и к 7–10-м суткам трансформируется в грануляционную (юную) соединительную ткань, а со временем созревает в рубцовую.
Особенности развития инфаркта в различных органах
В клинической практике наиболее часто отмечают инфаркт сердца (миокарда), головного мозга, кишечника, легких, почек и селезенки.
Время, необходимое для развития инфаркта в различных органах, неодинаково и зависит от функциональных энергозатрат и филогенетически сложившегося метаболизма, что определяет потребность ткани в обеспечении кислородом.
Для развития ИМ достаточно полного прекращения его кровоснабжения на 20–25 мин, однако ишемия длительностью 5 мин уже ведет к гибели отдельных мышечных клеток.
В реальной жизни формирование инфаркта сердечной мышцы требует несколько большего промежутка времени, так как в зоне ишемии всегда частично сохраняется кровоток по сосудистым анастомозам и коллатералям. Он недостаточен для того, чтобы полностью предотвратить некроз, но несколько увеличивает срок его развития и ограничивает размеры.
Инфаркт обычно локализуется в ЛЖ, чаще всего в передней стенке.
По типу это белый инфаркт с геморрагическим венчиком, имеющий неправильную форму.
В зависимости от объема и локализации пораженной ткани миокарда различают мелко- и крупноочаговый, субэпикардиальный, интрамуральный, субэндокардиальный и трансмуральный ИМ, охватывающий все слои сердечной стенки.
В зоне перехода инфаркта на эпикард или эндокард развивается реактивное вос паление, в первом случае приводящее к фиброзному перикардиту (выпот в полость перикарда плазмы крови, обогащенной фибрином, и образование фиб ринозных наслоений на эпикарде), во втором — к тромбоэндокардиту (пристеночный тромбоз соответственно зоне инфаркта).
Формирование ИМ начинается с ишемической стадии.
Наряду с прогрессирующим нарушением метаболизма и дезинтеграцией клеточных мембран отмечают фрагментацию, растяжение и дезинтеграцию миофибрилл кардиомиоцитов. В результате снижается активность внутриклеточных энзимов, изменяется характер окрашивания клеток при использовании основных или кислотных гистологических красителей, нарушается способность клеток к лучепреломлению в поляризованном свете и люминесцентно-микроскопические свойства.
Эти явления используются для ранней диагностики метаболических и ишемических повреждений сердца. Гистологические признаки гибели клеток — сморщивание, набухание и разрушение клеточного ядра, исчезновение продольной и поперечной исчерченности, гомогенизирование саркоплазмы выявляют через 12 ч (рис. 2.1).
Рис. 2.1. Острый ИМ
Параллельно с деструктивными изменениями рабочих клеток миокарда происходит сосудистотканевая реакция, характеризующаяся спазмированием и паретической дилатацией интрамуральных артерий и артериол, плазматическим пропитыванием и повышением проницаемости их стенок, а также нарушением микроциркуляции с внутрисосудистой агрегацией эритроцитов, отеком интерстиция.
При развитии некроза кровоток в некротической зоне прекращается, а в периинфарктной увеличивается.
Наряду с диапедезными кровоизлияниями в ней происходит экстравазация лейкоцитов и формируется лейкоцитарный вал.
В толще некротической зоны вокруг сохранившихся сосудов иногда выявляют островки жизнеспособной ткани, по периферии которых отмечают такие же явления, как и в окружающей инфаркт зоне.
В течение первых 18–24 ч от начала патологического процесса миокард в бассейне пораженной артерии отличается бледностью на фоне подчеркнуто неравномерного кровенаполнения остальной ткани.
В конце 1-х суток участок некроза становится различимым макроскопически.
В связи с непрерывной деятельностью сердца, высокой активностью ферментов, выделяющихся из лейкоцитов, на 3-и–5-е сутки начинается размягчение (миомаляция) погибшей ткани. Постепенное рассасывание (резорбция) некротизированной массы осуществляется при активном участии микрофагальных клеток, которые появляются на 4-й день кнаружи от лейкоцитарного вала.
Фибропластическая реакция интерстиция также возникает на 4–5-е сутки, а первые волокнистые элементы новообразованной соединительной ткани в зоне инфаркта появляются еще через 3 сут.
В течение последующей недели зона некроза представлена распадающимися мышечными волокнами, пропитана отечной жидкостью и инфильтрирована распадающимися лейкоцитами. По ее периферии и вокруг периваскулярных островков сохранившегося миокарда происходит новообразование соединительной ткани.
Процесс организации продолжается 2–2,5 мес. В дальнейшем соединительная ткань, образовавшаяся на месте некротических масс, уплотняется, ее сосуды запустевают и облитерируются, на месте некроза образуется рубец (рис. 2.2).
Рис. 2.2. Постинфарктный кардиосклероз
Проводящая система сердца более устойчива к гипоксии по сравнению с рабочим миокардом и способна дольше сохраняться в зонах ишемии, что важно для восстановления ритмичной работы сердца после экстренной инвазивной антиишемической терапии.
В почках обычно развивается белый инфаркт с геморрагическим венчиком.
Вследствие хорошего развития сосудистых анастомозов и коллатералей инфаркт возникает только при нарушениях проходимости сосудов больше го калибра, чем дольковая артерия. Характерное расположение инфаркта — передняя латеральная поверхность органа, так как в этой зоне почечные артерии ветвятся не по магистральному, а по рассеянному типу, при котором межсосудистые коллатерали выражены значительно слабее.
Обычно инфаркт почки напоминает по форме конус, обращенный основанием к капсуле, верхушкой к почечной лоханке.
Однако иногда процесс ограничивается только корой, не затрагивая пирамидки, и поражение приближается по форме к квадрату.
Инфаркт почки часто сопровождается гематурией вследствие попадания крови в мочевые канальцы при разрыве мелких сосудов. Ишемическая стадия инфаркта почек развивается по общим закономерностям.
Некроз всех структур почечной паренхимы наступает через 24 ч, однако повреждение эпителия почечных канальцев возникает значительно раньше.
Так, уже через 6 ч отмечается гибель эпителия извитых, а через 12 ч — прямых канальцев нефрона.
К этому же времени по периферии инфаркта развивается реактивное воспаление, достигающее своего максимума примерно к 3-му дню процесса.
Формирование демаркационной зоны сопровождается нарушениями кровотока в микрососудах, явлениями отека, плазморрагиями и диапедезными кровоизлияния ми, активной миграцией лейкоцитов. Это приводит спустя сутки к образованию периферической геморрагической зоны инфаркта и лейкоцитарного вала.
Примерно с этого же времени появляются макрофаги и начинается процесс резорбции некротических масс.
На 7-е сутки деструктивнорезорбтивные процессы сочетаются с отчетливо выраженными явлениями организации, которая через несколько недель завершается образованием плотного соединительно-тканного рубца, реже — кисты.
В селезенке обычный морфологический тип инфаркта — белый (ишемический).
В условиях выраженного венозного застоя инфаркт селезенки может быть геморрагическим, приобретающим в течение нескольких суток серую или белую окраску. Ишемический инфаркт селезенки конической формы, бледно-желтой окраски. На поверхности капсулы органа в области широкой части этого конуса, а также на границе зоны инфаркта развиваются реактивное воспаление, процессы лизиса, резорбции и организации некротических масс.
Непосредственно в зоне некроза вначале разрушается красная пульпа, затем фолликулы и трабекулы.
Организация инфаркта осуществляется по общим закономерностям. Созревание постинфарктного рубца сопровождается де формированием селезенки.
Инфаркт головного мозга в 85–90% случаев является белым, в остальных — красным или смешанного характера.
Белый инфаркт может поражать любые отделы мозга. Первоначально это нечетко отграниченный участок дряблой или крошащейся консистенции, красновато-серого цвета, со стертым естественным рисунком базальных узлов или коры головного мозга.
Геморрагические инфаркты в виде небольших очагов красного цвета локализуются преимущественно в пределах скоплений серого вещества, чаще всего в коре. Смешанные инфаркты состоят из белых и красных участков, причем последние располагаются в сером веществе.
Топография различных морфологических типов инфарктов мозга предопределена особенностями кровоснабжения его различных областей.
Наиболее часто они возни кают в бассейне средней мозговой артерии, реже — позвоночных и базиллярных артерий.
Геморрагические инфаркты формируются в хорошо васкуляризированных зонах — скоплениях серого вещества или в коре головного мозга.
Развитие инфаркта головного мозга включает ишемическую и некротическую стадии.
Ишемическая стадия характеризуется дистрофическими изменениями нервной ткани, кровоизлияниями и деструкцией клеточных мембран с необратимой дезорганизацией обменных процессов и электролитного гомеостаза нервных клеток. При микроскопическом исследовании отмечают лизис глыбок базофильного вещества, просветление цитоплазмы, гиперхроматоз и деформацию ядра.
В результате нервные клетки и их ядра приобретают угловатую форму, а цитоплазма гомогенизируется, утрачивает базофильные включения и просветляется. Нарушение циркуляции крови в микрососудах сочетается с перицеллюлярным отеком — появлением светлого промежутка между капиллярной стенкой или телом нейрона и окружающей тканью.
Вокруг капилляров отмечают отек и набухание отростков окружающих их глиальных клеток.
Некротическая стадия инфаркта — стадия нарастающего аутолиза ишемизированной ткани мозга. Гибели нейронов предшествует их резкое просветление либо уплотнение и превращение в пикноморфные (уплотненные дегидратированные) клетки, а затем и в гомогенную бесструктурную массу.
Вместе с нейроцитами в деструктивные изменения вовлекаются и клетки глии.
Из мелких сосудов происходят диапедезные кровоизлияния, небольшие и единичные в очагах белого инфаркта, множественные и сливающиеся между собой при геморрагическом инфаркте.
К началу 2-х суток начинается резорбция некротизированной нервной ткани.
На границе с очагом ишемического поражения скапливаются лейкоциты.
Вместе с ними в зону некроза внедряются многочисленные активированные астроциты и появляются зернистые шары с липидными включениями. Часть астроцитов утрачивает цитоплазматические отростки, в их цитоплазме выявляют многочисленные фибриллы, приобретающие способность к образованию волокнистых структур.
Инфаркт миокарда — причины, симптомы, диагностика и лечение

Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
Инфаркт миокарда
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
- крупноочаговый
- мелкоочаговый
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный — с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный — с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» — с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
- осложненный
- неосложненный
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные — с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
В этот период может развиться острая левожелудочковая недостаточность (сердечная астма, отек легких).
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Осложнения инфаркта миокарда
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца — кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина — белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина — тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики — операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
