Биохимия крови 2. Особенности обмена в эритроцитах и лейкоцитах
Эритроциты(erythrosytus) это форменные элементы крови, они образуются в костном мозге, циркулируют в крови около 120 дней, а потом разрушаются макрофагами в печени, селезёнке и костном мозге.В сутки обновляется 1% эритроцитов, т.е. в течение одной секунды в кровоток поступает около 2 млн. эритроцитов.
Организм взрослого человека содержит около 25*1012эритроцитов. Концентрация эритроцитов у мужчины составляет 3,9*1012— 5,5*1012/л, у женщины — 3,7*1012— 4,9*1012/л. Более высокое содержание эритроцитов у мужчин обусловлено стимулирующим эритропоэз влиянием андрогенов. Женские половые гормоны, наоборот тормозят эритропоэз.
ФункциИ эритроцитов
Основными функциями эритроцитов, которые
реализуются с участием гемоглобина,
являются транспорт от легких к тканям
О
Кроме того эритроциты адсорбируют и транспортируют на своей клеточной мембране аминокислоты, антитела, токсины, лекарственных веществ и другие вещества.
Строение эритроцитов
Эритроциты у человека и млекопитающих в токе крови обычно (80%) имеют форму двояковогнутых дисков и называются дискоцитами. Такая формаэритроцитов создаёт наибольшую площадь поверхности по отношению к объёму, что обеспечивает максимальный газообмен, а такжеобеспечивает большую пластичность при прохождении эритроцитами мелких капилляров.
Диаметр эритроцитов у человека колеблется от 7,1 до 7,9 мкм, толщина эритроцитов в краевой зоне — 1,9 — 2,5 мкм, в центре — 1 мкм. В нормальной крови указанные размеры имеют 75% всех эритроцитов — нормоциты; большие размеры (свыше 8,0 мкм) — 12,5 % —макроциты. У остальных эритроцитов диаметр может быть 6 мкм и меньше — микроциты.
Поверхность отдельного эритроцита у человека приблизительно равна 125 мкм2, а объём (MCV) – 75-96 мкм3.
Эритроциты человека и млекопитающих представляют собой безъядерные клетки, утратившие в процессе фило- и онтогенеза ядро и большинство органелл, они имеют только цитоплазму и плазмолемму (клеточную мембрану), толщиной около 20 нм.
Химический состав эритроцитов
1. Плазмолемма эритроцитов
Плазмолемма эритроцитов состоит из примерно равного количества липидов и белков, а также небольшого количества углеводов.
Липиды
Бислой плазмолеммы образован глицерофосфолипидами, сфингофосфолипидами, гликолипидами и холестерином. Внешний слой содержит много фосфатидилхолина, сфингомиелина и около 5% (от общего количества липидов) гликолипидов, внутренний — много фосфатидилсерина и фосфатидилэтаноламина.
Белки
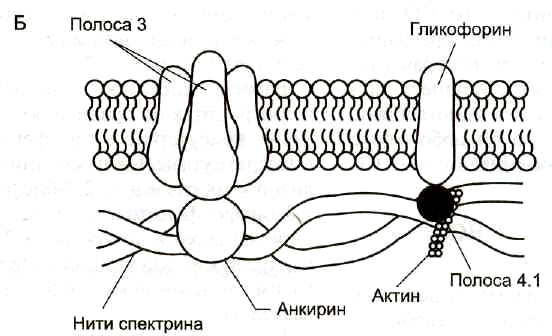
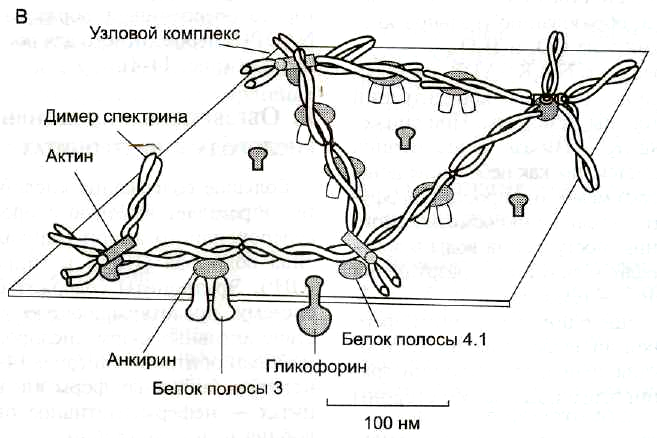
Самыми распространенными белками плазмолеммы (более 60% всех мембранных белков) являются спектрин, гликофорин и белок полосы 3.
Спектрин— основной белок цитоскелета эритроцитов (составляет 25% массы всех мембранных и примембранных белков), имеет вид фибриллы 100 нм, состоящей из двух антипаралельно перекрученных друг с другом цепей α-спектрина (240 кДа) и β-спектрина (220 кДа). Молекулы спектрина образуют сеть, которая фиксируется на цитоплазматической стороне плазмалеммы с помощью анкирина и белка полосы 3 или актина, белка полосы 4.1 и гликофорина.
Белок полосы 3— трансмембранный гликопротеид (100 кДа), его полипептидная цепь которого много раз пересекает бислой липидов. Белок полосы 3 является компонентом цитоскелета и анионным каналом, который обеспечивает трансмембранный антипорт для ионов НСО3—и Сl—.
Гликофорин— трансмембранный гликопротеин (30 кДа), который пронизывает плазмолемму в виде одиночной спирали. С наружной поверхности эритроцита к нему присоединены 20 цепей олигосахаридов, которые несут отрицательные заряды. Гликофорины формируют цитоскелет и, через олигосахариды, выполняют рецепторные функции.
Na+,K+
Са2+-АТФ-аза— мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны.
Углеводы
Олигосахариды (сиаловая кислота и антигенные олигосахариды) гликолипидов и гликопротеидов, расположенные на наружной поверхности плазмолеммы, образуют гликокаликс.
Олигосахариды гликофорина определяют антигенные свойства эритроцитов. Они являются агглютиногенами (А и В) и обеспечивают агглютинацию (склеивание) эритроцитов под влиянием соответствующих белков плазмы крови – - и-агглютининов, находящихся в составе фракции-глобулинов. Агглютиногены появляются на мембране на ранних стадиях развития эритроцита.
На поверхности эритроцитов имеется также агглютиноген — резус-фактор (Rh-фактор). Он присутствует у 86% людей, у 14% отсутствует. Переливание резус-положительной крови резус-отрицательному пациенту вызывает образование резус-антител и гемолиз эритроцитов.
Биохимия эритроцита
ГЕМАТОКРИТНОЕ ЧИСЛО:
СООТНОШЕНИЕ
ПЛАЗМА / ФОРМЕННЫЕ ЭЛЕМЕНТЫ
(ГЕМАТОКРИТ)
Эритроциты
Norma:4,0 – 5,0 х 10 *12/ л
4 ООО ООО – 5 ООО ООО В 1 МКЛ
— ЭРИТРОЦИТОЗ
— ЭРИТРОПЕНИЯ
Особенности строения эритроцитов :
Двояковогнутая форма.
Особенность мембраны и цитоскелета обеспечивает большую пластичность эритроцитов.
На эр – имеются группоспецифические антигены системы АВО.
Особенности метаболизма обеспечивают защиту этих клеток от активных форм кислорода.
В состав эритроцитов входят:
60% воды, 30-35% гемоглобин, 5% негемоглобиновые протеины, минералы, липиды, углеводы.
В состав оболочки эритроцитов на 49% входят белки, 43% жиры, 8% углеводы.
Обмен эритроцитов :
Высоко содержание ЛДГ.
Мембрана эритроцитов обладает незначительной активностью фосфолипаз, (нет продукции медиаторов арахидонового каскада).
Механизмы защиты гемоглобина от окисления:
1. Активно протекает ПФЦ НАДФh3
2. Высока концентрация глютатиона
3. Гликолиз – НАДН2
Глюкозо – 6 – фосфат дегидрогеназа
Дефект:
Образование метгемоглобина (тельца Гейнца)
Белки эритроцита
Спектрин и анкиринучаствуют в поддержании двояковогнутой формы эр, формируя сетчатую структуру, и обеспечивает эластичность эр в динамике.
Дефект белка спектрина, или дефект прикрепляющего его анкирина – ведёт к формированию наследственной патологии – микросфероцитоза – болезнь Минковского – Шоффара.
Белок 3- й полосы – интегральный белок, — переносчик ионовCLи бикарбонат-анионов, ( по механизму пассивного антипорта).
Антиген стареющих клеток – АСКпо мере взросления эр обретает неоантигенные свойства (распознаются макрофагами РЭС).
Натрий – калиевая АТФ-аза поддерживает градиент концентрации этих ионов по обе стороны мембраны. При снижении её активности, концентрация ионов натрия в клетке повышается поступление в клетку воды – гибель эр – гемолиз.
Кальций – зависимая АТФ – аза, обеспечивает выведение из эр – ионов кальция.
Кальций снижает сродство спектрина к цитоскелету клетки.
Гликофорин – интегральный гликопротен, кN– концевой части гликофорина присоединяются олигосахаридные группы – антигены системы АВО.
Биохимия крови 2. Особенности обмена в эритроцитах и лейкоцитах
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 курс.
Эритроциты(erythrosytus) это форменные элементы крови, они образуются в костном мозге, циркулируют в крови около 120 дней, а потом разрушаются макрофагами в печени, селезёнке и костном мозге.В сутки обновляется 1% эритроцитов, т.е. в течение одной секунды в кровоток поступает около 2 млн. эритроцитов.
Организм взрослого человека содержит около 25*1012эритроцитов. Концентрация эритроцитов у мужчины составляет 3,9*1012— 5,5*1012/л, у женщины — 3,7*1012— 4,9*1012/л. Более высокое содержание эритроцитов у мужчин обусловлено стимулирующим эритропоэз влиянием андрогенов. Женские половые гормоны, наоборот тормозят эритропоэз.
ФункциИ эритроцитов
Основными функциями эритроцитов, которые реализуются с участием гемоглобина, являются транспорт от легких к тканям О2 и обратно СО2, а также регуляция КОС.
Кроме того эритроциты адсорбируют и транспортируют на своей клеточной мембране аминокислоты, антитела, токсины, лекарственных веществ и другие вещества.
Строение эритроцитов
Эритроциты у человека и млекопитающих в токе крови обычно (80%) имеют форму двояковогнутых дисков и называются дискоцитами. Такая формаэритроцитов создаёт наибольшую площадь поверхности по отношению к объёму, что обеспечивает максимальный газообмен, а такжеобеспечивает большую пластичность при прохождении эритроцитами мелких капилляров.
Диаметр эритроцитов у человека колеблется от 7,1 до 7,9 мкм, толщина эритроцитов в краевой зоне — 1,9 — 2,5 мкм, в центре — 1 мкм. В нормальной крови указанные размеры имеют 75% всех эритроцитов — нормоциты; большие размеры (свыше 8,0 мкм) — 12,5 % —макроциты. У остальных эритроцитов диаметр может быть 6 мкм и меньше —микроциты.
Поверхность отдельного эритроцита у человека приблизительно равна 125 мкм2, а объём (MCV) – 75-96 мкм3.
Эритроциты человека и млекопитающих представляют собой безъядерные клетки, утратившие в процессе фило- и онтогенеза ядро и большинство органелл, они имеют только цитоплазму и плазмолемму (клеточную мембрану), толщиной около 20 нм.
Химический состав эритроцитов
1. Плазмолемма эритроцитов
Плазмолемма эритроцитов состоит из примерно равного количества липидов и белков, а также небольшого количества углеводов.
Липиды
Бислой плазмолеммы образован глицерофосфолипидами, сфингофосфолипидами, гликолипидами и холестерином. Внешний слой содержит много холина (фосфатидилхолин, сфингомиелин) и около 5% (от общего количества липидов) гликолипидов, внутренний — много фосфатидилсерина и фосфатидилэтаноламина.
Белки
В плазмолемме эритроцита идентифицировано 15 главных белков с молекулярной массой 15-250 кДа. Большинство этих белков (спектрин, гликофорин, белок полосы 3, белок полосы 4.1, актин, анкирин) образуют с цитоплазматической стороны плазмалеммы цитоскелет, который придает эритроциту двояковогнутую форму и высокую механическую прочность.
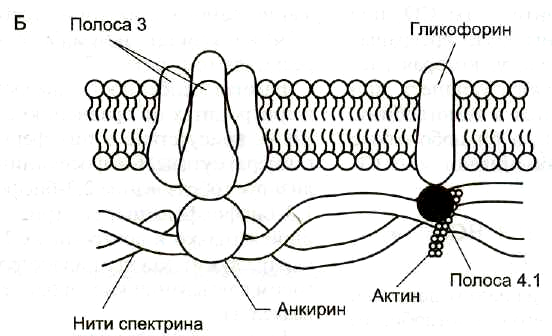
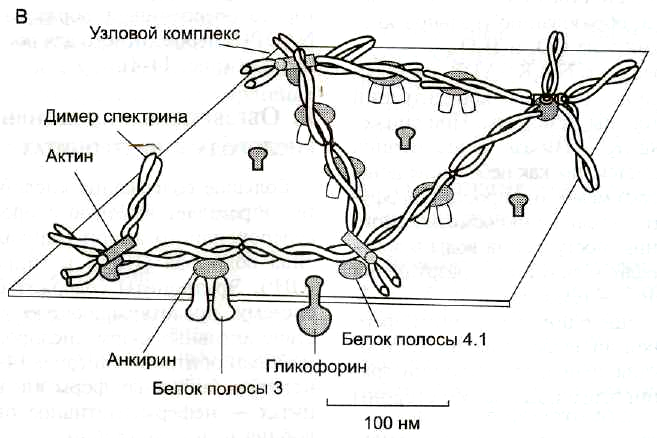
Самыми распространенными белками плазмолеммы (более 60% всех мембранных белков) являются спектрин, гликофорин и белок полосы 3.
Спектрин— основной белок цитоскелета эритроцитов (составляет 25% массы всех мембранных и примембранных белков), имеет вид фибриллы 100 нм, состоящей из двух антипаралельно перекрученных друг с другом цепей α-спектрина (240 кДа) и β-спектрина (220 кДа). Молекулы спектрина образуют сеть, которая фиксируется на цитоплазматической стороне плазмалеммы с помощью анкирина и белка полосы 3 или актина, белка полосы 4.1 и гликофорина.
Белок полосы 3— трансмембранный гликопротеид (100 кДа), его полипептидная цепь которого много раз пересекает бислой липидов. Белок полосы 3 является компонентом цитоскелета и анионным каналом, который обеспечивает трансмембранный антипорт для ионов НСО3—и Сl—.
Гликофорин— трансмембранный гликопротеин (30 кДа), который пронизывает плазмолемму в виде одиночной спирали. С наружной поверхности эритроцита к нему присоединены 20 цепей олигосахаридов, которые несут отрицательные заряды. Гликофорины формируют цитоскелет и, через олигосахариды, выполняют рецепторные функции.
Na+,K+-АТФ-азамембранный фермент, обеспечивает поддержание градиента концентраций Na+и К+по обе стороны мембраны. При снижении активности Na+K+-АТФ-азы концентрация Na+в клетке повышается, что приводит к увеличению осмотического давления, увеличению поступления воды в эритроцит и к его гибели в результате гемолиза.
Са2+-АТФ-аза— мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны.
Углеводы
Олигосахариды (сиаловая кислота и антигенные олигосахариды) гликолипидов и гликопротеидов, расположенные на наружной поверхности плазмолеммы, образуют гликокаликс.
Олигосахариды гликофорина определяют антигенные свойства эритроцитов. Они являются агглютиногенами (А и В) и обеспечивают агглютинацию (склеивание) эритроцитов под влиянием соответствующих белков плазмы крови – - и-агглютининов, находящихся в составе фракции-глобулинов. Агглютиногены появляются на мембране на ранних стадиях развития эритроцита.
На поверхности эритроцитов имеется также агглютиноген — резус-фактор (Rh-фактор). Он присутствует у 86% людей, у 14% отсутствует. Переливание резус-положительной крови резус-отрицательному пациенту вызывает образование резус-антител и гемолиз эритроцитов.
Гемоглобин –главный белок цитозоля эритроцитов
Одну треть клеточной массы эритроцитов составляет гемоглобин. Он же придает и красный цвет эритроциту и крови и выполняет следующие функции
Транспорт кислорода по крови
Участие в транспорте диоксида углерода
Участие в создании буферной системы, поддерживающей концентрацию ионов водорода во внеклеточном пространстве.
Содержание гемоглобина в одном эритроците можно рассчитать, зная общее содержание гемоглобина и количество эритроцитов При концентрации гемоглобина в 160 г/л крови, которая содержит 5000 млрд эритроцитов содержание Hb в одном эритроците 32 пиког ( в норме 27-54).
При отклонении значений ниже указанных говорят о гипохромной анемии ( недостаток железа)
При отклонении значений выше указанных говорят о гиперхромной анемии (недостаток В12)
При уменьшении концентрации Hb и числа эритроцитов и нормальном содержании Hb в одном эритроците говорят о нормохромной анемии.
У нормального взрослого массой 70 кг и объемом крови в 5 л при условии среднего содержания Гб 160 г/л (16 г% или 9.9.ммоль/л ) общее количество Hb составит 800 г. Ежедневно при этом 6.25 г или около 1% распадается и синтезируется вновь.
Таласемии – болезни, вызываемые нарушениями синтеза цепей глобина.
Врожденные нарушения синтеза одной из двух глобиновых цепей получили название талассемий. Гомозиготные формы (Thalassaemia major) приводят в отличие от более благоприятных, гетерозиготных форм (Thalassaemia minor) всегда к смерти в детском возрасте, так как молекулярные изменения при них таковы , что полноценное снабжение кислородом тканей становится невозможным.
- талассемии. Делеции генов, кодирующих глобиновые цепи являются наиболее частой причиной этих заболеваний. В геноме человека имеется 4 гена a цепей (соответственно по две на каждой хромосоме 16),и это объясняет более мягкое течение этих талассемий, потому, что гомозиготные формы – талассемии, которые ведут к водянке плода (Morbus haemolyticus neonatorum) и к внутриматочной смерти, связаны с делециями всех четырех генов, кодирующих -глобиновые цепи.
Вследствие нарушения биосинтеза a цепей уменьшается не только синтез HbA1 но и HbA2, и HbF. У эмбриона избыток цепей, возникающий из-за ограниченного синтеза цепей ведет к сборке тетрамера -цепей- Hb4 ( Hb Барт) . Так как после рождения - цепи замещаются цепями, последние, не находя цепи для образования нормального гемоглобина, собираются в тетрамеры цепей Hb4 (HbH). Hb Барт и HB-H не обладают эффектом Бора, их кривые насыщения кислородом — гиперболы (отсутствие кооперативного эффекта), обладают низкой стабильностью, имеют склонность к образованию агрегатов, вследствие чего нормальная продолжительность жизни эритроцитов сокращается и заболевание проявляется в форме умеренной гипохромной гемолитической анемии.
талассемии в отличие от талассемий начинают проявляться только после рождения, когда произойдет замена -цепей цепями. Возникающий относительный избыток -цепей у взрослого человека сопровождается сохранением синтеза и цепей поэтому у гетерозиготных форм повышено содержание HBA2, (a2) до 4-6 % ( в норме 2-3 %) и HBF (22) до 0,5-6 % (в норме отсутствует), однако тетрамеров -цепей обычно не образуется .
Неустойчивость эритроцитов больных талассемиями, частично обусловлена тем, что свободные и цепи сильнее подвержены аутоокислению чем в составе тетрамеров нормального гемоглобина, а это приводит к увеличению образования большего количества супероксидных анионов, что может перекрыть мощность дисмутазной системы и привести к пероксидному повреждению липидов и SH-групп белков эритроцитарных мембран.
При гомозиготных формах -талассемий содержание HBF в эритроцитах может достигать от 50 до 100 % и это объясняет летальные исходы этого заболевания, так как HBF приспособлен для транспорта кислорода в условиях кровообращения плода, а не у взрослых.
Точечные мутации в экзонных областях генов глобина ведут к образованию гемоглобинов с измененной функцией
Варианты аминокислотной последовательности цепей глобина наблюдаются примерно у каждого шестисотого человека. В какой мере замены аминокислот сказываются на структуре и функции гемоглобина зависит от типа замещения аминокислот(например, замена аминокислоты с гидрофобными свойствами гидрофильной аминокислотой), или расположения заменяемой аминокислоты в структуре белка (на поверхности или внутри молекулы). Аномалии гемоглобина наследуются аутосомально рецессивным путем. Гетерозиготные носители, которые имеют половину нормальных и половину патологических гемоглобинов обычно имеют достаточное количество нормального гемоглобина для снабжения кислородом ткани, в то время как у гомозиготных носителей наблюдаются тяжелые анемии и во многих случаях наступает смерть. Аномальные гемоглобины обозначаются большими буквами алфавита или по клинической картине, местности или имени пациентов, с которыми связано первое описание(см табл 14-17). Мутации обычно описываются либо указанием на место в ДНК (например. ГАГ— ГТГ) или в белке(6 ГЛУ — > ВАЛl или ГЛУ6ВАЛ), что означает замену остатка глутаминовой кислоты в положении 6 цепи валиловым остатком.
Табл 14-20. Генетически обусловленные нарушения последовательности аминокислот гемоглобина (известно около 300 вариантов)
Гемоглобин | Нарушение | Замещение |
Hb S | Образование серповидных клеток | 6 ГЛУВАЛ |
Hb M Iwate | Метгемоглобинобразование | 87 ГИСТИР |
Hb M Boston | Метгемоглобинобразование | 58 ГИСТИР |
Hb M Hyde Park | Метгемоглобинобразование | 92 ГИСТИР |
Hb M Saskatoon | Метгемоглобинобразование | 63 ГИСТИР |
Hb M Milwauki I | Метгемоглобинобразование | 67 ВАЛГЛУ |
Hb H Hammersmith | Отщепление гема | 42 ФЕН СЕР |
У гомозиготных форм серповидноклеточной болезни наблюдают в периферический и следовательно с низким содержанием кислорода крови появление серповидно клеточных эритроцитов, который склонны к гемолизу. С конца сороковых годов ХХ столетия известно, что пациенты с серповидноклеточной болезнью имеют гемоглобин с измененной электрофоретической подвижностью. Молекулярная причина дефекта, тем не менее, выяснилась после доказательства, что различие связано с заменой аминокислоты в цепи: пептиды трипсинового гидролизата гемоглобина после разделения электрофорезом и хроматографией давали характерные пятна, названные исследователями «отпечатками пальцев (fingerprints)». При сравнении передвижения трипсиновых пептидов нормального гемоглобина с пептидами полученными из гемоглобина больного серповидноклеточной анемией оказалось , что один пептидный фрагмент отличался своей подвижностью. Исследование этого фрагмента, октапептида -цепи показало, что он, в отличие от пептида HbА, имел остаток валина вместо глутаминовой кислоты.
Эта замена гидрофильной аминокислоты гидрофобной и послужила основой измененной электрофоретической подвижности HbS. После выяснения первичной структуры гемоглобина к началу 60ых годов было твердо установлено, что дефект в положении 6 - цепи HBS (a2b26ГЛУ ВАЛ) лежит в области, которая находится на поверхности молекулы гемоглобина. Это замещение вызвано заменой пуринового основания в кодоне (ГАГ), на кодон для валина (ГТГ). Присоединение кислорода в серповидноклеточном гемоглобине не нарушается, однако эритроциты, содержащие этот гемоглобин обладали особой наклонностью принимать форму серпа в периферической крови. Причина образования серповидных клеток связана с агрегацией молекул HbS. Преимущество отбора гетерозиготного носителя основывается на том, что в эритроцитах с HbS малярийные плазмодии не выживают.
Биохимия эритроцита
ГЕМАТОКРИТНОЕ ЧИСЛО:
СООТНОШЕНИЕ
ПЛАЗМА / ФОРМЕННЫЕ ЭЛЕМЕНТЫ
(ГЕМАТОКРИТ)
Эритроциты
Norma:4,0 – 5,0 х 10 *12/ л
4 ООО ООО – 5 ООО ООО В 1 МКЛ
— ЭРИТРОЦИТОЗ
— ЭРИТРОПЕНИЯ
Особенности строения эритроцитов :
Двояковогнутая форма.
Особенность мембраны и цитоскелета обеспечивает большую пластичность эритроцитов.
На эр – имеются группоспецифические антигены системы АВО.
Особенности метаболизма обеспечивают защиту этих клеток от активных форм кислорода.
В состав эритроцитов входят:
60% воды, 30-35% гемоглобин, 5% негемоглобиновые протеины, минералы, липиды, углеводы.
В состав оболочки эритроцитов на 49% входят белки, 43% жиры, 8% углеводы.
Обмен эритроцитов :
Высоко содержание ЛДГ.
Мембрана эритроцитов обладает незначительной активностью фосфолипаз, (нет продукции медиаторов арахидонового каскада).
Механизмы защиты гемоглобина от окисления:
1. Активно протекает ПФЦ НАДФh3
2. Высока концентрация глютатиона
3. Гликолиз – НАДН2
Глюкозо – 6 – фосфат дегидрогеназа
Дефект:
Образование метгемоглобина (тельца Гейнца)
Белки эритроцита
Спектрин и анкиринучаствуют в поддержании двояковогнутой формы эр, формируя сетчатую структуру, и обеспечивает эластичность эр в динамике.
Дефект белка спектрина, или дефект прикрепляющего его анкирина – ведёт к формированию наследственной патологии – микросфероцитоза – болезнь Минковского – Шоффара.
Белок 3- й полосы – интегральный белок, — переносчик ионовCLи бикарбонат-анионов, ( по механизму пассивного антипорта).
Антиген стареющих клеток – АСКпо мере взросления эр обретает неоантигенные свойства (распознаются макрофагами РЭС).
Натрий – калиевая АТФ-аза поддерживает градиент концентрации этих ионов по обе стороны мембраны. При снижении её активности, концентрация ионов натрия в клетке повышается поступление в клетку воды – гибель эр – гемолиз.
Кальций – зависимая АТФ – аза, обеспечивает выведение из эр – ионов кальция.
Кальций снижает сродство спектрина к цитоскелету клетки.
Гликофорин – интегральный гликопротен, кN– концевой части гликофорина присоединяются олигосахаридные группы – антигены системы АВО.
Биохимия эритроцита
ГЕМАТОКРИТНОЕ ЧИСЛО:
СООТНОШЕНИЕ
ПЛАЗМА / ФОРМЕННЫЕ ЭЛЕМЕНТЫ
(ГЕМАТОКРИТ)
Эритроциты
Norma:4,0 – 5,0 х 10 *12/ л
4 ООО ООО – 5 ООО ООО В 1 МКЛ
— ЭРИТРОЦИТОЗ
— ЭРИТРОПЕНИЯ
Особенности строения эритроцитов :
Двояковогнутая форма.
Особенность мембраны и цитоскелета обеспечивает большую пластичность эритроцитов.
На эр – имеются группоспецифические антигены системы АВО.
Особенности метаболизма обеспечивают защиту этих клеток от активных форм кислорода.
В состав эритроцитов входят:
60% воды, 30-35% гемоглобин, 5% негемоглобиновые протеины, минералы, липиды, углеводы.
В состав оболочки эритроцитов на 49% входят белки, 43% жиры, 8% углеводы.
Обмен эритроцитов :
Высоко содержание ЛДГ.
Мембрана эритроцитов обладает незначительной активностью фосфолипаз, (нет продукции медиаторов арахидонового каскада).
Механизмы защиты гемоглобина от окисления:
1. Активно протекает ПФЦ НАДФh3
2. Высока концентрация глютатиона
3. Гликолиз – НАДН2
Глюкозо – 6 – фосфат дегидрогеназа
Дефект:
Образование метгемоглобина (тельца Гейнца)
Белки эритроцита
Спектрин и анкиринучаствуют в поддержании двояковогнутой формы эр, формируя сетчатую структуру, и обеспечивает эластичность эр в динамике.
Дефект белка спектрина, или дефект прикрепляющего его анкирина – ведёт к формированию наследственной патологии – микросфероцитоза – болезнь Минковского – Шоффара.
Белок 3- й полосы – интегральный белок, — переносчик ионовCLи бикарбонат-анионов, ( по механизму пассивного антипорта).
Антиген стареющих клеток – АСКпо мере взросления эр обретает неоантигенные свойства (распознаются макрофагами РЭС).
Натрий – калиевая АТФ-аза поддерживает градиент концентрации этих ионов по обе стороны мембраны. При снижении её активности, концентрация ионов натрия в клетке повышается поступление в клетку воды – гибель эр – гемолиз.
Кальций – зависимая АТФ – аза, обеспечивает выведение из эр – ионов кальция.
Кальций снижает сродство спектрина к цитоскелету клетки.
Гликофорин – интегральный гликопротен, кN– концевой части гликофорина присоединяются олигосахаридные группы – антигены системы АВО.
Биохимия эритроцита
ГЕМАТОКРИТНОЕ ЧИСЛО:
СООТНОШЕНИЕ
ПЛАЗМА / ФОРМЕННЫЕ ЭЛЕМЕНТЫ
(ГЕМАТОКРИТ)
Эритроциты
Norma:4,0 – 5,0 х 10 *12/ л
4 ООО ООО – 5 ООО ООО В 1 МКЛ
— ЭРИТРОЦИТОЗ
— ЭРИТРОПЕНИЯ
Особенности строения эритроцитов :
Двояковогнутая форма.
Особенность мембраны и цитоскелета обеспечивает большую пластичность эритроцитов.
На эр – имеются группоспецифические антигены системы АВО.
Особенности метаболизма обеспечивают защиту этих клеток от активных форм кислорода.
В состав эритроцитов входят:
60% воды, 30-35% гемоглобин, 5% негемоглобиновые протеины, минералы, липиды, углеводы.
В состав оболочки эритроцитов на 49% входят белки, 43% жиры, 8% углеводы.
Обмен эритроцитов :
Высоко содержание ЛДГ.
Мембрана эритроцитов обладает незначительной активностью фосфолипаз, (нет продукции медиаторов арахидонового каскада).
Механизмы защиты гемоглобина от окисления:
1. Активно протекает ПФЦ НАДФh3
2. Высока концентрация глютатиона
3. Гликолиз – НАДН2
Глюкозо – 6 – фосфат дегидрогеназа
Дефект:
Образование метгемоглобина (тельца Гейнца)
Белки эритроцита
Спектрин и анкиринучаствуют в поддержании двояковогнутой формы эр, формируя сетчатую структуру, и обеспечивает эластичность эр в динамике.
Дефект белка спектрина, или дефект прикрепляющего его анкирина – ведёт к формированию наследственной патологии – микросфероцитоза – болезнь Минковского – Шоффара.
Белок 3- й полосы – интегральный белок, — переносчик ионовCLи бикарбонат-анионов, ( по механизму пассивного антипорта).
Антиген стареющих клеток – АСКпо мере взросления эр обретает неоантигенные свойства (распознаются макрофагами РЭС).
Натрий – калиевая АТФ-аза поддерживает градиент концентрации этих ионов по обе стороны мембраны. При снижении её активности, концентрация ионов натрия в клетке повышается поступление в клетку воды – гибель эр – гемолиз.
Кальций – зависимая АТФ – аза, обеспечивает выведение из эр – ионов кальция.
Кальций снижает сродство спектрина к цитоскелету клетки.
Гликофорин – интегральный гликопротен, кN– концевой части гликофорина присоединяются олигосахаридные группы – антигены системы АВО.
