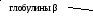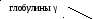Белки плазмы крови
В плазме крови открыто более 200 видов белков, которые составляют 7% объема плазмы. Белки плазмы крови синтезируются в основном в печени и макрофагах, а также в эндотелии сосудов, в кишечнике, лимфоцитах, почках, эндокринных железах. Разрушаются белки плазмы крови печенью, почками, мышцами и др. органами. Т½ белков плазмы крови составляет от нескольких часов до несколько недель.
В плазме крови белки выполняют следующие функции:
Создают онкотическое давление. Оно необходимо для удержания воды в кровяном русле.
Участвуют в свертывании крови.
Образуют буферную систему (белковый буфер).
Транспортируют в крови плохорастворимые в воде вещества (липиды, металлы 2 и более валентности).
Участвуют в иммунных процессах.
Образуют резерв аминокислот, который используется, например, при белковом голодании.
катализируют некоторые реакции (белки-ферменты).
Определяют вязкость крови, влияют на гемодинамику.
Участвуют в реакциях воспаления.
Строение белков плазмы крови
По строению белки плазмы крови являются глобулярными, по составу они делятся на простые (альбумины) и сложные.
Среди сложных, можно выделить липопротеины (ЛПОНП, ЛППП, ЛПНП, ЛПВП, ХМ), гликопротеины (почти все белки плазмы) и металлопротеины (трансферин, церрулоплазмин).
Общее количество белкав плазме крови в норме составляет 70-90 (60-80) г/л, его определяют с помощью биуретовой реакции. Количество общего белка в крови имеет диагностическое значение.
Повышение общего количества белка в плазме крови называется гиперпротеинемия, снижение –гипопротеинемия. Гиперпротеинемия возникает при дегидратации (относительная), травмах, ожогах, миеломной болезни (абсолютная). Гипопротеинемия наступает при спаде отеков (относительная), голодании, патологии печени, почек, кровопотере (абсолютная).
Кроме общего содержания белков в плазме крови также определяют содержание отдельных групп белков или даже индивидуальных белков. Для этого их разделяют с помощью электроэлектрофореза.
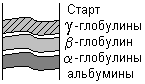
Электрофорез– это метод, при котором вещества с различным зарядом и массой, разделяются в постоянном электрическом поле. Электрофорез проводят на различных носителях, при этом получают разное количество фракций. При электрофорезе на бумаге белки плазмы крови дают 5 фракций: альбумины, α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины. При электрофорезе на агаровом геле получается 7-8 фракций, на крахмальном геле – 16-17 фракций. Больше всего фракций – более 30, дает иммуноэлектрофорез.
Белки плазмы можно также разделить спомощью высаливания нейтральными солями щелочных и щелочноземельных металлов (3 фракции: альбумины, глобулины и фибриноген) или осаждения в спиртовом растворе.
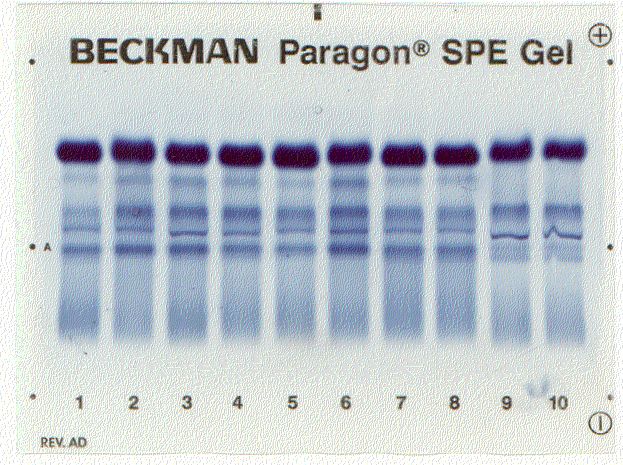
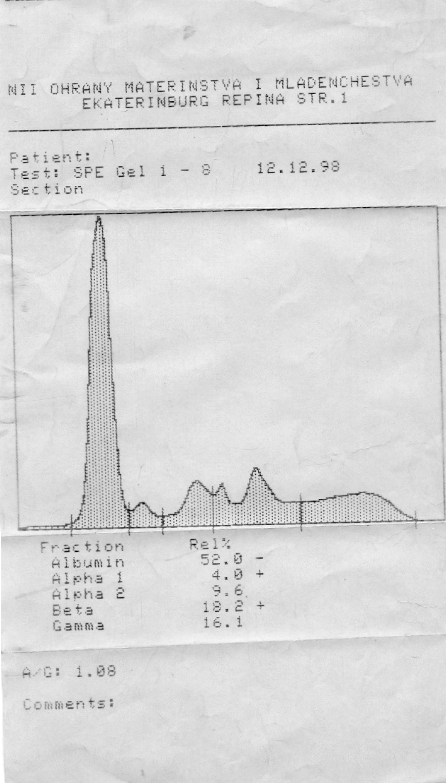
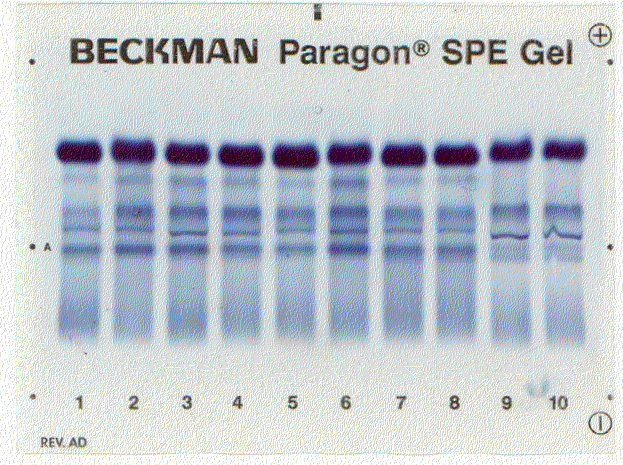
Денситограмма белков сыворотки крови | Электрофореграмма белков сыворотки крови (10 пациентов) |
|
|
Целесообразность разделения белков на фракции связана с тем, что белковые фракции плазмы крови отличаются между собой преобладанием в них белков, с определенными функциями, местом синтеза или разрушения.
Нарушение соотношения белковых фракций плазмы крови называется диспротеинемия. Выявление диспротеинемии имеет диагностическое значение.
4. Белки плазмы крови.
Нормальные плазменные концентрации отдельных ионов и небольших молекул почти такие же, как и в тканевой жидкости из-за свободного обмена воды и растворенных веществ через большинство кровеносных капилляров. Напротив, большинство капилляров непроницаемы для белков плазмы. В результате разница в концентрации белка между плазмой и интерстициальной жидкости создает градиент осмотического (онкотического) давления, который выступает против фильтрации плазмы из капилляров.
Белковую фракцию плазмы составляет несколько десятков различных белков. Их делят на две основные группы: альбумины и глобулины. В глобулиновую фракцию входит фибриноген.
Альбумины составляют около 60 % белков плазмы. Они участвуют в транспорте кровью различных веществ, таких как тироксин, билирубин, соли тяжелых металлов, жирные кислоты, фармакологические препараты.
Глобулины по показателям электрофоретической подвижности разделяют на α1-, α2-, β- и γ-глобулины. Эти фракции подразделяют на субфракции. Так, в α1-глобулинах имеются белки с углеводной группой – гликопротеины, в них циркулирует около 60 % всей глюкозы плазмы. Субфракция α 2-глобулинов церулоплазмин обладает способностью связывать медь.
β-глобулины участвуют в транспорте фосфолипидов, холестерина, стероидных горомонов, металлических катионов. Они удерживают около 75 % всех липидов плазмы. Металлосодержащий белок трансферрин осуществляет перенос железа кровью.
Во фракцию γ-глобулинов входят различные антитела, защищающие организм от вторжения вирусов и бактерий. Их подразделяют на группы IgA, IgG, IgE и т.д. Сюда же относят агглютинины крови.
Фибриноген обладает свойством становиться нерастворимым в определенных условиях (под воздействием тромбина), принимать при этом волокнистую структуру, переходя в фибрин.
Альбумины и фибриноген образуются в печени, глобулины – в печени, красном костном мозгу, селезенке, лимфатических узлах.
Таким образом, белки плазмы вместе с электролитами являются ее функциональными элементами. С их помощью в значительной степени осуществляется транспорт веществ из крови к тканям. К числу транспортируемых компонентов относятся питательные вещества, витамины, микроэлементы, гормоны, ферменты, а также конечные продукты обмена веществ. Кроме того, в силу способности связывать большое число циркулирующих в плазме низкомолекулярных соединений, белки участвуют в поддержании осмотического давления.
5. Клеточный состав крови
Клеточный состав крови представлен эритроцитами, лейкоцитами и тромбоцитами.
Эритроциты — безъядерные форменные элементы, 98% объема гомогенной цитоплазмы которых составляет гемоглобин. Их количество в среднем составляет 3,9—5*1012/л.
Активная часть жизненного цикла эритроцитов (120 сут) протекает в периферической крови, куда они поступают в стадии ретикулоцитов. Ретикулоциты активно поглощают ферритин; через 24—36 ч превращаются в зрелые эритроциты. Эритроциты составляют основную массу крови, они же определяют ее цвет.
Зрелые эритроциты млекопитающих имеют форму двояковогнутых дисков диаметром 7—10 мкм. Такая форма не только увеличивает площадь поверхности (до 3800 м2), но и способствует более быстрой и равномерной диффузии газов через клеточную мембрану. Плазмолемма эритроцитов имеет отрицательный заряд, аналогично заряжены внутренние стенки кровеносных сосудов. Одноименные заряды препятствуют слипанию. Вследствие большой эластичности эритроциты легко проходят по капиллярам, имеющим вдвое меньший, чем они диаметр (3—4 мкм).
Основной
функцией эритроцитов является транспорт
О2 от
легких к тканям и участие в переносе
СО2 от тканей к легким. Эритроциты переносят
также адсорбированные на их поверхности
питательные вещества, биологически
активные вещества, обмениваются липидами
с плазмой крови. Эритроциты участвуют
в регуляции кислотно-щелочного и ионного
равновесия в организме, водно-солевого
обмена организма. Эритроциты принимают
участие в явления иммунитета, адсорбируя
различные яды, которые затем разрушаются.
В эритроцитах содержится ряд ферментов
(фосфатаза) и витаминов (В1, В
— фракции белков крови — Биохимия
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% всего белка крови составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах.
Синтез белков плазмы крови осуществляют:
- печень – полностью синтезирует фибриноген и альбумины крови, большую часть α- и β-глобулинов,
- клетки ретикулоэндотелиальной системы (РЭС) костного мозга и лимфатических узлов – часть β-глобулинов и γ-глобулины (иммуноглобулины).
Существует довольно много различных методов разделения белков в зависимости от их некоторых качеств. Наиболее распространенным методом фракционирования белков крови является электрофорез..
Электрофорез белков
Ацетатцеллюлозная пленка, гель, специальная бумага (носитель) помещается на рамку, при этом противоположные края носителя свисают в кюветы с буферным раствором. На линию старта наносится сыворотка крови. Метод заключается в движении заряженых молекул белка по поверхности носителя под влиянием электрического поля. Молекулы с наибольшим отрицательным зарядом и наименьшим размером, т.е. альбумины, двигаются быстрее остальных. Наиболее крупные и нейтральные (γ-глобулины) оказываются последними.
На ход электрофореза влияет подвижность разделяемых веществ, находящаяся в зависимости от ряда факторов: заряд белков, величина электрического поля, состав растворителя (буферной смеси), тип носителя (бумага, пленка, гель).
Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
| Общий белок | взрослые | 65-85 г/л |
| дети 1-3 года | 55-85 г/л | |
| Белковые фракции | ||
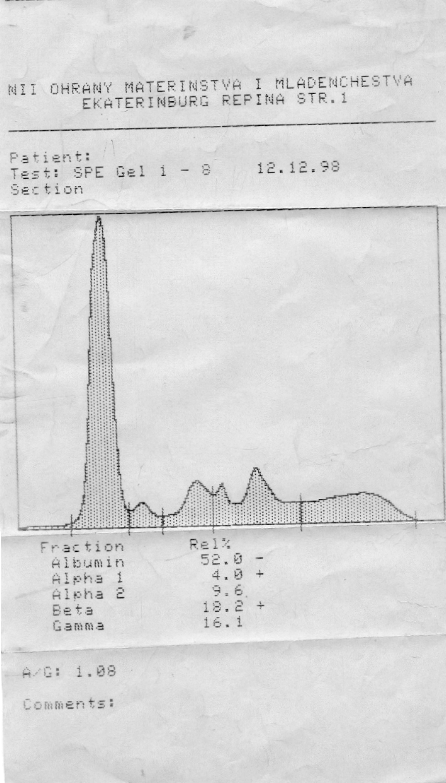
| Альбумины | 50-70 % | 30-50 г/л |
| α1-Глобулины | 3-6 % | 1-3 г/л |
| α2-Глобулины | 9-15 % | 6-10 г/л |
| β-Глобулины | 8-18 % | 7-11 г/л |
| γ-Глобулины | 15-25 % | 8-16 г/л |
Нормальные величины фракций белков в ликворе и моче можно посмотреть здесь.
Особенности содержания белков в крови у детей
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
Тип протеинограммы |
Альбумины |
Фракции глобулинов |
Примеры заболеваний |
|||
| α1 | α2 | β | γ | |||
| Острые воспаления | ↓↓ | ↑ | ↑ | — | ↑ | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, инфаркт миокарда |
| Хронические воспаления | ↓ | — | ↑↑ |
— | ↑↑ | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит |
| Нарушения почечного фильтра |
↓↓ |
— | ↑ | ↑ | ↓ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии |
| Злокачественные опухоли |
↓↓ |
↑↑ | ↑↑ | ↑↑↑ | ↑↑ | Метастатические новообразования с различной локализацией первичной опухоли |
| Гепатиты | ↓ | — | — | ↑ | ↑↑ | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата, некоторые формы полиартрита, дерматозы |
| Некроз печени | ↓↓ | — | ↓ | ↑ | ↑↑ | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов |
| Механические желтухи | ↓ | — | ↑ | ↑ | ↑ | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы |
| α2-глобулиновые плазмоцитомы | ↓ | ↓ | ↑↑ | ↓ | ↓ | α2-Плазмоцитомы |
| β-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↑↑ | ↓ | β1-Плазмоцитомы, β1-плазмоклеточная лейкемия и макроглобулинемия Вальденштрема |
| γ-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↓ | ↑↑ | γ-Плазмоцитомы, макроглобулинемия и некоторые ретикулезы |
Белки плазмы крови
В плазме крови открыто более 200 видов белков, которые составляют 7% объема плазмы. Белки плазмы крови синтезируются в основном в печени и макрофагах, а также в эндотелии сосудов, в кишечнике, лимфоцитах, почках, эндокринных железах. Разрушаются белки плазмы крови печенью, почками, мышцами и др. органами. Т½ белков плазмы крови составляет от нескольких часов до несколько недель.
В плазме крови белки выполняют следующие функции:
Создают онкотическое давление. Оно необходимо для удержания воды в кровяном русле.
Участвуют в свертывании крови.
Образуют буферную систему (белковый буфер).
Транспортируют в крови плохорастворимые в воде вещества (липиды, металлы 2 и более валентности).
Участвуют в иммунных процессах.
Образуют резерв аминокислот, который используется, например, при белковом голодании.
катализируют некоторые реакции (белки-ферменты).
Определяют вязкость крови, влияют на гемодинамику.
Участвуют в реакциях воспаления.
Строение белков плазмы крови
По строению белки плазмы крови являются глобулярными, по составу они делятся на простые (альбумины) и сложные.
Среди сложных, можно выделить липопротеины (ЛПОНП, ЛППП, ЛПНП, ЛПВП, ХМ), гликопротеины (почти все белки плазмы) и металлопротеины (трансферин, церрулоплазмин).
Общее количество белкав плазме крови в норме составляет 70-90 (60-80) г/л, его определяют с помощью биуретовой реакции. Количество общего белка в крови имеет диагностическое значение.
Повышение общего количества белка в плазме крови называется гиперпротеинемия, снижение –гипопротеинемия. Гиперпротеинемия возникает при дегидратации (относительная), травмах, ожогах, миеломной болезни (абсолютная). Гипопротеинемия наступает при спаде отеков (относительная), голодании, патологии печени, почек, кровопотере (абсолютная).
Кроме общего содержания белков в плазме крови также определяют содержание отдельных групп белков или даже индивидуальных белков. Для этого их разделяют с помощью электроэлектрофореза.
Электрофорез– это метод, при котором вещества с различным зарядом и массой, разделяются в постоянном электрическом поле. Электрофорез проводят на различных носителях, при этом получают разное количество фракций. При электрофорезе на бумаге белки плазмы крови дают 5 фракций: альбумины, α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины. При электрофорезе на агаровом геле получается 7-8 фракций, на крахмальном геле – 16-17 фракций. Больше всего фракций – более 30, дает иммуноэлектрофорез.
Белки плазмы можно также разделить спомощью высаливания нейтральными солями щелочных и щелочноземельных металлов (3 фракции: альбумины, глобулины и фибриноген) или осаждения в спиртовом растворе.
Денситограмма белков сыворотки крови | Электрофореграмма белков сыворотки крови (10 пациентов) |
|
|
Целесообразность разделения белков на фракции связана с тем, что белковые фракции плазмы крови отличаются между собой преобладанием в них белков, с определенными функциями, местом синтеза или разрушения.
Нарушение соотношения белковых фракций плазмы крови называется диспротеинемия. Выявление диспротеинемии имеет диагностическое значение.
Белки – преобладающие компоненты плазмы
К белкам пла змы крови о тно сится группа белков, удов летворяющих следующим требованиям:
1) содер жатся в плазме крови;
2) синтезируются в печени или ретикулоэндотелиальной системе (реже в специализированных тканях) ;
3) прояв ляют основную функцию в пределах сосудистой системы;
4) в кровь секретируются, а н е по падают в результате повреждени я тканей;
5) наход ятся в пла зме в концентрац ии большей, чем в дру гих биологи ческих ж идкостях;
6) могут проявлять генетически обусловленный полимор физм или им еть вариантные формы, но это не связа но с тканевым про исхождением;
7) не яв ляются продуктам и катаболического протеолиза в плазме, но могут быть продуктами ограни че нного протеолиза;
8) имеют большее время биологического полурас пада в пла зме, чем в ремя транспорта по крови.
Свыше 100 разных белков плазмы соответствуют этим крит ериям, и и зучение их функций, изменения содержания, состава при п атологии – одна из важных задач клинической биохимии.
Содержание различных белков в плазме колеблется в широких пределах. Уровень некоторых из них, называемых главными, достигает высоких значений (например, альбумина – 40 г/л). Таких белков около 10, но они составляют примерно 90 % количества всех белков плазмы. На остальные 10 % приходится свыше 100 различных белков, содержание которых может быть в пределах 50 – 200 мкг/л. Это минорные, следовые белки.
Общее содержание белка в плазме у человека составляет 60 — 80 г/л. При общем объеме крови 5 л объем плазмы при гематокрите 40 % составит 3 л, из которых можно выделить 180 – 240 г белка. В динамическом равновесии с внутрисосудистыми белками находятся белки внесосудистого пространства, занимающего объем 15 л и содержащего около 10 г/л белков (общее количество 150 г). Таким образом, общее количество внеклеточного белка составляет примерно 400 г. Это 4 % всех белков организма (10 кг).
Определение так называемого общего белка плазмы имеет низкую информативность, потому что не представляет данных о качественных и количественных изменениях отдельных белков. Обычно определяют концентрацию белка, т.е. количество белков в единице объема, изменения внеклеточной воды могут оказывать существенное влияние на результат определения. Так, например, потери воды при рвоте, непроходимости верхних отделов кишечника, диарее у детей, обширных ожогах могут быть причиной сгущения крови (гемоконцентрации) и давать мнимое повышение концентрации белков – гиперпротеинемию. Такую гиперпротеинемию называют относительной. В данном случае следует измерять гематокрит.
Абсолютная гиперпротеинемия наблюдается при значительном усилении синтеза отдельных белков. Например, раздражение ретикулоэндотелиальной системы токсинами разного происхождения сопровождается усиленным образованием γ-глобулинов. Острая воспалительная реакция в организме человека также вызывает значительное повышение содержания белков.
Гиперпротеинемия – один из важнейших признаков миеломной болезни, при которой интенсивно образуются миеломные белки.
Гипопротеинемия – снижение содержания общего белка плазмы. Она возникает при повышенных потерях белков организмом, в частности при воспалительных заболеваниях почек или усилении проницаемости капилляров для белков (заболевания кишечника) . Причиной ее может быть нарушение образования белков при поражении печени, неполноценном белковом питании, голодании.
Более информативными в клинической практике являются методы разделения белков на отдельные фракции или методы определения индивидуальных белков, количественные изменения которых могут иметь диагностическое значение.
Для выделения индивидуальных белков из сложной смеси часто используют растворители (спирт или ацетон), или солевые растворы, или их сочетания. При этом можно получить фракции белков, различающиеся по своей растворимости. Этот принцип лежит в основе методов высаливания, которые нашли применение для выделения белковых препаратов, используемых в дальнейшем в заместительной терапии некоторых патологических состояний. При помощи высаливания можно разделить белки плазмы на три главные группы: фибриноген, альбумин и глобулины, используя для этой цели разные концентрации сульфатов натрия или аммония и спирта или ацетона.
Для аналитических исследований большее распространение получили методы электрофореза белков плазмы на носителях или методы иммуноэлектрофореза. Существует много видов электрофореза, которые различаются по типу носителя: электрофорез на бумаге, крахмальном геле, агаровом геле, агарозе, полиакриламидном геле и т.д. В клинических лабораториях в качестве носителя широко используются полоски ацетата целлюлозы.
Для исследования пробу сыворотки наносят вблизи катода на полоску и вносят ее в прибор для электрофореза. При приложении напряжения белки начинают двигаться по величине заряда и размеров молекул (чем больше размеры, тем больше сопротивление нужно преодолевать в водном растворе) в сторону анода. После электрофореза полоски переносят в камеру для фиксации путем денатурации и окраски. Завершают исследование фотометрическим измерением окрашенных полосок и рассчитывают соотношение фракций по величине пиков кривой экстинкции. При знании общего содержания белка можно пересчитать относительное распределение в абсолютные значения. При обычно используемых методах получают пять фракций, в которых собраны белки с одинаковыми зарядами и размерами частиц: альбумины и глобулины с подфракциями α1, α2, β и γ (таб.13.2).
Клиническое значение такого метода электрофореза — выявление диспротеинемий, т.е. изменения соотношения между отдельными фракциями.
Таблица 13.2. Относительное и абсолютное содержание белков плазмы крови
Белки плазмы | Относительное содержание,% | Абсолютное содержание (при концентрации 70 г/л) |
Альбумины | 55–70 (60) | 38,5-49,0 |
α1-глобулины | 2–5 (4) | 1,4-3,5 |
α2-глобулины | 5–10 (8) | 3,5-7,0 |
β-глобулины | 10–15 (12) | 7-10,5 |
γ-глобулины | 12–20 (16) | 8,4-14,0 |
При иммуноэлектрофорезе электрофорез сочетается с последующей иммунной преципитацией. Для этого вначале белки разделяют методом электрофореза на агарозном геле, и затем электрофореграмму обрабатывают антисывороткой к белкам человека, полученной путем иммунизации кролика. При диффузии в гель антитела сыворотки взаимодействуют с белками в течение нескольких часов с образованием линий преципитации.
С помощью иммуноэлектрофореза можно обнаружить до 40 белков. Так как при обычном электрофорезе получаются фракции белков, объединенные одинаковым зарядом и размером частиц, удается обнаружить отдельные составные компоненты каждой фракции. Однако иммуноэлектрофорез дает представление только о качественном распределении, но не о количественном содержании белков сыворотки. Если нужно определить количество отдельных белков, то можно использовать специфические антитела к этому белку, которые получают иммунизацией животных(ELISA, РИА и т.д.). Преимущественно иммуноэлектрофорез используют для диагностики гемопатий или парапротеинемий.
7.4.1. Белки плазмы крови и их функциональное значение
Белковую фракцию плазмы составляет несколько десятков различных белков. Большая величина молекул дает основание относить их к коллоидам. Присутствие коллоидов в плазме обусловливает ее вязкость.
Белки плазмы различают по строению и функциональным свойствам. Их количественное и качественное определение производят специальными методами электрофореза, основанного на различной подвижности белков в электрическом поле, ультрацентрифугирования, иммуноэлектрофореза, при котором в электрическом поле передвигаются целые комплексы связанных со специфическими антителами молекул. В плазме крови человека содержится примерно 200—300 г белка. Белки плазмы делят на две основные группы: альбумины и глобулины. В глобулиновую фракцию входит фибриноген.
Альбумины. Альбумины составляют около 60% белков плазмы. Их высокая концентрация, большая подвижность при относительно небольших размерах молекулы, определяют онкотическое давление плазмы. Большая общая поверхность мелких молекул альбумина играет существенную роль в транспорте кровью различных веществ, таких как билирубин, соли тяжелых металлов жирные кислоты, фармакологические препараты (сульфаниламиды, антибиотики и др.). Известно, что, например, одна молекула альбумина может одновременно связать 25—50 молекул билирубина.
Глобулины. Эту группу белков электрофоретически, по показателям подвижности, разделяют на несколько фракций: α1—, α2—, β3— и γ—глобулины. С помощью иммуноэлектрофореза эти фракции подразделяют на мелкие субфракции более однородных белков. Так, во фракции α1—глобулинов имеются белки, простетической группой которых являются углеводы. Эти белки называются гликопротеинами. В составе гликопротеинов циркулирует около 60% всей глюкозы плазмы. Еще одна группа — мукопротеины — содержит мукополисахариды, фракцию аз составляет медьсодержащий белок церулоплазмин, в котором на каждую белковую молекулу приходится восемь атомов меди. Таким образом связывается около 90% всей содержащейся в плазме меди. В плазме имеются еще тироксинсвязывающий и другие белки.
β—глобулины. участвуют в транспорте фосфолипидов, холестерина, стероидных гормонов, металлических катионов. Они удерживают в растворе около 75% всех липидов плазмы. Металлсодержащий белок трансферрин осуществляет перенос железа кровью. Каждая молекула трансферрина несет два атома железа.
γ—глобулины характеризуются самой низкой электрофоретической подвижностью. В эту фракцию белков входят различные антитела, защищающие организм от вторжения вирусов и бактерий. Количество этой фракции возрастает при иммунизации животных. К γ—глобулинам относятся также агглютинины крови.
Фибриноген занимает промежуточное положение между фракциями β— и γ—глобулинов. Этот белок образуется в клетках печени и ретикулоэндотелиальной системы; обладает свойством становиться нерастворимым в определенных условиях (под воздействием тромбина), принимать при этом волокнистую структуру, переходя в фибрин. Содержание фибриногена в плазме крови составляет всего 0,3%, но именно его переходом в фибрин обусловливается свертывание крови и превращение ее в течение нескольких минут в плотный сгусток. Сыворотка крови по своему составу отличается от плазмы только отсутствием фибриногена.
Альбумины и фибриноген образуются в печени, глобулины в печени красном костном мозгу, селезенке, лимфатических узлах. При нормальном питании в организме человека за 1 сут вырабатывается около 17 г альбумина и
5 г глобулина. Период полураспада альбумина составляет 10—15 сут глобулина — 5 сут.
Белки плазмы вместе с электролитами являются ее функциональными элементами. С их помощью в значительной степени осуществляется транспорт веществ из крови к тканям. К числу транспортируемых компонентов относятся питательные вещества, витамины, микроэлементы, гормоны, ферменты а также конечные продукты обмена веществ.
Из питательных веществ самую большую часть составляют липиды. Их концентрация колеблется в широком диапазоне, но максимальное содержание отмечается после приема жирной пищи. На относительно постоянном уровне удерживаются переносимая плазмой глюкоза (44,4—66,6 ммоль/л) и аминокислотные остатки (4 мг%). Витамины могут переноситься либо в связанному белками, либо в свободном виде. Их уровень в плазме также подвержен колебаниям и зависит не только от их содержания в продуктах питания и синтеза кишечной флорой, но и от наличия особого фактора, облегчающего их всасывание в кишке.
Микроэлементы циркулируют в плазме в виде металлсодержащих белков (Со и др.) или белковых комплексов (Fe). Из конечных продуктов обмена наибольшей концентрации, особенно при тяжелой мышечной работе и недостатке кислорода, достигает молочная кислота. Не использованные организмом и подлежащие удалению конечные продукты обмена веществ (мочевина, мочевая кислота, билирубин, аммиак) доставляются плазмой к почкам, где и удаляются с мочой.
Белки плазмы в силу способности связывать большое число циркулирующих в плазме низкомолекулярных соединений участвуют, кроме того, в поддержании постоянства осмотического давления. Им принадлежит ведущая роль в таких процессах, как образование тканевой жидкости, лимфы, мочи, всасывание воды.
Белки плазмы крови.
Кровь состоит из плазмы и взвешенных в ней форменных элементов. Плазма составляет около 55% от объема крови. Эритроциты составляют основную массу форменных элементов – 44%.
Из 9-10% сухого остатка плазмы крови на болю белков приходится 6,5-8,5%.
Общее содержание белков составляет 60 – 80 г/л.
Для разделения белков плазмы крови используют следующие методы:
Высаливание.
Разделение белков проводят с использованием солей щелочных и щелочноземельных металлов. Наиболее часто используют сульфат аммония. Различные белки высаливаются из растворов при разных концентрациях растворов сульфата аммония: альбумины выпадают при 100% насыщении, глобулины при 50%.
При действии сульфата аммония, ацетона, спирта белки теряют гидратную оболочку, утрачивают устойчивость и выпадают в осадок.
В результате высаливания получают 2 фракции:
Альбумины – 40 – 50 г/л
Глобулины – 20 – 30 г/л
На долю фибриногена приходится – 2 – 4 г/л.
Плазма, лишенная фибриногена, называется сывороткой.
В условиях клинических лабораторий для разделения белков сыворотки крови применяют метод электрофореза.
Сыворотка – плазма, не содержащая фибриноген и др. факторы свертывания (т.е. жидкость, которая остается после формирования сгустка крови).
Высаливание.
Для высаливания применяют соли в разных концентрациях.
При малой концентрации солей осаждаются наиболее крупные, тяжелые и обладающие наименьшим зарядом частицы.
При повышенной концентрации солей выпадают все более мелкие частицы и устойчивые белковые фракции.
При использовании 33%-ного раствора (NH4)2SO4выпадают белки сыворотки крови, имеющие наибольший молекулярный вес – эйглобулины, при 50%-ной концентрации – псевдоглобулины, при 100%-ной – самые «легкие» альбумины.
Белки, осажденные сульфатом аммония, почти не денатурируются; после удаления соли из белкового осадка (диализом через целлофановую мембрану) ее растворяют и используют для различных целей.
Чтобы лишить высокомолекулярные частицы устойчивости, необходимо удалить их водные оболочки и снять электрический заряд.
При электрофорезе в поддерживающих средах имеет значение размер пор геля (молекулярно-ситовой эффект геля) и размеры молекул белка.
Электрофорез на бумаге.
Сыворотку крови наносят на бумажную полоску, смоченную буфером. Концы бумажной полосы опущены в раствор электролита, где находятся электроды источника постоянного тока. При замыкании электрической цепи белковые молекулы движутся со скоростью. Пропорциональной величине заряда. За единицу времени проходят разные расстояния, т.е. оказываются на разных участках бумажной полосы.
Электорфорез основан на передвижении заряженной частицы в электрическом поле.
Белки сыворотки крови различаются по молекулярной массе, заряду и изоэлектрической точке. На основании этих различий белки разделяются в электрическом поле.
В зависимости от условий проведения разделения различают электрофорез на бумаге, в растворе и в геле: крахмала, целлюлозы и полиакриламидном геле.
а) Электрофорез на
бумаге позволяет получить 5 белковых
фракций: 1. Альбумины. 2.  1-глобулины.
3.
1-глобулины.
3. 2-глобулины.
4.
2-глобулины.
4.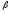 -глобулины.
5.
-глобулины.
5. -глобулины.
-глобулины.
б) Электрофорез в крахмальном геле позволяет получить 10 фракций.
в) Электрофорез в полиакриламидном геле позволяет получить до 18 фракций.
При электрофорезе в полиакриламидном геле используют пары буферных растворов с различными значениями рН и различной степени пористости гель.
Изоэлектрофокусировние – проведение электрофореза в поддерживающих средах с градиентом рН. Нахождение белка определяется его изоэлектрической точкой.
Иммунофорез представляет собой комбинацию электрического и иммунологического методов. Происходит электрофорез и реакция преципитации в одной среде.
Иммуноэлектрофорез – сочетание электрофореза в агаровом геле и иммунодиффузии. После электрофоретического разделения белков в канавку, идущую параллельно пути движения антигенов, вносят перциптирующую иммунную сыворотку. Антигены и антитела диффундируют на месте встречи дугообразные полосы преципитации.
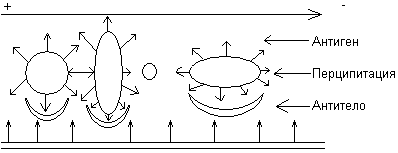
Электрофорез основан на способности белков перемещаться в электрическом поле.
Для функционирования белков сыворотки крови чаще всего используют веронал-мединаловый буфер с рН 8,6. При этом значении рН белки заряжаются отрицательно и движутся к аноду.
В связи с различием
в размерах молекул и в величине заряда
скорость движения белков самые малые
и имеющие наибольший заряд альбумины,
затем  -,
-, -,
и
-,
и -глобулины.
-глобулины.
Скорость передвижения белка в электрическом поле зависит от его электрофоретической подвижности.