Липопротеины атерогенные и антиатерогенные отличие
Перечислите и охарактеризуйте основные фракции липопротеидов, назовите атерогенные и антиатерогенные липопротеиды.
Все перечисленные жиры и жироподобные вещества (кроме свободных жирных кислот) находятся в плазме в соединении с белками в виде липопротеинов (ЛП). Они хорошо растворимы в воде и являются транспортной формой липидов в организме. ЛП представляют собой сферические частицы, отличающиеся размерами, количественным соотношением в них различных липидов и белка, а также плотностью, что позволяет разделить их на несколько классов.
Липопротеины высокой плотности (ЛПВП) — самые маленькие частицы, их плотность находится в пределах 1,063-1,210 г/мл. Хиломикроны (ХМ)— самые крупные частицы (плотность менее 0,95 г/мл). При выделении липопротеинов очень низкой и низкой плотности (ЛПОНП, ЛПНП)верхняя граница составляет соответственно 1,006 г/мл и 1,063 г/мл. Иногда еще выделяют ЛП промежуточной плотности (ЛППП) в пределах 1,006-1,019 г/мл. Обычно их относят к ЛП низкой плотности. Размеры частиц ЛПВП, ЛПНП, ЛППП, ЛПОНП и ХМ в среднем соответственно 8, 22, 27, 43, 500 нм.
По электрофоретической мобильности ЛП разделяют наальфа-липопротеины (ЛПВП), находящиеся ближе всего к аноду, пре-бета-липопротеины (ЛПОНП), бета-липопротеины (ЛПНП) и хиломикроны, которые остаются на месте старта.
Показано, что хиломикроны и ЛПОНП являются транспортными средствами для переноса триглицеридов, ЛПНП — для переноса ХС в ткани, а ЛПВП служат для обратного транспорта ХС из тканей.
Хиломикроны— самые большие частицы. Они образуются в стенке кишечника из пищевых триглицеридов. Из стенки кишечника хиломикроны по лимфатическим сосудам поступают в грудной лимфатический проток, а из последнего в ток крови. Хиломикроны содержат в своем составе до 87 % триглицеридов, около 5 % ХС, столько же фосфолипидов и немного белка (2 %). Они появляются в плазме крови вскоре после приема жирной пищи. При высоком содержании хиломикронов плазма имеет молочный вид. У здоровых людей натощак хиломикроны в плазме крови отсутствуют. Хиломикроны не обладают атерогенностью (способностью вызывать атеросклероз), так как из-за своих больших размеров они не проникают в артериальную стенку.
Пре-бета-липопротеины(ЛПОНП) — менее крупные частицы, чем хиломикроны, содержат до 60 % триглицеридов (синтезированных в печени), примерно 15 % ХС, столько же фосфолипидов и около 10 % белка. Они образуются в печени. Уровень пре-бета-липопротеинов в крови увеличен у лиц с некоторыми нарушениями липопротеинового и углеводного обмена. Наиболее мелкие частицы пре-бета-липопротеинов способны проникать в артериальную стенку. В плазме крови пре-бета-липопротеины при действии специального фермента превращаются в бета-липопротеины.
Бета-липопротеины(ЛПНП) — основной класс липопротеинов, переносящих холестерин, самые богатые ХС частицы (содержание его может доходить до 45 %) и самые атерогенные из всех липопротеинов. Диаметр этих частиц колеблется от 17 до 25 нм. Они проникают в артериальную стенку и обладают способностью в ней накапливаться. Уровень бета-липопротеинов (а одновременно и ХС) может резко повышаться при нарушениях липопротеинового обмена, особенно наследственной природы. Корреляция между высоким уровнем бета-липопротеинов справедлива не только в отношении ХС, но и апо-В. Имеются сведения, что у лиц с повышенным значением апо-В ЛПНП возрастает распространенность атеросклеротических проявлений, несмотря на относительно нормальный уровень ХС ЛПНП. Апо-В ЛПНП намного легче, чем крупные частицы ЛПНП, и потому легко проникают в артериальную стенку.
Альфа-липопротеины(ЛПВП) — самые мелкие липопротеиновые частицы, их диаметр 7-15 нм. Содержат высокий процент белка (до 55 %) и фосфолипидов (до 30 %) и соответственно небольшой процент ХС и ТГ. Синтезируются в печени. Эти частицы не только не обладают атерогенным действием, но и задерживают развитие атеросклероза. Антиатерогенное действие альфа-липопротеинов связывают со способностью этих частиц «захватывать» ХС из периферических тканей, в том числе из артериальной стенки, и транспортировать его в печень. В печени ХС частично подвергается окислению и превращению в желчные кислоты, а частично выводится с желчью в кишечник и удаляется из организма. В связи с наличием у альфа-липопротеинов антиатерогенных свойств гипер-альфа-липопротеинемия рассматривается как фактор, указывающий на устойчивость к развитию атеросклероза.
Липопротеин (а)(ЛП (а)) — образуется исключительно в печени, близок к ЛПНП, но содержит больше белка, в том числе и специфического.
У врача должны вызывать тревогу высокий уровень в крови именно ХС и ТГ, но не фосфолипидов. Последние, являясь одним из главных компонентов альфа-липопротеинов, играют защитную роль в развитии атеросклероза. Поэтому, чем выше коэффициент фосфолипиды/холестерин (в норме около 1), тем меньше вероятность развития тяжелых атеросклеротических поражений и возникновения стенокардии и инфаркта миокарда.
С клинической точки зрения, оценивая патогенетическую роль нарушенного липидного обмена в развитии атеросклероза, можно выделить ряд ведущих звеньев этого процесса. Это повышение содержания в крови больных ХС, ТГ, ЛПНП и ЛПОНП, апо-В, ЛП (а), снижение ЛПВП и апо-А. В то же время надо подчеркнуть, что нормальное или сниженное содержание ХС в крови не является абсолютным показателем отсутствия активного атеросклеротического процесса в сосудах.
Атерогенные и неатерогенные липопротеины
Богатые триглицеридами частицы – хиломикроны и крупные ЛПОНП, как пола-гают, не атерогенны, но их избыток может вызвать острый панкреатит. Что касается остатков липолиза богатых триглицеридами липопротеинов – ремнант хиломикронов и липопротеинов промежуточной плотности, то они считаются атерогенными. ЛПНП, ли-попротеины промежуточной плотности и мелкие ЛПОНП достаточно малы, и в случае химической модификации (вследствие окисления) легко задерживаются в сосудистой стенке.
ЛПНП – наиболее атерогенные липопротеины крови. Строгая, независимая прямая связь между уровнем ХС ЛПНП и риском ИБС четко установлена как у мужчин, так и у жен-щин, у лиц без признаков ИБС и больных ИБС. По расчетам, увеличение концентрации ХС ЛПНП на 1% может привести к увеличению риска ИБС на 2–3 %.
Согласно современным рекомендациям снижение концентрации ХС ЛПНП – стратегиче-ская цель профилактики ИБС и основная задача диетического и медикаментозного вмешательства при дислипидемии [8]. Помимо уровня ХС ЛПНП, на риск возникновения ИБС влияет и размер частиц ЛПНП. По данным проспективных исследований, у людей, у которых в крови преобладают мелкие, плотные частицы ЛПНП (фенотип В), риск ИБС более чем в 3 раза выше, независимо от уровня ХС ЛПНП [18].
Единое мнение об истинном значении триглицеридов в отношении увеличения риска ИБС пока отсутствует. При одномерном анализе большинства проспективных ис-следований уровень триглицеридов до 5 ммоль/л (450 мг/дл) предсказывает риск ИБС, особенно у женщин. Так, в Фрамингемском исследовании риск ИБС был тем выше, чем выше была концентрация триглицеридов. Но когда вводится поправка на другие факторы риска, особенно ЛПВП, независимый эффект триглицеридов исчезает или значительно ослабевает. Однако в последнее время стали появляться факты, свидетельствующие о не-зависимой связи концентрации триглицеридов с риском ИБС [27, 34].
Одна из главных причин, затрудняющих оценку высокого уровня триглицеридов как независимого фактора ИБС – это гетерогенность липопротеинов, богатых триглицеридами, содержащих апопротеин В. По мнению Brewer (1999), также как существует “хороший и плохой” ХС (ХС ЛПВП и ХС ЛПНП), есть два вида гипертриглицеридемии. Некоторые случаи гипертриглицеридемии ассоциируются с высоким риском ИБС, а другие – нет. Например, выраженная гипертриглицеридемия может быть за счет хиломикронов и крупных частиц ЛПОНП, однако они слишком крупные и не могут проникнуть в стенку сосуда. Синдром семейной хиломикронемии, в основе которого лежит дефицит либо липопротеинлипазы – фермента, ответственного за гидролиз триглицеридов, либо апопротеина С-II (кофактора фермента липопротеинлипазы), ассоциируется с низким риском ИБС, но повышенной вероятностью развития острого панкреатита. Также с низким риском ИБС ассоциируется гипертриглицеридемия, вызванная злоупотреблением алкоголя, приемом эстрогенов и некоторыми семейными формами гипертриглицеридемии. В отличие от крупных частиц ЛПОНП мелкие формы ЛПОНП, так же как и липопротеины промежуточной плотности, – атерогенны, и лица с гипертриглицеридемией за счет высокой концентрации мелких ЛПОНП и липопротеинов промежуточной плотности имеют высокий риск ИБС.
Тесная обратная связь между уровнем ХС ЛПВП и риском ИБС обнаружена у мужчин и женщин, у лиц без клинических проявлений атеросклероза и больных ИБС. По данным результатов 4-х больших эпидемиологических исследований (Framingam, LRS Prevention Mortality-Follow up Study, MRFIT), сделано заключение, что повышение ХС ЛПВП на 1 мг/дл (0,026 ммоль/л) сопряжено со снижением риска сердечно-сосудистых заболеваний на 1,9-2,9 % [18]. Механизм обратной взаимосвязи между ХС ЛПВП и ИБС не вполне ясен. ХС ЛПВП обычно снижен, когда уровень триглицеридов высок, и допус-кается вероятность того, что концентрация ХС ЛПВП – это лишь реципроктное отражение уровня атерогенных ЛП, таких как ЛПОНП. Не исключается возможность прямого защитного действия ЛПВП на артериальную стенку с помощью транспорта ХС из артериальной стенки в печень или ингибирования окисления ЛПНП.
Отрицательный совокупный эффект различных липидов и липопротеинов плазмы очень важен, так как сочетание гипертриглицеридемии с низким ХС ЛПВП и отношением общий ХС/ХС ЛПВП>5 связано особенно с высоким риском ИБС. Так, например, группа мужчин и женщин – участников Фрамингемского исследования с уровнем триглицеридов >150 мг/дл и уровнем ХС ЛПВП
Атерогенные и антиатерогенные липопротеины — что это такое
Достоверно оценить степень риска развития атеросклероза позволяет коэффициент атерогенности. Это понятие отражает соотношение между концентрацией полезного и вредного холестерола. Доказано, что повышение в сосудах последнего приводит к отложению атеросклеротических бляшек.
В зависимости от роли в атерогенезе липопротеиды (ЛП) бывают атерогенными и антиатерогенными. К первой группе относят ЛП низкой (ЛПНП), очень низкой (ЛПОНП) и промежуточной (ЛППП) плотности.
Вторая группа представлена единственной разновидностью – ЛПВП. Антиатерогенные свойства липопротеидам высокой плотности обеспечивает способность очищать стенки сосудов от уплотнений и более выраженное ( по сравнению с первой группой) сходство с апоЛП Е- и апоЛП В-рецепторами.

Атерогенность липопротеидов в определенной степени связана с размером самих частиц. Антиатерогенные ЛПВП являются самыми мелкими липопротеидами, поэтому они беспрепятственно проходят сквозь стенки артерий и так же свободно их покидают, не засоряя кровяное русло.
Крупные ЛП – это липопротеиды с очень низкой плотностью. Они, как и хилломикроны, в составе которых много триглицеридов, могут не обладать атерогенными свойствами, но их излишки способствуют развитию панкреатита. ЛП промежуточной плотности при окислении легко задерживаются в сосудах, поэтому их относят к атерогенным.
Повышение концентрации атерогенных липопротеинов увеличивает вероятность развития ИБС как у мужчин, так и у  женщин, независимо от склонности к заболеванию. Статистика показывает, что рост уровня ЛПНП всего лишь на один процент увеличивает вероятность развития ИБС до 3%, поэтому снижение показателей атерогенных липопротеидов является стратегической целью профилактики сердечной недостаточности и основной задачей медикаментозной и диетотерапии при дислипидемии.
женщин, независимо от склонности к заболеванию. Статистика показывает, что рост уровня ЛПНП всего лишь на один процент увеличивает вероятность развития ИБС до 3%, поэтому снижение показателей атерогенных липопротеидов является стратегической целью профилактики сердечной недостаточности и основной задачей медикаментозной и диетотерапии при дислипидемии.
Кроме концентрации ЛПНП вероятность развития ИБС увеличивает и их размер. Экспериментально установлено, что пациенты, у которых выявлены при обследовании преимущественно ЛПНП фенотипа В (мелкого и плотного вида) рискуют заболеть ИБС в 3 раза больше при любом содержании ЛПНП.
Единая концепция по поводу роли триглицерола (ТГ) в увеличении вероятности развития ИБС не выработана. Одномерный анализ многих исследований показал, что значения ТГ до 5 ммоль/л говорят о повышенном риске сердечных недугов, преимущественно – у женщин. Фрамингемский эксперимент показал, что риск развития сердечной недостаточности прямо пропорционален содержанию триглицерола.
При введении поправки на остальные факторы риска (в частности, на ЛПНП) независимое влияние ТГ значительно ослабевает или исчезает совсем. В то же время известны случаи, подтверждающие независимую связь триглицерола и риска развития ИБС.
Одна из основных причин такой неоднозначности – гетерогенность липопротеидов, богатых триглицеролом и апопротеином В. По мнению некоторых ученых, надо классифицировать 2 типа гипертриглицеридемии, так как в одном случае болезнь ассоциируют с повышенной вероятностью ИБС, а в другом такого риска нет.
Для вычисления этого важного интегрального показателя надо оценить состояние липидного обмена. При обследовании в липидограмме анализируют:
- Общий ХС;

- Триглицерол;
- ХС в составе ЛПВП;
- ХС в составе ЛПНП;
- ХС в составе ЛПОНП.
Атерогенность рассчитывают по формуле:
- Атерогенность = общий ХС – ХС из ЛПВП / ХС из ЛПВП.
Коэффициент атерогенности можно вычислить по такому алгоритму:
- КА = (ЛПНП + ЛПОНП) / ЛПВП. Норма этого показателя находится в диапазоне 2-2,5. Если выявлен коэффициент 3-4, можно думать об умеренной степени вероятности возникновения атеросклероза, при значении этого параметра 4 и выше диагностируют высокую опасность. При выраженных симптомах атеросклероза этот показатель составляет 7 и более единиц.

При повышенных значениях этого показателя кроме специальной диеты применяют медикаментозную терапию препаратами, снижающими холестерол. Лечение – комплексное, с учетом всех параметров заболевания.
Атеросклероз – патологическое состояние организма, связанное не только с изменениями в артериях, но и с нарушением метаболизма в целом.
Предпосылками развития недуга являются:
- Наследственные факторы;

- Продолжительное пребывание в стрессовой ситуации;
- Артериальная гипертония;
- Сахарный диабет;
- Избыточный вес;
- Гиподинамия;
- Курение.
Полная клиническая картина заболевания не установлена. Всемирная организация здравоохранения определяет атеросклероз как патологию, обусловленную нарушением интимы сосудов, очаговым скоплением жиров и сложных углеводов, а также синтезом соединительной ткани в очагах поражения.
Современные достижения медицины дают более детальное представление о биохимических и биофизических механизмах патогенеза этого заболевания. Доказано проникновение в интиму артерий как ЛП низкой, так и высокой плотности. В первом случае липопротеиды ЛПНП транспортируют в клетки холестерол, подвергаясь там необратимым процессам катаболизма, во втором – ХС выносится из клетки в кровь.

При формировании атеросклеротических бляшек транспортировка ЛПНП в стенки сосудов снижена, а проникающие ЛПВП в интиме блокируются. При катаболизации плотность эфиров холестерола в зоне атеросклеротической бляшки существенно увеличивается. Атероматоз значительно уменьшает возможности проникновения в интиму липопротеидов всех типов.
Сегодня коэффициент атерогенности – основной критерий, предоставляющий возможность отслеживать эффективность лечебных мер при гиперхолестеринемии. Грамотная терапия предполагает не только снижение концентрации ЛПНП, но и увеличение содержания ЛПВП, в противном случае коэффициент атерогенности будет стабильно низкий.
Если выбранная схема лечения приводит к понижению концентрации ЛП высокой плотности, то даже при снижении показателей общего холестерола и формальном повышении коэффициента атерогенности атеросклероз будет прогрессировать.
Атерогенные и антиатерогенные липопротеины — что это такое
Достоверно оценить степень риска развития атеросклероза позволяет коэффициент атерогенности. Это понятие отражает соотношение между концентрацией полезного и вредного холестерола. Доказано, что повышение в сосудах последнего приводит к отложению атеросклеротических бляшек.
В зависимости от роли в атерогенезе липопротеиды (ЛП) бывают атерогенными и антиатерогенными. К первой группе относят ЛП низкой (ЛПНП), очень низкой (ЛПОНП) и промежуточной (ЛППП) плотности.
Вторая группа представлена единственной разновидностью – ЛПВП. Антиатерогенные свойства липопротеидам высокой плотности обеспечивает способность очищать стенки сосудов от уплотнений и более выраженное ( по сравнению с первой группой) сходство с апоЛП Е- и апоЛП В-рецепторами.

Атерогенность липопротеидов в определенной степени связана с размером самих частиц. Антиатерогенные ЛПВП являются самыми мелкими липопротеидами, поэтому они беспрепятственно проходят сквозь стенки артерий и так же свободно их покидают, не засоряя кровяное русло.
Крупные ЛП – это липопротеиды с очень низкой плотностью. Они, как и хилломикроны, в составе которых много триглицеридов, могут не обладать атерогенными свойствами, но их излишки способствуют развитию панкреатита. ЛП промежуточной плотности при окислении легко задерживаются в сосудах, поэтому их относят к атерогенным.
Повышение концентрации атерогенных липопротеинов увеличивает вероятность развития ИБС как у мужчин, так и у  женщин, независимо от склонности к заболеванию. Статистика показывает, что рост уровня ЛПНП всего лишь на один процент увеличивает вероятность развития ИБС до 3%, поэтому снижение показателей атерогенных липопротеидов является стратегической целью профилактики сердечной недостаточности и основной задачей медикаментозной и диетотерапии при дислипидемии.
женщин, независимо от склонности к заболеванию. Статистика показывает, что рост уровня ЛПНП всего лишь на один процент увеличивает вероятность развития ИБС до 3%, поэтому снижение показателей атерогенных липопротеидов является стратегической целью профилактики сердечной недостаточности и основной задачей медикаментозной и диетотерапии при дислипидемии.
Кроме концентрации ЛПНП вероятность развития ИБС увеличивает и их размер. Экспериментально установлено, что пациенты, у которых выявлены при обследовании преимущественно ЛПНП фенотипа В (мелкого и плотного вида) рискуют заболеть ИБС в 3 раза больше при любом содержании ЛПНП.
Единая концепция по поводу роли триглицерола (ТГ) в увеличении вероятности развития ИБС не выработана. Одномерный анализ многих исследований показал, что значения ТГ до 5 ммоль/л говорят о повышенном риске сердечных недугов, преимущественно – у женщин. Фрамингемский эксперимент показал, что риск развития сердечной недостаточности прямо пропорционален содержанию триглицерола.
При введении поправки на остальные факторы риска (в частности, на ЛПНП) независимое влияние ТГ значительно ослабевает или исчезает совсем. В то же время известны случаи, подтверждающие независимую связь триглицерола и риска развития ИБС.
Одна из основных причин такой неоднозначности – гетерогенность липопротеидов, богатых триглицеролом и апопротеином В. По мнению некоторых ученых, надо классифицировать 2 типа гипертриглицеридемии, так как в одном случае болезнь ассоциируют с повышенной вероятностью ИБС, а в другом такого риска нет.
Для вычисления этого важного интегрального показателя надо оценить состояние липидного обмена. При обследовании в липидограмме анализируют:
- Общий ХС;

- Триглицерол;
- ХС в составе ЛПВП;
- ХС в составе ЛПНП;
- ХС в составе ЛПОНП.
Атерогенность рассчитывают по формуле:
- Атерогенность = общий ХС – ХС из ЛПВП / ХС из ЛПВП.
Коэффициент атерогенности можно вычислить по такому алгоритму:
- КА = (ЛПНП + ЛПОНП) / ЛПВП. Норма этого показателя находится в диапазоне 2-2,5. Если выявлен коэффициент 3-4, можно думать об умеренной степени вероятности возникновения атеросклероза, при значении этого параметра 4 и выше диагностируют высокую опасность. При выраженных симптомах атеросклероза этот показатель составляет 7 и более единиц.

При повышенных значениях этого показателя кроме специальной диеты применяют медикаментозную терапию препаратами, снижающими холестерол. Лечение – комплексное, с учетом всех параметров заболевания.
Атеросклероз – патологическое состояние организма, связанное не только с изменениями в артериях, но и с нарушением метаболизма в целом.
Предпосылками развития недуга являются:
- Наследственные факторы;

- Продолжительное пребывание в стрессовой ситуации;
- Артериальная гипертония;
- Сахарный диабет;
- Избыточный вес;
- Гиподинамия;
- Курение.
Полная клиническая картина заболевания не установлена. Всемирная организация здравоохранения определяет атеросклероз как патологию, обусловленную нарушением интимы сосудов, очаговым скоплением жиров и сложных углеводов, а также синтезом соединительной ткани в очагах поражения.
Современные достижения медицины дают более детальное представление о биохимических и биофизических механизмах патогенеза этого заболевания. Доказано проникновение в интиму артерий как ЛП низкой, так и высокой плотности. В первом случае липопротеиды ЛПНП транспортируют в клетки холестерол, подвергаясь там необратимым процессам катаболизма, во втором – ХС выносится из клетки в кровь.

При формировании атеросклеротических бляшек транспортировка ЛПНП в стенки сосудов снижена, а проникающие ЛПВП в интиме блокируются. При катаболизации плотность эфиров холестерола в зоне атеросклеротической бляшки существенно увеличивается. Атероматоз значительно уменьшает возможности проникновения в интиму липопротеидов всех типов.
Сегодня коэффициент атерогенности – основной критерий, предоставляющий возможность отслеживать эффективность лечебных мер при гиперхолестеринемии. Грамотная терапия предполагает не только снижение концентрации ЛПНП, но и увеличение содержания ЛПВП, в противном случае коэффициент атерогенности будет стабильно низкий.
Если выбранная схема лечения приводит к понижению концентрации ЛП высокой плотности, то даже при снижении показателей общего холестерола и формальном повышении коэффициента атерогенности атеросклероз будет прогрессировать.
Современные основы диагностики и коррекции атерогенных дислипопротеидемий | #07-08/02
Конец ХХ века ознаменовался крупными достижениями в лечении атеросклероза. Это связано в основном с успешной коррекцией дислипопротеидемий (ДЛП), которые являются патогенетическим звеном атерогенеза и одним из главных факторов риска коронарной (ишемической) болезни сердца (КБС).
В процессе атерогенеза в стенке артерий происходит накопление и отложение холестерина (ХС), что во многом определяет начальные этапы и дальнейшее развитие атеросклероза. Вместе с тем имеются веские основания полагать, что в основе данной патологии лежит не само по себе повышение уровня ХС в сыворотке (плазме) крови, то есть не «гиперхолестеринемия» как таковая. Точнее было бы сказать, что развитие заболевания определяется типом и концентрацией в крови липопротеидных частиц, транспортирующих ХС, и зависит от судьбы этих частиц в кровотоке и артериальной стенке.
Помимо ХС в состав липопротеидов входят другие липидные компоненты и аполипопротеины (апо) разных классов. Холестерин свободный и в виде эфиров и триглицериды (ТГ) являются компонентами как атерогенных, так и неатерогенных липопротеидов. Атерогенные липопротеиды низких плотностей отличаются от антиатерогенных липопротеидов высокой плотности (ЛВП) по белковому составу: основным апобелком липопротеидов низкой и очень низкой плотности (ЛНП и ЛОНП) является апо В, которого нет в ЛВП, а основным белковым компонентом ЛВП — апо А. Определение в сыворотке крови уровня апо А и апо В позволяет с высокой степенью достоверности оценить уровень липопротеидов высокой и низкой плотности; однако на практике проведение количественного измерения этих апобелков для большинства клинических лабораторий пока недоступно.
Содержание каждого класса липопротеидов с достаточной для клинической практики степенью достоверности характеризуется уровнем входящего в их состав холестерина. Известно, что ЛОНП служат основным транспортером триглицеридов, а содержание ХС ЛОНП рассчитывается по формуле
ХС ЛОНП (ммоль/л) = ТГ (ммоль/л)/2,2 или ХС ЛОНП (мг/дл) = ТГ (мг/дл)/5.
Уровень ХС ЛВП определяется в плазме или сыворотке крови после осаждения апо В-содержащих липопротеидов низких плотностей. После измерения уровней общего ХС, ТГ и ХС ЛВП (липидной триады) рассчитывают уровень ХС, входящего в состав наиболее атерогенных ЛНП по формуле Фридвальда:
ХС ЛНП = общий ХС — ТГ/2,2 — ХС ЛВП (при расчете в ммоль/л) или ХС ЛНП = общий ХС — ТГ/5 — ХС ЛВП (при расчете в мг/дл).
Липопротеиды различных классов обладают разным атерогенным потенциалом. В развитии атеросклероза большую роль играет проникновение в артериальную стенку из кровотока ЛНП, липопротеидов промежуточной плотности (ЛПП), подфракции мелких частиц липопротеидов ЛОНП. Чем выше содержание в сыворотке крови этих липопротеидов, тем выше риск атеросклероза и связанных с ним заболеваний. Подфракции крупных частиц ЛОНП и хиломикроны не проникают в артериальную стенку из-за большого размера частиц, поэтому не считаются атерогенными.
В настоящее время твердо установлено, что не только гиперхолестеринемия (повышенный уровень в крови ЛНП), но и гипертриглицеридемия, то есть повышенное содержание липопротеидов, обогащенных триглицеридами, ассоциируется с преждевременным развитием коронарного атеросклероза.
Гиперхолестеринемия и гипертриглицеридемия могут быть вторичными по отношению к ряду заболеваний (сахарный диабет, хроническая почечная недостаточность и нефротический синдром, гипотиреоз, алкоголизм и др.). ДЛП является одним из четырех основных компонентов высокоатерогенного метаболического синдрома. В этих случаях выявление и коррекция ДЛП необходимы для диагностики и лечения этих состояний.
Антиатерогенные ЛВП рассматриваются как показатель сниженного риска атеросклероза: чем ниже содержание в крови ЛВП и холестерина, входящего в их состав (ХС ЛВП), тем выше риск развития КБС. ЛВП обладают несколькими механизмами защиты от атеросклероза. В первую очередь, это участие их в обратном транспорте холестерина, когда частицы ЛВП захватывают ХС с мембран клеток, в том числе и артериальных, и транспортируют его в печень, где он превращается в желчные кислоты и выводится из организма. Эта способность ЛВП считается их основным физиологическим свойством. Кроме того, ЛВП препятствуют развитию атеросклероза благодаря своим антиоксидантным, антивоспалительным, антиагрегаторным и профибринолитическим свойствам. Низкий уровень ЛВП ассоциируется с «атерогенным» образом жизни, так как ХС ЛВП снижается при курении, ожирении, гиподинамии.
Среди практикующих врачей общепринятым стало мнение, что прогноз развития атеросклеротических заболеваний для пациента, у которого значительная доля ХС входит в состав ЛВП, отличается от прогноза для больного с таким же уровнем общего ХС, который, однако, распределен преимущественно в ЛНП, а доля ХС ЛВП низка.
В настоящее время появляется все больше информации о практических достижениях в области коррекции липидных нарушений. Это в значительной мере обусловлено созданием новых мощных гиполипидемических лекарственных препаратов, к разработке которых подталкивает понимание того, что современный крайне неблагоприятный образ жизни способствует повышению риска развития сердечно-сосудистых заболеваний (ССЗ), включая КБС. Независимо от уровня ХС увеличение массы тела способно изменять процессы метаболизма липопротеидов и приводить к потенциально атерогенным отклонениям в спектре липопротеидов. Иными словами, диагностика и коррекция ДЛП, которая основывается на понимании роли липопротеидов в атерогенезе и влияния образа жизни на их метаболизм, представляют собой намного более адекватный подход к профилактике атеросклероза, нежели лечение, нацеленное только на коррекцию уровня ХС.
Немаловажным в патогенезе атеросклероза является тот факт, что характер ДЛП оказывает мощное влияние на состояние сосудистого эндотелия: повышенное содержание ХС в ЛНП и ЛОНП вызывает нарушение ответа эндотелия на действие эндотелий-зависимых вазодилятаторов, тогда как ЛВП обладают противоположным действием. Более того, оказалось, что, если животным отменить питание, индуцирующее гиперхолестеринемию, функция эндотелия восстанавливается. Можно полагать, что и у людей гипохолестеринемическая диета будет сопровождаться коррекцией эндотелиальной дисфункции.
Каковы же механизмы, обусловливающие нарушение нормального функционирования эндотелия кровеносных сосудов при ДЛП? Для комбинированной ДЛП, то есть при увеличении концентрации как ЛНП, так и ЛОНП (общего ХС и ТГ), характерно накопление в крови мелких, плотных, модифицированных, чаще всего окисленных частиц ЛНП. Такие частицы вызывают дисфункцию эндотелия. Попадая в субэндотелиальное пространство, мелкие ЛНП подвергаются дальнейшему окислению, захватываются макрофагами и таким образом участвуют в образовании пенистых клеток, которые являются неотъемлемым компонентом атероматозной бляшки.
Химически модифицированные липопротеиды (окисленные, гликозилированные и др.) способны запускать аутоиммунный ответ. Это сопровождается формированием ЛНП-содержащих аутоиммунных комплексов, которые, в свою очередь, активируют макрофаги и повреждают эндотелиальные клетки. Кроме того, модифицированные ЛНП (и содержащие их иммунные комплексы) эффективно стимулируют выброс или секрецию моноцитами или образовавшимися из них макрофагами повышенного количества цитокинов, таких, как фактор некроза опухоли-альфа (TNF-α) и интерлейкин 1-бета (IL-1β). Патогенетический потенциал такой стимуляции в ускоренном атерогенезе огромен. Цитокины индуцируют адгезию лейкоцитов к эндотелиальным клеткам, способствуют синтезу и секреции эндотелием соединений, обладающих прокоагулянтными свойствами, а также факторов роста, способствующих пролиферации гладкомышечных клеток (ГМК).
Пролиферация ГМК считается одной из наиболее ярких характеристик развития атеросклеротического поражения. Было показано, что в условиях in vitro промежуточные продукты, образующиеся при синтезе ХС (изопреноиды), стимулируют рост и миграцию в интиму этих клеток. Поэтому лекарственные препараты, блокирующие синтез ХС на этапе образования мевалоната (ингибиторы ГМГ-КоА редуктазы), угнетают пролиферацию ГМК и таким образом могут независимо от действия на липопротеиды влиять на развитие атеросклероза и ИБС.
Модифицированные ЛНП оказывают хемотаксический эффект на моноциты, способствуя их прилипанию к эндотелию. Модифицированные ЛНП тормозят пролиферацию эндотелиальных клеток, которая представляет собой механизм восстановления поврежденного эндотелия. В противоположность этому ЛВП, наоборот, стимулируют пролиферацию эндотелия и способствуют нормализации его функций.
Имеются данные о том, что модифицированные ЛНП усиливают секрецию эндотелина-1, тормозят активность NO-синтазы и тем самым провоцируют спазмирование артерий. При повышенном уровне ХС ЛНП нарушается продукция простациклина — мощного вазодилятатора и ингибитора агрегации тромбоцитов; в то же время ЛВП усиливают его синтез и секрецию. Модифицированные ЛНП снижают активность фибринолиза, ингибируя секрецию эндотелиальными клетками тканевого активатора плазминогена (ТАП), стимулируя продукцию этими же клетками ингибитора ТАП (ИТАП-1) и усиливая таким образом тромбообразование.
Особенно атерогенной формой ЛНП является липопротеид (а) [ЛП (а)], состоящий из ЛНП и специфического апопротеина (а). Апо (а) по своей структуре в значительной мере подобен плазминогену. Предполагается, что ЛП (а), связываясь с рецепторами для плазминогена на поверхности эндотелия, конкурентно ингибирует превращение плазминогена в плазмин, что также способствует тромбообразованию.
Нарушением метаболизма липопротеидов можно объяснить ряд изменений в системе гемостаза, усугубляющих атеротромбоз. Процесс свертывания крови вызывается происходящей на клеточной поверхности активацией фактора VII, что имеет место при пищевой липидемии и усиливается при увеличении в плазме концентрации насыщенных жирных кислот. В результате активации фактора VII усиливается синтез фибриногена, индуцирующего агрегацию тромбоцитов и образование фибринового сгустка.
Таким образом, накопленные к настоящему времени фундаментальные знания о метаболизме липопротеидов служат основой как для проведения более дифференцированной диагностики атерогенных ДЛП, так и для разработки эффективных схем коррекции липидных нарушений, что позволяет достичь поставленных задач при лечении различных категорий пациентов, относящихся к группе высокого риска.
Принципиально новым подходом в коррекции ДЛП как одного из основных факторов риска КБС является оценка не только степени выраженности и типа ДЛП, но и суммарного (общего, тотального, абсолютного, глобального) риска КБС. Величина суммарного риска КБС определяется наличием и степенью выраженности всех имеющихся у конкретного человека факторов риска, что обусловлено многофакторной этиологией атеросклероза. В эпидемиологических проспективных исследованиях было показано, что частота возникновения острых эпизодов КБС (острый инфаркт миокарда смертельный или несмертельный и внезапная смерть) значительно выше при сочетании факторов риска, даже умеренно выраженных, чем при наличии одного изолированного фактора риска, даже очень высокого по уровню.
Исходя из этого, группа экспертов трех Европейских научных обществ, объединяющих специалистов в области сердечно-сосудистых заболеваний (по изучению гипертонии, атеросклероза и общества кардиологов), разработала методику коррекции факторов риска, прежде всего ГЛП и артериальной гипертонии, с использованием данных по оценке суммарного риска развития острых эпизодов (осложнений) КБС в ближайшие 10 лет.
Суммарный риск рассчитывается по прогностическим программам, составленным на основании данных проспективного наблюдения за заболеваемостью и смертностью в больших выборках населения, обследованных первично на наличие и уровень возможных факторов риска КБС. Суммарный риск рассчитывается либо по таблицам, опубликованным в зарубежной и отечественной литературе, так называемым специальным «счетчикам риска», выпускаемым рядом фармацевтических компаний, либо с помощью компьютерных программ, например подготовленной немецкими исследователями программы, созданной на основании эпидемиологического проспективного исследования программы PROCAM.
| Схема показаний к лечению гиперхолестеринемии с учетом уровня общего холестерина и суммарного коронарного риска (риска КБС) |
Тактика коррекции ДЛП строится исходя из уровня липидов (в основном общего ХС и ХС ЛНП) и из значений суммарного риска КБС каждого пациента (см. схему). При суммарном риске менее 20% предпочтительна немедикаментозная коррекция ДЛП, то есть оздоровление образа жизни по трем направлениям: гиполипидемическая диета, отказ от курения, физическая активация. При суммарном риске более 20% наряду с методами коррекции образа жизни решается вопрос о медикаментозном лечении ДЛП.
В рекомендациях европейских специалистов основными факторами высокого риска КБС считаются наличие самой КБС, возраст и пол, курение, уровень систолического артериального давления и уровень ХС сыворотки крови. Нормальным предлагается считать уровень общего ХС<5.0 ммоль/л (190 мг/дл). Среди дополнительных факторов риска, повышающих риск КБС, указываются следующие:
- наличие данных, позволяющих предположить наличие семейной формы ДЛП;
- наличие сахарного диабета, при котором риск КБС у мужчин возрастает в два раза, а у женщин — более чем в два раза;
- положительный семейный анамнез по ССЗ;
- низкий уровень антиатерогенного ХС ЛВП: ниже 1 ммоль/л (39 мг/дл) у мужчин и ниже 1,1 ммоль/л (43 мг/дл) у женщин;
- повышенный уровень ТГ — более 2,0 ммоль/л (180 мг/дл).
В настоящее время используется несколько видов медикаментозных препаратов, эффективно снижающих уровень общего ХС, в основном за счет снижения ХС ЛНП, а также снижающих ТГ и повышающих ХС ЛВП:
- статины — ингибиторы фермента ГМГ-КоА-редуктазы, ключевого фермента синтеза ХС;
- фибраты — производные фиброевой кислоты, действующие через активацию регулятора синтеза ряда белков, вовлеченных в обмен липопротеидов;
- ионообменные смолы — секвестранты жирных кислот в кишечнике;
- никотиновая кислота и ее производные, влияющие на обмен жирных кислот и липопротеидлиполиз.
Поскольку по каждому классу препаратов в отечественной и зарубежной литературе имеется громадное количество публикаций, остановимся только на характеристике нового статина — розувастатина — и на данных, касающихся применения новой формы хорошо известного статина флувастатина — лескола XL 80 мг.
Розувастатин является новым синтетическим статином, который гидрофилен, метаболизирует с участием цитохрома Р450 ЗА4, как и большинство других статинов. Розувастатин имеет довольно длительное время полужизни в плазме — 20 часов, что свидетельствует о значительном времени ингибирования ГМГ-КоА-редуктазы, близком к таковому у аторвастатина.
Надо отметить, что в сравнительном исследовании, в ходе которого назначались аторвастатин в дозе 10 мг и розувастатин в дозах 5 мг и 10 мг, последний снижал ХС ЛНП в большей степени (на 40% и 43% соответственно), чем аторвастатин (35%). Кроме того, розувастатин более эффективно повышал ХС ЛВП (на 12-13%) по сравнению с аторвастатином (не более чем на 8%) [5]. Розувастатин в комбинации с ниацином (1-2 г) снижает уровень ТГ на 34-39%, повышает ХС ЛВП на 17-24%, снижает атерогенный Лп (а) на 18-20%.
Профиль безопасности розувастатина близок к другим статинам [6]. Большие плацебо-контролируемые исследования показали, что количество побочных явлений при применении розувастатина приближалось к таковому для плацебо. Клинически значимое повышение АЛТ, превышающее верхний предел нормы (ВПН) в 3 раза, было зарегистрировано у 0,5% пациентов. Миопатии с повышением креатинкиназы (КК) выше 10-кратного ВПН отмечались у 0,2% пациентов, которые получали максимальную дозу розувастатина — 80 мг.
Синтетический статин флувастин, хорошо известный с начала 90-х годов, в последние 2-3 года привлек внимание исследователей и врачей в связи с появлением новой замедленно высвобождающейся формы — лескола XL (в Российской Федерации лескол XL зарегистрирован как лескол ЭЛ). Одна таблетка лескола XL содержит 80 мг флувастатина, находящегося в гелевом матриксе (на гидрофильной целлюлозной матрице), что обеспечивает медленное 8-часовое высвобождение препарата из таблетки и позволяет повышать однократную дозу с 80 мг до 320 мг, избегая опасных пиковых подъемов концентрации препарата в плазме крови.
Преимущества использования обычного препарата лескола в дозах 20 мг и 40 мг в день с достижением снижения уровня ХС ЛНП на 20% и 26% были обусловлены наименьшей опасностью развития миопатий и рабдомиолиза по сравнению с другими статинами. Это связано с тем, что изоформа цитохрома Р450 2С9, через которую катаболизирует флувастатин, отличается от изоформы ЗА4, через которую катаболизируют другие статины, а также фибраты, никотиновая кислота, циклоспорины и многие другие препараты, что повышает риск побочных явлений.
Для флувастатина описан целый ряд плейотропных антиатерогенных эффектов: положительное влияние на тромбообразование и фибринолиз, на воспалительные и иммунологические процессы, антиоксидантные системы, пролиферацию гладкомышечных клеток и другие реакции в атеросклеротической бляшке [7-9].
Антиатерогенное действие лескола было продемонстрировано в ангиографическом исследовании LCAS [10]. В исследование были включены 429 больных с умеренной гиперхолестеринемией и документированным ангиографическим коронарным атеросклерозом. За 2,5 года лечения лесколом (40 мг) минимальный диаметр просвета сосуда на месте стеноза сократился на 0,028 мм, тогда как в группе плацебо отмечалось более радикальное сокращение — на 0,1 мм. При этом в первой группе достоверно увеличилась перфузия миокарда, регрессировало поражений на 76% больше, а пациентов с новыми поражениями было на 41% меньше, чем в группе плацебо.
Целесообразность повышения дозы флувастатина до 80 мг подтвердили данные исследования, в ходе которого флувастатин в этой дозе с успехом применялся в течение 4 лет после операции транслюминальной ангиопластики [11]. В этом исследовании (Lescol Intervention Prevention Study, LIPS), длившемся 4 года, приняли участие 1677 пациентов. Риск развития серьезных сердечно-сосудистых осложнений в группе, получавшей 80 мг лескола, оказался на 22% ниже, чем в группе плацебо, а в группе больных сахарным диабетом — на 47% ниже. Кривые выживаемости больных без осложнений стали расходиться уже через год после начала лечения. Указанные выше клинические эффекты наблюдались при снижении ХС ЛНП на 27%, ТГ на 14% и повышении ХС ЛВП на 22%. При приеме флувастатина в дозе 80 мг отмечалась хорошая переносимость препарата. Значимого повышения активности КК или признаков миопатии не наблюдалось.
На основании данных исследований FLARE [15], LIPS [11] флувастатин в дозе 80 мг можно считать достаточно эффективным средством профилактики атеросклероза у больных КБС как до, так и после транслюминальной ангиопластики.
Что касается медленно высвобождающейся формы лескола XL в дозе 80 мг, то недавний сравнительный анализ, проведенный на 1674 больных, участвующих в трех плацебо-контролируемых исследованиях, показал: по гипохолестеринемическому эффекту она близка к таковому у обычной формы флувастатина в дозе 80 мг и превосходит показатели, характерные для обычной формы флувастатина в дозе 40 мг. При лечении лесколом ХL 80 мг уровень ХС ЛВП увеличивался на 8,7-21%, уровень ТГ снижался на 31% (при исходно высоком ТГ — более 7,8 ммоль/л). Лечение лесколом XL привело к снижению ХС ЛПНП на 38% и отношения ХС ЛНП/ХС ЛВп на 38,1%, уровня апо В на 25,3%. Толерантность лескола XL была хорошей и не отличалась от таковой у флувастатина в дозе 40 мг. Таким образом, лескол XL показал хорошую толерантность и может быть признан эффективным при гиполипидемическом лечении [12].
В целях выяснения степени безопасности новой формы лескола XL в отношении миопатии и повышения активности фермента КК был проведен анализ нескольких исследований, в ходе которых эффект препарата сравнивался с действием обычной формы флувастатина в дозе 20 мг и 40 мг, а также плацебо. Исследования проводились на большом количестве пациентов — 8951 человек [13]. При продолжительности лечения 48 недель во всех группах отмечалось примерно одинаковое увеличение активности КК, превышающее в 5 раз верхнюю границу нормы (ВГН): для лескола XL оно составило 5 на 1720 человек, то есть 0,3%, в группе плацебо этот показатель составил 0,9%. Увеличения активности КК в 10 раз выше ВГН для лескола XL не наблюдалось, для обычного флувастатина в дозе 40 мг оно составило 0,3%, 20 мг — 0,2%, для плацебо — 0,2%. Тот факт, что осложнения в виде миопатии возникают у больных чрезвычайно редко, можно объяснить высокой степенью связывания флувастатина с белками и низкой концентрацией флувастатина в системном кровотоке при использовании формы с замедленным высвобождением.
Для выяснения безопасности, толерантности и фармакокинетики новой формы флувастатина медленного высвобождения в дозе 80, 160, 320 и 640 мг в день в течение 13 дней проводилось специальное плацебо-контролируемое исследование [14] на 40 пациентах с гиперхолестеринемией. Исследование показало безопасность и хорошую толерантность лескола XL в дозах 80, 160 и 320 мг. В задачи исследования не входило установление гиполипидемической активности лескола XL в используемых дозах, однако следует отметить, что уровень ХС ЛНП в зависимости от дозы снижался на 36-59%, а уровень ТГ — на 14-29%.
Таким образом, можно заключить, что семейство эффективных липиднормализующих и антиатеросклеротических препаратов — статинов — продолжает пополняться новыми препаратами, тогда как уже имеющиеся лекарственные средства совершенствуются и становятся более безопасными. Можно не сомневаться, что эти препараты найдут свое место в профилактике и лечении заболеваний, обусловленных атеросклерозом.
Литература
1. Перова Н. В. Суммарный риск ишемической болезни сердца и показания к лечению гиперхолестеринемии (Применение Европейских рекомендаций 1994 г. к российским условиям)// Кардиология. 1996. № 3. С. 47-53.
2. Робинс С. Дж. Коррекция липидных нарушений. Основные принципы и практическое осуществление терапевтических вмешательств. М.: Медицина, 2001.
3. Lipid metabolism disorders and coronary heart disease. Primary prevention, diagnosis and therapy guidelines for general practice. Assmann G. (ed). 2nd edition. MMV Medizin Verlag, 1993.
4. Prevention of coronary heart disease in clinical practice. Recommendations of the second joint task force of European and other Societies of coronary prevention// European Heart J. 1998. 19: 11434-11503.
5. Davidson M. N. Rosuvastatin: a highly efficacious statin for the treatment of dyslipidaemia Epert onin// Invest Drugs. 2002. 11 (1): 125-132.
6. Shepherd J., Hunninghake D. Harris Setal A review of the safety profile of rosuvastatin in an international phase II/ III clinical trial programme (abstract) Intern. Symp. On Drug Affecting Lipid Metabolism (Dalm). Nye (9 — 13 September 2001).
7. Corsini A. Fluvastatin: Effects beyond cholesterol lowering J. Cardiovasc// Pharmacol Therap. 2000. 5(3): 161-175.
8. Hussein O., Rosenblat M., Sehlezinger et al. Reduced platelet aggregation after fluvastatin therapy is associated with altered platelet lipid composition and drug binding to the platelets// Br. J. Clin. Pharmacology. 1997. 44: 77-83.
9. Leonhardt W., Rurktschiee T., Meissner D. et al. Effects of fluvastatin therapy on lipids, antioxidants, oxidations of LDL and trace metals// Eur. J. Clin Pharmacology. 1997. 53: 65-59.
10. Herd J. A., Ballantine C. M., Farmer J. A. et al. Effects of fluvastatin in coronary atherosclerosis in patients with mild to moderate cholesterol atheroscleosis Study (LCAS)// Am J. Cardiol. 1997. 80: 278-286.
11. Serruys P. W. J. C., Feyter P., Maccya C. et al Prevention study (LIPS) Investigabors. Fluvastatin for prevention of cardial events following successful first percutaneaus coronary intervention. A Randomized Controlled Trial// JAMA. 2002. 217 (24): 3215-3222.
12. Ballantyne C. M., Pazzucconi F., Pintox et al. Efficacy and tolerability of fluvastatin extended — release delivery system — pooled analysis// Clinical Therapeutics. 2001. 2312: 177-190.
13. Benghozi R., Bortilini M., Jia Y. et al. Frequency of creatin kinase elevation during treatment with fluvastatin// Am J. Cardiol. 2002. 89: 231-233.
14. Sabia M., Prasad P., Smith H. T. et al. Safety, to lerability, and pharmacokinetics of an extended — release formulation of fluvastatin administered once daily to patients with primary hypercholesterolemia// J. Cardiovasc. Pharmacol. 2001. 37: 502-511.
15. Serruys P. W., Foley D. P. et al. A randomized placebo-controlled trial of fluvastatin for prevention of restenosis after successful coronary balloon angioplasty. Final results of the fluvastatin angiographic restenosis (FLARE) trial// European Heart Journal. 1999. 20: 58-69.
8. Модифицированные липопротеины
Модифицированные ЛП образуются в организме из нормально синтезированных и секретированных в кровь ЛП. Причиной их модификации могут быть выброс клетками свободных радикалов и продуктов ПОЛ, повышенная концентрация в крови, межклеточной жидкости и сосудистой стенке некоторых метаболитов (например, глюкозы), а также ферментов различного спектра действия. Важно отметить, что модифицированные ЛП образуются также и при замедлении скорости деградации нашивных ЛПНП, например: нарушение ре-
цепторного захвата ЛПНП -> снижение скорости катаболизма ЛПНП и удлинение времени их циркуляции —> воздействие метаболитов, продуктов ПОЛ и различных ферментов—>модификация (= приобретение атерогенно-сти) ЛПНП.
Возникновение концепции модифицированных ЛП относится к концу 70-х — началу 80-х годов и тесно связано с открытием специфических клеточных рецепторов к ним. Эксперименты, проведенные на обезьянах и крысах, показали, что если животным ввести внутривенно ЛПНП с блокированными лизиновыми и аргининовыми остатками, которые не распознаются апо В, Е-рецепторами, то такие химически модифицированные ЛП все равно удаляются из кровотока и во многих случаях быстрее нативных [Mahley R. Et al., 1980]. Это послужило основанием предположить, что, наряду с классическим рецепторным путем удаления ЛПНП из кровотока, должны быть и другие, одним из которых оказался так называемый скэвенджер-путь (дословно: путь уборки мусора), осуществляемый клетками РЭС. Предположение о наличии такого пути захвата и катаболизма ЛПНП было сделано М. Brown и соавт. (1979) на основании опытов, проведенных на культуре макрофагов с использованием химически модифицированных (ацетилированных) ЛПНП. Оказалось, что ацетилированные ЛПНП, почти нераспознаваемые апо-В, Е рецепторами фибробластов, активно захватывались макрофагами, причем в макрофагальных клетках происходило значительное накопление ЭХС. Последующие исследования позволили установить, что захват модифицированных ЛПВП также осуществляется при участии рецепторов, но другой природы, которые стали называть скэвенджэр-рецепторами, или ацетил-ЛПНП-рецепторами. Помимо макрофагов, скэвенд-жер-рецепторы имеют и другие клетки РЭС: звездчатые ретикулоэндотелтоци-ты (купферовские клетки печени), ретикулярные клетки селезенки и эндотели-альные клетки сосудов.
Недавно, благодаря многолетним исследованиям четырех лабораторий в США, удалось выделить в чистом виде скэвенджер-рецептор и установить его первичную структуру. Скэвенджер-рецептор представляет собой полипептидный тример. каждый мономер которого состоит из 453 ак и характеризуется высокой степенью гликозилирования. Рецептор распознает как конформацию лиганда, так и его заряд (многие химически модифицированные ЛПНП имеют избыточный отрицательный заряд благодаря блокированию положительно заряженных аминогрупп лизина, либо — присоединению дополнительных кар-боксильных групп).
Структура скэвенджер-рецептора представлена на рис. 8. Важные участки рецептора, выполняющие функцию взаимодействия с лигандом. -богатый цистеином (I) и коллаге-ноподобный (2) домены: последний по своей трехнитчатой правозакрученной спирали и аминокислотной последовательности напоминает фиброзный коллаген. Выяснилось, что и сам коллаген обладает способностью связывать перекисно-модифицированные ЛПНП. Вероятно, именно по этой причине они откладываются в богатых коллагеном тканях — сухо-жилиях. коже и развивающихся атеросклеротических поражениях.
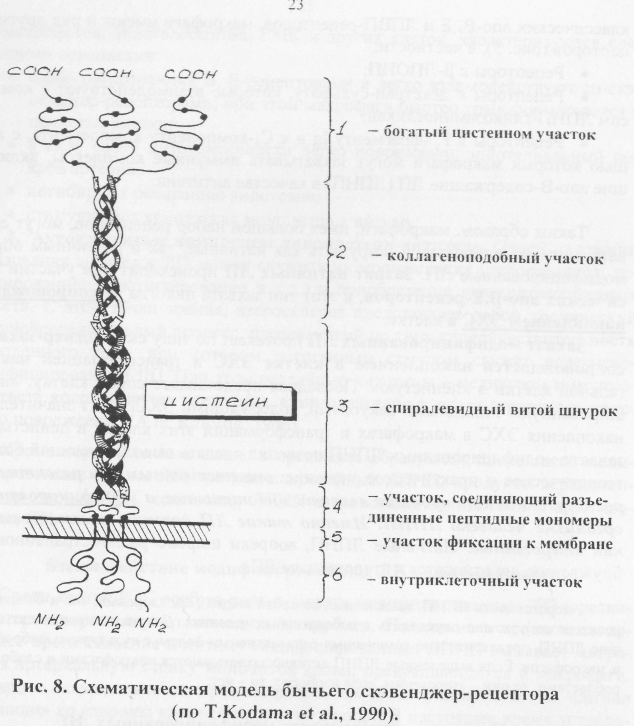
Особенность скэвенджер-захвата в том, что поступление модифицированных ЛП таким путем в клетку не регулируется или слабо регулируется по механизму отрицательной обратной связи. Содержание ХС в клетке при этом линейно нарастает в зависимости от концентрации в окружающей среде ЛП, содержащих ХС. Несмотря на то, что поступление ХС в клетку путем скэвенджер-захвата подавляет синтез собственно стерина, а также образование апо- В-Е рецепторов, это не спасает клетку от накопления в ней значительных количеств ХС, преимущественно в виде эфиров и, в меньшей степени, в виде свободного ХС и кристаллов моногидрата. С помощью скэвенджер-рецепторов осуществляется захват и других химически модифицированных ЛПНП (сукци-нилированных, ацетоацетилированных, обработанных малоновым диальдеги-дом и др.), а также ЛПНП, подвергнутых пероксидации. Помимо скэвенджер и
24
классических апо-В, Е и ЛПВП-рецепторов, макрофаги имеют и ряд других рецепторов (рис. 5), в частности:
Рецепторы к бета-ЛПОНП;
Рецепторы к декстран-сульфату, которые взаимодействуют с комплексом ЛПНП-гликозаминогликан;
Рецепторы к Fc -фрагменту Ig и к Сз-компоненту комплемента, с помощью которых макрофаги могут захватывать иммунные комплексы, включающие апо-В-содержащие ЛП (ЛПНП) в качестве антигена.
Таким образом, макрофаги, имея большой набор рецепторов, могут связывать, интернализировать и разрушать как нативные, так и различным образом модифицированные ЛП. Захват нативных ЛП происходит при участии классических апо-В,Е-рецепторов, и этот тип захвата никогда не сопровождается накоплением ЭХС в клетке.
Захват модифицированных ЛП протекает по типу скэвенджер-захвата и сопровождается накоплением в клетке ЭХС и трансформацией макрофа-гальной клетки в «пенистую». Последняя представляет собой клетку, «нафаршированную» липидными вакуолями, содержащими ЭХС. Факт значительного накопления ЭХС в макрофагах и трансформации этих клеток в пенистые при захвате модифицированных ЛПНП позволил сделать вывод, имеющий большое теоретическое и практическое значение: ответственными за развитие ате-росклеротического процесса являются не нативные, а модифицированные в организме человека ЛПНП. Именно такие ЛП должны рассматриваться как атерогенные. Нативные ЛПНП, вопреки широко распространенному заблуждению, не относятся к атерогенным ЛП.
Атерогенность ЛПНП, выделенных из крови людей (как здоровых, так и больных атеросклерозом), можно определить в лабораторных условиях. Для этого производят инкубацию ЛПНП. предварительно помеченных радиоактивным йодом, с культурами фибробластов и макрофагов. Если выделенные ЛПНП активно захватываются макрофагами и слабо — фиб-робластами. то они – атерогенны, если наоборот, го — нет.
Основные разновидности модифицированных ЛП
1. Гликозилированные ЛПНП и ЛПВП, образующиеся в больших количествах при сахарном диабете. Гликозилирование ЛПНП приводит к блокированию лизиновых остатков апо-В, что нарушает их взаимодействие с В,Е-рецепторами, замедляет их катаболизм и ведет к развитию ДЛП и гиперхолестеринемии. Гликозилирование ЛПВП, напротив, ускоряет катаболизм этих частиц и снижает тем самым их уровень в крови. Продукты превращения гликозилированных ЛП также способствуют развитию атеросклероза: повышают проницаемость эндотелия, усиливают адгезию на нем клеток крови, активируют хемотаксис моноцитов/макрофагов и пролиферацию ГМК в артериальнойстенке.
2. Перекисно-модифицированные ЛП. Перекисно-модифицированные ЛП, образовавшиеся в результате активации ПОЛ, с участием моноци-
тов/макрофагов, эндотелиоцитов, ГМК и других клеток, характеризуются следующими признаками:
слабо распознаются В, Е-рецепторами и легко взаимодействуют со скэвенджер-рецепторами; при этом макрофаги быстро трансформируются в пенистые клетки;
в силу своей цитотоксичности легко повреждают эндотелиальный покров артерий;
ингибируют репарацию эндотелия;
стимулируют хемотаксис моноцитов в интиму.
3. Аутоиммунные комплексы липопротеин-антитело. Одной из причин образования антител к ЛП может служить их модификация (пероксидация, де-сиалирование, гликозилирование и т.д.) и приобретение ими аутоантигенных свойств. С этой точки зрения, атеросклероз представляет собой хронический иммуновоспалительныи процесс, протекающий по типу гиперчувствительности замедленного типа, при котором антигенным стмулом служат перекисно-модифицированные ЛП. При этом различные цитокины — медиаторы иммунного ответа координируют клеточные взаимодействия в очаге атеросклеротиче-ского повреждения (А.Н. Климов, 1986).
Кроме перечисленных выше, в организме образуются также такие модифицированные формы ЛП, как десиалированные ЛПНП, продукты ограниченного протеолиза ЛП, комплексы ЛПНП с гликозаминогликанами и агрегированные ЛП.
Взаимодействие модифицированных ЛП с макрофагами
Среди клеток РЭС особую роль в захвате модифицированных ЛП и развитии атеросклероза играют моноциты/макрофаги. Появление в крови и последующее проникновение в интиму модифицированных ЛПНП вызывает миграцию в артериальную стенку моноцитов крови, превращающихся в макрофаги. Миграцию моноцитов можно рассматривать как своеобразный ответ на «сигнал о помощи» со стороны клеток сосудистой стенки. В настоящее время установлена природа этого «сигнала»; это — различные хемотаксические факторы, стимулирующие миграцию моноцитов. В качестве таких факторов, образующихся в сосудистой стенке, могут выступать Перекисно-модифицированные ЛПНП, тромбин, фибронектин, тромбоцитарный фактор роста, калликреин, фрагменты эластина и коллагена. Большая часть макрофагов, мигрировавшая в сосудистую стенку из крови, захватывает модифицированные ЛП, трансформируется в пенистые клетки и погибает. При этом в интиме накапливаются ЭХС и кристаллы моногидрата ХС. Очаговые скопления ХС приводят к развитию липидных пятен, а затем и атеросклеротических бляшек.
Таким образом, при ДЛП нормальная защитная функция макрофагов, направленная на захват и удаление из сосудистой стенки модифицированных (т.е., в той или иной степени, чужеродных) ЛП, превращается в реакцию, запускающую и усиливающую атеросклеротический процесс.
26
Взаимодействие модифицированных ЛП с эндотелием
По отношению к ЛП плазмы крови эндотелий выполняет следующие функции: 1) является местом действия липопротеинлипазы; 2) участвует в катаболизме ЛПНП путем их взаимодействия с апо-В, Е- и скэвенджер-рецепторами; 3) прямо или косвенно участвует в накоплении ЛП в субэндоте-лиальном пространстве (интиме) при атеросклерозе.
Несмотря на то, что эндотелиальные клетки имеют на своей мембране скэ-венджер-рецепторы и активно захватывают модифицированные ЛПНП, они никогда не накапливают в цитоплазме ЭХС и не трансформируются в подобие пенистых клеток. Вероятно, это обусловлено высокой ретроэндоцитозной активностью этих клеток, которая позволяет эффективно удалять избыток ЭХС. Кроме того, ХС из мембран эндотелиальных клеток откачивается и ЛПВП.
Однако при гиперхолестеринемии происходит заметное усиление везикулярного транспорта ЛП через эндотелиальные клетки в интиму. При этом клетки эндотелия активно захватывают как нормальные, так и модифицированные ЛПНП и путем ретроэндоцитоза выводят эти ЛП из просвета сосуда в интиму. Это сопровождается усиленным делением эндотелиальных клеток даже без повреждения целостности эндотелиального покрова. Вероятно, данная реакция эндотелия в условиях гиперхолестеринемии и связанного с ней ухудшения реологии крови — своеобразная «перестраховка» (или гиперкомпенсация) на случай возможного повреждения. Таким образом, повышение скорости пролиферации эндотелия способствует повышенному захвату делящимися клетками плазменных ЛП (нативных и модифицированных), а, следовательно, и ли-пидной инфильтрации интимы. По мере дальнейшего прегрессирования процесса происходит повреждение эндотелия, что еще больше стимулирует его ре-паративную регенерацию и связанный с ней захват различных ЛПНП.
Взаимодействие модифицированных ЛП с ГМК
Хорошо известно, что одна из характерных морфологических черт атеросклероза — пролиферация ГМК в интиме. Ряд исследователей (в частности, ав-торы моноклоиальной теории) придает этому явлению ведущее значение в развитии атеросклероза. Другие рассматривают ее как вторичную защитную реакцию в ответ на накопление в интиме ХС. В очаге атеросклеротического поражения развиваются три важнейших реакции со стороны ГМК: 1) миграция в интиму; 2) их пролиферация в интиме и 3) превращение ГМК из сократительного типа клеток в синтезирующий.
Миграция ГМК из медии в интиму происходит под влиянием хемотакси-ческих факторов, продуцируемых эндотелиальными клетками, макрофагами и фибробластами интимы. Стимуляторами выработки и секреции хемотаксиче-ских факторов для этих клеток служат модифицированные ЛП.
Пролиферация ГМК обусловлена действием различных факторов роста, в частности, тромбоцитарного фактора роста.
Мигрировавшие и пролиферирующие в интиме ГМК резко изменяют свои свойства и превращаются из нормальных клеток контрактильного типа в «ме-
27
таболически активные» или клетки «синтезирующего типа». Такие клетки способны синтезировать коллаген, эластин, гликозаминогликаны, т.е. соединительнотканный матрикс будущей атеросклеротической бляшки. Кроме того, ГМК синтезирующего типа секретируют хемотаксические факторы для моноцитов, а также свой собственный фактор роста, что значительно способствует прогрессированию атеросклеротической бляшки.
Взаимодействие нормальных ГМК и клеток синтезирующего типа с модифицированными ЛП существенно отличается. Нормальные ГМК не имеют на мембране скэвенджер-рецепторов и поэтому не способны захватывать или как-либо взаимодействовать с модифицированными ЛП.
Однако ГМК синтезирующего типа, несмотря на то, что они, как и нормальные ГМК, не имеют скэвенджер-рецепторов, способны при взаимодействии с модифицированными ЛПНП, накапливать ЭХС в цитоплазме, напоминая при микроскопии пенистые клетки.
Суммируя приведенные выше, а также и другие данные, можно представить основные клеточные механизмы развития атеросклеротического процесса в виде следующей таблицы.
Таблица 2
Молекулярно-клеточное взаимодействия в атеросклерозе
Кровь | Сосудистая стенка |
Атерогенные ЛП: Патологические и Модифицированные | Потеря атромбогенности эндотелия -> адгезия тромбоцитов Снижение секреции ЭРФ -> адгезия на эндотелии тромбоцитов и моноцитов. Секреция эндотелием моноцитарного хемотаксического фактора и фактора роста -> адгезия моноцитов, миграция и пролиферация ГМК. Повышение проницаемости эндотелиального покрова, отек субэндотелиального слоя. Некротические изменения участков эндотелия, секреция факторов роста, усиление репаративной регенерации и захвата атерогенных ЛП. Накопление липидов в макрофагах и ГМК -> пенистые клетки. Стимуляция макрофагов и лимфоцитов — секреция ци-токинов -> клеточные реакции интимы. |
Моноциты | Адгезия на эндотелии и проникновение в интиму. Связывание ЛПНП на поверхности эндотелия и проникновение их в интиму. Накопление липидов -> пенистые клетки. Выделение ферментов (коллагеназа и эластаза) -> расщепление межуточного вещества интимы. Секреция монокинов — дальнейшая адгезия моноцитов на эндотелии, рост и пролиферация ГМК и фибробластов, изменение фенотипа ГМК (превращение в клетки синтезирующего типа). |
Тромбоциты | Адгезия на эндотелии: Связывание и модификация ЛП на поверхности эндотелия. Экспрессия специфических белков. Дальнейшая адгезия тромбоцитов; стимуляция эндоцитоза -> накопление липидов в макрофагах –пенистые клетки; выделение фактора роста -> миграция и пролиферация ГМК, изменение фенотипа ГМК (превращение в клетки синтезирующего типа). |
Патогенез ранних морфологических изменений в сосудистой стенке при атеросклерозе представлен на схеме 2 (по В.А. Нагорневу, 1988 г.).
Схема 2
Избыточное отложение плазменных нативных и модифицированных ЛП в интиме артерий

Последующая модификация ЛП в интиме, пролиферация клеток, нерегулируемый захват модифицированных ЛП клетками


Трансформация клеток в пенистые клетки Разрастание соединительной ткани


Дегенерация ( разрушение пенистых клеток, лизис и фрагментация волокнистых структур)


Липидное пятно Очаговый некроз


РегрессияПрогрессирующая атеросклеротическая бляшка


Осложнение поражениеФиброзная бляшка
Липопротеиды высокой плотности как главный антиатерогенный фактор развития атеросклероза
Липопротеиды высокой плотности (ЛВП) впервые были выделены в качестве отдельного класса при анализе плазмы с помощью метода ультрацентрифугирования, что позволило в дальнейшем определить их состав [1]. В процессе изучения функциональных особенностей ЛВП было высказано предположение, что увеличение количество ЛВП может быть ассоциировано с более медленным развитием коронарной болезни сердца [2]. Данный процесс осуществляется благодаря обратному транспорту холестерина от периферических тканей к печени, тем самым обеспечивая антиатерогенную роль ЛВП. Данная концепция была высказана ещё в 60-х годах прошлого столетия, но до сих пор многие вопросы в механизме работы данного процесса остаются открытыми [3–5].
ЛВП плазмы крови представляют собой мелкие, плотные сферические липидно-белковые комплексы, содержащие около 50 % белков и 50 % липидов [6]. Если же говорить о биохимическом составе ЛВП, то можно выделить несколько структурных элементов. Основное место занимают 2 апопротеина ЛВП — апоА-I, с более высокой молекулярной массой, и апоА-II. Главная функция апоА-I состоит в том, что он выступает в роли основного структурного белка ЛВП, а также может активировать ЛХАТ. АпоА-II же, в свою очередь, менее изучен, хотя недавние исследования на трансгенных мышах позволяют предположить, что апоА-II может ингибировать преобразование частиц ЛВП печеночной липазой.
Кроме того, ЛВП содержат небольшие количества апотротеинов группы С, Е и апоА-IV, а также следовые количества белка — переносчика фосфолипидов (БПФЛ) и лецитин-холестерин-ацилтрансферазы (ЛХАТ). Эти вещества, присутствующие в очень малых количествах, играют важную роль в регуляции метаболизма ЛВП и липопротеидов.
Липопротеиды высокой плотности играют основополагающую роль в удалении из клеток холестерина. В ранних исследованиях Werb и Cohn [7] нагружали перитониальные макрофаги мышей холестерином и изучали его экскрецию. Макрофаги выделяли холестерин в течение всего времени присутствия сыворотки в культуральной среде. Также было выяснено, что гидролиз и экскреция запасов эфиров холестерина стимулировались присутствующими в культуральной среде акцепторами холестерина. В ходе проведения этого исследования было обнаружено, что определенные агенты особенно эффективно выполняют роль акцепторов холестерина, а именно: ЛВП, цельная сыворока, фракция d>1,21 г/мл, интактные эритроциты, казеин и тироглобулин. Другие же агенты, такие как липопротеины низкой плотности (ЛНП), напротив, оказались в этом плане неэффективны. Данное исследование позволило предположить, что ЛВП принимают участие в прямом гидролизе эфиров холестерина, удаляя при этом неэстерифированный холестерин из клеток. Таким образом прерывался цикл эфиров холестерина внутри макрофагов, т. е. непрерывный цикл эстерификации холестерина посредством клеточной АХАТ, за которым следует гидролиз эфиров холестерина гидролазой. Благодаря этому возможно предотвращение формирования атером в пенистых клетках, ограничивая данным образом формирование атероматозных бляшек и способствуя их регрессу.
Значительная часть информации, на основании которой описана нормальная регуляция уровня ЛВП у людей, получена в ходе исследований метаболизма [8–10]. Изменения концентрации холестерина и белков ЛВП могут ассоциироваться с изменениями синтеза или катаболизма белков ЛВП. Менее распространенным способом регуляции являются вариации синтеза апоА-I или апоА-II. В качестве примера можно привести пищевые рационы, богатые ненасыщенными жирными кислотами, которые вызывают уменьшение содержания холестерина ЛВП и апоА-I в результате снижения скорости транспорта апоА-I без каких-либо изменений фракционного катаболизма. Рацион с низким содержанием жиров снижает холестерин ЛВП вследствие уменьшения скорости транспорта аполипопротеинов ЛВП [11]. Возрастание ЛВП в результате терапии эстрогенами может быть вызвано повышением синтеза апоА-I [12, 13].
Вариации в уровне холестерина ЛВП, апоА-I и апоА-II между индивидуумами лучше всего коррелируют с различиями во фракционной скорости катаболизма (ФСК) этих аполипопротеинов, а не с различиями в скорости синтеза [10,13]. Поэтому факторы, воздействующие на катаболизм апоА-I (или холестерина ЛВП), могут играть определенную роль в регуляции уровня ЛВП. Breslow провел исследования метаболизма у большого числа лиц с широким диапазоном значений холестерина ЛВП (20–120 мг/дл). Эти исследования подтвердили четкую корреляцию между уровнем холестерина ЛВП и апоА-I и отсутствие корреляции между уровнем холестерина ЛВП и апоА-II. Была выявлена выраженная отрицательная корреляция между уровнем холестерина ЛВП и ФСК апоА-I и апоА-II (г = —0,81 и —0,76 соответственно). В отличие от этого не было выявлено взаимосвязи между уровнем холестерина ЛВП и скоростью транспорта апоА-1 и апоА-II (г = 0,06 и —0,35 соответственно). У женщин отмечена более низкая ФСК для апоА-I, чем у мужчин. Пациенты с гипоальфалипопротеидемией (низкий уровень холестерина ЛВП) также имели увеличенную ФСК для апоА-I и апоА-II по сравнению с лицами с нормальными значениями холестерина ЛВП. Эта закономерность отмечена у лиц с низким уровнем холестерина на фоне как нормо-, так и гипертриглицеридемии.
Таким образом, многие наблюдения свидетельствуют, что факторы, влияющие на катаболизм апоА-I и апоА-II, имеют большое значение в определении уровня холестерина ЛВП у людей. Поскольку уровни холестерина ЛВП и апоА-I характеризуются высокозначимой корреляцией, по данным о катаболизме невозможно установить, вызваны ли изменения холестерина ЛВП изменениями катаболизма апоА-I или наоборот. Однако некоторые соображения позволяют считать, что катаболизм апоА-I может регулироваться опосредованно, по крайней мере частично, факторами, которые влияют на обмен холестерина ЛВП.
Имеющиеся на сегодняшний день знания, касающиеся метаболической регуляции уровня холестерина ЛВП, до сих пор не дают определенной ясности и глубокого понимания факторов, регулирующих уровень триглицеридов, процесс переноса липидов, а также синтез генов апалипопротеинов. Для этого необходим молекулярный анализ транскрипционной и посттранскрипционной регуляции генов, таких как апоА-I, липопротеидлипазы, печеночной липазы, апоС-III и белка-переносчика эфиров холестерина — БПЭХ.
Механизм, посредством которого ЛВП обеспечивает защиту от атеросклероза, до сих пор неясен. Исследования на трансгенных и лишенных генов мышах помогут в его определении. Помимо стимуляции обратного транспорта холестерина и предупреждения окисленных модификаций ЛНП, в этот процесс могут быть вовлечены другие, неизвестные механизмы.
Очень нужны клинические программы вмешательств, предусматривающие изменения образа жизни у лиц с низким уровнем холестерина ЛВП или прием ими лекарственных препаратов для повышения значений холестерина. Как только появятся результаты таких вмешательств, можно будет сформулировать более рациональные терапевтические рекомендации относительно ЛВП.
Можно надеяться на создание препаратов, повышающих уровень холестерина ЛВП посредством различных механизмов. Они могут включать агенты, увеличивающие синтез апоА-I и активность липопротеинлипазы или снижающие уровень БПЭХ в плазме. Некоторые из них, вероятно, будут обладать антиатерогенным действием и найдут своё место в качестве недостающего звена в современной практике коронарной болезни сердца.
Литература:
1. Gofman JW, Lindgren F, Elliott H. et al. The role of lipids and lipoproteins in atherosclerosis. Science 1950; 111: 166–171.
2. Gofman JW, de Lalla O, Glazier F. Freeman NK, Lindgren FT, Nichols AV, Strisower EH, Tamplin AR. The serum lipoprotein transport system in health, metabolic disorders, atherosclerosis and coronary artery disease. Plasma 1954; 2: 413–484.
3. Glomset JA. The plasma lecithin: cholesterol acyltransferase reaction. J Lipid Res 1968;9: 155–167.
4. Агейкин А. В. Сравнительный анализ атеросклеротического поражения бедренной и плечевой артерий с помощью метода ИК-Фурье спектроскопии // Актуальные проблемы гуманитарных и естественных наук. 2014. № 9. С. 344–346.
5. Агейкин А. В., Пронин И. А. Диагностика заболеваний желудочно-кишечного тракта человека по выдыхаемому воздуху с помощью массива полупроводниковых газовых сенсоров // Молодой ученый. 2014. № 12 (71). С. 383–384.
6. Eisenberg S. High density lipoprotein metabolism. J Lipid Res 1984; 25:1017–1058. (5)
7. Werb Z, Cohn ZA. Cholesterol metabolism in the macrophage.Ingestion and intracellular fate of cholesterol and cholesterol esters. J Exp Med 1972;135: 21–44.
8. Blum CB, Levy RI, Eisenberg S, Hall M III, Goebel RH, Berman M. High density lipoprotein metabolism in man. J Clin Invest 1977;60:795–807.(114)
9. Rader DJ, Castro G, Zech LA, Fruchart J-C, Brewer HB Jr. In vivo metabolism of apolipoprotein A-I on high density lipoprotein particles LpA-I and LpA-L A-II. J Lipid Res 1991; 32: 1849–1859.
10. Brinton EA, Eisenberg S, Breslow JL. Human HDL cholesterol levels are determined by apoA-i fractional catabolic rate, which correlated inversely with estimates of HDL particle size. Arterioscler Thromb 1994; 14: 707–720.
11. Schaefer EJ, Foster DM, Zech LA, Lindgren FT. Brewer HB Jr. Levy RI. The effects of estrogen administration on plasma lipoprotein metabolism in premenopausal females. J Clin Endocrinol Metab 1983; 57:262–267.
12. Walsh BW, Sacks FM. Estrogen treatment raises plasma HDL concentrations by increasing HDL production. Arterioscler Thromb 1991; 11:140a.
13. Мельников В. Л., Рыбалкин С. Б., Митрофанова Н. Н., Агейкин А. В. Некоторые клинико-эпидемиологические аспекты течения атопического дерматита на территории пензенской области // Фундаментальные исследования. 2014. № 10–5. С. 936–940.
Атерогенные нарушения в системе транспорта липидов: подходы к диагностике и коррекции
Наталья Владимировна Перова
Докт. мед. наук, профессор, зав. отделом липопротеидов ГНИЦ профилактической
медицины МЗ РФ
Виктория Алексеевна Метельская
Докт. биол. наук, зав. лабораторией гормонально-клеточных взаимодействий
В процессе развития атеросклеротической бляшки происходит накопление и отложение холестерина (ХС) в интиме сосудистой стенки, что во многом определяет начальные этапы и развитие атеросклероза. Вместе с тем, известно, что ХС проникает в артериальную стенку из просвета сосуда в виде сформированных структурированных липопротеидных частиц. Развитие заболевания определяется типом и концентрацией в крови липопротеидных частиц, транспортирующих ХС, и зависит от судьбы этих частиц в кровотоке и артериальной стенке.
Атерогенные липопротеиды
Липопротеиды различных классов обладают разными атерогенными свойствами. В развитии атеросклероза большую роль играет проникновение в артериальную стенку из кровотока липопротеидов низкой и промежуточной плотности (ЛНП и ЛПП соответственно), подфракции мелких частиц липопротеидов очень низкой плотности (ЛОНП). Чем выше содержание в сыворотке крови этих липопротеидов, тем выше риск развития атеросклероза и связанных с ним заболеваний. Подфракции крупных частиц ЛОНП и хиломикроны не проникают в артериальную стенку из-за большого размера частиц, однако они могут подвергаться расщеплению и превращаться в более мелкие атерогенные частицы ЛПП и ЛНП. Помимо ХС в состав липопротеидов входят другие липидные компоненты и белки – аполипопротеины (апо). Холестерин (свободный и в виде эфиров), фосфолипиды и триглицериды (ТГ) являются компонентами как атерогенных, так и неатерогенных липопротеидов. Атерогенные липопротеиды низких плотностей отличаются от антиатерогенных липопротеидов высокой плотности (ЛВП) по белковому составу: апо В – основной транспортер ХС в клетки – является доминирующим апобелком ЛНП и ЛОНП.
Главным белковым компонентом ЛВП является апо А, способный захватывать ХС с мембран клеток и других липопротеидов. Определение уровня в сыворотке крови апо А и апо В служит хорошей оценкой уровней ЛВП и ЛНП, однако количественное измерение этих апобелков большинству клинических лабораторий пока практически недоступно.
Содержание каждого класса липопротеидов достаточно хорошо для клинической практики характеризуется уровнем входящего в их состав холестерина.
Известно, что ЛОНП служат основным транспортером синтезируемых в печени триглицеридов, а содержание ХС ЛОНП рассчитывается по формуле: в ммоль/л: ХС ЛОНП = ТГ/2,2, или в мг/дл: ХС ЛОНП = ТГ/5. Уровень ХС ЛВП определяется в плазме или сыворотке крови после осаждения ЛНП, содержащих апо В. После измерения уровней общего ХС, ТГ и ХС ЛВП (липидной триады) рассчитывают уровень ХС, входящего в состав наиболее атерогенных ЛНП, по формуле Фридвальда: в ммоль/л: ХС ЛНП = общий ХС – ТГ/2,2 – ХС ЛВП, или в мг/дл: ХС ЛНП = общий ХС – ТГ/5 – ХС ЛВП. Установлено, что не только гиперхолестеринемия (повышенный уровень в крови ХС ЛНП), но гипертриглицеридемия (т.е. повышенное содержание липопротеидов, обогащенных триглицеридами), ассоциируется с преждевременным развитием коронарного атеросклероза. Гиперхолестеринемия и гипертриглицеридемия могут быть как первичными, так и вторичными, т.е. быть проявлением ряда заболеваний (сахарный диабет, хроническая почечная недостаточность и нефротический синдром, гипотиреоз, алкоголизм и др.). В этих случаях выявление и коррекция дислипопротеидемии (ДЛП) является частью диагностики и лечения этих заболеваний.Роль ЛВП
Антиатерогенные ЛВП обладают способностью защищать организм человека от преждевременного развития атеросклероза: чем ниже содержание в крови ЛВП и холестерина, входящего в их состав (ХС ЛВП), тем выше риск развития ИБС. Предполагается несколько механизмов защитного от атеросклероза действия ЛВП. В первую очередь, ЛВП участвуют в обратном транспорте холестерина, когда частицы ЛВП захватывают ХС с мембран клеток, в том числе и артериальных, и транспортируют его в печень, где он превращается в желчные кислоты и выводится из организма. Эта способность ЛВП считается их основным физиологическим свойством. Кроме того, ЛВП препятствуют развитию атеросклероза благодаря своим антиоксидантным, противовоспалительным, антиагрегантным и профибринолитическим свойствам. Низкий уровень ЛВП может быть следствием нездорового образа жизни, так как ХС ЛВП снижается при курении, ожирении, гиподинамии.
Среди практикующих врачей уже достаточно укоренилось мнение, что прогноз развития атеросклеротических заболеваний у пациента с высоким уровнем ХС ЛВП лучше, чем прогноз для больного с таким же уровнем общего ХС, но с распределением холестерина преимущественно в ЛНП и низкой долей ХС ЛВП. Информация об улучшении течения ИБС при коррекции липидных нарушений основывается на положительных результатах профилактических программ с спользованием новых мощных гиполипидемических лекарственных препаратов.
Гиподинамия и ожирение также крайне неблагоприятны и предрасполагают к повышению риска развития сердечно-сосудистых заболеваний, включая ИБС. Ожирение, особенно абдоминального типа, способно изменять процессы метаболизма липопротеидов и приводить к потенциально атерогенным отклонениям в спектре липопротеидов. Диагностика и коррекция ДЛП, которые основываются на понимании роли различных липопротеидов в атерогенезе и влияния образа жизни на их метаболизм, представляются намного более продуктивным подходом к профилактике атеросклероза, нежели лечение, сфокусированное только на коррекции гиперхолестеринемии.Немаловажным в патогенезе атеросклероза является тот факт, что характер ДЛП оказывает мощное влияние на состояние сосудистого эндотелия: повышенное содержание ХС ЛНП и ХС ЛОНП вызывает нарушение продукции эндотелием эндотелийзависимых вазодилататоров, в первую очередь оксида азота, тогда как ЛВП обладают противоположным действием. Более того, оказалось, что после отмены питания, индуцирующего гиперхолестеринемию у животных, способность эндотелия продуцировать оксид азота восстанавливается. Можно полагать, что и у людей нормализация спектра липопротеидов плазмы будет сопровождаться восстановлением эндотелиальной функции.
Влияние химически модифицированных форм липопротеидов
Каковы же механизмы, обусловливающие нарушение нормального функционирования эндотелия кровеносных сосудов при ДЛП? Для комбинированной ДЛП, т.е. при увеличении концентрации как ЛНП, так и ЛОНП (общего ХС и ТГ), характерно накопление в крови мелких, плотных, легко подвергающихся окислению частиц ЛНП. Такие модифицированные частицы вызывают дисфункцию эндотелия. Попадая в субэндотелиальное пространство, мелкие ЛНП подвергаются дальнейшему окислению, захватываются макрофагами и, таким образом, участвуют в образовании пенистых клеток, которые являются неотъемлемым компонентом атероматозной бляшки. Химически модифицированные липопротеиды (окисленные, гликозилированные и др.) способны запускать аутоиммунные реакции. Это сопровождается формированием ЛНП-содержащих аутоиммунных комплексов, которые, в свою очередь, активируют макрофаги и повреждают эндотелиальные клетки. Кроме того, химически модифицированные ЛНП (и содержащие их иммунные комплексы) эффективно стимулируют выброс или секрецию моноцитами или образовавшимися из них макрофагами повышенных количеств провоспалительных соединений – цитокинов, включая фактор некроза опухоли альфа (TNF.) и интерлейкин-1-бета (IL-1.).
Патогенетический потенциал такой стимуляции в ускоренном атерогенезе огромен. Цитокины индуцируют прилипание лейкоцитов к эндотелиальным клеткам, они способствуют синтезу и секреции эндотелием соединений, обладающих прокоагулянтными свойствами, а также факторов роста, способствующих разрастанию (пролиферации) гладкомышечных клеток (ГМК). Пролиферация ГМК считается одной из наиболее ярких характеристик развития атеросклеротического поражения. Было показано, что в условиях in vitro промежуточные продукты, образующиеся при синтезе ХС (изопреноиды), стимулируют рост и миграцию этих клеток в интиму. Поэтому лекарственные препараты, блокирующие синтез ХС на этапе образования мевалоната (ингибиторы ключевого фермента синтеза ХС – ГМГ_КоА редуктазы), угнетают пролиферацию ГМК и, таким образом, могут влиять на развитие атеросклеротического повреждения. Модифицированные ЛНП оказывают хемотаксический эффект на моноциты, способствуя их прилипанию к эндотелию. Кроме того, они тормозят пролиферацию эндотелиальных клеток, которая является механизмом восстановления поврежденного эндотелия. В противоположность этому ЛВП стимулируют пролиферацию эндотелия и вносят позитивный вклад в нормализацию его функции.Имеются данные о том, что окисленно_модифицированные ЛНП усиливают секрецию эндотелина-1, тормозят активность NO-синтазы и, тем самым, способствуют спазмированию артерий. При повышенном уровне ХС ЛНП нарушается продукция простациклина – мощного вазодилататора и ингибитора агрегации тромбоцитов; в то же время ЛВП усиливают его синтез и секрецию. Модифицированные ЛНП снижают активность фибринолиза, ингибируя секрецию эндотелиальными клетками тканевого активатора плазминогена (ТАП) и стимулируя продукцию этими же клетками ингибитора ТАП (ИТАП_1), усиливая таким образом тромбообразование.
Особенно атерогенной формой ЛНП является липопротеид (а), состоящий из ЛНП и специфического апопротеина (а). Апопротеин (а) по своей структуре в значительной степени подобен плазминогену. Предполагается, что липопротеид (а), связываясь с рецепторами для плазминогена на поверхности эндотелия, конкурентно ингибирует превращение плазминогена в плазмин, что также способствует тромбообразованию.
Влияние системы липопротеидов на гемостаз
Нарушения метаболизма липопротеидов вызывают ряд изменений в системе гемостаза, усугубляющих атеротромбоз.
К таким изменениям прежде всего относится гиперкоагуляция с повышением уровня фибриногена и активности VII фактора свертывания крови и гипофибринолиз. При гипертриглицеридемии, в частности при пищевой липемии, на клеточной поверхности эндотелия происходит активация фактора VII, что особенно выражено при высокой концентрации в плазме крови насыщенных жирных кислот. В результате активации фактора VII усиливается синтез фибриногена, индуцирующего агрегацию тромбоцитов и образование фибринового сгустка.Оценка суммарного коронарного риска
Принципиально новым подходом в коррекции ДЛП как одного из основных факторов риска ИБС является оценка не только степени выраженности и типа ДЛП, но и суммарного (синонимы: общего, тотального, абсолютного, глобального) риска ИБС. Величина суммарного риска ИБС определяется наличием и степенью выраженности всех имеющихся у конкретного человека факторов риска, что соответствует многофакторной этиологии атеросклероза. В эпидемиологических проспективных исследованиях было показано, что частота возникновения острых эпизодов ИБС – острого инфаркта миокарда (смертельного или несмертельного) и внезапной смерти – значительно выше при сочетании факторов риска, даже умеренно выраженных, чем при наличии одного изолированного фактора риска, даже очень высокого по уровню. Исходя из этого группа экспертов трех европейских научных обществ, объединяющих специалистов в области сердечно-сосудистых заболеваний, разработала тактику коррекции факторов риска (прежде всего ДЛП и артериальной гипертонии) на основании данных по оценке суммарного риска развития острых эпизодов (осложнений) ИБС в ближайшие 10 лет.
Суммарный риск рассчитывается по прогностическим программам, составленным по данным проспективного наблюдения за заболеваемостью и смертностью в больших выборках населения, обследованных первично на наличие и уровень возможных факторов риска ИБС (первой такой выборкой было население американского города Фремингема). Суммарный риск рассчитывается по таблицам, опубликованным в зарубежной и в отечественной литературе, или по специальным счетчикам риска, выпускаемым рядом фармацевтических компаний, или по компьютерным программам. Тактика коррекции ДЛП строится исходя из уровня липидов (в основном общего ХС и ХС ЛНП) и из значений суммарного риска ИБС каждого пациента (см. схему). При суммарном риске менее 20% предпочтительна немедикаментозная коррекция ДЛП, т.е.
методами оздоровления образа жизни по трем направлениям: гиполипидемическая диета, отказ от курения, физическая активация. При суммарном риске более 20% наряду с методами коррекции образа жизни решается вопрос о медикаментозном лечении ДЛП.В рекомендациях европейских специалистов основными факторами высокого риска ИБС считаются наличие самой ИБС, возраст и пол, курение, уровень систолического артериального давления и уровень ХС сыворотки крови. Нормальным или “желательным” для достижения в результате лечения предлагается считать уровень общего ХС ниже 5 ммоль/л (190 мг/дл).
Схема показаний к лечению гиперхолестеринемии с учетом уровня общего холестерина и суммарного коронарного риска (риска ИБС).
Среди дополнительных факторов риска, повышающих риск ИБС, указываются следующие:
– наличие случаев атерогенных ДЛП в семье;
– сахарный диабет, повышающий риск вдвое у мужчин и более чем в два раза у женщин;
– положительный семейный анамнез по сердечно-сосудистым заболеваниям;
– низкий уровень антиатерогенного ХС ЛВП: ниже 1 ммоль/л (39 мг/дл) у мужчин и ниже 1,1 ммоль/л (43 мг/дл) у женщин;
– повышенный уровень ТГ более 2 ммоль/л (180 мг/дл).
Для России предпочтительна система оценки ДЛП, предложенная европейскими экспертами, поскольку расчет уровня ХС ЛНП проводится с использованием данных определения уровней общего ХС, ТГ и ХС ЛВП, а в нашей стране такое определение доступно не всем практическим лабораториям. В рекомендациях европейских экспертов подчеркивается, что для пациентов с клиническими признаками ИБС используются те же желательные уровни общего ХС, что и для лиц без ИБС, но поскольку больные ИБС имеют исходно более высокий суммарный риск острых эпизодов ИБС, то при повышенном уровне ХС более решительно назначается медикаментозная гиполипидемическая терапия. Таким образом, к настоящему времени накоплено достаточно доказательств того, что ДЛП вносят вклад в атерогенез как через нарушение транспорта липидов, так и через модификацию других, в том числе клеточных, звеньев атеротромбоза. Это дает основания ожидать, что применение терапии, направленной на коррекцию нарушений в системе липопротеидов, приведет к дальнейшим успехам в лечении заболеваний, обусловленных атеросклерозом.
Рекомендуемая литература
Friedwald W.T. et al. // Clin. Chem. 1972. V. 19. P. 499. Перова Н.В. // Кардиология. 1996. № 3. C. 47. Assmann G. et al. // Eur. Heart. J. 1998. V. 19. Suppl. A. P. A2. Prevention of coronary heart disease in clinical practice. Recommendations of the second joint task force of European and other Societies of coronary prevention // Eur. Heart J. 1998. V. 19. P. 11434. Робинс С.Дж. Коррекция липидных нарушений. Основные принципы и практическое осуществление терапевтических вмешательств. М., 2001.


