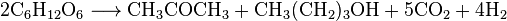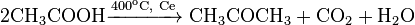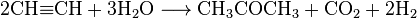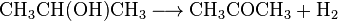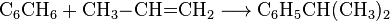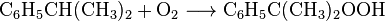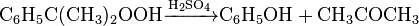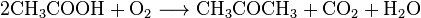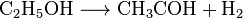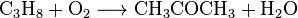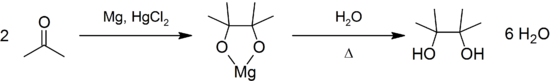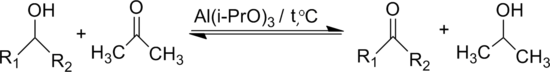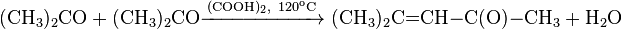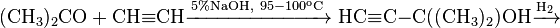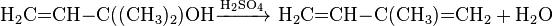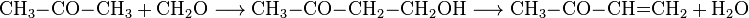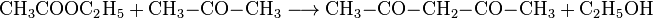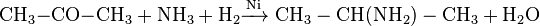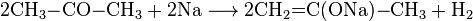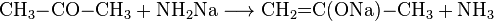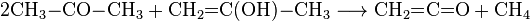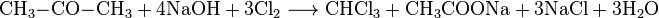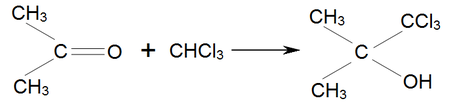В моче ацетон: причины, симптомы, лечение, норма
Одно из патологических состояний организма, когда требуется незамедлительная диагностика и дальнейшее лечение – это наличие ацетона в моче. Причины удушливого запаха урины – органические кетоновые тела. Если врач констатировал такой неприятный факт, он вправе поставить диагноз ацетонурию. При такой аномалии следы аммиака могут быть обнаружены и в крови. Все это говорит о том, что в организме произошел серьезный сбой. Согласно статистике, основные причины патологического состояния, неправильное питание и сопутствующие заболевания. Когда ацетон в моче диагностируют у женщин, как правило, это следствие губительной диеты. Если в моче присутствует ацетон, нужно срочно обращаться к врачу.
Диагностирование аммиака в кровяной среде
Аммиак в крови, так же как и в моче – признак серьезных заболеваний. В организме он трансформируется из белков, которые расщепляются в желудочно-кишечном тракте. Здоровая печень перерабатывает его в мочевину и впоследствии выводится с уриной. Когда концентрация аммиака в кровяной жидкости повышается, это говорит о том, что печень работает с недостаточной интенсивностью, то есть, перестала его перерабатывать
- цирроз;
- гепатит;
- дистрофия печени.
Также избыточное количество аммиака может быть вызвано с приемом некоторых медикаментозных средств: анальгетиков, фуросемида, барбитуратов. Симптомы аномалии достаточно ярко выражены: судороги, дрожание конечностей, головокружение, тошнота, рвота. В некоторых случаях кома, отек головного мозга. Сдавать анализы на аммиак нужно при появлении начальных признаков. Норма аммиака в кровяной жидкости для взрослых составляет 15-45мкг/дл, 11-32мкмоль/л. При патологическом состоянии может быть назначена диета и соответствующее лечение.
Запах ацетона в моче также влечет за собой ряд сложных патологий. Особенно опасно, если это касается женщин в состоянии беременности. Органические соединения, кетоновые тела могут появиться в моче у беременной вследствие особого состояния. Белковый метаболизм из-за возрастающих нагрузок будет протекать сложно, что может повлечь за собой кетонемию. Большинство женщин в состоянии беременности отмечают, что ко второй половине девятимесячного срока, проблема решается сама собой, однако, если симптомы, признаки аммиака в урине не прошли, вполне возможно развитие гестоза. У тех женщин в период беременности, у которых был диагностирован ацетон в моче, отмечалось плохое самочувствие, тошнота, рвота. Органические соединения кетоны в урине могут быть следствием чрезмерного употребления в пищу белков, жиров при минимуме углеводов. Также причины кетонов считаются: обезвоживание организма, ярко выраженная интоксикация.
Аномалия здоровья у женского пола
Анализ мочи на ацетон назначают, если у женщин, в том числе и в период беременности, выявились следующие симптомы:
- гормональные сбои;
- неправильная диета;
- заболевания печени;
- онкологические патологии;
- болезни инфекционного типа;
- период голодания.
Для женщин в состоянии беременности крайне важно вовремя принять меры, если моча пахнет ацетоном. Затягивание такого медицинского вопроса может привести к необратимым последствиям: обезвоживанию, выкидышу, интоксикации, ранним родам, коме и даже смерти. Для нормализации самочувствия требуется употреблять как можно больше жидкости, чтобы щелочной баланс в организме восстановился.
Тогда органические соединения кетоны придут в норму. Если у женщин в состоянии беременности запах аммиака в моче не исчезает, им следует пересмотреть рацион питания и отчасти ограничить себя в еде. При стационарном лечении, питание зародыша ведется посредством капельницы, которую ставят беременной. Внутривенно поступает глюкоза, витамины и другие полезные вещества. В целях выздоровления и профилактики повторных аномалий, для женщин в состоянии беременности назначается строгая диета.
Есть смысл отметить, какая норма ацетона должна быть в урине при беременности. Если у женщины со здоровьем все в порядке, лабораторные тесты не выявят содержание аммиака в моче, однако его концентрация в суточной норме урины все же присутствует 0,01-0,03гр. Индикаторные тест полоски также не покажут столь малое количество кетона. Женщина в период беременности в силах самостоятельно провести подобный анализ.
Причины ацетона в моче могут быть связаны с тем, что сахар в крови бывает повышен. Данное состояние особенно проявляется при диабете. Клеточный материал организма не получает в достаточной мере такой важный продукт как сахар, однако в крови его ощущается переизбыток. Это указывает на дефицит инсулина, вырабатываемого поджелудочной железой. При наличии патологического процесса начинается расщепление жиров, что приводит к увеличению кетона (ацетона).
О сахарном диабете
Если моча пахнет ацетоном, вполне вероятно, что повышен сахар в крови. Это может повлечь за собой диабет. Лечение патологии неразрывно связано с таким фактором как диета. Симптомы заболевания проявляются в постоянном чувстве жажды, запахе ацетона изо рта, повышенном аппетите, частом мочеиспускании. Люди, у которых повышен сахар, находятся в группе риска.
Лечение сложного заболевания длительное и предусматривает регулярный прием таблеток, в тяжелых случаях уколы инсулина. Если повышен сахар, нужно немедленно принимать меры. Здесь поможет качественная диета. Нельзя употреблять много жирной, соленой, копченой пищи.
Если сахар повышен, нужно уделять внимание спорту, исключить сидячий образ жизни. Также следует заметить, что придется вести контроль над уровнем глюкозы с помощью специального аппарата. Если повышен сахар в крови, придется отказаться от вредных привычек. Диета должна выстраиваться с учетом пола, веса, возраста. В нее нужно включить много овощей, чаи на травах, низкокалорийную пищу. В частности, стоит обратить внимание на диету №9. Когда сахар повышен, следует выявить индивидуальную непереносимость к отдельным продуктам. Лечение же сахарного диабета обязано быть согласовано с врачом. Если высокий сахар в крови, нужно употреблять витамины, сложные углеводы.
Запах ацетона у ребенка
Ацетон в моче у ребенка не всегда связан с патологией. Стрессы, переутомления вынуждают организм расщеплять собственные жировые и белковые запасы, что ведет к образованию ацетона и глюкозы. У детей это нормальное явление, что доказывает доктор Комаровский. Норма ацетона в моче у детей – его отсутствие либо мизерная толика. Однако не всегда запах ацетона – неопасен для организма. Если ощущается нехватка глюкозы, может быть соответствующий «аромат». Комаровский об ацетоне у детей имеет мнение, что высокий показатель кетона в крови диагностируется как ацетонемия. Когда ацетон в моче у ребенка – ацетонурия.
Симптомы могут свидетельствовать:
- наличие инвазий;
- кишечных инфекций;
- высокой температуры.
Комаровский также утверждает, что ацетон у детей в моче может быть при наличии соматических, эндокринных, инфекционных болезней. Аномалия встречается при недостаточной выработке инсулина и неправильном питании, когда в рационе присутствует много белков и жиров с малым количеством углеводов. Комаровский об ацетоне у детей констатирует тот факт, что резкое возбуждение сменяется вялостью, апатией. Возможны боли в животе и повышение температуры тела.
Доктор Комаровский при ацетоне у детей рекомендует специальную диету. В особых случаях требуется лечение. В целом, если показатели повышены, начать следует с питьевого режима. Рекомендовано поить детей различными питательными жидкостями, например, компотами. Комаровский утверждает, что таким образом можно повысить уровень глюкозы. Также диета подразумевает ежедневную порцию фруктозы. С ее помощью глюкоза поднимется до нужного уровня. Как утверждает Комаровский, отличным сухим фруктом является изюм. Детей следует поить таким отваром: столовую ложку сухофрукта залить кипятком и настоять четверть часа. Затем процедить. Диета также предусматривает употребление глюкозы в ампулах. Этот способ окажется полезен, если ребенок жалуется на плохое самочувствие. Рекомендована и минеральная вода без газа.
Комаровский отмечает важность того момента, что диета для детей обязана соблюдаться. В первый день ребенка нужно поить водой или компотом, но можно дать и отвар изюма. Во второй – запечённое яблоко и рисовый отвар. На третий день, как утверждает Комаровский, дать кашу на воде. Для этого подойдут: рис, гречка, овсянка. Суп из овощей с хлебцами тоже разрешен.
Аммиак — Википедия
Аммиа́к (нитрид водорода, аммониак, гидрид азота) — бинарное неорганическое химическое cоединение азота и водорода с формулой Nh4{\displaystyle {\ce {Nh4}}}, при нормальных условиях — бесцветный газ с резким характерным запахом.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн тонн.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H{\displaystyle {\ce {N-H}}}), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+{\displaystyle {\ce {Nh5^+}}}. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не даёт возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — кубические кристаллы.
- Благодаря наличию неподелённой электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда». Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»). Так, он присоединяет протон, образуя ион аммония:
- Nh4+H+⟶Nh5+{\displaystyle {\ce {Nh4 + H^+ -> Nh5^+}}}.
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
- Nh4+h3O⟶Nh5++OH−{\displaystyle {\ce {Nh4 + h3O -> Nh5^+ + OH^-}}}, Ko=1,8⋅10−5.
- Взаимодействуя с кислотами, даёт соответствующие соли аммония:
- Nh4+HNO3⟶Nh5NO3{\displaystyle {\ce {Nh4 + HNO3 -> Nh5NO3}}}.
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды, имиды и нитриды. Соединения, содержащие ионы Nh3−{\displaystyle {\ce {Nh3^-}}}, называются амидами, Nh3−{\displaystyle {\ce {NH^{2-}}}} — имидами, а N3−{\displaystyle {\ce {N^{3-}}}} — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
- 2Nh4+2K⟶2KNh3+h3{\displaystyle {\ce {2Nh4 + 2K -> 2KNh3 + h3}}}.
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы OH−{\displaystyle {\ce {OH^-}}} и Nh3−{\displaystyle {\ce {Nh3^-}}}, а также молекулы h3O{\displaystyle {\ce {h3O}}} и Nh4{\displaystyle {\ce {Nh4}}} изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
- NaNh3+h3O⟶NaOH+Nh4{\displaystyle {\ce {NaNh3 + h3O -> NaOH + Nh4}}}.
и в спиртах:
- KNh3+C2H5OH⟶C2H5OK+Nh4{\displaystyle {\ce {KNh3 + C2H5OH -> C2H5OK + Nh4}}}.
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
- KNh3⇄K++Nh3−{\displaystyle {\ce {KNh3\rightleftarrows {K^{+}}+NH_{2}^{-}}}}.
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNh3{\displaystyle {\ce {LiNh3}}} — нерастворим, NaNh3{\displaystyle {\ce {NaNh3}}} — малорастворим, KNh3{\displaystyle {\ce {KNh3}}}, RbNh3{\displaystyle {\ce {RbNh3}}} и CsNh3{\displaystyle {\ce {CsNh3}}} — хорошо растворимы.
- При нагревании аммиак разлагается, проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
- 2Nh4→1200—1300 ∘CN2+3h3{\displaystyle {\ce {2Nh4->[1200{\text{—}}1300~^{\circ }{\text{C}}]{N2}+3h3}}} (реакция обратима),
- 4Nh4+3O2⟶2N2+6h3O{\displaystyle {\ce {4Nh4 + 3O2 -> 2N2 + 6h3O}}} (без катализатора, при повышенной температуре),
- 4Nh4+5O2⟶4NO+6h3O{\displaystyle {\ce {4Nh4 + 5O2 -> 4NO + 6h3O}}} (в присутствии катализатора, при повышенной температуре).
На восстановительной способности Nh4{\displaystyle {\ce {Nh4}}} основано применение нашатыря Nh5Cl{\displaystyle {\ce {Nh5Cl}}} для очистки поверхности металла от оксидов при их пайке:
- 3CuO+2Nh5Cl⟶3Cu+3h3O+2HCl+N2{\displaystyle {\ce {3CuO + 2Nh5Cl -> 3Cu + 3h3O + 2HCl + N_2}}}.
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
- 2Nh4+NaOCl⟶N2h5+NaCl+h3O{\displaystyle {\ce {2Nh4 + NaOCl -> N2h5 + NaCl + h3O}}}.
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- Nh4+Ch4Cl⟶[Ch4Nh4]Cl{\displaystyle {\ce {Nh4 + Ch4Cl -> [Ch4Nh4]Cl}}} (гидрохлорид метиламмония).
- При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN{\displaystyle {\ce {HCN}}} и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
- 2Ch5+2Nh4+3O2⟶2HCN+6h3O{\displaystyle {\ce {2Ch5 + 2Nh4 + 3O2 -> 2HCN + 6h3O}}},
- Nh5OH⟶Nh4+h3O{\displaystyle {\ce {Nh5OH -> Nh4 + h3O}}}.
- C солями меди и с серебром образует комплексные соли-аммиакаты
- Cu(NO3)2+4Nh4⟶[Cu(Nh4)4](NO3)2{\displaystyle {\ce {Cu(NO3)2 + 4Nh4 -> [Cu(Nh4)4](NO3)2}}},
- Cu3(PO4)2+12Nh4⟶[Cu(Nh4)4]3(PO4)2{\displaystyle {\ce {Cu3(PO4)2 + 12Nh4 -> [Cu(Nh4)4]3(PO4)2}}},
- Cu(Ch4COO)2+4Nh4⟶[Cu(Nh4)4](Ch4COO)2{\displaystyle {\ce {Cu(Ch4COO)2 + 4Nh4 -> [Cu(Nh4)4](Ch4COO)2}}},
- AgNO3+2Nh4⟶[Ag(Nh4)2]NO3{\displaystyle {\ce {AgNO3 + 2Nh4 -> [Ag(Nh4)2]NO3}}}.
![{\displaystyle {\ce {AgNO3 + 2Nh4 -> [Ag(Nh4)2]NO3}}}](/800/600/https/upload.wikimedia.org/wikipedia/commons/thumb/1/1e/Ammoniak_Reaktor_BASF.jpg/220px-Ammoniak_Reaktor_BASF.jpg)
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air)[4]. Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака[5]. С того времени в мире начались исследования по получению аммиака из азота и водорода. Аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней. Проблема уменьшения запасов селитры обострилась к концу XIX века. Только в начале XX века удалось изобрести процесс синтеза аммиака, пригодный для промышленности. Это осуществил Ф. Габер, начавший трудиться над этой задачей в 1904 году и к 1909 году создавший небольшой контактный аппарат, в котором использовал повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия. 2 июля 1909 года Габер устроил испытания аппарата в присутствии К. Боша и А. Митташа, оба — от Баденского анилинового и содового завода (BASF), и получил аммиак. К. Бош к 1911 году создал крупномасштабную версию аппарата для BASF, а затем был построен и 9 сентября 1913 года вступил в строй первый в мире завод по синтезу аммиака, который был расположен в Оппау (ныне район в черте города Людвигсхафен-на-Рейне) и принадлежал BASF. В 1918 году Ф. Габер стал лауреатом Нобелевской премии по химии «за синтез аммиака из составляющих его элементов». В России и СССР первая партия синтетического аммиака была получена в 1928 году на Чернореченском химическом комбинате[6].
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке[источник не указан 130 дней], расположенному на перекрёстке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан[источник не указан 130 дней]. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак[источник не указан 130 дней].
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
- 2Nh4⟶Nh5++Nh3−{\displaystyle {\ce {2Nh4 -> Nh5^+ + Nh3^-}}}.
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg{\displaystyle {\ce {Mg}}}, Al{\displaystyle {\ce {Al}}}, а также Eu{\displaystyle {\ce {Eu}}} и Yb{\displaystyle {\ce {Yb}}}. В отличие от воды с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком Nh4{\displaystyle {\ce {Nh4}}} составляет несколько десятков процентов. В жидком аммиаке Nh4{\displaystyle {\ce {Nh4}}} также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, Na4Pb9{\displaystyle {\ce {Na4Pb9}}}.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(Nh4)6]{\displaystyle {\ce {[{\text{Э}}(Nh4)6]}}}, обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и Nh4{\displaystyle {\ce {Nh4}}}.
Растворённый в Nh4{\displaystyle {\ce {Nh4}}} металл постепенно реагирует с образованием амида:
- 2Na+2Nh4⟶2NaNh3+h3{\displaystyle {\ce {2Na + 2Nh4 -> 2NaNh3 + h3}}}.
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион Nh3−{\displaystyle {\ce {Nh3^-}}}, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li{\displaystyle {\ce {Li}}} к Cs{\displaystyle {\ce {Cs}}}. Реакция значительно ускоряется в присутствии даже небольших примесей h3O{\displaystyle {\ce {h3O}}}.
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами Nh4{\displaystyle {\ce {Nh4}}}. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
- CuSO4+4Nh4⟶[Cu(Nh4)4]SO4{\displaystyle {\ce {CuSO4 + 4Nh4 -> [Cu(Nh4)4]SO4}}}.
Чем ацетон отличается от… другого ацетона, или Не все ацетоны одинаково полезны
Когда я год назад впервые начал работать с 3D-принтером, то на этом сайте узнал, что такое ‘ABS-сок’, и как егоВ кладовке у меня на тот момент стояло две литровые бутыли с этой волшебной жидкостью — одна матовая полиэтиленовая неизвестного уже теперь производителя (потому что наклейка оторвалась и потерялась), и вторая — из прозрачного PET производства ООО ‘Экспохимтрейд’ (г.Королев Московской области). В то время (до 3D-эры) потребление ацетона в моей семье было минимальным, и обе бутыли стояли чуть початые уже несколько лет. Почему их было две — сам не помню. Возможно, когда-то срочно понадобился ацетон, и проще было сбегать в хозмаг за новой порцией, чем искать в заваленной кладовке старую. В-общем, это неважно.
Ну да ладно. Для первого приготовления ABS-сока была открыта первая бутыль — та, что из матового полиэтилена. Был произведен ‘отлив’ в малую посуду, и в нем был успешно растворен ABS. Растворение происходило почти моментально — кусочки прутка не успевали коснуться дна и расползались в стороны густым туманом. Был получен раствор нужной консистенции, который затем успешно использовался по назначению.
Всему хорошему приходит конец. Прошел почти год, и первая бутыль закончилась. Я открыл вторую (Экспохимтрейдовскую) бутыль, сделал привычный ‘отлив в мелкую тару’, накидал туда отрезков ABS-ного прутка, но… пластик растворяться не захотел. Прутки блестели глянцем, будучи погруженными в кристально прозрачную жидкость. Ни о каком растворении речи не шло. Оставил на сутки. Через сутки все же стало заметно, что прутки немного разбухли и осели на дно, потеряв упругость. Еще через день они слились в единую ‘блямбу’, покрывшую дно сосуда. И на этом всё — ‘ацетон’ (специально пишу в кавычках) даже не помутнел.
Если у кого-то прямо сейчас напросился ответ типа ‘разный ABS себя по-разному ведет’, то отвечаю со всей ответственностью — в течение всего года использовался не просто одинаковый пластик, а пластик с одной и той же катушки (ну, купил я когда-то килограмм серого ABS и печатаю из него очень мало и очень редко).
И вот теперь я не пойму, где настоящий ацетон, а где не настоящий. И чем они друг от друга отличаются? Я знаю, что химическая формула ацетона такая:
 Но у меня нет знакомой химической лаборатории, чтобы это проверить.
Но у меня нет знакомой химической лаборатории, чтобы это проверить.Единственное, что я могу — это громогласно заявить: люди, не покупайте ацетон завода ‘Экспохимтрейд’. Это неправильный ацетон.
Вот он:
 Не берите его — покупайте другой.
Не берите его — покупайте другой.Ацетон | Info-Farm.RU
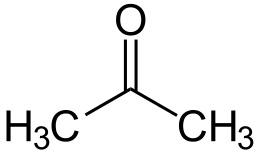
Ацетон, пропанон (от лат. Acetum — уксус) — первый представитель гомологического ряда алифатических кетонов. Формула (CH 3) 2 CO.
Общая характеристика
Бесцветная летучая жидкость с характерным запахом. Неограниченно смешивается с водой и полярными органическими растворителями, также в ограниченных пропорциях смешивается с неполярными растворителями.
Ацетон является ценным промышленным растворителем и благодаря небольшой токсичности он получил широкое применение при производстве лаков, взрывчатых веществ, лекарственных средств. Он является исходным сырьем в многочисленных химических синтезах. В лабораторной практике его применяют как полярный апротонный растворитель, для приготовления охлаждающих смесей вместе с сухим льдом и аммиаком, ацетон является очень полезным для мытья химической посуды.
Ацетон является одним из продуктов метаболизма в живых организмах, в частности, у человека. Он является одним из компонентов так называемых ацетоновых тел, которых в крови здорового человека содержится крайне мало, однако при патологических состояниях (длительное голодание, тяжелая физическая нагрузка, тяжелая форма сахарного диабета) их концентрация может значительно повышаться и достигать 20 ммоль / л (кетонемия) .
В Украине ацетон, в соответствии с Постановлением Кабинета Министров от 5 декабря 2012 N 1129 «Об утверждении перечня наркотических средств, психотропных веществ и прекурсоров», является прекурсором, по которому устанавливаются меры контроля. Кроме того таким же мерам контроля подлежат вещества, содержащие не менее 50% ацетона.
Промышленное значение
Ацетон, один из самых простых и важных кетонов, впервые обнаруженный в 1595 году немецким химиком Андреасом Либавиусом при сухой перегонке ацетата свинца. Но только в 1832 году Жан-Батист Дюма и Либих точно определили его природу и состав. К 1914 году ацетон получали почти исключительно при коксовании древесины, но повышенный спрос на него во время первой мировой войны очень быстро привел к созданию новых методов производства.
Получение
Старые методы
Старейший метод промышленного производства ацетона заключался в сухой перегонке ацетата кальция, который образуется при нейтрализации известью древесного уксуса, который образуется при коксовании древесины. Сейчас этот метод уже не применяется, поскольку ацетон в этом случае содержит слишком много примесей, а исходный материал дефицитный.
Известны также способы получения ацетона путем бактериального расщепления углеводов (крахмала, сахаров, мелассы), причем в качестве побочных продуктов образуются бутиловый или этиловый спирт. Ацетон и бутиловый спирт получают в мольном соотношении от 2: 1 до 3: 1.
В Германии был разработан технологический процесс производства ацетона на основе уксусной кислоты. При 400 ° С через контакты с церия пропускали уксусную кислоту:
Такой ацетон отличается особой чистотой.
Ацетон также производят из ацетилена прямым синтезом:
Ацетилен вступает во взаимодействие с водяным паром при 450 ° С в присутствии катализаторов (в частности оксида цинка или композита Fe 2 O 3 -ZnO).
Получение из изопропилового спирта
Одним из главных методов получения ацетона является дегидрогенизация изопропилового спирта:
Дегидрогенизация протекает при 350-400 ° С в присутствии таких катализаторов, как сплав железо-медь-цинк, оксид цинка или оксид цинка с 4,5% карбоната натрия, медь, свинец и другие. Вследствие эндотермической характера реакции процесс ведут в трубчатом реакторе, узкие длинные трубки которого обогреваются дымовыми газами. Производительность процесса возрастает при повышении давления (около 2,7-3,4 атмосферы).
Активность катализатора постепенно снижается из-за отложения на его поверхности сажи и смолистых веществ. Регенерация катализатора заключается в обжиге углеродных отложений кислородом, разбавленным инертными газами.
В последнее время все чаще ацетон получают путем окисления изопропилового спирта воздухом. При этом также образуется перекись водорода:
Этот метод играет определенную роль при производстве глицерина при отсутствии хлора. В качестве катализатора при проведении процесса применяют серебро, медь, никель, платину и другие.
В этом процессе воздух, насыщенный парами изопропилового спирта, пропускается над тонким слоем катализатора при температуре 400-650 ° C. Продукты реакции быстро охлаждают, и конденсат после нейтрализации небольших количеств уксусной кислоты дистиллированных. Выделенный технический ацетон ректификують, а непрореагировавшего изопропиловый спирт возвращают на окисление.
Реакция окисления изопропилового спирта сильно экзотермическая и ее трудно контролировать. Поэтому рекомендуется в одной реакции объединять и окисления, и дегидрогенизации, для того чтобы суммарный тепловой эффект приближался к нулю.
Метод прямого окисления пропилена
Разработана и внедрена в промышленности технология прямого синтеза ацетальдегида из этилена
может также служить для непосредственного получения ацетона из пропилена. В этом случае пропилен (или богатая пропиленом смесь газов) под действием раствора катализатора и в хлоридной кислоте превращается в ацетон. Восстановленный катализатор снова окисляется воздухом. При этом протекают следующие реакции:
Выход составляет 92-94% при 90-120 ° С и давлении 9-12 кгс / см². В качестве побочных продуктов образуются 0,5-1,5% пропионового альдегида (пропаналя) и ~ 2% моно- и дихлороацетонив. Предполагают, что реакция идет через комплекс [PdCl 2 (OH) C 3 H 6] -, который в присутствии воды гидролитически расщепляется на ацетон, палладий и хлорную кислоту. Агентами повторного окисления будут CuCl 2 или FeCl 3, а также смеси обоих соединений.
Реакцию можно проводить при комнатной температуре, но повышенные температуры ускоряют процесс. В большинстве случаев рН раствора составляет от 3 до 4. Давление также благоприятно влияет на ход реакции. Обычно работают с очень разбавленным раствором PdCl 2 (частично вместе с ацетатом меди). Использование концентрированного раствора ускоряет реакцию.
Модифицированные катализаторы акролеина применяются и при прямом окислении пропилена в ацетон. Катализаторы на основе MoO 3 или Bi 2 O 3 в присутствии H 3 PO4 илиH 3 BO 3 при 375 ° С дают рядом с ацетальдегидом, уксусной кислотой, формальдегидом, этилацетат и акролеин также и ацетон, причем положительного влияния оказывает добавление серебра. Можно использовать фосфоромолибдат висмута на Al 2 O 3 и фосфоромолибденову кислоту на SiO 2 (260 ° С, 1 с).
Кумол-гидропероксидний способ
Этот способ также является одним из основных промышленных способов получения ацетона, он на 40% дешевле метода получения ацетона с изопропилового спирта. Исходными продуктами служат бензол и пропилен.
Алкилирования бензола пропиленом осуществляют в присутствии катализатора хлорида алюминия при температуре 50 ° С. В качестве катализаторов использовали также концентрированную серную кислоту, фтороводорода, фторид бора и другие.
Окисление кумола проводится кислородом воздуха при 4-5 атмосферах и 110-120 ° С, при этом образуется гидропероксид кумола.
Гидропероксид кумола при температуре 30-60 ° С в присутствии примерно 0,1% серной кислоты разлагается на фенол и ацетон:
Другие методы
Ацетон можно получить каталитическим расписанию паров уксусной кислоты при повышенной температуре (400-450 ° С). Катализаторы — карбонат кальция или бария, оксиды кальция, алюминия, тория, урана, цинка, соли марганца и другие.
Другим известным методом является каталитическая дегидрогенизация паров этанола при температуре 450-500 ° С. Катализаторами процесса является оксид железа, активированный известь и другие.
Возможно образование ацетона при каталитическом окислении пропана кислородом воздуха при температуре 400 ° C:
Химические свойства
Ацетон обладает типичными химическими свойствами кетонов. Он тяжело окисляется, каталитически восстанавливается до изопропилового спирта. При восстановлении ацетона щелочными реагентами и особенно амальгама магния или цинка происходит конденсация и восстановления, завершаются образованием пинакон:
Ацетон окисляет вторичные спирты в кетоны в присутствии трет -бутилату алюминия (реакция Опенауера)
При использовании большого избытка ацетона реакция сдвигается вправо.
Под действием перекиси водорода на ацетон в кислой среде образуется перекись ацетона. Хромовый ангидрид окисляет ацетон до углекислого газа и воды.
Ацетон вступает в различные реакции конденсации. При альдольно конденсации происходит образование диацетонового спирта, применяют как растворитель:
При кротонов конденсации последовательно образуются оксид мезитилу, а затем Форон. Оксид мезитилу применяют для снижения летучести растворителей для лакокрасочных покрытий.
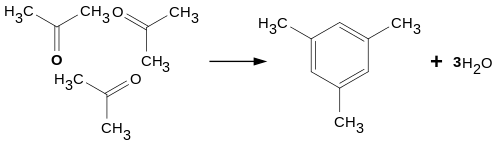
При конденсации трех молекул ацетона под действием концентрированной серной или соляной кислоты образуется симметричный триметилбензол (мезитилен):
При конденсации с ацетиленом ацетон образует диметилкарбинол, который легко превращается в изопрен:
При конденсации ацетона с формальдегидом в присутствии небольших количеств щелочей образуется ацетоспирт, который при действии йода или кислот при нагревании легко отщепляет воду, переходя в метилвинилкетон:
При конденсации уксусноэтиловый эфира с ацетоном получают ацетилацетон:
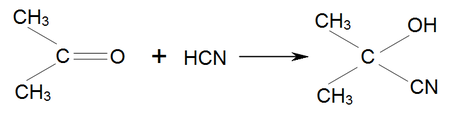
Одной из важнейших реакций ацетона является присоединение к нему синильной кислоты, в результате чего образуется ацетонциангидрин:
Ацетон реагирует с аммиаком и водородом в присутствии никеля или меди, образуя амины:
Обычно реакция проходит при температуре 125-175 ° С и давлении 5-10 атмосфер.
При воздействии на ацетон металлического натрия или амида натрия образуется ацетоннатрий — натриевый алкоголят изопропенилового спирта:
При пиролизе ацетона (500-700 ° С) над глиноземом или на раскаленной электрическим током платиновом проводе в специальном приборе — кетенний лампе, образуется самый кетен:
В присутствии щелочей ацетон легко реагирует с галоида с образованием хлороформа, йодоформа и бромоформа:
Ацетон также присоединяет хлороформ, образуя хлорэтона, который применяется как антисептик:
Ацетон также вступает с аммиаком в реакцию Манниха с образованием 2,2 ‘, 6,6’-тетраметилпиперидону-4 с приемлемыми выходами.
Применение
Ацетон — очень хороший растворитель жиров, масел, многих смол, нитролаков, сургуча, канифоли. Ацетон также растворяет целлулоид, нитро и ацетилцеллюлозу. Каучук, пек и мастичные смолы не растворяются в ацетоне.
Благодаря своей малой токсичности, хорошей растворимой способности ацетон очень широко применяется на предприятиях химической чистки.
При конденсации ацетона в щелочной среде можно получить различные продукты. При температуре 10-20 ° С в метанольного растворе ацетон димеризуеться в присутствии небольших количеств щелочи в диацетоновый спирт, из которого получают гексиленгликоль, оксид мезитилу, метилизобутилкарбинол, метилизобутилкетон, метиловый эфир гексиленгликоль.
Гексиленгликоль добавляется преимущественно к топливу. Оксид мезитилу способен вступать в различные реакции присоединения, например с метанолом в присутствии небольших количеств щелочи. Метилизобутилкетон — очень важный растворитель. Метилизобутилкетон и метилизобутилкарбинол очень хорошие растворителями для поливинилхлорида, сополимеров винилхлорида, производных целлюлозы, хлорированного каучука и других веществ. В большинстве случаев за растворимыми способностями они превосходят эфиры.
При каталитической конденсации ацетона в присутствии оснований при 200 ° С наряду с так называемыми изоциклитонамы образуется изофорон, который также является основой для различных синтезов. Сам изофорон занимает исключительное положение как растворитель виниловых лаков. Он предоставляет лакам горячей сушки блеска и прочности. При осторожном гидрировании с изофорон получают 3,3,5-триметилциклогексанон, который применяется на получение перекисей и служит растворителем. 3,3,5-триметилциклогексанол, который образуется в результате полной гидрогенизации изофорон, является важным компонентом специальных пластификаторов, особенно во взаимодействии с длинноцепочечных алифатических моно- и дикарбоновых кислотами. Но еще большее значение придают продукту его окисления азотной кислотой — α, α, γ-триметиладипиновий кислоте. Эту кислоту етерефикують в специальные пластификаторы и превращают через диметиловый эфир в 2,2,4-триметилгександиол-1, 6 путем энергичной гидрогенизации. Кроме того, кислоту можно превратить гидрогенизацией динитрила в 2,2,4-триметилгексаметилендиамин.
Другой путь получения диамина с изофорон заключается в воздействии на него синильной кислоты и образовании нитрила изофорон — 3,3,5-триметил-5-цианоциклогексанону, который при специальных условиях можно восстановить в 1-аминометил-1,3,3-триметил-5 -аминоциклогексан (изофорондиамин).
Диамины легко перевести в диизоцианата и дальше использовать как отвердители эпоксидных смол. Особенно велика их роль для изготовления прозрачных полиамидов. Полиамиды применяются для изготовления смол, связных компонентов лаков, клеев, высококачественных пластмасс.
Патофизиологический влияние
Общий характер действия
Наркотик, последовательно поражает все отделы центральной нервной системы. При вдыхании в течение длительного времени накапливается в организме. Токсический эффект зависит не только от концентрации, но и от времени действия. Медленное выделение из организма увеличивает возможности хронического отравления. Подавляет некоторые митохондриальные (окислительные) ферменты.
Влияние на животных
При остром отравлении в белых мышей боковое положение после 2-часовой экспозиции наступает при 30-40 мг / л; смерть — при 150 мг / л. В белых крыс боковое положение при 2-часовом воздействии 30 мг / л. Концентрации до 10 мг / л не оказывает влияния даже через 8:00. Первые признаки отравления установлены при 25 мг / л через 1,5-3 часа. При 50 мг / л рефлексы исчезают через 2-2,5 часа. В морских свинок и кроликов боковое положение наступало при 2-часовом воздействии 72 мг / л. Минимальные концентрации, изменяющие безумовнорефлекторну деятельность кроликов, 1,25-2,5 мг / л. У мышей, крыс, морских свинок и кроликов концентрации ацетона, вызвавшие боковое положение, приводили к увеличению содержания ацетона, ацетоуксусной и особенно β-оксимасляной кислоты в крови и моче. У кошек вдыхание 8-10 мг / л в течение 5:00 вызывает только раздражение слизистых оболочек носа и глаз, сонливость. У собак при 5-6 мг / л и экспозиции 7:00 условные рефлексы не изменяются.
При исследованиях хронического отравления белым крысам давали вдыхать 0,00053 мг / л ацетона непрерывно в течение 45 суток или 0,2 мг / л в день по 8:00. В результате не было обнаружено существенных признаков отравления. Влияние 0,019 мг / л по 4:00 в день в течение 3 недель не изменило условнорефлекторной деятельности. Животные выдерживали действие ацетона в течение 9 дней при концентрации в крови 100 мг% и не проявляли никаких признаков отравления, если не учитывать некоторой сонливости. При 250 мг% ацетона в крови — слабость и расстройство координации движений. У мышей и кроликов при ежедневных 4-часовых отравлениях концентрацией 8 мг / л в течение более 3 месяцев развивалось повышение чувствительности к ацетона с ухудшением общего состояния. По другим данным, наоборот, при вдыхании в течение 40 минут 1-2 раза в неделю растущих с 1 до 4 мг / л концентраций наблюдалось «привыкания». Содержание ацетона в крови «привыкших» животных при одной и той же концентрации в воздухе был ниже, чем у тех, которые впервые его вдыхали. У кошек повторное отравление 3-5 мг / л — вызвало лишь раздражение слизистых оболочек.
Воздействие на человека
Порог восприятия запаха составляет 0,0011 мг / л, порог действия, влечет возникновение електрокортикального условного рефлекса, 0,44 мг / л. При вдыхании 1,2 мг / л в течение 3-5 минут происходит раздражение слизистых оболочек глаз, носа и горла, а вдыхание 0,01 мг / л в течение 6:00 повышало активность холинэстеразы крови и коэффициент использования кислорода. Увеличение содержания в крови кетоновых тел происходило и при воздействии 0,001 мг / л; в моче содержание кетоновых тел не менялся.
В случае острого отравления, у пострадавшего содержание ацетона в крови на второй день достигал 18 мг% (норма 1-2 мг%). Ацетон был обнаружен также и в моче; через некоторое время в моче обнаруживали небольшое количество белка, лейкоциты и эритроциты. Уровень сахара в крови в день отравления достигал 142 мг%.
При одновременном содержании в воздухе 2,3-3 мг / л ацетона и бутанон отмечены случаи обмороков у работниц. При применении в качестве растворителя ацетона вместе с бутанон описанное отравления нескольких рабочих (недомогание, слезотечение, непродолжительная потеря сознания, сопровождавшаяся судорогами, головная боль). Массовое острое заболевание глаз у рабочих обувной фабрики (светобоязнь, слезотечение, конъюнктивит и даже расстройство зрения) было вызвано ацетонистим спиртом и зависело, очевидно, не столько от ацетона, сколько от метилового и аллилового спиртов. Аналогичные заболевания объяснялись загрязнением ацетона ацетальдегидом.
По наблюдениям в ходе исследований хронических отравлений при концентрации 0,1-0,12 мг / л ацетона в рабочих не наблюдалось никаких признаков отравления, хотя в моче он постоянно определялся; при 0,5-1 мг / л ацетон в крови не определялся в течение недели. Концентрация 5 мг / л в воздухе при ежедневном воздействии вызвала возникновение в крови до 40 мг% ацетона. При наличии ~ 0,6 мг / л ацетона в воздухе (в присутствии бутилацетата и этилового спирта) отмечались признаки отравления. Наблюдались изменения со стороны верхних дыхательных путей, чаще в форме атрофических катаров, анемия, сдвиг влево лейкоцитарной формулы, снижение аппетита. В некоторых рабочих в сыворотке крови было выявлено снижение уровня альбуминов и повышение уровня α-, β- и γ-глобулинов, а также общих липидва, без других симптомов интоксикации.
Воздействие на кожу
При погружении уши кролика в ацетон на 3:00 или при нанесении чистого ацетона на выстриженный кожу живота на 6:00 местного действия почти незаметно. При наложении компрессов из ацетона обнаружены изменения в периферической нервной системе, наиболее чувствительными оказываются мозговые нервные волокна.
Компрессы из ацетона, наложенные человеку на плечо в сутки, вызвали незначительное покраснение, которое вскоре исчезало. В рабочих на участках кожи, на которые в течение рабочего дня действовал ацетон, уменьшался pH и количество холестерина, подавлялась функция сальных желез.
Попадание в организм и поведение в нем
Жидкий ацетон может всасываться через кожу. Ацетон появляется в крови сразу после начала вдыхания его концентрация постепенно нарастает к установлению динамического равновесия. Содержание в тканях составляет следующий ряд: головной мозг → селезенка → печень → поджелудочная железа → почки → легкие → мышцы → сердце. Меченый углерод, входящий в молекулу ацетона, обнаруженный в составе гликогена, мочи, холестерина, жирных и аминокислот. Ацетон метаболизируется полнее при вдыхании невысоких концентраций. С выдыхаемым воздухом, выделяется неизмененный ацетон, а при его окислении образуется. Ацетон выделяется также через почки и кожу.
«Анализ на ацетон»
Ацетон, ацетоуксусная и бетаоксимасляна кислота, объединяются под общим названием кетоновые тела. Это продукты неполного окисления жиров и частично белков, тесно связаны между собой.
При нормальном состоянии организма кетоновые тела в общем анализе мочи отсутствуют. Следует отметить, что за сутки с мочой таки выделяется незначительное количество этих соединений, однако такие концентрации не могут быть определены обычными методами, которые применяются в лабораториях. Поэтому принято считать, что в норме в моче ацетоновых тел нет.
Кетоновые тела оказываются в общем анализе мочи при нарушении обмена углеводов и жиров. Такое нарушение сопровождается увеличением количества ацетоновых тел в тканях в крови (кетонемия). Содержание в моче ацетоновых тел называется кетонурии.
При нормальных условиях организм черпает энергию в основном из глюкозы. Глюкоза накапливается в организме, в первую очередь в печени в виде гликогена. Гликоген образует энергетический резерв, который можно быстро мобилизовать при необходимости компенсации внезапной нехватки глюкозы.
При физических и эмоциональных нагрузках, при болезнях с повышенной температурой и других повышенных затратах энергии запасы гликогена исчерпываются, организм начинает получать энергию из запасов жира. При распаде жира образуются кетоновые тела, которые выводятся с мочой. Если с ацетоновая телами в общем анализе мочи обнаруживается глюкоза, то это признак сахарного диабета. Также кетоновые тела в общем анализе мочи появляются вследствие обезвоживания организма, при резком похудении, лихорадке, голодании, тяжелых отравлениях с сильной рвотой и поносом.
Видео по теме
Изображения по теме
Аммиак реакция с кетонами — Справочник химика 21
Реакция кетонов с серой и аммиаком или аминами [c.444]Восстановление а.р-непредельных кетонов литием в жидком] аммиаке (реакция 3 схемы 1.3) является более общим методом образования специфических енолятов, так как необходимые исходные соединения легко получаются различными реакциями конденсаций (см. гл, 2), [c.14]
Аммиак реакция с альдегидами и кетонами 53 с мономами 136. [c.137]
Кетоны, за исключением циклогексанона и его производны.х,, с анилином не реагируют. Такое различие в реакционной способности и позволило разработать метод определения альдегидов в, присутствии кетонов [37]. При определении альдегидов в присутствии алифатических кетонов с температурой кипения ниже 150° С количество выделившейся при реакции воды находят, добавляя к реакционной смеси нитрид магния и определяя выделившийся при этом аммиак. Содержание кетона находят затем оксимированием, причем альдегид, связанный в шиффово Основание, не препятствует определению. [c.276]
Хотя известно [3], что третичные ацетиленовые спирты нри нагревании со щелочными агентами претерпевают распад по схеме обратной реакции Фаворского с образованием исходного кетона и ацетилена, нри нагревании диметилэтинилкарбинола в присутствии АВ-17 X 8 в ОН-форме в течение 4 час. при 60°С такой распад незначителен. Нами установлено также, что при выдерживании анионита в среде жидкого аммиака с компонентами реакции этинилирования при 40°С потери полной обменной емкости через 15 дней составляют 20—25% и зависят в основном от присутствия аммиака, а при нагревании смолы в течение 24 час. при 60 и 80°С в среде аммиака обменная емкость снижается на 12 и соответственно 18 о. Необходимо отметить, что смола поглощает определенное количество аммиака, исходного кетона и образующегося ацетиленового спирта, что может быть зафиксировано по изменению веса воздушно-сухого образца, однако количественная оценка сорбционной способности анионита по отношению к этим компонентам не проводилась. [c.162]
Как видно из формулы, образующийся таким образом триацетонамин представляет собой гетероциклическое соединение. Действие аммиака на кетоны, следовательно, скорее относится к реакциям уплотнения (конденсации), чем к реакциям присоединения. [c.161]
Восстановление альдегидов, кетонов и кпслот над катализаторами в спирты известно давно. Равным образом давно была изучена и реакция превращения спиртов в амнны под действием аммиака над другими катализаторами. Сведение обеих этих реакций в один процесс, осуществляемый над оригинальным новым катализатором, представляет несомненный интерес для техники. [c.502]
П. Амины образуются также при нагревании альдегидов или кетонов с муравьинокислым аммонием (или с аммиаком, первичными или вторичными аминами в присутствии муравьиной кислоты или ее солей) (реакция Лейкарта — Валаха ) [c.164]
Диацетил КИПИТ при 88° и обнаруживает все характерные для кетонов реакции подобно глиоксалю (стр. 318), он (а также все остальные а-дикетоны=) взаимодействует с аммиаком или аминами и альдегидами, образуя производные имидазола, например [c.320]
Ацетоуксусному эфиру свойственны реакции, характерные как для кетонов, так и для енолов. Как кетон [см. формулу (84а)] ацетоуксусный эфир реагирует с циановодородной кислотой, гидросульфитом натрия, аммиаком, гидроксиламином, фенилгидразином и мочевиной [c.240]
Реакция альдегидов и аммиака с альдегидами, кетонами или сложными эфирами (реакция Манниха) [c.415]
Оксим циклогексанона получают периодическим или непрерывным способом. В обоих случаях первой стадией является реакция кетона с сульфатом гидроксиламина (содержащим 4—5% Nh3OH) [30]. Вторая стадия заключается в нейтрализации этой смеси при добавлении водного 40%-ного раствора NaOH или нри пропускании газообразного аммиака. При этом в зависимости от температуры реакции получают кристаллический осадок оксима ( плавл = 89 90 ), который отфильтровывают от маточного раствора или при нагревании реакционной смеси по окончании оксимирования оксим отделяют декантацией в виде жидкого слоя [30]. [c.690]
Примером циклоковденсации четырех участников является синтез Д -тиазо-линов из двух молекул кетона, серы и аммиака (реакция АЗИНГЕРА) [c.415]
В настоящее время известны другие конкурирующие методы получения гидразина [26], являющиеся разновидностя.ми процесса Рашига. Они включают взаимодействие СКз и аммиака в кетонном растворе с образованием диазациклопропана этот про.межуточный продукт превращается в кетазин по катализируемой реакции с избытком кетона. Затем кетазин гидролизуют водой (при повышенном давлении) или раствором серной кислоты и получают гидразингид- [c.171]
Диметил- и диэтиламин могут быть обнаружены чувствительной цветной реакцией с фурфуролом. Реакция отличается высокой избирательностью и позволяет обнаруживать диметил(этил)-амин в присутствии первичных и третичных алкиламинов, четвертичных аммониевых оснований, аммиака, спиртов, кетонов и многих других соединений. [c.605]
Р -Метилкамфенилон (3,3,6-триметил[1,7,4]дициклогексанон-2). При пропускании окислов азота (крахмал + азотная кислота уд. в. 1,39) в раствор р-метилкамфена (20 г) в легком петролей-ном эфире при охлаждении картина реакции совершенно та же, что и при аналогичной обработке камфена [6]. Раствор окрашивается сначала в голубой цвет, затем постепенно в темно-зеленый после трехчасового пропускания окислов азота был сделан перерыв на ночь затем — новое насыщение в продолжение 3 час. На третий день продукт реакции расслоился внизу — густое желто-зеленое масло, сверху — небольшой слой петролейного эфира. По разделении слоев масло кипятилось в течение 9 час. с избытком водно-спиртового раствора едкого кали (40 г КОН,180 г воды и 15 г винного спирта) при этом наблюдалось обильное выделение аммиака. Образовавшийся кетон был отогнан затем с водяным паром и очищен через семикарбазон. [c.50]
U—185° U сопровождается выделением небольшого количества продуктов—воды, углекислого газа, аммиака и, частично, кетона, который периодически возвращают в реакщш. По мере нагревания смесь становится все более и более однородной. Когда отгонка воды практически прекратится (175
Пероксид ацетона — Википедия
| Пероксид ацетона[1] | |
|---|---|
 | |
| Изомеры | |
Общие | |
| Хим. формула | тример: C9H18O6 димер: C6H12O4 |
Физические свойства | |
| Молярная масса | |
| Плотность | тример: 1,2 г/см³ |
Термические свойства | |
| Т. плав. | тример: 92—93 ℃ димер: 133—135 ℃ |
| Т. кип. | тример: 184,93 ℃ |
| Т. всп. | тример: 51,467 ℃ |
| Давление пара | тример: 0,98 мм рт. ст. (25 °C) |
Оптические свойства | |
| Показатель преломления | тример: 1,382 |
Классификация | |
| Номер CAS | 1336-17-0 |
| PubChem | 15908632 |
| ChemSpider | 3582942 |
| Номер ООН | 3105 |
1S/C3H8O4/c1-3(2,6-4)7-5/h5-5H,1-2h4 | |
Безопасность | |
| Токсичность | токсичен. |
| Пиктограммы СГС |     |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Пероксид ацетона или перекись ацетона — инициирующее взрывчатое вещество, впервые полученное Рихардом Вольфенштейном в 1895 году[2][3].
Первые эксперименты по получению пероксидов ацетона были проведены Вольфенштейном в 1895 году, когда он изучал действие пероксида водорода на кониин в ацетоновом растворе, полагая, что ацетон и пероксид водорода не взаимодействуют. Вольфенштейн обнаружил, что из смеси равных объёмов ацетона и 10%-го пероксида водорода выпадают кристаллы, которые он охарактеризовал как тримерный пероксид ацетона (триперекись ацетона 2). Также он заметил, что реакция происходит быстрее при добавлении малых количеств фосфорной кислоты[4].
В 1899 году Адольф Байер и Виктор Виллигер синтезировали также димерный пероксид ацетона (диперекись ацетона 1). В 1933 году Лекок наблюдал процесс деполимеризации трипероксида ацетона при определении его молекулярной массы методом криоскопии, а также при плавлении. В 1947 году изучалось влияние кислот на образование пероксидов ацетона, в частности, было замечено, что серная, соляная, фосфорная и азотная кислоты значительно ускоряют окисление ацетона пероксидом водорода, а в присутствии органических кислот (уксусной, бензойной) образования продукта не происходит[4].
К настоящему времени получены пероксиды ацетона четырёх структур[5].
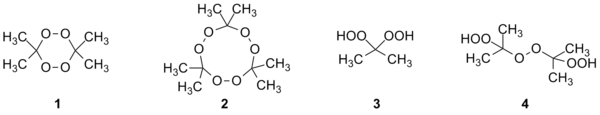
Димерный пероксид ацетона (диперекись ацетона, 1) получают с выходом 94 % при обработке ацетона 86%-ным пероксидом водорода в ацетонитриле в присутствии серной кислоты при пониженной температуре. Другим способом синтеза диперекиси ацетона является реакция ацетона с персульфатом калия в разбавленной серной кислоте. Тримерный пероксид ацетона (триперекись ацетона, 2) образуется в данных реакциях как примесь. Для препаративного получения данного продукта применяют реакцию ацетона с эквивалентным количеством 50%-ной перекиси водорода и 0,25 эквивалентами серной кислоты. Триперекись ацетона можно очистить низкотемпературной перекристаллизацией из пентана[5]. При этом она кристаллизуется в виде длинных плоских призмовидных кристаллов[4].
Пероксиды 3 и 4 могут быть получены в данных реакциях при отсутствии минеральной кислоты. Например, смесь ацетона и 50%-ной перекиси водорода при перемешивании в течение трёх часов при 0 °С даёт исключительно 2,2-бис(гидроперокси)пропан 3. Увеличение времени реакции приводит к образованию продукта 4[5].
Трипероксид ацетона легко возгоняется:
- при температуре от +14 до +18 °С он теряет около 6,5 % массы за 24 часа;
- при +25 °С — 68 % массы за 14 дней;
- при +50 °С — 1,5 % массы за 2 часа;
- при 100 °С — возгоняется весьма быстро[6].
Он растворим в этаноле (0,15 г / 100 г при +17 °С), диэтиловом эфире (5,5), петролейном эфире (7,35), ацетоне (9,15), сероуглероде (9,97), пиридине (15,4), бензоле (18,0), трихлорэтилене (22,7), четырёххлористом углероде (24,8), хлороформе (42,5)[6], но нерастворим в воде[7].
При нагревании с разбавленной серной кислотой пероксид ацетона количественно гидролизуется с образованием ацетона и пероксида водорода:
- C3H6O2+3h3O→3C3H6O+3h3O2{\displaystyle {\mathsf {C_{3}H_{6}O_{2}+3H_{2}O\rightarrow 3C_{3}H_{6}O+3H_{2}O_{2}}}}[4]
Миллиграммовые количества дипероксида и трипероксида ацетона в течение 15 минут разлагаются сильными кислотами (например, серной кислотой или метансульфокислотой). Поскольку реакция экзотермична, действие сильных кислот на граммовые количества вызывает детонацию. Также трипероксид ацетона эффективно разрушается хлоридом олова(II)[7][8].
При получении с использованием метансульфокислоты, хлорной или серной кислоты трипероксид ацетона самопроизвольно превращается в дипероксид ацетона. Однако при использовании хлорида олова(IV), соляной или азотной кислоты он остаётся стабильным[9].
Использование в качестве взрывчатого вещества[править | править код]
Воспламенение пероксида ацетонаВ военных целях пероксид ацетона не используется из-за высокой летучести и чувствительности, однако, c 1980-x годов применяется в террористических целях как инициирующее или основное взрывчатое вещество[6][10]. Также существуют упоминания о применении пероксида ацетона в диверсионной практике советских разведчиков первой половины 20 века как импровизированного взрывчатого вещества, которое можно легко сделать из подручных химикатов:
«Мало кому из людей «мирных профессий» известно, что самые банальные «химикалии» могут стать иногда грозными разрушителями. Ацетон продается в аптеках для удаления с ногтей старого лака. Перекись водорода — для корректуры природного цвета женских волос. Соляная кислота идет на балансирование желудка и для пайки металлов. Но не рекомендуется смешивать вместе эти три вещества. Получающийся от смеси белый порошок является сильнейшей взрывчаткой»[11].
Использование террористами связано с простотой синтеза, а также с тем, что в молекуле данного вещества отсутствует азот, что делает невозможным определение взрывающего устройства стандартными устройствами, отвечающими на азот[12]. Трипероксид ацетона обладает примерно такой же взрывной силой, как тротил. Кроме того, он весьма чувствителен к нагреванию и удару и может воспламеняться под действием открытого пламени и электрического разряда[5], что делает сам процесс создания взрывающих устройств опасным (по этой причине трипероксид ацетона получил название «Мать Сатаны»)[12].
The Times сообщает, что через несколько дней после теракта в Манчестере (теракт произошел в ночь на 23 мая 2017 года) в открытом доступе в социальной сети Facebook и на YouTube находились пошаговые инструкции по изготовлению взрывных устройств на основе пероксида ацетона, вещества, которое использовал Абеди для совершения теракта.[13]
Сообщается, что данное вещество детонирует даже при содержании воды до 25 %[7]. К удару перекись ацетона чуть менее чувствительна, чем азид свинца. По бризантности она превосходит азид свинца и гремучую ртуть[4].
При взрыве пероксида ацетона происходит резкое образование большого объёма газов: из его одной молекулы образуются три молекулы ацетона и одна молекула озона[2]. Приводят также и другое уравнение разложения:
- (C3H6O2)3→1,3CO2+2,44CO+2,61Ch5+0,63C2H6+0,23C2h5+0,47h3+0,96h3O+0,47C{\displaystyle {\mathsf {(C_{3}H_{6}O_{2})_{3}\rightarrow 1,3CO_{2}+2,44CO+2,61CH_{4}+0,63C_{2}H_{6}+0,23C_{2}H_{4}+0,47H_{2}+0,96H_{2}O+0,47C}}}[4]
Скорость детонации трипероксида ацетона составляет 5300 м/с при плотности 1,2 г/см³ и около 1430 м/с при 0,47 г/см³. В диапазоне плотностей от 0,35 до 1,2 г/см³ эта зависимость линейна и подчиняется уравнению
y=5405,1x−1149{\displaystyle y=5405,1x-1149}.
Теплота взрыва составляет 2803 кДж/кг, что составляет 67 % от тротилового эквивалента (4.19 МДж/кг)
Использование в качестве пищевой добавки[править | править код]
Пероксид ацетона является пищевой добавкой, которой присвоено обозначение E929. Он улучшает качество мучных изделий. Однако, по состоянию на 2017 год пероксид ацетона практически не используется с этой целью, вместо него применяются другие улучшители[14].
Трипероксид и дипероксид ацетона можно обнаружить или проанализировать методом тонкослойной хроматографии на силикагеле (элюент: толуол, Rf 0,57 и 0,66 соответственно, проявка 1 % дифениламина в концентрированной серной кислоте). Подобраны также условия для анализа газовой хроматографией и масс-спектрометрией[7].
- ↑ 17088-37-8 Acetone peroxide (неопр.). Дата обращения 24 июля 2013. Архивировано 26 июля 2013 года.
- ↑ 1 2 Encyclopedia of Forensic Sciences, 3V Set ONLINE. — Academic Press. — 2013. — P. 102. — ISBN 978-0-12-382165-2.
- ↑ Wolffenstein R. Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd (нем.) // Berichte der Deutschen Chemischen Gesellschaft (англ.)русск. : magazin. — 1895. — Bd. 28, Nr. 2. — S. 2265—2269. — DOI:10.1002/cber.189502802208.
- ↑ 1 2 3 4 5 6 Багал, 1975.
- ↑ 1 2 3 4 Agrawal J. P., Hodgson R. D. Organic Chemistry of Explosives. — Wiley, 2007. — P. 339—340. — ISBN 978-0-470-02967.
- ↑ 1 2 3 Yinon J. Forensic and Environmental Detection of Explosives. — John Wiley & Sons, 1999. — P. 10—12. — ISBN 0-471-98371-3.
- ↑ 1 2 3 4 Lunn G., Sansone E. B. Destruction of Hazardous Chemicals in the Laboratory. — John Wiley & Sons, 2012. — P. 459—462. — ISBN 978-0-470-48755-6.
- ↑ Oxley J. C., Smith J. L., Huang J., Luo W. Destruction of Peroxide Explosives (англ.) // Journal of Forensic Sciences. — 2009. — Vol. 54, no. 5. — P. 1029—1033. — DOI:10.1111/j.1556-4029.2009.01130.x. — PMID 19737243.
- ↑ Matyas R., Pachman J., Ang H.-G. Study of TATP: Spontaneous Transformation of TATP to DADP (англ.) // Propellants, Explosives, Pyrotechnics. — 2008. — Vol. 33, no. 2. — P. 89—91. — DOI:10.1002/prep.200700247.
- ↑ Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — DOI:10.1002/prep.201200116.
- ↑ Н. Хохлов. Право на совесть.
- ↑ 1 2 Girard J. E. Criminalistics: Forensic Science, Crime and Terrorism. — 2nd Ed.. — Jones & Bartlett Publishers, 2011. — P. 422. — ISBN 978-0-7637-7731-9.
- ↑ Террорист изготовил бомбу по инструкции в YouTube (неопр.). Cursorinfo. Дата обращения 24 июня 2017.
- ↑ Взрывоопасный кекс — о E-добавках, используемых при изготовлении хлебобулочных изделий, на канале «Наука 2.0»
- Багал Л. И. Химия и технология инициирующих взрывчатых веществ. — М.: Машиностроение, 1975. — С. 411—415.
- Wolffenstein R. Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1895. — Bd. 28, Nr. 2. — S. 2265—2269. — DOI:10.1002/cber.189502802208.
- Baeyer A., Villiger V. Ueber die Einwirkung des Caro’schen Reagens auf Ketone (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1900. — Bd. 33, Nr. 1. — S. 858—864. — DOI:10.1002/cber.190003301153.
- Экспериментальные статьи
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — DOI:10.1002/prep.201200116.
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part 2 (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — DOI:10.1002/prep.201200215.
а нашатырный спирт и аммиак одно и тоже?
Не следует путать с Нашатырём — хлоридом аммония. Нашатырный спирт — водный раствор аммиака (см. гидроксид аммония) обычно 10%-ный, прозрачная жидкость по виду похожая на воду. Применяется в медицине, а также при стирке для выведения пятен. В медицине нашатырный спирт применяется при обморочных состояниях (для возбуждения дыхания) , для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора) , ожоги кожного покрова, рефлекторную остановку дыхания (при вдыхании в высокой концентрации) . Известный народный рецепт приёма раствора нашатырного спирта внутрь для отрезвления не имеет объяснения и подтверждения современной токсикологией [1]. Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с) . Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки. Поскольку является слабым основанием, при взаимодействии нейтрализует кислоты. Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Нет, не одно и тоже. Нашатырный спирт — жидкость, водный раствор аммиака, где аммиак вступает в взаимодействие с водой с получением гидрокида аммония. Аммиак — газ.