Фактор свертываемости крови 13, субъединица A1 (F13A1). Выявление мутации G103T(Val34Leu)
Маркер связан с характером функционирования фактора XIIIA системы свертываемости крови. Исследуется для выявления генетической предрасположенности к инфаркту миокарда, тромбоэмболии.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Название гена – F13A1
OMIM +134570
Локализация гена на хромосоме – 6p25.1
Функция гена
Ген F13A1 кодирует А-субъединицу свертывающего фактора XIII (F13A1, субъединица А1) – белка, ответственного за конечную стадию в каскаде свертывания крови.
Генетический маркер G103T
Участок гена F13A1, в котором происходит замена нуклеотида гуанина (G) на тимин (Т) в позиции 103, обозначается как генетический маркер G103T. Следовательно, изменяются и биохимические свойства фермента, в котором аминокислота валин замещается на лейцин в позиции 34 аминокислотной последовательности белка.
Возможные генотипы
Встречаемость в популяции
Встречаемость аллеля T в европейской популяции составляет 23 %.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что поддерживает жидкое состояние крови.
Особое внимание при оценке риска тромбоэмболии и инфаркта миокарда уделяется генам коагуляционных (свертывающих) факторов крови 7 и 13 (F7, F13), изменения в которых в большинстве случаев направлены на обеспечение защитного эффекта. Снижение активности данных факторов способствует уменьшению тромбообразования.
Ген F13А1 кодирует А-субъединицу (F13A1, субъединица А-1) фактора XIII – белка, участвующего в процессе свертывания крови. Фактор XIII (F13), состоящий из двух А-субъединиц, имеющих каталитическую активность, и двух В-субъединиц, представляет собой плазматический гликопротеин, циркулирующий в плазме крови в комплексе с белком фибриногеном. При активации системы свертывания крови F13 подвергается расщеплению ферментом тромбином (фактором свертывания крови II, F2) в точке между аминокислотами аргинином и глицином, расположенными в положениях 37 и 38 аминокислотной последовательности.
Изменения в гене F13A1 в большинстве случаев снижают риск развития патологий, связанных с повышенным тромбообразованием. Участок, в котором происходит замена нуклеотида гуанина (G) на тимин (Т) в позиции 103, обозначается как генетический маркер G103T. Вследствие замены нуклеотида валин замещается на лейцин в позиции 34 аминокислотной последовательности (V34L). Данный участок располагается в непосредственной близости от сайта взаимодействия F13 с тромбином. В результате замены преобразуются биохимические свойства белка F13, а именно его способность «сшивать» фибриновые мономеры, вследствие чего фибриновые сгустки получаются более тонкими.
Ассоциация маркера с инфарктом миокарда (ИМ)
Выявлено, что аллель T гена F13A1 встречается с меньшей частотой в группе пациентов с инфарктом миокарда по сравнению с контрольной группой.
При анализе статей, посвященных эффекту полиморфизма по маркеру G103T, связанного с риском развития инфаркта миокарда, исследователи оценили частотность аллелей в двух группах: у пациентов, перенесших инфаркт миокарда (3663 человека), и у контрольной группы (5080 здоровых людей). На основании проведенного анализа был доказан защитный эффект присутствия в генотипе аллеля Т.
Ассоциация маркера с венозным тромбозом
Генотип G/T обнаруживается у 38,6 % пациентов с глубоким венозным тромбозом и у 41,2 % здоровых людей, а генотип Т/Т у больных тромбозом выявлен всего в 1,6 % случаев, по сравнению с 9,6 % здоровых людей.
Таким образом, было показано, что гомозиготы по аллелю Т (генотип Т/Т) реже заболевают венозным тромбозом и вероятность инфаркта миокарда у них ниже.
Выявив генотип по данному маркеру, можно оценить генетическую предрасположенность к инфаркту миокарда, тромбоэмболии и провести соответствующие профилактические мероприятия.
Интерпретация результатов
Оценка генотипа по маркеру:
- G/G – «нормальная» активность белка F13
- G/T – активность белка F13 умеренно снижена
- T/T – активность белка F13 значительно снижена
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Скачать пример результатаГенетический маркер входит в исследование:
[42-010] Генетический риск развития тромбофилии (расширенный)
Важные замечания
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена.
Литература
- Kohler, H. P., Stickland, M.
 H., Ossei-Gerning, N., Carter, A., Mikkola, H., Grant, P. J. Association of a common polymorphism in the factor XIII gene with myocardial infarction. Thromb. Haemost. 79: 8-13, 1998.
H., Ossei-Gerning, N., Carter, A., Mikkola, H., Grant, P. J. Association of a common polymorphism in the factor XIII gene with myocardial infarction. Thromb. Haemost. 79: 8-13, 1998. - Franco, R. F., Reitsma, P. H., Lourenco, D., Maffei, F. H., Morelli, V., Tavella, M. H., Araujo, A. G., Piccinato, C. E., Zago, M. A. Factor XIII val34-to-leu is a genetic factor involved in the aetiology of venous thrombosis. Thromb. Haemost. 81: 676-679, 1999.
- Shafey, M., Anderson, J. L., Scarvelis, D., Doucette, S. P., Gagnon, F., Wells, P. S. Factor XIII Val34Leu variant and the risk of myocardial infarction: a meta-analysis. Thromb. Haemost. 97: 635-641, 2007.
- Lorand L., Credo R.B., Janus T.J. Factor Xlll (fibrin-stabilizing factor). – Methods in enzymology, 1981, v. 80, p. 333-341.
Фактор VII инструкция по применению: показания, противопоказания, побочное действие – описание Factor VII Лиофилизат для приготовления раствора для в/в введения (6083)
Продолжительность заместительной терапии и дозы зависят от выраженности дефицита фактора VII, локализации и обширности кровотечения или кровоизлияния, а также клинического состояния больного. Назначаемая доза фактора VII рассчитывается в международных единицах (МЕ) согласно существующим стандартам ВОЗ для препаратов, содержащих фактор VII. Активность фактора VII в плазме может рассчитываться в процентах от нормы и в международных единицах.
Назначаемая доза фактора VII рассчитывается в международных единицах (МЕ) согласно существующим стандартам ВОЗ для препаратов, содержащих фактор VII. Активность фактора VII в плазме может рассчитываться в процентах от нормы и в международных единицах.
Одна международная единица активности фактора VII эквивалентна активности фактора VII в 1 мл нормальной человеческой плазмы.
Расчет требуемой дозы основан на эмпирическом наблюдении, согласно которому 1 Международная Единица (ME) фактора VII на килограмм массы тела увеличивает активность фактора VII в плазме крови примерно на 1,9 % (0,019 МЕ/мл) относительно нормального уровня активности.
Требуемая доза определяется с помощью следующей формулы:
Необходимая доза (ME) = масса тела (кг) х желаемое повышение активности Фактора VII (МЕ/мл) х 53* {единица, поделенная на наблюдаемое восстановление (мл/кг)}
*(поскольку 1: 0,019 = 52,6)
При определении дозы и частоты введения препарата в каждом конкретном случае следует учитывать клинический эффект.
| Вид кровотечения | Терапевтически необходимая активность фактора VII в плазме | Продолжительность поддержания терапевтически необходимой активности фактора VII в плазме |
| Небольшие кровотечения и малые хирургические вмешательства. | 10-20% | Однократная доза (при небольшом кровотечении) или до полного заживления раны (при малом хирургическом вмешательстве). |
| Тяжелые кровотечения и обширные хирургические вмешательства | 20-25% | В течение 8-10 дней или до полного заживления раны. |
При выборе интервала введения следует учитывать, что T1/2 фактора VII очень короткий — примерно 3-5 ч.
Если необходимо длительно поддерживать высокий уровень фактора VII в плазме, следует вводить препарат с интервалом 8-12 ч.
Коррекция дозы при заболеваниях печени не требуется.
Способ введения
Приготавливать раствор для в/в введения из лиофилизата фактора VII следует непосредственно перед введением.
Приготовление раствора из лиофилизированного концентрата
1. Закрытый флакон с растворителем нагреть до комнатной температуры (не выше 37°С).
2. Удалить защитные колпачки с флаконов с концентратом фактора VII и растворителем, продезинфицировать резиновые пробки на обоих флаконах.
3. Провернуть и затем снять защитную упаковку с одного конца иглы-переходника, входящей в комплект. Проткнуть этим концом иглы резиновую пробку флакона с растворителем.
4. Осторожно удалить защитную упаковку с другого конца иглы-переходника, не дотрагиваясь до самой иглы.
5. Перевернуть флакон с растворителем и проткнуть свободным концом иглы-переходника резиновую пробку флакона с концентратом фактора VII. За счет вакуума растворитель перетечет во флакон с концентратом фактора VII.
За счет вакуума растворитель перетечет во флакон с концентратом фактора VII.
6. Отсоединить флаконы, удалив иглу-переходник из флакона с концентратом фактора VII. Для более быстрого растворения концентрата флакон осторожно вращают и покачивают.
7. Для осаждения пены после полного растворения концентрата вставить во флакон имеющуюся в комплекте воздуховодную иглу. Удалить воздуховодную иглу после оседания пены.
В/в струйное введение
1. Провернуть и затем снять защитную упаковку с иглы-фильтра и насадить ее на стерильный одноразовый шприц. Набрать раствор в шприц.
2. Отсоединить иглу-фильтр от шприца, насадить иглу-бабочку или одноразовую иглу для инъекций и ввести раствор в/в медленно (со скоростью не более 2 мл/мин).
3. При введении в домашних условиях пациент должен сложить все использованные материалы в упаковку из-под препарата и сдать в лечебное учреждение, где он наблюдается для контроля.
В/в капельное введение
При в/в капельном введении следует использовать одноразовую систему для трансфузии с фильтром.
| Аимафикс | Лиофилизат д/пригот. р-ра д/инф. 200 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием рег. №: П N015034/01 от 18.10.12Лиофилизат д/пригот. р-ра д/инф. 500 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием рег. №: П N015034/01 от 18.10.12Лиофилизат д/пригот. | |||
| Иммунат | Лиофилизат д/пригот. р-ра д/в/в введен. 250 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения рег. №: П N015027/01 от 04.05.08Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/в/в введен. 1000 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения рег. №: П N015027/01 от 04.05.08 | |||
| Иммунин | Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/инф. 600 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения рег. №: П N013750/01 от 04.05.08Лиофилизат д/пригот. р-ра д/инф. 1200 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения рег. №: П N013750/01 от 04.05.08 | |||
| Коагил-VII | Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/в/в введения 2.4 мг: фл. 1 шт. в компл. с растворителем (амп. 1 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками рег. №: ЛСР-010225/09 от 15.12.09Лиофилизат д/пригот. р-ра д/в/в введения 4.8 мг: фл. 1 шт. в компл. с растворителем (амп. 2 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками рег. №: ЛСР-010225/09 от 15.12.09 | |||
| Коаплекс | Лиофилизат д/пригот. | |||
| Коаплекс | Лиофилизат д/пригот. р-ра д/в/в введения: фл. 500 ME в компл. с р-лем и устройством д/добавления р-ля рег. №: ЛП-003500 от 14.03.16 | |||
| Коэйт-ДВИ | Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/в/в введения 400-799 МЕ: фл. в компл. с растворителем 5 мл, двухсторонней иглой, иглой-фильтром и набором для вливания рег. №: П N012353/01 от 22.09.11Лиофилизат д/пригот. р-ра д/в/в введения 800-1400 МЕ: фл. в компл. с растворителем 10 мл, двухсторонней иглой, иглой-фильтром и набором для вливания рег. №: П N012353/01 от 22.09.11 | |||
| Октаплекс® | Лиофилизат для приготовления раствора для в/в введения рег. №: ЛП-004107
от 30.01.17
Дата перерегистрации: 06.02.19 №: ЛП-004107
от 30.01.17
Дата перерегистрации: 06.02.19 | Произведено: OCTAPHARMA (Франция) Первичная упаковка: OCTAPHARMA (Франция) Выпускающий контроль качества: OCTAPHARMA (Франция) | ||
| Протромплекс 600 | Лиофилизат для приготовления раствора для в/в введения рег. №: ЛСР-010486/08
от 24.12.08 №: ЛСР-010486/08
от 24.12.08 | |||
| Репленин-ВФ | Лиофилизат для приготовления раствора для в/в введения рег. №: П N009067 от 13.08.08 | |||
Уман-Комплекс Д. и. и. | Лиофилизат д/пригот. р-ра д/инф. 200 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием рег. №: П N015135/01-2003 от 23.01.09 | |||
| Уман-Комплекс Д.и. | Лиофилизат д/пригот. р-ра д/инф. 500 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием рег. №: П N015135/01-2003
от 23.01.09 №: П N015135/01-2003
от 23.01.09 | |||
| Фактор VII | Лиофилизат для приготовления раствора для в/в введения рег. №: П N016158/01 от 15.12.09 Дата перерегистрации: 22.06.18 | |||
| Фейба® | Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/инф. 1000 ЕД: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения рег. №: П N013644/01 от 04.05.08 Дата перерегистрации: 09.06.18 | Произведено (лиофилизат): BAXTER (Австрия) Произведено (растворитель): SIEGFRIED HAMELN (Германия) Вторичная упаковка и выпускающий контроль качества: BAXTER (Австрия) | ||
Эмоклот Д. и. и. | Лиофилизат д/пригот. р-ра д/инф. 250 МЕ: фл. 1 шт. в компл. с растворителем и системой для в/в введения рег. №: П N015035/01-2003 от 07.10.08Лиофилизат д/пригот. р-ра д/инф. 500 МЕ: фл. 1 шт. в компл. с растворителем и системой для в/в введения рег. №: П N015035/01-2003 от 07.10.08Лиофилизат д/пригот. р-ра д/инф. 1000 МЕ: фл. 1 шт. в компл. с растворителем и системой для в/в введения рег. №: П N015035/01-2003 от 07.10.08 | |||
| Гемофил М | Лиофилизат д/пригот. | |||
| Гемофил М | Лиофилизат д/пригот. р-ра д/в/в введения 1241-1700 МЕ: фл. 1 шт. в комплекте с растворителем рег. №: П N014383/01 от 10.09.08 | |||
| Гемофил М | Лиофилизат д/пригот. | |||
| Гемофил М | Лиофилизат д/пригот. р-ра д/в/в введения 850-1240 МЕ: фл. 1 шт. в комплекте с растворителем рег. №: П N014383/01 от 10.09.08 | |||
| Рекомбинат | Лиофилизат д/пригот. | |||
| Рекомбинат | Лиофилизат д/пригот. р-ра д/в/в введения 250 МЕ: фл. в комплекте с растворителем и системой для введения рег. №: П N015648/01 от 24.04.09 Дата перерегистрации: 10.05.17 | |||
| Рекомбинат | Лиофилизат д/пригот. | |||
В лечении пациентов с гемофилией очень важен собственный клинический опыт
Среди орфанных заболеваний одно из самых тяжелых — гемофилия, то есть врожденный дефицит факторов, обеспечивающих свертываемость крови. В начале 2000-х годов в нашей стране появились эффективные препараты для лечения гемофилии, и с их появлением удалось справиться с этим тяжелейшим недугом, приводившим прежде к ранней инвалидности. Об этом «РГ» рассказала заведующая Городским центром по лечению гемофилии Санкт-Петербурга, кандидат медицинских наук Татьяна Андреева.
Татьяна Андреевна, как возникает гемофилия? Есть ли факторы, провоцирующие развитие заболевания? Каковы различия в интенсивности проявления симптомов у пациентов?
Татьяна Андреева: Гемофилия — это наследственный дефицит факторов свертываемости крови. Либо фактора VIII — и тогда это гемофилия А, либо фактора IX — это гемофилия В. Дефицит возникает в связи с мутацией гена в женской Х-хромосоме. Она передается через относительно здоровую мать мальчикам. При этом все дочери мужчины, страдающего гемофилией, являются передатчицами этого гена. Правда, сейчас мы уже знаем, что примерно у 40 процентов больных возникают и спорадические, то есть случайные, мутации. Более точно это определяет медико-генетическое исследование. Заболевание имеет три степени тяжести: тяжелую, среднетяжелую, легкую, и это коррелирует с уровнем VIII или IX дефицитного фактора. У пациентов с гемофилией повышена склонность к кровотечениям. Главная проблема — тяжелые кровотечения в суставы. Чаще всего они возникают у пациентов, у которых активность фактора свертывания меньше одного процента. В дальнейшем в этих суставах при несвоевременном и недостаточном лечении могут возникать воспалительные процессы, страдает мышечно-связочный аппарат, кровообращение нарушается, и в суставе происходят глубокие изменения, которые приводят к инвалидности.
Либо фактора VIII — и тогда это гемофилия А, либо фактора IX — это гемофилия В. Дефицит возникает в связи с мутацией гена в женской Х-хромосоме. Она передается через относительно здоровую мать мальчикам. При этом все дочери мужчины, страдающего гемофилией, являются передатчицами этого гена. Правда, сейчас мы уже знаем, что примерно у 40 процентов больных возникают и спорадические, то есть случайные, мутации. Более точно это определяет медико-генетическое исследование. Заболевание имеет три степени тяжести: тяжелую, среднетяжелую, легкую, и это коррелирует с уровнем VIII или IX дефицитного фактора. У пациентов с гемофилией повышена склонность к кровотечениям. Главная проблема — тяжелые кровотечения в суставы. Чаще всего они возникают у пациентов, у которых активность фактора свертывания меньше одного процента. В дальнейшем в этих суставах при несвоевременном и недостаточном лечении могут возникать воспалительные процессы, страдает мышечно-связочный аппарат, кровообращение нарушается, и в суставе происходят глубокие изменения, которые приводят к инвалидности.
В каком возрасте чаще всего дебютирует это заболевание? На что следует обратить внимание родителям, чтобы не пропустить гемофилию?
Татьяна Андреева: Заболевание дебютирует по-разному: у некоторых новорожденных возникает кровотечение из пупочной ранки или при вакцинации еще в роддоме. У других — с 7-12 месяцев, когда дети начинают вставать в кроватке. Сначала у ребенка могут возникать кровотечения из слизистых оболочек, потом он начинает ползать, ходить, естественно, падает — у малыша возникают обширные гематомы мягких тканей — на ножках, ягодицах и т.д. И если болезнь не распознана, ребенок не получает адекватного лечения, то к пяти годам у таких пациентов два-три крупных сустава уже бывают деформированы. Родителям следует насторожиться, если у ребенка возникает множество синяков. Или длительное кровотечение при смене молочных зубов или при удалении зуба, при различных инвазивных манипуляциях. Перед любым хирургическим вмешательством детям и взрослым должен выполняться анализ крови для определения активированного частичного тромбопластинового времени (аЧТВ), протромбинового времени и ряда других показателей. Если в этих показателях выявляются отклонения, то такие пациенты обследуются в нашем центре. Для начала определяем активность факторов VIII, IX и ряда других факторов свертывания крови. И порой выявляем гемофилию. При первых признаках заболевания родители должны обратиться к своему участковому педиатру. В случае необходимости он направит на консультацию к гематологу. А уже потом, если потребуется, будет проведена и медико-генетическая консультация. Ведь существуют разные заболевания с повышенной кровоточивостью, с нарушениями гемостаза. Есть и более редкие коагулопатии, встречающиеся еще реже, чем гемофилия — например, дефицит VII фактора. Обследование позволяет выявить все нарушения в системе свертывания крови.
Если в этих показателях выявляются отклонения, то такие пациенты обследуются в нашем центре. Для начала определяем активность факторов VIII, IX и ряда других факторов свертывания крови. И порой выявляем гемофилию. При первых признаках заболевания родители должны обратиться к своему участковому педиатру. В случае необходимости он направит на консультацию к гематологу. А уже потом, если потребуется, будет проведена и медико-генетическая консультация. Ведь существуют разные заболевания с повышенной кровоточивостью, с нарушениями гемостаза. Есть и более редкие коагулопатии, встречающиеся еще реже, чем гемофилия — например, дефицит VII фактора. Обследование позволяет выявить все нарушения в системе свертывания крови.
Правда ли, что гемофилией страдают только представители сильного пола? Откуда же появляется дефектный ген у женщин, который в дальнейшем они могут передать своему ребенку?
Татьяна Андреева: Заболевание возникает в связи с мутацией гена в женской Х-хромосоме, который затем передается по женской линии. Заболевают же, в основном, мальчики. Но бывают и случаи женской гемофилии, когда ребенок рождается в союзе женщины-передатчицы дефектного гена и мужчины, больного гемофилией. В мире насчитывается всего несколько таких пациенток. Если болезнь не лечить, они погибают в пубертатном возрасте по понятным причинам. Например, сейчас на учете стоит девочка, у которой отец страдает тяжелой формой гемофилии, а мама совершенно здорова. Эта девочка передатчица, однако у нее снижен фактор VIII до таких же уровней, как у пациентов с тяжелой формой гемофилии. Мы также наблюдаем пациенток-носительниц гена гемофилии, у которых уровни факторов VIII или IX значительно снижены. Порой мы даже вводим их в регистр, чтобы они в определенных ситуациях (при удалении зуба, например, или при травме, в родах и т.п.) получали необходимый препарат.
Заболевают же, в основном, мальчики. Но бывают и случаи женской гемофилии, когда ребенок рождается в союзе женщины-передатчицы дефектного гена и мужчины, больного гемофилией. В мире насчитывается всего несколько таких пациенток. Если болезнь не лечить, они погибают в пубертатном возрасте по понятным причинам. Например, сейчас на учете стоит девочка, у которой отец страдает тяжелой формой гемофилии, а мама совершенно здорова. Эта девочка передатчица, однако у нее снижен фактор VIII до таких же уровней, как у пациентов с тяжелой формой гемофилии. Мы также наблюдаем пациенток-носительниц гена гемофилии, у которых уровни факторов VIII или IX значительно снижены. Порой мы даже вводим их в регистр, чтобы они в определенных ситуациях (при удалении зуба, например, или при травме, в родах и т.п.) получали необходимый препарат.
Как лечат пациентов с гемофилией?
Татьяна Андреева: Лечение гемофилии проводится пожизненно, по федеральной программе высокозатратных нозологий пациенты получают препараты бесплатно. Излечить заболевание полностью в настоящее время невозможно. Надежды на это связывают с генной терапией, возможно удастся редактировать дефектные гены, но это дело будущего.
Излечить заболевание полностью в настоящее время невозможно. Надежды на это связывают с генной терапией, возможно удастся редактировать дефектные гены, но это дело будущего.
В настоящее время существует достаточно большая линейка препаратов, восполняющих дефицит факторов свертываемости крови. Профилактическая заместительная терапия является золотым стандартом лечения пациентов с тяжелой формой гемофилии А и В. Она позволяет сократить количество спонтанных кровотечений, предотвратить развитие и прогрессирование гемофилической артропатии, улучшить качество жизни пациентов. Профилактика подразумевает регулярное (3 раза в неделю) введение препарата. Это непросто, однако необходимо для того, чтобы лечение было эффективным. Есть возможность снизить частоту введения у пациентов с длительным периодом полувыведения фактора. Для этого требуется индивидуализированный подбор режима дозирования с учетом фармакокинетических параметров пациента. Препараты фактора свертывания необходимы для купирования кровотечений и для обеспечения гемостаза при хирургических вмешательствах.
Насколько пациенты обеспечены терапией у нас, в России? Оправдан ли выбор исключительно инновационных препаратов для всех пациентов с гемофилией?
Татьяна Андреева: Когда 12 лет назад в нашей стране приняли программу высокозатратных нозологий, это был огромный прорыв. По ней все пациенты с гемофилией уже более 10 лет получают бесплатно эффективные лекарства. По обеспеченности пациентов с гемофилией мы вышли на уровень Западной Европы.
Каждый пациент индивидуален — и по фенотипу кровотечений, и по приверженности той или иной модели терапии. Например, пациенты, с нетяжелым геморрагическим фенотипом привыкли к интермиттирующей профилактике, когда у них есть довольно длительные перерывы — 1-2 или 3 месяца между курсами введений. Для таких пациентов регулярное постоянное введение, даже подкожное, представляет проблему, они не видят необходимости в таком лечении. Если пациент хорошо отвечает на традиционную терапию фактором или шунтирующим препаратом, оставляем его лечение без изменений.
Особняком стоят пациенты с легкой формой гемофилии, у которых развился ингибитор. Тяжелых геморрагических проявлений у них. Наиболее подходящее для них лечение — шунтирующий препарат.
Отдельная задача — дополнительная гемостатическая терапия — например, терапия по требованию, терапия при хирургическом вмешательстве.
В лечении пациентов с ингибиторной гемофилией важны все препараты — и те, которые мы применяем давно, и те, которые появились сравнительно недавно. Есть консервативные пациенты, они предпочитают оставаться на текущей терапии. Они руководствуются соображениями осторожности. Они наблюдают — какой накапливается опыт, как чувствуют себя те пациенты, которые стали получать новое лечение. Мы, врачи, хотели бы получить больше данных по применению препарата в реальной практике и наработать свой собственный опыт, потому что собственный клинический опыт не заменят никакие, даже очень убедительные, данные.
Опасна ли гемофилия сейчас, при наличии лечения?
Татьяна Андреева: В настоящее время в нашей стране все пациенты проводят домашнее лечение, как профилактическое так и по факту кровотечения. Если профилактическое лечение проводится, как назначено лечащим врачом, и больной соблюдает данный режим лечения, то у него абсолютно полноценная жизнь, он социализирован, работает или учится. Во-вторых, ему не требуется госпитализация, как было раньше. Но порой пациенты с легкой и среднетяжелой формой, у которых редко бывают кровотечения, думают, что все, можно забыть о своем тяжелом недуге, годами не обращаются к врачу и не имеют в холодильнике нескольких флаконов необходимого им препарата. И если вдруг возникает какая-то серьезная травма — и они, лежа на койке порой в тяжелом состоянии, вспоминают о своем диагнозе. При кровотечениях или травмах правило номер один — начинать лечение как можно раньше, не позже двух часов с момента кровотечения. И всех пациентов призываем не забывать, что заболевание никуда никогда не исчезает, и быть внимательными к себе.
Если профилактическое лечение проводится, как назначено лечащим врачом, и больной соблюдает данный режим лечения, то у него абсолютно полноценная жизнь, он социализирован, работает или учится. Во-вторых, ему не требуется госпитализация, как было раньше. Но порой пациенты с легкой и среднетяжелой формой, у которых редко бывают кровотечения, думают, что все, можно забыть о своем тяжелом недуге, годами не обращаются к врачу и не имеют в холодильнике нескольких флаконов необходимого им препарата. И если вдруг возникает какая-то серьезная травма — и они, лежа на койке порой в тяжелом состоянии, вспоминают о своем диагнозе. При кровотечениях или травмах правило номер один — начинать лечение как можно раньше, не позже двух часов с момента кровотечения. И всех пациентов призываем не забывать, что заболевание никуда никогда не исчезает, и быть внимательными к себе.
Какие существуют ограничения, связанные с заболеванием? Могут ли пациенты заниматься спортом? Выполняются ли плановые операции?
Татьяна Андреева: Пациенты должны избегать травм, тяжелых физических нагрузок, контактных видов спорта. Но физическая активность, тем не менее, рекомендуется — бег, пешие прогулки, плавание, и даже велосипед при соблюдении определенных мер безопасности.: если будет надет шлем, наколенники, налокотники — пожалуйста, вполне возможны велосипедные прогулки. Это дает большой оздоровительный эффект. Есть и другие ограничения: запрещены аспирин и подобные препараты, внутримышечные инъекции. Если необходима плановая операция, она проводится на фоне заместительной терапии препаратами факторов свертывания крови. И тут возникают небольшие сложности, поскольку на плановую операцию требуется значительное количество препаратов. Но федеральная программа не всегда предусматривает обеспечение ими в таком количестве. Есть некоторая проблема с прививками, лучше, когда они вводятся подкожно, причем не в день введения препаратов. Сейчас появилась проблема, связанная с гаджетами. Когда человек постоянно сидит в вынужденной позе с телефоном или планшетом, от этого могут страдать локтевые суставы. Важно, чтобы сам пациент был внимателен к себе, своим симптомам и соблюдал меры предосторожности.
Но физическая активность, тем не менее, рекомендуется — бег, пешие прогулки, плавание, и даже велосипед при соблюдении определенных мер безопасности.: если будет надет шлем, наколенники, налокотники — пожалуйста, вполне возможны велосипедные прогулки. Это дает большой оздоровительный эффект. Есть и другие ограничения: запрещены аспирин и подобные препараты, внутримышечные инъекции. Если необходима плановая операция, она проводится на фоне заместительной терапии препаратами факторов свертывания крови. И тут возникают небольшие сложности, поскольку на плановую операцию требуется значительное количество препаратов. Но федеральная программа не всегда предусматривает обеспечение ими в таком количестве. Есть некоторая проблема с прививками, лучше, когда они вводятся подкожно, причем не в день введения препаратов. Сейчас появилась проблема, связанная с гаджетами. Когда человек постоянно сидит в вынужденной позе с телефоном или планшетом, от этого могут страдать локтевые суставы. Важно, чтобы сам пациент был внимателен к себе, своим симптомам и соблюдал меры предосторожности.
Врожденные дефекты факторов свертывания крови и акушерские осложнения | Микович
1. Говорка Э. Плацента человека. Варшава. Польское государственное медицинское издательство. 1970:471.
2. Pike G.N., Bolton-Maggs P.H.B. Factor deficiencies in pregnancy. Haemotol. Oncol. Clin. N. Am. 2011;25(2):359–378.
3. Casini A., Blondon M., Lebreton A., Koegel G., Tintillier V., de Maistre E., Gautier Ph., Biron Ch., Neerman-Arbez M., de Moer-loose Ph. Natural history of patients with congenital dysfibrinoge-nemia. Blood. 2015;125(43):553–561.
4. The obstetric hematology manual Ed by S. Pavord and B. Hunt. Cambridge University Press. New York. 2010.
5. Ozgu-Erdinc A.S., Togrul C., Aktulay A., Buyukkagnici U., Eyi E.G.Y., Erkaya S. Factor XII (Hageman) levels in women with recurrent pregnancy loss. J. of Pregnancy. Vol 214. Article ID 459192, 3 pages DOI: 10.1155/2014/459192.
Ozgu-Erdinc A.S., Togrul C., Aktulay A., Buyukkagnici U., Eyi E.G.Y., Erkaya S. Factor XII (Hageman) levels in women with recurrent pregnancy loss. J. of Pregnancy. Vol 214. Article ID 459192, 3 pages DOI: 10.1155/2014/459192.
6. Amri Y., Kallel Ch., Becheur M., Dabboubi R., Elloumi M., Belaaj H., Kammoun S., Messaound T., de Moerloose Ph.. Toumi N. El H. Hypodysfibrinogenemia: a novel abnormal fibrinogen associated with bleeding and thrombotic complications. Clin. Chim. Acta. 2016;460(1):55–62.
7. Bouvier S., Chea M., Ripart S., Hanss M., de Mazancourt Ph., Gris J.Ch. Successful pregnancy under fibrinogen substitution with heparin and aspirin in a woman with dysfibrinogenemia revealed by placenta abruption. Thrombosis and haemostasis. 2018;8;118(11):2006– 2008. DOI: 10.1055/s-0038-1673615. ISSN 0340-6245.
8. Iwaki T, Sandoval-Cooper M.J., Paiva M., Kobayashi T., Plo-plis V.A., Castellino F.J. Fibrinogen stabilizes placental–maternal attachment during embryonic development in the mouse. Am. J. Pa-thol. 2002;160(3):1021–1034.
Iwaki T, Sandoval-Cooper M.J., Paiva M., Kobayashi T., Plo-plis V.A., Castellino F.J. Fibrinogen stabilizes placental–maternal attachment during embryonic development in the mouse. Am. J. Pa-thol. 2002;160(3):1021–1034.
9. Peyvandi F., Kunicki T., Lillicrap D. Genetic sequence analysis of inherited bleeding diseases. Blood. 2013;122(20):3423–3431.
10. Ebina Y., Ieko M., Naito S., Kobashi G., Deguchi M., Minakami H., Atsumi T., Yamada H. Low levels of plasma protein S, protein C and coagulation factor XII during early pregnancy and adverse pregnancy outcome. Thromb. Haemost. 2015;114(1):65–69.
Система гемостаза — — Статьи
Диагностика и методы исследования
Равновесие между свертывающими и противосвертывающими процессами в крови – необходимое условие существования нашего организма. Нарушение этого равновесия приводит к тяжелым последствиям: кровотечению или тромбообразованию. Поддерживается данный баланс системой гемостаза – одной из важнейших функциональных систем организма, которая решает две «противоположные» задачи:
Нарушение этого равновесия приводит к тяжелым последствиям: кровотечению или тромбообразованию. Поддерживается данный баланс системой гемостаза – одной из важнейших функциональных систем организма, которая решает две «противоположные» задачи:
• поддерживает жидкое состояние крови в обычных условиях;
• останавливает кровотечение при повреждении сосуда.
Свёртывающая система крови (гемостаз) нужна для остановки кровотечения, чтобы избежать значительных кровопотерь при повреждении сосудов. Механизмы гемостаза реализуются при любом повреждении эндотелия сосудистой стенки, вызванном физическими, гемодинамическими, химическими факторами, а также воспалительными процессами, действием иммунных комплексов, нарушением метаболизма (атеросклероз, коллагенозы) и др.
Свертывание крови является жизненно необходимым: мутации в генах основных белков свертывания, как правило, летальны. Система гемостаза удерживает абсолютное первенство среди множества систем нашего организма как главная непосредственная причина летальных исходов: люди болеют разными болезнями, но умирают почти всегда от нарушений системы свертывания крови.
Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: постоянно создаются новые методы диагностики и терапии нарушений системы свертывания. Но проблема заключается в том, что свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению жидкой плазмы крови в студенистый сгусток, который как пробка затыкает рану и останавливает кровотечение.
Система гемостаза состоит из десятков белков, которые взаимодействуют в сотнях реакций друг с другом, со стенками сосудов, с клетками крови. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных методах ее исследования.
I. Система свертываемости крови
По современным представлениям, в остановке кровотечения задействованы:
1) сосудисто-тромбоцитарный гемостаз (первичный), в котором принимают участие стенки сосудов, тромбоциты и, отчасти, эритроциты;
2) плазменный гемостаз (вторичный) — когда в процесс свертывания крови включаются белки плазмы (плазменные факторы свертывания крови).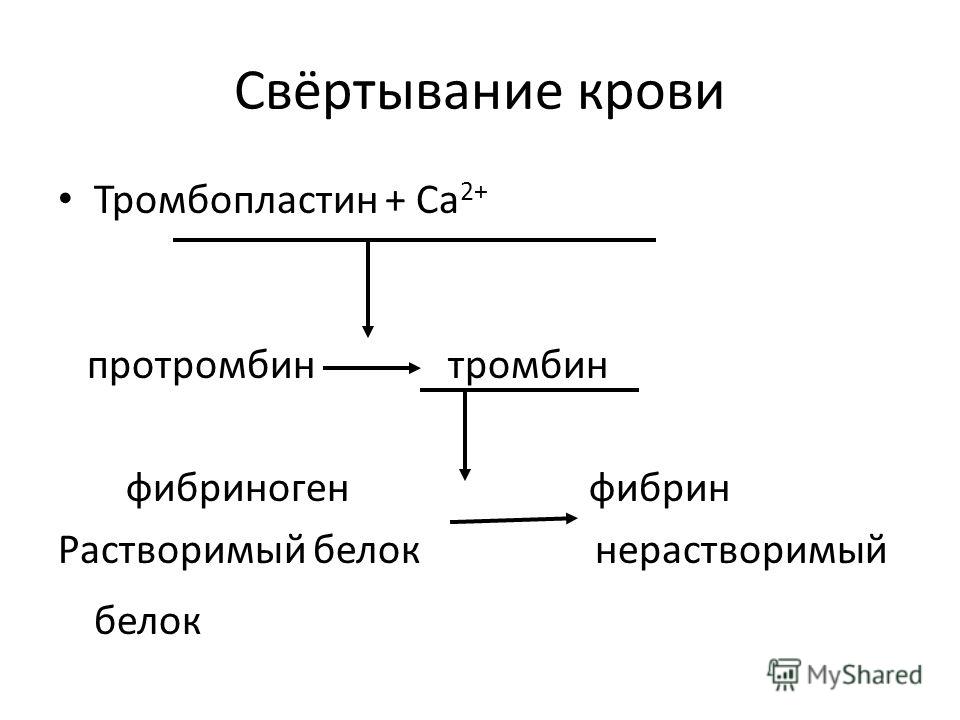
Такое деление гемостаза достаточно условно, так как в организме эти два звена свертывающей системы крови тесно взаимосвязаны.
1. Первичный гемостаз (сосудисто-тромбоцитарный)
Обеспечивает остановку кровотечения из мелких сосудов и сосудов с низким артериальным давлением.
Триггер – повреждение сосудистой стенки и обнажение волокон коллагена — запускает события, которые следуют одно за другим следующим образом.
Реакция кровеносного сосуда
1) Спазм – моментальное рефлекторное сужение сосуда.
Реакция тромбоцитов
2) Адгезия – тромбоциты, благодаря наличию рецепторов к коллагену, прилипают к внутренней стенке сосуда в месте повреждения. Такая стабилизация не дает току крови смывать сгусток тромбоцитов со стенки сосуда.
3) Активация — форма тромбоцитов изменяется, на их поверхности образуются отростки.
4) Агрегация — тромбоциты в большом количестве слипаются, набухают и образуют все более крупный агрегат — рыхлый тромбоцитарный сгусток.
Таким образом, место повреждения сосуда закрывается очень плотной многослойной пробкой (белый тромб), который формируется в течение 3-5 минут. Обычно этого достаточно, чтобы остановить кровотечение у здорового человека при повреждении мелких сосудов.
Таким образом, первичный гемостаз обусловлен сужением сосудов и их механической закупоркой агрегатами тромбоцитов.
| Единичный тромбоцит в активированном состоянии с отростками | |
| Тромбоцитарный сгусток | |
2. Вторичный гемостаз (плазменный, коагуляция)
Первичный белый тромб — это только временное решение, так как достаточно резкого движения или даже незначительных колебаний артериального давления (например, при физическом напряжении), чтобы сорвать тромбоцитарную пробку с места повреждения сосудистой стенки. Необходим дополнительный механизм, который укрепит скопление тромбоцитов и плотно свяжет его с краями раны. Начинается вторичный гемостаз, или собственно свертывание крови — коагуляция.
Начинается вторичный гемостаз, или собственно свертывание крови — коагуляция.
При свертывании крови запускается каскад реакций, превращающих растворенный в плазме белок фибриноген в нерастворимый фибрин, который формирует подобие тонкой сетки. Сеть фибрина захватывает находящиеся рядом лейкоциты и эритроциты, формирует красный тромб, уплотняет его и прикрепляет к краям раны. Коагуляция, или свертывание крови, останавливает кровотечение из крупных сосудов и предотвращает его возобновление. В коагуляционном каскаде реакций участвуют особые белки плазмы — факторы свертывания крови, которые обозначаются римскими цифрами в порядке их открытия (например, фактор II, VII и т.д.). Таким образом, в норме скорость свертывания крови зависит от взаимодействия целого ряда различных факторов.
3. Фибринолиз (растворение сгустка крови)
Система фибринолиза восстанавливает проходимость сосудов после ремонта места повреждения сосудистой стенки. Расщепление фибрина происходит под действием специального фермента — плазмина — с образованием продуктов деградации фибрина (ПДФ). Процесс фибринолиза длится от дней до недель, в зависимости от размера и выраженности повреждения сосуда.
Расщепление фибрина происходит под действием специального фермента — плазмина — с образованием продуктов деградации фибрина (ПДФ). Процесс фибринолиза длится от дней до недель, в зависимости от размера и выраженности повреждения сосуда.
II. Алгоритм диагностики нарушений системы гемостаза
Нарушения в системе свертываемости могут приводить к серьезным, с угрозой жизни, кровотечениям и тромбозам.
Которые, в конечном итоге, являются прямой или косвенной причиной наступления более половины всех летальных исходов: например, тромбозы при травме, сепсисе, онкологическом заболевании, хирургическом вмешательстве и др.
Поэтому своевременная точная оценка состояния системы гемостаза – одна из важнейших задач медицины.
Клиническая лабораторная диагностика решает эту задачу с помощью алгоритма:
от оценочных методов (скрининг) к специальным исследованиям (уточнение диагноза).
1. Скрининг
Первоначально выполняются исследования, отражающие состояние целых звеньев системы гемостаза.
Для этого существует стандартный набор тестов, традиционно называемых скрининговыми:
• время кровотечения
• протромбиновое время (ПВ)
• международное нормализованное отношение (МНО)
• активированное частичное тромбопластиновое время (АЧТВ)
• тромбиновое время (ТВ)
• концентрация фибриногена
• растворимые фибрин-мономерные комплексы (РФМК)
• Д-димер
Диагностическая значимость скрининга:
• нормальные результаты – нет значительных изменений в системе гемостаза
• аномальные результаты – показывают направленность нарушений в системе гемостаза
Протромбиновое время (ПВ) — один из основных базовых тестов в повседневной клинической практике; используется для определения времени свертывания и расчета МНО. Кровь собирают в пробирку с цитратом натрия, который действует как антикоагулянт: связывает ионы кальция, без которых кровь не свертывается.
| |
Международное нормализованное отношение (МНО) — результаты ПВ зависят от активности используемого в тесте реагента тромбопластина. Чтобы уйти от этой зависимости и стандартизовать измерения ПВ, был введён показатель МНО, который рассчитывается как отношение (ПВ пациента/ПВ норма)МИЧ. Где МИЧ – это международный индекс чувствительности тромбопластина, показывающий его активность для данной партии реагента.
| |
Активированное частичное тромбопластиновое время (АЧТВ) – представляет собой время, за которое формируется сгусток в образце плазмы крови, после добавления к ней специальных активаторов этого процесса. Таким образом, оценивается степень воздействия факторов свертывания крови на образование тромба.
| |
| Фибриноген (по Клаусу) — количественный анализ фибриногена — базовый тест оценки системы гемостаза. Фибриноген (I фактор свертывания) в крови находится в растворенном состоянии и под воздействием тромбина превращается в нерастворимый фибрин (полимеризация). Наиболее распространенный метод определения фибриногена — определение по Клаусу. Он основан на измерении времени, необходимого для образования нерастворимого полимера фибрина в разведенной плазме после добавлении большого количества тромбина. Показатель превращения фибриногена в фибрин: чем фибриногена больше, тем интенсивнее свертывание; если его слишком мало, то сгусток (тромб) образуется недостаточного размера и не может остановить кровотечение. | |
Тромбиновое время (ТВ) – используется для определения времени превращения фибриногена в фибрин и оценки антикоагулянтной активности крови. Превращение фибриногена в фибрин происходит в цитратной плазме после добавления в неё тромбина и кальция. При этом скорость образования фибринового сгустка зависит, главным образом, от количества и функциональной полноценности фибриногена и присутствия в крови антикоагулянтов. При этом скорость образования фибринового сгустка зависит, главным образом, от количества и функциональной полноценности фибриногена и присутствия в крови антикоагулянтов. | |
III. Методы исследования системы свертывания
Клоттинговый (англ. «сlot» – сгусток) – в пробе запускается процесс | |
| Хромогенный – в пробу добавляются субстраты, специфичные к определенному белку системы гемостаза. Когда в процессе свертывания нарабатывается искомый белок, он отщепляет от субстрата хромогенную часть, и по интенсивности хромогенного излучения определяют концентрацию и кривую наработки искомого белка. Доступно только для оптического способа измерения. | |
| Иммунотурбидиметрический – анализируемый белок связывается с взвешенными в пробе частицами, после чего по интенсивности светорассеяния взвеси определяют концентрацию искомого белка.  Доступно только для оптического способа измерения. |
Прибор для оценки системы гемостаза — коагулометр
Работа любого коагулометра основывается на способе регистрации времени образования фибринового сгустка — механическом или оптическом.
IV. Способы исследования системы свертывания
1) Механический способ – время образование сгустка определяется по изменению вязкости реакционной смеси:
• в реакционную кювету помещается металлический шарик;
• вокруг кюветы создаётся вращающееся магнитное поле;
• шарик вращается в магнитном поле со строго фиксированной скоростью или совершает колебательные движения с фиксированной амплитудой;
• при формировании сгустка вязкость пробы растет, движение шарика замедляется;
• прибор регистрирует изменение скорости движения шарика;
• остановка шарика приводит к автоматической остановке секундомера коагулометра.
ВАЖНО! Результат механического измерения не зависит от оптической плотности пробы, поэтому в качестве образца можно использовать как цитратную плазму, так и цельную кровь, в том числе, капиллярную.
ВАЖНО! Благодаря тому, что оптическая плотность пробы не влияет на результат механического измерения, можно исследовать «сложные» пробы (иктеричные, липемичные и гемолизные), без их отбраковки и повторных назначений. Доступно только для механического способа измерения.
Механика прощает ошибки преаналитического этапа.
Что такое иктеричность?
Иктеричная проба окрашена в ярко-желтый цвет из-за высокой концентрации билирубина в крови, которая чаще всего обусловлена различными заболеваниями печени, а также приемом некоторых лекарственных препаратов. Высокая концентрация билирубина в пробе может исказить значение лабораторного показателя. Предсказать иктеричность образца, как правило, невозможно. При этом не всегда возможно и скорректировать повышенный уровень билирубина в крови пациента. Чтобы выполнить анализ иктеричной пробы и получить достоверный результат, необходимо использовать соответствующие способы и оборудование, которые позволяют исследовать иктеричную пробу без определения оптической плотности – на механических коагулометрах.
Что такое липемия?
Липемичная проба имеет желтовато-белый цвет из-за высокой концентрации липидов (жиров) в крови. Чаще всего липемия обусловлена приемом жирной пищи незадолго до сдачи крови, а также некоторыми нарушениями обмена веществ, в частности, обмена жиров. Высокая концентрация жиров в крови может исказить значение лабораторного показателя. Как избежать влияния липемии на результат? Если нарушены правила подготовки к сдаче анализов, кровь можно пересдать. Но если липемия обусловлена нарушениями метаболизма, «улучшить» образец невозможно в принципе. Чтобы выполнить анализ такой пробы и получить корректный результат, необходимо использовать соответствующие способы и оборудование (без определения оптической плотности), которые позволяют исследовать мутную пробу.
ВАЖНО! Если аномальная окраска плазмы обусловлена, например, приемом лекарств, то новое взятие образца ситуацию с качеством пробы не улучшит. Для таких пациентов получение результата возможно только механическим способом. Таким образом, только механика даст корректный результат для «сложной» пробы, качество которой улучшить слишком затратно или вообще невозможно.
Таким образом, только механика даст корректный результат для «сложной» пробы, качество которой улучшить слишком затратно или вообще невозможно.
| ВАЖНО! Особенности механических коагулометров позволяют успешно применять их для оценки гемостаза как в рутинном скрининге, так и в педиатрической практике и при контроле лечения непрямыми антикоагулянтами. |
2) Оптический способ — детекция сгустка по изменению оптической плотности пробы:
• Исходная плазма прозрачна
• Формирование сгустка уменьшает
светопропускание через кювету
• Уменьшение светопропускания фиксируется
оптической системой прибора
ВАЖНО! Результат оптического измерения зависит от оптической плотности пробы, поэтому в качестве образца нельзя использовать цельную кровь, можно использовать только плазму. По этой же причине сложные пробы отбраковываются, а используемые реагенты должны быть прозрачными.
Оптический способ имеет лучшую чувствительность при замедленном образовании сгустка, при низком уровне фибриногена, на фоне антикоагулянтной терапии и в случае, если колебания шарика рвут слабые нити фибрина. С другой стороны, при скрининговых исследованиях (область использования полуавтоматических коагулометров) доля пациентов с такими особенностями свертывающей системы очень мала. Они обычно наблюдаются в специализированных клиниках, с другим парком оборудования и набором тестов. Поэтому вышеупомянутая особенность оптического метода не дает какого-либо ключевого преимущества в сравнении с механическим методом в области применения полуавтоматических коагулометров.
| Механика | Оптика |
Физические характеристики плазмы (мутность, желтушность) | Не влияют на результат | Влияют на результат |
Анализ цельной крови | Возможен | Не возможен |
Короткое время сворачивания | Всегда фиксируется | Не всегда фиксируется |
Методы исследования | Клоттинговый | Клоттинговый, хромогенный, турбидиметрический |
Определение сгустка при низком фибриногене | Затруднена | Возможна |
Графическое отображение хода реакции | Нет | Да |
II. Рациональный подход к анализатору гемостаза
Рациональный подход к анализатору гемостаза
Полуавтоматические коагулометры — наиболее востребованные и распространенные в практике лабораторной службы в современной России, особенно в условиях чрезвычайной ситуации с распространением новой коронавирусной инфекции.
Рассмотрим значимые характеристики полуавтоматического коагулометра на примере анализатора TS4000+ производства HTI.
Количество определяемых параметров
Современные полуавтоматические анализаторы гемостаза, в том числе TS4000+, имеют на борту уже предустановленные коагулологические методики (тесты). Как правило, это не менее 12 определяемых параметров гемостаза: основные скрининговые тесты и факторы свертывания.
В меню коагулометра TS4000+ запрограммированы 12 тестов: АЧТВ, ПВ, ТВ, Фибриноген и факторы свертывания II, V, VII, VIII, IX, X, XI, XII.
Метод исследования
Анализаторы гемостаза подразделяют, по способу регистрации момента образования сгустка, на оптические и механические. При этом надо помнить, что нет оптико-механического способа определения сгустка: выпускаются коагулометры оптико-механического типа, в которых технически осуществлена возможность проводить оценку гемостаза механическим или оптическим методом, который выбирает оператор.Коагулометр TS4000+ использует механический способ регистрации сгустка и не зависит от оптической плотности пробы. Это делает TS4000+ универсальным – он может работать как с цельной кровью, в том числе капиллярной, так и с плазмой, в различных разбавлениях и с применением любых реагентов, даже непрозрачных. Благодаря тому, что оптическая плотность пробы не влияет на измерения TS4000+, на нем возможно тестировать «сложные» пробы (мутные и окрашенные), без их отбраковки и избыточных затрат на повторное выполнение анализа.
Механика TS4000+ прощает ошибки преаналитического этапа.
Напомним, что на рынке РФ представлены также оптические коагулометры, позволяющие проводить исследование гемостаза хромогенными методами. Однако, трудоемкость выполнения, низкая селективность хромогенных субстратов (которые могут реагировать с другими продуктами реакции), высокая стоимость анализа, а также небольшое количество выполняемых соответствующих тестов накладывают ограничения на массовое применение данного метода.
Производительность коагулометра
Анализатор гемостаза выбирают, ориентируясь на прогнозируемое количество коагулологических тестов. Предлагаемые на рынке полуавтоматические коагулометры можно разделить на две группы по производительности: 2-канальные (10–20 проб в день) и 4-канальные (20–40 проб в день). КДЛ неспециализированных лечебных учреждений обычно выполняет стандартную коагулограмму, в среднем, 4 скрининговых теста на пациента.
Соответственно, в таких лабораториях востребованы 4-канальные полуавтоматические коагулометры, такие как TS4000+, которые способны полностью закрыть потребность в рутинных коагулограммах.
Одноканальные коагулометры не следует даже рассматривать, так как их функционал ограничен, а производительность крайне мала.
Объем пробы
Объем пробы для анализа – важный критерий выбора анализатора. Экономичный объем образца позволяет использовать приборы в педиатрии или при скрининговых исследованиях, а также дает возможность выполнять повторные исследования. Малый объем пробы существенно — в 2 раза — снижает потребление реагентов, по сравнению с ручными способами. Например, TS4000+ использует для анализа не более 100 мкл плазмы и 50–200 мкл реагентов.Стоимость эксплуатации, адаптация к реагентам
При выборе коагулометра большое значение имеет как его первоначальная стоимость и комплектация, так и последующие расходы в течение всего срока эксплуатации (регулярные закупки расходных материалов к нему — кювет, шариков-мешалок и реагентов).
Полуавтоматические коагулометры являются открытыми системами, что позволяет использовать реагенты любого производителя, без специальных адаптаций и аттестаций.
В отличие от «закрытых» полуавтоматических коагулометров, TS4000+ является полностью открытым бюджетным прибором как по первоначальной цене и комплектации, так и по стоимости использования в течение всего срока эксплуатации. Он открыт по реагентам, работает с наборами любых производителей, а также характеризуется низким энергопотреблением.
Он открыт по реагентам, работает с наборами любых производителей, а также характеризуется низким энергопотреблением.
Удобство эксплуатации
На выбор оборудования также влияет такой фактор как эргономичность. Простота и удобство работы с прибором могут стать решающими при прочих равных характеристиках.
Например, наличие у TS4000+ дозатора шариков, 7 позиций для реагентов с подогревом и без, 16 ячеек для предварительного прогрева образцов, возможность перепрограммирования тестовых протоколов, кнопочная клавиатура, встроенный термопринтер, интерфейс RS232 для передачи информации на отдельный компьютер или во внутреннюю лабораторную сеть – свидетельствуют о том, что данный прибор будет эффективен и удобен в работе.
При выборе коагулометра следует тщательно изучить все его особенности, рассчитать стоимость эксплуатации в соответствии с объемом коагулологических исследований, а также поинтересоваться мнением коллег.
И сделать правильный выбор!
Вернуться
17 апреля – Всемирный день гемофилии
17 апреля – Всемирный день гемофилии
Гемофилия – наследственное заболевание крови, которое вызвано врожденным отсутствием или уменьшением количества факторов свертывания крови. Болезнь характеризуется нарушением свертываемости крови и проявляется в частых кровоизлияниях в суставы, мышцы и внутренние органы.
Болезнь характеризуется нарушением свертываемости крови и проявляется в частых кровоизлияниях в суставы, мышцы и внутренние органы.
Система свертывания обеспечивает сохранение крови внутри сосудов, при нарушении их целостности (травмы, медицинские вмешательства), не давая ей изливаться наружу, закрывая повреждения специальными сгустками (тромбами). Сгустки образуются в результате биохимических реакций между молекулами, присутствующими в крови каждого человека. При изучении системы свертывания их назвали «факторами свертывания».
Причина повышенной кровоточивости при гемофилии – нарушение синтеза молекул плазменных факторов свертывания. В связи с этим различают следующие основные формы гемофилии:
-
гемофилия А — вызвана дефицитом VIII фактора свертывания;
-
гемофилия B — обусловлена дефицитом IX фактора;
На долю гемофилии А приходится 80% случаев, гемофилии В – 12%. На долю оставшихся 8% приходятся другие нарушения, обусловленные дефектом выработки факторов или нехваткой факторов с другими номерами.
На долю оставшихся 8% приходятся другие нарушения, обусловленные дефектом выработки факторов или нехваткой факторов с другими номерами.
Симптомы гемофилии. У новорожденных детей признаками гемофилии могут служить длительное кровотечение из пупочной ранки, подкожные гематомы. Кровотечения у детей первого года жизни могут быть связаны с прорезыванием зубов, операциями. Острые края молочных зубов могут стать причиной прикусывания языка, губ, щек и кровотечений из слизистых оболочек полости рта. Однако, в грудном возрасте гемофилия дебютирует редко в связи с тем, что в материнском молоке содержится достаточное количество активного фермента – тромбокиназы, которая способна улучшать формирование сгустка.

Вероятность посттравматических кровотечений значительно возрастает, когда ребенок с гемофилией начинает вставать и ходить. Для детей после года характерны носовые кровотечения, подкожные и межмышечные гематомы, кровоизлияния в крупные суставы. Обострения геморрагического диатеза случаются после перенесенных инфекций (ОРВИ, ветрянки, краснухи, кори, гриппа и др.) вследствие нарушения проницаемости сосудов. В этом случае нередко возникают самопроизвольные мелкие кровоизлияния. Ввиду постоянных и длительных кровотечений у детей с гемофилией развивается анемия различной степени выраженности.
При гемофилии часто возникают кровоизлияния в мягкие ткани – подкожную клетчатку и мышцы. У детей обнаруживаются непроходящие синяки на туловище и конечностях.
Характерным признаком гемофилии является отсроченный характер кровотечения, которое обычно развивается не сразу после травмы, а через некоторое время, иногда спустя 6-12 часов.
Диагностика. Диагностика гемофилии основана на семейном анамнезе, клинической картине и данных лабораторных исследований, среди которых ведущее значение имеют:
-
увеличение длительности свёртывания капиллярной и венозной крови;
-
уменьшение концентрации одного из антигемофильных факторов (VIII, IX).

Профилактика гемофилии. С целью профилактики рождения ребенка с гемофилией проводится медико-генетическое консультирование, возможна пренатальная диагностика.
Консультативная помощь пациентам оказывается на базе гематологических отделений областных больниц, консультативных центров крупных городов, РНПЦ.
17 апреля 2019 года с 14.00 до 16.00 часов
на базе государственного учреждения
«Республиканский научно-практический центр радиационной медицины и экологии человека»
будет работать «прямая» телефонная линия
по номеру 8(0232)38-99-16.
Анна Пигулевская, фельдшер-валеолог
отдела общественного здоровья
Гомельского областного ЦГЭ и ОЗ
Гемостаз | Анатомия и физиология II
Цели обучения
К концу этого раздела вы сможете:
- Опишите три механизма, участвующих в гемостазе
- Объясните, как внешний и внутренний пути коагуляции ведут к общему пути, и факторы свертывания, участвующие в каждом из .
- Обсудить нарушения, влияющие на гемостаз

Тромбоциты играют ключевую роль в гемостазе , процессе, с помощью которого организм закрывает разрыв кровеносного сосуда и предотвращает дальнейшую потерю крови.Хотя разрыв более крупных сосудов обычно требует медицинского вмешательства, гемостаз достаточно эффективен при лечении небольших простых ран. Процесс состоит из трех этапов: спазма сосудов, образования тромбоцитарной пробки и коагуляции (свертывания крови). Невыполнение любого из этих шагов приведет к кровотечению — чрезмерному кровотечению.
Спазм сосудов
При разрыве или проколе сосуда или при повреждении стенки сосуда возникает спазм сосудов. При спазме сосуда гладкие мышцы стенок сосуда резко сокращаются.Эта гладкая мышца имеет оба круговых слоя; более крупные сосуды также имеют продольные слои. Круглые слои имеют тенденцию сужать кровоток, тогда как продольные слои, если они есть, втягивают сосуд обратно в окружающую ткань, часто затрудняя хирургу поиск, зажим и перевязку разорванного сосуда. Считается, что спазм сосудов вызывается несколькими химическими веществами, называемыми эндотелинами, которые выделяются клетками выстилки сосудов и болевыми рецепторами в ответ на повреждение сосудов.Это явление обычно длится до 30 минут, но может длиться часами.
Считается, что спазм сосудов вызывается несколькими химическими веществами, называемыми эндотелинами, которые выделяются клетками выстилки сосудов и болевыми рецепторами в ответ на повреждение сосудов.Это явление обычно длится до 30 минут, но может длиться часами.
Формирование тромбоцитарной пробки
На втором этапе тромбоциты, которые обычно свободно плавают в плазме, сталкиваются с областью разрыва сосуда с обнаженной подлежащей соединительной тканью и коллагеновыми волокнами. Тромбоциты начинают слипаться, становятся шипами и липкими и связываются с обнаженным коллагеном и эндотелиальной оболочкой. Этому процессу способствует гликопротеин в плазме крови, называемый фактором фон Виллебранда, который помогает стабилизировать растущую пробку тромбоцитов .По мере того, как тромбоциты собираются, они одновременно выделяют химические вещества из своих гранул в плазму, которые дополнительно способствуют гемостазу. Среди веществ, выделяемых тромбоцитами:
- аденозиндифосфат (АДФ), который помогает дополнительным тромбоцитам прилипать к месту повреждения, укрепляя и расширяя пробку тромбоцитов
- серотонин, поддерживающий сужение сосудов
- простагландины и фосфолипиды, которые также поддерживают сужение сосудов и помогают активировать дальнейшие химические вещества свертывания крови, как обсуждается в следующем
Пробка с тромбоцитами может временно закрыть небольшое отверстие в кровеносном сосуде. Формирование пробок, по сути, отнимает у тела время, пока проводятся более сложные и долговечные ремонтные работы. Точно так же даже современные военно-морские военные корабли все еще имеют набор деревянных заглушек для временного ремонта небольших пробоин в их корпусах до тех пор, пока не будет сделан постоянный ремонт.
Формирование пробок, по сути, отнимает у тела время, пока проводятся более сложные и долговечные ремонтные работы. Точно так же даже современные военно-морские военные корабли все еще имеют набор деревянных заглушек для временного ремонта небольших пробоин в их корпусах до тех пор, пока не будет сделан постоянный ремонт.
Коагуляция
Эти более сложные и долговечные ремонтные работы в совокупности называются коагуляцией , образованием сгустка крови. Процесс иногда называют каскадом, потому что одно событие вызывает следующее, как в многоуровневом водопаде.В результате образуется гелеобразный, но прочный сгусток, состоящий из сетки фибрина — нерастворимого нитчатого белка, полученного из фибриногена, белка плазмы, введенного ранее, — в котором удерживаются тромбоциты и клетки крови. На рисунке 1 представлены три этапа гемостаза.
Рис. 1. (a) Повреждение кровеносного сосуда запускает процесс гемостаза. Свертывание крови состоит из трех этапов. Во-первых, спазм сосудов ограничивает кровоток. Затем образуется тромбоцитарная пробка, временно закрывающая небольшие отверстия в сосуде.Затем коагуляция позволяет восстановить стенку сосуда после прекращения утечки крови. (b) Синтез фибрина в сгустках крови включает либо внутренний путь, либо внешний путь, оба из которых ведут к общему пути. (Источник: Кевин Маккензи)
Во-первых, спазм сосудов ограничивает кровоток. Затем образуется тромбоцитарная пробка, временно закрывающая небольшие отверстия в сосуде.Затем коагуляция позволяет восстановить стенку сосуда после прекращения утечки крови. (b) Синтез фибрина в сгустках крови включает либо внутренний путь, либо внешний путь, оба из которых ведут к общему пути. (Источник: Кевин Маккензи)
Факторы свертывания, участвующие в коагуляции
В каскаде коагуляции химические вещества, называемые факторами свертывания (или факторами свертывания), вызывают реакции, которые активируют еще больше факторов свертывания.Процесс сложный, но он начинается двумя основными путями:
- Внешний путь, который обычно запускается травмой.
- Внутренний путь, который начинается в кровотоке и запускается внутренним повреждением стенки сосуда.
Оба они сливаются в третий путь, называемый общим путем (см. Рисунок 1b). Все три пути зависят от 12 известных факторов свертывания, включая Ca 2+ и витамин K (Таблица 1). Факторы свертывания крови секретируются в основном печенью и тромбоцитами. Печень нуждается в жирорастворимом витамине К для производства многих из них. Витамин К (наряду с биотином и фолиевой кислотой) несколько необычен среди витаминов, поскольку он не только потребляется с пищей, но также синтезируется бактериями, проживающими в толстом кишечнике. Ион кальция, который считается фактором IV, получается из диеты и разрушения костей. Некоторые недавние данные указывают на то, что активация различных факторов свертывания крови происходит на определенных рецепторных участках на поверхности тромбоцитов.
Факторы свертывания крови секретируются в основном печенью и тромбоцитами. Печень нуждается в жирорастворимом витамине К для производства многих из них. Витамин К (наряду с биотином и фолиевой кислотой) несколько необычен среди витаминов, поскольку он не только потребляется с пищей, но также синтезируется бактериями, проживающими в толстом кишечнике. Ион кальция, который считается фактором IV, получается из диеты и разрушения костей. Некоторые недавние данные указывают на то, что активация различных факторов свертывания крови происходит на определенных рецепторных участках на поверхности тромбоцитов.
12 факторов свертывания пронумерованы с I по XIII в соответствии с порядком их обнаружения. Фактор VI когда-то считался отдельным фактором свертывания крови, но теперь считается, что он идентичен фактору V. Вместо того, чтобы перенумеровать другие факторы, фактору VI разрешили остаться в качестве заполнителя, а также напоминания о том, что знания меняются с течением времени.
Таблица 1. Факторы свертывания Факторы свертывания | ||||
|---|---|---|---|---|
| Номер фактора | Имя | Тип молекулы | Источник | Путь (и) |
| I | Фибриноген | Белок плазмы | Печень | Обычный; превращается в фибрин |
| II | Протромбин | Белок плазмы | Печень * | Обычный; превращается в тромбин |
| III | Тромбопластин ткани или тканевой фактор | Смесь липопротеинов | Поврежденные клетки и тромбоциты | Внешний |
| IV | Ионы кальция | Ионы неорганические в плазме | Диета, тромбоциты, костный матрикс | Весь процесс |
| В | Proaccelerin | Белок плазмы | Печень, тромбоциты | Внешнее и внутреннее |
| VI | Не используется | Не используется | Не используется | Не используется |
| VII | Проконвертин | Белок плазмы | Печень * | Внешний |
| VIII | Антигемолитический фактор A | Фактор белка плазмы | Тромбоциты и эндотелиальные клетки | внутренний; дефицит приводит к гемофилии A |
| IX | Антигемолитический фактор B (тромбопластиновый компонент плазмы) | Белок плазмы | Печень * | внутренний; дефицит приводит к гемофилии B |
| х | Фактор Стюарта – Проуэра (тромбокиназа) | Белок | Печень * | Внешнее и внутреннее |
| XI | Антигемолитический фактор C (предшествующий тромбопластину плазмы) | Белок плазмы | Печень | внутренний; дефицит приводит к гемофилии C |
| XII | Фактор Хагемана | Белок плазмы | Печень | внутренний; инициирует свертывание крови in vitro также активирует плазмин |
| XIII | Фактор стабилизации фибрина | Белок плазмы | Печень, тромбоциты | Стабилизирует фибрин; замедляет фибринолиз |
| * Требуется витамин К. | ||||
Внешний путь
Более быстрый и прямой внешний путь (также известный как путь тканевого фактора ) начинается, когда происходит повреждение окружающих тканей, например, при травматическом повреждении. При контакте с плазмой крови поврежденные внесосудистые клетки, не входящие в кровоток, выделяют фактор III (тромбопластин). Последовательно добавляют Ca 2+ , затем фактор VII (проконвертин), который активируется фактором III, образуя ферментный комплекс.Этот ферментный комплекс приводит к активации фактора X (фактор Стюарта-Проуэра), который активирует общий путь, обсуждаемый ниже. События внешнего пути завершаются за секунды.
Внутренний путь
Внутренний путь (также известный как путь контактной активации) длиннее и сложнее. В этом случае задействованные факторы присущи кровотоку (присутствуют в нем). Путь может быть вызван повреждением тканей в результате внутренних факторов, таких как заболевание артерий; однако чаще всего это инициируется, когда фактор XII (фактор Хагемана) вступает в контакт с посторонними материалами, например, когда образец крови помещается в стеклянную пробирку.Внутри организма фактор XII обычно активируется, когда он сталкивается с отрицательно заряженными молекулами, такими как неорганические полимеры и фосфаты, образующиеся ранее в серии реакций внутреннего пути. Фактор XII запускает серию реакций, которые, в свою очередь, активируют фактор XI (антигемолитический фактор C или предшествующий тромбопластин плазмы), а затем фактор IX (антигемолитический фактор B или тромбоплазмин плазмы). Между тем, химические вещества, выделяемые тромбоцитами, увеличивают скорость этих реакций активации.Наконец, фактор VIII (антигемолитический фактор A) из тромбоцитов и эндотелиальных клеток объединяется с фактором IX (антигемолитический фактор B или плазменный тромбоплазмин) с образованием ферментного комплекса, который активирует фактор X (фактор Стюарта-Проуэра или тромбокиназа), что приводит к общему пути . События внутреннего пути завершаются за несколько минут.
Общий путь
И внутренний, и внешний пути ведут к общему пути , по которому вырабатывается фибрин, закрывающий сосуд.После активации фактора X внутренним или внешним путем фермент протромбиназа превращает фактор II, неактивный фермент протромбин, в активный фермент тромбин . (Обратите внимание, что если бы фермент тромбин обычно не находился в неактивной форме, сгустки образовались бы спонтанно, что не соответствует жизни.) Затем тромбин превращает фактор I, нерастворимый фибриноген, в цепи растворимого фибринового белка. Фактор XIII затем стабилизирует фибриновый сгусток.
Фибринолиз
На стабилизированный сгусток действуют сократительные белки тромбоцитов.По мере того, как эти белки сокращаются, они тянут за нити фибрина, сближая края сгустка более плотно, как мы это делаем при затягивании ослабленных шнурков (см. Рис. 1а). Этот процесс также выжимает из сгустка небольшое количество жидкости, называемой сывороткой , которая представляет собой плазму крови без факторов свертывания.
Чтобы восстановить нормальный кровоток по мере заживления сосуда, со временем необходимо удалить сгусток. Фибринолиз — постепенное разрушение сгустка. Опять же, существует довольно сложная серия реакций, в которых участвует фактор XII и ферменты, катаболизирующие белок.Во время этого процесса неактивный белковый плазминоген превращается в активный плазмин , который постепенно разрушает фибрин сгустка. Кроме того, высвобождается брадикинин, сосудорасширяющее средство, обращающее действие серотонина и простагландинов на тромбоциты. Это позволяет гладкой мускулатуре стенок сосудов расслабиться и помогает восстановить кровообращение.
Плазменные антикоагулянты
Антикоагулянт — любое вещество, препятствующее свертыванию.Некоторые антикоагулянты циркулирующей плазмы играют роль в ограничении процесса свертывания в области повреждения и восстановлении нормального состояния крови без образования тромбов. Например, кластер белков, вместе именуемый системой протеина C, инактивирует факторы свертывания крови, участвующие во внутреннем пути. TFPI (ингибитор пути тканевого фактора) ингибирует превращение неактивного фактора VII в активную форму во внешнем пути. Антитромбин инактивирует фактор X и препятствует превращению протромбина (фактор II) в тромбин обычным путем.И, как отмечалось ранее, базофилы выделяют гепарин , антикоагулянт короткого действия, который также противостоит протромбину. Гепарин также находится на поверхности клеток, выстилающих кровеносные сосуды. Фармацевтическая форма гепарина часто назначается терапевтически, например хирургическим пациентам с риском образования тромбов.
Посмотреть это
Каскад коагуляции восстанавливает гемостаз за счет активации факторов свертывания при наличии травмы.
Нарушения свертывания крови
Недостаточное или чрезмерное производство тромбоцитов может привести к тяжелому заболеванию или смерти.Как обсуждалось ранее, недостаточное количество тромбоцитов, называемое тромбоцитопенией, обычно приводит к неспособности крови образовывать сгустки. Это может привести к обильному кровотечению даже из незначительных ран.
Еще одна причина нарушения свертываемости крови — недостаточное производство функциональных количеств одного или нескольких факторов свертывания. Так обстоит дело с генетическим заболеванием гемофилия , которое на самом деле представляет собой группу родственных заболеваний, наиболее распространенным из которых является гемофилия А, на которую приходится примерно 80 процентов случаев.Это нарушение приводит к неспособности синтезировать достаточное количество фактора VIII. Гемофилия B — вторая по распространенности форма, на которую приходится примерно 20 процентов случаев. В этом случае наблюдается дефицит фактора IX. Оба эти дефекта связаны с Х-хромосомой и обычно передаются от здоровой матери (носителя) ее потомству мужского пола, поскольку самцы имеют XY. Самкам необходимо унаследовать дефектный ген от каждого родителя, чтобы проявить болезнь, поскольку они XX. У пациентов с гемофилией кровотечение происходит даже из незначительных внутренних и внешних ран, а кровь течет в суставные пространства после упражнений, а также с мочой и калом.Гемофилия С — это редкое заболевание, которое вызывается аутосомной (не половой) хромосомой, что делает фактор XI нефункциональным. Это не истинно рецессивное состояние, поскольку даже люди с единственной копией мутантного гена проявляют тенденцию к кровотечению. Регулярные инфузии факторов свертывания крови, выделенных от здоровых доноров, могут помочь предотвратить кровотечение у больных гемофилией. В какой-то момент генетическая терапия станет жизнеспособным вариантом.
В отличие от нарушений, характеризующихся нарушением коагуляции, это тромбоцитоз, также упомянутый ранее, состояние, характеризующееся чрезмерным количеством тромбоцитов, которое увеличивает риск чрезмерного образования сгустков, состояние, известное как тромбоз .Тромб (множественное число = тромбы) представляет собой скопление тромбоцитов, эритроцитов и даже лейкоцитов, обычно захваченных массой нитей фибрина. В то время как образование сгустка является нормальным после только что описанного механизма гемостаза, тромбы могут образовываться в интактном или лишь слегка поврежденном кровеносном сосуде. В большом сосуде тромб будет прилипать к стенке сосуда и уменьшать кровоток, и его называют настенным тромбом. В небольшом сосуде он может полностью блокировать кровоток и называется окклюзионным тромбом.Тромбы чаще всего вызываются повреждением сосудов эндотелиальной выстилки, которое активирует механизм свертывания крови. Они могут включать венозный застой, когда кровь в венах, особенно в ногах, остается неподвижной в течение длительного времени. Это одна из опасностей длительных полетов в самолетах в условиях скопления людей и может привести к тромбозу глубоких вен или атеросклерозу, скоплению инородных тел в артериях. Тромбофилия, также называемая гиперкоагуляцией, — это состояние, при котором существует тенденция к образованию тромбозов.Это может быть семейное (генетическое) или приобретенное. Приобретенные формы включают аутоиммунную волчанку, иммунные реакции на гепарин, истинную полицитемию, тромбоцитоз, серповидно-клеточную анемию, беременность и даже ожирение. Тромб может серьезно затруднить приток крови к региону или из него и вызвать локальное повышение артериального давления. Если необходимо поддерживать поток, сердцу необходимо будет создавать большее давление, чтобы преодолеть сопротивление.
Когда часть тромба отрывается от стенки сосуда и попадает в кровоток, это называется эмболом .Эмбол, который переносится через кровоток, может быть достаточно большим, чтобы заблокировать сосуд, важный для основного органа. Когда он застревает в ловушке, эмбол называется эмболией. Соответственно, эмболия сердца, мозга или легких может вызвать сердечный приступ, инсульт или тромбоэмболию легочной артерии. Это неотложная медицинская помощь.
Среди многих известных биохимических активностей аспирина — его роль как антикоагулянта. Аспирин (ацетилсалициловая кислота) очень эффективно подавляет агрегацию тромбоцитов.Его обычно вводят во время сердечного приступа или инсульта, чтобы уменьшить побочные эффекты. Иногда врачи рекомендуют пациентам с риском сердечно-сосудистых заболеваний ежедневно принимать низкие дозы аспирина в качестве профилактической меры. Однако аспирин также может вызывать серьезные побочные эффекты, в том числе повышать риск образования язв. Пациенту рекомендуется проконсультироваться с врачом перед началом приема аспирина.
Класс препаратов, известных под общим названием тромболитические агенты, может помочь ускорить разрушение аномального сгустка.Если тромболитический агент вводится пациенту в течение 3 часов после тромботического инсульта, прогноз пациента значительно улучшается. Однако некоторые инсульты вызваны не тромбами, а кровотечением. Таким образом, причина должна быть определена до начала лечения. Активатор тканевого плазминогена — это фермент, который катализирует превращение плазминогена в плазмин, основной фермент, разрушающий сгустки. Он естественным образом выделяется эндотелиальными клетками, но также используется в клинической медицине.Новые исследования продолжаются с использованием соединений, выделенных из яда некоторых видов змей, особенно гадюк и кобр, которые в конечном итоге могут иметь терапевтическую ценность в качестве тромболитических агентов.
Обзор главы
Гемостаз — это физиологический процесс прекращения кровотечения. Гемостаз включает три основных этапа: спазм сосудов, образование тромбоцитарной пробки и коагуляцию, при которой факторы свертывания крови способствуют образованию фибринового сгустка. Фибринолиз — это процесс разрушения сгустка в заживающем сосуде.Антикоагулянты — это вещества, препятствующие свертыванию. Они важны для ограничения степени и продолжительности свертывания крови. Неадекватное свертывание крови может быть результатом слишком малого количества тромбоцитов или недостаточного производства факторов свертывания, например, при генетическом заболевании гемофилии. Чрезмерное свертывание крови, называемое тромбозом, может быть вызвано чрезмерным количеством тромбоцитов. Тромб — это скопление фибрина, тромбоцитов и эритроцитов вдоль внутренней оболочки кровеносного сосуда, тогда как эмбол — это тромб, оторвавшийся от стенки сосуда и циркулирующий в кровотоке.
Самопроверка
Ответьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.
Вопросы о критическом мышлении
- Лаборант собирает образец крови в стеклянную пробирку. Примерно через час она берет сыворотку, чтобы продолжить анализ крови. Объясните, что произошло в течение часа, когда образец находился в стеклянной пробирке.
- Объясните, почему введение тромболитического средства является первым вмешательством для человека, перенесшего тромботический инсульт.
- Когда кровь контактирует со стеклом, инициируется внутренний путь коагуляции. Это приводит к общему пути и сгусткам крови. Примерно через 30 минут сгусток начинает сокращаться. Через час он станет примерно вдвое меньше первоначального. Его более тяжелый вес заставит его упасть на дно пробирки во время центрифугирования, что позволит лаборанту собрать сыворотку, оставшуюся наверху.
- При тромботическом инсульте кровеносный сосуд головного мозга заблокирован тромбом, скоплением тромбоцитов и эритроцитов внутри кровеносного сосуда.Тромболитическое средство — это лекарство, способствующее разрушению тромбов.
Глоссарий
антикоагулянт: вещество, такое как гепарин, которое препятствует коагуляции
антитромбин: антикоагулянт , который инактивирует фактор X и препятствует превращению протромбина (фактор II) в тромбин по общему пути
Факторы свертывания: Группа из 12 идентифицированных веществ, активных в процессе свертывания
коагуляция: образование тромба; часть процесса гемостаза
общий путь: конечный путь свертывания, активируемый внутренним или внешним путем и заканчивающийся образованием сгустка крови
эмбол: тромб, оторвавшийся от стенки кровеносного сосуда и вошедший в кровоток
внешний путь: начальный путь коагуляции, который начинается с повреждения ткани и приводит к активации общего пути
фибрин: нерастворимый нитчатый белок, образующий структуру сгустка крови
фибринолиз: постепенное разрушение сгустка крови
гемофилия: генетическое заболевание, характеризующееся недостаточным синтезом факторов свертывания крови
кровоизлияние: обильное кровотечение
гемостаз: физиологический процесс прекращения кровотечения
гепарин: антикоагулянт короткого действия, хранящийся в тучных клетках и высвобождаемый при повреждении тканей, противостоит протромбину
внутренний путь: начальный путь коагуляции, который начинается с повреждения сосудов или контакта с инородными веществами и приводит к активации общего пути
плазмин: белок крови, активный при фибринолизе
пробка тромбоцитов: накопление и адгезия тромбоцитов в месте повреждения кровеносного сосуда
сыворотка: плазма крови, не содержащая факторов свертывания
тромбин: фермент, необходимый для заключительных стадий образования фибринового сгустка
тромбоз: чрезмерное образование сгустка
тромб: агрегация фибрина, тромбоцитов и эритроцитов в интактной артерии или вене
тканевый фактор : белок тромбопластин , который инициирует внешний путь при высвобождении в ответ на повреждение ткани
спазм сосудов: начальный этап гемостаза, при котором сокращаются гладкие мышцы стенок разорванного или поврежденного кровеносного сосуда
| Количество и название факторов свертывания | Описание и происхождение | Функция |
| Факторы плазменной коагуляции: | ||
| фактор I: Фибриноген | Белок плазмы синтезируется в печени. | Предшественник фибрина, превращенный в фибрин на последней стадии свертывания крови. Сыворотка — это плазма без фибриногена. |
| фактор II: Протромбин | Белок плазмы синтезируется в печени. Для синтеза необходим витамин К. | Предшественник тромбина, фермента, превращающего фибриноген в фибрин. |
| фактор III: Тромбопластин | Сложный липопротеин, образованный из распадающихся тромбоцитов или тканей. | Объединяется с кальцием для преобразования протромбина в активный тромбин. |
| фактор IV: Ионы кальция | Неорганический ион в плазме, полученный из костей и пищи. | Необходим для образования тромбина и для всех стадий свертывания крови. |
| Фактор V: Проакцелерин, лабильный фактор или глобулин-ускоритель. | Белок плазмы синтезируется в печени. | Необходим для внешних и внутренних путей |
| Фактор VI | Больше не считается отдельной сущностью, возможно, такой же, как фактор V. | |
| фактор VII: Ускоритель конверсии протромбина в сыворотке (SPCA), стабильный фактор или проконвертин | Белок плазмы, синтезируемый в печени. Для синтеза необходим витамин К. | Необходим для первой фазы внешнего пути. |
| фактор VIII: Антигемофильный фактор (AHF), антигемофильный фактор A или антигемолитический глобулин (AHG) | Белок плазмы, синтезируемый в печени и других тканях. | Необходимо для первой фазы внутреннего пути.Дефицит вызывает гемофилию A, генетическое заболевание. |
| фактор IX: Тромбопластиновый компонент плазмы (PTC), фактор Рождества или антигемофильный фактор B | Белок плазмы синтезируется в печени. Для синтеза необходим витамин К. | Необходим для первой фазы внутреннего пути. Дефицит вызывает гемофилию B. |
| Фактор X: Фактор Стюарта-Проуэра или фактор Стюарта | Белок плазмы синтезируется в печени. Для синтеза необходим витамин К. | Необходим на ранних этапах внешних и внутренних путей. |
| f субъект XI: Предшественник тромбопластина в плазме (PTA) или антигемофильный фактор C | Белок плазмы, синтезируемый в печени. | Необходимо для первой фазы внутреннего пути. Дефицит вызывает гемофилию C. |
| Фактор XII : фактор Хагемана или фактор стекла | Белок плазмы, источник неизвестен. | Необходим для первой фазы внутреннего пути, активирует плазмин, активируется при контакте со стеклом, вероятно, участвует в свертывании крови вне тела. |
| фактор XIII: Фибрин-стабилизирующий фактор (ФСФ) или фактор Ларки-Лоранда | Белок присутствует в плазме и тромбоцитах, источник неизвестен. | Необходимо для финальной фазы свертывания крови. |
Исследование регуляции свертывания крови факторами VIIa и IXa
Михаил В.Ованесов, канд.
Отделение тканей и современной терапии
Отделение белковой терапии плазмы
Отделение гемостаза
Биоскетч
Доктор Ованесов — биофизик, который присоединился к Лаборатории гемостаза Управления исследований и анализа крови в 2009 году в качестве ученого-регулятора и главного исследователя. Он изучает свертывание крови с 1998 года и имеет междисциплинарный опыт в биохимии, нейровирологии и разработке биомедицинских инструментов.
Д-р Ованесов защитил кандидатскую диссертацию. степень по биохимии и биофизике в Национальном исследовательском центре гематологии в Москве, Россия, после чего последовали постдокторские стипендии в Лаборатории биомедицинских наук Американского Красного Креста в Роквилле, Мэриленд, Медицинской школе Университета Джона Хопкинса в Балтиморе, Мэриленд, и Janelia Farm Research Кампус медицинских институтов Говарда Хьюза в Эшберне, штат Вирджиния.
Д-р Ованесов проводит экспертную оценку заявок на новые исследуемые препараты (IND) и заявок на получение лицензии на биологические препараты (BLA) для продуктов, полученных из плазмы крови, и продуктов рекомбинантных белков плазмы, лиофилизированной плазмы человека, генной терапии гемофилии и связанных устройств.Он выступает в качестве рецензента продукта и председателя комитета по первоначальным представлениям BLA и участвует в инспекциях производственных мощностей.
Его лаборатория в CBER разрабатывает биологические эталоны и новые методы гемостаза, а также исследует механизмы действия прокоагулянтных терапевтических средств.
Общий обзор
CBER регулирует продукты, предотвращающие опасную для жизни кровопотерю у людей, у которых отсутствуют определенные белки, которые организм использует для свертывания крови (образования сгустков).Эти продукты включают фактор свертывания крови VII (активированный), фактор IX и фактор XI.
Свертывание крови — это сложный, многоступенчатый процесс, требующий множества различных факторов свертывания. Эти факторы должны работать вместе в скоординированной последовательности для образования тромба при повреждении кровеносных сосудов. Процесс свертывания может быть быстрым и эффективным; однако, если его не остановить, свертывание крови может привести к тромбозу (чрезмерное свертывание, которое блокирует кровоток). Кроме того, свертывание крови контролируется динамической системой белков свертывания, называемых ингибиторами.Когда тонкий баланс между свертыванием (прокоагуляцией) и ингибированием (антикоагуляцией) отклоняется в ту или иную сторону, результатом может быть опасный для жизни тромбоз или спонтанное кровотечение.
Наша лаборатория совершенствует тесты, используемые клиническими лабораториями и производителями лекарств для определения активности концентратов факторов свертывания крови. Мы делимся нашими методами с отраслью и регулирующими органами, чтобы эти продукты оставались безопасными и эффективными. Наши аналитические методы облегчают анализ новых продуктов, обладающих свойствами, отличными от свойств естественных факторов свертывания крови.Методы и международные стандарты, разработанные в нашей лаборатории, также помогают клиническим лабораториям и производителям стандартизировать мониторинг эффективности лечения пациентов, страдающих от этих разрушительных состояний.
Чтобы улучшить тестирование свертывания крови, мы разрабатываем новые методы, которые лучше отражают сложность системы свертывания крови. Доступные в настоящее время тесты, используемые для диагностики нарушений свертывания крови, представляют собой только отдельные этапы сложного процесса.Такие тесты могут диагностировать отсутствие одного конкретного фактора свертывания или ингибитора в крови пациента, но не могут указать состояние баланса между про- и антикоагулянтной системами. Таким образом, необходимы новые тесты для оценки степени тяжести заболевания у пациентов, мониторинга лечения для определения его эффективности или прогнозирования побочных эффектов лечения, таких как чрезмерное свертывание крови у пациента с кровотечением. Наша лаборатория работает над новыми тестами, которые отражают текущие знания о действии существующих и разрабатываемых препаратов фактора свертывания крови.
Один из таких тестов, тест на образование тромбина, позволяет осуществлять непрерывный мониторинг про- и антикоагуляционных событий в течение длительного периода времени одновременно в нескольких образцах плазмы. Мы также изучаем свертывание крови с помощью видеомикроскопа, который фиксирует рост размера сгустка на искусственной модели повреждения кровеносного сосуда.
Эти новые тесты помогли нам исследовать связь между острыми тромботическими событиями (инсульт и сердечный приступ) и распространенными контаминантами в терапии, получаемой из плазмы, такой как концентраты фактора IX и продукты иммуноглобулина.Мы обнаружили, что тромботические явления могут возникать как побочная реакция на введение зараженной терапии.
В своей работе мы объединяем современные модели свертывания крови с новыми лабораторными методами для повышения безопасности регулируемых продуктов. В конечном итоге наши результаты помогают улучшить контроль за качеством продукции и предотвратить распространение потенциально небезопасных лекарств среди пациентов.
Научный обзор
Дисбаланс в системе свертывания крови может вызвать опасный для жизни тромбоз и кровотечение.К сожалению, существующие анализы функции свертывания крови имеют плохую прогностическую ценность для многих патологических состояний и не могут использоваться для диагностики и мониторинга лечения. Мы считаем, что тестирование коагуляции можно улучшить, оценив физиологические процессы, которые не представлены традиционными анализами. Мы разрабатываем тесты, основанные на недавних открытиях, которые уточняют биологическую активность существующих и новых продуктов факторов свертывания крови. Использование этих инструментов улучшит лечение и уход за пациентами, страдающими нарушениями свертывания крови.
Потенциальные преимущества и риски существующих и новых продуктов, связанных с свертыванием крови, следует изучать с помощью физиологически значимых анализов. Наши исследования механизмов свертывания крови обеспечат основу для разработки более совершенных тестов на свертываемость и валидации анализов. Знания, полученные в результате наших исследований, помогают при оценке продуктов свертывания крови, чтобы гарантировать их эффективность, безопасность и высокое качество.
Наша исследовательская программа разработана, чтобы углубить наше понимание механизмов свертывания крови за счет использования новых анализов, которые измеряют глобальную функцию свертывания.Методы образования тромбина / фибрина и роста сгустка на основе видеомикроскопии позволяют оценить многие аспекты свертывания крови, как это происходит in vivo ; например, активация с низким уровнем физиологического триггера, постепенными изменениями ферментативной активности и свертывания крови, а также ограниченным разбавлением исследуемой плазмы. Однако эти новые анализы еще не оптимизированы и не валидированы специально для определения активности факторов свертывания, и, таким образом, валидация этих тестов является одной из целей наших исследований.
Другой целью является выяснение активированных факторов VII, IX и XI как регуляторов гемостаза и тромбоза. Лицензированная доза фактора VIIa превышает его физиологический уровень на несколько порядков; тем не менее, лечение является безопасным для целевой группы пациентов с гемофилией с ингибирующими антителами к факторам IX и VIII. Напротив, даже следовые количества фактора IXa в концентратах фактора IX или фактора XIa в продуктах иммуноглобулинов плазмы крови могут привести к серьезным тромботическим побочным эффектам.Чтобы лучше понять механизмы действия этих молекул, мы исследуем аналитические условия, которые могут предсказать продолжительность их клинического эффекта in vivo . Эти исследования помогают в оценке безопасности и эффективности продуктов, которые лечат нарушения свертывания крови.
Улучшение нашего понимания того, как поддерживается баланс процесса свертывания крови, помогает в нормативной оценке текущих продуктов и новых методов лечения, многие из которых являются генетически или химически модифицированными, чтобы иметь новые и уникальные биохимические характеристики.
Важные ссылки
Публикации
- Res Pract Thromb Haemost 2020 Jun 12; 4 (5): 944-5
Влияние pH на активность тромбина, измеренное с помощью калиброванной автоматической тромбинографии.
Джексон Ю.В., Суров С.С., Лян Ю., Парунов Л.А., Ованесов М.В. - Blood Adv 2019 Sep 10; 3 (17): 2668-78
Смягчение Т-клеточной иммуногенности с помощью реинжиниринга аналога фактора VIIa.
Jankowski W, McGill J, Lagasse HAD, Surov S, Bembridge G, Bunce C, Cloake E, Fogg MH, Jankowska KI, Khan A, Marcotrigiano J, Ovanesov MV, Sauna ZE - J Thromb Haemost 2019 Apr; 17 (4): 695-7
Создание 2-го международного стандарта ВОЗ по фактору V, плазма (16/374): сообщение от SSC ISTH.
Hubbard AR, Thelwell C, Rigsby P, Подкомитет по фактору VIII, фактору IX и редким нарушениям свертывания крови - Cell Mol Life Sci 2018 Oct; 75 (20): 3781-801
Анализ биохимической архитектуры и морфологических путей высвобождения внеклеточного везикулома тромбоцитов человека.
De Paoli SH, Tegegn TZ, Elhelu OK, Strader MB, Patel M, Diduch LL, Tarandovskiy ID, Wu Y, Zheng J, Ovanesov MV, Alayash A, Simak J - Haemophilia 2017 May; 23 (3): 466-75
Можно ли повысить диагностическую надежность теста на образование тромбина в качестве глобального метода гемостаза? Влияние концентрации хлорида кальция.
Парунов Л.А., Суров С.С., Лян Ю., Ли Т.К., Ованесов М.В. - Am J Hematol 2017 Apr; 92 (4): E44-5
Ассоциация внутривенных иммунных глобулинов (IGIV) и тромбоэмболических нежелательных явлений (TEE).
Ованесов М.В., Менис М.Д., Скотт Д.Е., Форши Р., Андерсон С., Брайан В., Голдинг В - J Thromb Haemost 2017 Apr; 15 (4): 709-20
Экспрессия и характеристика кодон-оптимизированного фактора свертывания крови VIII.
Shestopal SA, Hao JJ, Karnaukhova E, Liang Y, Ovanesov MV, Lin M, Kurasawa JH, Lee TK, McVey JH, Sarafanov AG - Arterioscler Thromb Vasc Biol 2016 Dec; 36 (12): 2334-45
Синергия между тканевым фактором и экзогенным фактором XIa в инициировании коагуляции.
Leiderman K, Chang WC, Ovanesov M, Fogelson AL - Haemophilia 2016 Sep; 22 (5): 780-9
Оптимизация тестовых компонентов образования тромбина для измерения эффективности концентратов фактора VIII.
Jha NK, Shestopal SA, Gourley MJ, Woodle SA, Liang Y, Sarafanov AG, Weinstein M, Ovanesov MV - J Extracellular Vesicles 2016 May 4; 5: 30422
Характеристика прокоагулянтных внеклеточных везикул и распада мембран тромбоцитов в DMSO-криоконсервированных тромбоцитах.
Tegegn TZ, De Paoli SH, Orecna M, Elhelu OK, Woodle SA, Тарандовский И.Д., Ованесов М.В., Simak J - Thromb Res 2016 Apr; 140: 132-9
Взаимосвязь параметров глобального гемостаза при одновременной оценке образования тромбина, образования фибрина и лизиса сгустка в нормальной плазме.
Синь KZ, Чанг В.С., Ованесов М.В. - J Pharm Sci 2016 Mar; 105 (3): 1023-7
Невидимое содержание частиц, состав и доза продукта-миметика эритропоэтинового пептида связаны с серьезными побочными эффектами постмаркетингового периода.
Котарек Дж., Стюарт К., Де Паоли С.Х., Симак Дж., Лин Т.Л., Гао Ю., Ованесов М., Лян И, Скотт Д., Браун Дж., Бай Ю., Меткалф Д.Д., Маршал Е., Рагхеб Дж. - J Thromb Haemost 2015 Dec; 13 (12): 2168-79
Введение препарата фактора свертывания крови и возникновение тромботических событий в тот же день, как было зарегистрировано в большой базе данных здравоохранения в течение 2008-2013 гг.
Экезуэ Б.Ф., Шридхар Г., Ованесов М.В., Форши Р.А., Изуриета Х.С., Селвам Н., Парунов Л., Джайн Н., Минц П.Д., Эпштейн Дж., Андерсон С.А., Менис М - J Thromb Haemost 2015 Aug; 13 (8): 1527-30
Отсутствие влияния ингибитора кукурузного трипсина на фактор XIa-зависимого образования тромбина: комментарий.
Парунов Л.А., Суров С.С., Такер Э., Ованесов М.В. - Врожденные дефекты Res C Embryo Today 2015 Сентябрь; 105 (3): 167-84
Эпидемиология венозной тромбоэмболии (ВТЭ), связанной с беременностью.
Парунов Л.А., Сошитова Н.П., Ованесов М.В., Пантелеев М.А., Серебряный И.И. - Biochemistry 2015 Jan; 54 (2): 481-9
Кластер III белка 1, связанного с рецептором липопротеинов низкой плотности, связывает активированный фактор свертывания крови VIII.
Kurasawa JH, Shestopal SA, Woodle SA, Ованесов М.В., Ли Т.К., Сарафанов А.Г.
Коагуляция — Creative Diagnostics
Введение коагуляции
Свертывание крови — это процесс, при котором кровь переходит из текущего жидкого состояния в нетекучий желеобразный сгусток.Это процесс ограниченного гидролиза ряда белков, участвующих в факторах свертывания крови. Ключевым процессом свертывания крови является превращение фибриногена в плазме в нерастворимый фибрин. Мультимерный фибрин сплетен в сеть, и многие клетки крови объединены в сеть, образуя сгустки крови. Вещества, непосредственно участвующие в процессе свертывания крови в крови и тканях, вместе называются факторами свертывания крови. Свертывание крови имеет 12 видов, и в международной номенклатуре признанных их видов они пронумерованы римскими цифрами.Кроме того, прекалликреин, кининоген и фосфолипиды, полученные из тромбоцитов, также непосредственно участвуют в процессе свертывания крови. В факторе свертывания крови фактор IV представляет собой ион, а остальные факторы свертывания крови представляют собой белки, при этом факторы II, VII, IX, X, XI и XII являются эндонуклеазами. Обычно в крови все II, IX, X, XI и XII находятся в форме неактивных зимогенов, которые должны быть активированы, чтобы быть активными. Активированные ферменты называют активными формами этих факторов. Через 1-2 часа после процесса свертывания крови сгусток крови сжимается и выпадает в осадок в виде бледно-желтой жидкости под действием тромбоцитов.Эта жидкость называется сывороткой. По сравнению с плазмой в сыворотке отсутствует фибриноген и небольшое количество других белков плазмы, участвующих в свертывании крови, а также небольшое количество веществ, выделяемых тромбоцитами во время гемагглютинации.
Механизм коагуляции
О механизме свертывания крови создано множество учений. До 1993 года Международный комитет по отбору названий факторов свертывания крови публиковал образцы механизмов свертывания крови человека, которые были широко приняты.По схеме коагуляцию можно разделить на четыре этапа: 1. Формирование активатора протромбина; 2. Образование тромбина; 3. Образование фибрина; 4. Фибринолиз.
Образование активатора протромбина
От начала коагуляции до образования тромбина он состоит из эндогенной и экзогенной систем. Эндогенный (присущий крови) механизм свертывания — это отдельный процесс крови. При контакте крови с поверхностью инородного тела (коллагенового волокна стенки кровеносного сосуда и т. Д.)), фактор XII и фактор XI контактного фактора активируются, а когда фактор VI активируется, он активирует неактивный фактор IX. С другой стороны, тромбоциты также прилипают и агломерируются на поверхности инородных тел и вызывают вязкий метаморфоз с высвобождением фактора III тромбоцитов. Сразу же в плазме фактор VIII и ионы кальция вступают в реакцию с этим активным фактором XI и фактором тромбоцитов III, чтобы активировать неактивный фактор X. Затем фактор V и фактор III тромбоцитов действуют на фактор X, превращая протромбин в тромбин.Механизм экзогенного (тканевого) происхождения — это процесс попадания тканевой жидкости в кровь. Активный компонент тканевой жидкости способствует взаимодействию между тромбопластином и фактором VII плазмы, а затем активирует фактор X. Наконец, фактор V и ион кальция действуют на активированный фактор X, превращая протромбин в тромбин.
Образование тромбина
Процесс превращения протромбина в тромбин. Фактор X и фактор V, активируемые на первой стадии свертывания, и ионы кальция, действующие на протромбин, разрывают связь аргинин-изолейцин в молекуле протромбина с образованием тромбина.
Образование фибрина
Процесс, при котором фибриноген превращается в фибриновый сгусток под действием тромбина. Из-за действия тромбина связь аргинин-глицин между α-связью и β-связью в молекуле фибриногена расщепляется, и пептиды фибрина A и B высвобождаются с образованием мономера фибрина. Мономер фибрина полимеризуется в полимер фибрина. Фактор VIII (трансглутаминаза), активируемый действием тромбина и ионов кальция вместе с ионами кальция, способствует образованию связи между глутамином и лизином в молекуле фибрина.В результате может образоваться прочный фибриновый блок. Кроме того, на третьем этапе коагуляции кровь свертывается в лепешку, но со временем из-за действия сократительных белков тромба тромбоцитов она сжимается.
Фибринолиз
Однако в организме есть четвертый этап: серия реакций с участием фибринолиза, вызванного плазмином, поэтому эти реакции также включены в понятие свертывания крови.
Клиническая значимость
Изучение механизмов свертывания крови способствовало пониманию многих геморрагических заболеваний, таких как гемофилия (процесс свертывания крови у пациента очень медленный или даже незначительное повреждение также вызывает кровотечение), в основном из-за отсутствия фактора VIII в плазме.Кроме того, установлено, что все факторы свертывания крови II, VII, IX и X синтезируются в печени, и витамин K необходим для участия в их образовании. Недостаток витамина К, будет склонность к кровотечениям; Применение витамина К может улучшить симптомы плохой коагуляции. Кроме того, в лабораторных или клинических условиях для каждого звена процесса свертывания крови могут быть приняты различные меры, необходимые для достижения цели задержки свертывания или эффективной остановки кровотечения.Если после операции предотвратить кровотечение, на место операции можно нанести коагулирующие вещества, такие как тромбин и фибрин, а также использовать теплую марлю, вату или желатиновую губку, чтобы придавить рану и способствовать коагуляции.
Тромбоз — это патологическое развитие тромбов. Эти сгустки могут разорваться и стать подвижными, образуя эмбол, или вырасти до такого размера, который закроет сосуд, в котором он развился. Сообщается, что эмболия возникает, когда тромб (сгусток крови) становится подвижным эмболом и мигрирует в другую часть тела, нарушая кровообращение и, следовательно, нарушая функцию органа ниже окклюзии.Это вызывает ишемию и часто приводит к ишемическому некрозу тканей. Большинство случаев венозного тромбоза вызвано приобретенными состояниями (пожилой возраст, хирургическое вмешательство, рак, неподвижность) или наследственными тромбофилиями (например, антифосфолипидным синдромом, фактором V Лейдена и различными другими генетическими недостатками или вариантами).
Артикулы:
- Furie B, Furie BC. Тромбообразование in vivo. Дж. Клин . Вкладывать деньги. 2005, 115 (12): 3355–3362.
- Паллистер CJ, Watson MS.Гематология. Издательство Scion . 2010. С. 334–336.
- Long AT и др. Пересмотр контактной системы: интерфейс между воспалением, коагуляцией и врожденным иммунитетом. Журнал тромбоза и гемостаза . 2015 г., 14: 427–437.
- Шапиро СС. Лечение тромбоза в 21 веке. N. Engl. J. Med . 2003, 349 (18): 1762–4.
- Giangrande PL. Шесть персонажей в поисках автора: история номенклатуры факторов свертывания. Br. J. Haematol . 2003, 121 (5): 703–12.
- MacFarlane RG. Ферментный каскад в механизме свертывания крови и его функция в качестве биохимического усилителя. Природа. 1964, 202 (4931): 498–9.
Твиттер Facebook
Трансферрин играет центральную роль в балансе коагуляции, взаимодействуя с факторами свертывания
Образцы атеросклеротической бляшки и плазмы человека
Институциональный наблюдательный совет Института зоологии Куньмина (KIZ) и больницы Яньаньского медицинского университета одобрил это исследование (КИЗ-Я-20150109).Все человеческие образцы были собраны с информированного согласия пациентов до исследования. Образцы плазмы от пациентов с ИБС ( n, = 120) и здоровых людей из контрольной группы ( n = 120) были собраны в больнице Яньаньского филиала Медицинского университета Куньмина (дополнительная информация, таблица S1). Всего в настоящем исследовании было отобрано 120 пациентов с ИБС, демонстрирующих ангиографически видимое сужение просвета. Пациентам с клиническими признаками стенокардии дополнительно диагностировали коронарную ангиографию.120 пациентов были сопоставлены со 120 здоровыми добровольцами в качестве нормальной контрольной группы с ангиографически нормальными коронарными артериями и отсутствием в анамнезе гипертонии, сахарного диабета или гиперхолестеринемии. Сразу после взятия крови (с 1,5% EDTA-Na 2 использовалось в качестве антикоагулянта) плазму получали центрифугированием при 3000 об / мин в течение 20 мин при 4 ° C и хранили при -80 ° C после упаковки .
Образцы атеросклеротических бляшек были получены в результате коронарной эндартерэктомии, а нормальные артерии были получены в результате операции коронарного шунтирования ( n = 12, возраст 30–80 лет) (дополнительная информация, таблица S2) из больницы Yan’an Affiliated of Kunming Medical Университет.Сразу после хирургического удаления некоторые образцы измельчали и гомогенизировали при 4 ° C для экстракции белка, а затем хранили при -80 ° C после упаковки; некоторые были зафиксированы в 10% забуференном формалине для приготовления замороженных срезов; а некоторые помещали в RNAlater (R0901-500ML, Sigma, США) для экстракции РНК и хранили при -80 ° C до дальнейшего использования.
Заявление о животных и этике
Все эксперименты на животных были одобрены Комитетом по уходу и использованию животных Института зоологии Куньмина (SMKX-2016013) и соответствовали Руководству Национального института здравоохранения США по уходу и использованию лабораторных животных ( The National Academies Press, 8-е издание, 2011 г.). Apoe — / — мышей (самки, возраст 8 недель, фон C57BL / 6J, количество обратных скрещиваний: 10 раз) и мышей C57BL / 6J (самки, возраст 8 недель) были приобретены у Vitalriver Experiment Animal Company ( Пекин, Китай) и размещены в среде, свободной от патогенов. Мышей содержали в стерильных изоляторах с автоклавированным кормом и водой при 12-часовом цикле свет — 12 часов темноты при 24 ° C.
Хромогенные анализы
Эффекты плазмы у пациента с ИБС и здоровой контрольной плазмы (кровь готовили путем смешивания 1: 9 объема тринатрийцитрата (0.13 M) и крови с плазмой, полученной затем центрифугированием при 3000 об / мин в течение 20 мин при 4 ° C) протеаз (калликреин, FXIIa, FXIa, FVIIa и тромбин), участвующих в коагуляции, тестировали с использованием соответствующих хромогенных субстратов. Тестируемый фермент инкубировали с плазмой (1 мкл) в 60 мкл буфера Tris-HCl (50 мМ, pH 7,4) в течение 5 минут с добавлением хромогенного субстрата определенной концентрации, как описано ниже. Немедленно отслеживали поглощение при 405 нм и записывали кинетическую кривую, используя меченый ферментом прибор (Epoch, BioTek, США) в течение 30 мин.Относительную активность фермента получали путем расчета скорости ферментативного гидролиза его субстрата. Человеческий α-тромбин (20 нМ, T6884, Sigma, США) и человеческий α-FXIIa (20 нМ, HFXIIa 1212a, Enzyme Research Laboratories, США) реагировали с 0,2 мМ хромогенными субстратами HD -Phe-Pip-Arg- p Na · 2HCl (CS-01, Hyphen Biomed, Франция) и HD -Pro-Phe-Arg- p NA · 2HCl (CS-31, Hyphen Biomed, Франция) соответственно. Концентрация калликреина (HPKa 1303, Enzyme Research Laboratory, США) и FXIa (HFXIa 1111a, Enzyme Research Laboratory, США) составляла 40 и 10 нМ соответственно, а соответствующие хромогенные субстраты равнялись 0.2 мМ HD -Pro-Phe-Arg- p NA · 2HCl (CS-31, Hyphen Biomed, Франция) и 0,2 мМ pyroGlu-Pro-Arg-pNA · HCl (S-2366, Chromogenix, США), соответственно. Концентрация, использованная для FVIIa (HFVIIa, Enzyme Research Laboratory, США), составляла 20 нМ, а хромогенный субстрат — 0,1 мМ CH 3 SO 2 -D-CHA-But-Arg- p NA · AcOH (ADG217L , Sekisui Diagnostics, Германия).
Очистка и идентификация трансферрина
Сначала были удалены альбумин и IgG с использованием колонки HiTrap Albumin and IgG depletion (GE, США).Плазму разбавляли (1: 1) 20 мМ трис-HCl буфером, содержащим 20 мМ NaCl (pH 7,8), а затем наносили на колонку Resource Q (17-1177-01, GE, США) для очистки с помощью быстрой жидкостной хроматографии белков. (FPLC) система (GE, США). Колонку предварительно уравновешивали растворителем A (20 мМ Трис-HCl, pH 7,8), и элюирование проводили с линейным градиентом 0–100% растворителя B (20 мМ Трис-HCl, 1 М NaCl, pH 7,8) выше 100 мин. Фракцию, проявляющую активность против тромбина и FXIIa, подвергали колонке Mono Q (17-5166-01, GE, США) для дальнейшей очистки с использованием той же системы элюирования, что и выше.
Очищенный усилитель тромбин / FXIIa (10 мкг) растворяли в 25 мМ буфере NH 4 HCO 3 и восстанавливали 10 мМ дитиотреитолом (DTT) в течение 1 часа при 37 ° C. Восстановленный образец алкилировали 30 мМ йодацетамидом, растворенным в том же буфере, в течение 30 мин при комнатной температуре в темном месте. Реакцию алкилирования заканчивали добавлением дополнительного количества DTT. Образец обрабатывали 1% трипсином (мас. / Мас.) При 37 ° C в течение ночи для масс-спектрометрии (МС). Матричный масс-спектрометр с лазерной десорбционной ионизацией по времени пролета (MALDI-TOF / TOF) (Autoflex speed, BrukerDaltonics, Германия) использовался для сбора данных в соответствии с инструкциями производителя.Спектры МС и МС / МС собирали и обрабатывали с использованием программного обеспечения FlexControl, FlexAnalysis и BioTools (BrukerDaltonics, Германия).
Измерение трансферрина в плазме крови человека и образцах тканей
Концентрацию трансферрина в плазме пациентов с ИБС и здоровых людей в контрольной группе определяли с использованием набора ELISA для человеческого трансферрина (EK12012-96T, Multi Sciences, Китай) в соответствии с инструкциями производителя. TIBC в плазме этих пациентов с ИБС и здоровых людей определяли с помощью набора TIBC (ab239715, Abcam, США) в соответствии с инструкциями производителя.Количество трансферрина в плазме и гомогенатах бляшек также определяли с помощью вестерн-блоттинга. Вкратце, гомогенаты плазмы и ткани сначала разделяли электрофорезом в 12% додецилсульфат натрия в полиакриламидном геле (SDS-PAGE), а затем переносили на мембраны из поливинилидендифторида (PVDF). Антитело против трансферрина (1: 2000, 11019-RP02, Sino Biological Inc, Китай) использовали для иммунореактивности. Для контроля загрузки и переноса плазмы мембраны окрашивали Red Ponceau после переноса или блоттинга на β-актин в качестве контроля загрузки гомогенатов бляшек.
Влияние трансферрина на ферментативную активность факторов свертывания
Влияние апо-трансферрина или голо-трансферрина (Sigma, чистота более 98%, отсутствие остаточной ферментативной активности FXIIa и тромбина) на протеазы, участвующие в коагуляции (калликреин, FXIIa , FXIa, FVIIa и тромбин) тестировали с использованием соответствующих хромогенных субстратов, как описано выше. Сывороточный альбумин человека (HSA, чистота более 98%) использовали в качестве контроля. Влияние трансферрина на тромбин на гидролиз его природного субстрата (фибриногена) анализировали с помощью системы высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC).Вкратце, человеческий α-тромбин (0,1 ед. NIH) в 40 мкл трис-HCl (25 мМ, pH 7,4) инкубировали с 500 мкл фибриногена (10 мг / мл, 16088, Кайман, США) в том же буфере, содержащем 0,15 M NaCl в присутствии апо-трансферрина (0,2–5 мкМ) в течение 30 мин при 37 ° C. После инкубации добавляли 500 мкл 20% трихлоруксусной кислоты (TCA), чтобы остановить реакцию, с последующим центрифугированием при 12000 об / мин в течение 10 минут при 4 ° C для осаждения нерастворимого белка. Аликвоты (700 мкл) супернатанта использовали для анализа RP-HPLC.Система элюирования состояла из растворителя A (0,025 M ацетат аммония, pH 6,0) и линейного градиента 0–100% растворителя B (50% ацетонитрила в 0,05 M ацетате аммония, pH 6,0) в течение 100 мин. Высвобождение FbpA и FbpB количественно оценивали путем расчета соответствующей площади элюированного пика на колонке C 18 (30 см × 0,46 см, Hypersil BDS, США) соответственно.
Эффект трансферрина на FXIIa по гидролизу его природного субстрата (прекалликреина, PK) анализировали с помощью SDS-PAGE. ПК (10 мкг, HPK1302, Enzyme Research Laboratory, США) инкубировали с α-FXIIa человека (20 нМ) в 40 мкл буфера Трис-HCl (50 мМ, pH 7.4) в присутствии апо-трансферрина (0,2–5 мкМ). После 30 мин инкубации при 37 ° C все реакции наносили на 12% SDS – PAGE. Продукция тяжелой цепи калликреина (HC ~ 52 кДа) и легкой цепи (LC ~ 36 и 33 кДа) была обнаружена с помощью вестерн-блоттинга с использованием поликлонального антитела PK против плазмы (1: 1000, SAPK-IG, Enzyme Research Laboratories, США. ). Кроме того, PK, тяжелая цепь FXIIa (FXIIa HC) и трансферрин также были обнаружены с использованием анти-плазменного PK, анти-FXII (1: 2000, ab242123, Abcam, США) и анти-трансферрина (1: 2000, 11019- RP02, Sino Biological Inc, Китай) соответственно.HC калликреина определяли количественно с использованием программного обеспечения ImageJ. Эффекты трансферрина на активацию протромбина (HP 1002, Enzyme Research Laboratories, США) и FXII (HFXII 1212, Enzyme Research Laboratories, США) оценивали с использованием соответствующих хромогенных субстратов и реакционной системы, как описано выше.
Влияние трансферрина на образование комплекса тромбин / FXa – AT in vitro
Вкратце, трансферрин (2,5–10 мкМ), AT (2 мкМ, A2221-125UG, Sigma, США) и тромбин (20 нМ) или FXa ( 20 нМ, HFXa 1011, Enzyme Research Laboratory, США) одновременно инкубировали в 60 мкл трис-HCl буфера (50 мМ, pH 7.4) в течение 5 минут при 37 ° C с активностью тромбина или FXa, затем тестировали с использованием соответствующих хромогенных субстратов, как описано выше для тромбина и Z-D-Arg-Gly-Arg-pNA · 2HCl (S-2765, Aglyco, Китай) для FXa. Только тромбин или FXa или инкубированные с AT в том же буфере также использовали для тестирования активности тромбина и FXa. В качестве контроля использовали равные концентрации HSA. Комплекс тромбин-АТ (ТАТ) тестировали с использованием набора для ELISA (ab108907, Abcam, США) в соответствии с инструкциями производителя. Комплекс FXa – AT измеряли с помощью сэндвич-ELISA.Вкратце, планшеты покрывали антителом против FXa человека (PAB19898, Abnova, США) и блокировали 2% бычьим сывороточным альбумином (BSA) перед инкубацией с указанным выше реакционным раствором при 37 ° C. После трехкратной промывки PBST (PBS (80 мМ Na 2 HPO 4 , 1,5 М NaCl, 20 мМ KH 2 PO 4 и 30 мМ KCl), 0,5% Твин-20, pH 7,4) при При комнатной температуре комплекс FXa-AT был обнаружен после инкубации с HRP-конъюгированным антителом против человеческого AT (1: 200, SAAT-APHRP, Enzyme Research Laboratory, США) при 37 ° C.Рассчитывали относительные уровни ТАТ и комплекса FXa – AT.
Влияние трансферрина на свертывание крови
Плазма здорового человека была собрана в Центре крови Куньмин, и кровь была приготовлена путем смешивания 1: 9 объема тринатрийцитрата (0,13 М) и крови с плазмой, полученной затем центрифугированием при 3000 об / мин в течение 20 минут при 4 ° C. Чтобы проверить влияние трансферрина на время рекальцификации плазмы, 20 мкл плазмы инкубировали с человеческим апо- или голо-трансферрином (0,2–5 мкМ) в 60 мкл буфера HEPES (20 мМ HEPES, 150 мМ NaCl, pH 7.4) в течение 10 мин при 37 ° C с последующим добавлением 60 мкл 25 мМ CaCl 2 , предварительно нагретого до 37 ° C. Свертывание контролировали при 650 нм, и время свертывания рассчитывали, измеряя время до половины максимального увеличения поглощения.
Модель Mouse AS
Apoe — / — мышей (самки, возраст 8 недель) кормили либо диетой с высоким содержанием жиров (HFD, 21% жира, 0,15% холестерина) в течение 6 недель для индукции AS, либо нормальная диета (ND) в качестве контроля. Через 6 недель мышей умерщвляли и собирали кровь для дальнейшего приготовления плазмы (кровь готовили путем смешивания 1: 9 объема тринатрийцитрата (0.13 M) и кровь с плазмой, полученной затем центрифугированием при 3000 об / мин в течение 20 мин при 4 ° C). После хирургического удаления корень аорты немедленно фиксировали в 4% параформальдегиде, растворенном в PBS, при 4 ° C в течение ночи. Органы, включая печень, мозг, селезенку, мышцы, почки и желудок, и бляшки также собирали и помещали в РНК позже для экстракции РНК или PBS для экстракции белка. Образцы корня аорты разрезали на срезы размером 8 мкм с помощью замораживающего микротома (Thermo Scientific, США).Некоторые участки корня аорты окрашивали масляно-красным О для исследования атеросклеротических поражений, тогда как другие использовали для иммунофлуоресцентного анализа, как описано ниже. Изображения масляно-красного окрашивания O получали с помощью микроскопа темного поля (Life Technologies, США), а области бляшек, окрашенных масляным красным O, измеряли с помощью Image J.
Процедуры экстракции РНК и обратной транскрипции кДНК выполняли с помощью с использованием набора для экстракции РНК (DP419, Tiangen, Китай) и набора для обратной транскрипции (A5000, Promega, США), соответственно, в соответствии с инструкциями производителя.Экспрессию трансферрина количественно оценивали как с помощью qRT-PCR (прямой праймер (5′ – 3 ′): GGACGCCATGACTTTGGATG; обратный праймер (5′ – 3 ′): GCCATGACAGGCACTAGACC), так и с помощью анализа вестерн-блоттинга. ПЦР проводили на приборе CFX-96 Touch Real-Time Detection System (Bio-Rad, США). Концентрацию трансферрина в плазме мышей определяли с использованием набора мышиного трансферрина ELISA (ab157724, Abcam, США). Количество трансферрина в гомогенатах бляшек также определяли вестерн-блоттингом с использованием антитела против трансферрина (1: 2000, 11019-RP01, Sino Biological Inc, Китай), как описано выше.
Анализ поверхностного плазмонного резонанса (SPR)
BIAcore 2000 (GE, США) использовали для анализа взаимодействия между трансферрином и факторами свертывания крови с использованием HSA в качестве контроля. Вкратце, апо-трансферрин или голо-трансферрин сначала разбавляли (20 мкг / мл) 200 мкл натрий-ацетатного буфера (10 мМ, pH 5), а затем протекали через активированную поверхность сенсорного чипа CM5 (BR100012, GE, США. ) со скоростью 5 мкл / мин, достигая резонансной единицы (RU) ~ 2000. Остальные активированные сайты на чипе блокировали 75 мкл этаноламина (1 M, pH 8.5). Серийные концентрации тромбина, FXIIa, фибриногена, AT, протромбина или FXII в буфере Tris-HCl (20 мМ, pH 7,4) применяли для анализа их взаимодействия с иммобилизованным апо-трансферрином или голо-трансферрином при скорости потока 10 мкл / мин. KD для связывания, а также константы скорости Ka и Kd определяли с использованием программы оценки BIA (GE, США). Чип сенсора CM5 был соединен со 100 единицами трансферрина с использованием описанного выше метода. Об изменении RU сообщается в технологии BIAcore, где ответ 1000 RU эквивалентен изменению поверхностной концентрации примерно на 1 нг / мм 2 белка, а молярное соотношение связывания между трансферрином и фибриногеном или AT было рассчитано путем сравнения RU насыщения. текущей фазы и RU иммобилизованной фазы, как описано в методе. 53
Native PAGE
Основной нативный PAGE использовали для дальнейшего анализа взаимодействия между трансферрином и факторами свертывания крови. Вкратце, человеческий апо-трансферрин (8 мкг) сначала инкубировали с различными концентрациями человеческого тромбина или человеческого FXIIa (2-8 мкг) в 30 мкл трис-HCl буфера (50 мМ, pH 7,4) в течение 10 минут при 37 °. C, а затем наносили на 8% готовый гель (PG00810-N, Solarbio, Китай) для анализа образования комплекса между трансферрином и тромбином / FXIIa в рабочем буфере (0.05 M Trizma, 0,38 M глицин, pH 8,9) при постоянном напряжении 200 В в течение 1 ч. Фибриноген (8 мкг) или AT (8 мкг) и различные концентрации апо-трансферрина (2-8 мкг) также использовали для анализа взаимодействия с помощью основного нативного PAGE. Анализ окрашивания проводили с помощью окрашивающего раствора (0,25% (об. / Об.) Кумасси бриллиантового синего R, содержащего 50% (об. / Об.) Метанола, 40% (об.) DH 2 O и 10% (об. / Об.) Уксусной кислоты). кислоты) и обесцвечивающих растворов (в основном состоит из 15% (об. / об.) метанола, 10% (об. / об.) уксусной кислоты и 75% (об. / об.) dH 2 O).
Конфокальная микроскопия
Образцы атеросклеротической бляшки человека или корня аорты мыши сначала разрезали на 8-мкм срезы с помощью замораживающего микротома (Thermo Scientific, США). Для иммунофлуоресцентного обнаружения трансферрина, тромбина или FXIIa в атеросклеротической бляшке срезы сначала инкубировали с трансферрином против мыши (1: 200, 11019-RP01), против трансферрина человека (1: 200, 11019-RP02), против трансферрина человека (1: 200, 11019-RP02), -тромбин (1: 200, ab17199, Abcam, США) и антитело против FXII мыши или человека (1: 200, SC-6670 или SC-66752, Санта-Крус, США) при 4 ° C в течение ночи, соответственно.После трехкратной промывки PBS для удаления избытка первичного антитела срез инкубировали с флуоресцентно меченным вторичным антителом в течение 1 ч при 37 ° C. Ядра клеток окрашивали 4,6-диамидино-2-фенилиндолом (DAPI, P36941, Lifetechnologies, США). Изображения иммунофлуоресценции получали с использованием конфокального микроскопа Olympus FluoView 1000 в соответствии с инструкциями производителя.
Анализы APTT и PT
Для анализа APTT 50 мкл реагента APTT (F008-1, Nanjing Jiancheng Bioengineering Institute, Китай) инкубировали с 50 мкл плазмы в течение 3 минут при 37 ° C с последующим добавлением 50 мкл CaCl 2 (25 мМ), предварительно нагретых до 37 ° C для проверки времени свертывания, с измерением поглощения при 405 нм с использованием полуавтоматического анализатора коагуляции (ThromboScreen 400c, Pacific Hemostasis, США).Для тестирования PT 50 мкл плазмы, предварительно нагретой до 37 ° C, смешивали со 100 мкл реагента PT (F007, Nanjing Jiancheng Bioengineering Institute, Китай), предварительно нагретого при 37 ° C в течение 15 минут, с измерением оптической плотности при 405 нм.
Измерение времени кровотечения
Модель рассечения хвоста мыши использовалась для проверки времени кровотечения из хвоста. Вкратце, мыши отрезали хвосты на расстоянии 2 мм от кончика, а затем осторожно погружали в 20 мл физиологического раствора, нагретого до 37 ° C. Время кровотечения регистрировали до прекращения кровотока.
Молекулярный докинг и конструирование ингибирующих пептидов
Трансферрин стыковали с экзосайтом I человеческого тромбина.Модель человеческого тромбина была гомологически сконструирована из известных структур (PDB ID: 4NZQ). С помощью еще двух сложных структур с PDB ID: 1A2C и 1HAH, сайт связывания был локально размещен для дальнейших процессов стыковки. Между тем, две структуры (PDB ID: 4XE4 и 4XDE) были использованы для построения рабочей модели человеческого FXIIa. Модель FXIIa была выровнена вдоль модели тромбина для подтверждения возможной бороздообразной области связывания. Затем модель трансферина человека была извлечена из комплекса (PDB ID: 3V8X), очищена и реконструирована путем восстановления недостающих остатков.Все три вышеупомянутые модели были оптимизированы с помощью короткой молекулярной динамики для устранения стерических конфликтов из-за упаковки боковых цепей. Модифицированную модель трансферрина стыковали с сайтом экзосайта I тромбина человека и аналогичным сайтом FXIIa путем выравнивания этих двух структур. Процессы стыковки выполнялись с помощью стандартного конвейерного протокола Discovery Studio (версия 3.1). В процессе стыковки использовались общие параметры для получения более точных результатов, и ZRank занял 2000 лучших поз с отсечкой RMSD 10.0 Ангстремов.
На основе молекулярного стыковочного анализа трансферрина и тромбина / FXIIa были охарактеризованы и синтезированы два пептида (Th26 и FX18). Th26 (RIGKHSRTRYERNIEK) и FX18 (RRNHSCEPCQTLAVRSYR) были выведены из последовательности экзосайта I домена тромбина (номер GenBank (NM_000506.3)) и последовательности экзосайта I домена аналога FXIIa (номер GenBank (NP_000496.2)) , соответственно. Также были разработаны и синтезированы скремблированные пептиды Th26 (Th26-scr, RKKGIRRYTERHSNIE) и FX18 (FX18-scr, SCPTHYSRQRCRNAVLER).
Влияние интерференции трансферрина на развитие AS у мышей
Несколько методов интерференции трансферрина, включая введение лентивируса или ретровируса (10 7 единиц трансдукции) в хвостовую вену Apoe — / — мышей для индукции трансферрина сверхэкспрессия или нокдаун, внутривенная инъекция антител к трансферрину дважды (50 мкг за раз) в неделю в течение 6 недель и внутривенная инъекция ингибирующих пептидов (Th26 и FX18) в различных дозировках (0.2–5 мг / кг) трижды в неделю в течение 3 недель, чтобы оценить их влияние на развитие мышиного AS, индуцированного HFD, как описано выше. Все вмешательства трансферрина начинались с начала индукции HFD. В соответствии с описанными выше способами время кровотечения из хвоста, образование тромба сонной артерии, индуцированное FeCl 3 , образование плазменного тромбина и FXIIa, APTT и PT также оценивали на этих моделях мышей. Количества железа и ферритина в плазме определяли с использованием набора для тестирования железа (метод феррозина, TC1016-100T, Leagene, Китай) и набора для тестирования ферритина (SEA518Mu, Uscn, Китай) соответственно.Средний корпускулярный объем (MCV), средний корпускулярный гемоглобин (MCH) и средняя концентрация корпускулярного гемоглобина (MCHC) были проанализированы с использованием машины для рутинного анализа крови (BC-2800Vet, Mindray, Китай). Время кровотечения из хвоста, образование тромба сонной артерии, индуцированное FeCl 3 , образование тромбина в плазме и FXIIa, APTT или PT также оценивали у мышей C57BL / 6J, которые выполняли интерференцию трансферрина (сверхэкспрессия трансферрина, нокдаун трансферрина, введение антител против трансферрина и введение интерференционных пептидов Th26 и FX18).
FeCl
3 -индуцированное образование тромба сонной артерииМыши C57BL / 6J (самки, 8 недель) и Apoe — / — мыши (самки, 8 недель) с интерференцией трансферрина были первыми. анестезирован 2,0% изофлураном, и внутренняя температура тела поддерживалась на уровне 37 ° C в течение всей операции. Одна из сонных артерий была обнажена шейным разрезом и отделена от прилегающей ткани и блуждающего нерва. Тромбоз вызывали наложением куска фильтровальной бумаги (2 × 2 мм), предварительно пропитанного 10% (масс. / Об.) Раствором FeCl 3 , на обнаженную сонную артерию.Кровоток сонных артерий во всех группах измеряли с помощью лазерной спекл-визуализации перфузии (PeriCam PSI, HR, Швеция) через 5 минут и 10 минут после индукции FeCl 3 соответственно. Единица перфузии интересующей области (ROI) также была записана для количественной оценки изменений кровотока.
Статистический анализ
Данные, полученные в независимых экспериментах, представлены как среднее значение ± стандартное отклонение. Все статистические анализы были двусторонними и с 95% доверительным интервалом (ДИ).Результаты анализировали с использованием однофакторного дисперсионного анализа с апостериорным тестом Даннета или непарного t-критерия с использованием Prism 6 (программное обеспечение GraphPad) и SPSS (SPSS Inc, США). Различия считались значимыми при P <0,05.
Для получения более подробной информации см. Дополнительная информация, Данные S1.
Как свертывается кровь? | Proteintech Group
Кровь — это важная жидкость, которая выполняет важные функции по транспортировке кислорода и питательных веществ к нашим клеткам.
Почти 1/10 -го массы тела человека состоит из крови (мужской +/- 5,5 литра; женский +/- 4,5 литра). Помимо транспортировки кислорода и питательных веществ к нашим клеткам, кровь играет ключевую роль в нашей иммунной системе и температурном гомеостазе (1).
Несколько фактов о крови
— Одна пинта сданной крови может спасти 3 человека.
— Кровь не всегда красная.
— В человеческом теле проходят 100 000 километров кровеносных сосудов.
— Тромбоциты, лейкоциты и эритроциты взвешены в плазме; желтый жидкий компонент крови.
— Человеческая кровь содержит атомы металлов, в том числе немного золота.
— В красных кровяных тельцах отсутствуют ядра.
— Существует 4 группы крови, которые различаются в зависимости от населения: A, B, AB и O. Каждая группа крови может быть RhD-положительной или RhD-отрицательной, что дает в общей сложности 8 основных групп крови.
Свертывание или коагуляция крови — каскад свертывания крови
Свертывание крови — это многоступенчатый процесс, известный как каскад свертывания крови (2).Каскад свертывания крови подразделяется на три пути: внешний, внутренний и общий (рис. 1).
Рисунок 1. Каскад свертывания крови. Загрузите плакат пути здесь.
Внешний путь освобождается поврежденными клетками и тканями. Он также известен как путь тканевого фактора. Внутренний путь — это параллельный путь активации тромбина фактором XII (рис. 2). Это вызвано тем, что кровь встречает волокна коллагена в сломанной стенке кровеносного сосуда.Оба пути в конечном итоге продуцируют активатор протромбина, запускающий общий путь, в котором протромбин становится тромбином с последующим превращением фибриногена в фибрин (3). Важно отметить, что это упрощенное описание, и исследования показывают, что этот процесс намного сложнее. Однако это полезный подход для лучшего понимания свертывания крови.
Рисунок 2. Иммунофлуоресцентный анализ (-20 ℃ этанол) фиксированных клеток HepG2 с использованием антитела к фактору XII (66089-1-Ig) в разведении 1: 100 и Alexa Fluor 488-конъюгированных AffiniPure Goat Anti-Mouse IgG (H + L ).
13 факторов свертывания крови
Наш организм активирует факторы свертывания крови, которые превращают кровь в комок, образуя специальный белок и фиксируя комок у раны. У человека есть 13 факторов свертывания крови (4), большинство из которых вырабатываются в печени (таблица 1).
Фактор коагуляции | Общее название
| Источник | Путь | Классификация |
Фактор I | фибриноген | печень | обыкновенный | семейство фибриногенов |
Фактор II (рисунок 3) | протромбин | печень | обыкновенный | витамин К зависимые белки |
Фактор III | тканевый фактор или тромбопластин | клеток поврежденной ткани, тромбоциты выделяют тромбопластин | внешний | Н / Д |
Фактор IV | ионы кальция | кость и всасывание через слизистую оболочку тонкой кишки | внешние, внутренние и общие | Н / Д |
Фактор V (рисунок 4) | проацелерин или лабильный фактор | печень и тромбоциты | Н / Д | семейство фибриногенов |
Фактор VI | акселерин, больше не используется | Н / Д | обыкновенный | Н / Д |
Фактор VII | проконвертин или стабильный фактор | печень | внешний | витамин К зависимые белки |
Фактор VIII (рисунок 5) | антигемофильный фактор | тромбоцитов и выстилки кровеносных сосудов | внутренний | семейство фибриногенов |
Фактор IX | Тромбопластиновый компонент плазмы / фактор Рождества | печень | внутренний | витамин К зависимые белки |
Фактор X | Фактор Стюарта Проуэра | печень | обыкновенный | витамин К зависимые белки |
Фактор XI | предшествующий тромбопластин плазмы | печень | внутренний | контактная семья |
Фактор XII (рисунок 6) | Фактор Хагемана | Печень | внутренний | контактная семья |
Фактор XIII | Фактор стабилизации фибрина | печень | обыкновенный | семейство фибриногенов |
Таблица 1.Факторы свертывания в крови (N / A — не применимо).
Рисунок 3. Иммуногистохимия предметного стекла с залитой в парафин тканью печени человека с использованием антитела F2 (66509-1-Ig) в разведении 1: 150 (под 10-кратной линзой).
Рисунок 4. Иммуногистохимия слайдов из залитой парафином ткани рака печени человека с использованием антитела F5 (20963-1-AP) в разведении 1: 200 (под линзой 40x). Антиген, опосредованный нагреванием, извлекается с помощью буфера Tris-EDTA (pH 9).
Рисунок 5.Иммунофлуоресцентный анализ (-20 ℃ этанол) фиксированных клеток HUVEC с использованием антитела F8 (21485-1-AP) в разведении 1:25 и AffiniPure Goat Anti-Rabbit IgG, конъюгированных с Alexa Fluor 488 (H + L).
Фигура 6. Иммуногистохимия слайдов из залитой парафином ткани рака печени человека с использованием антитела к фактору XIIIA (66325-1-Ig) в разведении 1: 400 (под линзой 40x). Антиген, опосредованный нагреванием, извлекается с помощью буфера Tris-EDTA (pH 9).
Что делать, если кровь плохо свертывается? Нарушения свертывания крови
Нарушения свертываемости крови возникают, когда кровь не свертывается достаточно быстро.Относительно общие недостатки факторов II, V, VII, X и XII связаны с проблемами свертывания крови или аномальными кровотечениями. Гемофилия A и B — широко известные нарушения свертывания крови. Кровь не свертывается должным образом, что приводит к чрезмерным синякам и внутреннему кровотечению. Наиболее распространенный тип — гемофилия А, которая отражает низкий уровень фактора свертывания крови VIII, а гемофилия В — низкий уровень фактора IX (5, 6).
Заключительное слово
Здоровое тело защищает себя, свертывая кровь при травме, удаляя сгустки, когда они больше не нужны, и предотвращая их разрастание.Несомненно, весь процесс свертывания крови сложен; тем не менее, изучение этого вопроса поможет в открытии новых способов улучшения коагуляции, а также в определении того, как предотвратить это ненадлежащим образом.
Список литературы
1. Эволюция клеток крови: факты и загадки.
2. Как все начинается: запуск каскада свертывания
3. Обзор системы коагуляции
4. Регулирование факторов свертывания крови
5.Нарушения свертывания и свертывания крови: обзор и обновление
6. Редкие нарушения свертывания крови: возникающая проблема
Оценка активности факторов свертывания на раннем этапе после тяжелой множественной травмы и их корреляция с тестами на коагуляцию и клиническими данными | World Journal of Emergency Surgery
Герберт Х.К., Хайдер А.А., Бутчарт А., Нортон Р. Глобальное здоровье: травмы и насилие. Заражение Dis Clin North Am. 2011. 25 (3): 653–68. DOI: 10.1016 / j.idc.2011.06.004.
Артикул PubMed Google Scholar
Сауайя А., Мур Ф.А., Мур Э.Е., Мозер К.С., Бреннан Р., Рид Р.А. и др. Эпидемиология смертей от травм: переоценка. J Trauma. 1995. 38 (2): 185–93.
CAS Статья PubMed Google Scholar
Hoyt DB. Клинический обзор дилемм кровотечения при травмах. Semin Hematol. 2004; 41 (1 Приложение 1): 40–3.
Артикул PubMed Google Scholar
Брохи К., Сингх Дж., Херон М., Коутс Т.Острая травматическая коагулопатия. J Trauma. 2003. 54 (6): 1127–30. DOI: 10.1097 / 01.TA.0000069184.82147.06.
Артикул PubMed Google Scholar
MacLeod JB, Lynn M, McKenney MG, Cohn SM, Murtha M. Ранняя коагулопатия предсказывает смертность при травмах. J Trauma. 2003. 55 (1): 39–44. DOI: 10.1097 / 01.TA.0000075338.21177.EF.
Артикул PubMed Google Scholar
Rugeri L, Levrat A, David JS, Delecroix E, Floccard B, Gros A и др. Диагностика ранних нарушений свертывания крови у пациентов с травмами методом ротационной тромбэластографии. J Thromb Haemost. 2007. 5 (2): 289–95. DOI: 10.1111 / j.1538-7836.2007.02319.x.
CAS Статья PubMed Google Scholar
Маегеле М., Леферинг Р., Юсель Н., Тьярдес Т., Риксен Д., Паффрат Т. и др. Ранняя коагулопатия при множественной травме: анализ из Немецкого реестра травм на 8724 пациентах.Травма, повреждение. 2007. 38 (3): 298–304. DOI: 10.1016 / j.injury.2006.10.003.
Артикул PubMed Google Scholar
Гонсалес Э.А., Мур Ф.А., Холкомб Дж.Б., Миллер С.К., Козар Р.А., Тодд С.Р. и др. Свежезамороженную плазму следует давать раньше пациентам, нуждающимся в массивном переливании. J Trauma. 2007. 62 (1): 112–9. DOI: 10.1097 / 01.ta.0000250497.08101.8b.
Артикул PubMed Google Scholar
Груен Р.Л., Юркович Г.Дж., Макинтайр Л.К., Фой Х.М., Майер Р.В. Типы ошибок, способствующих смертности от травм: уроки, извлеченные из 2594 смертей. Ann Surg. 2006. 244 (3): 371–80. DOI: 10.1097 / 01.sla.0000234655.83517.56.
PubMed Central PubMed Google Scholar
Брохи К., Коэн М.Дж., Гантер М.Т., Мэттэй М.А., Маккерси Р.С., Питте Дж.Ф. Острая травматическая коагулопатия: инициируется гипоперфузией: модулируется путем протеина С? Ann Surg.2007. 245 (5): 812–8. DOI: 10.1097 / 01.sla.0000256862.79374.31.
PubMed Central Статья PubMed Google Scholar
Brohi K, Cohen MJ, Ganter MT, Schultz MJ, Levi M, Mackersie RC, et al. Острая коагулопатия травмы: гипоперфузия вызывает системную антикоагуляцию и гиперфибринолиз. J Trauma. 2008. 64 (5): 1211–7. DOI: 10.1097 / TA.0b013e318169cd3c.
Артикул PubMed Google Scholar
Wolberg AS, Meng ZH, Monroe 3rd DM, Hoffman M. Систематическая оценка влияния температуры на активность ферментов свертывания и функцию тромбоцитов. J Trauma. 2004. 56 (6): 1221–8.
CAS Статья PubMed Google Scholar
Martini WZ, Pusateri AE, Uscilowicz JM, Delgado AV, Holcomb JB. Независимый вклад гипотермии и ацидоза в коагулопатию у свиней. J Trauma. 2005. 58 (5): 1002–9.
Артикул PubMed Google Scholar
Энгстром М., Шотт У., Ромнер Б., Реинструп П. Ацидоз нарушает коагуляцию: тромбоэластографическое исследование. J Trauma. 2006. 61 (3): 624–8. DOI: 10.1097 / 01.ta.0000226739.30655.75.
Артикул PubMed Google Scholar
Lucas CE, Ledgerwood AM, Mammen EF. Изменение содержания белка свертывания после реанимации альбумина. Ann Surg. 1982. 196 (2): 198–202.
PubMed Central CAS Статья PubMed Google Scholar
Martin DJ, Lucas CE, Ledgerwood AM, Hoschner J, McGonigal MD, Grabow D. Добавка свежезамороженной плазмы для массивного переливания эритроцитов. Ann Surg. 1985. 202 (4): 505–11.
PubMed Central CAS Статья PubMed Google Scholar
Ciavarella D, Reed RL, Counts RB, Baron L, Pavlin E, Heimbach DM, et al. Уровни фактора свертывания крови и риск диффузного микрососудистого кровотечения у пациента, перенесшего массовое переливание крови.Br J Haematol. 1987. 67 (3): 365–8.
CAS Статья PubMed Google Scholar
Харриган К., Лукас К.Э., Леджервуд А.М. Влияние геморрагического шока на каскад свертывания крови у травмированных пациентов. J Trauma. 1989. 29 (10): 1416–21.
CAS Статья PubMed Google Scholar
Ризоли С.Б., Скарпелини С., Каллум Дж., Насименто Б., Манн К.Г., Пинто Р. и др.Дефицит фактора свертывания крови при ранней травматической коагулопатии. J Trauma. 2011; 71 (5 Приложение 1): S427–34. DOI: 10.1097 / TA.0b013e318232e5ab.
PubMed Central CAS Статья PubMed Google Scholar
Коэн М.Дж., Катчер М., Редик Б., Нельсон М., Колл М., Кнудсон М.М. и др. Клинические и механистические факторы острой травматической коагулопатии. J Trauma Acute Care Surg. 2013; 75 (1 приложение 1): S40–7. DOI: 10.1097 / TA.0b013e31828fa43d.
PubMed Central CAS Статья PubMed Google Scholar
Вудхэмс Б., Жирардо О., Бланко М.Дж., Колесс Г., Гурмелин Ю. Стабильность белков свертывания в замороженной плазме. Свертывание крови Фибринолиз. 2001. 12 (4): 229–36.
CAS Статья PubMed Google Scholar
Minei JP, Schmicker RH, Kerby JD, Stiell IG, Schreiber MA, Bulger E, et al.Тяжелая травма: региональные различия в частоте и исходе. Ann Surg. 2010. 252 (1): 149–57. DOI: 10.1097 / SLA.0b013e3181df0401.
PubMed Central Статья PubMed Google Scholar
Цурчер М., Зульцер И., Барицци Г., Ламмле Б., Альберио Л. Анализ стабильности свертываемости, выполненный в плазме цитратной цельной крови, транспортируемой при температуре окружающей среды. Thromb Haemost. 2008. 99 (2): 416–26. DOI: 10.1160 / TH07-07-0448.
CAS PubMed Google Scholar
Вивьен Б., Ланжерон О., Морелл Э., Девилльерс С., Карли П.А., Кориат П. и др. Ранняя гипокальциемия при тяжелой травме. Crit Care Med. 2005. 33 (9): 1946–52.
CAS Статья PubMed Google Scholar
Hiippala ST, Myllyla GJ, Vahtera EM. Гемостатические факторы и замещение большой кровопотери концентратами эритроцитов с низким содержанием плазмы.Anesth Analg. 1995. 81 (2): 360–5.
CAS PubMed Google Scholar
Schlimp CJ, Voelckel W, Inaba K, Maegele M, Ponschab M, Schochl H. Оценка уровней фибриногена в плазме на основе гемоглобина, базового избытка и шкалы тяжести травмы при поступлении в отделение неотложной помощи. Crit Care. 2013; 17 (4): R137. DOI: 10.1186 / cc12816.
PubMed Central Статья PubMed Google Scholar
Янсен Дж., Скарпелини С., Пинто Р., Тьен ХК, Каллум Дж., Ризоли С.Б. Гипоперфузия у пациентов с тяжелой травмой связана со снижением активности фактора свертывания крови. J Trauma. 2011; 71 (5 Приложение 1): S435–40. DOI: 10.1097 / TA.0b013e318232e5cb.
CAS Статья PubMed Google Scholar
Бегби М., Нотли С., Тинлин С., Сойер Л., Лилликрэп Д. Реакция острой фазы фактора VIII требует участия NFkappaB и C / EBP.Thromb Haemost. 2000. 84 (2): 216–22.
CAS PubMed Google Scholar
Hollestelle MJ, Thinnes T, Crain K, Stiko A, Kruijt JK, van Berkel TJ, et al. Тканевое распределение экспрессии гена фактора VIII in vivo — более пристальный взгляд. Thromb Haemost. 2001. 86 (3): 855–61.
CAS PubMed Google Scholar
Жакмен М., Нейринк А., Германн М.И., Лавенд’омм Р., Рега Ф., Сен-Реми Дж. М. и др.Продукция FVIII эндотелиальными клетками микрососудов легких человека. Кровь. 2006. 108 (2): 515–7. DOI: 10.1182 / кровь-2005-11-4571.
CAS Статья PubMed Google Scholar
Брохи К., Коэн М.Дж., Давенпорт, РА. Острая коагулопатия травмы: механизм, идентификация и последствия. Curr Opin Crit Care. 2007. 13 (6): 680–5. DOI: 10.1097 / MCC.0b013e3282f1e78f.
Артикул PubMed Google Scholar
Theusinger OM, Spahn DR, Ganter MT. Переливание при травме: почему и как мы должны изменить нашу нынешнюю практику? Curr Opin Anaesthesiol. 2009. 22 (2): 305–12. DOI: 10.1097 / ACO.0b013e3283212c7c.
Артикул PubMed Google Scholar
Хейрабади Б.С., Крисси Дж. М., Дегузман Р., Холкомб Дж. Б.. Время кровотечения in vivo и измерения тромбэластографии in vitro являются лучшими индикаторами гипотермической коагулопатии при разведении, чем протромбиновое время.J Trauma. 2007. 62 (6): 1352–9. DOI: 10.1097 / TA.0b013e318047b805.
Артикул PubMed Google Scholar
Martini WZ, Cortez DS, Dubick MA, Park MS, Holcomb JB. Тромбэластография лучше, чем ПВ, АЧТВ и активированное время свертывания, в обнаружении клинически значимых нарушений свертывания крови после гипотермии, геморрагического шока и реанимации у свиней. J Trauma. 2008. 65 (3): 535–43. DOI: 10.

 H., Ossei-Gerning, N., Carter, A., Mikkola, H., Grant, P. J. Association of a common polymorphism in the factor XIII gene with myocardial infarction. Thromb. Haemost. 79: 8-13, 1998.
H., Ossei-Gerning, N., Carter, A., Mikkola, H., Grant, P. J. Association of a common polymorphism in the factor XIII gene with myocardial infarction. Thromb. Haemost. 79: 8-13, 1998. р-ра д/инф. 1000 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием
р-ра д/инф. 1000 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием р-ра д/в/в введен. 500 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения
р-ра д/в/в введен. 500 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения р-ра д/инф. 200 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения
р-ра д/инф. 200 МЕ: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения р-ра д/в/в введения 1.2 мг: фл. 1 шт. в компл. с растворителем (амп. 1 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками
р-ра д/в/в введения 1.2 мг: фл. 1 шт. в компл. с растворителем (амп. 1 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками р-ра д/в/в введения: фл. 250 ME в компл. с р-лем и устройством д/добавления р-ля
р-ра д/в/в введения: фл. 250 ME в компл. с р-лем и устройством д/добавления р-ля р-ра д/в/в введения 200-399 МЕ: фл. в компл. с растворителем 5 мл, двухсторонней иглой, иглой-фильтром и набором для вливания
р-ра д/в/в введения 200-399 МЕ: фл. в компл. с растворителем 5 мл, двухсторонней иглой, иглой-фильтром и набором для вливания р-ра д/инф. 500 ЕД: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения
р-ра д/инф. 500 ЕД: фл. 1 шт. в компл. с растворителем и набором д/растворения и введения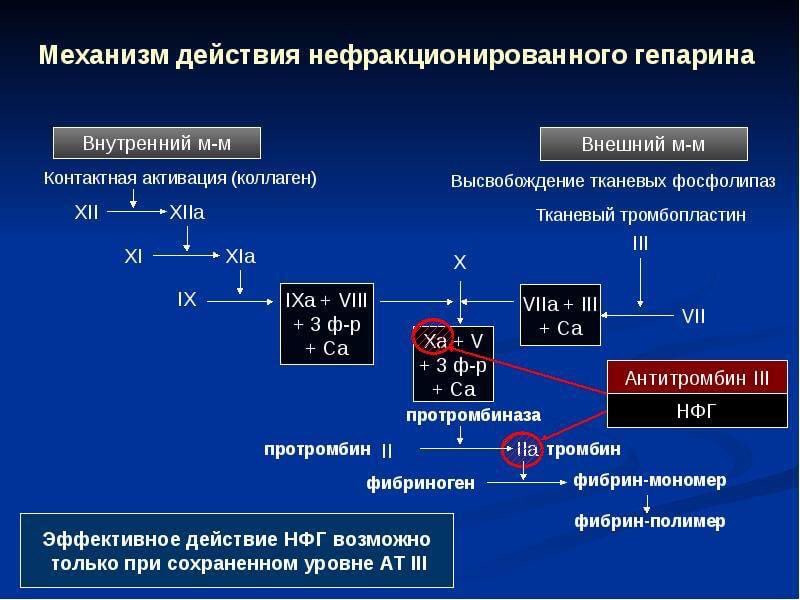 р-ра д/в/в введен. 220-450 МЕ: фл. 1 шт. в комплекте с растворителем
р-ра д/в/в введен. 220-450 МЕ: фл. 1 шт. в комплекте с растворителем р-ра д/в/в введения 451-849 МЕ: фл. 1 шт. в комплекте с растворителем
р-ра д/в/в введения 451-849 МЕ: фл. 1 шт. в комплекте с растворителем р-ра д/в/в введения 1000 МЕ: фл. в комплекте с растворителем и системой для введения
р-ра д/в/в введения 1000 МЕ: фл. в комплекте с растворителем и системой для введения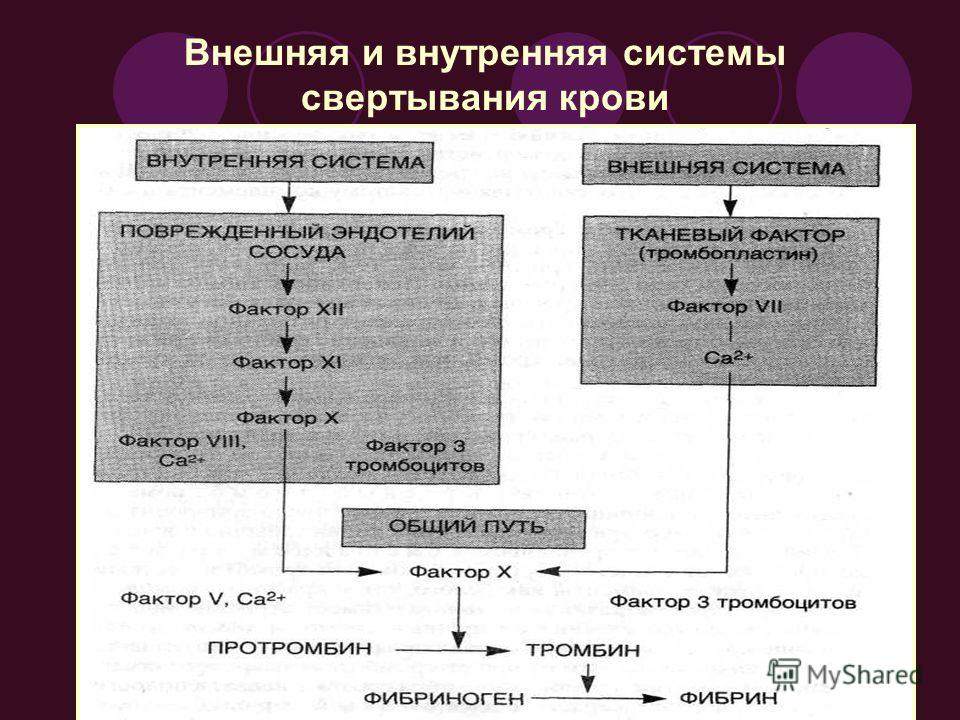 р-ра д/в/в введения 500 МЕ: фл. в комплекте с растворителем и системой для введения
р-ра д/в/в введения 500 МЕ: фл. в комплекте с растворителем и системой для введения Избыток кальция возвращает цитратной плазме способность к свёртыванию. Далее к плазме с кальцием добавляется тканевой фактор (III фактор свертывания), и измеряется время образования сгустка.
Избыток кальция возвращает цитратной плазме способность к свёртыванию. Далее к плазме с кальцием добавляется тканевой фактор (III фактор свертывания), и измеряется время образования сгустка.
