Кiлт сездер: геморрагиялык шок, гиповолемиялык шок, инфузионно-трансфузиялык терапия, циркуляцияланушы кан кeлемi, канныц койылу жYЙесi.
S. P. Uvarov
EFFICIENCY OF INTENSIVE CARE OFHEMORRHAGICSHOCK
 It is believed that hemorrhagic shock may be a model of hypovolemic shock, as the decline in blood volume is at the heart of this complication. Acute blood loss is most common in obstetric, surgical and trauma practice. Violation of the blood coagulation system in some diseases can also lead to bleeding and the subsequent development of hemorrhagic shock. The author concludes that the treatment of patients with hemorrhagic shock is effective in the III stage, and the effectiveness of treatment of hemorrhagic shock depends on the adequacy of infusion-transfusion therapy. Keywords: hemorrhagic shock, hypovolemic shock, infusion-transfusion therapy, blood volume, blood coagulation
It is believed that hemorrhagic shock may be a model of hypovolemic shock, as the decline in blood volume is at the heart of this complication. Acute blood loss is most common in obstetric, surgical and trauma practice. Violation of the blood coagulation system in some diseases can also lead to bleeding and the subsequent development of hemorrhagic shock. The author concludes that the treatment of patients with hemorrhagic shock is effective in the III stage, and the effectiveness of treatment of hemorrhagic shock depends on the adequacy of infusion-transfusion therapy. Keywords: hemorrhagic shock, hypovolemic shock, infusion-transfusion therapy, blood volume, blood coagulationСреди критических состояний геморрагический шок занимает одно из первых мест. Считается, что геморрагический шок может служить моделью гиповолемического шока, так как снижение объема циркулирующей крови лежит в основе этого осложнения.
Острая кровопотеря наиболее часто встречается в акушерской, хирургической и травматологической практике. Нарушения свертывающей системы крови при некоторых заболеваниях также могут привести к кровотечению с последующим развитием геморрагического шока.
Нарушения свертывающей системы крови при некоторых заболеваниях также могут привести к кровотечению с последующим развитием геморрагического шока.
Можно считать, что геморрагический шок является наиболее изученным среди других видов шока. Однако летальность при этом виде шока зависит от многих причин и может оставаться высокой по разным причинам. Особое значение имеет интенсивная терапия геморрагического шока с учетом патогенеза этого осложнения.
Цель работы — анализ интенсивной терапии геморрагического шока у больных различного профиля.
Для достижения поставленной цели были сформулированы следующие задачи: 1) оценить эффективность интенсивной терапии геморрагического шока в условиях центральной районной больницы; 2) выявить ошибки в лечении геморрагического шока.
МАТЕРИАЛ И МЕТОДЫ
В условиях Бухар-Жырауской центральной районной больницы геморрагический шок в течение 3 лет (2009-2012 г. ) регистрировался у 15 больных в возрасте от 16 до 73 лет, среди которых было 6
) регистрировался у 15 больных в возрасте от 16 до 73 лет, среди которых было 6
больных с желудочно-кишечным кровотечением. Из них кровотечение из язвы желудка и 12-перстной кишки отмечено у 4 больных, из варикозно-расширенных вен пищевода на фоне цирроза печени — у 2 пациентов. У больных акушерско-гинекологического профиля кровотечение было связано с родами (6 больных) и фибромиомой матки (1 пациент). Ножевое ранение органов брюшной полости с развитием геморрагического шока зарегистрировано у 2 больных.
Для определения тяжести геморрагического шока оценивали общее состояние больных и рожениц, измеряли артериальное давление (АД), частоту сердечных сокращений (ЧСС) по пульсоксиметру и кардиомонитору, частоту дыхания (ЧД), центральное венозное давление (ЦВД) путем катетеризации яремной иди подключичной вены (мм вод. ст.), почасовой диурез путем катетеризации мочевого пузыря.
Стадии геморрагического шока оценивали по общепринятым рекомендациям. К I стадии геморрагического шока (компенсированный шок) относили случаи с кровопотерей 15-20% объема циркулирующей крови (ОЦК), что соответствует кровопотере 700-1200 мл.
К I стадии геморрагического шока (компенсированный шок) относили случаи с кровопотерей 15-20% объема циркулирующей крови (ОЦК), что соответствует кровопотере 700-1200 мл.
Для II стадии геморрагичесокго шока (декомпенсированный обратимый шок) считали характерной кровопотерю 25-40% ОЦК (1200-2000 мл).
К III стадии геморрагического шока (деком-пенсированный необратимый шок) относили случаи с кровопотерей более 40% ОЦК (более 2000 мл). Для диагностики геморрагического шока и его ста-
дий также использовали «шоковый индекс» — отношение ЧСС к величине систолического АД. Считается, что «шоковый индекс» в норме равен 0,5; при кровопотере 20-30% ОЦК — 1,0; 30-50% ОЦК — 1,5.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ историй болезни показал, что геморрагический шок I степени имел место у 8 больных.
В клинической картине этой стадии у больных превалировали изменения сердечно-сосудистой системы функционального характера: бледность кожных покровов, умеренная тахикардия (ЧСС 101,7±6,2 уд. в мин.), умеренная олигурия (41,2±4,3 мл/ч). В этой группе систолическое АД составляло 108,4±7,4 мм рт. ст. Средняя кровопотеря у больных этой группы оценивалась в 1,1±0,12 л.
При лечении I стадии геморрагического шока в комплекс интенсивной терапии включали мероприятия по профилактике и борьбе с коагулопати-ей, нарушениями микроциркуляции. Так как при геморрагическом шоке инфузионно-транс-фузионная терапия является основой интенсивной терапии, было необходимо катетеризировать центральную вену, что позволяет вводить жидкости с большой скоростью. С этой целью чаще всего катетеризировали подключичную или яремную вену по методу Сельдингера.
Для борьбы с гиповолемией большое значение имеют плазмозаменители. Из синтетических плазмозаменителей чаще всего использовали ге-лофузин, рефортан, стабизол, из кристаллоидов -раствор Рингера, изотонический раствор хлорида натрия, 5% раствор глюкозы.
В I стадии геморрагического шока общий объем переливаемой жидкости превышал условный объем кровопотери в среднем в 1,5 раза. Если кро-вопотеря составляла 1 л, то общий объем переливаемой жидкости вместе с препаратами крови соответствовал 1,5 л. Из них синтетические коллоиды (гелофузин или рефортан) составили около 700 мл, эритроцитарная масса — 300,0±85,5 мл, раствор Рингера — 500 мл. Синтетические коллоиды вводили быстро, не допуская снижения АД ниже 90 мм рт. ст., почасового диуреза — 30 мл, ЦВД — 5 см вод. ст.
Дальнейшее введение жидкостей зависело от уровня волемии, которую оценивали по показателям АД, ЦВД, наличия или устранения нарушений микроциркуляции. При этом оценивали цвет кожных покровов и слизистых, ногтевых пластин, наличие или отсутствие симптома «белого пятна» и др.
При этом оценивали цвет кожных покровов и слизистых, ногтевых пластин, наличие или отсутствие симптома «белого пятна» и др.
Также при лечении геморрагического шока большое значение придавали переливанию свежезамороженной плазмы (СЗП), которая повышает онкотическое давление крови и тем самым способствует притоку и удержанию жидкости в сосудистом русле. Кроме того она содержит все факторы свертывающей системы и играет большую роль в профилактике и лечении ДВС-синдрома. Больным в I
стадии геморрагического шока введено в среднем 370±60,0 мл СЗП.
Кроме того при лечении геморрагического шока больным назначали ингибиторы протеаз (контри-кал 70000 АЕ, гордокс 300000 ЕД). В составе инфузионно-трансфузионной терапии соотношение коллоидных растворов к кристаллоидным в I стадии составляло 2:1.
После выведения из геморрагического шока больные продолжали получать инфузионные растворы, исходя из суточной потребности.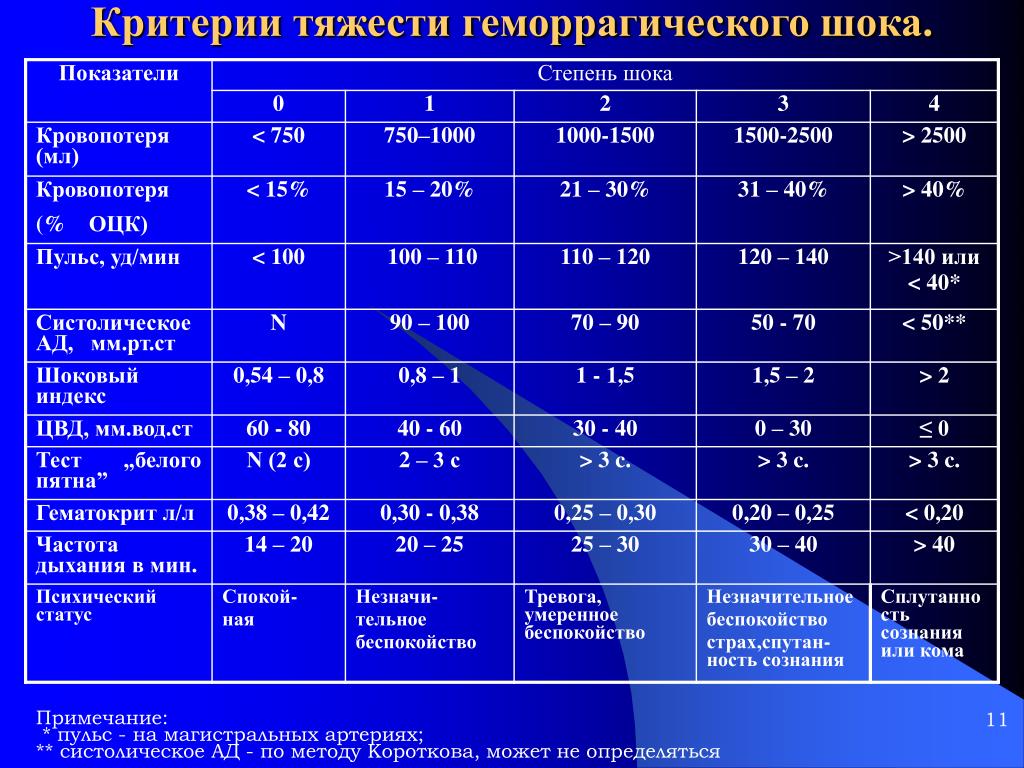 Общий объем жидкости в сутки складывается из объема «противо-шоковых» растворов (объем использованный для борьбы с шоком) и физиологических потребностей (ФП). ФП определяли по формуле 40млхМТ (масса тела). В объеме ФП соотношение растворов глюкозы к солевым и коллоидам составляло 1:1.
Общий объем жидкости в сутки складывается из объема «противо-шоковых» растворов (объем использованный для борьбы с шоком) и физиологических потребностей (ФП). ФП определяли по формуле 40млхМТ (масса тела). В объеме ФП соотношение растворов глюкозы к солевым и коллоидам составляло 1:1.
В группе больных во II стадии (декомпен-сированного обратимого) геморрагического шока (n=4) спазм периферических сосудов был не в состоянии компенсировать малый сердечный выброс. У них на первый план выступала артериальная гипотония. Общая кровопотеря составила в среднем 1650±290 мл. Систолическое АД определялось при поступлении на уровне 83,5±4,9 мм рт. ст., ЧСС -125,3±5,4 уд. в мин.
У всех больных была выражена одышка, ак-роцианоз на фоне бледности кожных покровов, холодный пот, беспокойство, олигурия (0,35±0,14 мл/ кг/ч), ЦВД — 0 см вод. ст., глухость сердечных тонов.
Для борьбы с шоком в этой группе назначали объемы жидкостей, превышающие кровопотерю в 2 раза.
Синтетические коллоиды (гелофузин, рефор-тан) вводили внутривенно струйно в дозе 1400 мл, СЗП — в дозе 580±185 мл, эритроцитарной массы было введено 1200±150 мл. Соотношение коллоидов к кристаллоидам составило 1:1. В качестве кристаллоидов использовали растворы Рингера и глюкозы.
В III стадии геморрагического шока (декомпен-сированный необратимый) кровопотеря превышала 40% ОЦК (2300±250 мл). В патогенезе необратимого шока основную роль играют парез капилляров, потеря плазмы, агрегация форменных элементов крови, нарастающий метаболический ацидоз. У больных этой группы (n=3) была выраженная бледность кожных покровов с участками мраморной пятнистости. Обращала на себя внимание выраженная одышка, пульс на периферических артериях не определялся. Систолическое АД составляло в среднем 55,3±4,4 мм рт. ст., ЧСС — 148±6,7 в мин. Отмечалась выраженная дыхательная недостаточность с участием вспомогательной мускулатуры. ЦВД отрицательное. Шоковый индекс соответствовал 1,5. Конечности холодные, анурия.
Отмечалась выраженная дыхательная недостаточность с участием вспомогательной мускулатуры. ЦВД отрицательное. Шоковый индекс соответствовал 1,5. Конечности холодные, анурия.
Инфузионно-трансфузионная терапия, направленная на борьбу с геморрагическим шоком, включала в себя введение коллоидов (гелофузин,
Медицина и экология, 2013, 1
25
рефортан) в общей дозе 1,5 л, СЗП — 800 мл, эритро-цитарную массу в общем объеме 1200 мл, раствор Рингера 2000 мл, 5% раствор глюкозы 1500 мл. В этой группе соотношение коллоидных растворов к кристаллоидным составило 1:1, а объема инфузион-но-транфузионных средств к кровопотере — 2,5:1. Во всех группах больным вводили ингибиторы протео-литических ферментов (контрикал по 80000 АЕ, гор-докс по 300000 ЕД).
В результате противошоковой терапии в первых двух группах удалось вывести из шока всех больных. Умерло 3 больных III группы, поступивших
Умерло 3 больных III группы, поступивших
в стадии декомпенсированного необратимого шока.
Таким образом, комплексная терапия больных с геморрагическим шоком эффективна в ЬП стадии, а эффективность лечения геморрагического шока зависит от адекватности инфузионно-трансфузионной терапии.
ЛИТЕРАТУРА 1. Франке Р. Восполнение объема циркулирующей крови с использованием коллоидных растворов. — Анестезиология и реаниматология. -2009. — №3. — С. 70-76.
Поступила 18.01.2013 г.
© КОЛЛЕКТИВ АВТОРОВ, 2013 УДК 616.13-007.64/.831-07
М. Т. Алиякпаров1, Е. С. Питель1, Г. В. Пак2
РОЛЬ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ И КОМПЬЮТЕРНО-ТОМОГРАФИЧЕСКОЙ АНГИОГРАФИИ В ДИАГНОСТИКЕ АНЕВРИЗМ ГОЛОВНОГО МОЗГА
1Кафедра визуальной диагностики Карагандинского государственного медицинского университета, 2Областная клиническая больница г. Зерттеу барысында аневризмалардын келес тYрлерi aныктaлFaн: алып — 2, iрi — 2 , орташа — 9, шаFын — 8, ал 1 наукаста 2 орташа капшыкты аневризма aныктaлFaн. Бас CYЙек iшiндегi кан кетулермен нaукaстaрдaFы ми iшiндегi артерия анвризмасын аныктау Yшiн ксмпьютерлiк ангиография е™зу нYCкaлFaн. Бул скшаулауды, кан кету кeлемi мен снын себептерЫ aныктaуFa, ссл сиякты инвaзивтi араласулар санын кыскaртуFa мYмкiндiк бередi. Макала авторлары компыотерлк-тсмсграфиялык ангиография шaFын, орташа, iрi жэне алып кeлемдегi аневризма-ларды анык бакылау мен бaFaлaуFa, сол сиякты аневризманы окшаулау орнын дэл белгiлеуге жэне онын трсмбaлaнбaFaн бeлiгiн бaкылaуFa мYмкiндiк бередi деген корытынды жaсaFaн.
Юлт сездер: ксмпьютерлiк томография, ксмпьютерлiк-тсмсгрaфиялык ангиография, бас миы тамырларынын аневризмасы, бас CYЙек iшiндегi кан кетуi, визуализация.
M. T Aliyakparov, Ye. S. Pitel, G. V. Pak
ROLEOFCOMPUTED TOMOGRAPHYAND COMPUTED TOMOGRAPHYANGIOGRAPHY FOR THE DIAGNOSIS OFBRAINANEURYSM
The article describes the research data of 20 patients with aneurysms of the cerebral vessels in age from 34 to 65 years. Among male patients predominated (65%). Persons aged 34 to 59 years accounted for 90% of the total number of patients. In the study identified the following types of aneurysms: huge — 2 large — 2, medium — 9 and small — 8, in 1 patient it was revealed 2 average saccular aneurysm. Angiography is recommended to carry out a computer to detect aneurysms of intracranial arteries in patients with intracranial hemorrhage, which allows determining the location, the amount of bleeding and the cause, as well as reducing the number of invasive procedures. The authors conclude that the computer-tomographic angiography allows clear visualization of the aneurysm of small, medium, large and giant size while maintaining the functioning of the lumen, a detailed assessment of the structure of saccular and fusiform shapes, the exact location of the aneurysm location, visualize it non-trombed part and to determine the presence of the waste receptacles.
Key words: computed tomography, computed tomographic angiography, cerebral aneurysms, intracranial hemorrhage, visualization
В связи с увеличением количества заболеваний сосудов головного мозга, приводящих к инвалидности или летальному исходу, своевременная и точная их диагностика представляет важную медицинскую и медико-социальную проблему, являясь актуальной задачей ангиологии [2, 6].
Смертность от сосудистых заболеваний головного мозга в экономически развитых странах занимает третье место после болезней сердца и
опухолей [1, 8]. Ишемические, геморрагические инсульты и субарахноидальные кровоизлияния являются наиболее частыми причинами смертности и первичной инвалидности, они могут возникать на фоне артериовенозных мальформаций и аневризм сосудов головного мозга [5, 6, 7].
Информативным методом в диагностике аневризм является компьютерная томография (КТ), высокая скорость получения изображений имеет
Геморрагический шок — статья из Инновационного сосудистого центра — ИСЦ
Геморрагический шок (ГШ) — это критическое состояние организма, связанное с острой кровопотерей, в результате чего возникает кризис макро-и микроциркуляции, синдром полиорганной и полисистемной недостаточности. С патофизиологической точки зрения — это кризис микроциркуляции, его неспособность обеспечить адекватный тканевой обмен, удовлетворить потребность тканей в кислороде, энергетических продуктах, удалить токсичные продукты обмена.
Организм здорового человека кровопотерю до 20% ОЦК (примерно 1000 мл) может восстановить за счет аутогемодилюции и перераспределению крови в сосудистом русле. При кровопотере более 20-25% эти механизмы могут ликвидировать дефицит ОЦК. При массивной кровопотере стойкая вазоконстрикция остается ведущей «защитной» реакцией организма, в связи с чем поддерживается нормальный или близкий к нему артериальное давление, осуществляется кровоснабжение мозга и сердца (централизация кровообращения), но за счет ослабления кровотока в мышцах внутренних органов, в том числе в почках, легких, печени.
Долговременная устойчивая вазоконстрикция, как защитная реакция организма сначала, в течение некоторого времени поддерживает в определенных пределах артериальное давление, в дальнейшем, при прогрессировании шока и при отсутствии адекватной терапии, способствует последовательному развитию тяжелых нарушений микроциркуляции, формированию «шоковых» органов и развитию острой почечной недостаточности и других патологических состояний.
Тяжесть и скорость нарушений при ГШ зависит от длительности артериальной гипотонии, восходящего состояния органов и систем. При восходящей гиповолемии кратковременная гипоксия в родах ведет к шоку, так как является пусковым механизмом нарушения гемостаза.
Клиника геморрагического шока
Геморрагический шок проявляется слабостью, головокружением, тошнотой, сухостью во рту, потемнением в глазах, при увеличении кровопотери — потерей сознания. В связи с компенсаторным перераспределением крови ее количество уменьшается в мышцах, коже проявляется бледностью кожных покровов с серым оттенком конечности холодные, влажные. Уменьшение почечного кровотока проявляется снижением диуреза, в последующем с нарушением микроциркуляции в почках, с развитием ишемии, гипоксии, некроза канальцев. При увеличении объема кровопотери нарастают симптомы дыхательной недостаточности: одышка, нарушение ритма дыхания, возбуждение, периферийное цианоз.
Выделяют четыре степени тяжести геморрагического шока:
- I степень тяжести отмечается при дефиците ОЦК 15%. Общее состояние удовлетворительное, кожные покровы бледного цвета, незначительное тахикардия (до 80-90 уд / мин) АД в пределах 100 мм рт.ст., гемоглобин 90г / л, центральное венозное давление в норме.
- II степень тяжести — дефицит ОЦК до 30%. Общее состояние средней тяжести, жалобы на слабость, головокружение, потемнение в глазах, тошноту, кожа бледная, холодная. Артериальное давление 80-90 мм рт.ст., центральное венозное давление ниже 60 мм вод.ст., тахикардия до 100-120 уд / мин, диурез снижен, гемоглобин 80г / л и ниже.
- III степень тяжести имеет место при дефиците ОЦК 30-40%. Общее состояние тяжелое. Наблюдается резкая заторможенность, головокружение, кожные покровы бледного цвета, акроцианоз, артериальное давление ниже 60-70 мм рт.ст., ЦВД падает (20-30 мм вод.ст. и ниже). Наблюдается гипотермия, частый пульс (130-140 уд / мин), олигурия.
- IV степень тяжести наблюдается при дефиците ОЦК более 40%. Состояние очень тяжелое, сознание отсутствует. Артериальное давление и центральное венозное давление не определяется, пульс отмечается только на сонных артериях. Дыхание поверхностное, учащенное, с патологическим ритмом, отмечается подвижное возбуждения, гипорефлексия, анурия.
- Быстрая и надежная остановка кровотечения.
- Пополнение ОЦК и поддержания макро-, микроциркуляции и адекватной тканевой перфузии с использованием управляемой гемодилюции, гемотрансфузии, реокорректоров, глюкокортикоидов и др..;
- Искусственная вентиляция легких в режиме умеренной гипервентиляции с положительным давлением в конце выдоха (профилактика «шоковых легких»)
- Лечение синдрома дессеминированного внутрисосудистого свертывания, нарушений кислотно-основного состояния, белкового и водно-электролитного обмена, коррекция метаболического ацидоза;
- Обезболивание, лечебный наркоз, антигипоксическая защита мозга;
- Поддержание адекватного диуреза на уровне 50-60 мл / час;
- Поддержание деятельности сердца, печени;
Устранение причины кровотечения — главный момент лечения геморрагического шока. Выбор метода остановки кровотечения зависит от ее причины. При лечении большое значение имеет скорость компенсации кровопотери и своевременное хирургическое лечение. При II степени тяжести геморрагический шок является абсолютным показанием к оперативной остановке кровотечения.
Инфузионная терапия при геморрагическом шоке должна проводиться в 2-3 вены: при АД в пределах 40-50 мм рт.ст. объемная скорость инфузии должна быть 300 мл / мин при АД 70-80 мм рт.ст. — 150-200 мл / мин при стабилизации АД до 100-110 мм рт.ст. инфузия проводится капельно под контролем АД и почасового диуреза.
Соотношение коллоидов и кристаллоидов должно быть 2:1. В инфузионную терапию включаются: реополиглюкин, волекам, эритромасса, нативная или свежезамороженная плазма (5-6 флаконов), альбумин, раствор Рингера-Локка, глюкоза, панангин, преднизолон, коргликон, для коррекции метаболического ацидоза — 4% раствор гидрокарбоната натрия, трисамин. При гипотензивном синдроме — введение дофамина или допамина. Объем инфузии должен превышать предполагаемую кровопотерю на 60-80%, одновременно проводится гемотрансфузия в объеме не более 75% кровопотери при ее одномоментном замещении, затем отсроченная гемотрансфузия в меньших дозах.
Для ликвидации вазоспазма после устранения кровотечения и ликвидации дефицита ОЦК применяют ганглиоблокаторы с препаратами, которые улучшают реологические свойства крови (реополиглюкин, трентал, компламин, курантил). Необходимо применять глюкокортикоиды в больших дозах (30-50мг/кг гидрокортизона или 10-30мг/кг преднизолона), мочегонные средства, искусственную вентиляцию легких.
Для лечения ДВС-синдрома при ГШ применяют свежезамороженную плазму, ингибиторы протеаз — контрикал (трасилол) по 60-80000 ОД, гордокс по 500-600000 ОД. Дицинон, этамзилат, андроксон снижают ломкость капилляров, усиливают функциональную активность тромбоцитов. Применяют сердечные гликозиды, иммунокорректоры, витамины, по показаниям — антибактериальную терапию, анаболики (неробол, ретаболил), эссенциале.
Летальность при геморрагическом шоке зависит от времени устранения кровотечения, объема кровопотери и проведения мероприятий интенсивной терапии. В настоящее время она составляет около 15% от всех случаев.
Большое значение после интенсивной терапии имеет реабилитационная терапия, лечебная гимнастика.
ВОЗМОЖНОСТИ ТЕРАПИИ ГЕМОРРАГИЧЕСКОГО ШОКА У БОЛЬНЫХ С ЖЕЛУДОЧНО-КИШЕЧНЫМ КРОВОТЕЧЕНИЕМ | Симутис
1. Gerasimov L.V., Samorukov V.Yu., Moroz V.V., Ivanova G.P. Primenenie eritropoetina u bolnykh s travmoi i krovopoterei. Obshchaya Reanimatologiya. [Use of erythropoietin in patients with injury and blood loss. General Reanimatology]. 2012; 8 (5): 11—18. [In Russ.]
2. Borisov D.B., Markov B.B., Mezentsev P.A., Poskotinov I.R., Istomina N.A. Stimulyatsiya eritropoeza u patsientov s posleoperatsionnoi anemiei. Obshchaya Reanimatologiya. [Erythropoiesis stimulation in patients with postoperative anemia. General Reanimatology]. 2013; 9 (4): 59—63. [In Russ.]
3. Marchenkov Yu.V., Yakovlev V.N., Korzheva I.Yu., Alekseyev V.G., Moroz V.V. Algoritmy diagnostiki i lecheniya legochnykh krovotechenii. Obshchaya Reanimatologiya. [Algorithms for the diagnosis and treatment of pulmonary hemorrhage. General Reanimatology]. 2013; 9 (2): 45—54. [In Russ.]
4. Filatov V.V., Dolgikh V.T. Osobennosti gemodinamiki I sverty vayushchei sistemy krovi u bolnykh, operirovannykh po povodu krovotechenii yazvennoi bolezni. Obshchaya Reanimatologiya. [Hemodynamics and blood coagulation system in patients operated following ulcer disease hemorrhagia. General Reanimatology]. 2013; 9 (3): 30—34. [In Russ.]
5. Yakovlev A.Yu., Kichin V.V., Nikolsky V.O., Kalentyev G.V., Ryabikov D.V., Ryabikova M.A., Protasov D.M., Galanina T.A., Smorkalov A.Yu., Evdokimova O.S. Effektivnost primeneniya sterofundina izotonich eskogo posle ostroi massivnoi krovopoteri v eksperimente. Obshchaya Reanimatologiya. [Efficacy of employment of isotonic sterofundin after experimental hemorrhagic shock. General Reanimatology]. 2013; 9 (3): 24—29. [In Russ.]
6. Gostishchev V.K., Evseyev M.A. Gastroduodenalnye krovotecheniya yazvennoi etiologii (patogenez, diagnostika, lechenie). Rukovodstvo dlya vrachei. [Bleeding gastroduodenal ulcer: Pathogenesis, diagnosis, treatment. A guide for physicians]. Moscow: GEOTAR – Media; 2008: 384. [In Russ.]
7. Stollman N., Metts D.S. Patofiziologiya i profilaktika stressovykh yazv u reanimatsionnykh bolnykh. [Pathology and prevention of stress ulcers in intensive care unit patients]. Russky Meditsinsky Zhurnal. 2005; 13 (25): 1668–1674. [In Russ.]
8. Cook D.J., Griffith L.E., Walter S.D., Guyatt G.H., Meade M.O., Heyland D.K., Kirby A., Tryba M.; Canadian Critical Care Trials Group. The attributable mortality and length of intensive care unit stay of clinically important gastrointestinal bleeding in critically ill patients. Crit. Care. 2001; 5 (6): 368—375. PMID: 11737927
9. Bolotskikh V.I., Tumanovsky Yu.M., Savina G.Yu. Tsentralnaya gemodinamika pri ispolzovanii razlichnykh metodov vosstanovleniya obyema tsirkuliruyushchei krovi pri gemorragicheskom shoke. Obshchaya Reanimatologiya. [Central hemodinamics in the use of different methods for recovering the circulating blood volume in hemorrhagic shock. General Reanimatoilogy]. 2009; 5 (1): 54—57. [In Russ.]
10. Potashov L.V., Savransky V.M., Morozov V.P. Krovotok i svobodno radikalnoe okislenie lipidov v slizistoi zheludka i dvenadtsatiperstnoi kishki pri oslozhnennom techenii duodenalnoi yazvy. [Blood flow and free radical oxidation of lipids in gastric and duodenal mucosa in complicated duodenal ulcers]. Khirurgiya. 1996; 5: 40—42. PMID: 9011655. [In Russ.]
11. Morgunov S.S. Korrektsiya reamberinom tkanevoi gipoksii i sostoyanie pro- i antioksidantnoi system u khirurgicheskikh bolnykh s gastroduodenalnym krovotecheniem. [Reamberin correction of tissue hypoxia and the pro- and antioxidant systems in surgical patients with gastroduodenal bleeding]. Vestnik Intensivnoi Terapii. 2006; 3: 58–62. [In Russ.]
12. Morgunov S.S. Korrektsiya reamberinom protsessov svobodnoradikalnogo okisleniya pri gastroduodenalnykh krovotecheniyakh. [Reamberin correction of free radical oxidative processes in gastroduodenal bleeding]. Fundamentalnye Issledovaniya. 2006; 6: 36—37. [In Russ.]
13. Oparin A.G., Vasilyev A.A. Perekisnoe okislenie lipidov i zashchitnyi slizistyi baryer pri yazvennoi bolezni. [Lipid peroxidation and the protective mucosal barrier in peptic ulcer]. Klinicheskaya Meditsina. 1990; 68 (10): 80—81. PMID: 2150211. [In Russ.]
14. Khramykh T.P., Dolgikh V.T. Patogenez intoksikatsii pri gemorragicheskoi gipotenzii (eksperimentalnoe issledovanie). Obshchaya Reanimatologiya. [Pathogenesis of intoxication in hemorrhagic hypotension (experimental study). General Reanimatoilogy]. 2008; 4 (5): 36—39. [In Russ.]
15. Maltseva L.A., Usenko L.V., Mosentsev N.F., Kosulnikov S.O., Volkov A.O., Mosentsev N.N., Abu Al Rub Bakha’a El Din. Gastrointestinalnaya nedostatochnost, puti diagnostiki i korrektsii. [Gastrointestinal failure, methods for diagnosis and correction]. Dnepropetrovsk: Novaya Ideologiya; 2006: 130. [In Russ.]
16. Bisenkov L.L., Glushkov S.I., Zamyatin M.L., Maksimova T.N., Gunyat R.Ya., Ivanchenko S.V., Slivin O.A. Primenenie reamberina dlya profilaktiki i lecheniya gastroduodenalnykh erozii i yazv posle operatsii na legkikh. [Use of reamberin to prevent and treat gastroduodenal erosions and ulcers after lung surgery]. Mezhdunarodnyi Meditsinsky Zhurnal. 2002; 5: 435—438. [In Russ.]
17. Golikov A.P., Davydov B.V., Rudnev D.V., Klychnikova E.V., Bykova N.S., Ryabinin V.A., Polumiskov V.Yu., Nikolayeva N.Yu., Golikov P.P. Vliyanie meksikora na okislitelnyi stress pri ostrom infarkte miokarda. [Effect of mexicor on oxidative stress in acute myocardial infarction]. Kardiologiya. 2005; 45 (7): 21–26. PMID: 16091656. [In Russ.]
18. Mikhin V.P., Pokrovsky M.V., Gureyev V.V., Chernova O.A., Alimenko Yu.V., Bogoslovskaya E.N. Effektivnost otechestvennogo miokardialnogo tsitoprotektora i ego farmakodinamika pri ostroi ishemii miokarda: klinicheskie rezultaty i eksperimentalnye modeli. [Efficacy of the Russian myocardial cytoprotector and its pharmacodynamics in acute myocardial ischemia: Clinical results and experimental models]. Rossiisky Kardiologichesky Zhurnal. 2011; 2: 37—42. [In Russ.]
19. Boyarinov G.A., Usanova A.A., Kotlov I.S., Saushev A.S., Komkov A.P. Medikamentoznaya profilaktika reperfuzionnykh povrezhdenii pri tromboliticheskoi terapii infarkta miokarda. Obshchaya Reanimatologiya. [Drug prevention of reperfusion lesions during thrombolytic therapy for myocardial infarction. General Reanimatoilogy]. 2010; 6 (1): 64—68. [In Russ.]
20. Statsenko M.E., Turkina S.V., Kosivtsova M.A. Vozmozhnosti meksikora pri ego ispolzovanii v sostave kombinirovannoi terapii u bolnykh ishemicheskoi boleznyu serdtsa i sakharnym diabetom 2-go tipa. [Additional advantages of mexicor used in combined therapy of coronary heat disease and diabetes mellitus of 2nd type]. Klinicheskaya Meditsina. 2013; 91 (5): 59—64. PMID: 24159791. [In Russ.]
21. Chumakov M.V., Efremov A.A., Zvereva N.Yu., Dublev A.V., Timerbayev V.Kh., Fedotova I.N., Davydov B.V., Kharitonova N.I., Malanyin D.V., Brand Ya.B. Okislitelnyi stress i metody korrektsii u bolnykh s ostrymi rasstroistvami koronarnogo krovoobrashcheniya v perioperatsionnom periode pryamoi revaskulyarizatsii miokarda. Obshchaya Reanimatologiya. [Oxidative stress and methods for its correction in patients with acute coronary circulatory disorders during perioperative direct myocardial revascularization. General Reanimatoilogy]. 2008; 4 (4): 26—31. [In Russ.]
Геморрагический шок | simcentr
ДОПОЛНИТЕЛЬНАЯ ПРОФЕССИОНАЛЬНАЯ ПРОГРАММА ПОВЫШЕНИЯ КВАЛИФИКАЦИИ
«ГЕМОРРАГИЧЕСКИЙ ШОК»
Цель программы «Геморрагический шок» — совершенствование знаний, профессиональных умений и навыков врачей анестезиологов – реаниматологов в области диагностики и неотложной терапии геморрагического шока.
Задачи программы:
Овладение знаниями оказания неотложной помощи при геморрагическом шоке у различной категории пациентов.
Обучение различным методам диагностики и лечения геморрагического шока.
Освоение методик остановки кровотечения, определения ориентировочной степени кровопотери, алгоритма первой помощи при геморрагическом шоке.
Изучение различных аспектов закономерности течения геморрагического шока у разных категорий пациентов.
Программа направлена на совершенствование имеющихся и получение новых компетенций, необходимых для профессиональной деятельности, и повышение профессионального уровня в рамках имеющейся квалификации.
Структура дополнительной профессиональной программы повышения квалификации врачей по теме «Геморрагический шок» состоит из планируемых результатов обучения, требований к итоговой аттестации обучающихся, учебного плана, учебно-тематического плана, условий обеспечения реализации программы, контрольно-измерительных материалов, перечня основной и дополнительной литературы, законодательных и нормативно-правовых документов.
В содержании программы дополнительной профессиональной программы повышения квалификации врачей по теме «Геморрагический шок» предусмотрены необходимые знания и практические умения для врачей анестезиологов — реаниматологов.
Программа реализуется на базе Аккредитационно-симуляционного центра ФГБОУ ВО Амурская ГМА Минздрава России.
Специальность: «Анестезиология — реаниматология»
Трудоемкость: 18 часов (3 дня)
Форма обучения: очная
Режим занятий: 6 часов
ОСК: 14 часов
ДОТ и ЭО: 4 часа
| ! Геморрагический шок — разновидность гиповолемического шока. Последний также возникает при ожогах и дегидратации. Классификация Компенсаторные механизмы Физиологические реакции Патогенез. Адаптацию больного к кровопотере во многом определяют изменения ёмкости венозной системы (содержащей у здорового человека до 75% объёма крови). Однако возможности для мобилизации крови из депо ограничены: при потере более 10% ОЦК начинает падать ЦВД и уменьшается венозный возврат к сердцу. Возникает синдром малого выброса, приводящий к снижению перфузии тканей и органов. В ответ появляются неспецифические компенсаторные эндокринные изменения. Освобождение АКТГ, альдостерона и АДГ приводит к задержке почками натрия, хлоридов и воду при одновременном увеличении потерь калия и уменьшении диуреза. Результат выброса адреналина и норадреналина — периферическая вазоконстрикция. Из кровотока выключаются менее важные органы (кожа, мышцы, кишечник), и сохраняется кровоснабжение жизненно важных органов (мозг, сердце, лёгкие), т.е. происходит централизация кровообращения. Вазоконстрикция приводит к глубокой гипоксии тканей и развитию ацидоза. В этих условиях протеолитические ферменты поджелудочной железы поступают в кровь и стимулируют образование кининов. Последние повышают проницаемость сосудистой стенки, что способствует переходу воды и электролитов в интерстициальное пространство. В результате в капиллярах происходит агрегация эритроцитов, создающая плацдарм для образования тромбов. Этот процесс непосредственно предшествует необратимости шока. Клиническая картина. При развитии геморрагического шока выделяют 3 стадии. ЛЕЧЕНИЕ. При геморрагическом шоке категорически противопоказаны вазопрессорные препараты (адреналин, норадреналин), поскольку они усугубляют периферическую вазо-констрикцию. Для лечения артериальной гипотёнзии, развившейся в результате кровопотери, последовательно выполняют перечисленные ниже процедуры.
|
Плазма крови в лечении геморрагического шока на догоспитальном этапе: новые исследования – Девятый вызов
В различных системах скорой медицинской помощи основным средством возмещения кровопотери при травме на догоспитальном этапе остаются изотонические кристаллоидные растворы. Как правило, это хлорид натрия или “сбалансированные” растворы (Рингер лактат). На постсоветском пространстве в этих целях применяются также коллоидные плазмозаменители.
Каждый из этих растворов имеет свои недостатки, и сегодня мы рассмотрим как исследуют одну из альтернатив: плазму крови. На этот препарат возлагают надежды в связи с возможной коррекцией коагулопатии, одного из звеньев “смертельной триады травмы”.
Плазму крови затруднительно использовать на догоспитальном этапе в связи со строгими условиями хранения, и в рассмотренных источниках упоминаются следующие препараты:
— замороженная плазма, которую размораживают в специальном устройстве непосредственно перед употреблением;
— размороженная плазма, которая сохраняет годность до 5 суток и затем утилизируется;
— лиофилизированная плазма, на использование которой по экстренным показаниям получило разрешение Министерство обороны США [3].
Оно же и финансирует экспериментальные исследования применения плазмы крови (пока в виде первых двух препаратов плазмы). В июле 2018 года опубликованы результаты двух таких исследований, которые мы сейчас рассмотрим.
Сведения, изложенные в настоящей публикации, не могут служить основанием для изменения сложившейся клинической практики. Всегда следуйте алгоритмам и протоколам, принятым в вашей организации, регионе, стране. Настоятельно рекомендуем ознакомиться с полным текстом обсуждаемых научных статей.
I. Первоочередная реанимация плазмой крови при лечении геморрагического шока в ходе экстренной медицинской эвакуации наземным транспортом в городских условиях: рандомизированное исследование [1]
Медицинский центр Денвера, являясь травмоцентром высшего уровня, включает подразделение парамедиков, которые и принимали участие в этом исследовании. Оно по традиции получило “говорящую” аббревиатуру COMBAT (Control Of Major Bleeding After Trauma).
Взрослые пострадавшие отбирались на основании критериев:
— систолическое артериальное давление 70 мм рт.ст. и ниже,
ИЛИ
— систолическое артериальное давление в диапазоне 71 — 90 мм рт.ст. при частоте сердечных сокращений 108 в мин. и более;
— предполагаемая связь гипотензии с острой кровопотерей.
Исключались заключённые, беременные, пациенты с изолированным огнестрельным ранением головы, асистолией или сердечно-легочной реанимацией до рандомизации, при отказе от введения продуктов крови и прочих юридических препятствиях.
Каждый из 33 автомобилей “скорой помощи” оснастили портативным холодильником для хранения замороженной плазмы и устройством для быстрой разморозки. Их применение в сочетании с плоскими, тонкими пакетами позволяет размораживать дозу плазмы за 3 минуты. Половина холодильников случайным образом снаряжалась не плазмой, а льдом эквивалентной массы. Парамедик узнавал, что в его контейнере, только когда принимал решение о включении пациента в исследование. Если он обнаруживал плазму, то начинал ее введение, и пациент зачислялся в экспериментальную группу. Если же в контейнере был ледяной муляж, инфузионная терапия проводилась по стандартному протоколу изотоническим раствором хлорида натрия, а пациент попадал в группу контроля.
Перед введением плазмы у пострадавшего брали образец крови, на котором сразу же выполняли тромбоэластографию. Для этого в бригады включали специально обученных ассистентов. Впоследствии в стационаре тромбоэластография выполнялась серийно.
С 1 апреля 2014 по 31 марта 2017 года 144 пациента были случайным образом распределены по двум группам. По различным причинам (в основном в связи с возрастом менее 18 лет и с отказом от вмешательства) в исследовании остались 125 пациентов: 65 в группе плазмы и 60 в группе контроля.
Медианное время от момента получения травмы до поступления в больницу составило 28 минут для группы плазмы и 24 минуты для группы контроля. Время транспортировки 19 и 16 минут соответственно. Время от момента травмы до получения первой дозы плазмы составило в среднем 59 минут в контрольной группе и 24 минуты в экспериментальной.
Исследователи отмечают, что по тяжести и характеру травм две группы схожи с некоторым преобладанием шока и гиперфибринолиза в группе плазмы на месте происшествия.
Итак, некоторые результаты.
Летальность через 28 дней после травмы:
— 10 (15%) в группе плазмы;
— 6 (10%) в группе контроля.
Досуточная летальность:
— 8 (12%) плазма;
— 6 (10%) контроль.
Острое легочное повреждение через 28 дней после травмы:
— 28 (43%) плазма;
— 30 (50%) контроль.
Полиорганная недостаточность через 28 дней после травмы (шкала Денвера > 3):
— 4 (6%) плазма;
— 1 (2%) контроль.
Композитный неблагоприятный исход (полиорганная недостаточность или смерть) через 28 дней:
— 14 (21%) плазма;
— 7 (12%) контроль.
Регуляторы признали продолжение исследования нецелесообразным еще до набора целевого количества пациентов. Однако исследователи считают различие результатов в группах статистически незначимым (!!! см. летальность и композитный исход). Вы можете согласиться или поспорить с ними, ознакомившись с полным текстом статьи.
Так или иначе, данное исследование не обнаружило преимуществ раннего введения плазмы крови по сравнению со стандартным протоколом в городских условиях.
Вторая статья выглядит более оптимистично:
II. Применение плазмы на догоспитальном этапе в ходе санитарно-авиационной эвакуации у пациентов с травмой и риском геморрагического шока [2]
Prehospital Air Medical Plasma (PAMPer) — это многоцентровое рандомизированное исследование 3 фазы по выявлению превосходства размороженной плазмы над стандартной реанимацией в условиях медицинской эвакуации воздушным транспортом. Основной результат — 30-дневная летальность.
В исследование включали пациентов, транспортируемых с места происшествия либо из лечебных учреждений низшего уровня в участвующий травмоцентр.
Критерии включения:
— эпизод гипотензии < 90 мм рт.ст. И тахикардии > 108 в мин.;
ИЛИ
— эпизод выраженной гипотензии < 70 мм рт.ст.
на любом этапе оказания помощи.
Критерии исключения:
— младше 18,
— старше 90,
— отсутствие сосудистого доступа,
— в механизме травмы только падение с высоты собственного роста,
— подтвержденная спинальная травма,
— заключенные,
— беременные,
— травматическая остановка кровообращения дольше 5 минут,
— открытая ЧМТ,
— повреждения получены в связи с утоплением или повешением,
— ожоги более 20% кожи,
— прочие обстоятельства организационного и юридического характера.
В исследовании приняли участие 27 баз санитарной авиации, которые раз в месяц случайным образом разделялись на “применяющие плазму” и “соблюдающие стандартный протокол”. С мая 2014 по октябрь 2017 авиамедицинскими бригадами этих 27 баз были перевезены 7275 пациентов в 9 участвующих травмоцентров. 501 пациент попал в когорту intention-to-treat: 230 получили плазму и 271 стандартное лечение.
Летальность через 30 дней:
— 23,2% в группе плазмы;
— 33,0% в группе контроля.
Досуточная летальность и потребность в компонентах крови в группе плазмы также были ниже. Не выявлено статистически значимых различий по частоте полиорганной недостаточности, острого легочного повреждения, нозокомиальных инфекций. Тяжелых осложнений, связанных с введением плазмы, не выявлено.
Авторы делают вывод, что введение размороженной плазмы крови пациентам с риском геморрагического шока в ходе санитарно-авиационной эвакуации безопасно и приводит к снижению 30-дневной летальности.
ИСТОЧНИКИ
1. Lancet. 2018 Jul 28;392(10144):283-291.
doi: 10.1016/S0140-6736(18)31553-8. Epub 2018 Jul 20.
Plasma-first resuscitation to treat haemorrhagic shock during emergency ground transportation in an urban area: a randomised trial.
Moore HB et al.
Pubmed | Lancet
2. N Engl J Med. 2018 Jul 26;379(4):315-326.
doi: 10.1056/NEJMoa1802345.
Prehospital Plasma during Air Medical Transport in Trauma Patients at Risk for Hemorrhagic Shock.
Sperry JL et al.
Pubmed | NEJM
3. FDA News release.
FDA takes action to support American military personnel by granting an authorization for freeze-dried plasma product to enable broader access while the agency works toward approval of the product.
Просмотры: 1 942
Травматология — Геморрагический шок
Геморрагический шок
Геморрагический шок – это состояние острой сердечно—сосудистой недостаточности, которая развивается после потери значительного количества крови и приводит к уменьшению перфузии жизненно важных органов.
Этиология: травмы с повреждением крупных сосудов, острая язва желудка и двенадцатиперстной кишки, разрыв аневризмы аорты, геморрагический панкреатит, разрыв селезенки или печени, разрыв трубы или внематочная беременность, наличие долек плаценты в матке и др.
По клиническим данным и величине дефицита объема крови различают следующие степени тяжести.
1. Не выраженная – клинические данные отсутствуют, уровень артериального давления в норме. Объем кровопотери до 10 % (500 мл).
2. Слабый – минимальная тахикардия, небольшое снижение артериального давления, некоторые признаки периферической вазоконстрикции (холодные руки и ноги). Объем кровопотери составляет от 15 до 25 % (750—1200 мл).
3. Умеренная – тахикардия до 100–120 ударов в 1 мин, снижение пульсового давления, систолическое давление 90—100 мм рт. ст., беспокойство, потливость, бледность, олигурия. Объем кровопотери составляет от 25 до 35 % (1250–1750 мл).
4. Тяжелая – тахикардия более 120 ударов в мин, систолическое давление ниже 60 мм рт. ст., часто не определяется тонометром, ступор, крайняя бледность, холодные конечности, анурия. Объем кровопотери составляет более 35 % (более 1750 мл). Лабораторно в общем анализе крови снижение уровня гемоглобина, эритроцитов и гематокрита. На ЭКГ обнаруживаются неспецифические изменения сегмента ST и зубца Т, которые обусловлены недостаточной коронарной циркуляцией.
Лечение геморрагического шока предусматривает остановку кровотечения, применение инфузионной терапии для восстановления ОЦК, использование сосудосуживающих средств или сосудорасширяющих средств в зависимости от ситуации. Инфузионная терапия предусматривает внутривенно введение жидкости и электролитов в объеме 4 л (физиологический раствор, глюкоза, альбумин, полиглюкин). При кровотечении показано переливание одногруппной крови и плазмы в общем объеме не менее 4 доз (1 доза составляет 250 мл). Показано введение гормональных препаратов, таких как мембраностабилизаторы (преднизолон 90—120 мг). В зависимости от этиологии проводят специфическую терапию.
Реанимационные стратегии при травматическом геморрагическом шоке | Annals of Intensive Care
Введение
Кровоизлияние остается основной причиной предотвратимой смерти после травм [1]. В острой фазе кровотечения терапевтический приоритет врача — как можно быстрее остановить кровотечение. Геморрагический шок — это патологическое состояние, при котором нарушается внутрисосудистый объем и доставка кислорода. Пока это кровотечение не контролируется, врач должен поддерживать доставку кислорода, чтобы ограничить тканевую гипоксию, воспаление и дисфункцию органов.Эта процедура включает в себя жидкостную реанимацию, использование вазопрессоров и переливание крови для предотвращения или коррекции травматической коагулопатии. Однако, оптимальная стратегия реанимационная является спорной: выбор жидкости для реанимации, цель гемодинамических целей контроля кровоизлияний, а также предотвращение оптимального травматической коагулопатии вопросы, которые остаются. Этот обзор посвящен новому пониманию реанимационных стратегий при травматическом геморрагическом шоке.
Гидравлическая реанимация
Гидравлическая реанимация — первое терапевтическое вмешательство при травматическом геморрагическом шоке.Обсуждаем выбор типа жидкости для реанимации. В литературе нет доказательств, подтверждающих превосходство одного типа жидкости над другим типом жидкости у пациентов с травмами. Наиболее важным двойным преимуществом коллоидов перед кристаллоидами является то, что коллоиды могут вызывать более быстрое и стойкое расширение плазмы из-за большего повышения онкотического давления, и они могут быстро достичь целей кровообращения. Хотя кристаллоиды дешевле, результаты исследований не показали улучшения выживаемости при введении коллоидов.Однако реанимация с использованием больших объемов кристаллоидов была связана с отеком тканей, повышенной частотой синдрома брюшной полости [2] и гиперхлоремическим метаболическим ацидозом [3].
Исследование SAFE продемонстрировало, что введение альбумина было безопасным для жидкостной реанимации для пациентов отделения интенсивной терапии (ОИТ) и что не было разницы в уровне смертности пациентов, получавших альбумин и физиологический раствор [4]. В подгруппе пациентов с травмами исследователи наблюдали положительную тенденцию в пользу использования физиологического раствора по сравнению с использованием альбумина.Это различие в относительном риске смерти было связано с большим количеством пациентов, имевших травмы и связанные с ними черепно-мозговые травмы и умерших после случайного отнесения к группе, получавшей альбумин, по сравнению с группой, получавшей физиологический раствор. Не было предложено никакого механизма для объяснения этого открытия, но низкая гипоосмолярность альбумина может увеличить риск отека мозга. В недавнем Кокрановском обзоре [5], посвященном тяжелобольным пациентам (пациентам с травмами, ожогами или после операции), не было получено данных РКИ о том, что реанимация коллоидами снижает риск смерти по сравнению с реанимацией кристаллоидами.В обзоре клинических исследований, проведенных в 2002 году с данными о безопасности, задокументированными у пациентов в отделении интенсивной терапии, получавших ГЭК, желатин, декстран или альбумин, Groeneveld et al. [6] продемонстрировали, что после инфузии ГЭК часто сообщалось о нарушении коагуляции, клиническом кровотечении и остром повреждении почек (ОПП). Примечательно, что на этот анализ сильно повлияло исследование VISEP (Объемное замещение и инсулиновая терапия при тяжелом сепсисе) [7], в котором использовался ГЭК предыдущего поколения (200 / 0,5) с дозами, превышающими рекомендованные максимальные дозы.Эти мета-анализы учитывают гетерогенные популяции пациентов с различными терапевтическими стратегиями. Недавно Perner et al. [8] показали повышенный риск смерти (смерть на 90-й день) у пациентов с тяжелым сепсисом, которым была назначена жидкостная реанимация ГЭК 130 / 0,42 (6% ГЭК 130 / 0,42 в ацетате Рингера, последнее поколение ГЭК) по сравнению с с теми, кто получал ацетат Рингера. Более того, большему количеству пациентов потребовалась заместительная почечная терапия в группе ГЭК 130 / 0,42 (22%), чем в группе ацетата Рингера (16%).В свете общих патофизиологических путей с активацией воспаления между сепсисом и травмой, использование ГЭК вызывает серьезные опасения относительно его безопасности у пациентов с травмами [9].
Таким образом, исследование пациентов с травмами, находящихся в геморрагическом шоке, является настоятельной необходимостью. Недавно было проведено двойное слепое рандомизированное контролируемое исследование, в котором сравнивали 0,9% физиологический раствор и гидроксиэтилкрахмал (HES 130 / 0,4) у пациентов с проникающей тупой травмой, которым потребовалось> 3 литров жидкостной реанимации [10].У пациентов с проникающей травмой (n = 67) применение ГЭК (130 / 0,4) было связано с лучшим клиренсом лактата, что предполагает раннюю реанимацию. Кроме того, в группе ГЭК наблюдались более низкие максимальные баллы по шкале SOFA и отсутствие острого повреждения почек. Однако у пациентов с тупой травмой (n = 42) не было различий в потребностях в жидкости, клиренсе лактата и максимальных оценках SOFA между двумя группами. Кроме того, сообщалось о большей потребности в крови и продуктах крови в группе ГЭК со значительно большим изменением коагуляции (тромбоэластография).Сложно делать выводы, потому что пациенты в группе HES получили более тяжелые травмы, чем пациенты в группе физиологического раствора; мы должны проявлять осторожность при интерпретации результатов, потому что исследование основано на небольшом размере выборки.
Последние европейские рекомендации по лечению кровотечений после тяжелой травмы [11] рекомендовали, чтобы кристаллоиды применялись изначально для лечения пациентов с кровоточащими травмами, и что добавление коллоидов следует рассматривать у гемодинамически нестабильных пациентов.Среди коллоидов следует использовать растворы ГЭК или желатина. В руководстве рекомендуется использовать ГЭК нового поколения в установленных пределах из-за риска ОПП и нарушения свертывания крови.
Гипертонический раствор (ГТС) — интересное средство при травматическом геморрагическом шоке. Основным преимуществом HTS является быстрое увеличение объема крови при введении небольшого объема, особенно если он используется с коллоидом. Кроме того, HTS можно использовать в качестве гиперосмолярного агента у пациентов с повышенным внутричерепным давлением.Однако в недавних РКИ HTS не улучшили результаты [12, 13]. Bulger et al. [12] сообщили, что внебольничная реанимация HTS + декстран не снижает выживаемость без острого респираторного дистресс-синдрома через 28 дней в популяции с тупой травмой с догоспитальным систолическим артериальным давлением (САД) ≤ 90 мм рт. Однако положительный эффект наблюдался в подгруппе пациентов, которым потребовалось 10 ЕД или более упакованных эритроцитов в первые 24 часа. Недавно те же авторы не смогли продемонстрировать улучшение выживаемости в результате внебольничного введения SSH + декстран у пациентов с геморрагическим шоком (SAP ≤ 70 мм рт. Ст. Или SAP 71–90 мм рт. Ст. При ЧСС ≥ 108 уд / мин). [13].Более того, более высокая смертность наблюдалась у пациентов, получавших HTS, в подгруппе пациентов, которым не делали никаких переливаний крови в первые 24 часа. Чтобы объяснить этот эффект, авторы предположили, что внебольничное введение SSH может замаскировать признаки гиповолемии и отсрочить диагностику геморрагического шока. Наконец, внебольничное введение SSH пациентам с тяжелой черепно-мозговой травмой не улучшило восстановление их неврологической функции.
Вазоактивные агенты
Жидкая реанимация — первая стратегия восстановления среднего артериального давления при геморрагическом шоке.Однако вазопрессоры также могут временно потребоваться для поддержания жизни и поддержания перфузии тканей в присутствии стойкой гипотензии, даже когда происходит расширение жидкости и гиповолемия еще не устранена. Этот момент имеет решающее значение, потому что перфузия тканей напрямую связана с движущим давлением (разницей между давлениями в местах входа и выхода капилляра), радиусом сосуда и плотностью капилляров; Кроме того, перфузия тканей обратно пропорциональна вязкости крови.Таким образом, артериальное давление является основным фактором, определяющим перфузию тканей.
Норэпинефрин (NE), который часто используется для восстановления артериального давления при септическом и геморрагическом шоке, в настоящее время является рекомендованным препаратом выбора при септическом шоке [14]. NE представляет собой симпатомиметическое средство с преимущественно сосудосуживающим действием. NE оказывает как артериальную, так и венозную альфа-адренергическую стимуляцию [15]. Помимо артериального сосудосуживающего действия, NE вызывает сужение вен (особенно на уровне внутреннего кровообращения), которое вызывает повышение давления в емкостных сосудах и активно перемещает объем венозной крови в большой круг кровообращения [16].Эта венозная адренергическая стимуляция может привлекать кровь из венозного нестрессированного объема, то есть объема крови, который заполняет кровеносные сосуды, не создавая внутрисосудистого давления. Более того, стимуляция β 2 -адренорецепторов снижает венозное сопротивление и увеличивает венозный возврат [16]. Poloujadoff et al. [17] в исследовании на животных во время неконтролируемого кровотечения предположили, что инфузия NE снижает количество жидкости, необходимое для достижения заданного целевого артериального давления, и соответствует снижению кровопотери и значительно улучшает выживаемость.Таким образом, мы можем предложить раннее использование NE для максимально быстрого восстановления артериального давления и ограничения инфузионной реанимации и гемодилюции. Однако эффекты NE не были тщательно исследованы у людей, перенесших травматический геморрагический шок. Анализ, проведенный во время многоцентрового проспективного когортного исследования, предназначенного для оценки исходов взрослых, перенесших тупую травму и находившихся в геморрагическом шоке, показал, что раннее использование вазопрессоров для гемодинамической поддержки после геморрагического шока может быть вредным по сравнению с агрессивным использованием. объемной реанимации, и подходить к нему следует с осторожностью [18].
Это исследование имеет несколько ограничений. Во-первых, это был вторичный анализ проспективного когортного исследования и не был разработан для ответа на конкретную проверенную гипотезу; во-вторых, в группе, получавшей вазопрессоры, частота торакотомии была выше. Таким образом, необходимо проспективное исследование для определения эффекта вазопрессоров у пациентов с геморрагическим шоком. В заключение, вазопрессоры могут быть полезны, если они используются временно для поддержания артериального давления и поддержания перфузии тканей во время стойкой гипотензии, несмотря на жидкостную реанимацию (рис. 1).Более того, раннее использование NE может ограничить жидкостную реанимацию и гемодилюцию. Если мы используем NE на ранней стадии, мы должны учитывать рекомендуемые целевые значения артериального давления (САД 80–100 мм рт. Ст.) [11]. Таким образом, дозу NE следует титровать до достижения целевого SAP (рисунок 1). Затем следует продолжить жидкостную реанимацию и титровать ее в соответствии с показателями реакции на преднагрузку, сердечным выбросом и маркерами оксигенации тканей.
Рисунок 1Блок-схема начального лечения травматического геморрагического шока. В острой фазе травматического геморрагического шока терапевтическим приоритетом является остановка кровотечения. Пока это кровотечение не контролируется, врач должен назначить жидкостную реанимацию, вазопрессоры и переливание крови для предотвращения или лечения острой коагулопатии травмы. АД — артериальное давление; САД, систолическое артериальное давление; ЧМТ — черепно-мозговая травма; Hb, гемоглобин; PT — протромбиновое время; АЧТВ, активированное частичное тромбопластиновое время.
Поскольку вазопрессоры могут увеличивать постнагрузку сердца при чрезмерной скорости инфузии или нарушении функции левого желудочка, важно оценить функцию сердца во время первоначального ультразвукового исследования.Дисфункция сердца может быть изменена у пациента с травмой после ушиба сердца, перикардиального выпота или вторичной травмы головного мозга с внутричерепной гипертензией. Наличие дисфункции миокарда требует лечения инотропными средствами, такими как добутамин или адреналин. При отсутствии оценки сердечной функции или мониторинга сердечного выброса, которые часто наблюдаются у пациентов в острой фазе геморрагического шока, мы должны подозревать сердечную дисфункцию при наличии плохой реакции на расширение жидкости и NE.
Какие цели жидкостной реанимации и артериального давления?
Среднее артериальное давление, которое представляет собой перфузионное давление всех органов (кроме сердца), может служить целью, которую врачи должны достичь путем раннего введения жидкости. Важнейшим элементом реанимации пациента с геморрагическим шоком является предотвращение потенциального увеличения кровотечения с помощью слишком агрессивного реанимационного маневра. Жидкая реанимация может способствовать коагулопатии за счет снижения факторов свертывания и развития гипотермии.Более того, чрезмерный уровень среднего артериального давления (САД) может способствовать кровотечению, предотвращая образование сгустка. В последние годы возникли две концепции: концепция «реанимации малого объема» и концепция «гипотензивной реанимации». Часто эти два понятия объединяются. Несколько экспериментальных исследований показали, что ограниченное введение жидкости, связанное с низким уровнем артериального давления в качестве конечной точки, может ограничить кровотечение без связанного с этим повышенного риска смерти [19]. Bickell et al.[20] в 1994 г. апробировали эту концепцию на гипотензивных пациентах с проникающими ранениями туловища. Они сравнили немедленную и отсроченную жидкостную реанимацию и сообщили, что агрессивное введение внутривенных жидкостей следует отложить до момента оперативного вмешательства. Таким образом, Bickell et al. поддержали концепцию как можно быстрее доставить пациента в травматологический центр и ограничить жидкостную реанимацию до момента оперативного вмешательства. Недавно ретроспективное когортное исследование пациентов из Американского банка данных о травмах [21] показало, что догоспитальное внутривенное введение или внутривенное введение жидкости не дает преимущества в выживаемости.Эта концепция может быть ограничена такими факторами, как пожилые пациенты, тяжелые травмы головного мозга или более длительное время транспортировки на догоспитальный этап (сельская травма). Дальнейшие исследования необходимы для уточнения объема и времени инфузионной реанимации перед хирургической или ангиографической эмболизацией для остановки кровотечения. Реанимация минимальным объемом предпочтительнее агрессивной реанимации объема до того, как будет остановлено активное кровотечение. Очень важно предотвратить гемодилюцию, ограничив реанимацию жидкостью и используя агрессивную стратегию переливания крови.Кроме того, несмотря на адекватную жидкостную реанимацию, только переливание крови может улучшить оксигенацию тканей [22]. Таким образом, одним из ключевых сообщений является то, что мы должны рассмотреть вопрос о переливании крови на ранней стадии лечения геморрагического шока, чтобы улучшить доставку кислорода в микрососуды.
Оптимальный уровень артериального давления во время реанимации пациента с геморрагическим шоком все еще обсуждается. Первоначальные цели — как можно скорее остановить кровотечение и поддерживать минимальное артериальное давление для ограничения гипоксии тканей.Восстановление артериального давления при неконтролируемом кровотечении подвергает пациента риску усиления кровотечения или предотвращения образования сгустка. Даттон и др. [23] обнаружили, что титрование начальной инфузионной терапии до более низкого, чем обычно, систолического артериального давления (70 мм рт. Ст.) Во время активного кровотечения не влияло на уровень смертности. Малое количество и неоднородность изученных пациентов ограничивают выводы этого исследования. Например, среднее систолическое артериальное давление было равно 100 ± 17 мм рт. Ст. В группе 70 мм рт. Ст., Потому что у некоторых пациентов артериальное давление спонтанно повышалось до нормального.Недавно Моррисон и др. [24] при оценке пациентов с геморрагическим шоком, которым потребовалось экстренное хирургическое вмешательство, сравнили интраоперационную гипотензивную реанимационную стратегию, в которой целевое значение MAP составляло 50 мм рт. Гипотензивная реанимационная стратегия была безопасной стратегией, которая привела к значительному сокращению переливаний продуктов крови и общего внутривенного введения жидкости с уменьшением послеоперационной коагулопатии.Однако в этом исследовании не было разницы в САД между двумя группами (64,4 мм рт. Ст. Против 68,5 мм рт. Ст.), Несмотря на разные цели САД. Авторы объясняют это отсутствие разницы MAP более быстрым контролем кровотечения в группе с 50 мм рт. Ст., Вызывая спонтанное увеличение MAP в этой группе. Таким образом, количество или качество доказательств для определения оптимального уровня артериального давления во время активного геморрагического шока недостаточно. Однако европейские рекомендации по ведению пациентов с кровотечением и травмой рекомендовали целевое систолическое артериальное давление от 80 до 100 мм рт.ст. до остановки большого кровотечения на начальной стадии после травмы для пациентов без травмы головного мозга [11] (рис. 1).Когда травматический геморрагический шок связан с тяжелой травмой головного мозга, необходимо поддерживать церебральное перфузионное давление путем повышения артериального давления, чтобы предотвратить вторичное повреждение головного мозга. Перед тем, как контролировать внутричерепное давление, мы должны определить оптимальный уровень артериального давления с помощью транскраниального допплера, чтобы определить наилучший баланс между оптимальной перфузией головного мозга и риском увеличения кровотечения (рис. 1).
Переливание и профилактика острой коагулопатии травмы
Коррекция и профилактика травматической коагулопатии (острая коагулопатия травмы, ACoT) стали центральными задачами раннего реанимационного лечения геморрагического шока.Как показано на рисунке 2, развитию травматической коагулопатии способствуют несколько взаимодействующих механизмов:
- 1)
Феномен «потери-разведения»: кровотечение и гемодилюция, вторичные по отношению к жидкостной реанимации, вызывают потерю факторов свертывания и тромбоцитов.
- 2)
Чрезмерная активация коагуляции: адаптированная активация коагуляции в ответ на геморрагическое повреждение может стать чрезмерной под влиянием местных или общих явлений.Например, повреждение тканей может вызывать повреждения эндотелия, связанные с местными и систематическими воспалительными реакциями; эти реакции важны для выработки тканевого фактора и фактора VII, которые могут чрезмерно активировать коагуляцию.
- 3)
Фибринолиз: при чрезмерной активации коагуляции фибринолитический ответ может превзойти его физиологическую роль в контроле коагуляции.
- 4)
Гипотермия: гипотермия способствует изменению функций тромбоцитов, факторов свертывания и фибринолиза. Гипотермии способствует агрессивная жидкостная реанимация.
- 5)
Ацидоз: метаболический ацидоз способствует коагулопатии за счет снижения активности факторов свертывания и функции тромбоцитов и деградации фибриногена.
- 6)
Гипокальциемия: гемодилюция, вызванная жидкостной реанимацией, и цитрат, содержащийся в продуктах крови после массивного переливания, способствуют гипокальциемии.
- 7)
Анемия: эритроциты играют важную гемостатическую роль.Потоки эритроцитов поддерживают тромбоциты близко к эндотелиальным клеткам, и они могут активировать функции тромбоцитов.
Основные патофизиологические механизмы, участвующие в острой травматической коагулопатии и стратегии переливания крови. САД, систолическое артериальное давление; Эритроциты, эритроциты; СЗП, свежезамороженная плазма.
Риск коагулопатии зависит от контекста. Когда кровотечение происходит во время операции, хирург должен немедленно остановить кровотечение с помощью быстрого введения жидкости и восстановления эритроцитов, чтобы избежать или ограничить коагулопатию только феноменом «потеря-разбавление».Однако при травматическом геморрагическом шоке коагулопатия бывает частой (от 10% до 34% травмированных больных) и многофакторной [25, 26], в зависимости от тяжести шока и травмы, и является независимым фактором заболеваемости и заболеваемости. смертность пациентов с травмами.
Очень важно избегать задержек с доставкой крови и компонентов крови. Оптимальная гемостатическая реанимация требует быстрых действий при хорошей коммуникации и координации между лечащими врачами и поставщиком услуг переливания крови.Двумя основными моментами в ведении этих пациентов являются: 1) регулярная оценка эффективности заместительной терапии с использованием клинической оценки и мониторинга параметров свертывания крови и 2) использование соответствующего протокола переливания крови с инструкциями по его правильному выполнению.
Поскольку может возникнуть неизбежная задержка в обработке и получении лабораторных результатов, все больше учреждений используют тестирование на месте, которое включает тромбоэластографию. Прикроватная коагуляция, наблюдение за пациентами с травмами с помощью тромбэластографии (TEG) или тромбоэластометрии (ROTEM) или активированного времени свертывания (ACT) приводят к более ранней и быстрой диагностике ACoT.Кроме того, эти устройства мониторинга позволяют персонализировать управление свертыванием, которое служит для управления коагуляционной терапией в соответствии с реальными потребностями пациента. Мы заметили, что некоторые клинические бригады изменили свою практику переливания крови на целенаправленное управление свертыванием крови на основе результатов ТЭГ [27, 28].
Учитывая неизбежные задержки, связанные с переливанием и реанимацией под контролем лаборатории, учреждение, которое заботится о пациентах с массивным кровотечением, должно внедрить соответствующие протоколы переливания и отслеживать распределение продуктов крови.Установление таких протоколов сокращает время распределения и введения компонентов крови. Текучесть рецептов и маршрутов распределения компонентов крови может помочь снизить уровень смертности пациентов с травмами, которым требуется массивное переливание крови.
Эритроциты и переливание свежезамороженной плазмы
Раннее введение красных кровяных телец (RBC) и свежезамороженной плазмы (FFP) является приоритетом для поддержания доставки артериального кислорода и восстановления эффективной коагуляции.Невозможно определить оптимальный уровень гемоглобина у пациентов с травматическим геморрагическим шоком, поскольку в исследованиях не оценивалась взаимосвязь между уровнем гемоглобина и неблагоприятными исходами у пациентов с критическим кровотечением. Кроме того, целевой уровень гемоглобина может зависеть от истории болезни пациента (возраст, сердечно-сосудистые заболевания в анамнезе) и типа травмы (наличие или отсутствие травмы головного мозга). Введение эритроцитов считается необходимым при уровне гемоглобина <7 г / дл [11] (рисунок 1).Эта рекомендация основана, главным образом, на результатах исследования «Требования к переливанию крови при интенсивной терапии» (TRICC) [29]. В этом исследовании Hebert et al. рандомизированные гемодинамически стабильные тяжелобольные пациенты выбирали либо либеральную стратегию переливания с целевым уровнем гемоглобина 10–12 г / дл, либо ограничительную стратегию с целевым уровнем гемоглобина 7–9 г / дл. Уровень смертности был сходным в двух группах исследования, что указывало на то, что ограничительная стратегия переливания была по крайней мере столь же безопасна, как и либеральный подход.У пациентов с черепно-мозговой травмой данных, подтверждающих ограничительный или либеральный уровень гемоглобина, недостаточно [30, 31]. Однако во многих центрах этим пациентам делают переливание крови до уровня гемоглобина 10 г / дл. Эта стратегия основана на обнаружении того, что повышение гемоглобина с 8,7 до 10,2 г / дл улучшает местную церебральную оксигенацию [32].
В случае серьезного опасного для жизни кровотечения пациенту могут быть перелиты O Rh-отрицательные эритроциты. Тем не менее, эту практику следует рассматривать как исключение, и ее необходимо внедрять как часть протокола массового переливания крови.
Введение СЗП следует как можно скорее связать с переливанием эритроцитов, чтобы компенсировать дефицит факторов свертывания крови. Начальная рекомендуемая доза составляет от 10 до 15 мл / кг [11]. Дополнительные дозы будут зависеть от результатов контроля параметров свертывания. FFP рекомендуется, когда PT или APTT в 1,5 раза больше нормального значения (рисунок 1).
Несколько недавних исследований с участием пациентов с военными или гражданскими травмами показали важность соотношения эритроцитов / СЗП примерно 1: 1.Однако эти результаты следует интерпретировать осторожно из-за потенциальной систематической ошибки выживания (то есть пациенты, которые рано умирают, с большей вероятностью получат более высокое соотношение эритроцитов / СЗП). Таким образом, оптимальное значение отношения RBC: FFP остается спорным. Кашук и др. [33] сообщили о гражданских пациентах, что высокое соотношение эритроцитов: СЗП (среднее 2: 1) было связано с лучшей выживаемостью, чем низкое соотношение эритроцитов: СЗП (среднее 4: 1), но эти авторы описали U-образную взаимосвязь. между риском смертности и соотношением эритроцитов: СЗП с критическим порогом выживаемости в диапазоне от 2: 1 до 3: 1 эритроциты: СЗП.Таким образом, нет абсолютного согласия по оптимальному целевому соотношению RBC: FFP. Дополнительные исследования должны быть направлены на определение этого оптимального целевого соотношения эритроцитов: СЗП и выявление тех пациентов, которым это может помочь. В австралийских и новозеландских рекомендациях по управлению кровью пациентов предлагается соотношение эритроцитов: СЗП: тромбоцитов ≤2: 1: 1 [34]. Аналогичная рекомендация была недавно принята Французским агентством по безопасности продуктов для здоровья (Agence nationale de sécurité du médicament et des produits de santé-AFSSAPS).Отношение эритроцитов: СЗП является важным элементом агрессивной реанимации эритроцитов и плазмы, но время переливания является важным элементом, и, что более важно, чем соотношение сырые эритроциты: СЗП, раннее использование эритроцитов и СЗП может улучшить исход больных с травматическим геморрагическим шоком [35]. Поэтому очень важно начать переливание плазмы как можно быстрее (в идеале одновременно с переливанием эритроцитов) (рис. 2). Основная идея состоит в том, чтобы иметь агрессивный план по восстановлению биологического гемостаза как можно быстрее, чтобы быстро остановить кровотечение.
Ранний мониторинг коагуляции необходим для выявления коагулопатии во время травмы и для облегчения целенаправленного переливания. Однако обычные тесты свертывания крови на основе плазмы, такие как протромбиновое время (PT), активированное частичное тромбопластиновое время (APTT), международное нормализованное отношение (INR), фибриноген и количество тромбоцитов, отражают только начало гемостатического процесса; тесты не могут использоваться для оценки усиления распространения или увеличения фибринолиза. Анализы цельной крови, такие как TEG или ROTEM, обеспечивают быструю оценку образования, силы и лизиса сгустка, которые отражают весь гемостатический процесс [36, 37].Появляются новые доказательства клинического применения этих прикроватных методик при травмах. Использование этих методов коренным образом изменило стратегию переливания крови некоторых клинических бригад. Например, Schöchl et al. [27, 28] изучали целенаправленное управление коагуляцией с использованием концентрата фибриногена и концентрата протромбинового комплекса (ПКК), вводимых в соответствии с измерениями ROTEM. В ретроспективном анализе эти авторы сравнили пациентов из своего травматологического центра и пациентов из реестра травм и сообщили, что эта целенаправленная стратегия управления свертыванием может снизить потребность в переливании эритроцитов или концентратов тромбоцитов по сравнению с гемостатической терапией на основе СЗП.Переливания эритроцитов удалось избежать у 29% пациентов в группе фибриноген-ПКС по сравнению только с 3% пациентов в группе СЗП; в обеих группах был сопоставимый уровень смертности. Этот подход интересен, особенно в отношении потенциальных рисков переливания. Переливание СЗП и концентратов тромбоцитов было связано с повышенным риском синдрома полиорганной дисфункции и острого респираторного дистресс-синдрома [38-40]. Однако вопрос о повышенном риске венозной тромбоэмболии при применении стратегии ПКК с концентратом фибриногена не рассматривался.
Переливание тромбоцитов и концентрат фибриногена
Переливание тромбоцитов рекомендуется, когда количество тромбоцитов <50,10 9 L -1 (Рисунок 1). Количество тромбоцитов должно поддерживаться на более высоком уровне в случае черепно-мозговой травмы, т.е. 100,10 9 л -1 .
Фибриноген является обязательным соединением в пути коагуляции, и уровень фибриногена в плазме следует корректировать, чтобы предотвратить свертывание. Порог для лечения концентратом фибриногена или криопреципитатом во время острого кровотечения недавно был повышен до уровня фибриногена в плазме менее 1.От 5 до 2,0 г / л (рисунок 1). Этот новый порог основан на экспериментальных и клинических данных ТЭГ, где введение фибриногена во время острой фазы геморрагического шока помогло исправить нарушения ТЭГ. К сожалению, использование СЗП не помогло быстро скорректировать гипофибриногенемию, вызванную кровотечением. Например, Chowdary et al. [27] сообщили, что реанимация 10-15 мл / кг -1 СЗП только увеличивала уровень фибриногена в плазме до 0,4 гл -1 . Более 30 мл.кг -1 ГЛП необходимо для повышения уровня фибриногена в плазме до 1 г л -1 .
Транексамовая кислота
Недавно рандомизированное контролируемое исследование с участием 20 211 пациентов с травмами [28] показало, что рутинное введение транексамовой кислоты (нагрузочная доза 1 г в течение 10 минут, затем инфузия 1 г в течение 8 часов) пациентам с геморрагическим шоком было связано со снижением смертности без увеличения тромбоэмболических осложнений. Таким образом, транексамовая кислота должна быть включена в текущее лечение пациентов с травматическим геморрагическим шоком (рисунки 1 и 2).Оптимальный эффект от этого препарата наблюдается в первые 3 часа приема [28].
Фактор VIIa
Учитывая неспособность рекомбинантного фактора VIIa снизить уровень смертности пациентов с геморрагическим шоком [41], использование этого фактора следует обсуждать в каждом конкретном случае, когда геморрагический шок невозможно контролировать. хирургическим и / или ангиографическим гемостазом, а также при адекватной коррекции различных биологических параметров гемостаза (т. е. гематокрита, тромбоцитов, ПВ, АЧТВ, кальциемии и pH) [42].Важно сбалансировать его использование с реальным риском тромбоэмболических событий.
Вспомогательные средства для лечения геморрагического шока
Травматический геморрагический шок связан с интенсивной системной воспалительной реакцией. В течение последнего десятилетия многие терапевтические стратегии были протестированы для лечения геморрагического шока, такие как рекомбинантный человеческий активированный протеин C (APC), антагонист рецептора IL-1, средства против TNF или против LPS или жесткий контроль гликемии. Однако эти методы лечения были в конечном итоге неэффективными, а иногда и вредными.
Недавно проведенное многоцентровое исследование показало, что назначение гидрокортизона пациентам с травмами было связано со значительным снижением риска развития пневмонии (36% против 51%) и сокращением продолжительности ИВЛ [30]. Разницы в уровне смертности между двумя группами не наблюдалось. Однако мы должны быть осторожны, прежде чем рекомендовать раннее применение кортикостероидов после травмы. Исследование CRASH, в котором изучалось использование кортикостероидов после тяжелой черепно-мозговой травмы у более чем 10 000 пациентов, обнаружило повышенный уровень смертности в группе кортикостероидов и отсутствие разницы в частоте возникновения пневмонии [31].Для изучения эффекта кортикостероидов после травмы необходимо более крупное исследование.
Трудности с поставкой и доступностью продуктов крови с риском инфекций и иммуномодуляции оправдывают разработку безопасных и эффективных переносчиков кислорода на основе гемоглобина (HBOC). Однако HBOC первого поколения приводили к системной и легочной гипертензии со снижением сердечного выброса, повреждением миокарда и другими эффектами, такими как удаление NO, окислительный стресс и гипероксия. HBOC второго поколения в настоящее время активно исследуются.Эти агенты лучше переносятся и вызывают меньше осложнений, связанных с истощением NO. Конъюгация гемоглобина с полиэтиленгликолем (ПЭГ) — потенциально многообещающий агент. Пегилирование увеличивает вязкость, что вызывает большее напряжение эндотелия и локальную продукцию NO с одновременным увеличением функциональной плотности капилляров [43]. Более того, пегилирование может повышать онкотическое давление и способствовать увеличению внутрисосудистого объема. Два исследования фазы III продемонстрировали, что введение оксигенированного ПЭГ-модифицированного гемоглобина (MP4OX) было связано со значительным снижением частоты гипотонии у пациентов, перенесших первичное эндопротезирование тазобедренного сустава под спинальной анестезией [44, 45].В настоящее время проводится исследование по оценке безопасности и эффективности MP4OX у пациентов с травмами, страдающих лактоацидозом из-за тяжелого геморрагического шока. HBOC могут стать еще одним инструментом для клиницистов, занимающихся реанимацией пациентов с травматическим геморрагическим шоком.
Жидкая реанимация при травме: какие стратегии и методы лечения лучше всего? | Международный журнал экстренной медицины
Haagsma JA, Graetz N, Bolliger I., Naghavi M, Higashi H, Mullany EC, et al.Глобальное бремя травм: заболеваемость, смертность, годы жизни с поправкой на инвалидность и временные тенденции из исследования Global Burden of Disease 2013. Inj Prev. 2016; 22 (1): 3–18.
PubMed Статья Google Scholar
Россент Р., Буйон Б., Черни В., Коутс Т.Дж., Дюранто Дж., Фернандес-Мондехар Э. и др. Европейское руководство по ведению большого кровотечения и коагулопатии после травмы: четвертое издание. Crit Care. 2016; 20: 100.
PubMed PubMed Central Статья Google Scholar
Черкас Д. Травматический геморрагический шок: достижения в области жидкостной терапии. Emerg Med Pract. 2011; 13 (11): 1–19, викторина 19–20.
PubMed Google Scholar
Мурад М.К., Ларсен С., Хусум Х. Догоспитальная помощь при травмах снижает смертность. Десятилетние результаты исследования временной когорты и аудита травм в Ираке.Scand J Trauma Resusc Emerg Med. 2012; 20:13.
PubMed PubMed Central Статья Google Scholar
Мурад М.К., Исса Д.Б., Мустафа FM, Хассан Х.О., Хусум Х. Система догоспитальной травмы снижает смертность при тяжелых травмах: контролируемое исследование дорожно-транспортных происшествий в Ираке. Prehospital Disaster Med. 2012. 27 (1): 36–41.
PubMed Статья Google Scholar
Hampton DA, Fabricant LJ, Differding J, Diggs B, Underwood S, De La Cruz D, et al. Добольничное внутривенное введение жидкости увеличивает выживаемость пациентов с травмами. J Trauma Acute Care Surg. 2013; 75 (1): S9–15.
PubMed PubMed Central Статья Google Scholar
Генри Дж. А., Рейнгольд А. Л.. Системы догоспитальной травмы снижают смертность в развивающихся странах: систематический обзор и метаанализ. J Trauma Acute Care Surg.2012 июль; 73 (1): 261–8.
PubMed Статья Google Scholar
Coppola S, Froio S, Chiumello D. Реанимация жидкости у пациентов с травмами: что мы должны знать? Curr Opin Crit Care. 2014 Август; 20 (4): 444–50.
PubMed Статья Google Scholar
Марик ЧП. Чувствительность к жидкостям и шесть руководящих принципов жидкостной реанимации. Crit Care Med.2016; 44 (10): 1920–2.
PubMed Статья Google Scholar
Bickell WH, Wall MJ, Pepe PE, Martin RR, Ginger VF, Allen MK, et al. Сравнение немедленной и отсроченной жидкостной реанимации у гипотензивных пациентов с проникающими повреждениями туловища. N Engl J Med. 1994. 331 (17): 1105–9.
CAS PubMed Статья Google Scholar
Деметриадес Д., Чан Л., Корнуэлл Е., Белцберг Х., Берн Т.В., Асенсио Дж. И др.Фельдшер против частной перевозки пациентов с травмами. Влияние на результат. Arch Surg Chic Ill 1960. 1996; 131 (2): 133–8.
CAS Google Scholar
Симон М.Дж., Фишер К.А., Гоган Дж., Ллойд М., Брэдли К.М., Сантора Т.А. и др. Догоспитальные процедуры перед торакотомией в отделении неотложной помощи: «черпай и беги» спасает жизни. J Trauma. Июль 2007 г., 63 (1): 113–20.
PubMed Статья Google Scholar
Paravar M, Hosseinpour M, Mohammadzadeh M, Mirzadeh AS. Догоспитальная помощь и госпитальная смертность пациентов с травмами в Иране. Prehospital Disaster Med. 2014; 29 (5): 473–7.
PubMed Статья Google Scholar
Santry HP, Alam HB. Жидкая реанимация: в прошлом. Настоящее и будущее шок. 2010. 33 (3): 229–41.
PubMed Google Scholar
Wise R, Faurie M, Malbrain MLNG, Hodgson E.Стратегии внутривенной инфузии жидкости у пациентов с травмами. World J Surg. 2017 Май; 41 (5): 1170–83.
PubMed PubMed Central Статья Google Scholar
Альбрейки М., Вогели Д. Разрешительная гипотензивная реанимация у взрослых пациентов с травматическим геморрагическим шоком: систематический обзор. Eur J Trauma Emerg Surg Off Publ Eur Trauma Soc. 2018; 44 (2): 191–202.
Артикул Google Scholar
Tremblay LN, Rizoli SB, Brenneman FD. Достижения в жидкостной реанимации геморрагического шока. Может J Surg. 2001. 44 (3): 172–9. Рассмотрение.
Лечение гиповолемического шока у пациента с травмой [Интернет]. [цитируется 13 мая 2018 г.]. Доступно по ссылке: https://www.aci.health.nsw.gov.au/__data/assets/pdf_file/0006/195171/HypovolaemicShock_FullReport.pdf
Haas B, Nathens AB. Дискуссия «за / против»: является ли подход «совок и беги» лучшим подходом к организации травматологических служб? Crit Care.2008; 12 (5): 224.
PubMed PubMed Central Статья Google Scholar
Kam C, Lai C, Lam S, So F, Lau C, Cheung K. Каковы десять новых заповедей в ведении тяжелой политравмы? Мир J Emerg Med. 2010. 1 (2): 85–92.
PubMed PubMed Central Google Scholar
Чатрат В., Хетарпал Р., Ахуджа Дж. Управление жидкостями у пациентов с травмой: ограничительный или либеральный подход.J Anaesthesiol Clin Pharmacol. 2015; 31 (3): 308–16.
CAS PubMed PubMed Central Статья Google Scholar
Стенсбалле Дж., Островски С.Р., Йоханссон П.И. Гемостатическая реанимация при травмах: новое поколение. Curr Opin Crit Care. 2016; 22 (6): 591–7.
PubMed Статья Google Scholar
Эль Саяд М., Нуреддин Х. Последние достижения в лечении кровотечений при тяжелых травмах.Emerg Med Int. 2014; 2014: 1–5.
Артикул Google Scholar
Cotton BA, Au BK, Nunez TC, Gunter OL, Robertson AM, Young PP. Предустановленные протоколы массивных переливаний крови связаны со снижением органной недостаточности и посттравматических осложнений. J Trauma. 2009; 66 (1): 41–8 обсуждение 48–49.
PubMed Статья Google Scholar
Финфер С., Белломо Р., Бойс Н., Френч Дж., Майбург Дж., Нортон Р. и др.Сравнение альбумина и физиологического раствора для жидкостной реанимации в отделении интенсивной терапии. N Engl J Med. 2004. 350 (22): 2247–56.
CAS PubMed Статья Google Scholar
Исследователи исследования SAFE, Группа клинических испытаний Австралийского и Новозеландского общества интенсивной терапии, Служба крови Австралийского Красного Креста, Институт международного здравоохранения Джорджа, Myburgh J, Cooper DJ, et al. Физиологический раствор или альбумин для жидкостной реанимации пациентов с черепно-мозговой травмой.N Engl J Med. 2007. 357 (9): 874–84.
Артикул Google Scholar
Duchesne JC, Simms E, Guidry C, Duke M, Beeson E, McSwain NE, et al. Иммунорегуляция для контроля повреждений: есть ли роль реанимации с низким объемом гипертонического раствора у пациентов, перенесших хирургическое вмешательство? Am Surg. 2012 сентябрь; 78 (9): 962–8.
PubMed Google Scholar
Аннан Д., Сиами С., Джабер С., Мартин С., Элатрус С., Деклер А.Д. и др.Влияние жидкостной реанимации коллоидами по сравнению с кристаллоидами на смертность тяжелобольных пациентов с гиповолемическим шоком: рандомизированное исследование CRISTAL. ДЖАМА. 2013; 310 (17): 1809–17.
CAS PubMed Статья Google Scholar
Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D, et al. Гидроксиэтилкрахмал или физиологический раствор для жидкостной реанимации в отделениях интенсивной терапии. N Engl J Med. 2012. 367 (20): 1901–11.
CAS PubMed Статья Google Scholar
Перель П., Робертс И., Кер К. Коллоиды против кристаллоидов для жидкостной реанимации у тяжелобольных пациентов. В: Кокрановская библиотека: Wiley; 2013 [цитируется 25 апреля 2018 г.]. Доступна с. https://doi.org/10.1002/14651858.CD000567.pub6/full.
Куреши С.Х., Ризви С.И., Патель Н.Н., Мерфи Дж. Мета-анализ коллоидов по сравнению с кристаллоидами у тяжелобольных, травматических и хирургических пациентов.Br J Surg. 2016, январь; 103 (1): 14–26.
CAS PubMed Статья Google Scholar
Льюис С. Р., Притчард М. В., Эванс Д. Д., Батлер А. Р., Олдерсон П., Смит А. Ф. и др. Коллоиды против кристаллоидов для жидкостной реанимации у тяжелобольных. Кокрановская база данных Syst Rev.2018; 8: CD000567.
PubMed Google Scholar
Ayuste EC, Chen H, Koustova E, Rhee P, Ahuja N, Chen Z, et al.Апоптоз печени и легких после геморрагического шока у свиней может быть уменьшен путем модификации обычного раствора Рингера. J Trauma. 2006. 60 (1): 52–63.
PubMed Статья Google Scholar
Рагхунатан К., Шоу А., Натансон Б., Штюрмер Т., Брукхарт А., Стефан М.С. и др. Связь между выбором кристаллоидов для внутривенного введения и внутрибольничной смертностью среди тяжелобольных взрослых с сепсисом *. Crit Care Med. 2014 июль; 42 (7): 1585–91.
CAS PubMed Статья Google Scholar
Pfortmueller CA, Schefold JC. Гипертонический раствор при критических состояниях — систематический обзор. J Crit Care. 2017 декабрь; 42: 168–77.
CAS PubMed Статья Google Scholar
Alnemari AM, Krafcik BM, Mansour TR, Gaudin D. Сравнение фармакологических терапевтических агентов, используемых для снижения внутричерепного давления после черепно-мозговой травмы.World Neurosurg. 2017 Октябрь; 106: 509–28.
PubMed Статья Google Scholar
Юнос Н.М., Белломо Р., Хегарти С., История Д., Хо Л., Бейли М. Связь между хлор-либеральной и хлор-рестриктивной стратегией внутривенного введения жидкости и повреждением почек у тяжелобольных взрослых. ДЖАМА. 2012, 17 октября; 308 (15): 1566–72.
CAS PubMed Статья Google Scholar
Северс Д., Хорн Э. Дж., Рукмейкер МБ. Критическая оценка внутривенных жидкостей: от физиологической основы до клинических данных. Пересадка нефрола Dial. 2015; 30 (2): 178–87.
CAS PubMed Статья Google Scholar
Wiedermann CJ, Dunzendorfer S, Gaioni LU, Zaraca F, Joannidis M. Гиперонкотические коллоиды и острое повреждение почек: метаанализ рандомизированных исследований. Crit Care. 2010; 14 (5): R191.
PubMed PubMed Central Статья Google Scholar
Mitra S, Khandelwal P. Все ли коллоиды одинаковы? Как правильно выбрать коллоид? Индийский J Anaesth. 2009. 53 (5): 592–607.
PubMed PubMed Central Google Scholar
Kozek-Langenecker SA. Жидкости и коагуляция. Curr Opin Crit Care. 2015 августа; 21 (4): 285–91.
PubMed Статья Google Scholar
Сингх А., Али С., Шетти Р. Эффективность и безопасность полигелина у пациентов с гиповолемией из-за травмы.J Emerg Trauma Shock. 2017; 10: 116.
PubMed PubMed Central Статья Google Scholar
Шах С., Сингх А., Кала С., Шетти Р. Полигелин у пациентов с гиповолемией, вызванной случайной травмой: проспективное многоцентровое исследование безопасности. Int Surg J. 2018; 5: 1432.
Артикул Google Scholar
Hussmann B, Lefering R, Kauther MD, Ruchholtz S, Moldzio P, Lendemans S.Влияние догоспитального замещения объема на исход у политравматизированных детей. Crit Care. 2012; 16 (5): R201.
PubMed PubMed Central Статья Google Scholar
Террис М., Крин П. Баланс жидкости и электролитов у детей. Anaesth Intensive Care Med. 2012; 13 (1): 15–9.
Артикул Google Scholar
Мун Т.С., Саппенфилд Дж. Анестезиологическое обеспечение и проблемы у беременных пациенток.Curr Anesthesiol Rep. 2016; 6 (1): 89–94.
Артикул Google Scholar
Бишоп С., Магуайр С. Анестезия и интенсивная терапия при сильных ожогах. Продолжить просвещение Anaesth Crit Care Pain. 2012; 12 (3): 118–22.
Артикул Google Scholar
Greenhalgh DG. Реанимация ожогов: результаты исследования ISBI / ABA. Burns J Int Soc Burn Inj. 2010. 36 (2): 176–82.
Артикул Google Scholar
Poelaert J, Flamée P. Влияет ли выбор коллоидов на результат у тяжелобольных пациентов? Критическая оценка. J Anaesthesiol Clin Pharmacol. 2015; 31 (3): 293–4.
CAS PubMed PubMed Central Статья Google Scholar
Хорасани Э.Н., Мансури Ф. Влияние раннего энтерального питания на заболеваемость и смертность детей с ожогами. Burns J Int Soc Burn Inj. 2010. 36 (7): 1067–71.
Артикул Google Scholar
Жорж Д. Ведение травмированной беременной пациентки [Интернет]. [цитируется 10 мая 2018 г.]. Доступно по адресу: http://www.trauma.org/archive/resus/pregnancytrauma.html
Prowle JR, Bellomo R. Введение жидкости и почки. Curr Opin Crit Care. 2013. 19 (4): 308–14.
PubMed Статья Google Scholar
Zarychanski R, Abou-Setta AM, Turgeon AF, Houston BL, McIntyre L, Marshall JC, et al.Связь применения гидроксиэтилкрахмала со смертностью и острым повреждением почек у пациентов в критическом состоянии, нуждающихся в объемной реанимации: систематический обзор и метаанализ. ДЖАМА. 2013. 309 (7): 678–88.
CAS PubMed Статья Google Scholar
Ландесберг Г., Гилон Д., Мероз Ю., Георгиева М., Левин П.Д., Гудман С. и др. Диастолическая дисфункция и смертность при тяжелом сепсисе и септическом шоке. Eur Heart J.2012. 33 (7): 895–903.
CAS PubMed Статья Google Scholar
Полли Ф., Гаттинони Л. Балансировка объема реанимации и лечения асцита при циррозе печени. Curr Opin Anaesthesiol. 2010 Апрель; 23 (2): 151–8.
PubMed Статья Google Scholar
Надим М.К., Дюран Ф., Келлум Дж. А., Левицкий Дж., О’Лири Дж. Г., Карвеллас С. Дж. И др. Ведение тяжелобольного пациента с циррозом печени: мультидисциплинарная перспектива.J Hepatol. 2016; 64 (3): 717–35.
PubMed Статья Google Scholar
de Lange N, Schol P, Lancé M, Woiski M, Langenveld J, Rijnders R, et al. Стратегия ограничительной реанимации по сравнению с массивной жидкостной реанимацией (исследование REFILL), влияние на кровопотерю и гемостатические параметры при акушерском кровотечении: протокол исследования для рандомизированного контролируемого исследования. Испытания. 2018; 19: 166.
PubMed PubMed Central Статья CAS Google Scholar
Лу И-Кью, Цай Икс-Дж, Гу Л-Х, Ван Цюй, Хуанг В-Д, Бао Д-Г. Экспериментальное исследование контролируемой жидкостной реанимации в лечении тяжелого и неконтролируемого геморрагического шока. J Trauma. 2007 Октябрь; 63 (4): 798–804.
PubMed Статья Google Scholar
Сингх А., Али С. Полигелин при гиповолемии из-за травматического повреждения: результаты открытого исследования среди населения Индии. Int J Crit Illn Inj Sci. 2016; 6:21.
PubMed PubMed Central Статья Google Scholar
Оценка и лечение геморрагического шока
Непреднамеренные травмы обычно являются основной причиной смерти в США пациентов любого возраста.Однако в 2011 году это была основная причина смерти пациентов в возрасте от 1 до 44 лет (Hoyert & Xu, 2012). Значительный процент этих смертей происходит в результате обескровливания (Sauaia et al., 1995), причем многие из них происходят еще до того, как пациент попадает в больницу.
Геморрагический шок — это разновидность гиповолемического шока, который возникает в результате уменьшения объема циркулирующей крови. Это уменьшение может происходить из-за того, что пациент фактически теряет кровь или, альтернативно, теряет только жидкий компонент крови.
В то время как персонал скорой помощи обычно связывает гиповолемический шок с травмой и кровотечением, существуют и другие потенциальные причины гиповолемического шока. Сильная диарея, продолжительная рвота и эндокринные нарушения могут вызвать значительную потерю циркулирующего объема. Гиповолемический шок также может быть результатом перемещения внутренней жидкости, вызванного ожогами и обширными инфекциями брюшной полости. Всегда считайте гиповолемию основной причиной шока, пока не докажете обратное.
Наличие механизма повреждения должно вызвать подозрение на кровотечение у травмированного пациента (Rossaint et al., 2010). Часто внешняя кровопотеря у пациентов с проникающей травмой является самым ранним диагностическим признаком развития геморрагического шока. Однако этот признак отсутствует у пациентов, перенесших тупую травму, что требует от персонала скорой помощи сосредоточиться на других прогностических факторах.
У многих пациентов с шоком скорость и глубина вентиляции увеличиваются в попытке компенсировать развивающийся тканевый ацидоз.Радиальный характер пульса (слабый или отсутствующий) в сочетании с моторным и вербальным компонентами шкалы комы Глазго позволяют прогнозировать необходимость спасательных вмешательств у пациентов с травмами без травм головы (Holcomb et al., 2005).
Определение частоты пульса само по себе является плохим предиктором необходимости хирургического вмешательства или переливания крови после травматического события (Brasel, Guse, Gentilello, & Nirula, 2007; Demetriades et al., 1998).
Фактически, почти половина всех пациентов в одном исследовании, которые обратились в отделение неотложной помощи после перенесенных проникающих травм живота или тяжелой, но изолированной травмы конечности, имели относительную брадикардию, в том числе около 35% пациентов с исходным систолическим артериальным давлением ниже 100 мм рт. ст. (Thompson, Adams, & Barrett, 1990).
Исторически сложилось так, что врачи использовали измерение систолического артериального давления как важный индикатор гипотонии и шока, обычно устанавливая порог шока на уровне 90 мм рт. Ст. (Kerby & Cusick, 2012).
Тем не менее, 15 процентов пациентов с травмами в одном исследовании, которым в конечном итоге потребовалась экстренная торакоабдоминальная хирургия и более пяти единиц пакетированных эритроцитов, были представлены персоналу скорой медицинской помощи с систолическим артериальным давлением выше 100 мм рт. Ст. (Luna, Eddy, & Copass, 1989 ).
Теперь исследователи задаются вопросом, начинается ли истинная гипоперфузия ткани на отметке 90 мм рт. Ст. Или она на самом деле намного выше (Bruns, Gentilello, Elliott, & Shafi, 2008; Eastridge et al., 2007; Истридж, Салинас, Уэйд и Блэкборн, 2011 г .; Edelman, White, Tyburski, & Wilson, 2007), в то время как другие предполагают, что показания артериального давления слишком ненадежны для использования при диагностике гипоперфузии тканей (Hick, Rodgerson, Heegaard, & Sterner, 2001; McGee, Abernethy, & Simel, 1999). .
Существует всеобщее мнение о том, что первым шагом в лечении пациента с кровотечением является контроль кровопотери.Также существует всеобщее согласие с тем, что медики должны поддерживать состояние кровообращения у пациентов с признаками и симптомами геморрагического шока.
Кристаллоиды, такие как лактатный раствор Рингера и физиологический раствор, являются наиболее широко используемыми растворами при догоспитальном лечении травм. Раствор Рингера с лактатом имеет теоретическое преимущество, поскольку он может буферизовать метаболический ацидоз и предотвращать ацидоз, возникающий из-за избыточной инфузии хлорид-ионов, связанной с введением физиологического раствора (Kobayashi, Costantini, & Coimbra, 2012).
Однако положительный исход возможен только тогда, когда становится необходимым массивное переливание крови (Healey, Davis, Liu, Loomis, & Hoyt, 1998). Исследования, связанные с кровотечением от легкой до умеренной степени тяжести, демонстрируют отсутствие преимущества в исходе, обеспечиваемого одним из этих решений по сравнению с другим (Moore et al., 2006; Schreiber, 2011).
Проверенная временем стратегия догоспитальной жидкостной реанимации следовала правилу 3: 1 Американского колледжа хирургов — на каждую единицу потерянной крови вливайте 3 литра кристаллоида (Комитет американских хирургов по травмам, 2008).
Однако жидкости, введенные перед хирургической остановкой кровотечения, могут привести к разрушению сгустка, что приведет к продолжающейся кровопотере (McSwain & Barbeau, 2010). Введение жидкости может также разбавить факторы свертывания (Bickell, Bruttig, Millnamow, O’Benar, & Wade, 1991; Hewson et al., 1985; Maegele et al., 2007), что замедляет образование сгустка.
Чтобы предотвратить эти осложнения, некоторые выступают за более ограничительную стратегию восполнения жидкости в догоспитальном периоде до того, как произойдет окончательный контроль кровотечения.Подход разрешающей гипотензии сводит к минимуму или ограничивает введение жидкости, пока пациент может поддерживать адекватную церебральную перфузию, а систолическое артериальное давление остается выше определенного порога (Kobayashi, Costantini, & Coimbra, 2012).
Отсроченная жидкостная реанимация улучшила выживаемость при проникающих травмах туловища (Bickell et al., 1994), травматической ампутации (Owens, Watson, Prough, Uchida, & Kramer, 1995), в то время как ограничение объемов жидкости для поддержания низкого среднего артериального давления привело к снижению послеоперационного периода. смертность (Morrison et al., 2011).
Данные на животных показывают, что раннее использование вазоактивных агентов, особенно до хирургического контроля кровопотери, может привести к приемлемому поддержанию артериального давления без необходимости реанимации большого объема жидкости и связанных с ней осложнений (Schwartz & Reid, 1981; Stadlbauer et al., 2003; Voelckel et al., 2003). На сегодняшний день исследователи завершили только одно рандомизированное контролируемое исследование с использованием вазопрессина в фазе острой реанимации (Cohn et al., 2011).
Их результаты не показывают значительного улучшения смертности, связанного с введением жидкости + вазопрессин, по сравнению с одной стандартной жидкостной реанимацией. Исследователи проспективно сравнили небольшую когорту пациентов, получавших раствор вазопрессина и гидроксиэтилкрахмала, с исторической контрольной группой, которая получала стандартные реанимационные мероприятия, у пациентов, поступивших в СМП с тупой травматической остановкой и демонстрирующих электрическую активность без пульса.
В группе лечения наблюдалось значительное улучшение восстановления спонтанного кровообращения и 24-часовой выживаемости (Grmec, Strnad, Cander, & Mally, 2008). С другой стороны, три крупных ретроспективных исследования показали, что введение вазопрессина пациентам с тяжелыми травмами и гипотензивными травмами увеличивает риск смерти (Collier et al., 2010; Plurad et al., 2011; Sperry et al., 2008). Польза применения вазопрессина для лечения геморрагического шока остается без ответа.
Оценка будущего шока
В настоящее время исследователи тестируют устройства для оказания медицинской помощи, которые могут быть полезным инструментом, помогающим персоналу скорой помощи распознать скрытое кровотечение или как ранний индикатор гипоперфузии тканей, вторичной по отношению к кровопотере.
Например, в одном портативном мониторе используется небольшой образец крови пациента для измерения количества лактата в сыворотке, аналогично тому, как глюкометры измеряют уровень глюкозы в крови.В одном исследовании с участием более 2000 пациентов, перенесших травму и поступивших с исходным систолическим артериальным давлением от 90 до 110 мм рт. и смертности (Vandromme, Griffin, Weinberg, Rue, & Kerby, 2010).
Уровни лактата в сыворотке, полученные парамедиками в полевых условиях во время транспортировки 1000 пациентов с травмами, при добавлении к начальным показателям жизненно важных функций и шкале GCS позволяют прогнозировать необходимость срочной хирургической помощи, синдром полиорганной недостаточности и смертность (Guyette et al., 2011). В настоящее время проводится многоцентровое догоспитальное исследование использования биомаркеров лактата в лечении пациентов с травмами (Resuscitation Outcomes Consortium, n.d.).
Список литературы
Комитет травм Американского колледжа хирургов. (2008). Продвинутая поддержка жизни при травмах для врачей: Учебное пособие для студентов (8-е изд.) .Чикаго: Американский колледж хирургов.
Бикелл, В. Х., Бруттиг, С. П., Миллнамов, Г. А., О’Бенар, Дж., И Уэйд, К. Э. (1991). Вредные эффекты внутривенного введения кристаллоидов после аортотомии у свиней. Хирургия, 110 (3) , 529-536.
Бикелл, В. Х., Уолл, В. Дж., Пепе, П. Э., Мартин, Р. Р., Джинджер, В. Ф., Аллен, М. К., и Маттокс, К.Л. (1994). Сравнение немедленной и отсроченной жидкостной реанимации у гипотензивных пациентов с проникающими повреждениями туловища. Медицинский журнал Новой Англии, 331 (17) , 1105-1109. DOI: 10.1056 / NEJM199410273311701
Бразел, К. Дж., Гус, К., Джентилелло, Л. М., и Нирула, Р. (2007). Частота сердечных сокращений: действительно ли это жизненно важный показатель? Journal of Trauma, 62 (4), 812–817. DOI: 10.1097 / TA.0b013e31803245a1
Брунс, Б., Джентилелло, Л., Эллиотт, А., и Шафи, С. (2008). Новое определение догоспитальной гипотензии. Journal of Trauma , 65 (6) , 1217–1221. DOI: 10.1097 / TA.0b013e318184ee63
Кон, С. М., Маккарти, Дж., Стюарт, Р. М., Джонас, Р. Б., Дент, Д. Л., и Михалек, Дж. Э. (2011). Влияние низких доз вазопрессина на исход травмы: проспективное рандомизированное исследование. Всемирный журнал хирургии, 35 (2) , 430–439.DOI: 10.1007 / s00268-010-0875-8
Коллиер, Б., Доссет, Л., Манн, М., Коттон, Б., Гилламондеги, О., Диас, Дж., Флеминг, С., Мэй, А., и Моррис, Дж. (2010). Использование вазопрессина связано со смертью пациентов с острой травмой и шоком. Journal of Critical Care, 25 (1) , 173.e9–173.e14. DOI: 10.1016 / j.jcrc.2009.05.003
Деметриадес, Д., Чан, Л. С., Бхасин, П., Берн, Т. В., Рамиконе, Э., Уикочеа, Ф., Велмахос, Г., Корнуэлл, Э. Э., Бельцберг, Х., Мюррей, Дж., Асенсио, Дж. А. (1998). Относительная брадикардия у пациентов с травматической гипотонией. Journal of Trauma, 45 (3) , 534–539.
Истридж, Б. Дж., Салинас, Дж., Макманус, Дж. Дж., Блэкберн, Л., Буглер, Э. М., Кук, У. Х., Конвертино, В. А., Уэйд, К. Э., и Холкомб, Дж. Б. (2007).Гипотония начинается при 110 мм рт. Ст.: Новое определение «гипотонии» с помощью данных. Journal of Trauma, 63 (2) , 291–297 [обсуждение: 297–9]. DOI: 10.1097 / TA.0b013e31809ed924
Истридж, Б. Дж., Салинас, Дж., Уэйд, К. Э. и Блэкборн, Л. Х. (2011). Гипотония на поле боя составляет 100 мм рт. Американский журнал хирургии, 202 (4) , 404–408. DOI: 10.1016 / j.amjsurg.2010.10.012
Эдельман, Д.А., Уайт, М. Т., Тыбурски, Дж. Г., и Уилсон, Р. Ф. (2007). Посттравматическая гипотензия: следует ли учитывать систолическое артериальное давление 90-109 мм рт. Shock, 27 (2), 134–138. DOI: 10.1097 / 01.shk.0000239772.18151.18
Грмек, С., Стрнад, М., Кандер, Д., и Малли, С. (2008). Протокол лечения, включающий раствор вазопрессина и гидроксиэтилкрахмала, связан с увеличением скорости восстановления спонтанного кровообращения у пациентов с тупой травмой с безимпульсной электрической активностью .Международный журнал неотложной медицины, 1 (4), 311–316. DOI: 10.1007 / s12245-008-0073-8
Гайетт, Ф., Суффолетто, Б., Кастильо, Дж. Л., Кинтеро, Дж., Каллавей, К., и Пуйана, Дж. К. (2011). Лактат сыворотки на догоспитальном этапе как предиктор исходов у пациентов с травмами: ретроспективное обсервационное исследование. Journal of Trauma, 70 (4), 782–786. DOI: 10.1097 / TA.0b013e318210f5c9
Хили, М.А., Дэвис, Р. Э., Лю, Ф. К., Лумис, В. Х., & Хойт, Д. Б. (1998). Лактат Рингера превосходит физиологический раствор в модели массивного кровотечения и реанимации. Journal of Trauma, 45 (5), 894–899.
Хьюсон, Дж. Р., Ним, П. Б., Кумар, Н., Айртон, А., Грегор, П., Дэвис, К., и Шрагге, Б. У. (1985). Коагулопатия, связанная с разжижением и гипотензией во время массивного переливания крови. Critical Care Medicine, 13 (5), 387–391.
Хик, Дж. Л., Роджерсон, Дж. Д., Хегаард, У. Г. и Стернер, С. (2001). Показатели жизнедеятельности не коррелируют с гемоперитонеумом от разрыва внематочной беременности. Американский журнал экстренной медицины, 19 (6) , 488–491. DOI: 10.1053 / ajem.2001.27133
Холкомб, Дж. Б., Салинас, Дж., Макманус, Дж. М., Миллер, К. К., Кук, В. Х., Конвертино, В.А. (2005). Ручные измерения жизненно важных функций надежно предсказывают необходимость спасательных вмешательств у пациентов с травмами. Journal of Trauma, 59 (4) , 821-828. DOI: 10.1097 / 01.ta.0000188125.44129.7c
Хойерт, Д. Л., Сюй, Дж. К. (2012). смертей: предварительные данные за 2011 г. Национальные статистические отчеты, 61 (6). Хяттсвилл, Мэриленд: Национальный центр статистики здравоохранения. Получено с http://www.cdc.gov/nchs/data/nvsr/nvsr61/nvsr61_06.pdf
Керби, Дж. Д., & Кьюсик, М. В. (2012). Догоспитальная неотложная помощь и лечение травм. Хирургические клиники Северной Америки, 92 (4), 823-841. DOI: 10.1016 / j.suc.2012.04.009
Кобаяши, Л., Костантини, Т. В., и Коимбра, Р. (2012). Реанимация гиповолемического шока. Хирургические клиники Северной Америки, 92 (6) , 1403–1423.DOI: 10.1016 / j.suc.2012.08.006
Луна, Г. К., Эдди, А. К., и Копасс, М. (1989). Чувствительность показателей жизнедеятельности при выявлении большого торакоабдоминального кровотечения. Американский журнал хирургии, 157 (5), 512–515. DOI: 10.1016 / 0002-9610 (89) -1
Maegele, M., Lefering, R., Yucel, N., Tjardes, T., Rixen, D., Paffrath, T., Simanski, C., Neugebauer, E., Bouillon, B. & AG Политравма Немецкого общества травматологии (DGU). (2007). Ранняя коагулопатия при множественной травме: анализ из Немецкого реестра травм на 8724 пациентах. Травма, 38 (3), 298–304. DOI: 10.1016 / j.injury.2006.10.003
МакГи, С., Абернети, В. Б. и Симел, Д. Л. (1999). Рациональное клиническое обследование. У этого пациента гиповолемия? Журнал Американской медицинской ассоциации, 281 (11), 1022–1029.DOI: 10.1001 / jama.281.11.1022
McSwain, N. Jr., & Barbeau, J. (2010). Возможное использование концентрата протромбинового комплекса в реанимации травм. Журнал травм, 70 (Приложение 5), S53 – S56. DOI: 10.1097 / TA.0b013e31821a5e5d
Мур, Ф. А., Мак-Кинли, Б. А., Мур, Э. Э., Натенс, А. Б., Уэст, М., Шапиро, М. Б., Бэнки, П., Фриман, Б., Харбрехт, Б.Г., Джонсон, Дж. Л., Миней, Дж. П., Майер, Р. В. и программа совместных исследований «Воспаление и реакция хозяина на травмы». (2006). Воспаление и реакция хозяина на травму, крупномасштабный совместный проект: Ядро исследования, ориентированного на пациента — стандартные операционные процедуры для клинической помощи. III. Руководство по шоковой реанимации. Journal of Trauma, 61 (1) , 82–89. DOI: 10.1097 / 01.ta.0000225933.08478.65
Моррисон, К.А., Каррик, М. М., Норман, М. А., Скотт, Б. Г., Уэлш, Ф. Дж., Цай, П., Лискам, К. Р., Уолл, М. Дж. Мл., И Маттокс, К. Л. (2011). Стратегия гипотензивной реанимации снижает потребность в переливании крови и тяжелую послеоперационную коагулопатию у пациентов с травмами и геморрагическим шоком: предварительные результаты рандомизированного контролируемого исследования. Journal of Trauma, 70 (3), 652–663. DOI: 10.1097 / TA.0b013e31820e77ea
Оуэнс, Т.М., Уотсон, В. К., Прро, Д. С., Учида, Т., и Крамер, Г. К. (1995). Ограничение начальной реанимации неконтролируемого кровотечения снижает внутреннее кровотечение и последующие потребности в объеме. Journal of Trauma, 39 (2), 200–207 [обсуждение: 208–209].
Плюрад, Д. С., Талвинг, П., Лам, Л., Инаба, К., Грин, Д., и Деметриадес, Д. (2011). Раннее применение вазопрессоров при критических повреждениях связано со смертностью независимо от объема. Journal of Trauma, 71 (3), 565–570 [обсуждение: 570–572]. DOI: 10.1097 / TA.0b013e3182213d52
Консорциум результатов реанимации. (нет данных). Текущие исследования. Получено с https://www.uwctc.org/tiki/current-studies
.Россент, Р., Буйон, Б., Черни, В., Коутс, Т. Дж., Дюранто, Дж., Фернандес-Мондехар, Э., Хант, Б. Дж., Комадина, Р., Нарди, Г., Нойгебауэр, Э., Озьер, Й., Риддез, Л., Шульц, А., Стахел, П. Ф., Винсент, Дж., И Спан, Д. Р. (2010). Управление кровотечением после серьезной травмы: обновленное европейское руководство. Critical Care, 14 (2) , R52. DOI: 10.1186 / cc8943
Сауая А., Мур. Ф. А., Мур, Э. Э., Мозер, К. С., Бреннан, Р., Рид, Р. А., и Понс, П. Т. (1995). Эпидемиология смертей от травм: переоценка. Journal of Trauma, 38 (2) , 185–193.
Шрайбер, М. А. (2011). Применение физиологического раствора для реанимации при травмах. Журнал Trauma, 70 (Приложение 5), S13 – S14. DOI: 10.1097 / TA.0b013e31821a4ba5
Шварц Дж. И Рид И. А. (1981). Влияние блокады вазопрессина на регуляцию артериального давления во время кровотечения у собак в сознании. Эндокринология, 109 (5), 1778–1780.DOI: 10.1210 / эндо-109-5-1778
Сперри, Дж. Л., Миней, Дж. П., Франкель, Х. Л., Уэст, М. А., Харбрехт, Б. Г., Мур, Э. Э., Майер, Р. В., и Нирула, Р. (2008). Раннее применение вазопрессоров после травмы: осторожность перед сужением. Journal of Trauma, 64 (1), 9–14. DOI: 10.1097 / TA.0b013e31815dd029
Штадльбауэр, К. Х., Вагнер-Бергер, Х. Г., Raedler, C., Voelckel, WG, Wenzel, V., Krismer, AC, Klima, G., Rheinberger, K., Nussbaumer, W., Pressmar, D., Lindner, K. H, & Königsrainer, A. (2003). Вазопрессин, но не жидкостная реанимация, увеличивает выживаемость на модели травмы печени с неконтролируемым и в противном случае летальным геморрагическим шоком у свиней. Анестезиология, 98 (3), 699–704.
Томпсон Д., Адамс С. Л. и Барретт Дж. (1990). Относительная брадикардия у больных с изолированной проникающей травмой живота и изолированной травмой конечности. Annals of Emergency Medicine , 19 (3), 268–275. DOI: 10.1016 / S0196-0644 (05) 82042-6
Vandromme, M. J., Griffin, R. L., Weinberg, J. A., Rue, L. W. 3 rd ., Kerby, J. D. (2010). Лактат является лучшим предиктором, чем систолическое артериальное давление, для определения потребности в крови и смертности: могут ли догоспитальные меры улучшить сортировку травм? Журнал Американского колледжа хирургии, 210 (5), 861–867, 867–9.DOI: 10.1016 / j.jamcollsurg.2010.01.012
Фелькель, В. Г., Рэдлер, К., Венцель, В., Линднер, К. Х., Крисмер, А. К., Шмиттингер, К. А., Херфф, Х., Райнбергер, К., и Кенигсрайнер, А. (2003). Аргинин вазопрессин, но не адреналин, улучшает выживаемость свиней при неконтролируемом геморрагическом шоке после травмы печени. Critical Care Medicine, 31 (4), 1160–1165. DOI: 10.1097 / 01.CCM.0000060014.75282.69
Новое лекарство для лечения шока, вызванного потерей крови или жидкости, признано безопасным и эффективным
Основные результаты исследований:
- Гиповолемический шок, вызванный серьезной потерей крови или биологических жидкостей, может быть смертельным, если не лечить вовремя.
- Centhaquine — новый препарат для лечения гиповолемического шока, который увеличивает приток крови к сердцу и органам, чтобы предотвратить органную недостаточность и смерть. Он все еще проходит клинические испытания в США .
- Результаты небольшого рандомизированного плацебо-контролируемого исследования в Индии показали, что центакин значительно улучшает кровяное давление, уровень лактата в крови и снижает смертность при добавлении к стандартному лечению.
Под эмбарго до 4 а.м. CT / 5:00 по восточному времени, понедельник, 9 ноября 2020 г.
ДАЛЛАС, 9 ноября 2020 г. — Центаквин, новый препарат для лечения пациентов с тяжелой кровопотерей или жидкостью, значительно улучшил результаты и снизил уровень смертности при добавлении к стандартному лечению по сравнению с одним стандартным лечением, согласно предварительным исследованиям будет представлена на Симпозиуме по реанимации 2020 Американской кардиологической ассоциации. Виртуальная встреча состоится 14-16 ноября и будет посвящена самым последним достижениям, связанным с лечением остановки сердца и травм, угрожающих жизни.
Сильная потеря крови или жидкости из-за травмы, кровотечения, желудочно-кишечного кровотечения, чрезмерной кровопотери после операции, диареи или рвоты может вызвать гиповолемический шок. Около 60000 человек в США и 1,9 миллиона человек во всем мире ежегодно умирают из-за геморрагического шока, при этом большой процент пациентов умирает от кровопотери в течение первых шести часов.
«Основная цель при лечении травматического кровотечения — контролировать кровопотерю и поддерживать сердечно-сосудистую функцию для предотвращения полиорганной недостаточности и смерти», — сказал Анил Гулати, M.D., доктор философии, ведущий автор исследования, председатель и главный исполнительный директор Pharmazz, Inc., компании, производящей центакин. «Несмотря на достижения медицинской науки, лечение гиповолемического шока мало изменилось за последние 50 лет, и существует острая потребность в эффективном реанимационном средстве для этого серьезного и опасного для жизни состояния. Мы исследовали безопасность и эффективность центакина по сравнению со стандартным лечением гиповолемического шока ».
Центаквин — это первое в своем классе реанимационное средство для лечения гиповолемического шока с уникальным механизмом действия.Он увеличивает объединенную венозную кровь, возвращающуюся к сердцу, и перераспределяет эту кровь к жизненно важным органам, что является важным процессом для сохранения функции органов и снижения смертности у пациентов с шоком.
Это многоцентровое рандомизированное плацебо-контролируемое клиническое исследование III фазы включало 105 пациентов в Индии, получавших стандартную помощь при гиповолемическом шоке в больнице или в условиях интенсивной терапии. Пациенты были рандомизированы для получения либо 1) стандартного лечения и внутривенного введения центакина, либо 2) стандартного лечения и физиологического раствора (контрольная группа).
Исследователи обнаружили несколько маркеров улучшения в группе, получавшей центаквин, по сравнению с теми, кто получал только стандартное лечение:
- Через 24 часа реанимации систолическое артериальное давление повысилось с 90 мм рт. Ст. Или ниже до более 110 мм рт. Ст. У 59% пациентов контрольной группы и 81% пациентов группы центакина.
- Кроме того, через 24 часа диастолическое артериальное давление было выше 70 мм рт.ст. в 50% контрольной группе и 78% в группе центакина.
- Снижение уровня лактата в крови до 1,5 ммоль / л или менее произошло у 47% пациентов контрольной группы и 69% пациентов, получавших центаквин. Высокий уровень лактата в крови связан с повышенным риском смерти для пациентов, испытывающих шок.
- 47% пациентов в группе стандартного лечения имели низкий базовый дефицит — показатель кислородного дисбаланса — по сравнению с 68% в группе центакина. Базовый дефицит является показателем низкой перфузии крови и оксигенации тканей.Более низкие числа указывают на лучшую перфузию крови и оксигенацию тканей.
- Уровень 28-дневной смертности составил 12% в контрольной группе и 3% в группе центакина.
Гулати добавил, что в группе центакина улучшились показатели острого респираторного дистресс-синдрома и множественной дисфункции органов по сравнению с контрольной группой.
«Время имеет решающее значение для пациентов с гиповолемическим шоком, и эти результаты предполагают более быстрое восстановление в направлении нормализации артериального давления с помощью центакина», — сказал Гулати.«Центакин, добавленный к стандартной шоковой терапии, также показал значительное снижение смертности по сравнению со стандартной шоковой терапией, с абсолютным снижением смертности на 9% по сравнению с контрольной группой».
Centhaquine в настоящее время доступен специалистам здравоохранения в Индии и приближается к поздним стадиям клинических испытаний в Соединенных Штатах.
Соавторы: Раджат Чоудхури, доктор медицины; Аджай Гупта, доктор медицины; Саураб Сингх, доктор медицины; С. К. Нушад Али, доктор медицины; Гурсаран Каур Сидху, доктор медицины; Парвез Дэвид Хак, доктор медицины; Прашант Рахат, доктор медицины; Адитья Р. Ботра, доктор медицины; Г.П. Сингх, доктор медицины; Санджив Махешвари, доктор медицины; Дипак Джесвани, доктор медицины; Самир Хавери, доктор медицины; Апурва Агарвал, доктор медицины, и Нилеш Радхешьям Агравал, доктор медицины, раскрытия информации об авторах представлены в аннотации.
Это исследование финансировалось Pharmazz, Inc.
Презентация: AOS.02c Lightning Round Устные аннотации: Фармакологические вмешательства при остановке сердца
Дополнительные ресурсы:
Заявления и выводы исследований, представленные на научных собраниях Американской кардиологической ассоциации, принадлежат исключительно авторам исследования и не обязательно отражают политику или позицию Ассоциации.Ассоциация не делает никаких заявлений и не гарантирует их точность или надежность. Ассоциация получает финансирование в основном от частных лиц; фонды и корпорации (включая фармацевтические компании, производителей устройств и другие компании) также делают пожертвования и финансируют определенные программы и мероприятия Ассоциации. Ассоциация придерживается строгой политики, чтобы эти отношения не влияли на содержание науки. Выручка от фармацевтических и биотехнологических компаний, производителей устройств и поставщиков медицинского страхования доступна здесь, а общая финансовая информация Ассоциации доступна здесь.
Об Американской кардиологической ассоциации
Американская кардиологическая ассоциация — ведущая сила в мире более долгой и здоровой жизни. Ассоциация из Далласа, на протяжении почти столетия работающей по спасению жизни, стремится обеспечить справедливое здоровье для всех. Мы являемся надежным источником, который дает людям возможность улучшить здоровье своего сердца, мозга и благополучия. Мы сотрудничаем с многочисленными организациями и миллионами добровольцев, чтобы финансировать инновационные исследования, выступать за усиление политики общественного здравоохранения и делиться жизненно важными ресурсами и информацией.Свяжитесь с нами на heart.org, Facebook, Twitter или по телефону 1-800-AHA-USA1.
###
Для запросов СМИ и экспертов AHA:
AHA News Media в Далласе: 214-706-1173; [email protected]
Моника Продажи: 214-706-1527; [email protected]
Для общественных запросов: 1-800-AHA-USA1 (242-8721)
heart.org и stroke.org
Помощь прометею: защита печени при остром геморрагическом шоке — Veith
Травматический геморрагический шок считается наиболее частой причиной смерти молодых людей в промышленно развитых странах.Повреждения крупных сосудов вызывают гиповолемию и генерализованную ишемию. Это приводит к нарушениям микроциркуляции, метаболическим изменениям и угнетению иммунной системы (1-5). Кроме того, это связано с низкой перфузией органов и дисбалансом между спросом на O2 и предложением O 2 (6). Реакцией организма является активация лейкоцитов и макрофагов, а также чрезмерное производство и высвобождение различных гуморальных и клеточных медиаторов, включая цитокины и эйкозаноиды, а также (7,8).Чтобы компенсировать прогрессирующую потерю крови, активируется адренергическая система. Следствием этого является сужение периферических сосудов и снижение скорости потока крови из-за ухудшения свойств потока. Нарушение микроциркуляции вызывает тканевую гипоксию и ацидоз (9-11). Следствием этого является перераспределение объема циркулирующей крови в первую очередь на жизненно важные органы, такие как мозг и сердце. Таким образом, органы перфузии, такие как печень, почки и желудочно-кишечный тракт, еще больше уменьшаются, поскольку они не участвуют в индуцированной гиповолемией централизации перфузии крови.Недостаточное снабжение этих органов приводит к отчетливым нарушениям микроциркуляции, которые в краткосрочной перспективе вызывают повреждение тканей и органов и могут в дальнейшем привести к развитию полиорганной недостаточности (10).
Стадии и последствия геморрагического шока
Исходя из расчетной кровопотери и связанных с этим последствий геморрагического шока в соответствии с рекомендациями Американского колледжа хирургов по поддержке жизни при тяжелых травмах (ATLS), геморрагический шок можно разделить на четыре стадии (12) (, таблица 1, ) .Стадия I классифицируется как потеря 15% объема циркулирующей крови. Частота сердечных сокращений и артериальное давление в этом случае все еще в норме. Первыми симптомами могут быть жажда и беспокойство. Стадия II определяется как кровопотеря 15–30%. Клиническими симптомами здесь являются тахикардия, тахипноэ, олигурия и умеренное возбуждение. Коррекция этого состояния может быть достигнута с помощью жидкостной реанимации или вазопрессорной поддержки. III стадия геморрагического шока — это категория с кровопотерей 30–40%. Симптомы включают выраженную тахикардию и тахипноэ, гипотензию, сильное беспокойство и дезориентацию.Кровопотеря> 40% представляет собой IV стадию геморрагического шока. Для этого состояния характерны, например, летаргия, дезориентация, тахикардия и тахипноэ. Желудочно-кишечный тракт особенно чувствителен к вызванным шоком изменениям перфузии крови, в основном затрагивая ткань, снабжаемую верхней брыжеечной артерией (13). Ишемия, вызванная геморрагическим шоком, может привести к повреждению барьера слизистой оболочки кишечника и последующему проникновению бактерий и эндотоксинов из просвета кишечника в брыжеечные сосуды (14).Проникающие бактерии проникают в печень через портальную систему кровообращения и вызывают высвобождение медиаторов (особенно IL-6, IL-1, TNF-α и кортикоидов) и радикалов макрофагами, моноцитами, эндотелиальными клетками и фибробластами. Высвобождение этих медиаторов оказывает значительное влияние на микроциркуляцию печени и функцию гепатоцитов (7,8,15). Реакция острой фазы контролируется медиаторами, которые влияют на синтез белка в печени (16,17). Цитокины, высвобождаемые в результате геморрагического шока, индуцируют синтез альбумина, С-реактивного белка, комплемента 5a, церулоплазмина, трансферрина, α1-кислотного гликопротеина и гаптоглобина, ответственных за контроль коагуляции и фибринолиза (17).Геморрагический шок поражает все клеточные системы печени: увеличивается количество активированных клеток Купфера и клеток Ито, а также увеличивается количество поврежденных эндотелиальных клеток. Это приводит к нарушению микроциркуляции печени, в частности к нарушению синусоидальной перфузии и дальнейшему нарушению регуляции функции гепатоцитов (18-20). Существенные изменения в печеночно-специфической аспартатаминотрансферазе могут быть обнаружены на модели шока у животных (21) через 3 часа в сыворотке. При геморрагическом шоке наблюдается снижение сердечного выброса и непропорционально большее снижение кровотока в печени из-за кровопотери.Следствием этого является нарушение микроциркуляции в печени и снижение перфузионного давления из-за уменьшения объема циркулирующей крови в организме. Это может привести к нарушению перфузии отдельных синусоидов печени. Одновременная адренергическая активация также приводит к уменьшению диаметра синусоиды с последующим дефицитом перфузии (20). Результат — нарушение работы синусоидальной сети печени. В условиях нормального давления циркулирующие лейкоциты свободно проходят через синусоиды печени, не вызывая взаимодействия с эндотелием сосудов.Нарушение кровообращения приводит к синусоидальному застою с повышенной активацией лейкоцитов (21,22), а также к усилению взаимодействия лейкоцитов с эндотелием (7).
Таблица 1 Поэтапная классификация комитета геморрагического шока по поддержанию жизни при поздних травмах (ATLS) [2004]. Американский колледж хирургов, Чикаго, 7-е издание (12)Полная таблица
Лечение
Для противодействия острому геморрагическому шоку используются внутривенные инфузии, такие как коллоидные и кристаллоидные растворы.Уменьшенный объем восстанавливается, пониженное артериальное давление быстро повышается до нормальных значений, а состояние кровообращения у травмированных пациентов стабилизируется. Увеличение венозного возврата к сердцу с таким же увеличением сердечного выброса, связанное с сопротивлением, должно поддерживать перфузию жизненно важных органов (23-25). Реанимационные мероприятия в малых объемах (УВО) стали выбором в качестве первичной терапии. УВО определяется как быстрое внутривенное вливание небольших гиперосмолярных солевых коллоидных растворов, которое улучшает микроциркуляцию и снабжение тканей кислородом.Вазопрессоры могут поддерживать периферическое сосудистое сопротивление при остром геморрагическом шоке. В этом контексте хорошо известны два катехоламина, адреналин и норадреналин, которые продуцируются в мозговом веществе надпочечников и специфически действуют на α- и β-рецепторы сосудов. Освобождение происходит особенно в стрессовых ситуациях. Однако главный критерий оценки — адреналин (26-28). Исследования показывают, что использование адреналина при остановке сердца не приводит к улучшению краткосрочной выживаемости. Увеличение дозы адреналина может даже привести к ухудшению неврологической работоспособности (28).Другим вазопрессором является гормон организма вазопрессин (29), который зарекомендовал себя как успешный вазопрессор при вазодилататорном шоке (30-32). Таким образом, вазопрессин улучшает кровоток в органе при геморрагическом шоке даже без эффекта катехоламинов и при наличии вазоплегии.
Экспериментальные подходы
Существует несколько экспериментальных моделей на животных, которые позволяют изучить улучшение микроциркуляции в печени после применения лекарств при остром геморрагическом шоке (, таблица 2, ).Эти конкретные животные модели в основном применяются к крысам, хомякам, овцам, собакам, свиньям и, в меньшей степени, также к мышам. Распространенными методами исследования микроциркуляции являются лазерно-допплеровская флюксметрия (21) и прижизненная микроскопия (45). Исследование 1978 года, проведенное на собаках, показало, что использование 5 мг дексаметазона (33) на килограмм веса тела после геморрагического шока приводит к улучшению среднего артериального давления. В результате увеличивается перфузия легких, почек, толстой кишки и желудка с последующим уменьшением повреждения клеток.В 1987 году группа Waxman et al. (34) показали, что использование пентоксифиллина (25 мг / кг) вызывает значительное увеличение напряжения кислорода на поверхности печени крыс. Марзи и др. (35) показали, что после геморрагического шока применение пентоксифиллина или альбифиллина в дозе 25 мг / кг приводит к значительному улучшению микрососудистого кровотока к печени. Снижение взаимодействия лейкоцитов с эндотелиальными клетками на стенке сосуда также было обнаружено с помощью прижизненной микроскопии.Также Flynn et al. обнаружили восстановление микроциркуляции печени с помощью пентоксифиллина (46). Shimizu et al. (36) показали, что применение дегидроэпиандростерона (1 мг / кг) у самцов крыс после геморрагического шока приводит к снижению продукции желчи, а также снижению продукции аланинаминотрансферазы в сыворотке крови, нитритов / нитратов печени, синтазы оксида азота (iNOS ) и эндотелина-1 по сравнению с необработанными животными. Следовательно, дегидроэпиандростерон может быть активным в восстановлении функции печени.Schmidt et al. смогли показать, что с помощью вазодилататора гидралазина (1,5 мг / кг) микрососудистый кровоток в печени может быть увеличен после острого геморрагического шока (37). Исследование подтвердило последующее снижение повреждения печени у крыс. Mathes et al. продемонстрировал снижение гепатоцеллюлярного повреждения у крыс, подвергшихся геморрагическому шоку, при предварительной обработке мелатонином (10 мг / кг) (38). Более того, наблюдалось улучшение перфузии по сравнению с контрольной группой.Предварительная обработка крыс аргинатом гемина (5 мг / кг) показала значительное улучшение микроциркуляции в печени (39). Предполагается, что за это отвечает активация гематоксигеназы-1; однако точный механизм пока не известен. Kubulus et al. исследовал влияние гемоглобина глутамера-200 и его влияние на высвобождение эндотелина-1 после острого геморрагического шока (40). Крысы опытной группы получали гемоглобин глутамер-200 после геморрагического шока. Таким образом определяли повышенную экспрессию эндотелина-1 с увеличением гепатоцеллюлярного повреждения.Второй экспериментальной группе дополнительно вводили неспецифический блокатор рецепторов эндотелина бозентан (10 мг / кг). Эта блокада привела к улучшению перфузии печени, уменьшению гепатоцеллюлярного повреждения и снижению высвобождения цитокинов. Махмуд и др. показали, что у крыс после геморрагического шока ингибирование фактора некроза опухоли-альфа (TNF-α) пентоксифиллином или инфликсимабом (50 мг / кг) приводит к значительному снижению повреждения печени (41). Ответственным за это, по-видимому, является снижение маркеров окислительного стресса, снижение экспрессии рецепторов TNF-α, TNF-α-типа 1 и ядерного фактора каппа B (NF-kB).Таким образом, ингибирование TNF-α может быть терапевтическим вмешательством при остром геморрагическом шоке. Наконец, Liu et al. показали, что уровни интерлейкина-6, молекулы внутриклеточной адгезии-1 (ICAM-1), а также активность миелопероксидазы, которая увеличивалась после геморрагического шока, снижались при применении сиртинола (1 мг / кг) (42). Это было обнаружено на крысиной модели геморрагического шока. Однако точный механизм противовоспалительного действия сиртинола еще не выяснен. Опять же, совсем недавно у крыс было обнаружено, что синтетический антимикробный пептид защищает от повреждения органов при тяжелом геморрагическом шоке (43).
Таблица 2 Экспериментальные исследования улучшения микроциркуляции в печениПолная таблица
Превосходная модель шока — овца Штауба. Использование более мелких животных, таких как крысы, морские свинки и собаки, дает финансовые и человеческие преимущества по сравнению с крупными животными. При использовании передовых методов, таких как прижизненная микроскопия, допплерография и магнитно-резонансная томография, при остром геморрагическом шоке наблюдались изменения функции лейкоцитов, активности макрофагов и микроциркуляции в печени.
Недавние исследования на животных показали, что разумное использование лекарств (, таблица 2, ) улучшает микроциркуляцию и снижает повреждение печени после острого геморрагического шока. Преимущества иммуномодулирующих веществ, выявленные в исследованиях на животных, до сих пор не решили клиническую проблему (47,48). Горячим кандидатом для лечения печеночной недостаточности на фоне геморрагического шока является адреномедуллин. Адреномедуллин — эндогенный пептид, защищающий от повреждений печени и кишечника, вызванных механической вентиляцией легких у мышей с пневмонией (44).В будущих исследованиях следует, в частности, сосредоточиться на механизмах ослабления воспаления и восстановления функции органов, чтобы добиться значительного снижения высокой смертности после острого геморрагического шока и тяжелой кровопотери.
Благодарности
Нет.
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Список литературы
- Пфейфер Р., Черниг Т., Лихте П. и др.Предварительная обработка MALP-2 модулирует системное воспаление при геморрагическом шоке. Журнал Инфламм (Лондон) 2013; 10: 17. [Crossref] [PubMed]
- Chaudry IH, Wichmann MW, Ayala A. Иммунологические изменения после геморрагического шока: рекомендации по реанимации с помощью кровезаменителей. В: Rabinovici R, Feuerstein G, Randolph AS. Editors. Fundamental Principles and Clinical Applications of Blood Substitutes. New York: Marcel Деккер, 1997: 165-88.
- DeCamp MM, Демлинг RH.Посттравматическая мультисистемная органная недостаточность. JAMA 1988; 260: 530-4. [Crossref] [PubMed]
- Shires GT. Ответ на «Отсроченная реанимация жидкости при геморрагическом шоке вызывает провоспалительный цитокиновый ответ». Энн Эмерг Мед 2007; 50: 354; ответ автора 354. [Crossref] [PubMed]
- Jiang JX, Diao YF, Tian KL, et al. Влияние геморрагического шока на индуцирующую эндотоксин продукцию TNF и экспрессию мРНК липополисахаридсвязывающего белка внутри тканей и их взаимосвязь.Шок 1997; 7: 206-10. [Crossref] [PubMed]
- Adams HA, Baumann G, Gänsslen A, et al. Определение видов шока. Anasthesiol Intensivmed Notfallmed Schmerzther 2001; 36 Приложение 2: S140-3. [Crossref] [PubMed]
- Marzi I, Bauer C, Hower R, et al. Взаимодействие лейкоцитов и эндотелиальных клеток в печени после геморрагического шока у крыс. Circ Shock 1993; 40: 105-14. [PubMed]
- Marzi I, Bauer M, Secchi A, et al. Влияние фактора некроза опухоли альфа на адгезию лейкоцитов в печени после геморрагического шока: прижизненное микроскопическое исследование на крысах.Шок 1995; 3: 27-33. [PubMed]
- Nuytinck HK, Offermans XJ, Kubat K и др. Воспаление всего тела у пациентов с травмами. Исследование вскрытия. Arch Surg 1988; 123: 1519-24. [Crossref] [PubMed]
- Кил М., Трентц О. Патофизиология политравмы. Травма 2005; 36: 691-709. [Crossref] [PubMed]
- Мессмер К. Реологические принципы шоковой терапии. Интернист (Берл) 1982; 23: 445-9. [PubMed]
- Американский колледж хирургов.Программа поддержки жизни при травмах ATLS для врачей (7-е изд.). Чикаго: Американский колледж хирургов, 2014.
- Мессмер К. 163. Кишечные факторы при шоке: кишечное кровообращение. Langenbecks Arch Chir 1967; 319: 890-909. [Crossref] [PubMed]
- Berg RD. Бактериальная транслокация из желудочно-кишечного тракта. J Med 1992; 23: 217-44. [PubMed]
- Swank GM, Deitch EA. Роль кишечника в полиорганной недостаточности: транслокация бактерий и изменения проницаемости.World J Surg 1996; 20: 411-7. [Crossref] [PubMed]
- Роуз С., Марзи И. Патофизиология политравмы. Zentralbl Chir 1996; 121: 896-913. [PubMed]
- Генрих П.С., Кастелл Дж. В., Андус Т. Интерлейкин-6 и реакция острой фазы. Biochem J 1990; 265: 621-36. [Crossref] [PubMed]
- Vollmar B. Микроциркуляция и снабжение печени кислородом при геморрагическом шоке и сепсисе. Anasthesiol Intensivmed Notfallmed Schmerzther 1995; 30 Приложение 1: S52-4.[Crossref] [PubMed]
- Mazzoni MC, Borgström P, Intaglietta M и др. Сужение капилляров при геморрагическом шоке корректируется гиперосмотической реинфузией физиологического раствора и декстрана. Circ Shock 1990; 31: 407-18. [PubMed]
- Koo A, Liang IY. Кровоток в синусоидах печени при экспериментальном геморрагическом шоке у крысы. Microvasc Res. 1977; 13: 315-25. [Crossref] [PubMed]
- Tang Y, Xia XF, Zhang Y, et al. Создание экспериментальной мышиной модели травмо-геморрагического шока.Exp Anim 2012; 61: 417-25. [Crossref] [PubMed]
- Клеменс М.Г., Бауэр М., Паннен Б.Х. и др. Ремоделирование реакции микрососудов печени после ишемии / реперфузии. Шок 1997; 8: 80-5. [Crossref] [PubMed]
- Kreimeier U, Christ F, Frey L, et al. Реанимация малых объемов при гиповолемическом шоке. Концепция, экспериментальные и клинические результаты. Анестезиолог 1997; 46: 309-28. [Crossref] [PubMed]
- Марик ЧП. Чувствительность к жидкостям и шесть руководящих принципов жидкостной реанимации.Crit Care Med 2016; 44: 1920-2. [Crossref] [PubMed]
- Marik PE, Linde-Zwirble W.T., Bittner EA и др. Введение жидкости при тяжелом сепсисе и септическом шоке, закономерности и исходы: анализ большой национальной базы данных. Intensive Care Med 2017; 43: 625-32. [Crossref] [PubMed]
- Paradis NA, Koscove EM. Адреналин при остановке сердца: критический обзор. Энн Эмерг Мед 1990; 19: 1288-301. [Crossref] [PubMed]
- Вудхаус С.П., Кокс С., Бойд П. и др.Адреналин в высоких и стандартных дозах не влияет на выживаемость по сравнению с плацебо при остановке сердца. Реанимация 1995; 30: 243-9. [Crossref] [PubMed]
- Behringer W, Kittler H, Sterz F и др. Кумулятивная доза адреналина во время сердечно-легочной реанимации и неврологический исход. Энн Интерн Мед 1998; 129: 450-6. [Crossref] [PubMed]
- Lindner KH, Prengel AW, Pfenninger EG, et al. Вазопрессин улучшает кровоток в жизненно важных органах при закрытой сердечно-легочной реанимации у свиней.Circulation 1995; 91: 215-21. [Crossref] [PubMed]
- Krismer AC, Wenzel V, Mayr VD, et al. Аргинин вазопрессин при сердечно-легочной реанимации и сосудорасширяющем шоке: текущий опыт и перспективы на будущее. Curr Opin Crit Care 2001; 7: 157-69. [Crossref] [PubMed]
- Dünser M, Wenzel V, Mayr AJ и др. Аргинин вазопрессин при вазодилататорном шоке: новый подход к терапии? Anaesthesist 2002; 51: 650-9; обсуждение 659-60. [Crossref] [PubMed]
- Моралес Д., Мэдиган Дж., Куллинейн С. и др.Купирование вазопрессином трудноизлечимой гипотензии в поздней фазе геморрагического шока. Circulation 1999; 100: 226-9. [Crossref] [PubMed]
- Ferguson JL, Roesel OF, Bottoms GD. Лечение дексаметазоном при геморрагическом шоке: артериальное давление, перфузия тканей и ферменты плазмы. Am J Vet Res 1978; 39: 817-24. [PubMed]
- Ваксман К., Холнесс Р., Томинага Г. и др. Пентоксифиллин улучшает оксигенацию тканей после геморрагического шока. Хирургия 1987; 102: 358-61.[PubMed]
- Marzi I, Maier M, Herzog C, et al. Влияние пентоксифиллина и альфифиллина на микроциркуляцию печени и адгезию лейкоцитов после геморрагического шока у крыс. J. Trauma 1996; 40: 90-6. [Crossref] [PubMed]
- Шимицу Т., Салай Л., Чоудри М.А. и др. Механизм благотворного действия андростендиола на функцию печени после травмы-кровотечения: роль эндотелиальной и индуцибельной синтазы оксида азота. Am J Physiol Gastrointest Liver Physiol 2005; 288: G244-50.[Crossref] [PubMed]
- Schmidt R, Baechle T, Hoetzel A, et al. Лечение дигидралазином ограничивает повреждение печени у крыс после геморрагического шока. Crit Care Med 2006; 34: 815-22. [Crossref] [PubMed]
- Матес А.М., Кубулус Д., Прадарутти С. и др. Предварительная обработка мелатонином улучшает функцию печени и печеночную перфузию после геморрагического шока. Шок 2008; 29: 112-8. [PubMed]
- Кубулус Д., Матес А., Прадарутти С. и др.Экспрессия гемоксигеназы 1, индуцированная аргинатом гемина, улучшает микроциркуляцию печени и опосредует противовоспалительный цитокиновый ответ после геморрагического шока. Шок 2008; 29: 583-90. [PubMed]
- Кубулус Д., Матес А, Реус Э и др. Эндотелин-1 способствует опосредованной гемоглобином глутамером-200 гепатоцеллюлярной дисфункции после геморрагического шока. Шок 2009; 32: 179-89. [Crossref] [PubMed]
- Махмуд М.Ф., Эль-Шазли С.М., Баракат В. Ингибирование TNF-α защищает от повреждения ишемией-реперфузией печени у крыс через NF-κB-зависимый путь.Наунин Шмидебергс Arch Pharmacol 2012; 385: 465-71. [Crossref] [PubMed]
- Лю ФК, Цай Ю.Ф., Ю. HP. Сиртинол ослабляет повреждение печени, вызванное травматическим кровотечением, через Akt-зависимый путь у крыс. J Trauma Acute Care Surg 2013; 74: 1027-32. [Crossref] [PubMed]
- Ямада Н., Мартин Л.Б., Зехендорф Э. и др. Новый синтетический пептид для защиты хозяина защищает от повреждения / дисфункции органов в модели тяжелого геморрагического шока у крыс. Энн Сург 2017.[Epub перед печатью]. [Crossref] [PubMed]
- Müller-Redetzky HC, Will D., Hellwig K, et al. Механическая вентиляция приводит к развитию пневмококковой пневмонии у мышей и к сепсису: защита адреномедуллином. Crit Care 2014; 18: R73. [Crossref] [PubMed]
- Menger MD, Marzi I, Messmer K. Флуоресцентная микроскопия in vivo для количественного анализа печеночной микроциркуляции у хомяков и крыс. Eur Surg Res 1991; 23: 158-69. [Crossref] [PubMed]
- Флинн В.Дж., Крайер Х.Г., Гарнизон РН.Пентоксифиллин, но не саралазин, восстанавливает кровоток в печени после реанимации после геморрагического шока. J Surg Res. 1991; 50: 616-21. [Crossref] [PubMed]
- Deitch EA. Животные модели сепсиса и шока: обзор и извлеченные уроки. Шок 1998; 9: 1-11. [Crossref] [PubMed]
- Эртель В., Моррисон М. Х., Аяла А. и др. Моноклональные антитела против TNF предотвращают вызванное кровотечением подавление презентации антигена клеток Купфера и экспрессии антигена MHC класса II.Иммунология 1991; 74: 290-7. [PubMed]
Цитируйте эту статью как: Veith NT, Histing T., Menger MD, Pohlemann T., Tschernig T. Помощь прометею: защита печени при остром геморрагическом шоке. Энн Трансл Мед 2017; 5 (10): 206. DOI: 10.21037 / атм.2017.03.109
Как распознать гиповолемический шок и отреагировать на него
В сопровождении своей дочери, Джорджа Морана, 81 год, он приходит в отделение неотложной помощи ослабленным и слабым. Его жизненно важные признаки: артериальное давление 82/40 мм рт. пульс 130 ударов в минуту и регулярный; и оральная температура 98.6 ° F (37 ° C). Он весит 125 фунтов (57 кг) — на 5 фунтов (2,3 кг) меньше его нормального веса. При осмотре вы обнаруживаете плохой тургор кожи и сухость слизистых оболочек; при пальпации вы замечаете, что его живот болезненный, но не вздутый. В соответствии с заказом вы получаете образцы крови и немедленно отправляете их в лабораторию.
Хотя мистер Моран апатичен, он может ответить на вопросы, если вы попытаетесь узнать его историю. Он заявляет, что у него были тошнота, рвота и водянистый понос в течение последних 2 дней и что сегодня он упал, вставая со стула.Его дочь добавляет, что в последнее время несколько членов семьи переболели «желудочным гриппом».
Когда возвращаются результаты лабораторных исследований, вы отмечаете повышенное количество лейкоцитов, высокий уровень азота мочевины в крови и погранично низкий уровень креатинина (0,8). Остальные значения нормальные.
Обобщая эту информацию с анамнезом и результатами оценки, вы начинаете подозревать, что г-н Моран потерял объем желудочно-кишечного тракта, что привело к гиповолемическому шоку. Его шоковый индекс (частота сердечных сокращений, деленная на систолическое артериальное давление) равен 1.59 — значительно выше, чем нормальный диапазон от 0,5 до 0,7.
Зная, что быстрое действие имеет решающее значение, вы немедленно устанавливаете 18G I.V. линии в левой антекубитальной вене г-на Морана и, как указано, начать вливание лактата Рингера со скоростью 250 мл / час.
Опасное падение перфузии
Гиповолемический шок возникает, когда объем кровообращения значительно падает. Как и при других типах шока, системное снижение перфузии тканей приводит к снижению доставки кислорода. Если начальный процесс не обратить вспять, длительное кислородное голодание вызывает клеточную гипоксию и накопление метаболических отходов, что приводит к мультисистемной органной недостаточности и смерти.К счастью, раннее распознавание гиповолемического шока и агрессивное лечение могут значительно улучшить исход пациента.
Гиповолемический шок чаще всего возникает в результате кровопотери. Снижение функции почек повышает риск этого типа шока у пожилых людей. Дети также подвергаются большему риску из-за того, что в их организме больше воды.
Патофизиологический процесс
При гиповолемии уменьшение объема жидкости снижает возврат крови к сердцу, вызывая снижение преднагрузки (объема крови, остающегося в левом желудочке в конце диастолы).По мере уменьшения преднагрузки снижается сердечный выброс.
Для компенсации низкого сердечного выброса частота сердечных сокращений увеличивается, а системное сосудистое сопротивление (SVR) увеличивается. Повышенный УВО, в свою очередь, увеличивает сердечный выброс, увеличивает давление перфузии тканей и запускает выброс катехоламинов. Объем крови увеличивается по мере того, как интерстициальная жидкость перемещается во внутрисосудистые пространства, а печень и селезенка высвобождают накопленные эритроциты (эритроциты). Эти изменения активируют систему ренин-ангиотензин-альдостерон, которая способствует задержке натрия и воды в попытке повысить систолическое давление.Затем диурез снижается.
Если кровопотеря продолжается, компенсаторные механизмы поддерживают перфузию к жизненно важным тканям, отводя кровь от нежизненных органов. Снижение перфузии приводит к повреждению клеток в катаболическом состоянии. Если не обратить процесс вспять, следует гибель клеток. Кроме того, уровень глюкозы повышается, поскольку инсулин теряет способность контролировать процессы, вызванные лактоацидозом. Когда организм находится в состоянии кислородной недостаточности, анаэробный метаболизм производит молочную кислоту, что напрямую отражает плохую перфузию и кислородную недостаточность на более поздних стадиях шока.При нескорректированном гиповолемическом шоке потеря буферной способности приводит к ацидозу (pH ниже 7,35).
Оценка и диагностика
Как и в случае с г-ном Мораном, история пациента может предоставить важную информацию. После получения подробного анамнеза настоящего заболевания проведите общую физическую оценку, включая артериальное давление, пульс, температуру, оксигенацию, диурез, психическое состояние и уровень боли.
Чтобы быстро оценить объем жидкости, подумайте о теории «шланга и пальцев ног»: объема жидкости достаточно, если «шланг» (почка) производит достаточное количество мочи, а пальцы ног розовые у светлокожих пациентов или коричневые у темнокожих. .
Будьте готовы взять образцы крови для общего анализа крови, который может предположить или помочь исключить инфекцию и некоторые другие состояния. Значения гемоглобина и гематокрита могут указывать на кровотечение; во время лечения они обеспечивают основу для оценки реакции пациента на переливание крови или другие замещающие жидкости. Также возьмите кровь для типирования и скрининга. Если у пациента анемия с острой кровопотерей, убедитесь, что кровь совпадает.
Другие полезные исследования могут включать профиль печени, анализ газов артериальной крови и измерение молочной кислоты, фибриногена и продуктов расщепления фибрина, а также уровней сердечных ферментов.Также может быть полезен расчет индекса шока; при острой гиповолемии индекс повышается. Врач может назначить ЭКГ для оценки сердечного ритма и рентген грудной клетки для поиска признаков пневмонии или сердечной недостаточности.
Менеджмент
Раннее вмешательство имеет решающее значение для положительного результата. Гиповолемический шок требует быстрой объемной реанимации для восстановления гомеостаза. Обеспечьте азы базовой реанимации — проходимость дыхательных путей, дыхание и кровообращение. Также необходимо лечить первопричину шока.
Ожидается установка периферийного I.V. с большим отверстием (18G или больше). линия или катетер центрального доступа для введения жидкости; Многопросветная линия способствует доставке жидкостей и I.V. лекарства. Выбор жидкости для замены зависит от типа потерянного объема.
Коллоиды и кристаллоиды
Коллоиды, молекулы которых слишком велики для прохождения через полупроницаемые мембраны, обеспечивают объем с более высокой осмолярностью, чем кристаллоиды, и помогают предотвратить перемещение жидкости. Находясь в основном во внутрисосудистом пространстве, они поддерживают осмотическое давление коллоидов плазмы.Примеры включают кровь и продукты крови, такие как упакованные эритроциты (PRBC), цельную кровь, свежезамороженную плазму, гетакрахмал и альбумин.
Если пациент потерял кровь в результате операции или травмы, будьте готовы к введению PRBC, которые обеспечивают способность переносить кислород без увеличения объема. Свежезамороженная плазма помогает увеличить внутрисосудистый объем и восстановить недостаточные факторы свертывания, тогда как цельная кровь увеличивает объем и повышает способность переносить кислород. Если у пациента тромбоцитопения, следует ожидать переливания тромбоцитов.
Кристаллоиды, такие как физиологический раствор и лактат Рингера, имеют меньшие молекулы, чем коллоиды, и могут проникать через полупроницаемые мембраны. Врач может назначить от 2 до 3 л кристаллоидов для поддержания баланса жидкости и электролитов. Раствор Рингера с лактатом изотоничен и обеспечивает буферизацию для противодействия последствиям ацидоза. Физиологический раствор полезен для пациента, у которого не наблюдается потеря эритроцитов.
Поскольку кристаллоиды распределяются из внутрисосудистого пространства по всему внеклеточному пространству, их необходимо вводить в больших объемах для лечения гиповолемического шока.Избегайте применения кристаллоидов, содержащих декстрозу
, которые могут повысить уровень глюкозы в сыворотке. (Жесткий гликемический контроль способствует заживлению.)
Вазопрессоры не являются препаратами первой линии для лечения гиповолемического шока. Обычно они вызывают сокращение периферической сосудистой сети, что приводит к оттоку крови к жизненно важным органам; однако при небольшом объеме этот механизм неэффективен. Тем не менее, если агрессивная объемная реанимация не улучшает артериальное давление, в дополнение к I.V. жидкости.
Имейте в виду, что И.В. жидкости увеличивают риск сердечной недостаточности у пациента. Во время приема жидкости обязательно оценивайте звуки дыхания, частоту сердечных сокращений и оксигенацию, а также следите за потреблением и выделением жидкости.
Другие медсестринские вмешательства
Ожидается, что вам будут назначать кислородную и вентиляционную поддержку, если это необходимо, для поддержки перфузии тканей. Чтобы оптимизировать артериальное давление, расположите пациента ровно или в положении Тренделенбурга, чтобы увеличить венозный возврат от ног.Но имейте в виду, что такое расположение увеличивает риск аспирации. Сама гиповолемия снижает перфузию кишечника; снижение притока крови к желудку может увеличить риск желудочных остатков, рефлюкса и аспирации. Поэтому, если пациент получает энтеральное питание, временно прекратите кормление через зонд.
Кроме того, низкая перфузия повышает риск возникновения пролежней. Хотя состояние кожи не является приоритетом во время жидкостной реанимации, вы можете предпринять шаги, чтобы уменьшить поверхность давления, приобретя матрас с низкой потерей воздуха и убедившись, что пациент не лежит на влажной твердой поверхности в течение длительного времени.
Осложнения
Если объем не будет восстановлен и кровотечение не остановлено, могут развиться коагулопатии — и жидкостная реанимация может их усугубить. Гиповолемический шок также может вызвать другие осложнения, в том числе:
- системная инфекция в результате использования внутривенного инъекционного аппарата большого диаметра. линия жидкостной реанимации
- реакция при переливании крови при переливании крови
- гипотермия, которая может возникнуть после травмы, хирургического вмешательства или инфузии большого количества внутривенного вливания. жидкости.Переохлаждение может усугубить ацидоз, поэтому обязательно согревайте пациента. Если температура тела упала, согреть в / в. жидкости снаружи, накройте теплыми одеялами или внешними устройствами для обогрева, либо увеличьте температуру в помещении.
Обеспечение оптимального исхода
Для пациента с гиповолемическим шоком успешный исход во многом зависит от своевременной диагностики и агрессивного лечения. Прогноз зависит от таких факторов, как раннее начало лечения и степень шока; в тяжелом шоке смерть может наступить, несмотря на немедленное лечение.
У пожилых пациентов особенно высока вероятность неблагоприятного исхода. Однако мистеру Морану повезло. После 2 часов жидкостной реанимации его кровяное давление повысилось, частота сердечных сокращений замедлилась, а постоянный мочевой катетер собрал около 100 мл жидкости. Вскоре он будет помещен в общую медпункт, где ему и дальше будут назначать внутривенные инъекции. жидкости, но с меньшей скоростью. Во многом благодаря медсестринскому опыту и быстрым действиям он смог избежать катастрофы. O
Избранные ссылки
Биркхан Р., Гаэта Т., Терри Д. и др.Индекс шока в диагностике ранней острой гиповолемии. Am J Emerg Med. 2005; 23: 323-326.
Gaieski D, Manaker S. Общая оценка и дифференциальная диагностика шока у взрослых. Официальный обзор темы от UpToDate. Доступно по адресу: http://patients.uptodate.com/topic.asp?file=cc_medi/11364. По состоянию на 1 марта 2007 г.
Келли Д. Гиповолемический шок: обзор. Crit Care Nurs Q. 2005; 28: 2-19.
Мюльберг А., Рут-Сахд Л. Лечение и вмешательства при гиповолемическом шоке, вызванном кровотечением.Dimension Crit Care Nurs. 2004; 23: 55-59.
Роуз Б., Мандель Дж. Лечение тяжелой гиповолемии или гиповолемического шока у взрослых. Доступно по адресу: http://patients.uptodate.com/topic.asp?file=fldlytes/16514. По состоянию на 1 марта 2007 г.
Маргарет М. Эклунд, MS, RN, CCRN, APRN-BC, клинический врач VI / практикующая медсестра по пульмональной медицине в Рочестерской больнице общего профиля в Рочестере, штат Нью-Йорк. Кристин Р. Эклунд, BSN, RN, работает медсестрой в Бет. Медицинский центр Израильской диакониссы в Бостоне, штат Массачусетс.
Реанимация при гиповолемическом шоке. Информационная страница
Гиповолемический шок возникает, когда объем кровеносной системы слишком истощен, чтобы обеспечить адекватное кровообращение в тканях тела. Целью реанимации является коррекция гиповолемии и гипоперфузии жизненно важных органов, таких как почки, до того, как произойдет необратимое повреждение.
Помните, что есть и другие причины шока :
- Кардиогенные — например, массивный инфаркт миокарда или другая причина первичной сердечной недостаточности (помпы).
- Обструктивная — например, массивная тромбоэмболия легочной артерии, тампонада, напряженный пневмоторакс.
- Распределительный — расширение сосудов +/- утечка из эндотелия; со следующими подтипами: септический, анафилактический и нейрогенный.
Факторы риска
Здоровый взрослый человек может без вреда выдержать потерю пол-литра из обращения около пяти литров; однако большие объемы и быстрая потеря порождают все более серьезные проблемы. Риск во многом зависит от степени гиповолемии и скорости коррекции.У детей и молодых людей тахикардия — один из самых ранних признаков гиповолемии, поскольку система кровообращения гораздо лучше справляется с тяжелой утратой. Риск заболеваемости и смертности намного выше с возрастом. Патология сердечно-сосудистой, дыхательной и почечной систем увеличивает риск.
Презентация
Симптомы
- Человек может чувствовать холод, недомогание, беспокойство, слабость и одышку.
- Из-за постуральной гипотензии может наблюдаться обморок при стоянии или даже при сидении.
- Могут присутствовать симптомы, связанные с причиной гиповолемии, такие как боль из-за кровоточащей язвы, расслаивающейся аневризмы, прерывистой внематочной беременности, травмы или ожогов.
- Ишемия кишечника может вызывать тошноту и рвоту, но ее значение часто упускается из виду.
Признаки
- Пациент может выглядеть бледным и вспотевшим.
- Возможно тахипноэ.
- Периферия может быть холодной из-за плохой перфузии, и время наполнения капилляров может увеличиться.Однако это может быть плохим индикатором гиповолемии.
- Возможны тахикардия и падение артериального давления (АД) или постуральная гипотензия. Перед падением АД могут возникать тахикардия и холод на периферии из-за сужения сосудов, особенно у детей и молодых людей.
- У молодых людей может наблюдаться незначительное повышение частоты пульса и отсутствие снижения АД, несмотря на значительное обескровливание. Очень легко недооценить тяжесть утраты молодого человека.
- Поздние признаки включают замешательство или даже кому.
Этиология
Причинами гиповолемического шока являются [1] :
- Потеря крови, которая может быть обнаружена или скрыта.
- Травма, которая может привести к видимому кровотечению или разрыву внутреннего органа, например селезенки или печени. При переломе бедренной кости будет кровоточить около полулитра, а при переломе таза будет потеряно около одного литра крови — обратите внимание, что эти объемы варьируются в зависимости от возраста / веса. Объем кровотечения мало указывает на степень кровотечения.Кровотечение при внематочной беременности также является скрытым с незначительной вагинальной потерей или без нее, и 30% внематочных беременностей прерываются до того, как менструальный цикл был пропущен. Важно поддерживать высокий уровень клинической подозрительности.
- Утечка плазмы и часто крови, как при ожогах.
- Сильная потеря воды и соли. Это может произойти при интенсивных упражнениях в жаркой среде, плохом питании, потере диареи и рвоты и несоответствующем диурезе.
Площадь ожогов следует оценивать по правилу девяток; в качестве альтернативы доступны калькуляторы [2] .Чем больше пораженная область, тем серьезнее проблема, особенно у детей и пожилых людей. К детям правило девяток не применяется, но, как правило, ладонь ребенка составляет около 1% площади поверхности. Детям нужно относительно больше жидкости, чем взрослым. Сильная диарея и рвота вызывают заметную потерю соли и воды. При холере понос может доходить до 20 литров в сутки. Упражнения в условиях сильной жары могут вызвать серьезную потерю воды и соли. По мере того, как скорость потоотделения увеличивается, концентрация натрия в поте повышается, так что общая потеря натрия возрастает по экспоненте.Способность выводить натрий из пота улучшается с акклиматизацией.
Исследования
- Проверьте Hb, U&E, LFT и, при кровотечении и ожогах, групповое и перекрестное соответствие.
- Экран коагуляции.
- Газы крови (артериальные или венозные) могут показывать метаболическую ацидемию из-за плохой перфузии; уровень лактата особенно отражает гипоперфузию.
- Контролируйте диурез, для чего может потребоваться катетер.
- Ультразвук может быть полезным для дифференциации гиповолемии от кардиогенного шока; полая вена может быть оценена на предмет адекватного наполнения, а эхокардиограмма может показать любой отказ помпы.
- Мониторинг центрального венозного давления (ЦВД) может быть полезен при наличии признаков шока.
Стадия
Для взрослых клиническая стадия, связанная с потерей объема крови, может быть классифицирована как [3] :
- Класс 1: 10-15% кровопотеря; физиологическая компенсация и отсутствие клинических изменений.
- Класс 2: кровопотеря 15-30%; постуральная гипотензия, генерализованное сужение сосудов и снижение диуреза до 20-30 мл / час.
- Класс 3: кровопотеря 30-40%; гипотония, тахикардия более 120, тахипноэ, диурез менее 20 мл / час и пациент сбит с толку.
- Класс 4: потеря крови 40%; выраженная артериальная гипотензия, тахикардия и тахипноэ. Моча отсутствует, пациент находится в коме.
Руководство по поддержке жизни при травмах взрослых описывает аналогичную классификацию, увязывающую объем кровопотери с конкретными физиологическими проявлениями — например, гиповолемический шок 4 стадии приводит к различным клиническим изменениям, включая частоту пульса> 140 уд / мин, частоту дыхания> 35 вдохов в минуту. минута и путаница [3] . Рекомендации полезны в обучении, но их роль в реальных клинических сценариях более ограничена, и следует проявлять осторожность [4, 3] .Например, у женщин с прерванной внематочной беременностью может казаться гемодинамически стабильной при обращении, а затем внезапно ухудшаться состояние.
Физиологически различают три стадии гиповолемического шока [5] :
- Компенсированный шок : барорецепторные рефлексы приводят к увеличению сократимости миокарда, тахикардии и вазоконстрикции. Они поддерживают сердечный выброс и АД и приводят к высвобождению вазопрессина, альдостерона и ренина.
- Прогрессирующий или некомпенсированный шок : возникает при угнетении миокарда, нарушении вазомоторных рефлексов и нарушении микроциркуляции, с повышением проницаемости капилляров, отложением осадка и тромбозом, что приводит к клеточной дисфункции и лактоацидозу.
- Необратимый шок : отказ жизненно важных органов с невозможностью выздоровления.
Эти стадии также применимы к детям, но у них период компенсированного шока может быть относительно дольше, чем у взрослых. Однако их сердечный резерв меньше, поэтому переход к некомпенсированному шоку может быстрее прогрессировать до необратимой стадии.
Менеджмент
Общие меры
- Необходимо подавать кислород.
- Венозный доступ необходимо заранее обеспечить.Это становится труднее, когда происходит дальнейший коллапс кровообращения. Могут быть некоторые опасения, что восполнение жидкости перед остановкой кровотечения может способствовать дальнейшему кровотечению, но поддержание адекватной перфузии жизненно важных органов более важно [6] .
- Реанимацию обычно начинают с кристаллоидов, таких как физиологический раствор или раствор Гартмана, хотя некоторые люди с самого начала предпочитают коллоиды [5, 7] . Исследования показали, что выбирать между двумя [8, 9] очень мало.Раньше избегали применения альбумина у тяжелобольных пациентов, поскольку он был связан с худшим исходом, но он может играть роль у пациентов, которым требуется значительное количество кристаллоидов для поддержания среднего артериального давления в условиях септического шока [10] . При кровотечении следует как можно скорее сдать кровь. Устройства для быстрой инфузии и переливание собственной крови могут использоваться, если кровопотеря большая и быстрая [5, 11] .
- Существует некоторая дискуссия по поводу замены жидкости там, где кровотечение продолжается.Современные идеи включают в себя предотвращение чрезмерной реанимации кристаллоидной жидкостью путем разрешения разрешающей гипотензии и раннего использования протоколов крови и массивных переливаний с хирургическим вмешательством для борьбы с летальной триадой гипотермии, коагулопатии и ацидоза [12] .
- Может потребоваться линия центрального венозного давления (ЦВД). ЦВД гораздо более чувствителен к балансу между потерей и замещением, чем пульс или АД, и у пожилых людей оно может предотвратить переливание крови и отек легких.В частности, у молодых пациентов наблюдается тенденция к чрезмерной замене для предотвращения ишемии тканей, хотя доказательная база на удивление скудна [8] . При ожогах может потребоваться высокое ЦВД для поддержания адекватного диуреза.
- В качестве меры первой помощи при ожогах очень полезна пленка Clingfilm® или подобная полиэтиленовая пленка, как для предотвращения инфекции, которая может преобразовать поверхностный ожог в полную толщину, так и для уменьшения потери жидкости и плазмы.
Фармакологический
- Традиционное учение гласит, что вазопрессоры не играют никакой роли, поскольку они только увеличивают ишемию тканей.Они могут иметь место, если не удается отреагировать на замену тома; однако доказательства неубедительны [13] .
- Сосудорасширяющая терапия предназначена для специалистов по интенсивной терапии. Применяется больше при септическом шоке. Если проблема в гиповолемии, объем следует заменить.
- Если есть боль, обезболивание следует вводить внутривенно, так как любой другой путь будет неэффективным. Боль увеличивает скорость метаболизма и тем самым усугубляет ишемию тканей.
Хирургический
- Если кровотечение продолжается, может потребоваться операция, чтобы остановить кровотечение.Обычно сначала проводят реанимацию, чтобы снизить риск, особенно потому, что введение анестезии может привести к нарушению хрупкого кровообращения. В некоторых случаях, таких как разрыв внематочной беременности и предлежание плаценты, частота кровотечения не может быть сопоставлена с помощью переливания, и причина должна быть устранена до того, как реанимация станет эффективной.
- При травмах меры первой помощи могут помочь остановить кровопотерю. При огнестрельных ранениях ищите не только входное, но и выходное ранение. Последний может быть значительно больше первого.Если использовалось мощное оружие, не следует предпринимать попытки первичного закрытия раны.
Реанимационная эндоваскулярная баллонная окклюзия аорты (REBOA)
- REBOA использовалась при гиповолемическом шоке в результате кровотечения [14] .
- Он включает введение баллона через бедренную артерию в аорту, который затем раздувается и, по сути, прекращает кровоснабжение выше точки кровотечения.
- Он использовался в различных ситуациях, включая послеродовое кровотечение, травму, кровотечение из верхних отделов желудочно-кишечного тракта и разрыв аневризмы аорты.
- Это только временная мера, пока не будет проведено более решительное лечение, чтобы остановить кровотечение.
- Доказательная база в настоящее время ограничена [15, 16] .
Осложнения
- Кровь отводится от почек и кишечника. Это может вызвать острое повреждение почек и осложнения ишемии кишечника.
- При акушерском шоке может возникнуть острый некроз канальцев.
- Неадекватная перфузия приводит к гипоксии и метаболическому ацидозу.
- Около 75% кровотока в правый желудочек и 100% в левый желудочек происходит в диастолу. Падение диастолического давления предрасполагает к сердечной аритмии и даже к остановке. Нарушение кислотно-щелочного баланса, гипоксия и нарушение электролитов усугубят проблему.
- У восприимчивых людей обезвоживание может привести к гемоконцентрации и закупорке кровообращения с такими осложнениями, как тромбоз венозного синуса.
Прогноз
У пожилых людей прогноз хуже, чем у молодых.Физическая подготовка улучшает исход. Быстрая и адекватная замена циркулирующего объема может предотвратить осложнения гипоперфузии, включая острое повреждение почек, почечную недостаточность, ишемическое повреждение кишечника, повреждение мозга и остановку сердца.
Профилактика
- Потерю циркулирующего объема необходимо диагностировать и лечить до того, как состояние станет критическим.
